Способ крупномасштабного выделения и очистки плазмидной днк
Формула / Реферат
1. Способ крупномасштабного выделения и очистки плазмидной ДНК из больших объемов ферментационной среды микробных клеток, включающий осуществление следующих стадий:
а) сбор микробных клеток после их культивирования в больших объемах;
б) добавление к собранным микробным клеткам необходимого количества лизирующего буфера, необязательно содержащего лизоцим;
в) нагревание микробных клеток с лизирующим буфером до температуры 70-100шС в проточном теплообменнике при скорости потока 160-850 мл/мин с получением неочищенного лизата;
г) центрифугирование неочищенного лизата и сбор супернатанта;
д) фильтрацию и диафильтрацию супернатанта, собранного на стадии г), с получением фильтрата;
е) обеспечение контактирования фильтрата, полученного на стадии д), с анионообменной матрицей;
ж) элюирование и сбор плазмидной ДНК с анионообменной матрицы;
з) обеспечение контактирования плазмидной ДНК, полученной на стадии ж), с матрицей, используемой для обратнофазовой жидкостной хроматографии высокого разрешения, и
и) элюирование и сбор плазмидной ДНК с указанной на стадии ж) матрицы.
2. Способ по п.1, отличающийся тем, что дополнительно осуществляют концентрирование и/или диафильтрацию плазмидной ДНК, полученной на стадии и), в фармацевтически приемлемом носителе.
3. Способ по п.2, отличающийся тем, что дополнительно осуществляют стерилизацию плазмидной ДНК.
4. Способ по любому из пп.1-3, отличающийся тем, что на стадии в) нагревание осуществляют до температуры 70-77шС.
5. Способ по любому из пп.1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), содержит субмикрограммовую концентрацию лизоцима.
6. Способ по любому из пп.1-3, отличающийся тем, что дополнительно осуществляют обработку РНКазой любого продукта, полученного после осуществления стадии а).
7. Способ по любому из пп. 1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), представляет собой модифицированный SТЕТ-буфер.
8. Способ по любому из пп. 1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), представляет собой модифицированный STET-буфер, содержащий субмикрограммовую концентрацию лизоцима.
Текст
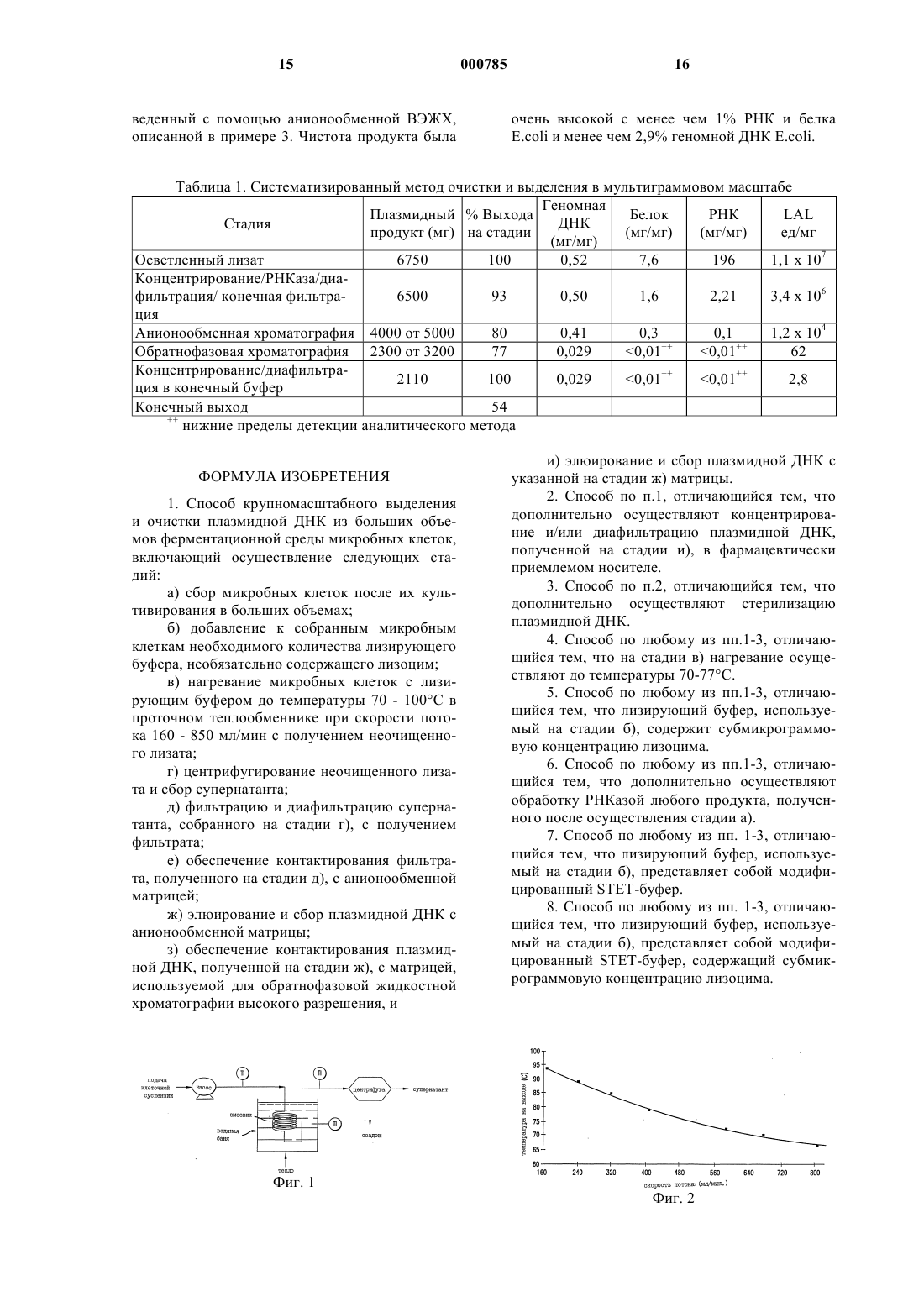
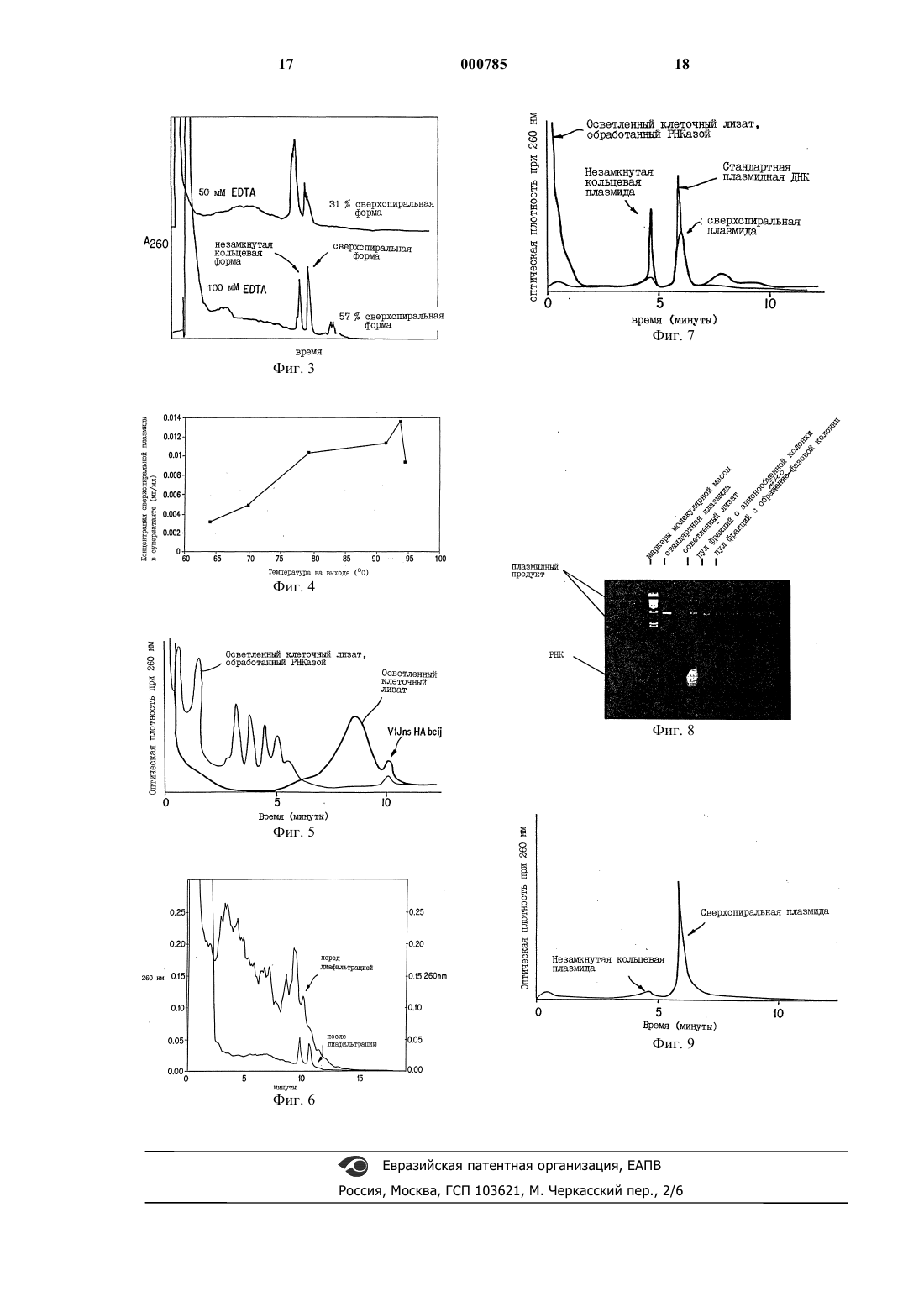
1 Настоящая заявка является частичным продолжением заявки США 08/446118, поданной 19 мая 1995 г. Предпосылки создания изобретения Классические методы выделения плазмидной ДНК из ферментированных микроорганизмов являются подходящими для получения небольших количеств плазмид или лабораторных плазмидных препаратов. Один из таких методов предусматривает щелочной лизис микробных клеток-хозяев, содержащих плазмиду, с последующей нейтрализацией ацетатом, вызывающим преципитацию геномной ДНК клеткихозяина и белков, которые затем удаляют, например, путем центрифугирования. Жидкая фаза содержит плазмидную ДНК, которую осаждают спиртом, а затем подвергают изопикническому центрифугированию с использованиемCsCl в присутствии бромистого этидия. Бромистый этидий необходим для выделения плазмидной ДНК в трех различных формах, суперспиральной (форма I), кольцевой с разрывом(форма II), и линеаризованной (форма III), при этом, нужную плазмидную форму собирают. Затем осуществляют экстракцию бутанолом,которая необходима для удаления остаточного бромистого этидия, после чего ДНК осаждают спиртом. Для удаления клеточных белков хозяина осуществляют дополнительные стадии очистки. Удаление белков хозяина осуществляют путем многократной экстракции фенолом или смесью фенола и хлороформа. Плазмидную ДНК осаждают спиртом, а остаток фенола удаляют путем экстракции изоамилом/хлороформом. И наконец, осажденную спиртом плазмидную ДНК растворяют в воде или в подходящем буферном растворе. Однако, этот способ имеет множество недостатков и ограничений: а) этот способ требует использования дорогостоящих и вредных химических соединений(CsCl и EtBr, которые используются при центрифугировании в градиенте плотности; EtBr является известным мутагеном и должен быть удален из конечных продуктов; кроме того, он является также интеркалирующим агентом, и может разрывать плазмиду); б) стадия центрифугирования в градиенте плотности не легко поддается масштабированию; в) для удаления остаточного EtBr необходимо осуществлять экстракцию органическим растворителем; г) для удаления остаточных белков и ДНКазы осуществляют экстракцию фенолом, а поэтому, при осуществлении способа, для расслоения эмульсии фенол/вода, необходимо проводить центрифугирование; д) из-за осуществления большого количества повторных стадий, этот способ является трудоемким и требует много времени (для выделения необходимо несколько дней); 2 е) значительные затруднения вызывает масштабируемость стадии химического лизиса,т.е., стадия обработки лизоцимом/щелочью/ КОАс является эффективной для лизиса клеток в небольших масштабах, однако, увеличение вязкости, наблюдающееся в этом процессе,служит серьезным препятствием для крупномасштабного производства; и ж) для ферментативного ослабления клеточной стенки бактерии перед ее лизисом необходимо использовать большие количества лизоцима. После этого, смесь нейтрализуют путем добавления кислоты, что приводит к преципитации высокомолекулярной хромосомной ДНК. Высокомолекулярную РНК и комплексы белокДСН осаждают путем добавления высокой концентрации соли КОАс. После центрифугирования плазмидный продукт находится в осветленном супернатанте. Недостатки этого метода заключаются в том, что указанные процедуры необходимо проводить быстро и в условиях охлаждения льдом для того, чтобы замедлить действие нуклеаз, которые не удаляются вплоть до экстракции фенолом. Основной примесью, присутствующей в супернатанте вместе с продуктом, является РНК. Другим широко используемым методом выделения и очистки плазмидной ДНК из бактериальных клеток является экспресс-метод,подходящий для получения плазмидной ДНК лишь в очень небольших количествах. В работе Holmes и Quigley (1981, AnalyticalBiochem., 114, рр 193-197) описан простой и быстрый метод получения плазмид, в котором бактерии обрабатывают лизоцимом, а затем кипятят в соответствующем буфере (STET) в течение 20-40 с при около 100 С, в результате чего образуется нерастворимый сгусток геномной ДНК, белка и дебриса, оставляя плазмиду в растворе вместе с РНК в качестве главной примеси. Очевидно, что для осуществления указанного метода необходимо использовать лизоцим,а следовательно и дополнительную стадию обработки, которая является не очень желательной для крупномасштабного получения ДНК, используемой в медицине или ветеринарии. Однако, добавление лизоцима может усиливать высвобождение плазмиды во время лизиса. Преимущество этого метода заключается в том, что термообработка клеток также способствует денатурации ДНКазы. Однако данный метод не может быть применен для бактериальной ферментации в больших объемах, то есть, в объемах 5 л и более. Вместо изопикнического центрифугирования с использованием CsCl, применяемого для очистки плазмид, были разработаны и опубликованы альтернативные способы. Эти способы применимы лишь для лабораторного выделения плазмид и предусматривают осуществление: 3 а) вытеснительной хроматографии, которая имеет, в основном, ограниченную пропускающую способность; б) гидроксиапатитной хроматографии, которая имеет тот недостаток, что для ее эффективности необходимо использовать высокие концентрации мочевины; в) обратнофазовой хроматографии; и г) ионообменной хроматографии. Отсюда очевидно, что для крупномасштабного выделения и очистки плазмидной ДНК из больших объемов ферментированных микроорганизмов необходимо разработать усовершенствованный способ получения плазмидных препаратов. Потребность в разработке крупномасштабного способа плазмидных ДНК продиктована стремительным развитием многих областей молекулярной биологии. В частности,последние достижения в области изготовления вакцин на основе полинуклеотидов для введения человеку, а также в области генной терапии требуют разработки такого метода, который позволил бы получать высокоочищенную полинуклеотидную вакцину в больших количествах. Поэтому, для разработки/внедрения крупномасштабного и технически осуществимого способа ферментации, выделения, очистки и характеризации ДНК в биофармацевтических целях необходимы совершенно новые технологии. Краткое описание изобретения Существующая технология, используемая для лабораторного выделения и очистки плазмидных ДНК, представляет собой серию классических лабораторных методов, которые не могут быть применены для промышленного получения ДНК. Например, центрифугирование в градиенте плотности не поддается масштабированию; а процедуры очистки, которые неизбежно влекут за собой использование вредных и дорогостоящих химических соединений/растворителей, таких как бромистый этидий (известный мутаген), являются трудоемкими и требуют большого количества времени. Поэтому был разработан масштабируемый альтернативный способ, который раскрывается в настоящей заявке. Кроме того, для прослеживания за ходом продуцирования плазмидного продукта в процессе осуществления соответствующих стадий и для выявления различных форм плазмид был разработан ВЭЖХ-анализ. Бактериальные клетки, включающие плазмиду, суспендируют и инкубируют (необязательно) с лизоцимом в буфере, содержащем детергент, а затем, для лизиса клеток, эти клетки нагревают с использованием проточного теплообменника и центрифугируют. После центрифугирования осветленный лизат, который содержит преимущественно РНК и плазмидный продукт, подвергают фильтрации через 0,45 мкм-фильтр, а затем диафильтрации, после чего лизат загружают на анионообменную колонку. 4 Плазмидный продукт может быть, но необязательно, обработан РНКазой перед фильтрацией или после не, либо на более ранней или более поздней стадии. Фракцию анионообменного продукта, содержащего плазмиду, загружают на колонку для обратнофазовой хроматографии и элюируют соответствующим буфером,в результате чего получают высокоочищенную плазмидную ДНК, которая может быть введена человеку. Краткое описание чертежей На фиг. 1 схематически показан подходящий теплообменник. На фиг. 2 представлен график зависимости температуры на выходе от скорости потока. На фиг. 3 представлены сравнительные хроматограммы общей плазмидной фракции в осветленном супернатанте, полученные с использованием 50 мМ EDTA и 100 мМ EDTA. На фиг. 4 представлен график зависимости выхода сверхспиральной плазмиды от температуры на выходе. На фиг. 5 показаны профили элюции, полученные при пропускании через анионообменную колонку обработанного РНКазой (жирная линия) и необработанного (тонкая линия) осветленного лизата. На фиг. 6 показаны профили элюции, полученные в результате анионообменной хроматографии осветленного лизата, который подвергали диафильтрации перед загрузкой в колонку,и лизата, который не подвергали диафильтрации перед загрузкой в колонку. На фиг. 7 показан профиль элюции плазмидной ДНК, полученной из клеточного лизата. На фиг. 8 приведены результаты анализа ДНК-продукта, полученного на различных промежуточных стадиях очистки, который выполнен с помощью электрофореза в агарозном геле. На фиг. 9 приведена схема мониторинга анионообменого ВЭЖХ-анализа ДНК- продукта, подтверждающего чистоту указанного продукта. Подробное описание изобретения Авторами настоящей заявки был разработан новый, масштабируемый альтернативный способ лизиса/удаления дебриса для крупномасштабного выделения и очистки плазмид,который предусматривает быстрое нагревание микробных клеток в целях индуцирования их лизиса и преципитации геномной ДНК, белков и остального дебриса, с удерживанием плазмиды в растворе. Этот способ предназначен для крупномасштабного выделения и очистки плазмидной ДНК. Авторами настоящей заявки было установлено, что суспендирование микробных клеток в модифицированном буфере STET (описанном ниже) с последующим нагреванием суспензии до около 70-100 С в проточном теплообменнике дает хорошие результаты лизиса. Непрерывное или периодическое центрифугирование лизата приводит к образованию осадка, 5 который содержит клеточный дебрис, белок и большую часть геномной ДНК, тогда, как плазмида остается в супернатанте. Способ настоящего изобретения имеет ряд преимуществ, заключающихся в получении более высоких уровней продукта, чем при химическом лизисе; в инактивации ДНКазы; простоте осуществления и возможности выбора объема получаемых продуктов. Настоящее изобретение относится к способу крупномасштабного выделения и очистки плазмидной ДНК из ферментированных микроорганизмов. При этом предусматривается, что полный объем ферментационной среды с микроорганизмами составляет более 5 л, либо микроорганизмы собирают из объема среды, составляющего более чем 5 л. Предложенный способ позволяет получать плазмидную ДНК в высокоочищенной форме,пригодную для введения человеку. Подходящими для введения человеку ДНК являются, но не ограничиваются указанными,полинуклеотидные вакцины и ДНК, предназначенные для геномной терапии человека. Полинуклеотидные вакцины используют для непосредственных инъекций человеку Montgomery,D.L. et al., 1993, Cell Biol., 169, pp. 244-247; Ulmer, J.B. et al., 1993, Science, 259, pp. 1745-1749. Также предложенный способ обеспечивает мониторинг в реальном масштабе времени за получением различных форм плазмидных ДНК в процессе стадий выделения и очистки. Как указывается выше, такими различными формами плазмидной ДНК, которые могут быть по отдельности выделены заявленным способом,являются форма I (сверхспиральная плазмида),форма II (плазмида с разрывом или релаксированная плазмида), и форма III (линеаризованная плазмида). Способ в соответствии с настоящим изобретением является подходящим, в основном для выделения плазмидной ДНК из ферментированных микроорганизмов. Однако для любого специалиста очевидно, что при осуществлении заявленного способа могут быть использованы разнообразные микробные клетки, включая, но не ограничиваясь указанными, клетки грибов например, дрожжей и бактериальные клетки. Предпочтительными являются ферментированные клетки бактерий, содержащие плазмиду,которую необходимо выделить и очистить, в частности, клетки E.coli, содержащие плазмиду,предназначенную для выделения и очистки. При этом, любому специалисту очевидно, что при осуществлении заявленного способа вместо Е.coli, могут быть использованы любые бактериальные клетки. Ферментация клеток может быть осуществлена в любой жидкой среде, подходящей для культивирования используемых бактерий. 6 Плазмидой, выделяемой и очищаемой способом настоящего изобретения, может быть любая экстрахромосомная ДНК-молекула. Эти плазмиды могут иметь высокое или низкое число копий на клетку. При этом они могут быть фактически любого размера. Следует отметить,что способом настоящего изобретения может быть выделена фактически любая плазмида,присутствующая в микробных клетках. Микробные клетки, содержащие плазмиду,собирают из ферментационной среды для получения клеточной пасты или суспензии. Для сбора клеток из жидкой среды может быть использован любой подходящий метод, включая, но не ограничиваясь указанными, центрифугирование или микрофильтрацию. Выделение плазмидной ДНК из собранных микробных клеток методами современной лабораторной технологии заключается, главным образом, в ферментативной обработке микробных клеток для ослабления клеточной стенки с последующим лизисом этих клеток. Стадии очистки включают многократное центрифугирование с использованием CsCl/EtBr с последующими экстракциями органическим растворителем и преципитацией для удаления тРНК, остаточных белков, EtBr и других примесей, происходящих из клеток-хозяев. Эти стадии не поддаются масштабированию, а поэтому непригодны для крупномасштабного производства. В противоположность этому, препаративная хроматография, проводимая в соответствующем масштабе,является высокоэффективным способом очистки, который позволяет достичь высокого уровня разрешения и повышенной продуктивности при очистке плазмидных ДНК-продуктов, и который является достаточно простым в своем осуществлении. Было показано, что применение двух различных методов хроматографии, а именно,обратнофазовой и анионообменной хроматографии, позволяет достичь высокого уровня очистки плазмидной ДНК, удовлетворяющего требованиям, предъявляемым к препаратам для введения человеку. Выделение методом обратнофазовой хроматографии основано на гидрофобных взаимодействиях, а выделение методом анионообменной хроматографии основано на электростатическом взаимодействии. Благодаря осуществлению этих двух ортогональных хроматографических стадий достигается разделение различных форм плазмиды (суперспиральной, незамкнутой релаксированной, линейной и конкатемерных форм), и удаление примесей,происходящих из клеток-хозяев, таких как LPS(эндотоксин), РНК, ДНК и остаточные белки. В способе настоящего изобретения, собранные микробные клетки ресуспендируют в модифицированном буфере STET, содержащем около 50 мМ Трис, около 50-100 мМ EDTA,около 8% сахарозы, около 2% Тритона Х-100, и необязательно, субмикрограммовые концентрации лизоцима, при рН 6,0-10,0. Концентрации 7 лизоцима, который может быть, но необязательно, использован в способе настоящего изобретения, являются значительно более низкими,чем концентрации лизоцима, используемые в традиционных способах. Для каждого специалиста очевидно, что основной состав вышеуказанного буфера может быть модифицирован и адаптирован для использования в способе настоящего изобретения. При этом, следует отметить, что модификации основного состава буфера не должны оказывать неблагоприятного воздействия на продуктивность способа настоящего изобретения или изменять выход продукта,который может быть достигнут с применением способа, входящего в объем настоящего изобретения. Для получения наилучших результатов,диапазон рН может быть скорректирован в соответствии с конкретно используемым штаммом бактерий. Предпочтительный диапазон рН составляет около 8,0-8,5. Затем суспензию нагревают примерно до 70-100 С, а предпочтительно до 70-77 С, в проточном теплообменнике. Лизат центрифугируют, в результате чего получают осадок, содержащий большое количество клеточного дебриса, белка, и большей части геномной ДНК. Для того, чтобы продемонстрировать возможность осуществления проточного теплового лизиса микробных клеток, содержащих плазмиду, была сконструирована соответствующая модель теплообменника. В частности, такой теплообменник состоит из трубки из нержавеющей стали (10 фут х 0,25 дюймов (внеш. диаметр), 30,48 мм х 6,35 мм), имеющей форму спирали. Эта спиральная трубка полностью погружена в водяную баню, имеющую высокую постоянную температуру. Объем задержки в змеевике теплообменника составляет около 50 мл. Для измерения температуры на входе и выходе, и температуры водяной бани используют термопары и термометр, соответственно. Продуктовый поток подают в нагревательный змеевик с помощью перистальтического насосаBeckman J-21 для осветления. На фиг. 1 схематически показано конкретное устройство, однако, в настоящем изобретении могут быть использованы и другие типы теплообменников,включая, но не ограничиваясь указанными, кожухотрубный теплообменник, который является предпочтительным. После центрифугирования, осветленный лизат может быть, но необязательно, обработан РНКазой, а плазмидный продукт может быть отфильтрован для дополнительного удаления мелкого дебриса. В этом способе могут быть использованы различные методы фильтрации,включая, но не ограничиваясь указанными,фильтрацию через мембрану, имеющую поры небольшого размера. Предпочтительным мето 000785 8 дом фильтрации является фильтрация через 0,45-микронный фильтр. Для последующего удаления примесей ДНК-продукта полученный материал может быть подвергнут диафильтрации. В данном способе могут быть использованы стандартные коммерчески доступные материалы для диафильтрации, проводимой в соответствии с известной методикой. Предпочтительным является метод диафильтрации с использованием ультрафильтрующей мембраны, с отсечением по молекулярной массе в пределах от 30 000 до 500 000, в зависимости от размера плазмиды. ДНК- препарат, описанный выше, подвергают диафильтрации с использованием ультрафильтрующей мембраны (с отсечением по молекулярной массе около 100 000) против колоночного буфера, а затем загружают в анионообменную колонку. Проведение диафильтрации перед загрузкой в анионообменную колонку является предпочтительным и позволяет значительно увеличить количество лизата, которое может быть загружено в колонку. Для применения в настоящем изобретении может быть использован широкий ряд коммерчески доступных матриц для анионообменной хроматографии, включая, но не ограничиваясь указанными, анионообменные смолы POROS,Qiagen, Toso Haas, Sterogene, Spherodex, Nucleopac, и Pharmacia. Колонку (Poros 11 P1/M,4,5 мм х 100) сначала уравновешивают 20 мМBis/Трис-пропаном (рН 7,5) и 0,7 М NaCl. Затем загружают образец и промывают тем же самым буфером. Затем проводят элюирование градиентом 0,5-0,85 М NaCl примерно в 25 объемах колонки и соответствующие фракции собирают. Анионообменная хроматография является идеальной первой стадией тонкой очистки, поскольку она обеспечивает прекрасную очистку от РНК, геномной ДНК и белка. На фиг. 5 (жирная линия) показан профиль элюции отфильтрованного осветленного клеточного лизата, полученный при пропускании через анионообменную колонку. Анализ в агарозном геле показал,что второй пик, который появляется после прохождения сквозного потока, состоит из плазмидного продукта. Более ранний широкий пик относится к РНК. Это было подтверждено путем инкубирования осветленного клеточного лизата с рибонуклеазой до загрузки в колонку, в результате чего наблюдалось исчезновение большого пика, и вместо него появлялось несколько более мелких и более быстрых пиков элюции,обусловленных расщеплением продуктов в результате гидролиза под действием рибонуклеазы. Фракцию продукта, полученную в результате анионообменной хроматографии, загружают на обратнофазовую колонку. Для использования в настоящем изобретении может быть использован широкий ряд коммерчески доступ 9 ных матриц, включая, но не ограничиваясь ими,матрицы от POROS, Polymer Labs, Toso Haas,Prarmacia, PQ Corp., Zorbax, смолы BioSepra,смолы BioSepra Hyper D, смолы BioSepra QHyper D и Amicon. Могут быть также использованы матрицы на основе полимеров или на основе силикагеля. Обратнофазовую колонку (Poros P/H) уравновешивают примерно 100 мМ бикарбонатом аммония, рН=8,5. Для элюирования связанного материала используют градиент 0-11% изопропанола. Этим способом могут быть выделены три формы плазмид, а именно, формыI, II, III, описанные выше. Затем элюированную плазмидную ДНК подвергают концентрированию и/или диафильтрации для снижения объема или для замены буфера. В случае ДНК, предназначенной для введения человеку, диафильтрация ДНК - продукта может быть осуществлена в фармацевтически приемлемый носитель или буферный раствор. Подходящие фармацевтически приемлемые носители или буферные растворы хорошо известны специалистам и описаны в литературе,например, в Remington s Pharmaceutical Sciences. В целях настоящего изобретения может быть использован любой приемлемый метод концентрирования ДНК-образца. Такими методами являются диафильтрация, преципитация спиртом, лиофилизация и т.п., при этом, предпочтительным методом является диафильтрация. После диафильтрации, конечный плазмидный ДНК-продукт может быть подвергнут стерилизации. При этом, может быть использован любой подходящий метод стерилизации ДНКпродукта при условии, что он не будет оказывать неблагоприятное воздействие на свойства ДНК-продукта; так, например, стерилизация ДНК-продукта может быть осуществлена путем его пропускания через мембрану, имеющую достаточно небольшой размер пор, например,0,2 микрон и менее. Ниже представлены примеры, иллюстрирующие осуществление заявленного способа,однако, эти примеры не должны рассматриваться как ограничение объема изобретения. Пример 1. Рост микробных клеток, клеточный лизис и осветление. Один литр замороженной клеточной суспензии E.coli использовали для получения 8 л клеточной суспензии в буфере STET (8% сахароза, 0,5% Тритона, 50 мМ буфера Трис при рН=8,5 и 50 мМ EDTA). Оптическая плотность клеточной суспензии при 600 нм составляла приблизительно 30. Измеренная вязкость клеточной суспензии составляла приблизительно 1,94 сантипуаз при комнатной температуре(24 С). Полученную суспензию непрерывно перемешивали до гомогенности. Затем, клеточную суспензию подавали насосом в теплообменник при 81 мл/мин, что соответствует времени пребывания клеточного раствора в теплообменнике приблизительно 35 с. Температуру 10 бани поддерживали при 92 С. Измеренная температура клеточного раствора на входе и выходе теплообменника составляла приблизительно 24 С и приблизительно 89 С (среднее значение),соответственно. Через теплообменник пропускали примерно один литр образца. Забивки в трубке визуально не наблюдалось, хотя лизат был несколько гуще, чем исходный материал. После охлаждения лизата до комнатной температуры его измеренная вязкость составляла примерно 40 сП. После этого клеточный лизат осветляли путем серийного центрифугирования при 9000 об/мин в течение 50 мин с использованием Beckman J-21. Анализ супернатанта подтвердил эффективность клеточного лизиса и выделения продукта. Выход продукта, полученный в результате теплового лизиса проточным методом, является, по крайней мере, сравнимым с выходом, полученным методом кипяченияQuigleyHolms. Однако, последний метод осуществляют в лабораторных условиях для получения небольших партий препарата, а поэтому он не подходит для крупномасштабного(5 л или выше) производства. Поскольку способ теплового обмена является проточным, то верхнего предела объема клеточной суспензии, которая может быть получена, не существует. Этот способ может быть адаптирован для крупномасштабных ферментаций бактерий с получением больших количеств высокоочищенных плазмидных ДНК. Затем осветленный лизат фильтровали через мембрану, имеющую размер пор 0,45 мкм,для удаления мелкого дебриса. Полученный фильтрат подвергали диафильтрации с использованием мембраны с отсечением по молекулярной массе около 100000. Пример 2. Регуляция и воспроизводимость клеточного лизиса с помощью теплообменника. Регулирование скорости потока, при которой клеточную суспензию пропускают через теплообменник, позволяет осуществлять непосредственный контроль температуры лизиса,т.е., температуры на выходе. Раствор клеточной суспензии получали, как описано в примере 1, и подавали насосом в теплообменник со скоростью потока, составляющей 160-850 мл/мин. Соответствующие температуры на выходе составляли от 93 до 65 С, соответственно. На фиг. 2 показано соотношение скорости потока и температуры. Первоначальная температура клеточной суспензии составляла 24 С, а температура бани поддерживалась постоянной при 96 С. Кроме того, был проведен ряд циклов прогона, где температура на выходе составляла 80 С. Выход 24 мг кольцевой ДНК на один литр осветленного супернатанта иллюстрирует воспроизводимость этого способа. Пример 3. Очистка плазмидной ДНК. Микробные клетки и лизаты были получены, как описано в примерах 1 и 2, а также были проведены следующие анализы. 11 Для иллюстрации того, что добавление 100 мМ EDTA по сравнению с 50 мМ EDTA увеличивает процентное содержание суперспиральной ДНК, и для определения допустимого диапазона температур на выходе (т.е., температуры лизиса) в отношении выделения суперспиральной ДНК, проводили следующие анализы. Суперспиральная форма плазмидной ДНК является желательной, поскольку она более стабильная, чем релаксированная кольцевая форма. Таким образом, суперспиральная форма ДНК может быть превращена в открытую кольцевую форму путем одноцепочечного разрыва под действием ДНКазы. Было обнаружено, что добавление 100 мМ EDTA по сравнению с 50 мМEDTA в буфере STET приводит к минимизации образования открытой кольцевой плазмиды. На фиг. 3 показаны сравнительные хроматограммы целой плазмиды в осветленном супернатанте с 50 мМ EDTA по сравнению со 100 мМ EDTA. Клеточную суспензию получали способом, описанным в примере 1. Рабочая скорость потока для этих серий составляла приблизительно 186 мл/мин. Температура на входе и выходе, и температура бани составляли 24, 92 и 96 С, соответственно. Приемлемые пределы температур лизиса определяли путем измерения процента суперспиральной плазмиды, генерированной для каждой серии. На фиг. 4 показана концентрация сверхспиральной плазмиды в зависимости от температуры на выходе. Приемлемые пределы температур лизиса составляют 75 - 92 С. При температуре ниже 75 С была получена более релаксированная кольцевая плазмида, что, по всей вероятности происходит благодаря увеличению активности ДНКазы. При температуре выше 93 С уровни суперспиральной плазмиды вероятно уменьшаются, что происходит, возможно, благодаря тепловой денатурации. После непрерывного теплового лизиса и центрифугирования 1 мл осветленного лизата либо инкубировали с 5 мкг РНКазы в течение 2 ч, либо использовали без обработки. Затем, необработанные образцы, и образцы, обработанные РНКазой, загружали на анионообменную колонку (Poros Q/M 4,6 х 100), которую предварительно уравновешивали смесью (50:50) растворителей А и В [ВЭЖХ: растворитель А: 20 мМ Трис/бис-пропан, рН 8,0; и растворитель В 1 М NaCl в 20 мМ Триса/бис-пропана, рН 8,0]. Колонку элюировали с использованием градиента 5085% В в 100 колоночных объемах. Открытую кольцевую плазмиду элюировали приблизительно при 68% В, а сверхспиральную плазмиду элюировали приблизительно при 72% В. На фиг. 5 показано сравнение элюата на анионообменной колонке от осветленного лизата, обработанного РНКазой (тонкая линия), и не обработанного РНКазой (жирная линия). Приблизительно через 10 мин образовывался пик, 000785 12 которым является плазмидная ДНК, а затем продуцировался большой пик, в необработанном образце, которым является РНК. В образце,обработанном РНКазой, большой пик РНК элиминируется, и обеспечивается более четкое разделение плазмидного пика и пиков примесей. Как описано выше, диафильтрация перед анионообменной хроматографией приводит к существенному увеличению количества лизата,который может быть загружен на колонку. Это проиллюстрировано на фиг. 6, на которой показано сравнение осветленного лизата, который подвергали диафильтрации, и осветленного лизата, который не подвергали диафильтрации перед проведением анионообменной хроматографией. Образцы получали способом, описанным выше, за исключением того, что один образец подвергали диафильтрации перед загрузкой на анионообменную колонку, а другой образец не подвергали диафильтрации. Колонку промывали и элюировали, как описано выше. На фиг. 6 показано, что количество примесей, элюированных с колонки, значительно выше в образце,который не был диафильтрован. Большое количество примесей, которые связывают матрицу на анионообменной колонке, может сильно снижать максимальную емкость колонки, что вызывает потери ДНК-продукта из-за неспособности матрицы связываться с любым другим материалом. Следовательно, диафильтрация удаляет примеси и позволяет связывать другой ДНК-продукт с анионообменной матрицей, что,в свою очередь, позволяет получить больший объем осветленного лизата, загруженного на колонку. Плазмидную ДНК, элюированную с анионообменной колонки, разделяли на отдельные формы с помощью обратнофазового ВЭЖХанализа. Отделение суперспиральной плазмиды(форма 1) от незамкнутой кольцевой плазмиды(форма 2) показано на фиг.7. Две формы были легко разделены, что позволило выделить отдельные формы плазмиды. Пример 4. Высокоочищенная плазмидная ДНК, полученная хроматографическим методом. Клеточную пасту для ферментации ресуспендировали в модифицированном буфереSTET, а затем подвергали тепловому лизису в устройстве периодического действия. Альтернативно, клеточную пасту для ферментации ресуспендировали в модифицированном буфереSTET, а затем подвергали тепловому лизису проточным методом, описанным выше. Лизат центрифугировали, как описано выше. 20 мл супернатанта фильтровали, как описано выше, а затем загружали на анионообменную колонку(Poros Q/M 4,6 х 100), которую предварительно уравновешивали смесью (50/50) буферов А и В,описанных выше. Градиент 5085% В прогоняли в 50 колоночных объемах при скорости потока 10 мл/мин. Фракции (2,5 мл - каждая) 13 собирали из колонки. Суперспиральную плазмидную ДНК элюировали из колонки при 72% В. Продукт, полученный в результате анионообменной хроматографии, загружали на обратнофазовую хроматографическую колонку(Poros R/H), которую предварительно уравновешивали 100 мМ бикарбонатом аммония при рН=8,0, и градиент 0%80% метанола использовали для элюирования связанного материала. Высокоочищенную суперспиральную плазмидную ДНК элюировали при 22% метанола. Фотография агарозного геля с фракциями продукта,полученными на каждой из основных стадий способа очистки, приведена на фиг. 8. Конечный продукт, показанный на фиг. 9, является высокоочищенным, о чем свидетельствует анализ в агарозном геле, колориметрический анализ и ВЭЖХ - анализ, описанные в примере 3. Полученный продукт содержал более 90% суперспиральной плазмиды и менее чем 10% незамкнутой кольцевой плазмиды. Уровень РНК был ниже пределов обнаружения используемого анализа. Уровни геномной ДНК и белковых примесей были ниже пределов обнаружения используемого анализа. Полный выход суперспиральной плазмиды в конечной стадии процесса составлял приблизительно 60% от выхода суперспиральной плазмиды в осветленном лизате. Пример 5. Очистка плазмидной ДНК в мультиграммовом масштабе. 4,5 л Замороженной клеточной суспензииE.coli использовали для получения 33,7 л клеточной суспензии в буфере STET (8% сахарозы,2% Тритон, 50 мМ Трис-буфер, 50 мМ EDTA,рН 8,5), содержащем 2500 единиц/мл лизоцима. Вычисленная оптическая плотность суспензии при 600 нм составляла около 30. Полученную суспензию перемешивали при комнатной температуре в течение 15 мин для обеспечения тщательного смешивания, а затем инкубировали в течение 45 мин с перемешиванием при температуре 37 С. После инкубирования размешивание продолжали при комнатной температуре, и клеточную суспензию подавали насосом в теплообменник при скорости потока 500 мл/мин. Температуру бани поддерживали при 100 С, а измеренные температуры на входе и выходе клеточной суспензии составляли приблизительно 24 С и 70-77 С, соответственно. Клеточный лизат, выходящий из теплообменника, собирали в центрифужные пробирки Beckman (500 мл каждая), и полученный материал сразу центрифугировали в центрифугах Beckman J-21 в течение 50 мин при 9000 об/мин. После центрифугирования было обнаружено, что супернатант содержал в 4-5 раз больше плазмидного продукта, чем в том случае, когда инкубирование с лизоцимом не проводили. После центрифугирования, супернатант сразу подвергали диафильтрации против 3 объемов буфера ТЕ (25 мМ 14 Трис-EDTA при рН 8,0), а затем инкубировали с 20 х 105 единицами РНКазы E.coli в течение 2-4 ч при комнатной температуре. После завершения инкубирования раствор продукта диафильтровали против дополнительных 6 объемов буфера ТЕ с использованием мембраны с отсечением по молекулярной массе 100 кДа, а затем фильтровали через фильтр 0,45 мкм для удаления остаточного дебриса. Отфильтрованный лизат разводили 0,7 М NaCl в буфере 20 мМ бис/трис-пропан-NaCl при рН=7,5, а затем, разведенный фильтрат загружали на анионообменную колонку. Анионообменная колонка (3,6 литров POROS RI/M) была предварительно уравновешена 20 мМ бис/трис-пропаном и 0,7 М хлоридом натрия. Отфильтрованный лизат загружали на колонку. В этом случае на анионообменную колонку загружали 5 г сверхспиральной плазмиды. После загрузки колонку промывали 2-4 колоночными объемами 20 мМ бистрис-пропана и 0,7 М NaCl. Для удаления других белков E.coli, РНК, и некоторых эндотоксинов использовали градиент 0,7 М NaCl2,0 МNaCl в 20 мМ бис/трис-пропане в 10 объемах колонки. Фракцию сверхспиральной плазмиды элюировали 1,4-2,0 М хлоридом натрия. Фракцию сверхспиральной плазмиды, полученную с анионообменной колонки и содержащую 4 г суперспиральной плазмиды, затем 2-3 раза разводили апирогенной водой, доводили до 1,2%IPA, и рН доводили до 8,5 путем добавления 1 н.NaOH. Разведенную на анионообменной колонке фракцию суперспиральной плазмиды затем загружали на 7-литровую обратнофазовую колонку (POROS R2/M), которую предварительно уравновешивали 100 мМ бикарбонатом аммония, содержащим 1,2% IPA. В данном случае,3,2 г суперспиральной плазмиды загружали на обратнофазовую колонку, а затем эту колонку промывали 6-10 колоночными объемами 1,2%IPA в 100 мМ бикарбонате аммония. Эту интенсивную промывку осуществляли для удаления примесей. Элюирование проводили градиентом 1,2% IPA11,2% IPA в 5 объемах колонки. Фракцию суперспиральной плазмиды элюировали примерно при 4% IPA. Затем, фракцию продукта суперспиральной плазмиды, полученную с обратнофазовой колонки, концентрировали и подвергали диафильтрации в нормальный физиологический раствор с использованием мембраны с отсечением по молекулярной массе 30 кДа. Объем конечного продукта фильтровали через фильтр с диаметром пор 0,22 мкм. Вышеописанный метод очистки систематизировали в таблице 1, в которой приведены данные по удалению примесей, а также выходы для каждой из основных стадий очистки. Полный выход продукта, полученного в соответствии с заявленным способом, составлял более чем 50% от выхода суперспиральной плазмиды в осветленном клеточном лизате, на что указывал анализ, про 15 веденный с помощью анионообменной ВЭЖХ,описанной в примере 3. Чистота продукта была Таблица 1. Систематизированный метод очистки и выделения в мультиграммовом масштабе Геномная Плазмидный % Выхода Белок РНКLAL ДНК Стадия продукт (мг) на стадии(мг/мг) Осветленный лизат 6750 100 0,52 7,6 196 1,1 х 107 Концентрирование/РНКаза/диафильтрация/ конечная фильтра 6500 93 0,50 1,6 2,21 3,4 х 106 ция Анионообменная хроматография 4000 от 5000 80 0,41 0,3 0,1 1,2 х 104 2110 100 0,029 0,01 0,01 2,8 ция в конечный буфер Конечный выход 54 нижние пределы детекции аналитического метода ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ крупномасштабного выделения и очистки плазмидной ДНК из больших объемов ферментационной среды микробных клеток,включающий осуществление следующих стадий: а) сбор микробных клеток после их культивирования в больших объемах; б) добавление к собранным микробным клеткам необходимого количества лизирующего буфера, необязательно содержащего лизоцим; в) нагревание микробных клеток с лизирующим буфером до температуры 70 - 100 С в проточном теплообменнике при скорости потока 160 - 850 мл/мин с получением неочищенного лизата; г) центрифугирование неочищенного лизата и сбор супернатанта; д) фильтрацию и диафильтрацию супернатанта, собранного на стадии г), с получением фильтрата; е) обеспечение контактирования фильтрата, полученного на стадии д), с анионообменной матрицей; ж) элюирование и сбор плазмидной ДНК с анионообменной матрицы; з) обеспечение контактирования плазмидной ДНК, полученной на стадии ж), с матрицей,используемой для обратнофазовой жидкостной хроматографии высокого разрешения, и и) элюирование и сбор плазмидной ДНК с указанной на стадии ж) матрицы. 2. Способ по п.1, отличающийся тем, что дополнительно осуществляют концентрирование и/или диафильтрацию плазмидной ДНК,полученной на стадии и), в фармацевтически приемлемом носителе. 3. Способ по п.2, отличающийся тем, что дополнительно осуществляют стерилизацию плазмидной ДНК. 4. Способ по любому из пп.1-3, отличающийся тем, что на стадии в) нагревание осуществляют до температуры 70-77 С. 5. Способ по любому из пп.1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), содержит субмикрограммовую концентрацию лизоцима. 6. Способ по любому из пп.1-3, отличающийся тем, что дополнительно осуществляют обработку РНКазой любого продукта, полученного после осуществления стадии а). 7. Способ по любому из пп. 1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), представляет собой модифицированный SТЕТ-буфер. 8. Способ по любому из пп. 1-3, отличающийся тем, что лизирующий буфер, используемый на стадии б), представляет собой модифицированный STET-буфер, содержащий субмикрограммовую концентрацию лизоцима.
МПК / Метки
МПК: C12N 15/10, C12P 19/34
Метки: очистки, крупномасштабного, выделения, плазмидной, днк, способ
Код ссылки
<a href="https://eas.patents.su/10-785-sposob-krupnomasshtabnogo-vydeleniya-i-ochistki-plazmidnojj-dnk.html" rel="bookmark" title="База патентов Евразийского Союза">Способ крупномасштабного выделения и очистки плазмидной днк</a>