Способ лечения рассеянного склероза и фармацевтический состав, содержащий сополимер-1
Номер патента: 3128
Опубликовано: 27.02.2003
Авторы: Тейтельбаум Двора, Линенберг Милка, Села Михаэль, Гилберт Адриан, Ривон-Крейтман Ривка, Арнон Рут
Формула / Реферат
1. Способ лечения рассеянного склероза, включающий прием внутрь или ингаляцию терапевтически эффективного количества сополимера-1.
2. Способ по п.1, в котором терапевтически эффективное количество сополимера-1 составляет от 0,1 до 1000 мг в день.
3. Способ по п.1, в котором указанный сополимер-1 принимают орально.
4. Способ по п.1, в котором указанный сополимер-1 принимают назально.
5. Способ по п.3 или 4, в котором указанный сополимер-1 принимают в виде ингаляции.
6. Способ по п.3, в котором указанный сополимер-1 принимают орально в виде капсул с энтеросолюбильным покрытием.
7. Применение сополимера-1 для производства медикамента, покрытого энтеросолюбильной оболочкой и предназначенного для лечения рассеянного склероза.
8. Применение по п.7, в котором медикамент содержит дневную дозу сополимера-1 от 0,1 до 1000 мг.
9. Применение по п.7 или 8, в котором медикамент предназначен для орального введения.
10. Фармацевтический состав для лечения рассеянного склероза, включающий терапевтически эффективное количество сополимера-1 и фармацевтически пригодный носитель, при этом данный фармацевтический состав покрыт энтеросолюбильной оболочкой.
11. Фармацевтический состав по п.10, отличающийся тем, что данный фармацевтический состав является твердым или жидким.
12. Способ лечения рассеянного склероза у людей, включающий введение терапевтически эффективного количества фармацевтического состава по любому из пп.10-11.
Текст
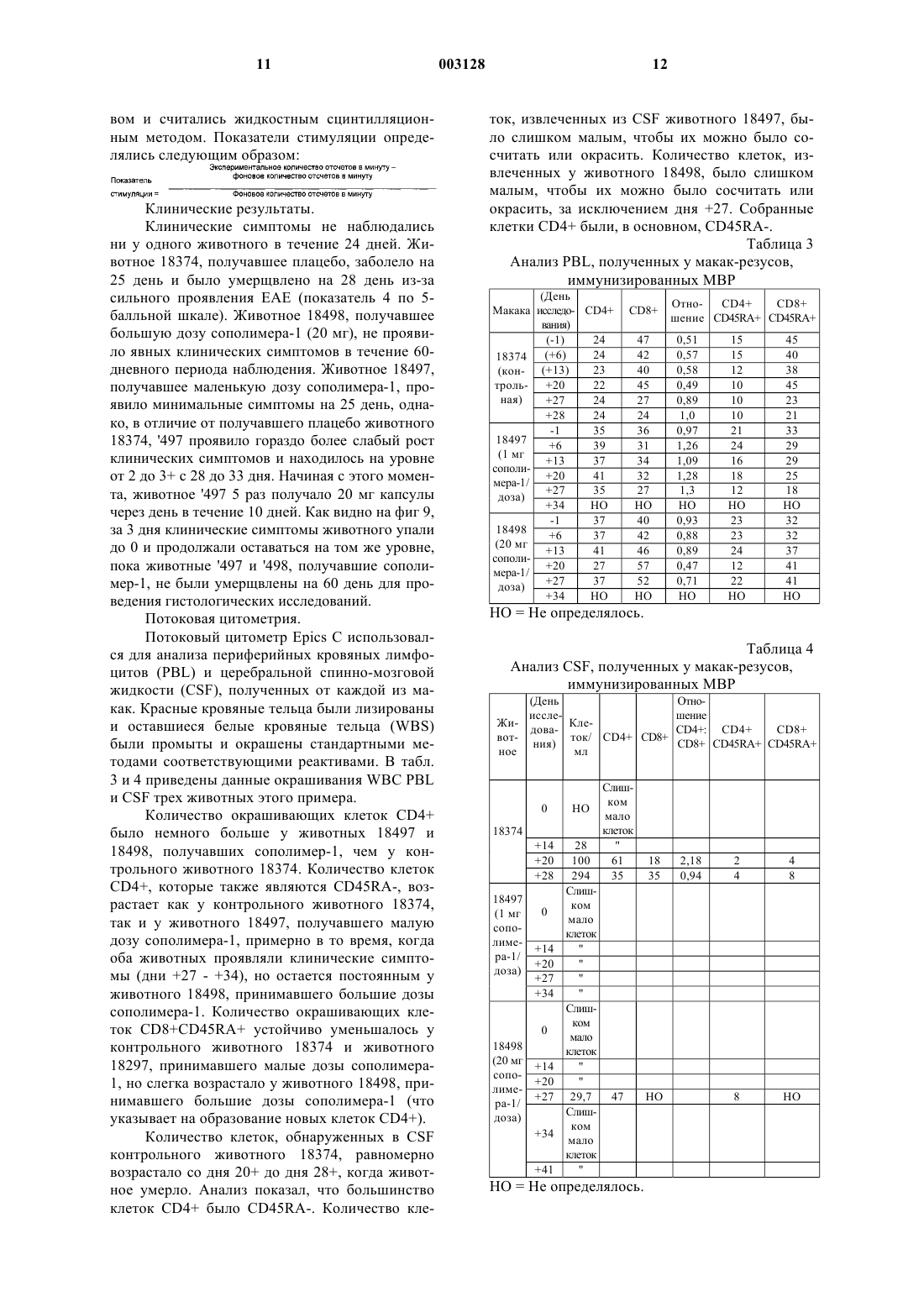
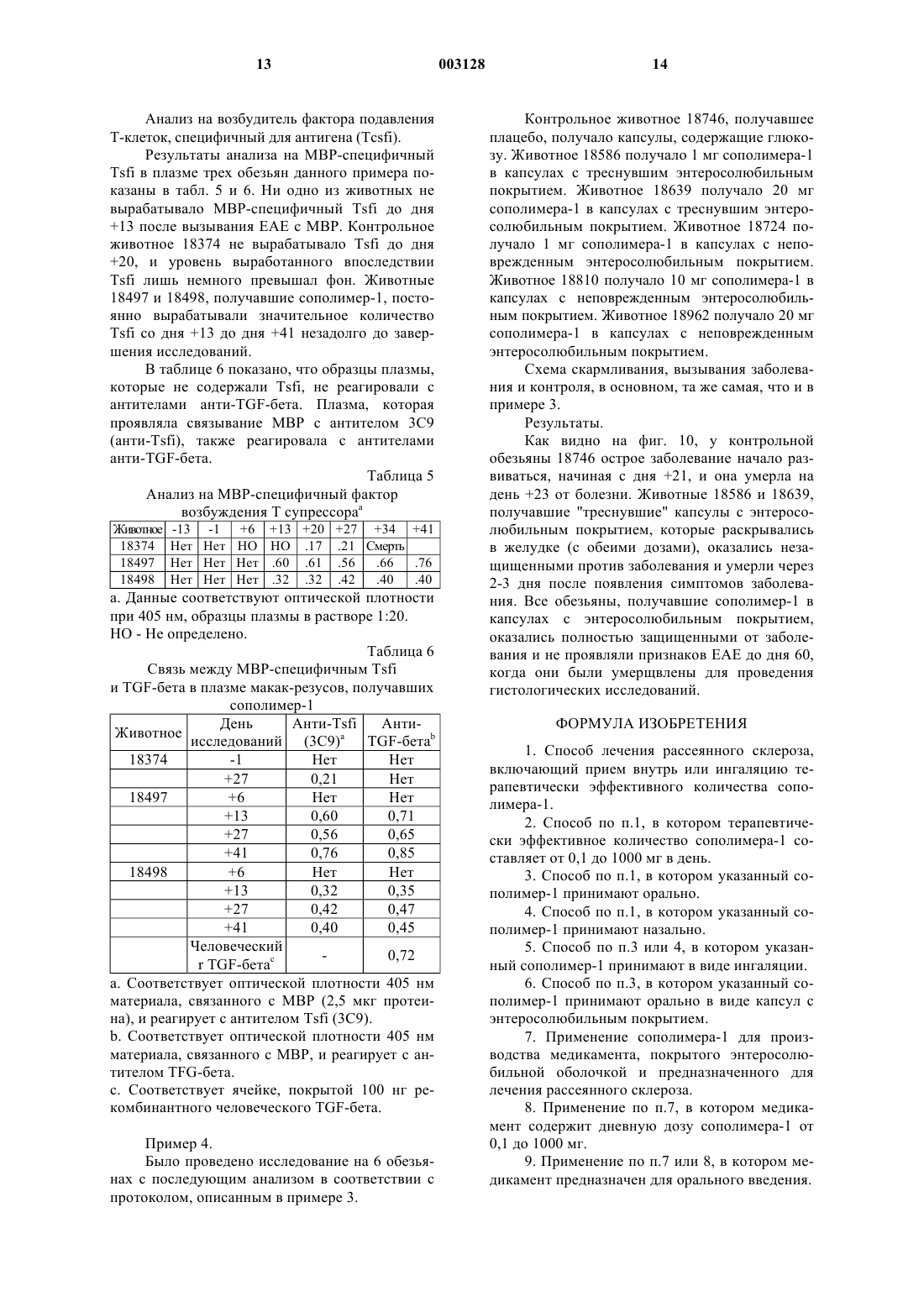
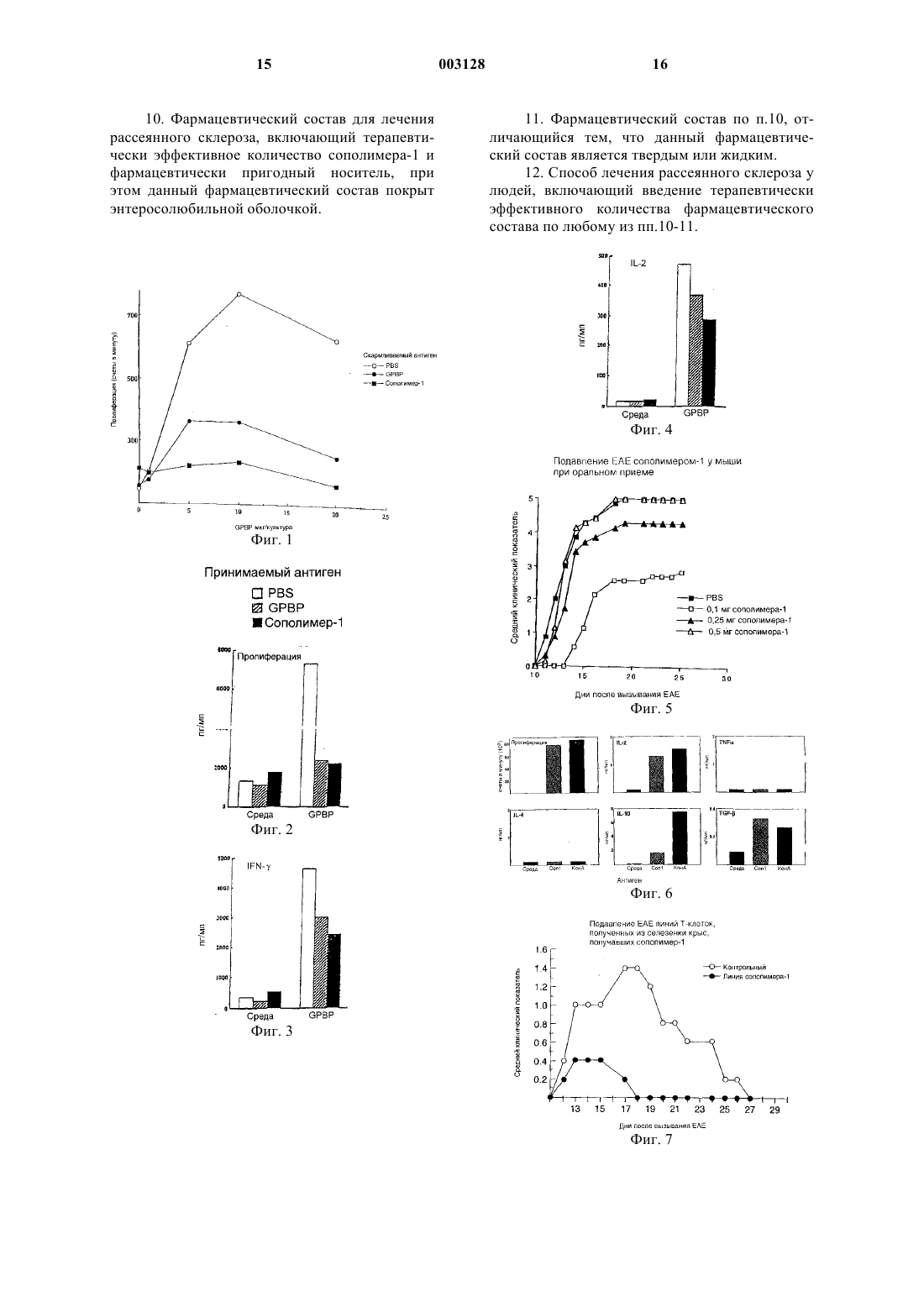
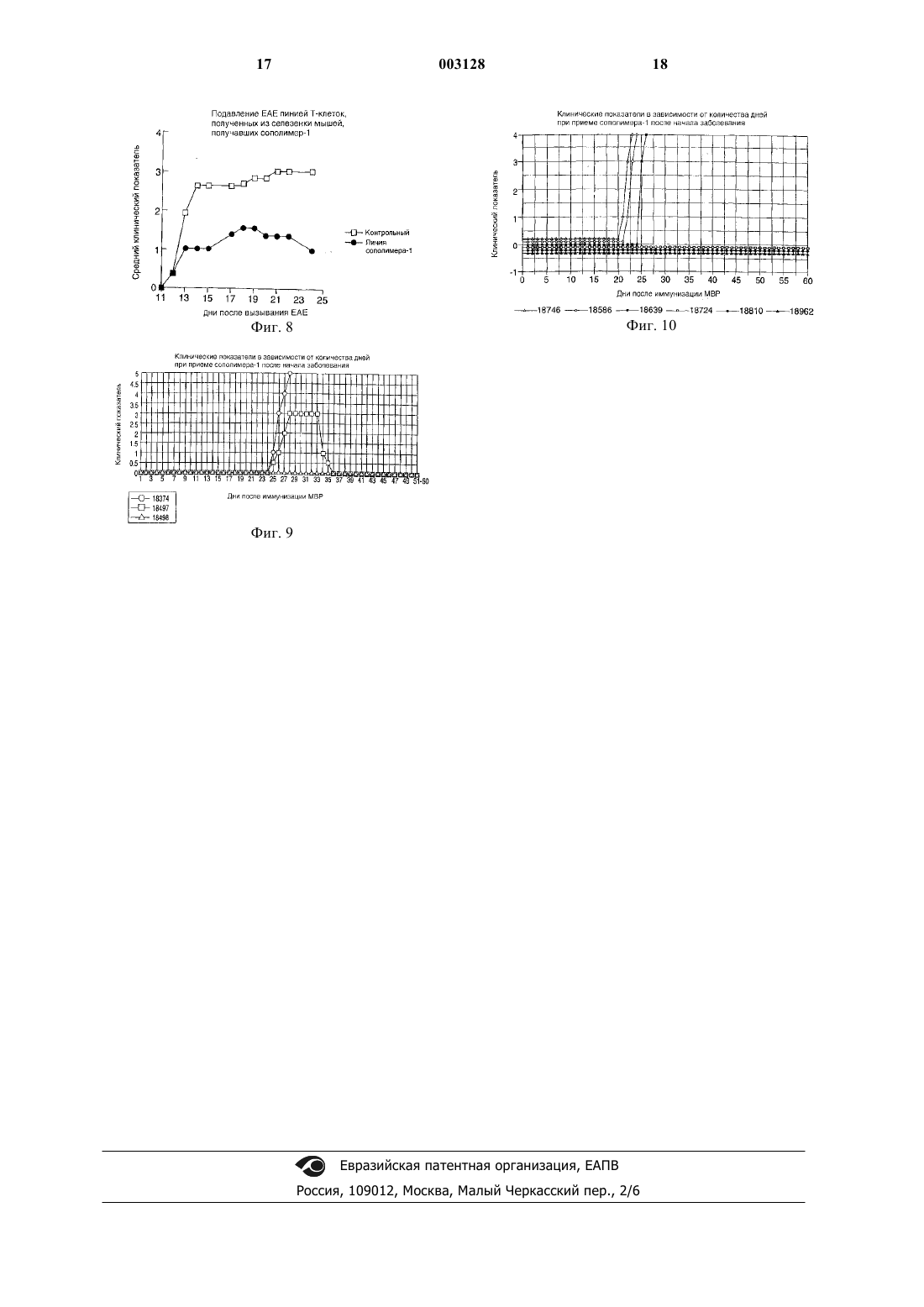
1 Область, к которой относится изобретение Настоящее изобретение относится к лечению рассеянного склероза путем приема внутрь или ингаляции сополимера-1 (описанного ниже). Настоящее изобретение также относится к фармацевтическому составу, включающему в себя сополимер-1, используемому для лечения рассеянного склероза, причем фармацевтический состав предназначен для приема внутрь или ингаляции. Предпосылки создания изобретения Сополимер-1, также известный как ацетат глатирамера и присутствующий на рынке под торговой маркой Сорахоnе, включает в себя ацетатные соли полипептидов, содержащие Lглутаминовую кислоту, L-аланин, L-тирозин иL-лизин. Средняя молярная доля аминокислот составляет 0,141, 0,427, 0,095 и 0,338 соответственно, и средний молекулярный вес сополимера-1 составляет от 4,700 до 11,000 Да. Он представляет собой неуатоантиген, который, как было показано, подавляет экспериментальный аллергический энцефаломиелит (ЕАЕ), вызываемый различными энцефалогенами, включая гомогенат спинного мозга мыши (MSCH), который содержит все миелиновые антигены, такие как миелиновый основной протеин (MBP) (Sela(Suppl. 1) S14-S22) во множестве разновидностей. ЕАЕ представляет собой принятую модель множественного склероза. Было показано, что сополимер-1 является активным при вводе подкожно, интраперитонеально, внутривенно или внутримышечно (D.Teitelbaum et al., Eur. J. Immunol. (1971) 1:242248; D. Teitelbaum et al., Eur. J. Immunol. (1973) 3:273-279). Было обнаружено, что в фазе III клинических испытаний ежедневные подкожные инъекции сополимера-1 замедляют развитие потери трудоспособности и снижают рецидив с случае обостряющегося-ремиссирующего множественного склероза (K.P. Johnson, Neurology (1995) 1:65-70). Терапия с использованием сополимера-1 в настоящее время ограничивается ежедневным подкожным введением. В настоящее время все утвержденные методы лечения рассеянного склероза включают в себя самостоятельную инъекцию активного вещества. Часто встречающиеся проблемы, связанные с инъекциями, включают в себя раздражение, аллергию, воспаления, боль и даже некроз ( в случае, по крайней мере, лечения интерфероном 1-В), а также проблемы с соблюдением лечебного режима. Таким образом, желательно иметь альтернативный метод лечения. Патент ЕР 359.783 описывает лечение аутоиммунных заболеваний путем орального приема 2 аутоантигенов. Он описывает оральный прием МBР при лечении множественного склероза. Оральный прием аутоантигена был названWO 91/12816, WO 91/08760 и WO 92/06704 описывают лечение аутоиммунных заболеваний с использованием метода "оральной толерантности" с различными аутоантигенами. Однако ни одна из этих работ не описывает лечение рассеянного склероза путем орального приема неаутоантигенного сополимера-1. Содержание этих патентов и все ссылки на литературу, сделанные выше, включаются в описание изобретения путем ссылки. Таким образом, объектом настоящего изобретения является способ лечения рассеянного склероза путем орального приема сополимера-1 путем приема внутрь или ингаляции. Краткое описание чертежей На фиг. 1 и 2 показано действие сополимера-1 на иммунную реакцию крыс (фиг. 1) и мышей (фиг. 2), на миелиновый основной протеин морской свинки (GPBP), определенное путем пролиферации клеток селезенки. Фиг. 3 и 4 показывают влияние сополимера-1 на клеточное деление. Фиг. 5 показывает подавление ЕАЕ у мышей путем орального ввода сополимера-1. Мыши (SJL/JxBAB/c) F1 принимали PBS , 0,1 мг сополимера-1 , 0,25 мг сополимера-1 ,или 0,5 мг сополимера-1 . Все дозы скармливались 7 раз в день по дням -7, -5, -3, 0, 2, 4 и 6. ЕАЕ вводился в день 0 путем инъекции MSCH. На фиг. 6 изображены пролиферация и цитокинетическая секреция линии Т-клеток, полученных из селезенки крыс, получавших сополимер-1. Клетки были выращены в среде сополимера-1 (50 мкг/мл) или конкавалина А (Кон А)(5 мкг/мл). Были измерены реакции пролиферации и цитокинетической секреции на эти антигены. На фиг. 7 изображено подавление ЕАЕ линией Т-клеток, полученных из селезенки крыс,получавших сополимер-1. Клетки (20 х 106/крыса) вводились интраперитонеально через 3 дня после стимуляции сополимером-1 с последующим вызыванием ЕАЕ. На фиг. 8 изображено подавление ЕАЕ линией Т-клеток, полученных из селезенки мышей,получавших сополимер-1. Клетки(15 х 106/мышь) вводились интраперитонеально через 3 дня после стимуляции сополимером-1 с последующим вызыванием ЕАЕ. На фиг. 9 изображен график зависимости клинического показателя от количества дней введения сополимера-1 при заболевании ЕАЕ у трех макак-резусов. На фиг. 10 изображен график зависимости клинического показателя от количества дней введения сополимера-1 при заболевании ЕАЕ у шести макак-резусов в сравнительном испыта 3 нии фармацевтических доз с покрытием и без. Нулевые значения по Y-оси разделены друг от друга для лучшей видимости результатов. Подробное описание изобретения Настоящее изобретение относится к использованию сополимера-1 для приготовления медикаментов для лечения рассеянного склероза. Медикаменты принимаются путем приема внутрь или ингаляции. Настоящее изобретение также относится к способу лечения рассеянного склероза, включающему применение терапевтически эффективного количества сополимера-1 путем приема внутрь или ингаляции. Настоящее изобретение также относится к фармацевтическому составу, принимаемому внутрь или путем ингаляции, содержащему фармацевтически приемлемый носитель и терапевтически эффективное количество сополимера-1, причем фармацевтический состав используется для лечения рассеянного склероза. Как утверждалось выше, сополимер-1 включает в себя ацетатные соли полипептидов,содержащие L-глутаминовую кислоту, Lаланин, L-тирозин и L-лизин. Средняя молярная доля аминокислот составляет 0,141, 0,427, 0,095 и 0,338 соответственно, и средний молекулярный вес сополимера-1 составляет от 4,700 до 11,000 Да. Настоящее изобретение основано на наблюдении, например, того, что оральный прием сополимера-1 эффективно подавляет ЕАЕ и,следовательно, имеет терапевтическую ценность при лечении множественного склероза. Как предполагается, сополимер-1 входит в контакт с теми лимфоидными тканями в слизистой выстилке, которые, как считается, являются основным источником сенсибилизации иммунной системы. Эти слизистые выстилки могут быть обнаружены (но не только) в синусах,трахее, бронхиальных путях (где они называются BALT или бронхиальными лимфоидными тканями) и желудочно-кишечных выстилках(называемых GAT или кишечными лимфоидными тканями). Таким образом, прием сополимера-1 может включать способы, в которых сополимер-1 вводится в тело путем приема внутрь или ингаляции. Например, сополимер-1 может быть введен через рот, через желудочный зонд,путем ингаляции в бронхиальные пути или носовой ингаляции. В одном из примеров осуществления настоящего изобретения сополимер-1 принимается орально в количестве от 0,1 до 1000 мг в день, одной дозой или несколькими дозами. Квалифицированные специалисты понимают,что терапевтически эффективная доза в общем случае зависит от возраста, пола и физического состояния пациента, а также от других применяемых методов лечения. Определение оптимальной, терапевтически эффективной дозировки входит в компетенцию специалистов. 4 При оральном приеме сополимера-1 он может смешиваться с другими съедобными веществами и употребляться в твердом, полутвердом виде, в виде суспензии или эмульсии; он может смешиваться с фармацевтически приемлемыми носителями, включая воду, суспендирующие агенты, эмульгаторы, вкусовые добавки и подобные вещества. В одном из применений настоящего изобретения состав покрывается энтеросолюбильной оболочкой. Использование энтеросолюбильных оболочек широко известно. Например, К. Lehman, Acrylis Coatings in Controlled Release Tablet Manufacturer, Manufacturing Chemist and Aerosol News, p. 39 (June 1973) и К. Lehman, Programmed Drug Release From OralProgram Forms; Pharma Int., vol. ISS 3 1971, p. 34-41, описывают энтеросолюбильные покрытия Eudragit S и Eudragit L. Handbook of Pharmaceutical Excipients, 2-издание, также описывает применение Eudragit S и Eudragit L. L30D55 является одним из Eudragit, который может быть использован в настоящем изобретении. Сополимер-1 также может вводиться через нос в некоторых из описанных выше форм путем ингаляции или в виде капель. Кроме того,для доставки сополимера-1 на слизистую выстилку трахейных и бронхиальных путей может использоваться оральная ингаляция. Сополимер-1 может быть приготовлен известными способами, например способом, описанным в патенте США 3.849.550, в которомN-карбоксиангидриды тирозина, аланина, глутамата -бензила и -N-трифторацетиллизина полимеризуются при комнатной температуре в безводном диоксане с диэтиламином в качестве инициатора. Освобождение -карбокcильной группы глутаминовой кислоты производится бромидом водорода в ледяной уксусной кислоте, после чего трифторацетиловые группы удаляются из лизиновых остатков с помощью пиперидина 1 М. Как описано в PCT/WО 95/31990, сополимер-1, имеющий нужный средний молекулярный вес около 72 кДа, может быть, в предпочтительном варианте, приготовлен способом,включающим реакцию защищенного сополимера-1 с бромисто-водородной кислотой с образованием трифторацетилового сополимера-1, обработку трифторацетилового сополимера-1 в водном растворе пиперидина и очистку сополимера-1, так что в результате получается сополимер-1 с нужным средним молекулярным весом. Настоящее изобретение будет описано на примерах, приведенных ниже. Однако настоящее изобретение не ограничивается ими. Если не оговорено иное, все доли, проценты и т.п. являются весовыми. Пример 1. Антигены. Сополимер-1, приготовленный в соответствии со способом,описанным вPCT/WO95/31990, был получен от Teva Pharmaceutical Industries Ltd., Израиль. GPBP был приготовлен из спинного мозга морской свинки путем экстрагирования кислотой и осаждения в сульфате аммония, как описано в Hirshfield H. etal., Febs Lett (1970) 7 317-320. Животные. Самки мыши (PL/JxSJL/J) F1 (возраст - 810 недель) были получены от Jackson Laboratories (Bar Harbor, M.E.). Самки крыс ЛьюисаHarlan-Olac (Bicester, G.B.). Введение и оценка ЕАЕ. Мышам вводилось 200 мкг GPBP, эмульгированного в равном объеме готового адъюванта Френда (CFA), содержащего 4 мг/мл микобактерий туберкулеза (H37Ra) (Difco Lab.,Detroit, Mich.). Эмульсия в полном объеме 0,1 мл вводилась во все четыре подушечки лап. Сразу же после и через 24 ч внутривенно вводился токсин коклюша (250 нг/мышь) (Sigma). Крысы иммунизировались 25 мкг GPBP,эмульгированного 1:1 в CFA, содержащем 4 мг/млH37Ra. Эмульсия в полном объеме 0,1 мл вводилась путем инъекции в подушечки двух задних лап. Животные ежедневно обследовались на признаки болезни, начиная с 10 дня после вызывания болезни. ЕАЕ оценивался следующим образом: 0 - нет заболевания, 1 - слабый хвост, 2- паралич двух задних конечностей, 3 - паралич всех четырех конечностей, 4 - агония, 5 смерть. Проведение оральной толерантности. Мышам скармливалось 250 мкг GPBP или сополимера-1, растворенного в соляном буферном растворе фосфата (PBS) в дни -7, -5, -3, 0, 2,4 и 6 путем ввода в желудок через питательную иглу размера 18 из нержавеющей стали (Thomas). Вызывание ЕАЕ проводилось в 0 день. Крысам скармливался 1 мг GPBP или сополимера-1, растворенного в PBS путем ввода в желудок через стерильную питательную трубку(Uno Plast, Дания). Скармливание проводилось 5 раз (полная доза 5 мг) перед инфицированием с интервалом 2-3 дня. Заболевание ЕАЕ вызывалось через 2 дня после последнего скармливания. Контрольным мышам и крысам скармливался PBS. Пролиферационный анализ. Пролиферационная реакция клеток селезенки исследовалась через 10-11 дней после вызывания ЕАЕ, описанного выше. Клетки от 3 животных из каждой группы собирались и выращивались до утраивания (5 х 105 клеток мышей и 2 х 105 клеток крыс) на пластинах микротитратора с различными концентрациями антигена(GPBP) в окончательном объеме 0,2 мл. Пластины микротитратора содержали питательную среду RPMI 1640 (полученную от Sigma Biochemicals, Сент-Луис, Миссури) с 1% аутологической сыворотки. После 72 ч инкубации клетки 6 подверглись облучению 3H-тимидином 1 мкКи в течение 18 ч, после чего были собраны на фильтровальную бумагу для измерения радиоактивности. Анализ цитокинетической секреции. Селезенка извлекалась через 10-11 дней после введения ЕАЕ и собирались клетки от трех мышей из каждой группы. Клетки(5x106/мл) выращивались до удвоения на пластинке с лунками в RPMI 1640 с добавлением 10% FCS (сыворотки из зародыша) в присутствии или при отсутствии антигена (GPBP 100 фг/мл). Супернатант собирался через 24-40 ч выращивания. Количественный анализ ЕLISА для IL-2, IFN-, IL-4, IL-6 и IL-10 проводился с использованием спаренных mAbs, характерных для соответствующего цитокинеза (Pharmingen,Ла Джолла, Калифорния), в соответствии с инструкциями производителя. Результаты. Эффективность орально принимаемого сополимера-1 в предотвращении клинических проявлений ЕАЕ у крыс Льюиса сравнивалась с эффективностью GPBP в условиях, аналогичным условиям исследования действия GPBP(P.J. HigginsH.L. Weiner, J. Immunol. (1988) 140 440-445). Результаты, приведенные в табл. 1,показывают, что сополимер-1 был более эффективен, чем GPBP, и существенно уменьшил заболеваемость (54% подавления) и серьезность(57% подавления) ЕАЕ по сравнению с крысами, которым для контроля скармливался PBS. Таблица 1 Подавление ЕАЕ у крыс путем орального приема сополимера-1 Скармливаемый антиген Средний макс. пока- Средний зательсреднеквад- срок начала ратичное отклонение заболевания 1,80,5 Каждая цифра представляет собой кумулятивный результат 3-5 независимых экспериментов. Величины р представляют собой статистическую значимость отличия от контрольной группы (тест точности Фишера). Максимальный средний показатель рассчитывался для всей группы. Эффект скармливания антигена на иммунную реакцию на GPBP. Эффект орального приема сополимера-1 иGPBP на иммунную реакцию на заболевание,включая антиген-GPBP, был проверен на мышах и крысах. Результаты приведены на фиг. 1, где показано уменьшение пролиферации клеток каждым из орально принимаемых составов (сополимер-1 или GPBP) в суспензии клеток селезенки крыс, стимулированной GPBP (на фиг. 2 показаны те же самые результаты для мышей). 7 Как видно, оральный прием сополимера-1 приводит к почти полному подавлению пролиферативных реакций на GPBP в этих двух случаях. В обоих случаях сополимер-1 был более эффективен, чем GPBP, в подавлении реакции на GPBP. Уровни цитокинеза были измерены в супернатантах культур клеток селезенки, полученных от мышей (фиг. 3 и 4). Контрольным мышам скармливался IL-2, IFN- и IL-6 (не показан), выделенный PBS как реакция на GPBP. У мышей, которым скармливался сополимер-1 или GPBP, количество воспалительных клетокIL-2 и IFN- Th1, образованных как реакция на стимулирование GPBP, было ниже, чем в контрольной группе, причем сополимер-1 оказался более эффективным супрессантом. IL-4 и IL-10 не были обнаружены ни при каком методе лечения. Результаты показывают, что сополимер-1 эффективно подавляет ЕАЕ при оральном приеме. Защитный эффект орально принимаемого сополимера-1 связан с регуляцией иммунной реакции Т-клеток на GPBP, таких как пролиферация и образование воспалительных клеток (IL-2 и IFN-). Пример 2. Дополнительное изучение подавления ЕАЕ путем орального приема сополимера-1 было проведено на крысах и мышах. В этих исследованиях была установлена оптимальная доза для каждого случая. Чтобы понять механизм, лежащий в основе орального подавления ЕАЕ сополимером-1, специфичная для сополимера-1 линия Т-клеток была выделена из селезенки животных, получавших сополимер-1. Исследовались реактивность in vitro клеточных линий и их эффект in vivo на вызывание заболевания. Материалы и методы Выделение специфичных для сополимера 1 линий Т-клеток. Крысам Льюиса 1 мг сополимера-1 давался 5 раз и мышам (SJL/JxBALB/c) F1 250 мкг мополимара-1 давались 7 раз с интервалом 2-3 дня. Через 4-12 дней после приема последней дозы животные умерщвлялись и у них извлекалась селезенка. Клетки селезенки 3 животных собирались и выращивались (50 х 106/пластина) с сополимером-1 (50 мкг) в среде, содержащей 1% аутологической сыворотки в течение 4 дней. Каждые 14-21 день клетки (4-6 х 106/пластина) рестимулировались 3-дневным воздействием сополимера-1(500 мкг), присутствующего в изогенных облученных (3000 рад) тимоцитах крыс (100 х 106/пластина) или спленоцитах мышей (50 х 106/пластина). После стимуляции происходило размножение в 10% супернатанте клеток селезенки нормальной мыши, активированных Кон А, являющихся фактором роста Т-клеток (TCGF). Анализ пролиферации. Линия Т-клеток (1 х 104 клеток) была выращена вместе с облученными (3000 рад) тимоци 003128 8 тами (крыс - 1 х 106) или спленоцитами (мышей 5 х 105) и указанными антигенами (10 мкг сополимера-1; 1 мкг Кон А) в конечном объеме 0,2 мл на пластинах микротитратора. После 48 ч инкубации клетки подверглись облучению 3Hтимидином и собирались через 6-12 ч. Цитокинетический анализ. Т-клетки клеточной линии крыс(0,5 х 106/мл) выращивались вместе с облученными тимоцитами (10 х 106) в присутствии или в отсутствие указанных антигенов (50 мкг сополимера-1, 5 мкг Кон А). Клетки выращивались в течение 24 ч в RPMI 1640 с 10% FCS для измерения IL-2, TNF, IL-4 и IL-10 и в не содержащей сыворотки среде - DCCM-1 (Biological Industries, Kibbutz Beit Haemek, Israel) - в течение 72 ч для измерения TGF. Уровень цитокинеза в супернатанте измерялся с помощью количественного анализа ELISA с использованием пар моноклональных антител,характерных для соответствующего цитокинеза. Вызывание ЕАЕ. Мышам (SJL/JхBALB/c) F1 во все четыре подушечки лап вводилось путем инъекции 2 мг гомогенизированного (MSCH) эмульгированного в отношении 1:1 в CFA, содержащего 1 мг/млH37Ra (Difco lab, Detroit, Mich), спинного мозга мышей. Токсин коклюша (250 нг/мышь) дважды вводился внутривенно, один раз сразу же после и один раз спустя 48 ч. Результаты. 1. Изучение реакции на дозу у мышей и крыс. Крысы получали 5 раз 0,5, 1 или 2 мг сополимера-1 в соответствии с установленным протоколом (см. Материалы и методы), после чего у них вызывался ЕАЕ. Результаты, приведенные в табл. 2, показывают, что наиболее эффективной дозой был 1 мг сополимера-1; 0,5 мг и 2 мг сополимера-1 были менее эффективны в подавлении ЕАЕ. Мыши (SJL/JxBALB/c) F1 7 раз получали 0,1, 0,25 или 0,5 мг сополимера-1 на -7, -5, -3, 0,2, 4 и 6 день путем ввода через трубку в желудок. ЕАЕ вызывался в день 0 путем инъекцииMSCH. Результаты, приведенные на фиг. 5, показывают, что оральный прием сополимера-1 может подавить заболевание мыши и наиболее эффективной дозой является 0,1 мг сополимера 1. Доза 0,25 мг сополимера-1 была менее эффективной, и доза 0,5 мг не оказала эффекта. Таким образом, результаты, полученные на крысах и мышах, показывают, что сополимер-1 при оральном приеме имеет оптимальную дозу и превышение оптимальной дозы приводит к неэффективному подавлению ЕАЕ. 2. Исследования с помощью Ts-линий, характерных для сополимера-1, полученных от животных, получавших сополимер-1. Линии Т-клеток супрессоров, характерных для сополимера-1, выделялись из селезенки крыс и мышей, оказавшихся не восприимчивыми к ЕАЕ в результате приема сополимера-1. Пролиферация и реакция цитокинетической секреции такой линии, полученной от крыс, показана на фиг. 6. Эта линия пролиферировала как реакция на сополимер-1 и выделила IL-2, некоторое количество IL10 и TGF, но не TNF или IL-4. Этот цитокинетический профиль сопоставим с клетками типа Тh3, которые вводились путем орального МВРin vivo. Линии клеток вводились через 3 дня после стимуляции in vivo сополимером-1(20 х 106 клеток/крысу, введенных интраперитонеально, и 15 х 106 клеток/мышь, введенных внутривенно). ЕАЕ у животных вызывался сразу же после переноса клеток. Результаты, приведенные на фиг. 7 и 8, показывают, что заболевание было существенно подавлено в животныхреципиентах. Таким образом, линии Т-клеток крыс и мышей, получавших сополимер-1, адаптивно переносят невосприимчивость к ЕАЕ,полученную в результате орального приема сополимера-1. Эти клетки активно уменьшают патологическую иммунную реакцию in vivo. Таблица 2 Изучение влияния дозы при оральном приеме сополимера-1 крысами Скармливаемый антиген Рассчитано по средним показателям. Каждое значение заболеваемости представляет кумулятивный результат двух отдельных экспериментов. Средний максимальный клинический показатель был рассчитан для всей группы. Пример 3. Был исследован эффект орального приема сополимера-1 на последствия вызывания ЕАЕ у макак-резусов. Материалы. Сополимер-1 был предоставлен TevaPharmaceutical Industries Ltd. в твердых капсулах в желатиновом покрытии с двумя дозировками: 1 мг сополимера-1 и 20 мг сополимера-1. Каждая дозировка была составлена с использованием маннитола и покрытия из Eudragit L30D55. Плацебо контрольных капсул составляли капсулы, содержащие 5 мг сахара. Бычий МВР был приобретен у Life Technologies, Grand Island, New York. Этот материал представляет собой сверхчистый препарат,дающий единственную полосу при 18,5 Kd после SDS-PAGE и окрашивания серебром. 10 Протокол скармливания. 3 макаки-резуса обрабатывались следующим образом. Одна макака была контрольной и получала плацебо-капсулы (содержащие только 5 мг глюкозы). Вторая и третья макаки получали капсулы, содержащие сополимер-1 в дозировке 1 мг/раз и 20 мг/раз соответственно. Животные получали капсулы через день, всего по 10 капсул: 5 раз до вызывания болезни (иммунизация в день 0) и 5 раз после иммунизации. Вызывание заболевания. Заболевание вызывалось в день 0 путем подкожной инъекции 8 мг бычьего МВР и 3 мгH37Ra M. tuberculosis в FCA в стопы, полный объем инъекции от 0,1 до 0,15 мл в каждую стопу. Животные наблюдались на клинические проявления ЕАЕ, различные иммунологические маркеры сыворотки и CSF, MRI спинного мозга и черепной MRI. Клинические показатели. Симптоматические показатели следующие: 0, нормальные результаты неврологического обследования; 1, потеря веса, гипоксемия, зевота, замедленная реакция, раздражительность или сонливость; 2, слабые неврологические симптомы, индифферентность, слюнотечение,непослушность конечностей, тремор, непроизвольные звуки и рассеянный взгляд; 3, умеренные неврологические симптомы, слепота (зрачки не реагируют на свет), акинезия, слабость ног или паралич; 4, сильные неврологические симптомы, полукома, кома, тетраплегия; 5, смерть. Индуцированная антигенами пролиферация лимфоцитов. Гепаринизированные образцы крови были растворены 1:1 в сбалансированном соляном растворе Ханкса (BSS), содержащем 5% инактивированной нагревом сыворотки из зародыша(FCS), и размещены в гипакфеколевый градиент. Центрифугирование (2000 об./мин в течение 20 мин при комнатной температуре) восстановило растворенную плазму и отделило лимфоциты на внутренней поверхности. Восстановленные лимфоциты были промыты 3 раза вBSS-5% FCS Ханкса и повторно суспендированы в среде RPMI 1640, содержащей среду RPMI 1640, 10% FCS и 1% следующих реактивов: неэфирные аминокислоты, пировиноградный натрий, L-глутамин, 2-монотиогликоль и пенициллин/стрептомицин. Восстановленные лимфоциты были пересчитаны и повторно суспендированы с окончательной концентрацией 2 х 106/мл. Культуры, содержащие 100 мкл суспензии клеток и 100 мкл МВР (20 мкг/ячейка),100 мкл/сополимера-1 (100 мкг/ячейка) или 100 мкл Кон А (1 мкг/ячейка), были высажены на пластины микротитратора с 96 ячейками с круглым дном. Культуры содержались при температуре 37 С в 5% СO2 в течение 6 дней. На 5 день выращивания каждая ячейка обрабатывалась 3 Нтимидином 1 мкКи в течение 16-18 ч. На 6 день культуры собирались автоматическим устройст 11 вом и считались жидкостным сцинтилляционным методом. Показатели стимуляции определялись следующим образом: Клинические результаты. Клинические симптомы не наблюдались ни у одного животного в течение 24 дней. Животное 18374, получавшее плацебо, заболело на 25 день и было умерщвлено на 28 день из-за сильного проявления ЕАЕ (показатель 4 по 5 балльной шкале). Животное 18498, получавшее большую дозу сополимера-1 (20 мг), не проявило явных клинических симптомов в течение 60 дневного периода наблюдения. Животное 18497,получавшее маленькую дозу сополимера-1, проявило минимальные симптомы на 25 день, однако, в отличие от получавшего плацебо животного 18374, '497 проявило гораздо более слабый рост клинических симптомов и находилось на уровне от 2 до 3+ с 28 до 33 дня. Начиная с этого момента, животное '497 5 раз получало 20 мг капсулы через день в течение 10 дней. Как видно на фиг 9,за 3 дня клинические симптомы животного упали до 0 и продолжали оставаться на том же уровне,пока животные '497 и '498, получавшие сополимер-1, не были умерщвлены на 60 день для проведения гистологических исследований. Потоковая цитометрия. Потоковый цитометр Epics С использовался для анализа периферийных кровяных лимфоцитов (PBL) и церебральной спинно-мозговой жидкости (CSF), полученных от каждой из макак. Красные кровяные тельца были лизированы и оставшиеся белые кровяные тельца (WBS) были промыты и окрашены стандартными методами соответствующими реактивами. В табл. 3 и 4 приведены данные окрашивания WBC PBL и CSF трех животных этого примера. Количество окрашивающих клеток CD4+ было немного больше у животных 18497 и 18498, получавших сополимер-1, чем у контрольного животного 18374. Количество клетокCD4+, которые также являются CD45RA-, возрастает как у контрольного животного 18374,так и у животного 18497, получавшего малую дозу сополимера-1, примерно в то время, когда оба животных проявляли клинические симптомы (дни +27 - +34), но остается постоянным у животного 18498, принимавшего большие дозы сополимера-1. Количество окрашивающих клеток CD8+CD45RA+ устойчиво уменьшалось у контрольного животного 18374 и животного 18297, принимавшего малые дозы сополимера 1, но слегка возрастало у животного 18498, принимавшего большие дозы сополимера-1 (что указывает на образование новых клеток CD4+). Количество клеток, обнаруженных в CSF контрольного животного 18374, равномерно возрастало со дня 20+ до дня 28+, когда животное умерло. Анализ показал, что большинство клеток CD4+ было CD45RA-. Количество кле 003128 12 ток, извлеченных из CSF животного 18497, было слишком малым, чтобы их можно было сосчитать или окрасить. Количество клеток, извлеченных у животного 18498, было слишком малым, чтобы их можно было сосчитать или окрасить, за исключением дня +27. Собранные клетки CD4+ были, в основном, CD45RA-. Таблица 3 Анализ PBL, полученных у макак-резусов,иммунизированных МBР Слишком мало клеток 28" 29,7 47 НО Слишком мало клеток Анализ на возбудитель фактора подавления Т-клеток, специфичный для антигена (Tcsfi). Результаты анализа на МBР-специфичныйTsfi в плазме трех обезьян данного примера показаны в табл. 5 и 6. Ни одно из животных не вырабатывало МВР-специфичный Tsfi до дня+13 после вызывания ЕАЕ с МВР. Контрольное животное 18374 не вырабатывало Tsfi до дняTsfi лишь немного превышал фон. Животные 18497 и 18498, получавшие сополимер-1, постоянно вырабатывали значительное количествоTsfi со дня +13 до дня +41 незадолго до завершения исследований. В таблице 6 показано, что образцы плазмы,которые не содержали Tsfi, не реагировали с антителами анти-ТGF-бета. Плазма, которая проявляла связывание МВР с антителом 3 С 9-13 -1 +6 +13 Нет Нет НО НО Нет Нет Нет .60 Нет Нет Нет .32 а. Данные соответствуют оптической плотности при 405 нм, образцы плазмы в растворе 1:20. НО - Hе определено. Таблица 6 Связь между МВР-специфичным Tsfi и TGF-бета в плазме макак-резусов, получавших сополимер-1 АнтиДень Анти-Tsfi Животное исследований (3 С 9)a ТGF-бетаb 18374r TGF-бетаc а. Соответствует оптической плотности 405 нм материала, связанного с МВР (2,5 мкг протеина), и реагирует с антителом Tsfi (3C9).b. Соответствует оптической плотности 405 нм материала, связанного с МВР, и реагирует с антителом TFG-бета. с. Соответствует ячейке, покрытой 100 нг рекомбинантного человеческого TGF-бета. Пример 4. Было проведено исследование на 6 обезьянах с последующим анализом в соответствии с протоколом, описанным в примере 3. 14 Контрольное животное 18746, получавшее плацебо, получало капсулы, содержащие глюкозу. Животное 18586 получало 1 мг сополимера-1 в капсулах с треснувшим энтеросолюбильным покрытием. Животное 18639 получало 20 мг сополимера-1 в капсулах с треснувшим энтеросолюбильным покрытием. Животное 18724 получало 1 мг сополимера-1 в капсулах с неповрежденным энтеросолюбильным покрытием. Животное 18810 получало 10 мг сополимера-1 в капсулах с неповрежденным энтеросолюбильным покрытием. Животное 18962 получало 20 мг сополимера-1 в капсулах с неповрежденным энтеросолюбильным покрытием. Схема скармливания, вызывания заболевания и контроля, в основном, та же самая, что и в примере 3. Результаты. Как видно на фиг. 10, у контрольной обезьяны 18746 острое заболевание начало развиваться, начиная с дня +21, и онa умерлa на день +23 от болезни. Животные 18586 и 18639,получавшие "треснувшие" капсулы с энтеросолюбильным покрытием, которые раскрывались в желудке (с обеими дозами), оказались незащищенными против заболевания и умерли через 2-3 дня после появления симптомов заболевания. Все обезьяны, получавшие сополимер-1 в капсулах с энтеросолюбильным покрытием,оказались полностью защищенными от заболевания и не проявляли признаков ЕАЕ до дня 60,когда они были умерщвлены для проведения гистологических исследований. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рассеянного склероза,включающий прием внутрь или ингаляцию терапевтически эффективного количества сополимера-1. 2. Способ по п.1, в котором терапевтически эффективное количество сополимера-1 составляет от 0,1 до 1000 мг в день. 3. Способ по п.1, в котором указанный сополимер-1 принимают орально. 4. Способ по п.1, в котором указанный сополимер-1 принимают назально. 5. Способ по п.3 или 4, в котором указанный сополимер-1 принимают в виде ингаляции. 6. Способ по п.3, в котором указанный сополимер-1 принимают орально в виде капсул с энтеросолюбильным покрытием. 7. Применение сополимера-1 для производства медикамента, покрытого энтеросолюбильной оболочкой и предназначенного для лечения рассеянного склероза. 8. Применение по п.7, в котором медикамент содержит дневную дозу сополимера-1 от 0,1 до 1000 мг. 9. Применение по п.7 или 8, в котором медикамент предназначен для орального введения. 15 10. Фармацевтический состав для лечения рассеянного склероза, включающий терапевтически эффективное количество сополимера-1 и фармацевтически пригодный носитель, при этом данный фармацевтический состав покрыт энтеросолюбильной оболочкой. 16 11. Фармацевтический состав по п.10, отличающийся тем, что данный фармацевтический состав является твердым или жидким. 12. Способ лечения рассеянного склероза у людей, включающий введение терапевтически эффективного количества фармацевтического состава по любому из пп.10-11.
МПК / Метки
МПК: A61P 37/02, A61K 38/02
Метки: способ, склероза, фармацевтический, содержащий, рассеянного, лечения, состав, сополимер-1
Код ссылки
<a href="https://eas.patents.su/10-3128-sposob-lecheniya-rasseyannogo-skleroza-i-farmacevticheskijj-sostav-soderzhashhijj-sopolimer-1.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения рассеянного склероза и фармацевтический состав, содержащий сополимер-1</a>
Предыдущий патент: Гетероарильные производные сукцинамидов и их применение в качестве ингибиторов металлопротеиназы
Следующий патент: Замещенные трициклические соединения.
Случайный патент: Способ получения метаксалона