Способы лечения или профилактики рвоты с помощью агентов, усиливающих секрецию гормона роста
Формула / Реферат
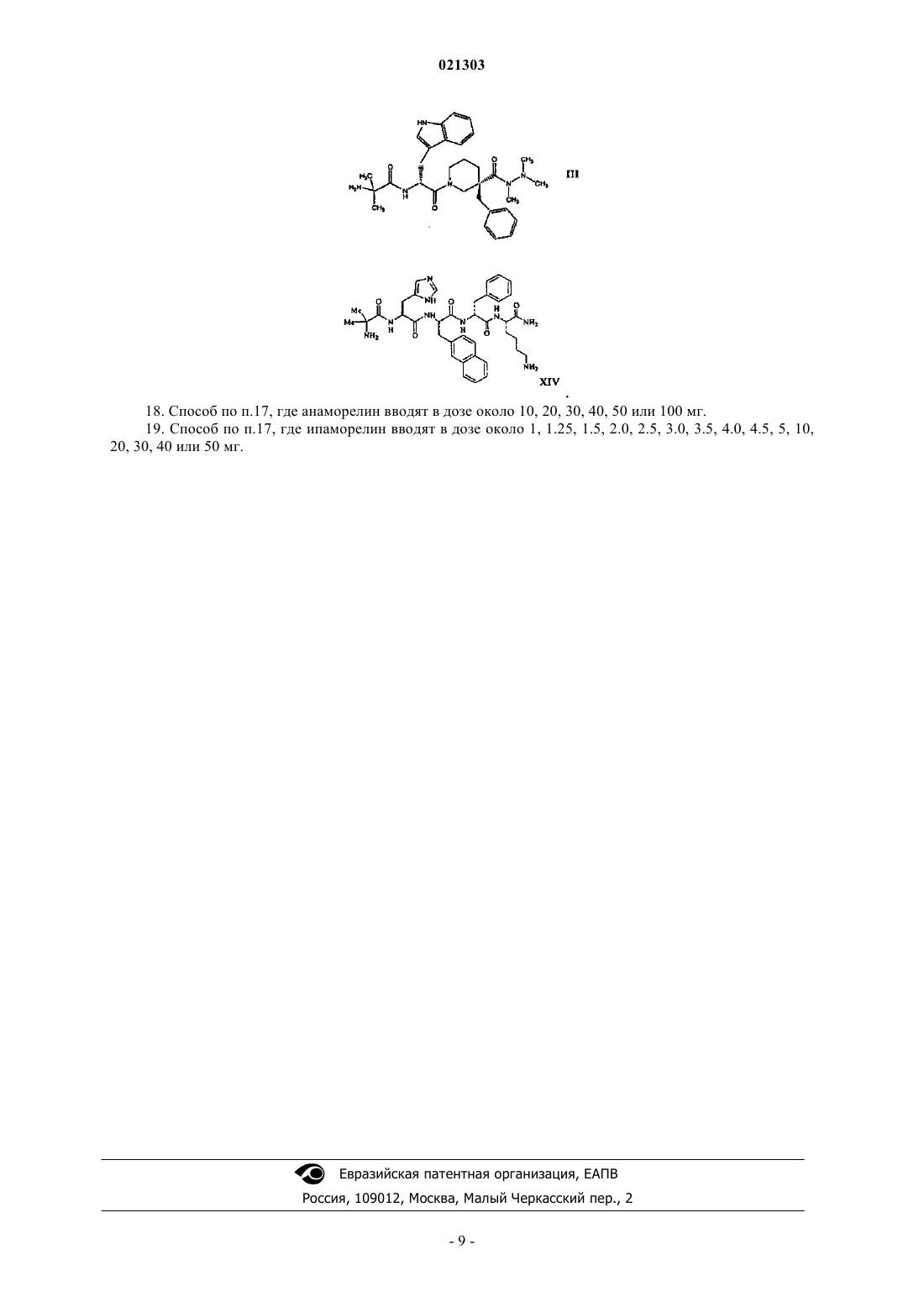
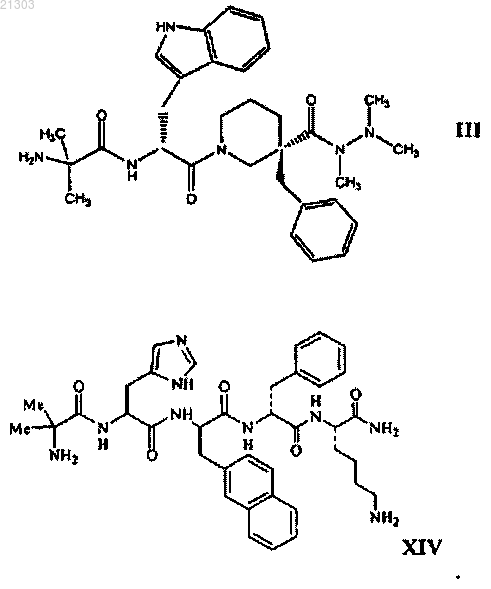
1. Способ лечения субъекта, испытывающего рвоту, вызванную химиотерапией или хирургическим вмешательством, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли
2. Способ по п.1, где лечение характеризуется увеличением латентного периода отсроченной рвоты у субъекта.
3. Способ по п.1, где лечение характеризуется снижением количества эпизодов тошноты и рвоты.
4. Способ по п.1, где рвота вызвана хирургическим вмешательством.
5. Способ по п.1, где рвота вызвана химиотерапией.
6. Способ по п.1, где вводимое соединение является анаморелином.
7. Способ по п.6, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг.
8. Способ по п.7, где анаморелин вводят в разовой дозе в день или многократных дозах в день.
9. Способ по п.8, где многократные дозы являются 1-4 дозами в день.
10. Способ по п.1, где вводимое соединение является ипаморелином.
11. Способ по п.10, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10, 20, 30, 40 или 50 мг.
12. Способ по п.11, где ипаморелин вводят в разовой дозе в день или многократных дозах в день.
13. Способ по п.12, где многократные дозы являются 1-4 дозами в день.
14. Способ увеличения латентного периода у субъекта до начала рвоты, вызванной химиотерапией, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли

15. Способ по п.14, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг.
16. Способ по п.14, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10, 20, 30, 40 или 50 мг.
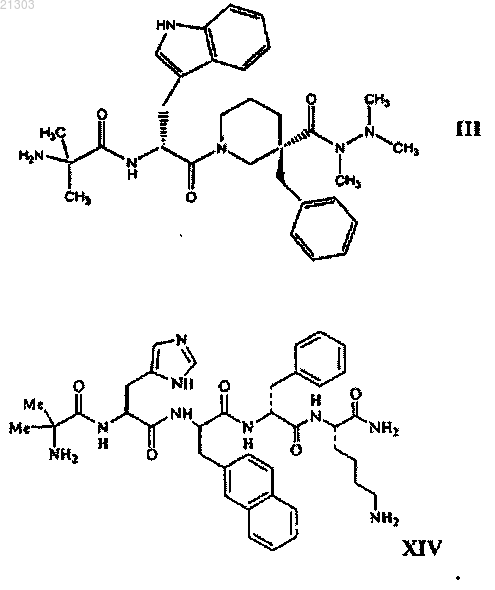
17. Способ снижения числа эпизодов позывов к рвоте у субъекта, вызванной химиотерапией, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли
18. Способ по п.17, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг.
19. Способ по п.17, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10, 20, 30, 40 или 50 мг.
Текст
СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РВОТЫ С ПОМОЩЬЮ АГЕНТОВ,УСИЛИВАЮЩИХ СЕКРЕЦИЮ ГОРМОНА РОСТА Изобретение относится к способам лечения или профилактики рвоты у субъекта путем введения указанному субъекту терапевтически эффективного количества усиливающего выделение гормона роста соединения или его фармацевтически приемлемой соли, а именно соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли. Изобретение также относится к способу увеличения латентного периода у субъекта до начала рвоты, вызванной химиотерапией, а также к способу снижения числа эпизодов позывов к рвоте у субъекта, вызванной химиотерапией. Указанные способы включают введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли. Родственные заявки Рассматриваемая заявка заявляет приоритет относительно предварительной заявки на патент США 60/922742, поданной 10 апреля 2007 г. Полное содержание вышеуказанной заявки специально включено сюда в качестве ссылки. Предпосылки настоящего изобретения Рвота представляет собой хорошо известный и часто встречающийся побочный эффект, возникающий в результате приема противораковых химиотерапевтических агентов, таких как цисплатин. Это вызывает серьезные проблемы при химиотерапии раковых заболеваний, и у некоторых пациентов рвота настолько серьезна, что приходится прерывать лечение. Поэтому противорвотные агенты часто вводят для облегчения указанных побочных эффектов, вызываемых противораковыми химиотерапевтическими агентами. Применяемыми противораковыми агентами обычно являются производные бензамида, такие как метоклопрамид, который обладает допаминовой антагонистической активностью. Ввиду присущей им допаминовой антагонистической активности производные бензамида, такие как метоклопрамид, сами по себе демонстрируют серьезные и нежелательные побочные эффекты, такие как экстрапирамидальные эффекты, то есть старческую дискинезию, острую дистонию, акатизию и тремор. Другие противорвотные лекарственные средства включают антагонисты 5-НТ 3, например онданстрон; кортикостероиды,например дексаметазон; и антагонисты NK1, например апрепитант. Указанные способы лечения не могут адекватно соответствовать нуждам пациента. Учитывая вышесказанное, в высшей степени необходима эффективная терапия рвоты, которая минимизирует или ослабляет один или более побочных эффектов способов лечения, которые в настоящее время доступны. Сущность изобретения Настоящее изобретение относится к способам лечения субъектов, у которых наблюдается рвота или которые подвержены риску ее возникновения. В настоящем изобретении также предложены способы лечения симптомов, сопровождающих раковые заболевания по данным теста ASAS. Указанные способы включают введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения, усиливающего секрецию гормона роста, или его фармацевтически приемлемой соли. Указанные способы настоящего изобретения можно использовать для обеспечения облегчения состояния пациента, испытывающего рвоту, или пациентов с симптоматикой раковых заболеваний, проходящих лечение химиотерапией, или тех, которым предстоит химиотерапия, или тех, которые выздоравливают после химиотерапии, при таких смертельных заболеваниях, как рак. Более конкретно, в настоящем изобретении предложен способ лечения рвоты у нуждающегося в этом субъекта путем введения указанному субъекту эффективного количества агента, усиливающего секрецию гормона роста. Примеры агентов, усиливающих выделение гормона роста, представлены формулами III или XIV или их фармацевтически приемлемыми солями. Один из агентов, усиливающих секрецию гормона роста, представлен структурной формулой III или его фармацевтически приемлемой солью. Соединение формулы III подробно раскрыто в патенте США 6576648, выданном Хансену с сотр.,полное содержание которого включено в описание в качестве ссылки. Химическое название соединения формулы III представляет собой 2-амино-N-(1R)-2-[3-бензил-3-(N,N',N'-триметилгидразинокарбонил)пиперидин-1-ил]-1-1 Н-индол-3-ил)-2-оксоэтил-2-метилпропионамид и носит название RC-1291 и анаморелин. Другое соединение, усиливающее выделение гормона роста, представлено структурной формулой или его фармацевтически приемлемой солью (ипаморелин). Подробное описание изобретения Настоящее изобретение основано на неожиданном открытии того, что пероральное введение агониста рецептора грелина уменьшает тошноту, если его вводят раковым пациентам, и ослабляет тяжелые симптомы рака у субъектов, больных раком и/или проходящих противораковое химиотерапевтическое лечение. Соответственно в настоящем изобретении предложены способы лечения или профилактики синдромов тошноты и рвоты и для ослабления тяжелых раковых симптомов у субъекта. Указанные способы включают введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения, усиливающего выделение гормона роста, или его фармацевтически приемлемой соли. Такое соединение, усиливающее выделение гормона роста, является соединением, представленным любой из формулIII или XIV, или его фармацевтически приемлемой солью. Указанные способы настоящего изобретения можно использовать, например, для лечения или профилактики тошноты у субъектов, которые проходят химиотерапевтическое лечение клеточного пролиферативного заболевания, например ракового заболевания. Настоящее изобретение также относится к способу увеличения латентного периода у субъекта до начала рвоты, вызванной химиотерапией, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV(ипаморелин) или его фармацевтически приемлемой соли Изобретение также относится к способу снижения числа эпизодов позывов к рвоте у субъекта, вызванной химиотерапией, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли. Соединения, усиливающие выделение гормона роста/агонисты грелина В том смысле, как использовано в описании, выражение "соединение, усиливающее выделение гормона роста", относится к веществу (например, к молекуле, к соединению), которое промотирует (индуцирует или усиливает) по меньшей мере одну функциональную характеристику рецептора соединения,усиливающего выделение гормона роста (рецептора GHS). Примерами соединений, усиливающих выделение гормона роста, являются имитаторы грелина, такие как агонисты грелина. В одном варианте соединение, усиливающее выделение гормона роста, или агонист грелина, связывается с рецептором GHS или рецептором грелина (то есть представляет собой агонист грелина или рецептора грелина) и индуцирует выделение гормона роста. Соединение, обладающее агонистической активностью в отношении рецептора GHS (например, являющееся агонистом рецептора GHS или рецептора грелина), можно идентифицировать и оценить его активность, используя любой подходящий способ. Так, например, аффинность связывания агониста рецептора GHS с рецептором GHS можно определить, используя анализы связывания с рецепторами, и стимуляцию гормона роста можно оценить, как раскрыто в патенте США 6919315, включенном в описание в качестве ссылки. Рецепторы GHS или грелина (GRLN) экспрессируются в гипоталамусе, гипофизе и поджелудочной железе, наряду с другими тканями. Активация указанных рецепторов в гипофизе индуцирует секрецию гормона роста. Кроме индуцирования секреции гормона роста, как показали последние исследования,соединение, усиливающее выделение гормона роста, может повысить аппетит и вес тела. Также известно, что при типичных дозах соединение, усиливающее выделение гормона роста, индуцирует секрециюIGF-1. Примеры соединений, усиливающих выделение гормона роста, раскрыты в патентах США 6303620, 6576648, 5977178, 6566337, 6083908, 6274584 и в патенте США 6919315, причем полное содержание всех этих патентов включено в описание в качестве ссылки. Соединение, усиливающее выделение гормона роста, представляет собой 2-амино-N-(1R)-2-[3-бензил-3(N,N',N'-триметилгидразинокарбонил)пиперидин-1-ил]-1-1 Н-индол-3-ил)-2-оксоэтил-2-метилпропионамид,представленный структурной формулой III и его фармацевтически приемлемые соли. Другим соединением, усиливающим высвобождение гормона роста, является ипаморелин (формула В том смысле, как использованы в описании, термины "рвотный синдром", "вызывающее рвоту состояние" "рвота", "тошнота" и "рвота" используют взаимозаменяемо, и они имеют одинаковое значение. Рвотные синдромы характеризуются рефлекторным действием удаления содержимого желудка через рот, или ощущением того, что указанное рефлекторное действие может осуществиться. Вызывающее рвоту состояние часто связано с химиотерапевтическим лечением (вызываемые химиотерапией тошнота и рвота (CINV или хирургическим вмешательством (послеоперационная тошнота и рвота (PONV. Рвотные синдромы, обусловленные химиотерапевтическим лечением, можно подразделить на три типа:(1) острые, (2) замедленные и (3) опережающие. Острая рвота наблюдается в течение около 24 ч после химиотерапии и замедленная наблюдается от около 24 до около 120 ч после химиотерапии (Grunberg etal. (2004) Cancer 100:2261-8). В том смысле, как использован в описании, термин "тяжесть симптомов рака" используют для оценки качества жизни субъектов с раковыми заболеваниями или степени облегчения существующих симптомов рака. В одном варианте тяжесть симптомов рака у субъекта определяют, используя систему оценки симптомов Андерсона (Anderson Symptom Assessment System) (ASAS). Тяжесть всех симптомов рака или состояние рвоты можно охарактеризовать, используя ряд шкал,которые известны специалистам. Например, система оценки симптомов Андерсона (Anderson SymptomAssessment System) (ASAS) представляет собой модифицированную форму системы оценки симптомов Эдмонтона (Edmonton Symptom Assessment System), которая включает оценку боли, усталости, тошноты,депрессии, беспокойства, сонливости, краткости дыхания, аппетита, сна и самочувствия (см. Palmer et al.(2005) J. Pain and Symptom Management 6:565-571). ASAS требует, чтобы пациенты определили тяжесть каждого из указанных симптомов по шкале 0-10, где 0 = отсутствие (или наилучшее) и 10 = наибольшее(или худшее из мыслимых). Оценка ASAS субъектов представляет собой полную сумму их численных оценок для указанных десяти симптомов. Альтернативно, шкалу Хескета (Hesketh) можно использовать для классификации рвотогенности противораковой химиотерапии (Hesketh et al. (1997) J. Clin. Oncology 15:103-109). Шкала Хескета предлагает пять уровней рвотогенности. Уровень 1 составляют агенты, которые не являются рвотогенными; уровень 2 составляют агенты, которые вызывают рвоту у 10-30% пациентов; уровень 3 составляют агенты, которые являются умеренно рвотогенными, причем рвоту испытывают 30-60% пациентов; уровень 4 составляют агенты, которые вызывают рвоту у 60-90% пациентов; и уровень 5 составляют агенты, которые вызывают рвоту более чем у 90% пациентов. Термин "субъект" в том смысле, как использован в описании, относится к животным, таким как млекопитающие, включая, но ими не ограничиваясь, приматов (например, людей), коров, овец, коз, лошадей, свиней, собак, кошек, кроликов, морских свинок, крыс, мышей или другие виды коров, овец, лошадей, собак, кошек, крыс или мышей. В предпочтительном варианте млекопитающим является человек. В том смысле, как использованы в описании, термины "лечение" и "способ лечения" относятся к лечению, ослаблению или профилактике рвоты у субъекта. В том смысле, как использован в описании, термин "терапевтически эффективное количество" относится к количеству, которого достаточно для создания необходимой биологической реакции. В рассматриваемом изобретении необходимой биологической реакцией является лечение или профилактика рвоты. Указанное терапевтически эффективное количество или доза будет зависеть от возраста, пола, веса пациента и существующего медицинского состояния пациента. Специалист сможет определить соответствующие дозы в зависимости от указанных и других факторов для достижения необходимой биологической реакции. Подходящая дневная доза соединения, усиливающего выделение гормона роста, может находиться в интервале от около 10, 20, 30, 40, 50 или 100 мг (для анаморелина) и около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5,4.0, 4.5, 5, 10, 20, 30, 40 или 50 мг (для ипаморелина). Указанную дозу можно вводить в виде одной дозы или в виде нескольких доз, например от 1 до 4 или более раз в день. Если используют многократные дозы, количество каждой дозы может быть одинаковым или различным. Введение соединений Введение можно осуществить при необходимости для профилактики или лечения состояния рвоты. Введение соединения, усиливающего выделение гормона роста, может происходить до, после или одновременно с введением химиотерапевтического агента, который, по-видимому, и вызывает тошноту или рвоту. Фармацевтические композиции и способы их введения Соединения, усиливающие выделение гормона роста (именуемые также "активные соединения"),настоящего изобретения можно включить в фармацевтические композиции. Такие композиции обычно включают соединения, усиливающие выделение гормона роста, и фармацевтически приемлемый носитель. В том смысле, как использован в описании, термин "фармацевтически приемлемый носитель" включает растворители, дисперсионные среды, покрытия, противобактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и т.п., совместимые с фармацевтическим введением. Дополнительные активные соединения также могут быть включены в указанные композиции. Фармацевтические композиции могут быть заключены в контейнер, пакет или дозатор вместе с инструкциями для введения. Фармацевтические композиции приготавливают таким образом, чтобы они были совместимы с предполагаемым способом их введения. Примеры способов введения включают парентеральное, например внутривенное, чрескожное, подкожное, пероральное (например, путем ингаляции), трансдермальное(наружное), через слизистую и ректальное введение. Растворы или суспензии для парентерального, чрескожного или подкожного введения могут включать следующие компоненты: стерильный разбавитель,такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин,пропиленгликоль или другие синтетические растворители; противобактериальные агенты, такие как бензиловый спирт или парабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферные соединения, такие как ацетаты, цитраты или фосфаты, и агенты для установления тоничности, такие как хлорид натрия или декстроза. Величину рН можно регулировать, используя кислоты и основания, такие как хлористоводородная кислота или гидроксид натрия. Препараты для парентерального введения могут быть заключены в ампулы, одноразовые шприцы или в содержащие несколько доз пузырьки, изготовленные из стекла или пластика. Соединения, предназначенные для использования в способе настоящего изобретения, можно подготовить для введения любым удобным способом, таким как для перорального или парентерального, например трансдермального, через слизистую (например, сублингвального, лингвального, (транс)буккального), вагинального (например, транс- и перивагинального), (интра)назального и(транс)ректального), подкожного, внутримышечного, чрескожного, интраартериального, внутривенного,путем ингаляции и наружного введения. В предпочтительных вариантах настоящего изобретения соединения, усиливающие выделение гормона роста, вводят перорально. Подходящие композиции и дозированные формы могут представлять собой таблетки, капсулы, таблетки в виде капсул, пилюли, гелевые капсулы, пастилки, дисперсии, суспензии, растворы, сиропы, гранулы, шарики, трансдермальные пластыри, гели, порошки, пилюли, взвеси, лепешки, кремы, пасты, пластыри, лосьоны, диски, суппозитории, жидкие спреи, сухие пудры или композиции в виде аэрозолей. Предпочтительно, чтобы соединения вводили перорально. Подходящие пероральные дозированные формы включают, например, таблетки, капсулы или таблетки в виде капсул, приготовленные обычными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза,микрокристаллическая целлюлоза или фосфат кальция); смазывающие агенты (например, стеарат магния, тальк или двуокись кремния); разрыхлители (например, натрийкрахмалгликоллят) или смачивающие агенты (например, натрийлаурилсульфат). При желании на таблетки можно нанести покрытие, например, чтобы обеспечить легкость набухания или обеспечить замедленное выделение активного агента,используя соответствующие способы. Жидкие препараты для перорального введения могут быть в форме растворов, сиропов или суспензий. Жидкие препараты (например, растворы, суспензии и сиропы) пригодны также для перорального введения и их можно приготовить, используя обычные способы, с фармацевтически приемлемыми агентами, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или съедобные гидрированные жиры); эмульгирующие агенты (например, лецитин или акация); неводные носители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). В том смысле, как использован в описании, термин "фармацевтически приемлемая соль" относится к соли предназначенного для введения соединения, полученного из фармацевтически приемлемых нетоксичных кислот, включая неорганические кислоты, органические кислоты. Примерами таких неорганических кислот являются хлористо-водородная, бромисто-водородная, азотная, серная и фосфорная кислоты. Подходящие органические кислоты можно выбрать, например, из алифатических, ароматических, карбоциклических и сульфоновых классов органических кислот, примерами которых являются муравьиная, уксусная, пропионовая, янтарная, камфорсульфоновая, лимонная, фумаровая, глюконовая, изотионовая, молочная, яблочная, винно-каменная, пара-толуолсульфоновая, гликолевая, глюкуроновая,малеиновая, фуранкарбоновая, глутамовая, бензойная, антраниловая, салициловая, фенилуксусная, миндальная, эмбоновая (памовая), метансульфоновая, этансульфоновая, пантотеновая, бензолсульфоновая(безилат), стеариновая, сульфаниловая, альгиновая, галактуроновая кислоты и т.п. Раскрытые. Следует понимать, что соединения, усиливающие выделение гормона роста, можно идентифицировать, например, скринируя библиотеки или коллекции молекул, используя соответствующие способы. Другим источником представляющих интерес соединений являются комбинаторные библиотеки, которые могут включать множество структурно отличающихся типов молекул. Комбинаторные библиотеки можно использовать для выделения наилучших соединений или для оптимизации ранее идентифицированных подходящих соединений. Такие библиотеки можно создать известными способами или с помощью комбинаторной химии и соответствующих способов скринирования. Примеры Далее настоящее изобретение иллюстрируется следующими примерами, которые никоим образом его не ограничивают. Пример 1. Было сконструировано дважды слепое, с контролируемым плацебо, рандомизированное исследование для определения возможности использования соединений, усиливающих выделение гормона роста,для лечения состояний рвоты. 82 человека были включены в 12-недельный параллельный эксперимент. Из 82 субъектов 74 классифицировали как подлежащую лечению группу (ITT). У всех этих 74 субъектов был активный рак, они получали по меньшей мере одну дозу исследуемого лекарственного средства и им проводили по меньшей мере одно измерение эффективности после дозы. 74 пациента разделили на две группы: плацебо-группа и RC-1291-группа. 30 из 36 пациентов плацебо-группы и 33 из 38 пациентов RC1291-группы получали одну и ту же форму химиотерапии. Группа RC-1291 получала 50 мг RC-1291 в двух 25-мг капсулах ежедневно. Плацебо-группа получала 2 капсулы ежедневно. Эффект от введения RC-1291 раковым пациентам сравнивали с эффектом плацебо, которое вводили аналогичной группе пациентов. Для определения способности RC-1291 уменьшать тяжесть симптомов у раковых пациентов, то есть показатель качества жизни, пациентов подвергали тесту в соответствии с системой оценки симптомов Андерсона (Anderson Symptom Assessment System) (ASAS) до, во время и после завершения исследований. Тест ASAS проводят, опрашивая пациентов (в соответствии с оценочной шкалой 0-10) относительно тяжести 10 симптомов: боль, усталость, тошнота, депрессия, беспокойство, сонливость, краткость дыхания, аппетит, сон и общее самочувствие (см. Palmer et al. (2005) J. Pain иSymptom Management 6:565-571). Приводимый далее текст отражает и преобразует оценки ASAS таким образом, что наивысшие значения соответствуют лучшему качеству жизни. После 12 недель исследований, во время которых пациенты получали стандартное лечение симптомов тошноты, пациенты, которым вводили RC-1291, сообщили об увеличенной полной оценке ASAS по сравнению с базовым значением 1,52 по сравнению с уменьшением оценки ASAS относительно базового значения 5,13 у пациентов, которым вводили плацебо. Общая разница в полной оценке ASAS между двумя группами, 6,66, оказалась статистически значимой (р-0,0287), что указывает на значительное улучшение качества жизни и ослабление тяжести симптомов рака у пациентов, которых лечили RC-1291,по сравнению с пациентами, получавшими плацебо. В частности, раковые пациенты, которых лечилиRC-1291, продемонстрировали статистически значимое уменьшение симптомов тошноты в шкале ASAS по сравнению с пациентами, получавшими плацебо (полное различие между двумя группами = 1,46, р = 0,0046). В отдельном перекрестном исследовании 16 раковых пациентов лечили RC-1291 или плацебо, как раскрыто выше, в течение 3 дней, отменяли лечение на 5 дней и затем вводили плацебо или RC-1291 (какой бы они не получали в начальный период в 3 дня). 12 из 16 пациентов плацебо-группы и 11 из 16 пациентов RC-1291-группы получали некоторую форму химиотерапии. Полное различие в шкале оценок ASAS симптомов тошноты, наблюдавшееся между двумя группами: уменьшение тошноты наблюдалось при лечении RC-1291 и усиление тошноты наблюдалось у пациентов, лечившихся плацебо. Полное различие между лечением, 0,71, приблизительная статистическая значимость (р = 0,0756). Приведенные результаты показывают, что RC-1291 приводит к резкому наступлению эффекта против тошноты, который наблюдается в течение 3 дней. В целом, приведенные результаты демонстрируют, что в отличие от пептида грелина, который, как было показано, проявляет противорвотный эффект только при интрацеребровентрикулярном введении,агонисты рецепторов грелина, такие как RC-1291, демонстрируют противорвотные свойства при системном введении, например при пероральном введении. Пример 2. Фармакологическое исследование оценки противорвотной активности ипаморелина у хорьков. Цель указанного исследования состоит в оценке противорвотной реакции ипаморелина после однократной внутривенной инъекции (медленный болюс) хорькам, обработанным цисплатином. Методы и схема эксперимента. 30 самцов хорьков (возраст 24 недели) используют в этом эксперименте. Сразу по прибытии всех животных подвергают общему физическому осмотру, который осуществляют квалифицированные ветеринары для того, чтобы убедиться в нормальном состоянии здоровья. Между прибытием животных и началом обработки оставляют период акклиматизации по крайней мере в одну неделю для того, чтобы животные привыкли к лабораторному окружению. Животных помещают индивидуально в клетки из нержавеющей стали с полом типа прутков, снабженные клапаном автоматической подачи воды. Каждую клетку тщательно помечают, используя цветные карты, в которых указывают проект, группу, номер животного и пол. Каждое животное идентифицируют, используя метку на ухе. Животных произвольно распределяют в следующие группы: а - Цисплатин (10 мг/кг) вводят как одну внутрибрюшинную инъекцию перед введением контрольного/сравнительного/тестируемого соединения,b - животные, которым вводили две отдельные внутривенные инъекции контрольного/сравнительного/тестируемого соединения: первую вводят сразу после введения цисплатина; вторую вводят на 30 мин позже,с - животное 104 было заменено животным 114 до начала обработки в связи с общим состоянием здоровья. Приготовление дозированных композиций Перед введением доз соответствующие количества тестируемого соединения растворяют в носителе для приготовления исходного раствора с концентрацией 4 мг/мл и два эквивалента ледяной уксусной кислоты добавляют при создании исходного раствора (4 мг/мл), значение рН доводят до 7,50,2 (при необходимости), добавляя 1 н. NaOH. Исходный раствор стерильно фильтруют, используя фильтры PVDF 0,22 мкм, отбирают аликвоты для каждого из дней введения доз и хранят замороженными (примерно 20C), используя для приготовления дозированных форм препарата. Дозированные формы тестируемых соединений приготавливают в каждый из дней введения доз. Соответствующую аликвоту исходного раствора (4 мг/мл) оттаивают при комнатной температуре. Соответствующее количество исходного раствора (4 мг/мл) затем разбавляют соответствующим объемом носителя (0,9% хлорид натрия для инъекций) для достижения необходимой конечной концентрации. Композиции грелина приготавливают в каждый день введения дозы. Необходимое количество сравнительного соединения смешивают с соответствующим объемом носителя (0,9% хлорид натрия для инъекций) для достижения необходимой конечной концентрации. Композиции цисплатина приготавливают один раз на два дня введения доз. Необходимое количество цисплатина смешивают с соответствующим объемом носителя (0,9% хлорид натрия для инъекций) для достижения необходимой конечной концентрации. Композиции цисплатина хранят в холодильнике(2-8C), защищенными от света до использования. Подготовка тестовых животных. Введение. Хорьков лишают корма в течение ночи перед введением дозы приблизительно на 16 ч. Примерно за 15 мин до начала введения доз всем животным дают примерно 50 г (половину банки) коммерческого корма для хорьков. Введение доз происходит в последовательные дни для приблизительно равного количества животных в каждой группе, причем дозы вводят каждый день. Сразу после одной внутрибрюшинной инъекции цисплатина контрольное/сравнительное/тестируемое соединение вводят с помощью медленной внутривенной инъекции в головную или ножную вену. Через 30 мин вторую медленную внутривенную инъек-6 021303 цию контрольного/сравнительного/тестируемого соединения вводят с помощью медленной внутривенной инъекции в головную или ножную вену. В каждом случае объем дозы составляет 5 мл/кг (для цисплатина так же, как для контрольного/сравнительного/тестируемого соединения), и реально вводимая доза основана на последних данных о практическом весе тела каждого животного. Анализ противорвотной реакции. После введения доз хорьков контролируют и наблюдают эпизоды рвоты в течение примерно 4 ч,которые подразделяют на 10-минутные интервалы. Время перед первым эпизодом позыва на рвоту или рвоты регистрируют (латентный период) так же, как и полное число позывов на рвоту и периодов рвоты,в течение каждого 10-минутного интервала на протяжении всего периода наблюдений (4 ч после введения дозы). Для целей указанного исследования эпизоды рвоты определяют как ритмичные абдоминальные сокращения, связанные с пероральным выбросом твердого или жидкого материала из желудочнокишечного тракта (т.е. рвотой), или не связанную с прохождением материала (т.е. позывами к рвоте). Эпизоды позывов к рвоте и/или рвоту рассматривают отдельно, если животное изменяет положение в клетке или если интервал между позывами к рвоте и/или рвотой превышает примерно 5-секундный промежуток времени. Статистические методы. Численные значения, полученные для животных, рассчитывают как среднее для группы и определяют средние квадратичные ошибки (SEM). Осуществляют следующие статистические сравнения. Противорвотную реакцию оценивают, используя индивидуальные наблюдения для латентного периода, среднего количества позывов к рвоте в 10-минутный интервал с присутствием позывов, среднего количества эпизодов рвоты в 10-минутный интервал с присутствием рвоты, полную частоту эпизодов позывов к рвоте за период наблюдения, полную частоту эпизодов рвоты за период наблюдения, полное количество 10-минутных интервалов с позывами к рвоте и полное количество 10-минутных интервалов с наличием рвоты. Если не наблюдается позывов к рвоте или эпизодов рвоты для всего периода наблюдения за животными, латентный период соответствует 4 ч и среднее количество эпизодов позывов к рвоте/рвоты за интервал с присутствием позывов к рвоте/рвоте оценивают как ноль. Каждый из указанных семи параметров подвергают следующему статистическому сравнению. Для сравнения всех рассматриваемых групп используют непараметрический тест Kruskal-Wallis. Если значения в тесте Kruskal-Wallis оказываются значимыми (р 0,05), тогда контрольную группу, которой вводили солевой раствор, сравнивают с каждой из обработанных групп, используя тест Данна(Dunn's test). Результаты. Смертность и клинические проявления. В рассматриваемом исследовании не наблюдалось гибели животных и не было никаких клинических признаков. Противорвотная реакция. Контрольные животные, которым вводили контрольный солевой раствор, демонстрировали в среднем 4,89 и 1,78 эпизодов позывов к рвоте и рвоты за 4-часовой период наблюдений соответственно. Животные, которым вводили грелин, демонстрировали в среднем 7,00 и 1,60 эпизодов позывов к рвоте и рвоты за 4-часовой период наблюдений соответственно. Ни время наступления эпизодов, ни количество позывов к рвоте или эпизодов рвоты статистически не отличалось от результатов для контрольных животных, которым вводили солевой раствор. Напротив, животные, которым вводили ипаморелин, демонстрировали в среднем 1,14 и 0,75 эпизодов позывов к рвоте и рвоты за 4-часовой период наблюдений соответственно. Обработанные ипаморелином животные демонстрировали умеренную, статистически незначимую (р 0,05) задержку в наступлении времени рвотной реакции после введения цисплатина. 82% уменьшения количества эпизодов позывов к рвоте по сравнению с результатами для контрольных животных, которым вводили солевой раствор, достигло статистической значимости (р 0,05). Уменьшение эпизодов рвоты по сравнению с контрольными животными не достигло статистической значимости (р 0,05). Вывод. В итоге ипаморелин, введенный внутривенно самцам хорьков в дозе 1,0 мг/кг/доза, заметно снижает количество эпизодов позывов к рвоте по сравнению с контролями (р 0,05). Эффект ипаморелина на уменьшение количества эпизодов рвоты не достиг статистической значимости по сравнению с контрольной группой животных, которым вводили солевой раствор. Внутривенное введение грелина в дозе 0,25 мг/кг/доза (i.v.) не демонстрирует заметной эффективности по сравнению с результатами для контрольных животных. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения субъекта, испытывающего рвоту, вызванную химиотерапией или хирургическим вмешательством, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли 2. Способ по п.1, где лечение характеризуется увеличением латентного периода отсроченной рвоты у субъекта. 3. Способ по п.1, где лечение характеризуется снижением количества эпизодов тошноты и рвоты. 4. Способ по п.1, где рвота вызвана хирургическим вмешательством. 5. Способ по п.1, где рвота вызвана химиотерапией. 6. Способ по п.1, где вводимое соединение является анаморелином. 7. Способ по п.6, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг. 8. Способ по п.7, где анаморелин вводят в разовой дозе в день или многократных дозах в день. 9. Способ по п.8, где многократные дозы являются 1-4 дозами в день. 10. Способ по п.1, где вводимое соединение является ипаморелином. 11. Способ по п.10, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10,20, 30, 40 или 50 мг. 12. Способ по п.11, где ипаморелин вводят в разовой дозе в день или многократных дозах в день. 13. Способ по п.12, где многократные дозы являются 1-4 дозами в день. 14. Способ увеличения латентного периода у субъекта до начала рвоты, вызванной химиотерапией,включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли 15. Способ по п.14, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг. 16. Способ по п.14, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10,20, 30, 40 или 50 мг. 17. Способ снижения числа эпизодов позывов к рвоте у субъекта, вызванной химиотерапией, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения структурной формулы III (анамолин) или XIV (ипаморелин) или его фармацевтически приемлемой соли 18. Способ по п.17, где анаморелин вводят в дозе около 10, 20, 30, 40, 50 или 100 мг. 19. Способ по п.17, где ипаморелин вводят в дозе около 1, 1.25, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5, 10,20, 30, 40 или 50 мг.
МПК / Метки
МПК: A61K 38/00, C07D 401/00, C07D 213/00
Метки: роста, способы, агентов, лечения, секрецию, помощью, профилактики, гормона, рвоты, усиливающих
Код ссылки
<a href="https://eas.patents.su/10-21303-sposoby-lecheniya-ili-profilaktiki-rvoty-s-pomoshhyu-agentov-usilivayushhih-sekreciyu-gormona-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения или профилактики рвоты с помощью агентов, усиливающих секрецию гормона роста</a>
Предыдущий патент: Узел наконечника и/или переходный узел для картриджа
Следующий патент: Устройство для сварки пакетов
Случайный патент: Способ увеличения срока хранения хлебобулочных изделий без очерствения