Способ получения стерильной суспензии частиц кортикостероида для введения путем ингаляции
Формула / Реферат
1. Способ приготовления стерильной водной суспензии, используемой в фармацевтических составах для ингаляции путем распыления, который включает следующие стадии:
а) приготовление в подходящей емкости водного раствора, представляющего собой основу, и затем пропускание его в турбоэмульсификатор, снабженный вакуумным насосом и мощной турбиной и связанный с загрузочной воронкой,
б) создание в турбоэмульсификаторе вакуума, и
в) добавление одного или более активных ингредиентов в форме стерильного тонкоизмельченного порошка к водному раствору, представляющему собой основу,
г) диспергирование активного ингредиента при помощи турбинной системы для получения гомогенной водной суспензии,
причем стерильный порошок активного ингредиента на стадии (в) загружают в загрузочную воронку и затем пропускают в турбоэмульсификатор через мощную турбину.
2. Способ по п.1, в котором турбоэмульсификатор снабжен системой перемешивания.
3. Способ по п.1, в котором турбина снабжена системой радиально расположенных выпускных отверстий.
4. Способ по любому из пп.1-3, в котором водный раствор, представляющий собой основу, содержит добавки или эксципиенты, выбранные из смачивающих веществ, стабилизаторов, изотонических и/или буферных агентов.
5. Способ по любому из пп.1-4, в котором водный раствор, представляющий собой основу, стерилизуют нагреванием или фильтрованием.
6. Способ по любому из пп.1-5, в котором активным ингредиентом является кортикостероид в тонкоизмельченной форме.
7. Способ по любому из пп.1-6, в котором кортикостероид стерилизуют облучением или нагреванием.
8. Способ по п.6 или 7, в котором кортикостероидом является беклометазона дипропионат.
9. Способ по п.8, в котором тонкоизмельченный беклометазона дипропионат стерилизуют гамма-излучением.
10. Способ по любому из пп.1-9, в котором стадию гомогенизации суспензии проводят при скорости от 750 до 4000 об./мин.
11. Способ по п.10, в котором указанная скорость составляет от 1600 до 3000 об./мин.
12. Способ по любому из предшествующих пунктов, в котором стадию гомогенизации суспензии проводят в течение времени от 5 до 60 мин.
13. Способ по п.12, в котором указанное время составляет от 20 до 40 мин.
14. Способ по любому из пп.8 или 9, в котором гомогенизацию суспензии проводят при скорости 2900 об./мин в течение 30 мин.
15. Способ по любому из пп.1-14, дополнительно включающий распределение водной суспензии в стерильный контейнер.
16. Способ по п.15, в котором стерильным контейнером является флакон для однократного приема.
17. Фармацевтический состав для введения путем распыления, находящийся в форме водной суспензии активного ингредиента, полученной способом по любому из пп.1-16, в котором средний объемный диаметр 90% частиц составляет менее 8 мкм, а средний объемный диаметр 50% частиц находится между 2 и 3,5 мкм, как определяют при помощи прибора Мальверна.
18. Фармацевтический состав по п.17, в котором концентрация активного ингредиента составляет от 0,01 до 0,1% (масса/объем).
19. Фармацевтический состав по любому из пп.17 или 18, включающий в качестве активного ингредиента кортикостероид в стерильной тонкоизмельченной форме.
20. Фармацевтический состав по п.19, где кортикостероид выбран из беклометазона дипропионата, мометазона фуроата, флунизолида, будесонида, флутиказона пропионата или циклесонида.
21. Фармацевтический состав по любому из пп.19 или 20, в котором кортикостероидом является беклометазона дипропионат в концентрации 0,04% (масса/объем).
22. Фармацевтический состав по любому из пп.19 или 20, в котором кортикостероидом является будесонид в концентрации от 0,025 до 0,05% (масса/объем).
Текст
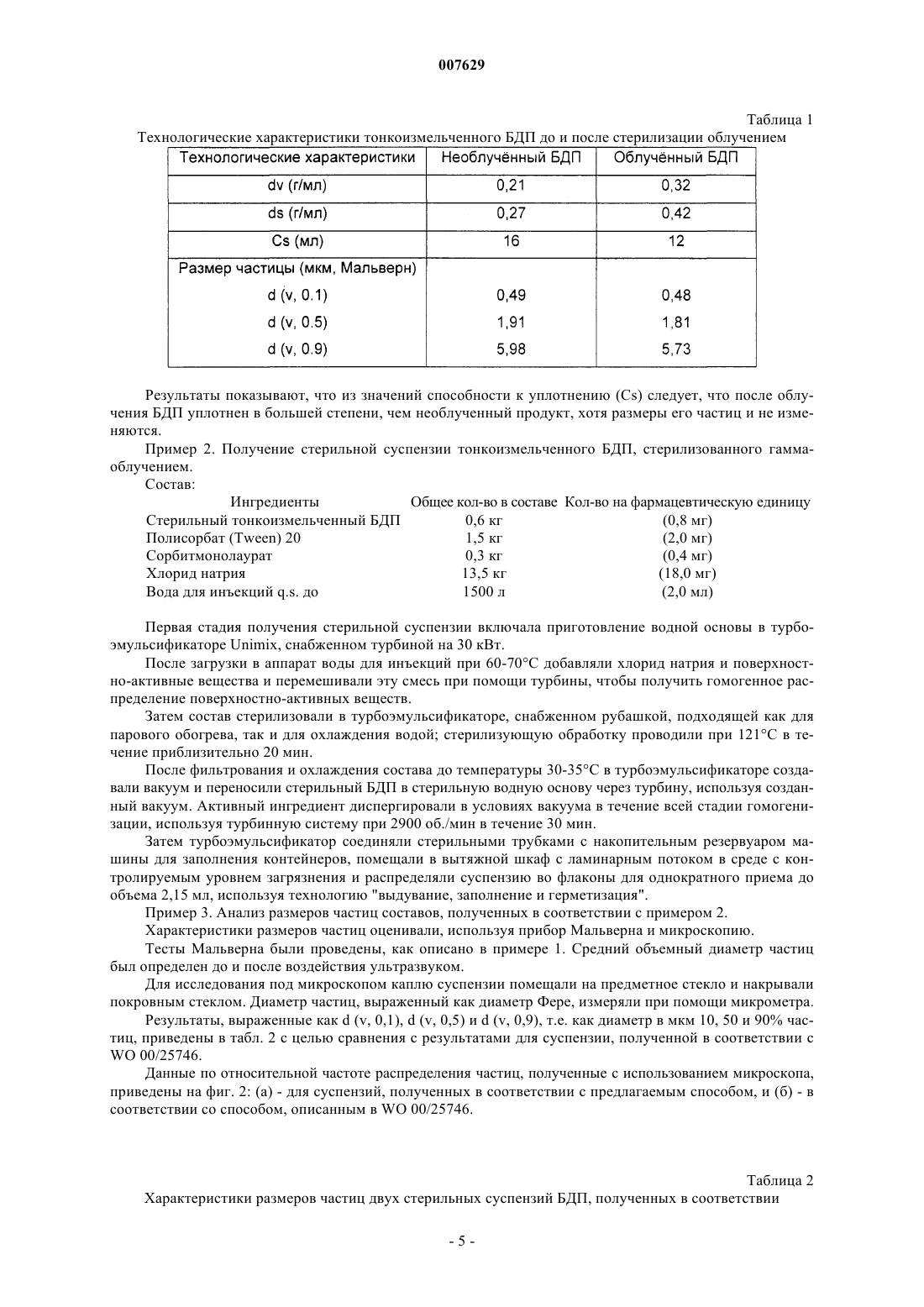
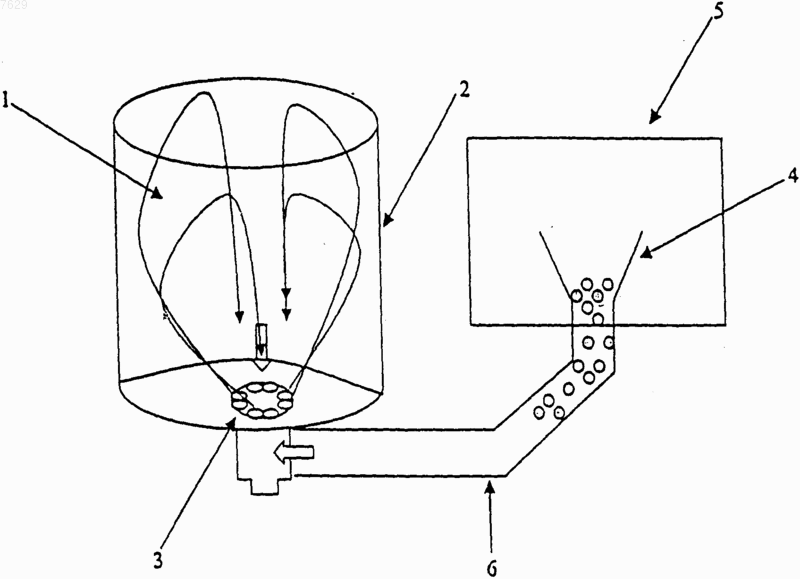
007629 Данное изобретение относится к способу получения водных суспензий частиц лекарства, предназначенных для введения путем ингаляций, который позволяет получить гомогенные дисперсии частиц,характеризующихся оптимальным размером и распределением по размерам. Метод введения лекарств путем ингаляции используют уже несколько лет, он является основным методом при лечении заболеваний, сопровождающихся обструкцией дыхательных путей, таких как астма и хронический бронхит. Преимущества ингаляции по сравнению с системным способом введения включают тот факт, что лекарство высвобождается непосредственно в месте воздействия, что предотвращает системные побочные эффекты и приводит к более быстрой клинической реакции и более высоким терапевтическим показателям. Среди различных типов лекарственных средств, которые вводят путем ингаляции для лечения заболеваний органов дыхания, значительную роль играют кортикостероиды, такие как беклометазона дипропионат (БДП), мометазона фуроат, флунизолид, будесонид, флутиказона пропионат и другие. Как правило, их вводят в тонкоизмельченной форме в виде суспензии в водной фазе, которая обычно содержит также поверхностно-активные вещества и/или сорастворители, или же в газе-распылителе. Лекарство ингалируют в форме аэрозоля, т.е. в форме дисперсии твердых частиц в газовой среде. Эффективность этой формы введения зависит от попадания достаточного количества частиц на место действия. Одним из наиболее важных параметров для обеспечения эффективного проникновения в нижние дыхательные пути пациента, т.е. в бронхиолы и альвеолы, является размер частиц, который должен быть равным или меньше 5-6 мкм. Этот размер количественно определяется путем измерения характеристического диаметра, эквивалентного диаметру сферы, известного как средний аэродинамический диаметр(САД), который выражает способность частиц перемещаться в суспензии под действием потока воздуха. Частицы с большим САД неэффективны, так как они осаждаются в полости рта и глотки и, следовательно, не способны достичь конечных ветвей бронхиального дерева; они могут также вызвать местные побочные эффекты или абсорбироваться через слизистую полости рта и вызывать системные побочные эффекты. Другой важной характеристикой для обеспечения корректного введения, а, следовательно, и терапевтической эффективности, является гомогенное распределение частиц в суспензии без образования агрегатов, которые препятствуют правильной аэрозолизации. Образование более-менее компактных агрегатов может также привести к возникновению проблем с распределением, а, следовательно, с однородностью доз при заполнении контейнеров. С технологической точки зрения, также очень важно, чтобы частицы попадали в наиболее узкий и наиболее гомогенный из возможных интервалов распределения по размерам и были настолько малы, насколько это возможно совместимо с верхней границей размера (5-6 мкм); это является следствием того, что при колебаниях влажности окружающей среды в водных суспензиях могут со временем возникать проблемы, связанные с постоянством распределения частиц, вследствие полной или частичной перекристаллизации небольшого количества растворенного вещества (Davis S. etPharm. 153, 93-104, 1997). Так как этот параметр обратно пропорционально связан с САД частиц, такое увеличение может снизить эффективность распыления и терапевтическую эффективность, так как частицы с САД, превышающим 5-6 мкм, не способны достичь предпочтительного места действия. Следовательно, чем меньше частицы, тем ниже вероятность того, что после частичной перекристаллизации они достигнут критических размеров, которые могут ухудшить свойства состава, касающиеся его технологических и терапевтических параметров. Другое важное требование, которому должны удовлетворять фармацевтические составы для ингаляции, - стерильность. Это требование по ряду причин (включая тот факт, что легкие являются чрезвычайно уязвимым органом человеческого организма и что многие пациенты, использующие ингалируемые лекарственные формы, страдают общими заболеваниями) становится все более и более обязательным,что подтверждается последним приказом FDA (Food and Drug Administration, США) "Sterility Requirementfor Aqueous-Based Drug Product for Oral Inhalation" ("Требования к стерильности готовых лекарственных форм на водной основе для пероральных ингаляций"), опубликованным в Федеральном Регистре 26 мая 2000 г. (65 FR 34082) и регулирующим качество и безопасность фармацевтических продуктов. Современной тенденцией является производство составов, свободных от консервантов и бактериостатов; как сообщалось в литературе, некоторые из обычно используемых для этой цели веществ могут вызывать аллергические реакции или раздражать слизистую дыхательных путей (Menendez R. et al., J.Allergy Clin. Immunol. 84, 272-274, 1989; Afferty P. et al., Thorax 43, 446-450, 1988). Для производства стерильных фармацевтических составов для ингаляций могут быть использованы различные способы. Например, активный ингредиент можно стерилизовать сухим нагреванием или облучением с последующим приготовлением состава в асептических условиях, или же состав может быть предварительно приготовлен, а затем стерилизован обработкой в автоклаве или фильтрованием. Некоторые из опубликованных способов стерилизации имеют ряд недостатков или ограничений. Например, обработка нагреванием не подходит для водных суспензий термолабильных кортикостероидов, таких как беклометазона дипропионат (БДП), а стерилизующее фильтрование не осуществимо для-1 007629 суспензий. В публикации WO 99/25359 описан способ стерилизации кортикостероидов путем их нагревания при температурах ниже тех, которые предписаны в некоторых фармакопеях (при 110-130 С вместо 140180 С), но он не содержит какого-либо руководства по получению соответствующих фармацевтических составов в виде суспензий. В патентной заявке WO 00/25746 заявитель описал способ получения водных суспензий для распыления на основе тонкоизмельченного активного ингредиента, стерилизованного гамма-излучением. Указанный способ, по существу, включает первую стадию приготовления водного раствора, представляющего собой основу и содержащего подходящие эксципиенты, в турбоэмульсификаторе с последующим добавлением стерильного тонкоизмельченного активного ингредиента, в свою очередь, диспергированного при атмосферном давлении в том же турбоэмульсификаторе. Дисперсию активного ингредиента в водной фазе можно подвергать дополнительной гомогенизирующей обработке при высоком давлении, которая еще больше уменьшает средний размер частиц в суспензии. В описании приведен пример (см. пример 2) приготовления суспензионного состава в опытном масштабе (100 л), при этом исходят из тонкоизмельченного БДП, стерилизованного посредством гаммаизлучения. В указанном примере активный ингредиент добавляют к стерильной водной основе и диспергируют, сначала просто при помощи магнитной мешалки, а затем при помощи турбинной системы в течение 15-20 мин. Однако, когда этот способ применили в промышленном масштабе, выяснилось, что для стадии гомогенизации необходимо длительное время обработки. Так, для приготовления составов объемом свыше 1000 л необходимо время перемешивания более 2 ч. Более того, полученные дисперсии не удовлетворяют должным образом требованию гомогенности. Было отмечено, что эти недостатки могут быть в значительной мере отнесены к технологическим характеристикам стерильного тонкоизмельченного активного ингредиента, который диспергируется в водной основе более медленно, а также более трудно, чем соединение, не подвергнутое стерилизации. Фактически, стерильные тонкоизмельченные частицы кортикостероидов для сохранения их стерильности необходимо хранить в условиях вакуума, а, следовательно, как показали измерения плотности, они склонны к агрегации в большей степени, чем нестерильные частицы того же активного ингредиента. Более интенсивная агрегация, в свою очередь, вызывает трудности, связанные с диспергированием. Задачей данного изобретения является предлагаемый способ получения в промышленном масштабе водных суспензий для распыления, включающих стерильный тонкоизмельченный активный ингредиент,предпочтительно стерилизованный гамма-излучением. Способ согласно изобретению позволяет уменьшить время обработки и получать суспензии с гомогенным и воспроизводимым распределением частиц и с оптимальным распределением частиц по размерам, с получением таким образом составов с высоким уровнем физической стабильности и терапевтической эффективности. Полученные при помощи предлагаемого способа суспензии используют в качестве фармацевтических составов для аэрозольных ингаляций после помещения в подходящие контейнеры, такие как флаконы-распылители для многократного приема, а предпочтительно - флаконы для однократного приема. В варианте осуществления изобретения способ осуществляют с использованием турбоэмульсификатора, снабженного мощной турбиной, и способ характеризуется тем, что активный ингредиент в виде порошка пропускают через турбину, используя вакуум, созданный в турбоэмульсификаторе. Напротив, в известных решениях уровня техники активный ингредиент добавляли сверху непосредственно в турбоэмульсификатор. Заявители обнаружили, что при работе в соответствии с идеей данного изобретения, т.е. при загрузке стерильного активного ингредиента в турбоэмульсификатор через турбину после создания вакуума вместо загрузки сверху при атмосферном давлении, можно получить за меньшее время в промышленном масштабе гораздо более эффективное диспергирование активного ингредиента, а, следовательно, гомогенные суспензии с воспроизводимым распределением от одной загрузки к другой. При работе в условиях вакуума возможно также исключить образование пены, а, следовательно, дополнительную операцию по ее удалению. Более того, неожиданно было обнаружено, что посредством предлагаемого способа можно получить более мелкие частицы с более узким и гомогенным интервалом распределения по размерам без необходимостив дальнейшей обработке, такой как обработка в гомогенизаторе высокого давления, как описано в WO 00/25746. Как уже было упомянуто, эти свойства дают значительные преимущества на стадии заполнения подходящих контейнеров (флаконов для многократного или однократного приема) нерасфасованной суспензией, а также во время хранения. В полученных при помощи предлагаемого способа суспензиях частицы оседают медленнее вследствие своего меньшего размера в соответствии с законом Стокса, выражаемом формулойV=d2(-0)g/(18) где V - скорость седиментации, d - средний диаметр частиц,- вязкость среды, выраженная в пуазах,- плотность частиц, 0 - плотность диспергирующей среды, g - ускорение силы тяжести. На стадии заполнения контейнеров условия рециркуляции, под действием которых находятся час-2 007629 тицы активного ингредиента, достаточны для достижения равномерного распределения частиц в контейнерах, так как частицы проходят через систему радиально расположенных выпускных отверстий турбины, и не возникает необходимости в использовании внешних элементов, таких как трубки или лопасти,для удержания частиц в суспензии. Использование таких элементов вызвало бы необходимость периодически открывать аппарат для очистки, тем самым была бы прервана непрерывность производства в стерильных условиях. В предлагаемом способе частицы не только осаждаются медленнее, но они также менее склонны к образованию агломератов, а это означает, что после помещения во флаконы суспензии будут более стабильными физически и срок их хранения можно будет увеличить. Образование агломератов, особенно "лепешек", т.е. высококомпактных групп суспендированных частиц, может препятствовать правильной дозировке лекарства или, по меньшей мере, сделать прием менее терапевтически эффективным, так как в этом случае из флакона в головку распылителя может быть перенесена неполная порция. Изобретение описано ниже подробно со ссылкой на фиг. 1, где изображена схема установки, которую можно использовать для осуществления предлагаемого способа. Для получения суспензии можно успешно использовать вакуумный турбоэмульсификатор (1), состоящий из стального контейнера (2), снабженный мощной турбиной и, возможно, системой перемешивания. Под "мощной турбиной" подразумевают турбину мощностью от 15 до 55 кВт. Предпочтительно использовать турбоэмульсификатор, снабженный турбиной на 30 кВт, который может перемешивать суспензию через систему радиально расположенных выпускных отверстий турбины (3), сквозь которую проходит активный ингредиент. Система снабжена также загрузочной воронкой (4) для загрузки порошка, установленной внутри изолятора (5) и связанной с турбиной эмульсификатора посредством жесткой трубки или рукава (6). Ввод порошка в трубку можно регулировать при помощи поворотной заслонки, чтобы минимизировать количество входящего воздуха, который может содействовать пенообразованию. Под "изолятором" подразумевают прозрачный контейнер, изготовленный, как правило, из плексигласа или поливинилхлорида(ПВХ) и снабженный одним или более входными отверстиями и защитными перчатками для переноса порошка. Первая стадия процесса приготовления включает приготовление водного раствора, представляющего собою основу, в подходящем резервуаре, предпочтительно изготовленном из нержавеющей стали; раствор, который можно стерилизовать нагреванием или фильтрацией, может содержать подходящие добавки или эксципиенты, предпочтительно выбранные из смачивающих веществ, таких как полисорбат 20 или сорбитанмонолаурат, изотонических агентов, таких как хлорид натрия, и, возможно, стабилизаторов, таких как динатриевая соль этилендиаминтетрауксусной кислоты, и/или буферов. Среду предпочтительно стерилизуют при 121 С в течение 20 мин. Если необходимо, полученный таким образом раствор подвергают фильтрованию для обеспечения прозрачности и переносят в турбоэмульсификатор, снабженный вакуумным насосом. На второй стадии после создания в турбоэмульсификаторе вакуума к водной среде добавляют один или более стерильных тонкоизмельченных активных ингредиентов путем их ввода из загрузочной воронки через турбину. В качестве альтернативы можно приготовить водный раствор, представляющий собой основу, и выполнить стерилизацию в турбоэмульсификаторе с рубашкой, подходящей как для обогрева паром, так и для охлаждения водой. Активный ингредиент преимущественно может представлять собой кортикостероид, такой как беклометазона дипропионат, мометазона фуроат, флутиказона пропионат, флунизолид, циклесонид или будесонид, тонко измельченный посредством обычных способов и стерилизованный облучением или нагреванием. Предпочтительно, чтобы активным ингредиентом был тонкоизмельченный беклометазона дипропионат, стерилизованный обработкой гамма-лучами при условиях, описанных в WO 00/25746. На третьей стадии активный ингредиент гомогенизируют, снова в вакууме, используя турбинную систему,функционирующую при скорости от 750 до 4000 об./мин, предпочтительно от 1000 до 3600 об./мин, еще более предпочтительно от 1600 до 3000 об./мин, в течение 5-60 мин, предпочтительно в течение 20-40 мин. В предпочтительных условиях используют турбинную систему, функционирующую при 2900 об./мин, в течение 30 мин. Суспензию тонкоизмельченного продукта, полученного по завершении обработки, распределяют по подходящим контейнерам, предпочтительно составленным из предварительно отформованных флаконов-распылителей для однократного приема, возможно, предварительно стерилизованных облучением бета-лучами или изготовленных при помощи технологии "выдувание, заполнение и герметизация". Как следствие, данное изобретение также относится к фармацевтическим составам для распыления,предпочтительно к препаратам единичной дозы, содержащим водную суспензию, полученную посредством предлагаемого способа. В указанных составах диаметр Фере по меньшей мере 90% суспендированных частиц в наполненном ими контейнере преимущественно меньше или равен 8 мкм. Предпочтительно, чтобы диаметр по меньшей мере 50% частиц составлял менее 3 мкм, а диаметр по меньшей мере 90% частиц - менее 7 мкм. Еще более предпочтительно, чтобы диаметр по меньшей мере 50% частиц составлял менее 2,5 мкм, а диаметр по меньшей мере 90% частиц - менее 6 мкм. "Диаметром Фере" называют расстояние между-3 007629 воображаемыми параллельными линиями, направленными по касательной относительно случайным образом ориентированной частицы и перпендикулярными относительно шкалы окуляра (фармакопея США 26, 2003, с. 2185). Характеристики размеров частиц были также оценены при помощи прибора Мальверна. В этом методе испытания дифракцию лазерного луча на частицах используют для определения распределения частиц в суспензии по размерам. Оцениваемым параметром является средний объемный диаметр 10, 50 и 90% частиц в мкм, выражаемый как d (v, 0,1), d (v, 0,5) и d (v, 0,9) соответственно и определяемый в предположении, что геометрическая форма частиц эквивалентна сфере. В предлагаемом составе в виде суспензии d (v, 0,9) после обработки ультразвуком преимущественно составляет менее 8 мкм, а d (v, 0,5) находится между 2 и 3,5 мкм. Более предпочтительно, чтобы d (v, 0,9) был менее 7 мкм, a d (v, 0,5) находился между 2,5 и 3 мкм, и чтобы распределение частиц по размерам (то есть разность между d (v, 0,9) иd (v, 0,1 не составляла более 7 мкм, предпочтительно более 6 мкм. Концентрация активного ингредиента в предлагаемых фармацевтических составах составляет от 0,01 до 0,1% (масса/объем), предпочтительно 0,04% (масса/объем) в случае БДП и 0,025-0,05% в случае будесонида. Задачей данного изобретения является также применение для лечения болезней легких, таких как астма и хронический бронхит, фармацевтических составов в препаратах с единичной дозой при их ежедневном однократном приеме, содержащих полученные в соответствии с предлагаемым способом водные суспензии. Как описано в литературе для будесонида (Tunek et al., Drug. Metab. Dispos. 1997, 25, 1311-1317),было обнаружено, что в микросомах клеток легких человека образуются стабильные сложные эфиры активного метаболита БДП, а именно беклометазон-17-монопропионата (17-БМП), с длинноцепочечными жирными кислотами, такими как олеиновая кислота. Эти эфиры задерживаются в клетках гораздо дольше, чем исходный стероид, и из них контролируемым образом высвобождается неизмененный активный ингредиент, так что время воздействия лекарства на ткань увеличивается. Было также обнаружено, что вследствие образования моноэфира в клетках легких период полувыведения и среднее время пребывания 17-БМП после введения водных суспензий БДП посредством распыления являются более длительными по сравнению с суспендированными составами, вводимыми в виде аэрозолей под давлением. Последнее открытие объясняли распределением частиц, получаемым после (повторного) суспендирования тонкоизмельченного активного ингредиента в водной среде. Как можно видеть из табл. 2 и фиг. 2 примера 3, частицы стерильного тонкоизмельченного активного ингредиента предлагаемой водной суспензии действительно намного мельче, чем частицы, полученные в соответствии с предшествующим уровнем техники, а также имеют более узкое и однородное распределение частиц по размерам. Указанные частицы могут легче растворяться в легочных жидкостях и лучше проникать в клетки, что позволяет активному ингредиенту, благодаря образованию сложных эфиров в клетках, дольше оставаться на месте воздействия, обусловливая, таким образом, пролонгированное действие. Как следствие оптимальных характеристик, касающихся размера частиц суспензионных составов,достигаемых при помощи предлагаемого способа, а также вследствие наблюдаемого поведения их активных метаболитов, могут быть получены фармацевтические составы для распыления БДП и будесонида, пригодные для лечения заболеваний легких и однократно принимаемые ежедневно. Это представляет собой значительное преимущество в отношении принятия этих препаратов пациентами. Изобретение описано подробнее в нижеследующих примерах. Примеры Пример 1. Технологические характеристики тонкоизмельченного беклометазона дипропионата(БДП), стерилизованного облучением гамма-лучами, по сравнению с эквивалентным нестерилизованным продуктом. Стерильный тонкоизмельченный БДП был получен, как описано в WO 00/25746. Кажущиеся объемы и плотности были измерены в соответствии с европейской фармакопеей, 4-ое издание, пункт 2.9.15. 100 г исследуемого вещества вносили, не уплотняя, в сухой цилиндр на 250 мл. Определяли этот неуплотненный кажущийся объем (V0), затем выполняли 10, 500 и 1250 постукиваний и определяли объемы (V10, V500 и V1250). Если разница между V500 и V1250 превышала 2 мл, выполняли еще 1250 постукиваний (V2500). В табл. 1 приведены: а) кажущаяся плотность до уплотнения (dv), которая представляет собой отношение массы (г) к неуплотненному объему (мл); б) кажущаяся плотность после уплотнения (ds), которая представляет собой отношение массы (г) к объему после уплотнения (мл); в) способность к уплотнению (Cs), которая представляет собой разность между V10 и V500 (мл). Характеристики размеров частиц были оценены при помощи прибора Мальверна. Результаты приведены в табл. 1.-4 007629 Таблица 1 Технологические характеристики тонкоизмельченного БДП до и после стерилизации облучением Результаты показывают, что из значений способности к уплотнению (Cs) следует, что после облучения БДП уплотнен в большей степени, чем необлученный продукт, хотя размеры его частиц и не изменяются. Пример 2. Получение стерильной суспензии тонкоизмельченного БДП, стерилизованного гаммаоблучением. Состав: Ингредиенты Общее кол-во в составе Кол-во на фармацевтическую единицу Стерильный тонкоизмельченный БДП 0,6 кг(18,0 мг) Вода для инъекций q.s. до 1500 л(2,0 мл) Первая стадия получения стерильной суспензии включала приготовление водной основы в турбоэмульсификаторе Unimix, снабженном турбиной на 30 кВт. После загрузки в аппарат воды для инъекций при 60-70 С добавляли хлорид натрия и поверхностно-активные вещества и перемешивали эту смесь при помощи турбины, чтобы получить гомогенное распределение поверхностно-активных веществ. Затем состав стерилизовали в турбоэмульсификаторе, снабженном рубашкой, подходящей как для парового обогрева, так и для охлаждения водой; стерилизующую обработку проводили при 121 С в течение приблизительно 20 мин. После фильтрования и охлаждения состава до температуры 30-35 С в турбоэмульсификаторе создавали вакуум и переносили стерильный БДП в стерильную водную основу через турбину, используя созданный вакуум. Активный ингредиент диспергировали в условиях вакуума в течение всей стадии гомогенизации, используя турбинную систему при 2900 об./мин в течение 30 мин. Затем турбоэмульсификатор соединяли стерильными трубками с накопительным резервуаром машины для заполнения контейнеров, помещали в вытяжной шкаф с ламинарным потоком в среде с контролируемым уровнем загрязнения и распределяли суспензию во флаконы для однократного приема до объема 2,15 мл, используя технологию "выдувание, заполнение и герметизация". Пример 3. Анализ размеров частиц составов, полученных в соответствии с примером 2. Характеристики размеров частиц оценивали, используя прибор Мальверна и микроскопию. Тесты Мальверна были проведены, как описано в примере 1. Средний объемный диаметр частиц был определен до и после воздействия ультразвуком. Для исследования под микроскопом каплю суспензии помещали на предметное стекло и накрывали покровным стеклом. Диаметр частиц, выраженный как диаметр Фере, измеряли при помощи микрометра. Результаты, выраженные как d (v, 0,1), d (v, 0,5) и d (v, 0,9), т.е. как диаметр в мкм 10, 50 и 90% частиц, приведены в табл. 2 с целью сравнения с результатами для суспензии, полученной в соответствии сWO 00/25746. Данные по относительной частоте распределения частиц, полученные с использованием микроскопа,приведены на фиг. 2: (а) - для суспензий, полученных в соответствии с предлагаемым способом, и (б) - в соответствии со способом, описанным в WO 00/25746. Таблица 2 Характеристики размеров частиц двух стерильных суспензий БДП, полученных в соответствии Результаты, приведенные в табл. 2 и на фиг. 2, подтверждают, что при помощи предлагаемого способа можно получить более мелкие частицы с более узким и более гомогенным распределением по размерам. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ приготовления стерильной водной суспензии, используемой в фармацевтических составах для ингаляции путем распыления, который включает следующие стадии: а) приготовление в подходящей емкости водного раствора, представляющего собой основу, и затем пропускание его в турбоэмульсификатор, снабженный вакуумным насосом и мощной турбиной и связанный с загрузочной воронкой,б) создание в турбоэмульсификаторе вакуума, и в) добавление одного или более активных ингредиентов в форме стерильного тонкоизмельченного порошка к водному раствору, представляющему собой основу,г) диспергирование активного ингредиента при помощи турбинной системы для получения гомогенной водной суспензии,причем стерильный порошок активного ингредиента на стадии (в) загружают в загрузочную воронку и затем пропускают в турбоэмульсификатор через мощную турбину. 2. Способ по п.1, в котором турбоэмульсификатор снабжен системой перемешивания. 3. Способ по п.1, в котором турбина снабжена системой радиально расположенных выпускных отверстий. 4. Способ по любому из пп.1-3, в котором водный раствор, представляющий собой основу, содержит добавки или эксципиенты, выбранные из смачивающих веществ, стабилизаторов, изотонических и/или буферных агентов. 5. Способ по любому из пп.1-4, в котором водный раствор, представляющий собой основу, стерилизуют нагреванием или фильтрованием. 6. Способ по любому из пп.1-5, в котором активным ингредиентом является кортикостероид в тонкоизмельченной форме. 7. Способ по любому из пп.1-6, в котором кортикостероид стерилизуют облучением или нагреванием. 8. Способ по п.6 или 7, в котором кортикостероидом является беклометазона дипропионат. 9. Способ по п.8, в котором тонкоизмельченный беклометазона дипропионат стерилизуют гаммаизлучением. 10. Способ по любому из пп.1-9, в котором стадию гомогенизации суспензии проводят при скорости от 750 до 4000 об./мин. 11. Способ по п.10, в котором указанная скорость составляет от 1600 до 3000 об./мин. 12. Способ по любому из предшествующих пунктов, в котором стадию гомогенизации суспензии проводят в течение времени от 5 до 60 мин. 13. Способ по п.12, в котором указанное время составляет от 20 до 40 мин.-6 007629 14. Способ по любому из пп.8 или 9, в котором гомогенизацию суспензии проводят при скорости 2900 об./мин в течение 30 мин. 15. Способ по любому из пп.1-14, дополнительно включающий распределение водной суспензии в стерильный контейнер. 16. Способ по п.15, в котором стерильным контейнером является флакон для однократного приема. 17. Фармацевтический состав для введения путем распыления, находящийся в форме водной суспензии активного ингредиента, полученной способом по любому из пп.1-16, в котором средний объемный диаметр 90% частиц составляет менее 8 мкм, а средний объемный диаметр 50% частиц находится между 2 и 3,5 мкм, как определяют при помощи прибора Мальверна. 18. Фармацевтический состав по п.17, в котором концентрация активного ингредиента составляет от 0,01 до 0,1% (масса/объем). 19. Фармацевтический состав по любому из пп.17 или 18, включающий в качестве активного ингредиента кортикостероид в стерильной тонкоизмельченной форме. 20. Фармацевтический состав по п.19, где кортикостероид выбран из беклометазона дипропионата,мометазона фуроата, флунизолида, будесонида, флутиказона пропионата или циклесонида. 21. Фармацевтический состав по любому из пп.19 или 20, в котором кортикостероидом является беклометазона дипропионат в концентрации 0,04% (масса/объем). 22. Фармацевтический состав по любому из пп.19 или 20, в котором кортикостероидом является будесонид в концентрации от 0,025 до 0,05% (масса/объем). Фиг. 1 Частота распределения частиц в соответствии с фракционным составом, выраженным в виде диаметра Фере и определенным микроскопически:
МПК / Метки
Метки: ингаляции, получения, кортикостероида, путем, частиц, суспензии, стерильной, введения, способ
Код ссылки
<a href="https://eas.patents.su/9-7629-sposob-polucheniya-sterilnojj-suspenzii-chastic-kortikosteroida-dlya-vvedeniya-putem-ingalyacii.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения стерильной суспензии частиц кортикостероида для введения путем ингаляции</a>
Предыдущий патент: Сочетание действующих веществ для фармакологического лечения никотиновой зависимости
Следующий патент: Способ и установка для этерификации жирных кислот
Случайный патент: Способ защиты молекулярного сита sapo от потери каталитической активности