Производные эпоксиянтарной кислоты
Номер патента: 438
Опубликовано: 26.08.1999
Авторы: Масаки Мицуо, Йосино Ясуси, Такахаси Тосихиро, Номура Ютака, Хара Каору
Формула / Реферат
1. Производные эпоксиянтарной кислоты следующей формулы
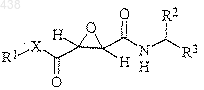
в которой R1 представляет атом водорода, алкил с 1-30 атомами углерода, арил с 6-40 атомами углерода или аралкил с 7-40 атомами углерода; каждый из R2 и R3 независимо представляет арил с 6-40 атомами углерода, аралкил с 7-20 атомами углерода или алкил с 3-10 атомами углерода; Х представляет -О- или -NR4; R4 представляет атом водорода, алкил с 1-10 атомами углерода или аралкил с 7-20 атомами углерода, или их фармацевтически приемлемые соли.
2. Фармацевтическая композиция для лечения костных заболеваний, которая содержит производные эпоксиянтарной кислоты следующей формулы
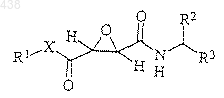
в которой R1 представляет атом водорода, алкил с 1-30 атомами углерода, арил с 6-40 атомами углерода или аралкил с 7-40 атомами углерода; каждый из R2 и R3 независимо представляет арил с 6-40 атомами углерода, аралкил с 7-20 атомами углерода или алкил с 3-10 атомами углерода; Х представляет собой -O-или -NR4; R4 представляет атом водорода, алкил с 1-10 атомами углерода или аралкил с 7-20 атомами углерода, или их фармацевтически приемлемые соли.
Текст
1 Настоящее изобретение относится к новым производным эпоксиянтарной кислоты и фармацевтической композиции для лечения костных заболеваний, содержащей такие соединения. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ. В костной ткани рассасывание кости и образование кости производится непрерывно и одновременно остеокластами и остеобластами соответственно. Структура и количество кости поддерживается их равновесием. Однако избыточное рассасывание кости вызывает костные заболевания, такие как остеопороз, злокачественная гиперкальциемия и синдром Педжета. Процесс рассасывания кости (т.е. декальцификация) остеокластами может быть разделен на две стадии, а именно: растворение минералов и разрушение костного субстрата. Считают, что разрушение костного субстрата происходит под действием лизосомных ферментов. Согласно недавним исследованиям признано, что среди лизосомных ферментов катепсин L и аналогичные ему ферменты, которые являются цистеинпротеазами, играют ключевую роль (Какегава и Кацунума, Molecular Medicine, 30(10), 1310-1318(1993) и Тезука и др., J. Biol. Chem., 269, 11061109 (1994. Далее сообщалось, что ингибитор цистеинпротеазы блокирует рассасывание кости(Делэсс и др., Biochem. Biophys., Res. Commun.,125, 441-447 (1984. Следовательно считается,что соединения, которые ингибируют действие цистеинпротеазы, такие как катепсин L, являются ценными для лечения костных заболеваний,таких как остеопороз. Например, уже предлагалось использовать определенные производные эпоксиянтарной кислоты для лечения костных заболеваний(предварительные публикации японских патентов 63-284127 иН 2-218610). Однако не было никаких сообщений о клиническом исследовании ингибиторов цистеинпротеазы, и такие исследования недавно начаты. В японском патенте 61-55509 раскрыты производные эпоксиянтарной кислоты (соединения эпоксисукцинамовой кислоты) в качестве ингибиторов протеазы, в действии которых принимает участие меркаптогруппа. Не приводится никаких сведений, однако, в отношении соединений, которые имеют разветвленную цепь атома углерода, связанного с соседним атомом азота N-замещенной карбомоильной группы, присоединенной к оксирановому кольцу, например дифенилметилкарбамоила и (3 метил-1-фенилбутил)карбамоила. Краткое описание изобретения. Целью настоящего изобретения является получение соединений и фармацевтической композиции, которые полезны для предотвращения и лечения костных заболеваний, таких как остеопороз, злокачественная гиперкальциемия и синдром Педжета. 2 Другой целью изобретения является получение соединений и фармацевтической композиции, которые полезны для лечения остеоартрита и ревматоидного артрита, которые сопровождаются аномальным увеличением активности катепсина L. Следующей целью изобретения является получение соединений, которые полезны в качестве лекарственного средства для лечения заболеваний, в которых принимают участие катепсин В и L, таких как мышечная дистрофия и мышечная атрофия. Вышеуказанные проблемы были решены тем, что было найдено, что производное эпоксиянтарной кислоты или его соль, которое представлено нижеприведенной формулой (I) и отличительным признаком которого является то,что заместитель амидной группы с правой стороны, который разветвлен, обладает активностью, ингибирующей рассасывание кости гораздо лучшей, чем производные эпоксиянтарной кислоты, описанные в вышеприведенном японском патенте 61-55509, и что оно полезно для предотвращения и лечения костных заболеваний. Настоящее изобретение основывается на открытии, указанном выше. Типичная активность соединения японского патента 6155509 показана сравнительными соединениями Х и Y далее в сравнительных опытах. Ниже приведена формула I: в которой R1 представляет атом водорода, алкил с 1-30 атомами углерода, арил с 6-40 атомами углерода или аралкил с 7-40 атомами углерода; каждый из R2 и R3 независимо представляет арил с 6-40 атомами углерода, аралкил с 7-20 атомами углерода или алкил с 3-10 атомами углерода; Х представляет -О- или -NR4; R4 представляет атом водорода, алкил с 1-10 атомами углерода или аралкил с 7-20 атомами углерода. ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ИЗОБРЕТЕНИЯ. Производные эпоксиянтарной кислоты следующей формулы (I) описаны далее: где R1 - атом водорода, алкил или аралкил. Предпочтительными являются атом водорода,алкил и аралкил. Алкил, арил и аралкил могут иметь заместитель (например гидроксигруппу,галоген, алкил с 1-10 атомами углерода, алкоксигруппу с 1-10 атомами углерода и арил с 6-20 атомами углерода). 3 Алкил предпочтительно содержит 1-30 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя,если заместитель присутствует), более предпочтительно 1-15 атомов углерода, наиболее предпочтительно 1-6 атомов углерода. Алкильная группа может иметь цепную или циклическую структуру. Алкильная группа цепной структуры может быть разветвленной. Арильная группа предпочтительно содержит 6-40 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует), более предпочтительно 6-30 атомов углерода, наиболее предпочтительно 6-20 атомов углерода. Примеры арильных групп включают фенил и нафтил. Аралкильная группа предпочтительно содержит 7-40 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует),более предпочтительно 7-30 атомов углерода,наиболее предпочтительно 7-20 атомов углерода. Примеры аралкильных групп включают бензил, фенэтил и дифенилметил. Каждый из R2 и R3 вышеуказанной формулы независимо представляет арил, аралкил или алкил с 3-10 атомами углерода. Каждая из алкильных групп, арильных групп и аралкильных групп может иметь заместитель (например гидроксигруппу, атом галогена, алкил с 1-10 атомами углерода, алкоксигруппу с 1-10 атомами углерода и арил с 6-20 атомами углерода). Арильная группа предпочтительно содержит 6-40 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует), более предпочтительно 6-30 атомов углерода, наиболее предпочтительно 6-20 атомов углерода. Примеры арильных групп включают фенил и нафтил. Алкильная группа содержит 3-10 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует). Алкильная группа предпочтительно содержит 3-6 атомов углерода. Алкильная группа может иметь цепную или циклическую структуру. Алкильная группа цепной структуры может быть разветвленной. Аралкильная группа предпочтительно содержит 7-20 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует),более предпочтительно 7-15 атомов углерода,наиболее предпочтительно 7-10 атомов углерода. Примеры аралкильных групп включают бензил и фенэтил. В вышеуказанной формуле Х представляет собой -О- или -NR4-. R4 представляет атом водорода, алкил или аралкил, предпочтительно атом водорода или алкил. Более предпочтительно атом водорода. Алкильная группа и арал 000438 4 кильная группа могут иметь тот же заместитель,который указан выше. Алкильная группа R4 предпочтительно содержит 1-10 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует),более предпочтительно 1-6 атомов углерода,наиболее предпочтительно 1-4 атома углерода. Алкильная группа предпочтительно имеет цепную структуру. Алкильная группа цепной структуры может быть разветвленной. Аралкильная группа в R4 предпочтительно содержит 7-20 атомов углерода (полное число атомов углерода, включая число атомов углерода заместителя, если заместитель присутствует),более предпочтительно 7-15 атомов углерода,наиболее предпочтительно 7-10 атомов углерода. Примеры аралкильных групп включают бензил и фенэтил. Оба атома углерода кольца оксирана являются асимметрическими атомами углерода. Вышеприведенная формула означает, что две карбонильные группы, связанные с кольцом оксирана, находятся в транс-конформации. Следовательно производное эпоксиянтарной кислоты изобретения может быть либо оптическим изомером в показанных ниже форме (Т 1), либо в форме (Т 2), или их смесью. Примеры производных эпоксиянтарной кислоты изобретения приведены в табл.1, в которой R1, R2, R3 и Х имеют значения, показанные в вышеприведенной формуле. Таблица 1 Соединение 1 2 3 4 5 6 7 Н Этил Изобутил Циклогексил Бензил Дифенилметил-O-O-O-O-O-O-O Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил п-Хлорфеп-Хлорфенил нил-O-O-O-NH-NH-Net-NH Изопентил Изопентил Изопентил Фенил Изопентил Фенил Фенил Н Этил Циклогексил Этил Этил Этил Дифенилметил Изопентил Изопентил Изопентил Фенил Изопентил Фенил Фенил Изопентил Изопентил Изопропил Бензил Фенил Фенил Фенил Бензил Фенил Изопропил Бензил Изобутил Изопропил Изобутил Бензил Бензил Производные эпоксиянтарной кислоты изобретения могут быть использованы в форме солей. В случае, когда R1 представляет атом водорода и Х представляет -О-, карбоксигруппа может быть образована в комбинации с карбонилом, связанным с кольцом оксирана, и может образовывать соль с основанием. Примеры катионов основания включают ионы щелочных металлов (например натрия и калия) и ионы щелочно-земельных металлов (например кальция). Производные эпоксиянтарной кислоты изобретения могут быть легко синтезированы способами, аналогичными способам синтеза,описанным в японском патенте 61-55509 и предварительной публикации японского патента 52-31024, или способами, описанными далее в примерах 1-10, или способами, подобными им. Фармакологические действия производного эпоксиянтарной кислоты изобретения описаны ниже. Производные эпоксиянтарной кислоты изобретения являются соединениями, обладающими ингибирующей активностью по отношению к тиолпротеазе. Тиолпротеазы включают катепсин L и катепсин В или калпаин. Следовательно ожидают, что производные эпоксиянтарной кислоты изобретения и их физиологически приемлемые соли будут оказывать фармакологические действия в отношении заболеваний, в которых участвуют протеазы. Как указано в описании предшествующего уровня техники, примеры заболеваний, в которых участвует катепсин L, включают костные заболевания, такие как остеопороз, злокачественная гиперкальциемия и синдром Педжета. Следовательно, производные эпоксиянтарной кислоты изобретения и их физиологически приемлемые соли полезны в качестве лекарственных средств для предотвращения или лечения данных костных заболеваний. Известно, что катепсин L разрушает коллаген типа II, типа IX и типа XI, включающие артикулярный в нейтральной области (FEBS Lett.,269, 189-193 (1990. Следовательно, производные эпоксиянтарной кислоты изобретения и их физиологически приемлемые соли, как ожидают, полезны для лечения остеоартрита и ревматоидного артрита, которые сопровождаются аномальным увеличением активности катепсинаL (смотри предварительную публикацию японского патента Н 5-178757) . 6 Производные эпоксиянтарной кислоты изобретения также эффективны в качестве ингибитора катепсина В. Более подробно, примеры заболеваний, в которых участвуют тиолпротеазы, отличные от катепсина L, такие как катепсин В, включают мышечную дистрофию и мышечную атрофию (в которых участвуют катепсин В и калпаин), болезнь Альцгеймера (в которой участвует калпаин) и заболевания, которые, как считают, обусловлены демиелинизацией нейрона, такие как рассеянный склероз и невропатия периферической нервной системы (в которой участвует калпаин), катаракта (в которой участвует калпаин), аллергическое заболевание (в которой участвует тиолпротеаза), молниеносный гепатит (в котором участвует калпаин), рак молочной железы, рак предстательной железы и гипертрофия предстательной железы (в которой участвует калпаин), избыточный рост ткани и метастазы рака (в которых участвует катепсин В и калпаин), агрегация тромбоцита (в которой участвует калпаин) (см. предварительную публикацию японского патента Н 6-239835). Следовательно считают, что производные эпоксиянтарной кислоты изобретения полезные для лечения и предотвращения этих заболеваний. Ожидают, что производные эпоксиянтарной кислоты изобретения и их физиологически приемлемые соли будут полезны для предотвращения и лечения вышеуказанных заболеваний. В частности, они полезны для предотвращения и лечения костных заболеваний, таких как остеопороз, злокачественная гиперкальциемия и синдром Педжета. Производные эпоксиянтарной кислоты изобретения могут быть введены пероральным или парентеральным способом. Композиция для перорального введения может быть приготовлена в форме таблеток, капсул, порошка, гранул или сиропа. Парентеральное введение может быть осуществлено через слизистую оболочку,поверхность тела, кровеносный сосуд или ткань. Введение через слизистую оболочку может быть выполнено при использовании глазных растворов, ингаляционных средств, средств для распыления или суппозиториев. Введение через поверхность тела может быть выполнено с помощью мазей. Введение через кровеносный сосуд и ткань может быть осуществлено с помощью инъекций. Композиция для перорального введения может быть приготовлена с использованием обычного носителя, дезинтегратора связующего агента, смазывающего агента красителя и разбавителя. Наполнителем обычно является глюкоза или лактоза. Дезинтегратор представляет собой крахмал или кальций карбоксиметилцеллюлозу. Смазывающим агентом может быть стеарат магния или тальк. Связующим агентом может быть гидроксипропилцеллюлоза, желатин или поливиниловый спирт. 7 Фармацевтическая композиция для парентерального введения может быть приготовлена обычным способом. Например, форма для инъекций может быть приготовлена с использованием обычной дистиллированной воды для инъекции, физиологического солевого раствора или раствора Рингера. Доза производного эпоксиянтарной кислоты изобретения составляет от 0,01 мг до 100 мг/день для взрослых в случае использования инъекций. В случае перорального введения доза составляет от 0,1 до 1 г/день для взрослых. Дозировка может быть увеличена или уменьшена в зависимости от возраста, расы и состояния больных. Пример 1. Этил-(2S, 3S)-3-дифенилметилкарбамоилоксиран-2-карбоксилат (соединение 2). К раствору (2S, 3S)-3-дифенилметилкарбамоилоксиран-2-карбоксилата (8,01 г, 50,0 ммоль) в этилацетате (120 мл) добавляли Nгидроксисукцинимид (5,76 г, 50,0 ммоль) и затем добавляли N,N-дициклогексилкарбодиимид(5,75 г, 50,0 ммоль) при охлаждении льдом. Образующуюся смесь перемешивали при 5 С в течение 1 ч и к смеси добавляли раствор аминодифенилметана (9,17 г, 50,0 ммоль) в этилацетате (30 мл). Смесь перемешивали при 5 С 1 ч и затем при комнатной температуре 1 ч. Образующуюся N,N'-дициклогексилмочевину (ДЦмочевина) удаляли фильтрованием, а фильтрат промывали последовательно 1 Н хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток перекристаллизовывали из смеси этилацетат-нгексан с получением целевого соединения в виде белого кристаллического продукта (1/25 г,выход 77%). 1 Н-ЯМР (400 МГц, CDCl3) : 1,32 (3 Н, т,J=7 Гц), 3,51 (1 Н, д, J=2 Гц), 3,77 (1 Н, д, J=2 Гц),4,2-4,3 (2 Н, м), 6,22 (1 Н, д, J=8 Гц), 6,67 (1 Н, д,J=8 Гц), 7,1-7,4 (10 Н, м). Пример 2. (2S, 3S)-3-Дифенилметилкарбамоилоксиран-2-карбоновая кислота (соединение 1). Этил-(2S, 3S)-3-дифенилметилкарбамоилоксиран-2-карбоксилат (5,50 г, 16,9 ммоль), полученный в примере 1, растворяли в этаноле(300 мл). К образующемуся раствору добавляли 0,5 Н раствор гидроксида натрия в этаноле (40,4 мл, 20,2 ммоль) и смесь перемешивали 3 ч при комнатной температуре. Растворитель отгоняли при пониженном давлении, а остаток промывали двумя порциями по 100 мл этилового эфира после добавления воды (300 мл). Водную часть доводили до рН 1-2 добавлением 2 Н хлористоводородной кислоты и экстрагировали 3 порциями по 100 мл этилацетата. Органическую часть промывали насыщенным водным раствором хлорида натрия и сушили над безводным 8 сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением целевого соединения в виде белого кристаллического порошкового продукта (4,76 г, выход 95%). 1 Н ЯМР (400 МГц, CD3OD) : 3,57 (1 Н, д,J=2 Гц), 3,71 (1 Н, д, J=2 Гц), 6,23 (1 Н, с), 7,2-7,4(10 Н, м). Пример 3. (2S, 3S)-3-Дифенилметилкарбамоилоксиран-2-карбоксилат натрия (натриевая соль соединения 1). В этилацетате (10 мл) растворяли соединение (100 мг, 0,336 ммоль), полученное в примере 2. К образующемуся раствору добавляли раствор бикарбоната натрия (28,2 мг, 0,336 ммоль) в воде (10 мл). Смесь интенсивно встряхивали. Водную часть отбирали и концентрировали до сухого состояния при пониженном давлении с получением белого порошкового продукта (106 мг, выход 99%). 1 Н ЯМР (400 МГц, D2O): 3,47 (1 Н, д, J=2 Гц), 3,63 (1H, д, J=2 Гц ), 6,15 (1H, с),7,3-7,5(1,25 г, 6,05 ммоль) в метиленхлориде (7 мл) при охлаждении льдом. Смесь перемешивали 30 мин при комнатной температуре. Затем к смеси добавляли при охлаждении льдом раствор хлоргидрата этиламина (493 мг, 6,05 ммоль) и триэтиламина (0,84 мл, 6,05 ммоль) в метиленхлориде (7 мл). Образующуюся смесь перемешивали в течение ночи при 5 С. Растворитель отгоняли при пониженном давлении, a N,N'дициклогексилмочевину (ДЦ-мочевину) удаляли фильтрованием после добавления этилацетата (10 мл). Раствор последовательно промывали водой, 0,5 Н хлористо-водородной кислотой,насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией среднего давления на силикагеле (хлороформ/метанол=1/0-50/1) с получением целевого соединения в виде белого кристаллического порошкового продукта (928 мг,выход 47%). Т.пл. 190,0-195,0 С (разл.). 1 Н ЯМР (400 МГц, СDСl3) : 1,14 (3 Н, т),3,30 (2 Н, дк), 3,51 (1 Н, д), 3,55 (1 Н, д), 5,95 (1 Н, 9 ш. с), 6,22 (1 Н, д, J= 8 Гц), 6,59 (1 Н, ш. д, J=8 Гц), 7,1-7,4 (10 Н, м). ИК (KВr) см-1: 3290, 3088, 3064, 3030,2980, 2933, 2773, 1653, 1551, 1495, 1452, 1446,1371, 1354, 1279, 1240, 1153, 1092, 1053, 1030,1030, 999, 960, 891, 864, 862, 847, 808, 754, 696,648, 598, 571, 536, 478. Пример 5. Этил-(2S, 3S)-3-4-метил-1-(3 метилбутил)пентил]карбамоил]оксиран-2-карбоксилат (cоединение 10). В бензоле (40 мл) суспендировали 3 этоксикарбонилоксиран-2-карбоксилат калия(1,98 г, 10,0 ммоль). Бензол отгоняли при атмосферном давлении для удаления воды. Остаточный раствор охлаждали до комнатной температуры. Раствор перемешивали и к перемешиваемому раствору по каплям добавляли тионилхлорид (0,88 мл, 12,0 ммоль). Смесь нагревали с обратным холодильником 2,5 ч с получением раствора хлорангидрида исходного соединения. В сухом бензоле (10 мл) растворяли 4 метил-1-(3-метилбутил)-пентиламин (2,06 г,12,0 ммоль) и триэтиламин (1,67 мл, 12,0 ммоль). К образующемуся раствору по каплям добавляли полученный ранее раствор хлорангидрида при охлаждении льдом. Затем смесь перемешивали 3 ч при комнатной температуре. К смеси добавляли воду (3 мл) и органическую часть отделяли. Органическую часть промывали последовательно 10% водным раствором лимонной кислоты, водой, насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией среднего давления на силикагеле (гексан/этилацетат = 5/1) с получением целевого соединения в виде желтого масла (1,40 г, выход 45%). 1 Н ЯМР (400 МГц, CDCl3) : 0,8-1,0 (12 Н,м) , 1,1-1,4 (6 Н, м), 1,32 (3 Н, т, J=7 Гц), 1,4-1,6(1,40 г, 4,47 ммоль) и 0,5 Н раствор гидроксида калия в этаноле (10,7 мл, 5,35 ммоль), и получали целевое соединение в виде бледно-желтого аморфного продукта (1,15 г, выход 90%). 1 Н-ЯМР (400 МГц, CDCl3) : 0,8-0,9 (12 Н,м) , 1,0-1,4 (6 Н, м), 1,4-1,6 (4 Н, м), 3,46 (1 Н, д,J= 2 Гц), 3,78 (1 Н, д, J=2 Гц), 3,84 (1 Н, м), 6,12(32,7 мг, 0,389 ммоль), и получают целевое соединение в виде бледно-желтого порошкового продукта (выход 75%). 1 Н-ЯМР (400 МГц, D2O) : 0,8-1,0 (12 Н, м),1,1-1,3 (4 Н, м), 1,4-1,7 (6 Н, м), 3,42 (1H, с), 3,51(соединение 21). Повторяют реакции и обработку примера 2, используя (2R, 3R)-3-этоксикарбонилоксиран 2-карбоксилат калия (3,97 г, 20,0 ммоль), тионилхлорид (2,86 г, 24,0 ммоль), 3-метил-1 фенилбутиламин (4,25 г, 26,0 ммоль) и триэтиламин (2,63 г, 26,0 ммоль), и получают целевое соединение в виде бесцветного вязкого масла(2R,3R)-3-[(3-Метил-1 фенилбутил)карбамоил]оксиран-2-карбоновая кислота (соединение 19). Повторяют реакции и обработку примера 2, используя соединение, полученное в примере 8 (2,13 г, 6,98 ммоль) и 0,5 Н раствор гидроксида калия в этаноле (18 мл, 9,0 ммоль), и получают целевое соединение в виде белого аморфного продукта (1,78 г, выход 92%). 1 Н-ЯМР (400 МГц, CDCl3) : 0,8-1,0 (6 Н,м), 1,4-1,8 (3 Н, м), 3,34 (0,5 Н, д, J= 2 Гц), 3,47(натриевая соль соединения 19). Повторяют реакции и обработку примера 3, используя соединение, полученное в примере 9 (1,70 г, 6,18 ммоль) и карбонат натрия (515 мг,6,13 ммоль), и получают целевое соединение в виде бледно-желтого порошкового продукта 11 Повторяют реакции и обработку примера 1, используя (2S, 3S)-3-этоксикарбонилоксиран 2-карбоновую кислоту (1,01 г, 6,31 ммоль), Nгидроксисукцинимид (726 мг, 6,31 ммоль), N,N'дициклогексилкарбодиимид (1,30 г, 6,31 ммоль) и -бензилфенэтиламин (1,43 г, 6,31 ммоль). Полученный продукт очищали колоночной хроматографией на силикагеле(хлороформ/метанол=50/1) с получением целевого соединения в виде бледно-желтого масла (2,22 г,выход количественный). 1 Н-ЯМР (400 МГц, CDCl3) : 1,30 (3 Н, т,J=7 Гц) , 2,65 (1 Н, дд, J=9,14 Гц), 2,86 (2 Н, д, J=7 Гц), 2,87 (1 Н, д, J=2 Гц), 2,92 (1 Н, дд, J=6,14 Гц),3,51 (1 Н, д, J=2 Гц), 4,2-4,3 (2 Н, м), 4,42 (1H, м),5,78 (1 Н, ш. д, J=9 Гц), 7,1-7,3 (10 Н, м). Пример 12. (2S, 3S)-3-[ (-Бензилфенэтил) карбамоил]оксиран-2-карбоновая кислота. Повторяют реакции и обработку примера 2, используя соединение, полученное в примере 11 (2,22 г, 6,28 ммоль), и 5 Н раствор гидроксида калия в этаноле (15,1 мл, 7,55 ммоль), и получают целевое соединение в виде белого аморфного продукта (1,78 г, выход 87%). 1 Н-ЯМР (400 МГц, D2O) : 2,6-2,8 (2 Н, м),2,89 (1 Н, с), 3,0-3,1 (2 Н, м), 3,22 (1 Н, с), 4,33(460 мг, 5,47 ммоль), и получают целевое соединение в виде белого порошкового продукта(1,77 г, выход 93%). 1 Н-ЯМР (400 МГц, D2O) : 2,7-2,8 (2 Н, м) ,2,90 (1 Н, д, J=2 Гц), 3,0-3,1 (2 Н, м), 3,23 (1 Н, д,J=2 Гц), 4,34 (1 Н, м), 7,2-7,4 (10 Н, м). ИК (KВr) см-1: 3398, 3246, 3089, 3026,2956, 2927, 2860, 1668, 1626, 1566, 1497, 1454,1396, 1311, 1259, 1215, 1119, 1084, 1028, 982,957, 897, 864, 847, 798, 746, 698, 677, 607, 519,492. Пример 14. Ингибирующая активность в отношении рассасывания кости. У мыши ICR (возраст 6-7 дней) в асептических условиях был извлечен свод черепа. После удаления соединительной ткани свод черепа был разделен вдоль средней линии на две части. Предварительное культивирование проводили в культуральной среде (BGjb модифицированная среда, содержащая 5% инактивированной бычьей плодной сыворотки) в количестве 1 мл на пару костей в течение 24 ч в условиях 5% СО при 37 С. После завершения предварительного культивирования каждую из костей помещали в 0,5 мл той же самой культуральной среды, содержащей тестируемое соединение в различной концентрации, и культивировали в течение 72 ч в присутствии 3 х 10-7 М паратироидного гормона 12 проводили тем же способом, за исключением того, что не использовали ни тестируемое соединение, ни РТН. После завершения культивирования определяли способом с использованием комплексона орто-крезофталеина количество кальция, выделившегося в культуральную среду в течение 72 ч культивирования, и количество кальция, содержащегося в кости (растворенной в 1 мл 6 Н хлористо-водородной кислоты). Относительное выделение кальция (%) рассчитывали по следующему уравнению. Относительное выделение (%) = [количество кальция, выделившегося в культуральную среду ]/[количество кальция, выделившегося в культуральную среду + количество кальция в кости] х 100. Относительное ингибирование (%) рассасывания кости тестируемым соединением рассчитывали по следующему уравнению. Относительное ингибирование (%) = [1(относительное выделение в присутствии РТН и тестируемого соединения - относительное выделение в контрольном опыте)/(относительное выделение в присутствии РТН - относительное выделение в контрольном опыте)] х 100. Результаты представлены в табл.2. Пример 15. Ингибирующая активность в отношении катепсина L.(1) Приготовление лизосомной фракции печени крысы. Самца крысы штамма Вистар умерщвляли кровоиспусканием и для циркуляции в воротную вену вводили охлажденный льдом физиологический солевой раствор. Затем извлекали печень. Последующие операции проводили при 4 С. Печень измельчали ножницами. Пять граммов измельченной печени гомогенизировали в тефлоновом гомогенизаторе типа гомогенизатора Поттера после добавления 9-кратного объема 0,25 М водного раствора сахарозы. Гомогенизированную смесь центрифугировали 10 мин при 800 об/мин. Образовавшуюся надосадочную жидкость далее центрифугировали 20 мин при 12000 об/мин. Осадок гомогенизировали в 25 мл 0,25 М водного раствора сахарозы и затем центрифугировали 20 мин при 12000 об/мин. Образовавшийся осадок далее гомогенизировали в 100 мл 0,25 М водного раствора сахарозы. Таким образом получали лизосомную фракцию. Лизосомную фракцию разбавляли 0,25 М водным раствором сахарозы, содержащим 0,33% Тритона Х-100 для измерения активности катепсина L.(2) Измерение активности катепсина L. К 0,25 мл раствора (рН 5,5), содержащего 340 мМ ацетата натрия, 60 мМ уксусной кислоты, 4 мМ ЭДТА (этилендиаминтетрауксусной кислоты) и 8 мM дитиотреитола (реагент Клеланда, ДТТ,трео-1,4-димеркапто-2,3-бутандиол) добавляли 0,1 мл лизосомной фракции, 5 мкл тестируемого соединения и 0,545 мл дистиллированной воды. Смесь предварительно инкубировали при 30 С в течение 15 мин. После чего добавляли 0,1 мл раствора 50 мкМ карббензокси-L-фенилаланилL-аргинин-4-метилкумарил-7-амида (Z-Phe-ArgMKA) и реакция начиналась. Реакцию проводили при 30 С в течение 20 мин и затем прекращали добавлением 1 мл водного раствора (рН 4,3), содержащего 100 мМ монохлорацетата натрия, 30 мМ ацетата натрия и 70 мМ уксусной кислоты. В конечном полученном растворе измеряли интенсивность флуоресценции (длина волны возбуждения 380 нм, длина волны испускания 460 нм).Z-Phe-Arg-MKA также разрушается катепсином В, который содержится в лизосомной фракции. Поэтому измерение проводили в присутствии 10-7 М СА-074 [Murata, et al., FEBSLett., 280, 307-310 (1991)], который известен как специфический ингибитор катепсина В, так что активность катепсина В была полностью ингибирована. Результаты примеров 14 и 15 представлены в табл.2. Таблица 2 Тестируемое соединение Пример 3 Пример 7 Сравнит. Ингибирование рассасывания кости (концентрация тестир. соединения) 10-6M 10-5 М 10-4 М 90 63 14 бавлением 0,1 мл раствора 50 мкМ карбобензокси-L-аргинин-L-аргинин-4-метилкумарил-7 амида (Z-Arg-Arg-MKA, субстрат). Реакцию проводили при 30 С в течение 20 мин и затем прекращали добавлением 1 мл водного раствора(рН 4,3), содержащего 100 мМ монохлорацетата натрия, 30 мМ ацетата натрия и 70 мМ уксусной кислоты. В конечном полученном растворе измеряли интенсивность флуоресценции (длина волны возбуждения 380 нм, длина волны испускания 460 нм). Результаты приведены в табл. 3. Таблица 3 Тестируемое соеди- Ингибирование катепсина нение В (ИК 50) Пример 3 2,3 х 10-7 Пример 7 3,1 х 10-7 Пример 13 2,0 х 10-7 Вышеприведенные результаты указывают,что производное эпоксиянтарной кислоты изобретения обладает ингибирующей активностью в отношении катепсина В в дополнение к ингибирующей активности в отношении катепсина Как видно из вышеприведенных результатов, производное эпоксиянтарной кислоты изобретения показывает гораздо более высокую ингибирующую активность в отношении рассасывания кости, чем сравнительные соединения Х и Y (которые описаны в японском патенте 61-55509, с. 14, примеры 61,62). Пример 16. Ингибирующая активность в отношении катепсина В. К 0,25 мл раствора (рН 6,0), содержащего 352 мМ КН 2 РО 4 , 48 мМ Nа 2 НРО 4, 5,32 мМ ЭДТА 2Nа и 10 мМ L-цистеина добавляли 0,1 мл лизосомной фракции, 5 мкл раствора тестируемого соединения и 0,545 мл дистиллированной воды. Смесь предварительно инкубировали 15 мин при 30 С. Затем начинали реакцию до ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные эпоксиянтарной кислоты следующей формулы в которой R1 представляет атом водорода, алкил с 1-30 атомами углерода, арил с 6-40 атомами углерода или аралкил с 7-40 атомами углерода; каждый из R2 и R3 независимо представляет арил с 6-40 атомами углерода, аралкил с 7-20 атомами углерода или алкил с 3-10 атомами углерода; Х представляет -О- или -NR4; R4 представляет атом водорода, алкил с 1-10 атомами углерода или аралкил с 7-20 атомами углерода,или их фармацевтически приемлемые соли. 2. Фармацевтическая композиция для лечения костных заболеваний, которая содержит производные эпоксиянтарной кислоты следующей формулы в которой R1 представляет атом водорода, алкил с 1-30 атомами углерода, арил с 6-40 атомами углерода или аралкил с 7-40 атомами углерода; каждый из R2 и R3 независимо представляет арил с 6-40 атомами углерода, аралкил с 7-20 атомами углерода или алкил с 3-10 атомами уг 15 лерода; Х представляет собой -O-или -NR4; R4 представляет атом водорода, алкил с 1-10 атомами углерода или аралкил с 7-20 атомами уг 16 лерода, или их фармацевтически приемлемые соли.
МПК / Метки
МПК: C07D 303/46, A61K 31/335
Метки: кислоты, эпоксиянтарной, производные
Код ссылки
<a href="https://eas.patents.su/9-438-proizvodnye-epoksiyantarnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные эпоксиянтарной кислоты</a>
Предыдущий патент: Состав для лечения вич-инфекции и способ лечения
Следующий патент: Тостер
Случайный патент: Способ получения полиэтилентерефталата













