Усеченный по амино-концу моноцитарный хемотаксический белок (mcp-2) и способы его использования
Формула / Реферат
1. Усеченный по амино-концу моноцитарный хемотаксический белок (MCP-2), у которого отсутствуют NH2-концевые аминокислоты, соответствующие аминокислотным остаткам 1-5 природного MCP-2, имеющий аминокислотную последовательность SEQ ID No:3 или SEQ ID No:4, который обладает антагонистической активностью в отношении хемокинов MCP-1, MCP-2, MCP-3 и RANTES.
2. Усеченный по амино-концу MCP-2 по п.1 в гликозилированной форме.
3. Молекула ДНК, кодирующая усеченный MCP-2 по п.1 или 2.
4. Экспрессирующий вектор, содержащий молекулу ДНК по п.3.
5. Клетка-хозяин, содержащая экспрессирующий вектор по п.4.
6. Рекомбинантный способ получения белка по п.1 или 2, включающий культивирование клеток по п.5 в соответствующей питательной среде и выделение продукта экспрессии.
7. Применение белка по п.1 или 2 в качестве лекарственного средства для лечения заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов MCP-1, MCP-2 и RANTES.
8. Применение белка по п.1 или 2 для изготовления лекарственного средства для лечения и/или диагностики заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов MCP-1, MCP-2 и RANTES.
9. Применение по п.8 для изготовления лекарственного средства для лечения воспалительных заболеваний, ВИЧ-инфекций, заболеваний, ассоциированных с ангиогенезом и гемопоэзом, и опухолей.
10. Фармацевтическая композиция, содержащая белок по п.1 или 2, в сочетании с одним или более фармацевтически приемлемыми носителями и/или наполнителями для лечения заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов MCP-1, MCP-2 и RANTES.
Текст
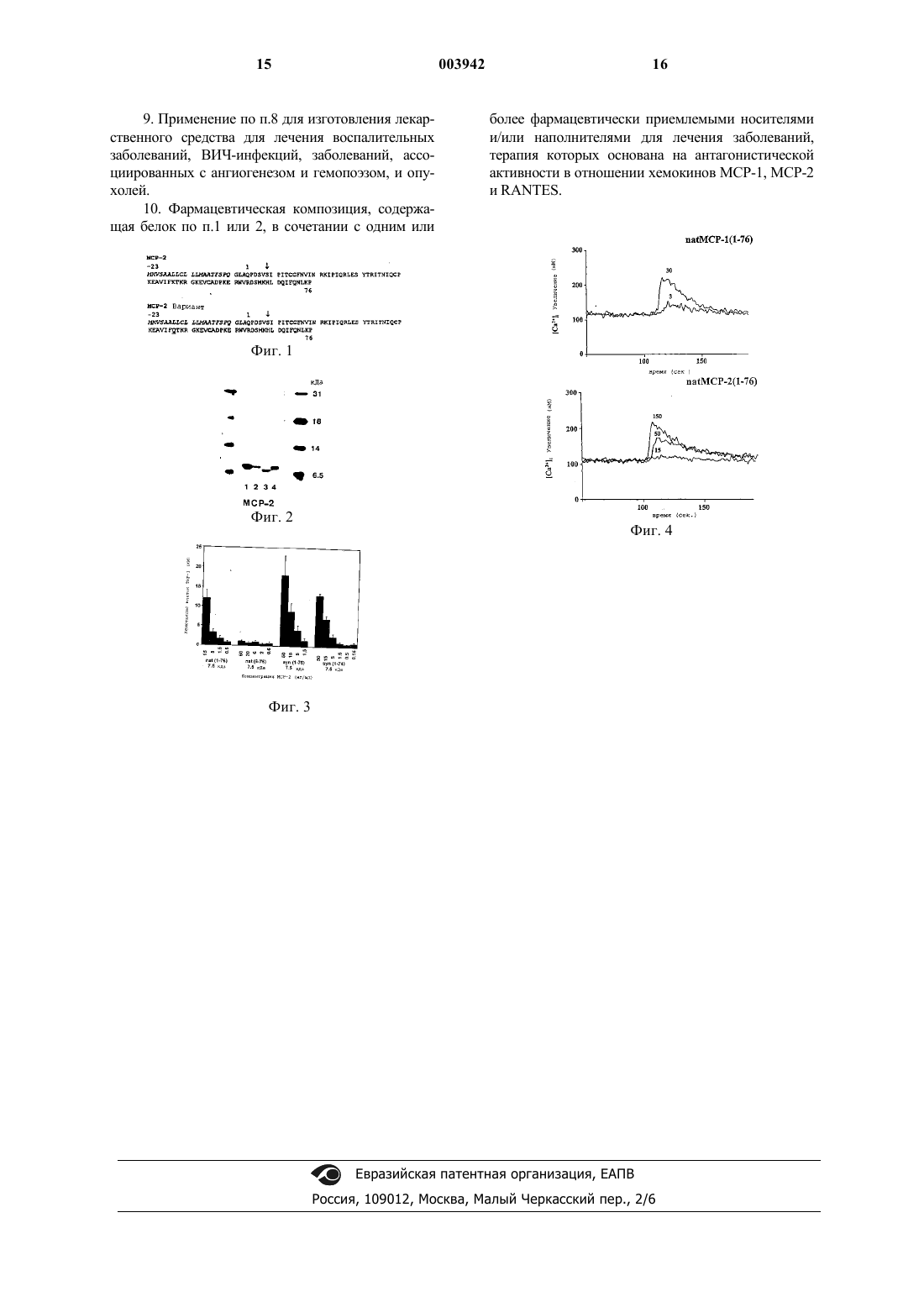
1 Область, к которой относится изобретение Настоящее изобретение относится к усеченным по аминоконцу МСР-2, у которых отсутствуют NH2-концевые аминокислоты, соответствующие аминокислотным остаткам 1-5 природного МСР-2, и которые обладают антагонистической активностью против хемокинов; а также к кДНК-последовательностям, кодирующим такие МСР-2, к их применению для лечения и/или диагностики заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов, и к фармацевтическим композициям, содержащим указанные МСР-2. Предпосылки создания изобретения Хемокины представляют семейство малых провоспалительных цитокинов, обладающих свойствами, стимулирующими хемотаксис и активацию лейкоцитов. В зависимости от положения первых цистеинов, это семейство хемокинов может быть подразделено на С-С-, С-ХС- и С-Х 3-С-хемокины (Baggiolini M. et al., 1994,Baggiolini M. et al., 1997 и Taub D. et al., 1996). Многие С-Х-С-хемокины, такие как интерлейкин-8 (IL-8) являются факторами, вызывающими хемотаксис нейтрофилов, тогда как СС-хемокины, такие как моноцитарный хемотаксический белок-3 (МСР-3), являются активными по отношению к ряду лейкоцитов, включая моноциты, лимфоциты, эозинофилы, базофилы,NK-клетки и дендритные клетки.NН 2-концевой домен хемокинов, участвующий в связывании с рецептором и NН 2 концевом процессинге, может либо активировать хемокины, либо делать хемокины полностью неактивными. Основный тромбоцитарный белок С-Х-Схемокина становится хемотаксическим пептидом для нейтрофилов (NAP-2) только после удаления 24 NН 2-концевых остатков (Walz А. etal., 1989 и Van Damme J. et al., 1990). Делеция вплоть до 8 NН 2-концевых остатков у IL-8 приводит к увеличению хемотаксической активности, но дополнительное отщепление мотива Glu-Leu-Arg, который расположен перед первым Cys во всех нейтрофильных хемотаксических С-Х-С-хемокинах, приводит к их полной инактивации (Clark-Lewis I. et al., 1991). Аналогичный NН 3-концевой протеолиз(вплоть до 8 аминокислот) другого С-Х-Схемокина, гранулоцитарного хемотаксического белка-2 (GCP-2), не оказывает влияния на хемотаксическую активность нейтрофилов (Proost P.NН 2-концевых аминокислот, являются неактивными по отношению к моноцитам и могут быть использованы как антагонисты рецепторов 2 Удлинение RANTES на один метионин приводит к полной инактивации молекулы иMet-RANTES начинает действовать как антагонист для аутентичного RANTES (Proudfoot A.E.et al., 1996). Клон человеческого МСР-2 (моноцитарный хемоаттрактант белок-2) был выделен путем дифференциального скрининга библиотеки кДНК-зондами, происходящими от стимулированных, но не покоящихся лимфоцитов периферической крови (ЛПК) (ранее называемых "НС 14", Chang H.C et al., 1989). Последовательность белка, происходящая от кДНК, была идентична последовательности очищенного природного МСР-2; однако, был также выделен предполагаемый аллельный вариант, в котором Lys 46 был заменен на Gln 46 (Van Coillie et al., 1997) МСР-2 был также синтезирован методом твердофазного химического синтеза (Proost P. et al.,1995). Описание изобретения Главной целью настоящего изобретения является получение усеченного по аминоконцу МСР-2, у которого отсутствуют NH2-концевые аминокислоты, соответствующие аминокислотным остаткам 1-5 природного МСР-2, и который обладает антагонистической активностью против хемокинов. Более конкретно, одной из целей настоящего изобретения является получение МСР-2(6-76), у которого отсутствуют 1-5-NH2 концевых аминокислот, как показано на фиг. 1 и в SEQ ID No:3 или SEQ ID No:4. Такой усеченный по аминоконцу МСР-2 настоящего изобретения может присутствовать в гликозилированной или в негликозилированной форме. Термин "антагонист хемокинов" означает"антагонист, который оказывает антагонистическое действие на зрелые полноразмерные природные хемокины". Другой целью настоящего изобретения является получение ДНК-молекул, содержащих ДНК-последовательности, кодирующие усеченный по аминоконцу МСР-2 настоящего изобретения, включая нуклеотидные последовательности, кодирующие, в основном, тот же МСР-2. Термин "нуклеотидные последовательности, кодирующие, в основном, тот же МСР-2" означает все другие нуклеотидные последовательности, которые благодаря вырожденности генетического кода, также кодируют данные аминокислотные последовательности. Настоящее изобретение также относится к экспрессирующим векторам, которые содержат вышеуказанные ДНК; к клеткам-хозяевам,трансформированным такими векторами; и к способу получения указанных усеченных по аминоконцу МСР-2 настоящего изобретения путем культивирования указанных трансформированных клеток в соответствующих культуральных средах. 3 ДНК-последовательность,кодирующая белки настоящего изобретения, может быть встроена и лигирована в соответствующую плазмиду. После ее продуцирования экспрессирующий вектор вводят в подходящую клеткухозяин, которая затем экспрессирует вектор(ы) с получением нужного белка. Экспрессия любого рекомбинантного белка настоящего изобретения, упоминаемого в данном описании, может быть осуществлена в эукариотических клетках (например, в клетках дрожжей, насекомых или млекопитающих) или в прокариотических клетках с использованием подходящих экспрессирующих векторов. В этих целях может быть использован любой метод,известный специалистам. Например, ДНК-молекулы, кодирующие белки, полученные любым из вышеуказанных методов, встраивают в соответствующим образом сконструированные экспрессирующие векторы способами, хорошо известными специалистам (см. Sambrook et al, 1989). Двухцепочечную кДНК сшивают с плазмидными векторами путем гомополимерного наращивания или путем рестрикционного лигирования, включая методы с использованием синтетических ДНКлинкеров или методы лигирования по тупым концам, т.е., для лигирования ДНК-молекул используют ДНК-лигазы, а нежелательное связывание предотвращают путем обработки щелочной фосфатазой. Для экспрессии нужного белка экспрессирующий вектор должен также включать специфические нуклеотидные последовательности,содержащие транскрипционные и трансляционные регуляторные элементы, присоединенные к ДНК, кодирующей нужный белок так, чтобы обеспечивалась экспрессия гена и продуцирование белка. Сначала, для того чтобы происходила транскрипция гена, необходимо, чтобы ему предшествовал промотор, который распознается РНК-полимеразой, и с которым связывается эта полимераза, что, таким образом, приводит к инициации процесса транскрипции. Существует ряд подходящих для использования, промоторов, которые действуют с различной эффективностью (сильные и слабые промоторы). Для эукариотических хозяев могут быть использованы различные транскрипционные и трансляционные регуляторные последовательности в зависимости от вида хозяина. Они могут быть получены из вирусных источников, таких как аденовирус, вирус коровьей папилломы обезьяний вирус или т.п., где указанные регуляторные сигналы ассоциированы с конкретным геном, имеющим высокий уровень экспрессии. В качестве примеров могут служить промотор ТК вируса герпеса, ранний промотор SV40,промотор гена gal 4 дрожжей и т.п. Могут быть выбраны регуляторные сигналы инициации транскрипции, обеспечивающие подавление и 4 активацию так, чтобы экспрессия генов могла быть модулирована. ДНК-молекулу, содержащую нуклеотидную последовательность, кодирующую белок настоящего изобретения, встраивают в вектор(ы), содержащий правильно присоединенные сигналы регуляции транскрипции и трансляции,и способный интегрировать нужные генные последовательности в клетку-хозяина. Клетки, которые были стабильно трансформированы введенной ДНК, могут быть отобраны посредством введения одного или нескольких маркеров, позволяющих проводить отбор клеток-хозяев, содержащих этот экспрессирующий вектор. Указанный маркер может также наделять ауксотрофного хозяина фототрофией, резистентностью к биоцидам, например, к антибиотикам или к тяжелым металлам,таким как медь и т.п. Ген селективного маркера может быть непосредственно присоединен к ДНК-последовательности экспрессируемого гена или введен в ту же самую клетку путем котрансфекции. Для оптимального синтеза белков настоящего изобретения могут быть также использованы дополнительные элементы. Важными факторами при отборе конкретного плазмидного или вирусного вектора являются легкость, с которой клетки-реципиенты,содержащие указанный вектор, могут быть идентифицированы и отделены от тех клетокреципиентов, которые не содержат указанного вектора; число копий вектора, которое должно присутствовать в данном хозяине; и требования к способности данного вектора реплицироваться в клетках-хозяевах разных видов. После получения вектора(ов) или ДНКпоследовательности, содержащей конструкцию(и), предназначенную для экспрессии, эта ДНК-конструкция(и) может быть введена в соответствующую клетку-хозяин различными подходящими методами, такими как трансформация, трансфекция, конъюгирование, слияние протопластов, электропорация, преципитация фосфатом кальция, прямая микроинъекция, и т.п. Клетки-хозяева могут быть прокариотическими или эукариотическими. Предпочтительными являются эукариотические хозяева, например, клетки млекопитающих, такие как клетки человека, обезьяны, мыши и клетки яичника китайского хомячка (СНО), поскольку они позволяют вносить посттрансляционные модификации в молекулы белка, включая соответствующую укладку или гликозилирование в нужных сайтах. Дрожжевые клетки также могут вносить посттрансляционные пептидные модификации, включая гликозилирование. Существует ряд технологий рекомбинантных ДНК, где используются последовательности сильных промоторов и высококопийное число плазмид,которые могут быть использованы для продуцирования нужных белков в дрожжах. Дрожжи 5 распознают лидерные последовательности на клонированных продуктах генов млекопитающих и секретируют пептиды, несущие лидерные последовательности (то есть, препептиды). После введения указанного вектора(ов) клетки-хозяева культивируют в селективной среде, которая обеспечивает селективный рост векторсодержащих клеток. Экспрессия клонированной генной последовательности(ей) приводит к продуцированию нужных белков. Усеченный по аминоконцу МСР-2 настоящего изобретения может быть получен любыми другими хорошо известными методами, а в частности, хорошо разработанными методами химического синтеза с использованием автоматических синтезаторов для твердофазного пептидного синтеза с последующей хроматографической очисткой. Хемокины настоящего изобретения могут быть, например, синтезированы с использованием групп Fmoc (9-флуоренилметоксикарбонила) и t-Boc (т-бутоксикарбонила) или любым другим аналогичным методом химического синтеза с использованием или без использования соответствующих боковых защитных групп на различных аминокислотах. Аминокислоты с соответствующими боковыми защитными группами, или без них, предварительно активируют,например, группами HBTU/HOBt [2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат/1-гидроксибензотриазол)], и присоединяют к растущей пептидной цепи. Перед добавлением следующего остатка защитную группу (например, Fmoc) отщепляют от -аминогруппы. После синтеза все защитные группы удаляют, интактные полноразмерные пептиды очищают и химически или ферментативно укладывают (включая образование дисульфидных мостиков между цистеинами) с получением соответствующих хемокинов настоящего изобретения. Очистку природных, синтетических или рекомбинантных белков осуществляют любым из хорошо известных методов, используемых для этих целей, т.е., любым стандартным методом, включая, экстракцию, преципитацию, хроматографию, электрофорез или т.п. (см., например, Proost et al., 1996). Дополнительной процедурой очистки, которая может быть предпочтительно использована для очистки белка настоящего изобретения, является аффинная хроматография с использованием моноклональных антител или аффинности к гепарину, где указанные антитела или гепарин связываются с целевым белком и где их продуцируют и иммобилизуют на гелевой матрице, находящейся в колонке. Препараты, содержащие белки с примесями,пропускают через колонку. Этот белок связывается с колонкой посредством гепарина или посредством специфического антитела, а примеси проходят через колонку. После промывки белок 6 элюируют из геля путем изменения рН или ионной силы. Усеченные по аминоконцу МСР-2 настоящего изобретения могут быть использованы для лечения и/или диагностики заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов. Примерами таких заболеваний являются воспалительные заболевания, заболевания, ассоциированные с ангиогенезом и гемопоэзом, опухоли, инфекционные заболевания, включая ВИЧ-инфекцию,аутоиммунные заболевания, атеросклероз, легочные заболевания и кожные болезни. Поэтому, в своем другом аспекте, настоящее изобретение относится к применению белка настоящего изобретения для изготовления лекарственного средства для лечения вышеупомянутых заболеваний. Лекарственное средство предпочтительно изготавливают в форме фармацевтической композиции, содержащей белки настоящего изобретения в сочетании с одним или несколькими фармацевтически приемлемыми носителями и/или наполнителями. Такие фармацевтические композиции входят в еще один аспект настоящего изобретения. Другим вариантом осуществления настоящего изобретения является способ лечения вышеупомянутых заболеваний, предусматривающий введение фармакологически активного количества усеченных по аминоконцу МСР-2 настоящего изобретения пациентам с риском развития таких заболеваний или пациентам, у которых уже имеются указанные патологии. Настоящее изобретение описано в нижеследующих примерах, которые не должны рассматриваться как некое ограничение настоящего изобретения. Ниже представлено конкретное описание чертежей. Описание чертежей На фиг. 1 показана аминокислотная последовательность МСР-2 и его известный вариант. Сигнальные последовательности указаны курсивом, а С-остатки указаны жирным шрифтом. Стрелками показаны первые аминокислоты усеченного по аминоконцу МСР-2(6-76) настоящего изобретения. Аминокислота, отличающаяся в варианте МСР-2, подчеркнута. На фиг. 2 проиллюстрирован электрофорез в ПААГ с ДСН усеченного по аминоконцу МСР-2 (6-76): Дорожка 1: природный МСР-2 (1-76, 100 нг/дорожку); Дорожка 2: природный МСР-2 (1-76, 30 нг/дорожку); Дорожка 3: природный МСР-2 (6-76, 30 нг/дорожку); и Дорожка 4: синтетический МСР-2 (1-76, 60 нг/дорожку). Гели пропускали в восстановительных условиях и белки окрашивали серебром. 7 На фиг. 3 показано сравнение хемотаксической способности модифицированных форм МСР-2. Интактный природный (nat) и синтетический (syn) МСР-2 (1-76), усеченный по NH2 концу природный МСР-2 (6-76) и усеченный по концу СООН синтетический МСР-2 (1-74) тестировали на хемотаксическую активность на клетках ТНР-1. Результаты представляют собой среднее ХИср.кв.ош. из четырех и более независимых экспериментов. На фиг. 4 показано, что природный МСР-2 является более слабым агонистом, чем МСР-1, в отношении мобилизации кальция в моноцитах. Интактный МСР-2 (15, 50 и 150 нг/мл) способствует дозозависимому увеличению [Са 2+]i в клетках ТНР-1. Представлен результат одного репрезентативного эксперимента из двух проведенных экспериментов. Примеры Пример 1. Усеченный по аминоконцу МСР-2 Материалы и методы Хемокин и иммуноанализ МСР-2 синтезировали и очищали методом,описанным ранее (Proost P. et al., 1995). Были получены специфические мышиные антитела против МСР-2 человека и очищены на колонке с сефарозой, с которой были связаны синтетические МСР-2 с использованием условий,указанных производителемELISA-планшеты покрывали аффинноочищенным антителом против МСР-2 человека,и биотинилированное антитело против МСР-2 использовали для захвата антител (Аb). Детектирование осуществляли с использованием меченного пероксидазой стрептавидина и ТМВ. Предел детекции для МСР-2 в ELISA составлял около 0,1 нг/мл. Продуцирование и очистка МСР-2 Моноцитарные хемотаксические белки выделяли из среды, кондиционированной мононуклеарными клетками периферической крови,взятой от 132 доноров и полученной из Центра по переливанию крови в Атверпене и в Лвене(Proost P. et al., 1996). Эритроциты и гранулоциты удаляли путем седиментации в гидроксиэтилированном крахмале (Fresenius AG, Bad Homburg, Germany) и путем градиентного центрифугирования в растворе метризоата натрияNyegaard, Oslo Norway). Мононуклеарные клетки (60 х 109 клеток) инкубировали (5 х 106 кл./мл) с 10 мкг/мл Con А и 2 мкг/мл ЛПС. Через 48 и 120 ч, кондиционированную среду собирали и хранили при -20 С вплоть до очистки. Природный МСР-2 очищали с использованием четырех стадий очистки, как описано ранее (Proost P. et al., 1996). 8 Вкратце, кондиционированную среду концентрировали на стекле с регулируемым размером пор или с использованием кремниевой кислоты, и частично очищали с помощью аффинной хроматографии на колонке с гепаринсефарозой (Pharmacia). Фракции, содержащие иммунореактивность МСП-2, дополнительно очищали на катионообменной колонке Mono S (Pharmacia) и элюировали в градиенте NaCl при рН 4,0. Природный МСР-2 очищали до гомогенности с помощью ОФ-ВЭЖХ на колонке с С-8Aquapore RP-300 (Perkin-Elmer, Norwak CT),уравновешенной 0,1% трифторуксусной кислотой (TFA. Белки элюировали в градиенте ацетонитрила. Биохимическая характеризация МСР-форм с помощью электрофореза в ПААГ с ДСН, анализ аминокислотной последовательности и массспекторометрия Чистоту колоночных фракций определяли с помощью электрофореза в ПААГ с ДСН (ПААГ-ДСН) в восстановительных условиях на Трис/трицин-гелях (Proost P. et al., 1996). Белки окрашивали серебром, а затем использовали относительные маркеры молекулярных масс(Mr): OVA (Mr 45000), карбонатдегидрогеназа (Mr 31000), соевый ингибитор трипсина (Мr 21500), -лактоглобулин (Mr 18400),лизоцим (Mr 14000) и апротинин (Mr 6500).NH2-концевую последовательность очищенных хемокинов определяли путем деградации по Эдману на импульсном жидкостном секвенаторе 477 А/120 А для секвенирования белков(Perkin Elmer) с использованием N-метилпиперидина в качестве связывающего основания. Блокированные белки расщепляли на участке между Asp и Pro в 75% муравьиной кислоте в течение 50 ч. Гидролизат муравьиной кислоты секвенировали без дополнительной очистки. Маркер (Mr) для МСР-2 определяли с помощью масс-спектрометрии, проводимой методом лазерной десорбционной ионизации на матрице/по времени пролета (MALDI/TOF-MS)(Micromass TofSpec, Manchester, UK). В качестве матрицы и внутреннего стандарта использовали альфа-циано-4-гидроксикоричную кислоту и цитохром С соответственно. Детекция хемотаксической активности МСР-2 тестировали на его хемотаксическую способность по отношению к свежевыделенным моноцитам (2 х 106 клеток/мл) или к моноцитам ТНР-1 (0,5 х 106 клеток/мл, через 2 дня после субкультивирования) в микрокамере Бойдена с использованием обработанных поливинилпирролидоном поликарбонатных мембран с размером пор 5 мкм. Образцы и клетки разводили в HBSS (Lifetechnologies/Gibco BRL, Paisley, Scotland), в который было добавлено 1 мг/мл сывороточного альбумина человека (Red Cross Belgium). После 2-часового инкубирования при 37 С, клетки 9 фиксировали и окрашивали растворами для окрашивания Diff-Quick (Harleco, Gibbstown, NJ),и клетки, которые мигрировали через мембраны, подсчитывали в десяти полях на микроскопе с масляной иммерсией и с 500-кратным увеличением. Хемотаксический индекс (ХИ) образца(тройные дупликаты в каждой камере) подсчитывали как число клеток, мигрировавших в образец, по отношению к числу клеток, мигрировавших в контрольную среду (Van Damme J etal., 1992). Для экспериментов на десенсибилизацию клетки инкубировали с биологически инактивированными вариантами хемокинов в течение 10 мин при 37 С, а затем добавляли в верхнюю лунку микрокамеры Бойдена. % Ингибирования ХИ вычисляли с использованием ХИ от HBSSобработанных клеток по отношению к образцу с известным значением. Детекция внутриклеточных концентраций Са 2+ Внутриклеточные концентрации кальция([Ca2+]i) измеряли, как описано ранее (Wuyts Aet al., 1997). Очищенные моноциты или клетки ТНР-1 (107 клеток/мл) инкубировали в минимальной поддерживающей среде Игла (ЕМЕМ,Gibco) + 0,5% FCS, содержащей флуоресцентный индикатор фура-2 (fura-2/AМ, 2,5 мкМ; молекулярные зонды, Molecular ProbesEurope BV, Leiden, The Netherlands) и 0,01% плюроник F-127 (Sigma. St Louis МО). После выдерживания в течение 30 мин при 37 С, клетки два раза промывали и ресуспендировали при 106 клеток/мл в HBSS с 1 мМ Ca2+ и 0,1% FCS (забуференного 10 мМ Hepes/NaOH при рН 7,4). Эти клетки уравновешивали при 37 С в течение 10 мин., а затем измеряли фура 2-флуоресценцию в люминесцентном спектрофотометре LS50B (Perkin Elmer). После возбуждения при 340 и 380 нм,флуоресценцию детектировали при 510 нм. Величину [Ca2+] вычисляли по уравнению Гринкевича (Grynkewicz et al., 1985). Для определенияRmax клетки лизировали 50 мкМ дигитонином. Затем рН доводили до 8,5 с использованием 20 мМ Триса, и величину Rmax получали при добавлении 10 мМ EGTA к лизированным клеткам. Используемая величина Kd составляла 224 нМ. Для экспериментов на десенcибилизацию моноциты или клетки ТНР сначала стимулировали буфером, хемокином или антагонистом хемокина в различных концентрациях. В качестве второго стимулятора использовали МСР-2 при концентрации, индуцирующей значительное увеличение [Са 2+]i после предварительной стимуляции буфером. Второй стимулятор вносили через 2 мин после добавления первого стимулятора. Вычисляли процент увеличения ингибирования [Ca2+]i в ответ на введение второго стимулятора путем сравнения сигнала, индуцированного после предварительной стиму 003942 10 ляции хемокином или антагонистом хемокина, с сигналом, индуцированным после добавления буфера. Результаты Выделение посттрансляционно модифицированных форм МСР-2 Для выявления различных форм МСР-2,продуцированных мононуклеарными клетками периферической крови, стимулированными митогеном и эндотоксином, использовали специфический и чувствительный ELISA. Кондиционированную среду очищали стандартными методами выделения (Proost P. etal., 1996), включая адсорбцию на поверхности стекла с регулируемым размером пор и хроматографию на гепарине-сефарозе. После этого проводили очистку с помощью катионообменной хроматографии на monoS (ЖЭХБ), а затем осуществляли дополнительную стадию очистки с помощью ОФ-ВЭЖХ с С-8. Молекулярные массы измеряли с помощью ДСН-ПААГ и с помощью MALDI/TOF-MS. Были выделены и другие формы МСР-2: помимо аутентичного 7,5 кДа-МСР-2(1-76), усеченная по NH2-концу 7 кДа-форма МСР-2, в которой отсутствовали пять остатков [МСР-2(676)], была очищена до гомогенности с помощью ОФ-ВЭЖХ и идентифицирована с помощью анализа аминокислотной последовательностиMALDI/TOF-MS (табл. 1) для интактного МСР 2 получали молекулярную массу 8881 Да (теоретический Мг 8893 Да), а молекулярная масса МСР-2(6-76) составляла 8365 Да, что подтверждало делецию пяти NН 2-концевых аминокислот (теоретически Мг 8384 Да). Функциональное сравнение этих природных форм МСР-2 в анализе на хемотаксис ТНР-1 показало, что интактный МСР-2 сохраняет активность при 5 нг/мл, тогда как усеченный МСР-2(6-76) утрачивает хемотаксическую активность при тестировании в пределах концентраций от 0,6 до 60 нг/мл (фиг. 3). Также проводили сравнение активности интактного природного МСР-2 с активностью синтетического МСР-2(1-76) и усеченной по СООН-концу синтетической формой(Proost P. et al., 1995), в которой отсутствовали два остатка [МСР-2(1-74)]. Было также установлено, что минимальная эффективная хемотаксическая концентрация этих форм составляет 5 нг/мл (фиг. 3), несмотря на то, что в анализе на хемотаксис, природные интактные МСР-1 и МСР-2 имеют сравнимую специфическую активность (Van Damme J., etal., 1992), способность МСР-2 к мобилизации кальция еще остается предметом обсуждения. Однако в экспериментах на мобилизацию Са 2+ минимальная эффективная доза как для природного, так и для синтетического МСР-2(1-76) в 10 раз превышала дозу природного интактного МСР-1(1-76) (фиг. 4), тогда как, МСР 2(6-76) оставался неактивным. 11 Тем не менее, интактный МСР-2 (50 нг/мл) был способен к десенсибилизации МСР-2 (15 нг/мл) и МСР-3 (10 нг/мл), что приводило к 52% и 45%-му ингибированию хемотаксиса, соответственно. Благодаря такой пониженной хемотаксической активности МСР-2 в анализе на Са 2+,десенсибилизацию хемотаксиса МСР-2 (6-76) осуществляли в микрокамере Бойдена. Поскольку сообщалось, что МСР-2 подвергается перекрестной десенсибилизации активными МСР-1, МСР-2 и МСР-3 в анализе на хемотаксис моноцитов (Sozzani S. et al., 1994), авторами было проведено исследование в целях выявления, может ли природный неактивный МСР-2(676) быть также десенсибилизирован МСР-1,МСР-2, МСР-3 и RANTES (табл. 2) . Предварительное инкубирование клеток ТНР-1 100 нг/мл инактивированного МСР-2(6-76) должно уже значительно ингибировать хемотаксис, индуцированный 10 нг/мл МСР-1 (63%), 5 нг/мл МСР-2(75%), 30 нг/мл МСР-3 (62%) и 100 нг/мл RANTES (75%). Более того, хемотаксис, индуцированный в ответ на в 3 раза меньшие концентрации соответствующих МСР, полностью (91100%) ингибировался 100 нг/мл МСР-2 (2-76). Кроме того, при концентрации, по меньшей мере, 10 нг/мл, МСР-2 (2-76) был еще способен к значительному ингибированию хемотаксической активности, индуцированной МСР-1 (3 нг/мл), МСР-2 (1,5 нг/мл) или МСР-3 (10 нг/мл) и RANTES (30 нг/мл). В целом, можно сделать вывод, что МСР-2 (6-76), продуцированный в природных условиях, является не активным как хемоаттрактант и является антагонистом некоторых С-С-хемокинов, то есть, оказывает действие,которое чаще всего наблюдается для МСР-3. Таблица 1. Биохимическая характеризация природных форм МСР-2, анализ NH2-концевой аминокислотной последовательности и сравнение экспериментальных (ДСН-ПААГ иMALDI/TOF-MS) и теоретических Мг для С-8-ОФ-ВЭЖХочищенных природных МСР-изоформ МСРNН 2-концеваяMS зилир. МСРблокирована 8893 7500 8881 2(1-76) МСРSIPITCC 8384 7000 8365 2(2-76) Таблица 2. МСР-2 (6-76) десенсибилизирует моноцитарный хемотаксический ответ МСР-1, МСР-2, МСР-3 и RANTES в микрокамере Хемокин 3 Концен- Антагонизация хемо- % Ингибиротрация таксического ответаb,c вания хемотаксиса Буфер 100 нг/мл МСР-2 (6-76) МСР-1 10 22.37.9 8.33.8 6321 3 15.08.0 1.30.3 991.0 МСР-2 5 36.012.6 10.86.1 758.0 1.5 6.71.4 1.50.3 917.0b верхние лунки микрокамеры заполняли клетками ТНР-1,которые были предварительно инкубированы с МСР-2(6-76) или с буфером с среднее значение ХИср.кв. ош. Из 3 независимых экспериментов ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Усеченный по аминоконцу моноцитарный хемотаксический белок (МСР-2), у которого отсутствуют NН 2-концевые аминокислоты, соответствующие аминокислотным остаткам 1-5 природного МСР-2, имеющий аминокислотную последовательность SEQ ID No:3 или SEQ ID No:4, который обладает антагонистической активностью в отношении хемокинов МСР-1, МСР-2, МСР-3 и RANTES. 2. Усеченный по аминоконцу МСР-2 по п.1 в гликозилированной форме. 3. Молекула ДНК, кодирующая усеченный МСР-2 по п.1 или 2. 4. Экспрессирующий вектор, содержащий молекулу ДНК по п.3. 5. Клетка-хозяин, содержащая экспрессирующий вектор по п.4. 6. Рекомбинантный способ получения белка по п.1 или 2, включающий культивирование клеток по п.5 в соответствующей питательной среде и выделение продукта экспрессии. 7. Применение белка по п.1 или 2 в качестве лекарственного средства для лечения заболеваний,терапия которых основана на антагонистической активности в отношении хемокинов МСР-1, МСР-2 и RANTES. 8. Применение белка по п.1 или 2 для изготовления лекарственного средства для лечения и/или диагностики заболеваний, терапия которых основана на антагонистической активности в отношении хемокинов МСР-1, МСР-2 и RANTES. 9. Применение по п.8 для изготовления лекарственного средства для лечения воспалительных заболеваний, ВИЧ-инфекций, заболеваний, ассоциированных с ангиогенезом и гемопоэзом, и опухолей. 10. Фармацевтическая композиция, содержащая белок по п.1 или 2, в сочетании с одним или 16 более фармацевтически приемлемыми носителями и/или наполнителями для лечения заболеваний,терапия которых основана на антагонистической активности в отношении хемокинов МСР-1, МСР-2 и RANTES.
МПК / Метки
МПК: A61K 38/19, A61P 43/00, G01N 33/68, C12N 15/19, C07K 14/52
Метки: mcp-2, использования, хемотаксический, амино-концу, моноцитарный, белок, способы, усеченный
Код ссылки
<a href="https://eas.patents.su/9-3942-usechennyjj-po-amino-koncu-monocitarnyjj-hemotaksicheskijj-belok-mcp-2-i-sposoby-ego-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Усеченный по амино-концу моноцитарный хемотаксический белок (mcp-2) и способы его использования</a>