Новые 2, 3, 3а, 4, 9, 9а – гексагидро – 8 – гидрокси – 1н – бенз[f]индолы, способ их получения и их применение в качестве лекарственных средств
Номер патента: 3370
Опубликовано: 24.04.2003
Авторы: Хёнке Кристоф, Паллук Райнер, Бехтель Вольф-Дитрих, Картер Адриан, Грауэрт Маттиас, Пшорн Уве, Вайзер Томас
Формула / Реферат
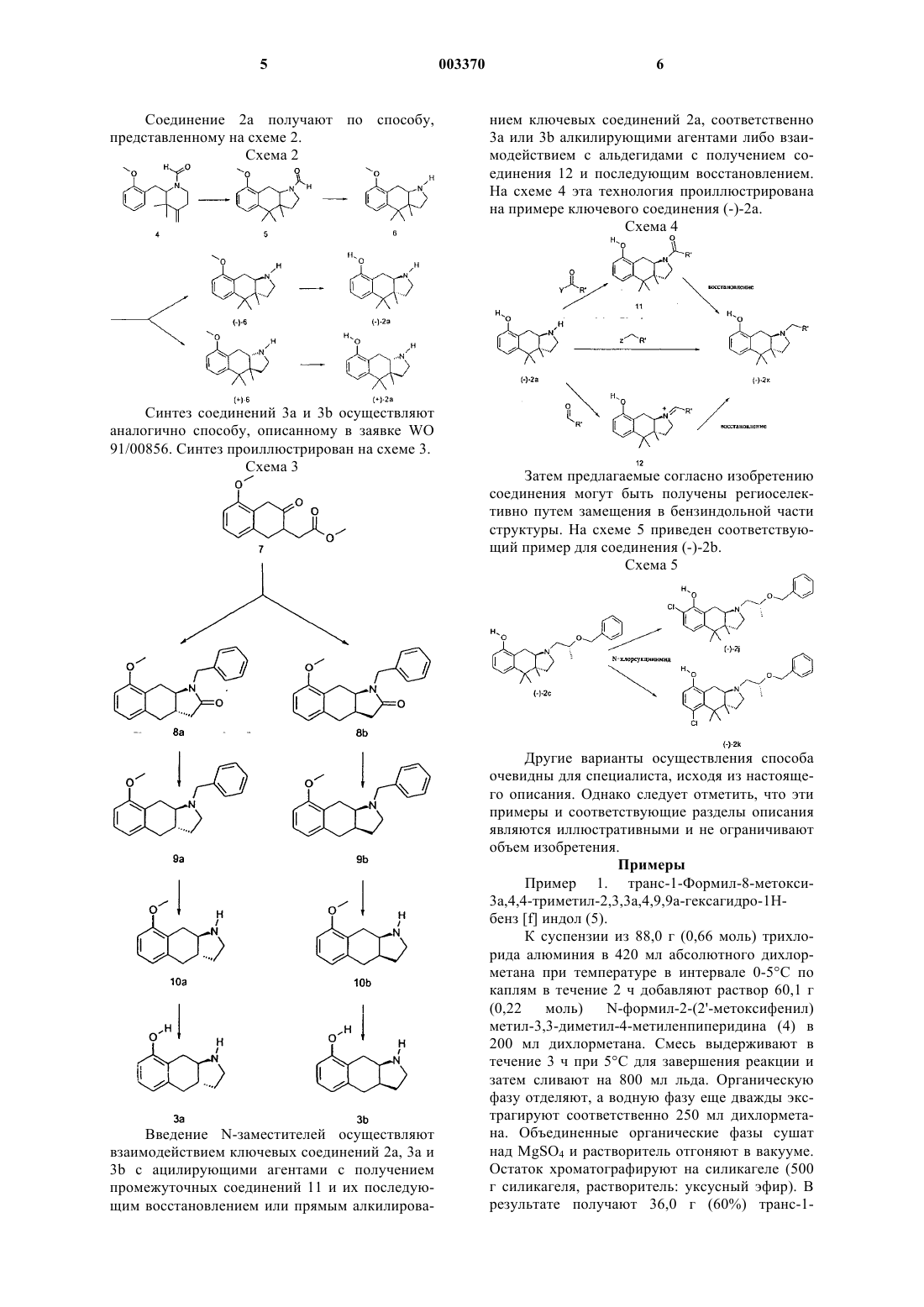
1. Производные индола общей формулы 1

где X обозначает простую связь, -O-, C1-C4алкил, C1-C3алкоксигруппу, -O-CH2-CH2-O- или -O-CH2-CH2-NH-,
R1 обозначает водород, метил, этил или фенил,
R2 обозначает водород или метил,
R3 обозначает водород, F, Cl, Br, гидрокси- или метоксигруппу,
R4 обозначает водород, метил или этил,
R5 обозначает водород, метил или этил,
R6 обозначает водород, метил или этил,
R7 обозначает трет-бутил, циклогексил,
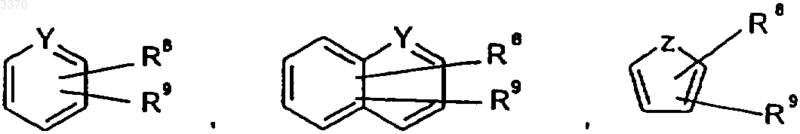
n обозначает целое число 0 или 1,
Y обозначает N или CH,
Z обозначает O, NH или S,
R8 обозначает водород, метил, F, Cl, Br или метоксигруппу,
R9 обозначает водород, метил, F, Cl, Br или метоксигруппу.
2. Соединения по п.1, отличающиеся тем, что они представлены в трансформе.
3. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1, а также его соответствующие кислотно-аддитивные соли и обычные вспомогательные вещества и носители.
4. Применение соединения по п.1 в качестве лекарственного средства.
5. Применение соединения по п.1 для изготовления лекарственного средства, являющегося антагонистом высвобождения глутамата.
6. Применение по п.5 для получения лекарственного средства, предназначенного для лечения аритмии, спазмов, сердечной и мозговой ишемии, а также нейродегенеративных заболеваний.
7. Применение по п.5 для изготовления лекарственного средства, предназначенного для лечения эпилептического статуса, гипогликемии, гипоксии, аноксии, травм головного мозга, отеков головного мозга, мозгового инсульта, перинатальной асфиксии, амиотрофного латерального склероза, болезни Хантингтона, болезни Альцгеймера, болезни Паркинсона, циклофрении, гипотонии, инфаркта миокарда, нарушений сердечного ритма, стенокардии, болей различного происхождения, прежде всего для лечения невропатии.
8. Применение по п.4 для получения местно-анестезирующего средства.
9. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают известными способами взаимодействию по атому азота с ацилирующим агентом, в котором Y обозначает замещаемую азотом уходящую группу, с получением соответствующего промежуточного продукта общей формулы 11 с последующим восстановлением этого промежуточного продукта по известным способам до соответствующего производного индола общей формулы 1
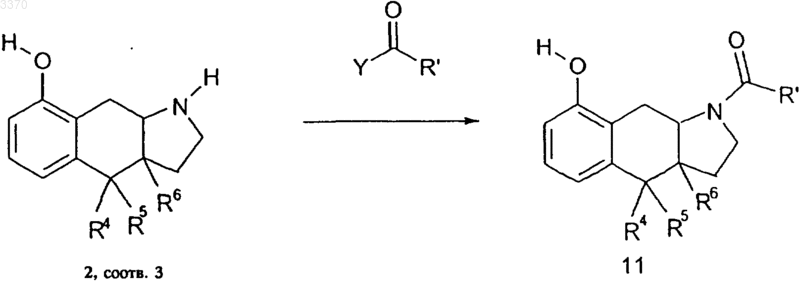
и в завершение выделяют продукт реакции общей формулы 1.
10. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают известными способами взаимодействию по атому азота с алкилирующим агентом, в котором Z обозначает замещаемую азотом уходящую группу,
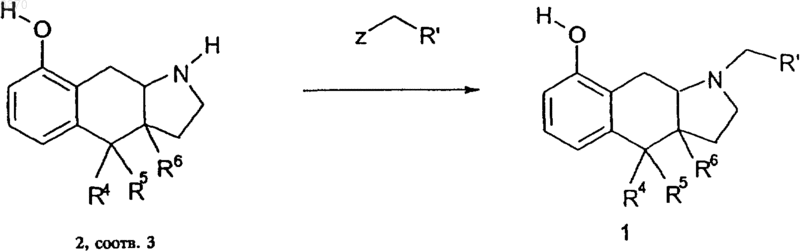
и в завершение выделяют продукт реакции общей формулы 1.
11. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают взаимодействию по атому азота с альдегидом с получением соответствующего промежуточного продукта общей формулы 12 с последующим восстановлением этого промежуточного продукта по известным способам до соответствующего конечного продукта общей формулы 1, который затем выделяют.
Текст
1 Настоящее изобретение относится к новым замещенным производным 2,3,3 а,4,9,9 а-гексагидро-8-гидрокси-1 Н-бенз[f]индола, к способу их получения и к их применению в качестве лекарственных средств. В изобретении предлагаются производные индола общей формулы 1-О-СН 2-СН 2-NН-,R1 означает водород, метил, этил или фенил,R2 означает водород или метил,R3 означает водород, F, Cl, Вr, гидроксиили метоксигруппу,R4 означает водород, метил или этил,R5 означает водород, метил или этил,R6 означает водород, метил или этил,R7 означает трет-бутил, циклогексил,n означает целое число 0 или 1,Y означает N или СН,Z означает О, NH или S,R8 означает водород, метил, F, Cl, Вr или метоксигруппу,R9 означает водород, метил, F, Cl, Вr или метоксигруппу. Объектом изобретения являются в том числе отдельные стереоизомеры, их смеси, а также соответствующие физиологически приемлемые кислотно-аддитивные соли с неорганическими или органическими кислотами, такими как НСl или НВr. Объектом изобретения являются также энантиомерные соединения и соответствующие рацематы. Предпочтительными являются соответствующие транс-производные. Предлагаемые соединения являются новыми. Из уровня техники известны 1-(С 1-С 8) алкил-, (С 1-С 8)алкенил-, соответственно (С 1-С 8) алкинил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индолы (WO 91/00856, С.Н. Lin и др., J. Med.Chem., 1993, 36, 1069-1083). Эти соединения обладают свойствами D2- и 5-НТ 1A-агонистов и используются для лечения ряда психических заболеваний, а также заболеваний, связанных с обменом веществ. Однако предлагаемые согласно изобретению аралкил-, арилоксиалкил-,алкокси-, циклоалкилалкильные и 1-бутилалкильные соединения в этих публикациях не описаны. 2 Биологические свойства Из существующего уровня техники известно, что вызываемое гипогликемией, гипоксией, аноксией, травмами и ишемией повреждение клеток и нарушение функций частично обусловлены повышенной синаптической активностью. С помощью серии экспериментов можно подтвердить, что такие гипогликемические и гипоксические состояния приводят к массовой деполяризации пораженных клеток. Вследствие такой деполяризации в свою очередь происходит патогенное возрастание уровня внутриклеточного кальция, а в нервных тканях дополнительно происходит повышенное высвобождение аминокислот,обладающих возбуждающей функцией (аминокислот-возбудителей). Зависящий от разности потенциалов натриевый канал играет решающую роль в этом каскаде. Поэтому за счет его блокады можно препятствовать деполяризации клеток, в результате чего снижается поток кальция по зависящим от разности потенциалов кальциевым каналам и наряду с этим также по каналам NMDA-рецепторов в нервные ткани. Кроме того, уменьшение притока ионов натрия в клетку препятствует работе механизма кальций/натриевого обмена в обратном направлении и поступлению в клетку кальция. Пониженный приток ионов натрия в клетку препятствует еще и работающему в обратном направлении транспорту глутамата и высвобождению глутамата [С.Р. Taylor и B.S. Meldrum,Trends Pharmacol. Sci., 16, 309-316 (1995); J.Urenjak и Т.Р. Obrenovitch, Am. Soc. Pharmacol. 48, 21-67 (1996)]. Рассматриваемые соединения являются блокаторами зависящего от разности потенциалов натриевого канала. Они представляют собой соединения, которые конкурентно или неконкурентно вытесняют батрахотоксин (ВТХ) с высокой аффинностью (Ki1000 нМ) из сайта связывания в натриевом канале. Такие соединения характеризуются "зависимостью от потребления" (usedependency) при блокаде натриевых каналов, т.е. для связывания соединений с натриевым каналом натриевые каналы сначала должны быть активированы. Максимальная блокада натриевых каналов может быть достигнута только после их повторной стимуляции. Вследствие этого соединения преимущественно связываются с теми натриевыми каналами, которые активированы в более сильной степени. Благодаря этому соединения обладают способностью проявлять свое действие преимущественно в тех областях организма, которые подвергнуты патологической сверхстимуляции. Тест-системой для определения блокирующего действия в отношении натриевого канала является ВТХ-связывание с натриевым каналом [S.W. Postma и W.A. Catteral, Mol.Pharmacol. 25, 219-227 (1984)], а также эксперименты типа "пэтч-кламп" (фиксация потенциала), с помощью которых можно установить, что 3 соединения по изобретению блокируют стимулированный электрическим напряжением натриевый канал "зависимым от применения" образом [W.A. Catteral, Trends Pharmacol. Sci., 8,57-65 (1987)]. Кроме того, нейрозащитное действие соединений по изобретению может быть определено по блокаде индуцируемого вератридином высвобождения глутамата [S. Villauneva, P.Frenz, Y. Dragnic, F. Orrego, Brain Res., 461, 377380 (1988)]. Вератридин представляет собой токсин, который держит натриевый канал постоянно в открытом состоянии, что приводит к повышенному притоку ионов натрия в клетку. Этот поток натрия, перемещающийся по вышеописанному каскаду, приводит к повышенному высвобождению глутамата в нервной ткани. Соединения по изобретению являются антагонистами этого высвобождения глутамата. Антиконвульсивные свойства соединений по изобретению определяют по защитному действию в отношении конвульсий, вызываемых максимально допустимым электрошоком, в опытах на мышах [М.А. Rogawski и R.J. Porter,Pharmacol. Rev. 42, 223-286 (1990)], а нейрозащитные свойства определяют по защитному действию в опытах с использованием МСАОмодели на крысах [U. Pschorn и A.J. Carter, J.Stroke Cerebrovascular Diseases, 6, 93-99 (1996)]. Кроме того, имеются данные о том, что блокатор натриевых каналов может применяться для лечения циклофрении (маниакальнодепрессивного психоза) [J.R. Calabrese, С. Bowden, M.J. Woyshville, Psychopharmacology: TheBloom и D.J. Kupfer), 1099-1111, New York, издво Raven Press Ltd.]. Таким образом, было установлено, что 1,2,3,4,5,6-гексагидро-2,6-метан-3-бензазоцин 10-олы общей формулы 1 могут применяться при заболеваниях, причиной которых является нарушение функций, обусловленное гипервозбуждением. К ним относятся такие болезни, как аритмии, спазмы, сердечные ишемии и ишемии головного мозга, а также нейродегенеративные заболевания различного генеза, к числу которых относятся, например, эпилептический статус,гипогликемия, гипоксия, аноксия, травмы головного мозга, отек головного мозга, инсульт головного мозга, перинатальная асфиксия, боковой амиотрофический склероз, болезнь Хантингтона, болезнь Альцгеймера, болезнь Паркинсона, циклофрения, гипотония, инфаркт миокарда, нарушения сердечного ритма, стенокардия, боли различных видов, соответственно этиологий, такие, например, как ноцицептивная боль с возбуждением болевых рецепторов при последующем прохождении импульсов в ЦНС или невропатическая боль вследствие повреждений периферической и центральной нервной системы (например, вследствие ампутации, параплегии, опоясывающего лишая или диабети 003370 4 ческой полиневропатии), боли, обусловленные функциональными нарушениями, такие, например, как мигрени, вызываемые нарушением регуляции сосудов, боли в спине вследствие телесных повреждений, включая психосоматические процессы, такие, например, как активация симпатического нерва в состоянии страха, мышечный спазм при эмоциональном стрессе. В соответствии с этим указанные соединения предназначены прежде всего для применения в качестве местного анестезирующего средства. Примеры композиций 1. Таблетки. Состав: Активное вещество по изобретению Стеариновая кислота Виноградный сахар Из указанных ингредиентов обычным образом изготавливают таблетки по 500 мг. При необходимости количество активного вещества может быть увеличено или уменьшено и соответственно может быть изменено в ту или иную сторону количество виноградного сахара. 2. Суппозитории. Состав: Активное вещество по изобретению Лактоза в виде порошка Масло какао Из указанных ингредиентов обычным образом изготавливают суппозитории весом 1,7 г. 3. Инфузионные растворы. Предлагаемое согласно изобретению активное вещество в фармацевтически эффективном количестве по известным способам вводят,например, в известные инфузионные физиологически приемлемые исходные растворы, например в 5%-й раствор ксилита или маннита. 4. Порошки для ингаляции. Микронизированным порошковым активным веществом (соединение формулы 1, размер частиц приблизительно 0,5-7 мкм) в количестве 5 мг, необязательно при добавлении микронизированной лактозы, заполняют твердожелатиновые капсулы. Порошок распыляют с помощью обычных ингаляторов, известных, например, из заявки DE-A 3345722, включенной в настоящее описание в качестве ссылки. Способы получения Ключевыми соединениями в синтезе являются норгексагидро-1H-бенз[f]индолы (соединения 2 а), которые представлены в данном описании в виде соответствующих (-)-энантиомеров, а также соединения 3 а и 3b. Схема 1 Синтез соединений 3 а и 3b осуществляют аналогично способу, описанному в заявке WO 91/00856. Синтез проиллюстрирован на схеме 3. Схема 3 Введение N-заместителей осуществляют взаимодействием ключевых соединений 2 а, 3 а и 3b с ацилирующими агентами с получением промежуточных соединений 11 и их последующим восстановлением или прямым алкилирова 003370 6 нием ключевых соединений 2 а, соответственно 3 а или 3b алкилирующими агентами либо взаимодействием с альдегидами с получением соединения 12 и последующим восстановлением. На схеме 4 эта технология проиллюстрирована на примере ключевого соединения (-)-2 а. Схема 4 Затем предлагаемые согласно изобретению соединения могут быть получены региоселективно путем замещения в бензиндольной части структуры. На схеме 5 приведен соответствующий пример для соединения (-)-2b. Схема 5 Другие варианты осуществления способа очевидны для специалиста, исходя из настоящего описания. Однако следует отметить, что эти примеры и соответствующие разделы описания являются иллюстративными и не ограничивают объем изобретения. Примеры Пример 1. транс-1-Формил-8-метокси 3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз [f] индол (5). К суспензии из 88,0 г (0,66 моль) трихлорида алюминия в 420 мл абсолютного дихлорметана при температуре в интервале 0-5 С по каплям в течение 2 ч добавляют раствор 60,1 гN-формил-2-(2'-метоксифенил) метил-3,3-диметил-4-метиленпиперидина (4) в 200 мл дихлорметана. Смесь выдерживают в течение 3 ч при 5 С для завершения реакции и затем сливают на 800 мл льда. Органическую фазу отделяют, а водную фазу еще дважды экстрагируют соответственно 250 мл дихлорметана. Объединенные органические фазы сушат над MgSO4 и растворитель отгоняют в вакууме. Остаток хроматографируют на силикагеле (500 г силикагеля, растворитель: уксусный эфир). В результате получают 36,0 г (60%) транс-1 7 формил-8-метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола (5) в виде масла. Пример 2. транс-8-Метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индол(6). 9,6 г (35 ммоль) транс-1-формил-8 метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (5) растворяют в 75 мл н-пропанола и смешивают с 25 мл концентрированной соляной кислоты и 15 мл воды. Затем нагревают в течение 12 ч с обратным холодильником, спирт отгоняют в вакууме и разбавляют 800 мл воды. Один раз экстрагируют 150 мл уксусного эфира (отбрасывают), водную фазу подщелачивают гидроксидом натрия и трижды экстрагируют уксусным эфиром порциями по 200 мл. Объединенные органические фазы сушат над MgSO4 и растворитель отгоняют в вакууме. В результате получают 8,6 г (100%) транс-8-метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола (6) в виде масла. Пример 3. Малат (-)-1R-транс-8-метокси 3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1Hбенз[f]индола -)6 МА) и малат (+)-1S-трансметокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола + )6 МА). 8,6 г (35 ммоль) транс-8-метокси-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1H-бенз[f] индола (6) растворяют в 89 мл метанола и смешивают с раствором 8,5 г (63 ммоль) L-(-)яблочной кислоты в 85 мл метанола. Затем перемешивают в течение 1 ч при комнатной температуре, выпавшие кристаллы отделяют вакуум-фильтрацией и перекристаллизовывают из 200 мл метанола. Таким путем получают 4,8 г(35%) малата (-)-1R-транс-8-метокси-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола -)6 МА), tпл 214C, []D25 = -42,5 (с = 1,метанол). Маточный раствор концентрируют, подщелачивают концентрированным аммиаком и дважды экстрагируют уксусным эфиром порциями по 200 мл. Объединенные органические фазы сушат над MgSO4 и растворитель отгоняют в вакууме. Затем с использованием D-(+)яблочной кислоты выделяют малат (+)-1Sтранс-8-метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола +)6 МА). Выход: 3,5 г (25%), tпл 214 С, []D25 =+46,1 (с = 1, метанол). Пример 4. Гидробромид (-)-1R-транс-8 гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1H-бенз[f]индола -)2 аВr). 4,8 г (12,8 ммоль) малата (-)-1R-транс-8 метокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола -)6 МА) сначала с помощью концентрированного аммиака переводят в свободное основание. Затем смешивают с 8 мл воды и 25 мл 62%-го бромистого водорода и нагревают в течение 3 ч с обратным холодиль 003370 8 ником. Затем концентрируют в вакууме и осадок перекристаллизовывают из 30 мл ацетона. Выход: 3,9 г (98%), tпл 250 С, []D25 =+ )2 аВr). С этой целью используют 19,3 г (51 ммоль) малата (+)-1R-транс-8-метокси-3 а,4,4-триметил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола(8 а) и цис 1-бензил-8-метокси-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индол-2-он (8b). 3,6 г (14,5 ммоль) метилового эфира 1,2,3,4-тетрагидро-5-метокси-3-оксо-2-нафталинуксусной кислоты (7) и 7,8 г (73 ммоль) бензиламина растворяют в 50 мл ТГФ и 50 мл метанола. Затем охлаждают до 0 С, подкисляют уксусной кислотой до рН=4,5 и перемешивают в течение 30 мин. После этого перемешивают с 1,8 г (29 ммоль) цианоборогидрида натрия и в течение 3 дней перемешивают при комнатной температуре. Реакцию в смеси прекращают добавлением 20%-го натрового щелока и органический растворитель отгоняют в вакууме. Затем трижды экстрагируют дихлорметаном порциями по 150 мл, объединенную органическую фазу один раз промывают насыщенным раствором хлорида натрия, сушат над MgSO4 и растворитель отгоняют в вакууме. Осадок хроматографируют на селикагеле (приблизительно 1000 г селикагеля, уксусный эфир/циклогексан в соотношении 1:1). В результате получают 0,5 г(10%) соединения 8 а и 1,1 г (25%) соединения 8b в виде масла. Пример 6. цис 1-Бензил-8-метокси 2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индол (9b). 0,51 г (13,4 ммоль) LiAlH4 предварительно вводят в 5 мл ТГФ, охлаждают до 0 С и по каплям добавляют раствор 1,0 г (3,3 ммоль) цис-1-бензил-8-метокси-2,3,3 а,4,9,9 а-гексагидро 1 Н-бенз[f]индол-2-она (8b) в 20 мл ТГФ. Затем в течение 5 ч нагревают с обратным холодильником, охлаждают до комнатной температуры и смешивают с 100 мл насыщенного раствора сульфата натрия. После этого трижды экстрагируют уксусным эфиром порциями по 100 мл,объединенную органическую фазу сушат надMgSO4 и растворитель отгоняют в вакууме. Осадок суспендируют в 15 мл метанола, нерастворимые компоненты отделяют вакуумфильтрацией и растворитель отгоняют в вакууме. В результате получают 0,5 г (52%) соединения 9b в виде масла. 9 Аналогично примеру 6 получают транс-1-бензил-8-метокси-2,3,3 а,4,9,9 а-гексагидро 1 Н-бенз[f]индол (9 а). С этой целью используют 0,21 г (5,5 ммоль) LiAlH4 и 0,5 г (1,6 ммоль) транс 1 бензил-8-метокси-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз[f]индол-2-она (8 а). Выход: 0,4 г (85%). Пример 7. цис 8-Метокси-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индол (10b). 1,7 г (5,8 ммоль) цис 1-бензил-8 метокси-2,3,3 а,4,9,9 а-гексагидро-1H-бенз[f] индола (9b) растворяют в 35 мл метанола и гидрируют при 20 С и давлении водорода 5 бар в присутствии 0,2 г Pd/C (10%-го). Через 5 ч фильтруют на селикагеле и растворитель отгоняют в вакууме. В результате получают 1,2 г(100%) соединения 10b в виде масла. Аналогично примеру 7 получают транс-8-метокси-2,3,3 а,4,9,9 а-гексагидро-1Hбенз[f]индол (10 а). С этой целью используют 0,47 г (1,6 ммоль) транс 1-бензил-8-метокси-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (9 а). В результате получают 0,32 г (100%) соединения 10 а в виде масла. Пример 8. Гидробромид цис 8-гидрокси-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола(3bBr). 0,55 г (2,7 ммоль) цис 8-метокси 2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (10b) добавляют к 6 мл воды и 12 мл концентрированной бромисто-водородной кислоты и нагревают в течение 20 ч с обратным холодильником. Затем концентрируют в вакууме, осадок еще раз растворяют в 10 мл этанола и растворитель повторно отгоняют в вакууме. В результате получают 0,69 г (95%) конечного продукта в виде гидробромида. Аналогично примеру 8 получают гидробромид транс 8-гидрокси-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (3 аВr). С этой целью используют 0,32 г (1,6 ммоль) транс 8-метокси-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (10 а). Выход: 0,41 г (95%). Пример 9. Гидрохлорид (-)-(1R,2'R)-транс 1-(2'-бeнзилoкcи)прoпил-8-гидpoкcи-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола-)2bНСl). 4,65 г (15 ммоль) (-)-1R-транс-гидрокси 3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1Hбенз[f]индола -)2 аНВr) и 5,0 г (39 ммоль) триэтиламина растворяют в 35 мл дихлорметана и через 30 мин по каплям добавляют раствор 3,6 г(18 ммоль) хлорангидрида (+)-R-2-бензилоксипропионовой кислоты в 10 мл дихлорметана. В течение 2 ч перемешивают при комнатной температуре, смешивают с 20 мл 2 н. соляной кислоты и органическую фазу отделяют. Затем органическую фазу сушат над MgSO4, растворитель отфильтровывают под вакуумом и остаток 10 растворяют в 60 мл тетрагидрофурана. К этому раствору добавляют 1,9 г (50 ммоль) LiAlH4,при этом температура повышается до 35 С. После выдержки в течение 1 ч смешивают с 20 мл 40%-го раствора тартрата аммония, органическую фазу отделяют и дважды экстрагируют уксусным эфиром порциями по 100 мл. Объединенные органические фазы сушат над MgSO4 и растворитель отфильтровывают под вакуумом. Остаток растворяют в 50 мл ацетона и с помощью эфирной соляной кислоты осаждают гидрохлорид. Кристаллы отделяют и промывают ацетоном. Выход: 2,8 г (45%), tпл 236 С, []D25 =-)2 сНСl): с этой целью используют 5,9 г (19 ммоль) гидробромида+)2bНСl): с этой целью используют 1,6 г (5 ммоль) гидробромида+ )2 сНСl): с этой целью используют 1,6 г (5 ммоль) гидробромида+)2dHCl): с этой целью используют 1,6 г (5 ммоль) гидробромида 11 гидрохлорид (-)-(1R)-транс-8-гидрокси-1(2'-фенокси)этил-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола -)2 еНСl): с этой целью используют 1,6 г (5 ммоль) гидробромида(-)69,3 (с = 1, метанол); гидрохлорид (+)-(1S)-транс-8-гидрокси-1(2'-фенокси)этил-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола +)2 еНСl): с этой целью используют 1,6 г (5 ммоль) гидробромида(+)71,5 (с = 1, метанол); оксалат тpaнc8-гидpoкcи-1-(2'-(2"фeнoкcи)этoкcи)этил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бенз[f]индола (3 еОХ): с этой целью используют 0,2 г (0,74 ммоль) гидробромида транс-8-гидрокси-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола (3 аВr) и 0,2 г (0,93 ммоль) хлорангидрида 2-(2'-фенокси)этокси) уксусной кислоты, при этом основание переводят в оксалат с помощью эфирной щавелевой кислоты,выход: 0,16 г (55%), tпл 181 С; оксалат цис 8-гидрокси-1-(2'-(2"фенокси)этокси)этил-2,3,3 а,4,9,9 а-гексагидро 1 Н-бенз[f]индола (3fOХ): с этой целью используют 0,63 г (2,3 ммоль) гидробромида цис-8-гидрокси-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола (3bНВr) и 0,5 г (2,6 ммоль) хлорангидрида 2-(2'-фенокси)этокси) уксусной кислоты, при этом основание переводят в оксалат с помощью эфирной щавелевой кислоты,выход: 0,3 г (33%), tпл 176 С. Пример 10. Гидрохлорид (+)-(1S,2'S)транс-1-(2'(2",6-дифтoрбeнзилoкси)пропил-8 гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола +)2fHCl). 1,46 г (4,7 ммоль) гидробромида (+)-1Rтранс-гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола +)2 аНВr) и 1,0 г(4,6 ммоль) (-)-S-2-(2',6'-дифторбензилокси) пропионовой кислоты растворяют в смеси из 50 мл тетрагидрофурана и 50 мл дихлорметана и смешивают с 0,8 г бензотриазола и 4 мл этилдиизопропиламина. Затем добавляют 0,9 г ТБТУO-(1 Н-бензотриазол-1-ил)N,N,N',N'-тетраметилурония) и перемешивают в течение 2 ч при комнатной температуре. Затем растворитель отгоняют в вакууме, остаток смешивают с 100 мл эфира уксусной кислоты и экстрагируют один раз 100 мл насыщенного раствора гидрокарбоната калия и 100 мл 1 н. рас 003370 12 твора соляной кислоты соответственно. Органическую фазу сушат над MgSO4 и растворитель отгоняют в вакууме. Остаток растворяют в 20 мл тетрагидрофурана и смешивают с 0,5 г (13 ммоль) LiAlH4. Далее выдерживают в течение 1 ч при 50 С, смешивают с 50 мл 40%-го раствора тартрата аммония, органическую фазу отделяют и дважды экстрагируют уксусным эфиром порциями по 100 мл. Объединенные органические фазы сушат над MgSO4 и растворитель отгоняют в вакууме. Остаток растворяют в 50 мл ацетона и с помощью эфирной соляной кислоты осаждают гидрохлорид. Кристаллы отделяют и промывают ацетоном. Выход: 1,3 г (63%), tпл 242 С, []D25 =(+)116,4 (с = 1, метанол). Аналогично примеру 10 получают следующие соединения: гидрохлорид (-)-(1R,2'S)-транс-1-(2'(2",6"дифторбензилокси)пропил-8-гидрокси-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола +)2gC17HCl): с этой целью используют 1,5 г (4,7 ммоль) гидробромида(-)33,8 (с = 1, метанол); оксалат (1RS,2'S)-транс-1-(2'-бензилокси) пропил-8-гидрокси-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз[f]индола (3 сОХ): с этой целью используют 0,2 г (0,74 ммоль) гидробромида транс 8-гидрокси-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола (3 аВr) и 0,13 г(0,74 ммоль) (-)-S-2-(бензилокси)пропионовой кислоты, при этом основание переводят в оксалат с помощью эфирной щавелевой кислоты,выход: 0,13 г (46%), tпл 193 С; оксалат(1RS,2'S)-цис-1-(2'-бензилокси) пропил-8-гидрокси-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз[f]индола (3dOX): с этой целью используют 0,46 г (1,7 ммоль) гидробромида цис 8-гидрокси-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола (3bНВr) и 0,31 г(1,7 ммоль) (-)-S-2-(бензилокси)пропионовой кислоты, при этом основание переводят в оксалат с помощью эфирной щавелевой кислоты,выход: 0,25 г (38%). Пример 11. Гидрохлорид (-)-(1R)-транс-8 гидрокси-1-(2'-(2"-фенокси)этокси)этил-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола -)2hHCl). 3,1 г (10 ммоль) гидробромида (-)-1Rтранс-гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола -)2 аВr) и 2,2 г (11 ммоль) 2-(2-фенокси)этоксиэтилхлорида растворяют в 50 мл диметилформамида (ДМФ),добавляют каталитическое количество KI и 3 г карбоната натрия. Смесь нагревают в течение 57 ч с обратным холодильником. Затем вакуум 13 фильтрацией отделяют неорганические соли и растворитель отгоняют в вакууме. Остаток растворяют в 100 мл воды, экстрагируют трижды уксусным эфиром порциями по 100 мл и объединенные органические экстракты промывают еще раз в 50 мл воды, сушат над MgSO4 и растворитель отгоняют в вакууме. Остаток фильтруют через небольшую силикагельную колонку(25 г силикагеля, 300 мл уксусного эфира), растворяют в ацетоне и с помощью эфирной соляной кислоты осаждают гидрохлорид. Выход: 3,3 г (76%), tпл 186 С, []D25 =+)2hHCl): с этой целью используют 3,1 г (10 ммоль) гидробромида(+)71,4 (с = 1, метанол); гидрохлорид (+)-(1S)-транс-8-гидрокси-1(2'(2"-(8-хинолинокси)этокси)этил-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола +)2iНСl): с этой целью используют 1,25 г (4 ммоль) гидробромида(-)-(1R)-транс-8-гидрокси-1-(2'(2"-(8 хинолинокси)этокси)этил-3 а,4,4-триметил 2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индол -)2i): с этой целью используют 1,25 г (4 ммоль) гидробромида(-)-1R-транс-гидрокси-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола -)2 аВr) и 1,2 г (4 ммоль) 2-(2'-(8 хинолинокси)этокси)этилхлорида, при этом свободное основание перекристаллизовывают из уксусного эфира/циклогексана,выход: 0,7 г (39%), tпл 163 С, []D25 =+)2jHCl). 0,93 г (4 ммоль) (+)-1R-транс-гидрокси 3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз[f]индола +)2 а) и 0,6 мл (7,2 ммоль) фуранилальдегида растворяют в 10 мл метанола,смешивают с молекулярным ситом и перемешивают в течение 2 ч при комнатной температуре. Затем молекулярное сито отфильтровывают и фильтрат смешивают с 0,31 г (5 ммоль) циано 003370 14 боргидрида натрия и 1,2 мл ледяной уксусной кислоты. Смесь оставляют на ночь, а затем смешивают с 20 мл 4 н. соляной кислоты и концентрируют в вакууме. Остаток растворяют в ацетоне и с помощью эфирной соляной кислоты осаждают гидрохлорид. Выход: 0,7 г (50%), tпл 250 С, []D25 =(-)-(1R)-транс-1-(3-фуранил)метил-8 гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f]индола -)2jНСl). С этой целью используют 0,93 г (4 ммоль)(-)-(1R,2'S)-транс-1-(2'-бензилокси)пропил-5 хлор-8-гидрокси-3 а,4,4-триметил-2,3,3 а,4,9,9 агексагидро-1 Н-бенз[f]индола -)2kHCl). 1,0 г (2,4 ммоль) гидрохлорида (-)-(1R,2'S)транс-1-(2'-бензилокси)пропил-8-гидрокси 3 а,4,4-триметил-2,3,3 а,4,9,9 а-гексагидро-1 Нбенз[f]индола -)2 сНСl) и 0,3 г (2,5 ммоль) Nхлорсукцинимида суспендируют в 20 мл ледяной уксусной кислоты и перемешивают в течение 24 ч при комнатной температуре, при этом суспензия переходит в раствор. Затем этот раствор концентрируют в вакууме, остаток смешивают с 100 мл ледяного 2 н. натрового щелока и трижды экстрагируют встряхиванием с уксусным эфиром, используя каждый раз порции по 100 мл. Объединенные органические фазы сушат над MgSO4 и растворитель отгоняют в вакууме. Затем осадок хроматографируют на оксиде алюминия (дихлорметан/метанол в соотношении 19:1). Соответствующие фракции концентрируют, остаток растворяют в 15 мл ацетона и с помощью эфирной соляной кислоты осаждают гидрохлорид. В результате получают 0,4 г (37%) соединения (-)-2iHCl, tпл 218 С,[]D25 = (-)12,3 (с = 1, метанол), и 0,44 г (41%) соединения (-)-2kHCl, tпл 250 С []D25 =-)2lНСl) и гидрохлорид (-)-(1R,2'R)-транс-1-(2'бензилокси)пропил-5-хлор-8-гидрокси-3 а,4,4 триметил-2,3,3 а,4,9,9 а-гексагидро-1 Н-бенз[f] индола -)2mНСl). С этой целью используют 0,42 г (1,0 ммоль) гидрохлорида (-)-(1R,2'S)-транс-1-(2'бензилокси)пропил-8-гидрокси-3 а,4,4-триметил 2,3,3 а,4,9,9 а-гексагидро-1H-бенз[f]индола(-)-2mНСl, tпл 252C, []D25 = (-)126,7 (с = 1,метанол). Заявка DE 19834714.6, на основании которой испрашивается приоритет по настоящей заявке, включена в настоящее описание в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные индола общей формулы 1 где Х обозначает простую связь, -О-, С 1 С 4 алкил, С 1-С 3 алкоксигруппу, -O-СН 2-СН 2-Оили -O-CH2-CH2-NH-,R1 обозначает водород, метил, этил или фенил,R2 обозначает водород или метил,R3 обозначает водород, F, Сl, Вr, гидроксиили метоксигруппу,R4 обозначает водород, метил или этил,R5 обозначает водород, метил или этил,R6 обозначает водород, метил или этил,R7 обозначает трет-бутил, циклогексил,n обозначает целое число 0 или 1,Y обозначает N или СН,Z обозначает О, NH или S,R8 обозначает водород, метил, F, Cl, Вr или метоксигруппу,R9 обозначает водород, метил, F, Cl, Вr или метоксигруппу. 2. Соединения по п.1, отличающиеся тем,что они представлены в трансформе. 3. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1, а также его соответствующие кислотноаддитивные соли и обычные вспомогательные вещества и носители. 4. Применение соединения по п.1 в качестве лекарственного средства. 5. Применение соединения по п.1 для изготовления лекарственного средства, являющегося антагонистом высвобождения глутамата. 6. Применение по п.5 для получения лекарственного средства, предназначенного для лечения аритмии, спазмов, сердечной и мозговой ишемии, а также нейродегенеративных заболеваний. 16 7. Применение по п.5 для изготовления лекарственного средства, предназначенного для лечения эпилептического статуса, гипогликемии, гипоксии, аноксии, травм головного мозга,отеков головного мозга, мозгового инсульта,перинатальной асфиксии, амиотрофного латерального склероза, болезни Хантингтона, болезни Альцгеймера, болезни Паркинсона, циклофрении, гипотонии, инфаркта миокарда, нарушений сердечного ритма, стенокардии, болей различного происхождения, прежде всего для лечения невропатии. 8. Применение по п.4 для получения местно-анестезирующего средства. 9. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают известными способами взаимодействию по атому азота с ацилирующим агентом, в котором Y обозначает замещаемую азотом уходящую группу, с получением соответствующего промежуточного продукта общей формулы 11 с последующим восстановлением этого промежуточного продукта по известным способам до соответствующего производного индола общей формулы 1 и в завершение выделяют продукт реакции общей формулы 1. 10. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают известными способами взаимодействию по атому азота с алкилирующим агентом, в котором Z обозначает замещаемую азотом уходящую группу и в завершение выделяют продукт реакции общей формулы 1. 11. Способ получения соединений общей формулы 1, отличающийся тем, что эдукт общей формулы 2 или 3 подвергают взаимодействию по атому азота с альдегидом с получением соответствующего промежуточного продукта общей формулы 12 с последующим восстановлением этого промежуточного продукта по известным способам до соответствующего конечного продукта общей формулы 1, который затем выделяют.
МПК / Метки
МПК: A61K 31/40, C07D 209/60, A61P 9/06
Метки: новые, бенз[f]индолы, получения, средств, применение, лекарственных, качестве, способ, гексагидро, гидрокси
Код ссылки
<a href="https://eas.patents.su/9-3370-novye-2-3-3a-4-9-9a-geksagidro-8-gidroksi-1n-benzfindoly-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 2, 3, 3а, 4, 9, 9а – гексагидро – 8 – гидрокси – 1н – бенз[f]индолы, способ их получения и их применение в качестве лекарственных средств</a>
Предыдущий патент: Новые фармацевтические композиции для лечения и жизнеобеспечения (поддержания жизненных функций) и способ их приготовления
Следующий патент: Применение биогенных сульфаматов эстрогенов для гормонзаместительной терапии
Случайный патент: Моющая композиция для дезинфекции кожных покровов и способ ее приготовления