Упакованный раствор для лечения повышения внутриглазного давления и глаукомы, включающий аналог pgf2α
Номер патента: 23661
Опубликовано: 30.06.2016
Авторы: Пеллинен Пертти, Реунамяки Тимо, Оксала Олли, Лехмуссаари Кари
Формула / Реферат
1. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий аналог PGF2α в качестве активного ингредиента, где указанный раствор содержит от 0,05 до 0,5% (мас./об.) неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилена)сорбитана моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена) сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат], и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60, от 0,005 до 0,2% стабилизатора, и, по существу, не содержит консервантов, где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена.
2. Упакованный водный раствор по п.1, где аналог PGF2α выбран из группы, состоящей из латанопроста, изопропил унопростона, травопроста, биматопроста и тафлупроста или смеси двух или более из указанных веществ.
3. Упакованный водный раствор по п.1, где аналог PGF2α представляет собой тафлупрост.
4. Упакованный водный раствор по п.3, где неионным поверхностно-активным веществом является полисорбат 80 или полиоксиэтиленовое гидрогенированное касторовое масло 40.
5. Упакованный водный раствор по любому из пп.1-4, в котором количество неионного поверхностно-активного вещества составляет 0,05-0,1% (мас./об.).
6. Упакованный водный раствор по любому из пп.1-5, в котором стабилизатор выбран из группы, состоящей из этилендиаминтетрауксусной кислоты и ее солей, нитрита натрия, аскорбиновой кислоты, стеарата L-аскорбиновой кислоты, гидросульфита натрия, альфатиоглицерина, эриторбовой кислоты, гидрохлорида цистеина, лимонной кислоты, токоферолацетата, дихлоризоцианурата калия, 2,6-ди-т-бутил-4-метилфенола, соевого лецитина, тиогликоллата натрия, тиомалата натрия, натурального витамина Е, токоферола, аскорбилпальмитата, пиросульфита натрия, бутилгидроксианизола, 1,3-бутиленгликоля, пентаэритрил тетракис[3-(3,5-ди-т-бутил-4-гидроксифенил)]пропионата, пропилгаллата, 2-меркаптобензимидазола и сульфата оксихинолина.
7. Упакованный водный раствор по п.6, в котором стабилизатором является эдетат динатрия.
8. Упакованный водный раствор по любому из пп.1-7, в котором количество стабилизатора составляет 0,01-0,1%.
9. Упакованный водный раствор по п.1 в лекарственной форме, содержащей разовую дозу.
10. Упакованный водный раствор по п.1, где полиэтиленовый контейнер изготовлен экструзией раздувным формованием.
11. Упакованный водный раствор по п.1, где полиэтилен представляет собой полиэтилен низкой плотности (LDPE).
12. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий
0,0001-0,01% мас./об. аналога PGF2α;
0,05-0,5% мас./об. неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилена)сорбитана моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена)сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат] и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60;
0,005-0,2% мас./об. стабилизатора и
регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах,
и, по существу, не содержащий консервантов,
где раствор упакован в контейнер, который может содержать не более 10% другого материала, отличного от полиэтилена.
13. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий
0,0010-0,0015% мас./об. тафлупроста;
0,05-0,1% мас./об. полисорбата 80;
0,01-0,1% мас./об. динатрий эдетата и
буферы, регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах,
и, по существу, не содержащий консервантов,
где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена.
14. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий
0,0015% мас./об. тафлупроста;
0,075% мас./об. полисорбата 80;
0,05% мас./об. эдетата динатрия;
2,25% мас./об. Глицерина;
0,2% мас./об. дигидрата дигидрофосфата натрия;
регуляторы pH
и, по существу, не содержащий консервантов, где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена.
15. Упакованный глазной водный раствор по любому из пп.12-14 в разовой дозе или в стандартной лекарственной форме.
16. Упакованный глазной водный раствор по любому из пп.12-14 в форме устройства для распыления жидкости.
Текст
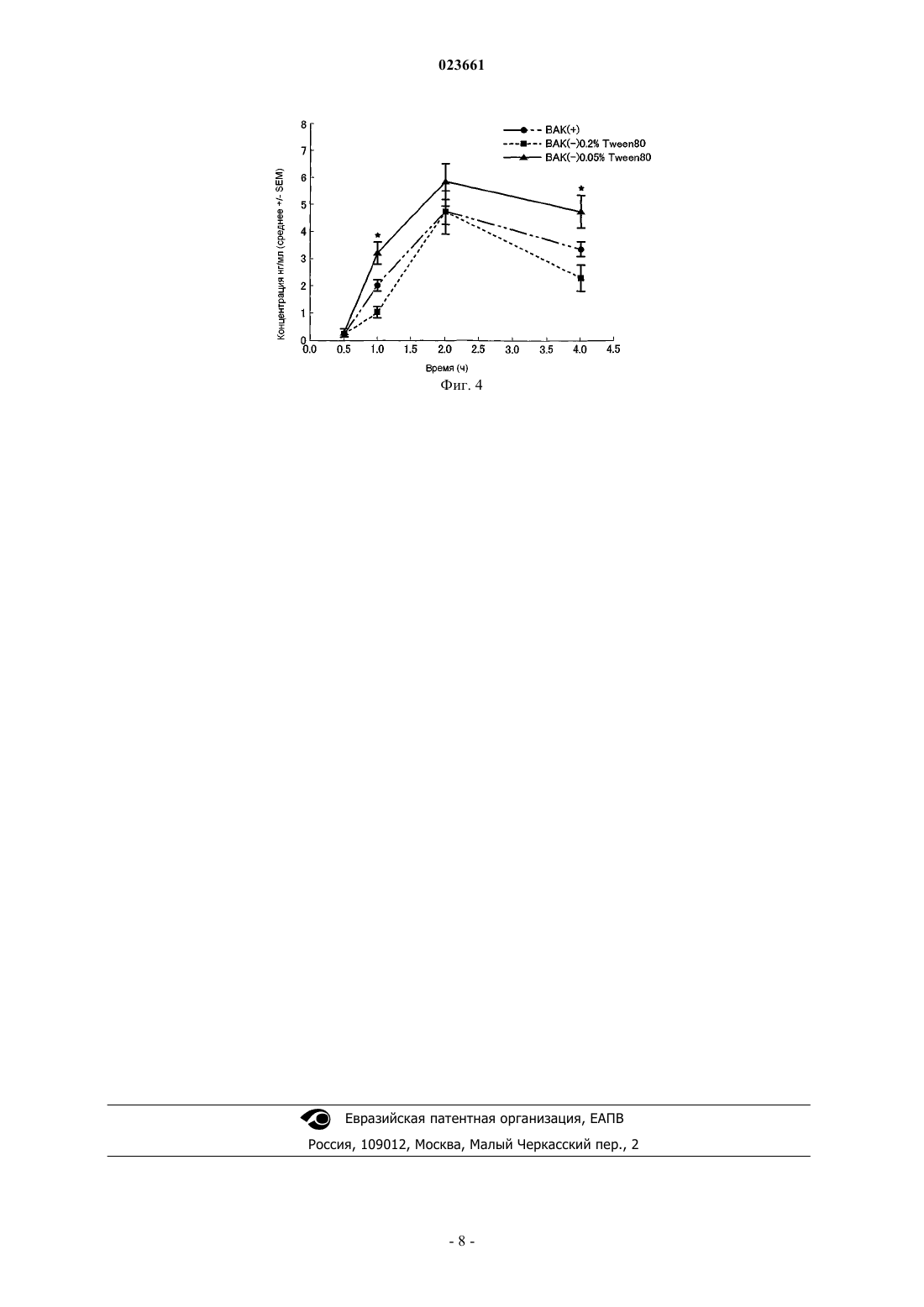
УПАКОВАННЫЙ РАСТВОР ДЛЯ ЛЕЧЕНИЯ ПОВЫШЕНИЯ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ И ГЛАУКОМЫ, ВКЛЮЧАЮЩИЙ АНАЛОГ PGF2 Настоящее изобретение относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, где раствор включает аналог PGF2 в качестве активного ингредиента,где указанный раствор содержит от 0,05 до 0,5% (мас./об.) неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилен)сорбинат моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена)сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат] и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40,полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60, от 0,005 до 0,2% стабилизатора и, по существу,не содержит консервантов, где раствор упакован в контейнер, выполненный из материала,содержащего не более 10% другого материала, отличного от полиэтилена. Область техники изобретения Настоящее изобретение относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, включающему аналог PGF2 в качестве активного ингредиента, не содержащему консерванта, для лечения повышения внутриглазного давления и глаукомы, к способу лечения повышения внутриглазного давления и глаукомы путем введения указанного раствора пациенту, нуждающемуся в таком лечении, и к способу увеличения водной растворимости и улучшения растворимости аналоговPGF2 в водном растворе. Предшествующий уровень техники изобретения Аналоги PGF2 широко использовались для лечения глаукомы и повышения внутриглазного давления вследствие их эффективности в снижении внутриглазного давления и их незначительных системных побочных эффектов. Аналоги PGF2 включают все известные аналоги PGF2, например тафлупрост, латанопрост, изопропилпростон, травопрост, биматопрост и аналоги, показанные в US 5886035,US 5807892, US 6096783. Тафлупрост представляет собой фторированный аналог изопропилового эфира PGF2 нового поколения, который является эффективным средством, снижающим внутриглазное давление (ЕР 0850926). Концентрация аналогов PGF2, используемых для лечения глаукомы, является очень низкой. Например, было обнаружено, что эффективная концентрация тафлупроста от 0,0005 до 0,005 (мас./об.),предпочтительно около 0,0015% в глазной композиции является достаточной для лечения повышения внутриглазного давления и глаукомы. Однако как липофильные вещества аналоги PGF2, такие как тафлупрост, подвергаются абсорбции смолистыми (пластиковыми) контейнерами или бутылями, обычно используемыми для хранения глазных растворов, и, следовательно, уже низкая концентрация лекарственного средства в глазном растворе может дополнительно быть снижена. Консерванты. Консерванты, которые оказывают достаточный антимикробный эффект на бактерии и грибы, традиционно используют в глазных композициях. В добавлении к этому консерванты должны быть стабильными и предпочтительно гомогенизировать и стабилизировать композицию путем взаимодействия с ингредиентами, например путем гомогенного диспергирования или растворения ингредиентов в носителе или основе (см. EP 0969846, EP 1916002 и EP 1547599). В настоящее время наиболее часто используемыми консервантами в коммерчески доступных глазных растворах являются хлорид бензалкония (BAK) и другие соли четвертичного аммония. Другие фармацевтически приемлемые консерванты для глазных растворов представляют собой, например, борную кислоту-полиол-хлорид цинка (EP 1115406) или соединения окиси хлора (EP 1905453), глюконат хлоргексидина, хлорид бензетония, сорбиновую кислоту,сорбат калия, этил п-гидроксибензоат и бутил п-гидроксибензоат. Однако консерванты также известны как основная причина кератоконъюнктивальных заболеваний и с целью безопасности предпочтительно, чтобы концентрация консерванта, такого как хлорид бензалкония (BAK), была настолько низкой, насколько возможно. Также разрабатывали глазные растворы без консервантов. С другой стороны BAK участвует в профилактике разложения простагландинов и в ингибировании абсорбции простагландинов смолистыми стенками контейнеров. Абсорбция тафлупроста и других аналогов PGF2 стенками смолистых контейнеров была проблемой, особенно для контейнеров, сделанных из полиэтилена. Из-за их свойств, таких как достаточная гибкость, мягкость, хорошая производимость и удобство в использовании, полиэтилен является предпочтительным материалом выбора для упаковки глазных композиций, особенно в стандартной лекарственной форме. Кроме того, абсорбция аналогов PGF2 стенками смолистых контейнеров зависит от площади поверхности стенок контейнера. Стандартная форма препарата содержит очень небольшое количество глазных композиций и площадь контакта препарата с контейнером является очень большой. Следовательно, абсорбция аналогов PGF2 к стенкам контейнера является серьезной проблемой стандартных лекарственных форм препаратов. Следовательно, до настоящего изобретения в практике не было возможным получить стабильные глазные растворы без консервантов, которые содержат аналоги PGF2 и которые могут быть упакованы и храниться в контейнерах, состоящих преимущественно из полиэтилена. В соответствии с EP 1011728 водные композиции простагландинов, упакованные в полипропиленовые контейнеры, являются более стабильными, чем таковые, упакованные в полиэтиленовые контейнеры. На основании результатов стабильности указанной публикации специалист в области техники не обязан выбирать полиэтилен, но скорее он отвергает его как материал контейнера, особенно для высоколипофильных соединений, таких как аналоги PGF2. Также возможны сополимеры полипропилена-полиэтилена, включающие полиэтилен в качестве второстепенного компонента, что не подразумевает полиэтилен как единственный материал или как основной компонент смолы (EP 1829545). Более того, почти все аналоги PGF2 являются практически не растворимыми в воде. Следовательно, необходимо решать также проблему растворимости в воде с целью рецептирования аналогов PGF2 в глазных растворах, особенно для стандартной лекарственной формы препаратов. В EP 1321144 и US 2007/248697 неионное поверхностно-активное вещество добавляли к глазному раствору для профилактики абсорбции производного простагландинов на смолистом контейнере. Другие попытки скомпенсировать трудности рецептирования высоколипофильных аналогов простагландинов в воде были описаны,например, в EP 0969846, EP 1666043, EP 1011728 и WO 2007/042262, но в них не упоминаются какиелибо композиции без консервантов. Следовательно, задачей настоящего изобретения является обеспечение глазного водного раствора,включающего аналоги PGF2, и, по существу, без консервантов, где абсорбция аналогов PGF2 к смолистым контейнерам, состоящим, по существу, из полиэтилена, предотвращается и где указанные аналоги остаются растворимыми, стабильными и биодоступными в препарате без консервантов. Водный глазной раствор по изобретению обеспечивает существенное клиническое преимущество, так как в настоящее время существует нерешенная клиническая необходимость для пациентов с глаукомой в простагландиновых глазных каплях без консерванта. Сущность изобретения Настоящее изобретение относится к упакованному водному глазному раствору для лечения повышения внутриглазного давления и глаукомы, включающему аналог PGF2 в качестве его активного ингредиента, такой раствор содержит неионное поверхностно-активное вещество, стабилизатор и, по существу, не содержит консервантов, в контейнере, состоящем преимущественно из полиэтилена. В частности настоящее изобретение относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, включающему аналога PGF2 в качестве активного агента; 0,05-0,5% мас./об. неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилен)сорбитан моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена) сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат] и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60; 0,005-0,2% мас./об. стабилизатора, и, по существу, не содержащему консервантов, где раствор упакован в контейнер, который может содержать не более 10% другого материала, отличного от полиэтилена. Аналог PGF2 выбирают из группы, состоящей из латанопроста, изопропил унопростона, травопроста, биматопроста и тафлупроста или смеси двух или более из указанных веществ. В частности аналог PGF2 представляет собой тафлупрост. Неионным поверхностно-активным веществом является полисорбат 80 или полиоксиэтиленовое гидрогенированное касторовое масло 40 и количество неионного поверхностно-активного вещества составляет 0,05-0,1% (мас./об.). В упакованном растворе стабилизатор выбран из группы, состоящей из этилендиаминтетрауксусной кислоты и ее солей, нитрита натрия, аскорбиновой кислоты, стеарата L-аскорбиновой кислоты, гидросульфита натрия, альфатиоглицерина, эриторбовой кислоты, гидрохлорида цистеина, лимонной кислоты, токоферолацетата, дихлоризоцианурата калия, 2,6-ди-т-бутил-4-метилфенола, соевого лецитина, тиогликоллата натрия, тиомалата натрия, натурального витамина E, токоферола, аскорбилпальмитата, пиросульфита натрия, бутилгидроксианизола, 1,3-бутиленликоля, пентаэритрил тетракис-[3-(3,5-ди-тбутил-4-гидроксифенил)]пропионата, пропилгаллата, 2-меркаптобензимидазола и сульфата оксихинолина, и количество стабилизатора составляет 0,01-0,1%. В частности, стабилизатором является эдетат динатрия. Упакованный водный раствор представлен в лекарственной форме, содержащей разовую дозу. Упакованный водный раствор помещен в полиэтиленовый контейнер, изготовлен экструзией раздувным формованием. В частности, полиэтилен представляет собой полиэтилен низкой плотности(LDPE). Изобретение относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, включающему 0,0001-0,01% мас./об. аналога PGF2; 0,05-0,5% мас./об. неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилен)сорбинат моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена)сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат] и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60,0,005-0,2% мас./об. стабилизатора и регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах,и, по существу, не содержащий консервантов, где раствор упакован в контейнер, который может содержать не более 10% другого материала, отличного от полиэтилена. Изобретение также относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, включающему 0,0010-0,0015% мас./об. тафлупроста; 0,05-0,1% мас./об. полисорбата 80; 0,010,1% мас./об. динатрий эдетата и буферы, регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах, и, по существу, не содержащему консервантов, где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена. Изобретение, кроме того, относится к упакованному водному раствору для лечения глазной гипертензии и глаукомы, включающему 0,0015% мас./об. тафлупроста; 0,075% мас./об. полисорбата 80; 0,05% мас./об. эдетата динатрия; 2,25% мас./об. глицерина; 0,2% мас./об. дигидрата дигидрофосфата натрия,регуляторы pH и, по существу, не содержащему консервантов, где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена. Указанный упакованный глазной водный раствор представлен в разовой дозе или в стандартной лекарственной форме. Упакованный глазной водный раствор также представлен в форме устройства для распыления жидкости. В рамках настоящего описания "по существу не имеющий консервантов" или "без консервантов" обозначает, что раствор абсолютно не содержит консервантов или раствор содержит консерванты в концентрации, которая является неопределяемой или не обеспечивает консервирующего эффекта. Краткое описание чертежей На фиг. 1-3 показан эффект полисорбата 80 (Tween 80; TW) на абсорбцию тафлупроста без консервантов к контейнерам из полиэтилена низкой плотности в трех различных концентрациях полисорбата при 5C, 25C и 40C соответственно. На фиг. 4 показана концентрация кислой формы тафлупроста в водянистой жидкости кролика после однократной инстилляции BAK-консервированного 0,0015% тафлупроста в глазном растворе [BAK(+)],глазном растворе 0,0015% тафлупроста без консервантов, содержащем 0,20% Tween 80 [BAK(-) 0,2%Tween 80] или глазном растворе 0,0015% тафлупроста без консервантов, содержащем 0,05% Tween 80[BAK(-) 0,05% Tween 80]. Столбики представляют стандартную ошибку средней концентрации кислой формы талбуфроста в каждый временной период и звездочки представляют собой статистически значимые различия концентрации кислой формы талбуфроста между растворами BAK(-) 0,2% Tween 80 иBAK(-) 0,05% Tween 80 (р 0,05 с N=8). Подробное описание изобретения Неионные поверхностно-активные вещества добавляют к глазному раствору по изобретению для их растворяющего эффекта и для профилактики абсорбции аналогов PGF2 к смолистым стенкам контейнера. Примеры неионных поверхностно-активных веществ представляют собой жирный эфир полиоксиэтилена, такой как полисорбат 80 [моноолеат сорбита и поли(оксиэтилена)], полисорбат 60 [моностеарат сорбита и поли(оксиэтилена)], полисорбат 40 [монопальмитат сорбита и поли(оксиэтилена)], монолаурат сорбита и поли(оксиэтилена), триолеат сорбита и поли(оксиэтилена) и полисорбат 65 [тристеарат сорбита и поли(оксиэтилена)], полиоксиэтиленовое гидрогенизированное касторовое масло, такое как полиоксиэтиленовое гидрогенизированное касторовое масло 10, полиоксиэтиленовое гидрогенизированное касторовое масло 40, полиоксиэтиленовое гидрогенизированное касторовое масло 50, и полиоксиэтиленовое гидрогенизированное касторовое масло 60, гликоли полиоксиэтилена полиоксипропилена, такие как полиоксиэтилен (160) полиоксипропилен (30) гликоль [Pluronic F68], полиоксиэтилен (42) полиоксипропилен (67) гликоль [Pluronic Р 123], полиоксиэтилен(54)полиоксипропилен(39)гликоль [Pluronic Р 85], полиоксиэтилен (196) полиоксипропилен (67) гликоль [Pluronic F127] и полиоксиэтилен (20) полиоксипропилен (20) гликоль [Pluronic L-44], полиоксил 40 стеарат и жирные эфиры сахарозы. Неионные поверхностно-активные вещества могут быть использованы отдельно или в комбинации. Предпочтительным примером неионных поверхностно-активных веществ является полисорбат 80 [моноолеат сорбита и поли(оксиэтилена)]. Другими предпочтительными неионными поверхностно-активными веществами являются полиоксиэтиленовое гидрогенизированное касторовое масло 60 и полиоксил 40 стеарат. Количество неионного поверхностно-активного веществ(а) в глазном растворе в соответствии с изобретением может быть выбрано в зависимости от количества и типа аналога простагландина и специфического поверхностно-активного веществ(а) и находится в рамках знаний специалиста в области техники. Для полисорбата 80 концентрация составляет, например, в диапазоне от 0,05 до 0,5% (мас./об.),еще более предпочтительно от 0,05 до 0,1% и наиболее предпочтительно около 0,075%. Также авторами настоящего изобретения было обнаружено, что слишком высокая концентрация неионного поверхностно-активного вещества обладает раздражающим эффектом на слой эпителия роговицы и нежелательным эффектом на биодоступность простагландина из глазного раствора. Например, в случае тафлупроста возможна верхняя граница 0,5% неионного поверхностно-активного вещества полисорбата 80. Глазной раствор по изобретению также содержит стабилизаторы для ингибирования разложения аналогов PGF2 в глазном растворе. Предпочтительными примерами стабилизаторов являются этилендиаминтетрауксусная кислота и ее соли, такие как эдетат динатрия и дибутилгидрокситолуол. Также могут быть использованы другие стабилизаторы, такие как нитрит натрия, аскорбиновая кислота, стеарат Lаскорбиновой кислоты, гидросульфит натрия, альфатиоглицерин, эриторбовая кислота, гидрохлорид цистеина, лимонная кислота, ацетат токоферола, дихлоризоцианурат калия, 2,6-ди-т-бутил-4-метилфенол,лецитин соевых бобов, тиогликоллат натрия, тиомалат натрия, натуральный витамин E, токоферол, аскорбилпастиминат, пиросульфит натрия, бутилгидроксианизол, 1,3-бутиленгликоль, пентаэритрилтетракис [3-(3,5-ди-т-бутил-4-гидроксифенил)]пропионат, пропилгаллат, 2-меркаптобензимидазол и сульфат оксихинолина. Количество стабилизирующих средств в глазном растворе по изобретению может быть выбрано в зависимости от специфического стабилизатора и находится в рамках умений специалиста в области техники. Например, когда стабилизатором является эдетат динатрия, концентрация обычно составляет от 0,005 до 0,2% (мас./об.), предпочтительно от 0,01 до 0,1%, еще более предпочтительно около 0,05%. Предпочтительным аналогом PGF2 для применения в глазном водном растворе в соответствии с изобретением является тафлупрост. Однако также могут быть использованы все известные аналогиPGF2, особенно другие аналоги PGF2 с омега-цепью, замещенной на фенильном цикле, такие как латанопрост, травопрост и биматопрост или смесь двух или более простагландинов. Альтернативные лекарственные средства для применения в глазном водном растворе в соответствии с изобретением представляют собой другие простагландины и их производные, такие как простагландин Е и его аналоги (см.US 6344477 и его ссылки). Также возможными являются комбинации простагландинов или аналогов и других глазных лекарственных средств, например, -блокаторов, таких как тимолол. Количество аналогов PGF2 в глазном растворе в соответствии с изобретением может быть выбрано в зависимости от специфического рассматриваемого простагландина, от заболеваний, подвергаемых лечению, и их симптомов. Для тафлуфроста количество, например 0,0001 до 0,01%, предпочтительно от около 0,0005 до 0,0025, еще более предпочтительно от 0,0010 до 0,0025% (мас./об.), расценивается как достаточное. Предпочтительные концентрации других аналогов PGF2 для лечения глаукомы составляют от 0,001 до 0,004% для травопроста, приблизительно 0,005% для латанопроста, около 0,03% для биматопроста и около 0,15% для унопростона. Глазной раствор по изобретению также может включать обычные вспомогательные вещества, используемые в глазных композициях, такие как буферы, растворители, регуляторы pH, средства, регулирующие тонус, и подобные. Примеры подходящих буферов включают, но не ограничиваются, дигидрат дигидрофосфата натрия, борную кислоту, боракс, лимонную кислоту или -аминокапроновую кислоту. Специфические примеры средств, регулирующих тонус, включают, но не ограничиваются, глицерин,сорбит, маннит и другие сахарные спирты, пропиленгликоль, хлорид натрия, хлорид калия и хлорид кальция.pH глазного водного раствора по изобретению предпочтительно составляет от 4 до 8, более предпочтительно от 5 до 7. В качестве регуляторов pH могут быть использованы обычные средства, регулирующие pH, такие как гидроксид натрия и/или соляная кислота. Материал смолистого контейнера состоит преимущественно из полиэтилена. Материал контейнера может содержать минимальные количества материалов, иных, чем полиэтилен, например полипропилен,полиэтилен терфталат, поливинилхлорид, акриловые смолы, полистирол, полиметилметакрилат и нейлон 6. Количество указанных материалов составляет предпочтительно не более чем от около 5 до 10% всего материала контейнера. Полиэтилен классифицируют на несколько типов по его плотности, а именно полиэтилен низкой плотности (LDPE), полиэтилен средней плотности (MDPE), полиэтилен высокой плотности (HDPE) и др., и такие полиэтилены включают в настоящее описание. Предпочтительным полиэтиленом являетсяLDPE. Контейнеры для упаковки и хранения водного глазного раствора в соответствии с изобретением включают все формы контейнеров, подходящие для благоприятного для потребителя местного глазного введения. Следовательно, контейнеры могут быть выбраны, например, из группы, состоящей из бутылей,пробирок, ампул, пипеток и устройств для распыления жидкости, в стандартной лекарственной форме,содержащей разовую дозу, или в форме нескольких доз. В соответствии с предпочтительным вариантом осуществления изобретения водный глазной раствор представляет собой форму, содержащую разовую дозу или стандартную лекарственную форму. Контейнеры для глазного раствора по изобретению являются предпочтительно произведенными путем метода пневмоформования с экструзией. Пневмоформование с экструзией дает более гладкую внутреннюю поверхность контейнера по сравнению с литьем под давлением с раздувкой, которое обычно используют для получения например многодозовых полиэтиленовых бутылей. Более гладкая внутренняя поверхность дает лучшую химическую стабильность простагландинов в полиэтиленовом контейнере по сравнению с полиэтиленовым контейнером, производимым литьем под давлением с раздувкой. Более того, когда используют контейнеры, содержащие разовые дозы, их стерилизуют во время процесса литья путем нагревания и не требуется дополнительная стерилизация контейнеров, что также улучшает стабильность простагландинов в контейнере, содержащем разовую дозу (см. EP 1825855 и EP 1349580). В общем, офтальмологический контейнер, содержащий разовую дозу, производимый методом пневмоформования, имеет объем около 1 мл и заполнен от около 0,2 до 0,5 мл раствора. Для таких контейнеров известно большое множество форм. Типичные примеры показаны US 5409125 и US 6241124. Хотя контейнеры, содержащие разовую дозу, являются предпочтительными для целей изобретения,водный глазной раствор по изобретению остается растворимым, стабильным и биодоступным также в устройстве для распыления жидкости для подачи минимальных количеств стерильной жидкости или в любом другом типе контейнера, где водный глазной раствор находится в контакте с материалом, состоящим преимущественно из полиэтилена. Такие устройства для распыления жидкости описаны, например, в US 5614172. Водный офтальмологический раствор без консервантов по изобретению может храниться при комнатной температуре в вышеуказанных подходящих контейнерах, включая пипетки со стандартной дозой и диспенсеры. Исследования стабильности показали, что водный глазной раствор талбуфроста без консервантов по изобретению является стабильным в полиэтиленовом контейнере в течение длительного времени, по меньшей мере в течение 12 месяцев при 25C и по меньшей мере в течение 30 месяцев при 5C. Предпочтительный вариант осуществления по изобретению представляет собой водный глазной раствор для лечения повышения внутриглазного давления и глаукомы, который включает 0,0001-0,01% мас./об. аналогов PGF2; 0,05-0,5% мас./об. неионного поверхностно-активного вещества,0,005-0,2% мас./об. стабилизатора,по существу, не содержит консервантов, и, необязательно, буферы, регуляторы pH и средства, регулирующие тонус, обычно используемые в глазных растворах,в контейнере, состоящем преимущественно из полиэтилена. Следующие примеры иллюстрируют изобретение без его ограничения каким-либо образом. Пример 1. Эффект неионного поверхностно-активного вещества на абсорбцию талбуфроста без консервантов в контейнерах из полиэтилена низкой плотности исследовали в течение 20 недель при 5, 25 и 40C. Использовали три различных концентрации полисорбата 80 (Tween 80), а именно 0,05, 0,075 и 0,1%. Состав водной композиции талбуфроста без консервантов за исключением полисорбата 80 был 0,0015% талбуфроста, 2,25% глицерина, 0,2% дигидрата дигидрофосфата натрия, 0,05% эдетата динатрия и гидроксид натрия и/или соляная кислота для регулирования pH 5,0-6,7. 0,3 мл композиции, полученной выше, заполняли в основную часть контейнера, содержащего стандартную дозу (LDPE), и герметизировали путем нагревания с верхней частью контейнера (LDPE). Внутренний объем контейнера, содержащего стандартную дозу, составил около 1 мл. Контейнер упаковывали в покрытую бумагой алюминиево-полиэтиленовую фольгу и хранили в холодильнике или инкубаторе. Оставшуюся концентрацию талбуфроста измеряли посредством ВЭЖХ. Результаты показаны на фиг. 1-3. Результаты показывают, что концентрация полисорбата оказывает влияние на абсорбцию талбуфроста к полиэтилену. Полисорбат (0,05-0,1%) ингибирует абсорбцию талбуфроста, в особенности при повышенной температуре (40C). Количество 0,075-0,1% полисорбата показывает хороший ингибирующий эффект на абсорбцию талбуфроста. Пример 2. Исследовали концентрацию свободной кислоты тафлуфроста в водянистой жидкости кроликов после однократной инстилляции 1) консервированного глазного 0,0015% раствора тафлуфроста, содержащего 0,01% BAK и 0,05% полисорбата 80, или 2) неконсервированного глазного 0,0015% раствора тафлуфроста, содержащего 0,20% полисорбата 80, или 3) неконсервированного глазного 0,0015% раствора тафлуфроста, содержащего 0,05% полисорбата 80. Концентрации ингредиентов за исключением полисорбата 80 в неконсервированных растворах были следующие: 2,25% глицерина, 0,2% дигидрата дигидрофосфата натрия, 0,05% эдетата динатрия и гидроксид натрия и/или соляная кислота для регуляции pH 5,0-6,7. Кролики получали глазные растворы, описанные выше. Кроликов умерщвляли в каждую временную точку (4 животных на лечение в момент времени) и получали образец водянистой жидкости. Концентрацию кислой формы тафлупроста измеряли с использованием утвержденного метода ЖХ-МС/МС. Результаты (N=8 для каждого исследуемого раствора в момент времени) показаны на фиг. 4. Из результатов может быть отмечено, что количество неионного поверхностно-активного вещества оказывает эффект на глазную биодоступность. Когда количество неионного поверхностно-активного вещества превосходит определенный предел, проникновение активного средства в водянистую жидкость начинает снижаться. Следовательно, количество неионного поверхностно-активного вещества должно быть сбалансировано, с одной стороны, для минимизации абсорбции аналогов PGF2 к стенкам контейнера и, с другой стороны, для максимизации глазной биодоступности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий аналогPGF2 в качестве активного ингредиента, где указанный раствор содержит от 0,05 до 0,5% (мас./об.) неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилена)сорбитана моноолеат],полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена)сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат], и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60, от 0,005 до 0,2% стабилизатора, и,по существу, не содержит консервантов, где раствор упакован в контейнер, выполненный из материала,содержащего не более 10% другого материала, отличного от полиэтилена. 2. Упакованный водный раствор по п.1, где аналог PGF2 выбран из группы, состоящей из латанопроста, изопропил унопростона, травопроста, биматопроста и тафлупроста или смеси двух или более из указанных веществ. 3. Упакованный водный раствор по п.1, где аналог PGF2 представляет собой тафлупрост. 4. Упакованный водный раствор по п.3, где неионным поверхностно-активным веществом является полисорбат 80 или полиоксиэтиленовое гидрогенированное касторовое масло 40. 5. Упакованный водный раствор по любому из пп.1-4, в котором количество неионного поверхностно-активного вещества составляет 0,05-0,1% (мас./об.). 6. Упакованный водный раствор по любому из пп.1-5, в котором стабилизатор выбран из группы,состоящей из этилендиаминтетрауксусной кислоты и ее солей, нитрита натрия, аскорбиновой кислоты,стеарата L-аскорбиновой кислоты, гидросульфита натрия, альфатиоглицерина, эриторбовой кислоты,гидрохлорида цистеина, лимонной кислоты, токоферолацетата, дихлоризоцианурата калия, 2,6-ди-тбутил-4-метилфенола, соевого лецитина, тиогликоллата натрия, тиомалата натрия, натурального витамина Е, токоферола, аскорбилпальмитата, пиросульфита натрия, бутилгидроксианизола, 1,3 бутиленгликоля, пентаэритрил тетракис[3-(3,5-ди-т-бутил-4-гидроксифенил)]пропионата, пропилгаллата,2-меркаптобензимидазола и сульфата оксихинолина. 7. Упакованный водный раствор по п.6, в котором стабилизатором является эдетат динатрия. 8. Упакованный водный раствор по любому из пп.1-7, в котором количество стабилизатора составляет 0,01-0,1%. 9. Упакованный водный раствор по п.1 в лекарственной форме, содержащей разовую дозу. 10. Упакованный водный раствор по п.1, где полиэтиленовый контейнер изготовлен экструзией раздувным формованием. 11. Упакованный водный раствор по п.1, где полиэтилен представляет собой полиэтилен низкой плотности (LDPE). 12. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий 0,0001-0,01% мас./об. аналога PGF2; 0,05-0,5% мас./об. неионного поверхностно-активного вещества, которое выбрано из группы, состоящей из сложных эфиров полиоксиэтилена и жирных кислот, таких как полисорбат 80 [поли(оксиэтилена)сорбитана моноолеат], полисорбат 60 [поли(оксиэтилена)сорбитана моностеарат], полисорбат 40 [поли(оксиэтилена)сорбитана монопальмитат], поли(оксиэтилена)сорбитана монолаурат, поли(оксиэтилена)сорбитана триолетат и полисорбат 65 [поли(оксиэтилена)сорбитана тристеарат] и полиоксиэтиленовые гидрогенизированные касторовые масла, такие как полиоксиэтиленовое гидрогенированное касторовое масло 10, полиоксиэтиленовое гидрогенированное касторовое масло 40, полиоксиэтиленовое гидрогенированное касторовое масло 50 и полиоксиэтиленовое гидрогенированное касторовое масло 60; 0,005-0,2% мас./об. стабилизатора и регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах,и, по существу, не содержащий консервантов,где раствор упакован в контейнер, который может содержать не более 10% другого материала, отличного от полиэтилена. 13. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий 0,0010-0,0015% мас./об. тафлупроста; 0,05-0,1% мас./об. полисорбата 80; 0,01-0,1% мас./об. динатрий эдетата и буферы, регуляторы pH и средства, регулирующие тоничность, обычно используемые в глазных растворах,и, по существу, не содержащий консервантов,где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена. 14. Упакованный водный раствор для лечения глазной гипертензии и глаукомы, включающий 0,0015% мас./об. тафлупроста; 0,075% мас./об. полисорбата 80; 0,05% мас./об. эдетата динатрия; 2,25% мас./об. глицерина; 0,2% мас./об. дигидрата дигидрофосфата натрия; регуляторы pH и, по существу, не содержащий консервантов, где раствор упакован в контейнер, выполненный из материала, содержащего не более 10% другого материала, отличного от полиэтилена. 15. Упакованный глазной водный раствор по любому из пп.12-14 в разовой дозе или в стандартной лекарственной форме. 16. Упакованный глазной водный раствор по любому из пп.12-14 в форме устройства для распыления жидкости.
МПК / Метки
МПК: A61K 47/18, A61K 9/08, A61K 31/5575, A61K 47/26, A61K 47/10
Метки: повышения, лечения, давления, раствор, pgf2&alpha, аналог, глаукомы, внутриглазного, включающий, упакованный
Код ссылки
<a href="https://eas.patents.su/9-23661-upakovannyjj-rastvor-dlya-lecheniya-povysheniya-vnutriglaznogo-davleniya-i-glaukomy-vklyuchayushhijj-analog-pgf2alpha.html" rel="bookmark" title="База патентов Евразийского Союза">Упакованный раствор для лечения повышения внутриглазного давления и глаукомы, включающий аналог pgf2α</a>