Способ получения замещенных бифенилов
Номер патента: 23304
Опубликовано: 31.05.2016
Авторы: Майвальд Фолькер, Шмидт-Лайтхофф Йоахим, Альтенхофф Ансгар Гереон, Смидт Зебастиан Пер, Виссель-Штолль Катрин, Кайл Михаэль
Формула / Реферат
1. Способ получения замещенных бифенилов формулы I
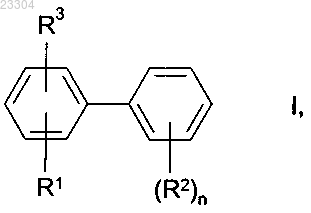
в которой заместители имеют следующие значения:
R1 означает нитро;
R2 означает циано, галоген, C1-C4-галогеналкил, C1-C4-галогеналкокси или C1-C4-галогеналкилтио;
n означает 0, 1, 2 или 3, причем в случае n = 2 или 3 остатки R2 могут иметь одинаковые или различные значения;
R3 означает водород, циано или галоген,
отличающийся тем, что галогенбензол формулы II
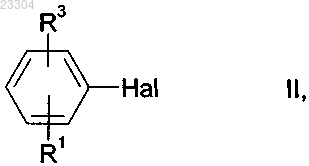
в которой HaI означает хлор или бром и R1 и R3 имеют указанные выше значения,
в присутствии основания и палладиевого катализатора, который состоит из палладия и бидентатного фосфорного лиганда формулы III

причем Ar означает фенил, который может содержать от одного до трех заместителей, выбранных из метила, метокси, фтора и хлора, R4 и R5, каждый независимо, означают C1-С8-алкил или C3-C6-циклоалкил или R4 и R5 вместе образуют 2-7-членный мостик, возможно замещенный одним C1-С6-алкильным заместителем,
в растворителе подвергают взаимодействию с фенилбороновой кислотой IVa
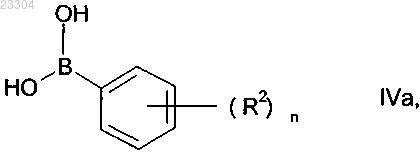
дифенилбориновой кислотой IVb
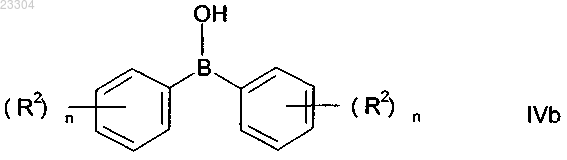
или смесью из IVa и IVb, где R2 и n имеют указанные выше значения.
2. Способ по п.1, отличающийся тем, что R2 означает галоген, n означает 2 или 3 и R3 означает водород или галоген.
3. Способ по п.1, отличающийся тем, что R2 означает фтор или хлор.
4. Способ по п.1, отличающийся тем, что R1 находится в орто-положении к фенильному кольцу, которое замещено R2.
5. Способ по п.1, отличающийся тем, что R1 и R3 находятся в пара-положении друг к другу.
6. Способ по п.1, отличающийся тем, что получают бифенилы формулы I, выбранные из 3,4-дифтор-2'-нитробифенила, 2,4-дихлор-2'-нитробифенила, 3,4-дихлор-2'-нитробифенила и 3,4,5-трифтор-2'-нитробифенила.
7. Способ по п.1, отличающийся тем, что получают 3,4,5-трифтор-2'-нитробифенил.
8. Способ по п.1, отличающийся тем, что Ar означает фенил.
9. Способ по п.1, отличающийся тем, что взаимодействие проводят при температуре от 50 до 140°С.
10. Способ по п.1, отличающийся тем, что взаимодействие проводят в смеси из воды и органического растворителя.
11. Способ по п.10, отличающийся тем, что в качестве органического растворителя применяют простой эфир.
12. Способ по п.1, отличающийся тем, что взаимодействия проводят под давлением от 1 до 6 бар.
13. 3,4,5-Трифтор-2'-нитробифенил.
14. Способ по п.1, отличающийся тем, что полученные замещенные бифенилы формулы I затем переводят с помощью гидрирования в соответственно замещенные аминобифенилы.
15. Способ по п.14, отличающийся тем, что полученные замещенные бифенилы формулы I выбраны из 3,4-дифтор-2'-нитробифенила, 2,4-дихлор-2'-нитробифенила, 3,4-дихлор-2'-нитробифенила и 3,4,5-трифтор-2'-нитробифенила.
16. Способ по п.14 или 15, отличающийся тем, что полученный замещенный бифенил формулы I представляет собой 3,4,5-трифтор-2'-нитробифенил.
Текст
СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ БИФЕНИЛОВ В изобретении заявлен способ получения замещенных бифенилов формулы I в которой заместители имеют следующие значения: R1 означает нитро, R2 означает циано, галоген,C1-C4-галогеналкил, C1-C4-галогеналкокси или C1-C4-галогеналкилтио, n означает 0, 1, 2 или 3,причем в случае n = 2 или 3 остатки R2 могут иметь одинаковые или различные значения, R3 означает водород, циано или галоген, заключающийся в том, что галогенбензол формулы II в которой Hal означает хлор или бром и R1 и R3 имеют указанные выше значения, в присутствии основания и палладиевого катализатора, который состоит из палладия и бидентатного фосфорного лиганда формулы III причем Ar означает фенил, который может содержать от одного до трех заместителей, выбранных из метила, метокси, фтора и хлора, и R4 и R5, каждый независимо, означают C1-C8-алкил или С 3-C6 циклоалкил или R4 и R5 вместе образуют 2-7-членный мостик, возможно замещенный одним C1-C6 алкильным заместителем, в растворителе подвергают взаимодействию с фенилбороновой кислотой или смесью из IVa и IVb, где R2 и n имеют указанные выше значения. Настоящее изобретение относится к способу получения замещенных бифенилов формулы I в которой заместители имеют следующие значения:n означает 0, 1, 2 или 3, причем в случае n = 2 или 3 остатки R2 могут иметь одинаковые или различные значения;R3 означает водород, циано или галоген,отличающемуся тем, что галогенбензол формулы II в которой HaI означает хлор или бром и R1 и R3 имеют указанные выше значения,в присутствии основания и палладиевого катализатора, который состоит из палладия и бидентатного фосфорного лиганда формулы III причем Ar означает фенил, который может содержать от одного до трех заместителей, выбранных из метила, метокси, фтора и хлора, и R4 и R5, каждый независимо, означают C1-C8-алкил или C3-C6 циклоалкил или R4 и R5 вместе образуют 2-7-членный мостик, возможно замещенный одним C1-С 6 алкильным заместителем,в растворителе подвергают взаимодействию с фенилбороновой кислотой IVa или смесью из IVa и IVb, где R2 и n имеют указанные выше значения. Катализированные палладием сочетания ароматических соединений хлора с ароматическими бороновыми кислотами и бориновыми кислотами сами по себе являются известными. Так в WO 97/33846 описывается, например, сочетание 2-нитрохлорбензола с галогензамещенными ароматическими бороновыми кислотами до получения соответствующим образом замещенных нитробифенилов. Трифенилфосфин при подобных реакциях сочетания представляет собой наиболее часто применяемый лиганд для палладия. Но применение трифенилфосфина в качестве лиганда таит в себе опасность, что применяемые в качестве реагентов сочетания ароматические бороновые и бориновые кислоты в большом количестве подвергаются протодеборонизации и в этом положении незамещенные ароматические соединения образуются в виде нежелательных побочных продуктов. Это имеет силу также в том случае, когда для улучшения избирательности и выхода используют трифенилфосфин в явном молярном избытке, в пересчете на палладиевый источник. Сейчас было обнаружено, что катализированная палладием реакция ароматических соединений хлора с галогензамещенными ароматическими бороновыми и бориновыми кислотами при применении бидентатных лигандов 1,3-бис-дифенилфосфанил-пропан (dppp) протекает с очень плохим выходом, чем с трифенилфосфином (см. пример 2b по сравнению с 2 а). Однако если применяют бидентатный лиганд,который слегка модифицирован посредством других заместителей в алкильной цепи, например, 1,3-бисдифенилфосфанил-2,2-диметилпропан или 1,3-бис-дифенилфосфанил-2-этил-2-бутил-пропан, то неожиданно получают желаемые продукты сочетания с очень хорошими выходами и в то же время только очень незначительно протодеборонизированные побочные продукты Другое преимущество при использовании этого указанного последним лиганда состоит в том, что как необходимое количество палладиевого источника, так и количество лиганда по сравнению с процессом с трифенилфосфином может быть явно снижено. Так как используемые соединения палладия, в общем, являются очень дорогими, то существует такая возможность уменьшения использования палладия высокой экономической стоимости. До сих пор в литературных источниках очень редко сообщалось о применении бидентатных бисфосфиновых лигандов в реакциях сочетания. В WO 98/16486 сообщается о применении липофильных алифатических бисфосфинов в реакциях обычных ароматических соединений хлора, однако, без подтверждения примерами.DE-A 4340490 описывает применение 1,2-бис-(дициклогексилфосфанил)этана и 1,2-бис(диэтилфосфанил)этана в реакциях сочетания. В данном случае с помощью богатых электронами ароматических соединений хлора достигали хороших результатов, однако не с ароматическими соединениями,которые имеют заместители, отнимающие электроны, такие как фтор или трифторметил. Разумеется, применение полностью алифатически замещенных фосфанов, в общем, является очень ограниченным, так как эти фосфаны являются очень чувствительными к воздействию воздуха и частично пирофорными. Поэтому в основе настоящего изобретения лежала задача, предоставить рентабельный и технически осуществимый в промышленном масштабе способ региоселективного получения замещенных бифенилов, который действует с уменьшенной концентрацией палладиевого катализатора. Определенный в начале способ преодолевает представленные недостатки уровня техники. Полученные в соответствии с данным способом замещенные бифенилы формулы I имеют следующие предпочтительные заместители:R2 означает циано, фтор, хлор, бром, трифторметил, трифторметокси или трифторметилтио, особенно предпочтительно фтор, хлор или трифторметилтио, в высшей степени предпочтительно фтор или хлор;R3 означает водород или или фтор. В высшей степени предпочтительно получение 3,4,5-трифтор-2'-нитробифенила. Проведение примыкающего гомогенно катализированного биарильного перекрестного сочетания Сузуки (Suzuki) предпочтительно происходит согласно следующей схеме: При этом предпочтительно исходят из фенилбороновых кислот формулы IVa или дифенилбориновых кислот формулы IVb или смесей из них, в которых R2 и n имеют указанные выше значения. В высшей степени предпочтительны 3,4,5-трифторфенилбороновая кислота и ди(3,4,5 трифторфенил)бориновая кислота в качестве исходных соединений формул (IVa, соответственно IVb). Преимущественно исходят из соединений формулы (II), которые содержат единственную нитроили аминогруппу, в особенности 2-нитрохлорбензол или 2-аминохлорбензол или 2-аминобромбензол. Соединение формулы II используется, в пересчете на фенилбороновую кислоту формулы IVa или дифенилбориновую кислоту формулы IVb, обычно примерно эквимолярно, предпочтительно с избытком,до приблизительно 30 мол.%. При этом при расчете молярных соотношений и избытков следует принимать во внимание, что дифенилбориновая кислота формулы IVb, используемая в чистом виде или как смесь с кислотой формулы IVa, может иметь два фенильных остатка. В качестве основания преимущественно применяют гидроксиды щелочных металлов, гидроксиды щелочно-земельных металлов, карбаматы щелочных металлов, карбаматы щелочно-земельных металлов,гидрокарбаматы щелочных металлов, ацетаты щелочных металлов, ацетаты щелочно-земельных металлов, алкоголяты щелочных металлов и алкоголяты щелочно-земельных металлов, в смеси и в особенности отдельно. В качестве основания особенно предпочтительны гидроксиды щелочных металлов, гидроксиды ще-2 023304 лочно-земельных металлов, карбаматы щелочных металлов, карбаматы щелочно-земельных металлов и гидрокарбаматы щелочных металлов. В качестве основания в особенности предпочтительны гидроксиды щелочных металлов, например,гидроксид натрия, гидроксид калия и гидроксид лития, а также карбаматы щелочных металлов и гидрокарбаматы щелочных металлов, например, карбонат лития, карбонат натрия и карбонат калия. Но также в качестве оснований могут использоваться органические основания, например, третичные амины. Предпочтительно применяют, например, триэтиламин или диметилциклогексиламин. Преимущественно основание используется с долей от 100 до 500 мол.%, особенно предпочтительно от 150 до 400 мол.%, в пересчете на фенилбороновую кислоту формулы IVa или дифенилбориновую кислоту формулы IVb. Пригодными источниками палладия являются, например, соли палладия II, такие как хлорид палладия II или ацетат палладия II соответственно их водные растворы, а также хлорид бисацетонитрилпалладия II или комплексы палладия с Pd в степени окисления 0. Особенно предпочтительно применяют хлорид палладия II. Пригодные в алкильной цепи замещенные, бидентатные фосфорные лиганды, а также их получение известны из более ранней заявки ЕР 08154184.9. При этом предпочтительны 1,3-бис(дифенилфосфанил)пропаны III с незамещенными фенильными кольцами, в особенности те, в которыхR4 означает C1-C6-алкил, такой как метил, этил, 1-метилэтил, n-бутил, 1-метилпропил, 2- метилпропил, nпентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, n-гексил, 1-метилпентил, 2-метилпентил, 3 метилпентил и 4-метилпентил или означает циклопропил и R5 означает C1-C6-алкил, такой как метил,этил, 1-метилэтил, n-бутил, 1-метилпропил, 2-метилпропил, n-пентил, 1-метилбутил, 2-метилбутил, 3 метилбутил, n-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил и 4-метилпентил, или в которыхR4 + R5 совместно означают этан-1,2-диил-, пропан-1,3-диил-, бутан-1,4-диил- или пентан-1,5-диил-цепь. Особенно предпочтительными фосфорными лигандами III являются 1,3-бис-(дифенилфосфанил)-2 метилпропан, 1,3-бис-(дифенилфосфанил)-2,2-диметилпропан, 1,3-бис-(дифенилфосфанил)-2-метил-2 этилпропан,1,3-бис-(дифенилфосфанил)-2,2-диэтилпропан,1,3-бис-(дифенилфосфанил)-2-метил-2 пропилпропан, 1,3-бис-(дифенилфосфанил)-2-этил-2-пропилпропан, 1,3-бис-(дифенилфосфанил)-2,2 дипропилпропан, 1,3-бис-(дифенилфосфанил)-2-метил-2-бутилпропан, 1,3-бис-(дифенилфосфанил)-2 этил-2-бутилпропан, 1,3-бис-(дифенилфосфанил)-2-пропил-2-бутилпропан, 1,3-бис-(дифенилфосфанил)2,2-дибутилпропан,1,3-бис-(дифенилфосфанил)-2-метил-2-циклопропилпропан,1,3-бис-(дифенилфосфанил)-2-метил-2-циклобутилпропан,1,3-бис-(дифенилфосфанил)-2-метил-2-циклопентилпропан,1,3-бис-(дифенилфосфанил)-2-метил-2-циклогексилпропан,1,1-бис-(дифенилфосфанил)циклопропан,1,1-бис-(дифенилфосфанил)циклобутан,1,1-бис-(дифенилфосфанил)циклопентан,1,1-бис(дифенилфосфанил)циклогексан, в особенности 1,3-бис-(дифенилфосфанил)-2,2-диметилпропан и 1,3 бис-(дифенилфосфанил)-2-этил-2-бутилпропан. Реактивность комплексных лигандов может быть повышена путем добавления четвертичной аммониевой соли, такой как бромид тетра-n-бутиламмония (ТВАВ) (см., например, D. Zim et al., TetrahedronLett. 2000, 41, 8199). Как правило, комбинируют от 0,5 до 5 молярных эквивалентов (мол.экв.) указанных выше комплексных лигандов, в особенности 1,3-бис-дифенилфосфанил-2,2-диметилпропан и 1,3-бисдифенилфосфанил-2-этил-2-бутилпропан с 1 экв. соли палладия II. Особенно предпочтительно использование 1 мол.экв. комплексного лиганда, в пересчете на соль палладия II. Палладиевый источник в способе согласно изобретению используется с низкой долей содержания от 0,001 до 5,0 мол.%, преимущественно от 0,1 до 1,0 мол.%, в особенности от 0,1 до 0,5 мол.%, в пересчете на соединение формулы IVa или формулы IVb. Для способа согласно изобретению пригодными органическими растворителями являются простые эфиры, такие как диметоксиэтан, диметиловый эфир диэтиленгликоля, тетрагидрофуран, 2 метилтетрагидрофуран, 3-метилтетрагидрофуран, диоксан, трет-бутилметиловый эфир и трет-бутилэтиловый эфир, углеводороды, такие как п-гексан, n-гептан, гептановые смеси изомеров, циклогексан,петролейный эфир, бензол, толуол и ксилол, спирты, такие как метанол, этанол, 1-пропанол, 2-пропанол,этиленгликоль, 1-бутанол, 2-бутанол и трет-бутанол, кетоны, такие как ацетон, этилметилкетон и изобутилметилкетон, амиды, такие как диметилформамид, диметилацетамид и N-метилпирролидон, а также диметилсульфоксид, каждый раз отдельно или в смеси. Предпочтительными растворителями являются простые эфиры, такие как диметоксиэтан, тетрагидрофуран, 2-метил-тетрагидрофуран, 3-метилтетрагидрофуран и диоксан, углеводороды, такие как циклогексан, толуол и ксилол, спирты, такие как этанол, 1-пропанол, 2-пропанол, 1-бутанол и трет-бутанол,каждый раз отдельно или в смеси. В одном особенно предпочтительном варианте в способе согласно изобретению используют воду,один или несколько нерастворимых в воде и один или несколько растворимых в воде растворителей, например смеси из воды и диоксана, или воды и тетрагидрофурана, или воды, диоксана и этанола, или воды, тетрагидрофурана и метанола, или воды, толуола и тетрагидрофурана, преимущественно воды и тетрагидрофурана или воды, тетрагидрофурана и метанола. Предпочтительно реакцию проводят в воде и тетрагидрофуране. Общее количество растворителя обычно составляет от 3000 до 100 и преимущественно от 2000 до 150 г на 1 моль соединения формулы II. Целесообразно для осуществления способа соединение формулы II фенилбороновую кислоту формулы IVa, соответственно дифенилбориновую кислоту формулы IVb, или смесь из обеих, основание, а также каталитическое количество палладиевого источника добавляют в смесь из воды и одного или нескольких инертных органических растворителей и перемешивают при температуре от 50 до 140 С, преимущественно от 70 до 110 С, особенно предпочтительно от 90 до 110 С, в течение промежутка времени от 1 до 50, преимущественно от 2 до 24 ч. В зависимости от применяемого растворителя и температуры устанавливается давление от 1 до 6 бар, предпочтительно от 1 до 4 бар. Проведение может осуществляться в обычных пригодных для подобных способов аппаратах. После окончательного взаимодействия получающийся в качестве твердого вещества палладиевый катализатор может быть отделен, например, путем фильтрации и сырой продукт освобождают от растворителя соответственно растворителей. Затем может подвергаться дальнейшей очистке методами, известными специалисту в данной области техники и соответствующими каждому продукту, например, путем перекристаллизации, дистилляции,сублимации, зонной плавки, кристаллизации расплава или хроматографии. Способ согласно изобретению обеспечивает соединения формулы I с очень высокими количественными выходами при очень хорошей чистоте. Галогенбензолы формулы II являются известными или могут быть получены согласно известным способам. Фенилбороновые кислоты формулы IVa и дифенилбориновые кислоты формулы IVb равным образом являются известными или могут быть получены известным образом (см., например, заявку WO 2006/092429). Полученные способом согласно изобретению замещенные бифенилы формулы I с R1 = нитро, например 3,4-дифтор-2'-нитробифенил, 2,4-дихлор-2'-нитробифенил, 3,4-дихлор-2'-нитробифенил и 3,4,5 трифтор-2'-нитробифенил, могут быть переведены известным образом с помощью гидрирования в соответственно замещенные бифенилы формулы I с R1 = амино. Данные бифенилы, в свою очередь, представляют собой важные промежуточные продукты для действующих веществ для защиты растений, например, фунгицидно активные пиразолкарбоксамиды формулы V (см., например, ЕР-А 589301 или WO 2006087343) причем R6 означает метил или галогенметил, такой как дифторметил или трифторметил. Пример получения: синтез 3,4,5-трифтор-2'-нитробифенила. а) Получение 3,4,5-трифторфенилбороновой кислоты. В реактор, инертизированный азотом или аргоном, сначала помещали 83,2 г (3,42 моль) магниевой стружки и затем добавляли 1646,2 г сухого, нестабилизированного тетрагидрофурана. 30 г (0,14 моль) 3,4,5-трифторбромбензола добавляли по каплям при 25 С при помешивании и выжидали ускорение реакции Гриньяра. Ускорение реакции Гриньяра дало о себе знать благодаря спонтанному повышению температуры до приблизительно 32 С. Затем добавляли 571,9 г (2,71 моль) дополнительного 3,4,5 трифторбромбензола в течение 5 ч при 25-35 С. Для дополнения реакции перемешивали еще 2 ч при 2530 С. Во втором реакторе помещали раствор из 328,0 г (3,16 моль) триметилбората и 452 г сухого, нестабилизированного тетрагидрофурана и предварительно охлаждали до -5 С. После этого добавляли раствор Гриньяра из первого реактора в течение 2,5 ч. Избыточный магний при этом оставался в первом реакторе. После окончательного добавления перемешивали еще в течение 2 ч при 20-25 С. Для гидролиза затем добавляли 1326,1 г (2,76 моль) 7,6%-ной хлористо-водородной кислоты при 25 С, после чего перемешивали 1 ч при 25 С. Смесь нагревали до 50 С и фазы разделяли. После этого органическую фазу экстрагировали с помощью 603,9 г воды при 50 С и фазу промывочной воды снова отделяли. Затем путем отгонки смеси тетрагидрофуран/вода органическую фазу концентрировали. Получали 1032,6 (82%) 40%-ного раствора 3,4,5-трифторфенилбороновой кислоты в тетрагидрофуране, который непосредственно использовали для последующих взаимодействий.b) Получение 3,4,5-трифтор-2'-нитробифенила путем сочетания Сузуки 3,4,5 трифторфенилбороновой кислоты с 2-нитро-хлорбензолом. В хорошо инертизированный сосуд под давлением помещали смесь из 49,6 г (0,113 моль) 40%-ного раствора из 3,4,5-трифторфенилбороновой кислоты в тетрагидрофуране из предварительной стадии а) с 121,6 г (0,304 моль) 10%-ного раствора едкого натра и 19,7 г (0,124 моль) 2-нитрохлорбензола. Затем добавляли соответствующий лиганд при комнатной температуре, перемешивали и в заключение хлорид палладия II. Затем реакционную смесь нагревали до 105 С. При этом устанавливалось давление приблизительно в 3-4 бар. Примерно через 12 ч реакционного времени давление в сосуде снижали до нормального давления, охлаждали до 30 С и реакционную смесь сливали. Для переработки реакционную смесь ресуспендировали в простом трет-бутилметиловом эфире, фазы разделяли и водную фазу дважды экстрагировали простым трет-бутилметиловым эфиром. Растворители полностью отгоняли при сниженном давлении, определяли навеску и содержание сырого 3,4,5-трифтор-2'-нитробифенила анализировали с помощью количественной ВЭЖХ. По желанию сырой 3,4,5-трифтор-2'-нитробифенил можно подвергать дополнительной очистке, например, путем кристаллизации из изобутанола. После кристаллизации из изобутанола получают чистый 3,4,5-трифтор-2'-нитробифенил с точкой плавления 79 С. 3,4,5 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения замещенных бифенилов формулы I в которой заместители имеют следующие значения:n означает 0, 1, 2 или 3, причем в случае n = 2 или 3 остатки R2 могут иметь одинаковые или различные значения;R3 означает водород, циано или галоген,отличающийся тем, что галогенбензол формулы II в которой HaI означает хлор или бром и R1 и R3 имеют указанные выше значения,в присутствии основания и палладиевого катализатора, который состоит из палладия и бидентатного фосфорного лиганда формулы III причем Ar означает фенил, который может содержать от одного до трех заместителей, выбранных из метила, метокси, фтора и хлора, R4 и R5, каждый независимо, означают C1-С 8-алкил или C3-C6 циклоалкил или R4 и R5 вместе образуют 2-7-членный мостик, возможно замещенный одним C1-С 6 алкильным заместителем,в растворителе подвергают взаимодействию с фенилбороновой кислотой IVa или смесью из IVa и IVb, где R2 и n имеют указанные выше значения. 2. Способ по п.1, отличающийся тем, что R2 означает галоген, n означает 2 или 3 и R3 означает водород или галоген. 3. Способ по п.1, отличающийся тем, что R2 означает фтор или хлор. 4. Способ по п.1, отличающийся тем, что R1 находится в орто-положении к фенильному кольцу, которое замещено R2. 5. Способ по п.1, отличающийся тем, что R1 и R3 находятся в пара-положении друг к другу. 6. Способ по п.1, отличающийся тем, что получают бифенилы формулы I, выбранные из 3,4 дифтор-2'-нитробифенила, 2,4-дихлор-2'-нитробифенила, 3,4-дихлор-2'-нитробифенила и 3,4,5-трифтор 2'-нитробифенила. 7. Способ по п.1, отличающийся тем, что получают 3,4,5-трифтор-2'-нитробифенил. 8. Способ по п.1, отличающийся тем, что Ar означает фенил. 9. Способ по п.1, отличающийся тем, что взаимодействие проводят при температуре от 50 до 140 С. 10. Способ по п.1, отличающийся тем, что взаимодействие проводят в смеси из воды и органического растворителя. 11. Способ по п.10, отличающийся тем, что в качестве органического растворителя применяют простой эфир. 12. Способ по п.1, отличающийся тем, что взаимодействия проводят под давлением от 1 до 6 бар. 13. 3,4,5-Трифтор-2'-нитробифенил. 14. Способ по п.1, отличающийся тем, что полученные замещенные бифенилы формулы I затем переводят с помощью гидрирования в соответственно замещенные аминобифенилы. 15. Способ по п.14, отличающийся тем, что полученные замещенные бифенилы формулы I выбраны из 3,4-дифтор-2'-нитробифенила, 2,4-дихлор-2'-нитробифенила, 3,4-дихлор-2'-нитробифенила и 3,4,5 трифтор-2'-нитробифенила. 16. Способ по п.14 или 15, отличающийся тем, что полученный замещенный бифенил формулы I представляет собой 3,4,5-трифтор-2'-нитробифенил.
МПК / Метки
МПК: C07C 205/12, C07C 205/11
Метки: получения, способ, замещенных, бифенилов
Код ссылки
<a href="https://eas.patents.su/8-23304-sposob-polucheniya-zameshhennyh-bifenilov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения замещенных бифенилов</a>
Предыдущий патент: Пептидная композиция для формирования толерантности к клещам домашней пыли и ее применение
Следующий патент: Гранулят гамма-гидроксимасляной кислоты
Случайный патент: Способ обработки подземной формации












