Способ получения 1,4,7,10-тетраазациклододекана
Номер патента: 3706
Опубликовано: 28.08.2003
Авторы: Рипа Джорджо, Манфреди Джузеппе, Аргезе Мария, Ребасти Фабрицио
Формула / Реферат
1. Способ получения соединения формулы (I), 1,4,7,10-тетраазациклододекана, по следующей схеме 1:
Схема 1
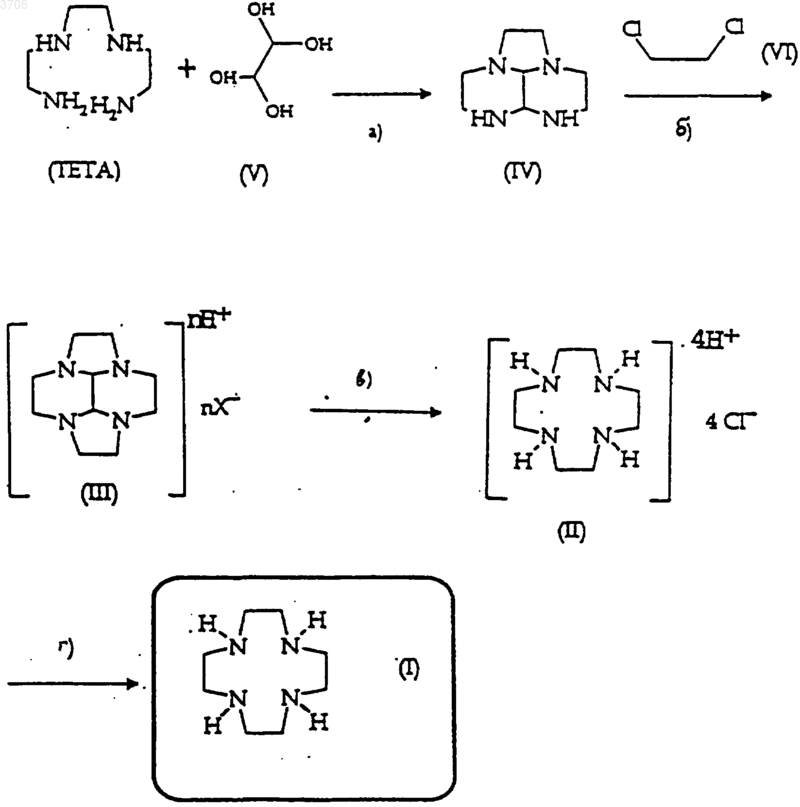
а) конденсация триэтилентетрамина (ТЭТА) с глиоксальгидратом в воде или водорастворимых растворителях или их смесях, при температуре в интервале от 0 до 5шC, в присутствии стехиометрических количеств или при незначительном избытке гидроксида кальция, с образованием соединения формулы (IV);
б) реакция соединения формулы (IV) с 1,2-дихлорэтаном в количествах от 1 до 5 молей на моль соединения (IV) в диметилацетамиде (ДМАА) и в присутствии Na2CO3 в количестве от 5 до 10 молей на моль соединения (IV), с добавлением NaBr в количестве от 0,1 до 2 молей на моль соединения (IV), при температуре от 25 до 150шC, с образованием соединения формулы (III), которое выделяют в виде соли неорганической кислоты, выбранной из группы, состоящей из соляной кислоты и фосфорной кислоты;
в) гидролиз соединения (III) путем реакции с диэтилентриамином в воде при pH в интервале от 5 до 9, при температуре в интервале от 90 до 120шC, в присутствии 5-10 моль диэтилентриамина на моль соединения (III), в атмосфере инертного газа или на воздухе, в течение 12-48 ч с получением соединения (II) в виде тетрагидрохлорида и, возможно,
г) количественное выделение основания с образованием соединения формулы (I).
2. Способ по п.1, где конденсацию соединения (IV) на стадии б) проводят 3-5 молями 1,2-дихлорэтана на моль соединения (IV) в диметилацетамиде (ДМАА) в присутствии карбоната натрия и с добавлением в качестве катализатора NaBr в количестве от 0,1 до 2 молей на моль соединения (IV).
3. Способ по п.2, где применяют 3 моля 1,2-дихлорэтана, 10 молей карбоната натрия и 0,5 моля NaBr.
4. Способ по пп.1-3, где в конечную реакционную смесь со стадии б) добавляют количество концентрированной HCl, эквивалентное 2-4 моль/моль соединения (IV).
5. Способ по п.4, где отношение ДМАА к соединению (IV) в растворе составляет 6 л ДМАА/моль соединения (IV).
6. Способ по пп.1-3, где в конечную реакционную смесь со стадии б) добавляют количество 85% H3PO4, эквивалентное, по меньшей мере, 2 моль/моль соединения (IV).
7. Способ по п.6, где отношение ДМАА к соединению (IV) в растворе эквивалентно 4,5 л ДМАА/моль соединения (IV).
8. Способ по пп.1-7, где на стадии в) мольное отношение соли соединения (III) к диэтилентриамину составляет 1:5.
Текст
Данное изобретение относится к новому способу получения 1,4,7,10-тетраазациклододекана (1), включающему стадии, представленные на схеме 1. Схема 1 В WO 97/49691 описано получение соединения (I) посредством стадий, представленных наcхеме 2, где соединение формулы (III), декагидро 2 а,4 а,6 а,8 а-тетраазациклопент[fg]аценафтилен,является ключевым промежуточным соединением для образования соединения (I), и его можно получить путем циклизации промежуточного соединения (IV), 3 Н,6 Н-октагидро-2 а,5,6,8 а-тетраазааценафтилена, в свою очередь, полученного из триэтилентетрамина и глиоксаля. Схема 2 Более конкретно, данное изобретение относится к способу получения 1,4,7,10-тетраазациклододекана (обычно называемого циклен[cyclen]), альтернативному классическому синтезу Richman-Atkins (см., например, J. Am.Chem. Soc., 96, 2268, 1974), который применяется в настоящее время в промышленном масштабе для производства соединения (I) в виде сульфатной соли. 1,4,7,10-Тетраазациклододекан является предшественником для синтеза макроциклических хелатообразующих агентов для ионов металлов, поскольку эти хелатообразующие агенты образуют очень стабильные комплексы с такими ионами. В частности, комплексы указанных хелатообразующих агентов с парамагнитными ионами металлов, особенно с ионом гадолиния,могут быть использованы в сфере медицинской диагностики посредством способа ядерного магнитного резонанса, в другом варианте трудно осуществимого из-за высокой токсичности свободного иона. В настоящее время промышленно выпускают две контрастные среды, а именно Dotarem и Рrоhаnсе - два комплекса гадолиния,химическая структура которых основана на циклене, в то время как другие находятся в процессе исследований. Следовательно, важно разработать способ синтеза для получения упомянутого строительного блока, который является существенным в отношении экономии и предпочтительным для промышленности. Таким образом, способ получения соединения (I) должен обладать преимуществами с позиции как экономики, так и охраны окружающей среды, избегая получения производных аминотозила, которые обычно используют в известном синтезе Richman-Atkins. Для того чтобы разорвать мостик из двух атомов углерода, который характеризует соединение (III), а следовательно получить соединение (I),был описан окислительный процесс, который позволяет трансформировать соединение (III) в продукты окисления, которые можно последовательно гидролизовать и превратить в соединение (I) с помощью щелочного гидролиза. В качестве альтернативы окислительному разрыву связи в WO 96/28432 предложен непосредственный гидролиз соединения (III) бромисто-водородной кислотой или гидроксиламином в растворе этанола при кипячении с обратным холодильником. С другой стороны, в итальянской патентной заявка на имя заявителя Ml 97 А 000982 описан в качестве альтернативы к вышеупомянутому обычный способ получения соединения(I) исходя из соединения (III), включающий стадию гидролиза в водном растворе первичным диамином формулы (VI), при слабокислом, нейтральном или слабощелочном значении рН, который представлен нижеследующей cхемой 3. Схема 3-СН 2 СН(ОН)СН 2-,-(СН 2)2NН(СН 2)2- или -[(CH2)2NH]2(CH2)2, если х равно 1 или Q представляет собой -СH2-, если х равно 2. Особенно предпочтительным является диэтилентриамин (ДЭТА). Реакция происходит в воде, в интервале рН от 5,5 до 9, предпочтительно от 6 до 8, при тем 3 пературах от 60 до 100 С, в присутствии 2-20 молей диамина на моль соединения (III), в атмосфере инертного газа или воздуха, в течение 1248 ч. После завершения реакции раствор подщелачивают основанием, таким как гидроксид натрия, концентрируют до небольшого объема или до остатка, и соединение (I) экстрагируют подходящим растворителем, таким как толуол,хлороформ, бутанол, амиловый спирт. Органическую фазу концентрируют до остатка, чтобы получить неочищенный макроцикл (I), который окончательно перекристаллизовывают из толуола или этилацетата. Однако преимущества, обеспечиваемые простой комбинацией этих двух способов в соответствии с нижеследующей схемой с целью получения представляющий интерес путь синтеза соединения (I), являются неудовлетворительными; наоборот, возникают неожиданные технические проблемы, таким образом,делая затруднительным применение этого способа в промышленном масштабе. Более конкретно выделение соединения(III), полученного экстракцией гексаном, как это описано в WO 97/49691, приводит к потере продукта на стадии концентрирования реакционной смеси - частично из-за явлений переноса, частично из-за химического разложения, связанного с присутствием паразитических алкилирующих агентов. Фактически, так как реакция циклизации является предпочтительной, но не селективной,реакция между соединением (IV) и 1,2-дихлорэтаном также приводит к образованию паразитических алкилирующих агентов вследствие побочных реакций частичного алкилирования указанного соединения (IV) в количествах, которыми нельзя пренебречь при работе в крупном масштабе. Эти продукты, вероятно, реагируют на стадии концентрирования, тем самым снижая выход по соединению (III). Неожиданно было обнаружено, что эти сложности можно преодолеть путем выделения соединения (III) в виде соли подходящей неорганической кислоты. Более того, было также обнаружено, что выделение соединения (I) из реакционной смеси в виде соли соляной кислоты улучшает возможность промышленного применения этого способа без влияния на общий выход по соединению(I), поскольку выделение соли соединения (I) является количественным. Следовательно, предметом данного изобретения является новый способ получения соединения (I) в соответствии со следующей схемой 1. Схема 1 которая включает следующие стадии: а) конденсацию триэтилентетрамина (ТЭТА) с глиоксальгидратом в воде или водорастворимых растворителях или их смеси при температуре в интервале от 0 до 5 С в присутствии стехиометрических количеств гидроксида кальция, или при его незначительном избытке, с образованием соединения формулы (IV); б) реакцию соединения формулы (IV) с 1,2-дихлорэтаном в количествах от 1 до 5 моля на моль соединения (IV) в диметилацетамиде(ДМАА) и в присутствии Na2CO3, в количествах от 5 до 10 моль на моль соединения (IV), при добавлении NaBr в количествах от 0,1 до 2 моль на моль соединения (IV), при температуре от 25 до 150 С, с образованием соединения формулы(III), которое выделяют в виде соли неорганической кислоты, выбранной из группы, состоящей из соляной кислоты и фосфорной кислоты; в) гидролиза соединения (III) путем реакции с диэтилентриамином в воде при рН в интервале от 5 до 9, при температуре в интервале от 90 до 120 С, в присутствии 5-10 молей диэтилентриамина на моль соединения (III), в атмосфере инертного газа или на воздухе, в течение 12-48 ч, с получением соединения (II) в виде тетрагидрохлорида; и, возможно,г) количественное выделение основания с образованием соединения формулы (I). Стадию (а), по существу, проводят так, как указано в WO 97/49691. Стадию (б) также проводят в соответствии со способом, описанным вWO 97/49691, но предпочтительно в соответствии с модифицированным способом, как это проиллюстрировано в опубликованной позже итальянской заявке MI 97 A000783. В частности, в способе по данному изобретению конденсацию соединения (III) проводят 3-5 молями 1,2-дихлорэтана на моль соединения 5 и с добавлением NaBr в качестве катализатора в количестве от 0,1 до 2 молей на моль соединения (III). Предпочтительные условия подразумевают 3 моля 1,2-дихлорэтана, 10 молей карбоната натрия и добавление 0,5 моля NaBr. Неожиданно было обнаружено, и это является предметом данного изобретения, что после завершения реакции и фильтрации неорганических солей, вышеупомянутые проблемы можно преодолеть путем добавления кислоты, которая с одной стороны растворима в диметилацетамиде, а с другой стороны образует с соединением(III) соль, нерастворимую в упомянутом биполярном апротонном растворителе. Было показано, что для этих целей наиболее пригодны соляная и фосфорная кислоты. Было обнаружено, что при использовании смесей, содержащих соответственным образом разбавленное ДМАА соединение (III), и при добавлении количества НСl, соответствующего 37 мас.%, что эквивалентно 2-4 моль/моль соединения (IV), предпочтительно 2,4 моль/моль,образуется осадок, содержащий около 95% соединения (III), образующегося при завершении реакции. Дальнейшее улучшение достигается при замене 37 мас.% НСl 85 мас.% Н 3 РO4, что позволяет снизить количество растворителя, необходимое для достижения почти полного осаждения соединения (III) в виде фосфата. Полученная соль является дифосфатом. В частности, проведенное исследование процесса осаждения доказало, что соотношение 2 моля Н 3 РO4 на моль исходного соединения(IV) является превосходным для осаждения соединения (III). Использование 85 мас.% Н 3 РO4 также включает применение меньшего количества H2O по сравнению с 37 мас.% НСl (что следует учитывать, когда ДМАА удаляют фракционированной перегонкой). Чтобы выделить гидрохлорид соединения(III), предпочтительно работать с разбавлением 6 л ДМАА/моль соединения (IV), в то время как в случае дифосфата можно работать в более концентрированном растворе, то есть 4,5 л ДМАА/моль соединения (IV), таким образом снижая количество растворителя. Стадия (в) является гидролизом, или, лучше, снятием защиты с соединения (III), которое является защищенной глиоксалем формой соединения (I), в соответствии со способом, описанным в итальянской патентной заявке MI 97A 000982, амином, способным необратимо замещать глиоксаль. Как было доказано, для этой цели особенно продуктивным является диэтилентриамин (ДЭТА). Однако присутствие ДЭТА вносит проблемы, связанные с прямым выделением свободного основания соединения (I) из смеси для гидролиза, которое, в соответствии с указаниями упомянутой патентной заявки, проводят пу 003706 6 тем добавления основания до получения сильно щелочной среды, экстракции толуолом и кристаллизации в подходящих температурных и концентрационных условиях. Применяя указанный способ, как это будет проиллюстрировано в примерах, при использовании чистого соединения (III), превращение(III)/(I) в реакционном сырье хотя и является довольно удовлетворительным, но выход очищенного продукта составляет около 70% из-за примеси ДЭТА, что делает необходимой дополнительную стадию кристаллизации. Таким образом, отделение ДЭТА от реакционной смеси является задачей первостепенной важности для качественных и количественных целей, в то время как определение воспроизводимой методики превращения (III)/(I) должно принимать во внимание, что исходным материалом является реакционное сырье. Неожиданно было обнаружено, что окончательное выделение соединения (I) в форме тетрахлорида позволяет извлечь более 95% соединения (I), полученного в ходе реакции гидролиза, и этот процесс является чрезвычайно селективным по отношению к соединению (I) по сравнению с ДЭТА и реакционными примесями,что дает продукт высокой чистоты. Если это необходимо, тетрахлорид можно количественно превратить в свободное основание в соответствии с известными способами путем реакции с водным NaOH с последующим удалением H2 О (например, азеотропной перегонкой с толуолом), фильтрации солей и кристаллизации из толуола. Оставшееся соединение (I), присутствующее в кристаллизационном маточном растворе,можно выделить в виде тетрахлорида и рециркулировать без потерь. Таким образом, превращение (I)4 НСl/(I) можно провести количественно. Мольное соотношение соединения (III): ДЭТА=1:5 является наиболее продуктивным для превращения (III) (гидрохлорид или фосфат)/(I). Кроме того, в этой реакции на очистку соединения (I) в виде гидрохлорида не влияет количество ДЭТА. Таким образом, проблемы, наблюдаемые в случае процитированных патентов, ликвидируются, что приводит к более подходящему для использования в промышленном масштабе способу. Следующие примеры иллюстрируют наилучшие экспериментальные условия для осуществления способа по данному изобретению. Экспериментальная часть Для газохроматографического анализа применяли следующий метод. Аппаратура. Газохроматографический блок Hewlett-Packard серии 5890 II Plus, снабженный автоматическим пробоотборником серии 7673 и блоком HP-3365. 7 Колонка. HP-ULTRA 1, 25 м, внутренний диаметр 0,32 мм, пленка 0,52 мкм (код HP nо. 19091 А-112) Температурная программа печи: первая изотерма при 150 С в течение 0,5 мин; подъем температуры со скоростью 10 С/мин до 185 С; вторая изотерма при 185 С в течение 0,01 мин; подъем температуры 20 С/мин до 240 С; третья изотерма при 240 С в течение 2 мин. Разделение инжектора (отношение деления потока 1:60) Поток разделения 72 мл/мин Температура 260 С Разделительная вставка (HP art. 1874080190) со стеклянной ватой (Chrompack art. 8490) и стационарной фазой Chromosorb W HP 80-100 меш (Supelco art. 2-0153). Детекция: Пламенный ионизационный детектор; температура 290 С. Скорость течения через колонку: 1,2 мл/мин. Газ-носитель: Не 2 Инжекция: 1 мкл. Концентрация пробы: 10-20 мг/мл в воде. Пример 1. Получение соединения (1). А) очистка ТЭТА. В подготовленный к проведению реакции реактор загружают, в атмосфере азота, 5 кг неочищенного ТЭТА; затем, поддерживая систему при перемешивании и в атмосфере азота, через 8 мин добавляют 800 г деионизированной воды,поддерживая температуру внутри системы ниже 45 С. После того, как температура системы установится на 35 С, к реакционной массе добавляют 1 г чистого гидрата ТЭТА прямой гонки,продолжая перемешивание в течение 1 ч, затем добавляют 10 л толуола через 20 мин. Реакционную смесь нагревают до 40 С, затем охлаждают до 25 С через 30 мин, поддерживая эту температуру в течение 30 мин. Осадок фильтруют через мембрану, промывают толуолом и сушат в стационарной сушилке (30 С) под вакуумом (2 кПа) в течение 24 ч. Получают 3,71 кг желаемого продукта. Выход: 89% (в расчете на безводное вещество) по отношению к содержанию линейного изомера в исходной смеси. Данные газовой хроматографии: 98,22%(% по площади). Н 2 О (анализ по К. Фишеру): 20,75%. Б) Получение соединения (IV). В реактор, подготовленный для проведения реакции, загружают, в атмосфере азота, 3,71 кг чистого гидрата ТЭТА прямой гонки, 20 кг Н 2O и 2,9 кг гидроксида кальция. Полученную суспензию перемешивают в атмосфере азота и охлаждают до 0-5 С, затем, поддерживая температуру реакции 0-5 С, добавляют 9 мас.% водный раствор глиоксаля, полученный смешением 2,9 кг 40% раствора с 10 кг Н 2O. 8 После завершения добавления смесь выдерживают при 5 С в течение 1 ч; добавляют 1 кг целита, предварительно промытого водой, и оставляют при перемешивании на 15 мин. Гидроксид кальция отфильтровывают. Фильтрат концентрируют в роторном испарителе при пониженном давлении до сухого остатка. Продукт не подвергают очистке, а используют для последующей реакции в том виде, в каком он есть. Выход: 98,5% (в расчете на безводное вещество). Данные газовой хроматографии: 95,5% (% по площади). Н 2O (анализ по К. Фишеру): 0,24%. В) Получение соединения (III) в виде фосфата (в полузаводском масштабе). В реактор, подготовленный к проведению реакции, предварительно нагретый до 40 С, загружают в атмосфере азота раствор 3,48 кг соединения (IV) (полученного, как это описано на предшествующей стадии) в 80 л ДМАА, 11,6 кг смеси Nа 2 СО 3:NаВr=10:1 (по массе), измельченной до микронного состояния, и 5,94 кг 1,2 дихлорэтана. Полученную смесь нагревают до 80 С и выдерживают при указанной температуре в течение 3 ч, затем охлаждают до 25 С и фильтруют через мембрану, промывая соли 10 л ДМАА. Фильтрат снова загружают в реактор. В атмосфере азота и поддерживая температуру внутри реактора при 20 С, добавляют в него по каплям 4,61 кг 85 мас.% Н 3 РO4. Смесь перемешивают при указанных условиях в течение 2 ч, затем оставляют стоять в течение ночи. Осадок фильтруют через мембрану и промывают 10 л изопропанола. Затем продукт сушат в стационарной сушилке под вакуумом с получением 7 кг неочищенного фосфата соединения(III) (содержание в дифосфате (III): 65 мас.%). Выход: 58%. Г) Получение соединения (I). В реактор, подготовленный к проведению реакции, загружают, в атмосфере азота, раствор 7 кг неочищенного фосфата соединения (III) в 14 кг Н 2O; к этому быстро добавляют 5 кг диэтилентриамина, и доводят рН полученной смеси до 7, добавляя 34% HCl. Полученную смесь,перемешиваемую в атмосфере азота, кипятят с обратным холодильником и выдерживают в указанных условиях в течение 24 ч, затем охлаждают до 25 С и добавляют 10 кг 34% HCl. Полученный раствор концентрируют при пониженном давлении до массы 30 кг. К этому добавляют равную массу 34%HCl, перемешивают по меньшей мере в течение 2 ч при 25 С; затем смесь оставляют стоять в течение ночи. Осадок фильтруют и промывают 20 мас.% HCl с получением 4 кг осадка, который растворяют в 5 кг воды при 60 С. Нерастворимые вещества отфильтровывают при указанной температуре; раствор переносят в реактор, предварительно нагретый до 50 С, и через 1 9 ч добавляют 7,15 кг 34 мас.% HCl, поддерживая указанную температуру и перемешивая смесь. Смесь охлаждают до 20 С и фильтруют, промывают 20 мас.% HCl и абсолютным этанолом. После сушки в стационарной сушилке под вакуумом получают 2,3 кг кристаллического тетрахлорида соединения (I). Выход: 36,1% (по сравнению с соединением (IV. Данные газовой хроматографии: 99,89%ZnSO4): 98,6% Данные 1H-ЯМР, 13 С-ЯМР, ИКС и массспектроскопии соответствуют установленной структуре. Пример 2. Выделение соединения (III) в виде неочищенного гидрохлорида. Получение гидрохлорида соединения (III),по существу, проводили, как на стадии (В) примера 1, за исключением того, что не проводили конечную сушку. Вместо фосфорной кислоты использовали концентрированную соляную кислоту. В конце выделения влажный продукт не подвергали сушке, а непосредственно анализировали на определение содержания (III). Выходы при различных условиях выделения приведены в табл. 1. Таблица 1 Выделение соединения (III) в виде неочищенного гидрохлорида Соединение Соединение ДМАА, моль Выход,(IV), кг ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы(I), 1,4,7,10-тетраазациклододекана, по следующей схеме 1: а) конденсация триэтилентетрамина (ТЭТА) с глиоксальгидратом в воде или водорастворимых растворителях или их смесях, при температуре в интервале от 0 до 5 С, в присутствии стехиометрических количеств или при незначительном избытке гидроксида кальция, с образованием соединения формулы (IV); б) реакция соединения формулы (IV) с 1,2 дихлорэтаном в количествах от 1 до 5 молей на моль соединения (IV) в диметилацетамиде(ДМАА) и в присутствии Na2CO3 в количестве от 5 до 10 молей на моль соединения (IV), с добавлением NaBr в количестве от 0,1 до 2 молей на моль соединения (IV), при температуре от 25 до 150 С, с образованием соединения формулы(III), которое выделяют в виде соли неорганической кислоты, выбранной из группы, состоящей из соляной кислоты и фосфорной кислоты; в) гидролиз соединения (III) путем реакции с диэтилентриамином в воде при рН в интервале от 5 до 9, при температуре в интервале от 90 до 120 С, в присутствии 5-10 моль диэтилентриамина на моль соединения (III), в атмосфере инертного газа или на воздухе, в течение 12-48 ч, с получением соединения (II) в виде тетрагидрохлорида и, возможно,г) количественное выделение основания с образованием соединения формулы (I). 2. Способ по п.1, где конденсацию соединения (IV) на стадии б) проводят 3-5 молями 1,2-дихлорэтана на моль соединения (IV) в диметилацетамиде (ДМАА) в присутствии карбоната натрия и с добавлением в качестве катализатора NaBr в количестве от 0,1 до 2 молей на моль соединения (IV). 3. Способ по п.2, где применяют 3 моля 1,2-дихлорэтана, 10 молей карбоната натрия и 0,5 моля NaBr. 4. Способ по пп.1-3, где в конечную реакционную смесь со стадии б) добавляют количество концентрированной HCl, эквивалентное 2-4 моль/моль соединения (IV). 5. Способ по п.4, где отношение ДМАА к соединению (IV) в растворе составляет 6 л ДМАА/моль соединения (IV). 6. Способ по пп.1-3, где в конечную реакционную смесь со стадии б) добавляют количество 85% Н 3 РO4, эквивалентное, по меньшей мере, 2 моль/моль соединения (IV). 12 7. Способ по п.6, где отношение ДМАА к соединению (IV) в растворе эквивалентно 4,5 л ДМАА/моль соединения (IV). 8. Способ по пп.1-7, где на стадии в) мольное отношение соли соединения (III) к диэтилентриамину составляет 1:5.
МПК / Метки
МПК: C07D 257/02
Метки: получения, способ, 1,4,7,10-тетраазациклододекана
Код ссылки
<a href="https://eas.patents.su/7-3706-sposob-polucheniya-14710-tetraazaciklododekana.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 1,4,7,10-тетраазациклододекана</a>
Предыдущий патент: Тиазолилциннамонитрилы и средства борьбы с вредителями
Следующий патент: Способ получения гранулированных моющих составов
Случайный патент: Применение производных п-аминофенола для приготовления фармацевтических композиций , используемых при лечении нейродегенеративных заболеваний











