Способ получения бензофенонов
Номер патента: 8040
Опубликовано: 27.02.2007
Авторы: Хоффманн Нико, Майвальд Фолькер, Веверс Ян-Хендрик, Фогельбахер Уве Йозеф, Кайл Михаэль
Формула / Реферат
1. Способ получения бензофенонов формулы I
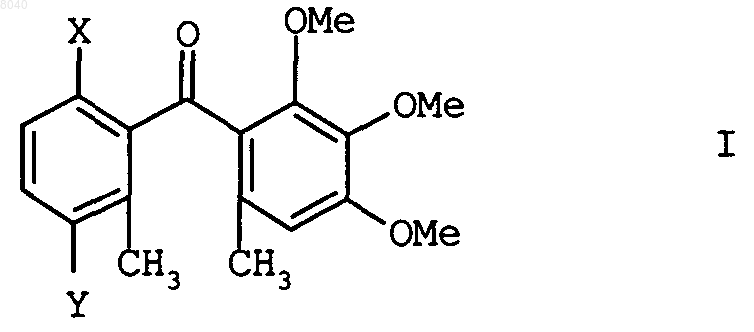
в которой Х может означать хлор, гидрокси, метокси или С1-С6-алкилкарбонилокси и Y может означать хлор или бром, взаимодействием хлорангидрида кислоты формулы II
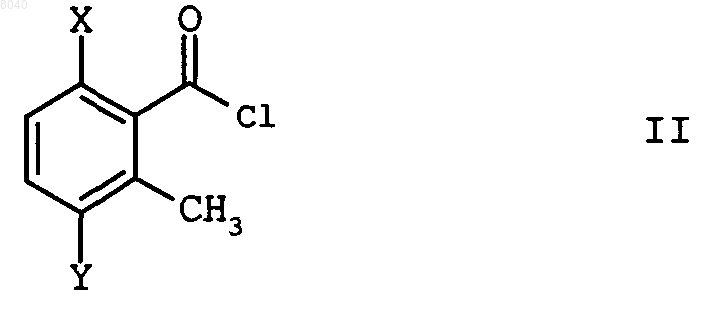
в которой Х и Y имеют вышеприведенное значение, с 3,4,5-триметокситолуолом, отличающийся тем, что реакцию проводят в присутствии
a) ароматического углеводорода, выбранного из группы, включающей хлорбензол, бензотрифторид и нитробензол, в качестве растворителя, и
b) от 0,01 до 0,2 мол.% железного катализатора в пересчете на хлорангидрид кислоты,
с) при температуре, лежащей между 60шС и точкой кипения соответствующего разбавителя.
2. Способ по п.1, отличающийся тем, что в качестве разбавителя применяют хлорбензол.
3. Способ по п.1 или 2, отличающийся тем, что 3,4,5-триметокситолуол, в случае необходимости, подают в соответствующем разбавителе и хлорангидрид кислоты, включая железный катализатор, дозируют, в случае необходимости, в соответствующем разбавителе.
4. Способ по пп.1-3, отличающийся тем, что образующуюся при реакции соляную кислоту удаляют из реакционной смеси стриппингом посредством потока инертного газа.
5. Способ по пп.1-4, отличающийся тем, что разбавитель отгоняют в конце или в течение реакции и оставшийся расплав продукта в C1-C6-спирте подвергают кристаллизации.
6. Способ по пп.1-5, отличающийся тем, что хлорангидрид кислоты формулы II получают взаимодействием кислоты формулы III
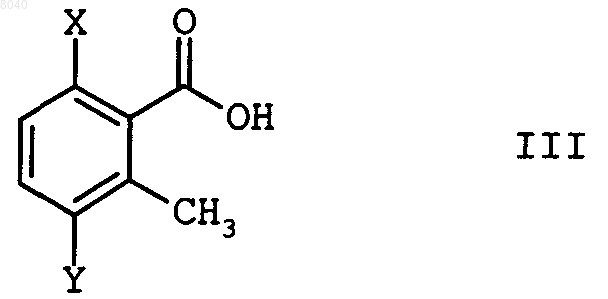
в которой Х и Y имеют вышеприведенные значения, с тионилхлоридом или фосгеном в присутствии диметилформамида в том же разбавителе, который применяют на следующей стадии по Фриделю-Крафту.
7. Способ по п.6, отличающийся тем, что после образования хлорангидрида кислоты II по меньшей мере часть разбавителя с избыточным тионилхлоридом отгоняют и возвращают в процесс.
8. Способ по п.6, отличающийся тем, что кислоту формулы IIIa
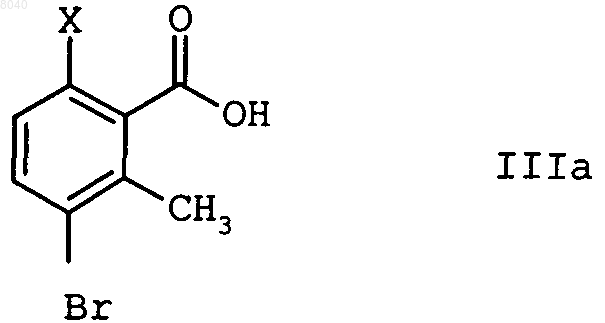
получают бромированием соединения IV
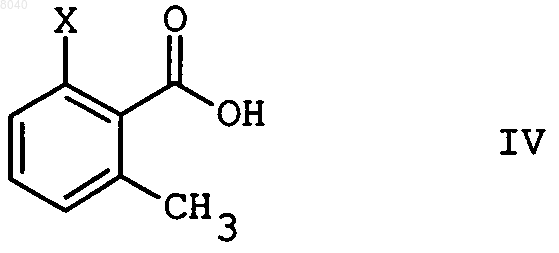
элементарным бромом в том же разбавителе, который применяют для обеих последующих стадий.
9. Способ по п.8, отличающийся тем, что по меньшей мере часть разбавителя и избыточный бром в конце бромирования отгоняют и возвращают в процесс.
Текст
008040 Способ получения бензофенонов формулы I в которой Х может означать хлор, гидрокси, метокси или С 1-С 6-алкилкарбонилокси и Y может означать хлор или бром, взаимодействием хлорангидрида кислоты формулы II в которой Х и Y имеют вышеприведенное значение, с 3,4,5-триметокситолуолом, отличающийся тем, что реакцию проводят в присутствииa) ароматического углеводорода в качестве разбавителя и разбавитель выбран из группы, включающей хлорбензол, бензотрифторид и нитробензол, иb) 0,01 до 0,2 мол.% железного катализатора в пересчете на хлорангидрид кислоты,c) при температуре, лежащей между 60 С и точкой кипения соответствующего разбавителя. Бензофеноны формулы I известны из европейской заявки ЕР-А 897 904. Ацилирование по Фриделю-Крафту проводится при этом со стехиометрическими количествами хлорида алюминия или пентоксида фосфора. В качестве разбавителя применяются при этом низкокипящие соединения, такие как дихлорметан или бензол. Эти способы при их технической реализации приводят к многочисленным проблемам. В частности, имеется недостаток водной обработки и образующихся брльших количеств содержащих алюминий, соответственно, фосфор отработанных вод. В международной заявке WO 01/51440 описывается способ получения бензофенонов формулы I,который проводится в присутствии хлорида железа (III) и больших количеств графита. В качестве разбавителя применяется 1,2-дихлорэтан. Выход выделенного бензофенона составляет только приблизительно 72%. Кроме того, отделение графита требует дополнительной стадии фильтрования. Задачей настоящего изобретения является разработка экономичного и селективного способа получения бензофенонов формулы I, который проводится с каталитическим количеством катализатора по Фриделю-Крафту и одновременно обеспечивает высокий выход на объем/время. Неожиданным образом было установлено, что имеющиеся в уровне техники недостатки могут быть устранены, если реакцию проводят в присутствииb) от 0,01 до 0,2 мол.% железного катализатора в пересчете на хлорангидрид кислоты,c) при температуре, лежащей между 60 С и точкой кипения соответствующего разбавителя. В качестве железного катализатора, как правило, применяют тонкоизмельченный железный порошок или соли железа (III). Предпочтителен оксид железа (III) и особенно предпочителен хлорид железа(III). В качестве разбавителя пригодны высококипящие и при условиях реакции инертные углеводороды,такие как, например, хлорбензол, бензотрифторид и нитробензол. Особенно предпочтительны галогенированные ароматические углеводороды и, в частности, хлорбензол. Применение высококипящего разбавителя имеет далее то преимущество, что образующаяся при реакции соляная кислота может быть удалена посредством потока инертного газа, который предпочтительно пропускается через реакционную смесь, без возникновения стоящих упоминания потерь разбавителя. На примере получения видно, что стриппингом инертным газом можно значительно сократить время реакции. Таким образом даже при очень малых количествах катализатора, например менее 0,1 мол.%,может быть реализовано время реакции ниже 10 ч, без больших потерь выхода. В качестве инертного газа пригодны благородные газы, такие как аргон, воздух и предпочтительно азот. Поток инертного газа предпочтительно пропускается через реакционную смесь. Предпочтительно, например, по возможности тонкое распределение частиц газа в рекационной смеси. Это может быть обеспечено соплом или раздувнным кольцом, причем эти средства размещены под мешалкой. Количество пропускаемого через реакционную смесь газа ориентируется, прежде всего, на количество реакционной смеси. На моль хлорангидрида кислоты вводят до 5 л/ч инертного газа. Применение разбавителя согласно изобретению имеет еще и то преимущество, что ацилирование по Фриделю-Крафту может проводиться при более высоких температурах, вследствие чего можно также снизить время реакции. В общем диапазон температур составляет от 60 С до точки кипения разбавителя. Предпочтитльно работают в диапазоне от 80 до 150 С.-1 008040 Железный катализатор применяется в молярном соотношении от 0,01 до 0,2 мол.% в пересчете на хлорангидрид кислоты. Предпочтительно применяют от 0,03 до 0,1 мол.% катализатора. Далее 3,4,5-триметокситолуол, как правило, применяется в молярном соотношении от 1 до 3 в пересчете на хлорангидрид кислоты. Предпочтительно применяется легкий избыток от 1,05 до 1,4 молярных эквивалентов 3,4,5-триметокситолуола. В одной предпочтительной форме выполнения способа согласно изобретению 3,4,5 триметокситолуол подается, в случае необходимости, в разбавителе и железный катализатор и хлорангидрид кислоты добавляется, в случае необходимости, в разбавителе в течение времени от 0,5 до 20 ч,предпочтительно от 4 до 6 ч в зависимости от выбранной температуры реакции. Железный катализатор предпочтительно добавляется растворенным в хлорангидриде кислоты. Обратный порядок (дозировка 3,4,5-триметокситолуола) как одноемкостный вариант имеет преимущества относительно применяемого оборудования, если уже хлорангидрид кислоты получают в той же реакционной емкости. Как видно из таблицы, этот способ приводит к более низким селективности и выходу при в остальном одинаковых приемах. Как правило, реакционная смесь после окончания дозировки дополнительно перемешивается еще в течение до 20 ч и предпочтительно от 2 до 4 ч. Время дополнительного перемешивания может, как правило, быть сокращено, если растворитель и, в случае необходимости, избыточный 3,4,5-триметокситолуол в конце ацилирования по Фриделю-Крафту удаляется дистилляцией. Дистилляцию можно уже начинать, если достигнута только частичная конверсия. Время дистилляции используется для завершения конверсии. Удаление разбавителя дистилляцией является предпочтительным вариантом переработки. В качестве продукта нижней части в реакционном котле остается расплав желаемого бензофенона, который может быть доведен до кристаллизации C1-C6-спиртом, предпочтительно метанолом. Часто может иметь преимущество добавка к спирту небольших количеств воды, чтобы полностью растворять соли железа. Способ согласно изобретению пригоден особенно для получения 5-бромо-2',6-диметил-2,4',5',6'тетраметоксибензофенонов. Далее способом согласно изобретению можно получать, например 2,5 дихлоро-2',6-диметил-4',5',6'-триметоксибензофенон,5-хлоро-2',6-диметил-2-гидрокси-4',5',6'-триметоксибензофенон или 5-бромо-2',6-диметил-2-гидрокси-4',5',6'-триметокеибенаофенон. В случае обоих последних соединений рекомендуется защищать свободные гидроксигруппы в 2-положении в форме C1-C6 алкилкарбонилоксигруппы и после окончания ацилирования по Фриделю-Крафту снова отщеплять. Способ согласно изобретению имеет то преимущество, что здесь образуется исключительно желаемая триклинная модификация. При до сих пор известных способах постоянно образовывались смеси, как правило, из двух модификаций. Термодинамически стабильная триклинная модификация имеет точку плавления от 99,5 до 100,5 С и в ИК-спектре имеет характеристические полосы при 445, 568, 641, 769,785 и 822 см-1. Как упомянуто выше, способ согласно уровню техники обеспечивает вторую термодинамически нестабильную модификацию с точкой плавления от 91,5 до 92,5 С и характеристическими полосами при 428, 648, 704 и 805 см-1 в инфракрасном спектре. Способ согласно изобретению имеет еще то преимущество, что получение хлорангидрида кислоты-2 008040 5-Бромо-2',6-диметил-2,4',5',6'-тетраметоксибензофенона (I'), (i) бромирование 2-метокси-6 метилбензойной кислоты IV' в 5-бром-2-метокси-6-метилбензойную кислоту IIIa', (ii) заключительное превращение в хлорангидрид II' и наконец (iii) ацилирование по Фриделю-Крафту в бензофенон I' - все три стадии проводятся в хлорбензоле (см. Chlorbenzol). Независимо от порядка дозировки на стадии ацилирования по Фриделю-Крафту все три стадии реакции могут быть сведены в одноемкостный вариант. Более высокие точки кипения разбавителей в способе согласно изобретению позволяют далее отделение дистилляцией исходных веществ, примененных предпочтительно в избытке, а именно брома на стадии бромирования, тионилхлорида (фосгена) на стадии получения хлорангидрида кислоты и 3,4,5 триметокситолуолоа на стадии ацилирования по Фриделю-Крафту и возвращение снова в соотвествующий процесс (i до iii). Если в качестве разбавителей применяются галогенированные углеводороды, такие как бензотрихлорид или хлорбензол, то на стадии ацилирования по Фриделю-Крафту удается вследствие разницы точек кипения (iii) получить дистилляцией растворитель, который свободен от 3,4,5 триметокситолуола и поэтому может непосредственно возвращаться на стадию бромирования (i). Образование хлорангидрида кислоты (стадия ii) проводится как подробно описано в литературе. В качестве агента хлорирования применяют, как правило, тионилхлорид или фосген. Температура реакции обычно составляет от комнатной температуры до 80 С. Бромирование (стадия i) может осуществляться как описано в литературе. Реакция может проводиться или в присутствии, предпочтительно без кислотного катализа. Температура реакции составляет в общем от 0 до 80 С. Примеры проведения способа Примеры 1-7. Общие предписания для способа получения 5-бромо-2',6-диметил-2,4',5',6'-тетраметоксибензоенона (I'), исходя из хлорангидрида 5-бром-2-метокси-6-метилбензойной кислоты (II'). Раствор из 1047 г (3,973 моль) хлорангидрида 5-бром-2-метокси-6-метилбензойной кислоты в 1715 г хлорбензола смешивают с 0,72 г (0,0044 моль) (примеры 1 до 4 и 7) соответственно, 0,36 г (0,0022 моль)(пример 5) соответственно, 0,18 г (0,0011 моль) (пример 6) с безводным хлоридом железа (III) и дозируют к раствору из 868,7 г (4,768 моль) 3,4,5-триметокситолуола в 467,8 г хлорбензола при указанной в таблице температуре реакции в течение 4 ч. После этого реакционную смесь перемешивают еще 2 ч при температуре реакции. Для удаления образовавшегося HCl во время дозировки и последующего перемешивания через реакционную смесь пропускают постоянный поток азота (соответствующий объем потока можно подчерпнуть из таблицы). Затем отгоняют хлорбензол при 80 мбар и температуре 80-105 С. Чистоту и выход сырого расплава продукта перед кристаллизацией анализируют посредством хроматографии ВСЖХ (результаты см. таблицу). Для кристаллизации 5-бромо-2',6-диметил-2,4',5',6'-тетраметоксибензофенона (I') подают 4900 г метанола при 50 С и вводят нагретый на 105 С расплав. Кристаллизация происходит посредством охлаждения до -5 С. Указанное в заголовке соединение центрифугированием выделяют, промывают в центрифуге метанолом и сушат.(i) Получение 5-бромо-2-метокси-6-метилбензойной кислоты (IIIa'). 700 г (4,212 моль) 2-метокси-6-метилбензойной кислоты (IV) суспендируют в 2343,5 г хлорбензола и затем прикапывают 707,2 г (4,423 моль) элементарного брома при константной внутренней температуре 15 С в течение 3 ч. После этого реакционную смесь перемешивают в течение 2 ч при 35 С. Затем 28,7 г хлорбензола отгоняют при внутренней температуре 77-82 С и 200 мбар, причем избыточный бром иHBr также удаляют из реакционной емкости. Содержащий бром дистиллят хлорбензола после анализа содержания брома можно было без вывода снова применять для следующей реакционной смеси. Подлежащее применению в ней количество брома можно было соответствующе снизить. Состав сырой смеси определяют количественным анализом ВСЖХ. Было получено 980,5 г (4,0 моль = 95% выход) суспензии соединения IIIa' в хлорбензоле. Селективность бромирования является высокой. Соотношение 5-бромного соединения к 3-бромному соединению составляет 500:1.(ii) Получение 5-бромо-2-метокси-6-метилбензоилхлорида (II'). Полученную на стадии (i) суспензию разбавляют добавкой 754,8 г хлорбензола и охлаждают до температуры 50 С. Потом добавляют 0,95 г (0,013 моль) диметилформамида и после этого дозируют 528,8 г (4,445 моль) тионилхлорида при внутренней температуре 50 С в течение 1,5 ч. В заключение при 50 С реакционную смесь дополнительно перемешивают в течение еще 1,5 ч. Затем отгоняют 754,8 г хлорбензола при внутренней температуре 83-90 С при 200 мбар, причем из реакционной смеси также удаляют избыточный тионилхлорид и остаточную соляную кислоту и диоксид серы. Содержащий тионилхлорид дистиллят хлорбензола после анализа на содержание тионилхлорида можно было без вывода применять в следующей реакционной смеси. Подлежащее применению в ней количество тионилхлорида можно было соответствующим образом снизить. Содержание продукта нижней части дистилляционной колонны определяют с помощью количественной ВСЖХ. Было получено 1047 г (3,973 моль = 99,5% выход) 5-бром-2-метокси-6 метилбензоилхлорида как раствор в хлорбензоле.iii) Получение 5-броом-2',6-диметил-2,4',5',6'-тетраметоксибензофенона (I'). Получение осуществляют аналогично примерам 1 до 7 также в хлорбензоле. Относительно выхода и чистоты полученного продукта можно было получить сравнительно одинаковые результаты, которые можно видеть в таблице. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения бензофенонов формулы I в которой Х может означать хлор, гидрокси, метокси или С 1-С 6-алкилкарбонилокси и Y может означать хлор или бром, взаимодействием хлорангидрида кислоты формулы II в которой Х и Y имеют вышеприведенное значение, с 3,4,5-триметокситолуолом, отличающийся тем, что реакцию проводят в присутствииb) от 0,01 до 0,2 мол.% железного катализатора в пересчете на хлорангидрид кислоты,с) при температуре, лежащей между 60 С и точкой кипения соответствующего разбавителя. 2. Способ по п.1, отличающийся тем, что в качестве разбавителя применяют хлорбензол. 3. Способ по п.1 или 2, отличающийся тем, что 3,4,5-триметокситолуол, в случае необходимости,подают в соответствующем разбавителе и хлорангидрид кислоты, включая железный катализатор, дозируют, в случае необходимости, в соответствующем разбавителе. 4. Способ по пп.1-3, отличающийся тем, что образующуюся при реакции соляную кислоту удаляют из реакционной смеси стриппингом посредством потока инертного газа. 5. Способ по пп.1-4, отличающийся тем, что разбавитель отгоняют в конце или в течение реакции и оставшийся расплав продукта в C1-C6-спирте подвергают кристаллизации.-4 008040 6. Способ по пп.1-5, отличающийся тем, что хлорангидрид кислоты формулы II получают взаимодействием кислоты формулы III в которой Х и Y имеют вышеприведенные значения, с тионилхлоридом или фосгеном в присутствии диметилформамида в том же разбавителе, который применяют на следующей стадии по Фриделю-Крафту. 7. Способ по п.6, отличающийся тем, что после образования хлорангидрида кислоты II по меньшей мере часть разбавителя с избыточным тионилхлоридом отгоняют и возвращают в процесс. 8. Способ по п.6, отличающийся тем, что кислоту формулы IIIa получают бромированием соединения IV элементарным бромом в том же разбавителе, который применяют для обеих последующих стадий. 9. Способ по п.8, отличающийся тем, что по меньшей мере часть разбавителя и избыточный бром в конце бромирования отгоняют и возвращают в процесс.
МПК / Метки
МПК: C07C 49/84, C07C 45/81, C07C 51/60, C07C 51/363, C07C 45/46
Метки: получения, способ, бензофенонов
Код ссылки
<a href="https://eas.patents.su/6-8040-sposob-polucheniya-benzofenonov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензофенонов</a>
Предыдущий патент: Новые липидные смеси для синтетических сурфактантов
Следующий патент: Водные суспензии измельченных минеральных веществ с низким ионным зарядом и их применение
Случайный патент: Присадка в качестве компонента композиции минерального нефтетоплива










