L-арабинодисахариды антрациклинов, способы их получения и фармацевтические композиции, содержащие их
Номер патента: 3455
Опубликовано: 26.06.2003
Авторы: Анимати Фабио, Чиполлоне Амалия, Магги Карло Альберто, Биджиони Марио, Береттони Марко
Формула / Реферат
1. Соединения общей формулы (I)

и их фармацевтически приемлемые соли,
где R представляет собой OH;
R1 представляет собой H или OH;
R2 представляет собой H или OH или NH2.
2. Соединения формулы (I) по п.1, включающие группу, состоящую из
i) 7-O-[2,6-дидеокси-4-O-(2,3,6-тридеокси-3-амино-a-L-арабиногексопиранозил)-a-L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R1=OH, R2=NH2);
ii) 7-O-[2,3,6-тридеокси-4-O-(2,3,6-тридеокси-3-амино-a-L-арабиногексопиранозил)-a-L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=OH, R1=H, R2=NH2);
iii) 7-O-[2,6-дидеокси-4-O-(2,6-дидеокси-a-L-арабиногексопиранозил)-a-L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R1=R2=OH);
iv) 7-O-[2,3,6-тридеокси-4-O-(2,6-дидеокси-a-L-арабиногексопиранозил)-a-L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R2=OH, R1=H).
3. Способ получения соединений общей формулы (I)
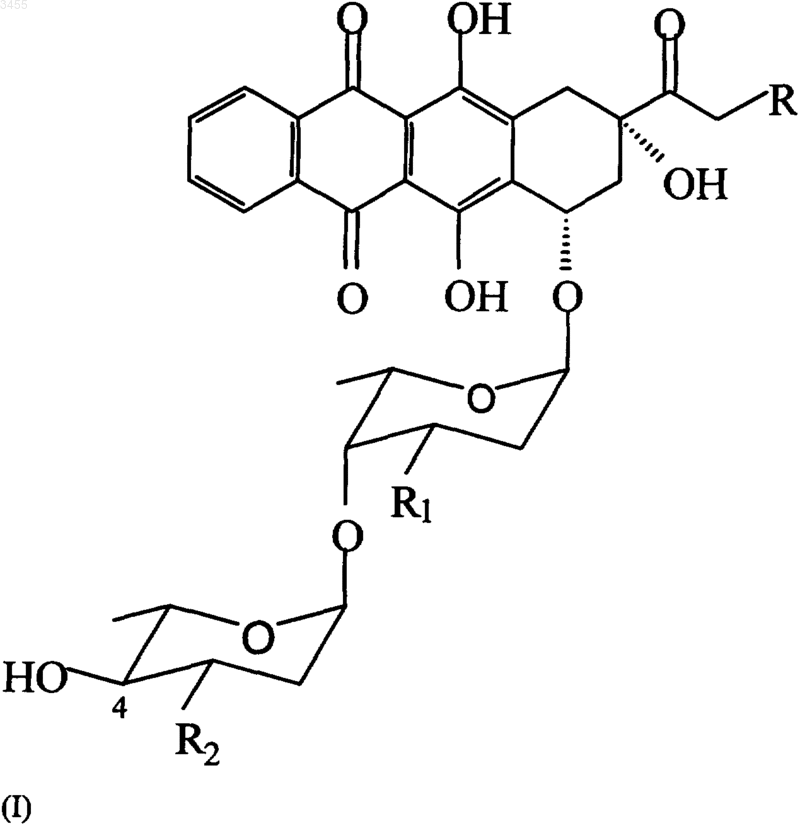
где R представляет собой OH;
R1 представляет собой H или OH;
R2 представляет собой H, или OH, или NH2,
или их фармацевтически приемлемых солей, включающий следующие стадии:
i) конденсацию соединения формулы (II)
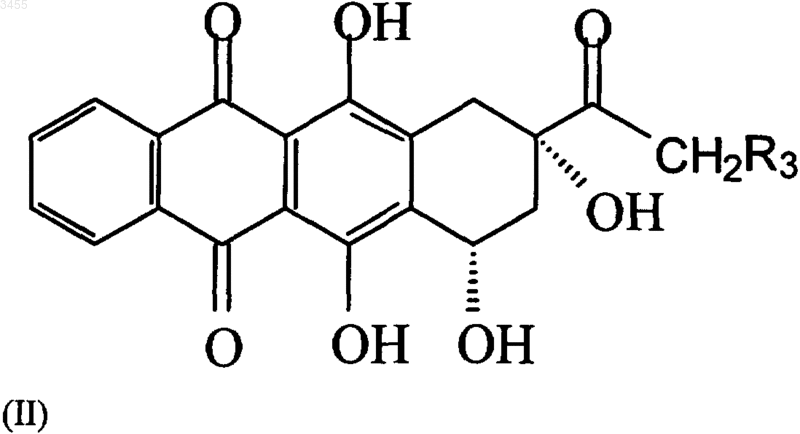
где R3 представляет собой OR4 группу, в которой R4 является защитной группой для спиртового радикала, выбранной из ацетильной, диметилтретбутилсилильной или п-метоксифенилди-
фенилметильной групп, с соединением формулы (III)
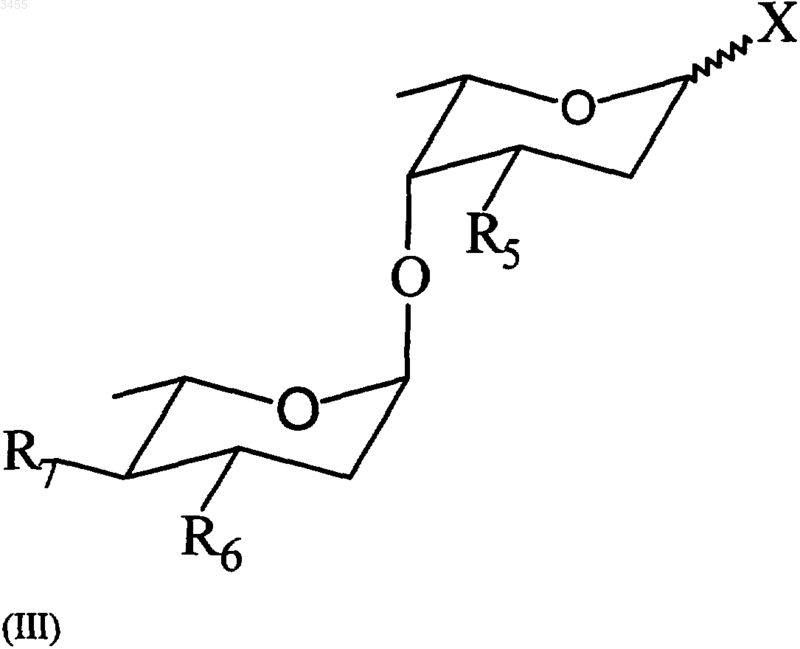
где R5 представляет собой H или защищенную -OH группу, R6 представляет собой H, или защищенную -OH группу, или защищенную NH2 группу; R7 представляет собой защищенную -OH группу и X представляет собой группу, выбранную из галогена или п-нитробензоилокси или тиофенильной группы, с получением соединений формулы (IV)
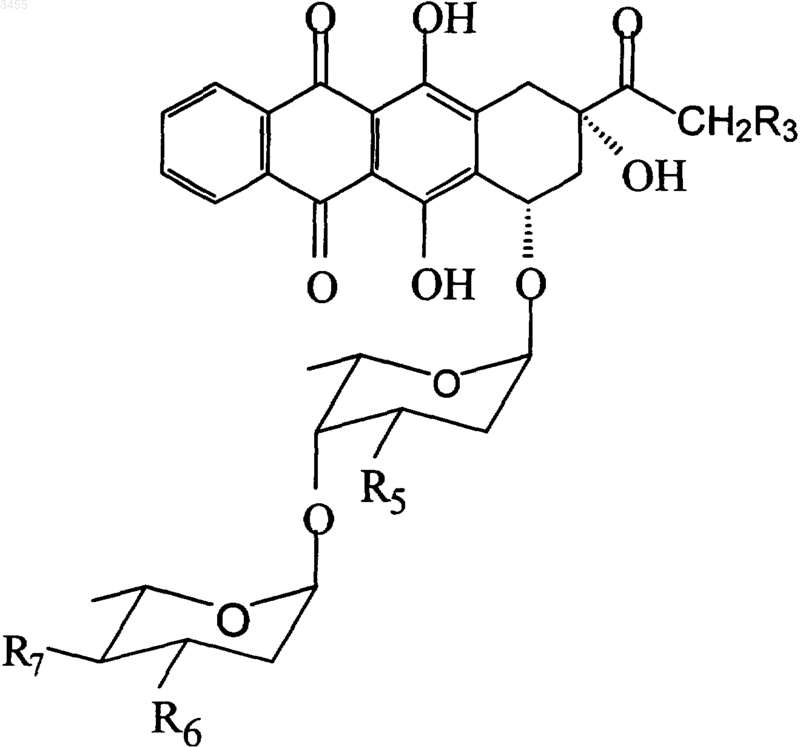
(IV)
где R3, R5, R6, R7 являются такими, как описано выше;
ii) одну или более реакцию (реакции) удаления защитных групп с OH и/или NH2 групп соединений формулы (IV) с получением соединений формулы (I), где R, R1, R2 являются такими, как определено выше;
iii) превращение, при необходимости, соединений формулы (I) в их фармацевтически приемлемые соли.
4. Способ получения соединений формулы (I) по п.1, где R2 и R2 являются такими, как определено выше, и R представляет собой OH группу, или их фармацевтически приемлемых солей, включающий следующие стадии:
i) бромирование углерода в положении 14 соединений формулы (I) или их фармацевтически приемлемых солей, где R1 и R2 являются такими, как определено выше, и R представляет собой H;
ii) гидролиз образованных 14-бромпроизводных с получением соединений формулы (I), где R1 и R2 являются такими, как определено выше, и R представляет собой OH группу.
5. Фармацевтическая композиция, содержащая в качестве активного ингредиента, по меньшей мере, соединение общей формулы (I) по любому из пп.1 или 2 или его фармацевтически приемлемую соль, объединенную с фармацевтически приемлемым разбавителем или носителем.
6. Применение соединений общей формулы (I) по любому из пп.1 или 2 или их фармацевтически приемлемых солей для получения фармацевтической композиции.
7. Применение по п.6, где фармацевтические композиции являются противораковым средством.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям общей формулы (I) и их фармацевтически приемлемым солям, обладающим противоопухолевыми (противораковыми) свойствами, гдеR2 представляет собой Н или ОН или NH2. Настоящее изобретение также относится к способам получения указанных соединений, их фармацевтически приемлемых солей и к фармацевтическим композициям, содержащим их. Предшествующий уровень техники Даунорубицин и доксорубицин являются признанными противоопухолевыми (противораковыми) лекарственными средствами, обычно использующимися в клинической практике для лечения различных твердых опухолей и лейкемии (F.Arcamone, Doxorubicin: Anticancer Antibiotics, Academic Press, N.Y., 1981). Однако известно, что тяжелые побочные эффекты (прежде всего, хроническая кардиотоксичность и, во-вторых, острая миелосуппрессия), вызываемые указанными антибиотиками и другими антрациклинами, использующимися в настоящее время, накладывают ограничения на их использование для большого числа пациентов, для которых, с другой стороны, лечение принесло бы облегчение. Указанные побочные эффекты фактически накладывают ограничение на максимальную вводимую дозу и на количество циклов лечения. Следовательно, существует крайне необходимая потребность для внедрения на рынок лекарств, которые являются высокоселективными в их ингибирующем действии против пролиферации больных клеток по отношению к здоровым клеткам и характеризующиеся более низкой кардиотоксичностью, что сделало бы возможным их использование в более высоких дозах и позволило достигнуть повышения терапевтических индексов. Объектом настоящего изобретения являются новые противоопухолевые лекарственные средства, в частности, аналоги антрациклина, в которых углеводородная часть состоит из дисахаридного остатка. Как правило, в известных природных или синтетических антрациклинах, обладающих противоопухолевой активностью, которые содержат два или более углеводородных остатка, 003455 2 остаток сахара непосредственно связанный с агликоном, всегда содержит свободную или замещенную аминогруппу. Недавнее промышленное изобретение (WO 95/09179) относится к антрациклинам с дисахаридным остатком, в котором сахар, непосредственно связанный с агликоном, никогда не содержит аминогрупп. Сущность изобретения Антрациклины, являющиеся объектом настоящего изобретения, всегда содержат Lарабиногруппу или их аминопроизводное по дисахаридной части, и указанная арабиногруппа всегда является самым дальним остатком сахара от агликоновой связи. Более того, в отличие от большинства активных антрациклинов, содержащих два или более углеводородных остатков, остаток сахара непосредственно связанный с агликоном, никогда не содержит аминогрупп. Для облегчения понимания стоит заметить,что в настоящем изобретении заместители дисахаридной группы, определенные в WO 95/09173 как R3, R4 и R5, находятся все в экваториальном положении и группа, определенная там как R5,является всегда гидроксильной группой. Экваториальное расположение гидроксильной группы в положении 4 во втором остатке сахара для соединений общей формулы (I) является особенно важным в настоящем изобретении. Неожиданно было обнаружено, что по сравнению с антрациклиновыми дисахаридами,описанными в WO 95/09173, которые содержат гидроксильную группу в положении 4 на втором остатке сахара в аксиальном положении[см. общую формулу (I)], антрациклины настоящего изобретения характеризуются более высокой противоопухолевой (противораковой) активностью и селективностью, так же как и более низкой кардиотоксичностью. Понижение кардиотоксичности не могло ожидаться исключительно в зависимости от присутствия названной гидроксильной группы в углеводородном остатке. Соединениями настоящего изобретения являются соединения общей формулы (I), как указывалось выше, и их фармацевтически приемлемые соли, в которых R, R1, R2 являются такими, как определено выше. Изобретение также относится к фармацевтическим композициям, содержащим вышеуказанные соединения или их соли с фармацевтически приемлемыми кислотами, предпочтительно, хлористо-водородной кислотой. Особенно предпочтительными являются следующие соединения: а) 7-O-[2,6-дидеокси-4-O-(2,3,6-тридеокси 3-аминоL-арабиногексопиранозил)L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R1=OH, R2=NH2);d) 7-O-[2,3,6-тридеокси-4-O-(2,6-дидеокси-L-арабиногексопиранозил)L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R2=OH, R1=H). Соединения общей формулы (I) могут быть получены на основе способа, состоящего из следующих стадий: а) конденсация соединения формулы (II) где R3 представляет собой OR4 группу, в которой R4 является защитной группой для спиртового радикала, предпочтительно выбранной из ацетильной, хлорацетильной, диметилтретбутилсилильной или п-метоксифенилдифенилметильной групп, с соединением формулы (III)-ОН группу, предпочтительно п-нитробензоат или аллилоксикарбонат; R6 представляет собой водород или защищенную -ОН группу, предпочтительно п-нитробензоат или аллилоксикарбонат, или защищенную NH2-группу, предпочтительно трифторацетамид или аллилкарбоксамид; R7 представляет собой защищенную -ОН группу, предпочтительно п-нитробензоат или аллилоксикарбонат, и Х представляет собой группу, способную образовывать в условиях конденсации устойчивый карбокатион, который сам может связываться с гидроксильной группой в положении С-7 соединения формулы (II),причем названная группа Х выбирается удобным образом из групп, использующихся в реакции гликозилирования, например, галоген, такой, как хлор или бром, предпочтительно хлор,или п-нитробензоилокси группа или тиофенильная или тиоэтильная группа, предпочтительно, тиофенил. Таким образом получают соединения формулы (IV)b) одна или более реакция (реакции) удаления защитных групп с ОН и/или NH2 групп соединений формулы (IV) с получением соединений формулы (I), где R, R1, R2 являются такими, как определено выше; с) перевод, при необходимости, вышеуказанных гликозидов формулы (I) в их фармацевтически приемлемую соль, предпочтительно,гидрохлорид. Условия реакции гликозилирования соединения формулы (II) с соединением формулы(III) для получения соединения формулы (IV) могут изменяться в зависимости от типа заместителей, присутствующих в соединениях формулы (III). С другой стороны, при необходимости, антрациклиновые гликозиды формулы (I), где R1,R2 являются такими, как определено выше, и R представляет собой ОН группу, могут быть получены из гликозидов формулы (I) или их фармацевтически приемлемых солей, где R1, R2 являются такими, как определено выше, и R представляет собой Н, путем бромирования углерода в положении 14 бромом в среде хлороформа с последующим гидролизом при комнатной температуре в течение 48 ч полученных 14-бромпроизводных формиатом натрия. Последовательность реакций, приводящих к получению соединений общей формулы (I),осуществляется в соответствии с методами, уже описанными (см., например, WO 95/09173), и следовательно уже известными из уровня техники. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль, объединенную с фармацевтически приемлемым разбавителем или носителем. В соответствии с настоящим изобретением терапевтически эффективная доза соединения формулы (I) объединяется с инертным носителем. Композиции могут быть приготовлены обычными методами с использованием обычных носителей. Заявляемые соединения применимы для терапевтического лечения людей и других млекопитающих. В частности, указанные соединения являются эффективными противоопухолевыми агентами в случае их введения в терапевтически эффективных дозах. Сведения, подтверждающие возможность осуществления изобретения Активность соединения, представленного формулой (I), была определена при сравнении его цитотоксичности in vitro с цитотоксичностью соединения 7-O-[2,6-дидеокси-4-O-(2,3,6 тридеокси-3-аминоL-ликсогексопиранозил) 5-L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорида общей формулы (V)(R8=H, R9=R10=R12=OH, R11=NH2), указанного в описании к патенту WO 95/09173 на строках Н 460 (легочная карцинома) и GLC-4 (легочная микрокарцинома). Полученные результаты представлены в табл. 1, где показана концентрация (в нмолях),необходимая для достижения 50% угнетение роста больных клеток после 24-часового воздействия лекарственного средства (IC50, нМ), по отношению к соединению (Iа) 7-O-[2,6-дидеокси-4-O-(2,3,6-тридеокси-3-аминоL-арабиногексопиранозил)L-ликсогексопиранозил]-4 деметоксидоксорубицинон гидрохлориду (соединение формулы (I), R=R1=OH, R2=NH2). Активность in vivo соединения (Iа) по сравнению с активностью соединения (V) также была определена на линии человеческой опухоли, имплантированной подкожно в мышь, лишенную волосяного покрова (легочная микроцитома GLC-4), после введения 6 мг/кг лекарственного средства каждые 3-4 дня за 5 циклов лечения. Полученные результаты представлены в табл. 2, которая показывает ингибирование роста веса опухоли % (Tumour Weight Inhibition %)(TWI % определяется спустя 7-10 дней после последнего введения) и Log уничтоженных клеток (Cell Kill) [LCK у животных, обработанных в соответствии с формулой: Т-C/DTx3,32, где Т и С - количество дней, за которые опухоли достигают значительного веса, отмеченного в каждом тесте, у лечащихся животных (Т) и в контроле (С)]. Таблица 2 Доза (мг/кг) Соединение Единичная Общая Соединения формулы (I), как оказалось,имеют меньшую кардиотоксичность, чем соединения формулы (V). Их кардиотоксичность определялась электрокардиографическим анализом параметров, таких, как QaT, SaT и QRS,через 3 дня, 4 недели и 13 недель соответственно, после последнего курса лечения. Указанные параметры могут быть соотнесены с кардиотоксичностью, как описано в J. Pharmacol. Meth., Контроль Продолжительность QaT (мс) 3 дня 4 недели 13 недель Продолжительность SaT (мс) 3 дня 4 недели 13 недель Продолжительность QRS (мс) 3 дня 4 недели 13 недель Напряжение QRS (мВ) 3 дня 4 недели 13 недель Следующие примеры иллюстрируют настоящее изобретение более детально. Пример 1. 7-O-[2,6-Дидеокси-4-O-(2,3,6 тридеокси-3-аминоL-арабиногексопиранозил)L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (соединение формулы (I), R=R1=OH, R2=NH2). Смесь защищенного 4-деметоксидоксорубицинона (соединение формулы (II), R3=OR4,где R4=ацетил) (210 мг, 0,5 ммоль) и 2,6 дидеокси-4-O-(2,3,6-тридеокси-4-O-аллилоксикарбонат-3-аллилкарбоксамидL-арабиногексопиранозил)-3-O-аллилоксикарбонатLликсогексопиранозил-п-нитробензоата (соединение формулы (III), R5=R7=аллилоксикарбонат,R6=аллилкарбоксамид, Х=п-нитробензоилокси)(407 мг, 0,6 ммоль) в 36 мл хлористого метилена и 12 мл этилового эфира в присутствии молекулярных сит при -20 С обрабатывают 201 мл (0,9 ммоль) триметилсилилфторметансульфатом. Реакционную смесь выдерживают 1 ч, разбавляют хлористым метиленом, промывают насыщенным раствором бикарбоната натрия и высушивают до получения сухого вещества. Остаток хроматографируют на силикагеле (элюент СН 2 Сl2-ЕtOН, 96/4), получают 220 мг защищенного 7-O-[2,6-дидеокси-4-O-(2,3,6-тридеокси-4O-аллилоксикарбонат-3-аллилкарбоксамидLарабиногексопиранозил)-3-O-аллилоксикарбонатL-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорида (соединение формулы (IV), R3=ОR4, где R4=ацетил, R5=R7=аллилоксикарбонат, R6=аллилкарбоксамид). Раствор защищенного гликозида соединения формулыR4=ацетил,R5=R7=аллилоксикарбонат,R6=аллилкарбо 7 ксамид), (215 мг, 0,23 ммоль) в хлористом метилене (5 мл) и метаноле (10 мл) обрабатывают в течение 1 ч при -10 С 0,5 М раствором карбоната калия (0,7 мл). Реакционную смесь нейтрализуют 0,1N НСl, разбавляют хлористым метиленом, промывают насыщенным раствором хлорида натрия и высушивают до получения сухого остатка. Остаток разделяют с помощью препаративной HPLC (высокоэффективная жидкостная хроматография) (колонка Merck RP-18,Н 2O+0,1% трифторуксусной кислоты=60%,CH2CN+0,1% трифторуксусной кислоты=40%). Фракции разбавляют AcOEt и обрабатывают насыщенным раствором бикарбоната натрия. Отделенную органическую фазу промывают водой и упаривают в вакууме с получением 144 мг 7-O-[2,6-дидеокси-4-O-(2,3,6-тридеокси-4-Oаллилоксикарбонат-3-аллилкарбоксамидLарабиногексопиранозил)-3-O-аллилоксикарбонатL-ликсогексопиранозил]-4-деметоксидоксорубицинона (соединение формулы (IV),R3=ОН, R5=R7=аллилоксикарбонат, R6=аллилкарбоксамид). Раствор защищенного гликозида соединения формулы (IV) (R3=ОН, R5=R7=аллилоксикарбонат, R6=аллилкарбоксамид) (140 мг, 0,156 ммоль) в хлористом метилене (20 мл) обрабатывают 15 мин в темноте при комнатной температуре N,N-диметилтриметилсилиламином (175 мл, 1,1 ммоль), триметилсилилацетатом (165 мл,1,1 ммоль) и тетракис(трифенилфосфин) палладием(0) (9 мг, 0,8 ммоль). Смесь разбавляютCH2Cl2 и промывают 2% раствором хлорида натрия. Органическую фазу высушивают над сульфатом натрия и упаривают в вакууме. В остаток добавляют водный раствор НСl(рН=3,75). Кислый водный раствор промываютAcOEt и высушивают при замораживании, получая 80 мг желаемого продукта (соединение формулы (I), R=R1=OH, R2=NH2). Выход 75%. 1m, 4 Н, ароматические). Следующие соединения формулы (I) были получены аналогичным способом, основанным на гликозилировании, снятии защиты и образовании конечного гидрохлорида. Пример 2. 7-O-[2,3,6-тридеокси-4-O-(2,3,6 тридеокси-3-аминоL-арабиногексопиранозил)L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=OH, R1=H,R2=NH2), конденсацией защищенного 4 деметоксидоксорубицинона (соединение формулы (II), R3=OR4, где R4=ацетил) с 2,3,6 003455(bd, 1H, Н-1'); 5.4 (s, 1H, OH-9); 8.0 и 8.3 (два m,4H, ароматические). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) и их фармацевтически приемлемые соли, гдеR2 представляет собой Н или ОН или NH2. 2. Соединения формулы (I) по п.1, включающие группу, состоящую изiv) 7-O-[2,3,6-тридеокси-4-O-(2,6-дидеоксиL-арабиногексопиранозил)L-ликсогексопиранозил]-4-деметоксидоксорубицинона гидрохлорид (R=R2=OH, R1=H). 3. Способ получения соединений общей формулы (I)NH2,или их фармацевтически приемлемых солей,включающий следующие стадии:i) конденсацию соединения формулы (II) где R3 представляет собой OR4 группу, в которой R4 является защитной группой для спиртового радикала, выбранной из ацетильной, диметилтретбутилсилильной или п-метоксифенилдифенилметильной групп, с соединением формулы (III)-ОН группу, R6 представляет собой Н или защищенную -ОН группу или защищенную NH2 группу; R7 представляет собой защищенную-ОН группу и Х представляет собой группу, вы 10 бранную из галогена или п-нитробензоилокси или тиофенильной группы, с получением соединений формулы (IV)ii) одну или более реакцию (реакции) удаления защитных групп с ОН и/или NH2 групп соединений формулы (IV) с получением соединений формулы (I), где R, R1, R2 являются такими, как определено выше;iii) превращение, при необходимости, соединений формулы (I) в их фармацевтически приемлемые соли. 4. Способ получения соединений формулы(I) по п.1, где R2 и R2 являются такими, как определено выше, и R представляет собой ОН группу, или их фармацевтически приемлемых солей, включающий следующие стадии:i) бромирование углерода в положении 14 соединений формулы (I) или их фармацевтически приемлемых солей, где R1 и R2 являются такими, как определено выше, и R представляет собой Н;ii) гидролиз образованных 14-бромпроизводных с получением соединений формулы (I),где R1 и R2 являются такими, как определено выше, и R представляет собой ОН группу. 5. Фармацевтическая композиция, содержащая в качестве активного ингредиента, по меньшей мере, соединение общей формулы (I) по любому из пп.1 или 2 или его фармацевтически приемлемую соль, объединенную с фармацевтически приемлемым разбавителем или носителем. 6. Применение соединений общей формулы (I) по любому из пп.1 или 2 или их фармацевтически приемлемых солей для получения фармацевтической композиции. 7. Применение по п.6, где фармацевтические композиции являются противораковым средством.
МПК / Метки
МПК: A61P 35/00, A61K 31/70, C07H 15/252
Метки: антрациклинов, содержащие, композиции, фармацевтические, получения, l-арабинодисахариды, способы
Код ссылки
<a href="https://eas.patents.su/6-3455-l-arabinodisaharidy-antraciklinov-sposoby-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">L-арабинодисахариды антрациклинов, способы их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Способ получения кальциевой соли зофеноприла
Следующий патент: Ингибитор эрозии зубов для кислых композиций
Случайный патент: Фармацевтическая композиция, включающая ингибитор sglt2, ингибитор дпп-iv и другой антидиабетический агент, и ее применение










