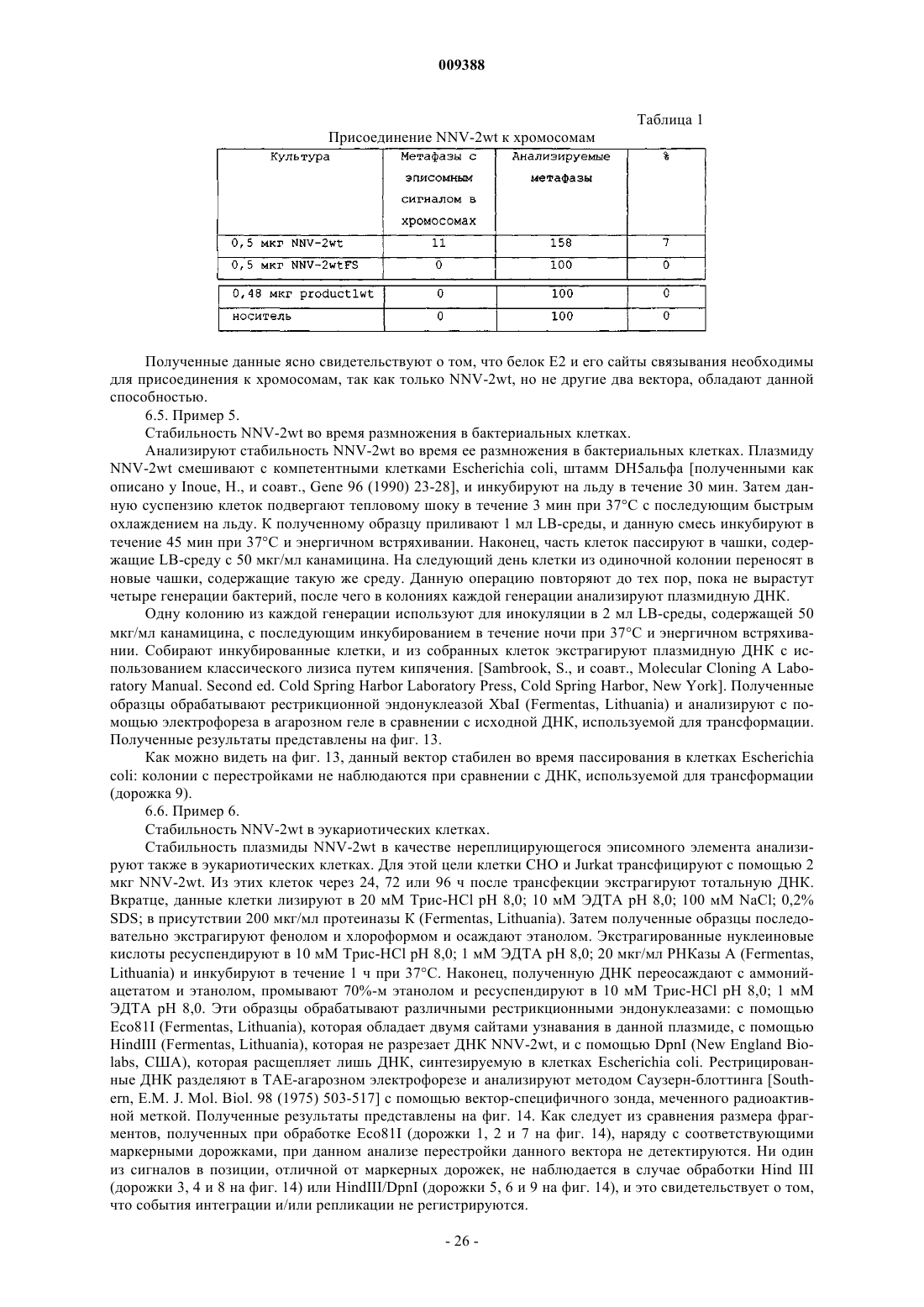
Векторы экспрессии и способы их применение
Номер патента: 9388
Опубликовано: 28.12.2007
Авторы: Тяхтинен Марья, Ранки Аннамари, Блажевиц Весна, Устав Эне, Крон Кай, Устав Март, Мянник Андрес, Тоотс Урве
Формула / Реферат
1. Экспрессирующий вектор, содержащий:
(a) последовательность ДНК, кодирующую заякоренный в ядре белок папилломавируса, оперативно связанную с гетерологичным промотором, причем указанный заякоренный в ядре белок содержит (i) ДНК-связывающий домен, который связывается со специфической ДНК-последовательностью, и (ii) функциональный домен, который связывается с ядерным компонентом, или его функциональный эквивалент;
(b) мультимеризованную ДНК-связывающую последовательность заякоренного в ядре белка,
где указанный вектор не содержит ориджина репликации, функционального в клетке млекопитающего.
2. Вектор по п.1, где указанный заякоренный в ядре белок представляет собой белок Е2 папилломавируса типа 1.
3. Вектор по п.1 или 2, где указанный ядерный компонент представляет собой митотический хроматин, ядерный матрикс, ядерный домен 10 (ND10) или ядерный домен POD.
4. Вектор по п.1 или 2, где указанный заякоренный в ядре белок представляет собой заякоренный на хроматине белок, а указанный функциональный домен связывает митотический хроматин.
5. Вектор по п.1 или 2, где указанный заякоренный в ядре белок содержит шарнирную или линкерную область.
6. Вектор по п.1 или 2, где указанный заякоренный в ядре белок представляет собой природный белок.
7. Вектор по п.1 или 2, где указанный заякоренный в ядре белок представляет собой искусственный белок.
8. Вектор по п.7, где указанный заякоренный в ядре белок представляет собой рекомбинантный белок, слитый белок или белок, полученный методами молекулярного моделирования.
9. Вектор по п.8, где указанный рекомбинантный белок, слитый белок или белок, полученный методами молекулярного моделирования, содержит любое сочетание ДНК-связывающего домена, который связывается с указанной специфической ДНК-последовательностью, и функционального домена, который связывается с ядерным компонентом, где указанный функциональный домен, который связывается с ядерным компонентом, представляет собой домен папилломавируса.
10. Вектор по п.9, где указанный рекомбинантный белок, слитый белок или белок, полученный методами молекулярного моделирования, содержит любое сочетание ДНК-связывающего домена, который связывается с указанной специфической ДНК-последовательностью, и функционального домена, который связывается с ядерным компонентом, где указанный функциональный домен, который связывается с ядерным компонентом, представляет собой домен белка Е2 папилломавируса типа 1 крупного рогатого скота.
11. Вектор по п.1 или 2, где указанный вектор дополнительно содержит одну или более экспрессирующих кассет представляющей интерес ДНК-последовательности.
12. Вектор по п.11, где указанная представляющая интерес ДНК-последовательность представляет собой ДНК-последовательность гена, полученного из инфекционного патогена.
13. Вектор по п.12, где указанный инфекционный патоген представляет собой вирус.
14. Вектор по п.13, где указанный вирус выбран из группы, состоящей из вируса иммунодефицита человека (ВИЧ), вируса простого герпеса (HSV), вируса гепатита С, вируса гриппа и энтеровируса.
15. Вектор по п.11, где указанная представляющая интерес ДНК-последовательность представляет собой ДНК-последовательность гена, полученного из бактерии.
16. Вектор по п.15, где указанная бактерия выбрана из группы, состоящей из Chlamydia trachomatis, Mycobacterium tuberculosis и Mycoplasma pneumonia.
17. Вектор по п.15, где указанная бактерия представляет собой Salmonella.
18. Вектор по п.11, где указанная представляющая интерес ДНК-последовательность представляет собой ДНК-последовательность гена, полученного из патогенного гриба.
19. Вектор по п.18, где указанный патогенный гриб представляет собой Candida albigans.
20. Вектор по п.11, где указанная представляющая интерес ДНК-последовательность имеет ВИЧ-происхождение.
21. Вектор по п.20, где указанная представляющая интерес ДНК-последовательность кодирует неструктурный регуляторный белок ВИЧ.
22. Вектор по п.21, где указанный неструктурный регуляторный белок ВИЧ представляет собой Nef, Tat или Rev.
23. Вектор по п.22, где указанный неструктурный регуляторный белок ВИЧ представляет собой Nef.
24. Вектор по п.20, где указанная представляющая интерес ДНК-последовательность кодирует структурный белок ВИЧ.
25. Вектор по п.24, где указанная представляющая интерес ДНК-последовательность соответствует гену, кодирующему gp120/gp160 ВИЧ.
26. Вектор по п.11, где первая указанная экспрессирующая кассета содержит представляющую интерес ДНК-последовательность, которая кодирует Nef, Tat или Rev, и где вторая указанная экспрессирующая кассета содержит представляющую интерес ДНК-последовательность, которая кодирует Nef, Tat или Rev.
27. Вектор по п.11, где первая указанная экспрессирующая кассета содержит представляющую интерес ДНК-последовательность, которая кодирует Nef, Tat или Rev, и где вторая указанная экспрессирующая кассета содержит представляющую интерес ДНК-последовательность, которая кодирует структурный белок ВИЧ.
28. Вектор по п.11, где представляющая интерес ДНК-последовательность кодирует белок, ассоциированный со злокачественной опухолью.
29. Вектор по п.11, где представляющая интерес ДНК-последовательность кодирует белок, ассоциированный с созреванием иммуннокомпетентности, с регуляцией иммунных ответов или с регуляцией аутоиммунных ответов.
30. Вектор по п.29, где указанный белок представляет собой APECED.
31. Вектор по п.11, где представляющая интерес ДНК-последовательность соответствует гену Aire.
32. Вектор по п.11, где представляющая интерес ДНК-последовательность кодирует белок, который является дефектным по любому моногенному наследственному заболеванию.
33. Вектор по п.11, где представляющая интерес ДНК-последовательность кодирует макромолекулярное лекарственное средство.
34. Вектор по п.11, где представляющая интерес ДНК-последовательность кодирует цитокин.
35. Вектор по п.34, где указанный цитокин представляет собой интерлейкин, выбранный из группы, состоящей из IL1, IL2, IL4, IL6 и IL12.
36. Вектор по п.34, где представляющая интерес ДНК-последовательность кодирует интерферон.
37. Вектор по п.11, где указанная представляющая интерес ДНК-последовательность кодирует биологически активную молекулу РНК.
38. Вектор по п.37, где указанная биологически активная молекула РНК выбрана из группы, состоящей из ингибирующей антисмысловой и рибозимной молекул.
39. Вектор по п.38, где указанные ингибирующая антисмысловая или рибозимная молекулы ингибируют функцию онкогена.
40. Применение вектора по любому из пп.1-39 в качестве лекарственного средства, действие которого зависит от свойств продукта, кодируемого представляющей интерес ДНК-последовательностью.
41. Применение вектора по любому из пп.1-39 в качестве вектора-носителя для последовательности ДНК, кодирующей белок или пептид инфекционного агента, терапевтического агента, макромолекулярного лекарственного средства или любое их сочетание.
42. Применение вектора по любому из пп.1-39 в качестве лекарственного средства для лечения наследственных или приобретенных генетических дефектов.
43. Применение вектора по любому из пп.1-39 в качестве терапевтической ДНК-вакцины против инфекционного агента.
44. Применение вектора по любому из пп.1-39 для получения белка, кодируемого указанной представляющей интерес ДНК-последовательностью в клетке или в организме.
45. Применение вектора по любому из пп.1-39 для получения макромолекулярного лекарственного средства in vivo.
46. Применение вектора по любому из пп.1-10 для получения фармацевтической композиции для обеспечения субъекта представляющим интерес белком, причем указанный вектор (i) дополнительно содержит ДНК-последовательность, кодирующую представляющий интерес белок, для обеспечения им субъекта, причем указанная ДНК-последовательность оперативно связана со вторым промотором, и (ii) не кодирует белок Е1 папилломавируса крупного рогатого скота.
47. Применение вектора по любому шч пп.1-10 для получения фармацевтической композиции для индукции иммунного ответа у субъекта на представляющий интерес белок, причем указанный вектор (i) дополнительно содержит ДНК-последовательность, кодирующую представляющий интерес белок, для обеспечения им субъекта, где указанная ДНК-последовательность оперативно связана со вторым промотором, и (ii) не кодирует белок Е1 папилломавируса крупного рогатого скота.
48. Применение вектора по любому из пп.1-11 для получения фармацевтической композиции для лечения инфекционного заболевания у субъекта, нуждающегося в указанном лечении, где указанная представляющая интерес ДНК-последовательность кодирует белок, содержащий иммуногенный эпитоп инфекционного агента.
49. Применение вектора по любому из пп.1-11 для получения фармацевтической композиции для лечения наследственного или приобретенного генетического дефекта у субъекта, нуждающегося в указанном лечении, где указанная представляющая интерес ДНК-последовательность кодирует белок, который действует на указанный наследственный или приобретенный генетический дефект.
50. Применение вектора по любому из пп.1-11 для получения фармацевтической композиции для обеспечения экспрессии представляющей интерес ДНК-последовательности у субъекта.
51. Способ получения вектора по любому из пп.1-39, предусматривающий:
(a) культивирование клетки-хозяина, содержащей указанный вектор;
(b) выделение вектора.
52. Способ по п.51, дополнительно предусматривающий перед стадией (а) стадию трансформации указанной клетки-хозяина указанным вектором.
53. Способ по п.51, где указанная клетка-хозяин представляет собой прокариотическую клетку.
54. Способ по п.52, где указанная клетка-хозяин представляет собой Escherichia coli.
55. Клетка-хозяин, отличающаяся тем, что содержит вектор по любому из пп.1-39.
56. Клетка-хозяин, отличающаяся тем, что содержит вектор по п.11.
57. Клетка-хозяин по п.55 или 56, представляющая собой бактериальную клетку.
58. Клетка-хозяин по п.55 или 56, представляющая собой клетку млекопитающего.
59. Вектор-носитель, содержащий вектор по любому из пп.1-39.
60. Фармацевтическая композиция, содержащая вектор по любому из пп.1-39 и фармацевтически приемлемый носитель.
61. ДНК-вакцина, содержащая вектор по любому из пп.1-39.
62. ДНК-вакцина, содержащая вектор по п.12.
63. ДНК-вакцина, содержащая вектор по п.13.
64. ДНК-вакцина, содержащая вектор по п.15.
65. ДНК-вакцина, содержащая вектор по п.18.
66. Агент для геннной терапии, содержащий вектор по любому из пп.1-39.
67. Способ получения ДНК-вакцины по любому из пп.61-65, предусматривающий объединение указанного вектора с приемлемым фармацевтическим носителем.
Текст
009388 1. Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к новым векторам, к ДНК-вакцинам и генотерапевтическим агентам, содержащим указанные векторы, к способам получения этих векторов, а также ДНК-вакцин и генотерапевтических агентов, содержащих указанные векторы, и к терапевтическому использованию указанных векторов. В частности, настоящее изобретение относится к новым векторам, содержащим (а) экспрессирующую кассету гена заякоренного в ядре белка, который содержит (i) ДНК-связывающий домен, способный связываться со специфической ДНК-последовательностью, и (ii) функциональный домен, способный связываться с ядерным компонентом, а также (b) мультимеризованную ДНК, образующую сайт связывания для заякоренного в ядре белка, и, необязательно, (с) одну или несколько экспрессирующих кассет представляющей интерес ДНК-последовательности. В частности, настоящее изобретение относится к векторам, в которых отсутствует ориджин репликации вируса папилломы. Кроме того,настоящее изобретение относится к векторам, у которых отсутствует функциональный ориджин репликации для клетки млекопитающего. Еще настоящее изобретение относится к способам экспрессирования у пациента представляющей интерес ДНК-последовательности. 2. Предпосылки изобретения Перенос аутологичных или гетерологичных генов в организм животного или человека с помощью соответствующих векторов осуществляют с использованием методики, обладающей огромными возможностями в лечении заболеваний с генетической основой, либо для предупреждения, либо лечения инфекционных заболеваний. Было создано и протестировано на животных и больных людях несколько типов вирусных и невирусных векторов по доставке гена/генов, дефектных вследствие мутаций и поэтому не функционирующих. Примеры таких векторов включают в себя аденовирусные векторы, векторы вируса герпеса, ретровирусные векторы, лентивирусные векторы и векторы на основе аденоассоциированного вируса. Вакцинация оказалась высокоэффективным и экономичным способом для предупреждения заболевания, вызываемого инфекционными агентами. С этого времени разработано и принято для повседневного использования введение вируса коровьей оспы в виде ослабленной вакцины против вируса натуральной оспы (Variola), вакцин против множества патогенов человека. В настоящее время вирус оспы человека ликвидирован благодаря вакцинациям, и то же самое ожидается в отношении полиовируса. Некоторые детские болезни, такие как коклюш, дифтерия и столбняк, можно эффективно предупреждать с помощью вакцинаций. В большинстве случаев наиболее успешными вирусными вакцинами являются живые авирулентные мутанты вирусов, вызывающих болезнь. Залог успеха данного подхода заключается в том, что живой вирус нацелен на одни и те же органы, один и тот же тип и сходную численность клеток, и тем самым,при размножении у данного реципиента, порождает продолжительный иммунный ответ, не вызывая данного заболевания или же вызывая лишь слабое заболевание. В сущности, живая аттенуированная вакцина осуществляет бессимптомное инфицирование, своего рода естественную иммунизацию. В результате должен индуцироваться полный иммунный ответ, включая гуморальный, клеточный и врожденный ответы и обеспечивая продолжительную, а иногда и пожизненную иммунную защиту против данного патогена. Несмотря на то что живые аттенуированные вакцины являются наиболее сильными, они могут вызывать пагубные побочные эффекты. Так, аттенуированная вирусная вакцина может ревертировать в вирулентный штамм или в случаях, когда данный аттенуированный вирус является непатогенным для взрослых, он все же может вызывать заболевание у детей младшего возраста или в ослабленном организме. Это верно в отношении вирусов, вызывающих хронические инфекции, такие как вирус иммунодефицита человека типа 1 и типа 2. Менее вероятно, что вакцины, составленные из вирусного и бактериального белков или иммуногенных пептидов, вызовут нежелательные побочные эффекты, но они не могут быть столь сильными, как указанные живые вакцины. Это, в частности, относится к вакцинам против микробов, таким как некоторые вирусы и внутриклеточные бактерии, вызывающим хронические инфекции. Сила и тип иммунного ответа зависит, тем не менее, от того, каким образом процессируются вирусные белки и как они представлены в иммунной системе антигенпредставляющими клетками (APCs), такими как макрофаги и дендритные клетки. Белковые и пептидные антигены, перемещенные с помощью АРС посредством эндоцитоза, процессируются в небольшие иммуногенные пептиды через эндосомный путь и представляются Т-лимфоцитам (Т-клетки) с помощью антигенов МНС (главный комплекс гистосовместимости) класса II [у человека - HLA (антигены лейкоцитов человека) класса II]. Напротив, белки,синтезируемые в АРС de novo или в вероятных клетках-мишенях для иммунного ответа, будут процессированы через цитоплазматический путь и представлены в Т-клетках антигенами МНС класса I (у человека HLA класс I). Как правило, представление иммуногенных пептидов с помощью антигенов класса II ведет к активации хелперных/индукторных Т-клеток, что, в свою очередь, приводит к активации Вклеток и к антительному ответу. В противоположность этому, представление с помощью МНС класса I благоприятствует индукции цитотоксических Т-лимфоцитов (CTL), которые способны распознавать и разрушать инфицированные вирусом клетки.-1 009388 В начале 1990 г. в практику был введен способ, имитирующий процессинг и представление антигена, который обычно осуществляется с помощью живых аттенуированных вакцин [Ulmer, J.В. и соавт.,Science 259 (1993) 1745-1749]. Было показано, что инъекция эукариотических экспрессирующих векторов в виде кольцевой ДНК в определенную мышцу индуцирует включение данной ДНК в мышечные (и,вероятно, другие) клетки и способна индуцировать экспрессию данного представляющего интерес гена и порождать иммунный ответ, в частности, клеточный иммунный ответ в виде CTL на белок, кодируемый данным вводимым геном. Со времени этого наблюдения иммунизация ДНК становится стандартным способом индукции иммунных ответов на чужеродные белки у экспериментальных животных и в исследованиях на человеке для нескольких ДНК-вакцин, создаваемых в настоящее время. Как правило, ДНК-векторы, используемые в этих вакцинных исследованиях, содержат клонирующий сайт для соответствующего гена, сильный вирусный промотор, такой как предранний промоторCMV-вируса, для осуществления экспрессии соответствующего гена, области полиаденилирования, а также гена устойчивости к антибиотику и бактериального ориджина репликации для размножения ДНКвектора (плазмиды) в бактериальных клетках. С помощью вышеописанных векторов можно получить детектируемый уровень экспрессии соответствующего гена после введения данного вектора экспериментальным животным или человеку либо путем прямой инъекции в мышцу или в кожу с помощью метода бомбардировки частицами, либо путем нанесения данного вектора в растворе непосредственно на слизистые мембраны. Однако экспрессия, получаемая с помощью этих векторов, непродолжительна: эти векторы обычно постепенно исчезают из трансфицированных клеток и не переносятся в дочерние клетки в делящейся популяции клеток. Кратковременная экспрессия соответствующего гена и ограниченная численность клеток-мишеней являются,по-видимому, основными причинами того, что у пациентов, иммунизированных вышеописанными ДНКвекторами, наблюдают лишь краткие иммунные ответы. Поэтому, например, Boyer и соавт. наблюдали у больных людей, которых иммунизировали несколько раз вектором, аналогичным вышеописанным[Boyer, J.D., J Infect Dis 181 (2000) 476-483], лишь временные иммунные ответы на Env- и Rev-белки ВИЧ-1. Отмечается возрастающий интерес к созданию новых продуктов, пригодных для генной терапии и ДНК-вакцинации. К примеру, предполагается, что векторы вируса папилломы, несущие экспрессирующие кассеты для соответствующего гена, являются пригодными кандидатами. В последнее время идентифицировано более 70 субтипов вирусов папилломы человека (HPV) и множество различных вирусов папилломы животных [zur Hausen, H. and de Villiers E., Annu. Rev. Microbiol. 48 (1994) 427-447; Bernard, H., и соавт., Curr. Top Microbiol. Immunol. 186 (1994) 33-54]. Все папилломные вирусы обладают сходной геномной организацией, и расстановка всех трансляционных открытых рамок считывания (ORF) весьма консервативна. Вирусы папилломы поражают сквамозные клетки эпителия кожи или слизистой в разных участках тела и вызывают образование доброкачественных опухолей, которые в некоторых случаях могут подвергаться малигнизации. Геном вируса папилломы реплицируется и поддерживается в инфицированных клетках в виде мультикопийных ядерных плазмид. Репликация, эписомная сохранность, экспрессия поздних генов и сборка вирусов тесно связаны с дифференцировкой эпителиальной ткани: репликация эписомной ДНК вируса папилломы осуществляется в период начального усиления репликации, а вторая,т.е. латентная, и третья, т.е. вегетативная, репликации происходят в дифференцирующемся эпителии[Howley, P.M.; Papillomavirinae: the viruses and their replication (Подсемейство папилломавирусов: вирусы и их репликация). В Virology, Fields, B.C., Knipe, D.M., Howley, P.M., Eds., Lippincott-Raven Publishers,Philadelphia, USA, 1996, 2.Edition, p. 2045-2076]. Установлено, что два вирусных фактора, кодируемые открытыми рамками считывания Е 1 и Е 2, необходимы и достаточны для инициации в клетках репликации ДНК с ориджина вируса папилломыUstav, Е., и соавт., Proc. Natl. Acad. Sci. USA 90 (1993) 898-902]. Функциональные ориджины инициации репликации ДНК были определены для BPV1 [Ustav, M., и соавт., EMBO J. 10 (1991) 4321-4329], HPV1a [Gopalakrishnan, V. and Khan, S., выше], HPB11 [Russel, J.,Botchan, M., J. Virol. 69 (1995) 651-660], HPV18 [Sverdrup, F. and Khan, S., J. Virol. 69 (1995) 1319-1323;Sverdrup, F. and Khan, S., J. Virol. 68 (1994) 505-509] и многих других. Характерно, что все эти ориджинфрагменты обладают высоким содержанием А/Т и они содержат несколько перекрывающихся индивидуальных последовательностей, узнающих последовательности E1-белка, которые совместно составляют сайт связывания E1 [Ustav, М., и соавт., EMBO J. 10 (1991) 4321-4329; Holt, S., и соавт., J. Virol. 68 (1994) 1094-1102; Holt, S. and Wilson, V., J. Virol. 69 (1995) 6525-3652; Sedman, Т., и соавт., J. Virol. 71 (1997) 2887-2996]. Кроме того, эти функциональные ориджин-фрагменты содержат сайт связывания Е 2, который в большинстве случаев существенен для инициации репликации ДНК in vivo (Ustav, Е., и соавт.,выше). Белок Е 2 облегчает первую стадию узнавания ориджина с помощью Е 1. После начального связывания мономерного Е 1 с ориджином начинается мультимеризация Е 1. Это приводит к образованию комплекса с активностью плавления ori. Было высказано предположение, что Е 2 не влияет на последующие стадии инициации репликации ДНК [Lusky, M. и соавт., Proc. Natl. Acad. Sci. USA 91 (1994) 8895-8899].OPC E2 BPV1 кодирует три белка, которые образуются в результате использования селективного промотора и альтернативного сплайсинга мРНК [Lambert, P., и соавт., Annu. Rev. Genet. 22 (1988) 235258]. Все эти белки могут образовывать друг с другом гомо- и гетеродимеры и специфически связываться с прерывистой палиндромной последовательностью 5'-ACCNNNNNNGGT-3' в 12 п.н. [Androphy, E., и соавт., Nature 325 (1987) 70-739]. В геноме BPV1 существует 17 сайтов связывания Е 2, а в геномах HPV - до четырех сайтов, которые играют ключевую роль в инициации репликации вирусной ДНК (Ustav, E., и соавт., выше) и в регуляции генной экспрессии вируса (Howley, P.M., Papillomavirinae: the viruses and their replication, in Virology,Fields, B.C., Knipe, D.M., Howley, P.M., Eds., Lippincott-Raven Publishers, Philadelphia, USA, 1996,2.Edition, p. 2045-2076). Структурный и мутационный анализы обнаруживают три различных функциональных домена в полноразмерном Е 2-белке. N-концевая часть (остатки 1-210) представляет собой домен активации транскрипции и репликации. Он следует за неструктурированной шарнирной областью(1989) 510-514]. На основе рентгеновских кристаллографических данных, ДНК-связывающий димеризационный домен Е 2 обладает структурой парно-симметричного восьминитевого антипараллельного цилиндра, составленного из двух идентичных "полуцилиндрических" субъединиц [Hegde, R., и соавт.,Nature 359 (1992) 505-512; Hegde, R., J. Nucl. Med. 36 (6 suppl) (1995) 25S-27S]. Функциональные элементы трансактивационного домена Е 2 обладают очень высокой структурной целостностью, что подтверждается с помощью мутационного анализа [Abroi, А., и соавт., J. Virol. 70 (1996) 6169-6179; Brokaw, J., и соавт., J Virol 71 (1996) 23-29; Grossel, M., и соавт., J. Virol. 70 (1996) 7264-7269; Ferguson, M. andBotchan, M., J. Virol. 70 (1996) 4193-4199] и рентгеновской кристаллографии [Harris, S., and Botchan,M.R., Science 284 (1999) 1673-1677 и Antson, А. и соавт., Nature 403 (2000) 805-809]. Кроме того, рентгеновская кристаллография свидетельствует о том, что N-концевой домен белка Е 2 образует димерную структуру, в которой Arg 37 играет важную роль в образования димера (Antson, А., и соавт., выше). Как было описано раньше, белок Е 2 вируса папилломы типа 1 крупного рогатого скота в трансконфигурации и его многочисленные сайты связывания в цис-конфигурации, необходимы и достаточны для присоединения хроматина эписомных генетических элементов. Предполагалось, что это явление обеспечивает механизм расчленения вирусного генома в процессе вирусного инфицирования в делящихся клетках [Ilves, I., и соавт., J. Virol. 73 (1999) 4404-4412]. Ни один из папилломных векторов или иных векторов, описанных до сих пор, не удовлетворяет критериям и требованиям, предъявляемым к оптимальной вакцине, которые являются теми же для ДНКвакцин и для традиционных вакцин. (Следует отметить, что эти требования предпочтительны, но не обязательны для использования в отношении вакцины.) Во-первых, оптимальная вакцина должна создавать защитный иммунитет с минимальными неблагоприятными последствиями. Поэтому такая вакцина должна быть лишена компонентов, которые являются токсичными и/или вызывают у реципиента симптомы определенного заболевания. Во-вторых, оптимальная вакцина должна индуцировать иммунный ответ, специфичный в отношении патогена, т.е. она должна вызывать сильный и измеряемый иммунный ответ на требуемый патоген, исключая иммунный ответ на другие компоненты данной вакцины. Эти два требования подразумевают, что вектор, используемый в виде ДНК-вакцины, в оптимуме должен экспрессировать только требуемый ген(ы) и в оптимуме не должен реплицироваться у хозяина или содержать какую-либо последовательность, гомологичную последовательностям данного реципиента, поскольку нуклеотидные последовательности, которые гомологичны в данном векторе и в геноме данного хозяина, могут обусловить интеграцию данного вектора в геном данного хозяина. В-третьих, оптимальная вакцина должна индуцировать надлежащий тип иммунного ответа; т.е. он должен порождать и гуморальный, и клеточный иммунные ответы, с тем, чтобы воздействовать на внутриклеточный и внеклеточный патоген. Наконец, оптимальная вакцина должна быть стабильной, т.е. должна сохранять свою эффективность в течение достаточно длительного времени в организме, чтобы вызвать иммунный ответ на состав вакцины при использовании в различных обстоятельствах во время хранения и приготовления. Кроме того, вакцины должны обладать умеренной ценой. Сверх того, путь и способ инокуляции существенны для оптимизации ДНК-иммунизации. При создании ДНК-вакцины достижение устойчивой экспрессии нужного гена иногда представляет собой большую проблему. Поэтому в прототипе было обращено внимание на поддержание функции или стойкости вектора в клетке реципиента, но часто ценой безопасности. Например, One, Y., и соавт. [Hum.Gene Ther. 6(3) (1995) 325-333] обнаружили вектор вируса папилломы, способный к стабильной высокоуровневой генной экспрессии, который предполагалось использовать в генной терапии. Из указанного вектора удалены трансформирующие ранние гены Е 5, Е 6 и Е 7, но он все еще содержит нуклеотидные последовательности, кодирующие другие гены вируса папилломы, такие как гены Е 1 и Е 2, которые участвуют в репликации данного вируса. Поэтому данный вектор продуцирует несколько дополнительных папилломных белков, которые могут вызывать нежелательные ответные иммунные реакции и которые создают риск интеграции данного вектора в данного реципиента. Кроме того, данный вектор является-3 009388 реплицируемым, поскольку он содержит ген Е 1. И еще, он обладает большим размером, и по этой причине в процессе получения подвергается бактериальной модификации. В международной патентной заявке РСТ/ЕЕ 96/00004 (WO 97/24451) раскрыты векторы, способные к длительному сохранению в хозяйской клетке, и способы использования таких векторов для осуществления продолжительного синтеза соответствующего генного продукта в хозяйской клетке млекопитающего, которая экспрессирует Е 1 и Е 2. Эти векторы содержат минимальный ориджин (МО) репликации вируса папилломы, элемент сохранения минихромосомы (ММЕ) вируса папилломы и ген, кодирующий указанный генный продукт, МО и ММЕ, состоящие из ДНК-последовательности, отличающейся от естественной последовательности вируса папилломы, и в некоторых вариантах осуществления изобретения гена Е 1. Кроме того, векторы, содержащие ММЕ и практически состоящие из десяти сайтов связывания Е 2, описаны в некоторых примерах. Эти векторы требуют для экспрессии присутствия белка Е 1 либо у хозяина, либо в векторе. Это наделяет данные векторы репликационной функцией. Эти векторы экспрессируют также белок Е 1, в дополнение к представляющему интерес гену и белку Е 2, и содержат последовательности, такие как кроличьи -глобиновые последовательности, которые обладают частичной гомологией с последовательностями человека, вызывающими очень большой риск интеграции в геном человека, что уменьшает возможности этих векторов в качестве ДНК-вакцин. Кроме того, данные векторы нестабильны из-за их размера (около 15 т.п.н.): на стадии получения в бактериальной клетке механизм бактериальной репликации стремится модифицировать данный вектор в результате случайного разрезания вектора, что ведет к неудовлетворительной экспрессии продуктов, в том числе и продуктов, вообще не содержащих соответствующего гена. Далее в международной патентной заявке РСТ/ЕЕ 96/00004 (WO 97/24451) показано, что Е 1 и Е 2 являются вирусными белками, необходимыми лишь для длительной эписомной репликации данных векторов. Кроме того, функция поддержания генома BPV1 связана с присутствием минимального ori (МО),который, как установлено, необходим, хотя и недостаточен, для длительного выживания или стабильной сохранности векторов данных клеток. Кроме того, цис-элементы, т.е. элементы, поддерживающие минихромосомы BPV1, как установлено, необходимы для стабильной репликации BPV1. В частности, мультимерные сайты связывания Е 2 (E2BS), как установлено, необходимы для стабильного сохранения данных векторов. Существует большая потребность в усовершенствованных новых векторах, которые могли бы быть пригодны в качестве ДНК-вакцин. Поэтому цель настоящего изобретения заключается в создании новых векторов, которые способны длительно сохраняться в большом и во все большем количестве различных клеток организма хозяина и тем самым способствовать созданию стабильной экспрессии требуемого антигена(ов). Другая цель настоящего изобретения заключается в создании новых векторов, сохраняющихся в течение длительного периода времени в клетках, которые изначально получают вектор и передают его в дочерние клетки после митотического клеточного деления. Еще одна цель настоящего изобретения заключается в разработке новых векторов, которые экспрессируют, помимо соответствующих гена или генов, предпочтительно лишь ген, необходимый для продолжительного сохранения в данных реципиентных клетках и, тем самым, исключают компоненты,которые токсичны или вызывают симптомы заболевания у данного реципиента. Следующая цель настоящего изобретения заключается в создании новых векторов, которые имитируют аттенуированные живые вирусные вакцины, особенно их функцию размножения в данном организме, не вызывая каких-либо существенных признаков заболевания и экспрессию нежелательных белков, что может вызвать неблагоприятные реакции у хозяина, инъецированного данной ДНК-вакциной. Еще одна цель настоящего изобретения заключается в создании новых векторов, которые не реплицируются у данного реципиента. Следующая цель настоящего изобретения заключается в создании новых векторов, которые индуцируют гуморальные и клеточные иммунные ответные реакции при использовании в качестве ДНКвакцин. Еще одна цель настоящего изобретения заключается в создании новых векторов, пригодных для их масштабного получения в бактериальной клетке. Еще одна цель настоящего изобретения заключается в создании новых векторов, которые неспецифичны по хозяину и поэтому могут производиться в разных бактериальных клетках. Дополнительная цель настоящего изобретения заключается в создании новых векторов, которые пригодны в качестве векторов-носителей соответствующих гена или генов. Еще одна дополнительная цель заключается в создании новых векторов, которые пригодны для генной терапии и в качестве агентов генной терапии, а также для производства макромолекулярных лекарственных средств in vivo. 3. Краткое изложение существа изобретения В настоящем изобретении раскрыты новые векторы, которые удовлетворяют требованиям к векторам-носителям соответствующих гена или генов, или оптимального вектора для ДНК-вакцинации, и которые предпочтительно исключают отрицательные и побочные эффекты векторов прототипа.-4 009388 Настоящее изобретение основывается на удивительном открытии того, что в пролиферирующих клетках распространен вектор (плазмида), несущий (i) экспрессирующую кассету ДНКпоследовательности, кодирующей заякоренный в ядре белок, и (ii) множество копий сайтов связывания с высоким сродством к указанному заякоренному в ядре белку. В итоге, численность клеток, несущих вектор, повышается даже в отсутствие репликации данного вектора. Когда данный вектор дополнительно несет соответствующие ген или гены, численность таких клеток, которые экспрессируют соответствующие ген или гены, также увеличивается без репликации данного вектора. Следовательно, вектор согласно изобретению не содержит ориджин репликации вируса папилломы. В предпочтительном варианте осуществления настоящего изобретения вектор настоящего изобретения не содержит ориджин репликации,который функционирует в клетке млекопитающего. Соответственно, в настоящем изобретении раскрыты новые векторы, пригодные в качестве векторов-переносчиков соответствующих гена или генов, для ДНК-вакцинации и генной терапии, а также в качестве агентов генной терапии. В конкретном варианте осуществления настоящего изобретения указанные векторы способны распространяться и, при необходимости, в течение длительного времени экспрессировать соответствующие ген или гены в возрастающем числе клеток. Векторы согласно изобретению предпочтительно экспрессируют только заякоренный в ядре белок, а также, если требуется, соответствующие ген или гены, и факультативно селективный маркер. Однако они предпочтительно не содержат каких-либо повторяющихся, онкогенно трансформирующих или потенциально токсичных последовательностей, исключая, таким образом, серьезный недостаток прежде раскрытых векторов или предложенных для применения в качестве ДНК-вакцин, т.е. гиперчувствительные реакции на другие вирусные компоненты. В некоторых вариантах осуществления настоящего изобретения это достигается путем низкоуровневой экспрессии в клетках заякоренного в ядре белка. Вместе с тем, векторы согласно изобретению индуцируют гуморальную и клеточную иммунные реакции, в случае, когда соответствующие ген или гены включены в данный вектор. Векторы согласно изобретению обладают преимуществом и при использовании in vitro (например,для уровня производства) и in vivo (например, вакцинации). Настоящее изобретение относится к теме, изложенной в прилагаемой формуле изобретения. Настоящее изобретение относится к экспрессирующим векторам, включающим в себя (а) ДНКпоследовательность, кодирующую заякоренный в ядре белок, присоединенный путем сшивки к гетерологичному промотору, причем указанный закрепленный в ядре белок включает (i) ДНК-связывающий домен, который связывается со специфической ДНК-последовательностью, и (ii) функциональный домен, который связывается с ядерным компонентом или с его функциональным эквивалентом; и (b) мультимеризованную ДНК-последовательность, образующую сайт связывания для заякоренного в ядре белка,в которой указанный вектор не содержит ориджин репликации папилломавируса. В предпочтительном варианте осуществления согласно изобретению вектор согласно изобретению не содержит в клетке млекопитающего функциональный ориджин репликации. В некоторых вариантах осуществления настоящего изобретения ядерный компонент представляет собой митотический хроматин, ядерный матрикс, ядерный домен 10 (ND10) или ядерный домен POD. В некоторых конкретных вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой заякоренный на хроматине белок, а указанный функциональный домен связывает митотический хроматин. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок содержит шарнирную или линкерную область. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой природный белок эукариотического, прокариотического или вирусного происхождения. В некоторых конкретных вариантах осуществления настоящего изобретения данный природный белок имеет вирусное происхождение. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой природный белок эукариотического происхождения. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой белок папилломавируса или белок вируса Эпштейна-Барр. В конкретных вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой белок Е 2 папилломавируса типа 1 крупного рогатого скота или ядерный антиген 1 вируса Эпштейна-Барр. В конкретных вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой белок Е 2 папилломавируса типа 1 крупного рогатого скота. В конкретных вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой белок из группы негистоновых хромосомных белков с высокой электрофоретической подвижностью. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок не является природным белком. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок пред-5 009388 ставляет собой рекомбинантный белок, слитый белок или белок, полученный методами молекулярного моделирования. В конкретных вариантах осуществления настоящего изобретения данный рекомбинантный белок,слитый белок или белок, полученный с помощью методов молекулярного моделирования, содержит любое сочетание ДНК-связывающего домена, который связывается с указанной специфичной ДНКпоследовательностью, и функционального домена, который связывается с ядерным компонентом, где указанный функциональный домен, который связывается с ядерным компонентом, представляет собой белок папилломавируса, вируса Эпштейна-Барр или белок из группы негистоновых хромосомных белков с высокой электрофоретической подвижностью. В некоторых конкретных вариантах осуществления настоящего изобретения указанный рекомбинантный белок, слитый белок или белок, полученный с помощью методов молекулярного моделирования, содержит любое сочетание ДНК-связывающего домена, который связывается с указанной специфичной ДНК-последовательностью, и функционального домена, который связывается с ядерным компонентом, где указанный функциональный домен, который связывается с ядерным компонентом, представляет собой белок Е 2 папилломавируса типа 1 крупного рогатого скота, ядерный антиген 1 вируса Эпштейна-Барр или белок из группы негистоновых хромосомных белков с высокой электрофоретической подвижностью. В некоторых вариантах осуществления настоящего изобретения данный вектор дополнительно включает в себя одну или несколько экспрессирующих кассет соответствующей ДНКпоследовательности. В некоторых вариантах осуществления настоящего изобретения соответствующая ДНКпоследовательность представляет собой последовательность инфекционного патогена. В некоторых вариантах осуществления настоящего изобретения данный инфекционный патоген представляет собой вирус. В некоторых конкретных вариантах осуществления настоящего изобретения данный вирус выбран из группы, состоящей из вируса иммунодефицита человека (ВИЧ), вируса простого герпеса (HSV), вируса гепатита С, вируса гриппа и энтеровируса. В некоторых вариантах осуществления настоящего изобретения соответствующая ДНКпоследовательность представляет собой бактерию. В некоторых вариантах осуществления настоящего изобретения данная бактерия выбрана из группы, состоящей из Chlamydia trachomatis, Mycobacteriumtuberculosis и Mycoplasma pneumonia. В конкретном варианте осуществления настоящего изобретения данная бактерия представляет собой Salmonella. В некоторых вариантах осуществления настоящего изобретения соответствующая ДНКпоследовательность представляет собой последовательность патогенного гриба. В некоторых вариантах осуществления настоящего изобретения данный патогенный гриб представляет собой Candida albigans. В некоторых вариантах осуществления настоящего изобретения источник соответствующей ДНКпоследовательности происходит из ВИЧ. В конкретных вариантах осуществления настоящего изобретения соответствующая ДНКпоследовательность кодирует неструктурный регуляторный белок ВИЧ. В более конкретных вариантах осуществления настоящего изобретения данный неструктурный регуляторный белок ВИЧ представляет собой Nef, Tat и/или Rev. В конкретном варианте осуществления настоящего изобретения неструктурный регуляторный белок ВИЧ представляет собой Nef. В некоторых вариантах осуществления настоящего изобретения соответствующая ДНКпоследовательность кодирует структурный белок ВИЧ. В конкретном варианте осуществления настоящего изобретения соответствующая ДНК-последовательность представляет собой ген, кодирующийgp120/gp160 ВИЧ. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению включает в себя первую экспрессирующую кассету, включающую в себя соответствующую ДНКпоследовательность, которая кодирует Nef, Tat и/или Rev, и вторую экспрессирующую кассету, включающую в себя соответствующую ДНК-последовательность, которая кодирует Nef, Tat и/или Rev. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению включает в себя первую экспрессирующую кассету, включающую в себя соответствующую ДНКпоследовательность, которая кодирует Nef, Tat и/или Rev, и вторую экспрессирующую кассету, включающую в себя соответствующую ДНК-последовательность, которая кодирует структурный белок ВИЧ. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует белок, ассоциированный со злокачественной опухолью. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует белок, ассоциированный с развитием иммунитета, регуляцией иммунных реакций или регуляцией аутоиммунных реакций. В конкретном варианте осуществления настоящего изобретения указанный белок представляет собой APECED. В конкретном варианте осуществления настоящего изобретения представляющая интерес ДНКпоследовательность представляет собой Aire-ген. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНК-6 009388 последовательность кодирует белок, который дефектен в любом моногенном наследственном заболевании. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует макромолекулярное лекарственное средство. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует цитокин. В некоторых конкретных вариантах осуществления настоящего изобретения указанный цитокин представляет собой интерлейкин, выбранный из группы, состоящей изIL1, IL2, IL4, IL6 и IL12. В некоторых других конкретных вариантах осуществления настоящего изобретения представляющая интерес ДНК-последовательность кодирует интерферон. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует биологически активную молекулу РНК. В некоторых конкретных вариантах осуществления настоящего изобретения указанная биологически активная молекула РНК выбрана из группы, состоящей из ингибирующей антисмысловой и рибозимной молекул. В некоторых конкретных вариантах осуществления настоящего изобретения ингибирующие антисмысловая и рибозимная молекулы противодействуют функции онкогена. Вектор согласно изобретению пригоден для использования в производстве терапевтического макромолекулярного агента in vivo. В некоторых вариантах осуществления настоящего изобретения создан вектор для использования в качестве лекарственного средства. В некоторых вариантах осуществления настоящего изобретения создан вектор для использования в качестве вектора переносчика гена, генов, или ДНК-последовательности или соответствующих ДНКпоследовательностей, таких как ген, гены, или ДНК-последовательность или ДНК-последовательности,кодирующие белок или пептид инфекционного агента, терапевтический агент, макромолекулярное лекарственное средство или любое их сочетание. В некоторых вариантах осуществления настоящее изобретение связано с вектором для использования в качестве лекарственного средства для лечения наследственных или приобретенных генетических дефектов. В некоторых вариантах осуществления настоящее изобретение связано с вектором для использования в качестве терапевтической ДНК-вакцины против инфекционного агента. В некоторых вариантах осуществления настоящее изобретение связано с вектором для использования в качестве терапевтического агента. Настоящее изобретение относится также к способам создания белка для больного, причем указанный способ включает в себя введение данному больному вектора согласно изобретению, где указанный вектор (i) дополнительно включает в себя вторую ДНК-последовательность, кодирующую указанный белок, созданный для больного, и вторая ДНК-последовательность оперативно связана со вторым промотором, и (ii) не кодирует белок Е 1 папилломавируса крупного рогатого скота, и где указанный больной не экспрессирует белок Е 1 папилломавируса крупного рогатого скота. Настоящее изобретение, кроме того, относится к способам индуцирования иммунного ответа на белок у больного, причем указанный способ включает в себя введение указанному больному вектора согласно изобретению, где указанный вектор (i) дополнительно включает в себя вторую ДНКпоследовательность, кодирующую указанный белок, а вторая ДНК-последовательность оперативно связана со вторым промотором, и (ii) не кодирует белок Е 1 папилломавируса крупного рогатого скота, и где указанный больной не экспрессирует белок Е 1 папилломавируса крупного рогатого скота. Кроме того, настоящее изобретение относится к способам лечения больного с инфекционным заболеванием, нуждающегося в указанном лечении, причем указанный способ включает в себя введение указанному больному терапевтически эффективного количества вектора согласно изобретению, в котором представляющая интерес ДНК-последовательность кодирует белок, включающий в себя иммуногенный эпитоп инфекционного агента. Кроме того, настоящее изобретение относится к способам лечения больного с наследственным или приобретенным генетическим дефектом, нуждающегося в указанном лечении, причем указанный способ подразумевает введение указанному больному терапевтически эффективного количества вектора согласно изобретению, в котором указанная представляющая интерес ДНК-последовательность кодирует белок, который подвержен воздействию указанного наследственного или приобретенного генетического дефекта. Настоящее изобретение относится также к способам экспрессирования ДНК-последовательности у больного, причем указанный способ включает в себя введение вектора согласно изобретению указанному больному. Настоящее изобретение относится также к способам экспрессирования ДНК-последовательности у больного, лечения наследственного или приобретенного генетического дефекта, лечения инфекционного заболевания, индуцирования иммунореактивности на белок и создания белка, в которых вектор согласно изобретению не кодирует белок Е 1 папилломавируса крупного рогатого скота и в которых указанный больной не экспрессирует белок Е 1 папилломавируса крупного рогатого скота.-7 009388 В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению используют для получения белка, кодируемого указанной представляющей интерес ДНКпоследовательностью в клетке или в организме. В настоящем изобретении создан также способ получения вектора по пп.1, 2 или 17, включающий в себя (a) культивирование хозяйской клетки, содержащей указанный вектор и (b) извлечение данного вектора. В конкретном варианте осуществления настоящего изобретения способ получения вектора согласно изобретению дополнительно включает в себя перед стадией (а) стадию трансформирования указанной хозяйской клетки с помощью указанного вектора. В некоторых конкретных вариантах осуществления настоящего изобретения данная хозяйская клетка представляет собой прокариотическую клетку. В конкретном варианте осуществления настоящего изобретения данная хозяйская клетка представляет собой клетку Escherichia coli. Настоящее изобретение относится также к хозяйской клетке, которая отличается тем, что содержит вектор согласно изобретению. В некоторых вариантах осуществления настоящего изобретения данная хозяйская клетка представляет собой бактериальную клетку. В некоторых других вариантах осуществления настоящего изобретения данная хозяйская клетка представляет собой клетку млекопитающего. Кроме того, настоящее изобретение относится к векторам-переносчикам, содержащим вектор согласно изобретению. Настоящее изобретение относится также к фармацевтической композиции, включающей в себя вектор согласно изобретению и соответствующее фармацевтическое связующее вещество. Настоящее изобретение относится также к ДНК-вакцине, содержащей вектор согласно изобретению. Настоящее изобретение относится также к агенту генной терапии, содержащему вектор согласно изобретению. Кроме того, настоящее изобретение относится к способу получения ДНК-вакцины, причем указанный способ включает в себя объединение вектора настоящего изобретения с подходящим фармацевтическим связующим веществом. Настоящее изобретение относится также к способу получения агента для использования в генной терапии, причем указанный способ включает в себя объединение вектора согласно изобретению с подходящим фармацевтическим связующим веществом. 4. Описание чертежей На фиг. 1 представлена схема-карта плазмиды super6. На фиг. 2 представлена схема-карта плазмиды VI. На фиг. 3 представлена схема-карта плазмиды II. На фиг. 4 показана экспрессия в Jurkat-клетках белков Nef и Е 2 из векторов super6, super6wt, VI,VIwt и II. На фиг. 5 представлена схема-карта плазмиды product1. На фиг. 6 А представлена схема-карта плазмид NNV-1 и NNV-2, а на фиг. 6 В представлена схема-карта плазмиды NNV-2wt. На фиг. 7 показана экспрессия в Jurkat-клетках Nef-белка из плазмид NNV-1, NNV-2, NNV-1wt,NNV-2-wt, super6 и super6wt. На фиг. 8 показана экспрессия в Jurkat-клетках белков Nef и Е 2 из плазмид NNV-2-wt, NNV-2-wtFS и product I. На фиг. 9 показана экспрессия белков Nef и Е 2 из плазмид NNV-2-wt, NNV-2-wtFS, product I в клетках Р 815. На фиг. 10 показана экспрессия белков Nef и Е 2 из плазмид NNV-2-wt, NNV-2-wtFS, product I в СНО-клетках. На фиг. 11 показана экспрессия белков Nef-белка из плазмид NNV-2-wt, NNV-2-wtFS, product I вRD-клетках. На фиг. 12 показана экспрессия молекул РНК NNV-2wt в клетках СНО, Jurkat и Р 815. На фиг. 13 показана стабильность NNV-2wt в бактериальных клетках. На фиг. 14 показан Саузерн-блот-анализ стабильности NNV-2wt в качестве нереплицирующегося эписомного элемента в клеточных линиях СНО и Jurkat. На фиг. 15 показано, что векторы NNV-2wt, NNV-2wtFS и product1 неспособны к фактор-зависимой репликации HPV-11. На фиг. 16 представлена схема-карта плазмиды 2wtd1EGFP. На фиг. 17 представлена схема-карта плазмиды gf10bse2. На фиг. 18 представлена схема-карта плазмиды 2wtd1EGFPFS. На фиг. 19 представлена схема-карта плазмиды NNVd1EGFP. На фиг. 20 показаны кривые роста Jurkat-клеток, трансфицированных плазмидами 2wtd1EGFP,2wtd1EGFPFS, NNVd1EGFP или только ДНК-носителем. На фиг. 21 показаны кривые роста Jurkat-клеток, трансфицированных плазмидами 2wtd1EGFP,2wtd1EGFPFS, gf10bse2 или только ДНК-носителем.-8 009388 На фиг. 22 показано выраженное в процентах изменение доли позитивных клеток d1EGFP в популяции Jurkat-клеток, трансфицированных векторами 2wtd1EGFP, 2wtd1EGFPFS или NNVd1EGFP. На фиг. 23 показано выраженное в процентах изменение доли позитивных клеток d1EGFP в популяции Jurkat-клеток, трансфицированных векторами 2wtd1EGFP, 2wtd1EGFPFS или gf10bse2. На фиг. 24 показано изменение численности клеток, экспрессирующих d1EGFP, в популяции Jurkatклеток, трансфицированных векторами 2wtd1EGFP, 2wtd1EGFPFS или NNVd1EGFP. На фиг. 25 показано изменение численности клеток, экспрессирующих d1EGFP, в популяции Jurkatклеток, трансфицированных векторами 2wtd1EGFP, 2wtd1EGFPFS или gf10bse2. Фиг. 26. Т-клеточные ответы на рекомбинантные Nef-белки (5 мкг/лунку), измеренные по Тклеточной пролиферации у пяти пациентов, иммунизированных 1 мкг GTU-Nef. Фиг. 27. Т-клеточные ответы на рекомбинантные Nef-белки (5 мкг/лунку), измеренные по Тклеточной пролиферации у пяти пациентов, иммунизированных 20 мкг GTU-Nef. Фиг. 28. Т-клеточные ответы на рекомбинантные Nef-белки (5 мкг/лунку), измеренные по Тклеточной пролиферации у пациента 1, иммунизированного 1 мкг GTU-Nef. Полученные результаты представлены в виде индекса стимуляции в анализе Т-клеточной пролиферации (Nef SI) и секреции IFNгамма в супернатант. Фиг. 29. (А) плазмида рЕВО LPP; (В) плазмида s6E2d1EGFP; (С) плазмида FRE2d1EGFP. Фиг. 30. Плазмида FREBNAd1EGFP. Фиг. 31. Векторы не вмешиваются в клеточную пролиферацию. Фиг. 32. Векторы сохраняются в клетках с разной кинетикой. Фиг. 33. Изменение числа клеток во времени, экспрессирующих d1EGFP в трансфицированной совокупной популяции клеток. Фиг. 34. Изменение числа клеток во времени, экспрессирующих d1EGFP в трансфицированной совокупной популяции клеток. (А) линия клеток 293 эмбриона человека; (В) мышиная клеточная линия 3T6. Фиг. 35. Nef- и Е 2-антительный ответ. Фиг. 36. Rev- и ТАТ-антительный ответ. Фиг. 37. Gag- и CTL-ответ. Фиг. 38. (A) GTU-1; (B) GTU-2Nef; (C) GTU-3Nef; (D) super6wtd1EGFP; (E) FREBNAd1EGFP; (F)p2RNT-CTL-optp17/24; (O) p2TRN-CTL-optp17/24-iE2-mGMCSF; (P) p2RNT-CTL-optp17/24-iE2mGMCSF; (Q) p3TRN-CTL-optp17/24; (R) p3RNT-CTL-optp17/24; (S) p3TRN-CTL-optp17/24-iE2mGMCSF; (T) p3RNT-CTL-optp17/24-iE2-mGMCSF; (U) FREBNA-RNT-CTL-optp1724; (V) super6wt-RNTCTL-optp17/24; (W) E2BSEBNA-RNT-CTL-optp17/24; (X) pCMV- Rnt-CTL-optp17/24. 5. Подробное описание изобретения 5.1. Векторы согласно изобретению Настоящее изобретение основано на неожиданном открытии, что экспрессирующие векторы, которые несут (А) экспрессирующую кассету гена заякоренного в ядре белка, связывающегося и со (i) специфичной ДНК-последовательностью, и с (ii) соответствующим ядерным компонентом, а также (В) мультимеризованную ДНК-последовательность, связывающую указанный заякоренный в ядре белок, способны распространяться в пролиферирующей клеточной популяции. Такие заякоренные в ядре белки включают в себя, но не ограничиваются этим, заякоренные на хроматине белки, такие, например, как белок Е 2 папилломавируса тип 1 (BPV1 Е 2; SEQ ID NO:50). ДНК-связывающие последовательности могут представлять собой, не ограничиваясь этим, мультимеризованные сайты связывания Е 2. На базе предшествующего уровня техники не было оснований предполагать, что функция сегрегации/разделения, например, папилломавирусов могла бы проявиться раздельно, и что добавление такой функции сегрегации/разделения к вакцинным векторам будет обеспечивать распределение данного вектора в пролиферирующей клеточной популяции. Кроме того, из предшествующего уровня техники не следовало, что можно создать функциональные векторы, действующие независимо от ориджина репликации. Термин "заякоренный в ядре белок", используемый в настоящем изобретении, относится к белку,который связывается со специфической ДНК-последовательностью и способен создать у данного вектора функцию пространственного разделения, т.е. он относится к белку, который способен заякорить или присоединить данный вектор к конкретному ядерному участку. В некоторых вариантах осуществления настоящего изобретения заякоренный в ядре белок является-9 009388 природным белком. Примерами таких ядерных участков являются митотический хроматин или митотические хромосомы, ядерный матрикс, ядерные домены, подобные ND10 и POD и т.п. Примерами заякоренных в ядре белков являются белок Е 2 папилломавируса тип 1 крупного рогатого скота (BPV1),EBNA1 (ядерный антиген 1 вируса Эпштейна-Барр; SEQ ID NO:52), и негистоновые белки хроматина с высокой электрофоретической подвижностью (HMG) и т.п. Термин "функциональный эквивалент заякоренного в ядре белка", используемый в настоящем изобретении, относится к белку или полипептиду природного или неприродного происхождения, обладающему свойствами заякоренного в ядре белка. В некоторых других вариантах осуществления настоящего изобретения заякоренный в ядре белок согласно изобретению представляет собой рекомбинантный белок. В некоторых конкретных вариантах осуществления настоящего изобретения заякоренный в ядре белок представляет собой слитый белок,химерный белок или белок, полученный с помощью молекулярного моделирования. Слитый белок, или белок, полученный с помощью молекулярного моделирования, в связи с настоящим изобретением, определяется по его способности связываться с ядерным компонентом и по его способности специфически связываться с ДНК. В предпочтительном варианте осуществления настоящего изобретения такой слитый белок кодируется вектором согласно изобретению, который содержит также специфическую ДНКпоследовательность, с которой связан слитый/химерный белок. Ядерные компоненты включают в себя,не ограничиваясь ими, хроматин, ядерный матрикс, домен ND10 и POD. Для того чтобы уменьшить риск нарушения экспрессии генов, эндогенных по отношению к хозяйской клетке, ДНК-связывающий домен и соответствующая ему ДНК-последовательность предпочтительно не являются эндогенными по отношению к хозяйской клетке/хозяйскому организму. Такие домены включают в себя, не ограничиваясь ими, ДНК-связывающий домен белка Е 2 (SEQ ID NO:50) вируса папилломавируса тип 1 крупного рогатого скота (BVP1), ядерный антиген 1 вируса Эпштейна-Барр (EBNA1; SEQ ID NO:52), и негистоновые белки хроматина с высокой электрофоретической подвижностью (HMG) (HMG-бокс). Вектор согласно изобретению может, кроме того, включать в себя "представляющую интерес ДНКпоследовательность", которая кодирует белок (в том числе пептид или полипептид), например, который является иммуногенным или терапевтическим. В некоторых вариантах осуществления настоящего изобретения эта представляющая интерес ДНК-последовательность кодирует биологически активную РНКмолекулу, такую, например, как антисмысловую РНК-молекулу или рибозим. Экспрессирующие векторы согласно изобретению, несущие экспрессирующую кассету гена заякоренного в ядре белка и мультимеризованные сайты связывания указанного заякоренного в ядре белка,распространяются в пролиферирующей хозяйской клеточной популяции. Это означает, что высокое число копий вектора или плазмиды доставляется в клетки-мишени, а использование функции сегрегации/разделения заякоренного в ядре белка и его мультимеризованных сайтов связывания обеспечивает распределение вектора по дочерним клеткам в течение клеточного деления. У вектора согласно изобретению отсутствует ориджин репликации вируса папилломы. Кроме того,в предпочтительном варианте осуществления настоящего изобретения у вектора согласно изобретению отсутствует ориджин репликации, функционирующий в клетке млекопитающего. Отсутствие ориджина репликации вируса папилломы или ориджина репликации млекопитающего является улучшением по сравнению с векторами прототипа по нескольким причинам. (1) Отсутствие ориджина репликации уменьшает размер вектора согласно изобретению по сравнению с векторами прототипа. Такое уменьшение размера повышает стабильность данного вектора и облегчает его поглощение клеткой-хозяином. (2) Отсутствие ориджина репликации снижает риск рекомбинации с геномом клеток хозяина, уменьшая тем самым риск возникновения нежелательных побочных эффектов. (3) Отсутствие ориджина репликации позволяет легко контролировать вводимый вектор, регулируя его количество. В противоположность этому, при функционирующем ориджине репликации репликация данного вектора должна приниматься во внимание при определении необходимой дозировки. (4) В том случае, если данный вектор не вводят в хозяйский организм непрерывно, отсутствие ориджина репликации позволяет данному хозяйскому организму освободиться от собственного вектора, обеспечивая тем самым больший контроль над содержанием ДНК-последовательностей, которые экспрессируются в данном организме-хозяине. Кроме того, способность хозяйского организма освобождаться от собственного вектора создает преимущество в том случае, когда присутствие данного вектора необходимо лишь в течение терапевтического курса, но является нежелательным для здорового индивида. Ген заякоренного в ядре белка, пригодный для векторов согласно изобретению, может представлять собой любую подходящую ДНК-последовательность, кодирующую природный или синтетический белок, такой, например, как рекомбинантный белок, слитый белок или белок, полученный методами молекулярного моделирования, обладающий требуемыми свойствами. Таким образом, данный ген природного заякоренного в ядре белка, который содержит ДНК-связывающий домен, способный связываться со специфической ДНК-последовательностью, и функциональный домен, способный связываться с ядерным компонентом, может представлять собой вирусный белок, такой как белок Е 2 вируса папилломы крупного рогатого скота или белок EBNA1 (ядерный антиген 1 вируса Эпштейна-Барр) вируса Эпштейна-Барр, эукариотический белок, такой как один из группы негистоновых хромосомных белков с высокой электрофоретической подвижностью (HMG), или им подобный, или прокариотический белок. Аль- 10009388 тернативно, ген заякоренного в ядре белка, который содержит ДНК-связывающий домен, способный связываться со специфической ДНК-последовательностью, и функциональный домен, способный связываться с ядерным компонентом, может также включать в себя ДНК-последовательности, которые кодируют домен клеточного белка, обладающего способностью присоединяться к определенной ядерной структуре, такой как митотические хромосомы, ядерный матрикс или ядерные домены, подобные ND10 или POD. Альтернативно, ДНК-последовательность, которая кодирует неприродный или синтетический белок, такой как рекомбинантный белок или слитый белок, или белок, полученный с помощью молекулярного моделирования, который содержит ДНК-связывающий домен, способный связываться со специфической ДНК-последовательностью, например, папилломавируса, такой как ДНК-связывающий домен белка Е 2 BVP1, но в котором N-конец заякоренного в ядре белка, например, белка Е 2, был заменен на домены любого подходящего белка с аналогичной функцией, например, на N-концевой домен последовательности ядерного антигена 1 вируса Эпштейна-Барр. Точно так же можно использовать ДНКпоследовательности, которые кодируют рекомбинантный белок или слитый белок, который содержит функциональный домен, способный связываться с ядерным компонентом, например, N-концевой функциональный домен папилломавируса, такого как белка Е 2 BVP1, но в котором С-концевой ДНКсвязывающий димеризационный домен заякоренного в ядре белка, например, белка Е 2, замещен на домен любого белка с достаточной ДНК-связывающей эффективностью, например, ДНК-связывающий домен белка Е 2 BVP-1 и EBNA-1. В предпочтительном варианте осуществления настоящего изобретения заякоренный в ядре белок представляет собой заякоренный на хроматине белок, который содержит ДНК-связывающий домен, который связывается со специфической ДНК-последовательностью, и функциональный домен, способный связываться с митотическим хроматином. Предпочтительным примером такого заякоренного на хроматине белка и его мультимеризованных связывающих сайтов, используемых в настоящем изобретении,являются белок Е 2 вируса папилломы типа 1 крупного рогатого скота и мультимеризованные связывающие сайты белка Е 2. Что касается Е 2, механизм функции распределения обусловлен двойственной функцией белка Е 2: способностью белка Е 2 присоединяться к митотическим хромосомам с помощью Nконцевого домена данного белка и способностью С-концевого домена белка Е 2 к специфическому связыванию последовательности, которая обеспечивает привязку векторов, содержащих мультимеризованный Е 2-связывающий сайт, с митотическими хромосомами. Так создается функция сегрегации/распределения для данных векторов. В другом предпочтительном варианте осуществления настоящего изобретения экспрессирующая кассета гена заякоренного на хроматине белка включает в себя ген любого подходящего белка, клеточного, вирусного или рекомбинантного происхождения, обладающего свойствами, аналогичными Е 2 BPV1,т.е. способностью присоединяться к митотическому хроматину с помощью одного домена и способностью кооперативно связывать ДНК с помощью другого домена с мультимеризованными связывающими сайтами, специфичными для данного ДНК-связывающего домена. В конкретном варианте осуществления настоящего изобретения последовательности, полученные из BPV1 и используемые в векторах согласно изобретению, сильно укорочены в размере, включая только два элемента из BPV1. Во-первых, они содержат кодирующую белок Е 2 последовательность, транскрибируемую под гетерологичным эукариотическим промотором и полиаденилированную по гетерологичному сайту полиаденилирования. Во-вторых, они содержат множественные сайты связывания белка Е 2,введенные в данный вектор в виде кластера, в котором данные сайты могут находиться в виде структур голова-к-хвосту или могут быть включены в данный вектор в результате пространственного позиционирования. Оба эти элемента необходимы и, что неожиданно, достаточны для функционирования данных векторов для их распределения в пролиферирующих клетках. Точно так же при использовании в векторах согласно изобретению ДНК-последовательностей, полученных из других подходящих источников,применимы те же принципы. В соответствии с настоящим изобретением, экспрессирующая кассета гена заякоренного в ядре белка, такая как экспрессирующая кассета заякоренного на хроматине белка, подобного Е 2 BPV1, которая содержит ДНК-связывающий домен, способный связываться со специфической ДНКпоследовательностью, и функциональный домен, способный связываться с ядерным компонентом, включает в себя гетерологичный эукариотический промотор, последовательность, кодирующую заякоренный в ядре белок, такую как последовательность, кодирующую заякоренный на хроматине белок, например,кодирующую последовательность белка Е 2 BPV1, и сайт поли-А. Могут использоваться различные гетерологичные эукариотические промоторы, которые контролируют экспрессию заякоренного в ядре белка. Нуклеотидные последовательности таких гетерологичных эукариотических промоторов хорошо известны в данной области техники и легко доступны. Такие гетерологичные эукариотические промоторы обладают разной эффективностью и тканевой специфичностью. В предпочтительном варианте осуществления настоящего изобретения заякоренный в ядре белок экспрессируется на низких уровнях. Мультимеризованные ДНК-связывающие последовательности, т.е. ДНК-последовательности, содержащие мультимерные связывающие сайты, как указано в рамках настоящего изобретения, представ- 11009388 ляют собой область, с которой связывается ДНК-связывающий димеризационный домен. Мультимеризованные ДНК-связывающие последовательности векторов согласно изобретению могут содержать любой подходящий ДНК-связывающий сайт, при условии, что он удовлетворяет вышеуказанным требованиям. В предпочтительном варианте осуществления настоящего изобретения мультимеризованная ДНКсвязывающая последовательность вектора согласно изобретению может содержать любой один из 17 известных, отличающихся по сродству, Е 2-связывающих сайтов в виде гексамера или олигомера более высокого порядка, в виде октамера или олигомера более высокого порядка, в виде декамера или олигомера более высокого порядка. Пригодны также олигомеры, содержащие разные Е 2-связывающие сайты связывания. Особенно предпочтительные Е 2-связывающие сайты, используемые в векторах согласно изобретению, представляют собой сайты 9 и 10 BVP1 с высоким сродством, но сродство сайта 9 более предпочтительно. Когда речь идет об олигомере более высокого порядка, его размер лимитируется лишь условиями создания, и он может содержать от 6 до 30 идентичных связывающих сайтов. Предпочтительные векторы согласно изобретению содержат в тандеме десять BPV-1-E2-связывающих сайтов 9. При мультимеризации ДНК-связывающие последовательности включают в себя разные Е 2-связывающие сайты, их размер и состав лимитируется лишь способом построения. Они могут содержать два или более различных Е 2-связывающих сайта, присоединенных к группе из 6-30, более предпочтительно - десять Е 2-связывающих сайта. Геном папилломавируса тип 1 крупного рогатого скота (SEQ ID NO:49) содержит 17 сайтов связывания белка Е 2, которые отличаются сродством к Е 2. Е 2-связывающие сайты описаны у Li и соавт. [Genes Dev 3(4) (1989) 510-526], которые включены здесь путем ссылки в ее полноте. Альтернативно, мультимеризованные ДНК-связывающие последовательности могут быть составлены из любых подходящих мультимерных специфичных последовательностей, способных индуцировать кооперативное связывание данного белка с данной плазмидой, таких как EBNA1 или соответствующего белка HMG. Повторы 21X30 п.н. сайтов связывания EBNA-1 локализованы на участке генома вируса Эпштейна-Барр (SEQ ID NO:51), простирающегося от нуклеотида 7421 до нуклеотида 8042. Эти сайты связывания EBNA-1 описаны в следующих ссылках: Rawlins и соавт., Cell 42(3) (1985) 859-868;Reisman и соавт., Mol. Cell. Biol. 5(8) (1985) 1822-1832; и Lupton and Levine, Mol. Cell. Biol. 5(10) (1985) 2533-2542, и все три включены здесь путем ссылки в их полноте. Положение мультимеризованных ДНК-связывающих последовательностей относительно экспрессирующей кассеты для ДНК-связывающего димеризационного домена не существенно и может представлять собой любое положение в данной плазмиде. Поэтому мультимеризованные ДНК-связывающие последовательности могут быть расположены справа или слева относительно экспрессирующей кассеты представляющего интерес гена, причем расположение вблизи промотора данного представляющего интерес гена является предпочтительным. Векторы согласно изобретению содержат также, в случае целесообразности, подходящий промотор для транскрипции гена или генов, или представляющих интерес ДНК-последовательностей, дополнительные регуляторные последовательности, последовательности полиаденилирования и интроны. Предпочтительно данные векторы могут также включать в себя ориджин репликации бактериальной плазмиды, а также один или несколько генов для селективных маркеров, чтобы способствовать получению данного вектора у бактериального хозяина, и подходящий промотор для экспрессии гена при отборе к антибиотику. Селективный маркер может представлять собой любой подходящий маркер, допустимый в ДНКвакцинах, такой как канамицин или неомицин, и другие. В тех случаях, когда это приемлемо, в векторы настоящего изобретения могут быть дополнительно включены и другие позитивные, и негативные селективные маркеры. Векторы согласно изобретению включают в себя только ДНК-последовательности, например ДНКпоследовательности BPV1, которые необходимы и достаточны для продолжительного сохранения. Все лишние последовательности, такие как онкогенные последовательности, которые могут вызывать неблагоприятные реакции, удаляют. Поэтому в предпочтительных векторах согласно изобретению последовательность, кодирующую Е 2, модифицируют с помощью мутационного анализа, так, чтобы она экспрессировала только белок Е 2, а перекрывающиеся последовательности Е 3, Е 4 и Е 5 были инактивированы в результате введения мутаций, которые инактивируют трансляцию открытых рамок считывания Е 3, Е 4 и Е 5. Вектор согласно изобретению не содержит ориджин репликации папилломавируса. Предпочтительно вектор настоящего изобретения не содержит ориджин репликации, функциональный в клетке млекопитающего или у млекопитающего. Кроме того, векторы согласно изобретению не специфичны для хозяина, поскольку экспрессия заякоренного в ядре белка, такого как белок Е 2, контролируется неприродным или гетерологичным промоторами. В зависимости от конкретного выбранного промотора, эти промоторы могут оказаться функциональными в широком ряду клеток млекопитающих или же они могут оказаться клеточно-специфичными или тканеспецифичными. Примерами промоторов для заякоренного в ядре белка, такого как белок Е 2,пригодных для векторов согласно изобретению, являются тимидинкиназные промоторы, предранний промотор цитомегаловируса человека, LTR вируса саркомы Рауса и тому подобные. Для экспрессии представляющего интерес гена предпочтительными промоторами являются сильные промоторы, обеспе- 12009388 чивающие высокий уровень экспрессии соответствующего гена, к примеру, таким промотором является предранний промотор цитомегаловируса человека. 5.2. Векторы согласно изобретению в качестве носителей для экспрессии представляющей интерес ДНК-последовательности Ген, гены или ДНК-последовательность, либо ДНК-последовательности, которые экспрессируются с помощью вектора согласно изобретению, могут представлять собой любую представляющую интерес ДНК-последовательность, экспрессия которой необходима. Поэтому данные векторы могут содержать ген, или гены, или ДНК-последовательность, или ДНК-последовательности инфекционных микробных патогенов, таких как вирусы, против которых не могут быть получены или использоваться живые аттенуированные вакцины либо инактивированные вакцины. Такие представляющие интерес ДНКпоследовательности включают в себя гены или ДНК-последовательности вирусов, таких как вирус иммунодефицита человека (ВИЧ), вирус простого герпеса (HSV), вирус гепатита С, вирус гриппа, энтеровирусы и т.д.; внутриклеточные бактерии, такие как Chlamydia trachomatis, Mycobacterium tuberculosis,Mycoplasma pneumonia и т.д.; внеклеточные бактерии, такие как Salmonella; или грибы, такие как Candidaalbigans. В предпочтительном варианте осуществления настоящего изобретения данные векторы содержат ген, кодирующий ранние регуляторные белки ВИЧ, т.е. неструктурные регуляторные белки Nef, Tat илиRev, предпочтительно Nef. В другом предпочтительном варианте осуществления настоящего изобретения векторы согласно изобретению содержат гены, кодирующие структурные белки ВИЧ. В другом предпочтительном варианте осуществления настоящего изобретения векторы согласно изобретению содержат два или более генов, кодирующих любое сочетание ранних регуляторных белков и/или структурных белков ВИЧ. Иллюстративные примеры таких сочетаний представляют собой сочетание гена, кодирующего Nef-белок и ДНК-последовательность, кодирующую Tat-белок, вместе с ДНКпоследовательностью, кодирующей гликопротеин наружной оболочки ВИЧ, gp120/gp160 или сочетание любого иммуногенного эпитопа в белках патогенов, внедренного в искусственный рекомбинантный белок. Альтернативно, векторы согласно изобретению могут содержать гены или ДНКпоследовательности наследуемых или приобретенных генетических дефектов, такие как последовательности различных антигенов меланомы, подобные последовательности, кодирующей тирозиназу А или кодирующей последовательность -катенины. В предпочтительном варианте осуществления настоящего изобретения векторы содержат ген, кодирующий белки, относящиеся к злокачественной опухоли или иным мутационным заболеваниям, предпочтительно заболеваниям, связанным с возникновением иммунитета и регуляции иммунного ответа к"своему" и "не своему", такому как ген APECED. В другом предпочтительном варианте осуществления настоящего изобретения данные векторы содержат любую ДНК-последовательность, кодирующую белок, который дефектен по любому наследуемому моногенному наследственному заболеванию. В другом предпочтительном варианте осуществления настоящего изобретения данные векторы содержат любую ДНК-последовательность, кодирующую макромолекулярное лекарственное средство, которое доставляется и продуцируется in vivo. Способ согласно изобретению получения векторов согласно изобретению включает в себя следующие стадии: (А) культивирование клетки-хозяина, содержащей вектор согласно изобретению, и (В) извлечение данного вектора. В некоторых конкретных вариантах осуществления настоящего изобретения стадии (А) предшествует трансформация клетки-хозяина с помощью вектора согласно изобретению. Векторы согласно изобретению предпочтительно амплифицируются в подходящей бактериальной клетке-хозяине, такой, например, как Escherichia coli. Векторы согласно изобретению стабильны и реплицируются, образуя большое число копий в бактериальных клетках. Если вектор согласно изобретению амплифицируется в бактериальной хозяйской клетке, то он содержит бактериальный ориджин репликации. Нуклеотидные последовательности бактериальных ориджинов репликации хорошо известны специалистам в данной области техники и могут быть легко получены. После трансфекции в хозяине-млекопитающем в большом числе копий данный вектор распределяется вместе с делением клеток, и численность клеток, несущих данный вектор, повышается без репликации данного вектора, каждая клетка приобретает способность экспрессировать искомый белок. Векторы согласно изобретению имеют своим результатом высокую экспрессию требуемого белка. Например, как продемонстрировано в примерах 4, 7-10: высокая экспрессия Nef-белка ВИЧ, зеленого флуоресцентного белка (EGFP) и AIRE-белка обнаруживается во многих разных клеточных линиях, и полученные данные свидетельствуют, что увеличивается во времени не только численность позитивных клеток, но и количество белка, кодируемого искомым геном. Векторы согласно изобретению индуцируют также гуморальный и клеточный ответ, что продемонстрировано в примерах 9 и 10. Полученные результаты свидетельствуют, что векторы настоящего изобретения можно эффективно использовать в качестве ДНК-вакцин. Вакцины согласно изобретению содержат вектор настоящего изобретения или смесь указанных- 13009388 векторов в соответствующем фармацевтическом носителе. Данная вакцина может, например, содержать смесь векторов, содержащих гены трех разных регуляторных белков ВИЧ и/или структурных белков ВИЧ. Вакцины согласно изобретению составляют с использованием стандартных способов вакцинной рецептуры для получения вакцин, которые вводят с помощью любого традиционного способа введения,т.е. внутримышечно, внутрикожно и тому подобное. Векторы настоящего изобретения могут содержать стимулирующие последовательности ISS, с тем,чтобы активировать иммунный ответ организма. Вакцины согласно изобретению могут использоваться в качестве традиционного профилактического способа для защиты индивидов от инфекции. Альтернативно, вакцины согласно изобретению могут использоваться в качестве терапевтических вакцин, особенно в случае вирусных инфекций, наряду с традиционной лекарственной терапией. Как указано выше, векторы настоящего изобретения, несущие механизм распределения в хозяйскую клетку, находят многочисленное применение в качестве вакцин, в генной терапии, в генном переносе и в качестве терапевтических иммуногенов. Векторы настоящего изобретения могут использоваться для доставки нормального гена хозяину, обладающего генным дефектом, осуществляя, таким образом,лечение или терапию наследственной болезни. К тому же данный вектор может доставлять гены иммуногенных белков инородного происхождения, например, гены микробов или аутологичных опухолевых антигенов, которые используются для создания вакцин против микробов или злокачественной опухоли. Более того, векторы настоящего изобретения могут доставлять соответствующие гены маркерных веществ в ядро, которые используются в исследованиях клеточной функции или в диагностике. Наконец,векторы согласно изобретению могут использоваться для прямой доставки гена полимерного лекарственного средства в ядро, делая возможным создание новых терапевтических основ для лечения и хода заболеваний, в которых экспрессия данного лекарственного средства на участке его действия, клеточном ядре, является важной. Эти лекарственные средства могут представлять собой химические макромолекулы, такие как любые белки или полипептиды с терапевтическим или лечебным эффектом, которые препятствуют любым ядерным процессам, таким как репликация или транскрипция, либо транспорту веществ в ядро или из него. В частности, векторы согласно изобретению могут использоваться для экспрессии специфических цитокинов, подобных интерлейкинам (IL1, IL2, IL4, IL6, IL12 и другие) или интерферону, с целью модуляции специфичных иммунных реакций организма (иммунотерапия) против чужеродных антигенов или для ревакцинации активности иммунной системы против видоизмененных собственных антигенов. Векторы согласно изобретению пригодны также для комплементации (восполнения) дисфункции мозга, связанной с утратой специфичных дофаминэргических нейронов, приводящей к необратимой нейродегенерации, которая вызывает болезнь Паркинсона, в результате экспрессии генов, участвующих в синтезе дофамина, подобных тирозингидроксилазе, а также других дефектных генов, которые обладают аналогичным эффектом. Векторы согласно изобретению пригодны также для экспрессии белков и пептидов,регулирующих мозговую активность, подобных дофаминовым рецепторам, CCK-A- и CCK-Bрецепторам, а также нейротрофических факторов, подобных GDNF, BDNF, и другим белкам, регулирующим мозговую активность. Кроме того, векторы согласно изобретению пригодны для долговременной экспрессии фактора IX в гепатоцитах и -1-антитрипсина в мышечных клетках в целях восполнения соответствующих дефицитов данного организма. 5.3. Изучаемые болезни и нарушения В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению используют в качестве вакцины. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению содержит представляющую интерес ДНК-последовательность, которая кодирует белок или пептид. После введения такого вектора пациенту, данный белок или пептид, кодируемый представляющей интерес ДНК-последовательностью, экспрессируется и стимулирует иммунный ответ,специфичный к данному белку или пептиду, кодируемому представляющей интерес ДНКпоследовательностью. В конкретных вариантах осуществления настоящего изобретения вектор согласно изобретению используют для лечения и/или для профилактики инфекционного заболевания и/или состояния, вызванного инфекционным агентом. Такие заболевания и состояния включают в себя, не ограничиваясь ими, инфекционные заболевания, вызванные бактериями, вирусами, грибами, простейшими, гельминтами и т.д. и т.п. В более конкретном варианте осуществления настоящего изобретения такое инфекционное заболевание представляет собой синдром приобретенного иммунодефицита. Предпочтительно, если необходимо лечить или предупреждать вирусные заболевания, используют ДНК-последовательности, кодирующие молекулы, включающие в себя эпитопы известных вирусов. Например, такие ДНК-последовательности, кодирующие антигенные эпитопы, можно получить из вирусов,включащих в себя, но не ограничивающихся ими, гепатит тип А, гепатит тип В, гепатит тип С, грипп,ветряную оспу, аденовирус, простой герпес тип I (HSV-I), простой герпес тип II (HSV-II), чуму рогатого скота, риновирус, ECHO-вирус, ротавирус, респираторно-синцитиальный вирус, папилломавирус, папо- 14009388 вавирус, цитомегаловирус, эхиновирус, арбовирус, гунтавирус, вирус коксаки, вирус (эпидемического) паротита, вирус кори, вирус краснухи, полиовирус, вирус иммунодефицита человека тип I (HIV-I) и вирус иммунодефицита человека тип II (HIV-II). Если необходимо лечить или предупреждать бактериальные инфекции, предпочтительно используют ДНК-последовательности, кодирующие молекулы, включающие в себя эпитопы известных бактерий. Например, такие ДНК-последовательности, кодирующие антигенные эпитопы, могут быть получены из бактерий, включая, но не ограничиваясь ими, микобактериальные рикеттсии, микоплазмы, нейссерии, легионеллы. Если необходимо лечить или предупредить протозойные инфекции, предпочтительно использовать ДНК-последовательности, кодирующие молекулы, включающие в себя эпитопы известных простейших. Например, такие ДНК-последовательности, кодирующие антигенные эпитопы, могут быть получены из простейших, включая, но не ограничиваясь ими, лейшмании, кокцидии и трипаносомы. Если необходимо лечить или предупредить паразитарные инфекции, предпочтительно использовать ДНК-последовательности, кодирующие молекулы, включающие в себя эпитопы известных паразитов. Например, такие ДНК-последовательности, кодирующие антигенные эпитопы, могут быть получены из паразитов, включая, но не ограничиваясь ими, хламидии и рикеттсии. В других специфичных вариантах осуществления настоящего изобретения вектор согласно изобретению используется для лечения пациента и/или профилактики у него новообразования. В этих вариантах осуществления настоящего изобретения представляющая интерес ДНК-последовательность кодирует белок или пептид, который специфичен или ассоциирован с данным новообразованием. В неограничивающем примере новообразование может представлять собой фибросаркому, миксосаркому, липосаркому, хондросаркому, остеобластосаркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому,лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, злокачественную опухоль ободочной кишки, злокачественную опухоль поджелудочной железы,злокачественную опухоль молочной железы, злокачественную опухоль яичника, злокачественную опухоль предстательной железы, плоскоклеточный [эпидермоидный] рак, базально-клеточную эпителиому,аденокарциному, злокачественную опухоль потовой железы, злокачественную опухоль сальной железы,папиллокарциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному,бронхогенный рак, гипернефроидный рак, гепатому, карциному желчных протоков, хориокарциному,семиному, эмбриональную карциному, опухоль Вильмса, злокачественную опухоль шейки матки, злокачественную опухоль яичка, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому,эпендимому, пинеалому, гемангиобластому, акустическую невриному, олигодендроглиому, менингиому,меланому, нейробластому, ретинобластому; лейкозы, например, острый лимфолейкоз, острый миелоцитарный лейкоз (миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз); хронический лейкоз (хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфолейкоз); и истинную полицитемию, лимфому (болезнь Ходжкина и лимфома не Ходжкина), множественную миелому, болезнь Вальденстрема, а также болезни тяжелых цепей и т.д. и т.п. В некоторых других вариантах осуществления настоящего изобретения представляющая интерес ДНК-последовательность кодирует белок, который не функционален или дисфункция которого связана с наследственным нарушением или с приобретенной мутацией в гене, кодирующем данный белок. Такие наследственные заболевания включают в себя, но не ограничиваясь этим, болезни метаболизма, например атеросклероз (пораженный ген: АРОЕ); злокачественную опухоль, например врожденный семейный колиполипоз (пораженный ген: АРС-ген); аутоиммунные заболевания, например врожденная аутоиммунная полиэндокринопатийно-кандидозо-эктодермальная дисплазия (пораженный ген: APECED); нарушения функции мышц, например обусловленная вакцинацией мышечная дистрофия Дюшенна (пораженный ген: DMD); заболевания нервной системы, например болезнь Альцгеймера (пораженные гены:PS1 и PS2). Еще в других вариантах осуществления настоящего изобретения векторы согласно изобретению используют для лечения и/или профилактики заболеваний и нарушений, вызванных патологически высокой активностью любого белка. В этих вариантах осуществления настоящего изобретения представляющая интерес ДНК-последовательность кодирует антагонист данного сверхактивного белка. Такие антагонисты включают в себя, не ограничиваясь этим, антисмысловые РНК-молекулы, рибозимы, антитела и доминантные негативные белки. В конкретных вариантах осуществления настоящего изобретения представляющая интерес ДНК-последовательность кодирует ингибитор онкогена. В некоторых вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует молекулу, которая противодействует росту злокачественной опухоли. В конкретных вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует подавляющий опухоль ген, такой как р 53, но не ограничиваясь им. В других конкретных вариантах осуществления настоящего изобретения представляющая интерес ДНКпоследовательность кодирует ген активатора апоптоза, такой как ген каспазы, но не ограничиваясь им. В настоящем изобретении разработаны способы, при помощи которых представляющая интерес- 15009388 ДНК-последовательность экспрессируется у пациента. В некоторых вариантах осуществления настоящего изобретения вектор, содержащий одну или несколько экспрессирующих кассет представляющей интерес ДНК-последовательности, вводят данному пациенту, причем у данного пациента не экспрессируется белок Е 1 папилломавируса крупного рогатого скота. 5.4. Терапевтические способы, используемые в настоящем изобретении 5.4.1. Рекомбинантная ДНК В различных вариантах осуществления настоящего изобретения вектор согласно изобретению включает в себя одну или несколько экспрессирующих кассет, включающих в себя представляющую интерес ДНК-последовательность. Эта представляющая интерес ДНК-последовательность может кодировать белок и/или биологически активную РНК-молекулу. В любом случае данная ДНКпоследовательность встраивается в вектор согласно изобретению для экспрессии в рекомбинантных клетках или в клетках хозяина, когда речь идет о генной терапии. Используемая здесь экспрессирующая кассета относится к представляющей интерес ДНКпоследовательности, присоединяемой путем сшивки к одной или нескольким регуляторным областям либо к энхансерной/промоторной последовательностям, которые способствуют экспрессии белка согласно изобретению в надлежащей хозяйской клетке. "Оперативно связанный" относится к присоединению,при котором данные регуляторные области и данная экспрессируемая ДНК-последовательность присоединяются и позиционируются таким образом, чтобы разрешить транскрипцию, а для белка - и трансляцию. Регуляторные области, необходимые для транскрипции представляющей интерес ДНКпоследовательности, могут быть созданы с помощью вектора согласно изобретению. В совместимой системе "хозяин-конструкция" клеточные факторы транскрипции, такие как РНК-полимераза, будут связываться с регуляторными областями данного вектора, чтобы осуществить транскрипцию указанной ДНКпоследовательности в организме данного хозяина. Точная природа регуляторных областей, необходимых для генной экспрессии, может варьировать у хозяина от клетки к клетке. Как правило, необходим промотор, который способен связывать РНК-полимеразу и стимулировать транскрипцию ассоциированной путем сшивки ДНК-последовательности. Такие регуляторные области могут включать в себя области 5'некодирующих последовательностей, участвующих в инициации транскрипции и трансляции, такие как ТАТА-бокс, копирующую последовательность, СААТ-последовательность и т.д. и т.п. 3'-Некодирующая область в данной кодирующей последовательности может содержать терминирующие транскрипцию регуляторные последовательности, такие как терминаторы и сайты полиаденилирования. Для экспрессии представляющей интерес ДНК-последовательности можно использовать и конститутивную, и индуцируемую регуляторные последовательности. В оптимальных условиях роста хозяйских клеток и в условиях высокоуровневой экспрессии представляющей интерес ДНК желательно использовать разные индуцируемые промоторы. Примеры пригодных регуляторных областей представлены ниже (раздел 5.4.4). С целью присоединения ДНК-последовательностей с регуляторными функциями, такими как промоторы, к представляющей интерес ДНК-последовательности или для встраивания представляющей интерес ДНК-последовательности в клонирующий сайт вектора, линкеры или адаптеры, создающие соответствующие сайты рестрикции, могут быть лигированы по концам кДНК с помощью методов, хорошо известных в данной области техники [Wu и соавт., Methods in Enzymol. 152 (1987) 343-349]. Расщепление с помощью фермента рестрикции осуществляют с последующей модификацией, чтобы перед лигированием создать тупые концы путем укорочения или путем достраивания концов одноцепочечной ДНК. Альтернативно, требуемый сайт фермента рестрикции можно ввести во фрагмент ДНК путем амплификации ДНК с помощью ПЦР с праймерами, содержащими сайт фермента рестрикции. Вектор, включающий в себя представляющую интерес ДНК-последовательность, оперативно связанный с регуляторной областью (энхансерная/промоторная последовательности), можно непосредственно ввести в подходящие хозяйские клетки для экспрессии указанной ДНК-последовательности без дальнейшего клонирования. Для экспрессии в хозяйских клетках млекопитающего представляющей интерес ДНКпоследовательности можно использовать разнообразные регуляторные области, например, ранний и поздний промоторы SV40, предранний промотор цитомегаловируса (CMV), промотор длинного концевого повтора вируса саркомы Рауса (RSV-LTR). Индуцируемые промоторы, которые могут быть пригодны для клеток млекопитающего, включают в себя, не ограничиваясь ими, промоторы, ассоциированные с геном металлотионеина II, с глюкокортикоидом, ответственным за длинные концевые повторы у вируса опухоли молочной железы мыши (MMTV-LTR), с геном -интерферона, и с геном hsp70 [Williams и соавт., Cancer Res. 49 (1989) 2735-42; Taylor и соавт., Mol. Cell Biol., 10 (1990) 165-75]. Преимуществом может являться использование промоторов теплового шока для осуществления экспрессии представляющей интерес ДНК-последовательности в рекомбинантных хозяйских клетках. Кроме того, данный экспрессирующий вектор может содержать селективный или скринируемый маркерный ген для исходного выделения, идентификации или отслеживания хозяйских клеток, которые содержат данный вектор. Для клеток млекопитающих можно использовать ряд селективных систем,- 16009388 включая, но не ограничиваясь этим, тимидинкиназу вируса простого герпеса [Wigler и соавт., Cell 11USA 48 (1962) 2026], и аденинфосфорибозилтрансферазу [Lowy и соавт., Cell 22 (1980) 817], гены которых могут использоваться, соответственно, в клетках tk-, hgprt- или aprt-. К тому же антиметаболитная устойчивость может использоваться в качестве базовой для селекции по дигидрофолатредуктазе (dhfr),которая придает резистентность к метотрексату [Wigler и соавт., Proc. Natl. Acad. Sci. USA 77 (1980) 3567; O'Hare и соавт., Proc. Natl. Acad. Sci. USA 78 (1981) 1527]; no gpt, который придает резистентность к микофеноловой кислоте [MulliganBerg, Proc. Natl. Acad. Sci. USA 78 (1981) 2072]; по неомицинфосфотрансферазе (neo), которая придает резистентность к аминогликозиду G-418 [Colberre-Garapin и соавт.,J. Mol. Biol. 150 (1981) 1]; и по гигромицинфосфотрансферазе (hyg), которая придает резистентность к гигромицину [Santerre и соавт., 1984, Gene 30 (1984) 147]. Могут также использоваться и другие селективные неограничивающие маркеры, такие как гистидинол и Zeocin. 5.4.2. Экспрессирующие системы и хозяйские клетки В способах согласно изобретению используют клетку-хозяина и/или организм-хозяин, предпочтительно не экспрессирующие белок Е 1 папилломавируса крупного рогатого скота. Кроме того, предпочтительно, если вектор согласно изобретению не кодирует белок Е 1 папилломавируса крупного рогатого скота. Предпочтительные хозяйские клетки млекопитающих включают в себя, но не ограничиваясь ими,клетки, полученные от человека, обезьян и грызунов (см., например, Kriegler M. в "Gene Transfer and Expression: A Laboratory Manual", New York, FreemanCo. 1990), такие как трансформированная с помощью SV40 линия клеток почки обезьяны (COS-7, ATCC CRL 1651); почечная линия эмбриона человека(293, 293-EBNA, или 293-клетки, субклонированные для роста в суспензионной культуре, Graham и соавт., J. Gen. Virol., 36 (1977) 59); почечные клетки детенышей хомяка (BHK, ATCC CCL 10); овариальные клетки-DHFR китайского хомячка [СНО, Urlaub and Chasin. Proc. Natl. Acad. Sci. 77 (1980) 4216]; мышиные клетки Сертоли [Mather, Biol. Reprod. 23 (1980) 243-251]; мышиные фибробластные клетки (NIH3T3), клетки почки обезьяны (CVI ATCC CCL 70); клетки почки африканской зеленой мартышки(VERO-76, ATCC CRL-1587); карциномные клетки шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы-буйвола (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, НВ 8065); и клетки злокачественной опухоли молочной железы мыши (ММТ 060562, ATCC CCL51). Векторы согласно изобретению можно синтезировать и собрать из известных ДНКпоследовательностей с помощью методов, хорошо известных в данной области техники. Регуляторные области и энхансерные элементы могут быть разного происхождения, и природного, и синтетического. Некоторые хозяйские клетки могут быть закуплены. Векторы согласно изобретению, содержащие представляющую интерес ДНК-последовательность,могут быть введены в клетку-хозяин разными неограничивающими методами, известными в данной области техники, включая следующие: в прокариотические клетки - путем бактериальной трансформации[Wolff и соавт., Proc. Natl. Acad. Sci. 84 (1987) 3344] и микроинъекции [Cappechi, Cell 22 (1980) 4794889]. В конкретном варианте осуществления настоящего изобретения клеточные линии, которые экспрессируют ДНК-последовательность согласно изобретению, могут быть созданы с использованием вектора, который содержит селективный маркер. В неограничивающием примере осуществления после введения вектора биотехнологически созданным клеткам можно предоставить возможность расти 1-2 дня на обогащенной среде и затем сменить ее на селективную среду. Селективный маркер в данном векторе придает устойчивость к отбору и благоприятствует росту в культуре только клеток, которые содержат данный вектор с данным селективным маркером. 5.4.3. Вакцинные технологии В отдельных вариантах осуществления настоящего изобретения вектор согласно изобретению, содержащий экспрессирующую кассету представляющей интерес ДНК-последовательности, вводят пациенту, чтобы индуцировать иммунный ответ. В частности, представляющая интерес ДНКпоследовательность кодирует белок (например, пептид или полипептид), который индуцирует специфичный иммунный ответ при его экспрессии. Примеры таких белков рассматриваются в разделе 5.3. Для доставки вектора согласно изобретению, используемого в качестве вакцины, можно выбрать способы из тех, которые известны в данной области техники и/или описаны в разделе 5.4.6. 5.4.4. Технологии генной терапии В конкретном варианте осуществления настоящего изобретения вектор согласно изобретению, содержащий экспрессирующую кассету, содержащие представляющие интерес ДНК-последовательности,вводят для лечения или для профилактики различных заболеваний. Представляющая интерес ДНКпоследовательность может кодировать белок и/или биологически активную РНК-молекулу. Генная тера- 17009388 пия относится к терапии, осуществляемой путем введения пациенту экспрессированной или экспрессируемой ДНК-последовательности. В данном варианте осуществления настоящего изобретения ДНКпоследовательности производят кодируемые ею белок или РНК-молекулу, которые опосредуют терапевтический эффект. Любой способ генной терапии, имеющийся в данной области техники, можно использовать в соответствии с настоящим изобретением. Стандартные способы описываются ниже. Полный обзор данного способа генной терапии смотрите у Goldspiel и соавт., Clinical Pharmacy 12(1993) 488-505; Wu and Wu, Biotherapy 3 (1991) 87-95; Tolstoshev, Ann. Rev. Pharmacol. Toxicol. 32 (1993) 573-596; Mulligan, Science 260 (1993) 926-932; Morgan and Anderson, Ann. Rev. Biochem. 62 (1993) 191217; May, TIBTECH 1, 1(5) (1993) 155-215. Способы технологии рекомбинантной ДНК, которые могут использоваться и являются общеизвестными в данной области, описаны у Ausubel и соавт., (eds.), CurrentProtocols in Molecular Biology (Современные протоколы в молекулярной биологии), John WileySons,NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Нижеследующие регуляторные области животных, проявляющие тканеспецифичность и использующиеся у трансгенных животных, могут применяться для экспрессии представляющей интерес ДНКпоследовательности в определенном виде ткани: контрольная область гена эластазы I, которая активна в ацинарных клетках поджелудочной железы [Swift и соавт., Cell 38 (1984) 639-646; Ornitz и соавт., ColdSpring Harbor Symp. Quant. Biol. 50 (1986) 399-409; MacDonald, Hepatology 7 (1987) 425-515]; контрольная область инсулинового гена, которая активна в -клетках поджелудочной железы [Hanahan, Nature 315 (1985) 115-122], контрольная область гена иммуноглобулина, которая активна в лимфоидных клетках[Grosschedl и соавт., Cell 38 (1984) 647-658; Adames и соавт., Nature 318 (1985) 533-538; Alexander и соавт., Mol. Cell. Biol. 7 (1987) 1436-1444], контрольная область гена мышиного вируса злокачественной опухоли молочной железы, которая активна в тестикулярных клетках, клетках молочной железы, лимфоидных и тучных клетках [Leder и соавт., Cell 45 (1986) 485-495], контрольная область гена альбумина,которая активна в печени [Pinkert и соавт., Genes and Devel. 1 (1987) 268-276], контрольная область гена-фетопротеина, которая активна в печени [Krumlauf и соавт, Mol. Cell. Biol. 5 (1985) 1639-1648; Hammer и соавт., Science 235 (1987) 53-58]; контрольная область гена -1-антитрипсина, которая активна в печени [Kelsey и соавт., Genes and Devel. 1 (1987) 161-171], контрольная область гена -глобина, которая активна в миелоидных клетках [Morgan и соавт., Nature 315 (1985) 338-340; Kollias и соавт., Cell 46 (1986) 89-94]; контрольная область гена основного белка миелина, которая активна в олигодендроглиоцитных клетках головного мозга [Readhead и соавт., Cell 48 (1987) 703-712]; контрольная область гена легкой цепи-2 миозина, которая активна в скелетной мышце [Sani, Nature 314 (1985) 283-286], и контрольная область гена гормона гонадолиберина, которая активна в гипоталамусе [Mason и соавт., Science 234(1986) 1372-1378]. Способы доставки, применяемые в методах генной терапии, хорошо известны в данной области техники и/или описаны в разделе 5.4.6. 5.4.5. Ингибирующие последовательности антисмысловой мРНК и рибозима В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению содержит представляющую интерес ДНК-последовательность, которая кодирует антисмысловую или рибозимную РНК-молекулу. Методы получения и использования таких молекул хорошо известны специалистам в данной области техники. Антисмысловые РНК-молекулы действуют непосредственно, блокируя трансляцию мРНК в результате гибридизации с мРНК-мишенью и предотвращая трансляцию белка. Методы создания антисмысловой терапии включают в себя создание олигонуклеотидов, которые комплементарны целевому гену мРНК. Созданные антисмысловые олигонуклеотиды должны связываться с комплементарными транскриптами целевого гена мРНК и предотвращать трансляцию. Полная комплементарность, хотя и предпочтительна, не требуется. Последовательность, "комплементарная" участку РНК, на которую здесь ссылаются, подразумевает последовательность, обладающую достаточной комплементарностью, чтобы быть в состоянии гибридизоваться, по меньшей мере, с участком РНК, не принадлежащем полиА-участку, образуя стабильный дуплекс; если речь идет о двухцепочечных антисмысловых нуклеиновых кислотах, то можно протестировать одноцепочечную дуплексную ДНК, либо можно проанализировать образование триплекса. Способность к гибридизации зависит от степени комплементарности и от длины антисмысловой нуклеиновой кислоты. Вообще чем длиннее гибридизующаяся нуклеиновая кислота, тем больше несовпадающих оснований с РНК она может содержать, все еще образуя стабильный дуплекс (или триплекс, в зависимости от обстоятельств). Специалисты в данной области техники могут удостовериться в степени нарушения комплементарного спаривания гетероциклических оснований путем применения стандартных методик для определения точки плавления гибридного комплекса. Антисмысловые нуклеиновые кислоты должны обладать длиной по меньшей мере в шесть нуклеотидов и предпочтительно представлять собой олигонуклеотиды с длиной, изменяющейся примерно от 6 до 50 нуклеотидов. Для конкретных целей данный олигонуклеотид содержит по меньшей мере 10 нук- 18009388 леотидов, по меньшей мере 17 нуклеотидов, по меньшей мере 25 нуклеотидов или по меньшей мере 50 нуклеотидов. В других вариантах осуществления настоящего изобретения антисмысловые нуклеиновые кислоты содержат в длину по меньшей мере 100, по меньшей мере 250, по меньшей мере 500 и по меньшей мере 1000 нуклеотидов. Независимо от выбранной последовательности-мишени, предпочтительно, чтобы в исследованияхin vitro прежде всего осуществлялся количественный анализ способности данного антисмыслового олигонуклеотида ингибировать генную экспрессию. Предпочтительно, чтобы в данных исследованиях использовались контроли, позволяющие различать ингибирование антисмысловым геном и неспецифические биологические эффекты олигонуклеотидов. Предпочтительно также, чтобы в этих исследованиях сравнивались уровни РНК-мишени или белка с уровнями внутренней контрольной РНК или белка. Кроме того, предполагается сравнивать результаты, полученные с использованием антисмысловой ДНКпоследовательности, с результатами, полученными с использованием контрольной ДНКпоследовательности. Предпочтительно, чтобы данная контрольная ДНК-последовательность обладала примерно той же длиной, что и тестируемый олигонуклеотид, и чтобы ДНК-последовательность данного олигонуклеотида отличалась от антисмысловой последовательности не больше, чем это необходимо для предотвращения специфичной гибридизации с данной последовательностью-мишенью. Хотя можно использовать антисмысловые ДНК-последовательности, комплементарные участку последовательности, кодируемой данным геном-мишенью, наиболее предпочтительными являются антисмысловые ДНК-последовательности, комплементарные транскрибированному, нетранслируемому участку. Чтобы экспрессировать биологически активную РНК, например, молекулу антисмысловой РНК с вектора согласно изобретению, ДНК-последовательность, кодирующую биологически активную молекулу РНК, оперативно связывают с сильным промотором, pol III или pol II. Использование такой конструкции для трансфекции клеток-мишеней пациента приводит к транскрипции достаточных количеств одноцепочечных РНК, которые образуют комплементарные пары оснований с эндогенными транскриптами гена-мишени и, тем самым, предотвращают трансляцию мРНК гена-мишени. Например, вектор согласно изобретению можно ввести, например, так, чтобы он поглотился клеткой и управлял транскрипцией антисмысловой РНК. Такие векторы можно создавать с помощью технологии рекомбинантной ДНК стандартными способами. Экспрессия последовательности, кодирующей антисмысловую РНК, может осуществляться под любым промотором, известным в данной области, который действует у млекопитающих,предпочтительно в клетках человека. Такие промоторы могут быть индуцируемыми или конститутивными. Такие промоторы включают в себя, но не ограничиваясь этим, промотор ранней области SV40 [Bernoist and Chambon, Nature 290 (1981) 304-310], промотор, содержащийся в утроенном концевом повторе вируса саркомы Рауса [Yamamoto, и соавт., Cell 22 (1980) 787-797], тимидинкиназный промотор герпеса[Wagner, и соавт., Proc. Natl. Acad. Sci. U.S.A. 78 (1981) 1441-1445], регуляторные последовательности гена металлотионеина [Brinster, и соавт., 1982, Nature 296 (1982) 39-42] и т.д. и т.п. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению содержит ДНК-последовательность, которая кодирует рибозим. Рибозимные молекулы, предназначенные для каталитического расщепления транскриптов мРНК гена-мишени, можно также использовать для предотвращения трансляции мРНК гена-мишени и, следовательно, для экспрессии продукта генамишени [см., например, Международная публикация (РСТ) WO90/11364, опубликованная 4 октября,1990 г.; Sarver, и соавт., Science 247 (1990) 1222-1225]. Рибозимы представляют собой ферментативные РНК-молекулы, способные катализировать специфическое расщепление РНК. [См. обзор Rossi, Current Biology 4 (1994) 469-471]. Механизм рибозимного действия включает в себя специфичную гибридизацию последовательности рибозимной молекулы с комплементарной РНК-мишенью и последующее эндонуклеолитическое расщепление. Структура рибозимных молекул должна включать одну или несколько последовательностей, комплементарных мРНК генамишени, и должна включать в себя хорошо известную каталитическую последовательность, ответственную за расщепление мРНК. Что касается этой последовательности, см., например, патент США 5093246, включенный здесь путем ссылки во всей его полноте. Несмотря на то что рибозимы, которые расщепляют мРНК на сайт-специфичные распознаваемые последовательности, могут использоваться для разрушения молекул мРНК гена-мишени, предпочтительно использование молотовидных рибозимов. Молотовидные рибозимы расщепляют молекулы мРНК в местах, определяемых фланкирующими областями, которые образуют с мРНК-мишенью комплементарные пары оснований. Единственное требование состоит в том, чтобы мРНК-мишень обладала следующей последовательностью из двух оснований: 5'-UG-3'. Конструкция и получение молотовидных рибозимов хорошо известны в данной области техники и более полно описаны у Myers, 1995, MolecularBiology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, New York, (см., в частности,фиг. 4, с. 833) и у HaseloffGerlach, Nature, 334 1988) 585-591, который включен здесь путем ссылки во всей ее полноте. Предпочтительно рибозим создают биотехнологически так, чтобы сайт узнавания расщепления локализовался вблизи 5'-конца гена-мишени мРНК, т.е. для увеличения эффективности и минимизации- 19009388 внутриклеточного накопления нефункциональных транскриптов мРНК. Рибозимы согласно изобретению включают в себя также эндорибонуклеазы РНК (далее "Cech-type рибозимы"), одна из которых встречается в природе у Tetrahymena thermophila (известная как IVS, или L19 IVS РНК) и которая широко описана Thomas Cech и соавторами [Zaug, и соавт., Science, 224 (1984) 574-578; Zaug and Cech, Science, 231 (1986) 470-475; Zaug, и соавт., Nature, 324 (1986) 429-433; опубликована в международной патентной заявкеWO88/04300 by University Patents Inc.; BeenCech, Cell, 47(1986) 207-216]. Cech-type рибозимы обладают активным сайтом из восьми пар комплементарных оснований, который гибридизуется с последовательностью РНК-мишени, после чего происходит расщепление данной РНК-мишени. Настоящее изобретение включает в себя такие Cech-type-рибозимы, которые нацелены на последовательности активного сайта с восемью парами комплементарных оснований,представленных в данном гене-мишени. Экспрессия рибозима может происходить под контролем сильного конститутивного промотора polIII или pol II, так, что трансфицированные клетки будут продуцировать достаточные количества данного рибозима для разрушения последовательностей РНК эндогенного гена-мишени и ингибирования трансляции. Поскольку рибозимные молекулы, в отличие от антисмысловых молекул, являются каталитическими, для их эффективности нужна сниженная внутриклеточная концентрация. В тех случаях, когда описанные здесь антисмысловые и/или рибозимные молекулы используются для подавления экспрессии мутантного гена, существует вероятность того, что данный метод может столь эффективно снизить или ингибировать трансляцию мРНК, производимой аллелями нормального гена-мишени, что, по-видимому, может возникнуть ситуация, при которой концентрация имеющегося продукта нормального гена-мишени может оказаться более низкой, чем это необходимо для нормального фенотипа. Поэтому, чтобы обеспечить в таких случаях поддержание практически нормальных уровней активности гена-мишени, молекулы нуклеиновой кислоты, которые кодируют и экспрессируют полипептиды гена-мишени, демонстрирующие нормальную активность гена-мишени, могут быть введены в клетки с помощью способов генной терапии, таких, которые описаны ниже в разделе 5.4.4 и не содержат последовательностей, восприимчивых к любой используемой антисмысловой, рибозимной или трехспиральной обработке. Альтернативно, в случаях, когда данный ген-мишень кодирует внеклеточный белок,его предпочтительно можно ввести совместно с белком нормального гена-мишени для поддержания требуемого уровня активности гена-мишени. Способы введения данного рибозима и антисмысловых РНК-молекул хорошо известны в данной области и/или описаны в разделе 5.4.6. 5.4.6. Фармацевтические композиции и способы их введения В предпочтительном аспекте фармацевтические средства согласно изобретению включают в себя практически очищенный вектор согласно изобретению (например, практически свободный от веществ,которые ограничивают его действие или вызывают нежелательные побочные эффекты). Пациент, которому вводят фармацевтическое средство способами настоящего изобретения, предпочтительно является животным, включая, но, не ограничиваясь ими, таких животных, как коровы, свиньи, лошади, цыплята,кошки, собаки и т.п., и предпочтительно является млекопитающим, но наиболее предпочтительно является человеком. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению непосредственно вводят in vivo, где представляющая интерес ДНК-последовательность экспрессируется,чтобы произвести кодируемый продукт. Это можно осуществить любым из многочисленных способов,известных в данной области. Векторы согласно изобретению могут быть введены таким образом, что их последовательности нуклеиновых кислот становятся внутриклеточными. Векторы согласно изобретению могут быть введены путем прямой инъекции "раздетой" ДНК; с использованием бомбардировки микрочастицами (например, генным ружьем; Biolistic, Dupont); покрытых липидами или рецепторами клеточной поверхности, или трансфицирующими агентами; инкапсулированными микрочастицами или микрокапсулами; могут быть введены путем присоединения к пептиду, о котором известно, что он проникает в ядро; введены путем присоединения к лиганду, подверженному рецептор-опосредованному эндоцитозу[см., например, Wu and Wu, J. Biol. Chem. 262 (1987) 4429-4432] (что можно использовать для специфических видов клеток-мишеней, экспрессирующих данные рецепторы); и т.д. и т.п. В конкретном варианте осуществления настоящего изобретения данное соединение или композицию можно доставить в везикуле, в частности, в липосоме [см. Langer, Science 249 (1990) 1527-1533; Treat и соавт., 1989, в Liposomesin the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353365; Lopez-Berestein, там же, pp. 312-327]. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению покрывают липидами или рецепторами клеточной поверхности, или трансфицирующими агентами, либо сшивают с гомеобокс-подобным пептидом, о котором известно, что он проникает в ядро [см., например,Joliot и соавт., Proc. Natl. Acad. Sci. USA 88 (1991) 1864-1868], и т.д. и т.п. В некоторых других вариантах осуществления настоящего изобретения могут быть образованы комплексы нуклеиновой кислоты с лигандом, в которых данный лиганд содержит способный к слиянию вирусный пептид для разрушения эндосом, позволяя данной нуклеиновой кислоте избежать лизосомной- 20009388 деградации. В других вариантах осуществления настоящего изобретения вектор согласно изобретению может быть целевым in vivo для поглощения специфичной клеткой и экспрессии с помощью направляющего специфичного рецептора (см., например, РСТ-Публикации WO 92/06180; WO 92/22635; WO 92/20316;WO 93/14188 и WO 93/20221). Способы, используемые в настоящем изобретении, включают в себя неограничивающим образом пути введения внутрикожный, внутримышечный, внутрибрюшинный, подкожный, интраназальный, эпидуральный и пероральный. Кроме того, способы, используемые в настоящем изобретении, включают в себя введение любым традиционным путем, например, путем инфузии или болюсной инъекции, путем впитывания через эпителиальную или слизисто-кожную выстилку (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки и кишечника, и т.д.). В конкретном варианте осуществления настоящего изобретения желательно вводить вектор согласно изобретению путем инъекции, при помощи катетера, при помощи свечи или при помощи имплантата, представленного пористым, непористым, или желатинообразным материалом, включая мембрану, такую как сиаловая или волокнистая. При уходе за больным следует использовать материалы, которые не впитывают данный вектор. Введение может быть системным или локальным. В некоторых вариантах осуществления настоящего изобретения вектор согласно изобретению вводят вместе с другими биологически активными агентами, такими как химиотерапевтические агенты или агенты, которые усиливают иммунную систему. Еще в одном варианте осуществления настоящего изобретения способы, используемые в настоящем изобретении, включают в себя доставку с помощью контролируемой системы высвобождения. В одном из вариантов осуществления настоящего изобретения можно использовать насос [см. Langer, выше;Sefton, CRC Crit. Ref. Biomed. Eng. 14 (1989) 201; Buchwald и соавт., Surgery 88 (1980) 507; Saudek и соавт., N. Engl. J. Med. 321 (1989) 574]. В другом варианте осуществления настоящего изобретения могут использоваться полимерные материалы [см. Medical Applications of Controlled Release (Применение контролируемого высвобождения в медицине), 1974, Langer and Wise (eds.), CRC Press., Boca Raton, Florida;Controlled Drug Bioavailability, Drug Product Design and Performance (Контролируемая биологическая доступность лекарственного средства, Создание лекарственного продукта и его эффективность), 1984,Smolen and Ball (eds.), Wiley, New York; Ranger and Peppas, Macromol. Sci. Rev. Macromol. Chem. 23Howard и соавт., J. Neurosbrg. 71 (1989) 105]. Другие контролируемые системы высвобождения рассматриваются в обзоре у Langer, Science 249(1990) 1527-1533. Фармацевтические композиции согласно изобретению включают в себя терапевтически эффективное количество вектора согласно изобретению и подходящий фармацевтический носитель. В конкретном варианте осуществления настоящего изобретения термин "подходящий фармацевтический носитель" подразумевает носитель, апробированный регулирующим агентством Федерального правительства или Штата или каталогизированный в Фармакопее США, или в других общепризнанных фармакопеях для животных и, в частности, для человека. Термин "носитель" относится к разбавителю, адъюванту, наполнителю или к носителю, с которым вводят терапевтическое средство. Такие подходящие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, масло соевых бобов, минеральное масло, кунжутное масло и им подобные. Вода является предпочтительным носителем, если данную фармацевтическую композицию вводят внутривенно. Солевые растворы и водная декстроза, а также растворы глицерина, могут также использоваться в качестве жидких носителей,особенно для инъекционных растворов. Подходящие фармацевтические наполнители включают в себя крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, натрийстеарат, глицеринмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, вода,этанол и тому подобное. По желанию данная композиция может содержать небольшие количества увлажняющих или эмульгирующих агентов или агентов, оказывающих буферное действие на рН. Эти композиции могут принимать форму растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков,составов с замедленным высвобождением и тому подобное. Данная композиция может быть составлена в виде суппозитория, с традиционными связывающими элементами и носителями, такими как триглицериды. Пероральная композиция может включать в себя обычные носители, такие как фармацевтически чистые маннит, лактоза, крахмал, магнийстеарат, натрийсахарин, целлюлозу, углекислый магний и т.п. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" под ред. E.W. Martin. Такие композиции должны содержать терапевтически эффективное количество нуклеиновой кислоты или белка согласно изобретению, предпочтительно в очищенной форме, вместе с соответствующим количеством носителя, с тем, чтобы создать форму для надлежащего введения данному пациенту. Композиция должна соответствовать способу введения. В конкретном варианте осуществления настоящего изобретения фармацевтические средства согласно изобретению составляются в соответствии со стандартными методиками в качестве фармацевти- 21009388 ческой композиции, адаптированной для внутривенного введения человеку. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости фармацевтическое средство согласно изобретению может также включать в себя солюбилизирующий агент и местное анестезирующее средство, такое как лидокаин, для облегчения боли на участке инъекции. В большинстве случаев указанные ингредиенты вносят либо раздельно, либо вместе, в форме дозированной единицы, например, в виде безводного лиофилизованного порошка или в виде безводного концентрата в герметически запаянном контейнере, таком как ампула или саше с указанием количества активного агента. Если данное фармацевтическое средство согласно изобретению вводят путем вливания, его можно дозировать с помощью инфузионной емкости, содержащей стерильную фармацевтически чистую воду или физиологический раствор. Если же фармацевтическое средство согласно изобретению вводят путем инъекции, ампулу со стерильной водой для инъекции или физиологическим раствором можно изготовить так, чтобы данные ингредиенты можно было перед введением смешивать. Для буккального введения данные композиции можно брать в виде таблеток или ромбовидных таблеток, создаваемых традиционном способом. Для введения путем ингаляции данные соединения, используемые в соответствии с настоящим изобретением, обычно доставляют в виде распыляемого раствора, поставляемого в герметизированных пакетах или в аэрозольном аппарате с использованием подходящего газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или иного подходящего газа. В случае герметизированного аэрозоля дозированную единицу можно определить с помощью клапана для выпуска контролируемого количества аэрозоля. Можно создать капсулы и ампулы, например, с желатином, в ингаляторе или инсуффляторе, содержащими смесь согласно изобретению и соответствующую порошкообразную основу, такую как лактоза или крахмал. Количество вектора согласно изобретению, которое должно быть эффективным для лечения или для профилактики указанного заболевания, можно определить с помощью стандартных клинических методов. Кроме того, необязательно использовать in vivo-анализы, чтобы помочь установить оптимальный диапазон доз. Точная доза, которую используют при подборе состава, должна также зависеть от пути введения, а также стадии указанного заболевания, и должна быть определена в соответствии с решением практикующего врача и истории болезни каждого пациента. Эффективные дозы можно получить путем экстраполяции из дозозависимых кривых, полученных in vitro или в тест-системах модельного животного. Настоящее изобретение можно лучше понять при ознакомлении с нижеследующими неограничивающими примерами, которые созданы в качестве типичных в настоящем изобретении. Нижеследующие примеры представлены с целью более основательной иллюстрации предпочтительных вариантов осуществления настоящего изобретения. Вместе с тем, они никоим образом не должны ограничивать рамки настоящего изобретения. 6. Примеры 6.1. Пример 1. Клонирование векторов super6 и super6wt и анализ их экспрессирующих характеристик. Векторные плазмиды super6 (фиг. 1) и super6wt получают соответственно на основе ранее полученных векторов VI (фиг. 2) и VIwt для генной вакцинации. Векторы VI и VIwt представляют собой, в основных чертах, синтетические бактериальные плазмиды, которые содержат транспозон Tn903, производное маркерного гена, устойчивого к канамицину [Oka, А., и соавт., J. Mol. Biol. 147 (1981) 217-226], и модифицированную форму репликона рМВ 1 [Yanisch-Perron, С., и соавт., Gene 33 (1985) 103-119], необходимого для размножения в клетках Escherichia coli. Векторы VI и VIwt содержат также предранний промотор цитомегаловируса, объединенный с лидерной последовательностью TK HSV1 и с последовательностью гена -глобина кролика, оба из которых получены из плазмиды pCG [Tanaka, M., и соавт., 69(1990) Cell 375-386]. Последние элементы нужны для экспрессии nef-кодирующей последовательности,полученной из HAN2-изолята штамма ВИЧ-1 [Sauermann, U., и соавт., AIDS Research. Hum. Retrov. 6(1990) 813-823]. Экспрессирующие векторы nef непосредственно слева от CMV-промотора несут группу из десяти сайтов, связывающих с высоким сродством Е 2 (производные плазмиды pUC1910BS, неопубликовано). Родительский вектор VI содержит модифицированную последовательность, кодирующую Е 2: шарнирная область Е 2 (аминокислоты 192-311) заменяется четырьмя глицин-аланиновыми повторамиEBNA1-белка вируса Эпштейна-Барр [Baer, R.J., и соавт., Nature 310 (1984) 207-211]. Белок, кодируемый данной последовательностью, носит название E2d192-311+4G. Родительский вектор VIwt содержит экспрессирующую кассету белка Е 2 дикого типа, из папилломавируса крупного рогатого скота тип 1, с точковыми мутациями, введенными для исключения кодирующей способности открытой рамки считывания Е 2 и Е 4 (ORF) в два стоп-кодона в обоих этих ORF. Кодирующие последовательности Е 2 клонируют в данных векторах между провирусным 5'-LTR вируса саркомы Рауса [Long, E.O., и соавт., Hum. Immunol. 31 (1991) 229-235] и областью полиаденилирования ростового гормона крупного рогатого скота [Chesnut,J.D., и соавт., J. Immunol. Methods 193 (1996) 17-27]. Плазмидные векторы super6 и super6wt конструируют путем делетирования из родительских векто- 22009388 ров соответственно VI и VIwt, всех -глобиновых последовательностей справа от nef-гена, за исключением второго интрона кроличьего -глобинового гена. Данные -глобиновые последовательности (особенно фрагмент экзона) демонстрируют некоторую гомологию с последовательностями человеческого глобинового гена, тогда как интрон не обладает какой-либо существенной гомологией с геномными последовательностями человека. Данный интрон амплифицируют с помощью ПЦР из плазмиды pCG [Tanaka, M., и соавт., Cell 60 (1990) 375-386] с использованием олигонуклеотидов, содержащих некоторые несовпадения (мисматчи) для модификации последовательностей сплайсирующего донорного и акцепторного сайтов интрона, до полного соответствия с консенсусными мотивами. Затем область полиаденилирования тимидинкиназного гена вируса простого герпеса типа 1 из pHook [Chesnut, J.D., и соавт., J.Immunol. Methods 193 (1996) 17-27] клонируют сразу по 3'-концу данного интрона, потому что в родительских плазмидах используется сигнал полиаденилирования кроличьего -глобина. Экспрессирующие характеристики белков Nef и Е 2, экспрессируемых с помощью плазмидных векторов super6 и super6wt, анализируют и сравнивают с экспрессирующими характеристиками белков Nef и Е 2, экспрессируемых с помощью VI и VIwt в Вестерн-блоттинге [Towbin и соавт., Proc. Natl. Acad. Sci.USA 76 (1979) 4350-4354] с моноклональными антителами к Nef и Е 2. Вначале Jurkat-клетки (лимфобластоидная клеточная линия Т-клеток человека) трансфицируют путем электропорации [Ustav и соавт.EMBO J. 2(1991) 449-457] 1 мкг super6, super6wt или эквимолярными количествами плазмид VI, VIwt. В качестве контроля используют эквимолярное количество вектора II (фиг. 3), который содержит идентичную Nef-кассету, но без Е 2-кодирующей последовательности. ДНК-носитель используют в качестве негативного контроля. Вкратце, данную плазмиду и ДНК-носитель смешивают с данной клеточной суспензией в 0,4 см кювете для электропорации (BioRad Laboratories, Hercules, США) и воздействуют электрическим импульсом (200 В; 1 мФ) с использованием ген-пульсатора IITM с наполнителем емкости (BioRadLaboratories, Hercules, США). Через 49 ч после трансфекции клетки лизируют путем обработки с помощью буфера для образцов,содержащего 50 мМ Трис-HCl рН 6,8; 2% SDS, 0,1% бромфенолового синего, 100 мМ дитиотрейтола, и 10% (v/v) глицерина. Полученные лизаты разделяют в 10%-ном или 12,5%-ном SDS-полиакриламидном геле и затем переносят на 0,45 мкм PVDF-нитроцеллюлозную мембрану (Millipore). Эту мембрану вначале блокируют в течение ночи в блокирующем растворе, содержащем 5% сухого молока (обезжиренного),0,1% Твин 20 в 50 мМ Трис-HCl рН 7,5; 150 мМ NaCl, и затем инкубируют в течение 1 ч с разбавленной в данном блокирующем растворе моноклональной антисывороткой анти-Nef (1:100) или анти-Е 2 антисывороткой (1:1000). После каждой стадии инкубирования несвязавшиеся белки удаляют путем трехкратного промывания полос с помощью TBS-0,1% Твин-20. Связавшиеся первичные иммуноглобулины детектируют путем инкубации этих полос с пероксидазой хрена, конъюгированной с антителами против мышиного IgG (Labas, Estonia), и последующей визуализации с использованием хемолюминисцентной системы детекции (Amersham Pharmacia Biotech, United Kingdom). Полученные результаты представлены на фиг. 4. Экспрессия Nef-белка показана на панели А, а экспрессия Е 2-белка - на панели В. Стрелками указаны истинные молекулярные размеры белков Nef и Е 2. Уровень экспрессии E2d192-311+4GA очень низкий, и по этой причине его невозможно видеть на блоте,представленном на фиг. 4. Количества Nef, экспрессируемого из плазмид super6, super6wt, VI и VIwt (дорожки 1-4 на фиг. 4 А),довольно сходны (фиг. 4, панель А, дорожки 1-4). Гораздо меньше белка продуцируется плазмидой II(дорожка 5). Уровни экспрессии Nef-белка выше в векторах, содержащих wtE2 (ср. дорожку 1 с дорожкой 2, а дорожку 3 с дорожкой 4). Это находится в соответствии с уровнями экспрессии белков Е 2 иE2d192-311+4GA из этих плазмид (фиг. 4, панель В). 6.2. Пример 2. Клонирование и анализ экспрессирующих свойств плазмид в группе product1 и NNV. Чтобы увеличить численность копий векторов super6 и super6wt в Escherichia coli, в этих векторах осуществляют дополнительные модификации. Ген устойчивости к канамицину Tn903, репликон рМВ 1 и десять сайтов, связывающих Е 2, удаляют обработкой с помощью HindIII/Nhel с последующим замещением на HindIII/Nhel-фрагмент из ретровирусного вектора pBabe Neo [Morgenstern, J.P. and Land, H., Nucleic Acids Research 18 (1990) 3587-3596]. Данный фрагмент содержит модифицированный репликонpMBl и ген устойчивости к канамицину Tn5, что позволяет ослабить тираж репликации данных плазмид в клетках бактерий. Полученные новые плазмиды назвали соответственно product1 (фиг. 5) и product1wt. Неудачная попытка вновь встроить обратно десять сайтов, связывающих Е 2, в затупленный Nhel-сайт слева от CMV-промотора привела, соответственно, к образованию вектора New Vector NNV лишь с двумя сайтами связывания, интегрированными в данную плазмиду. Дополнительные десять сайтов, связывающих Е 2, встраивают из плазмиды pUC1910BS в полученный New Vector непосредственно справа от экспрессирующей кассеты Е 2. Эти новые векторы назвалиNNV-1 и NNV-2 (фиг. 6 А). Для того чтобы заменить E2d192-311+4GA на wt Е 2 (с делетированнымиORFs Е 3 и Е 4), последовательность, кодирующую E2d192-311+4GA, содержащую фрагмент Bsp120I,замещают на wtE2, содержащую аналогичный фрагмент Bsp120I из super6wt. Образовавшиеся плазмиды- 23009388 назвали соответственно NNV-1wt и NNV-2wt (фиг. 6 В). Цифры 1 и 2 в векторах группы NNV означают ориентацию области 10 сайтов, связывающих Е 2, относительно экспрессирующей кассеты Е 2. Экспрессирующие свойства Nef-белка из NNV-плазмид, т.е. NNV-1, NNV-2, NNVwt и NNV-2wt,анализируют после трансфекции Jurkat-клеток с помощью электропорации при концентрации плазмиды 1 ig и сравнивают с экспрессирующими свойствами Nef-белков из super6 и super6wt методом Вестернблоттинга, практически так, как описано в примере 1. Количества super6 и super6wt, используемые для трансфекции, соответственно, составляют 0,95 и 1 ig. Полученные результаты представлены на фиг. 7. Векторы NNV-1 и NNV-2 обладают экспрессирующим потенциалом, аналогичным таковому плазмиды super6, что очевидно из сравнения дорожек 1 и 2 фиг. 8 с дорожкой 5. Это же относится к векторамNNV-1wt, NNV-2wt и super6wt (сравнить дорожки 3 и 4 с дорожкой 6 на фиг. 7). В соответствии с предварительными результатами экспрессии данных плазмид, экспрессия wt E2 производит больше Nefбелка, чем векторы E2d192-311+4GA (сравнить дорожку 1 с дорожкой 3, а с дорожку 2 с дорожкой 4 на фиг. 7). В этой связи и поскольку Nef-экспрессия из NNV-2wt несколько выше экспрессии из NNV-1wt,вектор NNV-2wt отбирают для последующих опытов. 6.3. Пример 3. Анализ экспрессирующих свойств NNV-2wt. Для анализа экспрессирующих свойств NNV-2wt, четыре отличающиеся клеточные линии, т.е. Jurkat (лимфобластоидные Т-клетки человека), Р 815 (клетки мастоцитомы мыши), СНО (овариальные клетки китайского хомячка) и RD (клетки рабдомиосаркомы эмбриона человека), трансфицируют с помощью электропорации и анализируют в них экспрессию Nef и Е 2. Для обнаружения активации транскрипции и поддержания характеристик, опосредуемых белком Е 2 и Е 2-олигомеризованными связывающими сайтами, в качестве контроля используют product1wt (фиг. 5). Плазмидный контроль дополняют плазмидойNNV-2wtFS, которая отличается от NNV-2wt наличием сдвига рамки считывания, вводимой в последовательность, кодирующую Е 2, в результате чего функциональный белок Е 2 не экспрессируется. Каждую клеточную линию трансфицируют разными количествами векторной ДНК с помощью электропорации, практически так же, как описано в примере 1. Временные точки берут примерно через два или пять дней после трансфекции. Результаты анализа представлены на фиг. 8 и 10.Jurkat-клетки трансфицируют 0,5 или 2 мкг NNV-2wt (дорожки 1, 2, 8 и 9 на фиг. 8), а также равными количествами плазмид NNV-2wtFS (дорожки 3, 4, 10 и 11 на фиг. 8) и product1wt (дорожки 5, 6, 12 и 13 на фиг. 8) или только носителем (дорожки 7 и 14 на фиг. 8). Временные точки берут через 44 ч (дорожки 1-7) и 114 ч (дорожки 8-14) после трансфекции. Экспрессию белков Nef и Е 2 анализируют методом Вестерн-блоттинга практически так же, как описано в примере 1. Клетки Р 815 трансфицируют 0,5 или 2 мкг NNV-2wt (дорожки 1, 2, 8 и 9 на фиг. 9) и равными количествами плазмид NNV-2wtFS (дорожки 3, 4, 10 и 11 на фиг. 9) и product 1wt (дорожки 5, 6, 12 и 13 на фиг. 9) или только носителем (дорожки 7 и 14 на фиг. 9). Временные точки берут через 45 ч (дорожки 17) и 119 ч (дорожки 8-14) после трансфекции. Экспрессию белков Nef анализируют методом Вестернблоттинга практически так же, как описано в примере 1. Блот с антителами против Е 2, через 119 ч после трансфекции, не представлен потому, что нет специфичного сигнала, который можно было бы детектировать. Обычно в этих клетках уровень экспрессии Nef-белка коррелирует с уровнем экспрессии Е 2 белка, что подтверждается тем фактом, что функция Е 2-белка состоит в активации транскрипции и помощи плазмиде для поддержки длительное время в пролиферирующих клетках. Клетки СНО трансфицируют 0,5 или 2 мкг NNV-2wt (дорожки 1, 2, 8 и 9 на фиг. 10) и равными количествами плазмид NNV-2wtFS (дорожки 3, 4, 10 и 11 на фиг. 10) и product1wt (дорожки 5, 6, 12 и 13 на фиг. 10) или только носителем (дорожки 7 и 14 на фиг. 10). Временные точки берут через 48 ч (дорожки 1-7) и 114 ч (дорожки 8-14) после трансфекции. Экспрессию белков Nef анализируют методом Вестернблоттинга практически так же, как описано в примере 1. Клетки RD трансфицируют 0,5 или 2 мкг NNV-2wt (дорожки 1, 2, 8 и 9 на фиг. 11) и равными количествами плазмид NNV-2wtFS (дорожки 3, 4, 10 и 11 на фиг. 11) и product1wt (дорожки 5, 6, 12 и 13 на фиг. 11) или только носителем (дорожки 7 и 14 на фиг. 11). Временные точки берут через 39 ч (дорожки 1-7) и 110 ч (дорожки 8-14) после трансфекции. Экспрессию белков Nef анализируют методом Вестернблоттинга практически так же, как описано в примере 1. Во всех четырех клеточных линиях уровень экспрессии Nef-белка, взятый в ранних временных точках (дорожки 1-7 на фиг. 8-11) и в поздних временных точках (дорожки 8-14 на фиг. 8-11), для плазмидыNNV-2wt оказывается выше, чем для контрольных векторов. Превосходство NNV-2wt более очевидно в поздних временных точках, как следует из сравнения дорожки 8 с дорожками 10 и 12 на фиг. 8, а также из сравнения дорожки 9 с дорожками 11 и 13 на фиг. 8-10. Картину экспрессии РНК этих плазмид анализируют также с использованием Нозерн-анализа [Alwine, J.С., и соавт., Proc. Natl. Acad. Sci. USA 74 (1977) 5350-5354] для вектора NNV-2wt. С этой целью клетки Jurkat и СНО трансфицируют 2 мкг NNV-2wt. Для трансфекции клеток Р 815 используют 10 мкгNNV-2wt. Трансфекции осуществляют практически так же, как описано в примере 1. Через 48 ч после трансфекции экстрагируют тотальную РНК с использованием набора RNAeasy (Qiagen) и образцы, содержащие 21 мкг (Р 815), 15 мкг (СНО) или 10 мкг (Jurkat) РНК, анализируют с помощью электрофореза- 24009388 в денатурирующих условиях (1,3% агарозный гель, содержащий 20 мМ MOPS рН 7,0; 2 мМ NaOAc; 1 мМ ЭДТА рН 8,0; 2,2 М формальдегида). Буфер для электрофореза содержит те же компоненты, за исключением формальдегида. Образцы вносят в буфер, содержащий формамид и формальдегид. После электрофореза разделенные образцы РНК блотируют на мембрану HybondN+ (Amersham Pharmacia Biotech, United Kingdom) и гибридизуют с помощью меченой радиоактивной меткой последовательности,кодирующей nef, последовательности, кодирующей Е 2, или целыми векторными зондами. В качестве контроля используют РНК из клеток, трансфицированных носителем. Результаты Нозерн-блот-анализа представлены на фиг. 12. Полученные результаты свидетельствуют о том, что нет других видов РНК, кроме комплементарных мРНК для Е 2 и nef, которые экспрессируются из данного вектора, поскольку дополнительные сигналы, при сравнении со специфичными nef- и Е 2-гибридизациями (сравнить дорожки 1-12 с дорожками 1318 на фиг. 12), не детектируются целым векторным зондом. 6.4. Пример 4. Анализ присоединения NNV-2wt к митотическим хромосомам. Присоединение NNV-2wt к митотическим хромосомам в СНО-клетках анализируют с помощью флуоресцентной гибридизации in situ (FISH) [Tucker J.D., и соавт., В: J.E.Celis (ed.), Cell Biology: A Laboratory Handbook, vol. 2, p. 450-458. Academic Press, Inc. New York, NY. 1994]. Через 36 ч после трансфекции клеток СНО путем электропорации с помощью 1 мкг NNV-2wt или с помощью эквимолярных количеств контрольных плазмид NNV-2wtFS и product1wt (осуществляемой практически так же, как описано в примере 1), данные культуры обрабатывают колхицином (Gibco) для задержки данных клеток в метафазе митоза. Вкратце, клетки выдерживают с колхицином, добавляемым в среду в конечной концентрации 0,1 мкг/мл в течение 1-4 ч для блокирования в митозе клеточного цикла. Путем обработки трипсином собирают блокированные клетки и суспендируют в 0,075 М KClрастворе, инкубируют при комнатной температуре в течение 15 мин, и фиксируют в смеси метанолледяная уксусная кислота (3:1, об./об.) ледяной температуры. Распластанные метафазные хромосомы и интерфазные ядра для анализа методом флуоресцентной гибридизации in situ получают путем раскапывания клеток на влажные предметные стекла. Для одной культуры получают несколько предметных стекол. Гибридизационные зонды создают путем ник-трансляции с использованием биотин-16-dUTP в качестве метки и плазмиды Product1wt в качестве матрицы. Типичная ник-трансляционная реакционная смесь содержит буфер для ник-трансляции, немеченые dNTPs, биотин-16-dUTP и ДНК-полимеразу Е.coli. Хромосомные препараты денатурируют при 70 С в 70%-ном формамиде (рН 7,0-7,3) в течение 5 мин, после чего сразу обезвоживают серией промывок (ледяные промывки 70%, 80% и 96%-й этанолом,каждая, в течение 3 мин) и сушат на воздухе. Гибридизационную смесь (18 мкл на предметное стекло) составляют из 50% формамида в 2xSSC (1xSSC представляет собой 0,15 М NaCl и 0,015 М цитрат натрия), 10% декстрансульфата, 150 нг биотинилированного плазмидного ДНК-зонда и 10 мкг ДНКносителя из спермы сельди. Через 5 мин денатурации при 70 С на каждый препарат на предметном стекле наносят ДНК-зонд, герметизируют покровным стеклом и гибридизуют в течение ночи при 37 С во влажной камере. Полученные препараты на покровных стеклах промывают в трех сменах 2xSSC, nd 2xSSC, содержащего 0,1% IGEPAL CA-630 (Sigma Chemical Co.) при 45 С. Перед иммунофлуоресцентным детектированием препараты на покровных стеклах преинкубируют в течение 5 мин в PNM-буфере[PN-буфер (25,2 г Na2HPO47H2O, 0,83 г NaH2PO4H2O и 0,6 мл IGEPAL СА-630 в 1 л H2O) с 5% обезжиренного сухого молока и 0,02% азида натрия]. Затем полученный зонд детектируют с помощью конъюгированного с флуоресцеинизотиоцианатом(FITC) экстравидина. Полученный сигнал усиливают с помощью биотинилированного антитела против авидина и второй серии экстравидин-ПТС-обработки. Между каждой стадией препараты на предметных стеклах промывают при комнатной температуре в течение 2x5 мин в PN-буфере, содержащем 0,05%IGEPAL CA-630. Хромосомы контрастируют радиоактивным йодистым пропидием и погружают в гистологическую среду с парафенилендиамином реагентом, предотвращающим выцветание. Препараты на предметных стеклах анализируют с помощью флуоресцентного микроскопа OlympusVANOX-S, снабженного соответствующим набором фильтров. Полученные результаты представлены в табл. 1. Полученные данные ясно свидетельствуют о том, что белок Е 2 и его сайты связывания необходимы для присоединения к хромосомам, так как только NNV-2wt, но не другие два вектора, обладают данной способностью. 6.5. Пример 5. Стабильность NNV-2wt во время размножения в бактериальных клетках. Анализируют стабильность NNV-2wt во время ее размножения в бактериальных клетках. ПлазмидуNNV-2wt смешивают с компетентными клетками Escherichia coli, штамм DH5 альфа [полученными как описано у Inoue, H., и соавт., Gene 96 (1990) 23-28], и инкубируют на льду в течение 30 мин. Затем данную суспензию клеток подвергают тепловому шоку в течение 3 мин при 37 С с последующим быстрым охлаждением на льду. К полученному образцу приливают 1 мл LB-среды, и данную смесь инкубируют в течение 45 мин при 37 С и энергичном встряхивании. Наконец, часть клеток пассируют в чашки, содержащие LB-среду с 50 мкг/мл канамицина. На следующий день клетки из одиночной колонии переносят в новые чашки, содержащие такую же среду. Данную операцию повторяют до тех пор, пока не вырастут четыре генерации бактерий, после чего в колониях каждой генерации анализируют плазмидную ДНК. Одну колонию из каждой генерации используют для инокуляции в 2 мл LB-среды, содержащей 50 мкг/мл канамицина, с последующим инкубированием в течение ночи при 37 С и энергичном встряхивании. Собирают инкубированные клетки, и из собранных клеток экстрагируют плазмидную ДНК с использованием классического лизиса путем кипячения. [Sambrook, S., и соавт., Molecular Cloning A Laboratory Manual. Second ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York]. Полученные образцы обрабатывают рестрикционной эндонуклеазой XbaI (Fermentas, Lithuania) и анализируют с помощью электрофореза в агарозном геле в сравнении с исходной ДНК, используемой для трансформации. Полученные результаты представлены на фиг. 13. Как можно видеть на фиг. 13, данный вектор стабилен во время пассирования в клетках Escherichiacoli: колонии с перестройками не наблюдаются при сравнении с ДНК, используемой для трансформации(дорожка 9). 6.6. Пример 6. Стабильность NNV-2wt в эукариотических клетках. Стабильность плазмиды NNV-2wt в качестве нереплицирующегося эписомного элемента анализируют также в эукариотических клетках. Для этой цели клетки СНО и Jurkat трансфицируют с помощью 2 мкг NNV-2wt. Из этих клеток через 24, 72 или 96 ч после трансфекции экстрагируют тотальную ДНК. Вкратце, данные клетки лизируют в 20 мМ Трис-HCl рН 8,0; 10 мМ ЭДТА рН 8,0; 100 мМ NaCl; 0,2%SDS; в присутствии 200 мкг/мл протеиназы К (Fermentas, Lithuania). Затем полученные образцы последовательно экстрагируют фенолом и хлороформом и осаждают этанолом. Экстрагированные нуклеиновые кислоты ресуспендируют в 10 мМ Трис-HCl рН 8,0; 1 мМ ЭДТА рН 8,0; 20 мкг/мл РНКазы А (Fermentas,Lithuania) и инкубируют в течение 1 ч при 37 С. Наконец, полученную ДНК переосаждают с аммонийацетатом и этанолом, промывают 70%-м этанолом и ресуспендируют в 10 мМ Трис-HCl рН 8,0; 1 мМ ЭДТА рН 8,0. Эти образцы обрабатывают различными рестрикционными эндонуклеазами: с помощью Есо 81I (Fermentas, Lithuania), которая обладает двумя сайтами узнавания в данной плазмиде, с помощьюHindIII (Fermentas, Lithuania), которая не разрезает ДНК NNV-2wt, и с помощью DpnI (New England Biolabs, США), которая расщепляет лишь ДНК, синтезируемую в клетках Escherichia coli. Рестрицированные ДНК разделяют в ТАЕ-агарозном электрофорезе и анализируют методом Саузерн-блоттинга [Southern, E.M. J. Mol. Biol. 98 (1975) 503-517] с помощью вектор-специфичного зонда, меченного радиоактивной меткой. Полученные результаты представлены на фиг. 14. Как следует из сравнения размера фрагментов, полученных при обработке Есо 81I (дорожки 1, 2 и 7 на фиг. 14), наряду с соответствующими маркерными дорожками, при данном анализе перестройки данного вектора не детектируются. Ни один из сигналов в позиции, отличной от маркерных дорожек, не наблюдается в случае обработки Hind III- 26009388 6.7. Пример 7. Анализ репликации NNV-2wt в присутствии факторов репликации папилломавируса человека. Ранее было показано, что папилломавирусные белки способны инициировать репликацию гетерологичных ori-содержащих плазмид из многих иных папилломавирусов человека и животных [Chiang,С.М., и соавт., Proc. Natl, Acad. Sci. USA 89 (1992) 5799-5803]. Несмотря на то что NNV-2wt не содержит вирусного ориджина репликации, анализировали то, каким образом ее репликация инициируется в присутствии белков Е 1 и Е 2 папилломавируса человека тип 1. СНО-клетки трансфицируют одним микрограммом любой одной из плазмид - NNV-2wt, NNV-2wtFS или product 1, или 4,5 мкг экспрессирующего вектора рМТ/Е 1 HPV11 белка E1 HPV-11 или тем же количеством pMT/E1 HPV11 и 4,5 мкг экспрессирующего вектора рМТ/Е 2 белка Е 2 HPV 11, как указано вверху на фиг. 15. Трансфекции осуществляют практически так же, как описано в примере 1. Экспрессирующие векторы Е 1 и Е 2 описаны раньше(Chiang, С.М. и соавт., выше). Эквимолярное количество плазмиды HPV11ORI, содержащей ориджин репликации HPV-11, трансфицируют теми же экспрессирующими векторами в качестве позитивного контроля. Низкомолекулярную ДНК экстрагируют с помощью модифицированного Hirt-лизиса [Ustav, и соавт., EMBO J. 2 (1991) 449-457] через 67 ч после трансфекции. Вкратце, клетки, промытые с помощьюPBS, лизируют на льду в чашках в течение 5 мин путем добавления щелочных лизирующих растворов I(50 мМ глюкозы; 25 мМ Трис-HCl, рН 8,0; 10 мМ ЭДТА, рН 8,0) и II (0,2 М NaOH; 1% SDS) в соотношении 1:2. Лизаты нейтрализуют с помощью 0,5 об. раствора III (смесь ацетата калия и уксусной кислоты, 3 М калия и 5 М ацетата). После центрифугирования супернатант осаждают изопропанолом, ресуспендируют и инкубируют при 55 С в 20 мМ Трис-HCl рН 8,0; 10 мМ ЭДТА рН 8,0; 100 мМ NaCl; 0,2% SDS; в присутствии 200 мкг/мл протеиназы К (Fermentas, Lithuania). Затем образцы последовательно экстрагируют фенолом и хлороформом с последующим осаждением этанолом. Осажденные нуклеиновые кислоты ресуспендируют в 10 мМ Трис-HCl рН 8,0; 1 мМ ЭДТА рН 8,0; 20 мкг РНКазы A (Fermentas,Lithuania) и инкубируют в течение 30 мин при 65 С. Инкубированные образцы обрабатывают с помощью линеаризованной эндонуклеазы (NdeI; Fermentas, Lithuania) в случае данных векторов или HindIII (Fermentas, Lithuania) - в случае HPV11ORI и DpnI (New England Biolabs, США) (разрывают нереплицированную ДНК), с последующим Саузерн-блоттингом, практически так же, как описано раньше, с использованием вектор-специфичного зонда с радиоактивной меткой. Для позитивного контроля гибридизации используют соответствующие маркеры линеаризованных векторов и HPV11ORI (дорожки, обозначенные как М, на фиг. 15). Как видно из результатов, представленных на фиг. 15, сигнал репликации для любой векторной плазмиды не детектируется. 6.8. Пример 8. Анализ Е 2 и его сайтов связывания зависит от разделения функции векторов в делящихся клетках. Как указано раньше, белок Е 2 в транс-конфигурации папилломавируса типа 1 крупного рогатого скота и его множественные связывающие сайты в конфигурации необходимы и достаточны для хроматинового присоединения эписомных генетических элементов. Данный феномен предполагает создание механизма разделения вирусного генома во время вирусного заражения в делящихся клетках [Ilves, I., и соавт., J. Virol. 73 (1999) 4404-4412]. Поскольку оба функциональных элемента включены в нашу векторную систему, задачей данного исследования является изучение значимости данного белка Е 2 и олигомеризованных связывающих сайтов для поддержания транскрипционно активного векторного элемента в популяции делящихся клеток. С этой целью Nef-кодирующую последовательность векторов NNV-2wt и super6wt замещают на кодирующую последовательность дестабилизированной формы зеленого флуоресцентного белка (d1EGFP),получаемую из вектора pd2EGFP-N1 (Clontech Laboratories). Поскольку время полужизни данного белка составляет 1 ч, он не накапливается в делящихся клетках, и экспрессия d2EGFP, детектируемая с помощью проточной цитометрии, коррелирует с присутствием в этих клетках транскрипционно активного вектора. Из NNV-2wt удаляют nef-кодирующую последовательность, и вместо нее встраивают фрагментSmaI-NotI из pd1EGFP-N1. Новый вектор назвали 2wtd1EGFP (фиг. 16). Аналогичное замещение осуществляют, соответственно, и в super6wt для образования gf10bse2 (фиг. 17). Последовательность узнавания для рестрикционной эндонуклеазы SpeI интродуцируют в EcoRI-сайт плазмиды super6wt, непосредственно слева от десяти E2BS. Вектор gf10bse2 получают из этой плазмиды путем замещения Nefкодирующей последовательности, содержащей NdeI-Bst1107I-фрагмент, на d1EGFP-кодирующую последовательность, содержащую фрагмент из 2wtd1EGFP, разрезаемого теми же ферментами. Созданы также плазмиды для негативного контроля, не содержащие либо функциональную Е 2 кодирующая последовательность, либо ее связывающие сайты. В случае 2wtd1EGFP сдвинутую рамку считывания вводят в Е 2-кодирующую последовательность путем замещения Е 2-кодирующей последовательности, содержащей Bsp120I-Bsp120I, на сходный фрагмент из плазмиды NNV-2wtFS. Результирующий вектор назвали 2wtd1EGFPFS (фиг. 18). Для создания контрольной плазмиды NNVd1EGFP (фиг. 19) из 2wtd1EGFP с помощью Bst1107 и NheI удаляют целую Е 2-экспрессирующую кассету (в качестве хо- 27009388 рошего бактериального репликона). Данный репликон воссоздают из плазмиды product1 в виде HindIII(заменяемый) NheI-фрагмента.Jurkat-клетки трансфицируют путем электропорации с помощью 1 мкг вектора 2wtd1EGFP или с помощью эквимолярных количеств плазмид 2wtd1EGFPFS, NNVd1EGFP, gf10bse2, или с помощью только носителя ДНК, как описано в примере 1. Суспензию данных клеток собирают и анализируют в разные временные точки после трансфекции, и собранные клеточные образцы разбавляют свежей средой. В каждой временной точке с помощью проточной цитометрии (Becton-Dickinson FACSCalibur System) подсчитывают общее число клеток, а также число клеток, экспрессирующих d1EGFP. На основании этих данных в образцах подсчитывают процентные доли клеток, экспрессирующих d1EGFP, с использованием клеток, несущих только носитель, в качестве негативного контроля фоновой флуоресценции. Подсчет числа клеток осуществляют с учетом сделанных разведений. Наконец, вычисляют значения ошибок на основании технических данных цитометрии о флуктуации скорости потока. Осуществляют два независимых эксперимента. Во-первых, поддержание d1EGFP, экспрессируемого из плазмид 2wtd1EGFP, 2wtd1EGFPFS и NNVd1EGFP, анализируют на протяжении восьми дней после трансфекции. Во втором эксперименте поддержание d1EGFP, экспрессируемого из плазмид 2wtd1EGFP,2wtd1EGFPFS и gf10bse2, анализируют на протяжении тридцати дней после трансфекции. Как видно из фиг. 20 и 21, скорости роста клеток, трансфицированных каким-либо вектором, либо только носителем, не различаются. Это означает, что различия в поддержании экспрессии d1EGFP не связано с влиянием собственно трансфицируемых векторов на деление клеток. Кроме того, во время анализа детектируют логарифмический рост данных клеток, за исключением второй временной точки в эксперименте, представленном на фиг. 20. Этот lag-период роста, вероятно, обусловлен электропорационным шоком клеток, поскольку первая временная точка взята почти через 19 ч после трансфекции. Как показано на фиг. 22 и 23, процентные доли клеток, экспрессирующих зеленый флуоресцентный белок, снижаются во всех популяциях, трансфицированных любой плазмидой, поскольку данные векторы не реплицируются в этих клетках. Однако, как видно на графиках, фракция позитивных клеток снижается быстрее в случае контрольных векторов, если сравнивать с векторами 2wtd2EGFP или gf10bse2. При сравнении друг с другом gf10bse2 обладает явным преимуществом перед 2wtd1EGFP (фиг. 23). Имеется также значительная разница в поддержании между контрольными плазмидами 2wtFSd1EGFP иNNVd1EGFP (фиг. 22). Эти различия между векторами становятся более очевидными, если эти данные представить в виде изменения числа клеток данной популяции, экспрессирующих d1EGFP (фиг. 24 и 25). В течение данного анализа количества позитивных клеток для контрольных плазмид существенно не меняются. Напротив, в случае 2wtd1EGFP количество клеток, экспрессирующих d1EGFP, повышается на протяжении первой недели после трансфекции, становясь примерно в пять-десять раз выше, чем в контрольных образцах(фиг. 24). После данной временной точки стартовая численность снижается (фиг. 25). Разница в поддержании является наиболее сильной у вектора gflbse2. На протяжении анализируемого периода количество позитивных клеток повышается непрерывно. Через две недели оно в 6 раз выше, чем в образце, трансфицированном с помощью 2wtd2EGFP, и в 45 раз выше, чем в популяции клеток, трансфицированных мутантом со сдвинутой рамкой считывания (фиг. 25). Полученные данные свидетельствуют о том, что данная векторная система согласно изобретению обладает активным механизмом сегрегации на основе заякоренного в ядре белка, т.е. Е 2-белка папилломавируса типа 1 крупного рогатого скота, а также его связывающими сайтами, которые способствуют его поддержанию в популяции пролиферирующих клеток в качестве транскрипционно активного элемента. 6.9. Пример 9. Клонирование AIRE-гена в Super6wt и экспрессия в линии эпителиальных клеток.AIRE-ген, кодирующий AIRE-белок (AIRE = аутоиммунный регулятор), является мутантным при аутосомно наследуемом синдроме APECED (врожденная аутоиммунная кандидомикозная полиэндокринопатийная дистрофия). Изредка AIRE экспрессируется в эпителиальных клетках сердцевины вилочковой железы и в дендритных клетках периферической крови, и в периферических лимфоидных органах. Следовательно, AIRE можно было бы лечить путем переноса немутантного AIRE-гена ex vivo в дендритные клетки периферической крови, с последующим введением исправленных дендритных клеток обратно данному пациенту. Для того чтобы проверить данную возможность, AIRE-ген человека и AIRE-ген мыши переносят в клетки COS-1. Для клонирования AIRE-гена в Super6wt готовят множественный препарат данного вектора. Вначале с помощью Super6wt трансфицируют TOP10-клетки (химически компетентная Escherichia coli от Invitrogen), в соответствии с протоколом производителя. Вкратце, данные клетки инкубируют на льду в течение 30 мин, после чего осуществляют тепловой шок в водяной бане при +42 С в течение 30 с. Затем эти клетки переносят прямо на лед на 2 мин и выращивают в 250 мкл SOC-среды (2% триптона, 0,5% дрожжевого экстракта, 10 мМ NaCl, 2,5 мМ KCl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкозы) при- 28009388 Посев осуществляют на LB-чашках с использованием канамицина (50 мкг/мл) для отбора. Для получения большого количества препарата колонии переносят в 150 мл LB-раствора, содержащего канамицин (50 мкг/мл), и растят в течение ночи при +37 С со встряхиванием. Получение препарата в большом количестве осуществляют с использованием набора Qiagen Plasmid Maxi, в соответствии с протоколом производителя. Обработку с использованием ферментов рестрикции BamHI и SalI используют для проверки данного вектора. Реакционная смесь содержит 500 нг Super6wt, 5 Ед. BamHI, 5 Ед. SalI, 2 мкл 2XTAGO-буфера(ферменты рестрикции и буфер от Fermentas) и стерильную воду в общем объеме 10 мкл. Данную обработку осуществляют при +37 С в течение 1 ч. Полученный обработанный вектор проверяют в 1%-м агарозном геле, содержащем этидийбромид 1 мкг/мл в 1X ТАЕ-буфера. Для клонирования ПЦР-амплифицированного AIRE-гена и Aire-фрагментов в данном Super6wt,4 мкг Super6wt обрабатывают с помощью 10 Ед. фермента рестрикции NotI (MBI Fermentas, в 2 мкл энзимного буфера и стерильной воды, добавляемой до конечного объема 20 мкл). Такую обработку осуществляют при +37 С в течение 1,5 ч, после чего в реакционную смесь приливают 1 Ед. ZIP-фермента (щелочная фосфатаза) и инкубируют еще в течение 30 мин. Обработку ZIP-ферментом осуществляют для содействия встраивания AIRE-гена в данный вектор для предотвращения самолигирования обратно в кольцевую форму. После обработки данный вектор выделяют путем очистки с использованием GFXTMPCR DNA и набора Gel Band Purification (Amersham Pharmacia Biotech) и растворяют в концентрации до 0,2 мкг/мкл. ПЦР-продукты человеческого и мышиного AIRE-гена обрабатывают также ферментом рестрикцииNotI. Для этой обработки используют 26 мкл ПЦР-продукта, 3 мкл соответствующего ферментного буфера и 10 Ед. рестрикционного фермента NotI (буфер и фермент от MBI Fermentas). Обработку осуществляют при +37 С в течение 2 ч, после чего обработанные ПЦР-продукты выделяют путем очистки и растворяют в стерильной воде до объема в 10 мкл. ПЦР-амплифицированные и обработанные AIRE-гены человека и мыши лигируют с Super6wt при помощи Т 4-ДНК-лигазы (MBI Fermentas). Берут обработанную ДНК-вставку (общий объем 10 мкл), 1,5 мкл лигазного буфера (MBI Fermentas), 5 Ед. Т 4-ДНК-лигазы, а стерильную воду добавляют до конечной концентрации 15 мкл. Лигирование осуществляют при +17 С в течение ночи. После лигирования берут 10 мкл лигирующей реакционной смеси для трансфекции в ТОР 10 клетки, в соответствии с протоколом производителя. Эти клетки инкубируют на льду в течение 30 мин,после чего осуществляют тепловой шок в водяной бане при +42 С в течение 30 с. Затем данные клетки трансфицируют прямо на льду в течение 2 мин и растят в 250 мкл SOC-среды (2% триптона, 0,5% дрожжевого экстракта, 10 мМ NaCl, 2,5 KCl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкозы) при +37 С со встряхиванием в течение 1 ч. Трансфицированные бактериальные клетки высевают в чашки с LB-канамицином, а на следующий день отбирают колонии в 2 мл LB-среды (1% триптона, 0,5% дрожжевого экстракта, 170 мМ NaCl) с канамицином и растят в течение ночи при +37 С.Miniprep ДНК-препараты из отобранных колоний выделяют путем очистки с использованием набора Qiagen Plasmid Midi и растворяют до объема 50 мкл стерильной водой. Наличие и размер вставки контролируют NotI- и BamHI-обработкой. Для обработки берут 10 мкл минимального количества ДНК, 5 Ед. ферментов NotI и BamHI, 2 мл ферментного буфера R+ и приливают стерильную воду до конечного объема 20 мкл. Данную обработку осуществляют при +37 С в течение 1 ч. Ориентацию вставки анализируют с помощью фермента рестрикции BamHI. Берут 10 мкл минипрепарата ДНК, 5 Ед. BamHI, 2 мкл BamHI-буфера (MBI Fermentas) и приливают стерильную воду до конечного объема 20 мкл. Обработку осуществляют в течение 1 ч при +37 С, а полученные продукты контролируют в 1%-м агарозном геле с EtBr в IX ТАЕ. На основе этих результатов отбирают плазмиду, содержащую мышиный AIRE-ген, и плазмиду, содержащую AIRE-ген человека, и готовят макси-препараты. Вкратце, 0,5 мл суспензии клеток Е. coli, содержащих соответствующую плазмиду или мини-препарат культуры, добавляют к 150 мл LB-среды, содержащей канамицин (50 мкг/мл) и растят в течение ночи при +37 С. Получают макси-препараты ДНК с использованием набора Qiagen Plasmid Maxi. Плазмида, содержащая мышиный AIRE-ген, обозначается в виде pS6wtmAIRE, а плазмида, содержащая AIRE-ген человека, - в виде pS6wthAIRE. Получаемые векторы секвенируют приблизительно на расстоянии 500 п.н. с каждого конца, чтобы проверить ориентацию и правильность вставки. Секвенирование осуществляют с использованием дидезокси-метода с РЕ Biosystem's Big Dye Terminator RR-mix, который содержит четыре разные терминирующие дидезоксинуклеотидтрифосфаты, меченные разными флуоресцентными метками. Плазмиды, содержащие AIRE-ген и фрагменты AIRE-гена, встраивают в селектируемую клеточную линию для контроля экспрессии данного белка с помощью Вестерн-блота после трансфекции. С помощью раствора трипсин-ЭДТА (Bio Whittaker Europe) собирают клетки Cos-1, и 10x106 кле- 29009388 ток/мл суспендируют в среде Игла, модифицированной Дюльбекко (Life Technologies), и 250 мкл клеточной суспензии берут для трансфекции. Трансфекцию Cos-1-клеток осуществляют с использованием электропорации для 2,5x106 клеток, 50 мкг ДНК спермы лосося в качестве носителя и 5 мкг соответствующего вектора. Трансфекцию осуществляют с помощью pS6wthAIRE, pS6wtmAIRE, Super6wt,pCAIRE, psiAIRE и pCAIRE S1-4. pCAIRE и psiAIRE представляют собой позитивные контроли AIRE человека, pCAIRE S1-4 представляет собой позитивный контроль мышиного AIRE, a Super6wt представляет собой негативный контроль. Электропорацию осуществляют с использованием Biorad's Gene Pulser с емкостью 960 мкФ, 240 В и 1 импульс. После электрического импульса клетки выдерживают при комнатной температуре в течение 10 мин и приливают 400 мкл среды. Клетки переносят в 5 мл среды и центрифугируют в течение 5 мин при 1000 об/мин. Клетки высевают в чашки и растят в течение 3-х дней при +37 С, 5% CO2. С помощью трипсин-ЭДТА собирают выращенные клетки и центрифугируют. Затем клетки однократно промывают 500 мл 1XPBS (0,14 мМ NaCl, 2,7 мМ KCl, 7,9 мкМ Na2HPO4, 1,5 мкМ KH2PO4). Добавляют 50 мкл PBS и 100 мкл SDS-буфера для внесения образцов (5% меркаптоэтанола, 16 мкМ бромфенолового синего, 20 мкМ ксиленцианола, 1,6 мМ фиколла 400), и клетки нагревают при +95 С в течение 10 мин. Для вестерн-блот-анализа готовят SDS-ПААГ с 10%-м разрешающим и 5%-м концентрирующим гелями в SDS-разделяющем буфере (25 мМ Трис, 250 мМ глицин, 0,1% SDS). Клеточные образцы и биотинилированный маркер молекулярного веса загружают в гель, и осуществляют электрофорез при 150 в течение 1 ч 50 мин. Перенос белков на нитроцеллюлозные мембраны осуществляют при комнатной температуре при 100 В в течение 1,5 ч с охлаждением буфера для переноса. Полученную мембрану блокируют в 5%-м молоке в TBS (0,05 М Трис-Cl, 0,15 М NaCl, pH 7,5) в течение 30 мин при комнатной температуре. Смесь первичных антител, антитела против AIRE6.1 (человек) и анти-AIRE8.1 (мышь) в разведении 1:100 в 5%-м молоке в TBS, наносят на мембраны и инкубируют в течение ночи при +4 С. Инкубированную мембрану промывают два раза с помощью 0,1% Твина в TBS в течение 5 мин и один раз - с помощью TBS в течение 5 мин. Вторичные антитела, мышиные биотинилированные анти-IgG в разведении 1:500 в 5%-м молоке в TBS инкубируют в течение 1 ч при комнатной температуре. Эту инкубированную мембрану промывают и добавляют пероксидазу хрена-авидин D в разведении 1:1000 в 5%-м молоке в TBS. Данную мембрану инкубируют при комнатной температуре в течение 1 ч и промывают. Субстрат для пероксидазы готовят из 5 мл хлоронафтола, 20 мл TBS и 10 мкл перекиси водорода и наносят на мембрану. После появления (развития) окраски данную мембрану промывают с помощью TBS и сушат. Антитела, детектирующие AIRE человека (анти-AIRE6.1), детектируют экспрессию AIRE-белка в препаратах, трансфицированных с помощью pS6wthAIRE, pCAIRE и psiAIRE. Антитела, детектирующие мышиный AIRE, также детектируют мышиный AIRE в клетках, трансфицированных с помощьюpS6wtmAIRE и pCAIRE S1-4. Негативный контроль (Super6wt) не обнаруживает AIRE/aire-белки. 6.10. Пример 10. Детекция клеточного и гуморального иммунного ответа на NNF HIV.1 у мышей, иммунизированных конструкцией NEF-NNV. ДНК-иммунизация Для дальнейшего изучения индукции гуморального иммунитета с помощью векторов согласно изобретению используют мышей, самцов и самок BALB/c (H-2d), в возрасте 5-8 недель. Для осуществления ДНК-иммунизации мышей анестезируют с помощью 1,2 мг пентобарбитала (i.p), и ДНК инокулируют в сбритую на брюхе кожу с использованием плазмидной ДНК, покрытой частицами золота. Эту инокуляцию осуществляют с помощью Helios Gene Gun (генное ружье Helios) (BioRad), с использованием давления в 300 psi (300 фунтов на квадратный дюйм). Частицы золота имеют 1 мкм в диаметре, 1 мкг ДНК/патрон. Мышей иммунизируют дважды (в день 0 и на 7-й день) общим количеством ДНК, составляющим 0,4 или 8 мкг/мышь. Контрольных мышей иммунизируют 8 мкг чистого вектора, без nef-гена,т.е. NNV-дельтаnef. Через две недели после последней иммунизации из хвостов мышей берут образец крови. Через четыре недели после последней иммунизации мышей умерщвляют, и образцы крови собирают в пробиркиEppendorf, содержащие 10 мкл 0,5 М блотирования ( vs. +) и в ELISA (наивысшая ОП, для большинства мышей наивысшая доза ЭДТА выше минимальной). Точное количество лейкоцитов/мл крови подсчитывают в этих образцах для каждой мыши. Сыворотку собирают для анализа антител и хранят при -20 С. Удаляют асептически селезенки, взвешивают и затем гомогенизируют до одноклеточных суспензий, для использования в анализах Т-, В- и NK-клеток, и окрашивают. Детекция гуморальной иммуногенности векторов согласно изобретению Для детекции Nef-специфичных антител с помощью Вестерн-блоттинга сывороточные образцы от мышей, иммунизированных векторными конструкциями согласно изобретению, разбавляют 1:100 5%-м молоком в TBS и наносят на полосы нитроцеллюлозы, пропитанные рекомбинантным Nef-белком ВИЧ 1. Для приготовления данных нитроцеллюлозных полосок очищенный рекомбинантный белок кипятят в
МПК / Метки
МПК: A61K 48/00, C12N 15/86, C12N 15/63, C12N 15/85, A61P 31/00
Метки: способы, применение, экспрессии, векторы
Код ссылки
<a href="https://eas.patents.su/30-9388-vektory-ekspressii-i-sposoby-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Векторы экспрессии и способы их применение</a>
Предыдущий патент: Азабициклические производные в качестве антагонистов мускаринового рецептора
Следующий патент: Использование растворимого cd 164 при воспалительных и/или аутоимунных нарушениях
Случайный патент: Машина для сухой очистки картофеля