Автоматизированные способы и системы для обнаружения и анализа сосудистых бляшек
Номер патента: 9382
Опубликовано: 28.12.2007
Авторы: Брозертон Томас Вудли, Хуизенга Джоэл Т., Андерсон Расселл В.
Формула / Реферат
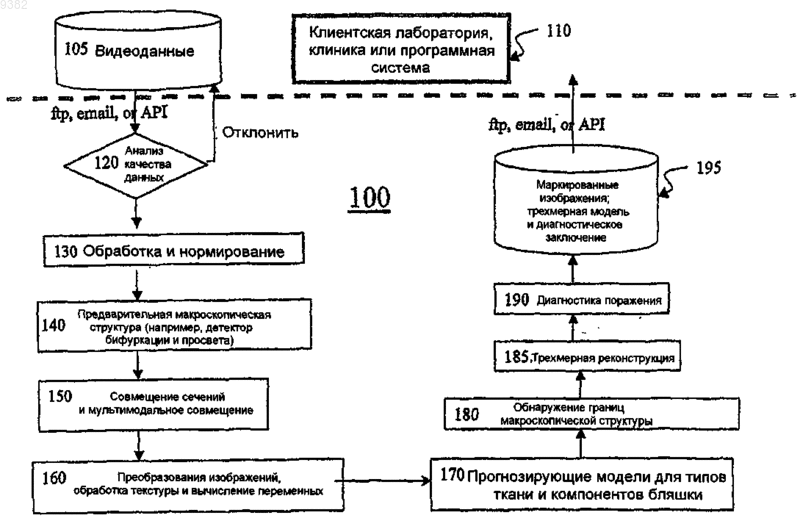
1. Автоматизированный способ оценки степени атеросклероза по меньшей мере в части сосудистой системы пациента, заключающийся в том, что осуществляют вычислительную обработку пригодных для обработки данных по меньшей мере из одного поперечного сечения по меньшей мере одного кровеносного сосуда сосудистой системы пациента, полученных из медицинской системы визуализации, чтобы определить, содержит ли данный кровеносный сосуд по меньшей мере одну ткань, коррелированную с присутствием бляшки, и, тем самым, оценить степень атеросклероза по меньшей мере в части сосудистой системы пациента.
2. Автоматизированный способ определения, содержит ли кровеносный сосуд сосудистой системы пациента бляшку, заключающийся в том, что осуществляют вычислительную обработку пригодных для обработки данных по меньшей мере из одного поперечного сечения кровеносного сосуда сосудистой системы пациента, полученных из медицинской системы визуализации, чтобы определить, содержит ли данный кровеносный сосуд по меньшей мере одну ткань, коррелированную с присутствием бляшки, причем в этом случае признают, что кровеносный сосуд содержит бляшку.
3. Автоматизированный способ по п.2, в котором медицинская система визуализации является неинвазивной системой визуализации.
4. Автоматизированный способ по п.3, в котором неинвазивная система визуализации содержит один или несколько приборов, выбранных из группы, состоящей из прибора для магнитно-резонансной томографии (МРТ), прибора для компьютерной томографии (КТ), прибора для позитрон-эмиссионной томографии (ПЭТ), прибора для термографии или ультразвукового прибора, предназначенных для выработки исходных видеоданных, из которых получают пригодные для обработки данные.
5. Автоматизированный способ по п.2, в котором медицинская система визуализации содержит прибор для МРТ, предназначенный для формирования исходных магнитно-резонансных данных, из которых получают пригодные для обработки магнитно-резонансные данные.
6. Автоматизированный способ по п.5, в котором используют множество различных серий последовательностей радиочастотных импульсов, причем каждая из различных серий последовательностей радиочастотных импульсов позволяет формировать исходные магнитно-резонансные данные для подгруппы различных тканей, которые могут присутствовать в кровеносном сосуде.
7. Автоматизированный способ по п.6, в котором по меньшей мере одна из различных серий последовательностей радиочастотных импульсов обеспечивает формирование исходных магнитно-резонансных данных, выбранных из группы, состоящей из данных, взвешенных по времени релаксации Т1 (Т1-взвешенных данных), Т2-взвешенных данных, взвешенных по времени релаксации Т2 (Т2-взвешенных данных), данных, взвешенных по плотности протонов (PDW-взвешенных данных), и данных, взвешенных по времени пролета (TOF-взвешенных данных).
8. Автоматизированный способ по п.2, в котором кровеносный сосуд является частью сосудистой системы, подающей кровь к органу, выбранному из группы, состоящей из мозга и сердца.
9. Автоматизированный способ по п.2, в котором кровеносный сосуд выбран из группы, состоящей из сонной артерии и коронарной артерии.
10. Автоматизированный способ по п.2, в котором пациентом является человек.
11. Автоматизированный способ по п.2, в котором пригодные для обработки данные формируют посредством предварительной обработки исходных данных, сформированных медицинской системой визуализации.
12. Автоматизированный способ по п.11, в котором дополнительно нормируют пригодные для обработки данных перед вычислительной обработкой пригодных для обработки данных.
13. Автоматизированный способ по п.1, в котором пригодные для обработки данные подвергают вычислительной обработке, чтобы определить, содержит ли данный кровеносный сосуд в области поперечного сечения артерию или бляшку.
14. Автоматизированный способ по п.13, в котором определение типа ткани осуществляют посредством сравнения компьютером различных типов тканей, идентифицированных в данных, с множеством статистических классификаторов.
15. Автоматизированный способ по п.14, в котором статистические классификаторы создают с использованием известных результирующих данных посредством процесса, выбранного из группы, состоящей из логистической регрессии, деревьев решений, непараметрической регрессии, дискриминантного анализа Фишера, сетевого моделирования Бейеса и системы с нечеткой логикой.
16. Автоматизированный способ по п.15, в котором по меньшей мере один из множества хранимых элементов классификатора тканей определен посредством процесса, выбранного из группы, состоящей из послеоперационного гистологического исследования, прямого изучения ткани или маркировки одним или более специалистами.
17. Автоматизированный способ по п.14, в котором пригодные для обработки данные подвергают вычислительной обработке, чтобы определить, содержит ли данный кровеносный сосуд в области поперечного сечения по меньшей мере еще одну ткань, выбранную из группы, состоящей из адвентиции, отложения кальция, отложения холестерина, фиброзной бляшки и тромба.
18. Автоматизированный способ по п.17, в котором определение типов тканей осуществляют посредством сравнения компьютером различных типов тканей, идентифицированных в данных, с множеством статистических классификаторов.
19. Автоматизированный способ по п.6, в котором осуществляют вычислительное совмещение компонентов, содержащих пригодные для обработки магнитно-резонансные данные.
20. Автоматизированный способ по п.19, в котором совмещение осуществляют посредством выравнивания компонентов, содержащих пригодные для обработки магнитно-резонансные данные, относительно представления, являющегося ориентиром, выбранным из группы, состоящей из центроида просвета сосуда и точки разветвления сосуда.
21. Автоматизированный способ по п.20, в котором ориентир выбирают из группы, состоящей из физического ориентира и вычислительного ориентира.
22. Автоматизированный способ по п.2, в котором осуществляют вычислительную обработку пригодных для обработки данных, полученных из множества удаленных друг от друга поперечных сечений кровеносного сосуда.
23. Автоматизированный способ по п.22, в котором дополнительно осуществляют вычислительную визуализацию трехмерной модели кровеносного сосуда по меньшей мере в части области, ограниченной наиболее удаленными поперечными сечениями кровеносного сосуда.
24. Автоматизированный способ по п.2, в котором дополнительно создают выходной файл, содержащий данные, полученные в результате вычислительной обработки.
25. Автоматизированный способ по п.24, в котором выходной файл содержит визуализированную вычислительным методом трехмерную модель кровеносного сосуда по меньшей мере в части области, ограниченной наиболее удаленными поперечными сечениями кровеносного сосуда.
26. Автоматизированный способ по п.23, в котором дополнительно осуществляют вычислительное определение объема бляшки, присутствующей в трехмерной модели кровеносного сосуда.
27. Автоматизированный способ по п.23, в котором дополнительно осуществляют вычислительное определение состава бляшки, присутствующей в трехмерной модели кровеносного сосуда.
28. Автоматизированный способ по п.27, в котором дополнительно осуществляют вычислительное различение, является ли данная бляшка уязвимой бляшкой или стабильной бляшкой.
29. Автоматизированный способ оценки эффективности курса лечения, заключающийся в том, что:
a) определяют объем бляшки у пациента с помощью автоматизированного способа по п.26;
b) назначают пациенту курс лечения, включающий в себя прием лекарственного препарата, предназначенного для стабилизации или уменьшения бремени бляшки у пациента в процессе курса лечения; и
c) определяют во время и/или в конце курса лечения, стабилизировался ли или уменьшился ли объем бляшки у пациента, чтобы, тем самым, оценить эффективность курса лечения.
30. Автоматизированный способ по п.24, в котором лекарственным препаратом является проходящий исследования лекарственный препарат.
31. Способ лечения пациента, имеющхую уязвимую бляшку в кровеносном сосуде, заключающийся в том, что:
a) определяют, что пациент имеет уязвимую бляшку в кровеносном сосуде с помощью автоматизированного способа по п.27; и
b) назначают пациенту курс лечения, направленный на стабилизацию или уменьшение уязвимости уязвимой бляшки для разрыва в процессе курса лечения, обеспечивая тем самым лечение пациента.
32. Способ по п.31, в котором курс лечения включает в себя прием лекарственного препарата, стабилизирующего или уменьшающего уязвимость бляшки для разрыва.
33. Способ по п.32, в котором лекарственный препарат выбирают из группы, состоящей из статинов, противовоспалительных препаратов и антикоагулянтов.
34. Компьютерный программный продукт, содержащий пригодный для компьютера носитель с содержащейся на нем машиночитаемой программой, причем машиночитаемая программа сконфигурирована для реализации автоматизированного способа по п.1 на компьютере, предназначенном для выполнения данной машиночитаемой программы.
35. Автоматизированный способ для анализа данных пациента, полученных с помощью медицинской системы визуализации, для определения, содержит ли кровеносный сосуд пациента бляшку, заключающийся в том, что:
a) получают пригодные для обработки данные по меньшей мере одного поперечного сечения кровеносного сосуда сосудистой системы пациента, причем пригодные для обработки данные получают из исходных данных, собранных с помощью медицинской системы визуализации;
b) передают пригодные для обработки данные в компьютер, сконфигурированный для приема и вычислительной обработки пригодных для обработки данных, для определения, содержит ли данный кровеносный сосуд в области поперечного сечения(й) по меньшей мере одну ткань, коррелированную с присутствием бляшки, в случае чего кровеносный сосуд признается содержащим бляшку; и
c) используют компьютер для вычислительной обработки пригодных для обработки данных и определения, содержит ли данный кровеносный сосуд бляшку.
36. Автоматизированный способ по п.35, в котором медицинская система визуализации и компьютер расположены в разных местах.
37. Автоматизированный способ по п.36, в котором компьютер находится в вычислительном центре, физически удаленном от каждого из множества центров визуализации, каждый из которых содержит медицинскую систему визуализации, способную формировать исходные данные, из которых можно получить пригодные для обработки данные.
38. Автоматизированный способ по п.37, в котором по меньшей мере один из центров визуализации передает исходные данные в вычислительный центр по телекоммуникационному каналу.
39. Автоматизированный способ по п.35, в котором дополнительно передают результаты анализа по адресу, указанному как сотрудничающий с медицинской системой визуализации, используемой для сбора исходных данных.
40. Система для анализа наличия бляшки в кровеносном сосуде сосудистой системы пациента, содержащая:
a) компьютер, способный исполнять машиночитаемую программу, содержащуюся в компьютерном программном продукте по п.34;
b) компьютерную систему хранения данных, сообщающуюся с компьютером и сконфигурированную для отправки и приема и/или сохранения данных, обработанных компьютером; и
c) функционально подключенный к компьютеру коммуникационный интерфейс для приема подлежащих обработке данных или для отправки данных после их обработки компьютером.
Текст
009382 Родственная заявка Приоритет настоящей заявки заявлен на основании даты подачи предварительной заявки на патент США 60/497375, поданной 21 августа 2003 г., которая включена в данное описание в полном объеме. Область техники, к которой относится изобретение Настоящее изобретение касается способов, программного обеспечения или систем для автоматизированного анализа медицинских видеоданных. Более конкретно, оно касается способов, программного обеспечения или систем для автоматизированного обнаружения и анализа бляшки в части или всей сосудистой системе пациента. Уровень техники 1. Введение. В следующем описании представлена информация, которая может быть полезной для понимания настоящего изобретения. При этом не утверждается, что любая такая информация является аналогом или релевантной для заявленных изобретений или что любая публикация, упомянутая явно или косвенно,является аналогом настоящего изобретения. 2. Известный уровень техники. Атеросклероз является наиболее распространенной причиной ишемической болезни сердца. Если рассматривать отдельно инсульт, то он является третьей лидирующей причиной смертности, а большинство случаев инсульта является результатом ишемических проявлений. Однако артериосклероз - это самая обычная воспалительная реакция, а атеросклероз, не сопровождающийся тромбозом, представляет собой, в общем, доброкачественное заболевание. В ряде исследований отмечалось, что именно состав бляшки, а не степень стеноза является ключевым фактором для прогнозирования уязвимости бляшки для разрыва или тромбоза. Такие склонные к тромбозу бляшки, или бляшки с повышенным риском, называются "уязвимыми" ("нестабильными") бляшками. Разрыв бляшки запускается механическими событиями, однако, уязвимость бляшки может быть обусловлена ослаблением фиброзного покрова, внутрибляшечным кровоизлиянием и размягчением компонентов бляшки, часто в результате инфекции, и инфильтрации макрофагов и Т-клеток. Обычно богатые липидами мягкие бляшки имеют более высокую склонность к разрыву, чем богатые коллагеном твердые бляшки. Существует ряд морфологических и физиологических признаков, которые связаны с уязвимой и стабильной бляшкой. Морфологические характеристики включают в себя структурную слабость или повреждение (тонкий или поврежденный фиброзный покров, кальциноз, отрицательное ремоделирование, реваскуляризация, большие отложения липидов и т.п.), а физиологические признаки включают в себя химический состав, активную инфекцию, воспалительные реакции и метаболизм. Многие из этих факторов являются субъективными или количественными, отражая тот факт, что не все характеристики подтверждены в качестве детерминант риска. Подтверждение факторов риска требует долгосрочных клинических исследований, проведения эндартерэктомий или аутопсий. Для идентификации уязвимых бляшек применяется ряд инвазивных методов, таких как внутрисосудистое ультразвуковое исследование (ВСУЗИ), ангиоскопия, интраваскулярная магнитно-резонансная томография и термография. Так как при инвазивных методах пациент подвергается существенному риску инсульта и инфаркта миокарда (ИМ), эти методы не годятся для скрининга или периодических исследований. И, наконец, поскольку эти методы требуют использования катетера, оценки общего бремени сосудистых бляшек необходимо экстраполировать из исследования только нескольких локальных отложений бляшек. Более того, в силу физических ограничений, таких как размер катетера и артерии, разветвлений артерий и т.п., большая часть сосудистой системы пациента недоступна для инвазивных приборов. Хотя магнитно-резонансная томография (МРТ) используется для идентификации морфологических признаков бляшек, таких как размер бляшки и толщина фиброзного покрова, с высокой степенью чувствительности и специфичности, однако, в большинстве попыток охарактеризовать бляшку применяется визуальный анализ томограмм компьютерной осевой томографии (КОТ) или МРТ специалистамирадиологами. Этот процесс занимает много времени (следовательно, дорогой) и подвержен ошибкам и некоторым субъективным отклонениям хотя бы потому, что человеку обычно сложно одновременно оценить статистические зависимости между двумя или тремя переменными. Естественной тенденцией является концентрация на макроскопических границах и локальных текстурах. При анализе мультимодальных изображений эта проблема многократно усугубляется, потому что для усвоения всех имеющихся свидетельств аналитику необходимо попиксельно оценить локальную среду в целых четырех отдельных модальностях. Обычно это вынуждает аналитика сконцентрироваться всего на одной модальности,имеющей "наилучший" контраст для конкретной ткани, и игнорировать потенциально противоположное свидетельство в других модальностях. Точность классифицирования зависит от изменчивости между результатами разных исследователей и даже одного и того же исследователя в течение времени, что делает стандартизированное диагностическое исследование практически невозможным. В большинстве случаев подтверждение интерпретированного изображения можно получить только посредством гистологического анализа эндартерэктомий. Учитывая важность обнаружения и анализа бляшек для здоровья пациентов, существует потреб-1 009382 ность в усовершенствованных способах обнаружения и анализа бляшек in vivo. 3. Определения. Прежде чем приступить к подробному описанию изобретения, будет дано определение некоторым терминам, используемым в контексте настоящего изобретения. Кроме этих терминов при необходимости другие термины будут определяться по тексту описания. Специальные термины, используемые в настоящем описании, употребляются в их общепринятых значениях в области медицины, если явным образом они не определены иначе. Понятие "медицинская система визуализации" относится к любой системе, которую можно использовать для сбора, обработки и формирования изображений некоторых или всех внутренних областей организма пациента. Обычно такие системы включают в себя устройство для формирования и сбора данных, а также компьютер, выполненный с возможностью обработки и анализа данных, а часто и формирования выходных изображений, представляющих эти данные. Устройства, используемые для формирования и сбора данных, включают в себя неинвазивные устройства, например приборы для магнитнорезонансной томографии (МРТ), приборы для позитрон-эмиссионной томографии (ПЭТ), приборы для компьютерной осевой томографии (КОТ), ультразвуковые приборы и т.п., а также устройства, которые формируют и собирают данные инвазивным путем, например эндоскопы (для передачи видеоизображений изнутри полости или просвета в организме) и катетеры, снабженные датчиками. Данные, полученные из таких устройств, затем передаются в процессор, который, по меньшей мере, в некоторых случаях,можно использовать для формирования изображений одной или более внутренних областей организма пациента. После этого медицинский работник, специально обученный интерпретировать изображения,изучает и интерпретирует эти изображения для составления диагноза или прогноза."Патентоспособный" состав, процесс, прибор, изделие или усовершенствование согласно настоящему изобретению означает, что данный объект удовлетворяет всем установленным требованиям патентоспособности, действующим на момент рассмотрения заявки. Например, если в отношении новизны,неочевидности или т.п. на более позднем этапе будет обнаружено, что один или более пунктов формулы изобретения охватывает один или более вариантов, которые будут отрицать новизну, неочевидность и т.п., то эти пункты формулы изобретения, будучи ограниченными определением "патентоспособных" вариантов, специально исключат такие непатентоспособные варианты. Кроме того, прилагаемые пункты формулы изобретения следует толковать как обеспечивающие самый широкий разумный объем, а также как сохраняющие их действительность. Кроме того, в случае изменения одного или более установленных требований патентоспособности или изменения стандартов оценки, удовлетворено ли конкретное требование патентоспособности, со времени подачи этой заявки, или в случае возникновения сомнений в отношении срока действия одного или более прилагаемых пунктов формулы изобретения, пункты формулы изобретения следует толковать таким образом, чтобы (1) они сохранили свою действительность и (2) обеспечили самое широкое толкование в данных обстоятельствах. Термин "лечение" или "терапия" означает любую работу, совершаемую в отношении заболевания или нарушения, включая предотвращение или профилактику данного заболевания или нарушения (т.е. препятствие развитию клинических симптомов (или основного процесса, который может вызывать возникновение или усиление этих симптомов); замедление заболевания или нарушения (т.е. остановку или подавление развития клинических симптомов или прекращение прогрессирования одного или более основных процессов, усиливающих патологию, которая может вызывать симптомы); и/или ослабление заболевания или нарушения (т.е. обеспечение регрессии клинических симптомов или регрессии одного или более процессов, вызывающих эти симптомы). Понятно, что не всегда можно провести четкую грань между "предотвращением" и "подавлением" заболевания или нарушения, так как конечный результат или результаты могут быть неизвестными или латентными. Соответственно, под "профилактикой" также подразумевается некий вид "лечения", который охватывает "предотвращение" и/или "подавление" или оба этих понятия. Термин "защита" также включает в себя "профилактику". Краткое изложение сущности изобретения В основу настоящего изобретения положена задача создания способов, программного обеспечения и систем для автоматического обнаружения и, при желании, анализа бляшек в одной или более областей сосудистой системы пациента, на основании данных, полученных из медицинской системы визуализации или первоначальных процессов определения или сбора данных, которые можно использовать для формирования изображения (но не ограничиваясь ими). Таким образом, один аспект настоящего изобретения касается автоматизированных способов оценки степени атеросклероза, по меньшей мере, в части сосудистой системы пациента, часто в части одного или более кровеносных сосудов, особенно тех сосудов, которые подают кровь в какой-либо орган, например мозг, сердце, почки, печень, легкие, органы пищеварения, мочевой пузырь, желудок, яичники и яички, а также в периферийные органы, например руки и ноги. Предпочтительными кровеносными сосудами для анализа являются сонные артерии, коронарные артерии и аорта. Хотя предложенные способы можно также использовать для определения и анализа сосудистой бляшки у многих животных, наиболее часто эти способы применяются на людях. Предложенные способы обычно включают в себя вычислительную обработку пригодных для обра-2 009382 ботки данных по меньшей мере из одного поперечного сечения (или его части) по меньшей мере одного кровеносного сосуда сосудистой системы пациента, полученных из медицинской системы визуализации,чтобы определить, содержит ли данный кровеносный сосуд (или, по меньшей мере, его анализируемая часть) по меньшей мере один компонент бляшки или ткань, связанную с наличием бляшки. Реализация этих способов позволяет получить оценку одной или более мер, связанных с атеросклерозом по меньшей мере в части сосудистой системы пациента. В предпочтительных вариантах изобретения эти способы позволяют определить, содержит ли кровеносный сосуд бляшку, в частности бляшку, уязвимую для разрыва. Для конкретного поперечного сечения анализируемые данные могут содержать некоторые или все первоначально собранные данные. Медицинская система визуализации, используемая для получения исходных данных, может быть инвазивной или неинвазивной системой визуализации. Предпочтительная неинвазивная система визуализации включает в себя один или несколько приборов для МРТ, КОТ и ПЭТ, термографии или ультразвукового исследования. Можно также использовать приборы, имеющие несколько неинвазивных функций визуализации. Предпочтительными инвазивными приборами являются катетеры, снабженные одним или несколькими датчиками. Примерами таких катетеров являются катетеры для ультразвукового исследования, ангиоскопии, интраваскулярной МРТ и термографии. Можно также объединить для анализа данные,полученные инвазивными и неинвазивными методами визуализации. Аналогичным образом, можно также включить в анализ другие или дополнительные данные, например данные, полученные при использовании контрастных веществ, меточных средств, специфических для одной или более тканей, типов клеток или лиганд, которые, например, содержат ткани или компоненты здоровой или патологической сосудистой системы, включая бляшки или их компоненты. Предпочтительной группой вариантов осуществления изобретения являются способы на основе МРТ. В этих вариантах используется MP-прибор для получения исходных магнитно-резонансных данных, из которых извлекаются пригодные для обработки магнитно-резонансные данные. Одна или более различных модальностей визуализации, реализуемых посредством одной или более различных серий последовательней радиочастотных импульсов, позволяют различать при последующем анализе различные ткани и компоненты тканей. Предпочтительные типы данных, формируемые такими модальностями,включают в себя Т 1-взвешенные данные, Т 2-взвешенные данные, PDW-взвешенные данные и TOFвзвешенные данные. Можно также объединять данные, сформированные комбинациями одного или нескольких этих и других типов данных. При осуществлении предложенных способов может быть желательным предварительно обработать и/или нормировать данные. В любом случае, пригодные для обработки данные подвергают вычислительной обработке, чтобы определить, содержит ли данный кровеносный сосуд в области поперечного сечения(й) (или его части(ей ткань артерии или бляшки или ее компоненты. В предпочтительных вариантах определение типа или компонента ткани осуществляется путем сравнения компьютером различных типов данных, идентифицированных в анализируемых данных, с одним или более статистическими классификаторами. Такие классификаторы можно создать, используя известные результирующие данные(например, послеоперационное гистологическое исследование, прямое изучение ткани или маркировку одним или более экспертами) в любом подходящем процессе, включая логистическую регрессию, деревья решений, непараметрическую регрессию, дискриминантный анализ Фишера, сетевое моделирование Бейеса, и систему с нечеткой логикой. Компоненты и ткани предпочтительно подвергаются сортировке на наличие мышцы, адвентиции, отложений кальция, отложений холестерола, липидов, фиброзной бляшки, коллагена и тромба. В предпочтительных вариантах, особенно в тех вариантах, где используются данные из нескольких модальностей визуализации или приборов визуализации, эти данные преобразуются в общий формат. Данные также предпочтительно совмещаются вычислительным образом, часто с использованием какоголибо ориентира, будь то представляющий интерес физический признак (например, точка разветвления артерии, такая как бифуркация сонной артерии) или вычислительный признак, такой как центроид просвета сосуда, вычисленный из обрабатываемых данных. В некоторых вариантах можно вычислительным путем визуализировать трехмерную модель кровеносного сосуда по меньшей мере в части области, ограниченной наиболее удаленными анализируемыми поперечными сечениями. Можно также выполнить множество других видов анализа или операций, включая вычисление общего объема или бремени бляшки, местоположение и/или состав бляшки и т.п. В зависимости от выполняемых видов анализа или операций результаты анализа могут выводиться в одном или нескольких выходных файлах и/или передаваться или пересылаться в другое место в системе для хранения. Альтернативно, эти данные могут передаваться в другое место. Еще один аспект изобретения касается оценки эффективности курса лечения или определения курса лечения. В этих способах применяется обнаружение или анализ бляшек согласно настоящему изобретению вместе с предоставлением или определением курса лечения, в зависимости от конкретного случая,на основании результатов обнаружения бляшек и предпочтительно их классификации и анализа. В некоторых вариантах курс лечения включает в себя прием лекарства, предназначенного для стабилизации или уменьшения бремени бляшек у пациента со временем. При желании можно оценивать эффективность-3 009382 курса лечения посредством последующего анализа, предпочтительно посредством дополнительного обнаружения бляшек и предпочтительно классификации, т.е. анализа согласно настоящему изобретению. Понятно, что предложенные способы будут полезны не только для осуществления одобренных стратегий лечения, но и для разработки новых стратегий. Например, эти способы могут быть полезны при оценке клинической эффективности исследуемых методов лечения, включая исследования, направленные на оценку лекарственных препаратов, предназначенных для лечения сердечно-сосудистых или цереброваскулярных заболеваний. Другой аспект изобретения относится к компьютерному программному продукту, который содержит используемую компьютером среду с содержащейся на ней машиночитаемой программой, причем машиночитаемая программа сконфигурирована для реализации автоматизированного способа согласно настоящему изобретению на компьютере, предназначенном для выполнения данной машиночитаемой программы. Вычислительные системы, сконфигурированные согласно настоящему изобретению для выполнения такой машиночитаемой программы, представляют собой дополнительный аспект изобретения, так же как и бизнес-модели для реализации таких способов, например бизнес-модели ASP и API. Например,в ASP модели медицинская система визуализации и вычислительная система, сконфигурированные с возможностью исполнения предложенной машиночитаемой программы, расположены в разных местах. Вычислительная система часто находится постоянно в вычислительном центре, который физически удален от каждого из множества центров визуализации, каждый из которых содержит медицинскую систему визуализации, способную формировать исходные данные, из которых можно получать пригодные для обработки данные. В предпочтительных вариантах, по меньшей мере, один из центров визуализации передает исходные данные в вычислительный центр по телекоммуникационному каналу связи. Что касается вычислительных систем, то они обычно содержат компьютер, способный исполнять машиночитаемую программу согласно настоящему изобретению, систему хранения данных, сообщающуюся с компьютером, и, необязательно, подключенный к компьютеру коммуникационный интерфейс для приема данных, подлежащих обработке, или для отправки данных после их обработки компьютером. Краткое описание чертежей Эти и другие аспекты и варианты осуществления настоящего изобретения станут более очевидными после изучения следующего подробного описания и прилагаемых чертежей, на которых представлены некоторые конкретные варианты осуществления изобретения, а именно фиг. 1 изображает блок-схему, иллюстрирующую общий вид нескольких предпочтительных вариантов изобретения; фиг. 2 - две панели, А и В. На панели А показано изображение, сформированное из исходных магнитно-резонансных данных (в формате DICOM), полученных из коммерческого МР-прибора, на котором видны градиенты освещения от поверхностных катушек. На панели В показано то же самое изображении, что и на панели А, после выравнивания гистограммы; фиг. 3 - четыре панели, A-D. Панель А представляет MP-томограмму, полученную из данных T1 взвешенной модальности (T1W). Панель В представляет MP-томограмму, полученную из данных Т 2 взвешенной модальности (T2W). Панель С представляет MP-томограмму, полученную из данных PDвзвешенной модальности (PDW). Панель D изображает результаты мультимодального совмещения изображений T1W, T2W и PDW in vivo; фиг. 4 - алгоритм, иллюстрирующий процесс для прогнозирующих моделей, полезных в контексте изобретения; фиг. 5 - четыре панели, A-D, иллюстрирующие процесс маркировки данных на MP-томограммах. Понятно, что данные изображений, включая MP-томограммы, можно формировать из данных, собранных с использованием различных протоколов (модальностей). На этой фигуре на панели А показаны MPтомограммы поперечного сечения артерии человека, визуализированные с помощью трех стандартных модальностей: взвешенной по плотности протонов (PDW модальность), взвешенной по времени релаксации T1 (T1W модальность) и взвешенной по времени релаксации Т 2 (T2W модальность). Для облегчения визуальной интерпретации можно объединить эти изображения PDW, T1W и T2W (510, 520 и 530 соответственно), чтобы получить полную псевдоцветную МР-томограмму 540 (зеленый = PDW, красный = Т 1, синий = Т 2), показанную на панели В. В полном изображении, показанном на панели В, мультиконтрастные нормированные изображения 510, 520 и 530 серой шкалы линейно отображены как зеленые,красные и синие каналы соответственно, где черный отображен нулем, а белый - 255 в каждом цветовом канале, чтобы создать цветное полное изображение и сформировать его трехмерную визуализацию с помощью MATLAB. Ткани с похожими химическими и окружающими свойствами обычно имеют похожий цвет. Дополнительными признаками для определения типа ткани являются анатомическое положение(например, внутри или снаружи мышечной стенки, т.е. внутри или снаружи кровеносного сосуда) и текстура (например, мышца обычно выглядит полосатой, а мягкая бляшка "пятнистой"). Специалистрадиолог часто может классифицировать фиброзную или уязвимую бляшку посредством подробного изучения таких данных неавтоматизированным способом (вручную), но эта работа чрезвычайно продолжительная и субъективная. Для разработки автоматизированной системы классификации бляшек необ-4 009382 ходимо "обучить" модель на известных примерах ("истине"). Можно обучить модель так, чтобы она имитировала работу специалиста, однако, предпочтительным методом является маркировка тех изображений или данных, использованных для создания изображений, которые имеют по возможности наиболее объективные критерии, например, подтвержденные с помощью гистопатологических срезов ткани. На панели С показана гистопатология (истина) поперечного сечения артерии, использованная для формирования изображений, показанных на панелях А и В. На панели D на фиг. 5 показано маркированное изображение, использованное для обучения модели, на котором каждый представляющий интерес класс ткани маркирован разным целевым цветом. Артериальная мышца (медия, 565) - розовая, адвентиция (фасция или коллаген, 570) - ярко-желтая, тромб (сгусток крови, 575) - красный, фиброзная бляшка (580) бледножелтая, липид (585) - белый и просвет сосуда (590) черный; фиг. 6 - три панели, А-С, и представляет другой пример маркировки данных. На панели А показана полная псевдоцветная МР-томограмма (610) поперечного сечения двух артерий. МР-томограмма 610 была сформирована путем объединения MP-томограмм серой шкалы, сформированных с использованием трех MP-модальностей: PDW, T1W и T2W, описанных в связи с псевдоцветной томограммой, показанной на фиг. 5. На панели В показана гистопатология поперечных сечений артерии. На панели С показано маркированное изображение (630), которое маркировано аналогично MP-томограмме на панели D на фиг. 5; фиг. 7 - три панели, А-С, с изображениями, обработанными с помощью алгоритма кластеризации методом К-средних; фиг. 8 - две панели, А и В, иллюстрирующие эффективность предпочтительного варианта изобретения, измеренную относительно маркированной истины (левая часть каждой панели); фиг. 9 - таблицу (таблица А) и три графика, показывающих эффективность трех прогнозирующих моделей для обнаружения сосудистой бляшки, ее компонента (т.е. липида) и мышечной ткани. В табл. А показана эффективность моделей RIPNet, основанных на статистике максимумов ХолмогороваСмирнова (Max-KS) и измерениях коэффициента Джини на ROC-кривых, показанных на данной фигуре; фиг. 10 - три панели, А-С, иллюстрирующие эффективность реализации предпочтительного варианта изобретения на изображении низкого качества, взятом из процесса разработки модели; фиг. 11 - две панели, А и В, показывающие центрированное на просвете преобразование изображения на панели А в полярные координаты на панели В. Это преобразование было использовано для повышения эффективности алгоритма обнаружения макроскопических границ; фиг. 12 - две панели, А и В, показывающие эффективность алгоритма сегментации ткани на двух поперечных сечениях артерии. После выполнения сегментации ткани были исключены пиксели, ложно маркированные как компоненты бляшки снаружи стенки сосуда, что уменьшило количество ложных позитивов. Кроме того, можно получить оценки бремени бляшки путем сравнения отношения пикселей,классифицированных как бляшка, к количеству пикселей внутри стенки. В этих примерах была получена оценка бремени (объема) бляшек 28 и 62% соответственно; фиг. 13 - трехмерный вид части сонной артерии в области бифуркации. На этой модели показаны внутренняя граница артериальной стенки (1920) и твердая бляшка (1930) внутри просвета сосуда (1940),а внешняя граница артерии не показана. Липид (1910) между внутренней поверхностью (1920) и внешней поверхностью артериальной стенки (не показана) показан красным. Твердая бляшка на модели имеет бежевую окраску. Специалистам будет понятно, что варианты, представленные на прилагаемых чертежах, являются всего лишь репрезентативными и не отражают истинный объем изобретения. Осуществлене изобретения Прежде чем приступить к подробному описанию изобретения, следует отметить, что изобретение не ограничено конкретными способами, методикой и описанными системами визуализации, поскольку они могут варьироваться. Также следует понимать, что использованная терминология служит только в целях описания конкретных вариантов и не ограничивает объем описанного изобретения. Настоящее изобретение касается автоматизированных, объективных способов и систем для обнаружения и анализа бляшек в одной или более областей сосудистой системы человека. Предложенные способы, в общем, включают в себя сравнение данных, извлеченных из одно-, двух- или трехмерных изображений, полученных с использованием медицинской системы визуализации (или предшественников сбора данных для таких систем), чтобы исследовать пациента относительно базы данных, содержащей информацию, которая позволяет классифицировать полученные у пациента данные и обнаружить бляшку, если таковая имеется. Дальнейшие сравнения позволяют анализировать бляшку, например, при желании классифицировать ее (например, является ли данная бляшка стабильной или уязвимой). Для выполнения этих сравнений используются методы распознавания образов. Эта информация, одна или в совокупности с другими данными о пациенте, может использоваться в различных целях, например, для определения курса лечения и уменьшения риска того, что у пациента может возникнуть какое-либо негативное последствие (например, инсульт или сердечный приступ). Полезными для осуществления изобретения методами визуализации являются те методы, которые можно использовать для формирования трехмерных изображений кровеносных сосудов, включая КОТ, ПЭТ и МРТ и ультразвуковое исследова-5 009382 ние. В настоящее время предпочтительным является МРТ. На практике, для получения данных о пациенте его направляют в центр МРТ (или другой визуализации), в котором пациента помещают в систему визуализации, формирующую основные входные данные, необходимые для выполнения последующего анализа. Для реализации изобретения в центрах визуализации не требуется никакого дополнительного оборудования. После сбора исходных данных в предпочтительных вариантах их отправляют (например, через Интернет в виде одного или нескольких файлов с зашифрованными электронными данными) в центр для анализа. Затем данные автоматически обрабатываются для формирования индивидуализированного результата путем сравнения образов данных пациента с базой данных с применением набора из одного или более статистических классификаторов. После этого можно подготовить индивидуализированный результат пациента и отправить его запросившему врачу. В предпочтительных вариантах результат пациента представляет собой трехмерную визуализацию сосудистой системы пациента, например, на которой могут быть указаны места как всех бляшек, так подгруппы бляшек, уязвимых для разрыва. Этот результат может быть также полезен для количественного определения объема отдельных бляшек, всех бляшек, отдельных уязвимых бляшек и всех уязвимых бляшек. При использовании предложенных способов и систем в течение времени для получения множества анализов для данного пациента, особенно пациента, проходящего курс лечения по поводу атеросклероза, их можно использовать для оценки эффективности лечения. Например, можно определить, уменьшило ли данное лечение общее бремя (объем) бляшек у пациента (и/или уменьшилась ли скорость развития (или ожидаемого развития) этого бремени), уменьшился ли процент или количество уязвимых бляшек, изменился ли со временем состав конкретных бляшек (например, стал ли он более или менее стабильным) и т.д. Предложенные способы можно легко воплотить в программных, или аппаратных средствах, или в их комбинации, для обеспечения автоматизированного, неинвазивного и объективного обнаружения и анализа (например, идентификации и классификации бляшек) атеросклеротических (AT) поражений удобным для использования и воспроизводимым методом. Изобретение позволяет исследователям, врачам и пациентам легко повысить эффективность существующих методов и стратегий лечения заболеваний. Эти важные диагностические и прогнозирующие способы и системы позволят улучшить лечение и его результаты для того класса заболеваний, который является единственной ведущей причиной заболеваемости и смертности в современном мире. 1. Автоматизированные способы обнаружения и анализа сосудистых бляшек. Предложенные способы, в общем, основаны на вычислительном анализе данных пациента, полученных с помощью медицинской системы визуализации, чтобы определить, имеет ли пациент атеросклероз по меньшей мере в части его сосудистой системы. Для обнаружения сосудистой бляшки компьютер обрабатывает и сравнивает данные, используя статистические классификаторы для определения, содержит ли одна или более анализируемых областей кровеносного сосуда(ов) по меньшей мере одну ткань,коррелированную (т.е. о которой известно, что она связана) с присутствием сосудистой бляшки. При желании можно также классифицировать бляшку, если таковая имеется, например, как стабильную или уязвимую бляшку, в зависимости от тканей, идентифицированных в области бляшки. Кроме того, можно также получить такие оценки как объем бляшки, бремя бляшки, развитие заболевания, эффективность лечения и т.п. Сначала с помощью медицинской системы визуализации собираются исходные видеоданные по меньшей мере одной точки, линии, плоскости, поперечного сечения или трех- (или более) мерного изображения тела пациента, в частности, всего кровеносного сосуда или его части. В данном контексте термин "поперечное сечение" подразумевает, что действительные данные, воплощенные в нем, могут относиться к меньшему или большему количеству данных. Предпочтительные медицинские системы визуализации являются неинвазивными системами и включают в себя MP-приборы. Исходные данные, собранные из прибора визуализации, затем преобразуются в форму, пригодную для компьютерного анализа. Этот анализ выполняется с помощью компьютера для сравнения обрабатываемых данных данного поперечного сечения по меньшей мере с одним, предпочтительно с несколькими статистически полученными классификаторами или прогнозирующими моделями по меньшей мере для одной, предпочтительно нескольких, различных здоровых и патологических тканей, о которых известно, что они имеются в сосудистой системе. Таким образом, можно построить модель по меньшей мере одного поперечного сечения по меньшей мере одного кровеносного сосуда. Если получены данные для нескольких или множества поперечных сечений, то можно построить модель большего размера, которая распространяется на область,ограниченную различными поперечными сечениями. При желании полученную модель можно использовать для реконструкции трехмерной модели области(ей) анализируемого кровеносного сосуда, которая может отображать различные признаки кровеносного сосуда. Например, эта трехмерная модель может показывать место(а) бляшки внутри сосуда. Такие модели можно также использовать для вычисления степени стеноза в одной или более областей кровеносного сосуда, а также объема бляшки внутри конкретной области сосуда. Объем бляшки можно вычислить с помощью любого пригодного метода. Например, можно вычислить общий объем просвета кровеносного сосуда в отсутствии бляшки, а также объем просвета в этой области в присутствии бляшки. Разность между ними можно использовать как-6 009382 представление оценочного объема бляшки в данной области и можно также легко вычислить степень(например, процент) стеноза. Аналогичным образом можно определить бремя бляшки, а также другие клинические параметры заболевания. А. Репрезентативная конфигурация системы. На фиг. 1 схематически проиллюстрирован в качестве репрезентативного примера общий вид предпочтительного варианта системы для обнаружения и анализа бляшек согласно настоящему изобретению с использованием МРТ анализа. Понятно, что различные компоненты системы предпочтительно являются модульными, что позволяет модернизировать или обновлять один или более компонентов без необходимости модернизации или обновления всей системы. Кроме того, множество проиллюстрированных операций являются факультативными и включены в целях описания вариантов предложенных способов и систем, которые являются предпочтительными в настоящее время. В конкретном применении может быть желательным не использовать один или более из этих факультативных элементов, операций или процессов. Как показано на фиг. 1, процесс начинается с того, что собирают MP-данные пациента в центре МРТ или другом учреждении (110). Эти собранные исходные данные (105) передаются в систему обнаружения и анализа бляшек, которая является либо частью системы, находящейся в центре, где собирались данные, либо в другом учреждении. Для оперативной обработки данных в другом учреждении данные предпочтительно передаются электронным путем, например, в виде файла с зашифрованными данными, передаваемого через Интернет в учреждение, содержащее один или более компьютеров, сконфигурированных с возможностью обработки этих данных для обнаружения и, при желании, анализа сосудистых бляшек. Предпочтительно исходные видеоданные проверяются на соответствие минимальным стандартам качества (анализ качества данных, 120), например, методом вычисления показателя стабильности популяции. Если данные не имеют достаточного качества (и не могут быть визуализированы с достаточным качеством в конкретном применении изобретения), чтобы обеспечить надежный выход, то они не обрабатываются дальше, и предпочтительно передается сообщение в центр визуализации, извещающее об отклонении исходных данных как непригодных для анализа. При желании можно передать еще раз другую копию первоначальных исходных данных или, альтернативно, собрать и снова передать для анализа другой набор исходных данных для анализа (105). Удовлетворяющие параметрам гарантии качества исходные данные одобряются для дальнейшей обработки. В предпочтительных вариантах исходные данные предварительно обрабатываются и/или нормируются (этап 130), а затем подвергаются вычислительному анализу для предварительной идентификации макроскопических структур в кровеносном сосуде (140). Если для анализа доступно два или более видов данных, то сечения и различные виды данных приводятся к соответствию (150) с помощью любого пригодного алгоритма, сконфигурированного для машинной реализации. После этого можно выполнить преобразование изображения, обработку текстуры и вычисление переменных (т.е. обработку изображения, 160), после чего данные можно классифицировать, используя статистические классификаторы или прогнозирующие модели для присвоения классификации ткани (170). Затем можно определить границы макроскопических структур в кровеносном сосуде (этап 180) и построить трехмерную реконструкцию сосуда из этих различных данных (185). После этого выполняется диагностика поражения (в данном случае сосудистой бляшки), после чего можно построить трехмерную модель кровеносного сосуда, при желании вместе с диагностическим/прогностическим заключением и/или маркированными изображениями (195). При желании можно затем передать результаты указанному получателю, например врачу, клинике или в систему хранения данных для последующего их извлечения. Далее будут более подробно описаны несколько этапов системы, описанной выше и проиллюстрированной на фиг. 1.i. Ввод данных. Исходные видеоданные (105) пациента можно представить в систему оценки бляшек согласно настоящему изобретению с помощью любого подходящего метода. Предпочтительным методом является модель ASP (через провайдера прикладных услуг), в которой исходные видеоданные (105) пациента передаются из центра визуализации через защищенное Интернет-соединение. Другой моделью является модель API (через интерфейс прикладного программирования), в которой система оценки бляшек внедрена в программный пакет, установленный на месте в центре визуализации.ii. Обработка и форматирование изображения. В предпочтительных вариантах исходные видеоданные подвергаются анализу на гарантию качества, чтобы гарантировать соблюдение минимальных критериев качества изображения. Затем данные, отвечающие этим стандартам, подвергаются предварительной обработке. Например, данные, полученные из различных учреждений МРТ, могут быть представлены в разных форматах из-за использования различных MP-приборов, различных версий программы управления прибором и т.п. Предпочтительным общим форматом MP-данных является DICOM, хотя можно адаптировать и другие форматы для использования в соответствии с настоящим изобретением. При желании можно также компенсировать разрешение и шкалу, обусловленные аппаратными различиями разных MP-приборов и РЧ катушек, таким образом, чтобы получить данные, относительно свободные от шума и искажений.-7 009382 Как известно, интенсивность MP-сигнала уменьшается с увеличением расстояния от поверхности РЧ катушек (1/R2). В результате этого изображения, сформированные из исходных МР-данных, имеют"градиент освещенности", показанный на фиг. 2. Для коррекции этого эффекта можно при желании использовать любой полезный алгоритм, который известен сейчас или будет разработан в будущем. Пригодные методы включают в себя выравнивание гистограмм (Gonzalas and Woods, Digital ImageProcessing, 1992 Addison Wesley), а также использование элементарных волн для моделирования функции РЧ катушек. Другие алгоритмы, которые можно использовать для коррекции этого эффекта, являются частью коммерческих программных продуктов для обработки изображений, таких как MATLAB(Mathworks, Inc., Natick, MA). См. также Han, et al. (2001), J. Mag. Res. Imaging, vol.13:428-436. Устойчивая к ошибкам дискриминация изображения редко зависит от абсолютной (но не относительной) интенсивности пикселей, в основном, из-за того, что интенсивность часто зависит от конкретных условий и самого прибора визуализации, использованного для сбора данных. Поэтому обычно является полезным нормировать данные по максимальной интенсивности пикселей в каждом соответствующем изображении. Обычно данные из каждой модальности сбора данных (например, T1, T2, PDW, TOF и т.д.) нормируются независимо таким образом, чтобы данные из каждой модальности имели одинаковый динамический диапазон. Однако, используя ненормированные данные, можно создать дополнительные переменные, сравнивающие абсолютные интрамодальные разности интенсивности. Мультимодальные переменные, например, такие как отношение Т 1 и Т 2, измеряют отношение нормированных величин. Было замечено, что динамический диапазон интенсивностей пикселей в некоторых случаях сокращался, например, в некоторых изображениях сонной артерии in vivo. К концу последовательности (ближайшей к голове) наблюдаемое разрешение может быть очень плохим, вероятно в результате использования локализованной шейной катушки. Однако в зависимости от применения, например, оценки общего бремени бляшек в отличие от классификации бляшек или идентификации микроструктур (таких как реваскуляризация или толщина фиброзного покрова), все же могут быть полезными изображения с низким разрешением. Кроме того, разрешение могут увеличивать последовательности импульсов замедления крови (Yang, et al. (2003), International J. of Cardiovascular Imaging, vol. 19:419-428), также как и сбор данных с использованием нескольких модальностей. Например, в TOF-изображениях можно хорошо различать фиброзный покров сосудистой бляшки.iii. Предварительная идентификация макроскопических структур. Для обнаружения и анализа сосудистой бляшки в визуализированном сечении тела пациента часто бывает желательно идентифицировать кровеносный сосуд(ы), который необходимо анализировать. Идентификация макроскопической ткани позволяет выделить для анализа представляющую интерес область, например кровеносный сосуд, из MP-среза. Это можно легко реализовать, например, с помощью морфологических методов идентификации просвета сосуда. Конечно, можно также применять идентификацию других макроскопических морфологических признаков, например, артериальной мышцы, адвентиции и т.п., самостоятельно или в совокупности с обнаружением просвета. При использовании обнаружения просвета, после определения исходного места просвета в последующих срезах изображения можно использовать положение просвета в предыдущем срезе, чтобы получить первоначальную оценку положения просвета. Центр просвета (т.е. центроид просвета) после его обнаружения предпочтительно итеративно переоценивается для каждого среза. Чтобы избежать накопления ошибок оценки центроида в последующих срезах, особенно в контексте патологической ткани с нерегулярными признаками, можно применять дополнительные эвристические алгоритмы, такие как повторное совмещение в более удаленном осевом положении и интерполяция между срезами.iv. Совмещение изображений. Интервалы времени, необходимые для проведения мультимодальных МРТ сканирований, могут вводить ошибки интермодального и интрамодального выравнивания и совмещения в результате движения пациента, сердцебиения, дыхания, артериальной дилатации и т.д. Для каротидной визуализации предпочтительно берется множество срезов изображения, например, 12-20, параллельно на каждое сканирование, что занимает 3-4 мин в обычных современных коммерческих МР-приборах. Для мультимодальных изображений требуются дополнительные сканирования. Поэтому весь процесс может занимать(в настоящее время) 3-20 мин или больше в обычных MP-приборах для каротидной визуализации. В то время как синхронизация с циклом сердцебиения или дыхания не приносит большой пользы при каротидной визуализации, увеличение времени снятия томограммы (например, которое может потребоваться для томографии с использованием множества модальностей) может повысить вероятность того, что пациент пошевелится во время процедуры сканирования. При визуализации коронарной артерии, чтобы учесть движение бьющегося сердца, синхронизация может быть основана на ЭКГ для сбора исходных магнитно-резонансных данных, хотя это часто существенно замедляет процесс для каждой модальности,и нередко требуется около 10 мин на каждую модальность. При использовании нескольких модальностей вероятнее всего может потребоваться интермодальное совмещение или выравнивание. Достаточное совмещение можно обеспечить с помощью прямого выравнивания центроидов просвета. Однако благодаря высокой контрастности крови во всех MPмодальностях является вполне тривиальным создание "детектора просвета" для центрирования изобра-8 009382 жений на важной опорной точке, или ориентире. Обнаружение просвета позволяет локализировать макроскопическую границу просвета, которую можно затем использовать в качестве первоначальной опорной точки для совмещения изображений. Woods, et al. (1998), Journal of Computer Assisted Tomography,vol. 22: 139-152. Хотя удовлетворительное выравнивание можно обеспечить путем линейного перемещения и поворота жесткого тела (см. фиг. 3), возможно также применение других более сложных методов, в которых учитывается деформация ткани, например, в результате изменений артериального давления. См., например, Dhawan, А. (2003), Medical Image Analysis, IEEE Press Series in Biomedical Engineering. Понятно, что в методах с применением более тонкого выравнивания, например выравнивания по пикселям, предпочтительно используется метрика, с помощью которой можно количественно определить качество совмещения. Такие метрики могут быть простыми, например нормированной взаимной корреляцией, или более сложными, такими как максимизация взаимной информации. Viola and WellsWells, et al. (1996), Med Image Anal., vol.1(1):35-51. Важно отметить, что при выравнивании изображений или наборов данных, разработанных с использованием различных модальностей визуализации, контрольное изображение и подлежащее выравниванию изображение часто отображают различные характеристики. Критерии максимизации выравнивания, как таковые, могут не проявляться настолько четко, как пик, как ожидалась бы, если бы два изображения или набора данных были собраны с помощью одной и той же модальности. Для вертикального совмещения просвет анализируемого сосуда предпочтительно используется для выравнивания срезов из различных модальностей вблизи общей анатомической опорной точки, компьютерной имитации (например, центроида просвета) или другого ориентира. Тогда можно будет легко выровнять последующие срезы относительно этой общей точки. Например, удобной опорной точкой при каротидной визуализации является бифуркация сонной артерии. И действительно, в анализе, описанном в следующих примерах, бифуркация сонной артерии использовалась в качестве осевой опорной точки. Интервалы между срезами в различных модальностях могут также потребовать применения алгоритмов линейной интерполяции.v. Обработка изображений. В предпочтительных вариантах пригодные для обработки данные (т.е. данные, сконфигурированные для обработки компьютером) пропускаются через алгоритмы обработки изображения, чтобы удалить шум, а также синтезировать текстурные признаки и другие представляющие интерес переменные. При этом для оценки любой произвольной нелинейной дискриминантной функции можно использовать модели непараметрической регрессии (например, нейронные сети или радиальные базисные функции). См. Cybenko. G. (1989), Mathematical Contl. SignalSystems, vol. 2: 303-314; Hornik, et al. (1989), NeuralNetworks, vol. 2: 359-366; Jang and Sun (1993), IEEE Trans. Neural Networks, vol. 4: 156-159. На практике полезно вводить в набор переменных любые известные зависимости, чтобы упростить проблему оптимизации. Обычные методы включают в себя линеаризацию переменных и преобразование или объединение переменных для захвата нелинейных зависимостей и т.п. Например, при построении модели дискриминации сейсмических сигналов эффективность чрезвычайно возрастает, если сначала преобразовать временные последовательности в частотную область. Dowla, et al. (1990), Bull. Seismo. Soc. Amer., vol. 80(5): 1346-1373. При этом общей целью обработки изображений является создание преобразований введенного изображения. Типы используемых операций обработки изображений можно приблизительно разделить на несколько классов (не взаимоисключающих) в зависимости от их математической цели: уменьшения шума, уменьшения размера, обнаружения текстуры или признака, и производных переменных(часто назначаемых на основании знаний специалиста, хотя их можно определять с помощью математических/статистических методов). Ниже будут описаны примеры переменных и преобразований, демонстрирующие повышение эффективности системы классификации бляшек согласно настоящему изобретению, однако, для реализации настоящего изобретения можно также адаптировать и другие известные методы обработки изображений.vi. Классификация ткани. После обработки изображения (160) преобразованные данные подаются в статистические классификаторы для классификации каждого пикселя в изображении как принадлежащего к одной из нескольких тканей, включая компоненты сосудистой бляшки. Маркировка изображений - это прямой процесс выполнения математической функции на каждом пикселе в изображении. Один принцип разработки прогнозирующих моделей описан ниже в примере 2. Детальный пример построения прогнозирующих моделей для классификации бляшек из MP-томограмм будет описан в следующем примере 3.vii. Сегментация ткани. Сегментация изображения выполняется на выходе классификатора ткани, чтобы выделить представляющие интерес ткани, степень стеноза и т.п., а также удалить нерелевантные признаки. Во многих случаях различие между компонентами бляшки и непатологическими тканями невозможно вне анатомического контекста. Например, твердая бляшка является, по существу, рубцовой тканью и состоит в основном из коллагена, как и артериальная фасция. Коллаген за пределами артериальной стенки является структурным и, безусловно, непатологическим.-9 009382 Аналогично, отложения липидов или кальция за пределами сосуда не имеют клинического значения в контексте обнаружения и анализа бляшек внутри кровеносных сосудов. Для этого процесса можно использовать любой подходящий принцип. В предпочтительном варианте можно использовать знания в данной области, так как некоторые переменные теряют чувствительность в зависимости от радиального расстояния от границ просвета. В другом предпочтительном варианте отличные результаты можно получить с помощью двухступенчатого подхода, при котором предсказания типа ткани пропускаются через второй модуль - модуль обработки макроскопической структуры. По существу, выход прогнозирующих моделей подается в алгоритмы обработки изображений (например, контроль потока градиента и активных контуров (Han, et al. (2003), IEEE Trans. Biomed. Eng., vol. 50(6):705-710, чтобы определить границы артериальной мышцы. Затем можно удалить из анализа все пиксели, находящиеся за пределами этой границы, как компоненты бляшки или других тканей в артериальной стенке, ограничивающей внутреннюю часть кровеносного сосуда. Подход с использованием алгоритма "активных контуров" или алгоритма "змеек" (Xu, Р. (1997), Gradient Vector Flow: A New External Force for Snakes, IEEE Conference onComputer Visual Pattern Recognition; Xu, P. (1997), Snakes Shapes and Gradient Vector Flow, IEEE Transactions on Image Processing) проиллюстрирован на данных ex vivo на фиг. 12. Можно также адаптировать другие известные специалистам алгоритмы сегментации для использования в контексте изобретения. Например, сегментацию ткани можно осуществлять с помощью методов на основе правил. Результаты, показанные на фиг. 11 и 12, были получены с использованием такого подхода. Такие методы можно также использовать в связи с методами обнаружения границ, в которых применяется поиск путей минимальной стоимости (Bishop, С. (1995), Neural Networks and Statistical PatternRecognition, Oxford University Press). В процессе, использованном для получения результатов, показанных на фиг. 11, был использован метод на основе правил для преобразования изображений сосудов, центрированных на просвете, в радиальную систему координат, которая линеаризует признаки, являющиеся по сути радиальными.viii. Трехмерная реконструкция. После того как все срезы MP-томограммы были маркированы, можно при необходимости построить полную трехмерную модель артерии и бляшки. Для этой цели можно использовать алгоритмы, которые обнаруживают макроскопическую структуру (например, просвет и внешнюю артериальную стенку) непосредственно из данных в формате DICOM, полученных из коммерческого МР-прибора (например,MP-прибора, выпускаемого компанией General Electric). В примере 4 описан репрезентативный пример того, как можно строить такие модели.ix. Диагностика поражения. Диагностику поражения, включая общий размер и степень стеноза, содержание липидов, размер и объем бляшки, тромб, кальциноз и т.п., можно оценить из трехмерных реконструкций кровеносного сосуда (вокселей). Конечно, можно использовать модальности визуализации, которые избирательно обнаруживают компонент бляшки (например, липид), для создания полезных моделей из меньшего объема данных, при этом может потребоваться меньшее число модальностей визуализации (например, T1, T2,PDW, TOF и т.д. в контексте MP-анализа) для создания моделей, в которых можно обнаружить и анализировать сосудистую бляшку (например, классифицировать ее в смысле уязвимости для разрыва и т.п.). х. Выходные данные. Выходные данные этой системы можно представить в стандартных форматах, а также в заказных форматах, содержащих такую информацию, которая может потребоваться для пересмотра полученных результатов. В некоторых вариантах выходные данные могут состоять из исходных данных, данных,маркированных прогнозирующими моделями, трехмерной модели и диагностического заключения,включая факторы риска и рекомендованное лечение, если это указано. Предпочтительно, чтобы выход предоставлялся непосредственно в систему, особенно в системах, основанных на API модели. В контексте ASP модели компьютерная система, выполняющая анализ, передает выходной файл автоматически или после приема соответствующей команды по указанному адресу. Таким адресом может быть адрес электронной почты лечащего врача, радиолога и/или специалиста, обследуемого пациента, медицинского центра визуализации, из которого были переданы исходные данные пациента, и т.п.xi. Обобщение и стандартизация. Понятно, что автоматизированный характер предложенных способов позволяет разработать стандартизированные процедуры, форматы и т.п. для анализа данных. Применение способов и систем согласно настоящему изобретению также позволяет исключить субъективный, а значит изменчивый характер существующего сейчас анализа видеоданных специалистами.xii. Прочие вопросы. Как раскрыто в данном описании, МРТ можно использовать для идентификации морфологических признаков бляшек, таких как размер бляшки и толщина фиброзного покрова, с высокой степенью чувствительности и специфичности. Кроме того, МРТ позволяет различать компоненты бляшек (например,фиброзный покров, кальциноз, содержание липидов, кровоизлияние и т.п.), характеристики уязвимых и стабильных бляшек во всех основных артериях: сонных, коронарных и аорте. Для минимизации артефактов движения разработаны более совершенные протоколы визуализации. Worthley, et al. (2001), Int'l J.Cardiovascular Imaging, vol. 17:195-201; Kerwin, et al. (2002), Magnetic Res. In Med., vol. 47: 1211-1217. Преимущество MPT состоит в том, что структуры можно визуализировать с использованием нескольких различных модальностей. Т 1-, Т 2-, PD- и TOF-взвешенные изображения (T1W, T2W, PDW иTOFW соответственно) одной и той же анатомической ткани могут быть совершенно разными в зависимости от химических компонентов и структуры ткани. Например, с помощью Т 2-взвешенных изображений можно различать кальциноз, фиброзную ткань и внутрибляшечное кровоизлияние. Кальций очень гипоинтенсивный в изображениях, взвешенных по плотности протонов (PDW-взвешенных), в то время как гладкая мышца может быть хорошо охарактеризована с относительно коротким Т. Изображения,взвешенные по времени пролета (TOF-взвешенные) дают хорошую дискриминацию внутрибляшечного кровоизлияния и богатых липидами, некротических ядер. Для улучшения обнаружения реваскуляризации, другого индикатора уязвимости бляшки, можно использовать контрастные вещества. Кроме того, в анализе согласно настоящему изобретению можно также использовать другие вещества, такие как меченые антитела, везикулы, содержащие целевые средства, специфические для компонента бляшки, чтобы улучшить или дополнить данные, собранные в медицинской системе визуализации. Авторами было определено, что в настоящее время для обнаружения и анализа бляшек предложенными автоматизированными методами на основании МРТ предпочтительно использовать данные, полученные из двух, трех или четырех различных режимов визуализации (например, T1, T2, PDW и TOF) или их производных (например, отношений Т 1/Т 2), чтобы отличать компоненты бляшек от другой ткани кровеносного сосуда, хотя одномодальный или другой мультимодальный анализ также подпадает под объем изобретения. Интеграция информации, полученной из множества сопоставлений, будет способствовать получению еще более оперативных, точных и воспроизводимых оценок присутствия бляшки, ее расположения и состава. Такой анализ можно затем использовать для уменьшения количества модальностей, необходимых для измерения и классификации бляшки, и это возможно приведет к созданию РЧ последовательностей с более высокой дискриминационной способностью. Аналогично, использование режимов сбора данных, специфических для конкретных компонентов сосудистой бляшки, уменьшит время сбора исходных данных, а также позволит усовершенствовать приборы визуализации и их рабочие программы и т.д. 2. Применения. Острый тромбоз на почве нарушенных/эродированных атеросклеротических поражений человека играет критическую роль в начале развития острых коронарных синдромов и атеросклероза. Патологические данные ясно показывают, что именно состав бляшки, а не степень стеноза, влияет на уязвимость бляшки и тромбогенность. Понятно, что предложенные способы и системы можно применять для автоматического анализа изображений, основанного на распознавании образов, для обнаружения, измерения и классификации атеросклеротических бляшек in vivo, a также общего бремени бляшек и соответствующих мер. В предпочтительных вариантах трехмерные изображения получают с помощью МРТ. Автоматизация позволяет анализировать данные быстро и объективно (независимо от наблюдателя). Такие методы могут иметь различные применения, включая, например, обнаружение и, при желании, анализ сосудистой бляшки. Этот анализ может включать в себя, например, количественное определение объема бляшки, определение положения бляшки и/или оценку состава бляшки. Кроме того, анализ сосудистой бляшки может быть сфокусирован на одной или более областей сосудистой системы, находящихся внутри и/или ведущих к одному или нескольким органам или областям (например, к мозгу, сердцу, почке и т.п.) у пациентов, у которых установлено или не установлено сердечно-сосудистое заболевание (эта информация может быть полезной для выбора лечения, включая хирургическое вмешательство и медикаментозное лечение), для оценки общего бремени бляшек (например, в контексте скрининга пациентов,тактики лечения и т.п.) и для оценки риска и стратификации. Эти методы можно также использовать в качестве стандартных объективных диагностических и прогностических мер, что позволяет сравнивать результаты различных лабораторий в продолжительных исследованиях и т.п., чтобы оценить заменяющие конечные точки в клинических испытаниях лекарств и других видов лечения, а также в различных приборах для визуализации. В клинических условиях эти методы также позволят существенно уменьшить затраты на диагностику, связанные с измерением степени стеноза и обнаружением склонных к тромбозу бляшек, и снизить риск и бремя для пациентов, которые в противном случае должны были бы подвергаться более инвазивным диагностическим методам, и в то же время эти методы дают намного более полезную информацию, чем существующие методы. А. Сердечно-сосудистые заболевания. Таким образом, один контекст применения изобретения касается сердечно-сосудистых заболеваний. Известно, что сердечно-сосудистые заболевания являются одной из основных причин смертности как у мужчин, так и у женщин. Около трети всего населения развитых стран умирает от сердечнососудистых заболеваний и еще гораздо больше страдает от осложнений, связанных с сердечнососудистыми заболеваниями, и сопутствующим им ухудшением качества жизни. Только в США более 15 миллиардов долларов тратится ежегодно на услуги визуализации сердца и бляшек. Недавние исследования показали, что разрывы уязвимых, нестабильных бляшек являются причиной инсультов и сердечных приступов. Важно отметить, что около 70% бляшек, разрывы которых приводят к сердечному приступу,- 11009382 возникают в тех областях сосудистой системы, где есть маленькая бляшка. Однако в настоящее время не существует объективного и оперативного метода, позволяющего провести различие между уязвимой нестабильной бляшкой, которая склонна к разрыву и возникновению тромбоза, который может привести к сердечному приступу или инсульту, и стабильной бляшкой. Настоящее изобретения решает эту важную потребность посредством создания неинвазивных, объективных и оперативных способов обнаружения и анализа бляшек по всей сосудистой системе, особенно в сосудистой системе мозга, шеи и сердца.i. Дооперационная диагностика поражений и скрининг пациентов. Все современные нормативы Американской кардиологической ассоциации основаны на степени стеноза и состоянии симптомов без учета состава бляшек. Ясно, что более точная дооперационная диагностика (например, состав бляшки, например, кальциноз, содержание липидов, тромбоз, толщина фиброзного покрова и т.п.) существенно улучшила бы дооперационную оценку риска, позволив медикам более надежно оценивать относительный риск хирургического вмешательства по сравнению с медикаментозным вмешательством.ii. Лечение. Многие превентивные меры и курсы лечения сердечно-сосудистых и цереброваскулярных заболеваний назначаются пациентам на основании оценки сердечно-сосудистого заболевания (ССЗ) или цереброваскулярного риска. В целях настоящего описания ССЗ будет обсуждаться в качестве репрезентативного примера атеросклероза, к которому, в основном, относится настоящее изобретение. Так нормативы Объединенного национального комитета по гипертензии и нормативы Комитета лечения взрослого населения/Национального комитета образования по холестеролу определяют пригодность к лечению на основании ожидаемого риска ССЗ, т.е. они определяют пороговые проценты для лечения, или уровни артериального давления или холестерола, при которых следует начинать лечение, на основании оценок риска ССЗ. Кроме того, они определяют цели лечения по ожидаемому риску ССЗ, т.е. агрессивности заболевания или уровням артериального давления или холестерола, до достижения которых необходимо проводить лечение. Эти нормативы теоретически оправданы, так как у людей с более высоким риском ССЗ существует больше риска, который следует снизить: одно и то же частичное снижение риска дает большее абсолютное снижение риска у людей, которые имеют более высокий основной риск ССЗ, а большее снижение риска ССЗ дает более высокую экономическую эффективность лечения (меньшему числу людей потребуется лечение для предотвращения ССЗ или смерти), и тем больше вероятность того, что польза (абсолютная) от лечения превзойдет причиненный им вред. В современных принципах оценки риска ССЗ (по которой прогнозируются пороговые уровни и цели лечения) не используется информация, относящаяся к уязвимым бляшкам. Так как уязвимая бляшка является ключевым детерминантом риска ССЗ (если не самым важным), и так как настоящее изобретение позволяет обнаружить и анализировать уязвимую бляшку объективным, автоматизированным и доступным методом, можно значительно повысить точность прогнозов риска ССЗ (прогнозов риска, нацеленных на различные конечные органы), что позволит заметно улучшить определение целей лечения. Улучшение прогнозов риска ССЗ (и стратификации риска) на основании эффективной оценки, например, уязвимых бляшек, общего бремени бляшек и т.п., может иметь важные экономические и жизнесохраняющие последствия. Улучшение определения цели лечения людей, реально находящихся в группе риска, позволит сохранить жизнь ценой меньших расходов и сэкономить средства для такого же сохранения жизни. Обнаружение бляшек и определение их характеристик также позволит принимать лучшие решения в отношении тех, кому требуется медицинское вмешательство, и относительно того, какое медицинское вмешательство будет оптимальным для конкретного пациента. Сюда может входить назначение лекарственных препаратов (дорогостоящих) для снижения уровня холестерола (например, аторвастатина, симвастатина, правастатина, ловастатина, розувастатина и флувастатина), на которые сейчас приходится самая большая доля расходов среди всех назначаемых лекарств в мире (их годовой рынок составляет 20 миллиардов долларов США), и применение которых по прогнозам значительно возрастет по мере старения населения. В более общем смысле, обнаружение и анализ бляшек может также существенно улучшить принятие решений по курсам лечения, направленным на снижение риска сердечно-сосудистых заболеваний посредством любого набора механизмов, включая, помимо прочих, препараты, снижающие артериальное давление (например, тиазидные диуретики, такие как гидрохлортиазид; бета-блокираторы, такие как атенолол; ингибиторы конвертирующего ангиотенсин фермента, такие как фозиноприл; блокираторы рецептора ангиотенсина, такие как ирбесартан; блокираторы кальциевых каналов, такие как нифедипин(дилтиазем и верапамил); альфа-блокираторы, такие как празоцин (теразоцин); и вазодиляторы, такие как гидралазин; препараты, стабилизирующие бляшки (что можно достичь с помощью некоторых статинов),уменьшающие уровень липидов (что можно достичь с помощью статинов, производных фибриновой кислоты, таких как гемфиброзил или фенофибрат; ниацина или вариантов типа ниаспана; усилителей секреции желчной кислоты, таких как колестипол или холестирамин; или блокираторов абсорбции холестирола, таких как эзетимиб); препараты, уменьшающие воспаления и/или антитромбоцитарные (например, аспирин, клопидогрел и т.п.) или антитромботические препараты (например, активатор плазминоге- 12009382 на или стрептокиназа. Конечно, в зависимости от конкретного пациента и условий лечения может быть желательным объединить одну или более из перечисленных терапий, самостоятельно или в комбинации с другими вмешательствами. Улучшение определения целей хирургического вмешательства для тех людей, у которых имеется максимальный риск, может быть еще более важным, так как потенциальные расходы на хирургическое вмешательство и связанный с ним риск должны нести только те лица, для которых реальный риск данной проблемы превышает риск, обусловленный хирургическим вмешательством. Оценка уязвимых бляшек может значительно улучшить определение, действительно ли пациент имеет такой высокий уровень риска.iii. Разработка лекарственных препаратов. Для контролирования эффективности понижающих содержание холестерола лекарственных препаратов исследователи используют ручную оценку неинвазивных видеоданных пациента в продолжительных исследованиях. Однако ручное исследование слишком дорогой способ для общей клинической диагностики. Что же касается автоматизированных способов и систем согласно настоящему изобретению,то их можно использовать для оперативной выработки статистически надежных оценок состава бляшек(например, кальциноза, содержания липидов, тромбоза, толщины фиброзного покрова и т.д.), общего бремени бляшек, бремени уязвимых бляшек, отношения уязвимых бляшек к стабильным, или отложений липидов, которые могут использоваться в качестве заменителей клинических последствий (например,разрыва, инсульта, ИМ), что существенно уменьшает время и стоимость исследований. Другим важным преимуществом, которое обеспечивает настоящее изобретение, является существенное уменьшение количества пациентов и продолжительности последующего наблюдения, необходимого для демонстрации эффективности сердечно-сосудистых и цереброваскулярных лекарственных препаратов, включая те, которые проходят клинические испытания. Например, учитывая существенную клиническую эффективность применения статинов, может быть неэтичным проводить новые испытания, которые включают в себя плацебо. Следовательно, для демонстрации существенного преимущества относительно современных сердечно-сосудистых препаратов испытания могут потребовать, по меньшей мере, всего нескольких тысяч пациентов и последующего наблюдения в течение 3-5 лет.iv. Улучшение диагностики. Другое применение предложенных способов и систем касается обеспечения более эффективных средств диагностики и прогнозирования для пациентов и врачей. В этом отношении обнаружение бляшек и аналитические данные и результаты, полученные при использовании изобретения, можно объединить с данными из других источников, чтобы получить еще более совершенные диагностические результаты и услуги. Например, для формирования карт оценки риска сердечно-сосудистых заболеваний (ССЗ) широко используется база данных кардиологических исследований Фремингема. Эта база данных была создана в результате контролирования 5209 пациентов в течение времени, и на ее основании были получены прогностические переменные, включающие возраст, пол, меры холестерола и гипертензии, демографические факторы, лекарства, состояние диабета, потребление алкоголя, курение, историю кардиологических проявлений (например, инфаркта миокарда (ИМ), стенокардии, тахикардии и брадикардии),реваскуляризацию, процедуры коронарного шунтирования, инсульт, уровни аналитов в крови (например,креатинина, протеина), классификацию личности (например, тип А) и количество "возникающих" факторов риска, включающих уровни С-реактивного протеина, молекул адгезии VCAM, ICAM, и другого в крови. Оцениваемые последствия включали в себя летальный исход (по специфической причине) и сердечно-сосудистые проявления, такие как ИМ, инсульт и внезапная смерть. База данных Фремингема не содержит MP-томограмм, однако, MP-томограммы пациентов in vivo из самых последних продолжительных испытаний статиновых препаратов содержат как MPтомограммы, так и соответствующие истории болезни пациентов и факторы риска (например, артериальное давление, уровни холестерола и т.п.). Например, исследовательская группа в Маунт-Синае собиралаMP-томограммы с интервалами шесть месяцев в течение двух лет (Woods et.al. (1998), Journal Of Computer Assisted Tomography, vol.22:139-152). Объединив результаты, полученные при использовании предложенных способов, с одной или более точками данных, коррелированных с ССЗ, можно реализовать еще более совершенные диагностические процедуры. В. Инсульт. Лучшее знание состава атеросклеротических поражений также позволит более точно стратифицировать риск возникновения инсульта у пациентов и облегчит выбор соответствующей терапии. Приблизительно 25% инсультов связано с окклюзией внутренней цервикальной сонной артерии. Варианты лечения включают в себя антитромбоцитарную терапию, эндартерэктомию, имплантаты и ангиопластику. Из этих методов лечения каротидная эндартерэктомия (проактивное хирургическое удаление) является предпочтительным вариантом лечения развитых каротидных поражений, и в США ежегодно проводится более 120000 таких операций. Несколько больших клинических исследований, включая Североамериканские исследования симптоматических каротидных эндартерэктомий (NASCET), исследования асимптоматического каротидного атеросклероза (ACAS) и исследования европейской группы по каротидной хирургии (ECST), показали, что эта процедура существенно снижает риск инсульта при определенных- 13009382 ограничениях. Для симптоматических пациентов со стенозом 70% оценка общего уменьшения двухгодичного риска инсульта составила 17%. Хирургия также повышает периоперационный риск: у хирургических пациентов смертность возрастает от 0,3 до 0,6%, случаи инсульта возрастают от 3,3 до 5,5% и цереброваскулярные осложнения возрастают от 3,3% до 5,5%. Для асимптоматических пациентов со стенозом выше 60% совокупный риск инсульта и периоперационного инсульта или смерти оценивается как 5,1% для хирургических пациентов по сравнению с 11% для тех, кого лечили медикаментозно. Более того, факты свидетельствуют, что в оценках отрицательных результатов, полученных в этих исследованиях, недооценивается вероятность отрицательного результата в реальных условиях, что еще больше повышает важность идентификации тех лиц, для кого вероятна действительная польза. Применение предложенных способов позволит лучше оценивать пациентов, а значит реализовать соответствующую терапию. Так же, как и для сердечно-сосудистых заболеваний, скрининг позволит диагностировать пациентов гораздо раньше в процессе развития заболевания, а это позволит осуществить более раннее терапевтическое вмешательство и значительно снизить развитие риска со временем. 3. Компьютерные реализации. Различные методики, способы и аспекты предложенного изобретения можно реализовать частично или полностью с использованием компьютерных систем и способов. Кроме того, можно использовать компьютерные системы и способы для совершенствования или расширения описанных выше функций,повышения скорости выполнения этих функций и обеспечения дополнительных признаков и аспектов как части или дополнительно к признакам и аспектам настоящего изобретения, описанным в настоящем документе. Далее будут описаны различные компьютерные системы, способы и реализации, соответствующие описанной выше технологии. Различные варианты, аспекты и признаки изобретения, описанные выше, можно реализовать с помощью аппаратных, программных средств или их комбинации, используя вычислительную систему,имеющую один или более процессоров. Фактически, в одном варианте эти элементы реализуются с использованием процессорной системы, способной исполнять описанные функции. Примерная процессорная система может включать в себя один или несколько процессоров. Каждый процессор подключен к коммуникационной шине. Различные варианты программного обеспечения будут описаны в связи с этим примером компьютерной системы. Варианты, признаки и функции изобретения в данном описании не зависят от конкретной вычислительной системы, или от архитектуры процессора, или от конкретной операционной системы. Фактически, на основании данного описания специалисту будет понятно, как реализовать настоящее изобретение, используя другие компьютерные или процессорные системы и/или архитектуры. Процессорная система обычно содержит основную память, предпочтительно оперативное запоминающее устройство (ОЗУ), а также одно или несколько вторичных запоминающих устройств, включающих в себя накопители на дисках, накопители на магнитной ленте, съемные накопители (например, подключаемые или съемные запоминающие устройства и накопители для магнитной ленты, приводы дляCD-ROM, DVD, флоппи-дисков, оптических дисков и т.п.). В альтернативных вариантах вторичные запоминающие устройства включают в себя прочие запоминающие устройства, позволяющие вызывать или загружать в вычислительную систему компьютерные программы или другие команды. Вычислительная система согласно настоящему изобретению может также включать в себя коммуникационный интерфейс (предпочтительно совместимый с телекоммуникационной сетью), чтобы позволить передавать программы и данные в вычислительную систему или между вычислительной системой и одним или несколькими внешними устройствами. Примерами коммуникационных интерфейсов являются модемы, сетевой интерфейс (например, карта Ethernet), коммуникационный порт, слот и картаPCMCIA и т.п. Программы и данные, передаваемые через коммуникационный интерфейс, будут иметь форму сигналов, которые могут быть электронными, электромагнитными, оптическими или другими сигналами,которые может принимать данный коммуникационный интерфейс. Эти сигналы обычно передаются в коммуникационный интерфейс по каналу, который несет сигналы и который можно реализовать с помощью беспроводной среды, провода, кабеля, оптоволоконной или другой коммуникационной среды. Некоторые примеры такого канала включают в себя телефонную линию, линию сотовой телефонной связи,РЧ канал, сетевой интерфейс и другие коммуникационные каналы. В настоящем документе термины "компьютерный программный продукт" и т.п. относятся, в общем,к таким средствам, как съемное устройство хранения данных, диск, пригодный для установки в дисководе, и сигналы в канале связи. Эти компьютерные программные продукты передают программное обеспечение или программные команды в процессор(ы). Компьютерные программы (также называемые компьютерной управляющей логикой) обычно хранятся в основной памяти и/или вторичной памяти. Компьютерные программы можно также принимать через коммуникационный интерфейс. Компьютерные программы при их исполнении позволяют компьютерной системе реализовывать признаки настоящего изобретения. В частности, компьютерные программы при их исполнении позволяют процессору(ам) реализовывать признаки настоящего изобретения. Соответственно, компьютерные программы представляют контроллеры вычислительной системы.- 14009382 В тех вариантах реализации изобретения, где применяется программное обеспечение, это программное обеспечение может храниться в компьютерном программном продукте или передаваться через него и загружаться в вычислительную систему с помощью любого подходящего устройства или коммуникационного интерфейса. Управляющая логика (программа) при исполнении процессором(ами) побуждает процессор выполнять описанные в данном документе функции изобретения. В другом варианте предложенные способы реализуются, в основном, в аппаратных средствах или в комбинации аппаратных и программных средств, с использованием, например, таких аппаратных элементов, как PAL, интегральные схемы прикладной ориентации (ASIC) или другие аппаратные компоненты. Для специалистов также будет очевидным применение аппаратного конечного автомата для выполнения описанных здесь функций. Примеры Описанные ниже примеры представлены для иллюстрации некоторых аспектов настоящего изобретения, чтобы помочь специалистам в его реализации. Эти примеры ни в коей мере не следует считать ограничивающими изобретение. Пример 1. Обработка изображения. В данном примере будет описано несколько конкретных предпочтительных методов обработки видеоданных в контексте настоящего изобретения, включая уменьшение шума, уменьшение размера и обработку текстуры. А. Уменьшение шума. Сложные мультиконтрастные изображения подвергались обработке в целях уменьшения шума и введения сглаживания. В каждом случае изображение сначала подвергали медианной фильтрации для удаления шума с импульсными характеристиками, а затем сглаживанию адаптивным фильтром Винера,который осуществляет подгонку к статистике в окружающем соседстве "N" пикселя. Среднее значение и дисперсию оценивали из интенсивностей a в положениях пикселя n1, n2 Затем эти оценки использовались для назначения параметра b для фильтра Винера Выполняли двухмерную свертку на каждой плоскости интенсивности изображения с приведенными выше коэффициентами b. В. Уменьшение размера. Из-за большого количества точек данных и переменных, подлежащих обработке, в целях минимизации эффектов шума предпочтительно уменьшить размерность набора данных, чтобы получить меньшее количество переменных, однако, имеющих при этом более высокое статистическое значение. Кластерный анализ представляет собой всего лишь один из множества методов, применяемых для уменьшения шума и размерности исходных данных, сформированных прибором визуализации, для получения наиболее ярко выраженных признаков. Кластеризация методом К-средних является одним из примеров алгоритма кластеризации. В этом алгоритме формируется К классов, члены которых находятся в положениях (признак-пространство), наименее удаленных от оцениваемого центроида каждого класса. В этом подходе первоначальная оценка выполняется на центроидах кластеров, а затем эти центроиды переоцениваются в соответствии с обновленным членством классов. В основе алгоритма кластеризации методом К-средних лежат следующие операции:i) выбор некоторого количества кластеров k с первоначальными центроидами;ii) разделение точек данных на k кластеров путем приписки каждой точки данных к ближайшему к ней центроиду кластера;iii) вычисление матрицы приписок кластеров иiv) оценка центроидов каждого кластера. Операции ii-iv повторяются до тех пор, пока не будут достигнуты критерии остановки, обычно, когда члены перестанут изменять членство в кластерах. См. Bishop (1995), Neural Networks and StatisticalPattern Recognition, Oxford University Press. Примерные результаты кластерного анализа представлены на фиг. 7. Из фигуры видно, что некоторые кластеры имеют высокую корреляцию с конкретными типами ткани. Кластеризация текстуры дала вполне визуально удовлетворительные результаты, однако, статистически они не так хороши, как прогнозирующая модель. Поэтому категории кластеров по К-средним были использованы в качестве вводов в прогнозирующие модели. Можно также использовать другие известные инструменты для уменьшения размерности, включая такие принципы, в которых сочетается теоретическая возможность подгонки к нелинейной кривой, свойственная обычной искусственной нейронной сети (ИНС), со стабильностью иерархических методов (Bates White, LLC software, RDMSTM). В результате эти программы оценки открыты только для тех вводов, о которых известно, что они имеют некоторую собственную прогностическую способность, и которые могут также воплощать ряд наиболее полезных основных нелинейных эффектов в модели. Эти шаги позволяют сфокусировать обучающую- 15009382 стадию ИНС на проблеме с меньшей размерностью и с меньшей нелинейностью в параметрах, чем это бы потребовалось в противном случае. Другие методы включают в себя анализ принципиальных компонентов, анализ независимых компонентов (Bell and Sejnowski (1995), Neural Computation, vol. (7)6:11291159), а также локальные информационные метрики (Haralick, R. (1979), Proc. IEEE, vol. 67(5. С. Меры текстуры. Компоненты ткани и бляшки можно визуально различать по их текстуре. Например, мышцы и коллагеновые ткани часто выглядят полосатыми, а некротические ядра - пятнистыми. Формальных математических определений текстуры не существует, однако, эти признаки имеют математические корреляты,такие как содержание информации, пространственные частоты и т.п. В обычно используемой классификации различается 28 мер текстуры. В данном случае было использовано два класса мер текстуры: статистика локальных изменений интенсивности и пространственной частоты. Использовавшиеся статистические меры пикселей были стандартными статистическими величинами, которые применялись к соседствам различного размера. Для формирования оценки пространственной спектральной энергии для ориентации "x" и "y" применялось дискретное косинусное преобразование (ДКП). Например, область пикселей, содержащая множество мелких деталей, имеет большую долю энергии в более высоких пространственных частотах. Выражение для двухмерного ДКПD. Производные переменные. Производные переменные синтезируются из основных записей, которые предположительно имеют прогностические свойства. Две переменные, подпадающие под эту категорию, включают в себя произведения и отношения исходных переменных и других комбинаций трех типов данных. Было обнаружено,что следующие три типа производных переменных имеют высокую дискриминационную способность: (i)"детектор жира", определяемый как отношение Т 1/Т 2, который полезен при обнаружении липидов; (ii) поворот оси: YCbCr. В этом формате информация освещенности сохраняется как один компонент (Y), а информация цветности сохраняется как два цветоразностных компонента (Cb, Cr). Cb представляет разность между синим компонентом и некоторым эталонным значением. Cr представляет разность между красным компонентом и некоторым эталонным значением. Третий тип (iii) - это локальная переменная среды, основанная на геометрическом расстоянии от границы просвета. Примеры других потенциально ценных признаков изображения приведены в следующей табл. 1. Таблица 1 Примеры переменных и преобразований для обработки изображения"Модель" - это математическое или статистическое представление данных или системы, используемое для объяснения или прогнозирования поведения в новых условиях. Модели могут быть механистическими (которые обычно используются в физико-технических науках) и эмпирическими/статистическими (в которых моделированные прогнозы не направлены на объяснение основных причинно-следственных связей). Статистическое моделирование имеет два соответствующих примененияразработка статистических классификаторов и прогнозирующих моделей. Статистические классификаторы предназначены для различия классов объектов на основании набора наблюдений. В прогнозирующих моделях делается попытка прогнозировать результат или предсказать будущее значение из текущих наблюдений или ряда наблюдений. В настоящем изобретении применяются оба типа моделей: статистические классификаторы применяются для классификации компонентов ткани и бляшек, а прогнозирую- 16009382 щие модели применяются для прогнозирования рисков, связанных, например, с сердечно-сосудистым заболеванием (ССЗ). Процесс разработки модели зависит от конкретного применения, однако, некоторые основные процедуры, схематически проиллюстрированные на фиг. 4, являются общими для типичной работы по разработке модели. Сначала необходимо создать набор данных для моделирования, включающий в себя последовательность наблюдений ("образов") и известных последствий, значений или классов, соответствующих каждому наблюдению (так называемых "маркированных" или "целевых" значений). На фиг. 4 этот этап обозначен как создание набора данных 410. Этот набор данных моделирования используется для построения (или "обучения") прогнозирующей модели. Затем эта модель используется для классификации новых (или немаркированных) образов. Разработка модели часто является итеративным процессом создания и выбора переменных, обучения модели и оценки, как будет описано ниже. А. Создание набора данных. Первым этапом процесса построения модели обычно является сбор всех доступных фактов, измерений или иных наблюдений, которые могут быть релевантными для рассматриваемой проблемы, в набор данных. Каждая запись в наборе данных соответствует всей имеющейся информации по данному событию. Для построения прогнозирующей модели необходимо установить "целевые значения", по меньшей мере, для некоторых записей в наборе данных. В математических терминах целевые значения определяют зависимые переменные. В примерном применении для прогноза риска ССЗ цели можно установить, используя клинические последствия, замеченные в долгосрочных клинических наблюдениях. В контексте обнаружения и анализа бляшек (например, классификации) эти цели соответствуют, например,изображениям, которые маркированы специалистом или подтверждены гистологическим исследованием. На фиг. 5 показан процесс маркировки данных, использованный в одном таком применении. В этом примере каждая пара образ/цель обычно называется "образец", или обучающий пример, которые используются для обучения, тестирования или подтверждения модели. Понятно, что состав образца образа зависит от цели моделирования.i. Разделение данных. Как показано на фиг. 4, реализация моделей обычно включает в себя разделение данных (этап 420). В большинстве работ по созданию моделей требуется два, а предпочтительно по меньшей мере три подмассива данных: набор данных для разработки (данных, используемых для построения/обучения модели) 427, набор данных для тестирования (данных, используемых для оценки и выбора отдельных переменных, предварительных моделей и т.д.) 425 и набора данных для подтверждения (данных для оценки окончательной эффективности) 429. С этой целью исходные данные произвольно делятся на три набора данных, которые не обязательно имеют одинаковый размер. Например, данные можно разделить следующим образом: 50% для разработки (427), 25% для тестирования (425) и 25% для подтверждения(429). Сначала разрабатывается модель с использованием данных для разработки (427). Полученный результат проверяется на данных для тестирования (425), чтобы контролировать такие проблемы, как излишняя подгонка (также известная как "переобучение"), т.е. модель должна продемонстрировать сопоставимую эффективность как на данных для разработки (427), так и на данных для тестирования (425). Если модель проявляет более высокую эффективность на данных для разработки (427), чем на данных для тестирования (425), то ее корректируют до тех пор, пока модель не достигнет стабильной эффективности. Чтобы удостовериться, что модель работает на любом независимом наборе данных, как ожидается,идеально отложить некоторую часть данных исключительно для окончательного подтверждения модели. Набор данных 429 для подтверждения (или "отложенный") состоит из набора примерных образов, которые не были использованы для обучения модели. Тогда можно будет использовать законченную модель для вычисления этих неизвестных образов, чтобы оценить, как она будет работать при вычислении новых образов. Кроме того, в некоторых применениях может потребоваться дополнительный, "внеочередной" набор данных для подтверждения, чтобы проверить стабильность работы модели со временем. Часто бывает необходимо дополнительное "разделение данных" для более сложных методов моделирования, таких как нейронные сети или генетические алгоритмы. Например, некоторые методы моделирования требуют набора данных для "оптимизации", чтобы контролировать процесс оптимизации модели. Следующий аспект моделирования связан с созданием/преобразованием переменных, как показано на этапе 430 на фиг. 4. Целью этой обработки является точность и введение знаний, существующих в данной области. Значения исходных данных не обязательно являются лучшими переменными для модели по многим причинам, например, из-за ошибок ввода данных, нечисловых значений, отсутствующих значений и посторонних значений. Прежде чем запускать в работу логику моделирования, часто требуется воссоздать или преобразовать переменные, чтобы лучше использовать собранную информацию. Чтобы исключить зависимость между данными для разработки, тестирования и подтверждения, всю логику преобразования предпочтительно извлекать только из данных для разработки. В связи с требуемым и/или необходимым преобразованием переменных процесс моделирования включает в себя этап 440 выбора переменных. После этого разработка модели может включать в себя- 17009382 обучение модели 450 в совокупности с тестированием модели. Далее может следовать подтверждение модели. Результаты подтверждения модели 460 показывают, достигнута ли целевая эффективность 470. Как показано на фиг. 4, если целевая эффективность достигнута, то процесс моделирования завершается на этапе 480. Если же целевая эффективность не была достигнута, то может потребоваться дополнительная разработка модели. Соответственно, процесс на фиг. 4 может возвратиться к этапу 430, чтобы изменить создание или преобразование переменных для достижения лучшей эффективности. Пример 3. Классификация бляшки. В этом примере описывается предпочтительный вариант изобретения для обнаружения и классификации бляшек с использованием статистических классификаторов. Сначала работа была направлена на построение системы с использованием набора моделей для обнаружения трех ключевых компонентов атеросклеротической бляшки на магниторезонансных (MP) томограммах кровеносных сосудов ex vivo. Система также обнаружила ткань артериальной мышцы, что позволило при объединении с системой обнаружения бляшек и липидов идентифицировать на изображении всю артерию и вычислить оценки бремени бляшки. Эта система полностью автоматизирована, и в данном примере единственное вмешательство человека в процесс обнаружения и анализ имело место во время сбора исходных магниторезонансных данных из MP-прибора. С помощью этой системы при классификации компонентов бляшки был достигнут успех, равный или превосходящий эффективность работы специалиста-радиолога. В данном примере прогнозирующие модели были обучены идентифицировать три типа ткани: бляшки, липиды и мышцы. Детектор бляшек обучали с помощью маркировки образцовых изображений,которые идентифицировали твердые бляшки. Детектор липидов обучали на меньшем наборе изображений, на которых можно было идентифицировать и маркировать липиды. Детектор мышц использовали для отделения ткани артериальной стенки от других частей сосуда, показанного на изображениях. Можно разработать дополнительные модели для обнаружения кальцифицированной ткани, тромба и других непатологических тканей. Правильная идентификация артериальных стенок позволяет вычислить оценки бремени бляшек в сосуде на основании выводов других моделей. Целью прогнозирующего моделирования является точное предсказание истинных классификаций для каждого пикселя на изображении на основании характеристик MP-томограммы для данного пикселя и его непосредственного окружения. Прогнозирующее моделирование начинается после того, как завершены операции обработки изображения, и исходные изображения преобразованы в колоночные данные, представляющие каждый пиксель как запись. Каждая запись пикселя содержит одну переменную, идентифицирующую истинную классификацию для каждого пикселя, и более четырех сотен дополнительных переменных, охватывающих характеристики, полученные на этапах обработки изображения. Проблема прогнозирующего моделирования в том, чтобы просеять эти сотни потенциальных переменных, выполнить тысячи переборов переменных и прийти к самой прогностической комбинации. В предпочтительном варианте используется принцип моделирования на основе искусственной нейронной сети (ИНС), известной как процессорная сеть с релевантным вводом (RIPNet; Bates White, LLC,San Diego, CA; Perez-Amaral and White (2003), Oxford Bulleting of Economics and Statistics, vol. 65:821838), однако, можно также использовать известные специалистам стандартные линейные и нелинейные регрессивные методы (такие как линейная и логистическая регрессия, деревья решений, непараметрическая регрессия (например, с использованием нейронных сетей или радиальных базисных функций), сетевое моделирование Бейеса, дискриминантный анализ Фишера, системы с нечеткой логикой и т.п.). RIPNet была разработана специально для решения проблемы, как идентифицировать сетевую архитектуру с множеством потенциальных переменных, избежав при этом излишней подгонки. Типичная проблема,связанная с оценкой на основе нейронной сети, состоит в том, что функциональная форма, воплощенная в этих моделях, по существу, является "слишком гибкой". Стандартные принципы ИНС определяют такой уровень гибкости модели, при котором, если осуществлять автоматическую оценку (если только не включен также автоматический процесс тестирования или взаимного подтверждения), то в итоге будет учитываться не только сигнал в данных, но и шум. Это приводит к излишней подгонке, т.е. к ситуации, в которой модель не обеспечивает удовлетворительного обобщения информации, не содержащейся в обучающих данных. Широкое распространение получили такие процедуры, как правила оптимальной остановки, в качестве метода остановки процедуры обучения сети (по существу, это алгоритм подбора методом наименьших квадратов) в точке перед началом подгонки шума. Эти процедуры имеют дело с симптомом, но не с причиной излишней подгонки модели. Излишняя подгонка в ИНС обусловлена, по существу, избыточной сложностью спецификации модели, что прямо аналогично проблемам излишней подгонки, которые могут встречаться в линейных моделях. Если излишняя подгонка имеет место в линейной модели, то одним из решений является не изменение программы подбора методов наименьших квадратов, а упрощение спецификации модели путем отброса переменных. Другим решением является использование набора данных с взаимным подтверждением для указания, когда следует остановить подгонку.RIPNet воплощает в себе фундаментально иной подход к оценке на основе нейронных сетей, нацеленной непосредственно на идентификацию уровня сложности модели, что гарантирует оптимальную эффективность прогноза вне выборки без внесения специальных изменений в сами алгоритмы подгонки. Существует пять основных процедур создания моделей с использованием принципа RIPNet, которые будут более подробно обсуждаться в следующих разделах: (1) создание набора данных, маркировка и выборка; (2) обнаружение аномальных данных; (3) предварительный выбор переменных и создание преобразований; (4) оценка прогнозирующей модели и выбор переменных; и (5) окончательное подтверждение модели.i. Создание набора данных. Модели были разработаны на базе совокупностей наборов данных MP-томограмм для прогнозирования присутствия каждого из нескольких основных признаков ткани на попиксельной основе. Десять маркированных изображений дали 112481 пригодных к использованию наблюдений ткани (т.е. пикселей). Эти результаты демонстрируют масштабируемый подход к обнаружению признаков, который не основан на специфике геометрии сосуда или на разрешении изображения, для получения клинически релевантных надежных результатов. Видеоданные, использованные для обучения модели и оценки, состояли из десяти артериальных сечений ex vivo, которые представляли все поперечные сечения артериальных изображений, доступных для данного проекта. Маркировку компонентов бляшки, мышцы и липида для каждой артерии выполняли путем прямого сравнения с гистологией. Все изученные изображения содержали важные примеры твердой бляшки, которая была маркирована для оценки. На большинстве изображений была ясно идентифицирована и маркирована мышца, но на некоторых изображениях, например на изображении низкого качества на фиг. 10, одна из артерий представляет гистологическую проблему. Только три изображения содержат примеры липида, причем самый большой пример представлен на изображении на фиг. 5. Данные, полученные из этих изображений, были в форме пикселей, которые обрабатывались как отдельные точки данных. Целевая переменная для процесса моделирования является переменной индикатора, который равен единице, если данный пиксель принадлежит целевому классу, и нулю в противном случае. Этот индикатор основан на маркировке изображения. С каждым пикселем в МР-томограмме связано три переменных, показывающих интенсивность на модальностях T1, T2 и PD. Динамический диапазон этих интенсивностей составляет от 0 до 255 и принимает только целые значения (8-битная глубина цвета). Эти данные подвергались интенсивной обработке для создания большого количества дополнительных переменных, суммирующих такие факторы, как средняя интенсивность в соседстве каждого пикселя, и другие более сложные преобразования, такие как меры локальных текстур. Так как образцы помещались на слайды, которые не дают полезной MP-информации, большое количество пикселей отбрасывалось, поскольку они не содержали релевантных данных. В данном случае эти пиксели идентифицировались, как пиксели, у которых переменные индикатора T1, T2 и PD были одновременно равны нулю. Эта процедура была консервативной и допускала некоторое количество пикселей со случайным шумом в наборе данных, хотя это не влияло на эффективность алгоритмов. Таким образом, было отброшено около 50% каждого исходного изображения. Для максимизации результатов в процедуре RIPNet предпочтительно данные разделяются на множество стадий в процессе моделирования, чтобы осуществлять систематическое тестирование реальной эффективности. По этой причине некоторые изображения были полностью зарезервированы для проверки эффективности. Для моделирования были использованы следующие наборы данных: обучающие, которые использовались для оценки параметров модели; подтверждающие, которые использовались для перекрестной проверки результатов моделирования на достоверность, чтобы проверить эффективность выбранных переменных на основании мер энтропии вне выборки и мер псевдо R-квадратов; проверочные, которые изредка использовались для сравнения относительной эффективности альтернативных спецификаций модели, этот набор данных был разработан и использован в алгоритме проверки реальностью добытчика данных (Data Miner's Reality Check (White, H. (2000), Econometrica, vol. 68:1097-1126; патенты США 5893069 и 6088676, потому что набор подтверждающих данных был тщательно изучен; и отложенные данные (три изображения и более 45000 наблюдений), которые полностью удерживались за пределами процессов оценки и подтверждения, чтобы предоставить модели реальные примеры. Все записи выбирались в соответствующих выборках произвольно.ii. Обнаружение аномальных данных. Алгоритм обнаружения аномальных данных был разработан для идентификации посторонних значений в данных. В данном случае детектор аномалий был реализован в форме алгоритма кластеризации,который позволяет идентифицировать многомерные посторонние значения в данных. Аномалия определялась как запись, удаленная (согласно измерению L1-нормой) от k соседей. Эти данные выделялись между выборкой "цель=0" и выборкой "цель=1", так что аномалии можно было идентифицировать относительно этих отдельных групп. В данном примере было выбрано k=10. Эта процедура обычно необходима для идентификации записей, которые могут иметь необычное влияние на оценочные программы модели. Однако если исходные видеоданные из прибора визуализации относительно чистые, как в случае большинства МР-данных, то никаких больших посторонних значений может- 19009382 и не быть идентифицировано. В следующей табл. 1a показаны содержания нескольких аномальных переменных. Таблица 1a Содержание аномальных переменных Данный механизм обнаружения аномальных данных также создавал аномальную переменную. Эта аномальная переменная преобразовывала две меры расстояния для каждого наблюдения (относительно выборок "цель=0" и "цель=1") в статистику отношения правдоподобия. Эта статистика вводит относительные расстояния до целевых выборок в преобразование входных переменных, что является мощным предиктором в некоторых случаях. Как показано в представленной выше табл. 1a, аномальная переменная для каждой модели содержит до пяти непрерывных входных переменных.iii. Предварительный выбор переменных и создание преобразований. Затем выполнялась дополнительная стадия создания преобразований переменных и предварительного удаления непрогностических переменных, чтобы уменьшить размеры наборов данных. Преобразования, созданные на этой стадии, включали в себя следующие преобразования для всех переменных на входном наборе данных: групповые преобразования, которые представляют собой одномерные непрерывные переменные, сгруппированные в децильные бины, которые затем объединялись с помощью алгоритма кластеризации, чтобы получить минимальное количество бинов без существенного снижения прогностической способности; векторные произведения, которые представляют собой одномерные непрерывные и дискретные переменные, взаимодействующие друг с другом и сгруппированные в организованные в виде бинов, категорийные переменные с использованием упомянутого выше алгоритма кластеризации; и бета-преобразования, которые представляют собой гибкую функциональную форму, основанную на подгонке функций бета-распределения к данным и вычислению отношений правдоподобия. Все переменные, созданные до этого момента, тестировались на эффективность на целевой переменной с использованием статистики псевдо R-квадратов вне выборки. Прямое вычисление энтропии сравнивалось с распределениями независимых переменных при данном состоянии зависимой переменной, что затем суммировалось в статистике псевдо R-квадратов для подтверждающей выборки. Эта статистика псевдо R-квадратов не была ограничена между нулем и единицей в малых выборках (потому что данная область не является точно такой же, как в оценочном примере). Десять наиболее прогностических переменных группового преобразования и десять наиболее прогностических переменных векторных произведений сохранялись в группе данных и передавались в оценочную программу модели. Сохранялось только пять высших прогностических переменных бета-преобразования. Переменные, которые имели низкую или отрицательную одномерную или двухмерную статистику псевдо R-квадратов, также постоянно выбрасывались из набора потенциальных подходящих переменных. Эти преобразования переменных показаны в следующей табл. 2.iv. Оценка модели и выбор переменных. Как в большинстве примеров распознавания образов имелось гораздо больше потенциально возможных переменных для включения, чем можно было позволить на практике в прогнозирующей модели,что выдвигало ряд существенных рисков. Один риск заключался в том, что потенциально полезные возможные переменные просто не замечались из-за слишком большого количества переменных для оценки. Другой риск состоял в том, что если использовать систематическую программу оценки и включения переменных, то она может привести к излишней подгонке. И, наконец, многие возможные переменные,вероятно, являются избыточными, что может вызывать проблемы в оценочных программах. Например,среднее значение в модальности Т 1 бралось из соседства в интервале от радиуса 3 пикселя до радиуса 9 пикселей, и все переменные были включены как возможные переменные. В процедуре RIPNet, использованной в данном примере, перечисленные риски решаются посредством объединения возможности теоретической подгонки к нелинейной кривой, свойственной обычной ИНС, со стабильностью иерархических методов. Этот поиск по нелинейным комбинациям и преобразованиям входных переменных можно затем использовать в стандартной модели логит-преобразования по максимальному правдоподобию. RIPNet содержит алгоритмы для создания переменных (сетевых узлов), тестирования переменных и оценки модели. Типичная сеть с прямой связью с одним скрытым уровнем, содержащая два входа и один выход,может иметь следующую архитектуру,где f(.) и g(.) - так называемые функции сплющивания (s-образные). Эти функции сплющивания обеспечивают силу ИНС, потому что они проявляют несколько различных поведений в зависимости от установок параметрови . Примеры таких установок включают в себя обратную, логарифмическую,экспоненциальную и пороговую функции. Стратегия моделирования RIPNet начинается с функциональной формы такого типа богатство и нелинейность которой вытекает из функций fi(x1,x2). Одним из основных вкладов алгоритмаRIPNet является высокопроизводительный метод создания моделированных сетевых узлов fi(xi,x2). Несмотря на внешнюю простоту, эту форму модели можно использовать для того, чтобы максимально приблизиться к эффективности традиционных ИНС. Следующим этапом этого процесса является выбор узла в классе относительно удобных для обработки моделей. Как и на этапах предварительной фильтрации переменных, выбор узла был основан на использовании подтверждающей выборки для проверки эффективности вне выборки. Возможные узлы вводились в модель по порядку их подтвержденной прогностической эффективности в прогнозирующей модели. Избыточность в процедуре выбора решалась двумя способами. Сначала при вводе дополнительных узлов в модель их ортогонализировали, чтобы удалить избыточные компоненты. Тестировалось- 21009382 множество порогов, чтобы идентифицировать оптимальный уровень ортогональности узла. Затем выбирался такой порог избыточности, при котором можно было вводить только узлы, менее 5% дисперсии которых объяснялось другими узлами в модели.v. Подтверждение модели. Этап окончательного подтверждения модели использовался для того, чтобы гарантировать, что какая бы модель не была выбрана в качестве конечной модели, она будет лучше, чем более простая контрольная модель или другие возможные модели. Снова использовалась проверка добытчика данных реальностью (Data Miner's Reality Check (DMRC) для тестирования моделей таким образом. В этом методе использовались прогнозы вне выборки и начальные распределения для формирования действительных р-значений для гипотезы, что тестируемая модель имеет такую же эффективность, как контрольная модель. Низкие р-значения показали, что тестируемая модель имеет значительно более высокую эффективность.vi. Результаты. Описанные выше прогнозирующие модели имели гораздо более высокую прогностическую эффективность, чем ведущие методы, используемые в настоящее время. На фиг. 9 показаны итоги эффективности описанных выше моделей. В табл. 1 показана эффективность моделей RIPNet на основании двух различных статистических мер: статистики максимумов по методу Холмогорова-Смирнова и коэффициента Джини, каждый из которых измеряет аспекты кривой ROC (регионарных рабочих параметров). Модели,основанные на принципе K-средних, использовались в качестве основы для сравнения. Эти результаты демонстрируют, что модели RIPNet всегда имели эффективность, превосходящую на 25-30% в абсолютных терминах эффективность метода K-средних. Этот результат можно представить как превосходящий на 50% показатель истинных позитивов при данном уровне ложных позитивов. Кривые ROC, по которым получены эти результаты, показаны на фиг. 9. Кроме статистических мер эффективности данный вывод также подтверждают совокупные результаты модели, которые показаны в виде изображения на фиг. 8. На фиг. 8 для каждого изображения на левой панели представлена маркированная истина, а на правой панели - смоделированные прогнозы для того же изображения. На этой фигуре мышца выглядит розовой на маркированных изображениях и красной на смоделированных результатах. Липиды выглядят белыми на маркированных изображениях и голубыми на смоделированных результатах, а бляшка выглядит желтой на обоих изображениях. Каждому пикселю присваивается категория в зависимости от того, какая модель выработала максимальное правдоподобие для данного пикселя. Пиксели с правдоподобием ниже 30% для всех смоделированных прогнозов кодировались как пустые. Изображение на фиг. 8 А, разработанное с помощью прогнозирующей модели, дает ясный пример возможностей предложенных прогнозирующих моделей. В частности, имеет место высокая степень соответствия между пикселями, маркированными как бляшка на первоначальном истинном маркированном изображении, и бляшкой, маркированной с помощью вычислительных моделей. Аналогично, также была хорошо идентифицирована мышца. Изображение на фиг. 8 В демонстрирует способность предложенных моделей обнаруживать не только твердые сосудистые бляшки, но также и бляшки, имеющие липидные компоненты. Области мышцы не были однородно идентифицированы, однако это имеет место точно в тех областях, где первоначальное изображение закрыто артефактами, и мышечная стенка тонкая. Интересно отметить, что имеет место несколько ложных позитивов, вытекающих из модели мышцы вдоль областей фиброзного покрова, закрывающего липидное ядро, показанное на этом изображении. В этот анализ было включено около 400 переменных, из которых были сформированы тысячи сетевых узлов. Для каждой модели из них было выбрано 140 узлов. Обычно это считается большим количеством, но для большого числа наблюдений в наборах данных. В представленной ниже табл. 3 проиллюстрированы несколько высших узлов, выбранных для каждой модели. Анализ этих узлов демонстрирует преимущества, получаемые при использовании автоматизированного метода, по сравнению с другими принципами. Например, модель бляшки содержит в основном переменные Т 1 и PD, и почти для всех включенных переменных была выбрана мера соседства 7 пикселей из всех прочих имеющихся мер. Эти виды выбора было бы практически невозможно воспроизвести без приложения огромных усилий. Аналогично, многие комбинации переменных не являются очевидными для глаза человека. Например, верхний узел липидной модели представляет собой линейную комбинацию максимума для соседства четырех пикселей для Т 2, дискретное косинусное преобразование PD и аномальную переменную, т.е. комбинации, для которых в настоящее время нет ясного объяснения. Несомненно, что ни один из обычных эвристических методов не смог бы их обнаружить. Важно также отметить высоко нелинейный характер этих моделей. Тот факт, что аномальная переменная возникает как одна из наиболее прогностических переменных, вносит вклад в недооценку этого факта. Скрытые элементы, групповые преобразования, бета-преобразования и т.п. являются нелинейными преобразованиями вводов, которые представляются в этих моделях переменными высшего ранга. Чтобы избежать излишней подгонки были предприняты меры предосторожности. Тестирование выполнялось на нескольких изображениях, которые были полностью изъяты из процесса моделирования. Как показано на фиг. 10, эти модели достаточно хорошо проявили себя при отделении мышцы от бляшки. Модель мышцы вычертила общий контур артериальной стенки и хорошо идентифицировала маркированные области бляшки. Так как это изображение представляло проблему для маркировки специалистами-радиологами, в первую очередь, данная проверка оказалась, несомненно, успешной. Пример 4. Трехмерные модели кровеносного сосуда. В этом примере описан предпочтительный способ построения трехмерных моделей кровеносных сосудов, которые визуализировались с помощью медицинского прибора визуализации. В частности, на фиг. 13 показана трехмерная визуализация сонной артерии в области бифуркации. На фигуре внутренняя артериальная стенка (1920) представляет границу просвета. Бляшка (1910) находится между внутренней поверхностью артериальной стенки и внешней поверхностью артерии (не показана). Эта модель была построена на основании одиннадцати MP-срезов ткани in vivo с использованием только модальности Т 1. Для создания модели были использованы следующие операции преобразования изображений срезов ткани. Сначала данные каждого среза пропускались через фильтр нижних частот (например, адаптивный фильтр Винера). Положение центра просвета для каждого среза оценивалось на основании положения центроида просвета из предыдущего среза. После центрирования на оценочном положении просвета каждое изо- 23009382 бражение обрезалось. Затем выполнялся линейный поиск пороговых интенсивностей, чтобы обнаружить области просвета, близкие к оценочному центроиду. После подтверждения того, что просвет имеет необходимые морфологические признаки, включая площадь и эксцентричность, снова оценивалось положение центроида просвета. Затем выполнялась сегментация ткани для идентификации липидных признаков вблизи центроида просвета. Понятно, что описанный процесс немного модифицировался в зависимости от того, находился ли срез ниже или выше бифуркации сонной артерии. Когда алгоритм отслеживал два просвета (т.е. на срезах выше бифуркации сонной артерии), использовалось геометрическое среднее для центроидов двух просветов. Затем результирующие срезы снова центрировались, чтобы компенсировать несовпадение осей. Можно также добавить другую информацию о ткани, включая информацию о мышце, адвентиции и компонентах бляшки, таких как липид, кровоизлияние, фиброзная бляшка и кальций. Полученные модели позволят осуществлять визуализацию и автоматическое количественное определение размера, объема и состава бляшки. Все описанные выше и заявленные способы, системы и изделия можно выполнить и осуществить на основании настоящего описания без излишнего экспериментирования. Хотя предложенные способы,системы и компьютерные программные продукты были описаны как предпочтительные варианты и факультативные признаки, специалистам будет понятно, что в эти описанные способы и их операции или последовательности операций можно внести модификации и изменения, не выходя за рамки объема притязаний изобретения. В частности, можно адаптировать различные алгоритмы, программы и данные для автоматизированного обнаружения и анализа сосудистой бляшки. Все такие эквивалентные или подобные адаптации, усовершенствования, модификации и замены, очевидные для специалистов, подпадают под объем изобретения, охарактеризованный в прилагаемой формуле изобретения. Изобретение было описано в широком и обобщенном виде. Каждый из более узких видов и более конкретных группировок, подпадающих под общее раскрытие, также составляет часть изобретения. Это включает в себя общее описание изобретения с оговоркой или отрицательным ограничением, исключающим любой объект из рода, независимо от того, был ли исключенный материал специально упомянут в описании. Проиллюстрированное изобретение можно реализовать в отсутствии любого элемента(ов), который не был специально упомянут как существенный. Использованные термины и выражения служат только в целях описания и не являются ограничительными, и использование этих терминов и выражений не содержит намерения исключить какие-либо уже существующие или разработанные в будущем признаки или их части, а признается, что возможны различные модификации в рамках объема заявленного изобретения. Термины "содержащий", "включающий в себя", "состоящий из" и т.п. следует толковать в широком смысле и без ограничения. Следует отметить, что в данном описании и прилагаемой формуле изобретения признаки, выраженные в единственном числе, также включают в свой объем множественную форму, если только контекст не содержит ясного указания на иное. Все упомянутые в описании патенты, заявки на патент и публикации раскрывают уровень техники,к которому относится изобретение. Все такие патенты, заявки на патент и публикации включены в данное описание в качестве ссылки в полном объеме для всех целей и в той мере, в которой каждый отдельный патент, заявка на патент и публикация были конкретно и отдельно указаны в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Автоматизированный способ оценки степени атеросклероза по меньшей мере в части сосудистой системы пациента, заключающийся в том, что осуществляют вычислительную обработку пригодных для обработки данных по меньшей мере из одного поперечного сечения по меньшей мере одного кровеносного сосуда сосудистой системы пациента, полученных из медицинской системы визуализации, чтобы определить, содержит ли данный кровеносный сосуд по меньшей мере одну ткань, коррелированную с присутствием бляшки, и, тем самым, оценить степень атеросклероза по меньшей мере в части сосудистой системы пациента. 2. Автоматизированный способ определения, содержит ли кровеносный сосуд сосудистой системы пациента бляшку, заключающийся в том, что осуществляют вычислительную обработку пригодных для обработки данных по меньшей мере из одного поперечного сечения кровеносного сосуда сосудистой системы пациента, полученных из медицинской системы визуализации, чтобы определить, содержит ли данный кровеносный сосуд по меньшей мере одну ткань, коррелированную с присутствием бляшки,причем в этом случае признают, что кровеносный сосуд содержит бляшку. 3. Автоматизированный способ по п.2, в котором медицинская система визуализации является неинвазивной системой визуализации. 4. Автоматизированный способ по п.3, в котором неинвазивная система визуализации содержит один или несколько приборов, выбранных из группы, состоящей из прибора для магнитно-резонансной томографии (МРТ), прибора для компьютерной томографии (КТ), прибора для позитрон-эмиссионной томографии (ПЭТ), прибора для термографии или ультразвукового прибора, предназначенных для выра- 24009382 ботки исходных видеоданных, из которых получают пригодные для обработки данные. 5. Автоматизированный способ по п.2, в котором медицинская система визуализации содержит прибор для МРТ, предназначенный для формирования исходных магнитно-резонансных данных, из которых получают пригодные для обработки магнитно-резонансные данные. 6. Автоматизированный способ по п.5, в котором используют множество различных серий последовательностей радиочастотных импульсов, причем каждая из различных серий последовательностей радиочастотных импульсов позволяет формировать исходные магнитно-резонансные данные для подгруппы различных тканей, которые могут присутствовать в кровеносном сосуде. 7. Автоматизированный способ по п.6, в котором по меньшей мере одна из различных серий последовательностей радиочастотных импульсов обеспечивает формирование исходных магнитнорезонансных данных, выбранных из группы, состоящей из данных, взвешенных по времени релаксации Т 1 (Т 1-взвешенных данных), Т 2-взвешенных данных, взвешенных по времени релаксации Т 2 (Т 2 взвешенных данных), данных, взвешенных по плотности протонов (PDW-взвешенных данных), и данных, взвешенных по времени пролета (TOF-взвешенных данных). 8. Автоматизированный способ по п.2, в котором кровеносный сосуд является частью сосудистой системы, подающей кровь к органу, выбранному из группы, состоящей из мозга и сердца. 9. Автоматизированный способ по п.2, в котором кровеносный сосуд выбран из группы, состоящей из сонной артерии и коронарной артерии. 10. Автоматизированный способ по п.2, в котором пациентом является человек. 11. Автоматизированный способ по п.2, в котором пригодные для обработки данные формируют посредством предварительной обработки исходных данных, сформированных медицинской системой визуализации. 12. Автоматизированный способ по п.11, в котором дополнительно нормируют пригодные для обработки данных перед вычислительной обработкой пригодных для обработки данных. 13. Автоматизированный способ по п.1, в котором пригодные для обработки данные подвергают вычислительной обработке, чтобы определить, содержит ли данный кровеносный сосуд в области поперечного сечения артерию или бляшку. 14. Автоматизированный способ по п.13, в котором определение типа ткани осуществляют посредством сравнения компьютером различных типов тканей, идентифицированных в данных, с множеством статистических классификаторов. 15. Автоматизированный способ по п.14, в котором статистические классификаторы создают с использованием известных результирующих данных посредством процесса, выбранного из группы, состоящей из логистической регрессии, деревьев решений, непараметрической регрессии, дискриминантного анализа Фишера, сетевого моделирования Бейеса и системы с нечеткой логикой. 16. Автоматизированный способ по п.15, в котором по меньшей мере один из множества хранимых элементов классификатора тканей определен посредством процесса, выбранного из группы, состоящей из послеоперационного гистологического исследования, прямого изучения ткани или маркировки одним или более специалистами. 17. Автоматизированный способ по п.14, в котором пригодные для обработки данные подвергают вычислительной обработке, чтобы определить, содержит ли данный кровеносный сосуд в области поперечного сечения по меньшей мере еще одну ткань, выбранную из группы, состоящей из адвентиции, отложения кальция, отложения холестерина, фиброзной бляшки и тромба. 18. Автоматизированный способ по п.17, в котором определение типов тканей осуществляют посредством сравнения компьютером различных типов тканей, идентифицированных в данных, с множеством статистических классификаторов. 19. Автоматизированный способ по п.6, в котором осуществляют вычислительное совмещение компонентов, содержащих пригодные для обработки магнитно-резонансные данные. 20. Автоматизированный способ по п.19, в котором совмещение осуществляют посредством выравнивания компонентов, содержащих пригодные для обработки магнитно-резонансные данные, относительно представления, являющегося ориентиром, выбранным из группы, состоящей из центроида просвета сосуда и точки разветвления сосуда. 21. Автоматизированный способ по п.20, в котором ориентир выбирают из группы, состоящей из физического ориентира и вычислительного ориентира. 22. Автоматизированный способ по п.2, в котором осуществляют вычислительную обработку пригодных для обработки данных, полученных из множества удаленных друг от друга поперечных сечений кровеносного сосуда. 23. Автоматизированный способ по п.22, в котором дополнительно осуществляют вычислительную визуализацию трехмерной модели кровеносного сосуда по меньшей мере в части области, ограниченной наиболее удаленными поперечными сечениями кровеносного сосуда. 24. Автоматизированный способ по п.2, в котором дополнительно создают выходной файл, содержащий данные, полученные в результате вычислительной обработки. 25. Автоматизированный способ по п.24, в котором выходной файл содержит визуализированную- 25009382 вычислительным методом трехмерную модель кровеносного сосуда по меньшей мере в части области,ограниченной наиболее удаленными поперечными сечениями кровеносного сосуда. 26. Автоматизированный способ по п.23, в котором дополнительно осуществляют вычислительное определение объема бляшки, присутствующей в трехмерной модели кровеносного сосуда. 27. Автоматизированный способ по п.23, в котором дополнительно осуществляют вычислительное определение состава бляшки, присутствующей в трехмерной модели кровеносного сосуда. 28. Автоматизированный способ по п.27, в котором дополнительно осуществляют вычислительное различение, является ли данная бляшка уязвимой бляшкой или стабильной бляшкой. 29. Автоматизированный способ оценки эффективности курса лечения, заключающийся в том, что:a) определяют объем бляшки у пациента с помощью автоматизированного способа по п.26;b) назначают пациенту курс лечения, включающий в себя прием лекарственного препарата, предназначенного для стабилизации или уменьшения бремени бляшки у пациента в процессе курса лечения; иc) определяют во время и/или в конце курса лечения, стабилизировался ли или уменьшился ли объем бляшки у пациента, чтобы, тем самым, оценить эффективность курса лечения. 30. Автоматизированный способ по п.24, в котором лекарственным препаратом является проходящий исследования лекарственный препарат. 31. Способ лечения пациента, имеющего уязвимую бляшку в кровеносном сосуде, заключающийся в том, что:a) определяют, что пациент имеет уязвимую бляшку в кровеносном сосуде с помощью автоматизированного способа по п.27; иb) назначают пациенту курс лечения, направленный на стабилизацию или уменьшение уязвимости уязвимой бляшки для разрыва в процессе курса лечения, обеспечивая тем самым лечение пациента. 32. Способ по п.31, в котором курс лечения включает в себя прием лекарственного препарата, стабилизирующего или уменьшающего уязвимость бляшки для разрыва. 33. Способ по п.32, в котором лекарственный препарат выбирают из группы, состоящей из статинов, противовоспалительных препаратов и антикоагулянтов. 34. Компьютерный программный продукт, содержащий пригодный для компьютера носитель с содержащейся на нем машиночитаемой программой, причем машиночитаемая программа сконфигурирована для реализации автоматизированного способа по п.1 на компьютере, предназначенном для выполнения данной машиночитаемой программы. 35. Автоматизированный способ для анализа данных пациента, полученных с помощью медицинской системы визуализации, для определения, содержит ли кровеносный сосуд пациента бляшку, заключающийся в том, что:a) получают пригодные для обработки данные по меньшей мере одного поперечного сечения кровеносного сосуда сосудистой системы пациента, причем пригодные для обработки данные получают из исходных данных, собранных с помощью медицинской системы визуализации;b) передают пригодные для обработки данные в компьютер, сконфигурированный для приема и вычислительной обработки пригодных для обработки данных, для определения, содержит ли данный кровеносный сосуд в области поперечного сечения(й) по меньшей мере одну ткань, коррелированную с присутствием бляшки, в случае чего кровеносный сосуд признается содержащим бляшку; иc) используют компьютер для вычислительной обработки пригодных для обработки данных и определения, содержит ли данный кровеносный сосуд бляшку. 36. Автоматизированный способ по п.35, в котором медицинская система визуализации и компьютер расположены в разных местах. 37. Автоматизированный способ по п.36, в котором компьютер находится в вычислительном центре, физически удаленном от каждого из множества центров визуализации, каждый из которых содержит медицинскую систему визуализации, способную формировать исходные данные, из которых можно получить пригодные для обработки данные. 38. Автоматизированный способ по п.37, в котором по меньшей мере один из центров визуализации передает исходные данные в вычислительный центр по телекоммуникационному каналу. 39. Автоматизированный способ по п.35, в котором дополнительно передают результаты анализа по адресу, указанному как сотрудничающий с медицинской системой визуализации, используемой для сбора исходных данных. 40. Система для анализа наличия бляшки в кровеносном сосуде сосудистой системы пациента, содержащая:a) компьютер, способный исполнять машиночитаемую программу, содержащуюся в компьютерном программном продукте по п.34;b) компьютерную систему хранения данных, сообщающуюся с компьютером и сконфигурированную для отправки и приема и/или сохранения данных, обработанных компьютером; иc) функционально подключенный к компьютеру коммуникационный интерфейс для приема подлежащих обработке данных или для отправки данных после их обработки компьютером.
МПК / Метки
МПК: A61B 5/05
Метки: анализа, системы, автоматизированные, бляшек, обнаружения, способы, сосудистых
Код ссылки
<a href="https://eas.patents.su/30-9382-avtomatizirovannye-sposoby-i-sistemy-dlya-obnaruzheniya-i-analiza-sosudistyh-blyashek.html" rel="bookmark" title="База патентов Евразийского Союза">Автоматизированные способы и системы для обнаружения и анализа сосудистых бляшек</a>
Предыдущий патент: Способ лазерного рассечения тканей при проведении хирургических операций
Следующий патент: Растворимый гликопротеин гиалуронидазы (shasegp), способ его получения, применение и фармацевтическая композиция его содержащая
Случайный патент: Фармацевтический состав в форме двухслойных таблеток, содержащих ингибитор hmg-coa редуктазы и ирбесартан