Способы и композиции обнаружения и анализа полинуклеотидов с помощью светособирающих полихромофоров
Формула / Реферат
1. Способ анализа, заключающийся в
приготовлении образца, предположительно содержащего целевой полинуклеотид;
получении поликатионного полихромофора, способного при возбуждении переносить энергию на сигнальный хромофор;
получении анионного сенсорного полинуклеотида, являющегося однонитевым и комплементарным целевому полинуклеотиду (полинуклеотиду-мишени), причём указанный сенсорный полинуклеотид конъюгирован с сигнальным хромофором, при этом сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в отсутствие целевого полинуклеотида сигнальный хромофор может испускать световое излучение; и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение;
контактировании образца с сенсорным полинуклеотидом и полихромофором в растворе в условиях, при которых сенсорный полинуклеотид может гибридизоваться с целевым полинуклеотидом, если он присутствует;
поднесении к раствору источника света, который может возбуждать полихромофор; и
обнаружении, является ли световое излучение сигнального хромофора более сильным в присутствии образца.
2. Способ по п.1, отличающийся тем, что полихромофор представляет собой структуру, выбранную из группы, состоящей из насыщенного полимера, конъюгированного полимера, дендримера и полупроводникового нанокристалла.
3. Способ по п.2, отличающийся тем, что полихромофор представляет собой насыщенный полимер.
4. Способ по п.3, отличающийся тем, что насыщенный полимер связан с люминесцентным красителем.
5. Способ по п.2, отличающийся тем, что полихромофор представляет собой дендример.
6. Способ по п.2, отличающийся тем, что полихромофор представляет собой полупроводниковый нанокристалл.
7. Способ по п.2, отличающийся тем, что полихромофор представляет собой конъюгированный полимер.
8. Способ по п.7, отличающийся тем, что конъюгированный полимер имеет структуру
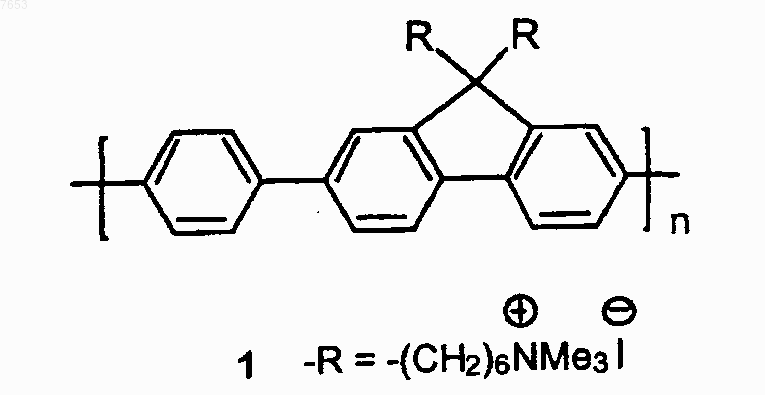
9. Способ по п.2, отличающийся тем, что полихромофор представляет собой агрегат конъюгированных молекул.
10. Способ по п.9, отличающийся тем, что агрегат конъюгированных молекул имеет структуру

11. Способ по п.1, отличающийся тем, что образец контактирует с сенсорным полинуклеотидом и полихромофором в присутствии достаточного количества органического растворителя для уменьшения гидрофобных взаимодействий между сенсорным полинуклеотидом и полихромофором.
12. Способ по п.1, отличающийся тем, что образец контактирует с рядом различных сенсорных полинуклеотидов, имеющих соответствующие различные последовательности, при этом указанные различные сенсорные полинуклеотиды содержат соответствующий различный сигнальный хромофор, и тем, что каждый из указанных различных сенсорных полинуклеотидов может селективно гибридизоваться с соответствующим различным целевым полинуклеотидом.
13. Способ по п.1, отличающийся тем, что сигнальный хромофор представляет собой флуорофор.
14. Способ по п.13, отличающийся тем, что флуорофор представляет собой зелёный флуоресцентный белок.
15. Способ по п.14, отличающийся тем, что флуорофор выбирают из полупроводникового нанокристалла, флуоресцентного красителя и хелата лантаноида.
16. Способ по п.15, отличающийся тем, что флуорофор представляет собой полупроводниковый нанокристалл.
17. Способ по п.15, отличающийся тем, что флуорофор представляет собой флуоресцентный краситель.
18. Способ по п.17, отличающийся тем, что флуоресцентный краситель представляет собой флуоресцеин.
19. Способ по п.15, отличающийся тем, что флуорофор представляет собой хелат лантаноида.
20. Способ по п.1, отличающийся тем, что целевой полинуклеотид представляет собой ДНК.
21. Способ по п.1, отличающийся тем, что целевой полинуклеотид представляет собой РНК.
22. Способ по п.1, отличающийся тем, что образец содержит однонитевой целевой полинуклеотид.
23. Способ по п.1, отличающийся тем, что образец содержит двухнитевой целевой полинуклеотид.
24. Способ по п.1, отличающийся тем, что целевой полинуклеотид получают реакцией амплификации.
25. Способ по п.24, отличающийся тем, что реакция амплификации представляет собой полимеразную цепную реакцию.
26. Способ по п.1, отличающийся тем, что испускаемое сигнальным хромофором световое излучение выше порогового уровня указывает, что целевой полинуклеотид присутствует в образце.
27. Способ по п.1, отличающийся тем, что количество светового излучения, испускаемого сигнальным хромофором, измеряют и используют для определения количества целевого полинуклеотида в образце.
28. Способ по п.1, отличающийся тем, что целевой полинуклеотид не является амплифицированным.
29. Способ по п.1, отличающийся тем, что его осуществляют на подложке (субстрате).
30. Способ по п.29, отличающийся тем, что подложку (субстрат) выбирают из группы, состоящей из микросферы, чипа, предметного стекла, многолуночного планшета, оптической нити, матрицы на основе необязательно пористого геля, фотодиода и оптоэлектронного прибора (устройства).
31. Способ по п.30, отличающийся тем, что субстрат представляет собой предметное стекло.
32. Способ по п.30, отличающийся тем, что субстрат представляет собой оптоэлектронное устройство.
33. Способ по п.30, отличающийся тем, что субстрат представляет собой матрицу на основе необязательно пористого геля.
34. Способ по п.32, отличающийся тем, что субстрат представляет собой золь-гель.
35. Способ по п.30, отличающийся тем, что субстрат является доступным для наноизмерений.
36. Способ по п.30, отличающийся тем, что субстрат является доступным для микроизмерений.
37. Способ по п.30, отличающийся тем, что субстрат конъюгирован с множеством различных сенсорных полинуклеотидов, имеющих соответствующие различные последовательности, причём каждый из указанных сенсорных полинуклеотидов может селективно гибридизоваться с соответствующим отличающимся целевым полинуклеотидом.
38. Способ по п.1, отличающийся тем, что включает осуществление флуоресцентной in situ гибридизации (FISH).
39. Способ по п.1, дополнительно содержащий контактирование образца в растворе с сенсорным полинуклеотидом, полихромофором и вторым сигнальным хромофором, который может воспринимать энергию от сигнального хромофора в присутствии мишени и излучать свет, причем обнаружение того факта, усиливается ли в присутствии образца световое излучение, испускаемое сигнальным хромофором, заключается в детектировании того, усиливается ли в присутствии образца световое излучение, испускаемое вторым сигнальным хромофором.
40. Способ по п.39, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель.
41. Раствор для распознавания полинуклеотида, содержащий сигнальный хромофор и поликатионный полихромофор, который при возбуждении способен переносить энергию на сигнальный хромофор, когда оказывается вблизи него, причём сигнальный хромофор излучает более сильную энергию в присутствии полинуклеотида, распознаваемого при возбуждении полихромофора.
42. Раствор для распознавания полинуклеотида по п.41, дополнительно содержащий второй сигнальный хромофор, который может принимать энергию от сигнального хромофора в присутствии мишени и излучать свет.
43. Раствор для распознавания полинуклеотида по п.42, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель.
44. Раствор для распознавания полинуклеотида по п.41, дополнительно содержащий сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду.
45. Раствор для распознавания полинуклеотида по п.41, отличающийся тем, что сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель, который может поглощать энергию полихромофора в присутствии мишени и излучать свет.
46. Раствор для распознавания полинуклеотида по п.41, отличающийся тем, что сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель, который может принимать энергию от полихромофора в присутствии мишени и переносить энергию на второй сигнальный хромофор, конъюгированный с сенсорным полинуклеотидом, который затем излучает свет.
47. Набор для анализа образца на целевой полинуклеотид, включающий
сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду;
сигнальный хромофор;
поликатионный полихромофор, который при возбуждении, оказавшись вблизи сигнального хромофора, способен переносить на него энергию, причём указанный сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение; и
упаковку для хранения реагентов набора.
48. Набор по п.47, дополнительно содержащий второй сигнальный хромофор, который может принимать энергию от сигнального хромофора в присутствии мишени и излучать свет.
49. Набор по п.48, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель.
50. Набор по п.47, дополнительно содержащий инструкции, приложенные к указанной упаковке, в которых описано, как применять компоненты набора для анализа образца на целевой полинуклеотид.
51. Комплекс для распознавания полинуклеотида, включающий
сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду, причём указанный сенсорный полинуклеотид связан с сигнальным хромофором;
поликатионный полихромофор, который при возбуждении способен переносить энергию на сигнальный хромофор, оказавшись вблизи него, причем указанный сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в отсутствие целевого полинуклеотида сигнальный хромофор может испускать световое излучение; и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение.
52. Сигнальный комплекс, получаемый способом по п.1.
53. Комплекс по п.52, дополнительно содержащий второй сигнальный хромофор.
54. Комплекс, связанный с подложкой (субстратом), полученный способом по п.29.
55. Комплекс, связанный с подложкой (субстратом), по п.54, дополнительно содержащий второй сигнальный хромофор.
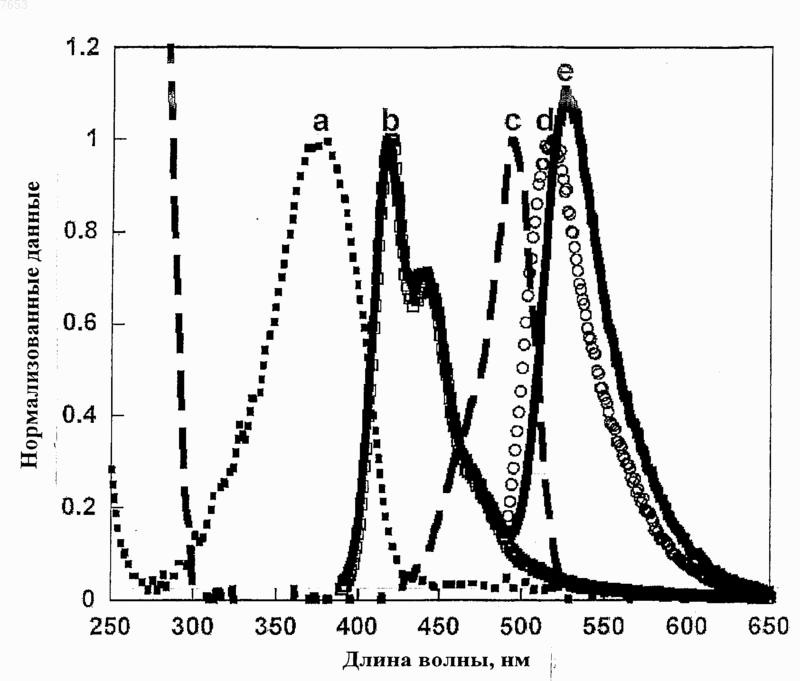
Текст
007653 Область, к которой относится изобретение Настоящее изобретение относится к способам, изделиям и композициям для обнаружения и анализа полинуклеотидов в образце. Предпосылки создания изобретения Методы, позволяющие обнаруживать последовательность ДНК в реальном времени и с высокой чувствительностью, представляют большой научный и экономический интерес 1,2,3. Их применение включает медицинскую диагностику, идентификацию генетических мутаций, мониторинг доставки генов и специфические геномные методы 4. Катионные органические носители, такие как этидийбромид и тиазол оранжевый, излучают при включении их в желобки двухнитевой (двухцепочечной) ДНК (днДНК,dsDNA) и служат в качестве непосредственных гибридизационных зондов ДНК, но у них отсутствует специфичность в отношении последовательностей 5,6. Существуют пары хромофоров для переноса энергии/электрона для анализов, специфических в отношении нити, но они требуют химического мечения двух ядерных кислот или двойной модификации той же самой изменнной нити (например, "молекулярные маяки")7,8. Трудности мечения двух сайтов ДНК приводят к низким выходам, высокой стоимости и примесям с одной меткой, что понижает чувствительность обнаружения 9. В технике существует необходимость в способах обнаружения и анализа конкретных полинуклеотидов в образце и в композициях и промышленных изделиях, применимых в таких методах. Сущность изобретения Изобретение охватывает способы, композиции и промышленные изделия для обнаружения и анализа целевого полинуклеотида в образце. Образец, предположительно содержащий целевой полинуклеотид (полинуклеотид-мишень), контактирует с поликатионным полихромофором и сенсорным полинуклеотидом, комплементарным к целевому полинуклеотиду. Сенсорный полинуклеотид содержит анионный остов, такой как типичный углеводно-фосфатный остов, и конъюгируется с сигнальным хромофором. В присутствии целевого полинуклеотида в образце передающий сигнал (сигнальный) хромофор может более эффективно поглощать энергию от возбужднного поликатионного полихромофора и излучать больше света или более сильный сигнал, который можно обнаружить. Целевой полинуклеотид (полинуклеотид-мишень) можно анализировать в том виде, в каком он встречается в образце, или его можно амплифицировать перед или одновременно с анализом. Хотя анионный сенсор может ассоциироваться с катионным полихромофором в отсутствие мишени, при связывании целевого полинуклеотида (полинуклеотида-мишени) с образованием двухнитевого комплекса наблюдается поразительное усиление сигнала в сравнении с сигналом, вызываемым смесью некомплементарных последовательностей. Это усиление сигнала можно использовать для применения в методах обнаружения при анализе целевого нуклеотида в образце. Изобретением охватываются растворы, содержащие реагенты, пригодные для осуществления способов по изобретению, а также наборы, содержащие такие реагенты. Также охватываются комплексы для контроля или детектирования, образующиеся из полихромофора и сенсорного полинуклеотида, и сигнальные комплексы (комплексы для передачи сигнала), дополнительно содержащие целевой полинуклеотид. Способы можно использовать в различных вариантах, в которых множество различных сенсорных полинуклеотидов используют для анализа множества различных целевых полинуклеотидов. Способы можно осуществлять на поверхности, например, используя связанный с поверхностью полихромофор; поверхность может быть сенсорной. Способы также могут осуществляться в гомогенном формате. Способы и изделия по данному описанию можно использовать в качестве альтернативы другим методам обнаружения полинуклеотидов. Краткое описание фигур На фиг. 1 изображены спектры поглощения (a - пунктирная линия и c - штриховая линия) и эмиссии(излучения) (b - квадраты и d - кружки) полимера 1 и конъюгированного с флуоресцеином сенсорного полинуклеотида. Возбуждение осуществляют при 380 и 480 нм для полимера 1 и для сенсорного полинуклеотида соответственно. Комплекс с переносом энергии полимера 1 и сенсорного полинуклеотида,возбужднный при 380 нм, также показан чрным (e - сплошная линия). На фиг. 2 показан спектр эмиссии сенсорной системы, содержащей гибридизованный (сплошная линия) и негибридизованный (пунктирная линия) сенсорные полинуклеотиды в буфере с рН=8, содержащем 10 ммоль цитрата натрия и 100 ммоль хлорида натрия. Спектры нормализованы относительно эмиссии полимера 1. На фиг. 3 изображн спектр эмиссии сенсорной системы, содержащей гибридизованный (сплошная линия) и негибридизованный (пунктирная линия) сенсорные полинуклеотиды, полученный в результате возбуждения полихромофора (полимер 1) и переноса энергии на сенсорный полинуклеотид с последующим переносом энергии на специфический в отношении полинуклеотида краситель (этидия бромид). Измерения проводят в буферном растворе фосфат калия-гидроксид натрия (50 мМ, рН=7,40). См. пример 4. На фиг. 4 изображены спектры повышенной эмиссии полинуклеотид-специфического красителя-1 007653 полинуклеотид. Усиленный сигнал эмиссии является результатом возбуждения полихромофора (полимер 1) и переноса энергии на сенсорный полинуклеотид с последующим переносом энергии на ЕВ. Видно,что непосредственная ЕВ эмиссия в двухнитевой ДНК (пунктирная линия) и эмиссия, возникающая в результате возбуждения сенсорного полинуклеотида с последующим переносом энергии на ЕВ (штриховая линия), демонстрируют усиленный сигнал, создаваемый поликатионным полихромофором. Измерения проводят в буферном растворе фосфат калия-гидроксид натрия (50 мМ, рН=7,40). См. пример 5. На фиг. 5 представлены спектры эмиссии ЕВ при возбуждении полимера 1 в присутствии ЕВ как в гибридизованном (сплошная линия), так и в негибридизованном (пунктирная линия) сенсорных полинуклеотидах в буферном растворе фосфат калия-гидроксид натрия (50 мМ, рН=7,40). См. пример 6. Эмиссия является результатом переноса энергии с поликатионного полихромофора на интеркалирующий ЕВ только в случае гибридизованной двухцепочечной ДНК. Подробное описание изобретения Настоящие методы для ДНК и РНК сенсоров (включая "генные чипы" и "ДНК-чипы") зависят от ковалентного связывания флуоресцентных меток (люмофоров) с одиночными нитями ДНК, зависящего от мечения образца аналита, что вызывает неизбежные проблемы, возникающие в результате изменения эффективности реакции мечения от образца к образцу, что требует сложных кросс-калибровок. Другие системы опираются на многообразно меченые зонды (например, "молекулярные маяки", зонды Taqman,Scorpion, Eclipse), требующие многообразного связывания люмофоров и тушителей флуоресценции с последовательностями, точно созданными методами рекомбинантной ДНК. Способ по изобретению заключается в контактировании образца с водным раствором, содержащим по меньшей мере два компонента: (а) светособирающую поликатионную люминесцентную полихромофорную систему, например, такую как конъюгированный полимер, полупроводниковая квантовоточечная или дендритная структура, которая является водорастворимой; и (b) сенсорный полинуклеотид,конъюгированный с люминесцентным сигнальным хромофором (называемым "Oligo-С", "Олиго-С"). Излучение света с характеристической длиной волны сигнального хромофора указывает на присутствие в растворе целевого нуклеотида с основной последовательностью, комплементарной основной последовательности сенсорного полинуклеотида. Применяя множество различных сенсорных полинуклеотидов,каждый с различной основной последовательностью и различным сигнальным хромофором (Oligo1-С 1,Oligo2-С 2 и т.д.), можно независимо обнаружить множество различных полинуклеотидов, каждый со специфическими основными последовательностями. Можно ввести третий компонент, такой, как полинуклеотид-специфический краситель, с целью повышения специфичности с помощью дополнительного переноса энергии с сенсорного полинуклеотида на полинуклеотид-специфический краситель. Светособирающий хромофор и сигнальный хромофор (С) выбирают таким образом, чтобы полосы поглощения двух видов имели минимальное перекрывание и чтобы спектры люминесценции двух видов были с разной длиной волны. Приготовленные в водном растворе светособирающая и люминесцентная полихромофорные системы являются положительно заряженными (например, положительно заряженными конъюгированными полиэлектролитами). Близость между отрицательно заряженным сенсорным полинуклеотидом и положительно заряженной светособиращей и люминесцентной полихромофорной системой обеспечивается электростатическим притяжением. При действии (экспонировании) падающего излучения с длиной волны в полосе поглощения светособирающего хромофора возникает эмиссия с сигнального хромофора, например, по механизму переноса энергии Ферстера. При добавлении целевого полинуклеотида, такого как однонитевая ДНК (онДНК, ssDNA), с последовательностью, комплементарной последовательности сенсорного полинуклеотида, онДНК гибридизуется с сенсорным полинуклеотидом, что приводит к повышению плотности отрицательного заряда вдоль нити ДНК 10,11. Принимая во внимание эти обстоятельства и рассматривая строго электростатические силы, можно заключить, что взаимодействие между сенсорным полинуклеотидом и положительно заряженной светособирающей полихромофорной системой является предпочтительным, так как приводит к эффективному переносу энергии и интенсивной эмиссии с сигнального хромофора. Когда прибавляют онДНК с основной последовательностью, не являющейся комплементарной основной последовательности сенсорного полинуклеотида, гибридизация пары оснований не происходит. Скрининг опосредованного электростатическими взаимодействиями комплексообразования между светособирающей полихромофорной системой и сенсорным полинуклеотидом осуществляют с помощью конкурентного взаимодействия с некомплементарной онДНК. Так, среднее расстояние между светособирающей полихромофорной системой и Oligo-С больше в присутствии некомплементарной последовательности, что в результате приводит к менее эффективному переносу энергии на сигнальный хромофор. Эмиссия сигнального Oligo-С сильнее в присутствии его комплементарной мишени, нежели в присутствии некомплементарной нити. Вся схема создат сенсор для обнаружения присутствия целевого полинуклеотида со специфической основной последовательностью в испытуемом растворе. Используя многие сенсорные полинуклеотиды, каждый из которых имеет отличную основную последовательность, и различный сигнальный хромофор, можно по отдельности обнаруживать многие мишени. Помимо описанного метода изобретение включает преимущественно водный раствор, содержащий по меньшей мере два компонента: (a) катионный полихромофор и (b) "сенсорный полинуклеотид" (Oligo-2 007653 С), содержащий анионный полинуклеотид, конъюгированный с сигнальным хромофором. Как показано в примерах, оптическую амплификацию, обеспечиваемую водорастворимым полихромофором, таким как конъюгированный полимер, можно использовать для обнаружения гибридизации полинуклеотида с сенсорным полинуклеотидом. Амплификацию можно повысить, применив более высокомолекулярные водорастворимые конъюгированные полимеры или другие структуры в качестве поликатионных полихромофоров по данному описанию. Изобретение может осуществляться в гомогенном формате, который использует лгкость методов обнаружения флуоресценции. Изобретение можно применять для обнаружения амплифицированных целевых полинуклеотидов или вследствие значительного усиления сигнала в качестве самостоятельного анализа, не требующего амплификации полинуклеотида. В отличие от метода "генного чипа" настоящее изобретение не требует обязательно метить перед анализом каждый анализируемый образец с помощью ковалентного связывания люмофоров или хромофоров с полинуклеотидами, содержащимися в образце или выделенными из образца. Эти методы связывания имеют собственные сложности по воспроизводимости эффективности связывания и приводят к необходимости кросс-калибровки от образца к образцу. Изобретение по данному описанию применимо к любому анализу, в котором могут возникнуть вопросы, касающиеся целевого полинуклеотида в образце. Типичные анализы включают определение присутствия целевого полинуклеотида в образце или его относительного количества, или анализы могут быть количественными или полуколичественными. Способы по изобретению могут осуществляться в многочисленных форматах. Множество различных сенсорных полинуклеотидов можно применять для обнаружения соответствующих различных целевых полинуклеотидов в образце при использовании различных сигнальных хромофоров, конъюгированных с соответствующими сенсорными полинуклеотидами. Создано много методов с применением 2, 3, 4,5, 10, 15, 20, 25, 50, 100, 200, 400 или более различных сенсорных полинуклеотидов, которые можно одновременно использовать для анализа соответствующих различных целевых полинуклеотидов. Методы можно осуществлять на субстрате (подложке), а также в растворе, хотя полагают, что формат раствора является более быстрым вследствие диффузии. Так, анализ можно проводить, например, в определнном формате на субстрате (подложке), который может быть сенсором. Это можно осуществлять с помощью "заякоривания" или другим образом вводить компонент для анализа, например, сенсорный полинуклеотид, поликатионный полихромофор или оба, на субстрат (на подложку). Эти подложки могут представлять собой поверхности стекла, силикагеля, бумаги, пластика или поверхности оптоэлектронных полупроводников (таких как, но без ограничения, нитрид галлия с добавкой индия или полимерные полианилины и т.д.), используемых в качестве оптоэлектронных датчиков. Локализация данного сенсорного полинуклеотида может быть известна или е можно узнать в определнном формате, и определнный формат может быть доступен для микро- или наноизмерений. В одном варианте изобретения один или более образцов, которые могут содержать продукт амплификации, можно связывать с субстратом, а субстрат может контактировать с одним или более сенсорных полинуклеотидов и поликатионным полихромофором. Прежде чем настоящее изобретение будет описано более подробно, следует понять, что данное изобретение не ограничивается конкретными описанными методами, приборами, растворами или аппаратами, так как такие методы, приборы, растворы и аппараты, естественно, могут меняться. Также следует понимать, что терминология применяется в данном описании только для характеристики конкретных вариантов изобретения и не претендует на ограничение объма настоящего изобретения. Применение формы единственного лица ("a", "an" и "the") включает ссылки на множественное число, если в тексте не указано иначе. Так, например, ссылка на "целевой полинуклеотид, полинуклеотидмишень" включает множество (ряд) целевых полинуклеотидов, ссылка на "сигнальный хромофор" включает множество (ряд) таких хромофоров, ссылка на "сенсорный полинуклеотид" включает множество(ряд) сенсорных полинуклеотидов и т.п. Кроме того, применение ссылок на конкретное множественное число, таких, как "два", "три" и т.д., если в тексте точно не указано иначе, относится к большему числу таких же субъектов. Термины, такие как "связанный", "присоединнный" и "соединнный" попеременно применяются в данном описании и охватывают прямое (непосредственное), а также непрямое соединение, присоединение, связывание или конъюгацию (сопряжение), если в тексте ясно не указано иначе. Если датся интервал значений, следует понимать, что также конкретно датся каждое входящее в этот интервал целое значение и каждый его отрезок между указанными верхним и нижним пределами, наряду с каждым субинтервалом между этими значениями. Верхний и нижний пределы любого интервала могут независимо включаться в этот интервал или исключаться из этого интервала, и каждый интервал, в который включены любой, ни один или оба предела, охватываются данным изобретением. Если обсуждаемое значение имеет собственные, присущие ему интервалы, например, если компонент может присутствовать в концентрации 0-100% или если рН водного раствора может изменяться в интервале 1-14, эти собственные интервалы конкретно охватываются. Если значение датся точно, следует понимать, что значения около этой величины или количества также входят в объм данного изобретения, так же как и интервалы,включающие это значение. Если охватывается комбинация, также конкретно охватывается и входит в-3 007653 объм этого изобретения каждая субкомбинация элементов этой комбинации. И напротив, если охватываются различные элементы или группы элементов, также охватываются их комбинации. Если любой элемент изобретения описывается как имеющий множество альтернатив, примеры этого изобретения, в котором каждая альтернатива исключается, одна или в любой комбинации с другими альтернативами,тем самым также охватываются; более одного элемента по изобретению может иметь такие исключения,и все комбинации элементов, имеющих такие исключения, тем самым охватываются. Если не указано иначе или если контекст чтко не предписывает иного, все технические и научные термины, применяемые в данном описании, имеют общепринятые и обычно понятные рядовому специалисту в данной области техники, к которой относится данное изобретение. Хотя любые методы и материалы, аналогичные или эквивалентные представленным в данном описании, можно использовать при практическом применении настоящего изобретения или при испытании по данному изобретению, в данном описании представлены предпочтительные методы и материалы. Все публикации, упомянутые в данном описании, вводятся в него ссылкой с целью раскрытия и описания конкретных материалов и методологий, для которых приводится ссылка. Публикации, обсуждаемые в данном описании, приводятся единственно по причине их раскрытия до даты подачи настоящей заявки. Ничто в данном описании не должно быть истолковано как признание того факта, что такое раскрытие изобретения можно датировать более ранним числом с помощью предыдущей техники. Определения При описании настоящего изобретения применяются следующие термины, и предполагается что они определяются как указано ниже. Термины "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" применяются в данном описании попеременно (взаимозаменяемо) в отношении полимерной формы нуклеотидов любой протяжнности и могут включать рибонуклеотиды, дезоксирибонуклеотиды,их аналоги или их смеси. Эти термины относятся только к первичной структуре молекулы. Таким образом, термины включают трх-, двух- и однонитевую дезоксирибонуклеиновую кислоту ("ДНК"), так же как трх-, двух- и однонитевую рибонуклеиновую кислоту ("РНК"). Они также включают модифицированные, например с помощью алкилирования и/или кэпирования, и немодифицированные формы полинуклеотида. Модифицированный или немодифицированный, сенсорный полинуклеотид является анионным и может взаимодействовать с катионным полихромофором в отсутствие целевого полинуклеотида. Целевой полинуклеотид, в принципе, может быть заряженным или незаряженным, хотя, как правило, ожидается, что он является анионным, например РНК или ДНК. Более конкретно, термины "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" охватывают полидезоксирибонуклеотиды (содержащие 2-дезокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу), включая тРНК, рРНК, гРНК и мРНК, сплайсированную или несплайсированную, полинуклеотид любого другого типа, который представляет собой N- или С- гликозид пуринового или пиримидинового основания, и другие полимеры, содержащие фосфатный или другой полианионный остов, и другие полимерные синтетические нуклеиновые кислоты со специфической последовательностью, при условии, что полимеры содержат нуклеиновые основания в конфигурации, которая делает возможными спаривание оснований и стекинг (вертикальное взаимодействие) оснований,такие как обнаруженные в ДНК и РНК. Не предполагается, что термины "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" подразумевают разницу в протяжнности, и эти термины употребляются в данном описании взаимозаменяемо. Эти термины относятся только к первичной структуре молекул. Таким образом, эти термины включают, например, 3'-дезокси-2',5'-ДНК,олигодезоксирибонуклеотид N3' Р 5' фосфорамидаты, 2'-О-алкилзамещнную РНК, двух- и однонитевую ДНК, а также двух- и однонитевую РНК и их гибриды, включая, например, гибриды ДНК и РНК, и также включают известные типы модификаций, например метки, алкилирование, "кэпы", замену одного или более нуклеотидов на аналог, межнуклеотидные модификации, например, такие как модификации с отрицательным зарядом связи (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации с боковыми цепями, например, такие как белки (включая ферменты (например, нуклеазы), токсины, антитела,сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаты (например, металлов, радиоактивных металлов, бора,окисляющиеся (окислительные) металлы и т.д.), модификации, содержащие алкиляторы, с модифицированными связями (например, альфа аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида или олигонуклеотида. Будет понятно, что термины "нуклеозид" и "нуклеотид", применяемые в данном описании, включают фрагменты, которые содержат не только известные пуриновые и пиримидиновые основания, но также другие гетероциклические основания, которые были модифицированы. Такие модификации включают метилированные пурины или пиримидины, ацилированные пурины или пиримидины или другие гетероциклы. Модифицированные нуклеотиды или нуклеозиды могут также включать модификации углеводного фрагмента, например, в которых одна или более гидроксильных групп замещена на галоген,алифатические группы или функциональные группы, такие как группы простого эфира, амины или т.п.-4 007653 Предполагается, что термин "нуклеотидная единица" охватывает нуклеозиды и нуклеотиды. Кроме того, модификации нуклеотидных единиц включают перегруппировку, присоединение, замену на по-другому меняющиеся функциональные группы в пуриновом или пиримидиновом основании,которые образуют водородные связи с соответствующим комплементарным пиримидином или пурином. Полученная модифицированная нуклеотидная единица, необязательно, может образовывать пару оснований с другими такими модифицированными нуклеотидными единицами, но не с А, Т, С, G или U. Могут вводиться АР-сайты, которые не препятствуют функции полинуклеотида; предпочтительно, полинуклеотид не содержит АР-сайтов. Некоторые или все остатки в полинуклеотиде могут, необязательно,быть модифицированы одним или более способом. Стандартные пары оснований А-Т и G-С образуются в условиях, которые делают возможным образование водородных связей между N3-Н и С 4-окситимидина и N1 и С 6-NH2, соответственно, аденозина и между С 2-окси, N3 и С 4-NH2 цитидина и С 2-NH2, N'-Н и С 6-окси, соответственно, гуанозина. Так,например, гуанозин (2-амино-6-окси-9D-рибофуранозилпурин) может быть модифицирован с образованием изогуанозина (2-амино-6-амино-9D-рибофуранозилпурина). Такая модификация дат в результате нуклеозидное основание, которое более не образует эффективно стандартную пару оснований с цитозином. Однако модификация цитозина (1D-рибофуранозил-2-окси-4-аминопиримидина) с образованием изоцитозина (1D-рибофуранозил-2-амино-4-оксипиримидина) дат модифицированный нуклеозид, который не образует эффективно пару оснований с гуанозином, но образует пару оснований с изогуанозином. Изоцитозин получают от Sigma Chemical Co. (St. Louis, МО); изоцитидин можно получить по методу, описанному Switzer et al. (1993) Biochemistry 32:10489-10496 и цитируемых в этой статье ссылках; 2'-дезокси-5-метилизоцитидин можно получить по методу, описанному Tor et al. (1993) J. Am.Chem. Soc. 115:4461-4467 и цитируемых в этой статье ссылках; и изогуаниновые нуклеотиды можно получать по методу, описанному Switzer et al. (1993), см. выше, и Mantsch et al. (1993) Biochem. 14:55935601, или методом, описанным в патенте США 5780610, выданном Collins et al. Другие неприродные пары оснований можно синтезировать методом, описанным в статье Piccirilli et al. (1990) Nature 343:3337 для синтеза 2,6-диаминопиримидина и его комплемента (1-метилпиразол[4,3]пиримидин-5,7-(4 Н,6 Н)диона). Известны другие такие модифицированные нуклеотидные единицы, которые образуют уникальные пары оснований, такие, как описанные в статье Leach et al. (1992) J. Am. Chem. Soc. 114:3675-3683 и"Предпочтительное связывание" или "предпочтительная гибридизация" относится к повышенной склонности одного полинуклеотида или ПНК (PNA) связываться со своим комплементом в образце по сравнению с некомплементарным полимером в образце. Условия гибридизации, как правило, включают концентрации солей менее примерно 1 М, более типично менее примерно 500 мМ и предпочтительно менее примерно 200 мМ. В случае гибридизации между пептид-нуклеиновой кислотой и полинуклеотидом гибридизацию можно проводить в растворах,содержащих мало соли или совсем не содержащих соли. Температура гибридизации может быть ниже 5 С, но, как правило, составляет выше 22 С, более типично выше примерно 30 С и предпочтительно выше примерно 37 С. Для специфической гибридизации более длинных фрагментов может потребоваться более высокая температура гибридизации. Другие факторы могут влиять на жсткость условий гибридизации, включая состав основания и протяжнность комплементарных нитей, наличие органических растворителей и степень неспаривания оснований, и комбинация используемых параметров является более важной, чем абсолютная величина любого из них по отдельности. Подходящие условия гибридизации для данного формата анализа может определить специалист в данной области техники; неограничивающие параметры, которые можно корректировать, включают концентрацию аналитических компонентов, используемые соли и их концентрацию, ионную силу, температуру, тип и концентрацию буфера, рН раствора, наличие и концентрацию блокаторов для уменьшения связывания остова, таких как растворы последовательностей повторов или блокирующих белков, тип(ы) и концентрацию детергентов, молекулы, такие как полимерные молекулы, которые повышают относительную концентрацию полинуклеотидов, ион(ы) металлов и их концентрацию(и), хелатирующий(ие) агент(ы) и их концентрацию(и) и другие условия, известные в технике."Многократность" ("множественность") в данном описании относится к анализу или другому аналитическому методу, при котором одновременно можно анализировать множество аналитов."Необязательный" или "необязательно" означает, что описанное затем событие или обстоятельство может или не может произойти и что описание включает примеры, в которых это событие или обстоятельство происходит, и примеры, в которых этого не происходит. Образец. Часть образца, содержащая или предположительно содержащая целевой полинуклеотид (полинуклеотид-мишень), может представлять собой любой источник биологического материала, содержащий полинуклеотиды, которые можно получить от живого организма непосредственно или опосредованно,включая клетки, ткань или жидкость, и отложения, оставляемые этим организмом, включая вирусы, микоплазму и органические остатки. Образец может также содержать целевой полинуклеотид, полученный-5 007653 синтетическими методами, полностью или частично. Как правило, образец получают или диспергируют,преимущественно, в водной среде. Примеры образца, без ограничения, включают кровь, мочу, сперму,молоко, мокроту, слизь, буккальный (ротовой) мазок, соскоб из влагалища, ректальный мазок, аспирационный материал, биопсию иглой, срез ткани, полученной, например, хирургическим путм или при вскрытии (аутопсия), плазму, сыворотку, ликвор, лимфу, внешние выделения (секрецию) кожи, дыхательной системы, желудочно-кишечного тракта и мочеполовой системы, слзы, слюну, опухоли, органы,образцы in vitro составляющих клеточных культур (включая, но без ограничения, кондиционированную среду, полученную в результате роста клеток в клеточной культуральной среде, клетки, предположительно инфицированные вирусом, рекомбинантные клетки и клеточные компоненты) и рекомбинантную библиотеку, содержащую полинуклеотидные последовательности. Образец может быть представлен на субстрате (подложке, носителе), как представлено в данном описании. Субстрат может представлять собой микроскопический препарат, содержащий образец, так как это используется при флуоресцентной insitu гибридизации (FISH). Образец может быть позитивным контрольным образцом, заведомо содержащим целевой полинуклеотид или его заменитель. Можно также использовать негативный контрольный образец, который, хотя не ожидают, что содержит целевой полинуклеотид, но предположительно содержит его (за счт примеси одного или более реагентов), или другой компонент, способный давать ложный позитивный продукт, и его тестируют, чтобы подтвердить отсутствие примеси целевого полинуклеотида в реагентах, используемых в данном анализе, а также определить, образуются ли при данном наборе условий анализа ложные позитивы (сигнал позитива даже в отсутствие целевого полинуклеотида (полинуклеотида-мишени) в образце). Образец можно разводить, растворять, суспендировать, экстрагировать или обрабатывать иным способом, чтобы солюбилизировать и/или очистить любой присутствующий целевой полинуклеотид или сделать его приемлемым для реагентов, которые применяются в схеме амплификации, или для детектирующих (обнаруживающих) реагентов. Если реагент содержит клетки, клетки можно лизировать или пермеабилизировать, чтобы выделить полинуклеотиды, содержащиеся в клетках. Для лизиса клеток можно использовать буферы для одностадийной пермеабилизации, что позволяет осуществлять последующие стадии, например, полимеразную цепную реакцию, непосредственно после лизиса. Целевой полинуклеотид и получаемые из него продукты амплификации. Целевой полинуклеотид может быть однонитевым, двухнитевым или с числом нитей более высокого порядка и может быть линейным или кольцевым. Примеры одноцепочечных (однонитевых) целевых полинуклеотидов включают мРНК, рРНК, тРНК, гяРНК, вирусные геномы с онРНК или онДНК, хотя эти полинуклеотиды могут содержать внутренне комплементарные последовательности и значительную вторичную структуру. Примеры двухнитевых целевых полинуклеотидов включают геномную ДНК, митохондриальную ДНК, хлоропластную ДНК, вирусные геномы с днРНК или днДНК, плазмиды, фаг и вироиды. Целевой полинуклеотид можно получать синтетически или очищать (выделять) из биологического источника. Целевой полинуклеотид можно очищать, удаляя один или более нежелательных компонентов, или снижая его содержание, или концентрируя целевой полинуклеотид. И напротив, если целевой полинуклеотид является слишком концентрированным для конкретного анализа, целевой полинуклеотид можно разбавить. После сбора образца и необязательного извлечения нуклеиновой кислоты нуклеотидную часть образца, содержащую целевой полинуклеотид, можно подвергнуть одной или более препаративных реакций. Эти препаративные реакции могут включать in vitro транскрипцию (IVT), мечение (введение метки),фрагментацию, амплификацию и другие реакции. мРНК сначала можно обработать обратной транскриптазой и праймером, чтобы создать кДНК перед обнаружением и/или амплификацией; это можно сделатьin vitro с помощью очищенной мРНК или in situ, например, в клетках или тканях, прикреплнных к предметному стеклу. Амплификация нуклеотида увеличивает число копий представляющей интерес последовательности, такой как последовательность целевого полинуклеотида. Для применения пригоден ряд методов амплификации; не ограничивающие примеры подходящих реакций амплификации включают метод полимеразной цепной реакции (ПЦР), лигазную цепную реакцию (ЛЦР), самоподдерживаемую репликацию последовательностей (3SR), амплификацию на основе нуклеотидной последовательности(NASBA), применение Q-бета-репликазы, обратная транскрипция, ник-трансляция и т.п. Если целевой полинуклеотид является однонитевым (одноцепочечным), в первом цикле амплификации образуется продукт удлинения праймера, комплементарный целевому полинуклеотиду. Если целевой полинуклеотид является однонитевой РНК, при первой амплификации для обращения транскрипции РНК в ДНК применяется полимераза с активностью обратной транскриптазы, и можно осуществить дополнительные циклы амплификации, чтобы реплицировать продукты удлинения праймера. Естественно,праймеры для ПЦР должны быть созданы таким образом, чтобы гибридизоваться с областями на соответствующей им матрице, которые дают амплифицируемый сегмент; следовательно, каждый праймер должен гибридизоваться таким образом, чтобы его 3' нуклеотид образовывал пару с нуклеотидом в комплементарной ему матричной нити, который локализован 3' от 3' нуклеотида праймера, используемого для репликации этой комплементарной матричной нити при ПЦР.-6 007653 Как правило, целевой полинуклеотид амплифицируют путм контактирования одной или более нитей целевого полинуклеотида с праймером и полимеразой с подходящей активностью с целью удлинения праймера и репликации целевого полинуклеотида с образованием полноразмерного комплементарного полинуклеотида или его меньшего участка. Можно использовать любой фермент, обладающий полимеразной активностью, который позволяет реплицировать целевой полинуклеотид, включая ДНКполимеразы, РНК-полимеразы, обратные транскриптазы, ферменты, имеющие более одного типа полимеразной активности, и фермент может быть термолабильным или термостабильным. Можно также применять смеси ферментов. Примеры ферментов включают ДНК-полимеразы, такие как ДНКполимераза I ("Pol I"), фрагмент Клнова ДНК-полимеразы Pol I, Т 4, Т 7, Секвеназа Т 7, Секвеназа Вариант 2.0 Т 7, ДНК-полимеразы Tub, Taq, Tth, Pfx, Pfu, Tsp, Tfl, Tli и Pyrococcus sp GB-D; PHKполимеразы, такие как РНК-полимеразы Е. coli, SP6, Т 3 и Т 7; и обратные транскриптазы, такие как обратные транскриптазы AMV, М-MuLV, MMLV, РНК-аза Н- MMLV (Superscript), Superscript II, ThermoScript, ВИЧ-1 и RAV2. Все эти ферменты выпускаются промышленностью (имеются в продаже). Примеры полимераз со многими видами специфичности включают RAV2 и Tli (экзо-)полимеразы. Примеры термостабильных полимераз включают ДНК-полимеразы Tub, Taq, Tth, Pfx, Pfu, Tsp, Tfl, Tli и Pyrococcus sp. GB-D. Выбирают подходящие условия реакции, при которых возможна амплификация целевого полинуклеотида, включая рН, буфер, ионную силу, наличие и концентрацию одной или более солей, наличие и концентрацию реагентов и кофакторов, таких как нуклеотиды и ионы магния и/или других металлов (например, марганца), необязательные сорастворители, температуру, термический профиль циклов для схем амплификации, включающих полимеразную цепную реакцию, условия реакции также могут частично зависеть от применяемой полимеразы, а также от характера образца. Сорастворители включают формамид (как правило, в количествах около 2-10%), глицерин (как правило, около 5-10%) и ДМСО (как правило, около 0,9-10%). В схеме амплификации могут быть использованы методы, позволяющие свести к минимуму продукцию ложных позитивов или артефактов, продуцируемых в процессе амплификации. Таковые включают методы "touchdown" ПЦР, методы "горячего старта", применение внутригенных праймеров или создание таких ПЦР праймеров, чтобы в событии образования праймер-димера они образовывали структуру стебель-петля и, следовательно, не амплифицировались. Можно использовать методы ускорения ПЦР, например, "центрифужную" (centrifugal) ПЦР, которая делает возможной более интенсивную конвекцию в образце, и содержащую стадии инфракрасного нагревания для быстрого нагревания и охлаждения образца. Можно осуществлять один или более циклов амплификации. В процессе ПЦР можно использовать избыток одного продукта удлинения праймера; предпочтительно продукт удлинения праймера, полученный в избытке, представляет собой продукт амплификации, который надо обнаружить. Для амплификации различных целевых полинуклеотидов или различных областей конкретного целевого полинуклеотида в образце можно использовать множество различных праймеров. Амплифицированные целевые полинуклеотиды можно подвергнуть послеамплификационной обработке. Например, в некоторых случаях может быть желательна фрагментация целевого полинуклеотида перед гибридизацией, чтобы получить сегменты, которые более доступны. Фрагментацию нуклеиновых кислот можно проводить любым методом, продуцирующим фрагменты такого размера, который пригоден для осуществляемого анализа; подходящие физические, химические и ферментативные методы известны в уровне техники. Реакцию гибридизации можно осуществлять в условиях, которые позволяют сенсорному полинуклеотиду гибридизоваться с продуктом амплификации, по меньшей мере, в течение части цикла амплификации. Когда анализ проводят таким образом, можно обнаружить это событие гибридизации в реальном времени с помощью мониторинга изменения излучения (эмиссии) света сигнальным хромофором, которое происходит при такой гибридизации в процессе схемы амплификации. Поликатионный полихромофор. Показано, что светособирающие полихромофорные системы являются эффективными поглотителями света за счт того, что они содержат множество хромофоров. Примеры включают, но без ограничения, конъюгированные полимеры, агрегаты конъюгированных молекул, люминесцентные красители,связанные с насыщенными полимерами, полупроводниковые квантово-точечные и дендритные структуры. Например, каждую единицу повтора вконъюгированном полимере можно рассматривать как вносящую вклад в хромофор, квантовые точки состоят из многих атомов, насыщенный полимер может быть функционализован по боковым цепям многими молекулами люминесцентного красителя, и можно синтезировать дендримеры, содержащие многие ковалентно связанные отдельные хромофоры. Связывание хромофорных ансамблей с тврдыми носителями (подложками), такими как полимерные гранулы (бусины) или поверхности, также можно использовать для светособирания. Светособирающие полихромофорные системы могут эффективно переносить энергию на соседние люминесцентные частицы (например, на "сигнальные хромофоры"). Механизмы переноса энергии включают, например, резонансный перенос энергии (ферстеровский (по механизму Ферстера) резонансный перенос (или резонансный перенос энергии флуоресценции), FRET), квантовый перенос заряда (перенос энергии по методу Декстера) и т.п. Однако, как правило, эти механизмы переноса энергии имеют отно-7 007653 сительно короткие пределы; т.е. для эффективного переноса энергии требуется тесная близость светособирающей полихромофорной системы с сигнальным хромофором. В условиях эффективного переноса энергии амплификация эмиссии из сигнального хромофора происходит тогда, когда количество отдельных хромофоров в светособирающей полихромофорной системе велико; т.е. эмиссия из сигнального хромофора более интенсивна, когда длина волны падающего света ("светового пучка накачки") такова,что свет поглощается светособирающей полихромофорной системой, нежели когда сигнальный хромофор непосредственно возбуждается световым пучком накачки. Конъюгированные полимеры (КП, СР) характеризуются делокализованной электронной структурой и могут быть использованы в качестве высокочувствительных оптических контрольных веществ для химических и биологических мишеней 12,13. Вследствие того, что эффективная длина конъюгации значительно короче, чем длина полимерной цепи, остов содержит большое количество конъюгированных сегментов, находящихся в тесной близости. Таким образом, конъюгированные полимеры эффективны для светосбора и делают возможной оптическую амплификацию по ферстеровскому механизму переноса энергии 14. Самопроизвольное межмолекулярное комплексообразование между катионными полиэлектролитами и ДНК описано и является в значительной степени результатом совместного действия электростатических сил 15,16,17. Также недавно открыты гидрофобные взаимодействия между ароматическими полимерными единицами и основаниями ДНК 18,19. Свободная энергия взаимодействий полиэлектролит/ДНК контролируется структурой участвующих частиц в сочетании с различными переменными характеристиками растворов, такими как рН, ионная сила и температура 20 . Сила и специфичность таких взаимодействий недавно были совместно применены для распознавания третичной структуры плазмидной ДНК 21. Полихромофоры, применяемые по данному изобретению, являются поликатионными, так что они могут электростатически взаимодействовать с сенсорным полинуклеотидом. В описанных методах можно использовать любой поликатионный полихромофор, который может поглощать свет и переносить энергию на сигнальный хромофор на сенсорном полинуклеотиде. Примеры полихромофоров, которые можно применять, охватывают конъюгированные полимеры, насыщенные полимеры или дендримеры,включающие множественные хромофоры любым практически осуществимым способом, и полупроводниковые нанокристаллы (SCNC). Можно получать конъюгированные полимеры, насыщенные полимеры и дендримеры таким образом, чтобы они включали сложные катионные частицы, или их можно дериватизировать, чтобы сделать их поликатионными после синтеза; полупроводниковые нанокристаллы можно сделать поликатионными, помещая катионные частицы на их поверхность. В предпочтительном варианте изобретения в качестве поликатионного полихромофора используют конъюгированный полимер. Конкретный пример представляет структура 1, где катионный водорастворимый конъюгированный полимер представляет собой поли(9,9-бис(6'-N,N,N-триметиламмоний) гексил)флуоренфенилен с иодид-противоионами (показан ниже как полимер 1)22. Конкретный размер этого полимера не важен до тех пор, пока полимер способен поглощать свет и переносить энергию на сигнальные хромофоры, находящиеся поблизости. Типичные значения "n" находятся в интервале от 2 до примерно 100000. Эта конкретная молекулярная структура не является важной; можно применять любой водорастворимый катионный конъюгированный полимер с адекватной эффективностью кванта люминесценции Водорастворимые конъюгированные олигомеры также могут использоваться в качестве поликатионного полихромофора. Пример такого водорастворимого катионного люминесцентного конъюгированного олигомера с йодидными противоионами показан ниже (обозначается в данном описании как олигомер 2) Хотя олигомер 2 с меньшим молекулярным весом не визуализует высокой сигнальной характеристики амплификации, характерной для полимера с более высоким молекулярным весом, такие более низкомолекулярные молекулы пригодны для деконволюции соотношения структура-свойства, которые-8 007653 трудно определить при собственной полидисперсности полимеров и их изменениях от партии к партии. Кроме того, в водных средах олигомеры, такие как 2, более растворимы, чем их полимерные аналоги, и полагают, что гидрофобные взаимодействия менее важны для 2, чем для полимерных структур. Таким образом, совокупности олигомеров могут быть желательны для специфических применений. Добавление органических растворителей, например, смешивающегося с водой органического растворителя, такого как этанол, может вызвать снижение фоновой эмиссии С. Присутствие органического растворителя может уменьшить гидрофобные взаимодействия и понизить фоновую С эмиссию. Сенсорный полинуклеотид. Получен сенсорный полинуклеотид, являющийся анионным и комплементарным целевому полинуклеотиду, который требуется анализировать, и он имеет заданную последовательность. Сенсорный полинуклеотид может быть разветвлнным, полимерным или кольцевым, но, как правило, линеен, и может содержать неприродные основания. Сенсорный полинуклеотид можно получать с любой заданной последовательностью оснований. Химические методы присоединения сигнального хромофора к сенсорному полинуклеотиду хорошо известны в технике 23. Структуры конкретных сенсорных полинуклеотидов, включая структуры, конъюгированные с хромофорами, можно получать готовыми из промышленных источников или можно синтезировать химически. Сигнальный хромофор. Хромофоры, применимые изобретению, представленному в данном описании, включают любое вещество, которое в соответствующем растворе может поглощать энергию поликатионного полихромофора и излучать свет. Для множества анализов можно использовать множество различных сигнальных хромофоров со значительно различающимися спектрами излучения. Хромофор может быть люминофором или флуорофором. Типичные флуорофоры включают флуоресцентные красители, полупроводниковые нанокристаллы, хелаты лантаноидов, красители, специфические в отношении полинуклеотидов и зелный флуоресцентный белок. Примеры флуоресцентных красителей включают флуоресцеин, 6-FAM, родамин, Техас красный,тетраметилродамин, карбоксиродамин, карбоксиродамин 6G, карбоксиродол, карбоксиродамин 110, Cascade Blue (каскад синий), Cascade Yellow (каскад жлтый), кумарин, Су 2, Су 3, Су 3.5, Су 5, Су 5.5,Су-Chrome, фикоэритрин, РеrСР (перидинин хлорофилл- а протеин), PerCP-Cy5.5, JOE (6-карбокси-4',5'дихлор-2',7'-диметоксифлуоресцеин), NED, ROX (5-(и 6-)карбокси-Х-родамин), HEX, Люцифер жлтый,синий морской, Орегон зелный 488, Орегон зелный 500, Орегон зелный 514, Alexa Fluor 350, AlexaTMR, BODIPY TR, их конъюгаты и их комбинации. Примеры хелатов лантаноидов включают хелаты европия, хелаты тербия и хелаты самария. Большой ряд флуоресцентных полупроводниковых нанокристаллов ("SCNC") известен в технике: методы получения и применения полупроводниковых нанокристаллов описаны в: международной заявке РСТ WO 99/26299, опубликованной 27 мая 1999 г., авторы изобретения Bawendi et al.; патенте США 5990479, выданном 23 ноября 1999 г. Weiss et al.; и Bruchez et al., Science 281:2013, 1998. Полупроводниковые нанокристаллы можно получать с очень узкими полосами эмиссии с чтко определнными длинами волн максимальной эмиссии, что позволяет в том же анализе в качестве сигнальных хромофоров применять широкий ряд различных SCNC, необязательно в комбинации с другими сигнальными хромофорами не-SCNC типа. Примеры красителей, специфичных в отношении полинуклеотидов, включают акридин оранжевый(462/481), ВО-PRO-3 йодид (575/599), 4',6-диамидино-2-фенилиндол, дигидрохлорид (DAPI), 4',6 диамидино-2-фенилиндол, дилактат (DAPI, дилактат), дигидроэтидиум (гидроэтидин), этидиум бромид,этидиум диазид хлорид, этидиум гомодимер-1 (EthD-1), этидиум гомодимер-2 (EthD-2), этидиум моноазид бромид (ЕМА), гексидиум йодид, Hoechst 33258, Hoechst 33342, Hoechst 34580, Hoechst S769121,гидроксистилбамидин, метансульфонат, JOJO-1 йодид (529/545), JO-PRO-l йодид (530/546),LOLO-l йодид (565/579), LO-PRO-l йодид (567/580), Neuro Trace 435/455, Neuro Trace 500/525,Neuro Trace 515/535, Neuro Trace 530/615, Neuro Trace 640/660, OliGreen (масляный зелный), PicoGreen онДНК, PicoGreen днДНК, РОРО-1 йодид (434/456), РОРО-3 йодид (534/570), РО-PRO-l йодид (435/455), PO-PRO-3 йодид (539/567), пропидиум йодид, RiboGreen, SlowFade, SlowFadeOrange, SYTO 17, SYTO 59, SYTO 60, SYTO 61, SYTO 62, SYTO 63, SYTO 64, SYTO Red (красный), нетропсин, дистамицин, акридин оранжевый (оранж), 3,4-бензопирен, тиазол оранжевый (оранж),ТОМЕНЕ, дауномицин, акридин, пентил-ТОТАВ и бутил-TOTIN. В качестве специфичных в отношении полинуклеотидов красителей можно использовать асимметрические цианиновые красители. Другие представляющие интерес красители включают красители, описанные Geierstanger, B.H. and Wemmer, D.E., Annu. Rev, Vioshys. Biomol. Struct. 1995, 24, 463-493; Larson,C.J. and Verdine, O.L., Bioorganic Chemistry: Nucleic Acids, Hecht, S.M., Ed., Oxford University Press: NewYork, 1996; pp 324-346; и Glumoff, T. and Goldman, A. Nucleic Acids in Chemistry and Biology, 2nd ed.,Blackburn, G.M. and Gait, M.J., Eds., Oxford University Press: Oxford, 1996, pp. 375-441. Полинуклеотид-специфичный краситель может быть интеркалирующим красителем и может быть специфичным в отношении двухцепочечных (двухнитевых) полинуклеотидов. Другие красители и флуорофоры описаны в Интернете по адресу www.probes.com (Molecular Probes, Inc.). Термин "зелный флуоресцентный белок " относится как к нативному Aequorea зелному флуоресцентному белку, так и к мутантным вариантам, которые были идентифицированы как проявляющие изменнные характеристики флуоресценции, включая изменнные максимумы возбуждения и эмиссии, а также спектры возбуждения и эмиссии различного профиля (Delagrave, S. et al. (1995) Bio/Technology 13:151-154; Heim, В. et al. (1994) Proc. Natl. Acad. Sci. USA 91:12501-12504; Heim, R. et al. (1995) Nature 373:663-664). Delgrave et al. выделили мутанты клонированного Aequorea victoria GFP, спектр возбуждения которого имеет сдвиг в красную область. Bio/Technology 13:151-154 (1995). Heim, R. et al. сообщил о мутантной форме (замена Туr66 на His), имеющей полосу флуоресценции в голубой области спектра(Proc. Natl. Acad. Sci. (1994) USA 91:12501-12504). В одном варианте второй сигнальный хромофор, который может быть непосредственно или опосредованно присоединн к другому аналитическому компоненту и/или к субстрату (подложке, носителю), используют для получения (улавливания) энергии от начального сигнального хромофора. В конкретных применениях это может обеспечить заметную дополнительную селективность. Например, специфичный в отношении полинуклеотида краситель можно использовать либо в качестве начального, либо в качестве дополнительного сигнального хромофора, и он может быть специфичным в отношении двухнитевых последовательностей. Затем энергия может быть перенесена с возбужднного катионного полихромофора на начальный сигнальный хромофор, который далее перенест энергию на дополнительный (второй) сигнальный хромофор, в общем формате он является селективным в отношении мишени. Этот каскад сигнальных хромофоров в принципе можно продолжить, используя любое число сигнальных хромофоров с совместимыми профилями поглощения и излучения (эмиссии). В одном таком варианте изобретения в качестве дополнительного (второго) сигнального хромофора используется интеркалирующий краситель, специфичный в отношении двухнитевых полинуклеотидов, а начальный сигнальный хромофор, способный переносить энергию на второй сигнальный хромофор, конъюгирован с сенсорным полинуклеотидом. Интеркалирущий краситель создат дополнительное требование для селективности,чтобы сенсорный и целевой полинуклеотиды были гибридизованы перед тем, как из них образуется комплекс. В присутствии мишени образуется дуплекс, вступает в действие краситель и возбуждение сигнального полихромофора приводит к передаче сигнала от второго сигнального хромофора. Субстрат. Способы по данному описанию можно осуществлять на субстрате (подложке, носителе) в любом из множества форматов. Субстрат может представлять собой широкий ряд материалов, либо биологических, небиологических, органических, неорганических, либо любую их комбинацию. Например, подложка может представлять собой полимерную плнку Ленгмюра-Блоджетт (Langmuir Blodgett, ПЛБ) функционализованное стекло, Si, Ge, GaAs, GaP, SiO2, SiN4, модифицированный кремний или любой из обширного разнообразия гелей или полимеров, таких, как (поли)тетрафторэтилен, (поли)винилиденфторид,полистирол, сшитый полистирол, полиакриловая кислота, полимолочная кислота, полигликолевая кислота, сополимер лактида с гликолидом, полиангидриды, полиметилметакрилат, сополимер этилена с винилацетатом, полисилоксаны, полимерный диоксид кремния, латексы, полимеры декстрана, эпоксисоединения, поликарбонаты, агароза, полиакриламид или их комбинации. Можно применять полимерные проводники и фотопроводниковые материалы. Субстраты могут быть планарными кристаллическим субстратами, таким как субстраты на основе диоксида кремния (например, стекло, кварц и т.п.), или кристаллическими субстратами, применяемыми,например, в полупроводниковой и микропроцессорной технике, такими как кремний, арсенид галлия,GaN с добавкой индия и т.п. и включают полупроводниковые нанокристаллы. Субстрат может принимать форму фотодиода, оптоэлектронного сенсора, такого как оптоэлектронный полупроводниковый чип или оптоэлектронный тонкоплночный полупроводник, или биочип. Расположение индивидуального(ых) сенсорного(ых) полинуклеотида(ов) на субстрате может быть адресуемым; это может быть совершено в форматах с высокой плотностью, и расположение может быть микроадресуемым или наноадресуемым. Аэрогели на основе диоксида кремния также можно использовать в качестве субстрата и их можно получать методами, известными из уровня техники. Субстраты-аэрогели можно использовать в качестве- 10007653 свободностоящих подложек или в виде покрытия из субстрата, нанеснного на другой материал. Подложка (субстрат, носитель) может иметь любую форму и, как правило, представляет собой плашку, предметное стекло, гранулу, пеллету, пластину, частицу, микрочастицу, наночастицу, нить, осадок, матрицу на основе необязательно пористого геля, листы, ампулу, сферу, контейнер, капилляр, подкладку (слой), полупроводниковую пластину (кристалл), плнку, чип, многолуночный планшет или плашку, оптическую нить и т.д. Подложка может быть любой формы, которая является жстко или полужстко закреплнной. Субстрат (подложка) может содержать выпуклые или вогнутые участки, на которых локализован сенсорный полинуклеотид или другой аналитический компонент. Поверхность субстрата можно протравить, используя хорошо известные методы, чтобы получить заданные особенности поверхности, например, борозды, V канавки, мезаструктуры и т.п. Поверхность подложки может состоять из того же материала, что и подложка или может быть из другого материала и может быть прикреплена к подложке (субстрату) химическими или физическими способами. Такие присоединнные (связанные) поверхности могут состоять из материала, выбранного из большого ряда материалов, например, полимеров, пластиков, смол, полисахаридов, диоксида кремния или материалов на основе диоксида кремния, углерода, металлов, неорганических сткол, мембран или любого из вышеперечисленных материалов для субстрата. Поверхность необязательно может быть прозрачной и может иметь поверхность с Si-ОН функциональными группами, такими, как группы, обнаруженные на поверхности диоксида кремния. Субстрат и/или его оптическую поверхность выбирают таким образом, чтобы обеспечить соответствующие оптические характеристики для используемых синтетических методов и/или методов обнаружения. Субстрат и/или поверхность могут быть прозрачными, чтобы была возможна экспозиция субстрата со светом, поступающим с разных сторон. Субстрат и/или поверхность могут быть созданы с отражающей "зеркальной" структурой для повышения "улавливания" света. Субстрат и/или его поверхность, как правило, устойчивы, или обрабатываются таким образом, чтобы быть устойчивыми, в условиях, в которых они экспонируются при использовании, и могут, необязательно, обрабатываться таким образом, чтобы удалять любой резистентный материал после экспозиции в этих условиях. Сенсорные полинуклеотиды могут быть собраны с субстратом или присоединены к субстрату любым подходящим способом, например, методами, описанными в патенте США 5143854, опубликованной международной заявке РСТ WO 92/10092, патентной заявке США 07/624120, поданной 6 декабря 1990 г.(в настоящее время абандонированной), в статье Fodor et al., Science, 251: 767-777 (1991) и в опубликованной международной заявке РСТ WO 90/15070. Методы синтеза этих "сборок" (матриц) с применением стратегии механических синтезов описаны, например, в опубликованной международной заявке РСТWO 93/09668 и в патенте США 5384261. Другие дополнительные способы включают методы с применением гранул, такие, как методы, описанные в патентной заявке PCT/US93/04145, и методы с применением штырьков, такие, как методы, описанные в патенте США 5288514. Дополнительные проточные методы или споттинг-методы, пригодные для связывания сенсорных полинуклеотидов с субстратом, описаны в патентной заявке США 07/980,523, поданной 20 ноября 1992 г., и в патенте США 5384261. Реагенты доставляют к субстрату либо (1) заливкой в заданные каналы на заранее определнных участках, либо (2) "споттингом" на предварительно определнные области. Для защиты участков субстрата можно применять защитное покрытие, такое, как гидрофильное или гидрофобное покрытие (в зависимости от природы растворителя), иногда в комбинации с материалами, которые облегчают смачивание раствором реагента в других областях. Таким образом, дополнительно предотвращается вытекание проточных растворов наружу из их проточных путей. Типичные диспенсеры включают микропипетку, необязательно контролируемую роботом, тврдочернильный лазерный принтер, набор пробирок, коллектор, набор пипеток и т.п., так чтобы последовательно или одновременно доставлять различные реагенты к реакционным областям. Возбуждение и обнаружение хромофоров. Для возбуждения можно применять любой измерительный прибор, который обеспечивает длину волны, способную возбуждать поликатионный полихромофор и более короткую, чем длина(-ы) волны,которую требуется обнаружить. Предпочтительно, чтобы источник возбуждения непосредственно незначительно возбуждал сигнальный хромофор. Источником может быть: источник широкополосного УФизлучения, такой как дейтериевая лампа с соответствующим фильтром, выводное устройство источника дневного света, такого как ксеноновая лампа или дейтериевая лампа, после прохождения через монохроматор с целью выделения полос света с заданными длинами волн, газовый лазер, обеспечивающий непрерывную волну (cw), тврдый диодный лазер или любой из пульсовых лазеров. Свет, излучаемый сигнальным хромофором, можно обнаруживать с помощью любого подходящего устройства или любым методом: в уровне техники известны многие подходящие способы. Например, для обнаружения, действительно ли при возбуждении полихромофора испытуемый образец излучает свет с параметрами длины волны сигнального хромофора, можно применять флуорометр или спектрофотометр.- 11007653 Наборы. Также в данном изобретении охватываются наборы, содержащие реагенты для осуществления способов по изобретению. В одном варианте изобретения набор содержит однонитевой сенсорный полинуклеотид, комплементарный представляющему интерес целевому полинуклеотиду, и поликатионный полихромофор. Сенсорный полинуклеотид конъюгирует с сигнальным хромофором. В присутствии в образце целевого полинуклеотида сенсорный полинуклеотид гибридизуется с мишенью целевым полинуклеотидом, что приводит к повышенной эмиссии энергии сигнальным хромофором, которую можно обнаружить. Компоненты набора можно хранить в упаковке. Инструкции по применению набора для осуществления способа по изобретению можно прилагать к упаковке и эти инструкции могут поставляться в любом установленном материале. Инструкции могут находиться внутри упаковки или вне упаковки и могут быть напечатаны на внутренней или внешней стороне любой поверхности, образующей упаковку, чтобы инструкцию было удобно читать. Набор может быть в виде сложной формы, содержащей некоторое количество одного или более различных сенсорных полинуклеотидов, которые могут гибридизоваться с соответствующими различными целевыми полинуклеотидами. Примеры. Нижеприведнные примеры представлены для того, чтобы дать рядовому специалисту в данной области техники полное описание того, как осуществлять и применять настоящее изобретение, и не претендуют на ограничение объма того, что относится к изобретению (что следует рассматривать как изобретение). Были предприняты усилия для того, чтобы гарантировать точность используемых величин(например, количеств, температуры и т.д.), но следует принять во внимание некоторые погрешности и девиации эксперимента. Если не указано иначе, части представляют собой весовые части, температура выражается в градусах Цельсия, а давление атмосферное или приблизительно атмосферное, и все материалы являются продажными. Пример 1. Идентификация схемы FRET. Гибридизационные тесты с применением переноса энергии от светособирающей полихромофорной системы на сигнальный хромофор продемонстрированы на катионном водорастворимом конъюгированном полимере поли(9,9-бис(6'-N,N,N-триметиламмоний)гексил)флуорене, полимере 1 с иодидпротивоионами. Последовательность сенсорного полинуклеотида 5'-GTAAATGGTGTTAGGGTTGC-3' соответствует плазмиде капсулы споры антракса (Bacillus anthracis), pX02, с флуоресцеином в положении 5', образуя пример Олиго-С (Oligo-C)24. Спектры поглощения и эмиссии полимера и сигнального хромофора показаны на фиг. 1. Данные показывают оптическое окно прозрачности для возбуждения полимера 1, между поглощением ДНК и флуоресцеина. Непосредственное возбуждение полимера 1 вызывает перенос энергии (ЕТ) на флуоресцеин, как показано на фиг. 1. Перекрывание поглощения флуоресцеина с эмиссией полимера 1 выбирают для гарантии FRET25. Величину ЕТ можно оценивать по отношению объединнной эмиссии акцептора к эмиссии донора. Пример 2. Демонстрации FRET в присутствии целевого полинуклеотида. Гибридизация зонда Oligo-С приводит к изменениям отношения ЕТ. Сенсорный полинуклеотид([Oligo-C]=2.110-8 M) отжигается при температуре, на 2 С ниже его Тпл(58,4 С) в присутствии нити из 40 пар оснований, содержащей комплементарную последовательность из 20 пар оснований, 5'CATCTGTAAATCCAAGAGTAGCAACCCTAACACCATTTAC-3', и аналогичным образом с некомплементарной нитью из 40 пар оснований с последовательностью 5'ААААТАТТGTGTATCAAAATGTAAATGGTGTTAGGGTTGC-3'. Непосредственное сравнение возникающей в результате флуоресценции показывает, что соотношение ЕТ более чем в 6 раз выше для гибридизованной ДНК (см. фиг. 2). Также очень важно то, что эта оптическая разница наблюдается в присутствии буфера 10 ммоль цитрата натрия и 100 ммоль хлорида натрия. Ионы буфера сортируются как заряды на комплементарных тяжах ДНК, что облегчает гибридизацию, но ослабляет электростатические взаимодействия между СР и тушителями флуоресценции противоположного заряда 26. При использовании флуорометра ксеноновой лампы, снабжнный стандартным РМТ, гибридизованная ДНК дат в 3 раза более высокие значения отношений ЕТ, при [сенсорный полинуклеотид]=2.810-9 М, чем негибридизованная ДНК. Пример 3. Оптимизация переноса энергии. Перенос энергии можно оптимизировать, варьируя отношение полимера 1 к Oligo-С. При концентрации [Oligo-С]=2.110-8 M начальное прибавление полимера вызывает мгновенное повышение значение отношения ЕТ, которое падает по мере того, как количество полимера 1 начинает значительно превосходить количество Oligo-С. Максимальное значение отношения ЕТ соответствует отношению полимерных цепей к Oligo-С, примерно равному 1:1. При высоких концентрациях полимера не каждая цепь дат прочный комплекс с Oligo-С, и эмиссия донора возрастает быстрее, чем эмиссия сигнального хромофора. Такая зависимость ожидается, так как, когда [полимер l]/[O1igo-С]1, не все тяжи сенсорного полинуклеотида могут эффективно давать комплекс с независимыми полимерными цепями. Напротив, в режиме [полимер l]/[O1igo-С]1 не все протоны, используемые (испускаемые) полимером 1 (донором),- 12007653 могут быть перенесены на Oligo-С (акцептор). Когда единица повтора полимера к Oligo-С достигает,примерно, 100, фотолюминесценция указанного хромофора более не увеличивается, что указывает на насыщение акцептора. Общая флуоресцентная эмиссия, примерно, в 4 раза выше, чем флуоресцентная эмиссия непосредственно возбужднного (480 нм) зонда в отсутствие полимера 1, что дат дополнительное доказательство амплификации сигнала. Пример 4. FRET перенос с полихромофора через сенсорный полинуклеотид на краситель полинуклеотида с целью повышенной селективности. Гибридизация зонда Oligo-С (5'-Fl-ATCTTGACTATGTGGGTGCT-3') приводит к различным значениям ЕТ отношения для двух различных сенсорных хромофоров. Сенсорный полинуклеотид ([OligoС]=110-8 М) отжигается при температуре на 2 С ниже его Тпл(58,5 С) в присутствии эквимолярного количества нити из 20 пар оснований, содержащей комплементарную последовательность из 20 пар оснований (5'-AGCACCCACATAGTCAAGAT-3'), и аналогичным образом с некомплементарной нитью из 20 пар оснований с последовательностью (5'-CGTATCACTGGACTGATTGG-3'). Смеси двух ДНК смешивают с этидиум бромидом ([ЕВ]=1.110-6 М) при комнатной температуре в буферном растворе одноосновного фосфата (дигидрофосфата) калия-гидроксида натрия (50 мМ, рН=7,40), где происходит интеркаляция ЕВ в структуре дуплекса гибридизованной пары ДНК. Прибавление полимера 1 в воде([1]=1.610-7 М) и последующее возбуждение 1 (380 нм) вызывают перенос энергии с 1 на сенсорный полинуклеотид, а затем перенос энергии с сенсорного полинуклеотида на ЕВ. Сравнение полученной флуоресценции показывает, что только раствор сенсора показывает эмиссию из интеркалирующего красителя ЕВ в присутствии гибридизованной ДНК. См. фиг. 3. Этот результат демонстрирует, что сенсор с последовательностью ДНК по данному изобретению может обнаруживать присутствие целевой одноцепочечной ДНК со специфической последовательностью оснований, комплементарной последовательности сенсорного полинуклеотида, с помощью обнаружения эмиссии из специфичного в отношении полинуклеотида красителя при возбуждении поликатионного полихромофора. Хромофоры, применяемые в данном примере, выбирают так, чтобы соответствующим образом перекрывались между собой энергии полихромофора и двух сигнальных хромофоров. Пример 5. Демонстрация оптической амплификации красителей полинуклеотида с применениемFRET полихромофорных систем. Возбуждение 1 в растворе 1, сенсорного полинуклеотида и красителя, специфичного в отношении полинуклеотида (этидиум бромида (этидийбромида, этидия бромида), ЕВ), вызывает эмиссию ЕВ с интенсивностью, примерно, в 8 раз более высокой, нежели интенсивность непосредственно возбужднного(500 нм) ЕВ в той же последовательности двухнитевой ДНК, в которой отсутствует сигнальный хромофор в сенсорном полинуклеотиде. Непосредственное возбуждение сигнального Oligo-С (480 нм), в отсутствие полимера 1, вызывает только примерно 4-кратную сенситизацию (сенсибилизацию, активацию) интеркалированного ЕВ. В целом данный пример предоставляет доказательство наличия амплификации сигнала с помощью FRET с поликатионного полихромофора (конъюгированного полимера 1) на диагностический ЕВ маркр. См. фиг. 4. Пример 6. FRET перенос на краситель полинуклеотида. Опыты с применением 1 и этидийбромида ("ЕВ") в качестве сигнального хромофора показывают,что прямой (непосредственный) перенос энергии с 1 на ЕВ можно продемонстрировать в присутствии двухцепочечной ДНК. Сенсорный полинуклеотид (5'-ATCTTGACTATGTGGGTGCT-3'), не содержащий сигнальный хромофор, ([Oligo]=110-8 M), отжигается при температуре на 2 С ниже его Тпл(58,5 С) в присутствии эквимолярного количества нити из 20 пар оснований, содержащей комплементарную последовательность из 20 пар оснований, (5'-AGCACCCACATAGTCAAGAT-3), и аналогичным образом с некомплементарной нитью из 20 пар оснований с последовательностью(5'CGTATCACTGGACTGATTGG-3'). Смеси двух ДНК смешивают с этидиум бромидом ([ЕВ]=1,110-6 М) при комнатной температуре в буферном растворе одноосновного фосфата (дигидрофосфата) калиягидроксида натрия (50 мМ, рН=7,40), где происходит интеркаляция ЕВ в структуре дуплекса гибридизованной пары ДНК. Прибавление полимера 1 в воде ([1]=1,610-7 М) и последующее возбуждение 1 (380 нм) вызывают перенос энергии с 1 на интеркалированный ЕВ только в случае гибридизованной или двухцепочечной ДНК. Эмиссию из ЕВ обнаруживают при возбуждении полимера 1 только для гибридизованных последовательностей. См. фиг. 5. Хотя данное изобретение подробно описано со ссылкой на предпочтительные варианты, специалисты в данной области техники поймут, в свете указаний в данном описании, что определнные изменения и модификации могут быть сделаны без отступления от сущности и объма изобретения. Соответственно, изобретение ограничивается только формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ анализа, заключающийся в приготовлении образца, предположительно содержащего целевой полинуклеотид; получении поликатионного полихромофора, способного при возбуждении переносить энергию на- 13007653 сигнальный хромофор; получении анионного сенсорного полинуклеотида, являющегося однонитевым и комплементарным целевому полинуклеотиду (полинуклеотиду-мишени), причм указанный сенсорный полинуклеотид конъюгирован с сигнальным хромофором, при этом сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в отсутствие целевого полинуклеотида сигнальный хромофор может испускать световое излучение; и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение; контактировании образца с сенсорным полинуклеотидом и полихромофором в растворе в условиях,при которых сенсорный полинуклеотид может гибридизоваться с целевым полинуклеотидом, если он присутствует; поднесении к раствору источника света, который может возбуждать полихромофор; и обнаружении, является ли световое излучение сигнального хромофора более сильным в присутствии образца. 2. Способ по п.1, отличающийся тем, что полихромофор представляет собой структуру, выбранную из группы, состоящей из насыщенного полимера, конъюгированного полимера, дендримера и полупроводникового нанокристалла. 3. Способ по п.2, отличающийся тем, что полихромофор представляет собой насыщенный полимер. 4. Способ по п.3, отличающийся тем, что насыщенный полимер связан с люминесцентным красителем. 5. Способ по п.2, отличающийся тем, что полихромофор представляет собой дендример. 6. Способ по п.2, отличающийся тем, что полихромофор представляет собой полупроводниковый нанокристалл. 7. Способ по п.2, отличающийся тем, что полихромофор представляет собой конъюгированный полимер. 8. Способ по п.7, отличающийся тем, что конъюгированный полимер имеет структуру 9. Способ по п.2, отличающийся тем, что полихромофор представляет собой агрегат конъюгированных молекул. 10. Способ по п.9, отличающийся тем, что агрегат конъюгированных молекул имеет структуру 11. Способ по п.1, отличающийся тем, что образец контактирует с сенсорным полинуклеотидом и полихромофором в присутствии достаточного количества органического растворителя для уменьшения гидрофобных взаимодействий между сенсорным полинуклеотидом и полихромофором. 12. Способ по п.1, отличающийся тем, что образец контактирует с рядом различных сенсорных полинуклеотидов, имеющих соответствующие различные последовательности, при этом указанные различные сенсорные полинуклеотиды содержат соответствующий различный сигнальный хромофор, и тем,что каждый из указанных различных сенсорных полинуклеотидов может селективно гибридизоваться с соответствующим различным целевым полинуклеотидом. 13. Способ по п.1, отличающийся тем, что сигнальный хромофор представляет собой флуорофор. 14. Способ по п.13, отличающийся тем, что флуорофор представляет собой зелный флуоресцентный белок. 15. Способ по п.14, отличающийся тем, что флуорофор выбирают из полупроводникового нанокристалла, флуоресцентного красителя и хелата лантаноида. 16. Способ по п.15, отличающийся тем, что флуорофор представляет собой полупроводниковый нанокристалл. 17. Способ по п.15, отличающийся тем, что флуорофор представляет собой флуоресцентный краситель. 18. Способ по п.17, отличающийся тем, что флуоресцентный краситель представляет собой флуоресцеин. 19. Способ по п.15, отличающийся тем, что флуорофор представляет собой хелат лантаноида.- 14007653 20. Способ по п.1, отличающийся тем, что целевой полинуклеотид представляет собой ДНК. 21. Способ по п.1, отличающийся тем, что целевой полинуклеотид представляет собой РНК. 22. Способ по п.1, отличающийся тем, что образец содержит однонитевой целевой полинуклеотид. 23. Способ по п.1, отличающийся тем, что образец содержит двухнитевой целевой полинуклеотид. 24. Способ по п.1, отличающийся тем, что целевой полинуклеотид получают реакцией амплификации. 25. Способ по п.24, отличающийся тем, что реакция амплификации представляет собой полимеразную цепную реакцию. 26. Способ по п.1, отличающийся тем, что испускаемое сигнальным хромофором световое излучение выше порогового уровня указывает, что целевой полинуклеотид присутствует в образце. 27. Способ по п.1, отличающийся тем, что количество светового излучения, испускаемого сигнальным хромофором, измеряют и используют для определения количества целевого полинуклеотида в образце. 28. Способ по п.1, отличающийся тем, что целевой полинуклеотид не является амплифицированным. 29. Способ по п.1, отличающийся тем, что его осуществляют на подложке (субстрате). 30. Способ по п.29, отличающийся тем, что подложку (субстрат) выбирают из группы, состоящей из микросферы, чипа, предметного стекла, многолуночного планшета, оптической нити, матрицы на основе необязательно пористого геля, фотодиода и оптоэлектронного прибора (устройства). 31. Способ по п.30, отличающийся тем, что субстрат представляет собой предметное стекло. 32. Способ по п.30, отличающийся тем, что субстрат представляет собой оптоэлектронное устройство. 33. Способ по п.30, отличающийся тем, что субстрат представляет собой матрицу на основе необязательно пористого геля. 34. Способ по п.32, отличающийся тем, что субстрат представляет собой золь-гель. 35. Способ по п.30, отличающийся тем, что субстрат является доступным для наноизмерений. 36. Способ по п.30, отличающийся тем, что субстрат является доступным для микроизмерений. 37. Способ по п.30, отличающийся тем, что субстрат конъюгирован с множеством различных сенсорных полинуклеотидов, имеющих соответствующие различные последовательности, причм каждый из указанных сенсорных полинуклеотидов может селективно гибридизоваться с соответствующим отличающимся целевым полинуклеотидом. 38. Способ по п.1, отличающийся тем, что включает осуществление флуоресцентной in situ гибридизации (FISH). 39. Способ по п.1, дополнительно содержащий контактирование образца в растворе с сенсорным полинуклеотидом, полихромофором и вторым сигнальным хромофором, который может воспринимать энергию от сигнального хромофора в присутствии мишени и излучать свет, причем обнаружение того факта, усиливается ли в присутствии образца световое излучение, испускаемое сигнальным хромофором,заключается в детектировании того, усиливается ли в присутствии образца световое излучение, испускаемое вторым сигнальным хромофором. 40. Способ по п.39, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель. 41. Раствор для распознавания полинуклеотида, содержащий сигнальный хромофор и поликатионный полихромофор, который при возбуждении способен переносить энергию на сигнальный хромофор,когда оказывается вблизи него, причм сигнальный хромофор излучает более сильную энергию в присутствии полинуклеотида, распознаваемого при возбуждении полихромофора. 42. Раствор для распознавания полинуклеотида по п.41, дополнительно содержащий второй сигнальный хромофор, который может принимать энергию от сигнального хромофора в присутствии мишени и излучать свет. 43. Раствор для распознавания полинуклеотида по п.42, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель. 44. Раствор для распознавания полинуклеотида по п.41, дополнительно содержащий сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду. 45. Раствор для распознавания полинуклеотида по п.41, отличающийся тем, что сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель, который может поглощать энергию полихромофора в присутствии мишени и излучать свет. 46. Раствор для распознавания полинуклеотида по п.41, отличающийся тем, что сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель, который может принимать энергию от полихромофора в присутствии мишени и переносить энергию на второй сигнальный хромофор, конъюгированный с сенсорным полинуклеотидом, который затем излучает свет. 47. Набор для анализа образца на целевой полинуклеотид, включающий сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду;- 15007653 сигнальный хромофор; поликатионный полихромофор, который при возбуждении, оказавшись вблизи сигнального хромофора, способен переносить на него энергию, причм указанный сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение; и упаковку для хранения реагентов набора. 48. Набор по п.47, дополнительно содержащий второй сигнальный хромофор, который может принимать энергию от сигнального хромофора в присутствии мишени и излучать свет. 49. Набор по п.48, отличающийся тем, что второй сигнальный хромофор представляет собой специфичный в отношении полинуклеотида краситель. 50. Набор по п.47, дополнительно содержащий инструкции, приложенные к указанной упаковке, в которых описано, как применять компоненты набора для анализа образца на целевой полинуклеотид. 51. Комплекс для распознавания полинуклеотида, включающий сенсорный полинуклеотид, являющийся однонитевым и комплементарным целевому полинуклеотиду, причм указанный сенсорный полинуклеотид связан с сигнальным хромофором; поликатионный полихромофор, который при возбуждении способен переносить энергию на сигнальный хромофор, оказавшись вблизи него, причем указанный сенсорный полинуклеотид взаимодействует с полихромофором и при возбуждении полихромофора в отсутствие целевого полинуклеотида сигнальный хромофор может испускать световое излучение; и при возбуждении полихромофора в присутствии целевого полинуклеотида сигнальный хромофор испускает более сильное световое излучение. 52. Сигнальный комплекс, получаемый способом по п.1. 53. Комплекс по п.52, дополнительно содержащий второй сигнальный хромофор. 54. Комплекс, связанный с подложкой (субстратом), полученный способом по п.29. 55. Комплекс, связанный с подложкой (субстратом), по п.54, дополнительно содержащий второй сигнальный хромофор.
МПК / Метки
МПК: C07H 21/04, C07H 21/00, C12Q 1/68, C07H 21/02
Метки: светособирающих, полинуклеотидов, полихромофоров, помощью, обнаружения, композиции, анализа, способы
Код ссылки
<a href="https://eas.patents.su/18-7653-sposoby-i-kompozicii-obnaruzheniya-i-analiza-polinukleotidov-s-pomoshhyu-svetosobirayushhih-polihromoforov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы и композиции обнаружения и анализа полинуклеотидов с помощью светособирающих полихромофоров</a>
Предыдущий патент: Способ обнаружения и анализа полинуклеотидов с помощью светособирающих полихромофоров
Следующий патент: Способ лечения закупорки стационарного катетера с использованием фибринолитических металлопротеиназ
Случайный патент: Способ отделения и извлечения ngl из углеводородных потоков












