Еро-имитирующие миметические антитела человека с центральной шарнирной областью, композиции, способы и применения
Номер патента: 9377
Опубликовано: 28.12.2007
Авторы: Гхрайеб Джон, Несспор Томас К., Хивнер Джордж, Найт Дэвид М., Скэллон Бернард, Хуан Чичи
Формула / Реферат
1. Нуклеиновая кислота по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащая по меньшей мере один полинуклеотид, кодирующий по меньшей мере одну аминокислотную последовательность SEQ ID NO:82 и 84, или полинуклеотид, комплементарный указанной аминокислотной последовательности.
2. Нуклеиновая кислота по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащая по меньшей мере один полинуклеотид, кодирующий по меньшей мере одну аминокислотную последовательность SEQ ID NO:83 и 85-89, или полинуклеотид, комплементарный указанной аминокислотной последовательности.
3. Нуклеиновая кислота по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащая по меньшей мере один полинуклеотид, кодирующий по меньшей мере одну аминокислотную последовательность SEQ ID NO:1-30, или полинуклеотид, комплементарный указанной аминокислотной последовательности.
4. Нуклеиновая кислота по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащая по меньшей мере один полинуклеотид, кодирующий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный ЕРО-имитирующий пептид, L означает линкерную последовательность, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина, m, n, о, р, q, r и s могут независимо означать целое число от 0, 1 или 2 до 10.
5. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий все смежные аминокислоты по меньшей мере одной SEQ ID NO:82 и 84.
6. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий все смежные аминокислоты по меньшей мере одной SEQ ID NO:83 и 85-89.
7. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий все смежные аминокислоты по меньшей мере одной SEQ ID NO:1-30.
8. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
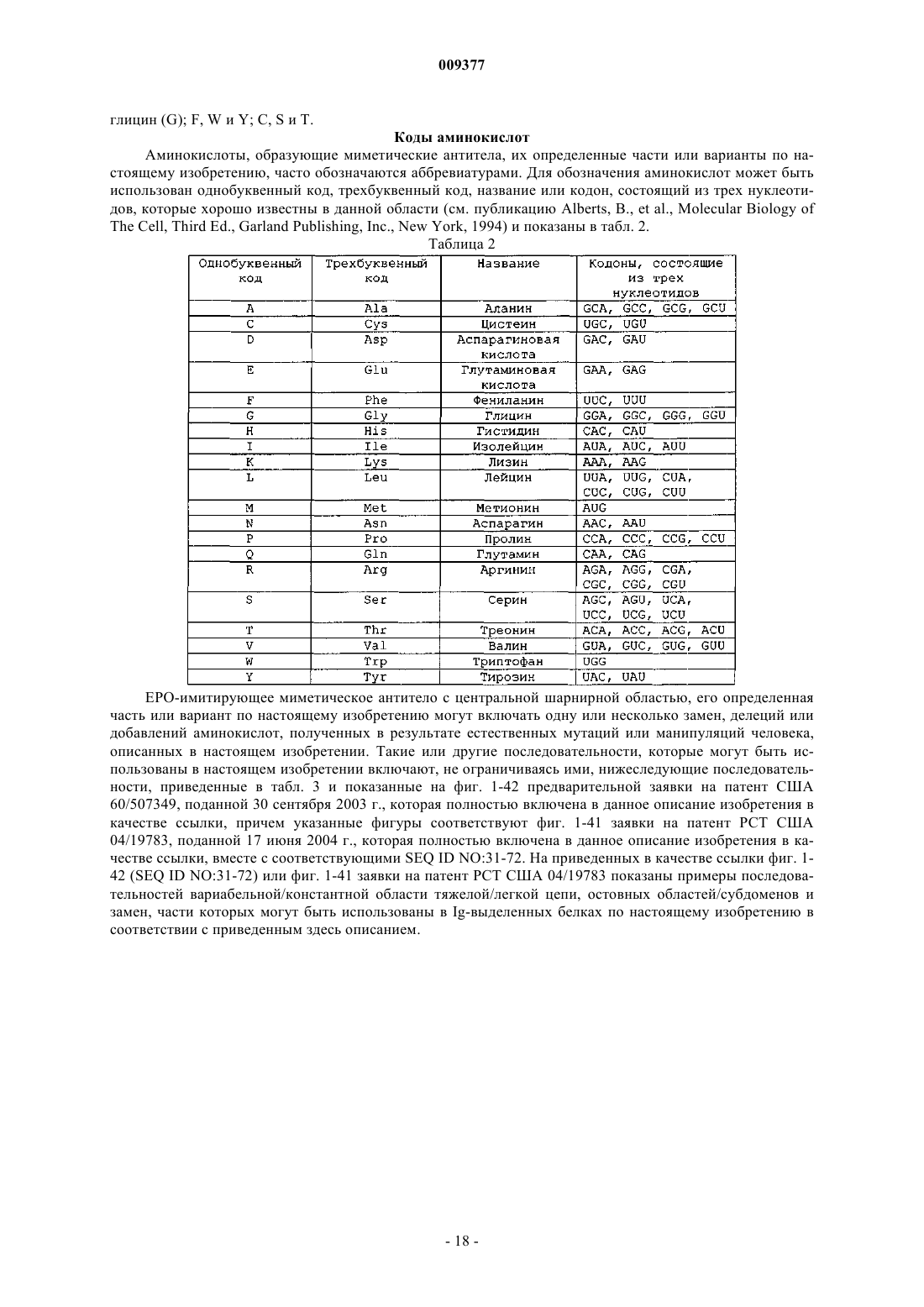
где V означает QIQ, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L содержит GS, GGGS (SEQ ID NO:73) или GSGGGS (SEQ ID NO:74), Н означает СРРСР (SEQ ID NO:75), СН2 означает

CH3 означает
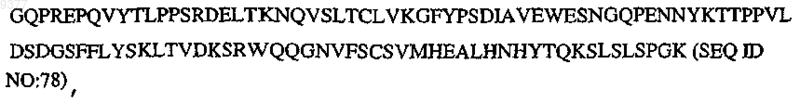
и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
9. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
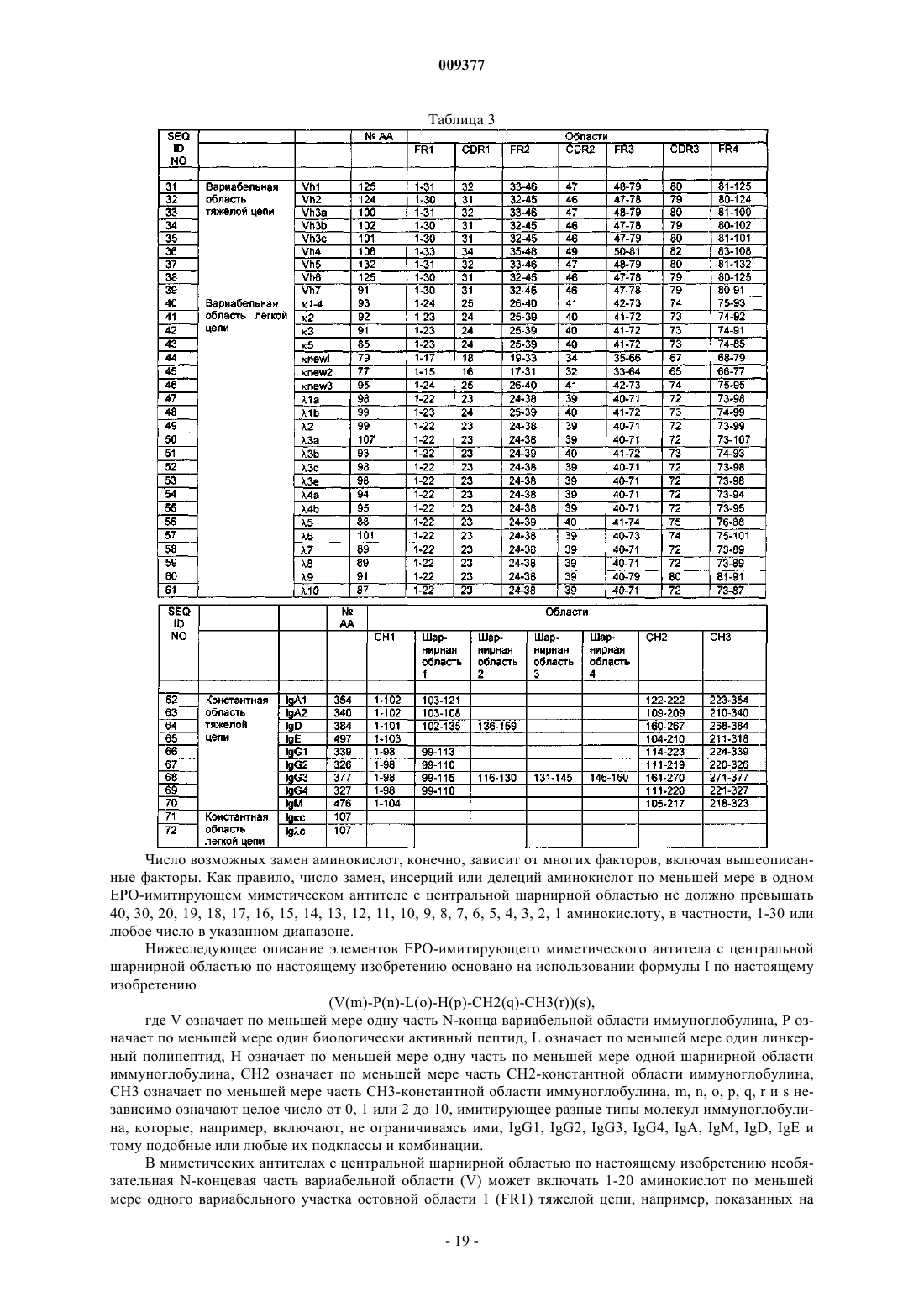
где V означает QIQ, P означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L содержит GS, GGGS (SEQ ID NO:73) или GSGGGS (SEQ ID NO:74), Н означает СРРСР (SEQ ID NO:75), СН2 означает
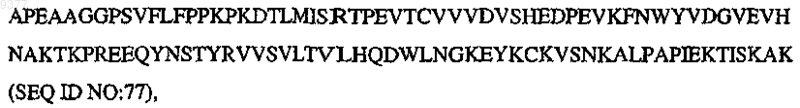
CH3 означает

и m, n, o, p, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
10. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r)) (s),
где V означает QIQ, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L содержит GS, GGGS (SEQ ID NO:73) или GSGGGS (SEQ ID NO:74), Н означает СРРСР (SEQ ID NO:75), СН2 означает

CH3 означает
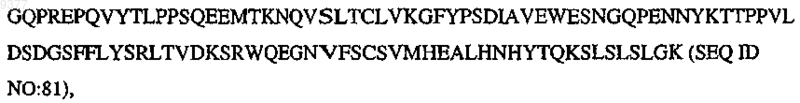
и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
11. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает QIQ, P означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L содержит GS, GGGS (SEQ ID NO:73) или GSGGGS (SEQ ID NO:74), Н означает СРРСР (SEQ ID NO:75), СН2 означает

CH3 означает
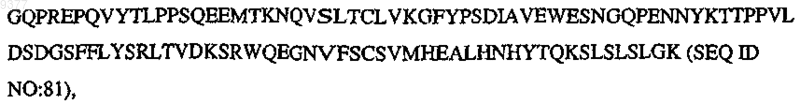
и m, n, o, p, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
12. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает N-концевую часть вариабельной области человека, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает
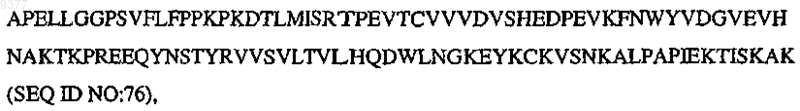
CH3 означает
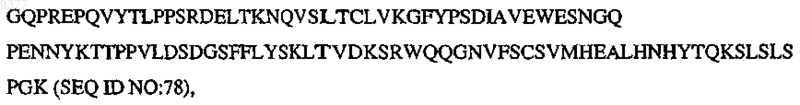
и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
13. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает N-концевую часть вариабельной области человека, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает

CH3 означает

и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
14. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает N-концевую часть вариабельной области человека, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает
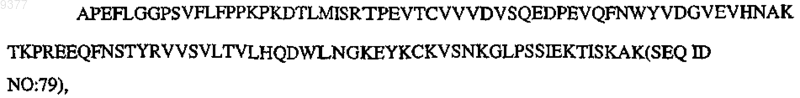
CH3 означает
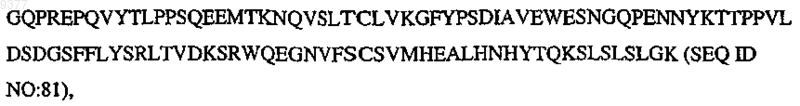
и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
15. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s)
где V означает N-концевую часть вариабельной области человека, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает

CH3 означает
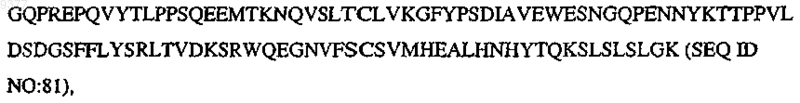
и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
16. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает QIQ, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
17. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный ЕРО-имитирующий пептид, L содержит GS, GGGS (SEQ ID NO:73) или GSGGGS (SEQ ID NO:74), Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
18. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный ЕРО-имитирующий пептид, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
19. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный ЕРО-имитирующий пептид, L означает линкерный полипептид, Н означает СРРСР (SEQ ID NO:75), СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
20. Полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий полипептид формулы (I)
(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r))(s),
где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный пептид, выбранный из SEQ ID NO:1-30, L означает линкерный полипептид, Н означает по меньшей мере часть центрального шарнирного участка вариабельной области иммуноглобулина, СН2 означает по меньшей мере часть СН2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина и m, n, о, р, q, r, s независимо означают целое число от 0, 1 или 2 до 10.
21. Нуклеиновая кислота ЕРО-имитирующего миметического антитела с центральной шарнирной областью или полипептид ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по одному из пп.1-20, причем указанный полипептид обладает по меньшей мере одной активностью по меньшей мере одного полипептида Р.
22. Антиидиотипическое моноклональное или поликлональное антитело, слитый белок или его фрагмент, которые специфически связываются с полипептидом по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по одному из пп.5-20.
23. Нуклеиновая кислота ЕРО-имитирующего миметического антитела с центральной шарнирной областью, кодирующая полипептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью или антитело к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью по любому из пп.1-20.
24. Вектор для ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащий по меньшей мере одну выделенную нуклеиновую кислоту по п.23.
25. Клетка-хозяин для ЕРО-имитирующего миметического антитела с центральной шарнирной областью, содержащая выделенную нуклеиновую кислоту по п.23.
26. Клетка-хозяин для ЕРО-имитирующего миметического антитела с центральной шарнирной областью по п.23, которая является по меньшей мере одной клеткой-хозяином, выбранной из COS-1, COS-7, НЕK293, ВНK21, СНО, BSC-1, Hep G2, 653, SP2/0, 293, NSO, DG44 CHO, CHO K1, HeLa, миеломных или лимфомных клеток либо их любых производных, иммортализованной или трансформированной клетки.
27. Способ получения полипептида по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью или антитела к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, предусматривающий трансляцию нуклеиновой кислоты по п.23 в условиях in vitro, in vivo или in situ, в результате чего ЕРО-имитирующее миметическое антитело с центральной шарнирной областью или антитело экспрессируется в обнаруживаемых или выделяемых количествах.
28. Композиция, содержащая нуклеиновую кислоту по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, полипептид ЕРО-имитирующего миметического антитела с центральной шарнирной областью или антитело к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью по меньшей мере по любому одному из пп.1-20.
29. Композиция по п.28, которая дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
30. Композиция по п.28, дополнительно содержащая по меньшей мере одну композицию, содержащую терапевтически эффективное количество по меньшей мере одного соединения, композиции или полипептида, выбранных из по меньшей мере одного из детектируемой метки или репортера, антагониста TNF, дезинфицирующего средства, средства для сердечно-сосудистой системы (CV), средства для центральной нервной системы (CNS), средства для автономной нервной системы (ANS), средства для дыхательных путей, средства для желудочно-кишечного тракта (GI), гормонального средства, средства для водно-солевого баланса, гематологического средства, противоопухолевого средства, иммуномодулирущего средства, глазного, ушного или назального средства, местнодействующего средства, средства от нарушения питания, цитокина или антагониста цитокина.
31. Композиция по п.28, по меньшей мере в одной форме, выбранной из жидкой, газообразной или сухой формы, раствора, смеси, суспензии, эмульсии или коллоида, лиофилизованного препарата или порошка.
32. Способ диагностики или лечения состояния, ассоциированного с лигандом ЕРО, в клетке, ткани, органе или у животного, предусматривающий:
(а) контактирование или введение композиции, содержащей эффективное количество нуклеиновой кислоты, антитела или полипептида по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по одному из пп.1-20, с или в указанную клетку, ткань, орган или животному.
33. Способ по п.32, в котором указанное эффективное количество составляет 0,001-50 мг антитела к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью; 0,000001-500 мг указанного ЕРО-имитирующего миметического антитела с центральной шарнирной областью или 0,0001-100 мкг нуклеиновой кислоты указанного ЕРО-имитирующего миметического антитела с центральной шарнирной областью на 1 кг указанных клеток, ткани, органа или животного.
34. Способ по п.32, в котором указанное контактирование или введение осуществляют по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, внутритолстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, интраренального, интраретинального, спинно-мозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного, в место поражения, в виде болюса, вагинального, ректального, трансбуккального, подъязычного, назального или трансдермального введения.
35. Способ по п.32, дополнительно предусматривающий введение до, одновременно или после вышеуказанного (а) контактирования или введения по меньшей мере одной композиции, содержащей эффективное количество по меньшей мере одного соединения или полипептида, выбранного из по меньшей мере одного из детектируемой метки или репортера, антагониста TNF, дезинфицирующего средства, средства для сердечно-сосудистой системы (CV), средства для центральной нервной системы (CNS), средства для автономной нервной системы (ANS), средства для дыхательных путей, средства для желудочно-кишечного тракта (GI), гормонального средства, средства для водно-солевого баланса, гематологического средства, противоопухолевого средства, иммуномодулирущего средства, глазного, ушного или назального средства, местнодействующего средства, средства от нарушения питания, цитокина или антагониста цитокина.
36. Устройство, содержащее полипептид, антитело или нуклеиновую кислоту по меньшей мере одного выделенного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по одному из пп.1-20, где указанное устройство пригодно для контактирования или введения указанного полипептида, антитела или нуклеиновой кислоты по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью при помощи по меньшей мере одного способа, выбранного из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, внутритолстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, интраренального, интраретинального, спинно-мозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного, в место поражения, в виде болюса, вагинального, ректального, трансбуккального, подъязычного, назального или трансдермального введения.
37. Готовое изделие для фармацевтического или диагностического применения при лечении человека, которое включает в себя упаковочный материал и емкость, содержащую полипептид, антитело или нуклеиновую кислоту по меньшей мере одного выделенного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по любому одному из пп.1-20.
38. Готовое изделие по п.32, в котором указанная емкость является компонентом парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, внутритолстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, интраренального, интраретинальное, спинномозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного, в место поражения, в виде болюса, вагинального, ректального, трансбуккального, подъязычного, назального или трансдермального устройства или системы доставки.
39. Способ получения полипептида, антитела или нуклеиновой кислоты по меньшей мере одного выделенного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере по одному из пп.1-20, который включает в себя обеспечение по меньшей мере одной клетки-хозяина, трансгенного животного, трансгенного растения, растительной клетки, способных экспрессировать в обнаруживаемых или выделяемых количествах указанный полипептид, антитело или нуклеиновую кислоту.
40. Полипептид, антитело или нуклеиновая кислота по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, полученные способом по п.39.
Текст
009377 Область техники, к которой относится изобретение Настоящее изобретение относится к ЕРО-имитирующим миметическим антителам млекопитающих с центральной шарнирной областью, их определенным частям и вариантам, специфичным к биологически активным белкам, фрагментам или лигандам; к нуклеиновым кислотам, кодирующим ЕРОимитирующие миметические антитела с центральной шарнирной областью, и комплементарным нуклеиновым кислотам; к клеткам-хозяевам и способам получения и применения указанных веществ, включая терапевтические препараты, способы введения и устройства. Уровень техники Рекомбинантные белки являются развивающимся классом терапевтических агентов. Открытие таких рекомбинантных терапевтических агентов стимулировало создание белковых препаратов и их химическую модификацию. Такие модификации могут усиливать лечебную пригодность терапевтических белков, например, в результате увеличения периода полувыведения (например, путем блокирования воздействия, оказываемого протеолическими ферментами), усиления биологической активности или сокращения нежелательных побочных эффектов. Одной такой модификацией является использование фрагментов иммуноглобулина, слитых с рецепторными белками, такими как энтерацепт. Кроме того, были созданы терапевтические белки с использованием Fc-домена для достижения более продолжительного периода полувыведения или введения таких функций как связывание с рецептором Fc, связывание с белком А и фиксация комплемента. Одной специфической и жизненно важной функцией гемопоэтической системы млекопитающего является продуцирование эритроцитов или красных кровяных телец, которые переносят кислород в разные ткани организма животного. Процесс продуцирования эритроцитов ("эритропоэз") происходит постоянно на протяжении всей жизни животного для восполнения разрушенных эритроцитов. Типичное красное кровяное тельце имеет относительно короткую продолжительность жизни, обычно от 100 до 120 дней. Эритропоэз представляет собой точно регулируемый физиологический механизм, благодаря которому образуется достаточное число эритроцитов, необходимых для оксигенации тканей, но не слишком большое, чтобы воспрепятствовать кровотоку. В настоящее время известно, что эритропоэз регулируется главным образом полипептидом, именуемым эритропоэтин (ЕРО), который является кислым гликопротеином. Эритропоэтин продуцируется в результате экспрессии однокопийного гена, локализованного в хромасоме млекопитающего. Аминокислотная последовательность рекомбинантного ЕРО человека ("rHuEPO"), по существу, идентична аминокислотной последовательности ЕРО, полученной из органов мочевыведения человека. Однако гликозилирование rHuEPO отличается от гликозилирования мочевого ЕРО и сывороточного ЕРО человека. У здорового млекопитающего ЕРО присутствует в плазме крови в очень низких концентрациях, так как ткани в достаточной степени снабжаются кислородом, существующим количеством циркулирующих эритроцитов. Присутствующий ЕРО стимулирует продуцирование новых эритроцитов взамен утраченных в процессе старения. Кроме того, продуцирование ЕРО стимулируется в условиях гипоксии, когда насыщение кислородом тканей организма опускается ниже нормального физиологического уровня, несмотря на достаточное кровоснабжение тканей. Гипоксия может быть вызвана кровотечением, разрушением эритроцитов вследствие облучения, разными типами анемии, большой высотой или длительной потерей сознания. В отличие от этого при превышении числа красных кровяных телец в кровотоке, необходимого для нормальной оксигенации тканей, продуцирование ЕРО уменьшается. Однако некоторые заболевания вызывают аномальный эритропоэз. Рекомбинантный ЕРО человека(rHuEPO) применяется в лечебных целях в ряде стран. Управление по контролю за продуктами и лекарствами США (FDA) утвердило применение rHuEPO для лечения анемии, обусловленной последней стадией болезни почек. Субъекты, подвергаемые гемодиализу для лечения указанного заболевания, обычно страдают сильной анемией, вызываемой разрушением и преждевременной гибелью эритроцитов в результате выполнения диализа. ЕРО применяют также при лечении анемии других типов. Например, при помощи ЕРО можно лечить анемию, вызванную химиотерапией, анемию, обусловленную миелодисплазией, анемию, обусловленную разными врожденными заболеваниями, СПИД-ассоциированную анемию и анемию, обусловленную преждевременным развитием. Кроме того, ЕРО может иметь важное значение в других случаях, например, для более быстрого восстановления нормального гематокрита у субъектов,которым был трансплантирован костный мозг, при подготовке субъектов к аутогемотрансфузии или для оказания помощи субъектам, страдающим заболеваниями, обусловленными повышенным содержанием железа. Эритропоэтин (ЕРО) является гликопротеиновым гормоном, состоящим из 165 аминокислот и четырех углеводных цепей, который действует в качестве основного регулятора эритропоэза в результате связывания со специфическим рецептором на поверхности клеток-предшественников эритроцитов. Указанное связывание сигнализирует о необходимости их пролиферации и дифференцировки в зрелые красные кровяные тельца. Рецептор эритропоэтина представляет собой гликопротеин, состоящий из 484 аминокислот, с высоким сродством к эритропоэтину. Для рецептора эритропоэтина лиганд-индуцированная гомодимеризация может быть одним из главных событий, вызывающих его активацию. Эритропоэтин имеет относительно короткий период полувыведения. Внутривенно введенный эритропоэтин удаляется со скоростью, сопоставимой с кинетикой первого порядка, при этом период полу-1 009377 выведения из кровотока составляет примерно 3-4 ч у субъектов с CRF. В диапазоне лечебных доз обнаруживаемые уровни эритропоэтина в плазме сохраняются в течение по меньшей мере 24 ч. При подкожном введении эритропоэтина максимальные уровни в сыворотке достигаются в течение 5-24 ч, после чего происходит медленное уменьшение концентраций. Низкомолекулярные пептидные миметики эритропоэтина были обнаружены несколькими группами ученых в результате скрининга рандомизированных пептидных библиотек, отображаемых на фаге, с целью определения сродства к рецептору эритропоэтина. Указанные последовательности не имеют гомологии с эритропоэтином. При выполнении функциональных анализов было установлено, что некоторые из указанных пептидов обладают активностью, которая составляет лишь 1/100000 долю активности рекомбинантного эритропоэтина. Хотя было предпринято несколько попыток повысить активность указанных пептидов путем получения ковалентных димеров или многомеров пептидных миметиков, указанные соединения по-прежнему являются в 1000-10000 раз менее активными, чем эритропоэтин, на молярной основе и имеют очень короткие периоды полувыведения, что делает их непригодными для использования в качестве лечебных средств. Таким образом, существует потребность в усовершенствованных и/или модифицированных вариантах терапевтических белков ЕРО, которые позволили бы решить одну из указанных проблем или другие проблемы, известные в данной области. Сущность изобретения Настоящее изобретение относится к ЕРО-имитирующим миметическим антителам человека с центральной шарнирной областью, которые включают в себя модифицированные иммуноглобулины, продукты расщепления и их другие определенные части и варианты, а также к композициям, содержащим ЕРО-имитирующие миметические антитела с центральной шарнирной областью, к кодирующим или комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам, композициям, препаратам, устройствам, трансгенным животным, трансгенным растениям, к способам получения и применения веществ, описанным в настоящем изобретении и/или ранее известным в данной области. Настоящее изобретение относится также по меньшей мере к одному выделенному ЕРОимитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту, описанному в настоящем изобретении и/или известному в данной области. ЕРОимитирующее миметическое антитело с центральной шарнирной областью может необязательно содержать по меньшей мере одну CH3-область, которая непосредственно связана по меньшей мере с одной СН 2-областью, которая непосредственно связана по меньшей мере с одной частью по меньшей мере одной шарнирной области или ее фрагментом (Н), которая непосредственно связана с необязательной линкерной последовательностью (L), которая непосредственно связана по меньшей мере с одним ЕРОимитирующим терапевтическим пептидом (Р), который дополнительно необязательно связан по меньшей мере с частью по меньшей мере одной вариабельной последовательности антитела (V). В предпочтительном варианте осуществления изобретения конструкция CH3-СН 2-шарнирная область-линкертерапевтический пептид может быть спарена с необязательной N-концевой последовательностью антитела при помощи ассоциативной или ковалентной связи, которая включает, не ограничиваясь ими, по меньшей мере одну дисульфидную связь Cys-Cys или по меньшей мере одну СН 4-область или другую последовательность иммуноглобулина. В одном варианте осуществления изобретения ЕРОимитирующее миметическое антитело с центральной шарнирной областью имеет формулу (I)V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r(s),где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный ЕРО-имитирующий полипептид, L означает по меньшей мере одну линкерную последовательность, Н означает по меньшей мере одну часть шарнирной области иммуноглобулина, СН 2 означает по меньшей мере часть СН 2-константной области иммуноглобулина, CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина, m, n, о, р, q, r и s могут независимо означать целое число от 0, 1 или 2 до 10, имитирующее разные типы молекул иммуноглобулина, которые, например, включают, не ограничиваясь ими IgG1, IgG2, IgG3, IgG4 IgA1, IgA2,IgM, IgD, IgE, любые их подклассы и тому подобные варианты или любую их комбинацию. Таким образом, ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению имитирует по меньшей мере часть структуры антитела или иммуноглобулина с присущими ему свойствами или функциями, позволяя получить терапевтический пептид, обладающий естественными или приобретенными in vitro, in vivo или in situ свойствами или активностями. Разные части антитела и терапевтического пептида по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью могут изменяться в соответствии с приведенным здесь описанием изобретения и данными, известными в данной области. Одним объектом настоящего изобретения являются выделенные молекулы нуклеиновых кислот,включающие в себя комплементарную последовательность, обладающую значительной идентичностью или гибридизирующую с полинуклеотидом, кодирующим специфические миметические антитела, их определенные части или варианты, содержащие по меньшей мере одну определенную последовательность, домен, ее часть или вариант. Настоящее изобретение дополнительно относится к рекомбинантным-2 009377 векторам, содержащим по меньшей мере одну вышеуказанную выделенную молекулу нуклеиновой кислоты ЕРО-имитирующего миметического антитела с центральной шарнирной областью, к клеткамхозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот ЕРО-имитирующего миметического антитела с центральной шарнирной областью, векторов и/или клеток-хозяев. По меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению имитирует связывание части Р миметического антитела по меньшей мере с одним лигандом или обладает биологической активностью по меньшей мере одного белка, субъединицы, фрагмента, части или любой его комбинации. Настоящее изобретение относится также по меньшей мере к одному выделенному ЕРОимитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту, описанному в настоящем изобретении и/или известному в данной области, которое обладает по меньшей мере одной активностью, которая включает, не ограничиваясь ими, известные биологические активности по меньшей мере одного биологически активного пептида или полипептида, соответствующего части Р в формуле I. Таким образом, ЕРО-имитирующее миметическое антитело с центральной шарнирной областью может быть исследовано в отношении соответствующей активности известными методами, такими как, например, метод нейтрализации активности белка или его фрагмента. Настоящее изобретение относится также по меньшей мере к одной композиции, содержащей (а) нуклеиновую кислоту, кодирующую по меньшей мере одно выделенное ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, и/или ЕРОимитирующее миметическое антитело с центральной шарнирной областью, описанное в настоящем изобретении; и (b) приемлемый носитель или разбавитель. Носитель или разбавитель может быть необязательно фармацевтически приемлемым в соответствии с известными методами. Указанная композиция может дополнительно необязательно содержать по меньшей мере еще одно соединение, белок или композицию. Настоящее изобретение относится также по меньшей мере к одному способу экспрессии по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта в клетке-хозяине, предусматривающему культивирование клеткихозяина методами, описанными в настоящем изобретении и/или известными в данной области, в условиях, в которых по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант экспрессируется в обнаруживаемых и/или выделяемых количествах. Настоящее изобретение дополнительно относится по меньшей мере к одному ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту в способе или композиции, когда введение осуществляют в терапевтически эффективном количестве для модуляции, лечения или ослабления симптомов по меньшей мере одного заболевания костей и суставов,сердечно-сосудистого заболевания, заболевания зубов или полости рта, дерматологического заболевания, заболевания уха, носа или горла, эндокринного заболевания или нарушения обмена веществ, желудочно-кишечного заболевания, гинекологического заболевания, заболевания печени или желчного пузыря, послеродового заболевания, гематологического заболевания, иммунологического или аллергического заболевания, инфекционного заболевания, костно-мышечного заболевания, онкологического заболевания, неврологического заболевания, заболевания, связанного с питанием, офтальмологического заболевания, педиатрического заболевания, заболевания, связанного с отравлением, психиатрического заболевания, заболевания почек, заболевания легких или любого другого известного заболевания (см., например, публикацию The Merck Manual, 17th ed., Merck Research Laboratories, Merck and Co., Whitehouse Station, NJ (1999), которая полностью включена в данное описание изобретения в качестве ссылки) и при необходимости во многих других случаях, которые включают, не ограничиваясь ими, введение до, после или во время лечения соответствующего заболевания, известного в данной области. Настоящее изобретение дополнительно относится по меньшей мере к одному ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту,применяемому при введении в терапевтически эффективном количестве для модуляции, лечения или ослабления симптомов по меньшей мере одного иммунного, сердечно-сосудистого, инфекционного, злокачественного и/или неврологического заболевания клетки, ткани, органа, животного или субъекта и/или при необходимости во многих других случаях, которые включают, не ограничиваясь ими, введение до,после или во время лечения соответствующего заболевания, известного в данной области и/или описанного в настоящем изобретении. Настоящее изобретение относится также по меньшей мере к одной композиции, устройству и/или способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта по настоящему изобретению. Настоящее изобретение дополнительно относится по меньшей мере к одному антиидиотипическому антителу по меньшей мере к одному ЕРО-имитирующему миметическому антителу с центральной-3 009377 шарнирной областью по настоящему изобретению. Указанное антиидиотипическое антитело представляет собой любую белок- или пептидсодержащую молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, которая содержит, не ограничиваясь ими, по меньшей мере один гипервариабельный участок (CDR) тяжелой или легкой цепи либо ее лиганд-связывающую часть, вариабельную область тяжелой или легкой цепи, константную область тяжелой или легкой цепи, остовную область или любую ее часть, которая конкурентно связывается с областью связывания рецептора ЕРО по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению. Такие идиотипические антитела по настоящему изобретению могут быть выделены у любых млекопитающих, к которым относятся, не ограничиваясь ими, человек, мыши, кролики,крысы, грызуны, приматы и тому подобные. Настоящее изобретение относится также по меньшей мере к одной выделенной молекуле нуклеиновой кислоты, включающей в себя комплементарную последовательность или последовательность, гибридизирующую с полинуклеотидом, кодирующим по меньшей мере одно антиидиотипическое антитело к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, которое включает одну определенную последовательность, домен, его часть или вариант. Настоящее изобретение далее относится к рекомбинантным векторам, содержащим молекулы нуклеиновых кислот, кодирующих указанное антиидиотипическое антитело к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, к клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или применения таких нуклеиновых кислот антиидиотипического антитела, векторов и/или клеток-хозяев. Настоящее изобретение относится также по меньшей мере к одному способу экспрессии по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью или антиидиотипического антитела к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, предусматривающему культивирование клетки-хозяина, как описано здесь, в условиях, в которых по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью или антиидиотипическое антитело экспрессируется в обнаруживаемых и/или выделяемых количествах. Настоящее изобретение относится также по меньшей мере к одной композиции, содержащей (а) выделенную нуклеиновую кислоту, кодирующую ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, и/или ЕРО-имитирующее миметическое антитело с центральной шарнирной областью; и (b) приемлемый носитель или разбавитель. Носитель или разбавитель может быть необязательно фармацевтически приемлемым известным носителем или разбавителем. Указанная композиция может дополнительно необязательно содержать по меньшей мере еще одно соединение, белок или композицию. Настоящее изобретение далее относится по меньшей мере к одному способу применения ЕРОимитирующего миметического антитела с центральной шарнирной областью или содержащей его композиции для введения терапевтичесвки эффективного количества с целью модуляции или лечения по меньшей мере одного ассоциированного с белком заболевания клетки, ткани, органа, животного или субъекта до, после или во время соответствущего заболевания, известного в данной области и/или описанного в настоящем изобретении. Настоящее изобретение относится также по меньшей мере к одной композиции, устройству и/или способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению. Настоящее изобретение далее относится по меньшей мере к одному способу применения ЕРОимитирующего миметического антитела с центральной шарнирной областью или содержащей его композиции для диагностики по меньшей мере одного ЕРО-обусловленного заболевания клетки, ткани, органа,животного или субъекта до, после или во время соответствующего заболевания, известного в данной области и/или описанного в настоящем изобретении. Настоящее изобретение относится также по меньшей мере к одной композиции, устройству и/или способу доставки для диагностики по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению. В одном аспекте настоящее изобретениеобеспечивает по меньшей мере одно выделенное ЕРОимитирующее миметическое антитело с центральной шарнирной областью, которое содержит по меньшей мере одну область Р(n), содержащую по меньшей мере часть по меньшей мере одной из SEQ IDNO:1-30, например, приведенных в нижеследующей табл. 1 или необязательно имеющих одну или несколько замен, делеций или инсерций, описанных в настоящем изобретении или известных в данной области. Другим аспектом настоящего изобретения является по меньшей мере одно выделенное ЕРОимитирующее миметическое антитело с центральной шарнирной областью, которое специфически связывается по меньшей мере с одним эпитопом, включающим в себя по меньшей мере 1-3 по меньшей мере одного лиганда или область связывания, где лиганд связывает по меньшей мере часть одной из SEQID NO:1-30, приведенных в нижеследующей табл. 1 или необязательно имеющих одну или несколько-4 009377 замен, делеций или инсерций, описанных в настоящем изобретении или известных в данной области. По меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью далее может быть одним из связывающего белка, обладающего сродством, выбранным из значений,равных по меньшей мере 10-9 М, по меньшей мере 10-10 М, по меньшей мере 10-11 М или по меньшей мере 10-12 М, который, по существу, нейтрализует по меньшей мере одну активность по меньшей мере одного белка или его части. Настоящее изобретение относится также к выделенной нуклеиновой кислоте,кодирующей по меньшей мере одно выделенное ЕРО-имитирующее миметическое антитело человека с центральной шарнирной областью; к вектору, несущему выделенную нуклеиновую кислоту, и/или к прокариотической или эукариотической клетке-хозяину, содержащей выделенную нуклеиновую кислоту. Клетка-хозяин может быть необязательно выбрана из COS-1, COS-7, НЕК 293, ВНК 21, СНО, BSC-1, HepG2, 653, SP2/0, 293, HeLa, миеломных или лимфомных клеток, а также из любых производных, иммортализованных или трансформированных указанных клеток. Настоящее изобретение относится также к способу получения по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, предусматривающему трансляцию нуклеиновой кислоты, кодирующей ЕРОимитирующее миметическое антитело с центральной шарнирной областью, в условиях in vitro, in vivo или in situ, в которых ЕРО-имитирующее миметическое антитело с центральной шарнирной областью экспрессируется в обнаруживаемых или выделяемых количествах. Настоящее изобретение относится также к композиции, содержащей по меньшей мере одно выделенное ЕРО-имитирующее миметическое антитело человека с центральной шарнирной областью и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Указанная композиция может далее необязательно содержать эффективное количество по меньшей мере одного соединения или белка, выбранного по меньшей мере из одного из детектируемой метки или репортера, дезинфицирующего средства, средства для сердечно-сосудистой системы (CV), средства для центральной нервной системы (CNS), средства для автономной нервной системы (ANS), средства для дыхательных путей, средства для желудочно-кишечного тракта (GI), гормонального средства, средства для водно-солевого баланса,гематологического средства, противоопухолевого средства, иммуномодулирующего средства, глазного,ушного или назального средства, местнодействующего средства, средства от нарушения питания, антагониста TNF, противоревматического средства, миорелаксанта, наркотического лекарственного средства,нестероидного противовоспалительного средства (NSAID), аналгетика, анестетика, седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства, антипсориазного средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонозаменителя, фармацевтического средства для лучевой терапии, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, агониста бета-рецепторов, ингалируемого стероида, эпинефрина или его аналога, цитокина или антагониста цитокина. Настоящее изобретение далее относится к антиидиотипическому антителу или его фрагменту, которые специфически связывают по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению. Настоящее изобретение относится также к способу диагностики или лечения заболевания клетки,ткани, органа или животного, предусматривающему:(а) контактирование или введение композиции, содержащей эффективное количество по меньшей мере одного выделенного ЕРО-имитирующего миметического антитела человека с центральной шарнирной областью по настоящему изобретению, с или в клетку, ткань, орган или животному. Указанный способ может далее необязательно включать использование композиции в эффективном количестве, равном 0,001-50 мг/кг клеток, ткани, органа или животного. Указанный способ может далее необязательно включать контактирование или введение, осуществляемое по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, толстокишечного, интрацервикального,внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного,интраректального, интраренального, интраретинального, спинномозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного введения, в виде болюса, вагинального, ректального,трансбуккального, подъязычного, назального или трансдермального введения. Указанный способ может далее необязательно включать введение до, одновременно или после (а) контактирование или введение по меньшей мере одной композиции, содержащей эффективное количество по меньшей мере одного соединения или белка, выбранного из по меньшей мере одного из детектируемой метки или репортера, дезинфицирующего средства, средства для сердечно-сосудистой системы (CV), средства для центральной нервной системы (CNS), средства для автономной нервной системы (ANS), средства для дыхательных путей, средства для желудочно-кишечного тракта (GI), гормонального средства, средства для водносолевого баланса, гематологического средства, противоопухолевого средства, иммуномодулирущего средства, глазного, ушного или назального средства, местнодействующего средства, средства от наруше-5 009377 ния питания, антагониста TNF, противоревматического средства, миорелаксанта, наркотического лекарственного средства, нестероидного противовоспалительного средства (NSAID), аналгетика, анестетика,седативного средства, местного анестетика, нервно-мышечного блокатора, антимикробного средства,антипсориазного средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонозаменителя, фармацевтического средства для лучевой терапии, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, агониста бета-рецепторов, ингалируемого стероида, эпинефрина или его аналога, цитокина или антагониста цитокина. Настоящее изобретение относится также к медицинскому устройству, содержащему по меньшей мере одно выделенное ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению, которое пригодно для контактирования или введения по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, толстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного,внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, интраренального, интраретинального, спинномозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного введения, в виде болюса, вагинального, ректального, трансбуккального, подъязычного, назального или трансдермального введения. Настоящее изобретение относится также к готовому изделию, предназначенному для фармацевтического или диагностического применения при лечении человека, которое включает упаковочный материал и емкость с раствором или лиофилизованной формой по меньшей мере одного ЕРО-имитирующего миметического антитела человека с центральной шарнирной областью по настоящему изобретению. Готовое изделие может необязательно включать емкость в качестве элемента устройства или системы для доставки лекарственного средства по меньшей мере одним способом, выбранным из парентерального,подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, внутричревного, внутримозжечкового, церебровентрикулярного, толстокишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, интраабдоминального, интраплеврального, интрапростатического, внутрилегочного, интраректального, интраренального, интраретинального, спинномозгового, внутрисуставного, интраторакального, внутриутробного, внутрипузырного введения, в виде болюса, вагинального, ректального, трансбуккального, подъязычного, назального или трансдермального введения. Настоящее изобретение относится также к способу получения по меньшей мере одного выделенного ЕРО-имитирующего миметического антитела человека с центральной шарнирной областью по настоящему изобретению, который включает в себя обеспечение клетки-хозяина, трансгенного животного,трансгенного растения или растительной клетки, способных экспрессировать ЕРО-имитирующее миметическое антитело с центральной шарнирной областью в выделяемых количествах. Настоящее изобретение далее относится по меньшей мере к одному ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, полученному вышеуказанным способом. Настоящее изобретение относится также по меньшей мере к одному способу экспрессии по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью или антиидиотипического антитела в клетке-хозяине, предусматривающему культивирование клетки-хозяина в вышеописанных условиях, в которых по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью экспрессируется в обнаруживаемых и/или выделяемых количествах. Настоящее изобретение далее относится к любому изобретению, рассмотренному в настоящем описании изобретения. Подробное описание изобретения Настоящее изобретение относится к выделенным, рекомбинантным и/или синтетическим миметическим антителам, их определенным частям или вариантам, а также к композициям и кодирующим молекулам нуклеиновых кислот, содержащим по меньшей мере один полинуклеотид, кодирующий по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью. Такие миметические антитела, их определенные части или варианты по настоящему изобретению включают специфические последовательности, домены, фрагменты и определенные варианты ЕРО-имитирующего миметического антитела с центральной шарнирной областью; объектами настоящего изобретения являются также способы получения и применения указанных нуклеиновых кислот и миметических антител,их определенных частей или вариантов, включая терапевтические композиции, способы и устройства. Настоящее изобретение относится также по меньшей мере к одному выделенному ЕРОимитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту, описанному в настоящем изобретении и/или известному в данной области. ЕРО-6 009377 имитирующее миметическое антитело с центральной шарнирной областью может необязательно содержать по меньшей мере одну CH3-область, которая непосредственно связана по меньшей мере с одной СН 2-областью, которая непосредственно связана по меньшей мере с одной шарнирной областью или ее фрагментом (Н), которая непосредственно связана с необязательной линкерной последовательностью(L), которая непосредственно связана по меньшей мере с одним терапевтическим пептидом (Р), который далее необязательно связан по меньшей мере с частью по меньшей мере одной вариабельной (V) последовательности антитела. В предпочтительном варианте осуществления изобретения ЕРО-имитирующее миметическое антитело с центральной шарнирной областью имеет формулу (I)V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r(s),где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный пептид, L означает полипептид, сообщающий структурную гибкость, позволяя миметическому антителу приобретать альтернативные ориентации и связывающие свойства, Н означает по меньшей мере часть шарнирного участка вариабельной области иммуноглобулина, СН 2 означает по меньшей мере часть СН 2-константной области иммуноглобулина,CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина, m, n, о, р, q, r и s независимо означают целое число от 0, 1 или 2 до 10, имитирующее разные типы молекул иммуноглобулина, которые, например, включают, не ограничиваясь ими IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgD, IgE и тому подобные или любую их комбинацию. Мономер, в котором m=1, может быть связан с другими мономерами при помощи ассоциативной или ковалентной связи, которая включает, не ограничиваясь ими,дисульфидную связь Cys-Cys или другую последовательность иммуноглобулина. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению имитирует структуру антитела с присущими ему свойствами и функциями, позволяя при этом получить терапевтический пептид, обладающий естественными или приобретенными in vitro, in vivo или in situ свойствами или активностями. Разные части антитела и терапевтического пептида по меньшей мере одного ЕРОимитирующего миметического антитела с центральной шарнирной областью могут изменяться в соответствии с приведенным здесь описанием изобретения и данными, известными в данной области. В используемом здесь значении термин "ЕРО-имитирующее миметическое антитело с центральной шарнирной областью", "часть ЕРО-имитирующего миметического антитела с центральной шарнирной областью", "фрагмент ЕРО-имитирующего миметического антитела с центральной шарнирной областью" и/или "вариант ЕРО-имитирующего миметического антитела с центральной шарнирной областью" и подобные миметики имеют или имитируют по меньшей мере одну лиганд-связывающую или биологическую активность по меньшей мере одного белка, в частности, лиганд-связывающую или биологическую активность in vitro, in situ и/или предпочтительно in vivo, характерную по меньшей мере для одной из SEQ ID NO:1-30. Например, приемлемое ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изоретению могут связывать по меньшей мере один лиганд белка, в том числе по меньшей мере один лиганд, рецептор, растворимый рецептор белка и тому подобные. Приемлемое ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант могут также модулировать, увеличивать, модифицировать, активировать передачу сигнала или другую измеряемую или детектируемую активность по меньшей мере одного рецептора белка. Миметические антитела, используемые в композициях и при осуществлении способов по настоящему изобретению, характеризуются приемлемым сродством связывания с лигандами или рецепторами белка и при этом необязательно и предпочтительно обладают низкой токсичностью. В частности, пригодным для настоящего изобретения является ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, в котором отдельные элементы, такие как часть вариабельной области, константная область (без CH1-части) и остовная область или любая их часть (например, часть J-, D- или Vучастков вариабельной области тяжелой или легкой цепи; по меньшей мере часть одной шарнирной области, константная область тяжелой или легкой цепи и тому подобные), отдельно и/или вместе необязательно и предпочтительно обладают низкой иммуногенностью. Миметические антитела, которые могут быть использованы в настоящем изобретении, необязательно характеризуются способностью оказывать лечебное действие в течение длительных периодов времени при достижении хорошего и даже превосходного ослабления симптомов заболевания и низкой токсичности. Низкая иммуногенность и/или высокое сродство, а также другие неизученные свойства, могут способствовать достижению хороших результатов терапевтического лечения. Термин "низкая иммуногенность" в используемом здесь значении означает усиление реакций НАМА, НАСА или НАНА менее чем примерно на 75% или предпочтительно менее чем примерно на 50, 45, 40, 35, 30, 35, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 и/или 1% у подвергаемых лечению субъектов и/или повышение низких титров у подвергаемых лечению субъектов (менее чем примерно на 300, предпочтительно менее чем примерно на 100 при измерении методом иммуноферментного анализа с двумя антигенами) (см., например, публикацию Elliott et al., Lancet 344:1125-1127 (1994.-7 009377 Полезность изобретения Выделенные нуклеиновые кислоты по настоящему изобретению можно использовать для получения по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его фрагмента или определенного варианта, которые могут воздействовать на клетку, ткань,орган или животное (включая млекопитающих и человека) с целью модуляции, лечения, облегчения состояния, профилактики возникновения или ослабления симптомов по меньшей мере одного ассоциированного с белком заболевания, выбранного из, не ограничиваясь этим, по меньшей мере иммунного нарушения или заболевания, сердечно-сосудистого нарушения или заболевание, инфекционного злокачественного и/или неврологического нарушения или заболевания, анемии, иммунного/аутоиммунного и/или ракового/инфекционного, а также других известных или изученных ассоциированных с белком состояний. Такой способ может содержать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, в клетку, ткань, орган, животному или субъекту, нуждающемуся в модуляции, лечении, облегчении состояния, профилактике возникновения или ослаблении симптомов, воздействий или механизмов. Эффективное количество может составлять от около 0,0001 до 500 мг/кг при однократном или многократном введении или количество, необходимое для достижения в сыворотке концентрации, равной 0,0001-5000 мкг/мл при однократном или многократном введении или любому эффективному значению в данном диапазоне, указанному в настоящем изобретении или известному в соответствующих областях. Ссылки Все публикации или патенты, приведенные в настоящем изобретении, полностью включены в данное описание изобретения в качестве ссылки, так как они показывают уровень техники в данной области во время создания настоящего изобретения и/или способствуют описанию и облегчают понимание настоящего изобретения. Публикации включают любые научные публикации, публикации патентов или любую другую информацию, опубликованную в средствах информации, включая все зарегистрированные публикации в электронном или печатном формате. Нижеследующие публикации полностью включены в настоящее описание изобретения в качестве ссылки: Ausubel, et al., ed., Current Protocols in Molecular Biology, John WileySons, be., NY, NY (1987-2003); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, a Laboratory Manual,Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John WileySons,Inc., NY (1994-2003); Colligan et al., Current Protocols in Protein Science, John WileySons, NY, NY,(1997-2003). Миметические антитела по настоящему изобретению ЕРО-имитирующее миметическое антитело с центральной шарнирной областью может необязательно содержать по меньшей мере одну CH3-область, которая непосредственно связана по меньшей мере с одной СН 2-областью, которая непосредственно связана по меньшей мере с одной частью по меньшей мере одного фрагмента шарнирной области (Н), включающей в себя, например, по меньшей мере одну центральную шарнирную область, которая непосредственно связана с необязательной линкерной последовательностью (L), которая непосредственно связана по меньшей мере с одним терапевтическим пептидом (Р), который далее необязательно связан по меньшей мере с частью по меньшей мере одной вариабельной последовательностью антитела (V). В предпочтительном варианте осуществления изобретения конструкция CH3-CH2-H-L-V спарена при помощи ассоциативной или ковалентной связи. Таким образом, ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению имитирует структуру антитела с присущими ему свойствами и функциями, позволяя при этом получить терапевтический пептид, обладающий присущими ему или приобретенными invitro, in vivo или in situ свойствами или активностями. Разные части антитела и терапевтического пептида по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению могут изменяться в соответствии с приведенным здесь описанием и данными, известными в данной области. Таким образом, миметические антитела по настоящему изобретению обладают по меньшей мере одним приемлемым свойством по сравнению с известными белками, которое включает, не ограничиваясь ими, более продолжительный период полувыведения, повышенную активность, более высокую удельную активность, увеличенную активность, более высокую или более низкую скорость выведения, выбранную или более приемлемую совокупность активностей, меньшую иммуногенность, более высокое качество или продолжительность по меньшей мере одного требуемого терапевтического действия, меньшее число побочных эффектов и тому подобные. Фрагменты миметических антител формулы (I) могут быть получены методами ферментативного расщепления, методами синтеза или методами рекомбинантных ДНК, известными в данной области и/или описанными в настоящем изобретении. Миметические антитела могут быть также получены в виде разных процессированных форм с использованием генов антитела, в которых вверху от естественного терминирующего сайта были введены один или несколько терминирующих кодонов. Разные части миме-8 009377 тических антител могут быть соединены вместе известными химическими методами или могут быть получены в виде смежного белка методами генной инженерии. Например, нуклеиновая кислота, кодирующая по меньшей мере одну из константных областей цепи антитела человека может быть экспрессирована с продуцированием смежного белка, предназначенного для использования в миметических антителах по настоящему изобретению. См., например, Ladner et al., патент США 4946778 и публикацию Bird,R.E. et al., Science, 242: 423-426 (1988), где описаны одноцепочечные антитела. В используемом здесь значении термин "миметическое антитело человека" означает антитело, в котором, по существу, каждая часть белка (например, ЕРО-имитирующий пептид, остовная область, CL-,CH-домены (например, CH2, CH3), шарнирная область, (VL, VH) ), как предполагается, является неиммуногенной для человека в результате выполнения лишь незначительных изменений или вариаций последовательностей. Такие изменения или вариации необязательно и предпочтительно сохраняют или уменьшают иммуногенность для человека по сравнению с немодифицированными антителами человека или миметическими антителами по настоящему изобретению. Таким образом, антитело человека и соответствующее ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению отличаются от химерного или гуманизированного антитела. Следует отметить, что антитело человека и ЕРО-имитирующее миметическое антитело с центральной шарнирной областью могут быть продуцированы животным, отличным от человека, или клеткой, способной экспрессировать гены иммуноглобулинов человека (например, тяжелую цепь и/или легкую цепь). Миметические антитела человека, которые являются специфичными по меньшей мере к одному лиганду или рецептору белка, могут быть созданы против соответствующего лиганда, например выделенного лиганда и/или рецептора или лиганда белка ЕРО или его части (включая синтетические молекулы,такие как синтетические пептиды). Такие миметические антитела получают известными методами для идентификации и исследования лиганд-связывающих областей или последовательностей по меньшей мере одного белка или его части. В предпочтительном варианте осуществления изобретения по меньшей мере одно ЕРОимитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант по настоящему изобретению продуцируют по меньшей мере в одной линии клеток, смешанной линии клеток, иммортализованной клетке или клональной популяции иммортализованных и/или культивируемых клеток. Иммортализованные белок-продуцирующие клетки могут быть получены приемлемыми методами. По меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант предпочтительно получают при помощи нуклеиновой кислоты или векторов, содержащих ДНК, последовательность которой выделена или, по существу,подобна по меньшей мере одному локусу иммуноглобулина человека, но при этом функционально реаранжирована или может быть подвергнута функциональной реаранжировке и имеет структуру описанного здесь миметического антитела, но не ограничивается формулой (I), в которой части С-и N-концевых вариабельных областей могут быть использованы для V, шарнирные области для Н, СН 2 для СН 2 и CH3 для CH3, как это известно в данной области. Термин "функционально реаранжированный" в используемом здесь значении означает сегмент нуклеиновой кислоты, полученной из локуса иммуноглобулина, который был подвергнут рекомбинацииV(D)J с образованием гена иммуноглобулина, кодирующего цепь иммуноглобулина (например, тяжелую цепь) или любую ее часть. Функционально реаранжированный ген иммуноглобулина может быть идентифицирован прямыми или непрямыми методом, такими как, например, секвенирование нуклеотида,гибридизация (например, саузерн-блоттинг, нозерн-блоттинг) с использованием зондов, способных гибридизировать с кодирующими сочленениями между сегментами генов, или ферментативная амплификация генов иммуноглобулина (например, полимеразная реакция синтеза цепи) с использованием затравок,способных гибридизировать с кодирующими сочленениями между сегментами генов. Приемлемыми методами можно также определить клетку, способную продуцировать ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его часть или вариант, содержащие определенную вариабельную область или вариабельную область, включающую определенную последовательность (например, по меньшей мере одну пептидную (Р) последовательность). Миметические антитела, их определенные части и варианты по настоящему изобретению могут быть также получены с использованием нуклеиновой кислоты, кодирующей по меньшей мере одно ЕРОимитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, для создания трансгенных животных или млекопитающих, таких как козы, коровы, лошади,овцы и тому подобные, продуцирующих такие миметические антитела, их определенные части или варианты в своем молоке. Такие животные могут быть созданы известными методами, используемыми для получения антитело-кодирующих последовательностей. См., например, не ограничиваясь ими, нижеследующие патенты США 5827690, 5849992, 4873316, 5994616, 5565362, 5304489 и тому подобные,которые полностью включены в данное описание изобретения в качестве ссылки. Миметические антитела, их определенные части и варианты по настоящему изобретению дополнительно могут быть получены с использованием нуклеиновой кислоты, кодирующей по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную-9 009377 часть или вариант, для создания трансгенных растений и культивируемых растительных клеток (которые включают, не ограничиваясь ими, табак и кукурузу), продуцирующих миметические антитела, их определенные части или варианты в частях растения или в культивируемых клетках, полученных из указанных растений. В качестве неограничивающего примера можно привести листья трансгенного табака,экспрессирующие рекомбинантные белки, которые были успешно использованы для получения больших количеств рекомбинантных белков, например, при помощи индуцибельного промотора. См., например,публикацию Cramer et al., Curr. Top. Microbiol. Immunol. 240:95-118 (1999) и приведенные в ней ссылки. Кроме того, трансгенный маис или кукурузу использовали для экспрессии белков млекопитающих в промышленном масштабе, причем биологическая активность указанных белков была эквивалента активности белков, продуцированных в других рекомбинантных системах или выделенных из природных источников. См., например, публикацию Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) и приведенные в ней ссылки. Антитела были также продуцированы в больших количествах из семян трансгенных растений, в том числе фрагменты антител, такие как одноцепочечные миметические антитела (scFv), при использовании семян табака и клубней картофеля. См., например, публикацию Conrad et al., Plant Mol. Biol. 38: 101-109 (1998) и приведенные в ней ссылки. Таким образом, миметические антитела, их определенные части и варианты по настоящему изобретению могут быть также продуцированы при помощи трансгенных растений в соответствии с известными методами. См., например, публикации Fischer et al., Biotechnol. Appl. Biochem. 30:99-108 (Oct., 1999), Ma et al., Trends Biotechnol. 13:522-7 (1995); Ma et al., PlantPhysiol. 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans. 22:940-944 (1994) и приведенные в них ссылки. Вышеуказанные публикации полностью включены в данное описание изобретения в качестве ссылки. Миметические антитела по настоящему изобретению могут связываться с лигандами белка человека в широком диапазоне сродства (KD). В предпочтительном варианте осуществления изобретения по меньшей мере одно ЕРО-имитирующее миметическое антитело человека с центральной шарнирной областью по настоящему изобретению может необязательно связываться с высокой степенью сродства по меньшей мере с одним лигандом белка. Например, по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению может связываться по меньшей мере с одним лигандом белка с KD, равным или менее примерно 10-7 М, более предпочтительно с KD, равным или менее примерно 0,1-9,9 (или любому значению в указанном диапазоне) х 10-7, 10-8, 10-9,10-10, 10-11, 10-12 или 10-13 М или любому значению в указанном диапазоне. Сродство или авидность ЕРО-имитирующего миметического антитела с центральной шарнирной областью в отношении по меньшей мере одного лиганда белка можно определить экспериментально любым приемлемым методом, например, используемым для определения сродства связывания или авидности антитело-антиген. (См., например, публикации Berzofsky et al., "Antibody-Antigen Interactions," InFundamental Immunology, Paul, W.E., Ed., Raven Press: New York, NY (1984); Kuby, Janis, Immunology,W.H. Freeman and Company: New York, NY (1992) и описанные в них методы). Измеренное сродство определенного ЕРО-имитирующего миметического антитела с центральной шарнирной областью может быть различным при измерении в разных условиях (таких как, например, концентрация соли, рН). Таким образом, измерения сродства и других лиганд-связывающих параметров (например, KD, Ka, Kd) предпочтительно производят с использованием стандартизированных растворов ЕРО-имитирующего миметического антитела с центральной шарнирной областью, лиганда и стандартизированного буфера, такого как буфер, описанный в настоящем изобретении. Молекулы нуклеиновых кислот Используя для получения ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению информацию, приведенную в настоящем описании изобретения, в частности, нуклеотидные последовательности, кодирующие по меньшей мере 90-100% смежных аминокислот по меньшей мере одной из SEQ ID NO:1-30, и по меньшей мере одну часть антитела, в которое вышеуказанные последовательности, их определенные фрагменты, варианты или консенсусные последовательности вводят в качестве пептидной (Р) последовательности из формулы (I), или вектор, содержащий по меньшей мере одну из указанных последовательностей, можно получить молекулу нуклеиновой кислоты по настоящему изобретению, кодирующую по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, при помощи методов, описанных в настоящем изобретении или известных в данной области. Молекулы нуклеиновых кислот по настоящему изобретению могут находиться в форме РНК, такой как мРНК, hnРНК, тРНК или любая другая, или в форме ДНК, включающей, не ограничиваясь ими,кДНК и геномную ДНК, полученную путем клонирования или синтеза либо любой комбинации указанных методов. ДНК может быть трехцепочечной, двухцепочечной или одноцепочечной или может включать любую их комбинацию. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, известной также как смысловая цепь, или некодирующей цепью, известной также как антисмысловая цепь. Выделенные молекулы нуклеиновых кислот по настоящему изобретению могут представлять собой молекулы нуклеиновых кислот, включающие открытую рамку считывания (ORF), необязательно с одним- 10009377 или несколькими интронами; молекулы нуклеиновых кислот, включающие кодирующую последовательность для ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта; и молекулы нуклеиновых кислот, включающие нуклеотидную дпоследовательность, по существу отличную от вышеописанных последовательностей, которая вследствие вырожденности генетического кода по-прежнему кодирует по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, описанное в настоящем изобретении и/или известное в данной области. Генетический код, несомненно, хорошо известен в данной области. Таким образом, специалисту в данной области не составит труда создать такие вырожденные варианты нуклеиновых кислот, кодирующих специфическое ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или варианты по настоящему изобретению. См., например, приведенную выше публикацию Ausubel, et al. Такие варианты нуклеиновых кислот входят в объем настоящего изобретения. Как указано в настоящем описании изобретения, молекулы нуклеиновых кислот по настоящему изобретению, включающие нуклеиновую кислоту, кодирующую ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, могут содержать, не ограничиваясь ими, последовательности, кодирующие аминокислотную последовательность фрагмента ЕРО-имитирующего миметического антитела с центральной шарнирной областью; последовательность,кодирующую все ЕРО-имитирующее миметическое антитело с центральной шарнирной областью или его часть; последовательность, кодирущую ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его фрагмент или часть, а также дополнительные последовательности, в частности,кодирующую последовательность по меньшей мере одной сигнальной лидерной последовательности или слитого пептида вместе с вышеуказанными дополнительными кодирующими последовательностями,такими как по меньшей мере один интрон, или без них, в сочетании с дополнительными некодирующими последовательностями, которые включают, не ограничиваясь ими, некодирующие 5'- и 3'-концевые последовательности, в частности, транскрибированные, нетранслированные последовательности, играющие определенную роль в транскрипции, процессинге мРНК, включая сигнальные последовательности сплайсинга или полиаденилирования (например, последовательности, определяющие связывание рибосомы и устойчивость мРНК); дополнительную последовательность, кодирующую дополнительные аминокислоты, например, определяющие дополнительную функциональность. Таким образом, последовательность, кодирующая ЕРО-имитирующее миметическое антитело с центральной шарнирной областью,его определенную часть или вариант, может быть слита с маркерной последовательностью, такой как последовательность, кодирующая пептид, что облегчает очистку слитого ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта, включая фрагмент или часть ЕРО-имитирующего миметического антитела с центральной шарнирной областью. Полинуклеотиды, избирательно гибридизирующие с полинуклеотидом по настоящему изобретению Настоящее изобретение относится к выделенным нуклеиновым кислотам, которые гибридизируют в условиях избирательной гибридизации с описанным здесь полинуклеотидом или другими полинуклеотидами, рассмотренными в настоящем описании изобретения, включая их определенные варианты или части. Таким образом, полинуклеотиды по данному варианту осуществления изобретения можно использовать для выделения, обнаружения и/или количественного определения нуклеиновых кислоты, включающих такие полинуклеотиды. Последовательности, недостаточно идентичные комплементарным последовательностям, обычно,но необязательно, гибридизируют в условиях низкой или умеренной строгости. Условия высокой строгости необязательно могут быть использованы для последовательностей с более высокой идентичностью. В условиях низкой строгости можно производить избирательную гибридизацию последовательностей,характеризующихся примерно 40-99% идентичностью, и идентифицировать ортологические или паралогические последовательности. Полинуклеотиды по настоящему изоретению необязательно кодируют по меньшей мере часть ЕРОимитирующего миметического антитела с центральной шарнирной областью, его определенную часть или вариант, кодированный полинуклеотидами, описанными в настоящем изобретении. Полинуклеотиды по настоящему изобретению включают последовательности нуклеиновых кислот, которые могут быть использованы для избирательной гибридизации с полинуклеотидом, кодирующим ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант по настоящему изобретению. См., например, приведенные выше публикации Ausubel; Colligan, которые полностью включены в данное описание изобретения в качестве ссылки. Создание нуклеиновых кислот Выделенные нуклеиновые кислоты по настоящему изобретению могут быть созданы (а) методами рекомбинантных ДНК, (b) методами синтеза, (с) методами очистки или их комбинациями, которые хорошо известны в данной области. Нуклеиновые кислоты могут включать другие последовательности дополнительно к полинуклеотиду по настоящему изобретению. Например, в нуклеиновую кислоту может быть введен сайт мультикло- 11009377 нирования, включающий один или несколько сайтов рестрикции эндонуклеазой, что облегчает процесс выделения указанного полинуклеотида. Кроме того, могут быть введены транслируемые последовательности, помогающие выделить транслированный полинуклеотид по настоящему изобретению. Например,маркерная последовательность, состоящая из шести гистидинов, является удобным средством выделения белков по настоящему изобретению. Нуклеиновая кислота по настоящему изобретению, за исключением кодирующей последовательности, необязательно является вектором, адаптором или линкером для клонирования и/или экспрессии полинуклеотида по настоящему изобретению. К таким клонирующим и/или экспрессирующим последовательностям могут быть добавлены дополнительные последовательности для оптимизации функции клонирования и/или экспрессии, которые помогают выделить указанный полинуклеотид или облегчить введение указанного полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов, адапторов и линкеров хорошо известно в данной области. См., например, приведенные выше публикации Ausubel или Sambrook. Методы рекомбинантных ДНК, применяемые для создания нуклеиновых кислот Выделенные нуклеиновые кислоты по настоящему изобретению, такие как РНК, кДНК, геномная ДНК или любые их комбинации, можно получить из биологических источников любыми методами клонирования, известными специалистам в данной области. В некоторых вариантах осуществления изобретения для идентификации требуемой последовательности в библиотеке кДНК или геномных ДНК используют олигонуклеотидные зонды, которые избирательно гибридизируют в условиях приемлемой строгости с полинуклеотидами по настоящему изобретению. Методы выделения РНК и создания библиотек кДНК и геномных ДНК хорошо известны специалистам в данной области. (См., например, приведенные выше публикации Ausubel или Sambrook). Методы синтеза, применяемые для создания нуклеиновых кислот Выделенные нуклеиновые кислоты по настоящему изобретению могут быть также получены путем прямого химического синтеза известными методами (см., например, приведенную выше публикациюAusubel et al.). В результате химического синтеза обычно получают одноцепочечный олигонуклеотид,который может быть превращен в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации с ДНК-полимеразой с использованием одной цепи в качестве матрицы. Специалисту в данной области должно быть известно, что, хотя химический синтез ДНК может быть ограничен последовательностями длиной около 100 или более оснований, в результате лигирования коротких последовательностей могут быть получены более длинные последовательности. Рекомбинантные экспрессирующие кластеры Настоящее изобретение далее относится к рекомбинантным экспрессирующим кластерам, включающим нуклеиновую кислоту по настоящему изобретению. Последовательность нуклеиновой кислоты по настоящему изобретению, например, последовательность кДНК или геномной ДНК, кодирующую ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант по настоящему изобретению, можно использовать для создания рекомбинантного экспрессирующего кластера, который может быть введен по меньшей мере в одну требуемую клетку-хозяина. Рекомбинантный экспрессирующий кластер обычно включает полинуклеотид по настоящему изобретению, функционально связанный с инициирующими транскрипцию регуляторными последовательностями, которые управляют транскрипцией полинуклеотида в требуемой клетке-хозяине. Для прямой экспрессии нуклеиновых кислот по настоящему изобретению могут быть использованы как гетерологичные,так и негетерологичные (то есть эндогенные) промоторы. В некоторых вариантах осуществления изобретения выделенные нуклеиновые кислоты, которые служат в качестве промотора, энхансера или других элементов, могут быть введены в соответствующее положение (в верхнюю область, нижнюю область или интрон) негетерологичной формы полинуклеотида по настоящему изобретению для увеличения или уменьшения экспрессии полинуклеотида по настоящему изобретению. Например, эндогенные промоторы могут быть изменены in vivo или in vitro в результате мутации, делеции и/или замены, известных в данной области. Полинуклеотид по настоящему изобретению может быть при желании экспрессирован в смысловой или антисмысловой ориентации. Следует отметить, что управление экспрессией гена в смысловой или антисмысловой ориентации может оказывать прямое влияние на получаемые характеристики. Другим методом супрессии является смысловая супрессия. Установлено, что введение нуклеиновой кислоты, конфигурированной в смысловой ориентации, является эффективным способом блокировки транскрипции генов-мишеней. Векторы и клетки-хозяева Настоящее изобретение относится также к векторам, которые включают молекулы выделенных нуклеиновых кислот по настоящему изобретению, к клеткам-хозяевам, создаваемым методами генетической инженерии с использованием рекомбинантных векторов, и к продуцированию по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта методами рекомбинантных ДНК, хорошо известными в данной области. См.,например, приведенные выше публикации Sambrook, et al. и Ausubel, et al., которые полностью включены в данное описание изобретения в качестве ссылки. Полинуклеотиды могут быть необязательно присоединены к вектору, содержащему селектируемый- 12009377 маркер, для размножения в клетке-хозяине. Плазмидный вектор обычно вводят в клетку приемлемыми известными методами, такими как электропорация и тому подобные, при этом другие известные методы включают использование вектора в виде преципитата, такого как преципитат фосфата кальция, или в комплексе с заряженным липидом. Если вектором является вирус, он может быть упакован in vitro с использованием соответствующей линии упаковочных клеток и затем введен в клетки-хозяева. ДНК-вставка должна быть функционально связана с соответствующим промотором. Экспрессирующие конструкции далее содержат сайты, необязательно включающие по меньшей мере один сайт инициации, терминации транскрипции и сайт связывания рибосомы, используемый для трансляции в транскрибированной области. Кодирующая часть зрелых транскриптов, экспрессированных указанными конструкциями, предпочтительно включает инициирующий трансляцию кодон в начале и терминирующий кодон (например, UAA, UGA или UAG), расположенный в конце транслируемой мРНК, причем для экспрессии в клетке млекопитающего или в эукариотической клетке предпочтительными кодонами являются UAA и UAG. Экспрессирующие векторы предпочтительно, но не обязательно, включают по меньшей мере один селектируемый маркер. Такие маркеры включают, не ограничиваясь ими, метотрексат (МТХ), дигидрофолат-редуктазу (DHFR, патенты США 4399216, 4634665, 4656134, 4956288, 5149636, 5179017, ампициллин, неомицин (G418), микофенольную кислоту или глутамин-синтетазу (GS, патенты США 5122464, 5770359, 5827739), ген устойчивости для культуры эукариотических клеток и ген устойчивости к тетрациклину или ампициллину для культивирования в Е. coli и других бактериальных или прокариотических клетках (вышеуказанные патенты полностью включены в данное описание изобретения в качестве ссылки). Соответствующие культуральные среды и условия культивирования вышеописанных клеток-хозяев хорошо известны в данной области. Специалист в данной области должен легко определить приемлемые векторы. Вектор можно ввести в клетку-хозяина методом трансфекции с использованием фосфата кальция, трансфекции, опосредованной DEAE-декстраном, трансфекции, опосредованной катионным липидом, электропорации, трансдукции, инфицирования или другими известными методами. Такие методы описаны в данной области, например, в приведенных выше публикациях Sambrook, Chapters 1-4 and 16-18; Ausubel, Chapters 1, 9, 13, 15, 16. По меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению могут быть экспрессированы в модифицированной форме, такой как слитый белок, и могут включать не только сигналы секреции, но и дополнительные гетерологичные функциональные области. Например, к N-концу ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта может быть добавлена область дополнительных аминокислот, в частности, заряженных аминокислот, для улучшения устойчивости в клетке-хозяине во время очистки, последующего манипулирования и хранения. Кроме того, к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью,его определенной части или варианту по настоящему изобретению могут быть добавлены пептидные части для облегчения очистки. Такие области могут быть удалены до конечного получения ЕРОимитирующего миметического антитела с центральной шарнирной областью или по меньшей мере одного его фрагмента. Такие методы описаны во многих стандартных лабораторных руководствах, таких как приведенные выше публикации Sambrook, Chapters 17.29-17.42 and 18.1-18.74; Ausubel, Chapters 16, 17and 18. Специалистам в данной области должны быть известны многочисленные экспрессирующие системы, пригодные для экспрессии нуклеиновой кислоты, кодирующей белок по настоящему изобретению. Типичным примером культур клеток, используемых для продуцирования миметических антител, их определенных частей или вариантов, являются клетки млекопитающего. Системы клеток млекопитающего часто находятся в форме монослоев клеток, хотя могут быть также использованы взвеси клеток млекопитающих или биореакторы. В данной области создан целый ряд приемлемых линий клетокхозяев, способных экспрессировать интактные гликозилированные белки, которые включают линии клеток C0S-1 (например, АТСС CRL 1650), COS-7 (например, АТСС CRL-1651), НЕК 293, ВНК 21 (например, АТСС CRL-10), СНО (например, АТСС CRL 1610, DG-44) и BSC-1 (например, АТСС CRL-26),клетки hepG2, клетки Р 3 Х 63Ag8.653, SP2/0-Agl4, клетки 293, клетки HeLa и тому подобные, которые могут быть легко приобретены, например, из Американской коллекции типовых культур, Manassas, Va. Предпочтительные клетки-хозяева включают клетки лимфоидного происхождения, такие как миеломные и лимфомные клетки. Особенно предпочтительными клетками-хозяевами являются клетки Р 3 Х 63Ag8.653 (АТСС, номер доступа CRL-1580) и клетки SP2/0-Ag14 (АТСС, номер доступа CRL-1851). Экспрессирующие векторы для указанных клеток могут включать одну или несколько нижеследующих контролирущих экспрессию последовательностей, которые включают, не ограничиваясь ими,ориджин репликации; промотор (например, поздний или ранний промоторы SV40, промотор CMV (например, патенты США 5168062, 5385839), tk-промотор HSV, pgk-промотор (фосфоглицерат-киназа),альфа-промотор EF-1 (например, патент США 5266491), по меньшей мере один промотор иммуноглобулина человека; энхансер и/или информационнопроцессирующие сайты, такие как сайты связывания рибосомы, сайты сплайсинга РНК, сайты полиаденилирования (например, большой сайт добавленияSV40 Т Ag поли А) и терминирующие транскрипцию последовательности. См., например, приведенные выше публикации Ausubel et al.; Sambrook et al. Известны другие клетки, пригодные для продуцирования нуклеиновых кислот или белков по настоящему изобретению, которые могут быть приобретены по каталогу линий клеток и гибридом Американской коллекции типовых культур (www.atcc.org) или из других известных коммерческих источников. При использовании эукариотических клеток-хозяев в вектор обычно вводят полиаденилирующие или терминирующие транскрипцию последовательности. Примером терминирующей последователности является полиаденилирующая последовательность из гена гормона роста крупного рогатого скота. В вектор могут быть также встроены последовательности для точного сплайсинга транскрипта. Примером сплайсирующей последовательности является интрон VP1 из SV40 (Sprague, et al., J. Virol. 45:773-781(1983. Кроме того, в вектор могут быть встроены генные последовательности для контроля репликации в клетке-хозяине, известные в данной области. Очистка ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант можно выделить и очистить из культур рекомбинантных клеток хорошо известными методами, которые включают, не ограничиваясь ими, очистку белком А, преципитацию сульфатом аммония или этанолом, кислотную экстракцию, анионо- или катионообменную хроматографию, хроматографию на колонках с фосфоцеллюлозой, гидрофобную хроматографию, аффинную хроматограцию,хроматографию на колонках с гидроксилапатитом и хроматографию на колонках с лектином. Очистка может быть также произведена при помощи высокоэффективной жидкостной хроматографии ("ВЭЖХ"). См., например, публикации Colligan, Current Protocols in Immunology, или Current Protocols in Protein Science, John WileySons, NY, NY (1997-2003), e.g. Chapters 1, 4, 6, 8, 9, 10, которые полностью включены в данное описание изобретения в качестве ссылки. Миметические антитела, их определенные части или варианты по настоящему изобретению включают естественно очищенные продукты, продукты химического синтеза и продукты, полученные методами рекомбинантных ДНК из эукариотической клетки-хозяина, включающей, например, дрожжевые клетки, клетки высших растений, клетки насекомых и клетки млекопитающих. В зависимости от хозяина, использованного для продуцирования методом рекомбинантных ДНК, ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению может быть гликозилированным или негликозилированным, причем гликозилированный продукт является педпочтительным. Такие методы описаны во многих стандартных лабораторных руководствах, таких как приведенные выше публикации Sambrook, Sections 17.37-17.42; Ausubel, Chapters 10,12, 13, 16, 18 and 20, Colligan, Protein Science, Chapters 12-14, которые полностью включены в данное описание изобретения в качестве ссылки. Миметические антитела, их определенные фрагменты и/или варианты Выделенные миметические антитела по настоящему изобретению включают ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант, кодированный одним из полинуклеотидов по настоящему изобретению, более полно рассмотренных в настоящем описании изобретения, или любое выделенное или полученное ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенную часть или вариант. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его лигандсвязывающая часть или вариант предпочтительно связывается по меньшей мере с одним лигандом или рецептором белка ЕРО и поэтому обладает по меньшей мере одной биологической активностью ЕРО соответствующего белка или его фрагмента. В данной области хорошо известны разные терапевтически или диагностически значимые белки, а также приемлемые анализы или биологические активности таких белков. Неограничивающие примеры приемлемых ЕРО-имитирующих пептидов по настоящему изобретению приведены в нижеследующей табл. 1. Указанные пептиды могут быть получены методами, описанными в настоящем изобретении и/или известными в данной области. В большинстве случаев использованы однобуквенные аббревиатуры аминокислот. Символ X в указанных последовательностях (и в данном описании изобретения за исключением особо оговоренных случаев) означает, что в данном положении может присутствовать любой из 20 природных или известных аминокислотных остатков или их известных производных либо любая известная модифицированная аминокислота. Любые из указанных пептидов могут быть связаны последовательно при помощи линкеров или без них, и в таблице приведено несколько примеров последовательно связанных пептидов. Линкеры обозначены символом и могут представлять собой любые из описанных здесь линкеров. Тандемные повторы и линкеры для ясности разделены тире. Любой пептид, содержащий остаток цистеинила, может быть необязательно перекрестно сшит с другим Cys-содержащим пептидом, причем любой из них или оба могут быть связаны с вектором. В таблице приведено несколько примеров перекрестно сшитых пептидов. Любой пептид, содержащий более одного остатка Cys, может также образовывать внутрипептидную дисульфидную связь; см., например, ЕРО-имитирующие пептиды в табл. 1. В таблице приведено несколько примеров пептидов, свя- 14009377занных внутрипептидной дисульфидной связью. Любые из указанных пептидов могут иметь производные пептиды, описанные в настоящем изобретении, поэтому в таблице приведено несколько примеров производных пептидов. В производных пептидах, в которых карбоксильный конец может быть кэппирован аминогруппой, кэппирующая аминогруппа показана как -NH2. В производных пептидах, в которых аминокислотные остатки заменены частями, не являющимися аминокислотными остатками, такие замены отмечены символом , который обозначает любые части, известные в данной области, например, описанные в публикациях Bhatnagar et al. (1996), J. Med. Chem. 39; 3814-9 and Cuthbertson et al. (1997), J.Med. Chem. 40:2876-82, которые полностью включены в данное описание изобретения в качестве ссылки. Заместитель J и заместители Z (Z5, Z6,Z40) имеют значения, указанные в патентах США 5608035,5786331 и 5880096, которые полностью включены в данное описание изобретения в качестве ссылки. В ЕРО-имитирующих последовательностях (табл. 1) заместители X2-X11 и целое число "n" имеют значения,указанные в заявке WO 96/40772, которая полностью включена в данное описание изобретения в качестве ссылки. Остатки, указанные жирным шрифтом, представляют собой D-аминокислоты, но необязательно могут быть L-аминокислотами. Все пептиды связаны пептидными связями за исключением особо оговоренных случаев. Аббревиатуры приведены в конце настоящего описания изобретения. В колонке"SEQ ID NO" "NR" означает, что данная последовательность не требует включения в список последовательностей. Таблица 1. ЕРО-имитирующие пептидные последовательности Биологические активности ЕРО хорошо известны в данной области. См., например, публикацииpharmacokinetic studies. Journal of Lab. Clin. Med. 119: 285-94 (1992); for further information see also individual cell lines used in individual bioassays. Все приведенные выше публикации полностью включены в данное описание изобретения в качест- 16009377 ве ссылки. ЕРО можно подвергнуть анализу, используя такие линии клеток как HCD57, NFS-60, TF-1 иUT-7, которые реагируют на данный фактор. Анализ активности ЕРО можно произвести методом колониеобразования с определением числа колониеобразующих единиц зритропоэтина (CFU-E) в клетках костного мозга. Альтернативным и совершенно отличным методом обнаружения является количественное определение цитокинов при помощи RT-PCR. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант, которые частично или предпочтительно в значительной степени обладают по меньшей мере одной биологической активностью по меньшей мере одного белка или его фрагмента, могут связываться с лигандом белка или его фрагмента и проявлять по меньшей мере одну активность, которая в противном случае опосредована связыванием белка по меньшей мере с одним лигандом или рецептором белка или другими механизмами, зависящими от белка или опосредуемыми белком. В используемом здесь значении термин "активность ЕРО-имитирующего миметического антитела с центральной шарнирной областью" относится к ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, которое может модулировать или вызывать по меньшей мере одну зависящую от белка активность в диапазоне от около 20% до 10000%, предпочтительно равную по меньшей мере примерно 60, 70,80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350,400, 450, 500, 550, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000% или больше в зависимости от выполняемого анализа. Способность ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта проявлять по меньшей мере одну зависящую от белка активность определяют при помощи по меньшей мере одного приемлемого биологического анализа белка, описанного в настоящем изобретении и/или известного в данной области. ЕРО-имитирующее миметическое антитело человека с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению могут быть подобны любому классу (IgG, IgA, IgM и т.д.) или изотипу и могут включать по меньшей мере часть легкой каппа- или лямбда-цепи. В одном варианте осуществления изобретения ЕРОимитирующее миметическое антитело человека с центральной шарнирной областью, его определенная часть или вариант включают вариабельный фрагмент тяжелой цепи IgG, шарнирную область, СН 2 иCH3, например, по меньшей мере одного из изотипов IgG1, IgG2, IgG3 или IgG4. По меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению связывается по меньшей мере с одним определенным лигандом, специфичным по меньшей мере к одному белку, субъединице, фрагменту, части или любой их комбинации. По меньшей мере один ЕРО-имитирующий пептид по меньшей мере одного ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта по настоящему изобретению может необязательно связываться по меньшей мере с одним эпитопом определенного лиганда. Связывающий эпитоп может включать любую комбинацию от одной аминокислотной последовательности, состоящей по меньшей мере из 1-3 аминокислот, до всей определенной части смежных аминокислот последовательностей, выбираемых из группы, включающей лиганд белка, такой как рецептор ЕРО или его часть. Такие миметические антитела могут быть получены в результате связывания разных частей ЕРОимитирующего миметического антитела с центральной шарнирной областью, указанных в формуле (I),при помощи известных методов получения и экспрессии по меньшей мере одной (то есть одной или нескольких) молекулы нуклеиновой кислоты, кодирующей ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, таких как известные методы рекоминантных ДНК или любые другие приемлемые методы, в частности, химический синтез. Миметические антитела, которые связываются с лигандами или рецепторами ЕРО человека и включают по меньшей мере одну часть определенной вариабельной области тяжелой или легкой цепи, могут быть получены приемлемыми методами, такими как отображение на фаге (Katsube, Y., et al., Int. J. Mol.Med., l(5):863-868 (1998, или методами с использованием трансгенных животных, известными в данной области и/или описанными в настоящем изобретении. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант могут быть экспрессированы с использованием кодирущей нуклеиновой кислоты или ее части в приемлемой клетке-хозяине. Такие миметические антитела или их лиганд-связывающие фрагменты предпочтительно могут связываться с лигандами или рецепторами ЕРО человека с высокой степенью сродства (например, KD меньше или равно примерно 10-7 М). Аминокислотные последовательности, которые, по существу, аналогичны описанным здесь последовательностям, включают последовательности с консервативными заменами аминокислот, а таккже с делециями и/или инсерциями аминокислот. Консервативная замена минокислот означает замену одной аминокислоты другой аминокислотой, у которой химические и/или физические свойства (например, заряд, структура, полярность, гидрофобность/гидрофильность) аналогичны свойствам первой аминокислоты. Консервативные замены включают замену одной аминокислоты другой аминокислотой в следующих группах: лизин (К), аргинин (R) и гистидин (Н); аспартат (D) и глутамат- 17009377 глицин (G); F, W и Y; С, S и Т. Коды аминокислот Аминокислоты, образующие миметические антитела, их определенные части или варианты по настоящему изобретению, часто обозначаются аббревиатурами. Для обозначения аминокислот может быть использован однобуквенный код, трехбуквенный код, название или кодон, состоящий из трех нуклеотидов, которые хорошо известны в данной области (см. публикацию Alberts, В., et al., Molecular Biology of ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант по настоящему изобретению могут включать одну или несколько замен, делеций или добавлений аминокислот, полученных в результате естественных мутаций или манипуляций человека,описанных в настоящем изобретении. Такие или другие последовательности, которые могут быть использованы в настоящем изобретении включают, не ограничиваясь ими, нижеследующие последовательности, приведенные в табл. 3 и показанные на фиг. 1-42 предварительной заявки на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки, причем указанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783, поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки, вместе с соответствующими SEQ ID NO:31-72. На приведенных в качестве ссылки фиг. 142 (SEQ ID NO:31-72) или фиг. 1-41 заявки на патент РСТ США 04/19783 показаны примеры последовательностей вариабельной/константной области тяжелой/легкой цепи, остовных областей/субдоменов и замен, части которых могут быть использованы в Ig-выделенных белках по настоящему изобретению в соответствии с приведенным здесь описанием. Число возможных замен аминокислот, конечно, зависит от многих факторов, включая вышеописанные факторы. Как правило, число замен, инсерций или делеций аминокислот по меньшей мере в одном ЕРО-имитирующем миметическом антителе с центральной шарнирной областью не должно превышать 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 аминокислоту, в частности, 1-30 или любое число в указанном диапазоне. Нижеследующее описание элементов ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению основано на использовании формулы I по настоящему изобретению(V(m)-P(n)-L(o)-H(p)-CH2(q)-CH3(r(s),где V означает по меньшей мере одну часть N-конца вариабельной области иммуноглобулина, Р означает по меньшей мере один биологически активный пептид, L означает по меньшей мере один линкерный полипептид, Н означает по меньшей мере одну часть по меньшей мере одной шарнирной области иммуноглобулина, СН 2 означает по меньшей мере часть СН 2-константной области иммуноглобулина,CH3 означает по меньшей мере часть CH3-константной области иммуноглобулина, m, n, о, р, q, r и s независимо означают целое число от 0, 1 или 2 до 10, имитирующее разные типы молекул иммуноглобулина, которые, например, включают, не ограничиваясь ими, IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgD, IgE и тому подобные или любые их подклассы и комбинации. В миметических антителах с центральной шарнирной областью по настоящему изобретению необязательная N-концевая часть вариабельной области (V) может включать 1-20 аминокислот по меньшей мере одного вариабельного участка остовной области 1 (FR1) тяжелой цепи, например, показанных на- 19009377 фиг. 1-9 (SEQ ID NO:31-39), или по меньшей мере одну вариабельную область легкой цепи, например,показанную на фиг. 10-31 (SEQ ID NO:40-61) в предварительной заявке на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; вышеуказанные фигуры соответствуют фиг. 1-41 в заявке на патент РСТ США 04/19783, поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки,включая замены, делеции или инсерции, показанные на указанных фигурах, причем предпочтительными являются элементы, представленные на фиг. 5, 6 и 8. Кроме того, предпочтительными являются вариабельные последовательности, включающие последовательность Q-X-Q. Часть Р может включать по меньшей мере один любой терапевтический пептид, известный в данной области или описанный в настоящем изобретении, в том числе, например, представленные в табл. 1SEQ ID NO:1-30 или известные в данной области, любую их комбинацию, консенсусную последовательность или любой слитый белок. Необязательная линкерная последовательность может представлять собой любой приемлемый пептидный линкер, известный в данной области. Предпочтительная последовательность включает любую комбинацию G и S, например, Х 1-Х 2-Х 3-Х 4-Хn, где X может означать G или S и n может быть равно 530. Неограничивающие примеры включают GS, GGGS, GSGGGS, GSGGGSGG и тому подобные. В настоящем изобретении часть СН 1 не использована и из N-конца шарнирной области удалено разное число аминокислот, например, как показано на фиг. 1-42 предварительной заявки на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; вышеуказанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783,поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки, и табл. 3. Разное число аминокислот, используемых для центральной шарнирной области миметического антитела по настоящему изобретению, включает, не ограничиваясь ими, делецию 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38,39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57 или 1-3, 2-5, 2-7, 2-8, 3-9, 4-10, 5-9, 510, 5-15, 10-20, 2-30, 20-40, 10-50 или любого числа в указанном диапазоне N-концевых аминокислот по меньшей мере в одной шарнирной области, например, показанных на фиг. 32-40 предварительной заявки на патент 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; указанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783, поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки, или приведенной выше таблице 3, в том числе, не ограничиваясь ими, делецию любых или всех аминокислот от 99-101 до 105-157, в том числе аминокислот 99-105, 99-108, 99-111, 99-112, 99113, 99-114, 99-115, 99-119, 99-125, 99-128, 99-134, 99-140, 99-143, 99-149, 99-155 и 99-158, показанных на фиг. 32-40 предварительной заявки на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; указанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783, поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки соответствующая SEQ ID NO:62-70, включая замены, инсерции или делеции, показанные на фиг. 32-40 предварительной заявки на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; указанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783, поданной 17 июня 2004 г., которая полностью включена в данное описание изобретения в качестве ссылки. В предпочтительных вариантах осуществления изобретения центральные шарнирные области по настоящему изобретению включают делецию N-конца шарнирной области, в результате чего образуется центральная шарнирная область, которая включает делецию остатков до остатка Cys, но не включая остаток Cys, или до последовательности Cys-Pro-Xaa-Cys, но не включая указанную последовательность. В другом предпочтительном варианте осуществления изобретения последовательности центральной шарнирной области, используемые в миметическом антителе с центральной шарнирной областью по настоящему изобретению, включают аминокислоты 109-113 или 112-113 на фиг. 36 (SEQ ID NO:66) (IgG1),105-110 или 109-110 на фиг. 37 (SEQ ID NO:67) (IgG2), 111-160, 114-160, 120-160, 126-160, 129-160, 135160, 141-160, 144-160, 150-160, 156-160 и 159-160 на фиг. 38 (SEQ ID NO:68) (IgG3), 106-110 или 109-110 на фиг. 39 (SEQ ID NO:69) (IgG4). СН 2, CH3 и необязательная последовательность СН 4 могут быть приемлемыми последовательностями человека или совместимыми с последовательностями человека, например, показанными на фиг. 142 предварительной заявки на патент США 60/507349, поданной 30 сентября 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки; указанные фигуры соответствуют фиг. 1-41 заявки на патент РСТ США 04/19783, поданной 17 июня 2003 г., которая полностью включена в данное описание изобретения в качестве ссылки, и табл. 3, а также последовательностями, известными в данной области, любой их комбинацией, консенсусной последовательностью или любым слитым белком. Аминокислоты в ЕРО-имитирующем миметическом антителе с центральной шарнирной областью,его определенной части или варианте по настоящему изобретению, которые являются незаменимыми для выполнения определенной функции, могут быть идентифицированы методами, известными в данной области, такими как сайтнаправленный мутагенез или аланин-сканирующий мутагенез (см., например,- 20009377 приведенную выше публикацию Ausubel, Chapters 8, 15; Cunningham and Wells, Science 244:1081-1085(1989. Метод, указанный последним, позволяет ввести одиночные мутации аланина во все остатки молекулы. Полученные мутантные молекулы затем тестируют в отношении биологической активности,включая, не ограничиваясь ею, по меньшей мере одну относящуюся к белку активность, описанную в настоящем описании изобретения или известную в данной области. Сайты, имеющие важное значение для связывания ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта, могут быть также идентифицированы при помощи структурного анализа, такого как кристаллизация, ядерный магнитный резонанс или мечение фотоаффинным методом(Smith, et al., J. Mol. Biol. 224:899-904 (1992) and de Vos, et al., Science 255:306-312 (1992. Миметические антитела, их определенные части или варианты по настоящему изобретению могут включать в качестве части Р в формуле (I), не ограничиваясь ими, по меньшей мере одну часть, последовательность или комбинацию, выбираемую из 3 или всех остатков по меньшей мере одной SEQ ID NO:130. Неограничивающие варианты, которые могут усилить или сохранить по меньшей мере одну из вышеуказанных активностей, включают, не ограничиваясь ими, любые вышеуказанные полипептиды, которые далее имеют по меньшей мере одну мутацию, соответствующую по меньшей мере одной замене,инсерции или делеции, которая не оказывает существенного влияния на приемлемые биологические активности или функции указанного ЕРО-имитирующего миметического антитела с центральной шарнирной областью. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, его определенная часть или вариант может далее необязательно включать по меньшей мере одну функциональную часть по меньшей мере одного полипептида в качестве части Р в формуле (I), по меньшей мере одну из 90100% SEQ ID NO:1-30. ЕРО-имитирующее миметическое антитело с центральной шарнирной областью может далее необязательно включать аминокислотную последовательность для части Р в формуле (I),выбранную из одной или нескольких SEQ ID NO:1-30. В одном варианте осуществления изобретения аминокислотная последовательность Р или ее часть примерно на 90-100% (то есть на 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или любое число в указанном диапазоне) идентична соответствующей аминокислотной последовательности соответствующей части по меньшей мере одной SEQ ID NO:1-30. Идентичность аминокислот, предпочтительно равную 90-100% (то есть 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% или любому числу в указанном диапазоне), определяют при помощи приемлемого компьютерного алгоритма, известного в данной области. Миметические антитела, их определенные части или варианты по настоящему изобретению могут содержать любое число смежных аминокислотных остатков из ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта по настоящему изобретению, причем указанное число остатков выбирают из целого числа остатков в пределах 10-100% смежных остатков в ЕРО-имитирующем миметическом антителе с центральной шарнирной областью. Указанная последовательность смежных аминокислот состоит примерно из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13,14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140,150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250 или большего числа аминокислот в указанном диапазоне значений. Кроме того, число таких последовательностей может соответствовать любому целому числу последовательностей, выбираемых из группы, включающей 1-20, по меньшей мере 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот. Как должно быть понятно специалистам в данной области, настоящее изобретение относится по меньшей мере к одному биологически активному ЕРО-имитирующему миметическому антителу с центральной шарнирной областью, его определенной части или варианту по настоящему изобретению. Биологически активные миметические антитела, их определенные части или варианты обладают удельной активностью, равной по меньшей мере 20, 30 или 40%, предпочтительно по меньшей мере 50, 60 или 70% и наиболее предпочтительно по меньшей мере 80, 90 или 95-100% активности нативного (несинтетического), эндогенного или родственного и известного встроенного или слитого белка, его определенной части или варианта. Методы анализа и количественного измерения ферментативной активности или субстратной специфичности хорошо известны специалистам в данной области. Другим объектом настоящего изобретения являются миметические антитела человека и лигандсвязывающие фрагменты, описанные в настоящем изобретении, которые модифицированы путем ковалентного присоединения органической части. В результате такой модификации можно получить ЕРОимитирующее миметическое антитело с центральной шарнирной областью или лиганд-связывающий фрагмент с улучшенными фармакокинетическими свойствами (например, с более высоким периодом полувыведения из сыворотки in vivo). Органическая часть может быть гидрофильной полимерной группой с линейной или разветвленной цепью, группой жирной кислоты или группой сложного эфира жирной кислоты. В конкретных вариантах осуществления изобретения гидрофильная полимерная группа может иметь молекулярную массу от около 800 до около 120000 Да и может представлять собой полиалкангликоль (например, полиэтиленгликоль (PEG), полипропиленгликоль (PPG, углеводный полимер,аминокислотный полимер или поливинилпирролидон, и группа жирной кислоты или сложного эфира жирной кислоты может содержать от около восьми до около сорока атомов углерода.- 21009377 Модифицированные миметические антитела и лиганд-связывающие фрагменты по настоящему изобретению могут включать одну или несколько органических частей, которые ковалентно связаны прямой или непрямой связью с ЕРО-имитирующим миметическим антителом с центральной шарнирной областью, его определенной частью или вариантом. Каждая органическая часть, связанная с ЕРОимитирующим миметическим антителом с центральной шарнирной областью или лиганд-связывающим фрагментом по настоящему изобретению, может независимо представлять собой гидрофильную полимерную группу, группу жирной кислоты или группу сложного эфира жирной кислоты. В используемом здесь значении термин "жирная кислота" означает монокарбоновые кислоты и дикарбоновые кислоты. Термин "гидрофильная полимерная группа" в используемом здесь значении означает органический полимер, который лучше растворяется в воде, чем в октане. Например, полилизин лучше растворяется в воде, чем в октане. Таким образом, в объем настоящего изобретения входит ЕРО-имитирующее миметическое антитело с центральной шарнирной областью, модифицированное путем ковалентного присоединения полилизина. Гидрофильные полимеры, пригодные для модифицикации миметических антител по настоящему изобретению, могут иметь линейную или разветвленную цепь и включают, например, полиалкангликоли (например, PEG, монометоксиполиэтиленгликоль (mPEG), PPG и тому подобные), углеводы (например, декстран, целлюлозу, олигосахариды, полисахариды и тому подобные), полимеры гидрофильных аминокислот (например, полилизин, полиаргинин, полиаспартат и тому подобные), полиалканоксиды (например, полиэтиленоксид, полипропиленоксид и тому подобные) и поливинилпирролидон. Гидрофильный полимер, модифицирующий ЕРО-имитирующее миметическое антитело с центральной шарнирной областью по настоящему изобретению, предпочтительно имеет молекулярную массу от около 800 до около 150000 Да в виде отдельной молекулярной частицы. Например, можно использоватьPEG2500, PEG5000, PEG7500, PEG9000, PEG10000, PEG12500, PEG15000 и PEG200, в которых подстрочный индекс означает среднюю молекулярную массу полимера в Дальтонах. Гидрофильная полимерная группа может быть замещена одной из примерно шести алкильных групп, групп жирной кислоты или групп сложного эфира жирной кислоты. Гидрофильные полимеры,замещенные группой жирной кислоты или сложного эфира жирной кислоты, могут быть получены разными приемлемыми методами. Например, полимер, содержащий аминогруппу, может быть связан с карбоксилатом жирной кислоты или сложного эфира жирной кислоты, и активированный карбоксилат (например, активированный N,N-карбонилдиимидазолом) жирной кислоты или сложного эфира жирной кислоты может быть связан с гидроксильной группой полимера. Жирные кислоты и сложные эфиры жирных кислот, пригодные для модификации миметических антител по настоящему изобретению, могут быть насыщенными или могут содержать одно или несколько ненасыщенных звеньев. Жирные кислоты, пригодные для модификации миметических антител по настоящему изобретению, включают, например, н-додеканоат (C12, лаурат), н-тетрадеканоат (C14, миристат), н-октадеканоат (C18, стеарат) н-эйкозаноат (С 20, арахидат), н-докозаноат (С 22, бегенат), нтриаконтаноат (С 30), н-тетраконтаноат (С 40), цис-9-октадеканоат (C18, олеат), все цис-5,8,11,14 эйкозатетраэноат (С 20, арахидонат), октандиовую кислоту, тетрадекандиовую кислоту, октадекандиовую кислоту, докозандиовую кислоту и тому подобные. Приемлемые сложные эфиры жирных кислот включают сложные моноэфиры ди-карбоновых кислот, содержащие низшую алкильную группу с линейной или разветвленной цепью. Низшая алкильная группа может содержать от одного до около двенадцати,предпочтительно от одного до около шести атомов углерода. Модифицированные миметические антитела человека и лиганд-связывающие фрагменты можно получить приемлемыми методами, такими как осуществление взаимодействия с одним или несколькими модифицирующими агентами. Термин "модифицирующий агент" в используемом здесь значении означает приемлемую органическую группу (например, гидрофильный полимер, жирную кислоту, сложный эфир жирной кислоты), включающую активирующую группу. "Активирующая группа" является химической частью или функциональной группой, которая в соответствующих условиях может взаимодействовать со второй химической группой с образованием ковалентной связи между модифицирующим агентом и второй химической группой. Например, активирующие группы, взаимодействующие с амином,включают электрофильные группы, такие как тозилат, мезилат, галоген (хлор, бром, фтор, иод), Nгидроксисукцинимидиловые эфиры (NHS) и тому подобные. Активирующие группы, способные взаимодействовать с тиолами, включают, например, имид малеиновой кислоты, иодацетил, акрилолил, пиридилдисульфиды, тиол 5-тиол-2-нитробензойной кислоты (TNB-тиол) и тому подобные. Альдегидная функциональная группа может быть связана с амин- или гидразидсодержащими молекулами, и азидная группа может взаимодействовать с трехвалентной фосфорной группой с образованием фосфорамидатных или фосфоримидных связей. В данной области известны приемлемые методы введения активирующих групп в молекулы (см., например, публикацию Hermanson, G.T., Bioconjugate Techniques, AcademicPress: San Diego, CA (1996. Активирующая группа может быть связана непосредственно с органической группой (например, гидрофильный полимер, жирная кислота, сложный эфир жирной кислоты) или при помощи линкерной части, в частности, двухвалентной С 1-С 12 группы, в которой один или несколько атомов углерода могут быть заменены гетероатомом, таким как атом кислорода, азота или серы. Приемлемые линкерные части включают, например, тетраэтиленгликоль, -(СН 2)3-, -NH-(CH2)6-NH-, -(CH2)2-NH- и-CH2-O-CH2-CH2-O-CH2-CH2-O-CH-NH-. Модифицирующие агенты, содержащие линкерную часть, могут быть получены, например, в результате взаимодействия моно-Вос-алкилдиамина (например, моноВос-этилендиамин, моно-Вос-диаминогексан) с жирной кислотой в присутствии 1-этил-3-(3 диметиламинопропил)карбодиимида (EDC) с образованием амидной связи между свободным амином и карбоксилатом жирной кислоты. Защитная группа Вос может быть удалена из продукта в результате обработки трифторуксусной кислотой (ТФУ) с получением первичного амина, который может быть связан с другим карбоксилатом, или подвергнут взаимодействию с малеиновым ангидридом с последующей циклизацией полученного продукта с образованием активированного малеимидного производного жирной кислоты. (См., например, публикацию Thompson, et al., WO 92/16221, которая полностью включена в данное описание изобретения в качестве ссылки). Модифицированные миметические антитела по настоящему изобретению могут быть получены в результате взаимодействия ЕРО-имитирующего миметического антитела человека с центральной шарнирной областью или лиганд-связывающего фрагмента с модифицирующим агентом. Например, органические части могут быть связаны с ЕРО-имитирующим миметическим антителом с центральной шарнирной областью несайтспецифическим образом в результате использования модифицирующего агента,взаимодействующего с амином, например, гидроксисукцинимидилового эфира (NHS) полиэтиленгликоля. Модифицированные миметические антитела человека или лиганд-связывающие фрагменты могут быть также получены в результате восстановления дисульфидных связей (например, дисульфидных связей внутри цепи) ЕРО-имитирующего миметического антитела с центральной шарнирной областью или лиганд-связывающего фрагмента. Восстановленное ЕРО-имитирующее миметическое антитело с центральной шарнирной областью или лиганд-связывающие фрагмент затем можно подвергнуть взаимодействию с модифицирующим агентом, взаимодействующим с тиолом, с образованием модифицированного ЕРО-имитирующего миметического антитела с центральной шарнирной областью по настоящему изобретению. Модифицированные миметические антитела человека и лиганд-связывающие фрагменты, содержащие органическую часть, связанную со специфическими сайтами ЕРО-имитирующего миметического антитела с центральной шарнирной областью, его определенной частью или вариантом по настоящему изобретению, могут быть получены приемлемыми методами, такими как обратный протеолизal., Biotechnol. Bioeng, 56(4):456-463 (1997) и методы, описанные в публикации Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996). Композиции на основе ЕРО-имитирующего миметического антитела с центральной шарнирной областью Настоящее изобретение относится также по меньшей мере к одной композиции на основе ЕРОимитирующего миметического антитела с центральной шарнирной областью, его определенной части или варианта, которая содержит по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть или более миметических антител,их определенных частей или вариантов, описанных в настоящем изобретении и/или известных в данной области, в виде не встречающейся в природе композиции, смеси или формы. Процентные значения такой композиции служат для обозначения массы, объема, концентрации, молярности или моляльности жидких или сухих растворов, смесей, суспензий, эмульсий или коллоидов, известных в данной области или описанных в настоящем изобретении. Такие композиции могут содержать 0,00001-99,9999% в расчете на массу, объем, концентрацию,молярность или моляльность жидких, газообразных или сухих растворов, смесей, суспензий, эмульсий или коллоидов, известных в данной области или описанных в настоящем изобретении, и, не ограничиваясь ими, могут иметь любые значения в указанном диапазоне, а именно 0,00001, 0,00003, 0,00005,0,00009, 0,0001, 0,0003, 0,0005, 0,0009, 0,001, 0,003, 0,005, 0,009, 0,01, 0,02, 0,03, 0,05, 0,09, 0,1, 0,2, 0,3,0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9,3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40,45, 50, 55, 60, 65, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94,95, 96, 97, 98, 99, 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8, 99,9%. Таким образом, композиции по настоящему изобретению содержат без каких-либо ограничений 0,00001-100 мг/мл и/или 0,00001-100 мг/г. Указанная композиция может далее необязательно содержать эффективное количество по меньшей мере одного соединения или белка, выбранного из по меньшей мере одного из дезинфицирующего средства, средства для сердечно-сосудистой системы (CV), средства для центральной нервной системы(CNS), средства для автономной нервной системы (ANS), средства для дыхательных путей, средства для желудочно-кишечного тракта (GI), гормонального средства, средства для водно-солевого баланса, гематологического средства, противоопухолевого средства, иммуномодулирующего средства, глазного, ушного или назального средства, местнодействующего средства, средства от нарушения питания или тому подобных. Такие лекарственные средства хорошо известны в данной области, включая препараты, показания, дозировку и введение (см., например, публикации Nursing 2001 Handbook of Drugs, 21st edition,Springhouse Corp., Springhouse, PA, 2001; Health Professional's Drug Guide 2001, ed., Shannon, Wilson,- 23009377Lange, Stamford, CT, которые полностью включены в данное описание изобретения в качестве ссылки). Дезинфицирующее средство может представлять собой по меньшей мере одно противоамебное средство, по меньшей мере одно средство против простейших, противоглистное средство, противогрибковое средство, противомалярийное средство, противотуберкулезное средство или по меньшей мере одно противолепрозное средство, аминогликозиды, пенициллины, цефалоспорины, тетрациклины, сульфонамиды, фторхинолоны, антивирусные средства, макролидные дезинфицирующие средства, смешанные дезинфицирующие средства. Средство для сердечно-сосудисной системы может представлять собой по меньшей мере одно инотропное средство, средство от аритмии, средство от стенокардии, гипотензивное средство, средство от гиперлипемии, смешанные сердечно-сосудистые средства. Средство для центральной нервной системы может представлять собой по меньшей мере один ненаркотический аналгетик или по меньшей мере одно жаропонижающее средство, нестероидное противовоспалительное средство, наркотический или по меньшей мере один опиоидный аналгетик, седативно-снотворное средство, противосудорожное средство, антидепрессант, транквилизатор, антипсихотическое средство, стимуляторы центральной нервной системы, средство от паркинсонизма, смешанные средства для центральной нервной системы. Средство для автономной нервной системы может представлять собой по меньшей мере одно холинергическое средство (парасимпатомиметическое средство), антихолинергическое средство, адренергическое средство (симпатомиметическое средство), адреноблокатор (симпатолитическое средство),миорелаксант скелетных мышц, нейромышечные блокаторы. Средство для дыхательных путей может представлять собой по меньшей мере одно антигистаминное средство, бронходилататор, отхаркивающее средство или по меньшей мере одно противокашлевое средство, смешанные средства для дыхательных путей. Средства для желудочно-кишечного тракта могут представлять собой по меньшей мере одно антацидное средство, по меньшей мере один адсорбент или по меньшей мере одно ветрогонное средство,пищеварительные ферменты или по меньшей мере один растворитель желчных конкрементов, средство от диареи, слабительное средство, противорвотное средство, противоязвенное средство. Гормональное средство может представлять собой по меньшей мере один кортикостероид, андроген или по меньшей мере один анаболический стероид, эстроген или по меньшей мере один прогестин, гонадотропин, антидиабетическое средство или по меньшей мере один глюкагон, тиреоидный гормон, антигонист тиреоидного гормона, гипофизарный гормон, средство, подобное паращитовидному гормону. Средство для водно-солевого баланса представляет собой по меньшей мере одно мочегонное средство, электролит или по меньшей мере один заменяющий раствор, подкислитель или по меньшей мере один подщелачиватель. Средство, повышающее количество гемоглобина в крови, может представлять собой по меньшей мере одно кроветворное средство, антикоагулянт, производный препарат крови, тромболитический фермент. Противоопухолевое средство может представлять собой по меньшей мере одно алкилирующее средство,антиметаболит, противоопухолевый антибиотик, противоопухолевое средство, изменяющее баланс гормонов, смешанные противоопухолевые средства. Иммуномодулирующее средство может представлять собой по меньшей мере один иммунодепрессант, вакцину или по меньшей мере один токсоид, антитоксин или по меньшей мере один антивенин, иммунную сыворотку, модификатор биологической реакции. Глазное, ушное или назальное средство может представлять собой по меньшей мере одно дезинфицирующее глазное средство, противовоспалительное глазное средство, миотическое средство, мидриатическое средство, глазное сосудосуживающее средство, смешанные глазные, ушные или назальные средства. Местнодействующее средство может представлять собой по меньшей мере одно местное дезинфицирующее средство, средство, убивающее чесоточных клещей, или по меньшей мере один педикулицид,местный кортикостероид. Средство от нарушения питания может представлять собой по меньшей мере один витамин, минеральное вещество или средство, повышающее калорийность. См., например, приведенную выше публикацию Nursing 2001 Drug Handbook. По меньшей мере одно противоамебное средство или средство от простейших может быть по меньшей мере одним средством, выбранным из атовахона, гидрохлорида хлорохина, фосфата хлорохина,метронидазола, гидрохлорида метронидазола, изетионата пентамидина. По меньшей мере одно противоглистное средство может быть по меньшей мере одним средством, выбранным из мебендазола, памоат пирантела, тиабендазола. По меньшей мере одно противогрибковое средство может быть по меньшей мере одним средством, выбранным из амфотерицина В, комплекса амфотерицина В с холестерилсульфатома, комплекса амфотерицина В с липидом, липосомного препарата амфотерицина В, флуконазола,флуцитозина, гризеофулвин-микрозиза, гризеофулвин-ультрамикрозиза, инраконазола, кетоконазола,нистатина, гидрохлорида тербинафина. По меньшей мере одно противомалярийное средство может быть по меньшей мере одним средством, выбранным из гидрохлорида хлорохина, фосфата хлорохина, доксициклина, сульфата гидроксихлорохина, гидрохлорида мефлохина, фосфата примахина, пириметамина,пириметамина с сульфадоксином. По меньшей мере одно противотуберкулезное средство или противолепрозное средство может быть по меньшей мере одним средством, выбранным из клофазимина, циклосерина, дапсона, гидрохлорида этамбутола, изониазида, пиразинамида, рифабутина, рифампина, рифапентина, сульфата стрептомицина. По меньшей мере один аминогликозид может быть по меньшей мере одним средством, выбранным из сульфата амикацина, сульфата гентамицина, сульфата неомицина,- 24009377 сульфата стрептомицина, сульфата тобрамицина. По меньшей мере один пенициллин может быть по меньшей мере одним средством, выбранным из амоксициллина/клавуланата калия, тригидрата амоксициллина, ампициллина, ампициллина натрия, тригидрата ампициллина, ампициллина натрия/сулбактама натрия, клоксациллиннатрия, диклоксациллиннатрий, мезлоциллиннатрия, нафциллина натрия, оксациллина натрия, пенициллина G-бензатина, пенициллина G-калия, пенициллина G-прокаина, пенициллинаG-натрия, пенициллина V-калия, пиперациллина натрия, пиперациллина натрия/тазобактама натрия, тикарциллина динатрия, тикарциллина динатрия/клавураната калия. По меньшей мере один цефалоспорин может быть по меньшей мере одним средством, выбранным из цефаклора, цефадроксила, цефазолина натрия, цефдинира, гидрохлорида цефепима, цефиксима, цефметазола натрия, цефоницида натрия, цефоперазона натрия, цефотаксима натрия, цефотетана динатрия, цефокситина натрия, цефподоксима проксетила, цефпрозила, цефтазидима, цефтибутена, цефтизоксима натрия, цефтриаксона натрия, цефуроксима аксетила, цефуроксима натрия, гидрохлорида цефалексина, моногидрата цефалексина, цефрадина, лоракарбефа. По меньшей мере один тетрациклин может быть по меньшей мере одним средством, выбранным из гидрохлорида демеклоциклина, доксициклина кальция, гиклата доксициклина, гидрохлорида доксициклина, моногидрата доксициклина, гидрохлорида миноциклина, гидрохлорида тетрациклина. По меньшей мере один сульфонамид может быть по меньшей мере одним средством, аметоксазол, сульфизоксазол, ацетилсульфизоксазол. По меньшей мере один фторхинолон может быть по меньшей мере одним средством, выбранным из мезилата алатрофлоксацина, ципрофлоксацина, эноксацина, левофлоксгщина, гидрохлорида ломефлоксацина, налидиксиновой кислоты, норфлоксацина, офлоксацина, спарфлоксацина, мезилата тровафлоксацина. По меньшей мере один фторхинолон может быть по меньшей мере одним средством, выбранным из мезилата алатрофлоксацина, ципрофлоксацина, эноксацина, левофлоксацина, гидрохлорида ломефлоксацина, налидиксиновой кислоты, норфлоксацина, офлоксацина,спарфлоксацина, мезилата тровафлоксацина. По меньшей мере одно антивирусное средство может быть по меньшей мере одним средством, выбранным из сульфата абакавира, ацикловира натрия, гидрохлорида амантадина, ампренавира, цидофовира, мезилата делавирдина, диданозина, эфавиренца, фамцикловира,фомивирсена натрия, фоскарнета натрия, ганцикловира, сульфата индинавира, ламивудина, ламивудина/зидовудина, мезилата нелфинавира, невирапина, фосфата озелтамивира, рибавирина, гидрохлорида римантадина, ритонавира, сахинавира, мезилата сахинавира, ставудина, гидрохлорида валацикловира,залцитабина, занамивира, зидовудина. По меньшей мере одно макролидное дезинфицирующее средство может быть по меньшей мере одним средством, выбранным из азитромицина, кларитромицина, диритромицина, эритромицинового основания, эстолата эритромицина, этилсукцината эритромицина, лактобионата эритромицина, стеарата эритромицина. По меньшей мере одно смешанное дезинфицирующее средство может быть по меньшей мере одним средством, выбранным из азтреонама, бацитрацина, сукцината хлорамфеникола-натрия, гидрохлорида клиндамицина, гидрохлорида пальмитата клиндамицина,фосфата клиндамицина, имипенема и циластатина-натрия, меропенема, макрокристаллического нитрофурантоина, микрокристаллического нитрофурантоина, хинупристина/далфопристина, гидрохлорида спектиномицина, триметоприма, гидрохлорида ванкомицина. (См., например, публикацию pp. 24-214 ofNursing 2001 Drug Handbook). По меньшей мере одно инотропное средство может быть по меньшей мере одним средством, выбранным из лактата амринона, дигоксина, лактата милринона. По меньшей мере одно средство от аритмии может быть по меньшей мере одним средством, выбранным из аденозина, гидрохлорида амиодарона, сульфата атропина, тозилата бретилия, гидрохлорида дилтиазема, дизопирамида, фосфата дизопирамида, гидрохлорида эсмолола, ацетата флекаинида, фумарата ибутилида, гидрохлорида лидокаина, гидрохлорида мексилетина, гидрохлорида морицизина, фенитоина, фенитоина натрия, гидрохлорида прокаинамида, гидрохлорида пропафенона, гидрохлорида пропранолола, бисульфата хинидина, глюконата хинидина, полигалактуроната хинидина, сульфата хинидина, соталола, гидрохлорида токаинида, гидрохлорида верапамила. По меньшей мере одно средство от стенокардии может быть по меньшей мере одним средством, выбранным из безилата амлодипидина, амилнитрита, гидрохлорида бепридила, гидрохлорида дилтиазема, динитрата изосорбида, мононитрата изосорбида, надолола, гидрохлорида никардипина, нифедипина, нитроглицерина, гидрохлорида пропранолола, верпамила, гидрохлорида верапамила. По меньшей мере одно гипотензивное средство может быть по меньшей мере одним средством, выбранным из гидрохлорида ацебутолола, безилата амлодипина, атенолола, гидрохлорида беназеприла, гидрохлорида бетаксолола, фумарата бизопролола, кандесартана цилексетила, каптоприла, гидрохлорида картеолола, карведилола, клонидина, гидрохлорида клонидина, диазоксида, гидрохлорида дилтиазема, мезилата доксазозина, эналаприлата, малеата эналаприла, мезилата эпросартана, фелодипина, мезилата фенлдопама, фозиноприла-натрия, ацетата гуанабенза, сульфата гуанадрела, гидрохлорида гуанфацина,гидрохлорида гидралазина, ирбесартана, исрадипина, гидрохлорида лабеталола, лизиноприла, лозартанакалия, метилдопа, гидрохлорида метилдопата, сукцината метопролола, тартрата метопролола, миноксидила, гидрохлорида моэксиприла, надолола, гидрохлорида никардипина, нифедипина, низолдипина, нитропруссида-натрия, сульфата пенбутолола, периндоприла эрбумина, мезилата фентоламина, пиндолола,гидрохлорида празозина, гидрохлорида пропранолола, гидрохлорида хинаприла, рамиприла, телмисартана, гидрохлорида теразозина, малеата тимолола, трандолаприла, валсартана, гидрохлорида верапамила.- 25009377 По меньшей мере одно средство от гиперлипемии может быть по меньшей мере одним средством, выбранным из аторвастатина-кальция, церивастатина-натрия, холестирамина, гидрохлорида колестипола,фенофибрата (очень тонко измельченного), флувастатина-натрия, гемфиброзила, ловастатина, ниацина,правастатина-натрия, симвастатина. По меньшей мере одно смешанное средство для сердечнососудистой системы может быть по меньшей мере одним средством, выбранным из абциксимаба, алпростадила, гидрохлорида арбутамина, цилостазола, бисульфата клопидогрела, дипиридамола, эптифибатида, гидрохлорида мидодрина, пентоксифиллина, гидрохлорида тиклопидина, гидрохлорида тирофибана.(См., например, публикацию pp. 215-336 of Nursing 2001 Drug Handbook). По меньшей мере один ненаркотический аналгетик или одно жаропонижающее средство может быть по меньшей мере одним средством, выбранным из ацетаминофена, аспирина, трисалицилата холина-магния, дифлунизала, салицилата магния. По меньшей мере одно нестероидное противовоспалительное средство может быть по меньшей мере одним средством, выбранным из целекоксиба, диклофенакакалия, ликлофенака-натрия, этодолака, фенопрофена-кальция, флурбипрофена, ибупрофена, индометацина, тригидрата индометацина-натрия, кетопрофена, кеторолака-трометамина, набуметона, напроксена,напроксена-натрия, оксапрозина, пироксикама, рофекоксиба, сулиндака. По меньшей мере один наркотический или опиоидный аналгетик может быть по меньшей мере одним средством, выбранным из гидрохлорида алфентанила, гидрохлорида бупренорфина, тартрата буторфанола, фосфата кодеина, сульфата кодеина, цитрата фентанила, системы трансдермальной доставки фентанила, системы доставки фентанила через слизистую оболочку, гидрохлорида гидроморфона, гидрохлорида меперидина, гидрохлорида метадона, гидрохлорида морфина, сульфат морфина, тартрат морфина, гидрохлорид налбуфина, гидрохлорида оксикодона, пектината оксикодона, гидрохлорида оксиморфона, гидрохлорида пентазоцина, гидрохлорида налоксона, лактата пентазоцина, гидрохлорида пропоксифена, напсилата пропоксифена, гидрохлорида ремифентанила, цитрата суфентанила, гидрохлорида трамадола, по меньшей мере одно седативно-снотворное средство может быть по меньшей мере одним средством, выбранным из хлоральгидрата, эстазолама, гидрохлорида флуразепама, пентобарбитала, пентобарбитала-натрия, фенобарбитала-натрия, секобарбитала-натрия, темазепама, триазолама, залептона,татртата золпидема. По меньшей мере одно противосудорожное средство может быть по меньшей мере одним средством, выбранным из ацетазоламида-натрия, карбамазепина, клоназепама, дикалийклоразепата, диазепама,дивалпроэкса-натрия, этосуксимода, фосфенитоина-натрия, габапентина, ламотригина, сульфата магния,фенобарбитала, фенобарбитала-натрия, фенитоина, фенитоина-натрия, фенитоина-натрия (пролонгированного действия), примидона, гидрохлорида тиагабина, топирамата, валпроата натрия, валпроиновой кислоты. По меньшей мере один антидепрессант может быть по меньшей мере одним средством, выбранным из гидрохлорида амитриптилина, памоата амитриптилина, амоксапина, гидрохлорида бупропиона, гидробромида циталопрама, гидрохлорида кломипрамина, гидрохлорида дезипрамина, гидрохлорида доксепина, гидрохлорида флуоксетина, гидрохлорида имипрамина, памоата имипрамина, миртазапина, гидрохлорида нефазодона, гидрохлорида нортриптилина, гидрохлорида пароксетина, сульфата фенелзина,гидрохлорида сертралина, сульфата транилципромина, малеата тримипрамина, гидрохлорида венлафаксина. По меньшей мере один транквилизатор может быть по меньшей мере одним средством, выбранным из алпразолама, гидрохлорида буспирона, хлордиазепоксида, гидрохлорида хлордиазепоксида, дикалийклоразепата, диазепама, гидрохлорида доксепина, эмбоната гидроксизина, гидрохлорида гидроксизина, памоата гидроксизина, лоразепама, мефробамата, гидрохлорида мидазолама, оксазепама. По меньшей мере одно антипсихотическое средство может быть по меньшей мере одним средством, выбранным из гидрохлорида хлорпромазина, клозапина, деканоата флуфеназина, энантата флуэфеназина, гидрохлорида флуфеназина, галогенперидола, деканоата галогенперидола, лактата галогенперидола, гидрохлорида локсапина, сукцината локсапина, безилата мезоридазина, гидрохлорида молиндона,оланзапина, перфеназина, пимозида, прохлорперазина, фумарата кветиапина, рисперидона, гидрохлорида тиорадазина, тиотиксена, гидрохлорида тиотиксена, гидрохлорида трифлуоперазина. По меньшей мере один стимулятор центральной нервной системы может быть по меньшей мере одним средством, выбранным из сульфата амфетамина, кофеина, сульфата декстроамфетамина, гидрохлорида доксапрама, гидрохлорида метамфетамина, гидрохлорида метилфенидата, модафинил, пемолин,гидрохлорид фентермина. По меньшей мере одно средство от паркинсонизма может быть по меньшей мере одним средством,выбраым из гидрохлорида амантадина, мезилата бензтропина, гидрохлорида биперидена, лактата биперидена, мезилата бромкриптина, карбидопа-леводопа, энтакапона, леводопа, мезилата перголида, дигидрохлорида прамипексола, гидрохлорида ропинирола, гидрохлорида селегилина, толкапона, тригексифенидилгидрохлорида. По меньшей мере одно смешанное средство для центральной нервной системы может быть по меньшей мере одним средством, выбранным из гидрохлорида бупропиона, гидрохлорида донепезила,дроперидола, малеата флувоксамина, карбоната лития, цитрата лития, гидрохлорида наратриптана, нико- 26009377 тина-полакрилекса, системы трансдермальной доставки никотина, пропофола, бензоата ризатриптана,моногидрата гидрохлорида сибутрамина, сукцината суматриптана, гидрохлорида такрина, золмитриптана. (См., например, публикацию pp. 337-530 of Nursing 2001 Drug Handbook). По меньшей мере одно холинергическое средство (например, парасиматомиметическое средство) может быть по меньшей мере одним средством, выбранным из хлорида бетанехола, хлорида эдрофония,бромида неостигмина, метилсульфата неостигмина, салицилата физостигмина, бромида пиридостигмина. По меньшей мере одно антихолинергическое средство может быть по меньшей мере одним средством, выбранным из сульфата атропина, гидрохлорида дицикломина, гликопирролата, гиосциамина,сульфата гиосциамина, бромида пропантелина, скополамина, бутилбромида скополамина, гидробромида скополамина. По меньшей мере одно адренергическое средство (симпатомиметическое средство) может быть по меньшей мере одним средством, выбранным из гидрохлорида добутамина, гидрохлорида допамина, битартрата метараминола, битартрата норепинефрина, гидрохлорида фенилэфрина, гидрохлорида псевдоэфедрина, сульфата псевдоэфедрина. По меньшей мере один адреноблокатор (симпатолитическое средство) может быть по меньшей мере одним средством, выбранным из мезилата дигидроэрготамина, тартрата эрготамина, малеата метисергида, гидрохлорида пропранолола. По меньшей мере один миорелаксант скелетных мышц может быть по меньшей мере одним средством, выбранным из баклофена, каризопродола, хлорзоксазона, гидрохлорида циклобензаприна, дантролена-натрия, метокарбамола, гидрохлорида тизанидина. По меньшей мере один нейромышечный блокатор может быть по меньшей мере одним средством,выбранным из безилата атракурия, безилата цизатракурия, хлорида доксакурия, хлорида мивакурия, бромида панкурония, бромида пипекурония, бромида рапакурония, бромида рокурония, хлорида сукцинилхолина, хлорида тубокурарина, бромида векурония. (См., например, публикацию pp. 531-84 of Nursing 2001 Drug Handbook). По меньшей мере одно антигистаминное средство может быть по меньшей мере одним средством,выбранным из малеата бромфенирамина, гидрохлорида цетиризина, малеата хлорфенирамина, фумарата клемастина, гидрохлорида ципрогептадина, гидрохлорида дифенгидрамина, гидрохлорида фексофенадина, лоратадина, гидрохлорида прометазина, теоклата прометазина, гидрохлорида трипролидина. По меньшей мере один бронходилататор может быть по меньшей мере одним средством, выбранным из албутерона, сульфата албутерона, аминофиллина, сульфата атропина, сульфата эфедрина, эпинефрина, битартрата эпинефрина, гидрохлорида эпинефрина, бромида ипратропия, изопротеренола, гидрохлорида изопротеренола, сульфата изопротеренола, гидрохлорида левалбутерола, сульфата метапротеренола, окстрифиллина, ацетата пирбутерола, ксинафоата салметерола, сульфата тербуталина, теофиллина. По меньшей мере одно отхаркивающее средство или противокашлевое средство может быть по меньшей мере одним средством, выбранным из бензонатата, фосфата кодеина, сульфата кодеина, гидробромида декстраметорфана, гидрохлорида дифенгидрамина, гуайфенезина, гидрохлорида гидроморфона. По меньшей мере одно смешанное средство для дыхательных путей может быть по меньшей мере одним средством, выбранным из ацетилцистеина, дипропионата беклометазона, берактанта, будезонида, калфактанта, кромолина-натрия, альфа-дорназа, эпопростенола-натрия, флунизолида, пропионата флутиказона, монтелукаста-натрия, недокромиля-натрия, паливизумабя, ацетонидя триамцинолона, зафирлукастя, зилеутоня. (См., например, публикацию pp. 585-642 of Nursing 2001 Drug Handbook). По меньшей мере одно антацидное средство, адсорбент или ветрогонное средство может быть по меньшей мере одним средством, выбранным из карбоната алюминия, гидроксида алюминия, карбоната кальция, магальдрата, гидроксида магния, оксида магния, симетикона, бикарбоната натрия. По меньшей мере один пищеварительный фермент или растворитель желчных конкрементов может быть по меньшей мере одним средством, выбранным из панкреатина, панкрелипазы, урзодиола. По меньшей мере одно средство от диареи может быть по меньшей мере одним средством, выбранным из аттапульгита, субсалицилата висмута, калыдий-поликарбофила, гидрохлорида дифеноксилата или сульфата атропина, лоперамида, ацетата октреотида, опиумной настойки, опиумной настойки (камфорированной). По меньшей мере одно слабительное средство может быть по меньшей мере одним средством, выбранным из бизокодила, кальция-поликарбофила, жостера, ароматического жидкого экстракта жостера,жидкого экстракта жостера, касторового масла, докузата кальция, докузата натрия, глицерина, лактулозы, цитрата магния, гидроксида магния, сульфата магния, метилцеллюлозы, минерального масла, полиэтиленгликоля или раствора электролита, псиллиума, кассии, фосфата натрия. По меньшей мере одно противорвотное средство может быть по меньшей мере одним средством, выбиранным из гидрохлорида хлорпромазина, дименгидрината, мезилата доласетрона, дронабинола, гидрохлорида гранисетрона, гидрохлорида меклизина, гидрохлорида метоклопроамида, гидрохлорида ондансетрона, перфеназина, прохлорперазина, эдизилата прохлорперазина, малеата прохлорперазина, гидрохлорида прометазина, скополамина, малеата тиэтилперазина, гидрохлорида триметобензамида. По меньшей мере одно противоязвенное средство может быть по меньшей мере одним средством,- 27009377 выбранным из циметидина, гидрохлорида циметидина, фамотидина, лансопразола, мизопростола, низатидина, омепразола, рабепрозола-натрия, цитратя рантидиня-висмута, гидрохлорида ранитидина, сукралфата. (См., например, публикацию pp. 643-95 of Nursing 2001 Drug Handbook). По меньшей мере один кортикостероид может быть по меньшей мере одним средством, выбранным из бетаметазона, ацетата бетаметазона или фосфата бетаметазона-натрия, фосфата бетаметазона-натрия,ацетата кортизона, дексаметазона, ацетата дексаметазона, фосфата дексаметазона-натрия, ацетата флудрокортизона, гидрокортизона, ацетата гидрокортизона, ципионата гидрокортизона, фосфата гидрокортизон-натрия, сукцината гидрокортизона-натрия, метилпреднизолона, ацетата метилпреднизолона, сукцината метилпреднизолона-натрия, преднизолона, ацетата преднизолона, фосфата преднизолона-натрия,тебутата преднизолона, преднизона, триамцинолона, ацетонида триамцинолона, диацетата триамцинолона. По меньшей мере один андроген или анаболический стероид может быть по меньшей мере одним средством, выбранным из даназола, флуоксиместерона, метилтестостерона, деканоата нандролона, фенпропионата нандролона, тестостерона, ципионата тестостерона, энантата тестостерона, пропионата тестостерона, системы трансдермальной доставки тестостерона. По меньшей мере один эстроген или прогестин может быть по меньшей мере одним средством, выбранным из этерифицированных эстрогенов, эстрадиола, ципионата эстрадиола, системы трансдермальной доставки эстрадиола/ацетата норетиндрона, валерата эстрадиола, эстрогенов (конъюгированных),эстропипата, этинилэстрадиола, этинилэстрадиола и дезогестрела, этинилэстрадиола и диацетата этинодиола, этинилэстрадиола и дезогестрела, этинилэстрадиола и диацетата этинодиола, этинилэстрадиола и левоноргестрела, этинилэстрадиола и норетиндрона, этинилэстрадиола и ацетата норетиндрона, этинилэстрадиола и норгестимата, этинилэстрадиола и норгестрела, этинилэстрадиола и норетиндрона, ацетата и фумарата железа, левоноргестрела, ацетата медроксипрогестерона, местранола и норетиндрона, норетиндрона, ацетата норетиндрона, норгестрела, прогестерона. По меньшей мере один гонадотропин может быть по меньшей мере одним средством, выбранным из ацетат ганиреликса, ацетата гонадорелина, ацетата гистрелина, менотропины. По меньшей мере одно антидиабетическое средство или глюкагон может быть по меньшей мере одним средством, выбраым из акарбозы, хлорпропамида, глимепирида, глипизида, глюкагона, глибурида, инсулинов, гидрохлорида метформина, миглитола, гидрохлорида пиоглитазона, репаглинида, малеата розиглитазона, троглитазона. По меньшей мере один тиреоидный гормон может быть по меньшей мере одним средством, выбранным из левотироксина-натрия, лиотиронина-натрия, лиотрикса, тиреоида. По меньшей мере один антагонист тиреоидного гормона может быть по меньшей мере одним средством, выбранным из метимазола, иодида калия, иодида калия (насыщенного раствора), пропилтиоурацила, радиоактивного иода (иодида натрия I), концентрированного раствора иода. По меньшей мере один гипофизарный гормон может быть по меньшей мере одним средством, выбранным из кортикотропина, козинтропина, ацетата десмофрессина, ацетата лейпролида, кортикотропина продленного действия, соматрема, соматропина, вазопрессина. По меньшей мере одно средство, подобное паращитовидному гормону, может быть по меньшей мере одним средством, выбранным из кальцифедиола, кальцитонина (человека), кальцитонина (лосося),кальцитриола, дигидротахистерола, динатрийэтидроната. (См., например, публикацию pp. 696-796 ofNursing 2001 Drug Handbook). По меньшей мере одно мочегонное средство может быть по меньшей мере одним средством, выбранным из ацетазоламида, ацетазоламида-натрия, гидрохлорида амилорида, буметанида, хлорталидона,этакрината натрия, этакриновой кислоты, фуроземида, гидрохлортиазида, индапамида, маннита, метолазона, спиронолактона, торземида, триамтерена, мочевины. По меньшей мере один электролит или заменяющий раствор может быть по меньшей мере одним средством, выбранным из ацетата кальция, карбоната кальция, хлорида кальция, цитрата кальция, глюбионата кальция, глюцептата кальция, глюконата кальция, лактата кальция, фосфата кальция (двухосновного), фосфата кальция (трехосновного), декстрана (высокомолекулярного), декстрана (низкомолекулярного), гетакрахмала, хлорида магния, сульфата магния, ацетата калия, бикарбоната калия, хлорида калия, глюконата калия, инъекционного раствора Рингера (лактированного), хлорида натрия. По меньшей мере один подкислитель или подщелачиватель может быть по меньшей мере одним средством, выбранным из бикарбоната натрия, лактата натрия, трометамина. (См., например, публикацию pp. 797-833of Nursing 2001 Drug Handbook). По меньшей мере одно средство, повышающее количество гемоглобина в крови, может быть по меньшей мере одним средством, выбранным из фумарата железа(2), глюконата железа(2), сульфата железа(2), сульфата железа (2) (сухого), железодекстрана, железосорбита, комплекса полисахарида-железа,комплекса натрия-глюконата железа. По меньшей мере один антикоагулянт может быть по меньшей мере одним средством, выбранным из ардепарина натрия, далтепарина натрия, данапароида натрия, эноксапарина натрия, гепарина кальция, гепарина натрия, варфарина натрия. По меньшей мере один производный препарат крови может быть по меньшей мере одним средством, выбранным из альбумина 5%,альбумина 25%, антигемофильного фактора, антикоагулянтного комплекса, антитромбина III (человека),- 28009377 фактора IX (человека, комплекс фактора IX, белковых фракций плазмы. По меньшей мере один тромболитический фермент может быть по меньшей мере одним средством, выбранным из алтеплазы, анистреплазы, ретеплазы (рекомбинантной), стрептокиназы, урокиназы. (См., например, публикацию pp. 834-66of Nursing 2001 Drug Handbook). По меньшей мере одно алкилирующее средство может быть по меньшей мере одним средством,выбранным из бусульфана, карбоплатина, кармустина, хлорамбуцила, цисплатина, циклофосфамида,ифосфамида, ломустина, гидрохлорида мехлорэтамина, мелфалана, гидрохлорида мелфалана, стрептозоцина, темозоломида, тиотепа. По меньшей мере один антиметаболит может быть по меньшей мере одним средством, выбранным из капецитабина, кладрибина, цитарабина, флоксуридина, фосфата флударабина,фторурацила, гидроксимочевины, меркаптопурины, метотрексаты, метотрексата-натрия, тиогуанина. По меньшей мере один противоопухолевый антибиотик может быть по меньшей мере одним средством, выбранным из сульфата блеомицина, дактиномицина, липосомного препарата цитрата даунорубицина, гидрохлорида даунорубицина, гидрохлорида доксорубицина, липосомного препарата гидрохлорида доксорубицина, гидрохлорид эпирубицина, гидрохлорида идарубицина, митомицина, пентостатина, пликамицина, валрубицина. По меньшей мере одно противоопухолевое средство, изменяющее гормональный баланс, может быть по меньшей мере одним средством, выбранным из анастозола, бикалутамида, фосфата эстрамустина-натрия, экземестана, флутамида, ацетата гозерелина, летрозола, ацетата лейпролида,ацетата мегестрола, нилутамида, цитрата тамоксифена, тестолактона, цитрата торемифена. По меньшей мере одно смешанное противоопухолевое средство может быть по меньшей мере одним средством, выбранным из аспарагиназы, бациллы Кальметта-Герена (BCG) (живой внутрипузырной), дакарбазина, доцетаксела, этопозида, фосфата этопозида, гидрохлорида гемцитабина, гидрохлорида иринотекана, митотана, гидрохлорида митоксантрона, паклитаксела, пегаспаргазы, порфимер-натрия, гидрохлорида прокарбазина, ритуксимаба, тенопозида, гидрохлорида топотекана,транстузумаба, третиноина, сульфата винбластина, сульфата винкристина, тартрата винореблина. (См., например, публикацию pp. 867-963 ofNursing 2001 Drug Handbook). По меньшей мере один иммунодепрессант может быть по меньшей мере одним средством, выбранным из азатиоприна, базиликсимаба, циклоспорина, даклизумаба, иммуноглобина лимфоцитов, муромонаба-CD3, микофенолята мофетила, гидрохлорида микрофенолята мофетила, сиролимуса, такролимуса. По меньшей мере одна вакцина или токсоид может быть по меньшей мере одним средством, выбранным из вакцины BCG, противохолерной вакцины, дифтерийной и столбнячной токсины (адсорбированных),адсорбированных дифтерийных и столбнячных токсин и бесклеточной вакцины против коклюша, дифтерийной и столбнячной токсины и цельноклеточной вакцины против коклюша, вакцин на основе конъюгата Haemophilius, вакцины против гепатита А(инактивированной), вакцины против гепатита В (рекомбинантной), вакцины против вируса гриппа 1999-2000 трехвалентных типов АВ (очищенных поверхностных антигенов), вакцины против вируса гриппа 1999-2000 трехвалентных типов АВ (субвириона или очищенного субвириона), вакцины против вируса гриппа 1999-2000 трехвалентных типов АВ(цельного вириона), вакцины против вируса японского энцефалита (инактивированной), вакцины против болезни Лима (рекомбинантной OspA), вакцины против вирусов кори, паротита и краснухи (живой), вакцины против вируса кори, паротита и краснухи (живой ослабленной), вакцины против вируса кори (живой ослабленной), менингококковой полисахаридной вакцины, вакцины против вируса паротита (живой),вакцины против вирусных бляшек, пневмококковой вакцины (поливалентной), полиомиелитной вакцины(инактивированной), полиомиелитной вакцины (живой, пероральной, трехвалентной), вакцины против бешенства (адсорбированной), вакцины против бешенства (диплоидной клетки человека), вакцины против вируса краснухи и паротита (живой), вакцины против вируса краснухи (живой, ослабленной), столбнячного токсина (адсорбированного), столбнячного токсина (жидкого), тифозной вакцины (пероральной), тифозной вакцины (парентеральной), тифозной полисахаридной вакцины, вакцины против вируса ветряной оспы, вакцины против желтой лихорадки. По меньшей мере один антитоксин или антивенин может быть по меньшей мере одним средством, выбранным из антивенина против яда паука "черная вдова", антисыворотки против яда Crotalidae (поливалентной), антитоксина против дифтерии (свиньи),антивенина против ядра Micrurus fulcius. По меньшей мере одна иммунная сыворотка может быть по меньшей мере одним средством, выбранным иммуноглобулина цитомегаловируса (внутривенный), иммуноглобина против гепатита В (человека), иммуноглобулина для внутримышечного введения, иммуноглобулина для внутривенного введения, иммуноглобулина против бешенства (человека), иммуноглобулина против респираторно-синцитиального вируса для внутривенного введения (человека), иммуноглобулина Rh0(D) (человека), иммуноглобулина Rh0(D) для внутривенного введения (человека), противостолбнячного иммуноглобулина (человека), иммуноглобулина против вируса ветряной оспы. По меньшей мере один модификатор биологической реакции может быть по меньшей мере одним средством,выбранным из альдеслейкина, альфа-эпоэтина, филграстима, ацетата глатирамера для инъекций, интерферона альфакона-1, интерферона альфа-2 а (рекомбинантного), интерферона альфа-2b (рекомбинантного), интерферона бета-1a, инртерферона бета-1b (рекомбинантного), интерфероно гамма-1b, гидрохлорида левамизола, опрелвекина, сарграмостима. (См., например, публикацию pp. 964-1040 of Nursing 2001- 29009377 По меньшей мере одно глазное дезинфицирующее средство может быть по меньшей мере одним средством, выбранным из бацитрацина, хлорамфеникола, гидрохлорида ципрофлоксацина, эритромицина, сульфата гентамицина, офлоксацина 0,3%, сульфата полимиксина В, сульфацетамида-натрия 10%,сульфацетамида-натрия 15%, сульфацетамида-натрия 30%, тобрамицина, видарабина. По меньшей мере одно глазное противовоспалительное средство может быть по меньшей мере одним средством, выбранным из дексаметазона, фосфата дексаметазона-натрия, диклофенака-натрия 0,1%, фторметолона, флурбипрофена-натрия, кеторолактрометамина, ацетата преднизолона (суспензии), фосфата преднизолонанатрия (раствора). По меньшей мере одно миотическое средство может быть по меньшей мере одним средством, выбранным из хлорида ацетилхолина, карбахола (внутриглазного средства), карбахола (местного средства), иодида эхотиофата, пилокарпина, гидрохлорида пилокарпина, нитрата пилокарпина. По меньшей мере одно мидриатическое средство может быть по меньшей мере одним средством,выбранным из сульфата атропина, гидрохлорида циклопентолата, гидрохлорида эпинефрина, эпинефрилбората, гидробромида гоматропина, гидрохлорида фенилэфрина, гидробромида скополамина, тропикамида. По меньшей мере одно глазное сосудосуживающее средство может быть по меньшей мере одним средством, выбранным из гидрохлорида нафазолина, гидрохлорида оксиметазолина, гидрохлорида тетрагидрозолина. По меньшей мере одно смешанное глазное средство может быть по меньшей мере одним средством, выбранным из гидрохлорида апраклонидина, гидрохлорида бетаксолола, тартрата бримонидина, гидрохлорида картеолола, гидрохлорида дипивефрина, гидрохлорида дорзоламида, дифумарата эмедастина, флуоресцеина-натрия, фумарата кетотифена, латанопроста, гидрохлорида левобунолола,гидрохлорида метипранолола, хлорида натрия (гипотонического средства), малеата тимолола. По меньшей мере одно ушное средство может быть средством, выбранным из борной кислоты, пероксида карбамида, хлорамфеникола, конденсата олеата триэтиноламина с полипептидом. По меньшей мере одно назальное средство может быть по меньшей мере одним средством, выбранным из дипропионата беклометазона, будезонида, сульфата эфедрина, гидрохлорида эпинефрина, флунизолида, пропионата флутиказона, гидрохлорида нафазолина, гидрохлорида оксиметазолина, гидрохлорида фенилэфрина, гидрохлорида тетрагидрозолина, ацетонида триамцинолона, гидрохлорида ксилометазолина. (См.,например, публикацию pp. 1041-97 of Nursing 2001 Drug Handbook). По меньшей мере одно местное дезинфицирующее средство может быть по меньшей мере одним средством, выбранным из ацикловира, амфотерицина В, крема на основе азелаиновой кислоты, бацитрацина, нитрата бутоконазола, фосфата клиндамицина, клотримазола, нитрата эконазола, эритромицина,сульфата гентамицина, кетоконазола, ацетата мафенида, метронидазола (для местного применения), нитрата миконазола, мупироцина, гидрохлорида нафтифина, сульфата неомицина, нитрофуразона, нистатина, серебряного сульфадиазина, гидрохлорида тербинафина, терконазола, гидрохлорида тетрациклина,тиоконазола, толнафтата. По меньшей мере одно средство, убивающее чесоточных клещей, или педикулицид может быть по меньшей мере одним средством, выбранным из кротамитона, линдана, перметрина, пиретринов. По меньшей мере один местный кортикостероид может быть по меньшей мере одним средством, выбранным из дипропионата бетаметазона, валерата бетаметазона, пропионата клобетазола, дезонида, дезоксиметазона, дексаметазона, фосфата дексаметазона-натрия, диацетата дифлоразона, ацетонида флуоцинолона, флуоцинонида, флурандренолида, пропионата флутиказона, галционида, гидрокортизона, ацетата гидрокортизона, бутирата гидрокортизона, валерата гидрокортизона, фуроата мометазона, ацетонида триамцинолона. (См., например, публикацию pp. 1098-1136 of Nursing 2001 Drug Handbook). По меньшей мере один витамин или минерал может быть по меньшей мере одним средством, выбранным из витамина А, комплекса витамина В, цианокобаламина, фолиевой кислоты, гидроксокобаламина, лейковорина-кальция, ниацина, ниацинамида, гидрохлорида пиридоксина, рибофлавина, гидрохлорида тиамина, витамина С, витамина D, холекальциферола, эргокальциферола, аналог витамина D,доксеркальциферола, парикалыдитола, витамина Е, аналога витамина К, фитонадиона, фторида натрия,фторида натрия (для местного применения), микроэлементов, хрома, меди, иода, марганеца, селена, цинка. По меньшей мере одно средство, повышающее калорийность, может быть по меньшей мере одним средством, выбранным из вливания аминокислоты (кристаллический препарат), вливания аминокислоты в декстрозе, вливания аминокислоты с электролитами, вливания аминокислоты с электролитами в декстрозе, вливания аминокислоты при печеночной недостаточности, вливания аминокислоты при высоком метаболическом стрессе, вливания аминокислоты при почечной недостаточности, декстрозы, жировых эмульсий, триглицеридов со средней цепью. (См., например, публикацию pp. 1137-63 of Nursing 2001Drug Handbook). Композиции по основе ЕРО-имитирующего миметического антитела с центральной шарнирной областью или полипептида по настоящему изобретению могут далее включать любое приемлемое и/или эффективное количество композиции или фармацевтической композиции, содержащей по меньшей мере одно ЕРО-имитирующее миметическое антитело с центральной шарнирной областью или белок для введения в клетку, ткань, орган, животному или субъекту, нуждающемуся в такой модуляции или лечении,которая далее необязательно включает по меньшей мере одно средство, выбранное из по меньшей мере
МПК / Метки
МПК: C07K 16/46, C07K 14/435, A61K 39/395, A61K 38/16, C07H 21/00, C12N 15/79
Метки: композиции, человека, областью, центральной, способы, применения, еро-имитирующие, шарнирной, миметические, антитела
Код ссылки
<a href="https://eas.patents.su/30-9377-ero-imitiruyushhie-mimeticheskie-antitela-cheloveka-s-centralnojj-sharnirnojj-oblastyu-kompozicii-sposoby-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Еро-имитирующие миметические антитела человека с центральной шарнирной областью, композиции, способы и применения</a>
Предыдущий патент: Нуклеиновые кислоты, специфично связывающие биоактивный грелин
Следующий патент: Многослойная, диспергируемая во рту таблетка
Случайный патент: Способ приготовления наносуспензии для изготовления полимерного нанокомпозита