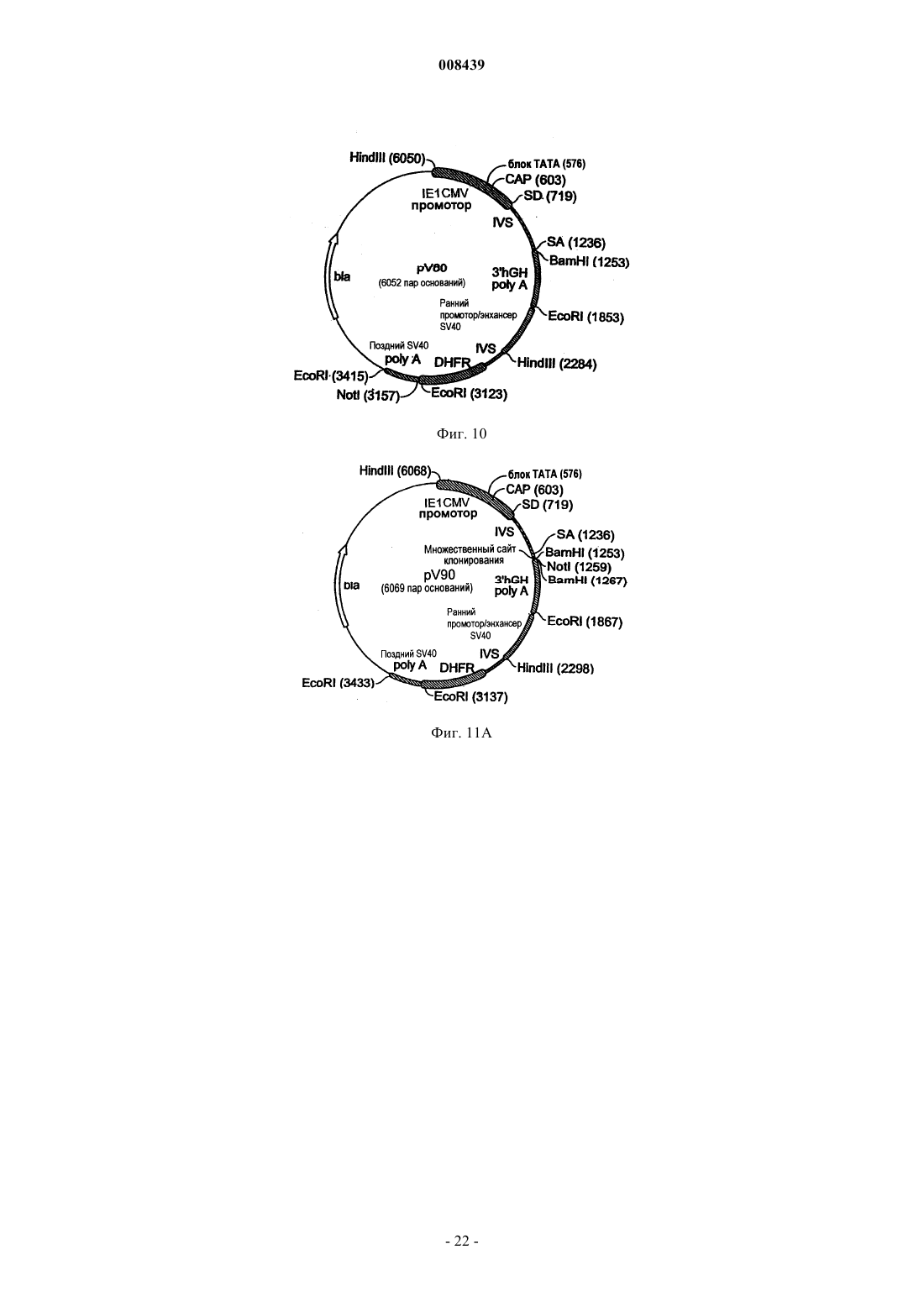
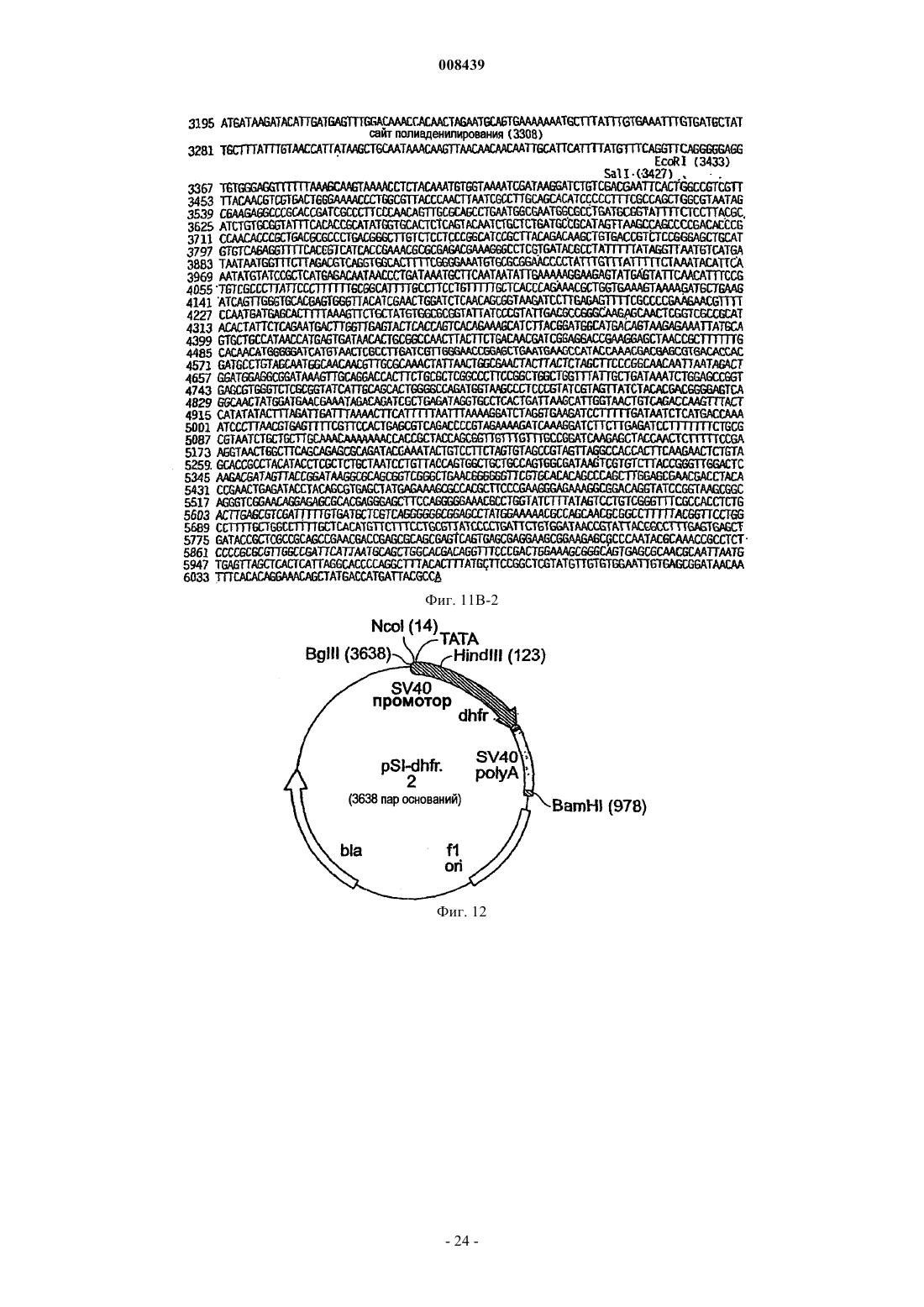
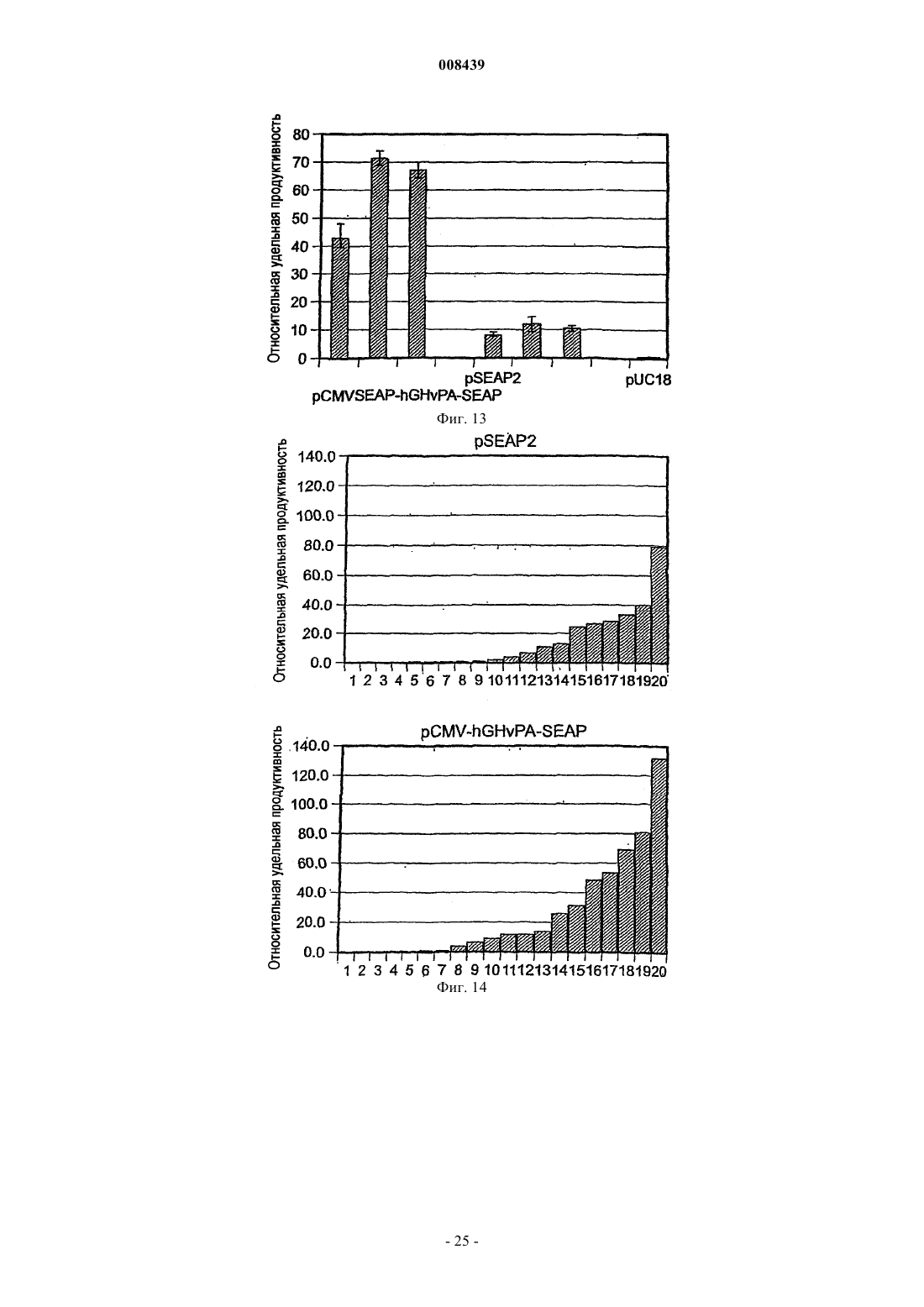
Экспрессионная кассета и вектор для временной или постоянной экспрессии экзогенных молекул
Формула / Реферат
1. Экспрессионная кассета, включающая область раннего промотора 1 (hCMV IE1)/энхансера CMV человека; интересующий полинуклеотид и сигнальный домен polyA варианта гормона роста человека (hGHv) или его вариант, где сигнальный домен hGHv polyA имеет длину по крайней мере 100 нуклеотидов и содержит последовательность ААТААА, и вариант polyA по крайней мере на 92% идентичен сигнальному домену hGH polyA.
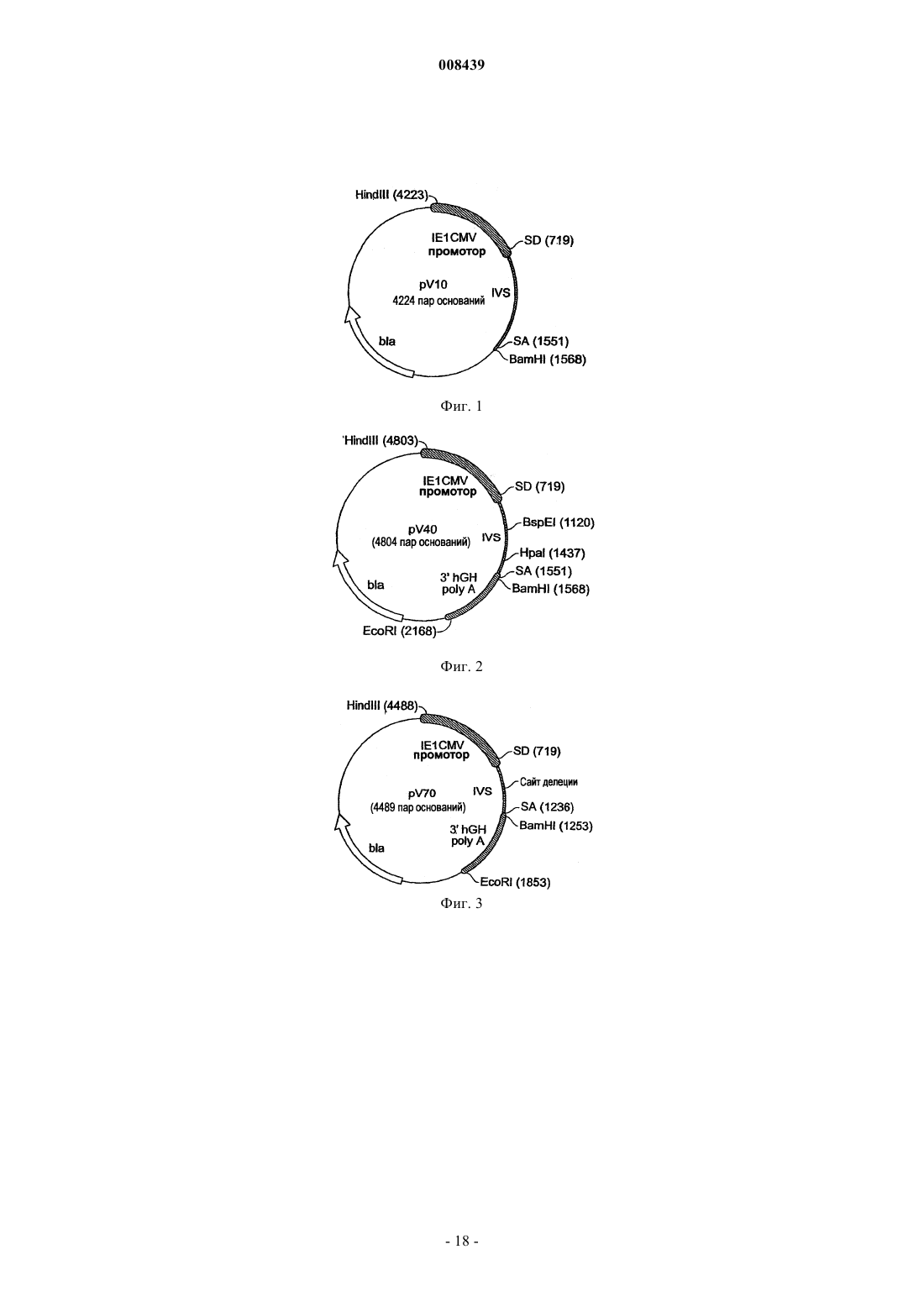
2. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV включает последовательность, представленную от приблизительно x1 до приблизительно x2 последовательности SEQ ID NO:1, где x1 обозначает нуклеотид приблизительно от 1 до 20 последовательности SEQ ID NO:1, а x2 обозначает нуклеотид приблизительно от 715 до 720 последовательности SEQ ID NO:1.
3. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV включает последовательность SEQ ID NO:1.
4. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV комплементарна последовательности SEQ ID NO:1.
5. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит последовательность, которая по меньшей мере на 95% идентична SEQ ID NO:1 или комплементарной ей последовательности.
6. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит последовательность, которая по меньшей мере на 97% идентична SEQ ID NO:1 или комплементарной ей последовательности.
7. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит нуклеотид от 1 до 1867 последовательности SEQ ID NO:1.
8. Экспрессионная кассета по п.1, которая дополнительно включает вставочную последовательность переменной длины (VLIVS), содержащую донорный сайт сплайсинга и акцепторный сайт сплайсинга.
9. Экспрессионная кассета по п.8, где VLIVS включает интрон А гена IE1 hCMV.
10. Экспрессионная кассета по п.8, где VLIVS включает интрон А гена IE1 hCMV с делецией между акцепторным сайтом сплайсинга и донорным сайтом сплайсинга интрона А.
11. Экспрессионная кассета по п.8, где VLIVS включает последовательность от приблизительно х3 до х4 последовательности SEQ ID NO:1, где x3 обозначает нуклеотид между приблизительно 715-720 последовательности SEQ ID NO:1, а х4 обозначает нуклеотид между приблизительно 1236-1254 последовательности SEQ ID NO:1.
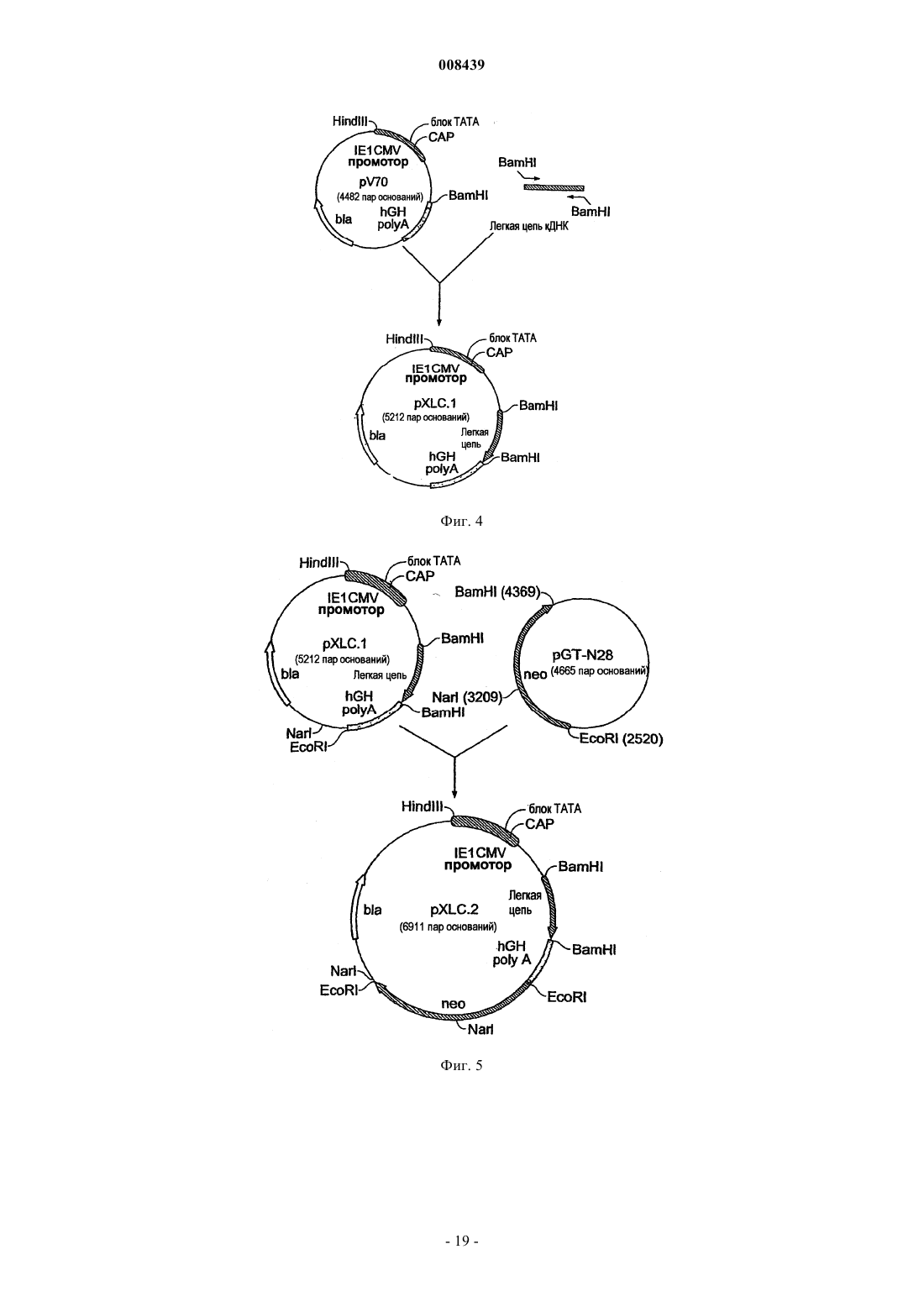
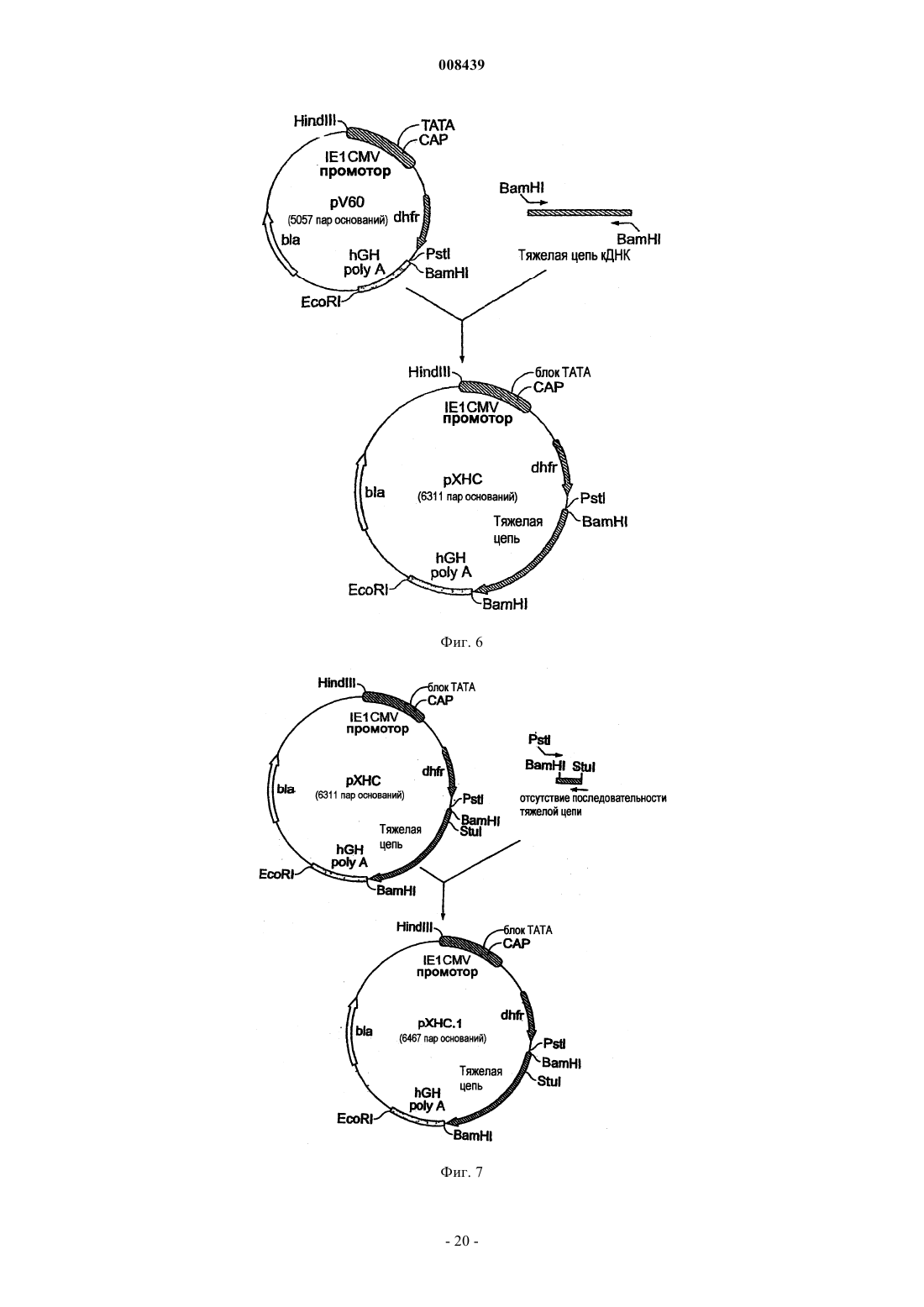
12. Экспрессионная кассета по п.1, дополнительно содержащая добавочный промоторный/энхансерный элемент или регуляторную область.
13. Экспрессионная кассета по п.12, где промоторный/энхансерный элемент представляет собой промоторный/энхансерный элемент SV40.
14. Экспрессионная кассета по п.12, где регуляторная область является областью полиаденилирования SV40.
15. Экспрессионная кассета по п.1, где маркер селекции выбран из группы, состоящей из дигидрофолатредуктазы, GPF, неомицина, Hugro, ZeocinФ, тимидинкиназы вируса простого герпеса, гипоксантин-гуанин фосфорибозилтрансферазы, аденинфосфорибозилтрансферазы, пуромицин N-ацетилтрансферазы или аденозиндеаминазы.
16. Экспрессионная кассета по п.15, где маркером селекции является дигидрофолатредуктаза.
17. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует терапевтический агент.
18. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует полипептид для диагностического или терапевтического применения.
19. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует антигенный полипептид для применения в качестве вакцины.
20. Экспрессионная кассета по п.1, где сигнальный домен polyA включает по крайней мере 100 последовательных нуклеотидов последовательности SEQ ID NO:19.
21. Экспрессионная кассета по п.20, где сигнальный домен polyA включает последовательность SEQ ID NO:19.
22. Экспрессионная кассета по п.1 в виде конструкции голой нуклеиновой кислоты.
23. Полинуклеотид, который специфически гибридизуется с полинуклеотидной последовательностью последовательности SEQ ID NO:1 приблизительно от 1 до приблизительно 1867 или ее фрагментом.
24. Экспрессионный вектор, содержащий экспрессионную кассету по любому из пп.1-22.
25. Клетка-хозяин, содержащая вектор экспрессии по п.24.
26. Клетка-хозяин, содержащая экспрессионную кассету по любому из пп.1-22.
27. Способ получения полипептида, включающий деление клетки-хозяина по п.25 или 26 и экспрессию интересующего полинуклеотида.
28. Способ доставки терапевтического агента животным, включающий деление клетки-хозяина по п.25 или 26 и экспрессию интересующего полинуклеотида.
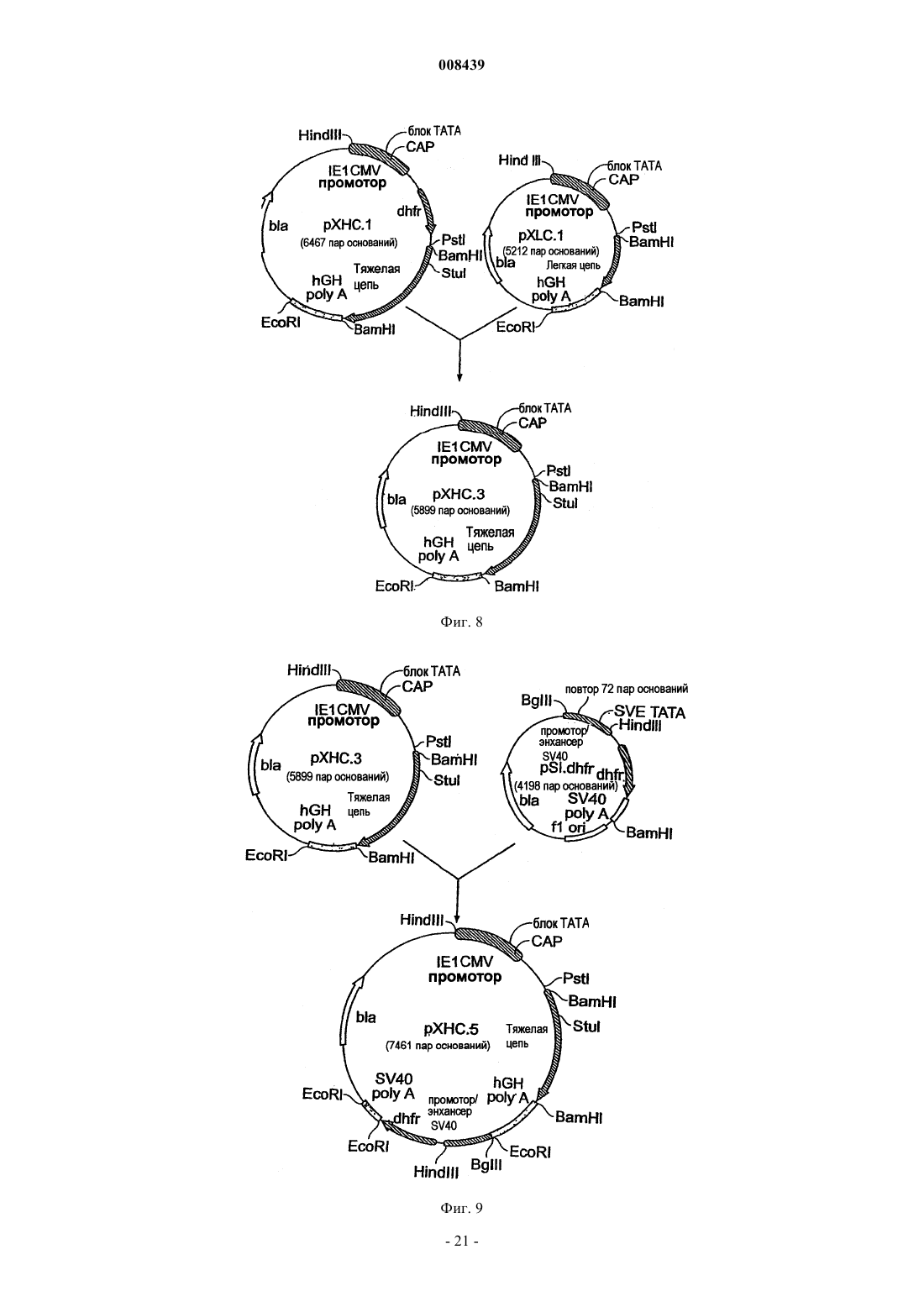
29. Генетический вектор hXHC.5.
Текст
008439 Область техники, к которой относится изобретение Настоящее изобретение относится к векторам и экспрессионным кассетам и, конкретно, к способам,композициям и системам для экспрессии экзогенной молекулы в организме. Уровень техники Введение молекул нуклеиновых кислот, полипептида, пептидов и небольших молекул в клеткимишени и ткани применяется как в качестве терапевтической системы доставки, так и с целью in vivo продукции терапевтических средств. Применимость данного подхода возросла благодаря прогрессу в понимании роли клеток-хозяев и молекулярной биологии клеточного деления, дифференцировки и механизмов экспрессии. Сущность изобретения Было обнаружено, что транскрипция, контролируемая промотором CMV и терминируемая доменомpolyA, полученным из варианта гена гормона роста человека (hGHv), более эффективна, чем другие векторы экспрессии, у которых отсутствует тот или другой, или оба этих элемента. Поэтому настоящее изобретение относится к экспрессионной кассете и вектору экспрессии, которые могут использоваться для экспрессии интересующих полинуклеотидов. Экспрессионная кассета по настоящему изобретению включает в себя комбинацию регуляторных элементов, которые обеспечивают эффективную транскрипцию, эффективную терминацию транскрипции и повышенную стабильность мРНК транскрибированных продуктов. В одном из вариантов осуществления экспрессионная кассета включает в себя промотор/энхансер цитомегаловируса человека, сайт клонирования или интересующий полинуклеотид и сигнальный домен полиаденилирования hGHv. Необязательно может присутствовать вставочная последовательность различной длины. Настоящее изобретение относится к экспрессионной кассете, которая включает в себя область раннего промотора 1 цитомегаловируса (CMV) человека (hCMV IE1)/энхансера, интересующий полинуклеотид и сигнальный домен polyA варианта гормона роста человека (hGHv) или его вариант. Длина Сигнальный домен polyA имеет длину по крайней мере 100 нуклеотидов и содержит последовательность ААТААА и по крайней мере на 92% идентичен сигнальному домену polyA hGH. Настоящее изобретение также относится к вектору экспрессии, который включает экспрессионную кассету по настоящему изобретению, а также к клетке-хозяину, содержащей экспрессионную кассету,или вектору экспрессии по настоящему изобретению. Настоящее изобретение, более того, относится к экспрессионной кассете, которая включает в себя область раннего промотора 1 цитомегаловируса (CMV) человека (hCMV IE1)/энхансера, вставочная последовательность переменной длины (VLIVS), содержащая донорный сайт сплайсинга и акцепторную область сплайсированного фрагмента, интересующий полинуклеотид и сигнальный домен polyA варианта гормона роста человека (hGHv) или его вариант. Сигнальный домен polyA или его вариант имеет длину по крайней мере 100 нуклеотидов и содержит последовательность ААТААА и по крайней мере на 92% идентичен сигнальному домену hGHv polyA. Настоящее изобретение относится также к вектору экспрессии, который включает в себя область раннего промотора 1 цитомегаловируса (CMV) человека (hCMV IE1)/энхансера, вставочную последовательность переменной длины (VLIVS), содержащую донорный сайт сплайсинга и акцепторный сайт сплайсинга, сайт клонирования, область полнаденилирования hGHv и селектируемый маркер. В одном из аспектов настоящего изобретения промоторная/энхансерная область hCMV IE1 располагается против хода транскрипции (5') относительно сайта клонирования, а область полиаденилирования hGH располагается по ходу транскрипции (3') относительно сайта клонирования. Настоящее изобретение также относится к способу доставки in vivo интересующего агента. Способ включает доставку субъекту композиции, содержащей экспрессионную кассету, при этом экспрессионная кассета включает в себя область промотора/энхансера hCMV IE1; вставочную последовательность переменной длины, содержащую донорный сайт сплайсинга и акцепторный сайт сплайсинга; полинуклеотид, кодирующий интересующий агент; и сигнальный домен polyA гормона роста человека (hGHv) или его вариант. Настоящее изобретение более того относится к экспрессирующей системе. Экспрессирующая система включает в себя клетку-хозяин, трансфекцированную или трансформированную экспрессионной кассетой по настоящему изобретению, где клетку-хозяин культивируют в условиях экспрессии интересующего полинуклеотида; и выделение интересующего агента. Подробное описание одного или нескольких вариантов осуществления настоящего изобретения представлены в прилагаемых далее рисунках и описании. Другие особенности, объекты и преимущества настоящего изобретения будут очевидны из описания и рисунков, а также из формулы изобретения. Все приведенные ссылки включены здесь в качестве ссылки. Описание чертежей На фиг. 1 представлена карта плазмиды вектора pV10. Ранний промотор 1 цитомегаловируса(CMV IE1) (IVS)/вставочная последовательность получали с помощью полимеразной цепной реакции(PCR) и клонировали в сайты HindIII и BamHI. Также указаны ген устойчивости к ампицилину, беталактамаза (blа).-1 008439 На фиг. 2 представлена карта плазмиды вектора pV40. Указаны ранний промотор 1 цитомегаловируса (CMV IE1), вставочная последовательность (IVS), сигнальный домен полиаденилирования hGHv(polyA), имеющий длину около 600 пар оснований, и ген устойчивости к ампицилину, бета-лактамаза(bla). На фиг. 3 схематически представлена плазмида pV70. Указаны промотор CMV IE1, IVS, включающий сайт делеции и донорный сайт сплайсинга (SD) и акцепторный сайт сплайсинга (SA), сигнальную область polyA hGHv и ген bla. Сайт делеции является результатом лигирования по тупым концам фрагментов BspEl'/'HpaI. На фиг. 4 схематически представлено получение вектора pXLC.l. Вектор pXLC.l конструируют, используя вектор экспрессии pV70 и продукт ПЦР, содержащий последовательность, кодирующую легкую цепь. pV70 линеаризуют с помощью BamHI, продукт ПЦР расщепляют с помощью BamHI, и оба продукта сшивают друг с другом с получением вектора pXLC.1. На фиг. 5 схематически представлено получение вектора pXLC.2. На фиг. 6 схематически представлен вектор pV60 и показано получение вектора рХНС. Вектор рХНС конструируют, используя вектор экспрессии pV60 и продукт ПЦР, содержащий большую часть кодирующей последовательности тяжелой цепи (не включены 52 N-концевые аминокислоты). pV60 линеаризуют с помощью BamHI, продукт ПЦР расщепляют действием BamHI, и оба продукта сшивают друг с другом. На фиг. 7 схематически представлен вектор рХНС.1. На фиг. 8 схематически представлен вектор рХНС.3. На фиг. 9 схематически представлен вектор рХНС.5, полученный в результате добавления кассетыdhfr к рХНС.3. Контрольные элементы экспрессионной кассеты получали из pSI (Promega, номер доступаU47121 в банке генов GenBank), и они включают в себя промотор/энхансер SV40, искусственную вставочную последовательность и позднюю последовательность полиаденилирования SV40. На фиг. 10 схематично представлен вектор pV80. Указаны фрагмент раннего промотора 1 цитомегаловируса (CMV IE1) (IVS)/вставочная последовательность, включающий донорный сайт сплайсинга(SD) и акцепторный сайт сплайсинга (SA), сигнальный домен (polyA) полиаденилирования hGHv, ген устойчивости к ампицилину, бета-лактамазу (bla), промотор/энхансер SV40, искусственную вставочную последовательность и позднюю последовательность полиаденилирования SV40. На фиг. 11 А и 11 В схематически представлен вектор pV90 и соответствующие аннотированные последовательности. На фиг. 11 А показана карта вектора. Указаны фрагмент раннего промотора 1 цитомегаловируса (CMV IE1) (IVS)/вставочной последовательности, включающий донорный сайт сплайсинга(SD) и акцепторный сайт сплайсинга (SA), сигнальный домен (polyA) полиаденилирования hGHv, ген устойчивости к ампицилину, бета-лактамазу (bla), промотор/энхансер SV40, искусственную вставочную последовательность и позднюю последовательность полиаденилирования SV40. У указанного вектора отсутствует сайт NotI в экспрессионной кассете dhfr. На фиг. 11 В представлена аннотированная последовательность вектора pV90. На фиг. 11 В показана последовательность от нуклеотидов 1275 до нуклеотидов 1866 последовательности с номером идентификации 19 (SEQ ID NO:19) обозначает hGHv polyA длиной около 600 нуклеотидов. На фиг. 12 представлена карта вектора pSI-DHFR.2. Промотор SV40 управляет геном dhfr. На фиг. 13 приведена диаграмма, показывающая относительные удельные продуктивности трансфекцированных пулов. Три пула анализируют на pCMV-hGHvPA-SEAP и pSEAP2, а один пул - наpUC18. На фиг. 14 приведены две диаграммы, показывающие относительные удельные продуктивности изолятов. В порядке возрастания приведены 20 наиболее больших изолятов каждой генной конструкции. На фиг. 15 приведена последовательность в GenBank с номером доступа K00470 (SEQ ID NO:18). Подробное описание изобретения Настоящее изобретение относится к экспрессионным кассетам и векторам, содержащим экспрессионную кассету. Экспрессионная кассета включает в себя регуляторную область транскрипции, способную контролировать транскрипцию в эукариотической клетке-хозяине, и область терминации транскрипции. Экспрессионные кассеты и векторы по настоящему изобретению обеспечивают стабильный старт и остановку транскрипции, а также повышенную стабильность мРНК транскрибированных продуктов. Настоящее изобретение относится к промотору и, необязательно, к энхансерным элементам любого штамма цитомегаловируса, таким как описаны в настоящем описании или в ссылках, например в патенте США 5658759, содержание которого приведено здесь в качестве ссылки. Например, подходящие области промотора CMV, которые могут использоваться в экспрессионных кассетах по настоящему изобретению,могут быть получены от CVM-усиленного вектора экспрессии -галактозидазы, CVM (MacGregor et al.,Nucl. Acids Res.17: 2365 (1989. Как описано далее в настоящем описании, сигнальный домен полиаденилирования hGHv обеспечивает стабильный сигнал остановки транскрипции, а также повышенную стабильность транскрипта мРНК. Элемент регулирования/экспрессии может быть отделен от сигнального домена полиаденилированияhGHv, например, интересующим полинуклеотидом или сайтом клонирования (например множественным сайтом клонирования). В одном из аспектов настоящее изобретение относится к полинуклеотиду, включающему экспрессионную кассету, которая содержит область регулирования транскрипции цитомегаловируса (CMV),вставочную последовательность переменной длины (например, полученную из вставочной последовательности А цитомегаловируса), интересующий полинуклеотид и сигнальный домен полиаденилирования. Изобретение также относится к способам и векторам экспрессии для продуцирования и извлечения гетерологичных полипептидов из клеток-хозяев. В соответствии с другим аспектом экспрессионная кассета по настоящему изобретению включает операбельно присоединенные (i) основную область раннего промотора 1 (IE1) CMV и вставочную последовательность переменной длины/энхансер (например, полученную из вставочной последовательности А), (ii) интересующий полинуклеотид и (iii) сигнальный домен полиаденилирования hGHv. Термин"операбельно присоединенный" относится к соединению, при котором компоненты взаимосвязаны, что позволяет им функционировать необходимым образом (например, они функционально связаны). Так,например, промотор/энхансер, операбельно присоединенный к интересующему полинуклеотиду, лигирован с последним таким образом, что экспрессия интересующего полинуклеотида достигалась в условиях,которые совместимы с активацией экспрессии промотором/энхансером. В конкретном варианте осуществления настоящего изобретения экспрессионная кассета включает последовательность, представленную в SEQ ID NO:1, от приблизительно нуклеотида 1 до приблизительно нуклеотида 1867 (например, приблизительно от 1 до 1865, 1866, 1867, 1868 или 1869). Экспрессионная кассета, представленная фрагментом от нуклеотида 1 до нуклеотида 1867 в SEQ ID NO:1, включает ряд различных доменов, таких как область промотора/энхансера CMV IE1, имеющая последовательность, представленную приблизительно от x1 до приблизительно x2 в SEQ ID NO:1, где x1 представляет собой нуклеотид от 1-20, а x2 представляет собой нуклеотид от приблизительно 715-720 (например приблизительно от 1 до 719 в SEQ ID NO:1). Другой домен экспрессионной кассеты включает вставочную последовательность переменной длины (VLIVS), содержащий донорный сайт сплайсинга и акцепторный сайт сплайсинга). Длина VLIVS может составлять по крайней мере 50 пар оснований (например, по крайней мере 100, 150, 200 или 250 пар оснований в длину), и VLIVS может содержать донорный сайт сплайсинга и акцепторный сайт сплайсинга из любого известного из области техники источника. См., в частности, Varani et al., Annu. Rev. Biophys. Biomol. Struct. 27: 407-45 (1998) и Konig, Eur. J. Biochem. 219: 25-42 (1994). Подходящий промежуточный домен может включать всю вставочную последовательность А генома CMV любого штамма или же может включать меньший фрагмент, содержащий 5'-последовательность, содержащую донорный сайт сплайсинга, лигированную с 3'-последовательность,содержащей акцепторный сайт сплайсинга. Например, VLIVS включает нуклеотиды приблизительно отx3 до приблизительно x4 в SEQ ID NO:1, где x3 представляет собой нуклеотид от 715-720, a x4 представляет собой нуклеотид от 1236-1254 (например от 719 до 1236 в SEQ ID NO:1). Размер вставочной последовательности, следующей за промотором/энхансером CMV IE1, может изменяться вплоть до 317 нуклеотидов, как представлено в SEQ ID NO:1. Например, 317 нуклеотидов вырезают из последовательности IVS, как указано в pV40 и pV70 (см., в частности, фиг. 2 и 3 соответственно), с получением VLIVS вSEQ ID NO:1. Таким образом, в соответствии с еще одним аспектом изобретения экспрессионная кассета включает последовательность от приблизительно нуклеотида 1 до приблизительно нуклеотида 1254 вIVS (т.е. по ходу транскрипции) может быть расположен множественный сайт клонирования (например,нуклеотиды 1255-1272 в SEQ ID NO:1 включают сайты BamHI и сайт Not1). Другие или дополнительные сайты рестрикции могут быть сконструированы в экспрессионной кассете с помощью методов, известных специалистам в данной области. Экспрессионная кассета, более того, включает домен polyA. Сигнальный домен polyA получают из гена hGHv, который может изменяться в его последовательности 3'UTR, в частности, от аллеля к аллелю. Один аллель гена hGHv описан в GenBank под номером доступа K00470 (SEQ ID NO:18), в то время как другая последовательность приведена на фиг. 11 В какSEQ ID NO:19, которая соответствует нуклеотидам от 2032 до 2625 в SEQ ID NO:18 (см. фиг. 15). Неприродные варианты сигнального домена polyA могут быть получены с методами мутагенеза, включая методы, которые используют для полинуклеотидов, клеток или организмов. Вариант polyA из гена hGHv включает сигнальный домен polyA, который отличается от сигнального домена polyA в hGHv дикого типа, однако остается сигналом терминации транскрипции и/или способен стабилизировать мРНК. Например, сигнальный домен полиаденилирования может включать последовательность сигнального домена полиаденилирования в hGHv, как указано в SEQ ID NO:18 или 19. Для специалиста в области молекулярной биологии должно быть понятно, что последовательности должны быть не более приблизительно 600 нуклеотидов. Скорее они включают любой домен последовательности polyA, который содержит последовательность смежных нуклеотидов, содержащую по крайней мере 100 нуклеотидов (например, по крайней мере 200, 300, 400, 500 или 600 нуклеотидов), включая канонический сайт ААТААА, из генаhGHv. Кроме того, настоящее изобретение охватывает последовательности, которые отличаются от вышеуказанных последовательностей до 8% (например, на 92% идентичны SEQ ID NO:18 или 19 или их-3 008439 определенному домену). Например, полинуклеотид длиной 100 нуклеотидов, на 95% идентичный нуклеотидам 1-1867 в SEQ ID NO:1 и включающий последовательность ААТААА, будет сохранять способность к терминации транскрипции. В еще одном аспекте настоящее изобретение относится к вектору, содержащему экспрессионную кассету. В данном описании под "вектором" понимают молекулу нуклеиновой кислоты (ДНК либо РНК),способную к автономной репликации при введении в клетку-реципиент (например, бактерию, такую как Е. coli). Примерами векторов являются плазмиды, вирусы и бактериофаги. Процесс "экспрессии" из вектора экспрессии хорошо известен и включает использование клеточных ферментов и способы получения продукта экспрессии из интересующего полинуклеотида. Векторами экспрессии являются векторы, способные опосредовать экспрессию полинуклеотида, клонированного в клетке-хозяине, которая может быть клеткой того же или другого типа, что и клетка, используемая для репликации или размножения вектора. Многие векторы экспрессии млекопитающих могут быть размножены в обычных бактериях(клетке-реципиенте), однако экспрессия интересующего полинуклеотида происходит в клетках млекопитающих (клетках-хозяевах), а не в бактерии. Настоящее изобретение относится к конструированию и применению векторов, которые обеспечивают эффективную транскрипцию и трансляцию полинуклеотидов в эукариотических клетках (например, в клетках млекопитающих и, особенно предпочтительно, в клетках человека, мышей, обезьян, коров, свиней, овец или грызунов). Векторы по настоящему изобретению, как указано ранее, включают экспрессионную кассету, содержащую сигнальный домен полиаденилирования, который обеспечивает эффективную терминацию транскрипции и стабильность мРНК. Векторы по настоящему изобретению включают сайт клонирования для получения интересующего полинуклеотида; регуляторные элементы транскрипции (например, области промотора/энхансера CMV IE1), достаточные для того, чтобы обеспечить транскрипцию полинуклеотида, вставленного в сайт клонирования в клетке-хозяине; элементы трансляции, достаточные для того, чтобы обеспечить трансляцию транскрипта РНК указанного полинуклеотида в клетке-хозяине, и (если необходимо) элементы репликации, достаточные для того, чтобы обеспечить репликацию указанного вектора в клетке-хозяине или другой клетке-реципиенте,которую используют для размножения вектора. Векторы по настоящему изобретению способны опосредовать такую экспрессию временно или постоянно в клетках-хозяевах. В конкретном варианте осуществления настоящего изобретения вектор по настоящему изобретению включает:(3) последовательность, которая по меньшей мере на 80% (предпочтительно по меньшей мере на 90; 95; 98 или 99%) идентична последовательности SEQ ID NO:1 или ее комплементу; или(4) вектор, содержащий SEQ ID NO:1 от приблизительно нуклеотида 1 до приблизительно нуклеотида 1867 и включающий интересующий полинуклеотид и/или селектируемый маркер. Вектор, содержащий SEQ ID NO:1, имеет ряд различных доменов и кодирующих областей. Например, в векторе присутствует область промотора/энхансера CMV IE1, которая имеет последовательность,представленную приблизительно от x1 до приблизительно x2 в SEQ ID NO:1, где x1 представляет собой нуклеотид от 1-20, а x2 представляет собой нуклеотид приблизительно от 715-720 (например, от приблизительно 1 до 719 в SEQ ID NO:1). Другой домен вектора экспрессии по настоящему изобретению включает вставочную последовательность переменной длины (VLIVS), содержащую донорный сайт сплайсинга и акцепторный сайт сплайсинга. Например, IVS включает нуклеотиды приблизительно от x3 до приблизительно x4 в SEQ ID NO:1, где x3 включает нуклеотид от 715-720, а x4 включает нуклеотид от 1236-1254 (например, приблизительно нуклеотиды от 719 до 1236 в SEQ ID NO:1). Множественный сайт клонирования вектора экспрессии включает нуклеотиды 1255-1272 в SEQ ID NO:1 (например, сайтыBamHI и сайт Not1). Различные или дополнительные сайты рестрикции могут быть сконструированы в векторе экспрессии с помощью методов, известных специалистам в данной области. Вектор экспрессии далее включает сигнальный домен polyA. Сигнальный домен polyA представляет собой сигнальный домен polyA hGHv или другой вариант сигнального домена polyA hGHv. Например, сигнальный доменpolyA включает последовательность сигнального домена polyA hGHv, указанную в SEQ ID NO:19. Кроме того, в векторе по настоящему изобретению содержится один или несколько селектируемых маркеров. Например, SEQ ID NO:1 включает ген дигдрофолятредуктазы (dhfr) (например, от приблизительно нуклеотида 2568 до приблизительно нуклеотида 3132 в SEQ ID NO:1). Вектор по настоящему изобретению,в дополнение к указанным выше, может включать дополнительные элементы промотора/энхансера и регуляторные области (например, домены полиаденилирования). Подобные дополнительные регуляторные элементы и домены полиаденилирования могут фланкировать селектируемый маркер или интересующий полинуклеотид (например, непосредственно примыкать к его 5'-концу и 3'-концу). Например,-4 008439 вектор, включающий SEQ ID NO:1, содержит ген дигидрофолятредуктазы (dhfr) от приблизительно нуклеотида 2568 до приблизительно нуклеотида 3132 в SEQ ID NO:1. Ген dhfr фланкирует элемент промотора/энхансера SV40 и область полиаденилирования SV40 (например, от приблизительно нуклеотида 1868 до приблизительно нуклеотида 2210 и от приблизительно нуклеотида 3144 до приблизительно нуклеотида 3440 в SEQ ID NO:1 соответственно). Конкретными примерами селектируемых маркеров являются такие селектируемые маркеры, которые кодируют белки, придающие устойчивость к цитостатическим и разрушающим клеткам лекарствам,такие как белок DHFR, который придает устойчивость к метотрексату (Wigler et al., Proc. Natl. Acad. Sci.USA 77: 3567 (1980); O'Hare et al., Proc. Natl. Acad. Sci. USA 78: 1527 (1981; белок GPF, который придает устойчивость к микофенольной кислоте (MulliganBerg. Proc. Natl. Acad. Sci. USA 78: 2072 (1981,маркер устойчивости к меомицину, который придает устойчивость к аминогликозиду G-418 (ColberreGarapin et al., J. Mol. Biol. 150: 1 (1981; белок Hygro, который придает устойчивость к гигромицинуInvitrogen). Кроме того, тимидинкиназа вируса простого герпеса (Wigler et al., Cell 11: 223 (1977, гипоксантин-гуанин фосфорибозилтрансфераза (SzybalskaSzybalski, Proc. Natl. Acad. Sci. USA 48: 2026(1962 и аденин фосфорибозилтрансфераза (Lowy et al., Cell 22: 817 (1980 могут быть использованы в клетках tk-, hgprt- или aprt- соответственно. Другие селектируемые маркеры кодируют пуромицин Nацетилтрансферазу или аденозиндеаминазу. Термины "идентичный" или "процент идентичности" в случае двух или нескольких молекул нуклеиновых кислот относятся к двум или нескольким последовательностям или субпоследовательностям,которые совпадают или содержат заданный процент совпадающих нуклеотидов, когда их сравнивают или проводят сравнительный анализ первичной структуры на предмет максимального соответствия матрице сравнения, который осуществляют с использованием алгоритма сравнения или с помощью ручного сравнительного анализа первичной структуры и визуальной оценки. Эта идентификация относится также к комплементу последовательности (например, комплементу последовательности, приведенному в SEQID NO:1, или его фрагменту, содержащему экспрессионную кассету). Например, экспрессионная кассета или ее фрагмент включает такие экспрессионные кассеты, нуклеотидная последовательность которых по крайней мере приблизительно на 80, 90, 95, 97, 98 или на 99% идентична части SEQ ID NO:1 (например,нуклеотидам 1-719, 1-1254 и т.п. в SEQ ID NO:1). Так, если последовательность имеет требуемую идентичность последовательности по отношению к полной последовательности в SEQ ID NO:1 или к ее домену, то тогда она может также функционировать, соответственно, в качестве экспрессионной кассеты или ее домена по настоящему изобретению. При сравнении последовательности, как правило, одна последовательность выполняет роль последовательности сравнения, с которой сравнивают тестируемые последовательности. При использовании алгоритма последовательности сравнения тестируемую последовательность и последовательность сравнения вводят в компьютер, если необходимо, обозначают координаты субпоследовательности и задают параметры программы алгоритма последовательности. Могут быть использованы значения программы по умолчанию или же установлены альтернативные параметры. Затем алгоритм сравнения последовательности рассчитывает процент идентичности последовательности для тестируемой(ых) последовательности(ей) по отношению к последовательности сравнения в соответствии с установленными или используемыми по умолчанию параметрами программы. "Матрица сравнения" в данном описании включает ссылку на сегмент одного из ряда смежных позиций, выбранных из группы, включающей от 25 до 600,обычно приблизительно от 50 до приблизительно 200, чаще приблизительно от 100 до приблизительно 150, в которой последовательность может быть сравнена с последовательностью сравнения с тем же количеством смежных позиций после того, как проведен оптимальный сравнительный анализ первичной структуры. Способы проведения сравнительного анализа первичной структуры последовательностей хорошо известны из области техники. Оптимальный сравнительный анализ первичной структуры может быть проведен, в частности, с помощью алгоритма локальной гомологичности, приведенного в SmithWaterman, Adv. Appl. Math. 2: 482 (1981), с помощью алгоритма гомологичного сравнительного анализа первичной структуры, приведенного в NeedlemanWunsch, J. Mol. Biol. 48: 443 (1970), по способу поиска схожести, приведенному в PearsonLipman, Proc. Natl. Acad. Sci. USA 85: 2444 (1988), путем компьютерного выполнения указанных алгоритмов (GAP, PILEUP, BESTFIT, FASTA и TFASTA в WisconsinGenetics Software Package, Genetics Compuret Group, 575 Science Dr., Мэдисон, Висконсин) или путем проведения ручного сравнительного анализа первичной структуры и визуальной инспекции. Одним из примеров алгоритма, который подходит для определения процента идентичности последовательностей (например, в случае значительной схожести или идентичности), является алгоритмBLAST, который приведен в Altschul, J. Mol. Biol. 215: 403-410, 1990. Программное обеспечение для проведения анализа BLAST общедоступно от National Center for Biotechnology Information (в Интернете на сайте ncbi.nlm.nih.gov/). Этот алгоритм включает вначале идентифицирование пар последовательностей с высокой степенью совпадения (HSP) посредством идентификации коротких фраз длиной W в очередной последовательности, который либо совпадает, либо соответствует некоторому положительному пороговому значению Т при сравнительном анализе с фразой той же длины из приведенной в базе дан-5 008439 ных последовательности. Указанные первичные совпадения с соседними фразами играют роль затравок для инициирования поиска содержащих их более длинных HSP. Совпадения фраз затем распространяют в оба направления вдоль каждой последовательности до тех пор, пока может быть увеличен кумулятивный количественный показатель сравнительного анализа первичной структуры. Кумулятивные показатели рассчитывают с использованием, в случае нуклеотидной последовательности, параметров М (призовой показатель для пары совпадающих остатков; всегда 0) и N (штрафной показатель для несовпадающих остатков; всегда 0). Распространение совпадений фраз в каждом направлении прекращают в том случае когда кумулятивный показатель сравнительного анализа первичной структуры уменьшается на величинуX от своего максимально достижимого значения; кумулятивный показатель изменяется от нуля и меньше вследствие накопления при анализе первичной структуры одного или большего количества остатков с отрицательным показателем; или достигнут конец последовательности. Параметры W, Т и X алгоритма BLAST определяют чувствительность и скорость проведения сравнительного анализа первичной структуры. В одном из вариантов осуществления настоящего изобретения для определения того, попадает ли последовательность нуклеиновой кислоты в объем притязаний по настоящему изобретению, используют программу BLAST (для нуклеотидных последовательностей), которая включает в качестве параметров по умолчанию длину фразы (W), равную 11, и ожидание (Е), равное 10, М=5, N=4, и проводят сравнение обеих цепочек. Для аминокислотных последовательностей программа BLAST использует в качестве параметров по умолчанию длину фразы (W), равную 3, ожидание(Е), равное 10 и матрицу подсчета BLOSUM62 (см., в частности, Henikoff, Proc. Natl. Acad. Sci. USA 89: 10915, 1989). Алгоритм BLAST проводит также статистический анализ сходства между двумя последовательностями (см., например, Karlin, Proc. Natl. Acad. Sci. USA 90: 5873-5787, 1993). Один проводимый алгоритмом BLAST замер сходства представляет собой вероятность суммы (P(N, которая обозначает вероятность возможного случайного соответствия между двумя нуклеотидами или аминокислотными последовательностями. Например, нуклеиновую кислоту считают схожей с последовательностью сравнения в том случае, если наименьшая вероятность суммы при сравнении тестируемой нуклеиновой кислоты с нуклеиновой кислотой сравнения составляет менее чем приблизительно 0,1, более предпочтительно менее чем приблизительно 0,01 и наиболее предпочтительно менее чем приблизительно 0,001. Настоящее изобретение относится также к полинуклеотидам, которые специфично гибридизуются в полинуклеотидную последовательность, представленную как SEQ ID NO: 1 от приблизительно нуклеотида 1 до нуклеотида 1867, или ее фрагмент. Фраза "селективно (или специфично) гибридизуется в" относится к связыванию, удвоению или гибридизации молекулы в конкретный полинуклеотид сравнения в жестких условиях гибридизации. Фраза "жесткие условия гибридизации" относится к условиям, при которых зонд в основном гибридизуется в свою целевую последовательность, как правило, в сложной смеси нуклеиновых кислот, а не в другие последовательности. Жесткие условия зависят от последовательности и будут меняться в различных обстоятельствах, в частности, в зависимости от длины зонда. Более длинные последовательности специфично гибридизуются при более высоких температурах. Обширное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen, Techniques in Biochemistry andMolecular Biology - Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). В общем случае жесткие условия гибридизации выбирают таким образом, чтобы они приблизительно на 5-10 С были ниже температуры плавления (Тm) конкретной последовательности при определенной ионной силе и величине рН. Тm представляет собой температуру (при заданной ионной силе, рН и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных целевой последовательности, гибридизуются в равновесных условиях в целевую последовательность (поскольку при Тm целевые последовательности имеются в избытке, то 50% зондов находятся в равновесных условиях). Жесткие условия будут такими условиями, в которых концентрация соли составляет менее приблизительно 1,0 М ионов натрия, как правило, концентрация ионов натрия (или других солей) составляет приблизительно от 0,01 до 1,0 М при величине рН от 7,0 до 8,3 и температуре по крайней мере приблизительно 30 С для коротких зондов (например, содержащих от 10 до приблизительно 50 нуклеотидов) и по крайней мере приблизительно 60 С для длинных зондов (например, содержащих более 50 нуклеотидов). Жесткие условия могут быть также достигнуты при добавлении дестабилизующих агентов, таких как формамид. При селективной или специфической гибридизации положительный сигнал (например, идентификация нуклеиновой кислоты по настоящему изобретению) приблизительно в 2 раза превышает фоновое значение гибридизации. "Жесткие" условия гибридизации, которые используют для идентификации в значительной степени идентичных нуклеиновых кислот, в соответствии с настоящим изобретением включают гибридизацию в буфере, содержащем 50% формамида, 5SSC и 1%SDS при температуре между 42 и 65 С, с промывкой смесью 0,2SSC и 0,1% SDS при 65 С для длинных зондов. Тем не менее, специалисту в данной области должно быть очевидно, что условия гибридизации могут быть модифицированы в зависимости от состава последовательности. Пример "сравнительно же-6 008439 сткие условия гибридизации" включают гибридизацию в буфере, содержащем 40% формамида, 1 М NaCl и 1% SDS при 37 С и промывку в 1SSC при 45 С. Положительное значение гибридизации по меньшей мере вдвое превышает фоновое значение. Специалистам в данной области понятно, что для аналогичных жестких условий могут быть применены альтернативные условия гибридизации и промывки. Так, экспрессионная кассета по настоящему изобретению может включать сигнальную область polyA hGHv, которая гибридизуется в очень жестких условиях в одноцепочечную ДНК, содержащую нуклеотидную последовательность SEQ ID NO:18 или 19. Экспрессионная кассета может использоваться в форме конструкции чистой нуклеиновой кислоты. Альтернативно, экспрессионная кассета может быть введена как часть вектора нуклеиновой кислоты(например вектора экспрессии, описанного выше). Подобные векторы включают плазмиды и вирусные векторы. Вектор может содержать последовательности, которые фланкируют экспрессионную кассету,которая включает последовательности, гомологичные эукариотическим геномным последовательностям,таким как геномные последовательности млекопитающих, или вирусным геномным последовательностям. Это позволяет ввести экспрессионную кассету в геном эукаритических клеток или вирусов путем гомологической рекомбинации. Например, плазмидный вектор, содержащий экспрессионную кассету,которая фланкирована вирусными последовательностями, может использоваться для получения вирусного вектора, который подходит для доставки экспрессионной кассеты в клетки позвоночных, включая клетки рыб, птиц или млекопитающих. Использованные методы хорошо известны специалисту в данной области. Под термином "интересующий полинуклеотид" понимают молекулы нуклеиновых кислот, которые,по крайней мере, могут быть транскрибированы. Молекулы могут быть в смысловом или антисмысловом направлении по отношению к промотору. Антисмысловые генные конструкции могут применяться для ингибирования экспрессии гена в клетке в соответствии с хорошо известными методами. Интересующий полинуклеотид может включать гетерологичный полинуклеотид. Термин гетерологичный полинуклеотид охватывает любой ген. Гетерологичный полинуклеотид, как правило, получают из отличного вида,по сравнению с регуляторным элементом, с которым он операбельно соединен в экспрессионную кассету или векторе экспрессии, а если его получают из того же источника, то он представляет собой модифицированный ген по сравнению с его исходной формой. Таким образом, гетерологичный полинуклеотид,операбельно присоединенный к промотору, получают из источника, отличного от источника, из которого получен промотор, или же, если он происходит из того же источника, то он представляет собой модифицированный промотор по сравнению с его исходной формой. Модификация гетерологичного полинуклеотида может возникнуть, в частности, при воздействии на ДНК ферментом рестрикции с образованием фрагмента ДНК, который позволяет операбельно присоединить его к промотору. Для модификации гетерологичного полинуклеотида также можно использовать сайт-направленный мутагенез. Гетерологичный полинуклеотид может также включать ген маркера (например кодирующий -галактозидазу или зеленый флуоресцентный белок) или гены, продукты которых регулируют экспрессию других генов. Таким образом, в настоящее описание включены полинуклеотиды, которые служат в качестве матрицы для мРНК,тРНК и рРНК. Гетерологичный ген может быть любым аллельным вариантом гена дикого типа или же он может быть мутантным геном. мРНК необязательно включает некоторые или все 5'- или 3'транскрибированные, но не транслированные фланкирующие области, естественным или иным образом связанные с транслированной кодирующей последовательностью. Интересующий полинуклеотид также необязательно может включать ассоциированные контрольные элементы, обычно связанные с транскрибированными молекулами, например сигналы остановки транскрипции, домены полиаденилирования или элементы энхансера по ходу транскрипции. Интересующий полинуклеотид может кодировать или служить матрицей для терапевтического продукта, который может быть, например, пептидом, полипептидом, белком или рибонуклеиновой кислотой. Интересующий полинуклеотид, как правило, представляет собой последовательность ДНК (такую как кДНК или геномная ДНК), кодирующую полипептидный продукт, такой как ферменты (например,-галактозидаза); производные крови; гормоны; цитокины; интерлейкины; интерфероны; TNF; факторы роста (например IGF-1); растворимые рецепторные молекулы (например растворимые молекулы рецептора к TNF); нейромедиаторы или их предшественники; трофические факторы, такие как BDNF, CNTF,NGF, IGF, GMF, aFGF, BfGF, NT3 и NT5; аполипопротеины, такие как ApoAI и ApoAIV; дистрофии или минидистрофин; опухоль-угнетающие белки, такие как р 53, Rb, Rap1A, DCC и k-rev; факторы, принимающие участие в коагуляции крови, такие как факторы VII, VIII и IX; или, в качестве альтернативы,весь или часть природного или искусственного иммуноглобулина (например Fab и ScFv либо легкая или тяжелая цепочка клонированного IgG). Интересующий полинуклеотид может также включать матрицу для генерирования антисмысловой молекулы, транскрипция которой способствует экспрессии гена в клетке-мишени или транскрипции молекул клеточных мРНК, которую необходимо контролировать. Подобные молекулы могут, например,транскрибироваться в клетке-мишени в молекулы РНК, комплементарные молекулам клеточных РНК, и в соответствии с известными методами могут, таким образом, блокировать их трансляцию в белок. В-7 008439 частности, антисмысловые молекулы могут применяться для блокирования трансляции в воспалительных или катаболических цитокинах при лечении артрита и потери ткани, вызванной указанными цитокинами. Интересующая полинуклеотидная последовательность обычно кодирует полипептид, используемый в диагностических или терапевтических целях. Полипептиды могут продуцироваться в биореакторахin vitro с помощью различных клеток-хозяев (например клеток COS или клеток СНО или их производных), содержащих экспрессионную кассету. В качестве альтернативы экспрессионная кассета и/или вектор экспрессии по настоящему изобретению может применяться для доставки гена, доставки белка и/или генной терапии. Настоящее изобретение может также использоваться для экспрессии токсических факторов или полипептидов. Последние могут быть, в частности, клеточными ядами (такими как токсин дифтерии, токсин псевдомоны и рицин А), продуктом, который индуцирует чувствительность к внешнему агенту (например тимидинкиназой или цитозиндезаминазой) или, в качестве альтернативы, факторами, способными индуцировать отмирание клеток (например GrB3-3 и антигеном против ras-ScFv). Под применением в терапевтических целях понимают применение, которое может обеспечить ослабление болезни или расстройства, излечение болезни или расстройства и/или уменьшение тяжести симптомов заболевания или расстройства. Применение в диагностических целях включает применение молекул, способных определять или давать информацию относительно причины болезни или связи молекулы с заболеванием, или молекул, способных определять присутствие или отсутствие болезни либо расстройства. Диагностический агент не вносит непосредственный вклад в ослабление интенсивности симптомов болезни или расстройства. Интересующий полинуклеотид может также кодировать антигенный полипептид для использования в качестве вакцины. Антигенные полипептиды или молекулы нуклеиновых кислот получают из патогенных организмов, таких как, например, бактерии или вирусы. Например, антигенные полипептиды включают антигенные детерминанты, которые присутствуют в геномах или генных продуктах патогенного организма, например, при вирусной геморрагической септицемии, бактериальном заболевании почек, вибриозе и фурункулезе. Антигенные полипептиды могут быть выбраны, например, из областей генома вируса гепатита С и генных продуктов. В тексте настоящего описания "выделенный" при описании молекулы или композиции, такой как,например, вектор экспрессии или экспрессионная кассета по настоящему изобретению или интересующий полипептид, означает, что молекулу или композицию отделяют по меньшей мере от одного другого соединения, такого как белок, ДНК, РНК или другие примеси, с которыми она связана in vivo или в природе. Таким образом, интересующий полипептид считается выделенным в том случае, если он отделен от любого другого компонента, с которым он связан естественным образом. Тем не менее, выделенная композиция может также быть в значительной мере чистой. Чистоту и гомогенность можно определить, в частности, с использованием методов аналитической химии, таких как, в частности, электрофорез в полиакриламидном геле (PAGE), электрофорез в агарозном геле или жидкостная хроматография высокого разрешения (HPLC). Использующиеся здесь термины "молекула нуклеиновой кислоты" и "полинуклеотид" используются взаимозаменяемо и включают олигонуклеотиды (т.е. короткие полинуклеотиды). Они также относятся к синтетическим и/или неприродным молекулам нуклеиновых кислот (например, включают нуклеотидные аналоги или модифицированные остатки каркаса или соединительные вставки). Термины относятся также к дезоксирибонуклеотидым или рибонуклеотидным олигонуклеотидам, либо в одноцепочечной,либо в двухцепочечной форме. Термины охватывают нуклеиновые кислоты, содержащие аналоги природных нуклеотидов. Термины также охватывают структуры, подобные нуклеиновым кислотам, с синтетическим каркасом. Аналоги с каркасом ДНК, рассматривающиеся в настоящем изобретении, включают фосфодиэфир, фосфоротиоат, фосфородитиоат, метилфосфонат, фосфорамидат, алкилфосфотриэфир,сульфамат, 3'-тиоацеталь, метилен (метилимино), 3'-N-карбамат, морфолинокарбамат и пептиднонуклеиновые кислоты (PNA); см. Oligonucleotides and Analogues, a Practical Approach, edited by F.Eckstein,IRL Press at Oxford University Press (1991); Antisense Strategies, Annals of the New York Academy ofN-(2-аминоэтил)глициновые фрагменты. Фосфотиолятные соединительные вставки описаны вWO 97/03211; WO 96/39154; Mata (1997) Toxicol. Appl. Pharmacol. 144: 189-197. Другие синтетические каркасы, которые охватываются указанным термином, включают метилфосфонатные соединительные вставки или перемежающиеся метилфосфонатные и фосфодиэфирные соединительные вставки (StraussSoukup (1997) Biochemistry 36: 8692-8698) и бензилфосфонатные соединительные вставки (Samstag(1996) Antisense Nucleic Acid Drug Dev. 6: 153-156). Как используется здесь, "рекомбинатный" относится к полинуклеотиду, синтезированному или подвергающемуся другому воздействию в условиях in vitro (например к "рекомбинантному полинуклеотиду"), к способам применения рекомбинантных полинуклеотидов для получения продуктов в клетках или других биологических системах или к полипептидам ("рекомбинантным белкам"), кодируемым реком-8 008439 бинантным нуклеотидом. Рекомбинантные полинуклеотиды охватывают молекулы нуклеиновых кислот,полученные из различных источников и лигированные в экспрессионную кассету или вектор экспрессии,например, гибридного белка или такие молекулы, которые получают индуцированной или конститутивной экспрессией полипептида (например, экспрессионной кассеты или вектора по настоящему изобретению, операбельно связанного с гетерологичным полинуклеотидом, таким как последовательность, кодирующая полипептид). В типичной экспрессирующей системе продукция полипептида из гетерологичного полинуклеотида либо не регулируется, либо регулируется модулирующей транскрипцией из промотора транскрипции,операбельно связанного в обратном направлении от полинуклеотида, кодирующего гетерологичный полипептид. Однако регуляция должна происходить четко в прямом направлении для того, чтобы обеспечить правильную терминацию транскрипции и стабильность мРНК. В одном из аспектов настоящего изобретения сигнальная область полиаденилирования (polyA) варианта гормона роста человека (hGHv) образуется в прямом направлении (3') интересующего полипептида, который содержится в экспрессионной кассете или векторе экспрессии по настоящему изобретению. Сигнальная область hGHv polyA включает последовательность, полученную из генетической последовательности гормона роста человека. Сигнальная область полиаденилирования hGHv обеспечивает четкую терминацию транскрипции и обеспечивает повышенную стабильность мРНК в эукариотических клетках. Указанная сигнальная область полиаденилирования hGHv обеспечивает явные преимущества по сравнению с известными экспрессионными кассетами и/или векторами экспрессии, включая те, которые могут использовать промотор/энхансер CMV. Могут также присутствовать трансляционные элементы, и подразумевается, что они охватывают специализированные последовательности (такие как сайты связывания рибосомы или инициирующие кодоны), которые необходимы для осуществления трансляции транскрипта РНК в белок. Трансляционные элементы могут также включать консенсусные последовательности, лидирующие последовательности, сигналы сплайсинга и т.п., которые служат для облегчения или повышения степени трансляции или для повышения стабильности экспрессированного продукта. Например, сигнальная область полиаденилирования hGHv обеспечивает повышенную стабильность мРНК. Векторы по настоящему изобретению могут содержать вспомогательные области транскрипции, такие как вставочная последовательность,сигналы полиаденилирования, сайты инициации трансляции Шайна-Дальгарно и консенсусные последовательности Козака (Shine et al. Proc. Natl. Acad. Sci. (USA) 71: 1342-1346 (1974); Kozak, Cell 44: 283-292(1986. Предполагается, что термин "репликационные элементы" охватывает специализированные последовательности (такие как точки инициации репликации), которые необходимы для осуществления репликации вектора в клетке-реципиенте. В общем случае подобные векторы содержат по крайней мере одну точку инициации репликации, достаточно эффективную для того, чтобы осуществить автономную стабильную репликацию вектора в клетке-реципиенте. Для облегчения выбора и сохранения вектора по настоящему изобретению в вектор могут быть включены один или несколько маркеров селекции (таких как полинуклеотиды, которые придают устойчивость к антибиотикам или дают клеткам возможность расти в минимальной среде или в присутствии токсических метаболитов). В соответствии с еще одним вариантом его осуществления настоящее изобретение относится к клеткам-хозяевам, содержащим вышеописанные генные конструкции (например экспрессионная кассета или вектор по настоящему изобретению). Экспрессионная кассета по настоящему изобретению может использоваться для рекомбинантной модификации клетки-хозяина путем трансфекции клетки-хозяина или трансформирования клетки-хозяина с целью экспрессии требуемого интересующего полинуклеотида. По тексту настоящего описания термин "рекомбинантно модифицированный" означает введение экспрессионной кассеты или вектора экспрессии по настоящему изобретению в живую клетку или экспрессирующую систему. Как правило, в векторе (например в плазмиде) содержится экспрессионная кассета,включающая интересующий полинуклеотид. Как приведено в настоящем описании, экспрессирующая система включает живую клетку-хозяин, в которую введен интересующий полинуклеотид, продукт которого необходимо экпрессировать. Клетки-хозяева представляют собой клетки, в которых может размножаться экспрессионная кассета(включая вектор, содержащий экспрессионную кассету), и могут экспрессироваться полипептиды, кодирующие продукты. Клетка-хозяин включает также любое потомство рассматриваемой клетки-хозяина или ее производные. Понятно, что все потомство может не быть идентично родительской клетке, поскольку в процессе репликации могут возникнуть мутации. Тем не менее, когда используется термин"клетка-хозяин", к нему также относится и потомство. Клетки-хозяева, которые могут использоваться по настоящему изобретению, включают клетки бактерий, клетки грибов (например клетки дрожжей), клетки растений или клетки животных. Например, клетки-хозяева могут быть клетками высших эукариот,такие как клетки млекопитающих, или клетками низших эукариот, такие как клетки дрожжей, или прокариотическими клетками, такими как клетки бактерий. Введение генной конструкции в клетку-хозяин может осуществляться путем трансфекции фосфата кальция, опосредованной DEAE-Dextran трансфек-9 008439 ции или с помощью электропорации (Davis, L., Dibner, M., Battey, I., Basic Methods in Molecular Biology(1986. В качестве характерного примера подходящих хозяев могут быть упомянуты: клетки грибов,такие как дрожжи; клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9; клетки животных, такие как СНО, COS или меланома Боуэса; клетки растений и т.п. Предполагается, что из представленных в данном описании примеров специалисты в данной области техники способны осуществить выбор подходящего хозяина. Клетки-хозяева для использования по настоящему изобретению представляют собой эукариотические клетки (например клетки млекопитающих). В одном из аспектов настоящего изобретения клеткихозяева представляют собой продуктивные клетки, адаптированные для роста в культуральной среде. Примерами таких обычно промышленно используемых клеток являются клетки СНО, VERO, BHK,HeLa, CV1 (включая Cos, Cos-7), MDCK, 293, 3 Т 3, С 127, линии клеток миеломы (особенно мышиные),РС 12 и W138, клетки яичника китайского хомячка (СНО), которые широко применяются для продуцирования нескольких комплексных рекомбинантных белков, в частности цитокинов, факторов коагуляции крови и антител (Brasel et al. Blood 88: 2004-2012 (1996); Kaufman et al. J. Biol. Chem. 263: 6352-6362(1990. Линии дефицитных по дигидрофолятредуктазе (DHFR) мутантных клеток (Urlaub et al., Proc.Natl. Acad. Sci. USA 77: 4216-4220 (1980 представляют собой линии клеток СНО, которые могут быть выбраны, поскольку эффективная DHFR экспрессирующая система селектируемого и способного к амплификации гена позволяет получить в указанных клетках высокий уровень экспрессии рекомбинантного белка (Kaufman, Meth. Enzymol. 185: 527-566 (1990. Кроме того, с указанными клетками легко обращаться как в виде прилипающих культур или суспензий культур, и они обладают относительно хорошей генетической стабильностью. Клетки СНО и экспрессируемые в них рекомбинантные белки интенсивно изучались и были одобрены для клинического применения. Кроме того, предполагается, что также могут применяться клетки-хозяева, полученные из любой из вышеуказанных клеточных линий и обладающие требуемым фенотипом. Например, полученная клетка-хозяин включает клетки СНО (например клеточную линию DG44), которые были селективно культивированы, с целью получения требуемого фенотипа(например, с помощью положительного и/или отрицательного процесса селекции). В качестве одного из аспектов настоящего изобретения предлагается экспрессирующая система дляin vitro продукции агента, кодируемого интересующим полинуклеотидом. Как обсуждается в настоящем описании, интересующий полинуклеотид может кодировать полипептид, который имеет фармацевтическую, медицинскую, питательную или промышленную ценность. Например, интересующий полинуклеотид может кодировать лекарство на основе полипептида. Как правило, подобный полипептид экспрессируется в виде внеклеточного продукта. Например, полипептиды, которые могут продуцироваться с использованием экспрессионной кассеты или вектора экспрессии по настоящему изобретению, включают,этим не ограничиваясь, лиганд F1t3, лиганд CD40, эритропоэтин, тромбопоэтин, кальцитон, лиганд Fas,лиганд для рецептора активатора NF-каппа В (RANKL), TNF-ассоциированный апоптоз-индуцирующий лиганд (TRAIL), ORK/Tek, полученный из стромы вилочковой железы лимфопоэтин, колониестимулирующий фактор гранулоцитов, гранулоцитарно-макрофагальный колониестимулирующий фактор, фактор роста тучных клеток, фактор роста стволовых клеток, эпидермальный фактор роста, RANTES, гормон роста, инсулин, инсулинотропин, инсулиноподобные факторы роста, паратиреоидный гормон, интерфероны (например интерферон бета), факторы роста нервов, интерлейкины от 1 до 18, колониестимулирующие факторы, лимфотоксин-, фактор некроза опухолей, фактор ингибирования лейкемии, онкостатин-М, различные лиганды для молекул Elk и Неk на поверхности клеток (такие как лиганды для ephсвязанных киназ, или LERKS) и легкие или тяжелые цепочки антител. Рецепторы любого из вышеуказанных белков могут быть также экспрессированы с использованием способов и композиций по настоящему изобретению, включая обе формы рецептора фактора некроза опухолей (обозначенных как р 55 и р 75), рецепторы интерлейкина-1 (типа 1 и 2), рецептор интерлейкина-4, рецептор интерлейкина-15, рецептор интерлейкина-17, рецептор интерлейкина-18, рецептор гранулоцитарно-макрофагального колониестимулирующего фактора, рецептор колониестимулирующего фактора гранулоцитов, рецепторы к онкостатину-М и фактору ингибирования лейкемии, рецептор активатора NF-каппа В (RANK), рецепторы к TRAIL, рецептор BAFF, рецептор лимфотоксина бета, рецепторы TGF типов I и II и рецепторы, которые включают домены смерти, такие как Fas или апоптоз-индуцирующий рецептор (AIR). Другие белки, которые могут быть экспрессированы с использованием экспрессионной кассеты и/или векторов экспрессии по настоящему изобретению, включают кластер антигенов дифференцировкиthe VIth International Workshop and Conference; Kishimoto, Kikutani et al., eds.; Kobe, Japan, 1996) или CD молекулы, раскрытые в последующих симпозиумах. Примеры подобных молекул включают CD27,CD30, CD39, CD40 и их лиганды (лиганд CD27, лиганд CD30 и лиганд CD40). Некоторые из них являются членами семейства рецепторов к TNF, которые также включают 41 ВВ и OX40; лиганды часто являются членами семейства TNF (также как лиганд 41 ВВ и лиганд OX40); таким образом, члены семейств TNF- 10008439 и TNFR также могут быть экспрессированы при использовании настоящего изобретения. В соответствии с настоящим изобретением могут быть также экспрессированы полипептиды, которые обладают ферментативной активностью. Примеры включают членов семейства металлопротеиназыдезинтегрина, различные киназы, глюкоцереброзидазу, супероксиддисмутазу, тканевый плазминогенный активатор, фактор VIII, фактор IX, аполипопротеин Е, аполипопротеин A-I, антагонист IL-2, альфа-1 антитрипсин, TNF-альфа превращающий фермент (ТАСЕ) и многочисленные другие ферменты. С использованием экспрессионной кассеты или вектора экспрессии по настоящему изобретению можно также экспрессировать лиганды ферментативно активных белков. Композиции и способы по настоящему изобретению применимы также для экспрессии других типов рекомбинантных белков и полипептидов, включая молекулы иммуноглобулина или их части и химерные антитела (например, антитела, содержащего константную область человека, соединенную с областью связывания мышиного антигена) или их фрагменты. Известны многочисленные методики, с помощью которых можно проводить манипуляции с ДНК, кодирующими молекулы иммуноглобулина, с получением ДНК, кодирующих рекомбинантные белки, такие как одноцепочечные антитела, антитела с повышенной аффинностью или другие полипептиды на основе антител (см., например, Larrick et al., Biotechnology 7: 934-938 (1989); Reichmann et al., Nature 332: 323-327 (1988); Roberts et al., Nature 328: 731734 (1987); Verhoyen et al., Science 239: 1534-1536 (1988); Chaudhary et al., Nature 339: 394-397 (1989. Клонированные гуманизированные антитела включают такие, которые специфично связываются с рецептором лимфотоксина бета и интегринами, такими как VLA-1, VLA-4 и 6. Подобные антитела могут быть агонистами или антагонистами. С использованием способов и композиций по настоящему изобретению могут также зкспрессироваться различные гибридные белки. Примеры подобных гибридных белков включают белки, экспрессированные как белки, слитые с частью молекулы иммуноглобулина, белки, экспрессированные как белки,слитые с зипперным фрагментом, и новые полифункциональные белки, такие как гибридные белки цитокина и фактора роста (например GM-CSF и IL-3, MGF и IL-3). В WO 93/08207 и WO 96/40918 описано получение различных растворимых олигомерных форм молекулы, обозначенной как CD40L, включая гибридный белок иммуноглобулина и гибридный зипперный белок соответственно; обсуждаемые в настоящем описании методики применимы и к другим белкам. Как только экспрессирован интересующий полинуклеотид, продукт экспрессии (например белок или полипептид) может быть очищен с использованием стандартных методов, известных в данной области техники. Например, в том случае, когда интересующий полипептид кодирует гибридный полипептид, содержащий метку очистки, то полипептид может быть очищен с помощью антител, которые специфично связываются с меткой. В одном из аспектов олигонуклеотид, кодирующий молекулярную метку, лигируют с 5'-или 3'-концом интересующего полипептида, который кодирует требуемый полипептид; указанный олигонуклеотид может кодировать polyHis (такой как hexaHis) или другую "метку", такую какFLAG, НА (гемаглютинин вируса гриппа) или myc, для которых имеются коммерчески доступные антитела. Указанную метку обычно конденсируют с полипептидом в процессе экспрессии полипептида, и она может служить как средство аффинной очистки требуемого полипептида от клетки-хозяина. Аффинную очистку можно осуществить, например, с помощью колоночной хроматографии с использованием в качестве аффинной матрицы антител против метки. Далее метку не обязательно можно удалить из очищенного полипептида с помощью различных методов, таких как протеолитическое расщепление. Экспрессионная кассета и векторы экспрессии по настоящему изобретению могут использоваться для достижения устойчивого переноса интересующего полипептида в клетку-хозяина. Устойчивый перенос означает, что интересующий полипептид постоянно сохраняется в хозяине. Экспрессионная кассета или вектор экспрессии по настоящему изобретению может также обеспечить временную экспрессию интересующего полипептида в клетке-хозяине. Временно трансфекцированные клетки-хозяева теряют ДНК в процессе репликации и роста клеток. Экспрессионная кассета по настоящему изобретению может применяться для доставки терапевтического агента нуждающемуся в лечении человеку или животному. Кроме того, экспрессионная кассета по настоящему изобретению может применяться в качестве вакцины для доставки субъекту (например человеку) агента, in vivo кодирующего потенциально иммуногенные полипептиды, в частности, для вакцинации домашних животных, включая используемых в пищу животных, таких как рыбы, свиньи, лошади, коровы, виды собачьих и виды кошачьих. Экспрессионная кассета по настоящему изобретению может вводиться непосредственно как генная конструкция голой нуклеиновой кислоты, как правило, включающий фланкирующие последовательности, гомологичные геному, клетки-хозяина. Усвоение генных конструкций голой нуклеиновой кислоты позвоночными достигается с помощью нескольких известных методов, включая биолистическую трансформацию и липофекцию. В качестве альтернативы экспрессионная кассета может вводиться как часть вектора, включая плазмидный вектор или вирусный вектор. Как правило, экспрессионная кассета или вектор экспрессии объединяют с фармацевтически приемлемым носителем или разбавителем с целью получения фармацевтической композиции. Подходящие- 11008439 носители и разбавители включают изотонический физиологический раствор, в том числе, например, забуференный фосфатом физиологический раствор. Композиция, содержащая экспрессионную кассету или вектор экспрессии, может быть составлена для различных типов введения, включая, например, внутримышечное введение. В том случае, когда композиция, содержащая экспрессионную кассету или вектор экспрессии, применяется в форме инъекции, ее обычно смешивают с носителем, который фармацевтически приемлем для получения состава для инъекции, пригодного для прямой инъекции в место, которое необходимо подвергнуть обработке. Фармацевтически приемлемым носителем или разбавителем может, например,быть стерильный изотонический раствор. Композиции, содержащие экспрессионную кассету или вектор экспрессии, могут быть также составлены в виде перорально активной формы. Конкретный применяемый состав может быть легко определен специалистом, и он будет меняться в зависимости от типа вводимого вещества и пути введения. Используемая доза вещества может быть подобрана в зависимости от различных параметров, особенно в зависимости от используемого вещества, возраста, веса и состояния субъекта, лечение которого необходимо провести, применяемого пути введения и требуемой схемы лечения. Врач сможет определить требуемый путь введения и дозу для любого конкретного субъекта и состояния. Примеры Конструирование вектора pV10 Дополнительные детали конструкции pV10 представлены на фиг. 1. Геномную ДНК выделяют из диплоидных фибропластов человека, инфицированных штаммом AD169 цитомегаловируса человека(АТСС no. VR-538) и используют для того, чтобы методом ПЦР амплифицировать область раннего гена промотора 1 CMV (CMV IE1 Р/Е)/энхансера (детали 5'UTR гена CMV IE1 см. фиг. 11(B) (SEQ ID NO:1. Промотор аплифицируют с использованием праймеров, содержащих сайт HindIII у 5'-конца(tttAAGCTTGACATTGATTATTGACTAG; SEQ ID NO:2; подчеркнут сайт рестрикции) и сайт BamHI у 3'-конца (ttttGGATCCCTGTCAAGGACGGTGACTGC; SEQ ID NO:3; подчеркнут сайт рестрикции). Концевые нуклеотиды "t", предшествующие сайту рестрикции, включены в конструкцию олигонуклеотида, с целью облегчить расщепление ферментом рестрикции, и удаляются по окончании стадии клонирования. Все реакции ПЦР проводят в ДНК-процессоре РТС-200 Pelier Thermal Cycler (MJ Research, Ватертаун, Массачусетс). Общий объем реакционной смеси составляет 100 мкл: буфер IX NEB Vent полимеразы (10 мМ KCl, 20 мМ Tris с рН 8,8 при температуре 25 С, 10 мМ (NH4)SO4, 2 мМ MgSO4, 0,1% Triton Х 100), 2,5 мМ dNTP's, 2 единицы Vent ДНК-полимеразы (New England Biolabs, Беверли, Массачусетс),1 мкг каждого праймера, 1 мкг геномной ДНК, выделенной из CMV-инфицированных клеток в качестве матрицы. Условия проведения реакции следующие: 99 С в течение 1 мин, 55 С в течение 30 с, 75 С в течение 1,5 мин для 15 циклов. Полученный фрагмент расщепляют ферментами рестрикции BamHI иHindIII (New England Biolabs) и субклонируют в вектор клонирования pUC19, который расщепляют с помощью BamHI и HindIII. Проводят анализ последовательности инсерции и определяют, что она совпадает с опубликованной последовательностью клонированной области промотора/энхансера CMV IE1. Конструирование вектора pV40 Конструкция pV40 приведена на фиг. 2. 3'UTR из гена hGHv, включающий сигнал polyA, амплифицируют с помощью ПЦР из геномной ДНК, которую выделяют из фибробластов человека.(+)-Цепь 5'-праймера (TTTTGGATCCCTGCCCGGGTGGCATCC; SEQ ID NO:20) содержит концевой сайт рестрикции(TTTTGAATTCATGAGAGGACAGTGCCAAGC; SEQ ID NO:21). Условия проведения ПЦР такие же, что и при конструировании вектора pV10. Полученный с использованием ПЦР фрагмент расщепляют с помощью BamHI и EcoRI, очищают методом гель-хроматографии и лигируют в вектор pV10, расщепленный с помощью BamHI и EcoRI. Структуру полученной плазмиды, которую обозначают как pV40, подтверждают с помощью рестрикционного ферментативного анализа. Последующее секвенирование показывает небольшое отличие в нуклеотидах между 3'UTR этого гена hGHv (SEQ ID NO:19) и опубликованной последовательностью гена hGHv, которая приведена в банке генов GenBank под номером доступаK00470 (SEQ ID NO:18). По крайней мере, некоторые изменения вызваны аллельными вариациями. Конструирование вектора pV70 Вектор pV40 расщепляют с помощью BspE1 и HpaI с целью удаления секции размером в 317 нуклеотидов из области вставочной последовательности A (IVS) (см. в частности, фиг. 2 и 3). PV60 получают лигированием по тупым концам в BspEI-HpaII кодирующего ghfr участка pV40. Вектор экспрессииpV70, с целью регулирования транскрипции, содержит основную область раннего промотора 1 цитомегаловируса (CMV) человека (hCMV IE1)/энхансера. Он также содержит hCMV IE1 5'UTR и вставочную последовательность А, где вставочная последовательность имеет делецию в 317 пар оснований. С целью терминации транскрипции, вектор содержит область полиаденилирования варианта гормона роста человека (hGHv polyA), SEQ ID NO:19. Детали конструкций pV40, pV60 и pV70 приводятся ниже, а также описываются на фигурах.A. Генерирование pXLC.1. Продукт ПЦР, содержащий последовательность, которая кодирует легкую цепь антитела, расщепляют с помощью BamHI и клонируют в уникальный сайт BamHI в векторе экспрессии pV70 (фиг. 3). Область, кодирующую легкий участок, вводят в уникальный сайт BamHI между 5'UTR последовательностью у 3'-конца вставочной последовательности hCMV IE1 и 5'-концом области hGHv polyA. Указанную плазмиду обозначают как pXLC.1. Схема генерирования вектора pXLC.l представлена на фиг. 4.B. Введение кластера neo-pXLC.2. Экспрессионную кассету неомицинтрансферазы (neo) вводят в pXLC.1 в качестве селектируемого маркера (фиг. 5). Кластер neo получают в виде BamHI/EcoRI фрагмента из коммерчески доступной плазмиды, называемой pGT-N28 (New England Biolabs, номер 307-28 по каталогу). В указанной плазмиде генneo управляется промотором фосфоглицераткиназы (PGK) и терминируется на сайте PGK полиаденилирования. BamHI конец у 5'конца кластера neo превращают в NarI конец с помощью следующих адаптерных олигонуклеотидов: Вместе с указанными линкерами добавляют также новый сайт EcoRI. Адаптер вначале лигируют кBamHI/EcoRI отрезку фрагмента neo, а затем конвертированный фрагмент клонируют в pXLC.1, расщепленный с помощью NarI и EcoRI. Указанным образом экспрессионную кассету neo вводят в 3'-конец последовательности легкой цепи плазмиды. Указанную плазмиду обозначают как pXLC.2 (фиг. 5). Конструирование тяжелой цепи вектора экспрессии - рХНС.5A. RT-PCR тяжелой цепи. Тяжелую цепь амплифицируют по реакцииTTTTGGATCCATGTACTGGGTGAAGCAG (SEQ ID NO:6), где выделенная курсивом последовательность представляет собой добавленный участок линкера с сайтом BamHI, а подчеркнутые основания соответствуют второму метионину в последовательности, кодирующей тяжелую цепь. Использованный 3' ПЦР-праймер, GCCCGGATCCTCATTTACCCGGAGACAG (SEQ ID NO:7), также содержит добавленный участок линкера с сайтом BamHI (выделен курсивом) и последовательность, соответствующую последовательности, кодирующей тяжелую цепь, которая включает кодон терминации (подчеркнут). Получают ожидаемый продукт реакции ЦПР, содержащий 1268 пар оснований.B. Конструирование рХНС. Поскольку использованный 5' ПЦР-праймер гибридизуется со вторым ATG кодоном в кодирующей области, а не инициирующим ATG в кодирующей области, содержащейся в продукте ПЦР, то кодирующая область тяжелой цепи является неполной. Фрагмент BamHI, содержащий неполную тяжелую цепь,клонируют в плазмиду pV60 (фиг. 6). Этот вектор идентичен вектору pV70 (описан выше) за исключением того, что он содержит кодирующую область dhfr в месте делеции во вставочной последовательности. Область, кодирующую тяжелую цепь, вставляют в уникальный сайт BamH между 5' нетранслированной последовательностью у 3'-конца вставочной последовательности hCMV IE1 и 5'-концом области polyA варианта hGHv. Указанную плазмиду с неполной тяжелой цепью обозначают как рХНС. С. Завершение последовательности, кодирующей тяжелую цепь - рХНС.1. Кодирующую область, которая отсутствует в последовательности тяжелой цепи, вставляют в рХНС, чтобы генерировать плазмиду, обозначенную как рХНС.1 (фиг. 7). Для этого посредством ПЦР генерируют фрагмент, содержащий в качестве матрицы кодирующую последовательность для антитела. Используемый 5' ПЦР-праймер представляет собой:BamHI, a последовательность, выделенная жирным шрифтом, соответствует последовательности, которая начинается за два основания перед кодоном инициации в последовательности тяжелой цепи. Используемый 3'-праймер представляет собой(SEQ ID NO:9). Указанный праймер гибридизуется к концу первого экзона, переменной области тяжелой цепи. Получают ожидаемый ПЦР-продукт из 445 пар оснований и разрезают его с помощью PstI и StuI. Фрагмент PstI/StuI клонируют в рХНС, разрезанный с помощью PstI и StuI, и получают рХНС.1D. Удаление dhfr вставочная последовательность - рХНС.3 рХНС.1 содержит ген dhfr во вставочной последовательности hCMV IE1. Вследствие потенциальных проблем с амплификацией, которые обнаружены для данной конфигурации, ген dhfr удаляют из вставочной последовательности, и экспрессионную кассету вставляют в направлении 3' от кластера тяжелой цепи (фиг. 8). Первой стадией является удаление гена dhfr из вставочной последовательности. Указанный процесс осуществляют, вырезая из рХНС.1 последовательность, кодирующую тяжелую цепь,в виде фрагмента PstI/EcoRI и клонируя ее в плазмиду pXLC.1, разрезанную тем же самым ферментом.- 13008439 Указанная стадия клонирования просто переключает в плазмиде легкую цепь на тяжелую цепь. Полученная плазмида идентична рХНС.1 за исключением того, что вставочную последовательность, содержащую ген dhfr, заменяют на вставочную последовательность с делецией, как описано выше для pXLC.1. Указанную плазмиду с тяжелой цепью обозначают как рХНС.3 (фиг. 8). Е. Инсерция кластера dhfr - рХНС.5. Второй стадией в изменении конфигурации dhfr является инсерция dhfr экспрессионной кассеты в направлении 3' от экспрессионной кассеты тяжелой цепи (фиг. 9). Экспрессионную кассету dhfr получают из плазмиды pSI-DHFR на фрагменте Bg1II/BamHI, и он включает ранний промотор SV40, ген dhfr и область SV40 polyA. Указанный фрагмент клонируют в сайт EcoRI, расположенный у 3' конца областиhGHv polyA в рХНС.3 с использованием следующих адаптерных олигонуклеотидов: Указанный адаптер вначале лигируют в плазмиду, разрезанную с помощью EcoRI, а затем кластерBg1II/BamHI dhfr лигируют в адаптированную плазмиду. Указанную плазмиду обозначают как рХНС.5(фиг. 9). Определение свойств pXLC.2 и рХНС.5 Обе плазмиды анализируют с помощью фермента рестрикции с целью подтверждения наличия и ориентации вставленных фрагментов. Кроме того, кодирующую область плазмид секвенируют для подтверждения того, что на стадиях ПЦР или клонирования не возникло мутаций. Присутствие функционального маркера селекции neo подтверждают путем трансфекции pXLC.2 в клетки СНО и демонстрации устойчивости к G418. Способность осуществлять двойную селекцию демонстрируют в том случае, когда плазмиды pXLC.2 и рХНС.5 совместно трансфектируют в не содержащий сыворотку адаптированный хозяин DG44 СНО. Колонии выращивают из совместной трансфекции в двойных селектирующих средах (а - MEM 10% dFBS с 400 мг/мл G418). В тех же условиях каждая селекция по отдельности (а - MEM или 400 мг/мл G418) способна убивать нетрансфекцированные клетки. Конструирование векторов: векторы pV80 или pV90pV80 генерируют из вектора экспрессии рХНС.5 тяжелой цепи (фиг. 10). Последовательность, кодирующую тяжелую цепь, удаляют из рХНС.5 с помощью BamHI. Каркас лигируют, чтобы восстановить циклизацию по сайту BamHI. С целью генерирования вектора pV90 проводят два изменения в векторе pV80 (фиг. 11). Разрушают сайт Not1, обнаруживаемый в генной конструкции pV80 в позиции 3166 (на конце кодирующей областиdhfr). Для этого плазмиду разрезают с помощью Not1 и вставляют нависающие части с помощью полимеразы Кленова. В результате вновь лигированная плазмида теряет сайт Not1 в позиции 3166. Затем создают новый сайт Not1 на сайте клонирования, разрезая вектор с помощью BamHI и вводя линкер Not1,полученный ренатурацией следующего 14-мера с самим собой: GATCCGCGGCCGCG (SEQ ID NO:12). При совместной ренатурации получают последовательность линкера: Указанная стадия клонирования восстанавливает сайты BamHI по обеим сторонам сайта Not1. Указанные сайты BamHI могут быть полезны при проведении генетического анализа стабильных клеточных линий с помощью указанного вектора. Последовательность сайта клонирования в pV90 подтверждают секвенированием. В векторе pV80 какой-либо полинуклеотид (например кодирующую последовательность) можно клонировать в сайт BamHI GGATCCCTGCCCGGGT (SEQ ID NO:15). Выделенная жирным шрифтом последовательность соответствует сайту BamHI. В векторе pV90 какой-либо полинуклеотид (например,кодирующую последовательность) можно клонировать в сайтGGATCCGCGGCCGCGGATCCCTGCCCGGGT (SEQ ID NO:16). Здесь выделенная жирным шрифтом последовательность соответствует сайту BamHI, a подчеркнутая последовательность - сайту Not1. С целью получения оптимальных результатов при использовании сайта Not1 "С" должен быть добавлен перед стартовым кодоном в ПЦР-праймерах с тем, чтобы наилучшим образом соответствовать последовательности Козака (например GGATCC GCGGCCGC С ATG (SEQ ID NO:17. Сайты рестрикции в pV80 и pV90pV80 и pV90 идентичны за исключением сайтов рестрикции NotI: pV80 содержит единственный сайт Not1 в положении 3166 (конец области, кодирующей dhfr), a pV90 содержит единственный сайтNot1 в положении 1260 (сайт клонирования). Общие сайты рестрикции, из которых обнаруживают 2 или менее, включают сайты рестрикции,приведенные в табл. 1. Не обнаружены следующие общие сайты ферментов рестрикции. Таблица 2 Клонирование репортерных генов. Экспрессионную кассету/вектор экспрессии, включающую CMV IE1, фрагмент вставочной последовательности А и генную конструкцию hGHv polyA, сравнивают с коммерчески доступным сильным вектором экспрессии на основе SV-40. Секретируемую алкалинфосфатазу (SEAP) используют в качестве репортера для сравнения плазмид. Вектор экспрессии на основе SV-40, pSEAP2-control (номер по каталогу 6052-1, Clontech) экспрессирует SEAP под контролем раннего промотора SV40 и энхансера SV40. За кодирующей SEAP последовательностью следует поздний сигнал полиаденилирования SV40, с целью обеспечения правильного,эффективного процессинга транскрипта SEAP в эукариотических клетках. Синтетический блокатор транскрипции (ТВ), составленный из примыкающих друг к другу сайтов полиаденилирования и временной приостановки транскрипции, которые расположены в обратном направлении от MCS, снижает фоновую транскрипцию. Вектор имеет ряд особенностей, которые улучшают чувствительность SEAP за счет повышения эффективности экспрессии SEAP или повышают полезность векторов. Они включают улучшенный консенсусный сайт инициации трансляции Козака; удаление вставочной последовательности SV-40 small-t, которая может вызывать латентный сплайсинг и приводить к снижению экспрессии в некоторых генах и/или типах клеток; переключение с раннего на поздний сигнал полиаденилирования SV40, который обычно вызывает пятикратное повышение уровней мРНК; расширенный множественный сайт клонирования (MCS); компактный размер плазмиды; и удаление посторонних последовательностей из 3' нетранслированной области SEAP мРНК. Номер доступа в U89938 в банке генов. С целью генерации плазмиды pCMV-hGHvPA-SEAP последовательность, кодирующую SEAP, извлекают из плазмиды pSEAP2-control с помощью ПЦР и клонируют в вектор pV110. Плазмида pV110 является производной от pV90 (отсутствует экспрессионная кассета dhfr, содержится отличный полилинкер, а в остальном то же самое). Конструкцию плазмиды pCMV-hGHvPA-SEAP подтверждают секвенированием. Хозяином, который используют для проведения трансфекций, является дефицитная по дигидрофолятредуктазе (DHFR) клеточная линия DG44 яичников китайского хомячка (Urlaub et al., Cell 33, 405-412(1983. Репортерные плазмиды CMVSEAP и pSEAP2-control подвергают совместной трансфекции плазмидой, кодирующей дигидрофолятредуктазу (dhfr) таким образом, чтобы для них могли быть выбраны стабильные трансфектанты (pSI-DHFR.2, фиг. 12). Каждая трансфекция содержит 50 мкг репортерной плазмиды и 5 мкг pSI-DHFR.2. Все ДНК получают с использованием набора реагентов Megaprep(Qiagen). Перед проведением трансфекций ДНК осаждают с помощью EtOH, промывают 70% EtOH, сушат, повторно суспендируют в HEBS (20 мМ Hepes, pH 7,05, 137 мМ NaCl, 5 мМ KCl, 0,7 мМ Na2HPO4,6 мМ декстрозы) и перед трансфекцией проводят количественный анализ. Отрицательные контроли включают pUC18 (ATCC No. 37253) в качестве репортерного контроля и ДНК без трансфекций в качестве контроля трансфекции (табл. 3). Клетки и ДНК трансфектируют электропорацией в 0,8 мл HEBS, используя кювету 0,4 см (BioRad) и 0,28 кВ и 950 мФ. Количество клеток, используемых для проведения каждой трансфекции, составляет 5 Е 6. После импульса электропорации каждой клетке дают инкубировать в кювете в течение 5-10 мин при комнатной температуре. Затем их переносят в пробирку центрифуги, содержащую 10 мл альфа MEM с нуклеозидами и 10% dFBS, и в течение 5 мин формируют таблетку при скорости вращения 1000 об./мин. Таблетки после повторного суспендирования высевают в 6-луночные планшеты в альфа MEM без нуклеозидов с 10% dFBS и инкубируют при 36 С с 5% CO2 в модифицированном инкубаторе до тех пор,- 15008439 пока не образуются колонии. Таблица 3 Приблизительно через 2 недели после трансфекции колонии образуются в трансфекциях, содержащих лишь плазмиду pSIDHFR.2. Стабильные трансфектанты анализируют либо в виде пула, либо в виде изолятов. Удельную продуктивность определяют с помощью анализов, в которых среду заменяют на свежую, а через 24 ч берут пробы среды и проводят подсчет клеток. Титр продукта нормализуют относительно количества клеток по окончании 24-часового анализа, и продуктивность выражают в виде активности SEAP на клетку. Анализ SEAP. Кондиционированную среду анализируют с помощью Great EscAPe SEAP ReporterSystem 3 (Clontech). В указанном анализе для определения активности SEAP в кондиционированной среде используют флуоресцентный субстрат. Набор реагентов применяют в 96-луночном формате в соответствии с рекомендациями изготовителя, за исключением следующего. Буферный раствор из набора для проведения анализа заменяют на раствор, содержащий 1,5 М диэтаноламина, 0,75 мМ MgCl2, 15 мМL-гомоаргинина и 10% Emerald II (номер по каталогу 9761, Applied Biosystems). Все стандартные растворы и образцы разбавляют свежей средой, а не предлагаемым буферным раствором для разбавления. Вместо того чтобы проводить одно считывание через 60 мин, проводят множество считываний через интервалы 10-20 мин, и их используют для выражения активности SEAP в виде относительных единиц флуоресценции в минуту (RFU/мин). Для планшет-ридера (Cytofluor II, PerSeptive Biosystems) вместо рекомендуемого фильтра 449 нм применяют фильтр испускания 460 нм. Значения RFU/мин нормализуют относительно стандартной кривой на основе стандарта, прилагаемого к набору реагентов. Поскольку прилагаемый стандарт не является количественным, то все значения являются относительными. Для получения величин относительной удельной продуктивности (активность SEAP на клетку в день) указанные относительные значения нормализуют по отношению к количеству клеток и инкубационному периоду. Пулы. После появления колоний клетки собирают и готовят пулы каждой трансфекции. Пулы высевают в 6-луночные планшеты в количестве 2105 клеток на лунку. На следующий день среду заменяют на 2 мл свежей среды. Через 24 ч клетки подсчитывают, и образец среды используют для анализа активности SEAP. Результаты анализа пулов приведены на фиг. 13. Изоляты. Изоляты получают "отбором" колоний из трансфекции. "Отбор" осуществляют отсасыванием прямо над колонией с помощью устройства Р 200 Pipetman, установленного на объем 50 мл. Колонии после отсасывания вначале переносят на 48-луночный планшет, а затем, когда будет получено достаточное количество клеток, переносят на 6-луночный планшет. Удельную продуктивность анализируют на 6-луночных планшетах при плотностях клеток, близких к конфлюэнтным, используя 24-часовой анализ, который описан выше (фиг. 14). Как суммировано на фиг. 13 и 14, вектор экспрессии на основе комбинации промотора CMV IE и сигнальной области hGHv polyA, значительно превосходит коммерчески доступный вектор, который отличается высокой экспрессирующей способностью. Описано несколько вариантов осуществления настоящего изобретения. Тем не менее, следует понимать, что могут быть внесены различные модификации, которые соответствуют сущности и объему притязаний по настоящему изобретению. Таким образом, другие варианты осуществления настоящего изобретения подпадают под следующую формулу изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Экспрессионная кассета, включающая область раннего промотора 1 (hCMV IE1)/энхансера CMV человека; интересующий полинуклеотид и сигнальный домен polyA варианта гормона роста человека(hGHv) или его вариант, где сигнальный домен hGHv polyA имеет длину по крайней мере 100 нуклеотидов и содержит последовательность ААТААА, и вариант polyA по крайней мере на 92% идентичен сигнальному домену hGH polyA. 2. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV включает последовательность, представленную от приблизительно x1 до приблизительно x2 последовательности SEQ IDNO:1, где x1 обозначает нуклеотид приблизительно от 1 до 20 последовательности SEQ ID NO:1, а x2 обозначает нуклеотид приблизительно от 715 до 720 последовательности SEQ ID NO:1.- 16008439 3. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV включает последовательность SEQ ID NO:1. 4. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV комплементарна последовательности SEQ ID NO:1. 5. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит последовательность, которая по меньшей мере на 95% идентична SEQ ID NO:1 или комплементарной ей последовательности. 6. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит последовательность, которая по меньшей мере на 97% идентична SEQ ID NO:1 или комплементарной ей последовательности. 7. Экспрессионная кассета по п.1, где область промотора IE1/энхансера hCMV содержит нуклеотид от 1 до 1867 последовательности SEQ ID NO:1. 8. Экспрессионная кассета по п.1, которая дополнительно включает вставочную последовательность переменной длины (VLIVS), содержащую донорный сайт сплайсинга и акцепторный сайт сплайсинга. 9. Экспрессионная кассета по п.8, где VLIVS включает интрон А гена IE1 hCMV. 10. Экспрессионная кассета по п.8, где VLIVS включает интрон А гена IE1 hCMV с делецией между акцепторным сайтом сплайсинга и донорным сайтом сплайсинга интрона А. 11. Экспрессионная кассета по п.8, где VLIVS включает последовательность от приблизительно х 3 до х 4 последовательности SEQ ID NO:1, где x3 обозначает нуклеотид между приблизительно 715-720 последовательности SEQ ID NO:1, а х 4 обозначает нуклеотид между приблизительно 1236-1254 последовательности SEQ ID NO:1. 12. Экспрессионная кассета по п.1, дополнительно содержащая добавочный промоторный/энхансерный элемент или регуляторную область. 13. Экспрессионная кассета по п.12, где промоторный/энхансерный элемент представляет собой промоторный/энхансерный элемент SV40. 14. Экспрессионная кассета по п.12, где регуляторная область является областью полиаденилирования SV40. 15. Экспрессионная кассета по п.1, где маркер селекции выбран из группы, состоящей из дигидрофолатредуктазы, GPF, неомицина, Hugro, Zeocin, тимидинкиназы вируса простого герпеса, гипоксантин-гуанин фосфорибозилтрансферазы,аденинфосфорибозилтрансферазы,пуромицинNацетилтрансферазы или аденозиндеаминазы. 16. Экспрессионная кассета по п.15, где маркером селекции является дигидрофолатредуктаза. 17. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует терапевтический агент. 18. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует полипептид для диагностического или терапевтического применения. 19. Экспрессионная кассета по п.1, где интересующий полинуклеотид кодирует антигенный полипептид для применения в качестве вакцины. 20. Экспрессионная кассета по п.1, где сигнальный домен polyA включает по крайней мере 100 последовательных нуклеотидов последовательности SEQ ID NO:19. 21. Экспрессионная кассета по п.20, где сигнальный домен polyA включает последовательностьSEQ ID NO:19. 22. Экспрессионная кассета по п.1 в виде конструкции голой нуклеиновой кислоты. 23. Полинуклеотид, который специфически гибридизуется с полинуклеотидной последовательностью последовательности SEQ ID NO:1 приблизительно от 1 до приблизительно 1867 или ее фрагментом. 24. Экспрессионный вектор, содержащий экспрессионную кассету по любому из пп.1-22. 25. Клетка-хозяин, содержащая вектор экспрессии по п.24. 26. Клетка-хозяин, содержащая экспрессионную кассету по любому из пп.1-22. 27. Способ получения полипептида, включающий деление клетки-хозяина по п.25 или 26 и экспрессию интересующего полинуклеотида. 28. Способ доставки терапевтического агента животным, включающий деление клетки-хозяина по п.25 или 26 и экспрессию интересующего полинуклеотида. 29. Генетический вектор hXHC.5.
МПК / Метки
МПК: C12N 5/02, C07H 21/04
Метки: молекул, временной, экспрессии, вектор, экспрессионная, постоянной, экзогенных, кассета
Код ссылки
<a href="https://eas.patents.su/30-8439-ekspressionnaya-kasseta-i-vektor-dlya-vremennojj-ili-postoyannojj-ekspressii-ekzogennyh-molekul.html" rel="bookmark" title="База патентов Евразийского Союза">Экспрессионная кассета и вектор для временной или постоянной экспрессии экзогенных молекул</a>
Предыдущий патент: Парентеральные композиции пептида для лечения системной красной волчанки
Следующий патент: Применение карбоксиметилцеллюлозы в буровых растворах
Случайный патент: Композиции для профилактики и локального лечения воспалительных заболеваний кожи, а также суставов и мышц, содержащие деароматизированный белый нафталан