Рутениевые комплексы в качестве (пред)катализаторов для реакций метатезиса
Формула / Реферат
1. Соединение формулы 1
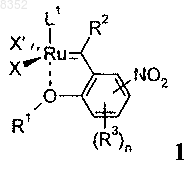
в которой X и X' обозначают галоген;
R1 обозначает -C1-С5алкил;
R2 обозначает Н;
n обозначает 0;
R3 отсутствует;
L1 обозначает P(R11)3, где R11 обозначает -С3-С8циклоалкил, или лиганд формулы 6а
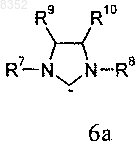
в которой R7 и R8 обозначают фенил, необязательно замещенный посредством до трех групп, независимо выбранных из -С1-С6алкила;
R9 и R10 обозначают Н.
2. Соединение по п.1 формулы 1а
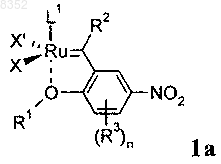
в которой L1, X, X', R1, R2, R3 и n имеют значения, указанные в п.1.
3. Соединение по п.1 или 2, в котором L1 обозначает РСу3 или лиганд формулы 6а; Су обозначает циклогексил; X и X' каждый обозначает атом хлора.
4. Соединение по одному из пп.1-3, в котором L1 обозначает лиганд формулы 6а, а R7 и R8 обозначают 2-метилфенил, 2,6-диметилфенил или 2,4,6-триметилфенил.
5. Соединение по одному из пп.1-4, в котором R1 обозначает изо-Рr; R2 обозначает Н.
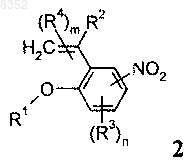
6. Соединение формулы 2
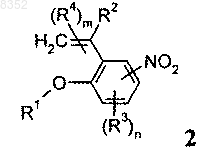
в которой R1 обозначает -С1-С5алкил;
R2 обозначает Н;
R3 отсутствует;
R4 отсутствует;
m обозначает 0 и
n обозначает 0.
7. Соединение по п.6 формулы 2а
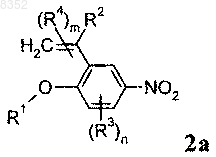
где R1, R2, R3, R4, m и n имеют значения, указанные в п.6.
8. Соединение по п.6 или 7, в котором R1 обозначает изопропил.
9. Способ получения комплексов по одному из пп.1-5, в котором проводят реакцию соединения формулы 2 или 2а по пп.6-8 с рутениевым комплексом общей формулы 5
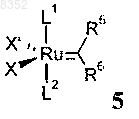
где L1 и L2, X и X' имеют значения, указанные в п.1;
R5 обозначает Н, -С1С20алкил;
R6 обозначает фенил.
10. Способ по п.9, который осуществляют в присутствии соли меди.
11. Способ получения промежуточных продуктов формулы 2 или 2а по одному из пп.6-8, который включает стадии:
а) алкилирования соединения формулы 3
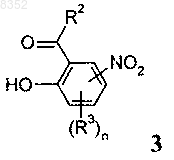
реагентом формулы R1Z (9) с получением промежуточного продукта формулы 4
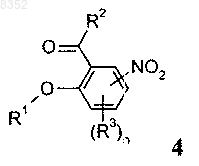
и
б) реакции промежуточного продукта формулы 4 с агентом олефинирования
формулы
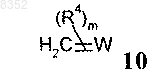
с получением соединения общей формулы 2
в которой R1, R2, R3, R4, m и n формул 2а, 3, 4, 9 и 10 имеют такие значения, как указанные в пп.6-8;
W обозначает уходящую группу, приемлемую для реакций олефинирования; а
Z обозначает атом галогена.
12. Способ проведения реакции метатезиса, включающий контактирование двух соединений, содержащих двойную связь С=С, или одного соединения, содержащего по меньшей мере две двойные связи С=С, с катализатором, где этот катализатор включает рутениевый комплекс по пп.1-5.
13. Способ проведения реакции замыкания цикла или перекрестного метатезиса, включающий контактирование диалкенильного соединения с рутениевым комплексом по пп.1-5.
Текст
008352 Область техники, к которой относится изобретение Настоящее изобретение относится к рутенийкарбеновым комплексам формулы 1, к их синтезу и к их практическому применению в качестве катализаторов для реакций метатезиса разных типов. Предпосылки создания изобретения За последние несколько лет в использовании метатезиса олефинов в органическом синтезе был достигнут большой прогресс. Были созданы некоторые рутенийкарбеновые комплексы, действующие как(пред)катализаторы, которые обладают высокой активностью в различных реакциях метатезиса, а также широкой совместимостью с рядом функциональных групп. Это сочетание характеристик служит основой для возможности применения таких (пред)катализаторов в органическом синтезе. Более того, для практического применения, в особенности в промышленном масштабе, весьма необходимо, чтобы эти рутениевые комплексы были стабильными в течение более длительного периода времени в условиях термической нагрузки и чтобы их можно было хранить, очищать и использовать без атмосферы защитных газов. Рутениевые комплексы с вышеупомянутыми характеристиками известны из литературы (см.J.Am.Chem.Soc. 2000, 122, 8168-8179 или Tetrahedron Lett. 2000, 41, 9973-9976). Однако было установлено, что улучшенная стабильность связана с пониженной каталитической активностью. Такое ограничение было найдено, например, у (пред)катализатора формулы А (см. Angew.Chemie Int.Ed. 2002, 114, 832). Далее, были описаны (пред)катализаторы формул В и С, которые демонстрируют повышенную каталитическую активность в сравнении с активностью (пред)катализатора формулы А. Катализаторы А, В и С содержат изопропоксигруппу, образующую с атомом металла хелат. Причиной повышенной активности систем В и С является пространственное затруднение, вызванное присутствием в орто-положении к изопропоксигруппе фенильной или (замещенной) нафтильной группы (Angew.Chemie Int.Ed. 2002, 114,832-834; Angew.Chemie Int.Ed. 2002, 114, 2509-2511). Было установлено, что рутениевые комплексные (пред)катализаторы общей формулы 1, содержащие ароматическую нитрогруппу, демонстрируют намного более высокую каталитическую активность в сравнении с активностью известных высокоактивных рутениевых комплексов и что одновременно с этим такие комплексы являются термически стабильными и стабильными на воздухе. Краткое изложение сущности изобретения Настоящее изобретение относится к новым рутениевым комплексам формулы 1 и их применению в качестве катализаторов или в качестве предкатализаторовL1 обозначает P(R11)3, где R11 обозначает -С 3-С 8 циклоалкил, или лиганд формулы 6 а где R7 и R8 обозначают фенил, необязательно замещенный посредством до трех групп, независимо выбранных из -C1-С 6 алкила; R9 и R10 обозначают Н. Соединения формулы 1 по настоящему изобретению можно использовать для катализа реакций метатезиса олефинов, включающих, хотя ими их список не ограничен, метатезисную полимеризацию с раскрытием цикла (МПРЦ), метатезис замыкания цикла (МЗЦ), деполимеризацию ненасыщенных полимеров, синтез телехелатных полимеров, метатезис "ен-в-ин" и синтез олефинов. Другой объект настоящего изобретения относится к новым производным 2-алкокси-5-нитростирола формулы 2, которые являются промежуточными продуктами для получения комплексов 1 представляет алкиленовую группу, в которой один или оба водородных атома у метиленового радикала можно заменить группой R4. Соответственно она охватывает следующие алкиленовые группы: Еще одним объектом изобретения является способ получения новых производных 2-алкокси-5 нитростирола формулы 2, в котором замещенный 2-гидрокси-5-нитробензальдегид 3 алкилируют посредством R1Z, где R1 имеет значение, указанное для формулы 1, а Z представляет собой уходящую группу, в частности, атом галогена. Затем замещенный 2-алкокси-5-нитробензальдегид формулы 4 обрабатывают агентом олефинирования формулы в которой R4 и m имеют значения, указанные для формулы 2, a W представляет собой уходящую группу,приемлемую для реакций олефинирования, с получением соединения формулы 2. Следующим объектом изобретения является способ получения рутениевого комплекса формулы 1,-2 008352 в котором проводят реакцию соединения формулы 2 или 2 а с рутениевым комплексом формулы 5 Соединения, представленные в настоящем описании, могут обладать центрами асимметрии. Соединения по настоящему изобретению, содержащие асимметрически замещенный атом, можно выделять в оптически активных или рацемических формах. В данной области техники хорошо известно, как получить оптически активные формы, в частности разделением рацемических форм или синтезом из оптически активных исходных материалов. В соединениях, представленных в настоящем описании, могут также присутствовать многие геометрические изомеры олефинов, и все такие стабильные изомеры рассматриваются как охватываемые объемом настоящего изобретения. Геометрические цис- и транс-изомеры соединений по настоящему изобретению описаны и могут быть выделены в форме смеси изомеров или как выделенные изомерные формы. Во всех случаях, если не указана конкретная стереохимическая или изомерная форма, предполагаются все хиральные, диастереоизомерные, рацемические формы и все геометрические по своему строению изомерные формы. Краткое описание чертежа На чертеже приведен график, на котором сопоставлены скорости циклизации 2-аллил-2-(2 метилаллил)диэтилмалоната, когда используют рутениевый катализатор в соответствии с настоящим изобретением и когда используют известный рутениевый катализатор. Подробное описание изобретения Понятиям, смысл которых в настоящем описании конкретно не раскрыт, следует придавать те значения, которые им обычно придает специалист в данной области техники с учетом описания и контекста. Однако во всех случаях, если не указано иное, используемые в данном описании следующие понятия имеют указываемый смысл и сопровождаются прилагаемыми к ним следующими условными обозначениями. В группах, радикалах или остатках, приводимых ниже, число углеродных атомов часто указано как предшествующее названию группы; так, например, -C1-С 6 алкил означает алкильную группу или радикал,содержащий от 1 до 6 углеродных атомов. Во всех случаях, если ниже не указано иное, во всех приводимых формулах и группах используют традиционные определения терминов и указывается обычная устойчивая валентность атомов. Понятие "замещенный", используемое в настоящем описании, означает, что любой один или несколько водородных атомов при называемом атоме замещены с выбором из указанного ряда при условии, что естественная валентность этого называемого атома не превышена и что замещение приводит к образованию стабильного соединения. Понятие "арил", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает любую ароматическую монокарбоциклическую систему или ароматические поликарбоциклические системы. Так, например, понятие "арил" охватывает фенильную или нафтильную циклическую систему. Понятие "атом галогена", используемое в настоящем описании, означает галоидный заместитель,выбранный из атомов фтора, хлора, брома и иода. Понятие "-С 1-С 20 алкил", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает ациклические, прямоцепочечные или разветвленные алкильные заместители, содержащие от одного до двадцати углеродных атомов. Понятия "-С 1-С 5 алкил" и"-C1-С 6 алкил", используемые в настоящем описании, имеют такое же значение, как вышеупомянутое понятие, но предусматривает содержание меньшего числа углеродных атомов, а точнее максимум пять или шесть углеродных атомов. Понятия "-C1-С 20 алкил", "-C1-С 5 алкил" и "-С 1-С 6 алкил" могут охватывать конкретно метил, этил, пропил, бутил, гексил, 1-метилэтил, 1-метилпропил, 2-метилпропил и 1,1 диметилэтил. Понятие "-С 2-С 20 алкенил", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает ациклические, прямоцепочечные или разветвленные алкенильные заместители, содержащие от двух до двадцати углеродных атомов и по меньшей мере одну двойную связь. Понятие "-С 2-С 6 алкенил", используемое в настоящем описании, имеет такое же значение,как вышеупомянутое понятие, но предусматривает содержание меньшего числа углеродных атомов, а точнее максимум шести углеродных атомов. Понятия "-С 1-С 20 алкенил" и "-C1-С 6 алкенил" могут охватывать конкретно винил и алленил.-3 008352 Понятие "-С 2-С 20 алкинил", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает ациклические, прямоцепочечные или разветвленные алкинильные заместители, содержащие от двух до двадцати углеродных атомов и по меньшей мере одну тройную связь. Понятие "-С 2-С 6 алкинил", используемое в настоящем описании, имеет при этом такое же значение, как вышеупомянутое понятие, но предусматривает содержание меньшего числа углеродных атомов, а точнее максимум шести углеродных атомов. Понятие "-С 5-С 6 циклоалкил", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает циклоалкильный заместитель, содержащий пять или шесть углеродных атомов, и конкретно охватывает циклопентил и циклогексил. Понятие "-C1-С 6 алкокси", используемое в настоящем описании либо самостоятельно, либо в сочетании с названием другого заместителя, означает заместитель -C1-С 6 алкил-О-, у которого алкил имеет приведенные выше значения, содержащий до шести углеродных атомов. Алкокси охватывает метокси,этокси, пропокси, 1-метилэтокси, бутокси и 1,1-диметилэтокси. Дополнительные варианты Предпочтительны соединения формулы 1 а, в которой L1, X, X', R1, R2, R3 и n имеют такие же значения, как указанные выше. Более предпочтительными являются соединения общей формулы 1 или 1 а, в которойL1 обозначает лиганд формулы 6 а, 6b, 6 с или 6d в которой R7 и R8 каждый независимо обозначает Н, -C1-С 20 алкил, -С 2-С 20 алкенил или фенил, где фенил необязательно замещен посредством до трех групп, независимо выбранных из -C1-С 6 алкила, -C1 С 6 алкокси и атома галогена; в отдельностиR9 и R10 каждый независимо обозначает Н, -C1-С 20 алкил, -С 2-С 20 алкенил или фенил, где фенил необязательно замещен посредством до трех групп, независимо выбранных из -С 1-С 6 алкила, -C1-С 6 алкокси и атома галогена, илиR9 и R10 совместно с углеродными атомами, к которым они присоединены, объединяются с образованием карбоциклического от 3- до 8-членного кольца;Y и Y' обозначают атомы галогена. Особенно предпочтительными являются соединения, у которыхR7 и R8 каждый независимо обозначает Н, -С 1-С 6 алкил, -С 2-С 6 алкенил или фенил, где фенил необязательно замещен посредством до трех групп, независимо выбранных из -C1-С 6 алкила, -C1-С 6 алкокси и атома галогена;R9 и R10 каждый независимо обозначает Н, -C1-С 6 алкил, -С 2-С 6 алкенил или фенил, где фенил необязательно замещен посредством до трех групп, независимо выбранных из -C1-С 6 алкила, -C1-С 6 алкокси и атома галогена, илиR9 и R10 совместно с углеродными атомами, к которым они присоединены, объединяются с образованием карбоциклического от 5- до 7-членного кольца. Наиболее предпочтительными являются соединения общей формулы 1 или 1 а, в которойL1 обозначает группу формулы 6 а, 6b, 6 с или 6d; и/илиn обозначает 0. Дополнительными вариантами являются соединения формулы 1 или 1 а, в которойX и X' каждый обозначает атом хлора; aL1 обозначает лиганд формулы 6 а в которой каждый из R7 и R8 обозначает 2,4,6-триметилфенил; аR9 и R10 каждый обозначает Н. Предпочтительны соединения формулы 2 а, в которой R1, R2, R3, R4, m и n имеют такие же значения,как указанные выше. Более предпочтительны соединения общей формулы 2 или 2 а, в которойR1 обозначает изопропильную группу и/илиR4 обозначает -C1-С 6 алкил, в частности метил или этил; и/илиm обозначает 0. Другими вариантами являются соединения формулы 2 или 2 а, в которойn обозначает 0. Более того, предпочтителен способ получения комплексов формулы 1 или 1 а, в котором проводят реакцию соединения общей формулы 2 или 2 а с рутениевым комплексом формулы 5X и X' обозначают анионные лиганды; необязательно в присутствии другого нейтрального лиганда L1. Более предпочтителен вышеупомянутый синтез рутениевого комплекса формулы 1, когда процесс проводят в присутствии соли меди, в частности CuCl; и/или в галоидированном или ароматическом растворителе, преимущественно выбранном из метиленхлорида, хлороформа, бензола, толуола, ксилола,мезитилена и их смесей; и/или при температуре от 0 до 100 С, в частности при температуре от 10 до 80 С, более конкретно при температуре от 20 до 60 С; и/или в течение периода времени от 1 до 24 ч, в частности от 1 до 10 ч, более конкретно от 1 до 4 ч. Наиболее предпочтителен вышеупомянутый синтез рутениевого комплекса, в котором реакцию проводят в одном сосуде смешением лиганда формулы 6 а, 6b, 6 с или 6d с твердым комплексом формулы 5, где оба лиганда L1 и L2 являются фосфинами формулы P(R11)3, в которой R11 имеет такие же значения,как указанные выше, и последующим добавлением лиганда формулы 2 или 2 а. Один предпочтительный вариант вышеупомянутого синтеза рутениевого комплекса заключается в получении in situ лигандов общей формулы 6 а, 6b, 6 с и 6d из стабильных солей формул 7 а, 7b, 7 с и 7d в которых анион выбирают из формиатного, ацетатного, трифторацетатного и других кислотных остат-5 008352 ков, атома галогена и [BF4]-. Следовательно, в предпочтительном варианте проводят реакцию соли в форме суспензии в растворителях, таких как алифатические и ароматические углеводороды, предпочтительно в гексане, с сильным основанием, выбранным из гидридов и алкоголятов щелочных металлов и щелочно-земельных металлов, преимущественно из трет-пентанолята калия, трет-амилата калия и третбутанолята калия. После этого реакцию продолжают добавлением твердого комплекса формулы 5, в которой оба лиганда L1 и L2 являются фосфинами формулы P(R11)3, и последующим добавлением лиганда формулы 2 или 2 а с получением соединения общей формулы 1 или 1 а. Более того, предпочтителен способ получения промежуточных продуктов, который включает стадии а) алкилирования соединения общей формулы 3 реагентом формулы R1Z (9) с получением промежуточного продукта формулы 4 и б) реакции соединения 4 с агентом олефинирования формулы 10 с получением соединения общей формулы 2 в которых R1, R2, R3, R4, m и n формул 2 а, 3, 4, 9 и 10 имеют такие значения, как указанные выше,W обозначает уходящую группу, приемлемую для реакций олефинирования, аZ обозначает атом галогена, -С 1-С 6 алкил-S(О)-О-, -С 1-С 6 фторалкил-S(О)-О-, арил-S(О)-О- или арилS(О)2-О-. Более предпочтителен способ, в котором вышеупомянутую стадию а) осуществляют в апротонном растворителе, в частности выбранном из ДМФ, ДМСО, ацетона, ацетонитрила, этилацетата, простого гликолевого эфира, метанола, этанола и их смесей, более конкретно растворитель представляет собой ДМФ; или в двухфазной системе растворителей, снабженной межфазным катализатором; или в присутствии катализатора, причем, в частности, катализатор выбирают из CS2CO2, CsF, четвертичных аммониевых солей, краун-эфиров и криптандов, более конкретно Cs2CO3; или в присутствии карбоната щелочного металла или гидроксида щелочного металла, в частности выбранного из Na2 СО 3, K2 СО 3, Li2 СО 3,Cs2CO3, NaOH, KОН, LiOH, CsOH; или в течение периода времени от 1 до 24 ч, в частности от 8 до 24 ч,более конкретно от 16 до 24 ч при температуре от 0 до 150 С, в частности при температуре от 10 до 100 С, более конкретно при температуре от 20 до 80 С. Исходя из соединения 4, соединение 2 получают в соответствии с условиями Теббе, Виттига, Виттига-Хорнера, Виттига-Хорнера-Эммонса или Петерсона, но предпочтителен способ, в котором вышеупомянутую стадию б) осуществляют в растворителе, выбранном из спиртов, гликолевых эфиров и циклических простых эфиров, а предпочтителен ТГФ; или W обозначает уходящую групп, приемлемую для реакций олефинирования в соответствии с Теббе, с титановым реагентом Теббе или в соответствии с Виттигом, с фосфонийилидным реагентом Виттига, более конкретно уходящую группу, выбранную изPPh3 или TiCp2, где Ph обозначает замещенный или незамещенный фенил, а Ср обозначает замещенный или незамещенный циклопентадиенильный анион, который можно обнаружить после реакции в его окисленной форме. Другим предпочтительным вариантом выполнения изобретения является способ проведения реакций метатезиса всех типов, включая контактирование олефина с катализатором общей формулы 1 или 1 а,в частности, когда реакция метатезиса представляет собой реакцию замыкания цикла или перекрестного метатезиса. Следующие примеры предназначены для иллюстрации различных вариантов выполнения настоящего изобретения, поэтому их нельзя воспринимать как ограничивающие каким-либо образом объем настоящего изобретения. Пример 1. 4.I. В перемешиваемую суспензию порошкообразного безводного карбоната калия (1,1 г, 8 ммоль),каталитически эффективного количества карбоната цезия (521 мг, 40 мол.%) и соединения 3.I (668 мг, 4 ммоль) в сухом ДМФ (25 мл) вводили неразбавленный 2-иодпропан (0,8 мл, 8 ммоль). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре (КТ), а затем под вакуумом выпаривали растворитель. Остаток выливали в воду (50 мл) и экстрагировали трет-ВuОМе (4 раза по 25 мл). Объединенные органические слои промывали рассолом, сушили Mg2SO4 и выпаривали досуха. Сырой продукт очищали с использованием хроматографии в колонке с силикагелем (циклогексан/ЕtOAс 8:2), получая 2-6 008352 изопропокси-5-нитробензальдегид 4.I в виде низкоплавкого твердого вещества (850 мг, 86%-ный выход). ИК(KВr):[см-1] = 3115, 2991,2942, 1679, 1609, 1526, 1348, 1284, 1111, 950, 832, 748, 667; 1H-ЯМР (500 МГц, CDCl3,[част./млн]): 1,48 (d, 6H, J = 6,1 Гц), 4,85 (q, 1 Н, J = 6,1 Гц), 7,10 (d, 1H,J = 9,2 Гц), 8,39 (dd, 1H, J = 2,9, 9,2 Гц), 8,69 (d, 1H, J = 2,9 Гц), 10,41 (s, 1H); 13 С-ЯМР (125 МГц, CDCl3,[част./млн]): 21,8, 72,6, 113,6, 124,7, 125,12, 130,4, 141,1, 164,3, 187,8; МС (El): m/z 209 (10, [М]+.), 167 (100), 137 (18), 120 (11), 93 (7), 75 (3), 65 (10), 53 (4); МСВР (Еl) рассч. для [М]+ (C10H11O4N): 209,0688; обнаруж.: 209,0686. 2.I. В перемешиваемую суспензию Ph3PCH3Br (932 мг, 2,53 ммоль) в сухом ТГФ (20 мл) при -78 С медленно последовательно добавляли раствор BuLi в гексане (1,8 мл, 2,7 ммоль, 1,5 М) и раствор соединения 4.I в сухом ТГФ (2 мл). После этого реакционной смеси давали нагреться до КТ и перемешивали в течение еще 10 ч. По прошествии этого времени добавляли насыщенного раствора NH4Cl (2 мл) и третВuОМе (100 мл). Нерастворимый материал отфильтровывали и полученный раствор выпаривали под вакуумом. Сырой продукт очищали хроматографией в колонке на силикагеле (с использованием циклогексана/EtOAc 8:2), получая 2-изопропокси-5-нитростирол 2.I в виде бледно-желтого масла (236 мг, 63%ный выход). ИК (пленка):[см-1] = 3088, 2982, 2967, 1627, 1607, 1583, 1516, 1341, 1271, 1107, 950, 742 см-1; 1 Н-ЯМР (500 МГц, CDCl3,[част./млн]): 1,41 (d, 6H, J = 6,0 Гц), 4,71 (q, 1 Н, J = 6,0 Гц), 5,40 (dd, 1H,J = 0,5, 11,2 Гц), 5,87 (dd, 1H, J = 0,5, 17,7 Гц), 6,91 (d, 1H, J = 9,l Гц), 7,00 (dd, 1H, J= 11,2, 17,7 Гц), 8,12 В аргоновой атмосфере карбеновый комплекс формулы 5.II, в которой L2 обозначает лиганд NHC формулы 6a.II (153 мг, 0,18 ммоль) и безводный CuCl (18 мг, 0,18 ммоль) загружали в трубку Шленка. Затем добавляли сухого дезоксигенированного CH2Cl2 (10 мл), после чего раствор соединения 2.I (38 мг, 0,18 ммоль) в CH2Cl2 (4 мл). Образовавшуюся суспензию перемешивали при 30 С в течение 1 ч, затем ее концентрировали под вакуумом и очищали хроматографией в колонке с силикагелем (циклогексан/ЕtOАс 5:2). После удаления растворителя и промывки небольшим количеством сухого н-пентана комплекс 1.II, у которого мез обозначает мезитильную группу, получали в виде зеленого микрокристаллического твердого вещества (100 мг, 83%-ный выход). Rf: 0,30 (гексан/ЕtOАс 8:2); 1 В аргоновой атмосфере карбеновый комплекс формулы 5.III (164,6 мг, 0,20 ммоль) загружали в трубку Шленка. Затем добавляли сухого дезоксигенированного CH2Cl2 (15 мл), после чего раствора соединения 2.I (50 мг, 0,24 ммоль) в CH2Cl2 (5 мл). Образовавшуюся суспензию перемешивали при 40 С в течение 1 ч, а затем ее концентрировали под вакуумом и очищали хроматографией в колонке с силикагелем (циклогексан/EtOAc 5:2). После удаления растворителей и промывки небольшим количеством сухого н-пентана комплекс 1.III получали в виде коричневого микрокристаллического твердого вещества (95 мг, 70%-ный выход). 1 После этого добавляли трет-амилата калия, СН 3 СН 2 С(СН 3)2 О-K+ (0,22 мл, 0,372 ммоль, 1,7 М раствор в толуоле) и полученный бледно-желтый мутный раствор перемешивали при КТ в течение 30 мин. Затем добавляли твердого рутениевого комплекса формулы 5.III (255 мг, 0,310 ммоль) и образовавшуюся суспензию кипятили с обратным холодильником в течение 30 мин. В полученную коричневорозовую суспензию при КТ добавляли раствор соединения 2.1 (83,5 мг, 0,403 ммоль) в CH2Cl2 (7 мл) и твердый CuCl (33,8 мг, 0,341 ммоль). Полученную смесь выдерживали при 40 С в течение 1 ч. Образовавшуюся смесь концентрировали под вакуумом и очищали хроматографией в колонке с силикагелем (циклогексан/ЕtOАс 5:2). После удаления растворителя и промывки небольшим количеством сухого н-пентана комплекс 1.II получали в виде зеленого микрокристаллического твердого вещества (149 мг, 72%-ный выход). Аналитические данные хорошо согласовывались с теми, которые получали ранее (см. пример 2). Пример 5. Получение комплекса 1.V аналогично примеру 2 приводило к образованию зеленого микрокристаллического твердого вещества (40%-ный выход). ИК (KВr):[см-1] = 2924 (s), 2853 (s), 1608 (m), 1523 (m), 1483 (s), 1343 (s), 1267, 1010 (w), 905 (s),826 (m), 745 (m).MC (LSIMS) m/z 644 (M+H+). Процессы с использованием соединения общей формулы 1 в качестве катализатора для реакции метатезиса соответственно в синтезах соединений, содержащих двойную связь С=С и/или другие функциональные группы, протекают с неожиданно большим успехом. Следовательно, описанные ниже новые(пред)катализаторы формулы 1 превосходят, по-видимому, другие сопоставимые с ними известные высокоактивные рутениевые катализаторы, в особенности в том, что касается их активности. Вследствие этого для улучшенного выхода продукта в сравнении с достигаемым с помощью зарекомендовавших себя обычно используемых комплексов требуются уменьшенные количества катализатора, более низкие реакционные температуры и уменьшенная продолжительность реакции. Это превосходство катализаторов формулы 1 демонстрируют следующие примеры с 6 по 10. Пример 6. Метатезисные реакции замыкания цикла, катализируемые соединениями формулы 1.II (см. пример 2) В раствор диена S1 (210 мг, 0,75 ммоль) в СН 2 Сl2 (35 мл) при 0 С добавляли раствор катализатора 1.II (5 мг, 1 мол.%) в CH2Cl2 (2 мл). После перемешивания при 0 С в течение дополнительного часа под вакуумом удаляли растворитель и остаток очищали с использованием хроматографии в колонке с силикагелем (циклогексан/ЕtOАс 8:2), получая соединение Р 1 (186 мг, 99%-ный выход) в виде бесцветного твердого вещества. ИК (KBr):[см-1] = 3030, 2942, 2899, 2855, 1657, 1596, 1450, 1332, 1286, 1162, 910, 816, 712; 1(d, 2H, J = 8,2 Гц), 7,64 (d, 2H, J = 8,2 Гц); 13 С-ЯМР (50 МГц, CDCl3,[част./млн]): 21,5, 29,9, 48,2, 126,9, 129,5, 130,1, 136,2, 142,9; МС (El): m/z 251 (5, [М]+) 223 (2), 184 (6), 155 (4), 105 (2), 91 (19), 96 (16), 77 (1), 65 (13), 42 (100); МСВР (El) m/z рассч. для [М]+ (C13H17 О 2NS): 251,0980; обнаруж.: 2251,0979. Пример 7. Реакции перекрестного метатезиса, катализируемые соединениями формулы 1.II (см. пример 2) В перемешиваемый раствор индола S2 (77,8 мг, 0,36 моль) и метилакрилата S2b (92,9 мг, 1,1 ммоль) в сухом CH2Cl2 (15 мл) добавляли раствор катализатора 1.II (12,1 мг, 5 мол.%) в CH2Cl2 (5 мл). Образовавшуюся смесь перемешивали при КТ в течение 2 ч. Под вакуумом удаляли растворитель и остаток очищали с использованием хроматографии в колонке с силикагелем (циклогексан/ЕtOАс 8:2), получая соединение (Е)-P2 (186 мг, 99%-ный выход) в виде желтого кристаллического твердого вещества. ИК (KBr):[см-1] = 3364, 2953, 2904, 1707, 1655, 1504, 1324, 1215, 750 см-1; 1 Н-ЯМР (500 МГц, CDCl3,[част./млн]): 2,42 (s, 3 Н), 3,61 (dd, 2H, J = 1,7, 6,0 Гц), 3,70 (s, 3 Н), 5,74(18), 143 (31), 127 (12), 115 (12), 84 (17); МСВР (El): m/z рассч. для [М]+. (C14H14O4N2): 247,0954; обнаруж.: 274,0959. Элементный анализ, рассч. (C14H14O4N2): С, 61,31, Н, 5,14; N, 10,21; обнаруж.: С, 61,05, Н, 5,22; N,10,09. Пример 8. Изучение скорости циклизации обрабатываемого вещества S3 (2-аллил-2-(2-метилаллил) диэтилмалонат), когда используют катализатор 1.II. В трубку Шленка при температуре 25 С загружали раствор диена S3 (100 мг, 0,4 ммоль) в CH2Cl2(20 мл) и добавляли раствор катализатора 1.II (2,6 мг, 0,004 ммоль, 1 мол.%) в CH2Cl2 (1 мл). Приготовленную смесь перемешивали в течение еще 18 ч при той же температуре. Степень превращения рассчитывали по данным ГХ (реакцию в аликвотах реакционной смеси сразу же гасили добавлением расчетного количества 1 М раствора этилвинилового эфира и анализировали с помощью ГХ). Полученные результаты представлены на чертеже в виде кривой 10 . Изучение скорости циклизации обрабатываемого вещества S3 (2-аллил-2-(2-метилаллил) диэтилмалонат) повторяли с использованием катализатора А. Эксперимент проводили в условиях, идентичных приведенным выше, за исключением того, что количество катализатора А увеличивали до 2,5 мол.%. Полученные результаты представлены на чертеже в виде кривой 2 . Пример 9. Сравнение эффективности катализаторов 1.II и С в реакции перекрестного метатезиса. Условие а) катализатор 1.II (1 мол.%), КТ, 30 мин, выход: 95%; б) катализатор С (2,5 мол.%), КТ, 20 мин, выход: 91%. В перемешиваемый раствор олефина S4 (107 мг, 0,5 ммоль) и метилакрилата S2b (86 мг, 1 ммоль) вCH2Cl2 (10 мл) добавляли раствор катализатора 1.II (3,4 мг, 1 мол.%) в CH2Cl2 (2 мл). Далее образовавшуюся смесь перемешивали при комнатной температуре в течение 30 мин. Под пониженным давлением удаляли растворитель и остаток очищали с использованием хроматографии в колонке с силикагелем(130 мг, 95%-ный выход) в виде бесцветного масла. В соответствии с данными в Angew.Chemie 2002, 114, 2509-2511, при проведении аналогичной реакции катализатор формулы С обеспечивает получение продукта Р 4 с выходом 91%. Пример 10. Сопоставление эффективности катализаторов 1.II и А в реакции перекрестного метатезиса. Условие а) катализатор 1.II (5 мол.%), КТ, 30 мин, выход: 87%; б) катализатор А (8 мол.%), КТ, 6 ч, выход: 79%. В перемешиваемый раствор диэтилаллилмалоната S5 (100 мг, 0,5 ммоль) и S5a (53 мг, 1 ммоль) вCH2Cl2 (5 мл) добавляли раствор катализатора 1.II (16,8 мг, 5 мол.%) в CH2Cl2 (5 мл). Образовавшийся раствор перемешивали при комнатной температуре в течение 30 мин. Под пониженным давлением удаляли растворитель и остаток очищали с использованием хроматографии в колонке с силикагелем (циклогексан/EtOAc 8:2). Продукт Р 5 получали в форме смеси (Е)- и (Z)-изомеров в соотношении 1:2 (98 мг,87%-ный выход) в виде бесцветного масла. В соответствии с Synlett 2001, 430-431, при проведении аналогичной реакции катализатор А обеспечивает получение продукта Р 5 с выходом 79%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1L1 обозначает P(R11)3, где R11 обозначает -С 3-С 8 циклоалкил, или лиганд формулы 6 а в которой R7 и R8 обозначают фенил, необязательно замещенный посредством до трех групп, независимо выбранных из -С 1-С 6 алкила; в которой L1, X, X', R1, R2, R3 и n имеют значения, указанные в п.1. 3. Соединение по п.1 или 2, в котором L1 обозначает РСу 3 или лиганд формулы 6 а; Су обозначает циклогексил; X и X' каждый обозначает атом хлора. 4. Соединение по одному из пп.1-3, в котором L1 обозначает лиганд формулы 6 а, а R7 и R8 обозначают 2-метилфенил, 2,6-диметилфенил или 2,4,6-триметилфенил. 5. Соединение по одному из пп.1-4, в котором R1 обозначает изо-Рr; R2 обозначает Н. 6. Соединение формулы 2 где R1, R2, R3, R4, m и n имеют значения, указанные в п.6. 8. Соединение по п.6 или 7, в котором R1 обозначает изопропил. 9. Способ получения комплексов по одному из пп.1-5, в котором проводят реакцию соединения формулы 2 или 2 а по пп.6-8 с рутениевым комплексом общей формулы 5R6 обозначает фенил. 10. Способ по п.9, который осуществляют в присутствии соли меди. 11. Способ получения промежуточных продуктов формулы 2 или 2 а по одному из пп.6-8, который включает стадии: а) алкилирования соединения формулы 3 реагентом формулы R1Z (9) с получением промежуточного продукта формулы 4 и б) реакции промежуточного продукта формулы 4 с агентом олефинирования формулы с получением соединения общей формулы 2W обозначает уходящую группу, приемлемую для реакций олефинирования; аZ обозначает атом галогена. 12. Способ проведения реакции метатезиса, включающий контактирование двух соединений, содержащих двойную связь С=С, или одного соединения, содержащего по меньшей мере две двойные связи С=С, с катализатором, где этот катализатор включает рутениевый комплекс по пп.1-5. 13. Способ проведения реакции замыкания цикла или перекрестного метатезиса, включающий контактирование диалкенильного соединения с рутениевым комплексом по пп.1-5.
МПК / Метки
МПК: C07F 15/00
Метки: пред)катализаторов, рутениевые, комплексы, качестве, реакций, метатезиса
Код ссылки
<a href="https://eas.patents.su/14-8352-rutenievye-kompleksy-v-kachestve-predkatalizatorov-dlya-reakcijj-metatezisa.html" rel="bookmark" title="База патентов Евразийского Союза">Рутениевые комплексы в качестве (пред)катализаторов для реакций метатезиса</a>
Предыдущий патент: Ингибиторы газовых гидратов
Следующий патент: Рекомбинантные антитела и фрагменты, узнающие n-гликолил gm3 ганглиозид и их применение в диагностике и лечении злокачественных опухолей
Случайный патент: Система и способ приготовления крахмальной предварительной дисперсии для производства гипсокартонных листов












