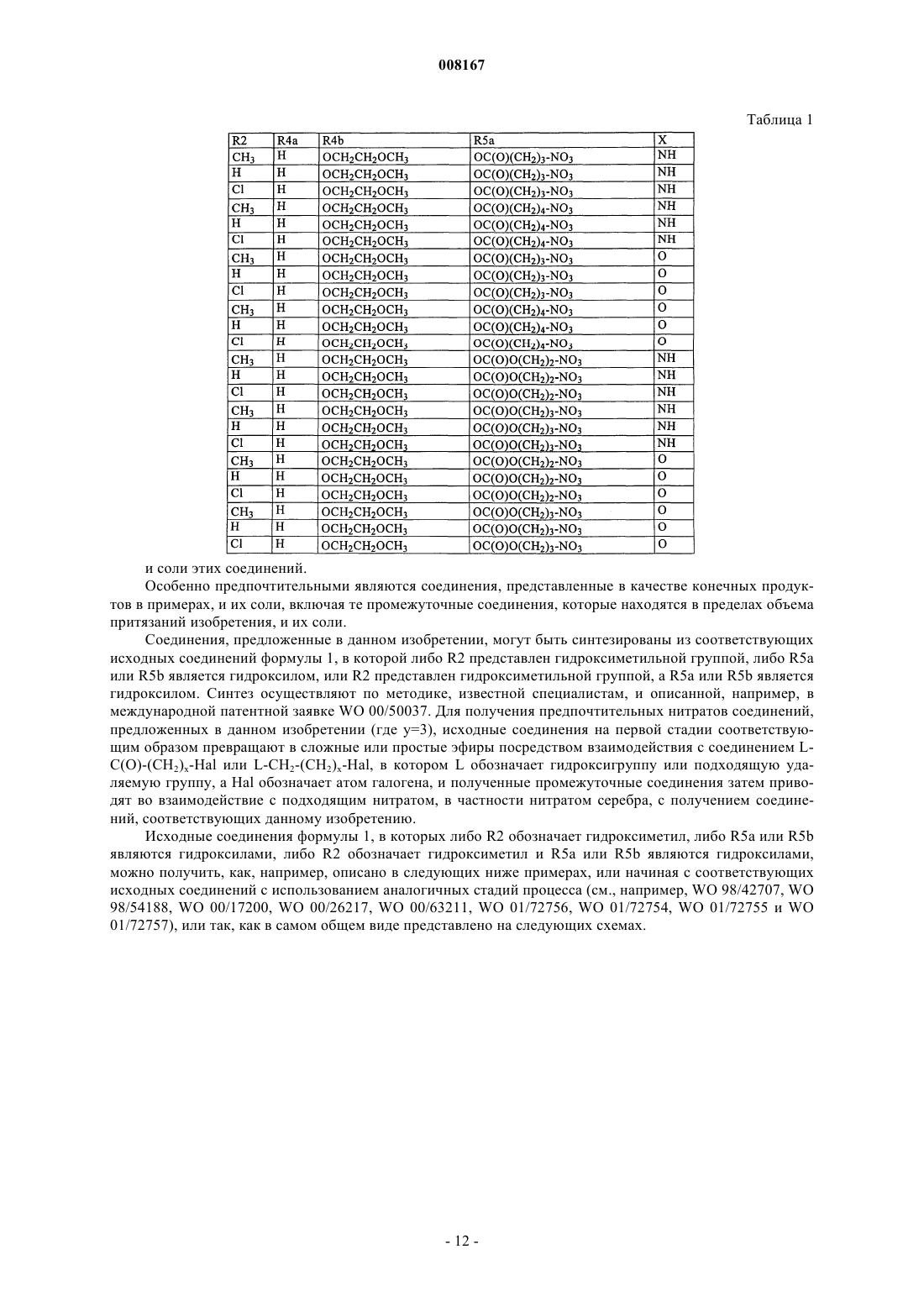
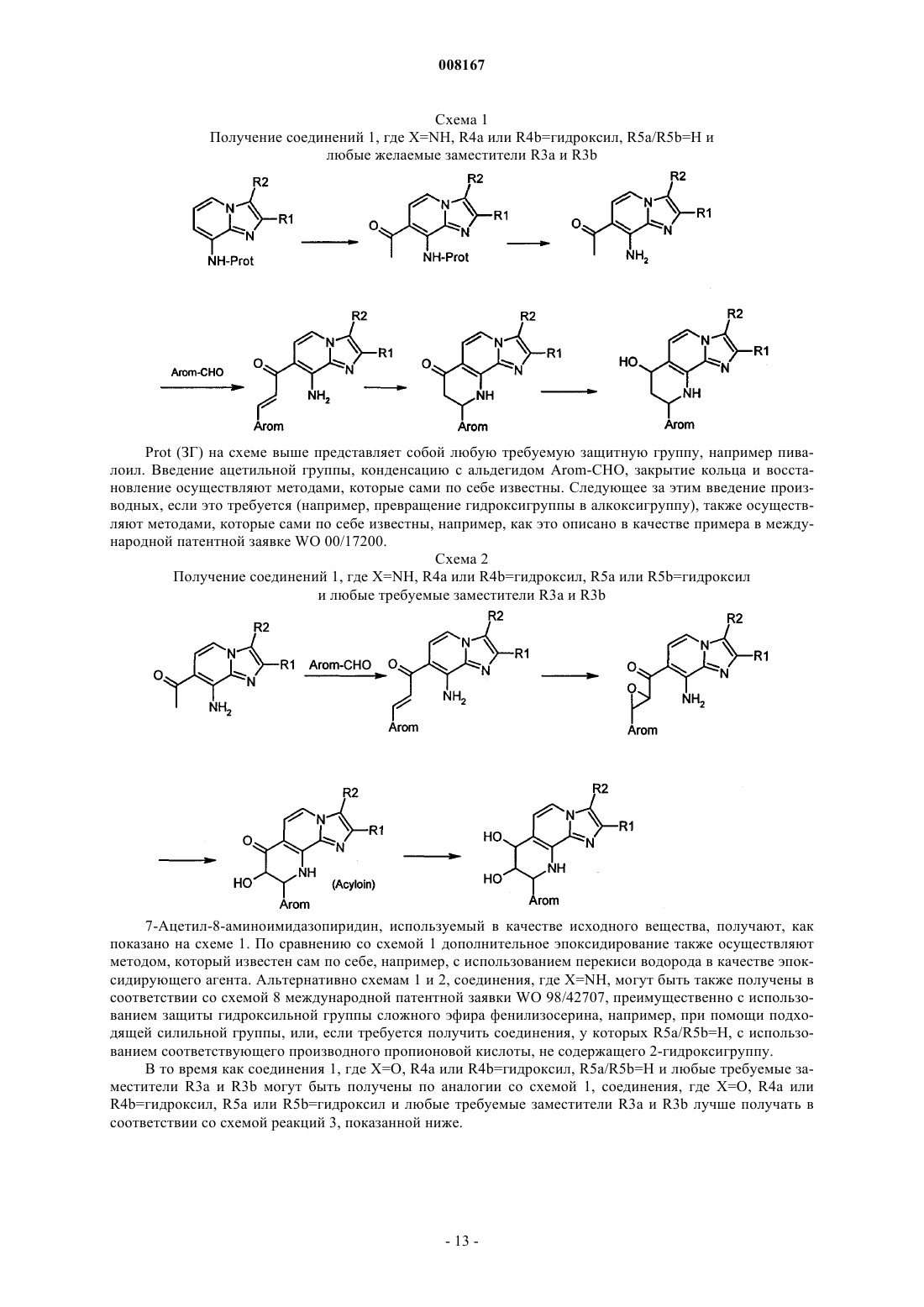
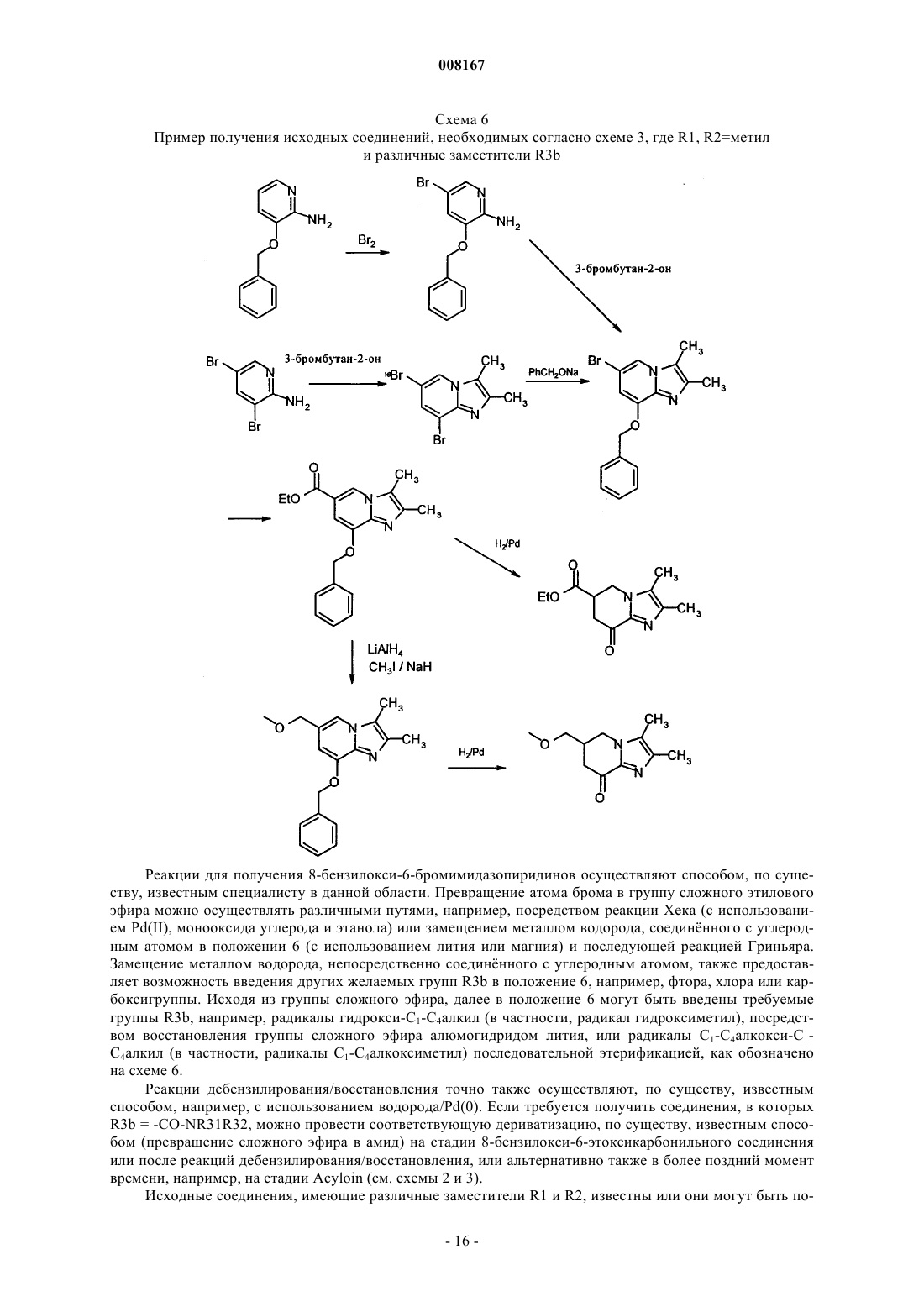
Нитрозированные имидазопиридины
Номер патента: 8167
Опубликовано: 27.04.2007
Авторы: Постиус Штефан, Зенн-Билфингер Йёрг, Циммерманн Петер Ян, Зимон Вольфганг-Александер, Кромер Вольфганг, Ханауэр Гуидо, Бур Вильм
Формула / Реферат
1. Соединения формулы 1*
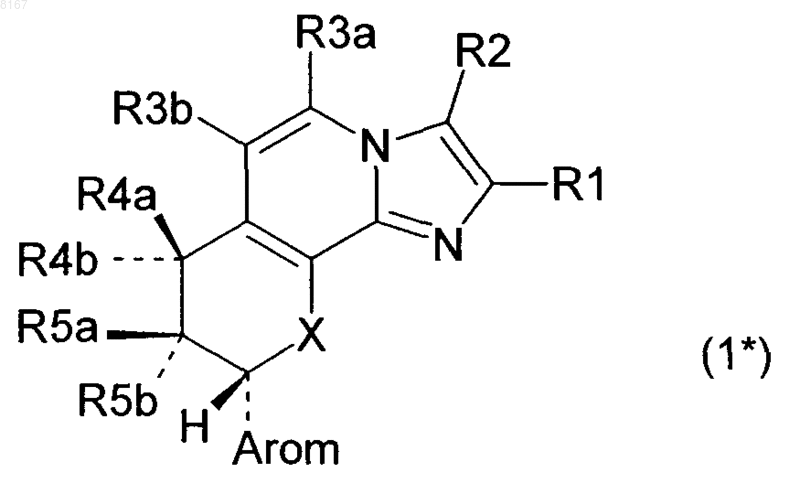
в которой R1 обозначает метил,
R2 обозначает водород, метил или хлор,
R3a обозначает водород,
R3b обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, метокси-, этокси-, гидроксиэтокси-, метоксиэтокси- или метоксиэтоксиэтоксигруппу,
R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-O-(CH2)x-O-NO2, -O-C(O)-C6H4-CH2-O-NO2 или -O-C2H4-(CH2)x-O-NO2,
в котором
х означает целое число от 2 до 4,
R5b обозначает водород,
Arom обозначает фенил, а
X обозначает О (кислород) или NH,
и их соли.
2. Соединения по п.1, в которых R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-O-(CH2)x-O-NO2 или -O-C(O)-C6H4-CH2-O-NO2.
3. Соединения по п.1, в которых
R1 обозначает метил,
R2 обозначает водород, метил или хлор,
R3a обозначает водород,
R3b обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает метоксиэтоксигруппу,
R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2 или -O-C(O)-O-(CH2)x-O-NO2, в котором
х означает целое число от 2 до 4,
R5b обозначает водород,
Arom обозначает фенил и
X обозначает О (кислород) или NH,
и их соли.
4. Соединения по п.1, в которых
R1 обозначает метил,
R2 обозначает метил,
R3a обозначает водород,
R3b обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4алкокси-C1-C4алкоксигруппу,
R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-C6H4-CH2-O-NO2 или -O-C(O)-O-(CH2)x-O-NO2, в котором х означает целое число от 2 до 4,
R5b обозначает водород,
Arom обозначает фенил и
X обозначает О (кислород) или NH,
и их соли.
5. Соединения по п.1, в которых
R1 обозначает метил,
R2 обозначает метил,
R3a обозначает водород,
R3b обозначает водород,
один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4алкокси-C1-C4алкоксигруппу,
R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2 или -O-C(O)-O-(CH2)x-O-NO2, в котором х означает целое число от 2 до 4,
R5b обозначает водород,
Arom обозначает фенил и
X обозначает О (кислород) или NH,
и их соли.
6. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически приемлемую соль вместе с обычными фармацевтическими наполнителями и/или носителями.
7. Применение соединений по п.1 и их фармакологически приемлемых солей для профилактики и лечения желудочно-кишечных заболеваний.
Текст
008167 Область техники Изобретение относится к новым соединениям, которые используются в фармацевтической промышленности в качестве активных соединений для получения лекарственных средств. Предшествующий уровень техники В публикациях международных патентных заявок WO 98/42707 (соответствующий патент US 6197783), WO 98/54188, WO 00/17200, WO 00/26217, WO 00/63211, WO 01/72756, WO 01/72754, WO 01/72755 и WO 01/72757 описаны производные трициклического имидазопиридина с заместителями довольно специфической структуры, которые должны подходить для лечения желудочных и кишечных расстройств. В публикациях международных патентных заявок WO 94/04484, WO 94/12463, WO 00/72838 и WO 01/66088 описаны различные NO-высвобождающие азотные эфиры и их применение в производстве медикаментов и для лечения таких заболеваний, как бактериальные инфекции. В публикациях международных патентных заявок WO 00/50037 и WO 02/00166 приводятся различные нитрозилированные и нитрозилированные ингибиторы протонного возбуждения. В журнале J. Med. Chem., 2001, v. 44, pp. 3463-3468. Marco L. Lolli et al. описывают NO-высвобождающие производные ибупрофена, обладающие противовоспалительными свойствами. Сущность изобретения Изобретение относится к соединениям формулы 1R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NOy или -CH2-O-C2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 6 и у означает целое число от 1 до 3,R3a обозначает водород, галоген, фтор-C1-C4 алкил, C1-C4 алкил, C2-C4 алкенил, C2-C4 алкинил, карбоксил, -СО-C1-C4 алкоксигруппу, гидрокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкил, C1-C4 алкокси-C1C4 алкокси-C1-C4 алкил, фтор-C1-C4 алкокси-C1-C4 алкил или радикал -CO-NR31R32,R3b обозначает водород, галоген, фтор-C1-C4 алкил, C1-C4 алкил, C2-C4 алкенил, C2-C4 алкинил, карбоксил, -СО-C1-C4 алкоксигруппу, гидрокси-C1-C4 алкил, C1-C4 алкокси-C1-C4 алкил, C1-C4 алкокси-C1C4 алкокси-C1-C4 алкил, фтор-C1-C4 алкокси-C1-C4 алкил или радикал -CO-NR31R32, гдеR32 обозначает водород, C1-C7 алкил, гидрокси-C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил,или где R31 и R32 совместно с атомом азота, к которому они оба присоединены, представляют собой радикал пирролидино, пиперидино или морфолино,один из заместителей R4a и R4b обозначает водород, C1-C7 алкил, C2-C7 алкенил, фенил или фен-C1C4 алкил, а другой обозначает гидроксил, C1-C4 алкоксигруппу, C1-C4 алкоксигруппу, замещенную оксогруппой, C3-C7 циклоалкокси-, C3-C7 циклоалкил-C1-C4 алкокси-, гидрокси-C1-C4 алкокси-, C1-C4 алкоксиC1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкокси-, C3-C7 циклоалкокси-C1-C4 алкокси-, C3-C7 циклоалкил-C1-C4 алкокси-C1-C4 алкокси-, C1-C4 алкилкарбонилоксигруппу, полностью или по преимуществу замещенную галогеном C1-C4 алкоксигруппу, радикал R41 или радикал R42, или в котором R4a иR41 обозначает радикал, из которого при физиологических условиях образуется гидроксигруппа, и гдеR42 обозначает -O-(CH2)m-S(O)n-R6, -S(O)n-(CH2)m-OH, -S(O)n-(CH2)m-O-R6, -S(O)n-(CH2)m-S(O)p-R6,-O-Alk1-S(O)n-R6, -S(O)n-R6, -S(O)n- Alk1-OH, -S(O)n- Alk1-O-R6 или -S(O)n- Alk1-S(O)p-R6,в котором R6 обозначает C1-C7 алкил, галоген-C1-C4 алкил, гидрокси-C1-C4 алкил, C1-C4 алкокси-С 1-C4 алкил, карбокси-C1-C4 алкил, C1-C4 алкоксикарбонил-C1-C4 алкил или ди-C1-C4 алкиламино-C1-C4 алкил, Ar или Ar-C1-C4 алкил, где Ar (арил) обозначает фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями, выбранными из группы, включающей C1-C4 алкил, C1C4 алкоксигруппу, C1-C4 алкилкарбонил, C1-C4 алкоксикарбонил, галоген, трифторметил, дифторметокси-,трифторметокси-, амино-, C1-C4 алкоксикарбониламино-, C1-C4 алкокси-C1-C4 алкоксикарбониламино- и-1 008167 нитрогруппу,Alk1 обозначает C2-C7 алкилен или C3-C4 алкенилен, замещенные C1-C4 алкилом, гидроксилом, оксогруппой, карбоксилом, галогеном, аминогруппой, C1-C4 алкоксикарбониламиногруппой или фенилом,m означает целое число от 2 до 7,n означает число 0, 1 или 2 и р означает число 0, 1 или 2,один из заместителей R5a и R5b обозначает водород, C1-C7 алкил, C2-C7 алкенил, фенил или фен-C1C4 алкил, а другой обозначает водород, гидроксил, C1-C4 алкоксигруппу, C1-C4 алкоксигруппу, замещенную оксогруппой, С 3-C7 циклоалкокси-, C3-C7 циклоалкил-C1-C4 алкокси-, гидрокси-C1-C4 алкокси-, C1C4 алкокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкокси-, C3-C7 циклоалкокси-C1-C4 алкокси-,C3-C7 циклоалкил-C1-C4 алкокси-C1-C4 алкокси-, C1-C4 алкилкарбонилоксигруппу, полностью или по преимуществу замещенную галогеном C1-C4 алкоксигруппу, радикалы R51, R52 или R53, либо в которыхR5a и R5b совместно представляют собой О (кислород) или C1-C7 алкилиден, гдеR51 обозначает радикал, из которого при физиологических условиях образуется гидроксигруппа,R52 обозначает -O-(CH2)q-S(O)r-R7, -S(O)r-(CH2)q-OH, -S(O)r-(CH2)q-O-R7, -S(O)r-(CH2)q -S(O)t-R7,-O-Alk2-S(O)r-R7, - S(O)r-R7, - S(O)r -Alk2-OH, -S(O)r-Alk2-O-R7 или -S(O)r-Alk2-S(O)t-R7,в котором R7 обозначает C1-C7 алкил, галоген-C1-C4 алкил, гидрокси-C1-C4 алкил, C1-C4 алкокси-С 1C4 алкил, карбокси-C1-C4 алкил, C1-C4 алкоксикарбонил-C1-C4 алкил или ди-C1-C4 алкиламино-C1-C4 алкил,арил или арил-C1-C4 алкил, где арил обозначает фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями, выбранными из группы, включающей C1-C4 алкил, C1C4 алкоксигруппу, C1-C4 алкилкарбонил, C1-C4 алкоксикарбонил, галоген, трифторметил, дифторметокси-,трифторметоксигруппу, аминогруппу, C1-C4 алкоксикарбониламино-, C1-C4 алкокси-C1-C4 алкоксикарбониламино- и нитрогруппу,Alk2 обозначает C2-C7 алкилен или C3-C4 алкенилен, замещенный C1-C4 алкилом, гидроксилом, оксогруппой, карбоксилом, галогеном, аминогруппой, C1-C4 алкоксикарбониламиногруппой или фенилом,q означает целое число от 2 до 7,r означает число 0, 1 или 2 иt означает число 0, 1 или 2,и где R53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -OC2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 6, а у означает целое число от 1 до 3,или в котором один из заместителей R4a и R4b, с одной стороны, один из заместителей R5a и R5b, с другой стороны, обозначает в каждом случае водород, C1-C7 алкил, C2-C7 алкенил, фенил или фен-C1C4 алкил, а другие заместители в каждом случае образуют совместно C1-C4 алкилендиоксигруппу, которая при необходимости является полностью или частично замещенной галогеном,Arom обозначает моно- или бициклический ароматический радикал, замещенный посредством R8,R9, R10 и R11, который выбран из группы, включающей фенил, нафтил, пирролил, пиразолил, имидазолил, 1,2,3-триазолил, индолил, бензимидазолил, фуранил (фурил), бензофуранил (бензофурил), тиофенилR8 обозначает водород, C1-C4 алкил, гидрокси-C1-C4 алкил, C1-C4 алкокси-, C2-C4 алкенилоксигруппу,C1-C4 алкилкарбонил, карбоксил, C1-C4 алкоксикарбонил, карбокси-C1-C4 алкил, C1-C4 алкоксикарбонил-C1C4 алкил, галоген, гидроксил, арил, арил-C1-C4 алкил, арилоксигруппу, арил-C1-C4 алкоксигруппу, трифторметил, нитро-, амино-, моно- или ди-C1-C4 алкиламино-, C1-C4 алкилкарбониламино-, C1-C4 алкоксикарбониламино-, C1-C4 алкокси-C1-C4 алкоксикарбониламиногруппу или сульфонил,R9 обозначает водород, C1-C4 алкил, C1-C4 алкоксигруппу, C1-C4 алкоксикарбонил, галоген, трифторметил или гидроксил,R10 обозначает водород, C1-C4 алкил или галоген иR11 обозначает водород, C1-C4 алкил или галоген,где арил обозначает фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями, выбранными из группы, включающей C1-C4 алкил, C1-C4 алкоксигруппу, карбоксил,C1-C4 алкоксикарбонил, галоген, трифторметил, нитрогруппу, трифторметоксигруппу, гидроксил и цианогруппу,X обозначает О (кислород) или NH,и их соли,при условии, что либоR2 имеет значение R21 или один из радикалов R5a и R5b принимает значение R53, либоR2 имеет значение R21 и один из радикалов R5a и R5b принимает значение R53.C1-C4 алкил представляет собой алкильные радикалы с прямой или разветвленной цепью, имеющей от 1 до 4 атомов углерода. В качестве примеров можно назвать такие радикалы, как бутил, изобутил,втор-бутил, трет-бутил, пропил, изопропил, этил и метил.C3-C7 циклоалкил представляет собой циклопропил, циклобутил, циклопентил, циклогексил и цик-2 008167 логептил, среди которых циклопропил, циклобутил, циклопентил являются предпочтительными.C3-C7 циклоалкил-C1-C4 алкил представляет собой один из вышеупомянутых C1-C4 алкильных радикалов, замещенных одним из вышеупомянутых C3-C7 циклоалкильных радикалов. В качестве примеров можно назвать такие радикалы, как циклопропилметил, циклогексилметил и циклогексилэтил.C1-C4 алкоксигруппа представляет собой радикалы, которые в дополнение к атому кислорода содержат алкильный радикал с прямой или разветвленной цепью, содержащей от 1 до 4 атомов углерода. В качестве примеров можно назвать такие группы, как бутокси, изобутокси, втор-бутокси, трет-бутокси,пропокси, изопропокси и предпочтительно этокси- и метоксигруппы.C1-C4 алкокси-C1-C4 алкил представляет собой C1-C4 алкильный радикал, замещенный одной из вышеупомянутых C1-C4 алкоксигрупп. В качестве примеров можно назвать такие группы, как метоксиметил, метоксиэтил и бутоксиэтил.C1-C4 алкоксикарбонил (-СО-C1-C4 алкокси) представляет собой карбонильную группу, к которой присоединена одна из вышеупомянутых C1-C4 алкоксигрупп. В качестве примеров можно назвать такие группы, как метоксикарбонил (СH3 О-С(О)-) и этоксикарбонил (СH3CH2O-С(O)-).C2-C4 алкенил представлен прямым или разветвленным алкенильным радикалом, имеющим от 2 до 4 углеродных атомов. В качестве примеров можно назвать такие радикалы, как 2-бутенил, 3-бутенил, 1 пропенил и 2-пропенил (аллильный радикал).C2-C4 алкинил представлен прямым или разветвленным алкенильным радикалом, имеющим от 2 до 4 углеродных атомов. В качестве примеров можно назвать такие радикалы, как 2-бутинил, 3-бутинил и предпочтительно 2-пропинил (пропаргиловый радикал). Фтор-C1-C4 алкил представляет собой один из вышеупомянутых радикалов C1-C4 алкил, которые замещены одним или несколькими атомами фтора. В качестве примеров можно назвать радикал трифторметил. Гидрокси-C1-C4 алкил представляет собой вышеупомянутые радикалы C1-C4 алкил, которые замещены гидроксигруппой. В качестве примеров можно назвать такие радикалы, как гидроксиметил, 2 гидроксиэтил и 3-гидроксипропил. Галоген в пределах значений изобретения представлен бромом, хлором и фтором. Группа -NOy, где у означает число 1, 2 или 3, представляет собой группу, способную высвобождать монооксид азота. Предпочтительная группа в этой связи представлена -NO3 (-O-NO2=нитрат)группой.C1-C4 алкокси-C1-C4 алкоксигруппа представляет собой одну из вышеупомянутых C1-C4 алкоксигрупп, которая замещена дополнительной C1-C4 алкоксигруппой. В качестве примеров можно назвать 2-(метокси)этоксигруппу (CH3-O-CH2-CH2-O-) и 2-(этокси)этоксигруппу (CH3-CH2-O-CH2-CH2-O-).C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкил представляет собой один из вышеупомянутых радикаловC1-C4 алкокси-C1-C4 алкил, который замещен одной из вышеупомянутых C1-C4 алкоксигрупп. В качестве примеров можно назвать 2-(метокси)этоксиметил (CH3-О-CH2-CH2-О-CH2-). Фтор-C1-C4 алкокси-C1-C4 алкил представляет собой один из вышеупомянутых радикалов C1C4 алкил, который замещен фтор-C1-C4 алкоксигруппой. В этом случае фтор-C1-C4 алкоксигруппа представляет собой одну из вышеперечисленных C1-C4 алкоксигрупп, которая полностью или по преимуществу замещена фтором. В качестве примеров полностью или по преимуществу замещенных фтором C1C4 алкоксигрупп можно назвать такие группы, как 1,1,1,3,3,3-гексафтор-2-пропокси-, 2-трифторметил-2 пропокси-, 1,1,1-трифтор-2-пропокси-, перфтор-трет-бутокси-, 2,2,3,3,4,4,4-гептафтор-1-бутокси-, 4,4,4 трифтор-1-бутокси-, 2,2,3,3,3-пентафторпропокси-, перфторэтокси-, 1,2,2-трифторэтокси-, в особенности 1,1,2,2-тетрафторэтокси-, 2,2,2-трифторэтокси-, трифторметокси- и предпочтительно дифторметоксигруппу.C1-C7 алкил представлен алкильным радикалом с прямой или разветвленной цепью, содержащей от 1 до 7 атомов углерода. В качестве примеров можно назвать такие радикалы, как гептил, изогептил (5 метилгексил), гексил, изогексил (4-метилпентил), неогексил (3,3-диметилбутил), пентил, изопентил (3 метилбутил), неопентил (2,2-диметилпропил), бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил, этил и метил.C2-C7 алкенил представлен алкенильным радикалом с прямой или разветвленной цепью, содержащей от 2 до 7 атомов углерода. В качестве примеров можно назвать такие радикалы, как 2-бутенил, 3 бутенил, 1-пропенил, 2-пропенил (аллил) и винил. Предпочтительными являются вышеупомянутые C2C4 алкенильные радикалы. Фен-C1-C4 алкил представляет собой один из вышеупомянутых радикалов C1-C4 алкил, который замещен фенилом. Предпочтительными являются фенэтил и в особенности бензил.C1-C4 алкоксигруппа, замещенная оксогруппой, представляет собой одну из вышеупомянутых C1C4 алкоксигрупп, которая вместо метиленовой группы содержит карбонильную группу. В качестве примера можно назвать 2-оксопропоксигруппу.C3-C7 циклоалкоксигруппа представляет собой циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и циклогептилокси, среди которых циклопропилокси, циклобутилокси и циклопентилокси являются предпочтительными.C3-C7 циклоалкил-C1-C4 алкоксигруппа представляет собой одну из вышеупомянутых C1-C4 алкок-3 008167 сигрупп, замещенную одним из вышеупомянутых C3-C7 циклоалкильных радикалов. В качестве примеров можно назвать такие группы, как циклопропилметокси-, циклобутилметокси- и циклогексилэтоксигруппы. Гидрокси-C1-C4 алкоксигруппа представляет собой вышеупомянутую C1-C4 алкоксигруппу, замещенную гидроксильной группой. В качестве предпочтительного примера можно назвать 2 гидроксиэтоксигруппу.C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппа представляет собой одну из вышеупомянутых C1C4 алкоксигрупп, замещенную одной из вышеупомянутых C1-C4 алкокси-C1-C4 алкоксигрупп. В качестве предпочтительного примера можно назвать метоксиэтоксиэтоксигруппу.C3-C7 циклоалкокси-C1-C4 алкоксигруппа представляет собой одну из вышеупомянутых C1C4 алкоксигрупп, замещенную одной из вышеупомянутых C3-C7 циклоалкоксигрупп. В качестве примеров можно назвать такие группы, как циклопропоксиметокси-, циклобутоксиметокси- и циклогексилоксиэтоксигруппы.C3-C7 циклоалкил-C1-C4 алкокси-C1-C4 алкоксигруппа представляет собой одну из вышеупомянутыхC1-C4 алкоксигрупп, замещенную одной из вышеупомянутых C3-C7 циклоалкил-C1-C4 алкоксигрупп. В качестве примеров можно назвать такие группы, как циклопропилметоксиэтокси, циклобутилметоксиэтокси и циклогексилэтоксиэтоксигруппы.C1-C4 алкилкарбонил представляет собой радикал, который в дополнение к карбонильной группе содержит один из вышеупомянутых C1-C4 алкильных радикалов. В качестве примера можно назвать ацетил.C1-C4 алкилкарбонилоксигруппа представляет собой одну из вышеупомянутыхC1C4 алкилкарбонильных групп, присоединенных к атому кислорода. В качестве примера можно назвать ацетоксигруппу (CH3 СО-О-). Полностью или по преимуществу замещенными галогеном C1-C4 алкоксигруппами прежде всего являются хлор- и/или особенно фторзамещенные C1-C4 алкоксигруппы. В качестве примеров C1C4 алкоксигрупп, замещенных галогеном, можно назвать такие группы, как 2,2,2-трихлорэтокси-, гексахлоризопропокси-, пентахлоризопропокси-, 1,1,1-трихлор-3,3,3-трифтор-2-пропокси-, 1,1,1-трихлор-2 метил-2-пропокси-, 1,1,1-трихлор-2-пропокси-, 3-бром-1,1,1-трифтор-2-пропокси-, 3-бром-1,1,1-трифтор 2-бутокси-, 4-бром-3,3,4,4-тетрафтор-1-бутокси-, хлордифторметокси-, 1,1,1,3,3,3-гексафтор-2-пропокси-,2-трифторметил-2-пропокси-, 1,1,1-трифтор-2-пропокси-, перфтор-трет-бутокси-, 2,2,3,3,4,4,4-гептафтор 1-бутокси-, 4,4,4-трифтор-1-бутокси-, 2,2,3,3,3-пентафторпропокси-, перфторэтокси-, 1,2,2-трифторэтокси-, в особенности 1,1,2,2-тетрафторэтокси-, 2,2,2-трифторэтокси-, трифторметокси- и предпочтительно дифторметоксигруппу.C1-C7 алкилиден представляет собой один из вышеупомянутых C1-C7 алкильных радикалов, но присоединенных посредством двойной связи. В качестве примеров можно назвать изопропилиденCH3)2 С=) и в особенности метилен (Н 2 С=). Под радикалом R41 или R51, из которого при физиологических условиях образуется гидроксигруппа, подразумевается значение радикала -OR', из которого группа R' удаляется гидролитически в организме человека или животного с образованием радикалов -ОН и нетоксичного соединения R'OH. Таким образом, радикал R' может быть также обозначен как защитная группа гидроксила или как пролекарственный радикал. Подобные защитные группы гидроксила или пролекарственные радикалы известны,среди прочего, из патентных заявок и патентов DE 4308095, WO 95/14016, ЕР 694547, WO 95/11884, WO 94/05282 и US 5432183. В качестве примеров можно упомянуть радикалы R' общей структуры -C(O)R,-C(O)NRaRb, -P(O)ORaORb или -S(O)2OR, где R, Ra и Rb представляют собой любой желаемый органический радикал или необязательно водород. В одном варианте воплощения изобретения R41 и R51 имеют общую защитную группу для гидроксила R', которая в таком случае может иметь, например, одну из следующих структур: -CRaRb-, -CRa(ORb)-, -C(ORa)(ORb)- или -P(O)OR-. В качестве примеров групп, упоминаемых в контексте предложенного изобретения как радикалы R',следует назвать следующие группы:Alk обозначает C1-C7 алкилен,R12 обозначает водород, C1-C7 алкил или C1-C4 алкил, замещенный галогеном, карбоксил, гидроксил, сульфо(-SO3 Н), сульфамоил (-SO2NH2), карбамоил (-CONH2), C1-C4 алкоксигруппа или C1C4 алкоксикарбонил,R13 обозначает водород или C1-C4 алкил,R14 обозначает водород, галоген, нитрогруппу, C1-C4 алкил, C1-C4 алкоксигруппу, C1-C4 алкоксикарбонил, C1-C4 алкоксикарбониламиногруппу, C1-C4 алкокси-C1-C4 алкоксикарбониламиногруппу или трифторметил иC1-C7 алкилен представляет собой радикалы C1-C7 алкилена с прямой или разветвленной цепью, например, радикалы метилен (-CH2-), этилен (-CH2CH2-), триметилен (-CH2CH2CH2-), тетраметиленCH2CH2CH2-). В этой связи, особо следует выделить в качестве примера следующие группы как радикалы R':CH2CH2SO3H, -P(O)(OH)2, -S(O)2NH2, -C(O)-H, -C(O)-C(CH3)3, -C(O)-CH2CH2COOH, -C(O)-CH3, -C(O)C2H5, -C(O)-C6H5, -C(O)-C6H4-4-NO2, -C(O)-C6H4-3-NO2, -C(O)-C6H4-4-OCH3, -C(O)-C6H4-4-C(O)-OCH3,-C(O)-OCH3, -С(O)-O-ментил, -С(O)-CH2-С(O)-ОCH3, -С(O)-CH2CH2-С(O)-ОCH3, -С(O)-С(O)-ОCH3,-С(O)-С(O)-OC2 Н 5 и -CH2 ОСН(CH3)2 или (при условии, что R41 и R51 содержат обычные защитные группы гидроксила) группы -С(CH3)2-, -Р(O)(ОН)- и -СН[С(CH3)3]-. В отношении заместителей R42 и R52 в качестве примеров радикалов R6 и R7 можно назвать следующие группы: метил, этил, пропил, изопропил, бутил, изобутил, пентил, дифторметил, 2,2,2 трифторэтил, 2-гидроксиэтил, 3-гидроксипропил, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил,карбоксиметил, карбоксиэтил, карбоксипропил, метоксикарбонилметил, диметиламиноэтил, диэтиламиноэтил, фенил, бензил, 4-хлорфенил, 4-аминофенил, 4-хлорбензил, 4-дифторметоксифенил, 4-трифторметоксифенил, 4-метилбензил, 3-метилбензил, 2,4-диаминофенил, 2-метил-4-трет-бутилфенил, 2-нитро 4-ацетилфенил, 4-фторбензил, 4-нитрофенил, 3-нитрофенил, 3-аминофенил, 2-метоксикарбониламино-6 метилфенил, 2-метоксиэтоксикарбониламино-6-метилфенил, 2-метокси-карбониламино-6-метилбензил и 2-метоксиэтоксикарбониламино-6-метилбензил. В качестве примеров групп алкилена и алкенилена Alk1 и Аlk2 в заместителях R42 и R52 можно назвать следующие группы: 1-метилэтилен, 2-метилэтилен, 1-фенилэтилен, 2-фенилэтилен, 1-пропилпропилен, 3-пропилпропилен, 2-аминопропилен, 2-трет-бутилоксикарбониламинопропилен, 2-гидроксипропилен, 2-оксопропилен, 2-карбоксипропилен 1-ацетил-1,2-диметилэтилен, 2-ацетил-1,2-диметилэтилен, 1,1-диметил-2-оксоэтилен, 1-оксо-2,2-диметилэтилен, 1,3-диоксобутилен, 2,4-диоксобутилен,1,2-диоксопропилен, 2,3-диоксопропилен, проп-1-енилен, проп-2-енилен, бут-1-енилен, бут-2-енилен,бут-3-енилен, бут-4-енилен, бута-1,3-диенилен, бута-2,4-диенилен, 1-оксобут-2-енилен, 4-оксобут-2 енилен, 1-оксо-2,2-дифторэтилен, 2-оксо-1,1-дифторэтилен, 1-оксопропилен, 3-оксопропилен, 1 карбоксиэтилен и 2-карбоксиэтилен. Галоген-C1-C4 алкил представляет собой один из вышеупомянутых C1-C4 алкильных радикалов, замещенный атомами одного из вышеупомянутых галогенов. В качестве примера можно назвать 3 хлорпропильный радикал. Карбокси-C1-C4 алкил представлен, например, карбоксиметильным (-CH2 СООН) или карбоксиэтильным радикалом (-CH2CH2 СООН).C1-C4 алкоксикарбонил-C1-C4 алкил представляет собой один из вышеупомянутых C1-C4 алкильных радикалов, замещенный одним из вышеупомянутых C1-C4 алкоксикарбонильных радикалов. В качестве примера можно назвать этоксикарбонилметильный радикал (CH3CH2OС(O)CH2-). Ди-C1-C4 алкиламиногруппа представлена аминогруппой, замещенной двумя одинаковыми или различными радикалами из вышеупомянутых C1-C4 алкильных радикалов. В качестве примеров можно назвать диметиламино-, диэтиламино- и диизопропиламиногруппу. Ди-C1-C4 алкиламино-C1-C4 алкил представляет собой один из вышеупомянутых C1-C4 алкильных радикалов, замещенный одной из вышеупомянутых ди-C1-C4 алкиламиногрупп. В качестве примеров можно назвать диметиламинометил, диметиламиноэтил и диэтиламиноэтил.Ar-C1-C4 алкил представляет собой один из вышеупомянутых, C1-C4 алкильных радикалов, замещенных посредством Ar, где Ar имеет вышеупомянутые значения. В качестве примеров можно назвать фенэтил и бензил.C1-C4 алкилкарбонил представлен радикалом, который кроме карбонильной группы содержит один из вышеупомянутых C1-C4 алкильных радикалов. В качестве примера можно привести ацетил.C1-C4 алкоксикарбониламиногруппа представлена аминогруппой, замещенной одним из вышеупомянутых C1-C4 алкоксикарбонильных радикалов. В качестве примеров можно назвать этоксикарбонила-5 008167 мино- и метоксикарбониламиногруппу.C1-C4 алкокси-C1-C4 алкоксикарбонил представлен карбонильной группой, к которой присоединена одна из вышеупомянутых C1-C4 алкокси-C1-C4 алкоксигрупп. В качестве примеров можно назвать 2(метокси)этоксикарбонил (CH3-O-CH2CH2-O-СО-) и 2-(этокси)этоксикарбонил (CH3CH2-О-CH2CH2-ОСО-).C1-C4 алкокси-C1-C4 алкоксикарбониламиногруппа представляет собой аминогруппу, замещенную одним из вышеупомянутых C1-C4 алкокси-C1-C4 алкоксикарбонильных радикалов. В качестве примеров можно назвать 2-(метокси)этоксикарбониламино- и 2-(этокси)этоксикарбониламиногруппу.C2-C7 алкилен представляет собой C2-C7 алкиленовый радикал с прямой или разветвленной цепью,например этилен (-CH2-CH2-), триметилен (-CH2-CH2-CH2-), тетраметилен (-CH2-CH2-CH2-CH2-), 1,2 диметилэтилен [-СН(CH3)-СН(CH3)-], 1,1-диметилэтилен [-С(CH3)2-CH2-], 2,2-диметилэтилен [-CH2 С(CH3)2-], изопропилиден [-С(CH3)2-], 1-метилэтилен [-СН(CH3)-CH2-], пентаметилен (-CH2-CH2-CH2CH2-CH2-), гексаметилен (-CH2-CH2-CH2-CH2-CH2-CH2-) и гептаметилен (-CH2-CH2-CH2-CH2-CH2-CH2CH2-).C1-C4 алкилендиокигруппа представлена группой, которая при необходимости полностью или частично замещена галогеном. В качестве примеров незамещенных групп могут быть названы метилендиокси- (-О-CH2-O-), этилендиокси- (-О-CH2-CH2-О-) или пропилендиоксигруппа (-О-CH2-CH2 -CH2-О-), а в качестве групп, замещенных галогеном, в частности, фторзамещенная C1-C2-алкилендиоксигруппа, например дифторэтилендиокси- (-O-CF2-CH2-O-), тетрафторэтилендиокси- (-O-CF2-CF2-O-) и, в особенности, дифторметилендиокси- (-O-CF2-O-) и 1,1,2-трифторэтилендиокси- (-O-CF2CHF-O-), а также хлортрифторэтилендиоксигруппа.C2-C4-алкенилоксигруппа представлена радикалом, который кроме атома кислорода содержит C2C4 алкенильный радикал. В качестве примера можно привести аллилоксигруппу. Арил-C1-C4 алкил представлен C1-C4 алкильным радикалом, замещенным арилом. В качестве примера можно привести бензил. Арил-C1-C4 алкоксигруппа представлена C1-C4 алкоксигруппой, замещенной арилом. В качестве примера можно привести бензилоксигруппу. Моно- или ди-C1-C4 алкиламиногруппы содержат кроме атома азота один или два вышеупомянутыхC1-C4 алкилкарбониламиногруппа представлена аминогруппой, к которой присоединен C1C4 алкилкарбонильный радикал. В качестве примеров можно назвать пропиониламиногруппу(C3 Н 7 С(O)NH) и ацетиламиногруппу (ацетамидный радикал) (CH3 С(О)NH-). Ароматические группы (Arom), которые можно назвать, представлены, например, следующими заместителями: 4-ацетоксифенил, 4-ацетамидофенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил,3-бензилоксифенил, 4-бензилоксифенил, 3-бензилокси-4-метоксифенил, 4-бензилокси-3-метоксифенил,3,5-бис(трифторметил)фенил, 4-бутоксифенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-хлор-6 фторфенил, 3-хлор-4-фторфенил, 2-хлор-5-нитрофенил, 4-хлор-3-нитрофенил, 3-(4-хлорфенокси)фенил,2,4-дихлорфенил, 3,4-дифторфенил, 2,4-дигидроксифенил, 2,6-диметоксифенил, 3,4-диметокси-5 гидроксифенил, 2,5-диметилфенил, 3-этокси-4-гидроксифенил, 2-фторфенил, 4-фторфенил, 4 гидроксифенил, 2-гидрокси-5-нитрофенил, 3-метокси-2-нитрофенил, 3-нитрофенил, 2,3,5-трихлорфенил,2,4,6-тригидроксифенил, 2,3,4-триметоксифенил, 2-гидрокси-1-нафтил, 2-метокси-1-нафтил, 4-метокси 1-нафтил, 1-метил-2-пирролил, 2-пирролил, 3-метил-2-пирролил, 3,4-диметил-2-пирролил, 4-(2 метоксикарбонилэтил)-3-метил-2-пирролил, 5-этоксикарбонил-2,4-диметил-3-пирролил, 3,4-дибром-5 метил-2-пирролил, 2,5-диметил-1-фенил-3-пирролил, 5-карбокси-3-этил-4-метил-2-пирролил, 3,5 диметил-2-пирролил,2,5-диметил-1-(4-трифторметилфенил)-3-пирролил,1-(2,6-дихлор-4-трифторметилфенил)-2-пирролил, 1-(2-нитробензил)-2-пирролил, 1-(2-фторфенил)-2-пирролил, 1-(4-трифторметоксифенил)-2-пирролил, 1-(2-нитробензил)-2-пирролил, 1-(4-этоксикарбонил)-2,5-диметил-3-пирролил, 5-хлор-1,3-диметил-4-пиразолил, 5-хлор-1-метил-3-трифторметил-4-пиразолил, 1-(4-хлорбензил)5-пиразолил, 1,3-диметил-5-(4-хлорфенокси)-4-пиразолил, 1-метил-3-трифторметил-5-(3-трифторметилфенокси)-4-пиразолил, 4-метоксикарбонил-1-(2,6-дихлорфенил)-5-пиразолил, 5-аллилокси-1-метил-3 трифторметил-4-пиразолил,5-хлор-1-фенил-3-трифторметил-4-пиразолил,3,5-диметил-1-фенил-4 имидазолил, 4-бром-1-метил-5-имидазолил, 2-бутилимидазолил, 1-фенил-1,2,3-триазол-4-ил, 3-индолил,4-индолил, 7-индолил, 5-метокси-3-индолил, 5-бензилокси-3-индолил, 1-бензил-3-индолил, 2-(4 хлорфенил)-3-индолил, 7-бензилокси-3-индолил, 6-бензилокси-3-индолил, 2-метил-5-нитро-3-индолил,4,5,6,7-тетрафтор-3-индолил, 1-(3,5-дифторбензил)-3-индолил, 1-метил-2-(4-трифторфенокси)-3-индолил,1-метил-2-бензимидазолил, 5-нитро-2-фурил, 5-гидроксиметил-2-фурил, 2-фурил, 3-фурил, 5-(2-нитро-4 трифторметилфенил)-2-фурил, 4-этоксикарбонил-5-метил-2-фурил, 5-(2-трифторметоксифенил)-2-фурил,5-(4-метокси-2-нитрофенил)-2-фурил, 4-бром-2-фурил, 5-диметиламино-2-фурил, 5-бром-2-фурил, 5 сульфо-2-фурил, 2-бензофурил, 2-тиенил, 3-тиенил, 3-метил-2-тиенил, 4-бром-2-тиенил, 5-бром-2-6 008167 тиенил, 5-нитро-2-тиенил, 5-метил-2-тиенил, 5-(4-метоксифенил)-2-тиенил, 4-метил-2-тиенил, 3 фенокси-2-тиенил, 5-карбокси-2-тиенил, 2,5-дихлор-3-тиенил, 3-метокси-2-тиенил, 2-бензотиенил, 3 метил-2-бензотиенил, 2-бром-5-хлор-3-бензотиенил, 2-тиазолил, 2-амино-4-хлор-5-тиазолил, 2,4-дихлор 5-тиазолил, 2-диэтиламино-5-тиазолил, 3-метил-4-нитро-5-изоксазолил, 2-пиридил, 3-пиридил, 4 пиридил, 6-метил-2-пиридил, 3-гидрокси-5-гидроксиметил-2-метил-4-пиридил, 2,6-дихлор-4-пиридил, 34-(4-хлорфенил)-3-пиридил,2-хлор-5 хлор-5-трифторметил-2-пиридил,4,6-диметил-2-пиридил,метоксикарбонил-6-метил-4-фенил-3-пиридил,2-хлор-3-пиридил,6-(3-трифторметилфенокси)-3 пиридил, 2-(4-хлорфенокси)-3-пиридил, 2,4-диметокси-5-пиримидинил, 2-хинолинил, 3-хинолинил, 4 хинолинил, 2-хлор-3-хинолинил, 2-хлор-6-метокси-3-хинолинил, 8-гидроксил-2-хинолинил и 4 изохинолинил. Возможные соли соединений формулы I, в зависимости от замещения, представлены главным образом всеми кислыми солями присоединения. Особого упоминания заслуживают фармакологически приемлемые соли неорганических и органических кислот, традиционно используемые в фармации. Такими подходящими солями являются водорастворимые и водонерастворимые кислые соли присоединения как,например, хлористо-водородная (соляная) кислота, бромисто-водородная кислота, фосфорная кислота,азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4-гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтойная кислота, где кислоты для приготовления солей берутся в эквимолярном или отличном от эквимолярного количественном соотношении, в зависимости от того, моно- или полиосновные кислоты используются, и от того, какие соли желательно получить. Фармакологически непереносимые соли, которые могут быть получены в начальной стадии, например, как продукты способа при получении соединений,соответствующих изобретению, в промышленном масштабе, превращают в фармакологически переносимые соли с помощью методов, известных квалифицированному специалисту в данной области. Специалисту в данной области известно, что соединения, предложенные в настоящем изобретении и их соли, если, например, они выделены в кристаллической форме, могут содержать различные количества растворителей. Следовательно, изобретение включает в себя также все сольваты и, в частности, все гидраты солей соединений формулы I. Соединения формулы I имеют до трех хиральных центров в исходной структуре. Таким образом,изобретение относится ко всем возможным стереоизомерам в любом желаемом соотношении в смеси друг с другом, включая чистые энантиомеры, которые являются предпочтительным предметом изобретения. Один вариант осуществления изобретения (воплощение 1) представлен соединениями формулы 1, в которых R2 обозначает R21, один из заместителей R5a и R5b обозначает водород, C1-C7 алкил, C2C7 алкенил, фенил или фен-C1-C4 алкил, а другой обозначает водород, гидроксил, C1-C4 алкоксигруппу, C1C4 алкоксигруппу, замещенную оксогруппой, C3-C7 циклоалкокси-, C3-C7 циклоалкил-C1-C4 алкокси-, гидрокси-C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкокси-, C3-C7 циклоалкокси-C1-C4 алкокси-, C3-C7 циклоалкил-C1-C4 алкокси-C1-C4 алкокси-, C1-C4 алкилкарбонилоксигруппу,полностью или по преимуществу замещенную галогеном C1-C4 алкоксигруппу, радикал R51 или радикалR52, или в которых R5a и R5b совместно представлены О (кислородом) или C1-C7-алкилиденом,и в которых R1, R3a, R3b, R4a, R4b, Arom и X имеют значения, указанные в начале, а также их соли. Другой вариант осуществления изобретения (воплощение 2) представлен соединениями формулы 1,в которых R2 обозначает водород, C1-C4 алкил, арил, C3-C7 циклоалкил, C3-C7 циклоалкил-C1-C4 алкил, C1C4 алкоксикарбонил, гидрокси-C1-C4 алкил, галоген, C2-C4 алкенил, C2-C4 алкинил, фтор-C1-C4 алкил или цианометил, один из заместителей R5a и R5b обозначает водород, C1-C7-алкил, C2-C7 алкенил, фенил или фен-C1-C4 алкил, а другой обозначает радикал R53,и в которых R1, R3a, R3b, R4a, R4b, Arom и X имеют значения, указанные в начале, а также их соли. Следующий вариант осуществления изобретения (воплощение 2) представлен соединениями формулы 1, в которых R2 обозначает R21, один из заместителей R5a и R5b обозначает водород, C1-C7 алкил,C2-C7 алкенил, фенил или фен-C1-C4 алкил, а другой обозначает радикал R53,и в которых R3b, R4a, R4b, Arom и X имеют значения, указанные в начале, а также их соли. Следует подчеркнуть такие соединения формулы 1, в которыхR1 обозначает водород, C1-C4 алкил, C3-C7 циклоалкил, C1-C4 алкокси-C1-C4 алкил, C2-C4 алкинил или фтор-C1-C4 алкил,R2 обозначает водород, C1-C4 алкил, арил, гидрокси-C1-C4 алкил, галоген, C2-C4 алкенил, C2C4 алкинил, фтор-C1-C4 алкил или R21, где R21 обозначает -CH2-O-С(O)-CH2-(CH2)х-NOy или -CH2-OC2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 6 и у означает целое число от 1 до 3,R3a обозначает водород,R3b обозначает водород, галоген, C1-C4 алкил или радикал -CO-NR31R32, где R31 обозначает водо-7 008167 род, C1-C7 алкил, гидрокси-C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил иR31 и R32 совместно с атомом азота, к которому они оба присоединены, обозначают радикалы пирролидино, пиперидино или морфолино,один из заместителей R4a и R4b обозначает водород или C1-C4 алкил, а другой обозначает гидроксил, C1-C4 алкоксигруппу, C1-C4 алкоксигруппу, замещенную оксогруппой, C3-C7 циклоалкоксигруппу,C3-C7 циклоалкил-C1-C4 алкокси-, гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкоксиC1-C4 алкокси-C1-C4 алкокси-, или в котором R4a и R4b вместе обозначают О (кислород),один из заместителей R5a и R5b обозначает водород или C1-C4 алкил, а другой обозначает водород,гидроксил, C1-C4 алкоксигруппу, C1-C4 алкоксигруппу, замещенную оксогруппой, C3-C7 циклоалкокси-,C3-C7 циклоалкил-C1-C4 алкокси-, гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси-, C1-C4 алкокси-C1C4 алкокси-C1-C4 алкокси-, или радикал R53, или в котором R5a и R5b вместе представлены О (кислородом), гдеR53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -OC2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 6,у означает целое число от 1 до 3,Arom обозначает моно- или бициклический ароматический радикал, замещенный радикалами R8,R9, R10 и R11, выбранными из группы, включающей фенил, фуранил (фурил) и тиофенил (тиенил), гдеR11 обозначает водород,X обозначает О (кислород) или NH, и их соли,при условии, что либо R2 имеет значение R21 или один из заместителей R5a и R5b принимает значение R53 или R2 имеет значение R21 и один из заместителей R5a и R5b принимает значение R53. Следует особо выделить такие соединения формулы 1, в которыхR1 обозначает C2-C4 алкил или C1-C4 алкокси-C1-C4 алкил,R2 обозначает водород, C1-C4 алкил, фенил, гидрокси-C1-C4 алкил, галоген или R21, где R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NOy или -CH2-O-C2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, C1-C4 алкокси-,гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппу, или в котором R4a и R4b совместно представлены О (кислородом),один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил, C1C4 алкоксигруппу, C1-C4 алкокси-C1-C4 алкоксигруппу или радикал R53, гдеR53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -OC2H4-(CH2)x-NOy, в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,Arom обозначает фенил, фуранил (фурил) или тиофенил (тиенил),X обозначает О (кислород) или NH, и их соли,при условии, что либо R2 имеет значение R21 или один из заместителей R5a и R5b принимает значение R53 или R2 имеет значение R21 и один из заместителей R5a и R5b принимает значение R53. Соединения воплощения изобретения 1, которые следует особо подчеркнуть, представлены такими соединениями формулы 1, в которыхR1 обозначает C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил,R2 обозначает R21, где R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NOy или -CH2-O-C2H4-(CH2)x-NOy,в которых х означает целое число от 2 до 4 и у означает целое число от 1 до 3,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, C1-C4 алкокси-,гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппу, или в котором R4a и R4b совместно представлены О (кислородом),-8 008167 один из заместителей R5a и R5b обозначает водород, а другой обозначает водород, гидроксил, C1C4 алкокси- или C1-C4 алкокси-C1-C4 алкоксигруппу,Arom обозначает фенил, фуранил (фурил) или тиофенил (тиенил),X обозначает О (кислород) или NH,и их соли. Соединения воплощения изобретения 2, которые следует особо подчеркнуть, представлены такими соединениями формулы 1, в которыхR1 обозначает C1 C4 алкил или C1-C4 алкокси-C1-C4 алкил,R2 обозначает водород, C1-C4 алкил, фенил, гидрокси-C1-C4 алкил или галоген,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, C1-C4 алкокси-,гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппу, или в котором R4a и R4b совместно представлены О (кислородом),один из заместителей R5a и R5b обозначает водород, а другой представлен радикалом R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -O-C2H4-(CH2)xNOy, в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,Arom обозначает фенил, фуранил (фурил) или тиофенил (тиенил),X обозначает О (кислород) или NH,и их соли. Соединения воплощения изобретения 3, которые следует особо подчеркнуть, представлены такими соединениями формулы 1, в которыхR1 обозначает C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил,R2 обозначает R21, где R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NOy или -CH2-O-C2H4-(CH2)x-NOy,в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, C1-C4 алкокси-,гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппу, или в котором R4a и R4b совместно представлены О (кислородом),один из заместителей R5a и R5b обозначает водород, а другой представлен радикалом R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -O-C2H4-(CH2)xNOy, в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,Arom обозначает фенил, фуранил (фурил) или тиофенил (тиенил),X обозначает О (кислород) или NH,и их соли. Среди соединений, соответствующих изобретению, включая воплощения изобретения 1-3 и соединения, которые следует выделить и особенно подчеркнуть, оптически чистые соединения формулы 1 являются предпочтительными, и в особенности соединения, в которых R5b=водород. Предпочтительные соединения формулы 1 представлены теми, в которыхR1 обозначает C1-C4 алкил или C1-C4 алкокси-C1-C4 алкил,R2 обозначает водород, C1-C4 алкил, фенил, гидрокси-C1-C4 алкил, галоген или R21, где R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NOy или -CH2-O-C2H4-(CH2)x-NOy, в которых х означает целое число от 2 до 4 и у означает целое число от 1 до 3,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, C1-C4 алкокси-,-9 008167 гидрокси-C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкокси- или C1-C4 алкокси-C1-C4 алкокси-C1-C4 алкоксигруппу,R5a обозначает водород, гидроксил, C1-C4 алкокси-, C1-C4 алкокси-C1-C4 алкоксигруппу или радикалR53, где R53 обозначает -O-C(O)-CH2-(CH2)x-NOy, -O-C(O)-O-(CH2)x-NOy, -O-C(O)-C6H4-CH2-NOy или -OC2H4-(CH2)x-NOy, в котором х означает целое число от 2 до 4 и у означает целое число от 1 до 3,R5b обозначает водород,Arom обозначает фенил, фуранил (фурил) или тиофенил (тиенил),X обозначает О (кислород) или NH,и их соли,при условии, что либо R2 имеет значение R21 или R5a принимает значение R53 или R2 имеет значениеR21 и R5a принимает значение R53. Соединения с примерами заместителей, которые следует особо подчеркнуть, представлены такими соединениями формулы 1, в которыхR1 обозначает водород, метил, циклопропил, метоксиметил или трифторметил,R2 обозначает водород, метил, фенил, гидроксиметил, хлор, бром, этинил, трифторметил или R21,где R21 обозначает -CH2-O-C(O)-CH2-(CH2)x-NO3 или -CH2-O-C2H4-(CH2)x-NO3, в котором х обозначает целое число 2 или 3,R3a обозначает водород,R3b обозначает водород, фтор, метил или группу -CO-N(CH3)2,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, метокси-,этокси-, пропокси-, изопропокси-, бутокси-, гидроксиэтокси-, метоксиэтокси-, метоксипропокси-, метоксиэтоксиэтокси-, 2-оксопропокси-, циклопропилокси- или циклопропилметоксигруппу,R5a обозначает водород, гидроксил, метокси-, этокси-, пропокси-, изопропокси-, бутокси-, метоксиэтокси-, метоксипропокси-, метоксиэтоксиэтокси-, 2-оксопропокси-, циклопропилокси-, циклопропилметоксигруппу или радикал R53, гдеR53 обозначает -O-C(O)-CH2-(CH2)x-NO3, -O-C(O)-O-(CH2)x-NO3, -O-С(O)-C6 Н 4-CH2-NO3 или -OC2H4-(CH2)x-NO3, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил, аR21 и R5a принимает значение R53. Предпочтительными являются соединения воплощения изобретения 2. Предпочтительные примеры соединений формулы 1 соответственно являются теми соединениями,в которыхR1 обозначает метил,R2 обозначает водород, метил или хлор,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, метокси-,этокси-, гидроксиэтокси-, метоксиэтокси- или метоксиэтоксиэтоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-NO3, -O-C(O)-O-(CH2)x-NO3,-O-C(O)-C6H4-CH2-NO3 или -O-C2H4-(CH2)x-NO3, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иX обозначает О (кислород) или NH,и их соли. Особенно предпочтительные примеры соединений формулы 1 представлены теми соединениями, в которыхR1 обозначает метил,R2 обозначает водород, метил или хлор,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой - метоксиэтоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-NO3 или -O-C(O)-O-(CH2)xNO3, в котором х означает целое число от 2 до 4,- 10008167X обозначает О (кислород) или NH,и их соли. Предпочтительные соединения формулы 1, соответствующие изобретению, представлены теми соединениями, в которыхR1 обозначает C1-C4 алкил,R2 обозначает C1-C4 алкил,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4 алкокси-C1C4 алкоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-C6H4-CH2-ONO2 или -О-C(O)-O-(CH2)x-O-NO2, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иX обозначает О (кислород) или NH,и их соли. Особенно предпочтительные соединения формулы 1, соответствующие изобретению, представлены теми соединениями, в которыхR1 обозначает C1-C4 алкил,R2 обозначает C1-C4 алкил,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4 алкокси-C1C4 алкоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2 или -O-C(O)-O-(CH2)xO-NO2, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иX обозначает О (кислород) или NH,и их соли. Особенно предпочтительные примеры соединений представлены теми соединениями формулы 1, в которых R1 обозначает метил, R3a обозначает водород, R3b обозначает водород, R5b обозначает водород и Arom обозначает фенил, а заместители и группы R2, R4a, R4b, R5a и X имеют значения, представленные в следующей табл. 1,и соли этих соединений. Особенно предпочтительными являются соединения, представленные в качестве конечных продуктов в примерах, и их соли, включая те промежуточные соединения, которые находятся в пределах объема притязаний изобретения, и их соли. Соединения, предложенные в данном изобретении, могут быть синтезированы из соответствующих исходных соединений формулы 1, в которой либо R2 представлен гидроксиметильной группой, либо R5a или R5b является гидроксилом, или R2 представлен гидроксиметильной группой, a R5a или R5b является гидроксилом. Синтез осуществляют по методике, известной специалистам, и описанной, например, в международной патентной заявке WO 00/50037. Для получения предпочтительных нитратов соединений,предложенных в данном изобретении (где у=3), исходные соединения на первой стадии соответствующим образом превращают в сложные или простые эфиры посредством взаимодействия с соединением LС(O)-(CH2)х-Наl или L-CH2-(CH2)х-Наl, в котором L обозначает гидроксигруппу или подходящую удаляемую группу, a Hal обозначает атом галогена, и полученные промежуточные соединения затем приводят во взаимодействие с подходящим нитратом, в частности нитратом серебра, с получением соединений, соответствующих данному изобретению. Исходные соединения формулы 1, в которых либо R2 обозначает гидроксиметил, либо R5a или R5b являются гидроксилами, либо R2 обозначает гидроксиметил и R5a или R5b являются гидроксилами,можно получить, как, например, описано в следующих ниже примерах, или начиная с соответствующих исходных соединений с использованием аналогичных стадий процесса (см., например, WO 98/42707, WO 98/54188, WO 00/17200, WO 00/26217, WO 00/63211, WO 01/72756, WO 01/72754, WO 01/72755 и WO 01/72757), или так, как в самом общем виде представлено на следующих схемах.- 12008167 Схема 1 Получение соединений 1, где X=NH, R4a или R4b=гидроксил, R5a/R5b=Н и любые желаемые заместители R3a и R3bProt (ЗГ) на схеме выше представляет собой любую требуемую защитную группу, например пивалоил. Введение ацетильной группы, конденсацию с альдегидом Arom-СНО, закрытие кольца и восстановление осуществляют методами, которые сами по себе известны. Следующее за этим введение производных, если это требуется (например, превращение гидроксигруппы в алкоксигруппу), также осуществляют методами, которые сами по себе известны, например, как это описано в качестве примера в международной патентной заявке WO 00/17200. Схема 2 Получение соединений 1, где X=NH, R4a или R4b=гидроксил, R5a или R5b=гидроксил и любые требуемые заместители R3a и R3b 7-Ацетил-8-аминоимидазопиридин, используемый в качестве исходного вещества, получают, как показано на схеме 1. По сравнению со схемой 1 дополнительное эпоксидирование также осуществляют методом, который известен сам по себе, например, с использованием перекиси водорода в качестве эпоксидирующего агента. Альтернативно схемам 1 и 2, соединения, где X=NH, могут быть также получены в соответствии со схемой 8 международной патентной заявки WO 98/42707, преимущественно с использованием защиты гидроксильной группы сложного эфира фенилизосерина, например, при помощи подходящей силильной группы, или, если требуется получить соединения, у которых R5a/R5b=Н, с использованием соответствующего производного пропионовой кислоты, не содержащего 2-гидроксигруппу. В то время как соединения 1, где X=О, R4a или R4b=гидроксил, R5a/R5b=Н и любые требуемые заместители R3a и R3b могут быть получены по аналогии со схемой 1, соединения, где X=О, R4a илиR4b=гидроксил, R5a или R5b=гидроксил и любые требуемые заместители R3a и R3b лучше получать в соответствии со схемой реакций 3, показанной ниже. На схеме 3 выше представлен в виде примера энантиоселективный синтез 7,8-диола (R4a или R4b иR5a или R5b представлены в каждом случае гидроксилом), который, в случае необходимости, может быть затем дополнительно алкилирован или его гидроксильные группы могут быть дополнительно дериватизированы подходящим способом (например, этерифицированы или превращены в группы R41/R51 или R42/R52). Группа Y на схеме 3 является подходящей удаляемой группой, например, атомом галогена, предпочтительно хлором или C1-C4 алкоксигруппой, предпочтительно метоксигруппой. Ацилирование осуществляют традиционным способом, известным специалисту в данной области, предпочтительно с использованием бис(триметилсилил)амида натрия или амида калия, если удаляемой группой является атом хлора. Окисление, следующее за ацилированием, точно также осуществляют при условиях, которые, по существу, общеизвестны, с использованием хлоранила, атмосферного кислорода, 2,3-дихлор-5,6 дициано-n-бензохинона или диоксида марганца в качестве окислителя. Для последовательного удаления защитных групп и циклизации должны быть выполнены определенные условия в отношении используемой вспомогательной кислоты. В качестве вспомогательной кислоты преимущественно применяют муравьиную кислоту. Восстановление диолов также осуществляют в стандартных условиях, как уже было показано в случае восстановления согласно схеме 2 (см., например, WO 98/54188), с применением, например, боргидрида натрия в качестве восстановителя, с помощью которого могут быть получены специфические 7,8 транс-диолы с диастереомерной чистотой, превышающей 90%. Этерификация, которая следует затем в случае необходимости и также осуществляется, по существу, традиционным способом, приводит к соединениям формулы 1, предложенным в изобретении, в которых R4a и R5b представлены водородом. Для получения соединений формулы 1, в которых R5a и R5b представлены водородом, вместо диоксолана, указанного в схеме 3, в качестве исходных веществ используют производные 3 гидроксипропионовой кислоты (соответствующим образом защищенные по гидроксильной группе), в которых Y (аналогично вышеуказанной схеме) обозначает подходящую удаляемую группу. Введение в дальнейшем радикала R' (пролекарства) в синтез для образования заместителей R41 или R51 осуществляют в соответствии со схемами 1-3 в плане проведения реакции ацилирования, исходя из соединений формулы 1, в которых по крайней мере один из радикалов R4a, R4b, R5a и R5b обозначает гидроксил, посредством взаимодействия с соединениями формулы R'-Z, в которых Z обозначает подходящую удаляемую группу, например атом галогена. Реакцию осуществляют, по существу, известным способом предпочтительно в присутствии подходящего вспомогательного основания. Для получения соединений формулы 1, в которых R4a или R4b обозначает C1-C4 алкоксигруппу или C1-C4 алкокси-C1C4 алкоксигруппу и R5a или R5b обозначает радикал R5', соединения формулы 1, в которых R4a или R4b- 14008167 обозначает C1-C4 алкоксигруппу или C1-C4 алкокси-C1-C4 алкоксигруппу и R5a или R5b обозначает гидроксил, вводят в реакцию с соединениями R'-Z. Для получения соединений формулы 1, в которых R4a илиR4b обозначает гидроксил и R5a или R5b обозначает радикал R5', соединения формулы 1, в которых R4a и R4b вместе представлены О (кислородом), a R5a или R5b обозначает гидроксил, вводят в реакцию с соединениями R'-Z. Затем восстанавливают кетогруппу до гидроксигруппы. Подобным образом получают соединения формулы 1, в которых радикал пролекарства находится в положении 7, а гидроксил илиC1-C4 алкоксигруппа, либо C1-C4 алкокси-C1-C4 алкоксигруппа находится в положении 8. Алкилирование соединений, полученных в соответствии со схемами 1-3, для получения соединений формулы 1, в которых R4a, R4b, R5a или R5b имеет значение C1-C7 алкил, C2-C7 алкенил, фенил или фенC1-C4 алкил, можно в основном провести в соответствии со схемами 4 и 5, представленными ниже. Схема 4 Получение соединений 1, в которых R4a или R4b принимает значения C1-C7 алкил, C2-C7 алкенил,фенил или фен-C1-C4 алкил Введение радикала R4a или R4b (для краткости называемого R4) в положение 7 осуществляют взаимодействием с подходящим органометаллическим (М=металл) соединением (например, метиллития, фениллития, 2,2-диметилвинилмагния бромид и т.д.), по существу, известным способом. Группа 8-ОН по выбору должна быть защищена, например, с использованием подходящего сильльного радикала. Полученный алкилированный продукт при необходимости может затем быть введен в дальнейшие реакции,как описано в данном контексте или способами, которые известны сами по себе (этерификация, введение радикала пролекарства и т.д.). Схема 5 Получение соединений, в которых R5a или R5b принимает значения C1-C7 алкил, C2-C7 алкенил,фенил или фен-C1-C4 алкил Введение радикала R5a или R5b (сокращенно R5) в положение 8 осуществляют, например, взаимодействием с подходящим галогенидом (Hal = галоген), таким как, например, метилйодид, бензилбромид и т.д., в подходящих, предпочтительно основных условиях, способом, который сам по себе известен. Предпочтительно, реакцию также можно проводить в условиях переноса фаз. Полученный алкилированный продукт при необходимости может затем быть введен в дальнейшие реакции, как описано в данном контексте или способами, которые известны сами по себе (восстановление 7-оксогруппы, этерификация,введение группы "пролекарства" и т.д.). В отношении конкретного получения и выделения чистых энантиомеров делаются ссылки, например, на соответствующие детали, раскрытые в международной патентной публикации WO 00/17200. Исходные вещества, показанные на схемах 1-3, известны (см., например, ЕР-А-299470, Kaminski и соавт., J. Med. Chem., 1985, v. 28, pp. 876-892; 1989, v. 32, pp. 1686-1700 и 1991, v. 34, pp. 533-541 иAngew. Chem., 1996, v. 108, pp. 589-591) или их можно получить способом, аналогичным для известных соединений, например, в соответствии со схемой реакции 6, приведенной ниже.- 15008167 Схема 6 Пример получения исходных соединений, необходимых согласно схеме 3, где R1, R2=метил и различные заместители R3b Реакции для получения 8-бензилокси-6-бромимидазопиридинов осуществляют способом, по существу, известным специалисту в данной области. Превращение атома брома в группу сложного этилового эфира можно осуществлять различными путями, например, посредством реакции Хека (с использованием Pd(II), монооксида углерода и этанола) или замещением металлом водорода, соединнного с углеродным атомом в положении 6 (с использованием лития или магния) и последующей реакцией Гриньяра. Замещение металлом водорода, непосредственно соединнного с углеродным атомом, также предоставляет возможность введения других желаемых групп R3b в положение 6, например, фтора, хлора или карбоксигруппы. Исходя из группы сложного эфира, далее в положение 6 могут быть введены требуемые группы R3b, например, радикалы гидрокси-C1-C4 алкил (в частности, радикал гидроксиметил), посредством восстановления группы сложного эфира алюмогидридом лития, или радикалы C1-C4 алкокси-C1C4 алкил (в частности, радикалы C1-C4 алкоксиметил) последовательной этерификацией, как обозначено на схеме 6. Реакции дебензилирования/восстановления точно также осуществляют, по существу, известным способом, например, с использованием водорода/Рd(0). Если требуется получить соединения, в которыхR3b = -CO-NR31R32, можно провести соответствующую дериватизацию, по существу, известным способом (превращение сложного эфира в амид) на стадии 8-бензилокси-6-этоксикарбонильного соединения или после реакций дебензилирования/восстановления, или альтернативно также в более поздний момент времени, например, на стадии Acyloin (см. схемы 2 и 3). Исходные соединения, имеющие различные заместители R1 и R2, известны или они могут быть по- 16008167 лучены, например, на основе схемы 6 известным способом по аналогии с получением известных соединений. Альтернативно, получение производных может быть осуществлено на стадии соединений 1. Таким образом, можно, например, исходя из соединений, в которых R2 = Н, получить соединения, где R2 =CH2 ОН (посредством реакции Вильсмайера с последующим восстановлением), где R2 = О или Br (хлорированием или бромированием), где R2 = пропинил (из соответствующих бромпроизводных с использованием реакции Соногашира) или где R2 = алкоксикарбонил (из соответствующих бромпроизводных с использованием карбонилирования Хека). Следующие примеры предназначены для более подробной иллюстрации изобретения, без его ограничения. Более того, дополнительные соединения формулы 1, чье получение в прямой форме не описано,могут быть получены аналогичным образом или способами, которые являются известными сами по себе для квалифицированного специалиста в данной области, с использованием традиционных методик синтеза. Сокращение мин обозначает минуты, ч - часы, ее - избыток энантиомера. Примеры Конечные продукты. 1. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-нитрооксивалерилокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 4,00 г (7,54 ммоль) (7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-бромвалерилокси)7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина добавляют к раствору 5,13 г (30,20 ммоль) нитрата серебра в ацетонитриле (100 мл) и реакционную смесь перемешивают в темноте в течение 20 ч при 25 С. Затем смесь упаривают под вакуумом и очищают хроматографией (диизопропиловый эфир/триэтиламин: 9/1) с получением соединения, указанного в заголовке (1,80 г/3,51 ммоль/47%) в виде бесцветного твердого вещества, температура плавления (т.пл.) 87,1 С (пентан/диизопропиловый эфир). 2. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(4-нитрооксибутирилокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 1,80 г (3,48 ммоль) (7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(4-бромбутирилокси)7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин добавляют к раствору 2,40 г (14,1 ммоль) нитрата серебра в ацетонитриле (16 мл) и реакционную смесь перемешивают в темноте в течение 72 ч при 25 С. Затем смесь упаривают под вакуумом и очищают хроматографией (диизопропиловый эфир/триэтиламин: 9/1) с получением соединения, указанного в заголовке (0,60 г/1,20 ммоль/35%) в виде бесцветного твердого вещества, т.пл.106,4 С (диизопропиловый эфир). 3. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-нитрооксивалерилокси)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. К раствору 2,80 г (16,55 ммоль) нитрата серебра в ацетонитриле (20 мл) добавляют 2,00 г (3,76 ммоль)(7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-бромвалерилокси)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин и реакционную смесь перемешивают в темноте в течение 16 ч при 25 С. Затем смесь упаривают под вакуумом и очищают хроматографией (диизопропиловый эфир/триэтиламин: 9/1) с получением соединения, указанного в заголовке (1,37 г/2,67 ммоль/71%) в виде бесцветного твердого вещества, т.пл.124 С (диэтиловый эфир),4.(7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(6-йод-2-оксакаприлокси)-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин и реакционную смесь перемешивают в темноте в течение 2 ч при 25 С. Затем смесь упаривают под вакуумом и очищают хроматографией (диизопропиловый эфир/триэтиламин: 9/1) с получением соединения, указанного в заголовке (1,25 г/2,36 ммоль/74%) в виде бесцветного твердого вещества, т.пл.116 С (диэтиловый эфир). 5.(7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(4-бромметилбензоилокси)-7,8,9,10 тетрагидро[1,2-h][1,7]нафтиридин и реакционную смесь перемешивают в темноте в течение 16 ч при 25 С. Затем смесь упаривают под вакуумом и очищают хроматографией (диизопропиловый эфир/триэтиламин: 9/1) с получением соединения, указанного в заголовке (0,15 г/0,27 ммоль/10%) в виде бесцветного твердого вещества. 1 Н-ЯМР (200 МГц, CDCl3):= 2,40 (s, 6H), 3,25 (s, 3 Н), 3,48-3,55 (m, 1H), 3,67-3,73 (m, 1 Н), 4,90 (dd,2 Н), 5,45 (s, 2 Н), 5,90 (t, 1 Н), 6,90 (d, 1 Н), 7,23-7,50 (m, 8 Н), 7,93 (d, 2 Н). Промежуточные и исходные соединения. А. 8-Гидрокси-2,3-диметил-9-(3-тиенил)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. 1,1 г 8-амино-7-[2,3-эпокси-1-оксо-3-(3-тиенил)пропил]-2,3-диметилимидазо[1,2-а]пиридина растворяют в 20 мл гексафторизопропанола при комнатной температуре, через 19 ч растворитель удаляют и остаток очищают на силикагеле (элюент: хлористый метилен/метанол = 100/3) с получением 70 мг соединения, указанного в заголовке, т.пл. 222-225 С (диэтиловый эфир).- 17008167 Б. 7,8-Дигидрокси-2,3-диметил-9-(3-тиенил)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 50 мг 8-гидрокси-2,3-диметил-9-(3-тиенил)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7 она суспендируют в 5 мл метанола и обрабатывают 100 мг боргидрида натрия при комнатной температуре и интенсивном перемешивании. Реакционную смесь перемешивают 1 ч при комнатной температуре,затем растворитель удаляют под вакуумом, остаток покрывают слоем воды (5 мл), доводят рН смеси до рН 1 добавлением нескольких капель полунасыщенной водной соляной кислоты и затем подводят до рН 8 с помощью насыщенного водного раствора гидрокарбоната натрия, экстрагируют хлористым метиленом (320 мл), объединенные органические слои упаривают досуха под вакуумом и полученный твердый остаток очищают на силикагеле (элюент: хлористый метилен/метанол = 13/1) с получением 45 мг соединения, указанного в заголовке, т.пл. 134-138 С. В. 2,3-Диметил-9-(3-тиенил)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. 2,6 г 8-амино-2,3-диметил-7-[3-(3-тиенил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридина обрабатывают 20 мл водной 70% серной кислоты при комнатной температуре, через 90 мин выливают в ледяную воду (100 мл), нейтрализуют 6 н. водным раствором гидроксида натрия и экстрагируют хлористым метиленом (350 мл). Объединенные органические слои промывают водой, высушивают над сульфатом натрия, растворитель упаривают в вакууме и оставшееся желтое масло перемешивают с 15 мл диэтилового эфира. Полученное твердое вещество желтоватого цвета отфильтровывают и высушивают под вакуумом с получением 1,8 г соединения, указанного в заголовке, т.пл. 176-177 С (диэтиловый эфир). Г. 9-(3-Фурил)-8-гидрокси-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Аналогично примеру А, 70 мг соединения, указанного в заголовке, получают в результате нагревания 460 мг 8-амино-7-[2,3-эпокси-1-оксо-3-(3-фурил)пропил]-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-а]пиридина в гексафторизопропаноле. 1 Н-ЯМР (200 МГц, ДМСО):= 2,31 (s, 3 Н), 2,36 (s, 3 Н), 4,09-4,15 (m, 1 Н), 4,62-4,67 (m, 1 Н), 5,775,80 (d, 10 Н), 6,53-6,54 (m, 1H), 6,95-6,98 (d, 1 Н), 7,44-7,48 (d, 1H), 7,55-7,63 (m, 4 Н, включая 1NH). Д. 9-(3-Фурил)-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Аналогично примеру В, 550 мг соединения, указанного в заголовке, получают посредством обработки 1,5 г 8-амино-2,3-диметил-7-[3-(3-фурил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридина 70%-ной серной кислотой. 1 Н-ЯМР (200 МГц, ДМСО):= 2,31 (s, 3 Н), 2,35 (s, 3 Н), 2,72-3,04 (m, 2H), 4,85-4,92 (m, 1 Н), 6,546,56 (m, 1H), 6,94-6,98 (d, 1H), 7,39-7,43 (d, 1H), 7,50 (s, 1H), 7,55-7,57 (m, 1H), 7,79-7,80 (d, 1NH).E. (7R,8R,9R)-8-Гидрокси-7-[2-(2-метоксиэтокси)этокси]-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 5 г (7R,8R,9R)-7,8-дигидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина растворяют в 40 мл 2-(2-метоксиэтокси)этанола, добавляют 3,2 г 98% серной кислоты и смесь нагревают при 50 С в течение 16 ч, после чего выливают на лед, добавляют 100 мл хлористого метилена и доводят рН смеси до рН 7 с помощью водного 8 н. раствора 8N гидроксида натрия. Затем отделяют органический слой, водный слой еще дважды экстрагируют хлористым метиленом (250 мл), объединенные органические слои промывают 100 мл воды, высушивают над сульфатом натрия и растворитель удаляют под вакуумом. Остаток очищают на силикагеле (растворитель: диэтиловый эфир/2-пропанол = 10/1) с получением 105 мг соединения, указанного в заголовке. 1 Н-ЯМР (200 МГц, ДМСО):= 2,25 (s, 3H), 2,33 (s, 3H), 3,23 (s, 3H), 3,32-3,47 (m, 6 Н), 3,59-3,69 (m,2 Н), 3,97-4,07 (q, 1H), 4,44-4,47 (m, 2 Н), 5,18-5,21 (d, 1 ОН), 5,85-5,86 (d, 1NH), 6,74-6,78 (d, 1H), 7,19-7,45(m, 6 Н). Ж. (7S,8R,9R)-8-Гидрокси-7-[2-(2-метоксиэтокси)этокси]-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 350 мг соединения, указанного в заголовке, получают с помощью хроматографической очистки на колонке с силикагелем (элюент: диэтиловый эфир/2-пропанол = 10/1) неочищенного продукта вышеупомянутой реакции (7R,8R,9R)-7,8-дигидрокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h](т, 6 Н). З. (8R,9R)-8-Гидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. 30 мл концентрированной соляной кислоты добавляют по каплям в течение 20 мин при комнатной температуре к 29,8 г (73,1 ммоль) (8R,9R)-8-(тpeт-бутилдиметилсиланилокси)-2-метил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридина-7-она, растворяют в 30 мл метанола. Смесь перемешивают в течение еще 30 мин при комнатной температуре. Метанол упаривают и с помощью 2 М раствора гидроксида натрия доводят рН оставшегося раствора до рН 10. Смесь экстрагируют дихлорметаном (330 мл),объединенные слои дихлорметана промывают водой (130 мл) и органический слой сушат над сульфатом магния. Осушитель отфильтровывают, фильтрат упаривают и остаток подвергают кристаллизации с помощью диэтилового эфира. Кристаллизат отфильтровывают и высушивают под вакуумом при 50 С с[1,7]нафтиридина-7-она суспендируют в 30 мл 2-пропанола и 2 мл 0,3% метанольного раствора метоксида натрия. Добавляют по каплям в течение 10 мин при 10 С 0,4 г (10,2 ммоль) боргидрида натрия, растворенного в 5 мл 0,3%-ного метанольного раствора метоксида натрия. Реакционную смесь (суспензию) перемешивают в течение ночи при комнатной температуре и при этом образуется раствор. Реакционный раствор добавляют к 90 мл воды и экстрагируют этилацетатом (330 мл). Объединенные слои этилацетата промывают один раз водой и упаривают. Остаток подвергают хроматографии на силикагеле (этилацетат/2-пропанол, 95:5). Фракции продукта концентрируют и кристаллизуют с помощью диэтилового эфира. Кристаллы отфильтровывают и высушивают при 50 С в глубоком вакууме с получением 4,3 г соединения, указанного в заголовке (71% от теоретически возможного), т.пл. 119 С (разложение). К. (7S,8R,9R)- и (7R,8R,9R)-8-Гидрокси-2-метил-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 6 г (20,3 ммоль) (7R,8R,9R)-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина добавляют к 75 мл монометилового эфира этиленгликоля при 65 С, обрабатывают 4,9 г (50,8 ммоль) метансульфоновой кислоты и смесь перемешивают при 65 С в течение 1,5 ч. Раствор реакции концентрируют на роторном испарителе и остаток обрабатывают 50 мл дихлорметана и 50 мл воды. Водный слой доводят до рН 8 с помощью насыщенного раствора гидрокарбоната натрия, органический слой отделяют и водный слой экстрагируют дихлорметаном (220 мл). Объединенные слои дихлорметана объединяют и упаривают, а остаток разделяют хроматографией на силикагеле (этилацетат/2 пропанол/конц. раствор аммиака в воде, 98:2:0,1). Разделенные фракции продукта упаривают и продукт высушивают при 50 С в глубоком вакууме с получением 1,7 г (7S,8R,9R)-8-гидрокси-2-метил-7-(2 метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина (23% от теоретически возможного), т.пл. 149-152 С, и 0,9 г (7R,8R,9R)-8-гидрокси-2-метил-7-(2-метоксиэтокси)-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридина (12b), (13% от теоретически возможного), т. пл. 108-110 С. Л.(7R,8R,9R)-3-Бром-8-гидрокси-7-(2-метоксиэтокси)-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Суспензию 3,30 г (5,90 ммоль) (7R,8R,9R)-10-ацетил-3-бром-7-(2-метоксиэтокси)-2-метил-9-фенил 8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 1,00 мл (6,00 ммоль) водного 6 н. раствора гидроксида калия и 2,00 мл (51,40 ммоль) гидразингидрата в метаноле перемешивают при 60 С в течение 4 ч. Метанол упаривают под вакуумом и реакционную смесь разбавляют водой. После этого смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (толуол/диоксан/уксусная кислота: 8/1/1) с получением 1,50 г (3,47 ммоль/59%) соединения, указанного в заголовке, в виде светло-желтого твердого вещества, т.пл.153154 С (ацетон). М.(7R,8R,9R)-3-Хлор-8-гидрокси-7-(2-метоксиэтокси)-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Суспензию 0,27 г (0,53 ммоль) (7R,8R,9R)-10-ацетил-3-хлор-7-(2-метоксиэтокси)-2-метил-9-фенил 8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 0,10 мл (0,60 ммоль) водного 6 н. раствора гидроксида калия и 0,20 мл (5,14 ммоль) гидразингидрата в метаноле перемешивают при 60 С в течение 4 ч. Метанол упаривают под вакуумом и реакционную смесь разбавляют водой. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (толуол/диоксан/уксусная кислота: 8/1/1) с получением 0,34 г (0,88 ммоль/51%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл.123-126 С (ацетон). Н. (7R,8R,9R)-3-Хлор-8-гидрокси-7-(2-метоксиэтокси)-2-метил-9-фенил-7 Н-8,9-дигидропирано[2,3 с]имидазо[1,2-а]пиридин. Суспензию 0,70 г (1,48 ммоль) (7R,8R,9R)-3-хлор-7-(2-метоксиэтокси)-2-метил-9-фенил-8 пивалоилокси-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина и 0,10 г (0,72 ммоль) карбоната калия в метаноле перемешивают при 25 С в течение 18 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (этилацетат) с получением 0,45 г (1,16 ммоль/78%) соединения, указанного в заголовке, в виде бесцветного твердого вещества,т.пл.146 С (ацетон). О.- 19008167 перемешивают при 25 С в течение 18 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (этилацетат) с получением 0,55 г (1,55 ммоль/68%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,26 (s, 3 Н), 3,28 (s, 3 Н), 3,48-3,53 (m, 2 Н), 3,80-3,96 (m, 2 Н),3,98-4,18 (m, 1 Н), 4,63 (d, 1 Н), 5,04 (d, 1 Н), 6,79 (d, 1 Н), 7,32-7,53 (m, 5 Н), 7,61 (d, 1 Н), 8,05 (d, 1 Н). П. (7R,8R,9R)-7,8-Дигидрокси-2-метил-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. К суспензии 0,46 г (1,43 ммоль) (8R,9R)-8-формилокси-2-метил-9-фенил-7 Н-8,9-дигидропиран-7 он[2,3-с]имидазо[1,2-а]пиридина в метаноле добавляют 60 мг (1,50 ммоль) боргидрид натрия и смесь перемешивают при 25 С в течение 1 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (дихлорметан/метанол: 13/1) с получением 0,31 г (1,05 ммоль/73%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл.252254 С (ацетон). Р. (7S,8R,9R)-7,8-Дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. К охлажденному при 0 С и перемешиваемому раствору бромисто-водородной кислоты добавляют 1,00 г (3,39 ммоль) (7R,8R,9R)-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина. Через 0,5 ч реакцию останавливают добавлением льда и водного раствора аммиака до тех пор, пока рН реакционной смеси не достигнет рН 9,8. Выпавший осадок отделяют, промывают водой, высушивают под вакуумом при 60 С и получают соединение, указанное в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,30 (s, 3 Н), 3,84 (m, 1 Н), 4,34 (t, 1 Н), 4,48 (dd, 1 Н), 6,72 (d, 1 Н),7,25-7,45 (m, 5 Н), 7,56 (d, 1 Н), 7,73 (d, 1 Н). С.(7R,8R,9R)-8-Гидрокси-7-метокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. К суспензии 0,62 г (2,10 ммоль) (7S,8R,9R)-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в диметоксипропане добавляют 0,51 г (26,2 ммоль) птолуолсульфокислоты и ацетон (4,0 мл). Смесь перемешивают 6 ч при 60 С и 96 ч при 25 С. Реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (дихлорметан/метанол: 100/3) с получением 0,12 г (0,34 ммоль/16%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,29 (s, 3 Н), 3,25 (s, 3 Н), 4,05 (q, 1 Н), 4,32 (d, 1 Н), 4,47 (dd, 1 Н),6,61 (d, 1 Н), 7,19-7,46 (m, 5 Н), 7,54 (s, 1 Н), 7,72 (d, 1 Н). Т.(7S,8R,9R)-8-Гидрокси-7-метокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. К суспензии 0,62 г (2,10 ммоль) (7S,8R,9R)-7,8-дигидрокси-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в диметоксипропане добавляют 0,51 г (26,2 ммоль) п-толуолсульфокислоты и ацетон (4,0 мл). Смесь перемешивают 6 ч при 60 С и 96 ч при 25 С. Реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (дихлорметан/метанол: 100/3) с получением 0,18 г (0,52 ммоль/25%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,28 (s, 3 Н), 3,30 (s, 1 Н), 3,09-4,03 (m, 1 Н), 4,06 (d, 1 Н), 4,49 (dd,1 Н), 6,67 (d, 1 Н), 7,22-7,44 (m, 5 Н), 7,54 (d, 1 Н), 7,69 (d, 1 Н). У.(7R,8R,9R)-3-Гидроксиметил-8-гидрокси-7-(2-метоксиэтокси)-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Суспензию 0,60 г (1,10 ммоль) (7R,8R,9R)-10-ацетил-3-гидроксиметил-7-(2-метоксиэтокси)-2 метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина и 0,30 г (2,10 ммоль) карбоната калия в аминоэтаноле перемешивают при 90 С в течение 2 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (дихлорметан/метанол: 13/1) с получением 0,20 г (0,52 ммоль/47%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл.180-183 С (диэтиловый эфир). Ф. (7R,8R,9R)-3-Гидроксиметил-8-гидрокси-7-(2-гидроксиэтокси)-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин.- 20008167 Суспензию 0,17 г (0,30 ммоль) (7R,8R,9R)-10-ацетил-3-гидроксиметил-7-(2-гидроксиэтокси)-2 метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина и 0,30 г (2,10 ммоль) карбоната калия в аминоэтаноле перемешивают при 90 С в течение 2 ч. Реакцию останавливают добавлением смеси непосредственно на силикагеле для проведения очистки с помощью колоночной хроматографии (дихлорметан/метанол: 13/1) с получением 0,02 г (0,06 ммоль/19%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,29 (s, 1 Н), 3,30-3,44 (m, 2 Н), 3,46-3,65 (m, 2 Н), 4,01 (q, 1 Н),4,47 (t, 2 Н), 4,70 (d, 2 Н), 6,79 (d, 1 Н), 7,20-7,43 (m, 5 Н), 7,63 (d, 1 Н).[1,2-h][1,7]нафтиридин. К суспензии 2,00 г (6,40 ммоль) (7R,8R,9R)-7,8-дигидрокси-2,3-диметил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридина в 2-метоксиэтаноле (100 мл) добавляют 1,26 г (12,8 ммоль) серной кислоты и смесь перемешивают в течение 3 ч при 55 С. Затем реакцию выливают в охлажденный до 0 С водный 2 н. раствор гидроксида натрия. Смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают водой четыре раза, сушат над сульфатом натрия и упаривают в вакууме. Неочищенный продукт подвергают колоночной хроматографии (диэтиловый эфир/2-пропанол: 10/1) с получением 0,35 г (0,99 ммоль/16%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл.107-109 С (диэтиловый эфир). Ц.[1,2-h][1,7]нафтиридин. Суспензию 1,14 г (2,05 ммоль) (7R,8R,9R)-10-ацетил-3,9-дифенил-7-(2-метоксиэтокси)-2-метил-8 пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина и 2,28 г (16,5 ммоль) карбоната калия в аминоэтаноле перемешивают при 60 С в течение 4 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют этилацетатом. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (диэтиловый эфир/ петролейный эфир: 7/3) с получением 0,52 г (1,21 ммоль/60%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл.190-192 С (диэтиловый эфир). Ч.(8R,9R)-8-Гидрокси-2-метоксиметил-3-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-п][1,7] нафтиридин-7-он. 7,1 г 7-[(2R,3S)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-2-метоксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридина добавляют к 95 мл 70%-ной серной кислоты при охлаждении льдом. Когда добавление закончено, ледяную баню убирают и продолжают перемешивание в течение 3 ч при комнатной температуре. Реакционную смесь выливают в 200 г измельченного льда и доводят рН до приблизительно рН 9 добавлением 10%-ного раствора гидроксида натрия. Водный слой экстрагируют дихлорметаном, органический слой промывают водой и сушат над безводным сульфатом натрия. Растворитель упаривают в вакууме и остаток оставляют для кристаллизации из смеси ацетон/диэтиловый эфир с получением 3,2 г (65%) твердого вещества, т.пл. 168-173 С. Ш. (7R,8R,9R)-7,8-Дигидрокси-2-метоксиметил-3-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-она суспендируют в 40 мл метанола и добавляют небольшими порциями 0,6 г боргидрида натрия в течение 30 мин. Через 1 ч при температуре окружающей среды реакционную смесь выливают в 60 мл ледяной воды с добавлением 2 г хлорида аммония. Органический слой отделяют и водный слой трижды экстрагируют дихлорметаном. Объединенные органические слои сушат над безводным сульфатом натрия и растворитель упаривают под вакуумом. Остаток очищают при помощи колоночной хроматографии на силикагеле (элюент: дихлорметан/метанол 100:1). Кристаллизация из диэтилового эфира приводит к 4,7 г (78%) соединения, указанного в заголовке, в виде светло-коричневого твердого вещества, т.пл.102-104 С. Щ. (7S,8R,9R)- и (7R,8R,9R)-8-Гидрокси-7-(2-метоксиэтокси)-2-метоксиметил-3-метил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2,0 г (7R,8R,9R)-7,8-дигидрокси-2-метоксиметил-3-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридина растворяют в 50 мл 2-метоксиэтанола и медленно прибавляют 1 мл метансульфокислоты. Реакцию нагревают при 55 С в течение 3 ч и затем выливают в 80 мл ледяной воды и 100 мл дихлорметана. Органический слой отделяют и водный слой трижды экстрагируют дихлорметаном. Объединенные органические слои сушат над безводным сульфатом натрия и растворитель упаривают под вакуумом. Два стереомера разделяют при помощи колоночной хроматографии на силикагеле (элюент: диэтиловый эфир) с получением 850 мг (36%) (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2-метоксиметил 3-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина (28 а, т.пл. 63-65 С) и 400 мг (17%)(7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2-метоксиметил-3-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина (т.пл. 50-53 С). Э. (7S,8R,9R)- и (7R,8R,9R)-7-Этокси-8-гидрокси-2-метоксиметил-3-метил-9-фенил-7,8,9,10- 21008167 тетрагидроимидазо[1,2-h][1,7]нафтиридин. Соединение, указанное в заголовке, 7S,8R,9R-, с т.пл. 145-147 С (диэтиловый эфир/ацетон), и соединение, указанное в заголовке, 7R,8R,9R-, с т.пл. 188-190 С (ацетон) получают аналогично примеру Щ. АА. (8R,9R)-8-Гидрокси-2-метил-9-фенил-7H-8,9-дигидропиран-7-он[2,3-с]имидазо[1,2-а]пиридин. К охлажденной до 0 С суспензии 2,08 г (6,5 ммоль) (8R,9R)-8-формилокси-2-метил-9-фенил-7 Н-8,9 дигидропиран-7-он[2,3-с]имидазо[1,2-а]пиридина в метаноле (40 мл) добавляют 0,20 г (1,44 ммоль) карбоната калия и перемешивают в течение 2 ч при этой температуре. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Затем смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над безводным сульфатом натрия и растворитель упаривают под вакуумом. Неочищенный продукт подвергают кристаллизации из ацетона с получением 1,50 г (5,10 ммоль/78%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл. 173-175 С (ацетон). ББ. 7-Ацетил-2,3-диметил-8-пивалоиламиноимидазо[1,2-а]пиридин. К интенсивно перемешиваемому раствору 65,4 г 2,3-диметил-8-пивалоиламиноимидазо[1,2-а] пиридина в 1,4 л диэтилового эфира прикапывают при -78 С в атмосфере аргона в качестве защитного газа 500 мл выпускаемого в промышленности 1,5 молярного раствора трет-бутиллития в н-пентане так,чтобы температура не поднималась выше -70 С. Затем смесь охлаждают до -90 С в течение 15 мин и к темно-красной суспензии прикапывают 54 мл ацетилхлорида. Затем смеси позволяют нагреться до -40 С(30 мин), обрабатывают 60 мл метанола, содержимое колбы выливают в 1 л ледяной воды и водную фазу экстрагируют метиленхлоридом (3150 мл). Объединенные органические слои промывают водой (3100 мл), сушат над безводным сульфатом натрия и растворитель удаляют под вакуумом. Остаток очищают на силикагеле (элюент: этилацетат/петролейный эфир = 3/7) с получением 23,2 г соединения, указанного в заголовке. ВВ. 7-Ацетил-8-амино-2,3-диметилимидазо[1,2-а]пиридин. Охлажденный раствор 80,4 г 7-ацетил-2,3-диметил-8-пивалоиламиноимидазо[1,2-а]пиридина в 720 мл метанола обрабатывают 496 мл концентрированной серной кислоты и нагревают с обратным холодильником в течение 2,5 ч. Затем смесь выливают в 1 л ледяной воды, добавляют 400 мл хлористого метилена и рН смеси доводят до рН 7 добавлением при охлаждении 10 н. раствора гидроксида натрия. После разделения фаз, водный слой вновь экстрагируют хлористым метиленом (3300 мл), органические слои собирают, промывают все вместе 1 л воды, сушат над сульфатом натрия и растворитель удаляют под вакуумом. Твердый остаток очищают на силикагеле (элюент: этилацетат) с получением 22,5 г соединения, указанного в заголовке, т.пл. 195-197 С (диэтиловый эфир). ГГ. 8-Амино-2,3-диметил-7-[3-(3-тиенил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридин. Смесь 5 г 7-ацетил-8-амино-2,3-диметилимидазо[1,2-а]пиридина, 2,9 г тиофен-3-карбоксальдегида,1,6 г гидроксида натрия и 100 мл этанола перемешивают при комнатной температуре в течение 3 дней. Затем смесь упаривают под вакуумом до половины объема, выливают в 100 мл насыщенного раствора хлорида аммония и экстрагируют метиленхлоридом (3100 мл). Объединенные органические слои промывают небольшим количеством воды, растворитель удаляют под вакуумом и остаток перемешивают в этиловом эфире. После фильтрования и высушивания в вакууме получают 4,6 г соединения, указанного в заголовке. ДД. 8-Амино-7-[2,3-эпокси-1-оксо-3-(3-тиенил)пропил]-2,3-диметилимидазо[1,2-а]пиридин. Суспензию 2,6 г 8-амино-2,3-диметил-7-[3-(3-тиенил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридина в 80 мл этанола последовательно обрабатывают 5,2 мл 6 н. водного раствора гидроксида натрия и 5 мл 30%-ного водного раствора перекиси водорода, перемешивают при комнатной температуре в течение 48 ч, выливают в 200 мл ледяной воды и доводят рН до рН 7-8 с помощью полунасыщенной водной соляной кислоты. Затем смесь экстрагируют метиленхлоридом (3100 мл), объединенные органические слои промывают один раз насыщенным раствором тиосульфата натрия и один раз 100 мл дистиллированной воды, растворитель упаривают под вакуумом и остаток очищают на силикагеле (элюент: метиленхлорид/метанол = 100/3) с получением 1,2 г соединения, указанного в заголовке, т.пл. 186-189 С (диэтиловый эфир). ЕЕ. 8-Амино-2,3-диметил-7-[3-(3-фурил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридин. 4,6 г соединения, указанного в заголовке, получают взаимодействием 5 г 7-ацетил-8-амино-2,3 диметилимидазо[1,2-а]пиридина с 2,9 г фуран-3-карбальдегида аналогично примеру ГГ. ЖЖ. 8-Амино-7-[2,3-эпокси-1-оксо-3-(3-фурил)пропил]-2,3-диметил-7,8,9,10-тетрагидроимидазо[1,2-а]пиридин. Аналогично примеру ДД, 0,7 г соединения, указанного в заголовке, получают взаимодействием 2,4 г 8-амино-2,3-диметил-7-[3-(3-фурил)-1-оксо-2-пропенил]имидазо[1,2-а]пиридина с 30% водным раствором перекиси водорода. ЗЗ. 2-Метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. 60 г (251,8 ммоль) 8-бензилокси-2-метилимидазо[1,2-а]пиридина (Kaminski et al. J. Med. Chem.,- 22008167 1985, v. 28, pp. 876-892) гидрируют на Pd-угле в 400 мл метанола при давлении водорода 55 бар и температуре 70 С. После завершения гидрирования катализатор отфильтровывают и фильтрат концентрируют. Остаток (38 г) растворяют в дихлорметане и раствор обрабатывают при комнатной температуре порциями диоксида марганца (109,5 г). Реакционную смесь перемешивают при комнатной температуре в течение 22 ч и затем фильтруют через силикагель. Фильтрат концентрируют до получения остатка и кристаллизат высушивают под вакуумом при 60 С с получением 25,13 г соединения, указанного в заголовке[1,2-h][1,7]нафтиридин-7-он. 19,4 г (128,3 ммоль) 2-метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-она, 42,07 г (130,2 ммоль) этилового эфира (2R,3R)-3-амино-2-(трет-бутилдиметилсиланилокси)-3-фенилпропионовой кислоты и 0,65 г моногидрата п-толуолсульфоновой кислоты кипятят с обратным холодильником в водном сепараторе в течение 1,5 ч в 100 мл абсолютного толуола. Раствор охлаждают до комнатной температуры и обрабатывают 100 мл абсолютного тетрагидрофурана. Затем к охлажденному до -25 С раствору добавляют по каплям 154 мл 2 М раствора ЛДА (диизопропиламид лития) в ТГФ. После добавления ЛДА температуре позволяют подняться до 0 С и смесь далее перемешивают при 0 С в течение 1 ч. Реакционный раствор промывают при комнатной температуре один раз 200 мл насыщенного раствора хлорида аммония,один раз 50 мл насыщенного раствора хлорида аммония и один раз водой. Органический слой упаривают и подвергают хроматографии на силикагеле (петролейный эфир/этилацетат, 2:1). Фракции концентрированного продукта сушат в высоком вакууме с получением 50,8 г соединения, указанного в заголовке(97% от теоретически возможного). КК. (8R,9R)-8-(трет-Бутилдиметилсиланилокси)-2-метил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридин-7-он. 50,7 г (123,8 ммоль) (8R,9R)-8-(трет-бутилдиметилсиланилокси)-2-метил-9-фенил-5,6,7,8,9,10 гексагидроимидазо[1,2-h][1,7]нафтиридин-7-она обрабатывают порциями при температуре 5-10 С посредством 35,6 г (153,5 ммоль) 2,3-дихлор-5,6-дициано-п-бензохинона. После окончания добавления реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь экстрагируют 150 мл раствора гидроксида натрия, отделяют слой раствора гидроксида натрия, экстрагируют 150 мл толуола и объединенные слои толуола промывают 150 мл воды. Органический слой концентрируют и остаток сушат в течение ночи в глубоком вакууме. Выкристаллизовавшееся таким образом вещество перемешивают с диизопропиловым эфиром, отфильтровывают с отсасыванием и сушат в вакууме при 50 С с получением 10,1 г соединения, указанного в заголовке (20% от теоретически возможного). ЛЛ.(7R,8R,911)-10-Ацетил-3,9-дифенил-7-(2-метоксиэтокси)-2-метил-8-пивалоилокси-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2,61 г (4,67 ммоль) (7R,8R,9R)-10-ацетил-3-бром-7-(2-метоксиэтокси)-2-метил-9-фенил-8 пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 0,63 г (5,14 ммоль) фенилбороновой кислоты, 0,89 г (15,4 ммоль) KF (высушенного распылением), 0,14 г (0,15 ммоль) Pd2(dba)3, 0,07 г (0,36 ммоль/10 мас.% раствор в гексане) Р(t-Bu)3 и ТГФ (30 мл) помещают в трубку Шленка под аргоном. Затем трубку Шленка вакуумируют и вновь заполняют аргоном методом циклического замораживанияоткачивания-размораживания три раза. Реакционную смесь перемешивают в атмосфере аргона в течение 2 дней при 25 С. После этого реакцию разбавляют добавлением этилацетата и затем фильтруют через силикагель. Сконцентрированный неочищенный продукт подвергают колоночной хроматографии (диэтиловый эфир/петролейный эфир: 6/4) с получением 1,80 г (3,24 ммоль/70%) соединения, указанного в заголовке,в виде аморфного бесцветного твердого вещества. 1H-ЯМР (200 МГц, [d6] ДМСО):= 1,20 (s, 9 Н), 2,20 (s, 3 Н), 2,43 (s, 3 Н), 3,30 (s, 3 Н), 3,40-3,57 (m,2 Н), 3,88 (t, 2 Н), 4,64 (d, 1 Н), 5,35 (t, 1 Н), 5,83 (d, 1 Н), 7,00 (d, 1H), 7,10-7,30 (m, 5 Н), 7,41-7,68 (m, 5 Н),8,24 (d, 1 Н). ММ. (7R,8R,9R)-10-Ацетил-3-бром-7-(2-метоксиэтокси)-2-метил-9-фенил-8-пивалоилокси-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К охлажденному до 0 С раствору 2,20 г (4,60 ммоль) (7R,8R,9R)-10-ацетил-7-(2-метоксиэтокси)-2 метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в этаноле (20 мл) добавляют 0,84 г (4,60 ммоль) N-бромсукцинимида (NBS) и смесь перемешивают в течение 1 ч. Затем реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия и дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают кристаллизации(циклогексан) с получением 1,60 г (2,86 ммоль/62%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл. 166-167 С (циклогексан). НН.(7R,8R,9R)-10-Ацетил-7-(2-метоксиэтокси)-2-метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. К охлажденному до -30 С раствору 7,40 г (17,6 ммоль) (7R,8R,9R)-10-ацетил-7-гидрокси-2-метил-9 фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в дихлорметане (25 мл) и N- 23008167 метилпирролидинона (25 мл) добавляют 4,00 г (19,3 ммоль) метоксиэтилтрифлата и 1,40 г (35,2 ммоль) гидрида натрия и перемешивают еще 2 ч при той же температуре. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. После этого смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (этилацетат/циклогексан/триэтиламин: 5/4/1) с получением 7,50 г (15,63 ммоль/89%) соединения, указанного в заголовке, в виде аморфного вещества желтого цвета. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 1,19 (s, 9 Н), 2,15 (s, 3 Н), 2,38 (s, 3 Н), 3,27 (s, 3 Н), 3,45-3,57 (m,2 Н), 3,83-3,93 (m, 2 Н), 4,60 (d, 1 Н), 5,31 (t, 1 Н), 5,79 (d, 1 Н), 6,94 (s, 1 Н), 7,20 (s, 5 Н), 7,74 (s, 1 Н), 8,43 (d,1 Н). ОО. (7R,8R,9R)-10-Ацетил-3-хлор-7-(2-метоксиэтокси)-2-метил-9-фенил-8-пивалоилокси-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К охлажденному до 0 С раствору 1,00 г (2,10 ммоль) (7R,8R,9R)-10-ацетил-7-(2-метоксиэтокси)-2 метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в этаноле (20 мл) добавляют 0,28 г (2,10 ммоль) N-хлорсукцинимида (NCS) и смесь перемешивают в течение 2 ч. Затем реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия и дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (этилацетат/циклогексан: 1/1) с получением 0,89 г (1,73 ммоль/82%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл. 167-170 С (циклогексан). ПП. (7R,8R,9R)-10-Ацетил-3-бром-8-(2-метоксиэтокси)-2-метил-9-фенил-7-пивалоилокси-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К охлажденному до 0 С раствору 0,40 г (0,83 ммоль) (7R,8R,9R)-10-ацетил-8-(2-метоксиэтокси)-2 метил-9-фенил-7-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в этаноле (5 мл) добавляют 0,15 г (0,83 ммоль) N-бромсукцинимида (NBS) и смесь перемешивают в течение 1 ч. Затем реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия и дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают колоночной хроматографии (эфир/триэтиламин: 95/5) с получением 0,30 г (0,53 ммоль/65%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 0,96 (s, 9 Н), 2,09 (s, 3 Н), 2,42 (s, 3 Н), 3,23 (s, 3 Н), 3,40-3,53 (m,2H), 3,69-3,98 (m, 2H), 4,23 (t, 1H), 5,75 (d, 1H), 6,02 (s, 1H), 6,80 (d, 1H), 7,16 (s, 5H), 8,18 (d, 1H).(23,80 ммоль) цианоборгидрида натрия, метилоранж (0,5 мл в растворе этилового спирта) и соляную кислоту в этаноле, пока цвет раствора не станет красным. Смесь перемешивают в течение еще 2 ч при 0 С. Затем реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия и дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом с получением 4,90 г (11,6 ммоль/98%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 1,21 (s, 9 Н), 2,11 (s, 3 Н), 2,37 (s, 1 Н), 4,72 (t, 1 Н), 5,04-5,10 (m,1 Н), 5,66 (d, 1 Н), 7,00 (d, 1 Н), 7,17 (s, 5 Н), 7,74 (s, 1 Н), 8,45 (d, 1 Н). СС.(8R,9R)-10-Ацетил-2-метил-9-фенил-8-пивалоилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин-7-он. К охлажденному до 0 С раствору 7,00 г (18,5 ммоль) (8R,9R)-2-метил-9-фенил-8-пивалоилокси 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-она в толуоле (70 мл) добавляют 4,10 мл (55,5 ммоль) ацетилхлорида и 7,70 мл (55,5 ммоль) триэтиламина и реакционную смесь перемешивают в течение 1 ч при 0 С. После этого к реакционной смеси добавляют еще 4,10 мл (55,5 ммоль) ацетилхлорида и 7,70 мл (55,5 ммоль) триэтиламина, смесь нагревают до 25 С и перемешивают при такой температуре в течение 1 ч. После этого реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. Смесь дважды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт подвергают кристаллизации из диэтилового эфира с получением 5,4 г (12,7 ммоль/7%) соединения, указанного в заголовке, в виде бесцветного твердого вещества, т.пл. 168-169 С (диэтиловый эфир). ТТ. 2-Метил-7-[(2R,3S)-2,3-О,О-изопропилиден-3-фенилпропан-1-он-1-ил]-6,7-дигидро-5 Н-имидазо-8-имидазо[1,2-а]пиридин-8-он. К суспензии 5,00 г (33,3 ммоль) 2-метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-она в ТГФ (100 мл) прикапывают при 10 С 35,0 мл NaHDMS (1M раствор в ТГФ/35,0 ммоль) и 4,90 мл (35,0 ммоль) триэтиламина. Реакционную смесь перемешивают в течение 1 ч. После этого смесь охлаждают до -78 С и- 24008167 медленно добавляют 8,42 г (35,0 ммоль) (2R,3S)-2,3-О,О-изопропидиден-3-фенилпропионилхлорида. Реакционную смесь перемешивают в течение 2 ч при температуре между -70 и - 60 С и позволяют нагреться до 25 С и вновь перемешивают в течение 4 ч. Реакцию останавливают добавлением насыщенного водного раствора хлорида аммония. После этого смесь дважды экстрагируют этилацетатом. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и упаривают под вакуумом. Неочищенный продукт фильтруют через силикагель. Фракции продукта концентрируют под вакуумом и кристаллизуют из диэтилового эфира с получением 6,10 г (17,2 ммоль/51%) соединения,указанного в заголовке, в виде бесцветного твердого вещества, т.пл. 126 С (диэтиловый эфир). УУ. 2-Метил-7-[(2R,3S)-2,3-O,O-изопропилидиден-3-фенилпропан-1-он-1-ил]имидазо-8-имидазо[1,2-а]пиридин-8-ол. Смесь 20,5 г (57,8 ммоль) 2-метил-7-[(2R,3S)-2,3-O,O-изопропилиден-3-фенилпропан-1-он-1-ил]6,7-дигидро-5 Н-имидазо-8-имидазо[1,2-а]пиридин-8-она и 14,2 г (57,8 ммоль) хлоранила в диоксане (200 мл) перемешивают в течение 40 ч при 50 С. Затем растворитель упаривают под вакуумом и смесь подвергают очистке посредством колоночной хроматографии (толуол/диоксан/уксусная кислота: 8/1/1). Фракции и продукта концентрируют под вакуумом и кристаллизуют из 2-пропанола с получением соединения в виде твердого вещества светло-желтого цвета 4,40 г (12,5 ммоль/21%), т.пл. 229 С (2 пропанол). ФФ. 2-Метоксикарбонил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридин. К перемешиваемому раствору 30 г 2-амино-3-пивалоиламинопиридина в 300 мл сухого ТГФ прикапывают в атмосфере аргона 40 г 3-бром-2-оксобутановой кислоты в метиловом эфире. Раствор коричневого цвета перемешивают при температуре окружающей среды в течение 3 дней. Полученную суспензию выливают в смесь ледяной воды с этилацетатом и смесь нейтрализуют добавлением 10 М раствора гидроксида натрия. Органический слой отделяют и водный слой экстрагируют дважды этилацетатом. Объединенные водные слои промывают водой и сушат над безводным сульфатом натрия. Растворитель удаляют под вакуумом и остаток голубого цвета очищают посредством колоночной хроматографии на силикагеле с получением 35 г (78%) твердого вещества светло-коричневого цвета (т.пл. 132 С).XX. 2-Гидроксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридин. К раствору 36,6 г 2-метоксикарбонил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридина в 400 мл сухого ТГФ добавляют 5,5 г алюмогидрида лития при температуре окружающей среды в течение 1 ч. Затем реакционную смесь осторожно гидролизуют добавлением 15 мл воды и 16 мл 15% раствора гидроксида натрия. Осадок удаляют фильтрованием и тщательно промывают ТГФ. Фильтрат промывают 100 мл насыщенного раствора хлорида аммония и концентрируют под вакуумом. Остаток растворяют в 400 мл ТГФ/толуол, 1:1 (об./об.) и растворитель отгоняют при 80 С. Осадок отфильтровывают и высушивают под вакуумом с получением 27,2 г (83%) соединения, указанного в заголовке (т.пл. 186-187 С). ЦЦ. 2-Хлорметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридин. К перемешиваемой суспензии 13 г 2-гидроксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а] пиридина в 500 мл сухого дихлорметана прикапывают раствор 6,5 г тионилхлорида в 50 мл сухого дихлорметана при 0-5 С с получением светло-желтого раствора. Через 2 ч реакционную смесь подвергают гидролизу добавлением при охлаждении 200 мл насыщенного раствора бикарбоната натрия. Полученную смесь переносят в делительную воронку и энергично встряхивают. Органический слой отделяют, промывают водой и сушат над безводным сульфатом натрия. Растворитель упаривают под вакуумом с получением 12,7 г (92%) соединения, указанного в заголовке (т.пл. 168 С). ЧЧ. 2-Метоксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридин. Раствор 12,8 г 2-хлорметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридина в 600 мл сухого метанола кипятят с обратным холодильником в течение 5 ч. Реакционную смесь концентрируют под вакуумом до половины объема. После добавления 200 мл насыщенного раствора бикарбоната натрия смесь экстрагируют диэтиловым эфиром. Органический слой промывают водой и сушат над безводным сульфатом натрия. Удаление растворителя под вакуумом приводит к 12,5 г (99%) соединения, указанного в заголовке (т.пл. 104 С). ШШ. 7-[(2R,3S)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-2-метоксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридин. Прикапывают 60 мл раствора трет-бутиллития (1,5 М раствор в н-пентане) к 50 мл безводного диэтилового эфира при температуре -90 С в атмосфере аргона при недопущении влаги. Добавляют раствор 11,0 г 2-метоксиметил-3-метил-8-пивалоиламиноимидазо[1,2-а]пиридина в 220 мл безводного диэтилового эфира при такой скорости, чтобы температура сохранялась на (-90) - (-95)С. Через 15 мин быстро добавляют раствор 21,7 г метил-(2R,3S)-2,3-O-изопропилиден-3-фенилпропионата в 20 мл диэтилового эфира (приблизительно за 1 мин). По окончании добавления охлаждающую баню убирают. Когда температура внутри смеси достигнет -35 С, добавляют 40 мл метанола. Смесь переносят в делительную воронку и разбавляют 700 мл воды. После отделения органического слоя водный слой дважды диэтиловым эфиром. Объединенные органические слои промывают водой, сушат над сульфатом натрия и упаривают под вакуумом. Остаток очищают на силикагеле (элюент: диэтиловый эфир) и полученную таким образом фракцию продукта дополнительно очищают хроматографией на силикагеле (элюент: ацетонитрил). Ос- 25008167 таток дважды упаривают вместе с ацетонитрилом и дихлорметаном и высушивают под вакуумом с получением 8,6 г (45%) соединения, указанного в заголовке, в виде твердого вещества желтого цвета (т.пл. 50-52 С). ЩЩ. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-бромвалерилокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 10,0 г (55,8 ммоль) 5-бромвалериановой кислоты и 9,13 г (56,3 ммоль) N,N'-карбонилдиимидазола перемешивают в ТГФ в течение 3 ч при 40 С. Затем добавляют при 25 С последовательно 10,0 г (27,2 ммоль)[1,2-h][1,7]нафтиридин и 8,33 мл (55,8 ммоль) 1,8-диазабицикло[5,4,0]ундек-7-ена и смесь перемешивают в течение еще 2 ч. Реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната натрия. Смесь трижды экстрагируют дихлолрметаном и объединенные органические слои концентрируют под вакуумом. Неочищенный продукт подвергают хроматографии (дихлорметан/метанол: 100/3 до 13/1) и получают целевое соединение в виде бесцветного твердого вещества (9,60 г/18,1 ммоль/66%),т.пл. 98,6 С (диизопропиловый эфир). ЭЭ.(7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(4-бромбутирилокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Перемешивают 10,0 г (56,0 ммоль) 4-броммасляной кислоты и 9,70 г (56,0 ммоль) N,N'карбонилдиимидазола в ТГФ в течение 3 ч при 40 С. Последовательно добавляют при 25 С 10,0 г (27,2 ммоль)[1,2-h][1,7]нафтиридина и 8,70 мл (56,0 ммоль) 1,8-диазабицикло[5,4,0]ундек-7-ена и смесь перемешивают в течение дополнительных 2 ч. Реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната. Смесь трижды экстрагируют дихлорметаном и объединенные органические слои упаривают под вакуумом. Неочищенный продукт подвергают хроматографии (дихлорметан/метанол: от 100/3 до 13/1) и получают целевое соединение в виде бесцветного твердого вещества (2,15 г/4,16 ммоль/15%),т.пл. 114,4 С (диизопропиловый эфир).AAA. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(5-бромвалерилокси)-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. 3,33 г (18,2 ммоль) 5-бромвалериановой кислоты и 3,04 г (18,2 ммоль) N,N'-карбонилдиимидазола перемешивают в ТГФ в течение 2 ч при 30 С. Последовательно добавляют при 25 С 3,29 г (8,90 ммоль) (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2 метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин и 2,77 мл (18,2 ммоль) 1,8 диазабицикло[5,4,0]ундек-7-ена и смесь перемешивают в течение еще 2 ч. Реакцию останавливают добавлением насыщенного водного раствора гидрокарбоната. Смесь трижды экстрагируют дихлорметаном и объединенные органические слои упаривают под вакуумом. Неочищенный продукт подвергают хроматографии (дихлорметан/ацилоидин/метанол). ААБ.(7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(6-йод-2-окcaкаприлокси)-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К раствору 2,00 г (4,00 ммоль) (7R,8R,9R)-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-8-(6-хлор-2 оксакаприлокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]-нафтиридина в ацетоне добавляют 7,50 г (37,90 ммоль) йодида натрия и смесь перемешивают в течение 56 дней при 25 С. После этого смесь упаривают под вакуумом и очищают хроматографией (дихлорметан/метанол: 100/3) с получением соединения, указанного в заголовке (1,95 г/3,28 ммоль/82%) в виде гигроскопичной пены.MS (МеОН/Н 2O/НСООН: 80/20/0,1,+,ESI): m/z (%) = 594 (55) [М+Н]. ААВ. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(6-хлор-2-оксакаприлокси)-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К раствору 5,00 г (13,6 ммоль) (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 5,8 мл (42,00 ммоль) триэтиламина и 0,17 г (1,40 ммоль) диметилпиридина в дихлорметане (50 мл) добавляют 3,82 мл (27,2 ммоль) 4 хлорбутилхлорформиата и реакционную смесь перемешивают в течение 18 ч при 25 С. После этого смесь выливают на лед и дважды экстрагируют дихлорметаном. Объединенные органические слои упаривают под вакуумом. Неочищенный продукт подвергают хроматографии (этилацетат/петролейный эфир: 1/1) с получением соединения, указанного в заголовке (3,30 г/6,57 ммоль/48%) в виде бесцветного твердого вещества, т.пл. 123,5 С (этилацетат/петролейный эфир). ААГ. (7R,8R,9R)-2,3-Диметил-7-(2-метоксиэтокси)-9-фенил-8-(4-бромметилбензоилокси)-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. К раствору 5,00 г (13,6 ммоль) (7RR,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин, 4,46 мл (32,00 ммоль) триэтиламина и 0,17 г (1,40 ммоль) диметилпиридина в дихлорметане (50 мл) добавляют при -10 С 4,60 г (16,0 ммоль) 4 бромметилбензоилбромида и реакционную смесь перемешивают в течение 1 ч при -5 С. После этого смесь выливают на лед и дважды экстрагируют дихлорметаном. Объединенные органические слои промывают насыщенным раствором NaHCO3, упаривают под вакуумом и неочищенный продукт подвергают хроматографии (дихлорметан/метанол: 100/3) с получением соединения, указанного в заголовке (3,00- 26008167 г/5,31 ммоль/39%) в виде бесцветного твердого вещества. 1 Н-ЯМР (200 МГц, [d6] ДМСО):= 2,34 (d, 6H), 3,07-3,30 (m, 5 Н), 3,36-3,46 (m, 1 Н), 4,72-4,80 (m,3 Н), 4,92 (m, 1 Н), 5,68 (t, 1 Н), 6,49 (d, 1 Н), 7,19-7,29 (m, 3 Н), 7,80-7,87 (m, 2 Н). Промышленная применимость Соединения формулы 1 и их соли обладают ценными фармакологическими свойствами, обеспечивающими их коммерческую применимость. В частности, с одной стороны, их можно охарактеризовать как антагонисты кислотного насоса (АКН), имеющие меньше побочных эффектов, чем известные АКН сравнимой структуры. С другой стороны, их можно охарактеризовать как соединения с заметной активностью в отношении Helicobacter bacteria, имеющие меньше побочных эффектов, чем известные соединения, обладающие такой активностью. Кроме того, соединения формулы 1 можно охарактеризовать за счет их NО (окись азота) высвобождающей активности - как соединения с антибактериальной активностью, у которых действие против Helicobacter bacteria синергетически усиливается за счет подавляющего действия этих соединений на желудочный сок. Соединение формулы 1 проявляют заметное подавление желудочной секреции и превосходное защитное действие в отношении желудка и кишечника у теплокровных животных, в особенности человека. Соединения, предложенные в изобретении, отличаются высокой селективностью действия, полезной продолжительностью действия, особенно хорошей кишечной активностью, отсутствием значительных побочных эффектов и большой широтой терапевтического применения. В дополнение к этому, высокая активность соединений формулы 1 и их солей в отношении Helicobacter bacteria допускает их использование в лекарственных препаратах для людей в качестве активных соединений для лечения заболеваний,вызванных Helicobacter bacteria. В этой связи "желудочная и кишечная защита" понимается в значении профилактики и лечения желудочно-кишечных болезней, в особенности желудочно-кишечных воспалительных заболеваний и патологических изменений (таких как, например, язва желудка, язва желудка и двенадцатиперстной кишки,включая язвенное кровотечение, язва двенадцатиперстной кишки, гастрит, повышенная кислотность или функциональная диспепсия, связанная с лекарственными препаратами), которые могут быть вызваны,например, микроорганизмами (такими как Helicobacter pylori), бактериальными токсинами, лекарствамиNSAIDs и СОХ-ингибиторы), химическими веществами (например, этанол), желудочной кислотой или стрессовыми ситуациями. В соответствии с обычным уровнем знаний понятие "желудочная и кишечная защита" включает в себя гастроэзофагальную рефлюксную болезнь (ГЭРБ), симптомы которой включают, без ограничения перечисленных, изжогу и/или кислую отрыжку. По своим замечательным свойствам соединения, предложенные в данном изобретении, неожиданно оказались явно превосходящими соединения, известные в уровне техники, в различных моделях, в которых измерялись противоязвенные и противосекреторные свойства. Вследствие этих свойств соединения формулы 1 и их фармацевтически приемлымые соли исключительно подходят для применения в ветеринарных лекарственных препаратах, где они используются, в частности, для лечения и/или профилактики заболеваний желудка и кишечника. Следовательно, изобретение относится далее к способу лечения млекопитающих, в особенности человека, страдающих заболеваниями, вызванными повышенной кислотностью желудка и/или присутствием Helicobacter bacteria. Способ включает введение больному индивиду терапевтически эффективного и фармакологически переносимого количества одного или нескольких соединений формулы 1 и/или их фармакологически переносимых солей. Более того, изобретение относится к соединениям формулы 1 и их фармакологически переносимым солям для использования при лечении заболеваний, основанных на повышенной кислотности желудка и/или присутствии Helicobacter bacteria. Изобретение также включает применение соединений формулы 1 и их фармакологически переносимых солей в производстве лекарственных препаратов, которые применяют для контроля заболеваний,основанных на повышенной кислотности желудка и/или присутствии Helicobacter bacteria. Далее изобретение относится к лекарственным средствам для контроля Helicobacter bacteria, которые содержат одно или несколько соединений общей формулы 1 и/или их фармакологически переносимых солей. Среди штаммов Helicobacter, против которых оказались активными соединения формулы 1, прежде всего можно назвать штамм Helicobacter pylori. Таким образом, следующим объектом изобретения являются соединения, соответствующие изобретению, для использования при лечении и/или профилактики перечисленных выше заболеваний. Также изобретение включает применение соединений, соответствующих изобретению, для изготовления лекарственных средств, которые применяются при лечении и/или профилактики перечисленных выше заболеваний. Более того, изобретение включает применение соединений, соответствующих изобретению, для лечения и/или профилактики перечисленных выше заболеваний. Следующим объектом изобретения являются лекарственные средства, которые содержат одно или- 27008167 несколько соединений формулы 1 и/или их фармакологически переносимые соли. Лекарственные препараты изготавливаются способами, которые являются известными сами по себе и знакомы квалифицированному специалисту в данной области. В качестве лекарственных средств фармакологически активные соединения (= активные соединения), соответствующие изобретению, применяют либо как таковые, или предпочтительно в комбинации с подходящими фармацевтическими наполнителями или носителями в форме таблеток, таблеток, покрытых оболочкой, капсул, суппозиториев, пластырей (например, таких как трансдермальные терапевтические системы), эмульсий, суспензий или растворов, в которых содержание активного соединения преимущественно находится в интервале от 0,1 до 95%. При этом можно с помощью подходящего выбора носителя или наполнителя получить форму для фармацевтического введения, которая в точности подходит активному соединению и/или требуемому началу действия и/или продолжительности действия (например, форма с задержанным высвобождением или кишечная форма). Квалифицированному специалисту в данной области знакомы основанные на своих специальных знаниях носители и наполнители, которые подходят для желаемого фармацевтического препарата. В дополнение к растворителям, веществам, образующим гели, основам суппозиториев, наполнителям таблеток (связующим веществам) и другим носителям активных соединений возможно использование, например, антиоксидантов, диспергирующих веществ, эмульгаторов, противопенных веществ, летучих модификаторов лекарственных веществ, консервантов, солюбилизаторов, красящих веществ или, в частности,ускорителей проникновения и комплексообразователей (например, циклодекстринов). Активные соединения могут быть введены перорально, парентерально или чрескожно. В основном, в отношении лекарственных препаратов для людей доказано, что для получения желаемого результата предпочтительно вводить активное соединение(я) в случае перорального приема в суточной дозе от приблизительно 0,01 до приблизительно 20, предпочтительно от 0,05 до 5, в частности от 0,1 до 1,5 мг/кг массы тела, причем уместно в форме нескольких индивидуальных доз, предпочтительно от 2 до 4. В случае парентерального лечения могут быть применены подобные или (в частности,при внутривенном введении активных соединений), как правило, меньшие дозы. Любой квалифицированный специалист в данной области на базе своих специальных знаний может легко назначить дозу и метод введения активных соединений, необходимые в каждом конкретном случае. Если соединения, предложенные в данном изобретении, и/или их соли предназначены для лечения упомянутых выше заболеваний, фармацевтические препараты могут также содержать один или несколько фармакологически активных составляющих других фармацевтических групп. В качестве примеров можно упомянуть: транквилизаторы (например, из группы, содержащей бензодиазепины, например диазепам), спазмолитические средства (например, биэтамиверин или камилофин), противохолинергические препараты (например, оксифенциклимин или фенкарбамид), местные анестетики (например, тетракаин или прокаин), и при необходимости также ферменты, витамины или аминокислоты. Особенно следует выделить в этой связи комбинацию соединений, соответствующих изобретению,с фармацевтическими препаратами, ингибирующими секрецию кислоты, такими как, например, Н 2 блокаторы (например, циметидин, ранитидин) или ингибиторы Н+/K+ АТФ-азы (например, омепразол,лансопразол, рабепразол и, в особенности, пантопразол), или далее - с антагонистами желудочного секретина, с помощью которых возможно повышение основного действия в смысле добавления и супердобавления активности и/или исключения или уменьшения побочных эффектов, или далее - комбинацию с другими антибактериально активными веществами (такими как, например, цефалоспорины, тетрациклины, пенициллины, макролиды, нитроимидазолы или альтернативно соли висмута) для контролированияHelicobacter pylori. Можно назвать такие антибактериально активные компоненты комбинации, как, например, мезлоциллин, ампициллин, амоксициллин, цефалотин, цефокситин, цефотаксим, имипенем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин, азитромицин и их комбинации (например, кларитромицин + метронидазол). С точки зрения превосходного желудочного и кишечного защитного действия, соединения формулы 1 подходят для свободной или связанной комбинации с теми лекарственными препаратами (например, определенными противовоспалительными и противоревматоидными, такими как нестероидные противовоспалительные лекарственные вещества), для которых известна определенная ульцерогенная эффективность. Кроме этого, соединения формулы 1 подходят для свободной или связанной комбинации с лекарствами, модифицирующими сократительную способность. Фармакология Превосходное защитное действие в отношении желудка и ингибирующая активность соединений,предложенных в изобретении, в отношении желудочной секреции могут быть продемонстрированы в исследованиях на экспериментальных моделях животных. Соединениям, соответствующим изобретению, которые испытывали в моделях, указанных ниже, были присвоены номера, соответствующие номерам этих соединений в примерах. Тестирование секреторной-ингибирующей активности на перфузном желудке крысы. В табл. А, представленной ниже, показано влияние соединений, предложенных в изобретении, после внутривенного введения на секрецию кислоты перфузным желудком крысы, стимулированную пен- 28008167 тагастрином, in vivo. Таблица А Методика Брюшную полость анестезированных крыс (крысы CD, самки, 200-250 г; 1,5 г/кг уретана внутримышечно) открывают после трахеотомии посредством срединного верхнего абдоминального рассечения и катетер из поливинилхлорида закрепляют в пищеводе трансорально, а другой катетер - через привратник, таким образом, чтобы концы трубок выступали как раз в полость желудка. Катетер, выходящий из привратника выводят наружу через боковое отверстие в правой абдоминальной стенке. После тщательного промывания (приблизительно 50-100 мл) через желудок непрерывно подают теплый физиологический раствор NaCl при 37 С (0,5 мл/мин, рН 6,8-6,9; Braun-Unita I). Определяют рН(рН-метр 632, стеклянный электрод ЕА 147; =5 мм, Metrohm) и с помощью титрования раствора свежеприготовленным раствором 0,01 н. NaOH до рН 7 (Dosimat 665 Metrohm) - секретированную НСl в вытекающем потоке, который в каждом случае собирают с интервалом 15 мин. Желудочную секрецию стимулируют непрерывной перфузией 1 мкг/кг (= 1,65 мл/ч) пентагастрина внутривенно (в левую бедренную вену) приблизительно 30 мин после окончания операции (т.е. после исследования двух подготовительных фракций). Вещества, подлежащие тестированию, вводят внутридуоденально в количестве 2,5 мл/кг объема жидкости через 60 мин после начала непрерывной инфузии пентагастрина. Температуру тела животных поддерживают постоянной 37,8-38 С с помощью инфракрасного облучения и обогрева лапок (автоматический плавный контроль при помощи датчиков ректальной температуры). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы 1 в которой R1 обозначает метил,R2 обозначает водород, метил или хлор,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает гидроксил, метокси-,этокси-, гидроксиэтокси-, метоксиэтокси- или метоксиэтоксиэтоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-O-(CH2)x-ONO2, -O-C(O)-C6H4-CH2-O-NO2 или -O-C2H4-(CH2)x-O-NO2,в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил, аR3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает метоксиэтоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2 или -O-C(O)-O-(CH2)xO-NO2, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иR1 обозначает метил,R2 обозначает метил,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4 алкокси-C1C4 алкоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2, -O-C(O)-C6H4-CH2-ONO2 или -O-C(O)-O-(CH2)x-O-NO2, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иR1 обозначает метил,R2 обозначает метил,R3a обозначает водород,R3b обозначает водород,один из заместителей R4a и R4b обозначает водород, а другой обозначает C1-C4 алкокси-C1C4 алкоксигруппу,R5a обозначает радикал R53, где R53 обозначает -O-C(O)-CH2-(CH2)x-O-NO2 или -O-C(O)-O-(CH2)xO-NO2, в котором х означает целое число от 2 до 4,R5b обозначает водород,Arom обозначает фенил иX обозначает О (кислород) или NH,и их соли. 6. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически приемлемую соль вместе с обычными фармацевтическими наполнителями и/или носителями. 7. Применение соединений по п.1 и их фармакологически приемлемых солей для профилактики и лечения желудочно-кишечных заболеваний.
МПК / Метки
МПК: C07D 221/00, C07D 471/14, C07D 311/00, C07D 235/00, A61K 31/436, C07D 491/14, A61P 1/00, A61K 31/437
Метки: нитрозированные, имидазопиридины
Код ссылки
<a href="https://eas.patents.su/30-8167-nitrozirovannye-imidazopiridiny.html" rel="bookmark" title="База патентов Евразийского Союза">Нитрозированные имидазопиридины</a>
Предыдущий патент: Производные азобициклооктанов и нонанов обладающие активностью в ингибировании dpp – iv
Следующий патент: Способ получения карбапенемовых соединений
Случайный патент: Дисплей