Карбаматные ингибиторы каспазы и их использование
Номер патента: 5740
Опубликовано: 30.06.2005
Авторы: Беббингтон Дэвид, Голек Джулиан, Мортимор Майкл, Кэй Дэвид, Шаррьер Жан-Дамиен, Стадли Джон, Негтел Рональд
Формула / Реферат
1. Соединение формулы I
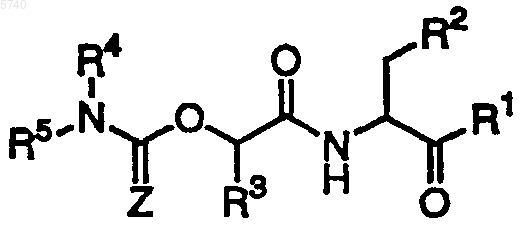
или его фармацевтически приемлемое производное,
где Z представляет кислород;
R1 представляет -CH2Y;
Y представляет галоген;
R2 представляет CO2H, его сложные эфиры, амиды;
R3 представляет C1-C4алкил и
R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола, индолина, карбазола, фенотиазина, 5H-дибензо[b,f]азепина, 10,11-дигидро-5H-дибензо[b,f]азепина и дигидрофенантридина, необязательно замещенных до 2 заместителями, выбранными из галогена, трифторметила или C1-C6 алифатической группы.
2.Соединение по п.1 где R1 представляет -CH2F.
3. Соединение по п.1, где R2 представляет -CO2H.
4. Соединение по п.1, где R3 представляет этил, изопропил или трет.бутил.
5. Соединение по п.4, где R3 представляет изопропил.
6. Соединение по п.1, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола, карбазола или фенотиазина, необязательно замещенных до 2 заместителями, выбранными из галогена, трифторметила или C1-C6 алифатической группы.
7. Соединение по п.6, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола, карбазола или фенотиазина, необязательно замещенных до 2 атомами хлора.
8. Соединение по п.7, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола или карбазола, необязательно замещенных до 2 атомами хлора.
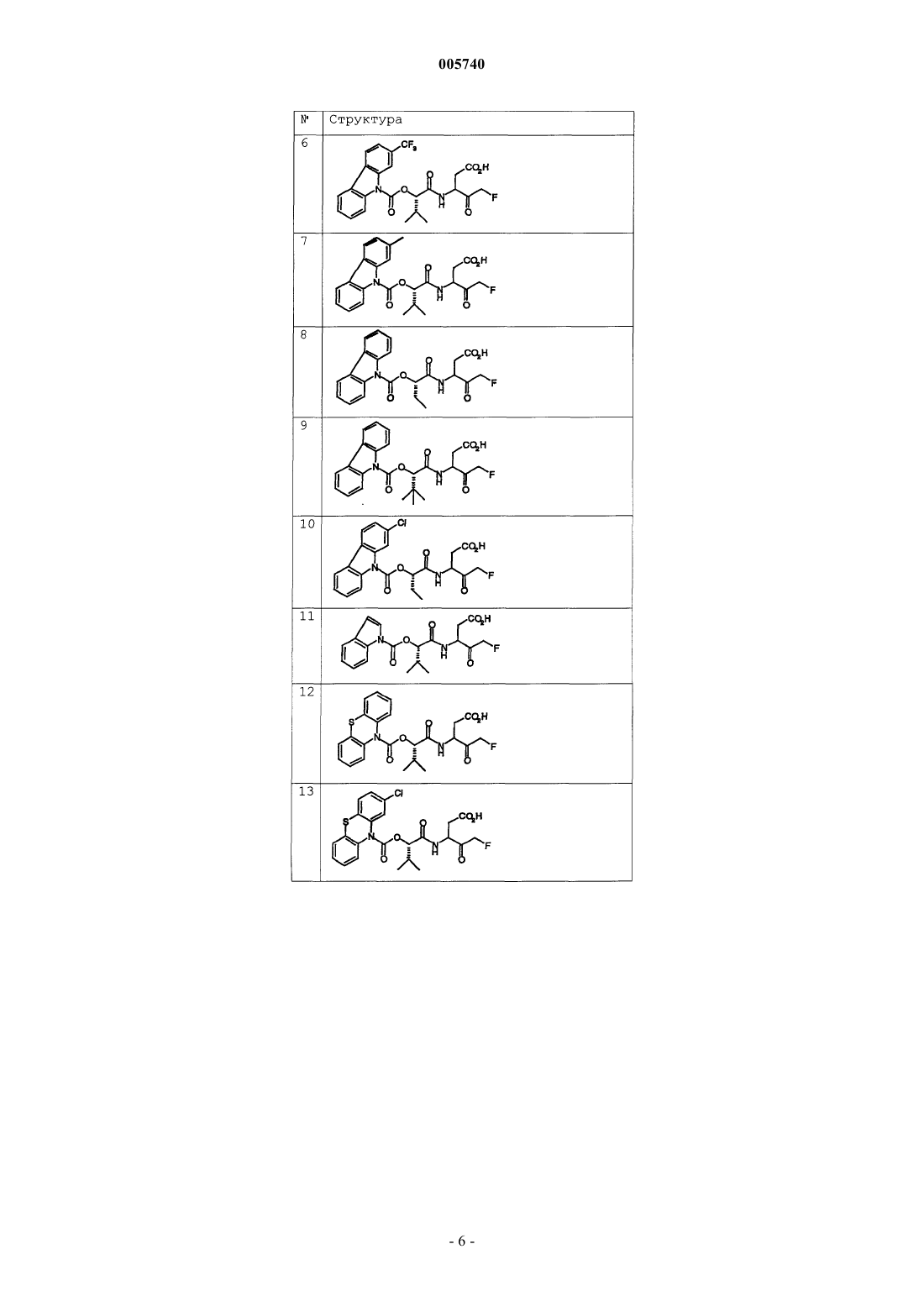
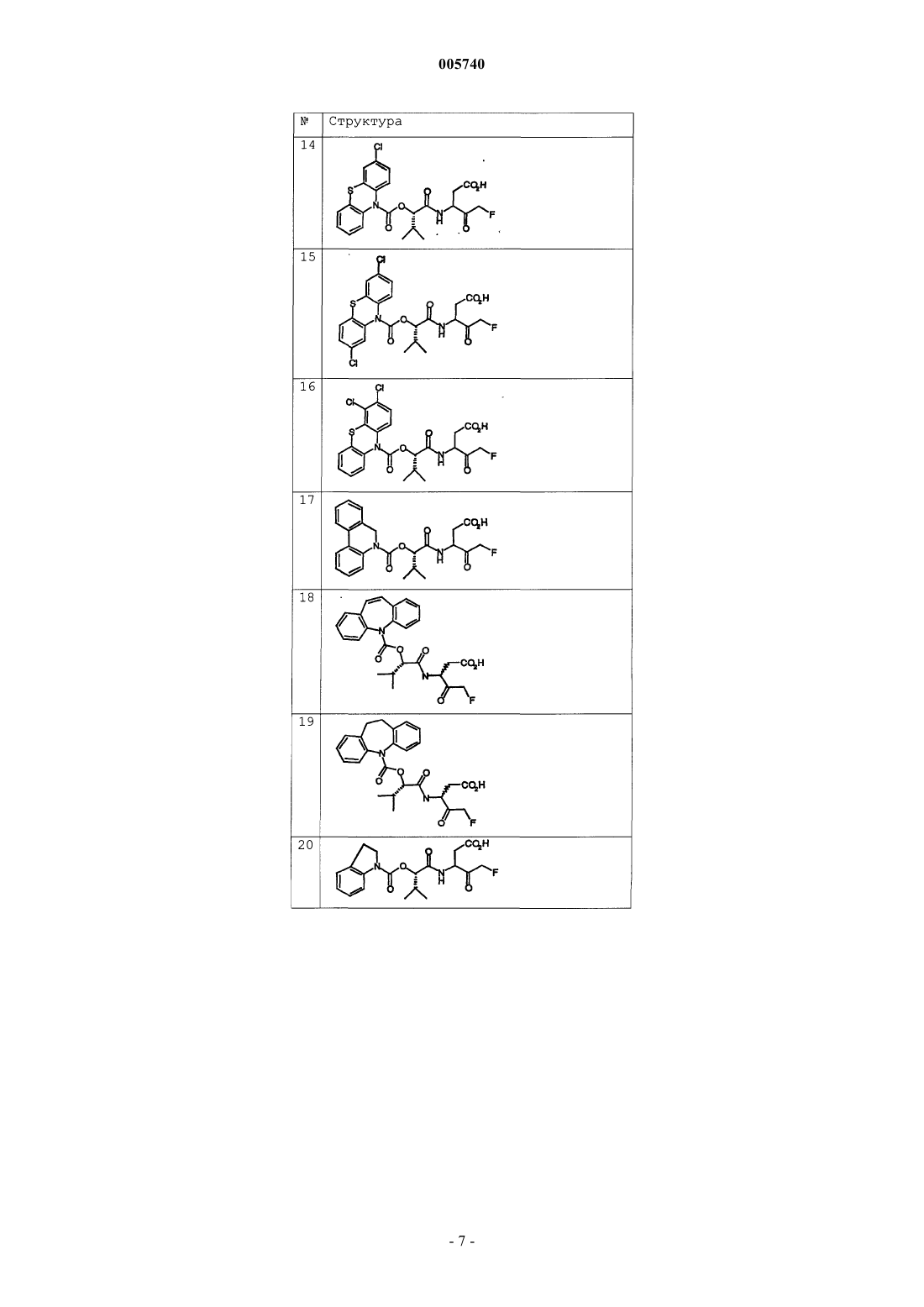
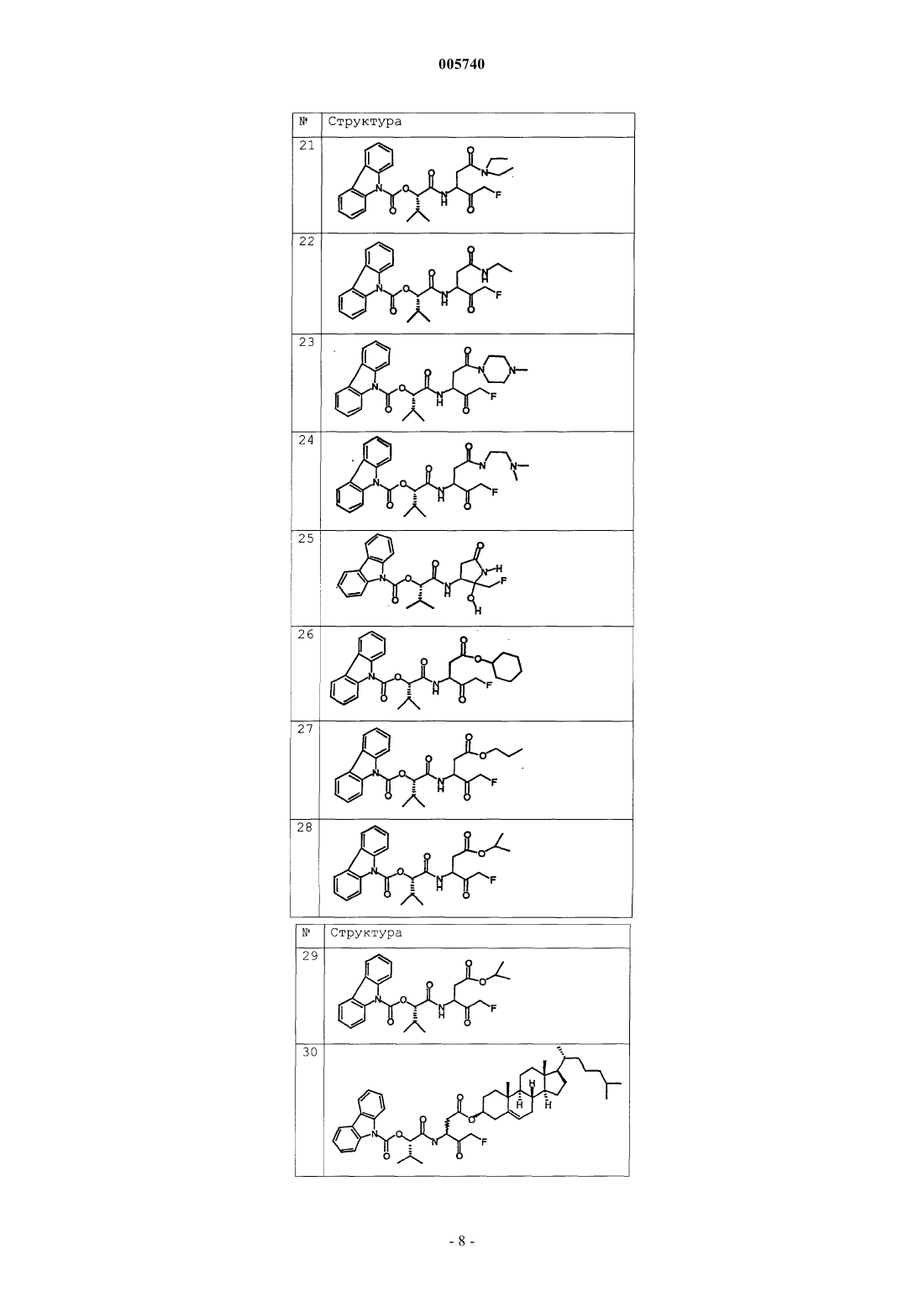
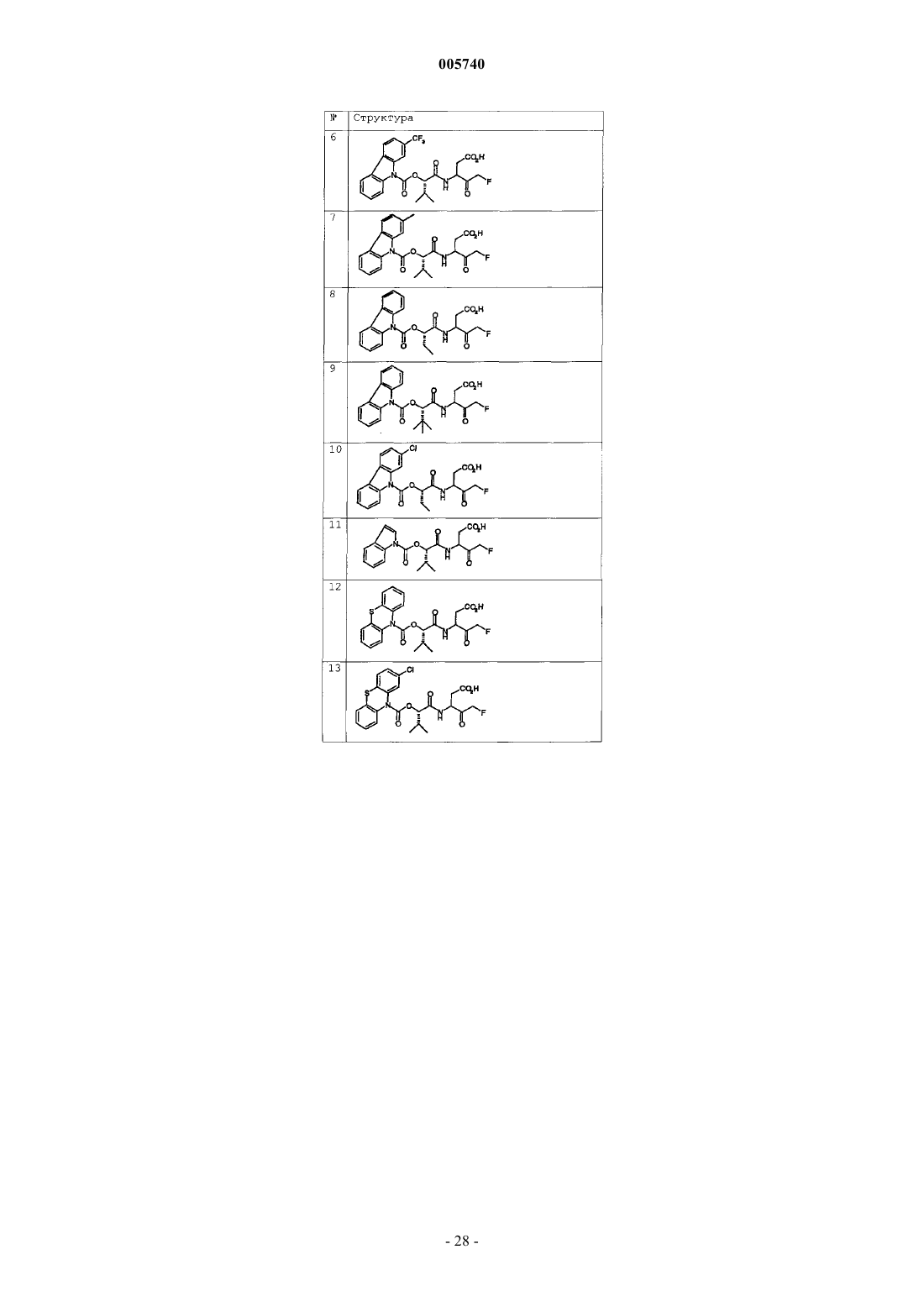
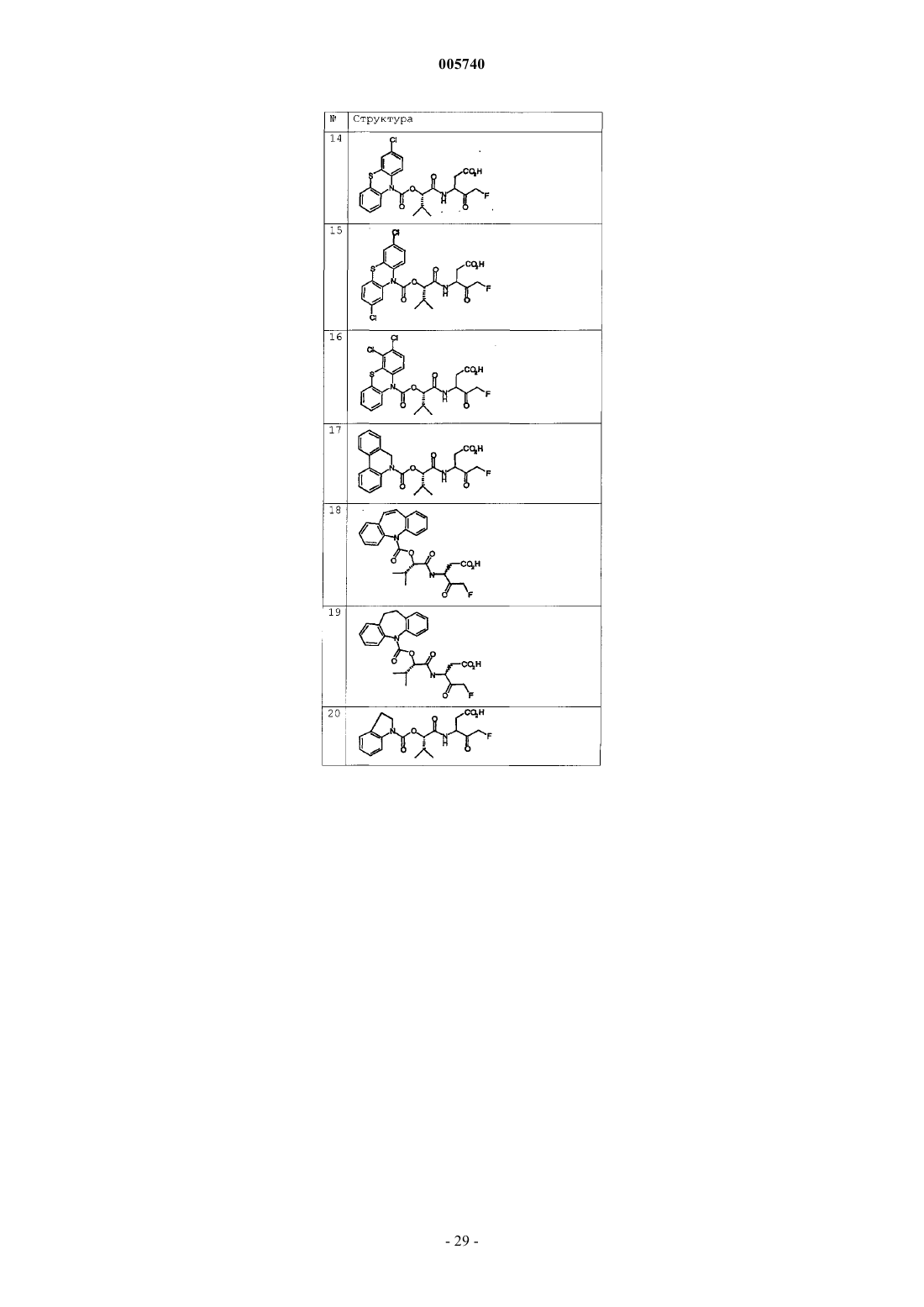
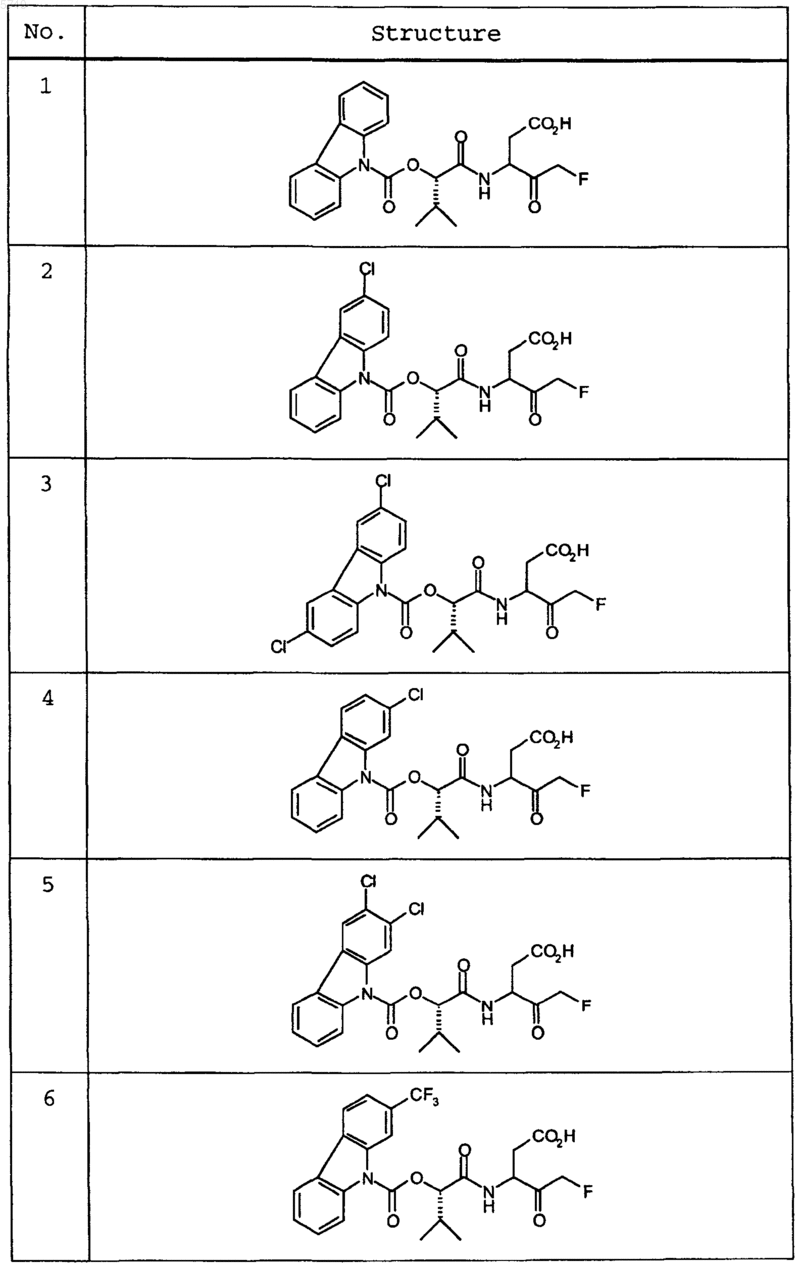
9. Соединение по п.1, которое выбрано из следующих соединений:
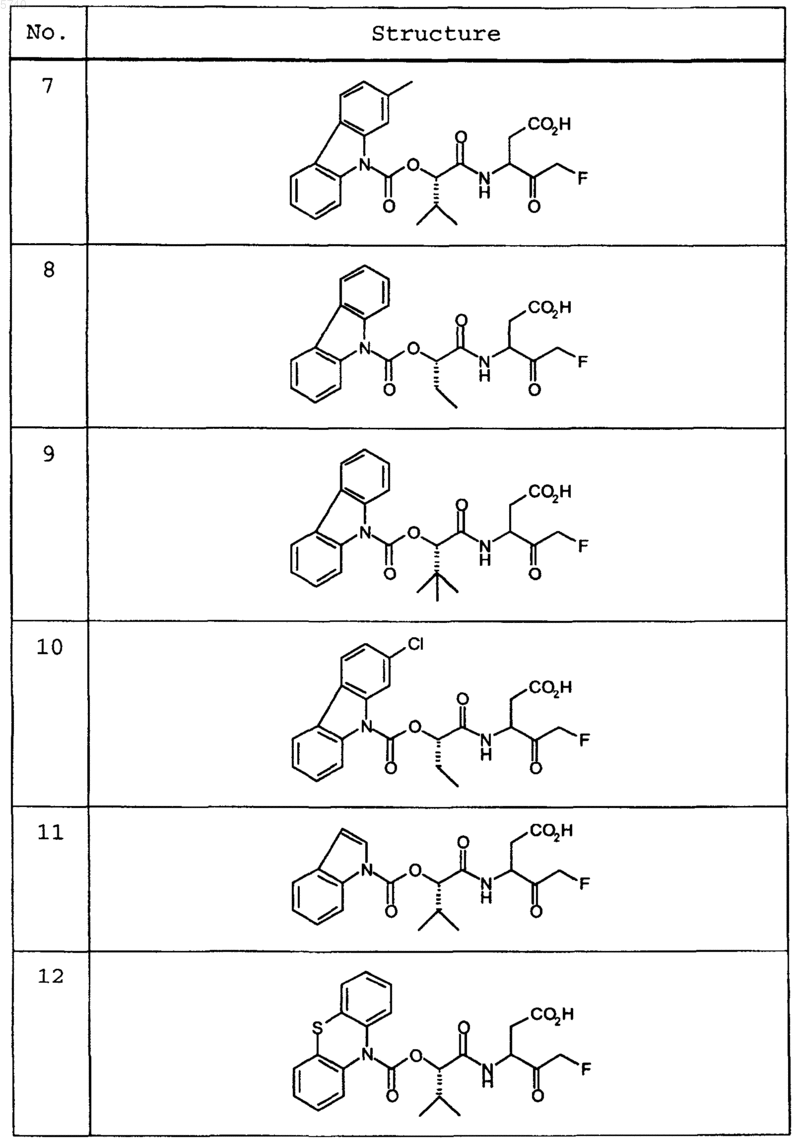
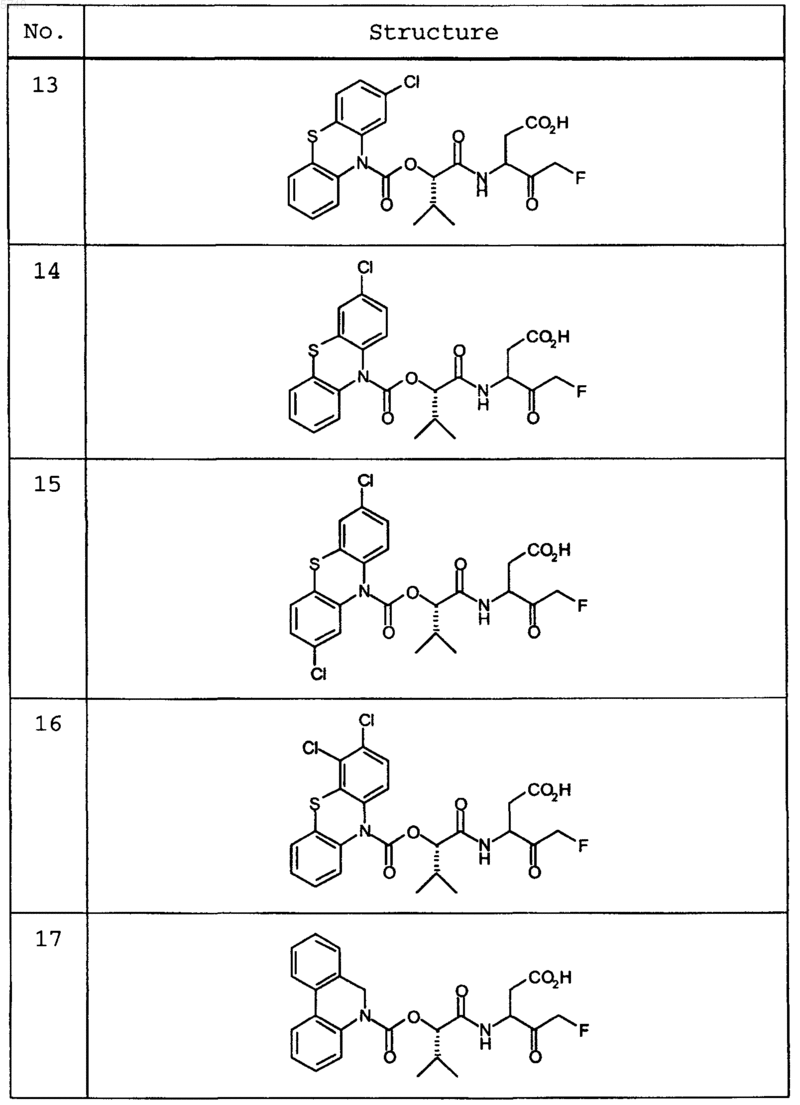
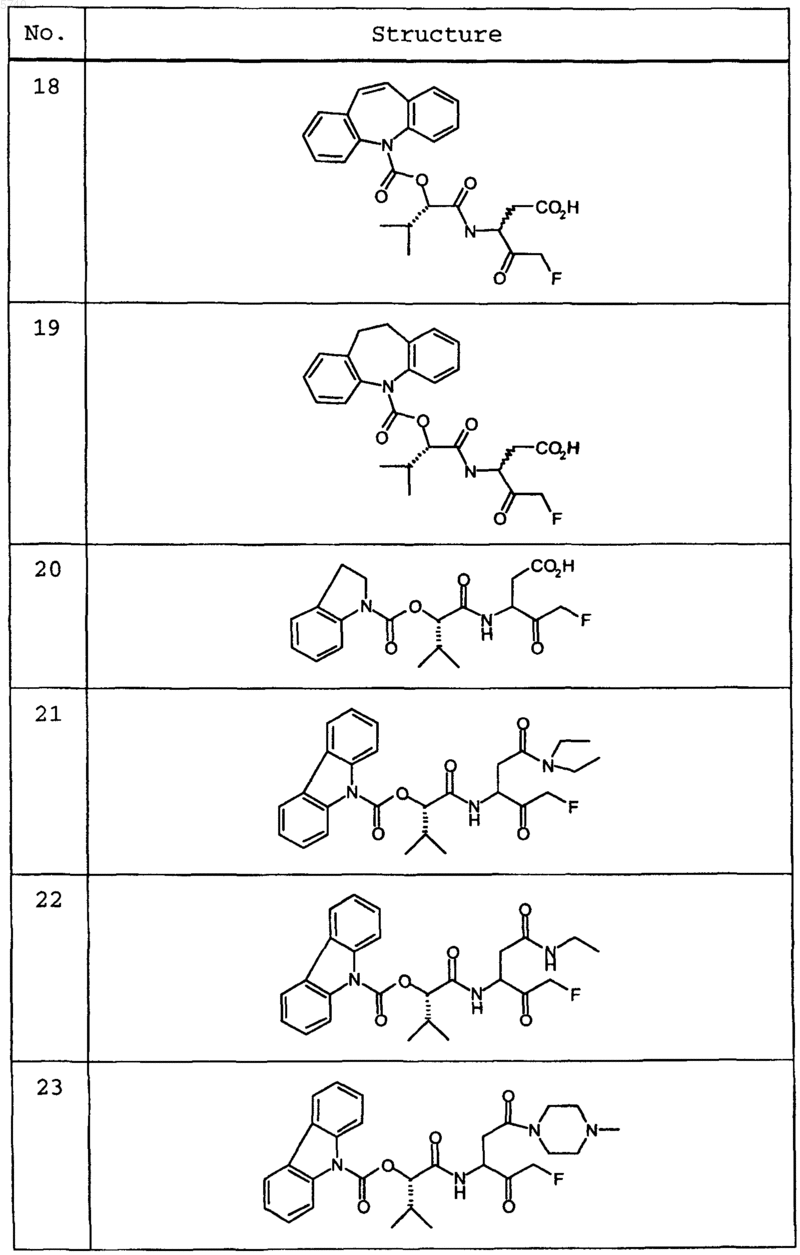


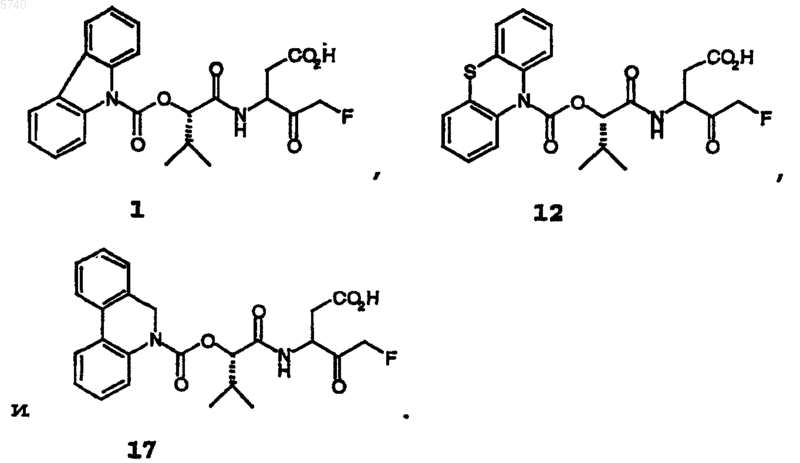
10. Соединение по п.9, выбранное из
11. Фармацевтическая композиция для ингибирования активности каспазы, включающая соединение по любому из пп.1-10 и фармацевтически приемлемый носитель.
12. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 для лечения или профилактики заболевания, выбранного из IL-1-опосредованного заболевания, опосредованного апоптозом заболевания, воспалительного заболевания, аутоиммунного заболевания, деструктивного костного нарушения, пролиферативного нарушения, инфекционного заболевания, дегенеративного заболевания, заболевания, ассоциированного с гибелью клеток, заболевания, связанного с избыточным потреблением пищевого спирта, опосредованного вирусами заболевания, увеита, воспалительного перитонита, остеоартрита, панкреатита, астмы, респираторного дистресс-синдрома взрослых, гломерулонефрита, ревматоидного артрита, системной красной волчанки, склеродермы, хронического тиреоидита, болезни Грейва, аутоиммунного гастрита, диабета, аутоиммунной гемолитической анемии, аутоиммунной нейтропении, тромбоцитопении, хронического активного гепатита, тяжелой псевдопаралитической миастении, воспалительного заболевания кишечника, болезни Крона, псориаза, атопического дерматита, рубцевания, гомологичной болезни ("трансплантат против хозяина"), отторжения органа-трансплантата, остеопороза, лейкоза и родственных заболеваний, миелодиспластического синдрома, костного нарушения, относящегося к множественной миеломе, острого миелоидного лейкоза, хронического миелоидного лейкоза, метастатической меланомы, саркомы Капоши, множественной миеломы, геморрагического шока, сепсиса, септического шока, ожогов, шигеллеза, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, болезни Кеннеди, заболевания, вызванного белком прионом, церебральной ишемии, эпилепсии, ишемии миокарда, острой и хронической болезни сердца, инфаркта миокарда, застойной сердечной недостаточности, атеросклероза, трансплантации обходного шунта каронарной артерии, спинальной мышечной атрофии, бокового амиотрофического склероза, рассеянного склероза, ВИЧ-относящегося энцефалита, старения, алопеции, неврологического повреждения вследствие удара, неспецифического язвенного колита, травматического повреждения головного мозга, повреждения спинного мозга, гепатита B, гепатита C, гепатита G, желтой лихорадки, лихорадки денге или японского энцефалита, различных форм заболеваний печени, почечного заболевания, полиаптического заболевания почек, связанной с H. pylori язвенной болезни желудка и двенадцатиперстной кишки, ВИЧ-инфекции, туберкулеза, менингита, лечения осложнений, связанных с трансплантациями обходных шунтов коронарных артерий, или иммунотерапии для лечения различных форм рака.
13. Фармацевтическая композиция по п.12, для лечения осложнений, связанных с трансплантациями обходных шунтов коронарных артерий.
14. Фармацевтическая композиция для использования в способе консервации клеток, который включает стадию промывания клеток в растворе соединения или его фармацевтически приемлемого производного, включающая соединение по любому из пп.1-10 в качестве активного ингредиента.
15. Фармацевтическая композиция для консервации органа-трансплантата или продуктов крови, включающая соединение или его фармацевтически приемлемые производные по любому из пп.1-10 в качестве активного ингредиента.
16. Фармацевтическая композиция по п.12 для иммунотерапии при лечении рака.
Текст
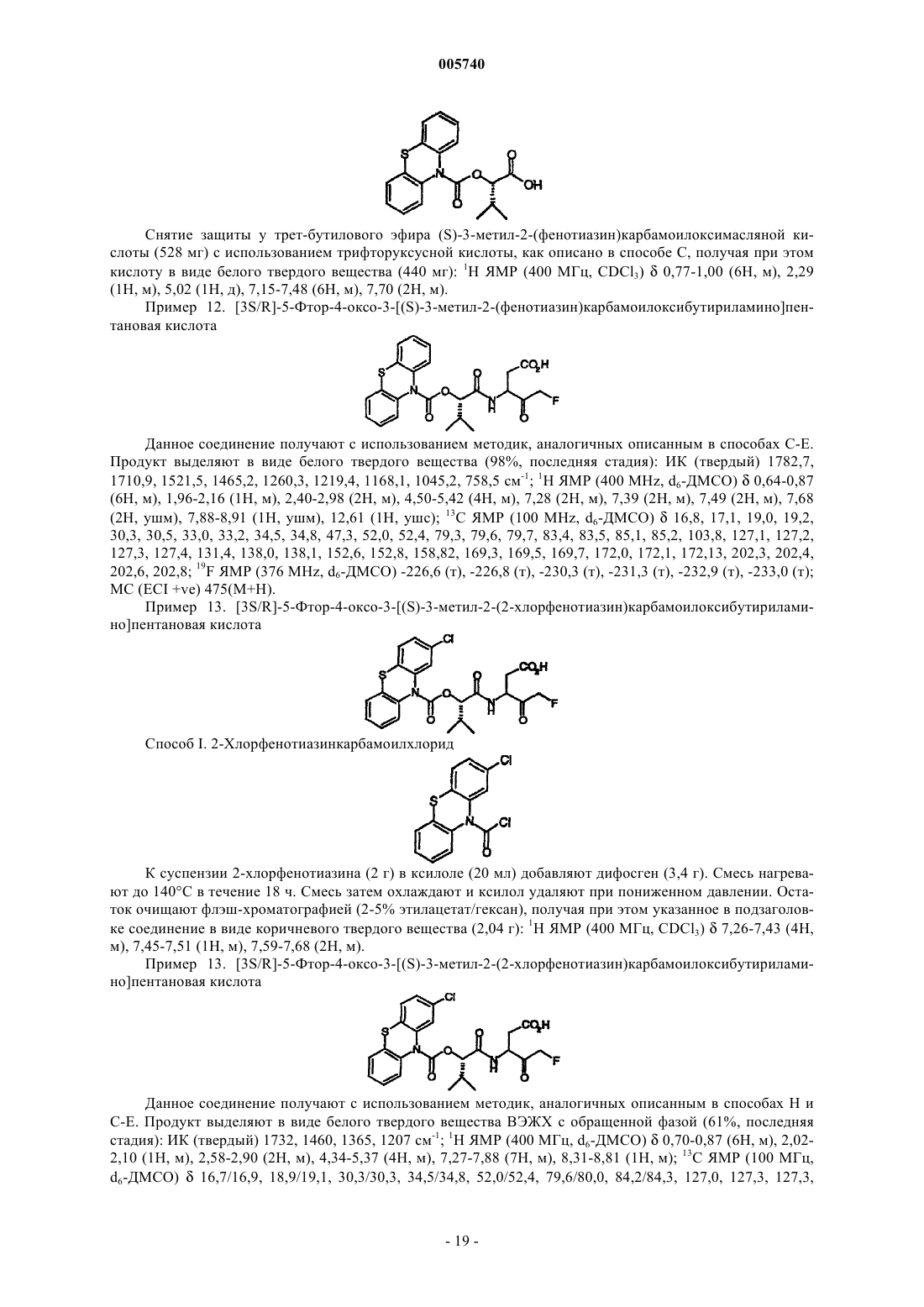
005740 Родственные заявки По данной заявке испрошен приоритет по заявке на предварительный патент США 60/192826, зарегистрированной 29 марта 2000. Область изобретения Данное изобретение относится в области медицинской химии и относится к новым соединениям и их фармацевтическим композициям, которые ингибируют каспазы, которые опосредуют апоптоз клеток и воспаление. Изобретение относится также к способам использования соединений и фармацевтических композиций данного изобретения для лечения заболеваний, которые ассоциируются с активностью каспазы. Предпосылки создания изобретения Апоптоз или запрограммированная гибель клеток является основным механизмом, по которому организмы ликвидируют нежелательные клетки. Нарушение регуляции апоптоза, либо чрезмерный апоптоз, либо недостаток его, имеет место при ряде заболеваний, таких как рак, острые воспалительные и аутоиммунные нарушения, ишемические заболевания и некоторые нейродегенеративные нарушения (см. в общем Science, 1998, 281, 1283-1312; Ellis et al., Ann. Rev. Cell. Biol., 1991, 7, 663). Каспазы являются семейством ферментов цистеинпротеаз, которые являются ключевыми медиаторами в путях передачи сигналов для апоптоза и ликвидации скопления клеток (Thornberry, Chem. Biol. 1998, 5, R97-R103). Эти пути передачи сигналов изменяются в зависимости от типа клеток и стимула, но все пути апоптоза, как оказалось, сходятся у общего эффекторного пути, приводящего к протеолизу ключевых белков. Каспазы участвуют как в эффекторной фазе передачи сигналов, так и, кроме того, в предшествующих событиях при его инициации. Каспазы предшествующих событий, участвующие в событиях инициации, становятся активированными и, в свою очередь, активируют другие каспазы, которые участвуют в поздних фазах апоптоза. Каспаза-1, первая идентифицированная каспаза, известна также как превращающий интерлейкин фермент или ICE. Каспаза-1 превращает предшественник интерлейкина-1- (pIL-1) в провоспалительную активную форму специфическим расщеплением pIL-1 между Аsp-116 и Ala-117. Кроме каспазы-1 имеется также одиннадцать других известных каспаз человека, все из которых расщепляют специфически у остатков аспартила. Замечено также, что они имеют строгую потребность по меньшей мере в четырех аминокислотных остатках в N-концевой области сайта расщепления. Каспазы классифицированы на три группы в зависимости от аминокислотной последовательности,которая распознается предпочтительно или в первую очередь. Обнаружено, что группа каспаз, которая включает каспазы 1, 4 и 5, имеет предпочтительно гидрофобные ароматические аминокислоты в положении 4 в N-концевой области сайта расщепления. Другая группа, которая включает каспазы 2, 3 и 7,распознает аспартильные остатки в обоих положениях 1 и 4 в N-концевой области сайта расщепления и предпочтительно последовательность Asp-Glu-X-Asp. В третьей группе, которая включает каспазы 6, 8, 9 и 10, допускаются многие аминокислоты в первичной последовательности распознавания, но, повидимому, предпочтительны остатки с разветвленными алифатическими боковыми цепями, такими как валин и лейцин в положении 4. Каспазы были также сгруппированы в соответствии с их воспринимающей функцией. Первое подсемейство состоит из каспаз-1 (ICE), 4 и 5. Обнаружено, что данные каспазы участвуют в провоспалительном процессинге цитокина и, следовательно, играют важную роль в воспалении. Каспаза-1, наиболее изученный фермент этого класса, активирует предшественник IL-1 протеолитическим расщеплением. Данный фермент следовательно играет ключевую роль в воспалительной реакции. Каспаза-1 участвует также в процессинге гамма индуцирующего фактора интерферон (IGIF или IL-18), который стимулирует продуцирование гамма интерферона, ключевого иммунорегулятора, который модулирует представление антигена, активацию Т-клеток и клеточную адгезию. Остальные каспазы образуют второе и третье подсемейства. Эти ферменты имеют основное значение во внутриклеточных путях передачи сигнала, приводящего к апоптозу. Одно подсемейство состоит из ферментов, участвующих в событиях инициации в апоптозном пути, включая трансдукцию сигналов от мембраны плазмы. Члены указанного подсемейства включают каспазы 2, 8, 9 и 10. Другое подсемейство, состоящее из эффекторных каспаз 3, 6 и 7, участвует в конечных последующих событиях расщепления, которые приводят к систематическому разрушению и гибели клеток апоптозом. Каспазы, участвующие в предшествующей трансдукции сигнала, активируют каспазы последующих событий, которые затем повреждают механизмы репарации ДНК, фрагментируют ДНК,удаляют мантию клеточного цитоскелета и, наконец, фрагментируют клетку. Для субстратов ферментов определили последовательность из четырех аминокислот, распознаваемую, главным образом, каспазами. Talanian et al., J. Biol. Chem. 272, 9677-9682 (1997); Thornberry et al.,J. Biol. Chem. 272, 17907-17911 (1997). Знание последовательности из четырех аминокислот, распознаваемой, главным образом, каспазами, использовали для разработки ингибиторов каспаз. Получены обратимые тетрапептидные ингибиторы, имеющие структуру СН 3 СО-[Р 4]-[Р 3]-[Р 2]-СН(R)CH2CO2H, где Р 2 Р 4 представляют оптимальную аминокислотную последовательность распознавания и R представляетThornberry, Chem. Biol. 4, 149-155 (1997); Mjalli, et al., Bioorg. Med. Chem. Lett. 3, 2689-2692 (1993); Nicholson et al., Nature 376, 37-43 (1995). Получены необратимые ингибиторы на основе аналогичной тетрапептидной последовательности распознавания, где R представляет ацилоксиметилкетон - COCH2OCOR'. Примером R' является необязательно замещенный фенил, такой как 2,6-дихлорбензоилокси, и R представляет COCH2X, где Х представляет уходящую группу, такую как F или Сl. Thornberry et al., Biochemistry 33, 3934 (1994); Dolle et al., J. Med. Chem. 37, 563-564 (1994). Использование ингибиторов каспазы для лечения различных заболеваний млекопитающих, связанных с повышением клеточного апоптоза, было показано с использованием пептидных ингибиторов каспазы. Например, на моделях грызунов было показано, что ингибиторы каспазы уменьшают размер инфаркта и ингибирут апоптоз кардиомиоцитов после инфаркта миокарда, уменьшают объем ранки и неврологический дефицит, являющийся результатом удара, уменьшают послетравматический апоптоз и неврологический дефицит при травматическом повреждении головного мозга, являются эффективными при лечении внезапного и быстрого разрушения печени и повышают выживаемость после эндотоксического шока. Yaoita et al., Circulation, 97, 276 (1998); Endres et al., J Cerebral Blood Flow and Metabolism, 18,238, (1998); Cheng et al., J. Clin. Invest., 101, 1992 (1998); Yakovlev et al., J Neuroscience, 17, 7415 (1997);Rodriquez et al., J. Exp. Med., 184, 2067 (1996); Grobmyer et al., Mol. Med., 5, 585 (1999). В общем, пептидные ингибиторы, описанные выше, являются очень сильнодействующими против некоторых из ферментов каспаз. Однако эта активность не всегда отражалась на клеточных моделях апоптоза. Кроме того, пептидные ингибиторы обычно характеризуются нежелательными фармакологическими свойствами, такими как низкая пероральная абсорбция, низкая стабильность и быстрый метаболизм. Plattner and Norbeck, in Drug Discovery Technologies, Clark and Moos, Eds. (Ellis Horwood, Chichester,England, 1990). Имеются сообщения о модифицированных пептидных ингибиторах. В WO 91/15577 и WO 93/05071 описаны пептидные ингибиторы ICE формулыZ-Q2-Asp-Q1 где Z представляет N-концевую защитную группу; Q2 представляет от 0 до 4 аминокислот и Q1 представляет электроотрицательную уходящую группу. В WO 99/18781 описаны дипептидные ингибиторы каспазы формулы где R1 представляет N-концевую защитную группу; АА представляет остаток природной-аминокислоты или -аминокислоты, R2 представляет водород или CH2R4, где R4 представляет электроотрицательную уходящую группу и R3 представляет алкил или водород. В WO 99/47154 описаны дипептидные ингибиторы каспазы формулы где R1 представляет N-концевую защитную группу; АА представляет остаток неприродной-аминокислоты или -аминокислоты и R2 представляет, необязательно, замещенный алкил или водород. В WO 00/023421 описаны (замещенный)ацилдипептидные ингибиторы апоптоза, имеющие формулу где n равно 0, 1 или 2; q равно 1 или 2; А представляет остаток определенной природной или неприродной аминокислоты; В представляет атом водорода, атом дейтерия, алкил с C1-10-неразветвленной или разветвленной цепью, циклоалкил, фенил, замещенный фенетил, нафтил, замещенный нафтил,2-бензоксазолил, замещенный 2-оксазолил, (СН 2)mциклоалкил, (CH2)mфенил, (СН 2)m(замещенный фенил), (CH2)m-(1- или 2-нафтил), (СН 2)mгетероарил, галогенметил, CO2R13, CONR14R15, CH2ZR16,СН 2 ОСОарил, СН 2 ОСО(замещенный арил), CH2OCO(гетероарил), CH2OCO(замещенный гетероарил) или СН 2OРО(R17)R18, где R13, R14, R15, R16, R17 и R18 имеют значения, указанные в заявке; R2 выбран из группы, состоящей из водорода, алкила, циклоалкила, фенила, замещенного фенила, (CH2)mNH2; R3 представляет водород, алкил, циклоалкил, (циклоалкил)алкил, фенилалкил или замещенный фенилалкил; Х представляет CH2, С=O, О, S, NH, C=ONH или CH2OCONH; и Z представляет атом кислорода или серы. В WO 97/24339 описаны ингибиторы превращающего интерлейкин-1 фермента формулы где R1 представляет Н, алкил, алкокси, карбоцикл, гетероцикл и различные другие группы; АА 1 и АА 2 представляют простые связи или аминокислоты и Y представляет группу формулыR-A1-A2-X-A3 где R представляет Н, защитную группу или необязательно замещенный в кольце PhCH2O; A1 представляет остаток -гидрокси- или -аминокислоты, A2 представляет остаток -гидроксикислоты или-аминокислоты или A1 и А 2 вместе образуют псевдодипептид или имитирующий дипептид остаток; Х представляет остаток, образованный из Asp, где А 3 представляет CH2X1COY1, CH2OY2, CH2SY3 или СН 2(СО)mY6, где X1 представляет О или S, m равно 0 или 1 и Y1, Y2, Y3 и Y6 представляют необязательно замещенные циклоалифатические или арильные группы. В WO 98/16502 описаны, среди прочего, ингибиторы ICE формулы где R1 и R2 имеют значения, описанные в заявке, и кольцо пирролидина замещено различными группами. Хотя описан ряд ингибиторов каспаз, не ясно, обладают ли они подходящими фармакологическими свойствами, чтобы быть терапевтически полезными. Следовательно, продолжает существовать потребность в ингибиторах каспаз в виде небольших молекул, которые являются сильнодействующими, стабильными и проникают через мембраны, обеспечивая при этом эффективное ингибирование апоптоза invivo. Такие соединения могут быть в высшей степени полезными при лечении указанных выше заболеваний, в которых играют роль ферменты каспазы. Краткое изложение сущности изобретения В настоящее время обнаружено, что соединения данного изобретения и фармацевтические композиции эффективны в качестве ингибиторов каспазы и на клеточных моделях апоптоза. Данные соединения имеют общую формулу IR4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола,индолина, карбазола, фенотиазина, 5 Н-дибензо[b,f]азепина, 10,11-дигидро-5 Н-дибензо[b,f]азепина и дигидрофенантридина, необязательно замещенных до 2 заместителями, выбранными из галогена, трифторметила или C1-C6 алифатической группы. Соединения данного изобретения обладают ингибирующими свойствами в отношении всего диапазона целевых каспаз с хорошей эффективностью на клеточных моделях апоптоза. Кроме того, указанные соединения могут иметь хорошую клеточную проницаемость и фармакинетические свойства и, как следствие их активности, имеют хорошую эффективность против заболеваний, в которых участвуют каспазы. Подробное описание изобретения Данное изобретение относится к новым соединениям и их фармацевтически приемлемым производным, которые являются полезными в качестве ингибиторов каспаз. Изобретение относится также к способам применения соединений для ингибирования активности каспаз и для лечения опосредованных каспазами болезненных состояний. Данные соединения имеют общую формулу IR4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола,индолина, карбазола, фенотиазина, 5 Н-дибензо[b,f]азепина, 10,11-дигидро-5 Н-дибензо[b,f]азепина и дигидрофенантридина, необязательно замещенных до 2 заместителями, выбранных из галогена, трифторметила или C1-C6 алифатической группы. Используемые в данном описании термины имеют следующие определения, если не оговорено особо. Используемый термин алифатический означает С 1-С 12-углеводороды с неразветвленной или разветвленной цепью, которые являются полностью насыщенными или которые содержат одну или несколько единиц ненасыщенности. Например, подходящие алифатические группы включают замещенные или незамещенные, неразветвленные, разветвленные или циклические алкильные, алкенильные или алкинильные группы и их производные, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил. Термин галоген означает F, Cl, Вr или I. Термины алифатический, алкил относятся к замещенным или незамещенным группам. Когда данные группы замещены, они могут содержать один или несколько заместителей. Примеры подходящих заместителей включают галоген, -R, -OR, -ОН, -SH, -SR, защищенный ОН (такой как ацилокси), фенил (Ph), замещенный Ph, -OPh, замещенный -OPh, -NO2, -CN, -NH2, -NHR, -N(R)2, -NHCOR,-NHCONHR, -NHCON(R)2, -NRCOR, -NHCO2R, -CO2R, -CO2H, -COR, -CONHR, -CON(R)2, -S(O)2R,-SONH2, -S(O)R, -SO2NHR, -NHS(O)2R, =O, =S, =NNHR, =NNR2, =N-OR, =NNHCOR, =NNHCO2R,=NNHSO2R или =NR, где R представляет алифатическую группу или замещенную алифатическую группу. Замещаемый азот в гетероциклическом кольце может быть необязательно замещен. Подходящие заместители на азоте включают R, COR, S(O)2R и CO2R, где R представляет алифатическую группу или замещенную алифатическую группу. Азот и сера могут быть в их окисленной форме и азот может быть в кватернизованной форме. Когда группа R2 находится в форме сложного эфира или амида, настоящие соединения претерпевают метаболическое расщепление в соответствующие карбоновые кислоты, которые являются активными ингибиторами каспаз. Поскольку они претерпевают метаболическое расщепление, точная природа эфирной или амидной группы не является критической для использования данного изобретения. Структура группы R2 может изменяться от относительно простого диэтиламида до стероидного эфира. Примеры эфиров карбоновых кислот R2 включают, но не ограничиваются ими, C1-12-алифатические, такие как C1-6 алкиловые или С 3-20-циклоалкиловые, ариловые, такие как фениловый, аралкиловые, такие как бензиловый или фенетиловый, гетероциклиловые или гетероциклоалкиловые. Примеры подходящих гетероциклических колец R2 включают, но не ограничиваются ими, 5-6-членные гетероциклические кольца,имеющие один или два гетероатома, такие как пиперидинил, пиперазинил или морфолинил. Амиды карбоновых кислот R2 могут быть первичными, вторичными или третичными. Подходящие заместители на азоте амида включают, но не ограничиваются ими, одну или несколько групп, независимо выбранных из алифатических, арильных, аралкильных, гетероциклильных или гетероциклилалкильных групп, описанных выше для спирта сложного эфира R2. Таким же образом в объем данного изобретения включены другие пролекарства. См. Bradley D. Anderson, Prodrugs for Improved CNS Delivery inAdvanced Drug Delivery Reviews (1996), 19, 171-202. Примеры группы R3 включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, третбутил. Соединения данного изобретения, где R2 представляет СООН, являются гамма-кетокислотами, которые могут существовать в растворе в виде либо открытого кольца формы 1, либо циклизованного полукеталя формы 2. Представление любой изомерной формы означает, что она включает другую форму. Аналогичным образом может также иметь место циклизация, когда R2 представляет CH2COOH, и понятно, что такие циклизованные изомеры включены, когда представлена форма с открытым кольцом. Таким же образом, специалисту в данной области должно быть очевидно, что некоторые соединения данного изобретения могут существовать в таутомерных формах или гидратированных формах, причем все такие формы соединений входят в объем изобретения. Если не оговорено особо, имеется в виду,что представляемые структуры включают все стереохимические формы структуры, т.е. R- и Sконфигурации для каждого асимметричного центра. Следовательно, индивидуальные стереохимические изомеры, а также энантиомерные и диастереомерные смеси настоящих соединений входят в объем изобретения. Если не оговорено особо, имеется в виду также, что представляемые структуры включают соединения, которые отличаются только присутствием одного или нескольких атомов, обогащенных изотопами. Например, соединения, имеющие представленные структуры, за исключением того, что водород заменен на дейтерий или тритий, или углерод заменен на 13 С- или 14 С-обогащенный углерод, входят в объем настоящего изобретения. Одно осуществление данного изобретения относится к соединениям,которые имеют одно или несколько, предпочтительно все следующие признаки:(iii) R2 представляет СO2 Н или его сложный эфир, амид;(iv) R3 представляет С 1-С 4-алкил, который является группой, которая встраивается в субсайт S2 диапазона каспаз. Конкретные примеры соединений I показаны в табл. 1. Таблица 1. Примеры соединений формулы I (Z представляет кислород)-8 005740 После оценки многих гетероциклических колец R4-N-R5 было обнаружено, что трицикличекие соединения, у которых концевые кольца по существу являются копланарными, неожиданно проявляют превосходящую активность широкого спектра действия по отношению к каспазам по сравнению с ациклическими аналогами или другими трициклическими системами, которые по существу не являются копланарными. Такую существенную копланарность можно достичь, когда среднее кольцо трициклической системы колец является 5- или 6-членным кольцом, таким как кольцо карбазола или фенотиазина. Кроме того, данные, по существу копланарные трициклические кольцевые системы, а также бициклические кольцевые системы, такие как индол и индолин, придают соединениям лучшую активность широкого спектра действия по отношению к каспазам, чем у соответствующих соединений, где гетероциклическое кольцо R4-N-R5 является моноциклическим, таким как пиперидин, пиперазин или морфолин. В соответствии с этим предпочтительное осуществление данного изобретения относится к соединениям формулы I, где R4-N5-R5 является трициклической кольцевой системой, имеющей 1-6 гетероатомов,предпочтительно 1-4 гетероатома, выбранные из азота, кислорода или серы, где концевые кольца кольцевой системы имеют 5-7 атомов и среднее кольцо имеет 5 или 6 атомов. Один аспект этого осуществления относится к соединениям формулы II где X представляет связь или -S-. Соединения данного изобретения можно получить, в общем, способами, известными специалистам в данной области для аналогичных соединений, что иллюстрируется приведенными ниже общими схемами и следующими препаративными примерами. Схема I Реагенты: (а) R5-N=C=Z (2), (b) NаОН/ТГФ/Н 2 О; (с) EDS/DMAP/HOBt; (d) i. периодинан DessMartin, (ii) ТГФ/DCM. На приведенной выше схеме I показан синтетический путь получения соединений, где R4 представляет водород. Взаимодействие изоцианата или тиоизоцианата 2 с производным молочной кислоты 1 дает карбамат 3. Эфирную группу соединения 3 гидролизуют с использованием основания или, когда эфир является трет-бутиловой группой, с использованием трифторуксусной кислоты, получая при этом кислоту 4, которая затем реагирует с аминоспиртом 5. В зависимости от природы R1 и R2 вместо аминоспирта можно использовать аминокетон, чтобы избежать последующей стадии окисления. В случае фторметилкетонов, где R1 представляет CH2F, аминоспирт 5 можно получить по способу Reversz et al., TetrahedronLett., 1994, 35, 9693. Наконец, гидроксильную группу в соединении 6 окисляют и полученное соединение обрабатывают в соответствии с природой R2. Например, если требуется, чтобы в продукте I R2 был карбоновой кислотой, тогда R2 в соединении 6 предпочтительно является эфиром и конечной стадией схемы является гидролиз. Исходные изоцианаты или тиоизоизоцианаты 1 являются коммерчески доступными, или их можно получить взаимодействием амина с фосгеном или эквивалентом фосгена (или тиофосгеном для получения тиоизоцианатов) в присутствии основания, такого как триэтиламин. Производные лактатов являются-9 005740 коммерчески доступными или их можно получить взаимодействием аминокислоты с реагентом диазотирования, таким как NaNO2. Схема II Реагенты: (а) CDI/ТГФ; (b) MeOTf/CH2Cl2; (с) R4R5NH (8)/ТГФ. На приведенной выше схеме II показан синтетический путь получения соединений I данного изобретения, где R4 представляет алкильную группу или когда R4 и R5 вместе образуют кольцо. Взаимодействие производного лактата 2 с 1,1'-карбонилдиимидазолом (CDI) дает имидазол 7. Метилирование соединения 7 метилтрифлатом с последующим взаимодействием с амином 8 (см. J. Med. Chem., (1996), 39,982) дает промежуточный продукт 3. На приведенной выше схеме I показано, как соединение 3 можно превратить в соединение I. Схема III Реагенты: (a) COCl2/CH2Cl2; (b) 1/ТГФ. Альтернативный синтетический путь получения соединений I данного изобретения, где R4 представляет алкильную группу или когда R4 и R5 вместе образуют кольцо, показан на приведенной выше схеме III. Обработка амина 8 фосгеном дает карбамоилхлоридный промежуточный продукт 9. Взаимодействие соединения 9 с производным лактата 1 дает промежуточный продукт 3. Схема IV Реагенты: (а) Сl3 СОС(О)С 1/ТГФ; (b) R4R5NH (8), NaOH, Вu4NВr. На приведенной выше схеме IV показан синтетический путь получения соединений данного изобретения, где R4 представляет водород или алкильную группу или когда R4 и R5 вместе образуют кольцо. Взаимодействие сложного гидроксиэфира 1 с фосгеном или эквивалентом фосгена, таким как дифосген или трифосген, дает хлорформиатный промежуточный продукт 10. Взаимодействие соединения 10 с амином 8 дает промежуточный продукт 3. Соединения данного изобретения предназначаются для ингибирования каспаз. Следовательно, соединения данного изобретения можно испытывать непосредственно на их способность ингибировать апоптоз, высвобождение IL-1 или каспазную активность. Испытания на каждую из активностей описаны ниже в разделе испытания и хорошо известны в данной области. Одно осуществление данного изобретения относится к композиции, включающей соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Если в данных композициях используют фармацевтически приемлемые соли соединений данного изобретения, указанные соли предпочтительно получают из неорганических или органических кислот или оснований. Такие соли кислот включают следующие: ацетат, адипат, альгинат, аспартат, бензоат,бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, полусульфат, гептаноат, гесаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли оснований включают аммониевые соли, соли щелочных металлов, такие как натриевые и калиевые соли,соли щелочно-земельных металлов, такие как кальциевые и магниевые соли, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и так далее. Кроме того, группы, содержащие основный азот, можно кватернизовать такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -иодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; галогениды с длинной цепью, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -иодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды и другие. Таким образом получают водо- или маслорастворимые или диспергируемые продукты. Соединения, используемые в композициях и способах данного изобретения, можно также модифицировать присоединением подходящих функциональных групп для усиления селективных биологиче- 10005740 ских свойств. Такие модификации известны в данной области и включают модификации, которые повышают биологическую проницаемость в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость для осуществления введения инъекцией, изменяют метаболизм и изменяют скорость экскреции. Фармацевтически приемлемые носители, которые можно использовать в данных композициях,включают, но не ограничиваются ими, ионообменники, оксид алюминия, стеарат алюминия, лецитин,сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, цинковые соли, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, воски, блок-полимеры полиэтилен-полиоксипропилен, полиэтиленгликоль и ланолин. В соответствии с предпочтительным осуществлением композиции данного изобретения изготовляют для фармацевтического введения млекопитающему, предпочтительно человеку. Такие фармацевтические композиции настоящего изобретения можно вводить перорально, парентерально, ингаляционным распылением, местно, ректально, назально, трансбуккально, вагинально или через имплантированный резервуар. Используемый термин парентеральный включает способы подкожной, внутривенной, внутримышечной, внутрисуставной, внутригрудинной, внутриоболочечной,внутрипеченочной, внутричерепной инъекции или инфузии и инъекции и инфузии в место поражения. Композиции предпочтительно вводят перорально или внутривенно. Стерильные инъецируемые формы композиций данного изобретения для инъекций могут быть водной или масляной суспензией. Данные суспензии можно изготовить в соответствии со способами, известными в данной области, с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может быть также стерильным раствором для инъекций или суспензией в нетоксичном парентерально приемлемом разбавителе или носителе,например в виде раствора в 1,3-бутандиоле. Приемлемыми среди других наполнителями и растворителями, которые можно использовать, являются вода, раствор Рингера и изотоничный раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные,нелетучие масла. Для этих целей можно использовать любое смешанное нелетучее масло, в том числе синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются полезными при получении препаратов для инъекций, когда они являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло,особенно их полиоксиэтилированные производные. Указанные масляные растворы или суспензии могут содержать также спиртовый (спирт с длинной цепью) разбавитель или диспергатор, такой как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно используют при приготовлении фармацевтически приемлемых дозированных лекарственных форм, включая эмульсии и суспензии. Другие, обычно используемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгирующие агенты или агенты повышения биологической доступности, которые обычно используют при изготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм,можно также использовать для целей получения готовой препаративной формы. Фармацевтические композиции данного изобретения можно перорально вводить в любой перорально приемлемой лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Обычно также добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в форме капсулы пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения требуются водные суспензии, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При необходимости можно также добавить подслащивающие или красящие агенты или корригенты. Альтернативно фармацевтические композиции данного изобретения можно вводить в форме суппозиториев для ректального введения. Их можно получить смешиванием агента с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но становится жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции настоящего изобретения можно также вводить местно, особенно,когда цель лечения включает участки или органы, легко доступные для местного применения, включая заболевание глаз, кожи или нижнего кишечного тракта. Подходящие местные готовые препаративные формы легко получают для каждого из указанных участков или органов. Местное применение для нижнего кишечного тракта можно выполнить введением соединения в ректальной готовой препаративной форме в виде суппозитория (см. выше) или в подходящей препаративной форме в виде клизмы. Можно также использовать местные чрескожные пластыри.- 11005740 Для местного применения фармацевтические композиции можно изготовить в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введения соединений данного изобретения включают, но не ограничиваются ими, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтиленовое, полиоксипропиленовое соединение, эмульгирующий воск и воду. Альтернативно фармацевтические композиции можно изготовить в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются ими, минеральное масло, моностеарат сорбита, полисорбат 60, воск из цетиловых сложных эфиров, цетеариловый спирт, 2-октилдодеканол,бензиловый спирт и воду. Для офтальмического применения фармацевтические композиции можно изготовить в виде микронизированных суспензий в изотоническом стерильном физиологическом растворе с регулированным рН или, что предпочтительно, в виде растворов в изотоническом стерильном физиологическом растворе с регулированным рН либо с консервантом, таким как хлорид бензилалкония, либо без него. Альтернативно для офтальмического применения фармацевтические композиции можно изготовить в виде мази, такой как вазелин. Фармацевтические композиции данного изобретения можно также вводить назальным аэрозолем или ингаляцией. Такие композиции получают по способам, хорошо известным в области технологии приготовления фармацевтических препаратов, их можно получить в виде растворов в физиологическом растворе с использованием бензилового спирта и других подходящих консервантов, стимуляторов абсорции для повышения биологической доступности, фторуглеродов и/или других общепринятых солюбилизирующих или диспергирующих агентов. Описанные выше композиции являются особенно полезными при терапевтических применениях,относящихся к IL-1-опосредованному заболеванию, апоптозопосредованному заболеванию, воспалительному заболеванию, аутоиммунному заболеванию, деструктивному костному нарушению, пролиферативному нарушению, инфекционному заболеванию, дегенеративному заболеванию, заболеванию, ассоциированному с гибелью клеток, заболеванию, связанному с избыточным потреблением пищевого спирта, опосредованному вирусами заболеванию, увеиту, воспалительному перитониту, остеоартриту,панкреатиту, астме, респираторному дистресс-синдрому взрослых, гломерулонефриту, ревматоидному артриту, системной красной волчанке, склеродерме, хроническому тиреоидиту, болезни Грейва, аутоиммунному гастриту, диабету, аутоиммунной гемолитической анемии, аутоиммунной нейтропении, тромбоцитопении, хроническому активному гепатиту, тяжелой псевдопаралитической миастении, воспалительному заболеванию кишечника, болезни Крона, псориазу, атопическому дерматиту, рубцеванию, гомологичной болезни, отторжению органа-трансплантата, остеопорозу, лейкозу и родственным заболеваниям, миелодиспластическому синдрому, костному нарушению, относящемуся к множественной миеломе, острому миелоидному лейкозу, хроническому миелоидному лейкозу, метастатической меланоме,саркоме Капоши, множественной миеломе, геморрагическому шоку, сепсису, септическому шоку, ожогам, шигеллезу, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, болезни Кеннеди,заболеванию, вызванному белком прионом, церебральной ишемии, эпилепсии, ишемии миокарда, острой и хронической болезни сердца, инфаркту миокарда, застойной сердечной недостаточности, атеросклерозу, обходному шунту каронарной артерии, спинальной мышечной атрофии, боковому амиотрофическому склерозу, рассеянному склерозу, ВИЧ-относящемуся энцефалиту, старению, алопеции, нейрологическому повреждению вследствие удара, неспецифическому язвенному колиту, травматическому повреждению головного мозга, повреждению спинного мозга, гепатиту В, гепатиту С, гепатиту G, желтой лихорадке, лихорадке денге или японскому энцефалиту, различным формам заболевания печени, почечному заболеванию, полиаптическому заболеванию почек, связанной с Н. pylori язвенной болезни желудка и двенадцатиперстной кишки, ВИЧ-инфекции, туберкулезу и менингиту. Соединения и композиции являются также полезными при лечении осложнений, связанных с обходными шунтами коронарной артерии и в качестве компонента иммунотерапии для лечения различных форм рака. Количество соединения, присутствующего в указанных выше композициях, должно быть достаточным для того, чтобы вызвать поддающееся обнаружению снижение серьезности заболевания или активности каспазы и/или апоптоза клеток, как измерено любым из анализов, описанных в примерах. Соединения данного изобретения полезны также в способах консервации клеток, которые могут быть необходимы для трансплантации органа, или для консервации продуктов крови. Аналогичные использования ингибиторов каспаз описаны (Schierle et al., Nature Medicine, 1999, 5, 97). Способ заключается в обработке данных клеток или ткани, которые нужно консервировать, раствором, включающим ингибитор каспазы. Количество необходимого ингибитора каспазы будет зависеть от эффективности ингибитора для данного типа клеток и промежутка времени, требуемого для предохранения клеток от гибели от апоптоза. В соответствии с другим осуществлением композиции данного изобретения могут дополнительно включать другой терапевтический агент. Такие агенты включают, но не ограничиваются ими, тромболитические агенты, такие как тканевый активатор плазминогена и стрептокиназа. Когда используют второй- 12005740 агент, его можно вводить либо в виде отдельной лекарственной формы, либо как часть одной лекарственной формы с соединениями или композициями данного изобретения. Должно быть понятно, что определенная доза и схема лечения для любого отдельного пациента будет зависеть от различных факторов, в том числе от активности используемого определенного соединения, возраста, массы тела, общего здоровья, пола, питания, времени введения, скорости экскреции, комбинации лекарственных средств и решения лечащего врача и серьезности определенного подвергаемого лечению заболевания. Количество активных ингредиентов будет зависеть также от определенного соединения и другого, если он присутствует, терапевтического агента в композиции. В предпочтительном осуществлении изобретение предлагает способ лечения млекопитающего,имеющего одно из указанных выше заболеваний, включающий стадию введения указанному млекопитающему фармацевтически приемлемой композиции, описанной выше. В данном осуществлении, если пациенту вводят другой терапевтический агент или ингибитор каспазы, его можно доставить вместе с соединением данного изобретения в одной лекарственной форме или в виде отдельной лекарственной формы. При введении в виде отдельной лекарственной формы другой ингибитор каспазы или агент можно вводить до, во время или после введения фармацевтически приемлемой композиции, включающей соединение данного изобретения. Чтобы данное изобретение было более понятным, приводятся следующие препаративные примеры и примеры испытания. Данные примеры приводятся только для цели иллюстрации, и никоим образом не должны истолковываться как ограничивающие объем изобретения. Примеры синтезов Следующие примеры предоставляют синтетические методики для выбранных соединений данного изобретения. Пример 1. [3S/R]-5-фтор-4-оксо-3-[(S)-3-метил-2-(карбазолкарбамоилоксибутириламино]пентановая кислота К раствору дифосгена (4,55 г) в ТГФ (34 мл) при 0 С по каплям в течение 25 мин добавляют раствор трет-бутилового эфира (S)-2-гидрокси-3-метилмасляной кислоты (способ получения см. в Tetrahedron Lett., (1933), 7409) (4,0 г) и пиридина (1,82 г) в ТГФ (34 мл). Полученной смеси дают возможность нагреться до комнатной температуры на протяжении 4 ч. Смесь затем фильтруют через целит и фильтрат концентрируют при пониженном давлении. Остаток снова растворяют в диэтиловом эфире (200 мл) и снова фильтруют через целит. Фильтрат концентрируют при пониженном давлении, получая при этом указанное в подзаголовке соединение в виде бледно-желтого масла (5,27 г): 1H ЯМР (400 МГц, CDCl3)0,98-1,10 (6 Н, м), 1,55 (9 Н, с), 2,30 (1 Н, м), 4,83 (1 Н, м). Способ В. трет-Бутиловый эфир (S)-3-метил-2-(карбазолкарбамоилокси)масляной кислоты К раствору карбазола (15,15 г) в дихлорметане (180 мл) и ТГФ (142 мл) при 0 С добавляют гранулированный гидроксид натрия (5,45 г) с последующим добавлением тетрабутиламмонийбромида (2,93 г). Полученную смесь перемешивают в течение 30 мин, затем по каплям на протяжении 55 мин добавляют раствор хлорформиата (21,41 г) в ТГФ (81 мл). Смеси затем дают возможность нагреться до комнатной температуры на протяжении ночи. Добавляют дихлорметан (1 л) и воду (350 мл) и органическую фазу отделяют. Водную фазу затем экстрагируют дихлорметаном (2 х 250 мл) и объединенные органические фазы промывают водой (200 мл), затем насыщенным раствором соли (200 мл), сушат (сульфатом магния), фильтруют и концентрируют. Остаток очищают флэш-хроматографией (0-5% этилацетат/гесан),получая при этом указанное в подзаголовке соединение в виде бесцветного масла (29,3 г): 1H ЯМР (400 МГц, CDCl3)1,15-1,23 (6 Н, м), 1,55 (9 Н, с), 2,52 (1 Н, м), 5,27 (1 Н, д), 7,36-7,57 (4 Н, м), 8,03 (2 Н, д), 8,47 Трифторуксусную кислоту (84 мл) добавляют по каплям к перемешиваемому, охлажденному льдом раствору трет-бутилового эфира (S)-3-метил-2-(карбазолкарбамоилокси)масляной кислоты (4,11 г) в безводном DCM (300 мл). Смесь перемешивают при 0 С в течение 2 ч, затем при комнатной температуре в течение 1 ч. Смесь концентрируют при пониженном давлении и затем остаток растворяют в сухом DCM и растворитель снова удаляют при пониженном давлении. Процесс повторяют несколько раз, чтобы удалить избыточную трифторуксусную кислоту. Это дает кислоту в виде бледно-зеленой смолы (3,30 г): 1H ЯМР (400 МГц, CDCl3)1,12-1,37 (6 Н, м), 2,70 (1 Н, м), 5,47 (1H, м), 7,32-7,56 (4 Н, м), 8,00 (2 Н, д), 8,37 Перемешиваемую смесь (S)-3-метил-2-(карбазол) карбамоилоксимасляной кислоты (3,30 г), третбутилового эфира 3-амино-5-фтор-4-гидроксипентановой кислоты (2,42 г), HOBt (1,58 г), DMAP (1,49 г) и ТГФ (80 мл) охлаждают до 0 С, затем добавляют EDC (2,24 г). Смеси дают возможность нагреться до комнатной температуры в течение 16 ч, затем концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (15-45% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде белой пены (4,60 г): 1H ЯМР (400 МГц,CDCl3)1,09-1,50 (15 Н, м), 2,49-2,80 (3 Н, м),3,20-3,62 (1H, м), 3,92-4,58 (4 Н, м), 5,32-5,42 (1H, д), 6,86 (1H, ушм), 7,40-7,55 (4 Н, м), 8,02 (2 Н, д), 8,35 Перемешиваемый раствор трет-бутилового эфира [3S/R,4S/R]-5-фтор-4-гидрокси-3-S)-3-метил-2(карбазол)карбамоилоксибутириламидо)пентановой кислоты (4,60 г) в безводном DCM (100 мл) обрабатывают 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-оном (4,68 г) при 0 С. Полученную смесь выдерживают при 0 С в течение 2 ч, разбавляют этилацетатом, затем выливают в смесь 1:1 насыщенного водного гидрокарбоната натрия и насыщенного водного тиосульфата натрия. Органический слой отделяют и водный слой снова экстрагируют этилацетатом. Объединенные органические экстракты сушат(сульфатом магния) и концентрируют. Остаток очищают флэш-хроматографией (10-40% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде белого твердого вещества Данное соединение получают с использованием методики, аналогично описанной выше в способе С. Продукт выделяют в виде белого твердого вещества (88%, последняя стадия): ИК (твердый) 1721,2,1695,6, 1664,9, 1449,8, 1378,1, 1198,9, 1040,1, 758,5 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,10 (6 Н, ушм),2,41 (1 Н, м), 2,54-3,04 (2 Н, м), 4,31-4,82 (1,6 Н, м, CH2F), 5,10-5,41 (2,4 Н, м), 7,45 (2 Н, м), 7,57 (2 Н, м),- 14005740 8,22 (2 Н, м), 8,30 (2 Н, м), 8,51-8,99 (1 Н, ушм), 12,60 (1H, ушс), 13 С ЯМР (100 МГц, d6-ДМСО)19,0, 19,1,19,3, 30,4, 30,5, 30,6, 32,9, 34,5, 34,7, 47,3, 47,4, 52,0, 52,3, 80,4, 80,8, 83,2, 83,4, 83,4, 85,1, 85,2, 116,2,116,3, 124,1, 125,7, 125,9, 137,9, 151,7, 151,9, 152,0, 168,8, 169,0, 169,2, 172,0, 172,1, 173,1, 173,2, 202,2,202,4, 202,5, 202,6; 19F ЯМР (376 МГц, d6-ДМСО) -226,6 (т), -226,8 (т), -230,5 (т), -230,9(т), -232,9(т), 233,0 (т); МС (ESI +ve) 443(M+H). Пример 2. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(3-хлоркарбазол)карбамоилоксибутириламино] пентановая кислота Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Продукт выделяют в виде белого твердого вещества (99%, последняя стадия): ИК (твердый) 1721,2,1690,6, 1664,9, 1444,7, 1367,9, 1209,1, 1040,1 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,02-1,13 (6 Н, м), 2,40 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Продукт выделяют в виде белого твердого вещества (99%, последняя стадия): ИК (твердый) 1721,2,1659,7, 1470,3, 1434,4, 1367,9, 1209,1, 1075,9, 1045,2 см-1, 1H ЯМР (400 МГц, d6-ДМСО)0,98-1,14 (6 Н,м), 2,30-2,50 (1H, м), 2,50-3,01 (2 Н, м), 4,29-4,84 (1,5 Н, тп), 5,09-5,41 (2,5 Н, м), 7,66 (2 Н, м), 8,19-8,29 (2 Н,м), 8,45 (2 Н, м), 8,57-8,99 (1H, ушм), 12,60 (1H, уш, ОН); 13 С ЯМР (100 МГц, d6-ДМСО)15,5, 19,1, 19,2,30,4, 30,45, 30,6, 33,0, 34,5, 34,7, 47,3, 47,5, 52,0, 52,3, 80,8, 81,1, 81.2, 83,4, 84,43, 85,1, 85,2, 117,8, 121,1,126,3, 128,4, 128,7, 136,9, 151,2, 151,4, 168,6, 168,8, 168,9, 168,95, 172,0, 172,04, 173,1, 173,14, 202,2, 202,3,202,4, 202,6; 19F ЯМР (376 МГц, d6-ДМСО) -226,6 (т), -226,8 (т), -230,4 (т), -230,8 (т), -232,8 (т), -232,9 (т); МС (ESI +ve) 511/513(М+Н). Пример 4. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(2-хлоркарбазол)карбамоилоксибутириламино] пентановая кислота К раствору 2-бромнитробензола (646 мг) в ТГФ (17 мл) в атмосфере азота добавляют тетракис(трифенилфосфин)палладий (0) (900 мг). Полученную смесь перемешивают при комнатной температуре в течение 20 мин, затем добавляют раствор 4-хлорфенилбороновой кислоты (1,0 г) в этаноле (17 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 1 ч. Затем добавляют 2 М карбонат натрия (17 мл) и реакционную смесь кипятят с обратным холодильником в течение 2 ч. Смеси затем дают возможность охладиться и концентрируют при пониженном давлении. Остаток растворяют в- 15005740 этилацетате (100 мл) и водный слой удаляют. Органическую фазу промывают насыщенным раствором соли (20 мл), сушат (сульфатом магния), фильтруют и концентрируют. Остаток очищают флэшхроматографией (0-10% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде желтого твердого вещества (646 мг): 1H ЯМР (400 МГц, CDCl3)7,24-7,31 (2 Н, м), 7,41-7,47 (3H, м),7,52 (1 Н, м), 7,65 (1 Н, м), 7,90 (1 Н, д). Способ G. 2-Хлоркарбазол Смесь 4'-хлор-2-нитробифенила (640 мг) и триэтилфосфита (1,9 мл) нагревают при 150 С в течение 3 ч. Смесь затем оставляют для охлаждения и очищают флэш-хроматографией (5-10% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде белого твердого вещества (382 мг): 1H ЯМР (400 МГц, d6-ДМСО)7,12-7,23 (2 Н, м), 2,40 (1 Н, м), 7,46-7,54 (2 Н, м), 8,12 (2 Н, д). Пример 4. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(2-хлоркарбазол)карбамоилоксибутириламино] пентановая кислота Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Продукт выделяют в виде белого твердого вещества (99%, последняя стадия): ИК (твердый) 1731,4,1695,6, 1664,9, 1424,2, 1367,9, 1326,9, 1193,7, 1045,2 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,58-1,70 (6 Н,м), 2,85-3,10 (1H, м), 3,10-3,54 (2 Н, м), 4,85-5,39 (1,4 Н, м), 5,65-5,98 (2,6 Н, м), 7,94-8,20 (3H, м), 8,73-8,90 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. 2,3-Дихлоркарбазол получают с использованием методик, аналогичных описанным в способам F и G. Продукт выделяют в виде белого твердого вещества (98%, последняя стадия): ИК (твердый) 1721,2,1659,7, 1434,4, 1367,9, 1204,0, 1188,6, 1045,2 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,04-1,14 (6 Н, м), 2,292,48 (1 Н, м), 2,53-3,00 (2 Н, м), 4,30-4,84 (1,7 Н, м), 5,09-5,41 (2,3H, м), 7,49 (1 Н, м), 7,63 (1 Н, м), 8,20-8,33 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. 2-Трифторметилкарбазол получают с использованием методик, аналогичных описанным в способах F иG. Продукт выделяют в виде белого твердого вещества (85%, последняя стадия): ИК (твердый) 1731,4,1695,6, 1695,7, 1434,4, 1321,8, 1198,9, 1122,1, 1065,7 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,06-1,15 (6 Н,м), 2,42 (1 Н, м), 2,50-3,01 (2 Н, м), 4,29-4,83 (1,6 Н, м), 5,08-5,42 (2,4 Н, м), 7,53 (1 Н, м), 7,68 (1 Н, м), 7,83 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Продукт выделяют в виде белого твердого вещества (90%, последняя стадия): ИК (твердый) 1726,3,1700,7, 1664,9, 1552,2, 1460,0, 1552,2, 1460,0, 1367,9, 1332,0, 1209,1, 1193,7, 1040,1 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,01-1,19 (6 Н, м), 2,30-3,00 (6 Н, м), 4,29-4,85 (1,5 Н, м), 5,11-5,52 (2,5 Н, м), 7,29 (1 Н, м),7,45 (1 Н, м), 7,55 (1 Н, м), 8,05-8,18 (3H, м), 8,27 (1 Н, м), 8,50-9,10 (1 Н, ушм), 12,50 (1 Н, ушс); 13 С ЯМР Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Хлорформиат получают из трет-бутилового эфира (S)-2-гидроксибутановой кислоты, как описано в способе А. Продукт выделяют в виде белого твердого вещества (90%, последняя стадия): ИК (твердый) 1716,1, 1654,6, 1449,8, 1372,9, 1326,9, 1204,0, 1050,4, 1029,9 см-1; 1H ЯМР (400 MHz, d6-ДМСО)1,031,12 (3H, м), 1,96-2,15 (2 Н, м), 2,50-3,01 (2 Н, м), 4,31-4,82 (1,8 Н, м), 5,11-5,43 (2,2 Н, м), 7,45 (2 Н, м), 7,59 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Хлорформиат получают из трет-бутилового эфира (S)-2-гидрокси-3,3-диметилбутановой кислоты (способ получения см. в Tetrahedron Lett. (1993), 7409), как описано в способе А. Продукт выделяют в виде белого твердого вещества (94%, последняя стадия): ИК (твердый) 1782,7, 1721,2, 1526,6, 1444,7, 1373,0,1332,0, 1301,3, 1198,9, 1117,0, 1040,1, 753,3 см-1; 1H ЯМР (400 МГц, d6-ДМСО)1,15 (9 Н, с), 2,50-2,98 Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Хлорформиат получают из трет-бутилового эфира (S)-2-гидроксибутановой кислоты, как описано в способе А. 2-Хлоркарбазол получают, как описано в способах F-G. Продукт выделяют в виде белого твердого вещества (77%, последняя стадия): ИК (твердый) 1733,03, 1699,89, 1662,97, 1448,18, 1423,38, 1369,84,1332,48, 1215,16, 1199,62, 1052,26, 1033,17, 764,57, 747,53, 720,08, 651,85 см-1; 1 Н ЯМР (400 МГц, d6 ДМСО)1,06-1,10 (3H, м), 2,01-2,09 (2 Н, м), 2,53-2,98 (2 Н, м), 4,34-4,78 (1,6 Н, м), 5,14-5,39 (2,4 Н, м),7,45-7,61 (3H, м), 8,24-8,31 (4 Н, м), 8,63-8,99 (1 Н, ушм), 12,50 (1 Н, ушс); 13 С ЯМР (100 МГц, dg-ДМСО)9,7, 23,7, 25,0, 31,3, 34,6, 34,8, 52,0, 52,3, 77,4, 77,6, 83,4, 85,2, 110,9, 111,6, 116,2, 116,3, 119,0, 119,4,120,7, 120,9, 121,9, 122,1, 124,2, 124,3, 124,6, 124,8, 126,3, 128,3, 130,2, 132,0, 138,1, 138,4, 151,3, 169,6,172,1; 19F ЯМР (376 МГц, d6-ДМСО) -226,60 (т), -226,83 (т), -230,34 (т), -231,88 (т), -232,84 (т), -232,99 (т). Пример 11. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(индол)карбамоилоксибутириламино]пентановая кислота Данное соединение получают с использованием методик, аналогичных описанным в способах А-Е. Продукт выделяют в виде белого твердого вещества (92%, последняя стадия): ИК (твердый) 1731,4,1664,9, 1536,8, 1454,9, 1393,5, 1326,9, 1239,8, 1035,0 см-1; - 1H ЯМР (400 МГц, d6-ДМСО)1,30-1,62 (6 Н,м), 2,79 (1H, м), 3,00-3,48 (2 Н, м), 4,77-5,04 (1,6 Н, м), 5,42-5,88 (2,4 Н, м), 7,29 (1H, м), 7,70-7,90 (2 Н, м),8,10-8,31 (2 Н, м), 8,51-8,63 (1H, м), 8,91-9,45 (1H, м), 13,0 (1H, ушс); 13 С ЯМР (100 MHz, d6-ДМСО)15,5, 17,3, 17,6, 18,9, 19,2, 30,6, 32,9, 34,5, 34,7, 47,4, 52,0, 52,3, 65,3, 80,0, 80,3, 80,5, 83,4, 83,41, 85,1, 85,2,104,02, 108,7, 108,71, 108,8, 114,9, 122,0, 123,5, 125,0, 126,3, 130,5, 135,0, 150,4, 168,8, 169,0, 169,1, 169,14,172,0, 172,1, 173,1, 202,2, 202,4, 202,5, 202,6; 19F ЯМР (376 МГц, d6-ДМСО) -226,1 (т), -226,3 (т), -230,0(для получения см. Tetrahedron Lett., (1993), 7409) (300 мг) в ТГФ (5 мл) при 0 С добавляют гидрид натрия (60% суспензия в минеральном масле, 72 мг). Полученную смесь перемешивают в течение 30 мин,затем добавляют фенотиазин-10-карбонилхлорид (450 мг) и смеси дают возможность нагреться до температуры окружающей среды на протяжении 12 ч. Реакционную смесь затем разбавляют этилацетатом(15 мл) и водой (3 мл). Органическую фазу отделяют и водную фазу экстрагируют 2 хмл этилацетата. Объединенные органические фазы затем промывают насыщенным раствором соли (5 мл), сушат (сульфатом магния), фильтруют и концентрируют. Остаток очищают флэш-хроматографией (0-10% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде бесцветного масла (528 мг): 1 Н ЯМР (400 МГц, CDCl3)0,75-0,96 (6 Н, м), 1,58 (9 Н, с), 2,20 (1 Н, м), 4,86 (1 Н, д), 7,12-7,45 (6 Н, м),7,70 (2 Н, м). Снятие защиты у трет-бутилового эфира (S)-3-метил-2-(фенотиазин)карбамоилоксимасляной кислоты (528 мг) с использованием трифторуксусной кислоты, как описано в способе С, получая при этом кислоту в виде белого твердого вещества (440 мг): 1H ЯМР (400 МГц, CDCl3)0,77-1,00 (6 Н, м), 2,29 Данное соединение получают с использованием методик, аналогичных описанным в способах С-Е. Продукт выделяют в виде белого твердого вещества (98%, последняя стадия): ИК (твердый) 1782,7,1710,9, 1521,5, 1465,2, 1260,3, 1219,4, 1168,1, 1045,2, 758,5 см-1; 1H ЯМР (400 MHz, d6-ДМСО)0,64-0,87 К суспензии 2-хлорфенотиазина (2 г) в ксилоле (20 мл) добавляют дифосген (3,4 г). Смесь нагревают до 140 С в течение 18 ч. Смесь затем охлаждают и ксилол удаляют при пониженном давлении. Остаток очищают флэш-хроматографией (2-5% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде коричневого твердого вещества (2,04 г): 1H ЯМР (400 МГц, CDCl3)7,26-7,43 (4 Н,м), 7,45-7,51 (1 Н, м), 7,59-7,68 (2 Н, м). Пример 13. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(2-хлорфенотиазин)карбамоилоксибутириламино]пентановая кислота Данное соединение получают с использованием методик, аналогичных описанным в способах Н и С-Е. Продукт выделяют в виде белого твердого вещества ВЭЖХ с обращенной фазой (61%, последняя стадия): ИК (твердый) 1732, 1460, 1365, 1207 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,70-0,87 (6 Н, м), 2,022,10 (1 Н, м), 2,58-2,90 (2 Н, м), 4,34-5,37 (4 Н, м), 7,27-7,88 (7 Н, м), 8,31-8,81 (1 Н, м); 13 С ЯМР (100 МГц,d6-ДМСО)16,7/16,9, 18,9/19,1, 30,3/30,3, 34,5/34,8, 52,0/52,4, 79,6/80,0, 84,2/84,3, 127,0, 127,3, 127,3,Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. Фенотиазин получают по методикам, описанным в J. Chem. Soc. (1970), 2437-2441. Продукт выделяют в виде белого твердого вещества (89%, последняя стадия): ИК (твердый) 1717, 1527, 1469, 1350,1322, 1217, 1042 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,67-0,85 (6 Н, м), 2,00-2,06 (1H, м), 2,58-2,87 (2 Н,м), 4,33-4,86 (2,6 Н, м), 5,12-5,36 (1,4 Н, м), 7,27-7,30 (1H, м), 7,38-7,51 (3H, м), 7,63-7,68 (3H, м), 8,24-8,82 Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. Фенотизин получают по методикам, описанным в J. Chem. Soc. (1970), 2437-2441. Продукт выделяют в виде белого твердого вещества ВЭЖХ с обращенной фазой (76%, последняя стадия): ИК (твердый) 1793, 1721, 1521, 1465, 1317, 1214, 1086, 1044 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,71-0,76 (3H, м),0,84-0,88 (3H, м), 2,05-2,12 (1 Н, м), 2,58-2,92 (2 Н, м), 4,31-4,87 (2,5 Н, м), 5,09-5,36 (1,5 Н, м), 7,47-7,56 Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. Фенотиазин получают по методикам, описанным в J. Сhem. Soc. (1970), 2437-2441. Продукт выделяют в виде белого твердого вещества ВЭЖХ с обращенной фазой (58%, последняя стадия): ИК (твердый) 1736, 1436, 1365, 1222, 1050 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,66-0,85 (6 Н, м), 2,00-2,08 (1 Н, м),2,57-2,93 (2 Н, м), 4,30-5,35 (4 Н, м), 7,31-7,71 (6 Н, м), 8,27-8,83 (1 Н, м); 13 С ЯМР (100 МГц; d6-ДМСО)16,8/17,1, 19,0/19,1, 30,3, 34,5/34,8, 52,0/52,4, 79,7/80,0, 84,2/84,3, 179,2/178,6, 127,1, 127,3, 127,5, 128,2,128,5, 128,5, 129,6, 130,0, 133,7, 137,3/137,3, 137,6/137,6, 152,5, 169,5/169,5, 172,0/172,1, 202,3; 19F ЯМР Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. 9,10-Дигидрофенантридин получают, как описано в J. Сhem. Soc. (1951), 3207-3211. Продукт выделяют в виде белого твердого вещества ВЭЖХ с обращенной фазой (56%, последняя стадия): ИК (твердый) 1732, 1365, 1226, 1212, 1203 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,84 (6 Н, м), 2,05 (1H, м), 2,55-2,90 Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. Продукт выделяют в виде белого твердого вещества (100%, последняя стадия): ИК (твердый) 1791,2, 1714,9, 1683,4, 1525,6, 1492,6, 1370,1, 1325,6, 1229,3, 1212,5, 1053,4, 1032,7, 798,4 см-1; 1H ЯМР Данное соединение получают с использованием методик, аналогичных описанным в способах Н, I и С-Е. Продукт выделяют в виде белого твердого вещества (100%, последняя стадия): ИК (твердый) 1796,9,1683,9, 1521,8, 1491,5, 1368,3, 1324,8, 1278,6, 1213,4, 1201,9, 1108,0, 1056,4, 931,1, 776,5, 746,7 см-1; 1H ЯМР- 21005740 К перемешиваемому раствору бензилового эфира (S)-2-гидрокси-3-метилмасляной кислоты (получение см. в J. Med. Chem., (1996), 39, 982, 1,5 г) в ТГФ (20 мл) добавляют карбонилдиимидазол (1,17 г) и полученную смесь перемешивают при комнатной температуре в течение 12 ч. Реакционную смесь концентрируют при пониженном давлении и остаток снова растворяют в этилацетате (30 мл). Раствор промывают 1% фосфорной кислотой (2 х 10 мл), затем насыщенным раствором соли (10 мл), сушат (сульфатом магния), фильтруют и концентрируют, получая при этом указанное в подзаголовке соединение в виде бесцветного масла (1,89 г): 1 Н ЯМР (400 МГц, CDCl3)1,02 (3H, д), 1,11 (3H, д), 2,47 (1 Н, м), 5,15 К перемешиваемому раствору бензилового эфира (S)-2-(имидазолкарбамоилокси)-3-метилмасляной кислоты (355 мг) в ТГФ (7 мл) при 0 С добавляют метилтрифторметансульфонат (0,13 мл). Полученный раствор перемешивают в течение 30 мин. Затем добавляют индолин (280 мг) и смеси дают возможность нагреться до комнатной температуры на протяжении 12 ч. Реакционную смесь концентрируют при пониженном давлении и остаток снова растворяют в этилацетате (30 мл). Раствор промают насыщенным раствором бикарбоната натрия (5 мл), затем 1 М хлористо-водородной кислотой (2 х 5 мл), затем насыщенным раствором соли (5 мл), сушат (сульфатом магния), фильтруют и концентрируют. Остаток очищают флэш-хроматографией (5-7% этилацетат/гексан), получая при этом указанное в подзаголовке соединение в виде бесцветного масла (342 мг): 1H ЯМР (400 МГц, СDСl3)0,86-1,18 (6 Н, м), 2,35 (1 Н, м),3,08-3,25 (2 Н, м), 4,05-4,25 (2 Н, м), 4,95-5,32 (3H, м), 6,95-7,91 (9 Н, м). Способ L. (S)-(2,3-Дигидроиндол-1-карбамоилокси)-3-метилмасляная кислота К перемешиваемому раствору бензилового эфира (S)-(2,3-дигидроиндол-1-карбамоилокси)-3 метилмасляной кислоты (342 мг) в метаноле (25 мл) добавляют 10% палладий на угле (80 мг). Смесь затем гидрируют при комнатной температуре в течение 2 ч. Смесь затем фильтруют через целит и фильтрат концентрируют, получая при этом указанное в подзаголовке соединение в виде бесцветного масла Данное соединение получают с использованием методик, аналогичных описанным в способах С-Е. Продукт выделяют в виде белого твердого вещества (94%, последняя стадия): ИК (твердый) 1680,2,1485,6, 1413,9, 1137,4, 1050,4, 758,5 см-1; 1H ЯМР (400 МГц, d6-ДМСО)0,95 (6 Н, ушм), 2,17 (1H, ушм),2,50-2,94 (2 Н, м), 3,12 (2 Н, ушм), 3,84-4,23 (2 Н, ушм), 4,27-5,39 (4 Н, м), 6,98 (1H, м), 7,22 (2 Н, м), 7,67 Способ М. К перемешиваемому раствору кислоты (пример 1; получен, как описано в способах А-Е)(100 мг) в ТГФ (2 мл) при 0 С добавляют диэтиламин (16 мг) в ТГФ (0,5 мл), затем гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (EDC), (48 мг). Смесь затем нагревают до комнатной темпе- 22005740 ратуры на протяжении 12 ч. Растворитель удаляют при пониженном давлении и остаток очищают флэшхроматографией (50-60% этилацетат/гексан), получая при этом амид в виде белого твердого вещества (54 мг); 1H ЯМР (400 МГц, CDCl3)0,69-1,38 (12 Н, м), 2,42-3,37 (7 Н, м), 4,85-4,92 (1H, м), 5,01-5,55 (3H, м),7,31-7,70 (5 Н, м), 7,90-8,05 (2 Н, м), 8,25-8,42 (2 Н, м); 19F ЯМР (376 МГц, CDCl3) -232,6 (т), -232,8 (т); MC Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (62%, последняя стадия): 1H ЯМР (400 МГц, CDCl3)0,96-1,31 (9 Н, м), 2,21-2,45 (1 Н, м), 2,48-2,80 (2 Н, м), 3,15-3,48 (2 Н, м), 4,23-4,76 (3H, м), 5,05-5,42 (1 Н,м), 6,42-6,84 (1 Н, м), 7,38-7,60 (4 Н, м), 7,95-8,09 (2 Н, м), 8,20-8,41 (2 Н, м); 19F ЯМР (376 МГц, СDCl3) 223,8 (т), -224,5 (т), -226,5 (т), 227,1 (т), -231,9 (т), -232 (т); МС (ESI +ve) 452 (M+H2O). Пример 23. Пиперазинамид [3S/R]-5-фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентановой кислоты Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (78%): 1H ЯМР (400 МГц, СDCl3)1,10-1,35 (6 Н, м),1,80-3,55 (14 Н, м), 4,82-4,98 (1 Н, м), 5,00-5,45 (3H, м), 7,38-7,60 (5 Н, м), 7,95-8,08 (2 Н, м), 8,27-8,45 (2 Н,м); 19F ЯМР (376 МГц, CDCl3) -232,5 (т), -232,7 (т); МС (ESI +ve) 525(М+Н). Пример 24. N,N-Диметиламиноэтиламид [3S/R]-5-фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентановой кислоты Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (49%): 1H ЯМР (400 МГц, CDCl3)1,14-1,31 (6 Н, м),1,88-3,04 (13 Н, м), 3,88-4,41 (3H, м), 4,57-4,74 (1 Н, м), 5,33-5,61 (1 Н, м), 6,86-7,12 (1 Н, м), 7,33-7,56 (4 Н,м), 8,01-8,05 (2 Н, м), 8,27-8,41 (2 Н, м); 19F ЯМР (376 МГц, СDCl3) -222,4 (т), -222,5 (т); МС (ESI +ve) 513(М+Н). Пример 25. [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентаноамид Способ N. К перемешиваемому раствору [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-карбазолкарбамоилоксибутириламино]пентановой кислоты из примера 1 (150 мг) в дихлорметане (1,5 мл) и диметилформамиде (0,075 мл) добавляют карбонилдиимидазол (66 мг). Смесь перемешивают в течение 2 ч,затем охлаждают до 0 С, в то время как через смесь барботируют аммиак. Смесь разбавляют смесью этилацетат/10% раствор гидросульфата калия. Органическую фазу отделяют и водную фазу экстрагируют этилацетатом. Объединенные органические экстракты сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают флэш-хроматографией (5% метанол/дихлорметан), получая при этом амид в виде белого твердого вещества (80 мг): 1H ЯМР (400 МГц, CDCl3) 1,10-1,28 (6 Н, м), 2,12-2,75 (3H,м), 4,10-4,85 (4 Н, м), 5,29 (1 Н, м), 6,36, 6,55, 6,78, 6,98 (1 Н, 4 х с), 7,17 (1 Н, м), 7,42 (2 Н, м), 7,50 (2 Н, м),7,99 (2 Н, м), 8,29 (2 Н, м); 19F ЯМР (376 MHz, CDCl3) -225,47 (т), -226,00 (т), -227,33 (т), -227,50 (т),-228,43 (т); MC (ESI +ve) 424 (М-Н 2O+Н). Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (37%): 1H ЯМР (400 МГц, СDCl3)0,90-1,80 (16 Н,м), 2,59 (1 Н, м), 2,75-3,15 (2 Н, м), 4,40 (0,5 Н, м), 4,64 (0,5 Н, м), 4,95-5,45 (4 Н, м), 7,25 (1 Н, м), 7,42 (2 Н,м), 7,52 (2 Н, м), 8,05 (2 Н, м), 8,36 (2 Н, м); 19F ЯМР (376 МГц, CDCl3) -231,95 (т), -232,08 (т). Пример 27. н-Пропиловый эфир [3S/R]-5-Фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентановой кислоты Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (82%): 1H ЯМР (400 МГц, CDCl3)0,80 (3H, м),1,13-1,36 (6 Н, м), 1,42 (1 Н, м), 1,58 (1 Н, м), 2,60 (1 Н, м), 2,80-3,08 (2 Н, м), 3,70 (1 Н, м), 3,98 (1 Н, м), 4,925,50 (4 Н, м), 7,21 (1 Н, м), 7,40 (2 Н, м), 7,50 (2 Н, м), 8,00 (2 Н, м), 8,32 (2 Н, м); 19F ЯМР (376 МГц, CDCl3) 232,00 (т), -232,01 (т); МС (ESI +ve) 485 (М+Н). Пример 28. Изопропиловый эфир [3S/R]-5-фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентановой кислоты Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (7%): 1H ЯМР (400 МГц, CDCl3)0,90-1,33 (12 Н, м),2,55 (1H, м), 2,78-3,15 (2 Н, м), 4,80-5,50 (5 Н, м), 7,25 (1 Н, ушс), 7,43 (2 Н, м), 7,55 (2 Н, м), 8,05 (2 Н, м),8,36 (2 Н, м); 19F ЯМР (376 МГц СDCl3) -232,00 (т), -232,03 (т). Пример 29. Метиловый эфир [3S/R]-5-фтор-4-оксо-3-[(S)-3-метил-2-(карбазол)карбамоилоксибутириламино]пентановой кислоты Данное соединение получают с использованием методик, аналогичных описанным в способе М. Продукт выделяют в виде белого твердого вещества (81%): 1H ЯМР (400 МГц, CDCl3)1,20 (6 Н, м), 2,58 Данное соединение получают с использованием методик, аналогичных описанным в способе N, с использованием карбонилдиимидазола в качестве реагента сочетания. Продукт выделяют в виде белого(1H, м); 19F ЯМР (376 МГц CDCl3) -231,91 (ас), -232,03 (т). Соответствующий кеталь также выделяют в виде белого твердого вещества (21%): 1H ЯМР (400 МГц СDCl3)0,65-2,10 (48 Н, м), 2,35-3,15 (2 Н, 3 х м), 3,42-3,69 (1H, м), 4,10-4,96 (4 Н, м), 5,15-5,65 (2 Н, м), 6,78 (1H, м), 7.45 (2 Н, м), 7,57 (2 Н, м), 8,05 (2 Н,м), 8,34 (2 Н, м); 19F ЯМР (376 МГц CDCl3) -230,57 (т), -230,67 (т). Способы испытания Анализы для ингибирования каспазы основаны на расщеплении флуорогенного субстрата рекомбинантными, очищенными каспазами-1, -3, -7 или -8 человека. Анализы проводят, по существу, таким же способом, как анализы, описанные у Garcia-Calvo et al. (J. Biol. Chem. 273 (1998), 32608-32613), с использованием субстрата, специфичного для каждого фермента. Субстратом для каспазы-1 является ацетилТуr-Vаl-Аlа-Аsр-амино-4-метилкумарин. Субстратом для каспаз-3, -7 и -8 является ацетил-Аsр-Glu-ValАsр-амино-4-метилкумарин. Наблюдаемую степень инактивации фермента при определенной концентрации ингибитора, kobs,вычисляют непосредственным компьютерным отсчетом данных с помощью уравнения, разработанногоThornberry et al. (Biochemistry 33 (1994). 3943-3939), с использованием компьютерной программы нелинейного метода наименьших квадратов (PRISM 2,0; программное обеспечение GraphPad). Для получения константы степени второго порядка kinact, величины kobs наносят на график по отношению к соответствующим концентрациям ингибитора и величины kinact затем вычисляют компьютерным методом линейной регрессии. Многие из настоящих соединений, которые были испытаны, имели для каспазы-1 величины kinact от 25000 до 1500000 M-1c-1; для каспазы-3 величины kinact от 9000 до 1500000 М-1c-1; для каспазы-8 величины kinact от 10000 до 700000 М-1 с-1. Ингибирование секреции IL-1 из смешанной популяции моноядерных клеток периферической крови (РВМС) Процессинг пре-IL-1 каспазой-1 можно измерить в клеточной культуре с использованием различных источников клеток. РВМС человека, полученная от здоровых доноров, обеспечивает смешанную популяцию лимфоцитных и моноядерных клеток, которые продуцируют разнообразие интерлейкинов и цитокинов в ответ на многие классы физиологических стимуляторов. Экспериментальная методика Испытуемое соединение растворяют в диметилсульфоксиде (ДМСО, Sigma В-2650) с получением 100 мМ исходного раствора. Его разводят в полной среде, состоящей из RPMI, содержащей 10% инактивированной нагреванием FCS (Gibco BRL 10099-141), 2 мМ L-глутамин (Sigma, G-7513), 100 единиц пенициллина и 100 мг/мл стрептомицина (Sigma Р-7539). Диапазон конечных концентраций испытуемого соединения составляет от 100 мкМ до 6 нМ после восьми стадий разведения. Самая высокая концентрация испытуемого соединения эквивалентна 0,1% ДМСО в анализе. РВМС человека выделяют из лейкоцитарных пленок, полученных из банка крови, с использованием центрифугирования на среде выделения лейкоцитов Ficoll-Paque (Amersham, 17-1440-02) и клеточный анализ проводят в стерильном 96-луночном плоскодонном планшете (Nunc). Каждая лунка содержит 100 мкл клеточной суспензии, 1x10-5 клеток, 50 мкл разведений соединения и 50 мкл LPS (Sigma L-3012) при конечной концентрации 50 нг/мл. Контроли состоят из клеток +/- стимуляция LPS и серийное разведение ДМСО, разведенного таким же способом, как соединение. Планшеты инкубируют в течение 16-18 ч при 37 С в атмосфере с 5% CO2 и влажностью 95%. Спустя 16-18 ч супернатанты собирают после центрифугирования планшетов при 100 хg и 18 С в течение 15 мин и анализируют на содержание в них IL-1. Измерение зрелых IL-1 в супернатанте проводят с использованием наборов Quantikine (RD Systems) в соответствии с инструкциями изготовителя. Уровни зрелых IL-1 приблизительно 600-1500 пг/мл наблюдают для РВМС в лунках положительного контроля. Ингибирующую активность соединений можно представить величиной IC50, которая является концентрацией ингибитора, при которой обнаруживают 50% зрелых IL-1 в супернатанте по сравнению с положительным контролями. Выбранные соединения были испытаны в данном анализе и, как было показано, ингибируют высвобождение IL-1 с величинами IС 50 от 0,04 до 20 мкМ. Анализ апоптоза, индуцированного анти-Fas Клеточный апоптоз можно индуцировать связыванием лиганда Fas (FasL) с его рецептором CD95(Fas). СВ 95 является одним из семейства родственных рецепторов, известных как рецепторы гибели клеток, которые могут запускать апоптоз в клетках посредством активации каскада фермента каспазы. Процесс инактивируют связыванием адаптерной молекулы FADD/MORT-1 с цитоплазматическим доменом комплекса рецептор CD-95-лиганд. Каспаза-8 затем связывает FADD и становится активированной, инициируя при этом каскад событий, который заключается в активации каспаз последующего действия и последующий клеточный апоптоз. Апоптоз можно также индуцировать в клетках, экспрессирующихCD95, например клеточной линии Jurkat Т-клеточной лимфомы Е 6.1, с использованием антител, а неFasL, для перекрестного сшивания CD95 клеточной поверхности CD95. Анти-Fas-индуцированный апоп- 25005740 тоз также запускается посредством активации каспазы-8. Это обеспечивает основу для анализа на клеточной основе с целью отбора соединений для ингибирования опосредованного каспазой-8 апоптозного пути. Экспериментальная методика Клетки Jurkat E6.1 культивируют в полной среде, состоящей из RPMI-1640 (Sigma ) + 10% фетальной бычьей сыворотки (Gibco BRL10099-141) + 2 мМ L-глутамина (SigmaG-7513). Клетки собирают в логарифмической фазе роста. 100 мл клеток при плотности 5-8 х 105 клеток/мл переносят в стерильные 50 мл пробирки для центрифугирования Falcon и центрифугируют в течение 5 мин при 100 хg при комнатной температуре. Супернатант удаляют и объединенный осадок клеток снова суспендируют в 25 мл полной среды. Клетки подсчитывают и плотность доводят до 2 х 106 клеток/мл полной средой. Испытуемое соединение растворяют в диметилсульфоксиде (ДМСО) (SigmaD-2650), получая при этом 100 мМ исходный раствор. Его разводят до 400 мкМ в полной среде, затем серийно разводят в 96-луночном планшете перед добавлением к планшету для анализа клеток. 100 мкл суспензии клеток (2 х 106 клеток) добавляют к каждой лунке стерильного 96-луночного круглодонного агглютационного планшета (Costar3790). К лункам добавляют 50 мкл раствора соединения при подходящем разведении и 50 мкл антитела анти-Fas, клон СН-11 (KamiyaМС-060) при конечной концентрации 10 нг/мл. Устанавливают контрольные лунки без антител и без соединения, но с серийным разведением ДМСО в качестве контроля-наполнителя. Планшеты инкубируют в течение 16-18 ч при 37 С в атмосфере с 5% CO2 и влажностью 95%. Апоптоз клеток измеряют количественным определением фрагментации ДНК с использованием Анализа обнаружения гибели клеток от Boehringer-Mannheim,1544 675. После инкубации в течение 16-18 ч аналитические планшеты центрифугируют при 100 х g при комнатной температуре в течение 5 мин. 150 мкл супернатанта удаляют и заменяют 150 мкл свежей полной среды. Клетки затем собирают и 200 мкл буфера для лизиса, доставляемого в наборе для анализа, добавляют в каждую лунку. Клетки измельчают для обеспечения полного лизиса и инкубируют в течение 30 мин при 4 С. Планшеты затем центрифугируют при 1900 х g в течение 10 мин и супернатант разводят 1:20 в предоставленном буфере для инкубации. 100 мкл данного раствора затем анализируют в соответствии с инструкциями изготовителя, предоставленными с набором. OD405 нм измеряют спустя 20 мин после добавления конечного субстрата в аппарате для прочтения планшетов SPECTRAmax Plus (Molecular Devices). Величины OD406 нм наносят на график по отношению к концентрации соединения и величины IC50 для соединений вычисляют с использованием программы построения кривых SOFTmax Pro (Molecular Devices), применяя опцию подгонки из четырех параметров. Выбранные соединения были испытаны в данном анализе и, как было обнаружено, они ингибируютFas-индуцированный апоптоз клеток Jurkat с величинами IC50 от 0,001 до 0,15 мкМ. Хотя авторами был описан ряд осуществлений данного изобретения, очевидно, что основные примеры авторов могут быть изменены для получения других осуществлений, которые используют соединения и способы данного изобретения. Кроме того, должно быть понятно, что объем данного изобретения должен определяться прилагаемой формулой изобретения, а не определенными осуществлениями, которые были представлены в примерах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемое производное,где Z представляет кислород;R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола,индолина, карбазола, фенотиазина, 5 Н-дибензо[b,f]азепина, 10,11-дигидро-5 Н-дибензо[b,f]азепина и дигидрофенантридина, необязательно замещенных до 2 заместителями, выбранными из галогена, трифторметила или C1-С 6 алифатической группы. 2. Соединение по п.1 где R1 представляет -CH2F. 3. Соединение по п.1, где R2 представляет -СО 2 Н. 4. Соединение по п.1, где R3 представляет этил, изопропил или трет-бутил. 5. Соединение по п.4, где R3 представляет изопропил.- 26005740 6. Соединение по п.1, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола, карбазола или фенотиазина, необязательно замещенных до 2 заместителями, выбранными из галогена, трифторметила или C1-С 6 алифатической группы. 7. Соединение по п.6, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола, карбазола или фенотиазина, необязательно замещенных до 2 атомами хлора. 8. Соединение по п.7, где R4 и R5, взятые вместе с находящимся между ними азотом, образуют кольцо, выбранное из индола или карбазола, необязательно замещенных до 2 атомами хлора. 9. Соединение по п.1, которое выбрано из следующих соединений:
МПК / Метки
МПК: C07D 209/86, A61K 31/395, A61P 43/00
Метки: карбаматные, каспазы, использование, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-5740-karbamatnye-ingibitory-kaspazy-i-ih-ispolzovanie.html" rel="bookmark" title="База патентов Евразийского Союза">Карбаматные ингибиторы каспазы и их использование</a>
Предыдущий патент: Способ амплификации нуклеиновых кислот
Следующий патент: Фильтрующий элемент
Случайный патент: Полиамидная композиция, содержащая полиамид 4,10