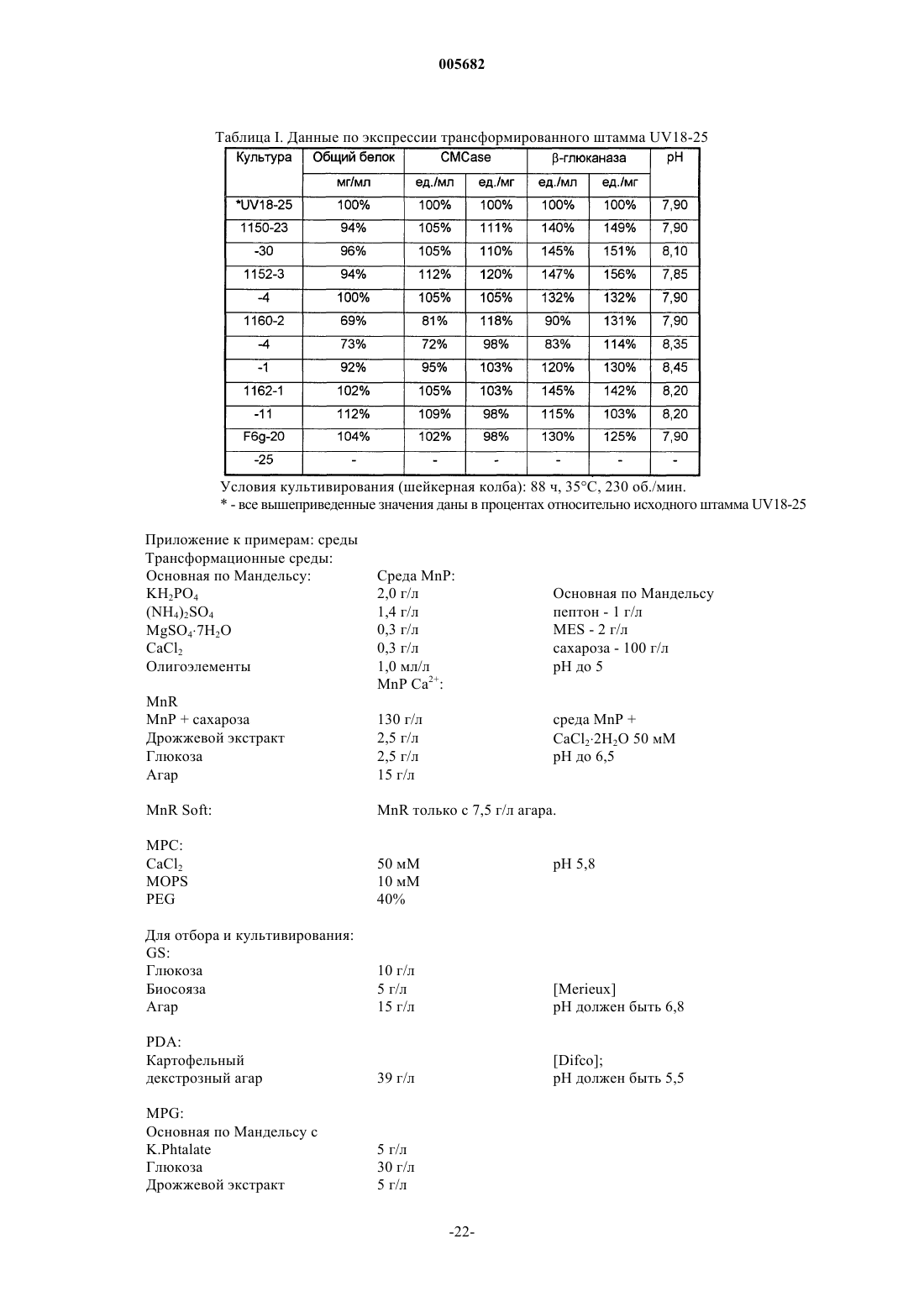
Трансформированные грибы, в частности рода chrysosporium, способные к синтезу гетерологичных полипептидов
Номер патента: 5682
Опубликовано: 28.04.2005
Авторы: Берлингейм Ричард Пол, Ван Зейл Корнелия Мария Йоханна, Пант Питер Ян, Парриш Мартин, Эмалфарб Марк Аарон, Буссон Жан Кристоф, Олсон Филип Терри, Синицин Аркадий Пантелеймонович, Пиннонен Кристин Мари
Формула / Реферат
1. Трансформированный микроорганизм рода Chrysosporium, содержащий последовательность нуклеиновой кислоты, кодирующую заданный полипептид, функционально связанную с гомологичным или гетерологичным участком, регулирующим экспрессию, распознаваемым указанным микроорганизмом Chrysosporium, и, необязательно, с секреторной сигнальной последовательностью, полученный путем трансформации исходного микроорганизма Chrysosporium генетической конструкцией, включающей последовательность нуклеиновой кислоты, кодирующую указанный полипептид.
2. Трансформированный микроорганизм по п.1, отличающийся тем, что указанный полипептид является гетерологичным полипептидом растений, животных (включая человека), водорослей, бактерий, архебактерий, вирусов или грибов.
3. Трансформированный микроорганизм по п.1, отличающийся тем, что указанный полипептид является гомологичным полипептидом, который экспрессируется на более высоком уровне по сравнению с соответствующим нетрансформированным микроорганизмом при одинаковых условиях.
4. Трансформированный микроорганизм по любому из пп.1-3, отличающийся тем, что указанный полипептид выбран из расщепляющих углеводы ферментов, протеаз, липаз, эстераз, других гидролаз, оксидоредуктаз и трансфераз.
5. Трансформированный микроорганизм по любому из пп.1-3, отличающийся тем, что указанный полипептид выбран из ферментов грибов, обеспечивающих сверхвыработку первичных метаболитов, органических кислот, вторичных метаболитов и антибиотиков.
6. Трансформированный микроорганизм по любому из пп.1-5, отличающийся тем, что указанный полипептид проявляет оптимальную активность и/или стабильность при pH выше 6 и/или сохраняет более 50% своей активности и/или стабильности при pH выше 6.
7. Трансформированный микроорганизм по любому из пп.1-6, содержащий гомологичную или гетерологичную секреторную сигнальную последовательность, полученную из грибов, функционально связанную с последовательностью нуклеиновой кислоты, кодирующей заданный полипептид.
8. Трансформированный микроорганизм по п.7, отличающийся тем, что указанная сигнальная последовательность представляет собой сигнальную последовательность целлюлазы, b-галактозидазы, ксиланазы, пектиназы, эстеразы, протеазы, амилазы, полигалактуроназы или гидрофобина.
9. Трансформированный микроорганизм по любому из пп.1-8, дополнительно содержащий селективный маркер, например маркер, обеспечивающий резистентность к лекарственному средству или восстанавливающий пищевой дефект.
10. Трансформированный микроорганизм по любому из пп.1-9, отличающийся тем, что указанный участок, регулирующий экспрессию, содержит индуцибельный или конститутивный промотор.
11. Трансформированный микроорганизм по п.10, отличающийся тем, что указанный промотор представляет собой промотор целлобиогидролазы, глюкоамилазы, глицеральдегидфосфатдегидрогеназы, алкогольдегидрогеназы-A, алкогольдегидрогеназы-R, фосфоглицерата, аспартопротеазы, липазы, b-галактозидазы, гидрофобина, протеазы, амилазы, ксиланазы, пектиназы, эстеразы, эндоглюканазы или полигалактуроназы.
12. Мутантный штамм Chrysosporium lucknowense, полученный с помощью мутагенеза, а именно УФ-облучением и/или обработкой N-метил-N'-нитро-N-нитрозогуанидином штамма C. lucknowense C1 (VKM F-3500 D), вырабатывающий, по крайней мере, такое же количество целлюлазы в молях на литр и/или вырабатывающий протеазы меньше, чем исходный штамм.
13. Мутантный штамм по п.12, представляющий собой штамм C. lucknowense UV13-6 (VKM F-3632 D), или происходящий от него.
14. Мутантный штамм по п.12, представляющий собой штамм C. lucknowense NG7C-19 (VKM F-3633 D), или происходящий от него.
15. Мутантный штамм по п.12, представляющий собой штамм C. lucknowense UV18-25 (VKM F-3631 D), или происходящий от него.
16. Мутантный штамм по любому из пп.13-15, отличающийся тем, что указанный штамм характеризуется биомассой, меньшей, чем половина от таковой у Trichoderma reesei, при этом указанная Trichoderma в культуре проявляет вязкость 200-600 сП при культивировании в эквивалентных условиях.
17. Мутантный штамм по любому из пп.13-16, отличающийся тем, что вырабатывает меньше, чем половину от количества протеазы, вырабатываемой исходным штаммом, на основе которого он получен.
18. Микроорганизм по п.1, полученный путем трансформации исходного штамма C. lucknowense C1 (VKM F-3500 D) и любого мутантного штамма по пп.13-17.
19. Конструкция нуклеиновой кислоты, включающая участок, регулирующий экспрессию, происходящий от микроорганизма Chrysosporium lucknowense, предпочтительно от штамма C. lucknowense C1 (VKM F-3500 D) или C. lucknowense UV18-25 (VKM F-3631 D), функционально связанный с последовательностью нуклеиновой кислоты, кодирующей заданный полипептид.
20. Конструкция нуклеиновой кислоты по п.19, отличающаяся тем, что указанный участок, регулирующий экспрессию, представляет собой промотор целлюлазы, ксиланазы или глицеральдегидфосфатдегидрогеназы, предпочтительно целлобиогидролазы (CBH1).
21. Трансформированный штамм микроскопического гриба, содержащий конструкцию нуклеиновой кислоты по любому из пп.19-20, способный экспрессировать полипептид, кодируемый соответствующей последовательностью нуклеиновой кислоты.
22. Способ получения полипептида, включающий культивирование микроорганизма по любому из пп.1-11, 18 и 21 в условиях, обеспечивающих экспрессию и предпочтительно секрецию полипептида, и последующее выделение полученного полипептида.
23. Способ по п.22, отличающийся тем, что культивирование осуществляют при pH в диапазоне 4-10 и/или при температуре от 25 до 43шC.
24. Способ получения микроорганизма рода Chrysosporium по любому из пп.1-13, включающий стабильную трансформацию исходного микроорганизма последовательностью нуклеиновой кислоты, кодирующей заданный полипептид, функционально связанной с участком, регулирующим экспрессию указанного полипептида.
25. Способ по п.24, отличающийся тем, что трансформацию осуществляют методом трансформации протопластов.
Текст
005682 Краткое содержание изобретения Предмет настоящего изобретения относится к новой трансформационной системе в области грибовгифомицетов для экспрессии и секреции гетерологичных белков или полипептидов. Также настоящее изобретение охватывает способ выработки больших количеств полипептида в промышленном масштабе. Данная система включает трансформированный или трансфицированный грибковый штамм рода Chrysosporium, более конкретно вида Chrysosporium lucknowense или его мутантов или производных. Также оно охватывает трансформантов, несущих кодирующие последовательности Chrysosporium. Заявлены новые мутантные штаммы Chrysosporium, a также получаемые от них новые ферменты. Предпосылки изобретения Ряд организмов-хозяев для экспрессии генов и способы трансформации были описаны в данной области техники ранее. Часто упоминаются бактерии, например, Escherichia coli. Однако, E.coli - это микроорганизм, который не способен секретировать ряд белков или полипептидов, и поэтому он является нежелательной клеткой-хозяином с точки зрения выработки белка или полипептида в промышленном масштабе. Дополнительным недостатком E.coli, который справедлив и для бактерий в целом, является то, что прокариотические организмы не могут обеспечивать дополнительные модификации, необходимые для большинства эукариотических белков или полипептидов, которые должны быть выработаны в активной форме. Гликозилирование белков и точная пространственная укладка белков - примеры процессинга, необходимого для обеспечения выработки активного белка или полипептида. Для обеспечения такого процессинга иногда можно использовать клетки млекопитающих: однако, недостатком таких клеток является то, что часто их трудно воспроизводить и для них нужны дорогостоящие культуральные среды. Следовательно, такие трансформационные системы непригодны для выработки белков или полипептидов в промышленном масштабе. Они могут быть рентабельны в случае получения очень дорогих фармацевтических соединений, требующихся в относительно небольшом количестве, но это не относится к ферментам, имеющим промышленное значение. Был разработан ряд грибковых экспрессионных систем, например, Aspergillus niger, Aspergillusawamori, Aspergillus nidulans, Trichoderma reesei. To же предполагалось и для ряда других объектов, но по различным причинам они не были приняты или не нашли широкого применения. В целом, идеальный организм-хозяин должен удовлетворять большому числу критериев: идеальный хозяин должен легко ферментироваться с использованием недорогих сред; идеальный хозяин должен эффективно утилизировать питательную среду; идеальный хозяин должен вырабатывать полипептид или белок с высоким выходом, т.е. должен проявлять высокое отношение количества белка к биомассе; идеальный хозяин должен быть способным к эффективной секреции данного белка или полипептида; идеальный хозяин должен обеспечивать простые выделение и очистку желательного белка или полипептида; идеальный хозяин должен процессировать желательный белок или полипептид таким образом, чтобы он вырабатывался в активной форме и чтобы не требовалось дополнительных стадий активации или модификации; идеальный хозяин должен легко подвергаться трансформации; идеальный хозяин должен позволять использовать широкий круг элементов, регулирующих экспрессию, тем самым обеспечивая простоту применения и эксплуатационную гибкость; идеальный хозяин должен позволять использовать простые селективные маркеры, использование которых недорого; идеальный хозяин должен продуцировать стабильные трансформанты; идеальный хозяин должен культивироваться в условиях, не являющихся вредными для экспрессируемого белка или полипептида, например, при низкой вязкости, низком сдвиговом усилии (при перемешивании). Грибковые системы, которые еще не нашли широкого применения, описаны, например, в патенте США 5578463 (Berka et al.), представляющем Neurospora, Podospora, Endothia, Mucor, Cochoibolus иPyricularia наряду с Aspergillus и Trichoderma. Однако, иллюстрации трансформации и экспрессии были представлены только для Aspergillus и Trichoderma и отсутствовали подробности в случае с любыми другими предусмотренными хозяевами. Международная патентная заявка WO 96/02563 и патенты США 5602004, 5604129 и 5695985,выданные Novo Nordisk, описывают недостатки систем Aspergillus и Trichoderma и предлагают условия культивирования для других грибков, которые могли бы быть более подходящими для крупномаcштабной выработки белка. Единственными представленными примерами среди возможных трансформированных культур являются примеры штаммов Myceliophthora thermophila, Acremonium alabamense,Thielavia terrestris и Sporotrichum cellulophilum. Штамм Sporotrichum описан как лизирующий и вырабатывающий зеленый пигмент в таких условиях ферментации, которые не дают такого результата в случае с другими штаммами. Неспорулирующий мутант Thielavia terrestris описан как организм выбора благодаря его морфологии. Однако при этом же подтверждается, что эффективность образования протопла-1 005682 стов Thielavia и Acremonium (где использованный штамм Acremonium был представлен несовершенной стадией использованного штамма Thielavia) низка и что гигромицин неприменим в качестве селективного маркера. Для большой группы других объектов также предположено потенциальное применение исходя из их морфологических параметров, однако их трансформация не описана. Предполагаемые штаммы относятся к родам Corynascus, Thermoascus, Chaetomium, Ctenomyces, Scytalidium и Talaromyces. Трансформированные хозяева упоминались исключительно как вырабатывающие низкие уровни внесенной ксиланазы Humicola, причем наименьшее ее количество вырабатывалось в Thielavia; однако, информация носит неясный характер и может скрывать то, что на самом деле лучшим оказался вариант сThielavia. Номенклатура этих ссылок основывается на наименованиях АТСС для промышленных грибков от 1994 г. Таким образом, ясно, что не было достигнуто высокого уровня гетерологичной экспрессии и на самом деле нет положительной корреляции между выбираемой морфологией и уровнем экспрессии. Если какая-либо корреляция и может иметь место, то скорее всего отрицательная. В соответствии с классификацией грибков АТСС от 1996 г. штамм Sporotrichium thermophilum ATCC 20493 является штаммомMyceliophthora thermophila. В настоящее время этот штамм идентифицируется как Myceliophthora thermophila. На основании этих недавних материалов видна непредсказуемость данной области техники. Также была описана (Allison et al., 1992, Curr. Genet., 21, 225-229) трансформация Humicola grisea сорта thermoidea с использованием литий-ацетатного метода и последовательность, кодирующая фермент Humicola, однако, сообщений об экспрессии гетерологичного белка этим штаммом представлено не было. В 1997 г. Hawaii Biotechnology Group был выдан патент на трансформированный грибок Neurospora,предназначенный для экспрессии такого пептида млекопитающих, как химозин. Для трансформации ауксотрофных Neurospora crassa использовали сферопласты. Были внесены эндогенные элементы регуляции транскрипции с осуществлением котрансформации. Ничего не говорится о других организмаххозяевах и других способах трансформации. Из имеющегося описания ничего нельзя сказать об уровне экспрессии. Сомнительно, чтобы уровень экспрессии был высоким, потому что иммунологические методы (применимые для выявления малых количеств белка) были единственными методами, использовавшимися для того, чтобы показать присутствие данного белка. Реального выделения белка заявлено не было. Международная патентная заявка WO 97/26330 от Novo Nordisk предлагает способ получения мутантов родительских клеток грибов-гифомицетов, обладающих улучшенным свойством вырабатывать гетерологичный полипептид. Этот способ включает вначале обнаружение специфически измененной морфологии с последующей оценкой того, вырабатывал ли трансформант больше гетерологичного полипептида по сравнению с его родительским штаммом. Данный способ проиллюстрирован только на штаммах Fusarium A3/5 и Aspergillus oryzae. Предполагается, что данный способ применим для Aspergillus, Trichoderma, Thielavia, Fusarium, Neurospora, Acremonium, Tolyplocadium, Humicola, Scytalidium,Myceliophthora или Mucor. Как отмечено выше, непредсказуемость данной области техники и также непредсказуемость способа процитированной заявки не дает принципиально применимой идеи для обоснованного достижения успеха. Подробное описание изобретения Теперь авторами изобретения будет описана альтернативная грибковая экспрессионная система,характеризующаяся упрощенным использованием по сравнению с упоминавшимися выше Aspergilli иTrichoderma, удовлетворяющая приведенным выше требованиям. Эта новая система не подразумевалась и не предполагалась в известной области техники. Эта новая система в соответствии с настоящим изобретением представляет дополнительные преимущества в том, что уровни трансформации выше тех,которые характерны для часто используемой системы Trichoderma reesei. Кроме того, условия культивирования предоставляют дополнительный плюс, т.к. являются преимущественными для экспрессируемого полипептида. По мере обращения в данном описании и прилагающейся формуле изобретения к полипептидам или представляющим интерес полипептидам, как продуктам экспрессионной системы по настоящему изобретению, этот термин также охватывает белки, т.е. полипептиды, обладающие конкретной функцией и/или вторичной, и/или третичной структурой. Величина рН культуральной среды может быть нейтральной или щелочной, т.е. без агрессивного и потенциально инактивирующего воздействия кислого рН на выработанный белок или полипептид. Также возможным является культивирование и при кислых значениях рН, например, рН=4, в случаях, когда белок или полипептид больше подходит для кислой среды. Предпочтительно культуры могут иметь место при рН=4,0-10,0. Однако предпочтение отдается нейтральному-щелочному рН, поскольку штаммхозяин лучше растет при таких величинах рН, как, например, между 6 и 9. Рост при щелочных значениях может происходить при рН=8 и выше и даже при таком высоком значении, как рН=10, что также в некоторых случаях является хорошей альтернативой. Также температура культивирования таких штаммовхозяев обеспечивает преимущество некоторым типам вырабатываемых полипептидов с точки зрения их стабильности. Подходящей температурой культивирования является температура 25-43 С. Температура в диапазоне от 40 С и ниже до 23 или 30 С также имеет преимущество по ее применению. Ясно, что такие условия представляют особенный интерес для выработки полипептидов млекопитающих. Выбирае-2 005682 мая температура будет зависеть от рентабельности культивирования и чувствительности полипептида или культивируемого штамма. Эти условия будут определены специалистом в данной области техники в каждом конкретном случае без излишних экспериментов, что является обычным в данной области техники. Также было установлено, что отношение биомассы к вязкости и количество выработанного белка является весьма предпочтительным для организма-хозяина по настоящему изобретению. Для проведения сравнений использовали Trichoderma longibrachiatum (ранее известный также как Trichoderma reesei) иAspergillus niger. Trichoderma longibrachiatum дал 2,5-5 г/л биомассы, Aspergillus niger - 5-10 г/л биомассы, а хозяин по настоящему изобретению - 0,5-1 г/л биомассы при соответствующих для него оптимизированных условиях. Таким образом, это означает 5-10-кратное улучшение по сравнению с используемыми промышленными штаммами. Эти промышленные штаммы являются штаммами, которые сами по себе рассматриваются в данной области техники как интенсивные продуценты белков и поэтому они успешно используются для промышленной выработки белков. Их культивируют при оптимальных для них условиях, разработанных и осуществляемых в масштабах крупных промышленных ферментационных установок. Те же штаммы были использованы для того, чтобы продемонстрировать огромное улучшение параметров вязкости для культур организма-хозяина по настоящему изобретению. В конце процесса ферментации Trichoderma longibrachiatum дает значение динамической вязкости 200-600 сПз (сантипуаз),Aspergillus niger - величину 1500-2000 сПз, а хозяин по настоящему изобретению - величину менее 10 сПз. Таким образом, это дает по крайней мере 20-200-кратное улучшение значений вязкости по сравнению с использованными промышленными штаммами. Следующим весьма неожиданным аспектом явилось то, что уровни белка, определенные для клеток-хозяев по настоящему изобретению, оказались более высокими по сравнению с промышленными штаммами Aspergilli и Trichoderma reesei, даже при упоминавшихся выше неожиданно меньших уровнях биомассы и вязкости. Как итог, внедряется простота использования гибкой улучшенной трансформационной системы и экспрессионной системы с улучшенными условиями культивирования. Штаммы по настоящему изобретению вырабатывают неожиданно высокие уровни белка при этих улучшенных условиях, и, кроме того, они обеспечивают это за более короткое время ферментации. Настоящее изобретение направлено на мутантные штаммы Chrysosporium, включающие последовательность нуклеиновой кислоты, кодирующую гетерологичный белок или полипептид, причем указанная последовательность нуклеиновой кислоты функционально соединена с регулирующим экспрессию сегментом и необязательно - с последовательностью, кодирующей секреторный сигнал, и/или с последовательностью, кодирующей белок-переносчик. Предпочтительно рекомбинантный штамм по настоящему изобретению должен секретировать представляющий интерес полипептид. Это позволит избежать необходимости разрушать клетку с целью выделения интересующего полипептида и также сведет к минимуму риск разрушения экспрессированного продукта другими компонентами клетки-хозяина.Chrysosporium может быть классифицирован по морфологии в соответствии с представленным уBarnettHunter, 1972, "Illustrated Genera of Imperfect Fungi", 3d Ed., Burgess Publ. Co. Известны и другие источники, описывающие подробности, касающиеся классификации грибков рода Chrysosporium, например, классификация по Саттону (C.A.N. Van Oorschot et al., 1980, "А revision of Chrysosporium andallied genera". In "Studies in Mycology", No. 20. CBS, Baarn, Netherlands, pp. 1-36). CBS - это одно из депозитарных учреждений, в соответствии с Будапештским договором. В соответствии с этими данными родChrysosporium входит в состав семейства Moniliaceae, относящегося к отряду Hyphomycetales (гифомицеты). Критерии, которые могут быть учтены, таковы. 1. Признаки отряда Hyphomycetales. Конидии образуются непосредственно на мицелии - на отдельных спороносных клетках или на обособленных конидиеносцах. 2. Признаки семейства Moniliaceae. Конидии и конидиеносцы (если они присутствуют) прозрачные или яркоокрашенные; конидиеносцы одиночные или образуют рыхлые пучки (коремии). 3. Признаки рода Chrysosporium Corda, 1833. Колонии обычно распластанные, белые, иногда кремовые, бледно-коричневые или желтые, бархатистые и/или порошковидные. Гифы почти всегда прозрачные, с гладкой поверхностью, с нерегулярным, более или менее ортотопическим ветвлением. Плодные гифы слабо дифференцированы или не дифференцированы вовсе. Конидии концевые и боковые,таллические, всегда расположенные на верхней стороне гиф, сидячие или расположенные на коротких ножках или боковых веточках, полупрозрачные или бледно-желтые, тонко- или толстостенные, почти шаровидные, булавовидные, грушевидные, обратнояйцевидные, одноклеточные, редко двуклеточные,усеченные. Иногда присутствующие интеркалярные конидии одиночные, в редких случаях образующие цепочки, полупрозрачные или бледно-желтые, шире нижележащей гифы, обычно одноклеточные, усеченные по обоим концам. Иногда присутствуют хламидоспоры. Другим источником, представляющим информацию по номенклатуре грибков, является АТСС(США). Сайт в Интернете этой коллекции - http://www.atcc.org. CBS также имеет свой сайт в Интернете-3 005682 такой информации является коллекция VKM в Москве: ее адрес в Интернете http://www.bdt.org.br.bdt.msdn.vkm/general. Другим источником является адрес http://NT.arsgrin.gov/fungaldatabases. Все эти источники могут предоставить информацию по диагностическим признакам Chrysosporium. Штаммы, определяемые как Myceliophthora thermophila, не рассматриваются как определяющие штаммы Chrysosporium в соответствии с определяемым в настоящем изобретении. В последнее время имелись существенные разногласия в номенклатуре некоторых штаммов Myceliophthora. Предпочтительными Chrysosporium по настоящему изобретению являются те штаммы, которые четко определяются и не могут быть перепутаны с Myceliophthora, Sporotrichum или Phanerochaete Chrysosporium. Следующие штаммы определяются как представляющие Chrysosporium, хотя определение Chrysosporium не ограничивается этими штаммами: С.botryoides, С.carmichaelii, С.crassitunicatum, C.europae,C.evolceannui, С.farinicola, C.fastidium, C.filiforme, C.georgiae, C.globiferum, C.globiferum var. articulatum,C.globiferum var. niveum, C.hirundo, C.hispanicum, C.holmii, C.indicum, C.inops, C.keratinophilum,C.kreiselii, C.kuzurovianum, C.lignorum, C.lobatum, C.lucknowense, C.lucknowense Garg 27K, C.medium,C.medium var. spissescens, C.mephiticum, C.merdarium, C.merdarium var. roseum, C.minor, C.pannicola,C.parvum, C.parvum var. crescens, C.pilosum, C.pseudomerdarium, C.pyriformis, C.queenslandicum, C.sigleri,C.sulfureum, C.synchronum, C.tropicum, C.undulatum, C.vallenarense, C.vespertilium, C.zonatum. С.lucknowense является одним из видов Chrysosporium, которые привлекали конкретное внимание потому, что он представляет собой естественный интенсивный продуцент целлюлазных белков (WO 98/15633 и связанный патент США 5811381). Характеристики С.lucknowense таковы: Колонии за 14 дней достигают 55 мм в диаметре при росте на агаре с глюкозой Sabouraud, окрашены в кремовый цвет, пушистые и бархатистые; плотные, 3-5 мм в высоту; края четкие, правильной формы и бахромчатые; обратная сторона от бледно-желтой до кремовой. Гифы прозрачные, гладко- и тонкостенные, слабо ветвящиеся. Большинство воздушных гиф плодущие и имеют часто расположенные перегородки, шириной примерно 1-3,5 мм. Погруженные гифы бесплодны, примерно 1-4,5 мм в ширину, а более тонкие гифы обычно бывают закрученными. Конидии концевые и боковые, в основном сидячие или на коротких, часто на конических ножках или коротких боковых веточках. Конидии одиночные, но расположены плотно друг к другу, на 1 клетке гифы развивается по 1-4 конидии - полупрозрачные, отчетливо тонко- и гладкостенные, в основном почти шарообразные, также булавовидные и обратно яйцевидные, 1-клеточные, 2,5 х 11 х 1,5-6 мм, с широкими базальными рубцами (1-2 мм). Интеркалярные конидии отсутствуют. Хламидоспоры отсутствуют. Примерами штаммов Chrysosporium lucknowense являются АТСС 44006, CBS 251.72, CBS 143.77 и CBS 272.77, а другие примеры представлены в WO 98/15633 и в патенте США 5811381. У этого вида был выделен еще один штамм, характеризующийся даже более высокой способностью вырабатывать целлюлазы. Этот штамм обозначен С 1 в соответствии с собственной индексацией и был депонирован в Международный депозитарий Всероссийской коллекции микроорганизмов Российской Академии наук по адресу: Россия 113184, Москва, ул. Бахрушина, 8, - 29 августа 1996 г. в соответствии с Будапештским договором под депозитарнымVKM F-3500D. Он называется Chrysosporiumlucknowense Garg 27K. Характеристики штамма С 1 таковы. Примерно за 7 дней колонии вырастают на картофельно-декстрозном агаре до примерно 55-66 мм в диаметре; окрашены в беловато-кремовый цвет, пушистые, в центре высотой 2-3 мм; края четкие, правильной формы, бахромчатые; обратная сторона бледно-кремовая. Гифы прозрачные, гладко- и тонкостенные, слабо ветвящиеся. Воздушные гифы - плодущие, с перегородками, шириной 2-3 мм. Погруженные гифы бесплодные. Конидии концевые и боковые; сидячие или находящиеся на коротких боковых веточках; отсутствуют; одиночные, но расположены близко друг от друга, прозрачные, тонко- и гладкостенные, почти шаровидные, булавовидные или обратнояйцевидные, 1-клеточные, 4-10 мм. Хламидоспоры отсутствуют. Интеркалярные конидии отсутствуют. Способ выделения штамма С 1 описан в WO 98/15633 и в патенте США 5811381. Штаммы, характеризующиеся такой морфологией, включены в определение Chrysosporium в соответствии с настоящим изобретением. Также в диапазон определения Chrysosporium включаются штаммы, производные от предшественников Chrysosporium, включая те, которые были мутированы так или иначе либо нативным путем, либо с помощью индуцированного мутагенеза. В частности, настоящее изобретение охватывает мутанты Chrysosporium, полученные с помощью индуцированного мутагенеза, например, путем сочетания облучения и химического мутагенеза. Например, штамм С 1 был мутирован путем воздействия на него ультрафиолета с образованием штамма UV13-6. Этот штамм был после этого мутирован действием N-метил-N'-нитро-Nнитрозогуанидина с получением штамма NG7C-19. Последний штамм, в свою очередь, подвергали мутированию действием ультрафиолета с получением штамма UV18-25. В ходе этого мутационного процесса морфологические признаки в некоторой степени варьировались как в жидкой культуре и на чашках, так и при анализе под микроскопом. На каждом последующем этапе мутагенеза культуры проявляли менее пушистый и бархатистый вид на чашках по сравнению с тем, что было описано в характеристике Chrysosporium, вплоть до получения плоских и матовых колоний. Также у мутантных штаммов в меньшей сте-4 005682 пени выражен коричневый пигмент, выявляемый в некоторых средах у штамма дикого типа. В жидкой культуре мутант UV18-25 заметно менее вязок по сравнению с диким типом С 1 и мутантами UV13-6 иNG7C-19. Хотя все штаммы сохраняют основные микроскопические характеристики Chrysosporium, мицелий становится все уже по мере последовательного мутирования, и у штамма UV18-25 можно наблюдать отчетливую фрагментацию мицелия. По-видимому, эта фрагментация мицелия обусловлена меньшей вязкостью, характерной для культур UV18-25. Способность штаммов к споруляцими снижается с каждым этапом мутирования. Вышесказанное иллюстрирует то, что для штаммов, принадлежащих к роду Chrysosporium, характерно некоторое отклонение от описанных выше морфологических критериев. Помимо этого на каждом этапе мутирования выработка целлюлазы и внеклеточных белков также увеличивается, хотя некоторые мутации обусловливают снижение экспрессии протеаз. Критерии, на основании которых может быть определена таксономия грибков, доступны, например, от CBS, VKMF и АТСС. В частности, анаморф Chrysosporium, как было обнаружено, пригоден для использования в выработке по настоящему изобретению. Метаболизм у анаморфа делает его исключительно подходящим для высокоинтенсивной экспрессии. Телеоморф также должен быть пригоден потому, что генетические основы анаморфов и телеоморфов идентичны. Различие между анаморфом и телеоморфом состоит в том,что один из них представляет бесполый тип, а другой - половой тип. Эти два типа в некоторых условиях характеризуются неодинаковой морфологией. Предпочтительно использовать нетоксичные штаммы Chrysosporium, значительное число которых известно в данной области техники, потому что они будут снижать опасность для окружающей среды в случае крупномасштабной выработки и будут упрощать процедуры выработки при соответствующем снижении себестоимости. Регулирующим экспрессию участком является последовательность ДНК, распознаваемая в связи с экспрессией штаммом-хозяином Chrysosporium. Он включает промоторную последовательность, функционально соединенную с последовательностью нуклеиновой кислоты, кодирующей предназначенный для экспрессии полипептид. Промотор присоединен таким образом, чтобы расположенный вслед за ним инициирующий кодон в последовательности, предназначенной для экспрессии, обеспечивал экспрессию. Промоторная последовательность может быть конститутивной или индуцибельной. Рассматривается любая регулирующая экспрессию последовательность или их сочетание, способные обеспечивать экспрессию полипептида в штамме Chrysosporium. Предпочтительно регулирующая экспрессию последовательность является грибковым регулирующим экспрессию участком, например, регуляторным участком аскомицета. Подходящим грибковым регулирующим экспрессию участком является участок от любого из следующих родов грибков: Aspergillus, Trichoderma, Chrysosporium, Hansenula, Mucor, Pichia, Neurospora,Tolypocladium, Rhizomucor, Fusarium, Penicillium, Saccharomyces, Tolaromyces или их альтернативные половые типы, такие как Emericella, Hypocrea, например, промотор целлобиогидролазы Trichoderma,промотор глюкоамилазы Aspergillus, промотор глицеральдегидфосфатдегидрогеназы Aspergillus, промотор алкогольдегидрогеназы-А и алкоголь-дегидрогеназы-R Aspergillus, промотор амилазы ТАKА Aspergillus, промоторы факторов контроля фосфоглицератных и связанных метаболических путей Neurospora,промотор аспартопротеазы Rhizomucor miehei, промотор липазы Rhizomucor miehei и промотор галактозидазы Penicillium canescens. Наиболее подходящей является регулирующая экспрессию последовательность от представителя того же рода, что и штамм-хозяин, поскольку в этом случае наиболее вероятно удастся направленно приспособить его к конкретному хозяину. Таким образом, предпочтительная регулирующая экспрессию последовательность происходит от штамма Chrysosporium. Авторы изобретения обнаружили конкретные штаммы Chrysosporium, экспрессирующие белки в очень высоких количествах, и конкретный интерес представляют естественные регулирующие экспрессию последовательности от этих штаммов. Эти штаммы согласно собственной номенклатуре обозначены как штамм С 1, штамм UV13-6, штамм NG7C-19 и штамм UV18-25 Chrysosporium. Они были депонированы в соответствии с Будапештским договором в депозитарий Всероссийской коллекции (VKM) в Москве. Штамм дикого типа С 1 был депонирован в соответствии с Будапештским договором под номеромVKM F-3500 D, дата депонирования - 29 августа 1996 г., мутант C1 UV13-6 был депонирован под номером VKM F-3632 D, дата депонирования - 2 сентября 1998 г., мутант Cl NG7C-19 был депонирован под номером VKM F-3633 D, дата депонирования - 2 сентября 1998 г., а мутант C1 UV18-25 был депонирован под номером VKM F-3631 D, дата депонирования - 2 сентября 1998 г. Предпочтительно используется регулирующий экспрессию участок, обеспечивающий интенсивную экспрессию в выбранном хозяине. Также им может быть регулирующий интенсивную экспрессию участок, производный от гетерологичного хозяина, такого как те, которые хорошо известны в данной области техники. Конкретными примерами белков, для которых известна экспрессируемость в больших количествах и которые поэтому предоставляют подходящие регулирующие экспрессию последовательности по настоящему изобретению, являются, тем самым не ограничиваясь, гидрофобии, протеаза, амилаза,ксиланаза, пектиназа, эстераза, -галактозидаза, целлюлаза (например, эндоглюканаза, целлобиогидролаза) и полигалактуроназа. Интенсивная выработка была установлена в условиях и твердофазной, и глубинной ферментации. Тесты на оценку присутствия или выработки таких белков хорошо известны в-5 005682 данной области техники. Многочисленные примеры можно найти, например, в каталогах Sigma и Megazyme. Фирма Megazyme находится в Ирландии: Bray Business Park, Bray, County Wicklow. У фирмыSigma Aldrich имеется много филиалов в различных странах мира, например, в США: P.O.Box 14508,St.Louis, МО. Для целлюлазы авторы использовали доступные из коммерческих источников тесты, такие как тесты CMCase, эндовискометрические тесты, тесты с авицелазой, -глюканазные тесты, тестыRBBCMCase, тесты Cellazyme-C. Альтернативные тесты хорошо известны специалистам в данной области техники и могут быть найдены в научной литературе, касающейся данного объекта, и такая информация включена здесь для сведения в виде библиографических ссылок. В качестве примера авторы ссылаются на журнал "Methods in Enzymology" от 1-го тома (1955) до томов 297-299, вышедших в 1998 г. Предпочтительно используется промоторная последовательность Chrysosporium с целью обеспечения хорошего распознавания ее организмом-хозяином. Авторы изобретения обнаружили, что гетерологичные регулирующие экспрессию последовательности работают в Chrysosporium столь же эффективно, как и нативные последовательности Chrysosporium. Это позволяет использовать хорошо известные конструкции и векторы для трансформации Chrysosporium, равно как и предоставляет многочисленные иные возможности для конструирования векторов,обеспечивающих хорошие уровни экспрессии в данном новом экспрессирующем и секретирующем хозяине. Например, стандартные способы трансформации Aspergillus могут быть использованы в соответствии с описанным, например, у Christiansen et al., 1988, BioTechnol., 6, 1419-1422. Другие документы, в которых имеются подробности о векторах для трансформации Aspergillus, например, патенты США 4816405, 5198345, 5503991, 5364770 и 5578463, ЕР-В-215594 (также для Trichoderma), и их содержание включено здесь для сведения в виде библиографических ссылок. Поскольку для штаммов Chrysosporium были установлены исключительно высокие уровни экспрессии целлюлазы, то конкретно предпочтительными являются регулирующие экспрессию участки таких белков. В качестве конкретных примеров авторы ссылаются на ранее упоминавшиеся депонированные штаммы Chrysosporium. Конструкция нуклеиновой кислоты, включающая участок, регулирующий экспрессию нуклеиновой кислоты, из Chrysosporium, предпочтительно из Chrysosporium lucknowense или его производного, образует отдельный вариант настоящего изобретения, как это имеет место в мутантном штамме Chrysosporium, у которого он функционально присоединен к полипептиду, который должен быть экспрессирован. Предпочтительно такая конструкция нуклеиновой кислоты будет являться регулирующим экспрессию участком из Chrysosporium, связанным с экспрессией целлюлазы или ксиланазы, предпочтительно с экспрессией целлобиогидролазы, более конкретно с экспрессией целлобиогидролазы 55 кД. В качестве примера рассматриваются промоторные последовательности эндоглюканазы 25 кД (C1-EG5) и эндоглюканазы 43 кД (C1-EG6) Chrysosporium, причем молекулярные массы определяют по данным электрофореза в ДСН-ПААГ (по параметрам аминокислотных последовательностей молекулярные массы составили 21,9 кД и 39,5 кД). Таким образом, промоторные последовательности гидрофобина, протеазы, амилазы, ксиланазы, эстеразы, пектиназы, -галактозидазы, целлюлазы (например, эндоглюканазы, целлобиогидролазы) и полигалактуроназы рассматриваются как также попадающие в объем настоящего изобретения. Подходящим образом могут быть использованы любые промоторные или регуляторные участки экспрессируемых ферментов, описанных в табл. А или В. Последовательность нуклеиновой кислоты по настоящему изобретению подходящим образом может быть получена от штамма Chrysosporium в соответствии с настоящим изобретением, причем такой штамм определен в другой части данного описания. Способы,с помощью которых могут быть определены промоторные последовательности, многочисленны и хорошо известны в данной области техники. На такую последовательность будут указывать эксперименты по нуклеазному удалению участка, находящегося перед кодоном ATG в начале анализируемого гена. Также,например, к нахождению представляющего интерес гена может привести анализ консенсусных последовательностей. С применением методов гибридизации и амплификации специалист в данной области техники легко сможет достичь соответствующих промоторных последовательностей. Промоторные последовательности эндоглюканаз С 1 были идентифицированы таким путем с помощью клонирования соответствующих генов и приведены в SEQ ID NO 2 (EG5) и 1 (EG6), соответственно. Другими предпочтительными промоторами в соответствии с настоящим изобретением являются промотор целлобиогидролазы 55 кД (СВН 1) и промотор ксиланазы 30 кД (XylF), поскольку эти ферменты экспрессируются на высоком уровне под контролем их собственных промоторов. Соответствующие промоторные последовательности могут быть идентифицированы напрямую путем клонирования в соответствии с описанным ниже для промоторов эндоглюканазы с использованием информации о частичных последовательностях, приведенных в SEQ ID NO 4 (для СВН 1) и SEQ ID NO 5 (для XylF), соответственно. Промоторы ферментов Chrysosporium, разрушающих углеводы, особенно промоторы С 1, могут иметь преимущество в использовании для экспрессии желательных полипептидов в организме-хозяине, особенно в грибке или ином микробном организме-хозяине. Частью настоящего изобретения являются промоторные последовательности, характеризующиеся идентичностью нуклеотидных последовательностей по крайней мере на 60%, предпочтительно по крайней мере 70%, наиболее предпочтительно по крайней-6 005682 мере 80% по отношению к последовательности, показанной в SEQ ID NO 1 и 2 или последовательностям,обнаруживаемым в других генах Chrysosporium. В качестве вариантов рекомбинантного штамма и последовательности нуклеиновой кислоты по настоящему изобретению авторы также ссылаются на примеры. Также авторы изобретения ссылаются на рекомбинантные штаммы в известной области техники, описывающей обеспечивающие интенсивную экспрессию промоторные последовательности, в частности, те, которые обеспечивают интенсивную экспрессию в грибках, например, такие, которые заявлены для Aspergillus и Trichoderma. В известной области техники представлен ряд регулирующих экспрессию участков для использования в Aspergillus, например, в патенте США 5252726, Novo, и в патенте США 5705358, Unilever. Содержание таких документов из известной области техники включено здесь для сведения в виде библиографических ссылок. Ген гидрофобина является грибковым геном, характеризующимся интенсивной экспрессией. Так,предполагается, что промоторная последовательность гена гидрофобина, предпочтительно от Chrysosporium, может быть подходящим образом использована в качестве регулирующей экспрессию последовательности в предпочтительном варианте настоящего изобретения. Последовательности генов гидрофобина Trichoderma reesei и Trichoderma harzianum были описаны, например, в известной области техники,равно как и последовательность гена Aspergillus fumigatus и Aspergillus nidulans, и соответствующая информация о последовательностях включена здесь в виде библиографических ссылок (Munoz et al., 1997,Curr. Genet., 32 [3], 225-230; T. Nakari-Setala et al., 1996, Eur. J. Biochem., 235 [1-2], 248-255; M. Parta et al.,1994, Infect. Immunol., 62 [10], 4389-4395; M.A. Stringer et al., 1995, Mol. Microbiol., 16 [1], 33-44). С использованием информации по этим последовательностям специалист в данной области может получить регулирующие экспрессию последовательности генов гидрофобина Chrysosporium без дополнительных экспериментов с помощью стандартных методов, которые уже упоминались выше. Рекомбинантный штамм Chrysosporium по настоящему изобретению может включать участок регуляции гидрофобина,функционально присоединенный к последовательности, кодирующей интересующий полипептид. Регулирующая экспрессию последовательность также может включать дополнительно энхансер или силенсер. Они также хорошо известны в данной области техники и обычно располагаются на некотором расстоянии от промотора. Регулирующие экспрессию последовательности также могут включать промоторы с сайтами связывания активаторов и сайтов связывания репрессоров. В некоторых случаях такие сайты также могут быть модифицированы с целью удаления такого типа регуляции. Были описаны промоторы грибков-гифомицетов, в составе которых имеются сайты сrеА. Такие сайты сrеА могут быть мутированы с целью исключения глюкозной репрессии, которая в норме обусловливается присутствием немутированных сайтов. Этот принцип проиллюстрирован в WO 94/13820 от Gist-Brocades. Использование такого промотора обеспечивает выработку полипептида, кодируемого последовательностью нуклеиновой кислоты, регулируемой данным промотором в присутствии глюкозы. Тот же принцип также ясен из международной патентной заявки WO 97/09438. Данные промоторы могут быть использованы либо с сайтами сrеА, либо без них. Мутанты, у которых были мутированы сайты сrеА, могут быть использованы в качестве регулирующих экспрессию последовательностей в рекомбинантных штаммах по настоящему изобретению, а последовательность нуклеиновой кислоты, которую они регулируют, может быть затем экспрессирована в присутствии глюкозы. Такие промоторы Chrysosporium обеспечивают дерепрессию аналогично тому, что показано в международной патентной заявке WO 97/09438. В данной области техники известна идентичность сайтов сrеА. С другой стороны, возможным является использование промотора с сайтами связывания СrеА, которые не были подвергнуты мутированию, в штамме-хозяине, несущем мутацию где-либо еще в составе репрессибельной системы, например в самом гене сrеА, таким образом, что этот штамм способен, несмотря на присутствие сайтов связывания сrеА, вырабатывать белок или полипептид в присутствии глюкозы. Терминаторные последовательности также являются регулирующими экспрессию последовательностями, и они функционально присоединены к 3'-концу последовательности, которая должна быть экспрессирована. По-видимому, любой грибковый терминатор может быть функциональным в штаммехозяине Chrysosporium по настоящему изобретению. Примерами являются терминатор trpC A.nidulans(1), терминатор -глюкозидазы A.niger (2), терминатор глюкоамилазы A.niger (3), терминатор карбоксипротеазы Mucor miehei (патент США 5578463) и терминатор целлобиогидролазы Trichoderma reesei. В естественных условиях терминаторные последовательности Chrysosporium будут функционировать вChrysosporium и они являются подходящими, например, терминатор EG6. Подходящий рекомбинантный штамм Chrysosporium по настоящему изобретению несет предназначенную для экспрессии последовательность нуклеиновой кислоты, функционально соединенную с последовательностью, кодирующей аминокислотную последовательность, определяемую как сигнальная последовательность. Сигнальная последовательность - это аминокислотная последовательность, которая,в случае функционального соединения с аминокислотной последовательностью экспрессированного полипептида, позволяет ей секретироваться из грибка-хозяина. Такая сигнальная последовательность может быть нативно ассоциированной с гетерологичным полипептидом или может являться нативной для данного хозяина. Также она может быть чужеродной и для хозяина, и для полипептида. Последовательность нуклеиновой кислоты, кодирующая сигнальную последовательность, должна располагаться в пре-7 005682 делах общей рамки считывания, чтобы была обеспечена трансляция сигнальной последовательности и гетерологичного полипептида. Рассматривается любая сигнальная последовательность, способная обеспечивать секрецию полипептида из штамма Chrysosporium. Предпочтительно такая сигнальная последовательность является грибковой сигнальной последовательностью, предпочтительно сигнальной последовательностью аскомицета. Подходящими примерами сигнальных последовательностей могут быть производные дрожжей в целом или любых из следующих конкретных родов грибков: Aspergillus, Trichoderma, Chrysosporium,Pichia, Neurospora, Rhizomucor, Hansenula, Humicola, Mucor, Tolypocladium, Fusarium, Penicillium, Saccharomyces, Talaromyces или их альтернативные половые типы, подобные Emericella, Hypocrea. В частности,применимыми часто являются сигнальные последовательности, которые естественным образом связаны со следующими белками - целлобиогидролазой, эндоглюканазой, -галактозидазой, ксиланазой, пектиназой, эстеразой, гидрофобином, протеазой или амилазой. Примерами являются амилаза или глюкоамилазаAspergillus или Humicola (4), ТАКА-амилаза Aspergillus oryzae, -амилаза Aspergillus niger, карбоксипептидаза Mucor (патент США 5578463), липаза или протеиназа Rhizomucor miehei, целлобиогидролазаTrichoderma (5), -галактозидаза Penicillium canescens и -фактор полового типа дрожжей Saccharomyces. Как альтернатива, сигнальная последовательность может происходить от гена амилазы или субтилизина штамма Bacillus. Сигнальная последовательность от того же рода, к которому относится конкретный штамм-хозяин, является наиболее подходящей потому, что она с наибольшей вероятностью специфическим образом приспособится к конкретному хозяину: следовательно, предпочтительной сигнальной последовательность является сигнальная последовательность Chrysosporium. Авторами изобретения были обнаружены отдельные штаммы Chrysosporium, выделяющие белки в очень высоких количествах,поэтому нативные сигнальные последовательности из таких штаммов представляют конкретный интерес. Согласно собственной номенклатуре эти штаммы обозначаются как штамм С 1, штамм UV13-6, штаммNG7C-19 и штамм UV18-25 Chrysosporium. Они были депонированы в соответствии с Будапештским договором, что описано в другой части настоящей заявки. Применимы сигнальные последовательности от грибков-гифомицетов, дрожжей и бактерий. Также рассматриваются как применимые сигнальные последовательности негрибкового происхождения, в частности, бактериальные, растительные и от млекопитающих. Рекомбинантный штамм Chrysosporium по любому из вариантов настоящего изобретения может дополнительно включать селективный маркер. Такой селективный маркер будет обеспечивать простой отбор трансформированных или трансфицированных клеток. Часто селективный маркер кодирует генный продукт, обеспечивающий специфический тип резистентности, нехарактерный для нетрансформированного штамма. Это может быть резистентность к тяжелым металлам, антибиотикам и биоцидам в целом. Применимым селективным маркером, не связанным с антибиотиками, также является прототрофия. Не являющиеся антибиотиками селективные маркеры могут быть предпочтительными тогда, когда интересующий белок или полипептид предназначен для использования в пищевом или фармацевтическом продукте, с точки зрения более быстрого или менее сложного пути официальной сертификации такого продукта. Очень часто в качестве таких маркеров используется индикация GRAS. Для специалиста в данной области техники доступное значительное количество таких маркеров. Например, такой список предоставляет FDA. Наиболее часто используемыми являются селективные маркры, выбираемые из группы, придающей резистентность к лекарственному средству или восстановление пищевого дефекта,например, из группы, включающей amdS (ацетамидаза), hph (гигромицинфосфотрансфераза), pyrС (оротидин-5'-фосфатдекарбоксилаза), trpC (антранилатсинтаза), аrgВ (орнитинкарбамоилтрансфераза), sC(сульфатаденилтрансфераза), bar (фосфинотрицинацетилтрансфераза) резистентность к глюфозинату,niaD (нитратредуктаза), ген резистентности к блеомицину, более конкретно Sh-ble, резистентность к сульфонилмочевине, например, ацетолактатсинтазная мутация ilv1. Также отбор может быть проведен с использованием котрансформации, когда селективный маркер входит в состав отдельного вектора или когда селективный маркер находится в том же фрагменте нуклеиновой кислоты, что и последовательность, кодирующая интересующий полипептид. По использованию в данном тексте термин гетерологичный полипептид обозначает белок или полипептид, который в норме не экспрессируется и не секретируется штаммом-хозяином Chrysosporium,используемым для экспрессии в соответствии с настоящим изобретением. Полипептид может происходить от растения или животного (позвоночного или беспозвоночного), например, от млекопитающего,рыбы, насекомого, или от микроорганизма, при условии, что он отсутствует в штамме-хозяине. Млекопитающим может являться человек. Микроорганизмами являются вирусы, бактерии, архебактерии и грибки, например, гифомицеты и дрожжи. Соответствующие списки бактерий и архебактерии представлены в руководстве "Bergey's Manual for Bacterial Determinology". С точки зрения фармацевтических целей весьма часто преимущество будут получать белки человека, поэтому рекомбинантный хозяин по настоящему изобретению, сформированный в предпочтительном варианте, будет являться хозяином, в котором полипептид происходит от человека. Для таких целей, как выработка пищевых продуктов, подходящий гетерологичный полипептид будет производным от животного, растения или водорослей. Следо-8 005682 вательно, такие варианты также рассматриваются как подходящие примеры настоящего изобретения. Альтернативные применимые варианты также включают гетерологичный полипептид любого бактериального, дрожжевого, вирусного, архебактериального и грибкового происхождения. Наиболее предпочтительным является грибковое происхождение. Подходящий вариант настоящего изобретения будет включать последовательность гетерологичной нуклеиновой кислоты с адаптированной библиотекой кодонов. Такая последовательность кодирует нативную аминокислотную последовательность организма-хозяина, от которой она происходит, но характеризуется отличающейся нуклеотидной последовательностью, т.е. нуклеотидной последовательностью,в которой определенные кодоны были заменены другими кодонами, кодирующими ту же аминокислоту,но которые чаще используются штаммом-хозяином, используемым для экспрессии. Это может обеспечивать лучшую экспрессию последовательности гетерологичной нуклеиновой кислоты. Это является обычной практикой для специалистов в данной области техники. Такая коррекция библиотеки кодонов может быть осуществлена на основе известной библиотеки кодонов при сопоставлении грибковых и не грибковых библиотек. Она также может быть еще более целенаправленно адаптирована к библиотеке кодоновAspergillus, должны обеспечивать обмен последовательностями таких организмов без коррекции библиотеки кодонов. Подробности, касающиеся библиотек кодонов этих грибков, доступны специалистам и включены здесь для сведения в виде библиографических ссылок. Настоящее изобретение не ограничивается вышеупомянутыми рекомбинантными штаммами Chrysosporium, но также охватывает рекомбинантный штамм Chrysosporium, включающий последовательность нуклеиновой кислоты, кодирующую гомологичный для штамма Chrysosporium белок, при том, что указанная последовательность нуклеиновой кислоты функционально присоединена к регулирующему экспрессию участку, а указанный рекомбинантный штамм экспрессирует упомянутый белок более интенсивно, чем соответствующий нерекомбинантный штамм, при соблюдении одинаковых условий. В случае интересующего гомологичного полипептида им предпочтительно является нейтральный или щелочной фермент, такой как гидролаза, протеаза или фермент, разрушающий углеводы, описанные в литературе. Также полипептид может быть кислым. Предпочтительно рекомбинантный штамм будет экспрессировать полипептид в большем количестве, чем нерекомбинантный штамм. Все замечания, приведенные выше для гетерологичного белка, также справедливы (в равной степени) для гомологичного полипептида целлюлазы. Таким образом, настоящее изобретение также охватывает генетически сконструированные штаммыChrysosporium, причем внесенная последовательность может происходить от Chrysosporium. Однако такой штамм может отличаться от встречающихся в природе штаммов тем, что, например, в последовательности нуклеиновой кислоты, использованной для трансформации или трансфекции Chrysosporium,имеются гетерологичные последовательности, тем фактом, что присутствуют множественные копии последовательности, кодирующей представляющий интерес полипептид, или тем фактом, что они экспрессируются в количестве, превышающем таковое у генетически несконструированного штамма при идентичности условий, или тем фактом, что экспрессия происходит в таких условиях, в которых в норме экспрессия отсутствует. Последнее может иметь место в случае, если индуцибельный промотор регулирует интересующую последовательность в противоположность ситуации с нерекомбинантным штаммом, или если иной фактор индуцирует экспрессию, чего не происходит в случае генетически несконструированного штамма. В соответствии с определенными предыдущими вариантами настоящее изобретение не призвано охватить штаммы Chrysosporium, встречающиеся в естественных условиях. Настоящее изобретение направлено на штаммы, сконструированные с применением либо классических генетических методов, либо генноинженерных методик. Все рекомбинантные штаммы по настоящему изобретению могут включать последовательность нуклеиновой кислоты, кодирующую гетерологичный белок, выбираемый из разрушающих углеводы ферментов (целлюлаз, ксиланаз, маннаназ, маннозидаз, пектиназ, амилаз, например, глюкоамилаз, амилаз, - и -галактозидаз, - и -глюкозидаз, -глюканаз, хитиназ, хитаназ), протеаз (эндопротеаз,аминопротеаз, амино- и карбоксипептидаз), других гидролаз (липаз, эстераз, фитаз), оксидоредуктаз (каталаз, глюкооксидаз) и трансфераз (трансгликозилаз, трансглютаминаз, изомераз и инвертаз).-9 005682 Таблица А. Диапазон рН, при которых ферменты сохраняют активность и/или стабильность- молекулярные массы (по данным MALDI). Примечание:все другие молекулярные массы по данным электрофореза в ДСН-ПААГферменты были взяты при равном количестве белкаХуl = ксиланазаэндо = эндоглюканазаGal = галактозидазаGluc = глюкозидазаСВН = целлобиогидролазаPGU = полигалактуроназа Таблица В. Активности ферментов, выделенных из ультрафильтратов штамма 18-25,в отношении рамичных субстратов (при рН=5), ед./мг белка молекулярные массы (по данным MALDI)активность в отношении красильного казеина выражена в условных единицах на мг-10 005682 Наиболее интересными продуктами, которые должны быть получены в соответствии с настоящим изобретением, являются целлюлазы, ксиланазы, пектиназы, липазы и протеазы, причем целлюлазы и ксиланазы расщепляют -1,4-связи, а целлюлазы включают эндоглюканазы, целлобиогидролазы и глюкозидазы. Эти белки характеризуются интенсивным применением в различных производственных процессах, известных в данной области техники. Конкретно в связи с целлюлазами авторы ссылаются,например, на WO 98/15633, описывающую использование целлобиогидролаз и эндоглюканаз. Содержание упомянутой заявки включено здесь для сведения. Также авторы изобретения ссылаются на таблицы А и В, дающие дополнительную информацию о представляющих интерес белках Chrysosporium. В настоящем изобретении было обнаружено, что мутанты Chrysosporium могут быть получены таким образом, чтобы снизить экспрессию протеазы, делая их еще более подходящими для выработки продуктов белковой природы, особенно в случаях, когда такой белковый продукт чувствителен к протеазной активности. Таким образом, настоящее изобретение также включает мутантный штамм Chrysosporium,который вырабатывает меньше протеазы, чем немутантный штамм Chrysosporium, например, меньше,чем штамм C.lucknowense C1 (VKM F-3500 D). В частности, протеазная активность таких штаммов составляет менее половины того количества, в частности, менее 30% от того количества, которое вырабатывается штаммом C1. Для определения снижения протеазной активности можно использовать известные методыб, такие как измерение образующихся ореолов на пленках снятого молока или определение уровня разрушения БСА. Представляющим конкретный интерес вариантом настоящего изобретения является рекомбинантный Chrysosporium по настоящему изобретению, у которого последовательность нуклеиновой кислоты,кодирующая интересующий полипептид, кодирует полипептид, который инактивируется или нестабилен при кислых рН, т.е. при рН менее 6, даже менее 5,5, предпочтительнее рН менее 5 и даже на уровне рН=4 и меньше. Это является конкретным интересным вариантом потому, что в целом имеющиеся грибковые экспрессионные системы не культивируют в условиях, являющихся нейтральными или щелочными, но культивируются при кислом рН. Таким образом, система по настоящему изобретению представляет грибковую экспрессионную систему, безопасную для белков или полипептидов, которые чувствительны по инактивации или являются нестабильными при кислых значениях рН. Более конкретно рекомбинантный штамм в соответствии с определенным в любом из вариантов настоящего изобретения, у которого нуклеотидная последовательность, кодирующая представляющий интерес полипептид, кодирует белок или полипептид, проявляющий оптимальную активность и/или стабильность при рН выше 5, предпочтительно при нейтральном или щелочном рН (т.е. выше 7), и/или при рН выше 6, рассматривается как предпочтительный вариант по настоящему изобретению. Более 50%,более 70% и даже более 90% от оптимальной активности при таких значениях рН принимается как соответствующее конкретным применимым вариантам. Полипептид, экспрессируемый при данных условиях культивирования, необязательно должен быть активным при этих условиях культивирования, а на самом деле предпочтительным для него может быть то, чтобы культивирование проходило при условиях, при которых он неактивен, поскольку его активная форма могла бы быть опасной для хозяина. Например, это относится к случаю с протеазами. Однако то, что необходимо, -это стабильность белка или полипептида в условиях культивирования. Стабильность может быть термостабильностью. Она также может быть стабильностью против конкретных композиций или химических веществ, таких как те, которые присутствуют, например, в композициях или процессах выработки, или при применении интересующих полипептида или белка. LAS в детергентных композициях, содержащих целлюлазы или липазы и т.п., - это пример химически опасного влияния на белки. Продолжительность практического использования может варьироваться от кратковременной до длительного воздействия, поэтому стабильность может варьироваться в связи со временем действия, варьирующегося в связи с конкретным применением. Специалист сможет установить конкретные условия по параметрам конкретного случая. Можно использовать ряд доступных коммерческих тестов для определения оптимальных активностей различных ферментных продуктов. Например, такое можно найти в каталогах Sigma и Megazyme. Упоминания конкретных примеров таких тестов имеются в данном описании. Производители предоставляют руководства по применению. Авторами изобретения было неожиданно обнаружено, что штамм Chrysosporium, который подходящим образом может быть использован для трансформации или трансфекции интересующей последовательности, предназначенной для экспрессии, является штаммом, характеризующимся относительно низкой биомассой. Было обнаружено, что штаммы Chrysosporium, характеризующиеся в 2-5 раз меньшей биомассой при сравнении с Trichoderma reesei в случае культивирования до уровня вязкости 200-600 сПз в конечный момент ферментации, также проявляют в 10-20 раз меньшую биомассу по сравнению с Aspergillus niger при культивировании до вязкости 1500-2000 сПз в соответствующих условиях, т.е. их соответствующие оптимальные условия культивирования могут обеспечивать высокий уровень экспрессии. Этот уровень экспрессии намного превосходит таковые уровни у двух коммерческих контрольных штаммов при существенно меньшей биомассе и при существенно меньшей вязкости. Это означает, что выход экспрессии у таких штаммов Chrysosporium будет заметно выше, чем у Aspergillus niger и Tricho-11 005682derma reesei. Такой трансформированный или трансфицированный штамм Chrysosporium образует соответствующий вариант настоящего изобретения. Была установлена биомасса 0,5-1,0 г/л штамма С 1(18-25) Chrysosporium в противоположность 2,55,0 г/л для Trichoderma reesei и 5-10 г/л для Aspergillus niger в описанных выше условиях. Подробности этого будут описаны в примерах. В предпочтительном варианте рекомбинантный штамм Chrysosporium по настоящему изобретению вырабатывает белок или полипептид в количестве, по крайней мере эквивалентном выработке (в молях на литр) целлюлазы штаммами UV13-6 или С-19, а наиболее предпочтительно - по крайней мере эквивалентном или превосходящем по отношению к штамму UV18-25, при соблюдении соответствующих или идентичных условий, т.е. в соответствующих оптимальных для них условиях культивирования. Также заявителями было установлено, что уровни экспрессии и секреции чрезвычайно высоки при использовании штамма Chrysosporium, характеризующегося морфологией мицелия штамма UV18-25, т.е. имеющего короткий фрагментированный мицелий. Таким образом, рекомбинантный штамм по настоящему изобретению преимущественно должен проявлять такую морфологию. Однако, настоящее изобретение также охватывает нерекомбинантные штаммы или по-иному сконструированные штаммы Chrysosporium, проявляющие данный новый и изобретательский признак. Также настоящим изобретением охватывается рекомбинантный штамм Chrysosporium в связи с любым из описанных вариантов настоящего изобретения, который дополнительно характеризуется сниженной споруляцией по сравнению с С 1,предпочтительно ниже уровня штамма UV13-6, предпочтительно ниже такового у NG7C-19, предпочтительно ниже такового у UV18-25 при эквивалентных условиях ферментации. Также настоящим изобретением охватывается рекомбинантный штамм Chrysosporium в связи с любым из описанных вариантов настоящего изобретения, который дополнительно проявляет по крайней мере то же отношение количества вырабатываемого белка к биомассе по сравнению с С 1, предпочтительно по сравнению с таковым у любого из штаммов UV13-6, NG7C-19 и UV18-25 при эквивалентных условиях ферментации. Однако настоящее изобретение также охватывает нерекомбинантные штаммы или по-иному сконструированные штаммы Chrysosporium, проявляющие этот новый и изобретательский признак сам по себе или в сочетании с любым из других вариантов. Другой привлекательный вариант настоящего изобретения также охватывает рекомбинантный штамм Chrysosporium, проявляющий вязкость, меньшую таковой у штамма NG7C-19, предпочтительно меньшую чем у UV18-25 при соответствующих или идентичных условиях ферментации. Однако настоящее изобретение также охватывает нерекомбинантные или по-иному сконструированные штаммы Chrysosporium, проявляющие этот новый и изобретательский признак сам по себе или в сочетании с любым из других вариантов. Заявители определили, что вязкость культуры UV18-25 ниже 10 сПз в противопоставление таковой у Trichoderma reesei, составляющей порядка 200-600 сПз, и таковой у Aspergillus niger,составляющей порядка 1500-2000 сПз, при оптимальных условиях культивирования в конце процесса ферментации. Способ, использованный для такой оценки, рассмотрен в примерах. Во многих случаях вязкость может быть оценена путем визуального контроля. Текучесть вещества может варьироваться в очень широких пределах, т.е. оно может быть почти твердым, соусо-подобным или жидким. Также вязкость может быть легко определена с помощью ротационных вискозиметров Брукфилда, с использованием трубок для анализа кинематической вязкости, вискозиметра с падающим шариком (Стокса) или чашечного вискозиметра. Выходы в таких культурах с низкой вязкостью выше таковых, характерных для известных промышленных высоковязких культур, в расчете на единицу времени и на клетку. Обработка таких культур с низкой вязкостью по настоящему изобретению, в частности, имеет преимущество при повышении масштаба культивирования. Рассматриваемые штаммы Chrysosporium с низкой вязкостью хорошо культивируются в объемах вплоть до 150000 л. Таким образом, любой объем культуры вплоть до 150000 л представляет собой применимый вариант настоящего изобретения. С использованием штаммов по настоящему изобретению любой стандартный ферментационный объем должен быть осуществлен успешно. До этого проблемы создавало то, что при крупномасштабном производстве могут образовываться агрегации, содержащие слишком плотный мицелий и/или неравномерно распределенный мицелий. В результате культуральная среда не может быть эффективно утилизирована в ходе культивирования, что, следовательно, ведет к неэффективности производственного процесса, в частности, при крупномасштабной ферментации, например, более 150000 л. Проблематичными становятся аэрация и перемешивание, что приводит к кислородному и пищевому голоданию, а, следовательно, к снижению концентрации продуктивной биомассы и снижению выхода полипептида в ходе культивирования, и/или может привести к более продолжительному времени ферментации. Кроме того, высокая вязкость и высокое сдвиговое усилие являются нежелательными в промышленных ферментационных процессах, и в современных промышленных процессах они являются факторами, ограничивающими производительность. Все эти негативные аспекты могут быть преодолены с помощью хозяина Chrysosporium по настоящему изобретению, который проявляет лучшие характеристики по сравнению с Trichoderma reesei, Aspergillus niger и Aspergillus oryzae, которые применяются для этого в промышленности,т.е. проявляет более высокие уровни выработки белка и лучшие параметры вязкости и биомассы.-12 005682 Очень хорошо различные аспекты настоящего изобретения иллюстрируются штаммом Chrysosporium, выбираемым из C1, UV13-6, NG7C-19 и UV18-25. Однако настоящее изобретение также охватывает рекомбинантные штаммы или иным путем сконструированные штаммы Chrysosporium, производные от четырех депонированных штаммов, которые также проявляют любой из новых и изобретательских признаков сам по себе или в сочетании. Данные по депонированию этих штаммов приведены в другой части настоящей заявки. Также настоящее изобретение охватывает рекомбинантные штаммы или по-иному сконструированные штаммы Chrysosporium, производные от четырех депонированных штаммов, которые также проявляют любой из новых и изобретательских признаков сам по себе или в сочетании. Штамм Chrysosporium по настоящему изобретению также включает штамм, проявляющий при соответствующих условиях культивирования уровень биомассы, который вдвое ниже, чем у Trichoderma reesei,предпочтительно даже более чем в 5 раз ниже, чем у Trichoderma reesei, в частности, чем у Trichodermareesei, проявляющей вязкость на уровне 200-600 сПз, показанном при условиях, описанных в примерах. Штамм Chrysosporium по настоящему изобретению также включает штамм, вырабатывающий полипептид целлюлазы по крайней мере в том же количестве (в молях на литр), что и штаммы C1, UV13-6,NG7C-19 или UV18-25, при соответствующих или идентичных условиях. Штаммы Chrysosporium по настоящему изобретению являются дополнительно предпочтительными тогда, когда они проявляют оптимальные параметры роста при нейтральном-щелочном рН и температурах 25-43 С. Предпочтение может быть отдано нейтральной или даже щелочной рН. Такие условия производства предпочтительны для ряда полипептидов и белков, в частности, для тех, которые чувствительны к действию кислого рН, или тех, которые неактивны или нестабильны при низких температурах. Однако, также имеется вариант изобретения, включающий штаммы Chrysosporium, которые можно культивировать при кислом рН, что применимо для определенных белков и полипептидов. Подходящие кислые рН начинаются, снижаясь от 7,0. Кислый рН менее 6,5 рассматривается как представляющий эффективный вариант настоящего изобретения. рН в диапазоне 5,0-7,0 также является подходящим вариантом. Нейтральный рН может составлять 7,0 или быть около 7 - например, 6,5-7,5. Как описано в литературе,оптимальный рН зависит от ряда факторов, которые очевидны специалистам в данной области техники. Могут быть использованы рН выше 7,5, т.е. щелочные, предпочтительно в диапазоне 7,5-9,0. При сравнении параметров штаммов по настоящему изобретению с параметрами других штаммов,предположительно обладающих иными оптимальными условиями (например, Aspergillus и Trichoderma),с помощью измерений вязкости, определения биомассы или выработки белка, эти сравнения должны быть осуществлены с использованием соответствующих оптимальных условий для соответствующего штамма. Это должно быть очевидно для специалистов в данной области техники. Штамм Chrysosporium по любому из описанных выше вариантов настоящего изобретения, причем указанный штамм дополнительно характеризуется выработкой одного или нескольких грибковых ферментов, выбираемых из разрушающих углеводы ферментов, протеаз, других гидролаз, оксидоредуктаз и трансфераз, упоминавшихся выше, рассматривается как конкретный применимый вариант настоящего изобретения. Конкретными наиболее интересными продуктами являются целлюлазы, ксиланазы, пектиназы, липазы и протеазы. Однако, также в качестве применимого варианта настоящего изобретения рассматривается штамм Chrysosporium, характеризующийся выработкой одного или нескольких грибковых ферментов, который проявляет оптимальную стабильность и/или активность в нейтральных или щелочных условиях, предпочтительно оптимальную стабильность и/или активность при щелочных условиях,причем упомянутый фермент выбирают из разрушающих углеводы ферментов, гидролаз и протеаз,предпочтительно гидролаз и разрушающих углеводы ферментов. В случае нерекомбинантного Chrysosporium предпочтительно такими ферментами являются иные ферменты, нежели целлюлазы, которые были заявлены в WO 98/15633. Представляющими конкретный интерес ферментами являются ксиланазы, протеазы, эстеразы, -галактозидазы, -галактозидазы, -глюканазы и пектиназы. Эти ферменты не ограничиваются вышеперечисленным. Замечания, касающиеся стабильности и активности в других частях данного описания, также справедливы и здесь. Также настоящее изобретение охватывает способ получения интересующего полипептида, причем упомянутый способ включает культивирование штамма Chrysosporium в любом из вариантов настоящего изобретения в условиях, обеспечивающих экспрессию и предпочтительно секрецию полипептида и последующее выделение выработанного интересующего полипептида. При упоминании белка или полипептида подразумевается, что включаются варианты и мутанты,например, мутанты с заменами, вставками или делениями естественно встречающихся белков, которые проявляют активность немутантного варианта. То же самое справедливо для соответствующих последовательностей нуклеиновых кислот. Такие способы, как перемешивание генов, белковая инженерия и направленное изменение с помощью сайт-специфичного мутагенеза и случайного мутагенеза, являются способами, с помощью которых могут быть получены такие полипептиды, варианты или мутанты. Направленные изменения представлены в патентах США 5223409, 5780279 и 5770356. С помощью этих способов в любом типе клеток, применяя вносящую ошибки ПЦР, создают библиотеку случайно мутировавших генных последовательностей, сформированных, например, по методу перемешивания генов. Каждый ген включает секреторный сигнал и иммобилизующий участок, прикрепленный к нему-13 005682 так, чтобы образующийся в результате белок секретировался и оставался прикрепленным к поверхности хозяина. Соответственно, создаются условия, которые необходимы для биологической активности конкретного полипептида. Этот процесс включает ряд циклов, в конечном счете приводящих к окончательному гену с желательными параметрами. Другими словами, ускоряется процесс направленного изменения. Также патент США 5763192 описывает способ получения ДНК, РНК, пептидов, полипептидов или белка путем синтетического сочетания полинуклеотидов, полученных от случайным образом сформированных последовательностей, внесения их в организм-хозяин с последующим отбором клеткихозяина с соответствующим заданным признаком. Стандартные методы клонирования и выделения белка или полипептида могут быть использованы для получения необходимой информации о последовательности. Участки известных последовательностей можно использовать в качестве зондов для выделения других гомологов у других родов и штаммов(видов). Последовательность нуклеиновой кислоты, кодирующая конкретную ферментативную активность, можно использовать для скрининга, например, библиотеки Chrysosporium. Специалист в данной области техники сможет понять, какие условия гибридизации являются подходящими. Стандартные методы гибридизации нуклеиновых кислот из библиотек и методы клонирования описаны у Sambrook et al.(Eds.), 1989, "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor, Press Plainview, NY, и у Ausubel et al. (Eds.), 1987, "Current Protocols in Molecular Biology", John WileySons, NY. Соответствующая информация также может происходить из более поздних руководств и патентов, равно как и из доступных на коммерческой основе различных наборов для данной области техники. В альтернативном варианте упомянутый способ включает культивирование штамма по настоящему изобретению в условиях, обеспечивающих экспрессию и предпочтительно секрецию белка или полипептида, или их предшественника, и выделение полученного в результате полипептида, и необязательно дополнительные стадии выделения и очистки предшественника с целью получения представляющего интерес полипептида. Такой способ предпочтительно должен включать стадию расщепления предшественника на интересующий полипептид или предшественник. Стадия расщепления может быть расщеплением Кех 2-подобной протеазой, любой протеазой, конъюгирующей с основной аминокислотой, или Кех-2, например, в случае, когда сайт протеазного расщепления связывает эффективно секретируемый белок-переносчик и интересующий полипептид. Специалист в данной области техники легко сможет найти Кех 2-подобные протеазные последовательности, поскольку подробное описание их консенсусной последовательности доступно, а также уже был описан ряд альтернатив, например фурин. Предпочтительно в способе выработки полипептида по любому из вариантов по настоящему изобретению культивирование осуществляют при рН выше 5, предпочтительно при 5-10, более предпочтительно при 6-9. Предпочтительно в таком способе культивирование проводят при температуре в диапазоне 25-43 С, предпочтительно при 30-40 С. Штамм Chrysosporium, используемый в способе по настоящему изобретению, предпочтительно является рекомбинантным штаммом Chrysosporium по любому из заявляемых вариантов. В этом случае способ по настоящему изобретению может дополнительно предвосхищаться стадией получения рекомбинантного штамма Chrysosporium по настоящему изобретению. Выбор подходящих условий будет зависеть от природы полипептида, который должен быть экспрессирован, и такой выбор находится в пределах компетенции специалиста в данной области техники. Способ получения рекомбинантного штамма Chrysosporium по настоящему изобретению также является частью предмета настоящего изобретения. Этот способ включает стабильное встраивание последовательности нуклеиновой кислоты, кодирующей гетерологичный или гомологичный полипептид, в штамм Chrysosporium, причем указанная последовательность нуклеиновой кислоты функционально присоединена к регулирующему экспрессию участку, причем упомянутое встраивание осуществляется путем, уже известным для трансформации грибков-гифомицетов. Как отмечалось выше, доступны многочисленные источники, и небольшая их часть была процитирована. Представленная информация достаточна для того, чтобы специалист осуществил данный способ без излишней нагрузки. Способ включает встраивание последовательности нуклеиновой кислоты, включающей любые из элементов нуклеиновой кислоты, описанных в различных вариантах рекомбинантного Chrysosporium по настоящему изобретению, как по отдельности, так и в сочетании. В качестве примера способа встраивание можно использовать метод трансформации протопластов. Этот способ описан в примерах. Известны альтернативные методы трансформации протопластов или сферопластов: они могут быть использованы в соответствии с описанным в известной области техники для других грибков-гифомицетов. Подробности таких способов можно найти во многих процитированных материалах и включены для сведения в качестве библиографических ссылок. Способ по настоящему изобретению предпочтительно включает использование нерекомбинантного штамма Chrysosporium по настоящему изобретению в качестве исходного материала для внесения желательной последовательности, кодирующей представляющий интерес полипептид. Настоящее изобретение также охватывает способ получения фермента Chrysosporium, причем упомянутый способ включает культивирование штамма Chrysosporium по любому из вариантов настоящего изобретения в соответствии с описанным выше в или на культуральной среде при рН выше 5, предпоч-14 005682 тительно при 5-10, более предпочтительно при 6-9, предпочтительно при 6-7,5 и при 7,5-9, как примерах нейтрального и щелочного диапазонов рН. Также настоящее изобретение охватывает такой способ с использованием культуральной среды при температуре в диапазоне 25-43 С, предпочтительно при 30-40 С. Сочетание предпочтительных рН и температуры являетсяособенно предпочтительным вариантом способа получения фермента Chrysosporium по настоящему изобретению. В целом, дополнительно настоящее изобретение охватывает способ выработки фермента, проявляющего нейтральную или щелочную оптимальную активность и/или стабильность, предпочтительно щелочную оптимальную активность и/или стабильность. Предпочтительные диапазоны рН и оптимальной активности, равно как и тесты для их определения, описаны в других частях настоящей заявки. Фермент должен быть выбран из разрушающих углеводы ферментов, протеаз, других гидролаз, оксидоредуктаз и трансфераз в соответствии с описанным выше, причем способ включает культивирование клетки-хозяина, трансформированной или трансфицированной последовательностью нуклеиновой кислоты,кодирующей соответствующий фермент. Предпочтительно таким ферментом будет фермент Chrysosporium. Предпочтительный способ, такой как этот, включает конкретную выработку целлюлазы, ксиланазы, пектиназы, липазы и протеазы, причем целлюлаза и ксиланаза расщепляют -1,4-связи, а целлюлаза включает эндоглюканазу, целлобиогидролазу и -глюкозидазу. Способ по настоящему изобретению может включать культивирование любого хозяина Chrysosporium по настоящему изобретению, несущего нуклеиновую кислоту, кодирующую такие упоминавшиеся выше ферменты. Предпочтительно получение нерекомбинантных хозяев Chrysosporium по настоящему изобретению направлено на выработку ферментов, разрушающих углеводы, гидролаз и протеаз. В таком случае ферментом предпочтительно является иной фермент, нежели целлюлаза. Подходящие примеры продуктов, предназначенных для получения,приведены в табл. А и В. Способы их выделения аналогичны таковым, которые описаны в WO 98/15633,и включены здесь для сведения. Ферменты, вырабатываемые штаммами Chrysosporium по настоящему изобретению, также охватываются настоящим изобретением. Также охватываются ферменты, происходящие от Chrysosporium, которые могут быть выделены из нерекомбинантных штаммов Chrysosporium по настоящему изобретению. Они проявляют указывавшиеся выше параметры стабильности и активности. Предпочтительно они стабильны в присутствии LAS. В частности, заявляются протеазы с рI=4-9,5, протеазы с молекулярной массой 25-95 кД, ксиланазы с рI=4,0-9,5, ксиланазы с молекулярной массой от 25 до 65 кД, эндоглюканазы с рI=3,5-6,5, эндоглюканазы с молекулярной массой 25-55 кД, -глюкозидазы, ,-галактозидазы с рI=44,5, -глюкозидазы, ,-галактозидазы с молекулярной массой 45-50 кД, целлобиогидролазы с рI=4-5,целлобиогидролазы с молекулярной массой 45-60 кД, например с молекулярной массой 55 кД и рI=4,4,полигалактуроназы с рI=4,0-5,0, полигалактуроназы с 60-70 кД, например 65 кД, эстеразы с рI=4-5 и эстеразы с молекулярной массой 95-105 кД с упоминавшимися выше параметрами стабильности и активности. Молекулярные массы (MW) определены в методе электрофореза в ДСН-ПААГ. Нерекомбинантный, т.е. встречающийся в естественных условиях фермент - иной, нежели целлюлаза, как заявлено в WO 98/15633. Фермент, заявленный в WO 98/15633, исключается. Ферменты в соответствии с настоящим изобретением, представлены ферментами табл. В. Также охватываются ферменты, характеризующиеся сочетанием указанных выше значений рI и молекулярной массы. Также настоящее изобретение касается (сверх)выработки мутантными (рекомбинантными) штаммами по настоящему изобретению небелковых продуктов. Такими небелковыми продуктами являются первичные метаболиты, такие как органические кислоты, аминокислоты, и вторичные метаболиты, такие как антибиотики, например, пенициллины и цефалоспорины. Эти продукты являются результатом сочетаний биохимических механизмов, вовлекающих некоторые интересующие грибковые гены. Грибковые первичные и вторичные метаболиты и способы получения этих метаболитов в организмах грибков хорошо известны в данной области техники. Примеры выработки первичных метаболитов были описаны уM. Mattey, 1992, "The Production of Organic Acids", Curr. Rev. Biotechnol., 12, 87-132. Примеры получения вторичных метаболитов были описаны у Penalva et al., 1998, "The Optimization of Penicillin Biosynthesis inFungi", Trends in Biotechnol.,16, 483-489. Примеры Примеры определения биомассы и вязкости Диапазоны следующих операционных параметров были определены для процессов грибковой ферментации с использованием трех различных видов грибков. Сравниваемые виды грибков таковы: Trichoderma longibrachiatum (ранее - T.reesei), Aspergillus niger и Chrysosporium lucknowense (UV18-25). Вязкость. Вязкость определяли с помощью вискозиметра Brookfield LVF с адаптером для малых образцов и шпулькой 31. Включение водяного насоса на 5 мин перед применением вискозиметра использовали для уравновешивания водяной рубашки. Температура водяной рубашки должна составлять 30 С.-15 005682 Получают свежий образец ферментационного бульона и помещают 10 мл этого бульона в шпульку для малого объема образца. Выбирают скорость вращения шпульки для снятия показаний в диапазоне 10-80. Ожидают четыре (4) мин и снимают показания со шкалы вискозиметра. Умножают показания на приведенные ниже коэффициенты для получения значения вязкости в сантипуазах (сП). Скорость вращения шпульки Коэффициент 6 50 12 25 30 10 60 5 Следующие диапазоны вязкости были определены для процессов ферментации с использованием указанных видов грибков с применением описанной выше процедуры: Биомасса. Биомассу определяли в следующей процедуре. На алюминиевой чашке весов предварительно взвешивают фильтровальную бумагу 5,5 см (Whatman 54). Фильтруют 5,0 мл цельного бульона через бумагу 5,5 см на бюхнеровской воронке и промывают отфильтрованный осадок с использованием 10 мл деионизованной воды, помещают промытый осадок и фильтр на чашку весов и высушивают в течение ночи при 60 С. Окончательно высушивают при 100 С в течение 1 ч, затем охлаждают в эксикаторе. Определяют вес высушенного материала. Общая биомасса (в г/л) равна разности между исходными и конечными весами, умноженной на 200. Следующие диапазоны биомассы были определены для процессов ферментации с использованием указанных видов грибков в описанной выше процедуре: Белок. Уровни белка определяли в тесте BioRad (Sigma Co.). Наивысшие уровни белка выявлены у Chrysosporium. Данные, приведенные выше, представляют собой значения, определенные за 48 ч до окончания процесса ферментации. Все величины для Aspergillus и Trichoderma относятся к промышленным грибкам и действительно отражают реальные промышленные показатели. Такой грибковый штамм, как С.lucknowense (UV18-25), имеет преимущество в том, что низкая вязкость позволяет использовать меньшие мощность исходной загрузки и/или сдвиговое усилие в тех ферментационных процессах с недостатком кислорода, когда влияние сдвигового стресса (от перемешивания) на продукт может быть опасным с точки зрения снижения продуктивности из-за физического повреждения выработанных молекул. Низкий уровень биомассы при высоком уровне белка указывает на более высокую эффективность организма при превращении ферментационной среды в продукт. Таким образом, Chrysosporium дает улучшенные параметры биомассы и вязкости, при этом также вырабатывая столько же белка, а на самом деле намного больше белка, чем две используемые в промышленности системы, что очевидно лучше, чем у типичных депонированных штаммов Aspergillus или Trichoderma reesei из базовых открытых коллекций. Высокий уровень белка при низкой биомассе, вырабатываемого С.lucknowense (UV18-25), должен позволить разработать условия ферментации желательного продукта для большего увеличения биомассы тогда, когда увеличение биомассы будет приводить к увеличению продуктивности до достижения предельных условий ферментации. Имеющиеся в настоящее время высокие уровни биомассы и вязкости,характерные для видов Т.longibrachiatum и A.niger, ограничивают увеличение биомассы потому, что имеющиеся уровни биомассы и вязкости вплотную приблизились к предельным практическим условиям ферментации.-16 005682 Примеры сравнительной трансформации Chrysosporium, Trichoderma и Tolypocladium Geodes Два нетрансформированных штамма Chrysosporium C1 и один контрольный штамм Trichodermareesei были проанализированы в двух культуральных средах (Gs - рН=6,8, и агаровая Pridham, PA рН=6,8). Для анализа уровней устойчивости к антибиотикам споры собирали на 7-дневных чашках PDA. Отобранные чашки инкубировали при 32 С и анализировали через 2, 4 и 5 дней. Было установлено, что С-1 штаммы NG7C-19 и UV18-25 характеризуются отчетливо низкой исходной устойчивостью и к флеомицину, и к гигромицину. Этот уровень сопоставим с таковым у контрольного широко используемого лабораторного штамма T.reesei. Таким образом, это ясно дает понять, что эти два стандартных грибковых селективных маркера могут быть использованы в штаммах Chrysosporium. Проблем с другими стандартными селективными маркерами для грибков возникнуть не должно. Отбор Sh-blе-трансформированных (резистентность к флеомицину) штаммов Chrysosporium успешно проводили при 50 мкг/мл. Это также соответствует уровню, используемому для T.reesei: это указывает на то, что дифференцированный отбор может быть легко достигнут у Chrysosporium. Те же замечания справедливы для трансформированных штаммов с резистентностью к гигромицину при концентрации 150 мкг/мл. Таблица С Метод трансформации протопластов использовали в отношении Chrysosporium, основываясь на наиболее часто применяемых методах трансформации грибов. Все споры с 90-мм чашки PDA выделяли в 8 мл IC1 и переносили в шейкерную колбу с 50 мл культуральной среды IC1 для инкубации в течение 15 ч при 35 С и 200 об./мин. После этого культуру центрифугировали, полученный сгусток промывали в МnР, возвращали обратно в раствор в 10 мл МnР и 10 мг/мл Caylase С 3 и инкубировали в течение 30 мин при 35 С при перемешивании (150 об./мин). Раствор отфильтровывали и полученный фильтрат центрифугировали в течение 10 мин при 3500 об./мин. Сгусток промывали в 10 мл МnРСа 2+. Полученное центрифугировали в течение 10 мин при 25 С. Затем добавляли 50 мкл холодного МРС. Смесь выдерживали на льду в течение 30 мин, после чего добавляли 2,5 мл РМС. Через 15 мин при комнатной температуре 500 мкл обработанных протопластов смешивали с 3 мл MnR Soft и сразу высевали на чашку MnR, содержащую флеомицин или гигромицин в качестве селективного агента. Трансформанты анализировали после инкубации в течение 5 дней при 30 С (клоны становятся видимыми через 48 ч). Эффективность трансформации определяли с использованием 10 мкг контрольной плазмиды pAN8-119. Полученные результаты представлены в нижеследующей табл. D. Таблица D. Эффективность трансформации (с использованием 10 мкг контрольной плазмиды pAN8-1) Полученные результаты показывают, что жизнеспособность трансформантов Chrysosporium предпочтительнее таковой у Trichoderma. Трансформационная способность этих штаммов сравнима, поэтому число трансформантов, полученных в одном эксперименте, в 4 раза выше у Chrysosporium, чем у T.reesei. Таким образом, трансформационная система Chrysosporium не только равна обычно используемой системе T.reesei, но даже превосходит ее. Это улучшение может быть особенно важным для векторов, которые менее эффективны по трансформационной способности по сравнению с pAN8-1. Примерами таких низкоэффективных трансформационных векторов являются векторы белков-переносчиков, предназначенные для выработки негрибковых белков, которые в целом проявляют в 10 раз худшую способность к трансформации. Ряд других трансформационных и экспрессирующих векторов был сконструирован с последовательностями, кодирующими гомологичный белок Chrysosporium, а также с последовательностями, коди-17 005682 рующими гетерологичный белок, для использования в экспериментах по трансформации Chrysosporium. Карты этих векторов показаны на фиг. 6-11. Предназначенный для экспрессии гомологичный белок выбирают из группы целлюлаз, вырабатываемых Chrysosporium, включающей эндоглюканазу-6, которая принадлежит к семейству 6 (молекулярная масса 43 кД), а гетерологичный белок являлся эндоглюканазой-3, которая относится к семейству 12pF6g включает фрагмент промотора эндоглюканазы-6 Chrysosporium, присоединенный к сигнальной последовательности эндоглюканазы-6 в общей рамке с открытой кодирующей рамкой эндоглюканазы-6, после которой находится терминаторная последовательность эндоглюканазы-6. Отбор трансформантов проводят с использованием котрансформации с селективным вектором.pUT1150 включает промотор целлобиогидролазы Trichoderma reesei, присоединенный к сигнальной последовательности эндоглюканазы-6 в общей рамке с открытой кодирующей рамкой эндоглюканазы-6 с последующей терминаторной последовательностью целлобиогидролазы Т.reesei. Дополнительно этот вектор несет вторую экспрессионную кассету с селективным маркером, а именно геном резистентности к флеомицину (ген Sh-ble).pUT1152 включает промотор глицеральдегид-3-фосфатдегидрогеназы-А Aspergillus nidulans, присоединенный к сигнальной последовательности эндоглюканазы-6 в общей рамке с открытой кодирующей рамкой эндоглюканазы-6 с последующей терминаторной последовательностью антранилатсинтазы(trpC) A.nidulans. Дополнительно этот вектор несет вторую экспрессионную кассету с селективным маркером, а именно геном резистентности к флеомицину (ген Sh-ble).pUT1155 включает промотор глицеральдегид-3-фосфатдегидрогеназы-А A. nidulans, присоединенный к сигнальной последовательности целлобиогидролазы Trichoderma reesei в общей рамке с белкомпереносчиком Sh-ble, который, в свою очередь, присоединен в общей рамке к открытой кодирующей рамке эндоглюканазы-6 с последующей терминаторной последовательностью trpC A.nidulans. Этот вектор основан на методологии использования белка-переносчика, химеризованного на интересующий белок, что, как известно, в значительной степени улучшает секрецию интересующего белка.pUT1160 включает промотор глицеральдегид-3-фосфатдегидрогеназы-А Aspergillus nidulans, присоединенный к сигнальной последовательности целлобиогидролазы Trichoderma reesei в общей рамке с белком-переносчиком Sh-ble, который, в свою очередь, присоединен в общей рамке к открытой кодирующей рамке эндоглюканазы-3 пеницилла с последующей терминаторной последовательностью trpCpUT1162 включает промотор целлобиогидролазы Trichoderma reesei, соединенный с сигнальной последовательностью эндоглюканазы-3 в общей рамке с открытой кодирующей рамкой эндоглюканазы-3Penicillium с последующей терминаторной последовательностью целлобиогидролазы Т.reesei. Дополнительно этот вектор несет вторую экспрессионную кассету с селективным маркером, а именно геном резистентности к флеомицину (ген Sh-ble). Таблица Е.Сравнительная трансформация В табл. Е показаны результаты трансформации Chrysosporium UV18-25, и Tolypocladium geodes. Использованный протокол трансформации описан в разделе по гетерологичной трансформации. Примеры гетерологичной и гомологичной экспрессии у трансформантов Chrysosporium Штаммы C1 (NG7C-19 и/или UV18-25) были проанализированы по их способности секретировать различные гетерологичные белки: бактериальный белок (белок резистентности к флеомицину Streptoalloteichus hindustanus - Sh-blе), грибковый белок (ксиланаза-II Trichoderma reesei - XYN2) и белок человека (лизоцим человека - HLZ).C1-штаммы NG7C-19 и UV18-25 были трансформированы плазмидой pUT7201. Этот вектор представляет следующую грибковую экспрессионную кассету: промотор глицеральдегид-3-фосфатдегидрогеназы (gpdA) Aspergillus nidulans2; синтетическая сигнальная последовательность целлобиогидролазы-I (cbhI) Trichoderma reesei1,3; ген резистентности к флеомицину Sh-ble Streptoalloteichus hindustanus4; терминатор триптофансинтазы (trpC) Aspergillus nidulans5. Также этот вектор включает ген -лактамазы (blа) и сайт начала репликации E.coli из плазмидыpUC186. Подробная карта плазмиды показана на фиг. 2. Протопласты C1 трансформировали в соответствии с Durand et аl.7, адаптируя процедуру к штаммуC1 (культуральные среды и растворы композиций раскрыты в литературе). Все споры нетрансформированного штамма C1 с одной 90-мм чашки PDA выделяли в 8 мл IC1 и переносили в шейкерную колбу с 50 мл культуральной среды IC1 для инкубации в течение 15 ч при 35 С и 150 об./мин. После этого культуру центрифугировали, сгусток промывали в МnР, разводили в 10 мл МnР плюс 10 мг/мл Caylase С 3 и инкубировали в течение 30 мин при 35 С с перемешиванием (150 об./мин). Раствор отфильтровывали и полученный фильтрат центрифугировали в течение 10 мин при 3500 об./мин. Сгусток промывали в 10 мл МnРСа 2+. Полученное центрифугировали в течение 10 мин при 3500 об./мин и сгусток отбирали в 1 мл МnРСа 2+. 10 мкг ДНК плазмиды pUT270 добавляли к 200 мкл раствора протопластов и инкубировали в течение 10 мин при комнатной температуре (примерно 20 С). Затем добавляли 50 мкл холодного МРС. Полученную смесь выдерживали на льду в течение 30 мин, после чего добавляли 2,5 мл РМС. Через 15 мин при комнатной температуре 500 мкл обработанных протопластов смешивали с 3 мл MnR Soft и сразу высевали на чашку MnR, содержащую флеомицин (50 мкг/мл при рН=6,5) в качестве селективного агента. Через 5 дней инкубации при 30 С анализировали трансформанты (клоны становятся видимыми через 48 ч). Выработку Sh-blе трансформантами С 1 (резистентные к флеомицину клоны) анализировали следующим образом. Первичные трансформанты вносили на чашки со средой GS с флеомицином (5 мкг/мл) и выращивали в течение 5 дней при 32 С для проверки резистентности. Каждый клон, для которого подтверждали резистентность, субклонировали на чашки GS. По два субклона каждого трансформанта использовали для инокуляции чашек PDA с целью получения спор для инициации жидких культур. Жидкие культуры в среде IC1 выращивали в течение 5 дней при 27 С (встряхивание при 200 об./мин). Затем культуры центрифугировали (5000g, 10 мин) и собирали 500 мкл надосадочной фракции. Из этих образцов белки осаждали с помощью ТСА и ресуспендировали в буфере Western Sample Buffer до 4 мг/мл общего белка (метод Лоури 8). 10 мкл (примерно 40 мкг общего белка) загружали в 12%-ный акриламидный-ДСН гель и подвергали электрофорезу (система BioRad Mini Trans-Blot). Вестерн-блоттинг проводили в соответствии с инструкциями фирмы BioRad (мембрана с порами 0,2 мкм: SchleicherSchull) с использованием кроличьей антисыворотки к Sh-ble (Cayla:по каталогу ANTI-0010) в качестве первичного антитела. Полученные результаты показаны на фиг. 1 и в табл. F. Таблица F. Установленные уровни выработки Sh-ble в С 1 Эти данные показывают, что 1) Гетерологичные сигналы транскрипции и трансляции из плазмиды pUT720 функциональны вChrysosporium. 2) Гетерологичная сигнальная последовательность из pUT720 функциональна в Chrysosporium.-19 005682 3) Chrysosporium можно использовать в качестве хозяина для секреции гетерологичного бактериального белка.C1-штаммы NG7C-19 и UV18-25 были трансформированы плазмидой pUT970G9. Этот вектор включает следующую грибковую экспрессионную кассету: промотор глицеральдегид-3-фосфатдегидрогеназы (gpdА) Aspergillus nidulans2; синтетическая сигнальная последовательность целлобиогидролазы-I (cbhI) Trichoderma reesei1,3; ген резистентности к флеомицину Sh-ble Streptoalloteichus hindustanus4, используемый в качестве белка-переносчика; шарнирный домен глюкоамилазы (glaA2) Aspergillus niger, клонированный из плазмиды pAN56211,12; линкерный пептид (LGERK), соответствующий КЕХ 2-протеазоподобному сайту расщепления 1; синтетический ген лизоцима человека (hlz)10; терминатор триптофансинтазы (trpC) Aspergillus nidulans5. Также этот вектор включает ген -лактамазы (blа) и сайт начала репликации E.coli из плазмидыpUC186. Подробная карта плазмиды показана на фиг. 3. Протопласты С 1 были трансформированы плазмидой pUT970G в соответствии с той же процедурой, уже описанной в примере 1. Химерный белок (Sh-bleшарнир GAMHLZ) функционален в отношении резистентности к флеомицину, позволяя тем самым легко отбирать трансформанты С 1. Более того, уровень резистентности к флеомицину в определенной степени коррелирует с уровнем экспрессииhlz. Выработка HLZ трансформантами С 1. (резистентные к флеомицину клоны) анализировали в тесте на активность лизоцима следующим образом. Первичные трансформанты наносили на чашки со средойGS с флеомицином (5 мкг/мл) (проверка резистентности) и также на чашки LYSO (выявление активностиHLZ по визуально просветленным зонам 1,10). Чашки выращивали в течение 5 дней при 32 С. Каждый подтвержденный клон субклонировали на чашки LYSO. По два субклона от каждого трансформанта использовали для инокуляции чашек PDA с целью получения спор для инициации жидких культур. Жидкие культуры в среде IC1 выращивали в течение 5 дней при 27 С (встряхивание при 180 об./мин). Затем культуры центрифугировали (5000g, 10 мин). На материале этих образцов активность лизоцима определяли в соответствии с Mrsky et al.13 Таблица G. Уровни выработки активного HLZ в С 1 Эти данные показывают, что 1) Выводы 1 и 2 из примера 1 подтверждены. 2) Sh-blе функционален в Chrysosporium в качестве маркера резистентности. 3) Sh-blе функционален в Chrysosporium в качестве белка-переносчика. 4) Сайт расщепления КЕХ 2-подобной протеазой функционален в Chrysosporium (другой в составеHLZ не должен быть активен). 5) Chrysosporium можно использовать в качестве хозяина для секреции гетерологичного белка млекопитающих.C1-штамм UV18-25 был трансформирован плазмидами pUT1064 и PUT1065. Плазмида pUT1064 включает две следующие грибковые экспрессионные кассеты: Первая кассета позволяет вести отбор трансформантов, резистетных к флеомицину: промотор гена-1 контроля метаболических механизмов (срс-1) Neurospora crassa14; ген Sh-blе резистентности к флеомицину Streptoalloteichus hindustanus4; терминатор триптофансинтазы (trpC) Aspergillus nidulans5. Вторая кассета является кассетой выработки ксиланазы:-20 005682 промотор cbh1 T.reesei штамма TR215; ген хуn2 (включая его сигнальную последовательность) T.reesei штамма TR216; терминатор cbh1 T.reesei штамма TR215. Этот вектор также включает сайт начала репликации E.coli из плазмиды pUC196. Подробная карта этой плазмиды показана на фиг. 4. Плазмида pUT1065 включает следующую грибковую экспрессионную кассету: промотор глицеральдегид-3-фосфатдегидрогеназы (gpdA) Aspergillus nidulans2; синтетическая сигнальная последовательность целлобиогидролазы-1 (cbhI) Trichoderma reesei1,3; ген резистентности к флеомицину Sh-ble S.hindustanus4, используемый в качестве белкапереносчика 10; линкерный пептид (SGERK), характеризующий сайт расщепления КЕХ 2-подобной протеазой 1; ген хуn2 (без сигнальной последовательности) T.reesei штамма TR216; терминатор триптофансинтазы (trpC) Aspergillus nidulans5. Также этот вектор включает ген -лактамазы (bla) и сайт начала репликации E.coli из плазмидыpUC186. Подробная карта плазмиды показана на фиг. 5. Протопласты С 1 трансформировали плазмидой pUT1064 или pUT1065 в соответствии с той же процедурой, уже описанной в примере 1. Химерный белок в плазмиде pUT1065 (Sh-bleXYN2) функционален по отношению к резистентности к флеомицину, что позволяет легко отбирать трансформанты С 1. Более того, уровень резистентности к флеомицину ориентировочно коррелирует с уровнем экспрессииxyn2. В плазмиде pUT1064 ген хуn2 был клонирован с его собственной сигнальной последовательностью. Выработка ксиланазы трансформантами С 1 (клоны, резистентные к флеомицину) анализировали с помощью теста на активность ксиланазы следующим образом. Первичные трансформанты наносили иглой на чашки со средой GS с флеомицином (5 мкг/мл) (проверка резистентности) и также на чашкиXYLAN (выявление активности ксиланазы путем визуализации просветляющихся зон 17). Чашки культивировали в течение 5 дней при 32 С. Каждый подтвержденный клон субклонировали на чашки XYLAN. По два субклона каждого трансформанта использовали для инокуляции чашек PDA с целью получения спор для инициации жидкой культуры. Жидкие культуры в среде IC1 плюс 5 г/л KPhtalate выращивали в течение 5 дней при 27 С (встряхивание при 180 об./мин). Затем культуры центрифугировали (5000g, 10 мин). В этих образцах активность ксиланазы измеряли с помощью метода DNS в соответствии с Miller etal.18 Таблица Н. Уровни выработки активной XYN2 в С 1 (наилучшие продуценты) Эти данные показывают, что 1) Подтверждаются выводы 1-4 примера 2. 2) С 1 можно использовать в качестве хозяина для секреции гетерологичного грибкового белка.[4]. Авторы изобретения также показывают данные по экспрессии трансформированного UV18-25,причем в табл. I приведены результаты для плазмид, которые использовали для трансформации. Эта таблица показывает хорошие уровни экспрессии эндоглюканазы и целлобиогидролазы при использовании гетерологичных регулирующих экспрессию последовательностей и сигнальных последовательностей, но также и с гомологичными регулирующими экспрессию последовательностями и сигнальными последовательностями. Подробности об этих плазмидах можно найти в других частях настоящего описания и на фигурах. Выработку осуществляли при щелочном рН и при температуре 35 С. Таблица I. Данные по экспрессии трансформированного штамма UV18-25 Условия культивирования (шейкерная колба): 88 ч, 35 С, 230 об./мин.- все вышеприведенные значения даны в процентах относительно исходного штамма UV18-25 Приложение к примерам: среды Трансформационные среды: Основная по Мандельсу: Основная по Мандельсу пептон - 1 г/лMnP + сахароза Дрожжевой экстракт Глюкоза Агар[Merieux] рН должен быть 6,8[Difco]; рН должен быть 5,5MPG: Основная по Мандельсу с среда MnP + СаСl22 Н 2O 50 мМ рН до 6,5-22 005682 Регенерационную среду (MnR), дополненную 50 мкг/мл флеомицина или 100-150 мкг/мл гигромицина, использовали для отбора трансформантов. Среду GS, дополненную 5 мкг/мл флеомицина, использовали для подтверждения резистентности к антибиотикам.PDA - это полная среда для быстрого роста и эффективной споруляции. Жидкие среды инокулировали 1/20-й суспензии спор (все споры с одной 90-мм чашки с PDA в 5 мл 0,1% Твин). Эти культуры выращивали при 27 С в шейкерных колбах (200 об./мин). Выделение и характеристика белков С 1 Способ получения различных белков описывается с помощью ряда характеристик этих белков. В табл. А, В и J представлены подробности, касающиеся схемы очистки и активности. Выделение проводили из культурального фильтрата Chrysosporium с использованием ион-обменной хроматографии наDEAE-Toyopearl аналогично методу, который описан в WO 98/15633, которая включена здесь для сведения в виде библиографической ссылки. Несвязанные фракции (F 60-31 CF), полученные на этом хроматографическом этапе, очищали с использованием макропрепаративной ион-обменной хроматографииMacro Prep Q после уравновешивания при рН=7,6. Несвязанную фракцию (NBNB) объединяли и связанные белки элюировали в градиенте 0-1 М NaCl. Фракция NBNB показала основные белковые бэнды 19,30, 35 и 46 кД и минорную фракцию 51 кД. В градиенте 0-1 М NaCl белковые пики элюировали из различных фракций. Фракции 39-41 включали белки 28, 36 и 60 кД, фракции 44-48 включали белки 28, 45 и 66 кД в качестве основных белковых бэндов с белками 33, 36, 55, 60 и 67 кД, фракции 49-51 дали белки 30, 36, 56 и 68 кД, а фракции 52-59 включали основные белки 33 и 55 кД и минорные белки 28 и 36 кД. Объединенные фракции NBNB далее очищали с помощью гидрофобной хроматографии на фенилсуперозе. Фракцию NBNB уравновешивали с помощью 0,03 М Na-фосфатного буфера - рН=7,0, содержащего 1,2 М (NH4)2SO4, и загружали на колонку. Адсорбировавшиеся белки элюировали в градиенте 1,2-0,6 М(NH4)2SO4. Таким образом, гомогенные ксиланазы с молекулярными массами 30 и 51 кД и pI 9,1 и 8,7,соответственно, были получены, равно как и протеаза 30 кД с рI=8,9. Ксиланазы не проявляли MUF-целлобиазной активности и, следовательно, являются истинными ксиланазами. Щелочная ксиланаза 30 кД (рI=9,1) проявляла высокую активность в очень широком диапазоне рН=5-8, сохраняя 65% от максимальной активности при рН=9-10; она относится к семейству ксиланаз F; ее частичные нуклеотидная и аминокислотная последовательности показаны в SEQ ID NO 5. Приведенная частичная аминокислотная последовательность соответствует примерным аминокислотам 50-170 от N-конца зрелого белка. Ксиланазы по настоящему изобретению характеризуются по крайней мере 60%-ной, предпочтительно по крайней мере 70%-ной, наиболее предпочтительно по крайней мере 80%-ной идентичностью последовательностей по отношению к частичной аминокислотной последовательности SEQ ID NO 5. Соответствующий ксиланазный промотор, который является предпочтительным вариантом настоящего изобретения, может быть идентифицирован с использованием частичной нуклеотидной последовательности SEQ ID NO 5. Ксиланаза 51 кД (pI=8,7) проявляет максимальную активность при рН=6 и сохраняет по крайней мере 70% активности при рН=7,5, и сохраняет по крайней мере 50% активности при рН=8,0. Она не очень стабильна при активности только 15% при рН=5,5 и 4% при рН=7,5. Константа Михаэлиса в отношении ксилана березы составила 4,2 г/л для ксиланазы 30 кД и 3,4 г/л для ксиланазы 51 кД. Температурный оптимум был высоким и был равен у обеих ксиланаз 70 С. Активность протеазы 30 кД, измеренная в отношении белков фракции NBNB, по-видимому, равна 0,4 х 10-3 ед./мл при 50 С и рН=7,90. Эта фракция проявляла активность в отношении красильного казеина на уровне 0,4 условных единиц на мг (рН=7). Добавление мочевины, как хаотрофного агента, приводило к 2-3-кратному увеличению активности протеазы. Влияние протеазы на активность ксиланазы было существенным. Только 30% ксиланазной активности сохранялось при рН=10,3 и 50 С после 30-минутной инкубации. При рН=8 сохранялось 95% ксиланазной активности. Добавление LAS приводило к резкому снижению ксиланазной активности при рН=8 и 10,3 при наличии только 50% ксиланазной активности через 10 мин инкубации с протеазным ингибитором PMSF или без него. Протеаза 30 кД была щелочной при оптимуме рН 10-11. Ее активность подавлялась фенилметилсульфонилфторидом (PMSF), но не иодуксусной кислотой, пепстатином-А и ЭДТА, что характеризует ее как протеазу серинового типа. Эта протеаза неактивна в отношении белков С 1 при нейтральном рН и при 50 С в отсутствие хаотрофного агента. Увеличение рН и добавление хаотрофных агентов, таких как LAS, ДСН и мочевина, в существенной степени усиливает протеолиз. Фракция 39-41 была очищена с помощью гидрофобной хроматографии на фенолсуперозе. Фракции уравновешивали с 0,03 М Na-фосфатного буфера, рН=7,2, содержащего 1,5 М (NH4)2SO4, и загружали на колонку. Адсорбировавшиеся белки элюировали в градиенте 1,5-0 М (NH4)2SO4. Таким образом была получена гомогенная ксиланаза с молекулярной массой 60 кД и рI=4,7. Эта ксиланаза проявляла активность в отношении ксилана, MUF-целлобиозы, MUF-ксилозида и MUF-лактозида. Предположительно эта ксиланаза относится к семейству 10 (семейство F). Эта ксиланаза была стабильной при рН от 5 до 8 в течение 24 ч и сохраняла более 80% активности при 50 С. Она сохраняла 70% активности при рН=5-7 при 60 С. Она сохраняла 80% активности в течение 5 ч и 35% в течение 24 ч при 50 С и рН=9. При рН=10 60% активности сохранялось при 50 С и получасе инкубации. Было установлено, что имеющиеся 45% активности через 5 ч инкубации при рН=8 и 60 С через 24 ч снижались до 0. Она имела оптимум рН в-23 005682 диапазоне рН=6-7 и удерживала 70% активности при рН=9 и 50% своей активности при рН=9,5. Константа Михаэлиса в отношении ксилана березы составила 0,5 г/л. Температурный оптимум был высоким,равным 80 С. Фракция 44-48 была затем очищена методом хроматофокусирования на Моnо-Р. Для элюции белков использовали градиент рН 7,63-5,96. В результате была выделена эндоглюканаза 45 кД с рI=6. 45 кД эндо имела максимум активности при рН=5 в отношении CMC и при рН=5-7 в отношении RBBCMC. 45-кД эндо сохраняла 70% от своей максимальной активности в отношении CMC при рН=6,5, и 70% от своей максимальной активности в отношении RBB-CMC сохранялось при рН=7,0; 50% от ее максимальной активности в отношении CMC сохранялось при рН=7, и 50% от ее максимальной активности в отношении RBB-CMC сохранялось при рН=8. Константа Михаэлиса в отношении CMC составила 4,8 г/л. Температурный оптимум был высоким и составлял 80 С. Другие белки - 28, 33, 36, 55, 60 и 66 кД были элюированы в смеси друг с другом. Фракцию 52-58 очищали методом хроматофокусирования также на Моnо-Р в градиенте рН=7,6-4,5. Была выделена отдельная эндоглюканаза 55 кД с рI=4,9. 55-кД эндо была нейтральной. Она проявляла широкий оптимум рН в диапазоне 4,5-6, и 70% активности сохранялось при рН=7,0 в отношении и CMC,и RBB-CMC, и 50% активности сохранялось при рН=8 и для CMC, и RBB-CMC. Константа Михаэлиса в отношении CMC составила 1 г/л. Температурный оптимум был высоким и составлял 80 С. Ряд фракций также содержал белки с молекулярной массой 28, 33 и 36 кД. Белки 45, 48 и 100 кД были выделены из связанных на DEAE-Toyopearl фракций F 60-8 UF conc культуры Chrysosporium из фракций 50-53 с использованием хроматографии Macro Prep Q. Фракцию 50-53 уравновешивали 0,03 М буфера имидазол-HCl, рН=5,75, и загружали на колонку, а адсорбировавшиеся белки элюировали в градиенте 0,1-0,25 М NaCl в течение 4 ч. В результате в виде гомогенных компонентов были выделены белки 45 кД (рI=4,2), 48 кД (рI=4,4) и 100 кД (рI=4,5) (фиг. 17). Белок 45 кД предположительно является ,-галактозидазой, на что указывает его активность в отношении п-нитрофенилгалактозида и п-нитрофенилгалактозида. Оптимум рН составил 4,5: 70% активности сохранялось при рН=5,7 и 50% его активности сохранялось при рН=6,8. Температурный оптимум составил 60 С (фиг. 18). Белок 48 кД являлся целлобиогидролазой, проявлявшей высокий уровень активности в отношении п-нитрофенилгалактозида, а также активность в отношении MUF-целлобиозида, MUF-лактозида и пнитрофенилбутирата. Белок 48 кД имел оптимум рН=5 в отношении CMC и 5-6 в отношении RBB-CMC(фиг. 19). Белок 100 кД с рI=4,5 проявлял активность только в отношении п-нитрофенилбутирата. Предположительно он является эстеразой, но не ферулоилэстеразой, поскольку он не проявлял активности в отношении сложного метилового эфира феруловой кислоты. Он имел нейтральный/щелочной оптимум рН(рН=8-9) и температурный оптимум 55-60 С (фиг. 20, 21). Протеаза 90 кД с рI=4,2 была выделена из связанной фракции, и ее активность, измеренная в отношении белков фракции NBNB, оказалась равной 12 х 10-3 ед./мл при 50 С и рН=7,90. Эта фракция проявляла активность в отношении красильного казеина на уровне 0,01 условных ед./мг (рН=7). Добавление мочевины в качестве хаотрофного агента приводило к 2-3-кратному увеличению протеазной активности,как и добавление LAS при рН и 7, и 9 (50 С). Протеаза 90 кД была нейтральной при оптимуме рН на уровне рН=8. Активность подавляется фенилметилсульфонилфторидом (PMSF), но не иодуксусной кислотой, пепстатином-А и ЭДТА, что характеризует ее как протеазу серинового типа. Также из связанной фракции были выделены эндоглюканаза 43 кД с рI=4,2 (фракция 33-37) и эндоглюканаза 25 кД с рI=4,1 (фракция 39-43), целлобиогидролаза 55 кД с рI=4,9 (фракция 39-43) и полигалактуроназа 65 кД с рI=4,4 (фракция 39-43). Эндоглюканазы не проявляли активности в отношении авицеля или MUF-целлобиозида, но проявляли высокую активность в отношении МС, RBB-CMC,CMC41, -глюкана и эндоглюканазы. 25-кД эндо не вырабатывала глюкозы из CMC, что отмечено для 43-кД эндо. Не образовывалась глюкоза из авицеля. Оптимум рН для белка 43 кД составил 4,5 при сохранении 70% максимальной активности при рН=7,2 и 50% при рН=8. 43-кД эндо сохраняла 70% активности при рН=5-6 в течение 25 ч инкубации. Она удерживала только 10% при рН=7 в течение такого периода инкубации. 25-кД эндо имела оптимальную активность при рН=5 в отношении CMC и широкий оптимум рН для активности в отношении RBB-CMC при сохранении 70% максимальной активности при рН=9 и 50% максимальной активности при рН=10. Она сохраняла 100% активности при рН=5-6 и 80% при рН=7, 8, 8,6 и 9,6 в течение 120 ч инкубации. 25-кД эндо имела температурный оптимум активности при 70 С. 43-кД эндо имела температурный оптимум активности при 60 С. Константы Михаэлиса в отношении CMC составили 62 и 12,7 г/л для эндоглюканаз 25 и 43 кД, соответственно. Полигалактуроназа является пектиназой. Константа Михаэлиса в отношении PGA составила 3,8 г/л. Оптимум рН активности PGU находится в пределах рН=5-7 и температурный оптимум - 50-65 С. Гены, кодирующие белки С.lucknowense, были выделены с использованием ПЦР и охарактеризованы путем секвенирования. Соответствующие полноразмерные гены были получены путем (частичного) скрининга генных библиотек с использованием выделенных ПЦР-фрагментов. Полный ген эндоглюкана-24 005682 зы 43 кД (EG6, семейство 6) штамма С 1 был клонирован, секвенирован и проанализирован (включая промоторный участок длиной 2,5 т.п.н. и терминаторный участок длиной 0,5 т.п.н.). Его нуклеотидная и аминокислотная последовательности приведены в SEQ ID NO 1. Предсказанная молекулярная масса зрелого белка - 39427 Д, а предсказанная рI=4,53: эти величины хорошо согласуются с данными измерений. Анализ сопоставления белков с другими гликозилгидролазами семейства 6.2 показывает, что C1-EG6 не включает целлюлозосвязывающий домен (CBD). Анализ гомологии с использованием программы SwissProt SAMBA (алгоритм по Смиту-Уотерману; установки: gap penalty - 12/2; alignment - 10; Blosum62matrix) показывает, что C1-EG6 на 51,6% идентичен EG-B Fusarium oxysporum (no 376 аминокислотам),на 51,0% идентичен СВН 3 шампиньона Agaricus bisporus (пo 353 аминокислотам) и на 50,7% идентичен СВН 2 Trichoderma reesei (no 367 аминокислотам). Предполагаемая сигнальная последовательность простирается от метионина-1 до аргинина-28. Промотор включает несколько потенциальных СrеАсвязывающих сайтов, поэтому весьма вероятно, что этот промотор будет подвержен глюкозной репрессии в грибковом штамме с действующей СrеА-регуляцией. Сходным образом полный ген эндоглюканазы 25 кД (EG5, семейство 45) штамма С 1 был клонирован, секвенирован и проанализирован (включая промоторный участок длиной 3,3 т.п.н. и терминаторный участок длиной 0,7 т.п.н.). Нуклеотидная и аминокислотная последовательности приведены в SEQ ID NO 2. Предсказанная молекулярная масса зрелого белка - 21858 Д, а предсказанная рI=4,66: эти величины хорошо согласуются с данными измерений. Это наименьшая из грибковых эндоглюканаз, известных к настоящему времени. Анализ сопоставления белковых последовательностей с другими гликозилгидролазами семейства 45 показывает, что C1-EG5 не включает ни целлюлозосвязывающего домена (CBD), ни домена типа когезин/докерин. Анализ гомологии с помощью программы NCBI-BLASTP2 (установки:gар penalty - 11/1; alignment - 10; Blosum62 matrix) показывает, что наибольший уровень гомологии с белком C1-EG5 проявляет EG-K Fusarium oxysporum: 63% идентичности. Предполагаемая сигнальная последовательность простирается от метионина-1 до аланина-18. Промотор включает множество потенциальных СrеА-связывающих сайтов, поэтому очень вероятно, что этот промотор будет подвержен глюкозной репрессии в грибковом штамме с действующей СrеА-регуляцией. Более того, еще одна эндоглюканаза была обнаружена с помощью ПЦР при проведении анализа гомологии с целлюлазами семейства 12. Частичные нуклеотидная и аминокислотная последовательности этой дополнительной эндоглюканазы (EG3, семейство 12) даны в SEQ ID NO 3. Белок 55 кД является целлобиогидролазой (в данном тексте обозначен как СВН 1) с активностью в отношении к MUF-целлобиозида, MUF-лактозида, FP и авицеля, а также в отношении п-нитрофенил-глюкозида, целлобиозы и п-нитрофениллактозида. Ее активность в отношении MUF-целлобиозида подавляется целлобиозой. Константа ингибирования была определена на уровне 0,4 мМ. Константа Михаэлиса в отношении MUF-целлобиозида составила 0,14 мМ, в отношении MUF-лактозида - 4 мМ, и в отношении CMC - 3,6 г/л. Оптимум рН достаточно широк - 4,5-7. При рН=8 удерживается 50% максимальной активности в отношении CMC и 80% активности в отношении RBB-CMC. При рН=5-8 70-80% активности сохраняется в течение 25 ч инкубации. Температурный оптимум - 60-70 С. Предположительно СВН 1 входит в семейство целлобиогидролаз 7; ее частичные нуклеотидная и аминокислотная последовательности показаны в SEQ ID NO 4. Приведенная частичная аминокислотная последовательность примерно соответствует аминокислотам 300-450 N-концевой части зрелого белка. Целлобиогидролаза по настоящему изобретению характеризуется по крайней мере 60%-ной, предпочтительно по крайней мере 70%-ной, наиболее предпочтительно по крайней мере 80%-ной идентичностью последовательностей по сравнению с частичной аминокислотной последовательностью SEQ ID NO 4. Соответствующий промотор СВН, который является предпочтительным вариантом настоящего изобретения, может быть идентифицирован с использованием частичной нуклеотидной последовательности SEQ ID NO 4. В процессе гидролиза авицеля был установлен эффект синергизма между эндоглюканазой 25 кД и СВН 55 кД. Максимальный коэффициент синергизма имелся при отношении 25-кД эндо и СВН 55 кД - 80:20. Максимальный Ksyn составил 1,3. В табл. А, В и J показаны подробности описанного выше.-25 005682 Таблица J Схема очистки Очистка образцов F 60 8 (UF-conc) и F 60-31 CF Уровень экспрессии пяти основных генов Chrysosporium был изучен с помощью Нозерн-блоттинга. Различные штаммы C.lucknowense выращивали в обогащенной культуральной среде, содержащейPharmedia с целлюлозой и лактозой (среда 1), или в обогащенной среде, содержащей Pharmedia с глюкозой (среда 2), при 33 С. Через 48 ч собирали мицелий и выделяли РНК. РНК гибридизовали с 5 различными зондами: EG5, EG6, EG3, XyLF и СВН. После обработки Нозерн-блоты разрезали на полосы и вновь гибридизовали с зондом к рибосомному белку L3, являющемуся контролем количества мРНК на блоте. Большинство штаммов показали очень высокий уровень ответа на СВН и высокий уровень ответа на XyLF в среде 1; в среде 2 половина штаммов показала высокий уровень ответа на все гены, а другая половина проявила слабые ответы. На основании этих данных был определен следующий порядок уровней экспрессии: СВНXyLFEG5EG3EG6. Табл. А, В и J иллюстрируют подробности описанного выше. Описание чертежей Фиг. 1 - Вестерн-блот, описанный в примерах. Фиг. 2 - карта pUT720. Фиг. 3 - карта pUT970G. Фиг. 4 - карта pUT1064. Фиг. 5 - карта pUT1065. Фиг. 6 - карта pF6g. Фиг. 7 - карта pUT1150. Фиг. 8 - карта pUT1152. Фиг. 9 - карта pUT1155. Фиг. 10 - карта pUT1160. Фиг. 11 - карта pUT1162. Фиг. 12 - ион-обменная хроматография на Macro Prep Q фракции NB после DEAE-Toyopearl образца F-60-31 CF. Фиг. 13 - зависимость от рН активности ферментов фракций NB образца F-60-31 CF. Фиг. 14 - стабильность ферментов из фракции NB образца F-60-31 CF при рН=5,5 и 7,5 (60 С). Фиг. 15 - рН-стабильность при 60 С и 50 С Хуl 60 кД (рI=4,7) из фракции NB образца F-60-31. Фиг. 16 - зависимость от температуры ферментов из фракции NB образца F-60-31. Фиг. 17 - ион-обменная хроматография на Macro Prep Q связанных фракций 50-53 после DEAEToyopearl образца F-60-8. Фиг. 18 - зависимость активности -галактозидазы из F-60-43, UF-conc от рН и температуры. Фиг. 19 - зависимость активности СВН 48 кД (рI=4,4) из связанных фракций F-60-8 UF-conc от рН. Фиг. 20 - зависимость активности в отношении п-нитрофенилбутирата образца F-60-8 UF-conc от температуры. Фиг. 21 - зависимость активности в отношении п-нитрофенилбутирата образца F-60-8 UF-conc от рН. Фиг. 22 - связь с рН активностей протеаз 30 кД (рI=8,9) и 90 кД (рI=4,2) в отношении белков С 1(50 С, 30 мин инкубации). Фиг. 23 - влияние щелочной протеазы 30 кД (рI=8,9) на ксиланазную активность фракции NBNB-26 005682 Фиг. 24 - влияние нейтральной протеазы 90 кД (рI=4,2) на СМСазе-активность белков из связанной фракции 44-45 (DEAE-Toyopearl) образца F 60-8 UV-conc при 50 С. Фиг. 25 - полный гидролиз полигалактуроновой кислоты действием полиагалактуроназы 65 кД(рI=4,4): 50 С, рН=4,5; концентрация PGA - 5 г/л, концентрация белка - 0,1 г/л. Фиг. 26 - зависимость активности полигалактуроназы F-60-43 UF-conc от рН и температуры. Фиг. 27 - подавление активности СВН 55 кД (рI=4,4) в отношении MUF-целлобиозида целлобиозой: рН=4,5, 40 С. Фиг. 28 - эффект синергизма между 25 кД эндо (рI=4,1) и 55 кД СВН (рI=4,4) в отношении авицеля(40 С, рН=5, 25 мин). Фиг. 29 - полный гидролиз CMC (а) и авицеля (b) ферментами, выделенными из связанной фракции образца F-60-8 UF-conc (50 С, рН=5): концентрация CMC и авицеля - 5 г/л, концентрация 25 кД эндо 0,01 г/л, концентрация 43 кД эндо - 0,02 г/л; 1-25 кД эндо (pl=4,1), 2 - 43 кД эндо (pl=4,2). Фиг. 30 - полный гидролиз CMC (1) и авицеля (2) действием СВН 55 кД (рI=4,4) без (а) и с (b) глюконолактоном (50 С, рН=4,5): концентрация CMC и авицеля - 5 г/л, концентрация белка - 0,1 г/л, концентрация глюконолактона - 5 г/л. Фиг. 31 - рН-зависимость CMCase и RBB-CMCase у ферментов, выделенных из образца F-60-8 UFconc: 1-25 кД эндо (рI=4,1), 2-43 кД эндо (рI=4,2). Фиг. 32 - рН-зависимость CMCase и RBB-CMCase активности у СВН 55 кД (рI=4,4). Фиг. 33 - зависимость от температуры CMCase активности (рН=4,5) у ферментов, выделенных из связанных фракций образца F-60-8 UF-conc: 1-55 кД СВН (рI=4,4), 2-25 кД эндо (рI=4,1), 3-43 кД эндо(рI=4,2). Фиг. 34 - рН-стабильность (50 С) ферментов, выделенных из связанных фракций образца F-60-8UF-conc: 1-55 кД СВН (рI=4,4), 2-25 кД эндо (рI=4,1), 3-43 кД эндо (рI=4,2). Фиг. 35 - адсорбция ферментов, выделенных из связанных фракций образца F-60-8 UF-conc. Библиография (ее содержание включено здесь для сведения) 1. Calmels T.P., Martin F., Durand H., and Tiraby G. (1991) Proteolytic events in the processing of secreted proteins in fungi. J. Biotechnol. 17(1): p. 51-66. 2. Punt P.J., Dingemanse M.A., Jacobs-Meijsing B.J., Pouwels Р.H., and van den Hondel C.A. (1988) Isolation and characterization of the glyceraldehyde-3-phospfate dehydrogenase gene of Aspergillus nidulans. Gene 69(1): p. 49-57. 3. Shoemaker S., Schweickart V., Ladner M., Gelfand D., Kwok S., Myambo K., and Innis M. (1983) Molecular cloning of exo-cellobiohydrolase I derived from Trichoderma reesei strain L27. Bio/Technology
МПК / Метки
МПК: C12N 15/80
Метки: частности, способные, грибы, chrysosporium, рода, синтезу, трансформированные, гетерологичных, полипептидов
Код ссылки
<a href="https://eas.patents.su/30-5682-transformirovannye-griby-v-chastnosti-roda-chrysosporium-sposobnye-k-sintezu-geterologichnyh-polipeptidov.html" rel="bookmark" title="База патентов Евразийского Союза">Трансформированные грибы, в частности рода chrysosporium, способные к синтезу гетерологичных полипептидов</a>