Растворимый гетеродимерный рецептор цитокина
Номер патента: 5496
Опубликовано: 24.02.2005
Авторы: Новак Джулия Э., Фостер Доналд К., Зу Венфенг, Чандрасехер Ясмин А., Джасперс Стивен Р.
Формула / Реферат
1. Выделенный растворимый рецептор, состоящий из субъединицы IL-22R и субъединицы IL-20RB, где субъединица IL-22R состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, 13, 25, 26, 31 и 32, а субъединица IL-20RB состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 15-21, 23, 28, 29, 34 и 35.
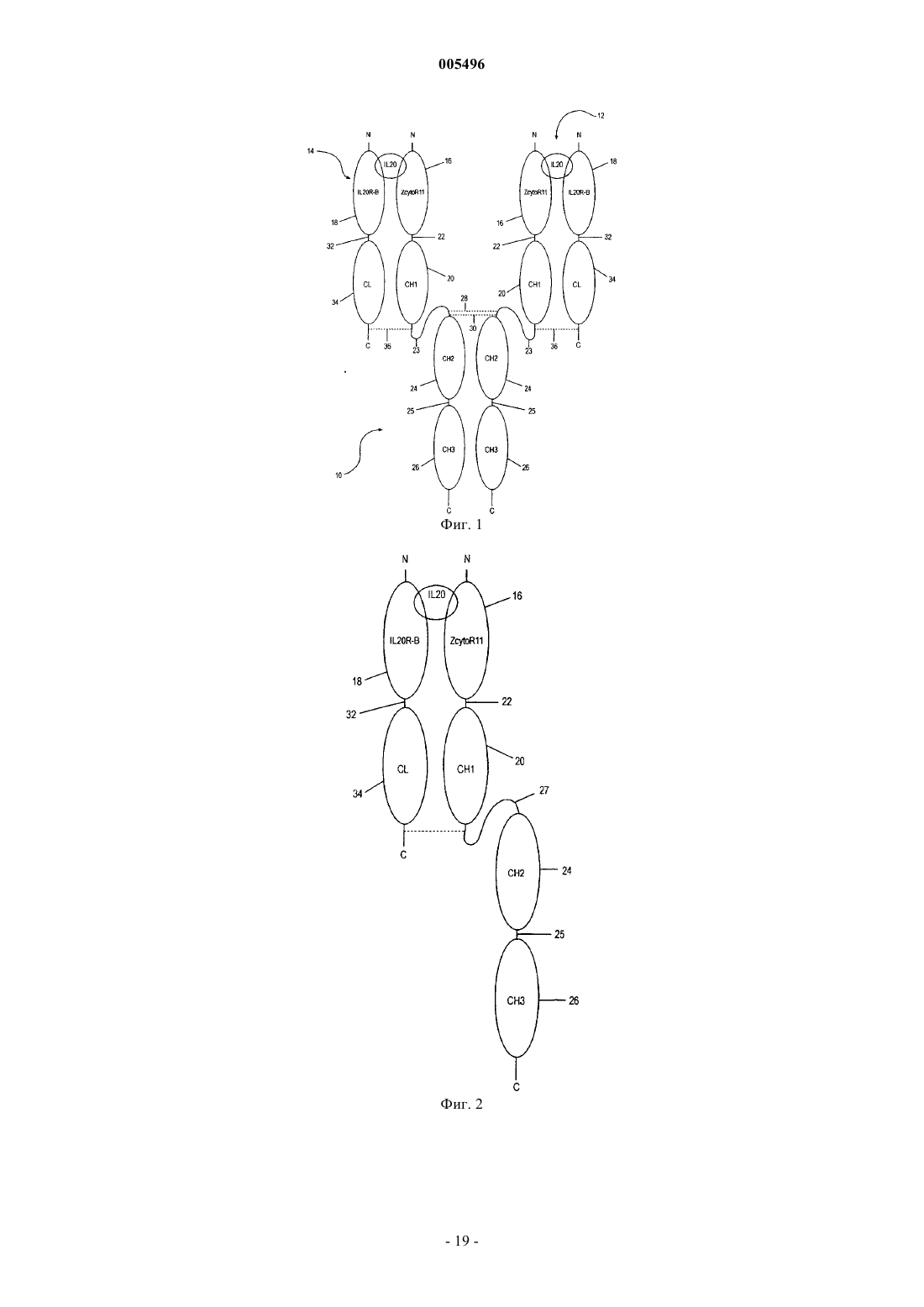
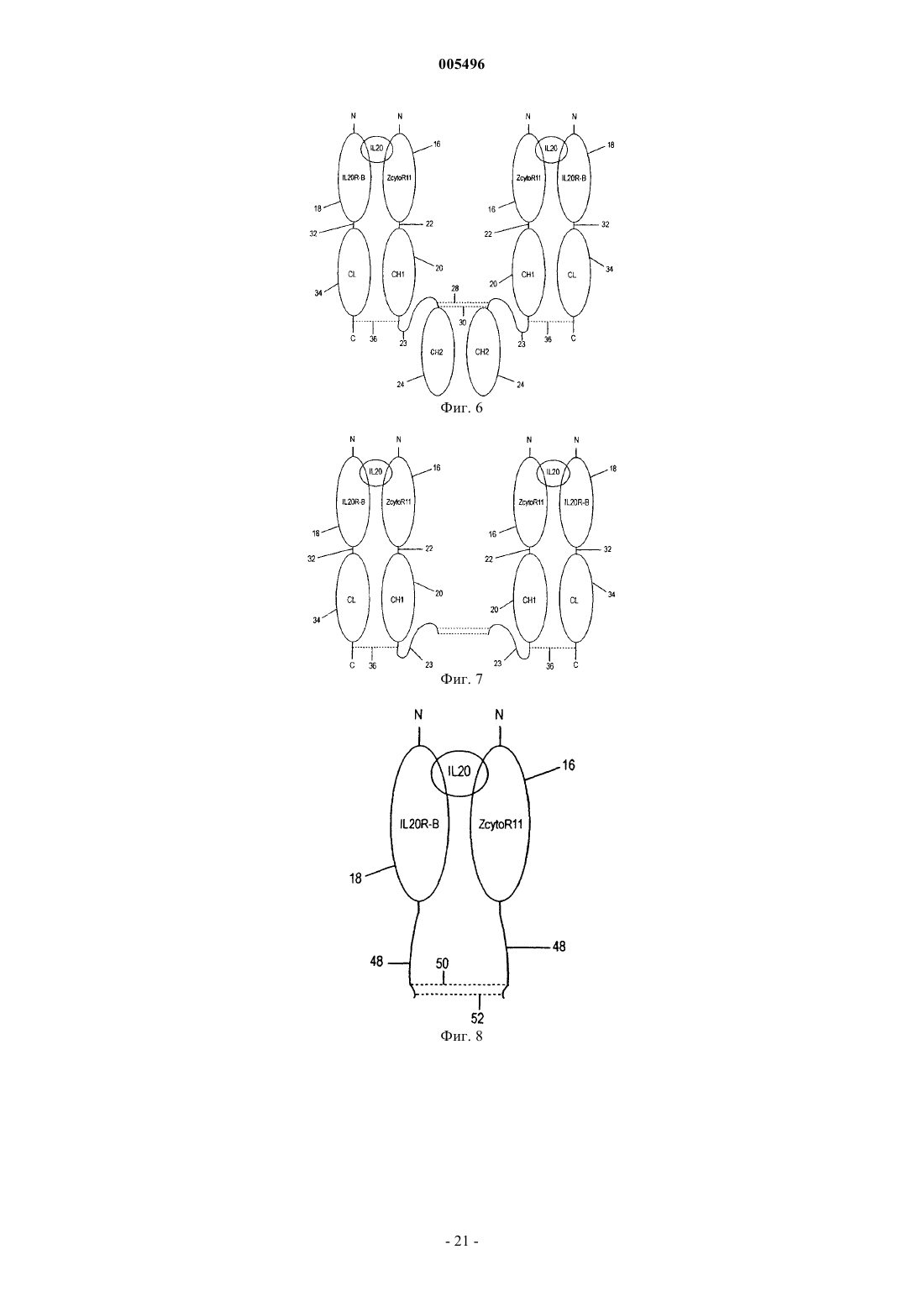
2. Растворимый рецептор по п.1, где субъединица IL-22R и субъединица IL-20RB связаны вместе полипептидным линкером.
3. Растворимый рецептор по п.2, где полипептидный линкер имеет приблизительно 100-240 аминокислотных остатков.
4. Растворимый рецептор по п.3, где полипептидный линкер имеет приблизительно 170 аминокислотных остатков.
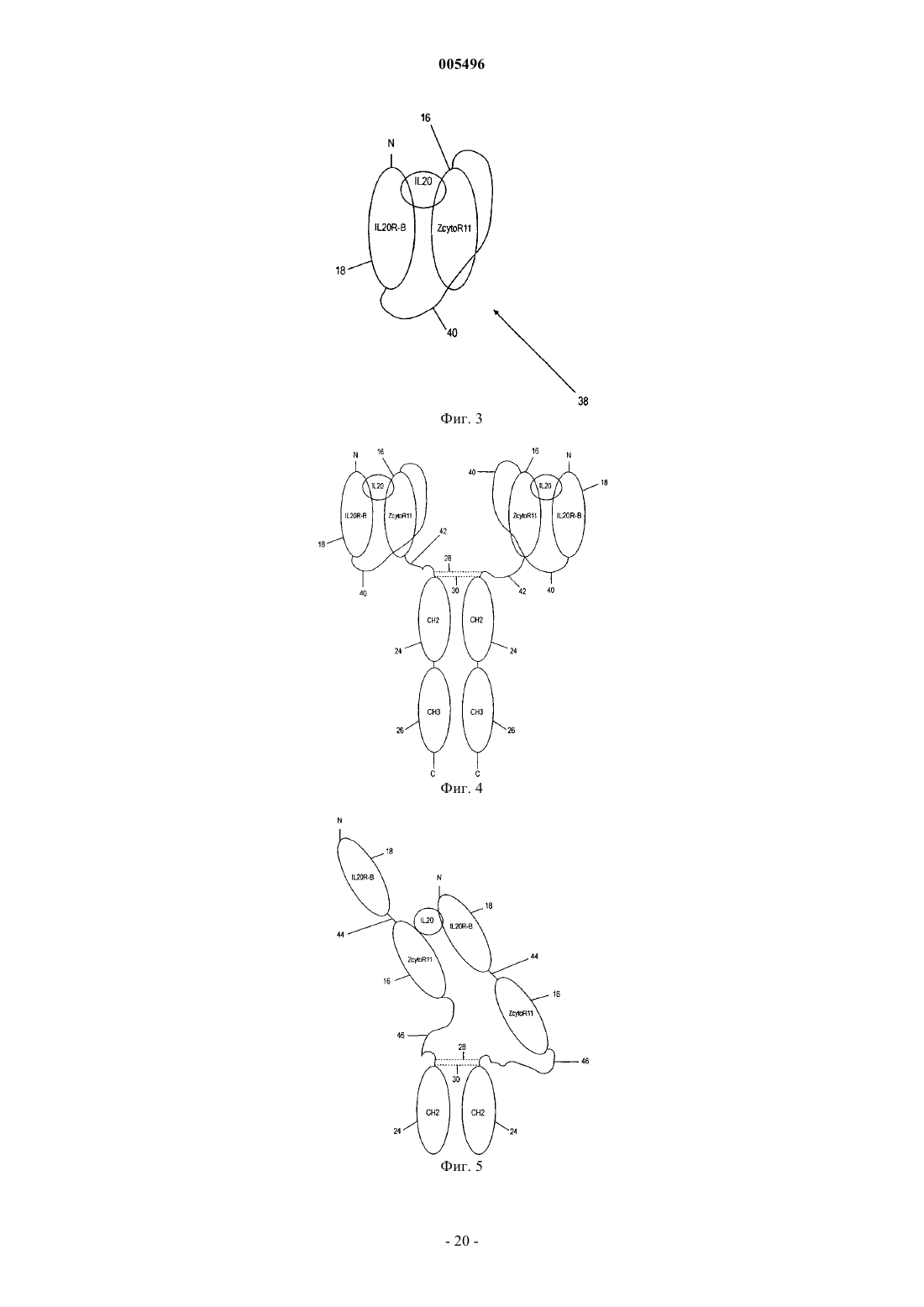
5. Растворимый рецептор по п.1, где субъединица IL-22R и субъединица IL-20RB, каждая, имеют полипептидный линкер, слитый с данной субъединицей, и каждый из этих полипептидных линкеров имеет по меньшей мере один остаток цистеина, где по меньшей мере одна дисульфидная связь образуется с цистеином из полипептидного линкера субъединицы IL-22R и с цистеином из полипептидного линкера субъединицы IL-20RB.
6. Растворимый рецептор по п.5, где субъединица IL-22R слита со всей константной областью или частью константной области тяжелой цепи молекулы иммуноглобулина (Ig), а субъединица IL-20RB слита со всей константной областью или частью константной области легкой цепи молекулы иммуноглобулина, где эта легкая цепь и эта тяжелая цепи связаны между собой дисульфидной связью.
7. Растворимый рецептор по п.6, где константная область тяжелой цепи состоит из домена CH1, домена CH2 и шарнирной последовательности, которая соединяет домен CH1 с доменом CH2.
8. Растворимый рецептор по п.6, где субъединица IL-22R, слитая с константной областью тяжелой цепи, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 25, 26, 31 и 32, а субъединица IL-20RB, слитая с константной областью легкой цепи молекулы Ig, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 28, 29, 34 и 35.
9. Растворимый рецептор по п.5, где субъединица IL-20RB слита со всей константной областью или частью константной области тяжелой цепи молекулы иммуноглобулина (Ig), а субъединица IL-22R слита со всей константной областью или частью константной области легкой цепи молекулы иммуноглобулина, где эта легкая цепь и эта тяжелая цепи связаны между собой дисульфидной связью.
10. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (a) введение в клетку-хозяина первой последовательности ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-22R, и ДНК, которая кодирует константную область легкой цепи иммуноглобулина, (b) введение в клетку-хозяина второй конструкции ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-20RB, и последовательности ДНК, которая кодирует домен константной области тяжелой цепи иммуноглобулина; (c) выращивание этой клетки-хозяина в подходящей для выращивания среде при физиологических условиях, позволяющих продуцирование слитого белка, состоящего из внеклеточных доменов IL-22R и IL-20RB, и (d) выделение этого полипептида из клетки-хозяина.
11. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (a) введение в клетку-хозяина первой последовательности ДНК, состоящей из ДНК, которая кодирует внеклеточную часть IL-20RB, и ДНК, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клетку-хозяина второй конструкции ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-22R, и последовательности ДНК, которая кодирует константную область тяжелой цепи иммуноглобулина; (c) выращивание этой клетки-хозяина в подходящей для выращивания среде при физиологических условиях, позволяющих продуцирование димеризованного гетеродимерного слитого белка, состоящего из внеклеточных доменов IL-22R и IL-20RB; и (d) выделение этого димеризованного полипептида из клетки-хозяина.
12. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (a) введение в клетку-хозяина конструкции ДНК, содержащей конструкцию ДНК, которая кодирует внеклеточную часть IL-20RB, и конструкцию ДНК внеклеточной части IL-22R, (b) выращивание этой клетки-хозяина в подходящей среде при физиологических условиях, позволяющих продуцирование внеклеточного домена IL-22R и внеклеточного домена IL-20RB; и (d) выделение этих полипептидов из клетки-хозяина.
13. Клетки-хозяева, трансформированные или трансфицированные конструкцией ДНК, которая кодирует внеклеточный домен IL-22R, и конструкцией ДНК, которая кодирует внеклеточный домен IL-20RB.
Текст
005496 Описания всех цитируемых ссылок включены здесь в качестве ссылки в их полном виде. Цитокины являются растворимыми белками, которые влияют на рост и дифференцировку многих типов клеток. Их рецепторы состоят из одного или нескольких интегральных мембранных белков, которые связывают цитокин с высокой аффинностью и трансдуцируют это событие связывания в клетку через цитоплазматические части определенных субъединиц рецептора. Рецепторы цитокинов были сгруппированы в несколько классов на основе сходства в их внеклеточных доменах связывания лиганда. Например, рецепторные цепи, ответственные за связывание и/или трансдукцию действия интерферонов(IFN), являются членами семейства рецепторов цитокинов типа II (CRF2) на основе характерного состоящего из 200 остатков внеклеточного домена. Демонстрируемые in vivo активности этих интерферонов иллюстрируют огромный клинический потенциал цитокинов и потребность в других цитокинах,агонистах цитокинов и антагонистах цитокинов. Некоторые цитокины участвуют в воспалительном каскаде и могут усиливать такие заболевания, как ревматоидный артрит, болезнь Крона, псориаз, сердечные заболевания и т.д. Таким образом, существует потребность в обнаружении цитокинов и их рецепторов,которые участвуют в воспалении. После этого можно использовать выделенные растворимые рецепторы цитокина для ингибирования опосредованного этим цитокином воспаления. Краткое описание чертежей Фиг. 1-8 являются схематическими представлениями различных вариантов растворимого рецептора данного изобретения. Описание изобретения Данное изобретение удовлетворяет эту потребность обеспечением открытого недавно растворимого рецептора, который связывается с интерлейкином-20 (IL-20). Этот растворимый рецептор может быть использован в понижающей регуляции IL-20 и, следовательно, в лечении воспалительных заболеваний,таких как псориаз и воспалительные заболевания легких.IL-20 был формально назван "Zcyto10" (Международная публикацияWO 99/27103) и имеет аминокислотные последовательности SEQ ID NO:1-9. Гетеродимерный рецептор, который связывается с IL20, состоит из двух цепей, альфа-цепи и бета-цепи. Альфа-цепь называют IL-22R (ранее ее называлиDIRS1. См. Международную патентную заявкуPCT/US99/03735. Настоящее изобретение относится к растворимому рецептору, состоящему из внеклеточного домена IL-22R и внеклеточного домена IL-20RB. Данное изобретение включает в себя выделенный растворимый рецептор, состоящий из субъединицы "IL-22R" и субъединицы "IL-20RB", где субъединица IL-22R состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:11, 12 и 13, а субъединица IL-20RB состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-23. Субъединицы IL-22R и IL-20RB обычно связаны вместе полипептидным линкером. Связывание может осуществляться любым способом, но обычно осуществляется пептидной связью или дисульфидной связью между полипептидом, соединенным с субъединицей IL22R, и полипептидом, соединенным с субъединицей IL-20RB. Данное изобретение относится также к выделенным полинуклеотидам, которые кодируют новые полипептиды IL-22R и IL-20RB данного изобретения. В одном варианте субъединица IL-22R слита с константной областью тяжелой цепи молекулы иммуноглобулина (Ig) или ее частью, а субъединица IL-20RB слита с константной областью легкой цепи молекулы Ig, так что константная область легкой цепи связана дисульфидной связью с константной областью тяжелой цепи, обычно с остатком цистеина на шарнирной области тяжелой цепи. Может встречаться и обратная ситуация, т.е. субъединица IL-22R может быть слита с константной областью легкой цепи молекулы Ig, a субъединица IL-20RB может быть слита с константной областью тяжелой цепи молекулы Ig. В одном варианте растворимого рецептора данного изобретения субъединица IL-22R, слитая с константной областью тяжелой цепи, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 25, 26, 31 и 32, а субъединица IL-20RB, слитая с константной областью легкой цепи молекулы Ig, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 28 и 29. Данное изобретение дополнительно относится к способу для ингибирования интерлейкина-20 (IL20), предусматривающему введение индивидууму растворимого гетеродимерного полипептида IL22R/IL-20RB. Данное изобретение относится также к способу для ингибирования IL-20, предусматривающему введение индивидууму антитела, которое связывается с IL-22R. Далее, данное изобретение относится к полинуклеотиду, кодирующему внеклеточный домен IL-22R и внеклеточный домен IL-20RB. Примером такого полинуклеотида является вектор или плазмида, содержащая полинуклеотид, который кодирует IL-22R и IL-20RB. Определения Перед более подробным изложением данного изобретения может быть полезным для его понимания определение следующих терминов.-1 005496 Термины "амино-концевой" и "карбоксил-концевой" используются здесь для обозначения положений внутри полипептидов. Там, где позволяет контекст, эти термины используются со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, некоторая последовательность, расположенная карбоксил-терминально относительно ссылочной последовательности в полипептиде, расположена проксимально относительно карбоксилконца ссылочной последовательности, но не обязательно находится при карбоксил-конце полного полипептида. В применении здесь, термин "слитый с антителом белок" относится к рекомбинантной молекуле,которая содержит компонент антитела и терапевтический агент. Примеры терапевтических агентов, подходящих для таких слитых белков, включают в себя иммуномодуляторы (слитый белок антителоиммуномодулятор) и токсины (слитый белок антитело-токсин). Термин "пара комплемент/антикомплемент" обозначает неидентичные части молекулы, которые образуют нековалентно связанную, стабильную пару при подходящих условиях. Например, биотин и авидин (или стрептавидин) являются членами-прототипами пары комплемент/антикомплемент. Другие примеры пар комплемент/антикомплемент включают в себя пары рецептор/лиганд, пары антитело/антиген (или гаптен или эпитоп), пары смысловой/антисмысловой полинуклеотид и т.п. В случае, когда желательна последующая диссоциация пары комплемент/антикомплемент, пара комплемент/антикомплемент предпочтительно имеет аффинность связывания 109 М-1. Термин комплементы полинуклеотидной молекулы" обозначает полинуклеотидную молекулу,имеющую комплементарную последовательность оснований и обращенную ориентацию в сравнении со ссылочной последовательностью. Термин контиг обозначает полинуклеотид, который имеет непрерывный отрезок идентичной или комплементарной последовательности относительно другого полинуклеотида. Говорят, что непрерывные последовательности (контиги) "перекрывают" конкретный отрезок полинуклеотидной последовательности либо полностью, либо вдоль частичного отрезка этого полинуклеотида. Термин вырожденная нуклеотидная последовательность обозначает последовательность нуклеотидов, которая включает в себя один или более вырожденных кодонов (в сравнении со ссылочной полинуклеотидной молекулой, которая кодирует полипептид). Вырожденные кодоны содержат различные триплеты нуклеотидов, но кодируют один и тот же аминокислотный остаток (т.е. триплеты GAU и GAC,каждый, кодируют Asp). Термин экспрессирующий вектор используется для обозначения молекулы ДНК, линейной или кольцевой, которая содержит сегмент, кодирующий представляющий интерес полипептид, функционально связанный с дополнительными сегментами, которые обеспечивают его транскрипцию. Такие дополнительные сегменты включают в себя промоторную и терминаторную последовательности и могут также включать в себя одну или несколько точек инициации репликации, один или несколько селектируемых маркеров, энхансер, сигнал полиаденилирования и т.д. Экспрессирующие векторы обычно произведены из плазмидной или вирусной ДНК или могут содержать элементы обеих. Термин "выделенный", в применении к полинуклеотиду, обозначает, что этот полинуклеотид был удален из его природной генетической среды и, следовательно, не содержит других посторонних или нежелательных кодирующих последовательностей и находится в форме, подходящей для применения в генетически сконструированных системах продуцирования белков. Такие выделенные молекулы являются молекулами, которые выделены из их природного окружения, и включают в себя кДНК-клоны и геномные клоны. Выделенные молекулы ДНК данного изобретения не содержат других генов, с которыми они обычно связаны, но могут включать в себя природно встречающиеся 5'- и 3'-нетранслируемые районы, такие как промоторы и терминаторы. Идентификация ассоциированных районов будет очевидной лицу с обычной квалификацией в данной области (см., например, Dynan and Tijan, Nature 316:774-78, 1985). Термин выделенный полипептид или белок представляет собой полипептид или белок, который обнаруживается в условиях, иных, чем его природное окружение, например, отдельно от крови и ткани животного. В предпочтительной форме, выделенный полипептид является по существу не содержащим других полипептидов, в частности, других полипептидов животного происхождения. Предпочтительно обеспечение полипептидов в высокоочищенной форме, т.е. имеющих чистоту более 95%, более предпочтительно чистоту более 99%. При использовании в этом контексте, термин выделенный не исключает присутствия того же самого полипептида в альтернативных физических формах, таких как димеры или альтернативно гликозилированные или дериватизованные формы. Термин функционально (оперативно) связанные в применении к сегментам ДНК, указывает, что эти сегменты расположены таким образом, что они функционируют совместно для их предполагаемых целей, например, транскрипция инициируется в промоторе и протекает через кодирующий сегмент до терминатора. Термин "полинуклеотид" обозначает одно- или двухцепочечный полимер дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемых от 5'-конца к 3'-концу. Полинуклеотиды включают в себя РНК и ДНК и могут быть изолированы из природных источников, синтезированы in vitro или по-2 005496 лучены из комбинации природных и синтетических молекул. Размеры полинуклеотидов выражаются как пары нуклеотидов (сокращенно "п.н."), нуклеотиды ("нт") или тысячи пар нуклеотидов ("т.п.н."). Там,где позволяет контекст, два последних термина могут описывать полинуклеотиды, которые являются одноцепочечными или двухцепочечными. При применении этого термина к двухцепочечным молекулам его используют для обозначения общей длины, и должно быть понятно, что он является эквивалентным термину "пары нуклеотидов". Специалистам в данной области будет понятно, что две цепи двухцепочечного полинуклеотида могут слегка отличаться по длине и что их концы могут быть расположены ступенчатым образом в результате ферментативного расщепления; таким образом, не все нуклеотиды в двухцепочечной полинуклеотидной молекуле могут быть спаренными. Термин "полипептид" является полимером аминокислотных остатков, соединенных пептидными связями, получен ли он природным путем или синтетическим путем. Полипептиды, имеющие менее приблизительно 10 аминокислотных остатков, обычно называют "пептидами". Термин "промотор" используется здесь в его общепринятом в данной области значении для обозначения части гена, содержащей последовательности ДНК, которые обеспечивают связывание РНКполимеразы и инициацию транскрипции. Промоторные последовательности обнаруживаются обычно, но не всегда, в 5'-некодирующих районах генов. Термин "белок" обозначает макромолекулу, содержащую одну или несколько полипептидных цепей. Белок может включать в себя также непептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные заместители могут быть присоединены к белку клеткой, в которой продуцируется данный белок, и будут варьироваться в зависимости от типа клетки. Белки определены здесь в терминах их аминокислотных скелетных структур; заместители, такие как углеводные группы, обычно не указаны, но тем не менее они могут присутствовать. Термин "рецептор" обозначает связанный с клеткой белок, который связываются с биоактивной молекулой (т.е. лигандом) и действует как посредник для этого лиганда на клетку. Мембраносвязанные рецепторы отличаются мультидоменной структурой, содержащей внеклеточный домен связывания лиганда и внутриклеточный домен, который обычно участвует в трансдукции сигнала. Связывание лиганда с рецептором приводит к конформационному изменению в рецепторе, что вызывает взаимодействие между эффекторным доменом (доменами) этого рецептора и другой молекулой (молекулами) в клетке. Это взаимодействие, в свою очередь, приводит к изменению в метаболизме клетки. Метаболические события, связанные с взаимодействиями рецептор-лиганд, включают в себя транскрипцию генов, фосфорилирование, дефосфорилирование, пролиферацию клеток, увеличение в продуцировании циклического АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, клеточную адгезию, гидролиз инозитлипидов и гидролиз фосфолипидов. Обычно, рецепторы могут быть мембраносвязанными,цитозольными или ядерными, мономерными (например, рецептор DGF, рецептор тиреоидстимулирующего гормона, рецептор IL-3, рецептор GM-CSF, рецептор G-CSF, рецептор эритропоэтина и рецепторIL-6). Термин секреторная сигнальная последовательность обозначает последовательность ДНК, которая кодирует полипептид (секреторный пептид), который, как компонент большего полипептида, направляет этот больший полипептид через секреторный путь клетки, в которой он синтезируется. Этот больший полипептид обычно расщепляется с удалением секреторного пептида во время прохождения через этот секреторный путь. Термин "сплайсинговый вариант" используется здесь для обозначения альтернативных форм РНК,транскрибированных из гена. Сплайсинговая вариация возникает природно посредством использования альтернативных сайтов сплайсинга в транскрибируемой молекуле РНК, или менее обычно между раздельно транскрибируемыми молекулами РНК, и может приводить к нескольким мРНК, транскрибируемым из одного и того же гена. Сплайсинговые варианты могут кодировать полипептиды, имеющие измененную аминокислотную последовательность. Термин сплайсинговый вариант используют здесь также для обозначения белка, кодируемого сплайсинговым вариантом мРНК, транскрибируемым из гена. Должно быть понятно, что молекулярные массы и длины полимеров, определяемые неточными аналитическими методами (например гель-электрофорезом), являются приблизительными величинами. Когда такая величина выражается как "около" X или "приблизительно" X, указанная величина X должна пониматься как величина, определенная с точностью до 10%. Как указывалось выше, IL-20 (формально называемый Zcyto10), является определенным, и способы его получения и антитела к IL-20 описаны в Международной патентной заявкеPCT/US98/25228, публикацииWO 99/27103, опубликованной 25 ноября 1998 г. и патентной заявке США 09/313458, поданной 17 мая 1999 г. Полинуклеотид и полипептид IL-20 человека представлены SEQ ID NO: 1-4, а мышиного IL-20 SEQ ID NO: 5-9. Был обнаружен рецептор, который связывается с IL-20, и он является гетеродимером, состоящим из полипептида, названного 'IL-22R', и полипептида, названного 'IL-20RB'. IL-22R, также называемый ZcytoR11, полипептид, нуклеиновая кислота, которая его кодирует, антитела к IL-22R и способы его получения описаны в патенте США 5965704, выданном 12 октября 1999 г. SEQ ID NO: 10-12 являются поли-3 005496 нуклеотидами и полипептидами IL-22R. Внеклеточный домен IL-22R человека состоит либо из SEQ IDNO:12, либо из SEQ ID NO:13. Внеклеточный домен IL-20RB (SEQ ID NO: 14-15 и вариантные SEQ ID NO:22 и 23) состоит из полипептида, выбранного из группы, состоящей из SEQ ID NO:16-21. Предпочтительно внеклеточный домен полипептида IL-22R и внеклеточный домен IL-20RB ковалентно связаны вместе. В предпочтительном варианте полипептид одной внеклеточной субъединицы имеет константную область тяжелой цепи иммуноглобулина, слитую на его карбоксиконце, а другая внеклеточная субъединица имеет константную область легкой цепи иммуноглобулина (Ig), слитую на ее карбоксиконце, так что эти два полипептида вместе образуют растворимый рецептор и между тяжелой и легкой цепями Ig образуется дисульфидная связь. В другом варианте пептидный линкер может быть слит с двумя карбоксиконцами этих полипептидов с образованием ковалентно связанного растворимого рецептора.SEQ ID NO:24 и 25 являются конструкциями внеклеточного домена IL-22R, слитого с константной областью мутированного иммуноглобулина гамма 1 человека. SEQ ID NO:26 является предсказанной зрелой последовательностью без сигнальной последовательности. SEQ ID NO:27 и 28 являются конструкциями внеклеточного домена IL-20RB, слитого с константной областью легкой цепи каппа иммуноглобулина дикого типа человека. SEQ ID NO:29 является предсказанной зрелой последовательностью без сигнальной последовательности. Фиг. 1 является схематическим представлением этого гетеротетрамера.SEQ ID NO:30 и 31 являются являются конструкциями внеклеточного домена IL-22R, слитого с константной областью мутированного иммуноглобулина гамма 1 человека. SEQ ID NO:32 является предсказанной зрелой последовательностью без сигнальной последовательности. SEQ ID NO:33 и 34 являются конструкциями внеклеточного домена IL-20RB, слитого с константной областью легкой цепи каппа иммуноглобулина дикого типа человека, полученными в соответствии с процедурой примера 12. SEQ IDNO:35 является предсказанной зрелой последовательностью без сигнальной последовательности. Полученный гетеротетрамер не имеет полипептидного линкера между внеклеточными доменами и началом константных областей Ig, 22 на фиг. 1. В дальнейшем, термин "внеклеточный домен рецептора" обозначает внеклеточный домен рецептора или часть этого внеклеточного домена, которая является необходимой для связывания с его лигандом, причем в данном случае этим лигандом является IL-20. Внеклеточные домены IL-22R и IL-20RB можно соединить различными путями, так что полученный растворимый рецептор может связываться с IL-20. Фиг. 1-8 иллюстрируют репрезентативное число вариантов данного изобретения. Одинаковые элементы в каждом из этих чертежей указаны одной и той же цифрой. Фиг. 1 представляет вариант данного изобретения SEQ ID NO:24, 25, 26, 27, 28 и 29. Конструкция растворимого рецептора, обозначенного 10, состоит из двух полипептидных цепей сайта связывания IL-20, обозначенных 12 и 14. Каждый сайт связывания состоит из внеклеточного домена IL-22R,обозначенного 16, и внеклеточного домена IL-20RB, обозначенного 18. Внеклеточный домен 16, IL-22R связан с константным тяжелым доменом 1 (СН 1) 20, константной области тяжелой цепи иммуноглобулина гамма 1 человека через линкер 22, который является SEQ IDNO:36. Затем, домен СН 1, 20, связан с доменом СН 2, 24, через шарнирную область 23. Домен СН 2, 24,связан с доменом СН 3, 26, через шарнирную область 25. При сравнении конструкции фиг. 1 с SEQ ID NO:25 видно, что зрелый внеклеточный домен 16, IL22R простирается от аминокислотного остатка 18, пролина, до аминокислотного остатка 228, треонина,SEQ ID NO:25, включительно. Полипептидный линкер 22 простирается от аминокислотного остатка 229,глицина, до аминокислотного остатка 243, серина, SEQ ID NO:25, включительно. Домен СН 1, 22 фиг. 1,простирается от аминокислотного остатка 244, аланина, до аминокислотного остатка 341, валина, SEQ IDNO:25, включительно. Шарнирная область 23 фиг. 1 простирается от аминокислотного остатка 342, глутаминовой кислоты, до аминокислотного остатка 356, пролина, SEQ ID NO:25, включительно. Цепи 12 и 14 являются дисульфид-связанными вместе посредством дисульфидных связей 28 и 30. Эти дисульфидные связи образованы между тяжелыми цепями посредством остатков цистеина в положениях 352 и 356SEQ ID NO:25 каждой из двух тяжелый цепей. Внеклеточный домен 18, IL-20RB связан с константной областью легкой цепи каппа человека (CL),34 фиг. 1, через полипептидный линкер 32, который является полипептидом SEQ ID NO:36. Внеклеточный домен 18, IL-20RB простирается от аминокислотного остатка 30, валина, до аминокислотного остатка 230, аланина SEQ ID NO:28, включительно. Полипептидный линкер 32 простирается от аминокислотного остатка 231, глицина, до аминокислотного остатка 245, серина, SEQ ID NO:28, включительно. Легкая константная область каппа 34 простирается от аминокислотного остатка 246, аргинина, до конечного аминокислотного остатка 352, цистеина, SEQ ID NO:28, включительно. Цистеин в положении 352 SEQID NO:28 образует дисульфидную связь 36 на фиг. 1 с цистеином в положении 346 SEQ ID NO:25. Таким образом, константная легкая цепь 34 связана с шарнирной областью 23 дисульфидной связью 36. Таким образом внеклеточный домен 16, IL-22R связан с внеклеточным доменом 18, IL-20RB с образованием растворимого рецептора. Если бы остатки цистеина в положениях 352 и 356 SEQ ID NO:25 были заменены на другие аминокислотные остатки, эти два связывающих полипептида IL-20, 12 и 14, не были бы связаны вместе ди-4 005496 сульфидными связями и образовали бы конструкцию, показанную на фиг. 2, имеющую шарнирную область 27. Фиг. 3 показывает очень простой растворимый рецептор 38 данного изобретения, где внеклеточный домен 16, IL-22R связан с внеклеточным доменом 18, IL-20RB посредством полипептидного линкера 40. Этот полипептидный линкер простирается от аминоконца внеклеточного 16, IL-22R и связан с карбоксил-концом внеклеточного домена 18, IL-20RB. Этот полипептидный линкер должен иметь длину между 100 и 240 аминокислотами, предпочтительно приблизительно 170 аминокислотных остатков. Подходящий линкер мог бы состоять из остатков глицина и серина. Возможным линкером могли бы быть множественные звенья SEQ ID NO:36, предпочтительно приблизительно 12. Фиг. 4 показывает вариант, который имеет внеклеточный домен 16, IL-22R, связанный с внеклеточным доменом 18, IL-20RB посредством линкера 40, как показано на фиг. 3, в то время как этот внеклеточный домен 16, IL-22R связан с доменом СН 1 20, как и на фиг. 1, посредством полипептидного линкера 42, который должен иметь длину приблизительно 30 аминокислотных остатков. Идеальный линкер состоял бы из глицина и серина, как в SEQ ID NO:72, и шарнирной последовательности 23 фиг. 1. Фиг. 5 показывает другой возможный вариант данного изобретения В этом варианте полипептидный линкер 44 из приблизительно 15 аминокислотных остатков например, SEQ ID NO:36, связывает карбоксил-конец внеклеточного домена 18, IL-20RB с аминоконцом внеклеточного домена 16, IL-22R. Полипептидный линкер 46 из приблизительно 30 аминокислотных остатков простирается от карбоксиконца внеклеточного домена 16, IL-22R до домена СН 2. Карбоксилконец линкера 46 предпочтительно мог бы состоять из шарнирной части, простирающейся от аминокислотного остатка 342, глутаминовой кислоты, до аминокислотного остатка 356, пролина, SEQ ID NO:25, включительно. Тем не менее полипептидный линкер 46 в идеале мог бы иметь по меньшей мере один остаток цистеина на его карбоксилконце, так что могла бы образоваться дисульфидная связь. Растворимый рецептор IL-20 фиг. 6 является идентичным рецептору фиг. 1, за исключением того,что домен СН 3, 26 фиг. 1 не присутствует на варианте изобретения фиг. 6. Район СН 3 начинается при аминокислотном остатке 467, глицине, и простирается до последнего остатка 573 SEQ ID NO:25. Фиг. 7 показывает конструкцию растворимого рецептора IL-20, которая идентична конструкции фиг. 1, за исключением того, что отсутствуют как домен СН 2, так и домен СН 3. Домены СН 2 и СН 3 простираются от аминокислотного остатка 357, аланина, до конца полипептидной последовательности SEQID NO:25. Фиг. 8 показывает конструкцию, где как IL-22R, 16, так и IL-20RB имеют полипептидный линкер,48, слитый с их соответствующими карбоксил-концами. Каждый полипептидный линкер имеет два остатка цистеина, так что при их экспрессии эти цистеины образуют две дисульфидные связи, 50 и 52. В этом случае полипептидный линкер состоит из шарнирной области 23 на фиг. 1. Эта шарнирная область простирается от аминокислотного остатка 342, глутаминовой кислоты, до аминокислотного остатка 356SEQ ID NO:25, включительно. В другом аспекте данного изобретения заявлен способ для получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (а) введение в клеткухозяина первой последовательности ДНК, состоящей из транскрипционного промотора, функционально связанного с первой секреторной сигнальной последовательностью, за которой следуют по ходу транскрипции (справа) и в правильной рамке считывания ДНК, которая кодирует внеклеточную часть IL-22R,и ДНК, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клеткухозяина второй конструкции ДНК, состоящей из транскрипционного промотора, функционально связанного со второй секреторной сигнальной последовательностью, за которой следуют по ходу транскрипции(справа) и в правильной рамке считывания ДНК, которая кодирует внеклеточную часть IL-20RB, и ДНК,которая кодирует константную область тяжелой цепи иммуноглобулина, выбранную из группы, состоящей из Сн 1, Сн 2, Сн 3 и Сн 4; (с) выращивание этой клетки-хозяина в подходящей среде для выращивания при физиологических условиях, чтобы сделать возможной секрецию слитого белка, состоящего из внеклеточного домена IL-22R и IL-20RB; и (d) выделение этого полипептида из клетки-хозяина. В одном варианте вторая последовательность ДНК дополнительно кодирует шарнирную область тяжелой цепи иммуноглобулина, где эта шарнирная область соединена с доменом константной области тяжелой цепи. В другом варианте вторая последовательность ДНК дополнительно кодирует вариабельную область иммуноглобулина, соединенную против хода транскрипции (слева) и в правильной рамке считывания с константной областью тяжелой цепи иммуноглобулина. В альтернативном варианте заявлен способ для получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (а) введение в клетку-хозяина первой последовательности ДНК, состоящей из транскрипционного промотора, функционально связанного с первой секреторной сигнальной последовательностью, за которой следуют по ходу транскрипции (справа) и в правильной рамке считывания ДНК, которая кодирует внеклеточную часть IL-20RB, и ДНК, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клетку-хозяина второй конструкции ДНК, состоящей из транскрипционного промотора, функционально связанного со второй секреторной сигнальной последовательностью, за которой следуют по ходу транскрипции (справа) и-5 005496 в правильной рамке считывания ДНК, которая кодирует внеклеточную часть IL-22R, и ДНК, которая кодирует константную область тяжелой цепи иммуноглобулина, выбранную из группы, состоящей из Сн 1, Сн 2, Сн 3 и Сн 4; (с) выращивание этой клетки-хозяина в подходящей среде для выращивания при физиологических условиях, чтобы сделать возможной секрецию слитого белка, состоящего из внеклеточного домена IL-22R и IL-20RB; и (d) выделение этого полипептида из клетки-хозяина. В одном варианте вторая последовательность ДНК дополнительно кодирует шарнирную область тяжелой цепи иммуноглобулина, где эта шарнирная область соединена с доменом константной области тяжелой цепи. В другом варианте вторая последовательность ДНК дополнительно кодирует вариабельную область иммуноглобулина, соединенную против хода транскрипции (слева) и в правильной рамке считывания с константной областью тяжелой цепи иммуноглобулина. В другом варианте заявлен способ для получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL-20RB, предусматривающий (а) введение в клетку-хозяина конструкции ДНК, содержащей конструкцию ДНК, которая кодирует внеклеточную часть IL-20RB, и конструкцию ДНК внеклеточной части IL-22R; (b) выращивание клетки-хозяина в подходящей среде для выращивания при физиологических условиях, чтобы сделать возможной продуцирование внеклеточного домена IL22R и внеклеточного домена IL-20RB; и (d) выделение этих полипептидов из клетки-хозяина. Другие аспекты данного изобретения включают в себя клетки-хозяева, трансформированные или трансфицированные конструкцией ДНК, которая кодирует внеклеточный домен IL-22R, и конструкции ДНК, которая кодирует внеклеточный домен IL-20RB. Обе конструкции могут быть на одном векторе или на отдельных векторах. Полинуклеотид, обычно последовательность кДНК, кодирует описанные здесь полипептиды. Последовательность кДНК, которая кодирует полипептид данного изобретения, состоит из ряда кодонов,причем каждый аминокислотный остаток кодируется кодоном, и каждый кодон состоит из трех нуклеотидов. Аминокислотные остатки кодируются их соответствующими кодонами следующим образом. Аланин (Ala) кодируется GCA, GCC, GCG или GCT. Цистеин (Cys) кодируется TGC или TGT. Аспарагиновая кислота кодируется GAC или GAT. Глутаминовая кислота (Glu) кодируется GAA или GAG. Фенилаланин (Phe) кодируется ТТС или ТТТ. Глицин (Gly) кодируется GGA, GGC, GGG или GGT. Гистидин (His) кодируется САС или CAT. Изолейцин (Ilе) кодируется АТА, АТС или АТТ. Лизин (Lys) кодируется ААА или AAG. Лейцин (Leu) кодируется ТТА, TTG, СТА, СТС, CTG или СТТ. Метионин (Met) кодируется ATG. Аспарагин (Asp) кодируется ААС или ААТ. Пролин (Pro) кодируется CCA, CCC, CCG или ССТ. Глутамин (Gln) кодируется САА или CAG. Аргинин (Аrg) кодируется AGA, AGG, CGA, CGC, CGG или CGT. Серии (Ser) кодируется AGC, AGT, ТСА, ТСС, TCG или ТСТ. Треонин (Thr) кодируется АСА, АСС, ACG или ACT. Валин (Val) кодируется GTA, GTC, GTG или GTT. Триптофан (Тrр) кодируется TGG. Тирозин (Туr) кодируется ТАС или ТАТ. Должно быть понятно, что в соответствии с данным изобретением, когда заявляется полинуклеотид, как описано здесь, следует иметь в виду, что заявляется как смысловая цепь, так и антисмысловая цепь, причем эта ДНК в виде двухцепочечной ДНК имеет как смысловую, так и антисмысловую цепи,отожженные (гибридизованные) вместе посредством их соответствующих водородных связей. Также заявляется мессенджер-РНК (мРНК), которая кодируется описанной здесь ДНК. Мессенджер-РНК(мРНК) будет кодировать полипептид с использованием кодонов, определенных здесь, за исключением того, что каждый нуклеотид тимин (Т) заменен нуклеотидом урацилом (U). Специалисту с обычной квалификацией в данной области будет также понятно, что различные виды могут проявлять "предпочтительное (преферентивное) использование кодонов". В общем, см., Grantham,et al., Nuc.Acids Res. 8 1893-1912, 1980; Haas, et al., Curr. Biol. 6: 315-324, 1996; Wain-Hobson, et al., Gene 13: 355-364, 1981; Grosjean and Fiers, Gene 18: 199-209, 1982; Holm, Nuc. Acids Res. 14: 3075-3087, 1986;Ikemura, J. Mol. Biol. 158: 573-597, 1982. В применении здесь, термин "предпочтительное (преферентивное) использование кодонов" или "предпочтительные (преферентивные) кодоны" является термином данной области, относящимся к кодонам трансляции белка, которые наиболее часто используются в клетках определенных видов, с проявлением, следовательно, предпочтения одному или немногим представителям возможных кодонов, кодирующих каждую аминокислоту. Например, аминокислота треонин(Thr) может кодироваться АСА, АСС, ACG или ACT, но в клетках млекопитающих наиболее обычно используемым кодоном является АСС, в других видах, например, в клетках насекомых, дрожжей, виру-6 005496 сов или бактерий, могут быть предпочтительными другие кодоны Thr. Предпочтительные кодоны для конкретных видов могут быть введены в полинуклеотиды данного изобретения различными способами,известными в этой области. Введение предпочтительных последовательностей кодонов в рекомбинантную ДНК может, например, усиливать продуцирование этого белка, делая трансляцию белка более эффективной в конкретном типе клеток или виде. Последовательности, содержащие предпочтительные кодоны, могут быть тестированы и оптимизированы для экспрессии в различных видах и тестированы на функциональность, как описано здесь. Способы синтеза аминокислот и аминоацилирования тРНК известны в данной области. Транскрипцию и трансляцию плазмид, содержащих нонсенс-мутации, проводят в бесклеточной системе, содержащей экстракт Е. coli S30 и коммерчески доступные ферменты и другие реагенты. Белки очищают хроматографией. См., например, Robertson et al., J. Am. Chem. Soc. 113: 2722, 1991; Ellman et al., Methods Enzymol. 202:301, 1991; Chung et al., Science 259:806-809, 1993 и Chung et al., Proc. Natl. Acad. Sci. USA 90 10145-1019, 1993). Bo втором способе трансляцию проводят в ооцитах Xenopus микроинъекцией мутированной мРНК и химически аминоацилированных супрессорных тРНК (Turcatti et al., J. Biol. Chem. 271: 19991-19998, 1996). В третьем способе клетки Е. coli культивируют в отсутствии природной аминокислоты, которую предстоит заменить (например, фенилаланина), и в присутствии желательной природно не встречающейся аминокислоты (аминокислот) (например, 2-азафенилаланина, 3-азафенилаланина, 4 азафенилаланина или 4-фторфенилаланина). Природно не встречающаяся аминокислота включается в этот белок вместо ее природной копии. См. Koide et al., Biochem. 33:7470-7476, 1994. Природно встречающиеся аминокислотные остатки могут быть превращены в природно не встречающиеся разновидности химической модификацией in vitro. Химическая модификация может комбинироваться с сайтнаправленным мутагенезом для дополнительного расширения диапазона замен (Wynn and Richards, Protein Sci. 2:395-403, 1993). Аминокислотные остатки могут быть заменены ограниченным числом неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, не встречающихся природно аминокислот и неприродных аминокислот. Незаменимые аминокислоты в полипептидах данного изобретения могут быть идентифицированы в соответствии с процедурами, известными в данной области, такими как сайт-направленный мутагенез или аланинсканирующий мутагенез (Cunningham and Wells, Science 244 1081-1085 (1989), Baas et al.,Proc. Natl. Acad. Sci. USA 88:4498-502 (1991). В последнем способе отдельные мутации аланина вводят при каждом остатке в молекуле и полученные в результате мутантные молекулы тестируют на биологическую активность, как описано ниже, для идентификации аминокислотных остатков, которые являются критическими для активности данной молекулы. См. также Hilton et al., J. Biol. Chem. 271:4699-708, 1996. Сайты взаимодействия лиганд-рецептор могут быть также определены физическим анализом структуры,определяемой такими способами, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение, в сочетании с мутацией аминокислот предполагаемого сайта контакта. См., например, de Vos et al., Science 255:306-312, 1992, Smith et al., J. Mol. Biol. 224:899-904, 1992,Wlodaver et al., FEBS Lett. 309:59-64, 1992. Многочисленные аминокислотные замены могут быть произведены и тестированы с использованием известных способов мутагенеза и скрининга, таких как описанные Reidhaar-Olson and Sauer Science 241:53-57 (1988) или Bowie and Sauer Proc. Natl. Acad. Sci. USA 86:2152-2156 (1989). Вкратце, эти авторы описывают способы одновременной рандомизации двух или более положений в полипептиде, отбора на функциональный полипептид и затем секвенирования мутагенизированных полипептидов для определения спектра допустимых замен в каждом положении. Другие способы, которые могут быть использованы, включают в себя способ фагового представления (например, Lowman et al., Biochem. 30:10832-10837,1991; Ladner et al., U.S. Patent No. 5 223 409; Huse, WIPO Publication WO 92/06204) и район-направленный мутагенез, Derbyshire et al., Gene 46:145 (1986); Ner et al., DNA 7:127 (1988). Варианты описанных последовательностей ДНК и полипептидных последовательностей IL-20, IL22R и IL-20RB могут быть образованы перетасовкой ДНК, описанной Stemmer, Nature 370: 389-391,1994, Stemmer, Proc. Natl. Acad. Sci. USA 91:10747-10751, 1994 и WIPO Publication WO 97/20078. Вкратце, вариантные ДНК генерируют посредством гомологичной рекомбинации in vitro случайной (неспецифической) фрагментацией исходной ДНК с последующей повторной сборкой при помощи ПЦР, приводящей к случайновведенным точковым мутациям. Этот способ может быть модифицирован с использованием семейства исходных ДНК, таких как аллельные варианты или ДНК из различных видов, для введения дополнительной вариабельности в этот процесс. Отбор или скрининг на желательную активность с последующими дополнительными повторениями мутагенеза и анализа обеспечивает быструю "эволюцию" последовательностей посредством отбора на желательные мутации с одновременным отбором против вредных изменений. Способы мутагенеза, описанные выше, могут комбинироваться с высокопроизводительными автоматизированными способами скрининга для обнаружения активности клонированных мутагенизированных полипептидов в клетках-хозяевах. Мутагенизированные молекулы ДНК, кодирующие активные полипептиды, могут быть извлечены из клеток-хозяев и быстро секвенированы с использованием совре-7 005496 менного оборудования. Эти способы делают возможным быстрое определение важности индивидуальных аминокислотных остатков в представляющем интерес полипептиде и могут применяться к полипептидам неизвестной структуры. Получение белков Полипептиды могут продуцироваться в генетически сконструированных клетках-хозяевах в соответствии с общепринятыми способами. Подходящими клетками-хозяевами являются те типы клеток,которые могут быть трансформированы или трансфицированы экзогенной ДНК и выращены в культуре,и они включают в себя бактерии, грибковые клетки и культивируемые высшие эукариотические клетки. Эукариотические клетки, в частности, культивируемые клетки многоклеточных организмов, являются предпочтительными. Способы манипулирования клонированными молекулами ДНК и введения экзогенной ДНК в различные клетки-хозяева описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual,Second edition, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989) и Ausubel et al., eds.,Current Protocols in Molecular Biology (John Wiley and Sons, Inc., NY, 1987). Обычно последовательность ДНК, кодирующую полипептид, функционально связывают с другими генетическими элементами, требующимися для ее экспрессии, обычно включающими в себя промотор и терминатор транскрипции, в экспрессирующем векторе. Этот вектор обычно будет также содержать один или несколько селектируемых маркеров и одну или несколько точек инициации репликации, хотя специалистам в данной области будет понятно, что в некоторых системах селектируемые маркеры могут быть обеспечены на отдельных векторах, и репликация экзогенной ДНК может быть обеспечена интеграцией в геном клетки-хозяина. Выбор промоторов, терминаторов, селектируемых маркеров, векторов и других элементов является предметом рутинного конструирования в пределах обычной квалификации в данной области. Многие такие элементы описаны в литературе и являются доступными через коммерческих поставщиков. Для направления полипептида в секреторный путь клетки-хозяина, в экспрессирующем векторе обеспечивают секреторную сигнальную последовательность (также известную как лидерная последовательность, пре-пропоследовательность или пре-последовательность). Секреторная сигнальная последовательность может быть сигнальной последовательностью природных полипептидов или может быть произведена из другого секретируемого белка (например, t-PA (тканевого активатора плазминогена или синтезирована de novo. Секреторная сигнальная последовательность функционально соединена с последовательностью ДНК, т.е. эти две последовательности соединены в правильной рамке считывания и помещены для направления новосинтезированного полипептида в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности обычно расположены 5 (слева) от последовательности ДНК,кодирующей представляющий интерес полипептид, хотя некоторые сигнальные последовательности могут быть расположены в другом месте в представляющей интерес последовательности ДНК (см., например, Welch et al., U.S. Patent5 037 743; Holland et al., U.S. Patent5 143 830). Альтернативно, секреторную сигнальную последовательность, содержащуюся в полипептидах данного изобретения, используют для направления других полипептидов в секреторный путь. Данное изобретение обеспечивает такие слитые полипептиды. Секреторная сигнальная последовательность, содержащаяся в слитых полипептидах данного изобретения, предпочтительно слита на аминоконце с дополнительным пептидом для направления дополнительного пептида в секреторный путь. Такие конструкции имеют многочисленные применения, известные в данной области. Например, эти новые слитые конструкции секреторной сигнальной последовательности могут направлять секрецию активного компонента обычно несекретируемого белка, такого как рецептор. Такие слияния могут быть использованы in vivo или in vitro для направления пептидов через секреторный путь. Культивируемые клетки млекопитающих являются подходящими хозяевами в данном изобретении. Способы введения экзогенной ДНК в клетки-хозяева млекопитающих включают в себя опосредованную фосфатом кальция трансфекцию, Wigler et al., Cell 14:725 (1978), Corsaro and Pearson, Somatic Cell Genetics 7:603 (1981), Graham and Van der Eb, Virology 52:456 (1973), электропорацию (Neumann et al., EMBOMed. 2:714 (1996) Получение рекомбинантных полипептидов в культивируемых клетках млекопитающих описано, например, Levinson et al., U.S. Patent4 713 339; Hagen et al., US Patent4 784 950; Palmiter etal., US Patent 4 579 821 и Ringold, U.S. Patent4 656 134. Подходящие культивируемые клетки млекопитающих включают в себя клеточные линии COS-1 (ATCC No CRL 1650), COS-7 (ATCC No CRL 1651),ВНК (ATCC No CRL 1632), ВНК 570 (ATCC No CRL 10314), 293 (ATCC No CRL 1573; Graham et al., J.Gen. Virol. 36:59 (1977) линии клеток яичника китайского хомячка (например, СНО-К 1, ATCC No CCL 61). Дополнительные подходящие клеточные линии известны в данной области и доступны из публичных депозитариев, таких как American Type Culture Collection, Rockville, Maryland. В общем, предпочтительны сильные промоторы транскрипции, такие как промоторы из SV-40 или цитомегаловируса. См.,например, U.S. Patent No. 4 956 288. Другие подходящие промоторы включают в себя промоторы из ге-8 005496 нов металлотионеина (U.S. Patent4 579 821 и U.S. Patent4 601 978) и основной поздний промотор аденовируса. Отбор с лекарственным средством обычно применяют для отбора на культивируемые клетки млекопитающих, в которые была встроена чужеродная ДНК. Такие клетки обычно называют "трансфектантами". Клетки, которые культивировались в присутствии селективного агента и способны передавать представляющий интерес ген их потомству, называют "стабильными трансфектантами". Предпочтительным селектируемым маркером является ген, кодирующий устойчивость к антибиотику неомицину. Отбор проводят в присутствии лекарственного средства типа неомицина, такого как G-418 или т.п. Системы отбора могут быть также использованы для увеличения уровня экспрессии представляющего интерес гена, способа, называемого "амплификацией". Амплификацию проводят культивированием трансфектантов в присутствии низкого уровня селективного агента и затем увеличением количества селективного агента для отбора клеток, которые продуцируют высокие уровни продуктов введенных генов. Предпочтительным амплифицируемым селектируемым маркером является дигидрофолатредуктаза, которая сообщает клеткам устойчивость к метотрексату. Другие гены устойчивости к лекарственным средствам(например, устойчивости к гигромицину, множественной устойчивости к лекарственным средствам, пуромицинацетилтрансферазе) также могут быть использованы. Альтернативные маркеры, которые вводят измененный фенотип, такие как зеленый флуоресцентный белок или белки клеточной поверхности, такие как CD4, CD8, МНС класса I, щелочная фосфатаза плаценты, могут быть использованы для сортинга трансфицированных клеток от нетрансфицированных клеток такими способами, как FACS-сортинг (сортинг клеток с возбуждением флуоресценции) или способ разделения при помощи магнитных гранул. Другие высшие эукариотические клетки могут быть также использованы в качестве хозяев, в том числе клетки растений, клетки насекомых и клетки птиц. Применение Agrobacterium rhizogenes в качестве вектора для экспрессии генов в клетках растений рассмотрено Sinkar et al., J. Biosci (Bangalore) 11:47(1987). Трансформация клеток насекомых и получение в них чужеродных полипептидов описаны вGuanno et al., U.S. Patent5 162 222 и WIPO publication WO 94/06463. Клетки насекомых могут быть инфицированы рекомбинантным бакуловирусом, обычно произведенным из вируса ядерного полиэдрозаAutographa californica (AcNPV) ДНК, кодирующую представляющий интерес полипептид, встраивают в геном бакуловируса вместо кодирующей последовательности гена полиэдрина (AcNPV) одним из двух способов. Первый способ является традиционным способом гомологичной рекомбинации ДНК междуAcNPV дикого типа и вектором-переносчиком, содержащим ген, фланкированный последовательностями AcNPV. Подходящие клетки насекомых, например, клетки SF9, инфицируют AcNPV дикого типа и трансфицируют вектором-переносчиком, содержащим полинуклеотид, функционально связанный с промотором, терминатором и фланкирующими последовательностями гена полиэдрина AcNPV. Cм. King,L.A. and Possee, R.D. The Baculovirus Expression System: A Laboratory Guide, (Chapman and Hall, London); ОReilly D. R. et al., Baculovirus Expression Vectors; A Laboratory Manual (Oxford University Press, NewYork, 1994) и Richardson, C.D., Ed., Baculovirus Expression Protocols. Methods in Molecular Biology, Humana Press, Totowa, NJ 1995. Природная рекомбинация в клетке насекомого будет приводить к рекомбинантному бакуловирусу, который содержит кодирующие последовательности, запускаемые промотором полиэдрина. Рекомбинантные вирусные исходные материалы получают способами, обычно используемыми в данной области. Второй способ получения рекомбинантного бакуловируса использует систему на основе транспозона, описанную Luckow V.А., et al., J. Virol. 67:4566 (1993). Эта система продается в наборе Bac-to-Bac(Life Technologies, Rockville, MD). Эта система использует вектор-переносчик, pFastBac (Life Technologies), содержащий транспозон Тn7, для перемещения ДНК, кодирующей полипептид, в геном бакуловируса, поддерживаемый в Е. coli, в виде большой плазмиды, названной "бакмидой". Векторпереносчик pFastBac использует промотор полиэдрина AcNPV для управления экспрессией представляющего интерес гена. Однако, pFastBac может быть в значительной степени модифицирован. Промотор полиэдрина может быть удален и заменен промотором основного белка бакуловируса (также известного как Рсоr, р 6.9 или промотор МР), который экспрессируется раньше в бакуловирусной инфекции и,как было показано, является предпочтительным для экспрессии секретируемых белков . См. Hill - Perkins, M.S. and Possee, R.D. J. Gen. Virol. 71:971 (1990), Bonning, В.С. et al., J. Gen. Virol. 75:1551 (1994) иChazenbalk G.D. and Rapoport, B., J. Biol. Chem. 270:1543 (1995). В таких векторах-переносчиках могут быть использованы короткая или длинная версия промотора основного белка. Кроме того, могут быть сконструированы векторы-переносчики, которые заменяют природные секреторные сигнальные последовательности секреторными сигнальными последовательностями, полученными из белков насекомых. Например, секреторная сигнальная последовательность из экдистероидглюкозилтрансферазы (EGT), мелиттина медоносной пчелы (Invitrogen, Carlsbad, СА) или бакуловируса gp67 (PharMingen, San Diego, CA) могут быть использованы для замены природной секреторной сигнальной последовательности. Кроме того, векторы-переносчики могут содержать слияние в рамке считывания с ДНК, кодирующей метку эпитопа, на С- или N-конце экспрессируемого полипептида, например, метку эпитопа Glu-Glu (Grussenmeyer Т. et al., Proc. Natl. Acad. Sci. 82:7952 (1985). При помощи способа, известного в данной области,вектор-переносчик, содержащий рекомбинантный ген, трансформируют в Е. coli и подвергают скринин-9 005496 гу на бакмиды, которые содержат прерванный ген lacZ, свидетельствующий о рекомбинантном бакуловирусе. Бакмидную ДНК, содержащую рекомбинантный геном бакуловируса, выделяют при помощи известных способов и используют для трансфекции клеток Spodoptera frugiperda, например, клеток Sf9. Затем получают рекомбинантный вирус, экспрессирующий этот полипептид. Исходные материалы рекомбинантного вируса готовят способами, обычно используемыми в данной области. Этот рекомбинантный вирус используют для инфицирования клеток-хозяев, обычно клеточной линии, полученной из осенних "походных (ратных) червей", Spodoptera frugiperda. См., в общих чертах,Glick and Pasternak, Molecular Biotechnology: Principles and Applications of Recombinant DNA (ASM Press,Washington, D.C., 1994). Другой подходящей клеточной линией является клеточная линия High FiveO(Invitrogen), произведенная из Trichoplusia ni (Патент США 5 300 435). Для выращивания и поддержания этих клеток используют коммерчески доступные бессывороточные среды. Подходящими средами являются Sf900 II (Life Technologies) или ESF 921 (Expression Systems) для клеток Sf9; или ExcellO405 (JRH Biosciences, Lenexa, KS) или Express FiveO (Life Technologies) для клеток Т. ni. Клетки выращивают от плотности инокуляции приблизительно 2-5 х 105 клеток до плотности приблизительно 12 х 106 клеток и в это время добавляют исходный материал рекомбинантного вируса при множественности заражения (MOI) 0,1-10, более часто около 3. Рекомбинантные инфицированные вирусом клетки обычно продуцируют рекомбинантный полипептид при 12-72 ч после инфицирования и секретируют его с варьирующейся эффективностью в среду. Культуру обычно собирают спустя 48 ч после инфицирования. Для отделения клеток от среды используют центрифугирование (супернатант). Супернатант, содержащий полипептид, фильтруют через микропористые фильтры, обычно с размером пор 0,45 мкм. Используемые процедуры в общем описаны в доступных лабораторных руководствах (King, L.A. andPossee, R.D., ibid, O'Reilly, D.R. et al , ibid, Richardson, С. D., ibid). Последующая очистка полипептида из супернатанта может быть достигнута с использованием описанных здесь способов. Грибковые клетки, в том числе дрожжевые клетки, могут быть также использованы в данном изобретении. Виды дрожжей, представляющие особый интерес в этом отношении, включают в себя Saccharomyces cerevisiae, Pichia pastons и Pichia methanolica. Способы трансформации клеток S. cerevisiae экзогенной ДНК и получения из них рекомбинантных полипептидов описаны, например Kawasaki, U.S. Patent4 599 311, Kawasaki et al., U.S. Patent4 931 373, Brake, U.S. Patent4 870 008, Welch et al., U.S.Patent5 037 743 и Murray et al., U.S. Patent4 845 075. Трансформированные клетки отбирают по фенотипу, определяемому селектируемым маркером, обычно по устойчивости к лекарственному средству или по способности расти в отсутствии определенного питательного вещества (например, лейцина). Предпочтительной векторной системой для применения в Saccharomyces cerevisiae является векторная система РОТ 1, описанная Kawasaki et al. (U.S. Patent4 931 373), которая позволяет отбирать трансформированные клетки по росту в содержащей глюкозу среде. Подходящие промоторы и терминаторы для применения в дрожжах включают в себя промоторы и терминаторы из генов гликолитических ферментов (см.,например, Kawasaki, U.S. Patent4 599 311, Kingsman et al., U.S. Patent4 615 974 и Bitter, U.S. Patent4 977 092) и генов алкогольдегидрогеназы. См. также патенты США с номерами 4 990 446, 5 063 154, 5 139 936 и 4 661 454. Системы трансформации для других дрожжей, в том числе Hansenuia polymorpha, Schizosaccharomyces pombe, Kluyveromyces lactis, Kluyveromyces fragilis, Ustilago maydis, Pichia pastons, Pichia methanolica,Pichia guillermondii и Candida maltosa, известны в данной области. См., например, Gleeson et al., J. Gen. Microbiol. 132:3459 (1986) и Cregg, U.S. Patent4 882 279. Клетки Aspergillus могут быть использованы в соответствии со способами McKnight et al., U.S. Patent4 935 349. Способы трансформации Acremonium chrysogenum описаны Sumino et al., U.S. Patent5 162 228. Способы трансформации Neurospora описаны Lambowitz, U.S. Patent4 486 533. Применение Pichia methanolica в качестве хозяина для получения рекомбинантных белков описано в WIPO публикациях с номерами WO 97/17450, WO 97/17451, WO 98/02536 и WO 98/02565. Молекулы ДНК для применения в трансформации P. methanolica обычно получают в виде двухцепочечных кольцевых плазмид, которые предпочтительно линеаризуют перед трансформацией. Для получения полипептидов в P. methanolica предпочтительно, чтобы промотор и терминатор в этой плазмиде были промотором и терминатором гена P. methanolica, таким как ген утилизации спирта P. methanolica (AUG1 или AUG2). Другие применимые промоторы включают в себя промоторы генов дигидроксиацетонсинтазы (DHAS),форматдегидрогеназы (FMD) и каталазы (CAT). Для облегчения интеграции этой ДНК в хромосому хозяина предпочтительно иметь весь сегмент экспрессии этой плазмиды, фланкированный на обоих концах последовательностями ДНК хозяина. Предпочтительным селектируемым маркером для применения вPichia methanolica является ген ADE2 P. methanolica, который кодирует фосфорибозил-5 аминоимидазолкарбоксилазу (AIRC; ЕС 4.1.1.21), который позволяет клеткам-хозяевам ade2 расти в отсутствии аденина. Для крупномасштабных, промышленных процессов, где желательно минимизировать применение метанола, предпочтительно использовать клетки-хозяева, в которых делетированы оба гена утилизации метанола (AUG1 и AUG2). Для получения секретируемых белков предпочтительны клеткихозяева, дефектные по генам вакуолярных протеаз (РЕР 4 и PRB1). Электропорацию используют для облегчения введения плазмиды, содержащей ДНК, кодирующую представляющий интерес полипептид, в клетки P. methanolica. Предпочтительно трансформировать клетки P. methanolica электропорацией с ис- 10005496 пользованием экспоненциально затухающего, пульсирующего электрического поля, имеющего напряженность поля от 2,5 до 4,5 кВ/см, предпочтительно 3,75 кВ/см, и константу времениот 1 до 40 мс,наиболее предпочтительно приблизительно 20 мс. Прокариотические клетки-хозяева, в том числе штаммы бактерий Escherichia coli, Bacillus и другие роды, также являются применимыми клетками-хозяевами в данном изобретении. Способы трансформации этих хозяев и экспрессии клонированных в них чужеродных ДНК хорошо известны в данной области (см, например, Sambrook et al., ibid.). При экспрессии полипептида в бактериях, таких как Е. coli, этот полипептид может сохраняться в цитоплазме, обычно в виде нерастворимых гранул, или может быть направлен в периплазматическое пространство бактериальной секреторной последовательностью. В первом случае эти клетки лизируют и гранулы извлекают и денатурируют при помощи, например, гуанидинизотиоцианата или мочевины. Затем денатурированный полипептид может быть повторно уложен и димеризован разведением продукта денатурации, например, диализом против раствора мочевины и комбинации восстановленного и окисленного глутатиона, с последующим диализом против забуференного солевого раствора. В последнем случае этот полипептид может быть извлечен из периплазматического пространства в растворимой и функциональной форме разрушением этих клеток (например, обработкой ультразвуком или осмотическим шоком) для высвобождения содержимого периплазматического пространства и извлечения этого белка, посредством чего устраняется необходимость денатурации и повторной укладки. Трансформированные или трансфицированные клетки-хозяева культивируют в соответствии с общепринятыми процедурами в культуральной среде, содержащей питательные вещества и другие компоненты, необходимые для роста выбранных клеток-хозяев. Различные подходящие среды, в том числе среды с определенным составом среды и комплексные среды, известны в данной области и обычно включают в себя источник углерода, источник азота, незаменимые аминокислоты, витамины и минеральные соединения. Среды могут также содержать такие компоненты, как факторы роста или сыворотка, если требуется. Среда для выращивания будет обычно производить отбор на клетки, содержащие экзогенно добавленную ДНК, например, посредством отбора с использованием лекарственного средства или недостаточности незаменимого питательного компонента, который дополняется селектируемым маркером, имеющимся на экспрессирующем векторе или котрансфицируемым в клетку-хозяина. КлеткиP. methanolica культивируют в среде, содержащей адекватные источники углерода, азота и микроэлементов, при температуре приблизительно 25-35 С. Жидкие культуры обеспечивают достаточной аэрацией с использованием общепринятых средств, таких как встряхивание небольших колб или барботирование ферментеров. Предпочтительной культуральной средой для P. methanolica является YEPD (2% Dглюкоза, 2% Бакто Пептон (Difco Laboratories, Detroit, MI), 1% Бакто дрожжевой экстракт (DifcoLaboratories), 0,004% аденин и 0,006% L-лейцин). Выделение белков Предпочтительной является очистка полипептидов данного изобретения до 80% чистоты, более предпочтительно до 90% чистоты, еще более предпочтительно до 95% чистоты и особенно предпочтительно до фармацевтической чистоты, которая является 99,9% чистотой, в отношении загрязняющих макромолекул, в частности, других белков и нуклеиновых кислот и инфекционных и пирогенных агентов. Предпочтительно, очищенный полипептид является по существу не содержащим других полипептидов, в частности, других полипептидов животного происхождения. Экспрессируемые рекомбинантные полипептиды (или химерные полипептиды) могут быть очищены с использованием фракционирования и/или общепринятых способов и сред очистки. Для фракционирования проб могут быть использованы осаждение сульфатом аммония и кислотная или хаотропная экстракция. Примеры стадий очистки могут включать в себя гидроксиапатитную, гель-фильтрационную,жидкостную экспресс-хроматографию белков (FPLC) и высокоэффективную жидкостную хроматографию с обращенной фазой. Подходящие анионообменные среды включают в себя производные декстрана,агарозу, целлюлозу, полиакриламид, специальные диоксиды кремния и т.п. Предпочтительными являются производные PEI, DEAE, QAE и Q. Примеры хроматографических сред включают в себя среды, дериватизованные фенильной, бутильной или октильной группами, такие как Phenyl-Sepharose FF(Pharmacia), Toyopearl butyl 650 (Toso Haas, Montgomeryville, PA), Octyl-Sepharose (Pharmacia) и т.п.; или полиакриловые смолы, такие как Amberchrom CG 71 (Toso Haas) и т.п. Подходящие твердые носители включают в себя стеклянные гранулы, смолы на основе диоксида кремния, целлюлозные смолы, агарозные гранулы, сшитые агарозные гранулы, полистироловые гранулы, сшитые полиакриламидные смолы и т.п., которые являются нерастворимыми в условиях, в которых они должны использоваться. Эти носители могут быть модифицированы реакционноспособными группами, позволяющими присоединение белков посредством аминогрупп, карбоксильных групп, сульфгидрильных групп, гидроксильных групп и/или углеводных частей молекул. Примеры химических способов связывания включают в себя активацию цианогенбромидом, активацию N-гидроксисукцинимидом, активацию эпоксидом, активацию сульфгидрильными группами, активацию гидразидом и карбоксил- и аминопроизводные для химических способов сочетания с использованием карбодиимида. Эти и другие твердые среды являются хорошо из- 11005496 вестными и широко используемыми в данной области и доступны из коммерческих источников. Способы связывания рецепторных полипептидов со средами-носителями хорошо известны в данной области. Выбор конкретного способа является рутинным и определяется отчасти свойствами выбранного носителя. См., например, Affinity Chromatography: PrinciplesMethods (Pharmacia LKB Biotechnology, Uppsala,Sweden, 1988). Полипептиды могут быть выделены путем использования их свойств. Например, адсорбционная хроматография с иммобилизованным ионом металла (IMAC) может быть использована для очистки богатых гистидином белков, в том числе белков, содержащих полигистидиновые метки. Вкратце, гель сначала загружают ионами двухвалентного металла с образованием хелата, Sulkowski, Trends in Biochem 3:1(1985). Богатые гистидином белки будут адсорбироваться на этом матриксе с различными аффинностями в зависимости от используемого иона металла и будут элюироваться конкурентной элюцией, понижением рН или применением сильных хелатообразователей. Другие способы очистки включают в себя очистку гликозилированных белков аффинной хроматографией с иммобилизованным лектином и ионообменной хроматографией. Белок, слитый с Fc-частью иммуноглобулина, может быть очищен с использованием Протеин А-колонки, Methods in Enzymol., Vol. 182, "Guide to Protein Purification", M. Deutscher, (ed.),pages 529-539 (Acad. Press, San Diego, 1990). В дополнительных вариантах данного изобретения может быть сконструировано слияние представляющего интерес полипептида и аффинной метки (например,мальтозусвязывающего белка, домена иммуноглобулина) для облегчения очистки. В применении здесь, термин антитела включает в себя поликлональные антитела, аффинноочищенные поликлональные антитела, моноклональные антитела и антигенсвязывающие фрагменты,такие как протеолитические F(ab')2- и Fab-фрагменты. Также включены генетически сконструированные природные антитела или фрагменты, такие как химерные антитела, Fv-фрагменты, одноцепочечные антитела и т.д., а также синтетические антигенсвязывающие пептиды и полипептиды. Антитела не из человека могут быть "гуманизированы" ("очеловечены") прививкой только CDR не человека на каркасные и константные области иммуноглобулина человека или включением полных вариабельных доменов не человека (необязательно окутыванием их подобной человеческой поверхностью путем замещения экспонированных остатков, результатом чего является "облицованное" антитело). В некоторых случаях "гуманизированные" ("очеловеченные") антитела могут сохранять остатки иммуноглобулина не человека в каркасных доменах вариабельной области человека для усиления характеристик правильного связывания. Посредством "гуманизирования" антител может быть увеличен биологический полупериод существования в организме, и уменьшается потенциал неблагоприятных иммунных реакций при введении людям. Разнообразные анализы, известные специалистам с квалификацией в данной области, могут быть использованы для детектирования антител, которые связываются с белком или пептидом. Примеры анализов описаны подробно в Antibodies: A Laboratory Manual, Harlow and Lane (Eds.) (Cold Spring HarborLaboratory Press, 1988). Репрезентативные примеры таких анализов включают в себя: конкурентный иммуноэлектрофорез, радиоиммуноанализ, радиоиммунопреципитацию, твердофазный иммуноферментный анализ (ELISA), дот-блот или Вестерн-блот-анализ, анализ ингибирования или конкурентный анализ и сэндвич-анализ. Растворимые рецепторы данного изобретения могут быть использованы для понижающей регуляции IL-20, который, как было показано, участвует с ряде воспалительных процессов. Конкретно, было показано, что IL-20 повышающим образом регулирует IL-8. Воспалительными заболеваниями, в которых важную роль играет IL-8 и для которых уменьшение количества IL-8 было бы полезным, являются респираторный дистресс-синдром взрослых (ARD), септический шок, недостаточность множественных органов, воспалительное повреждение легких, такое как астма или бронхит, бактериальная пневмония,псориаз, экзема, атопический и контактный дерматит и воспалительное заболевание пищеварительного тракта, такое как язвенный колит и болезнь Крона. Таким образом, растворимый рецептор IL-20 данного изобретения может вводиться пациентам для лечения этих заболеваний. Биология IL-20, его рецептор и его роль в псориазе Два orphan-рецептора цитокинов класса II, оба из которых экспрессируются на коже, были идентифицированы в качестве субъединиц рецептора IL-20. Обе субъединицы IL-20 являются необходимыми для связывания лиганда, что отличает их роль от роли субъединиц в четырех других известных рецепторах цитокинов класса II. IL-22R и IL-20RB также коэкспрессируются в ряде тканей человека, кроме кожи, в том числе яичнике, надпочечниках, яичке, слюнных железах, мышцах, легких, почках, сердце и в меньшей степени в тонкой кишке, что предполагает дополнительные ткани-мишени для действия IL-20. Авторы изобретения делают вывод, что этот гетеродимерный рецептор IL-20 является структурно сходным с другими рецепторами цитокинов класса II и экспрессируется в коже, где авторы продемонстрировали активность лиганда IL-20. Две линии доказательств указывают на роль IL-20 и его рецептора в псориазе. Это мультигенное кожное заболевание отличается увеличенной пролиферацией кератиноцитов, измененной дифференцировкой кератиноцитов и инфильтрацией иммунных клеток в кожу. Первой линией доказательств ролиIL-20 в псориазе является то, что наблюдаемый гиперкератоз и утолщенный эпидермис в трансгенных- 12005496 мышах сходны с аномалиями псориаза человека. Уменьшенные количества тонофиламентов, которые,как считают, связаны с дефектной кератинизацией, являются поразительным признаком псориаза человека. Интрамитохондриальные включения были обнаружены как в химически индуцированных, так и в природно встречающихся гиперпластических состояниях кожи в мышах. Причина этих включений и их влияние на функцию митохондрий, если они имеются, являются неизвестными. Авторы приходят к выводу, что IL-20-трансгенные мыши проявляют многие характеристики, наблюдаемые в псориазе человека. Применение антагониста к IL-20 для лечения псориаза Как указывалось в приведенном выше обсуждении и указывается в примерах ниже, IL-20 участвует в патологии псориаза. Таким образом, растворимые рецепторы данного изобретения могут вводиться индивидууму для понижающей регуляции IL-20 и, следовательно, лечить псориаз. Псориаз является одним из наиболее обычных дерматологических заболеваний, поражающих 1-2 процента населения всего мира. Он является хроническим воспалительным кожным нарушением, отличающимся эриматозными; резко разграниченными папулами и округленными бляшками, покрытыми серебристой подобной слюде чешуйкой. Травмированные зоны часто развивают повреждения псориаза. Кроме того, другие внешние факторы могут обострять псориаз, в том числе инфекции, стресс и лекарственные средства, например литий, бета-блокаторы и противомалярийные средства. Наиболее обычную разновидность псориаза называют псориазом типа бляшек. Пациенты с псориазом типа бляшек имеют стабильные, медленно растущие бляшки, которые остаются в основном неизменными в течение продолжительных периодов времени. Наиболее обычными встречающимися зонами для псориаза в виде бляшек являются сгибы локтей, ягодичная щель и волосистая часть кожи головы. Поражение склонно к симметричному расположению. Отклоняющийся от обычного расположения псориаз поражает интертригинозные районы, в том числе подмышечные ямки, паховую область, зону под молочными железами и пупок, а также склонен поражать волосистую кожу головы, ладони и подошвы. Отдельные поражения являются резко разграниченными бляшками, но могут быть влажными вследствие их местоположения. Псориаз типа бляшек обычно развивается медленно и проходит безболезненную стадию. Он редко проявляет спонтанные временные ослабления. Эруптивный псориаз (каплевидный псориаз) является наиболее обычным у детей и молодых взрослых людей. Он развивается остро в индивидуумах без псориаза или в индивидуумах с хроническим псориазом типа бляшек. Пациенты обнаруживают множественные небольшие эриматозные, чешуйчатые папулы, часто после инфекции верхних дыхательных путей бета-гемолитическими стрептококками. Пациенты с псориазом могут также развивать пустулезные повреждения. Они могут быть локализованы на ладонях и подошвах или могут быть генерализованными и связанными с лихорадкой, недомоганием,диареей и артралгиями. Приблизительно половина всех пациентов с псориазом имеют поражения ногтей пальцев рук, проявляющихся в виде пятнистых углублений, утолщения ногтей или подногтевого гиперкератоза. Около 510 процентов пациентов с псориазом имеют жалобы, связанные с суставами, и они наиболее часто обнаруживаются в случае пациентов с поражениями ногтей. Хотя некоторые пациенты имеют одновременное наличие классического ревматоидного артрита, многие имеют заболевание суставов, которое попадает в один из пяти типов, ассоциированных с псориазом: (1) заболевание, ограниченное единственным суставом или небольшим числом небольших суставов (70 процентов случаев); (2) серонегативное подобное ревматоидному артриту заболевание; (3) поражение дистальных межфаланговых суставов; (4) тяжелый деструктивный артрит с развитием артритных инвалидов; и (5) заболевание, ограниченное позвоночником. Псориаз может лечиться введением антагонистов к IL-20. Предпочтительными антагонистами являются растворимый рецептор к IL-20 или антитела, фрагменты антител или одноцепочечные антитела,которые связываются либо с рецептором IL-20, либо с IL-20. Антагонисты к IL-20 могут вводиться отдельно или в комбинации с другими установленными средствами терапии, такими как смазывающие вещества, кератолитические агенты, кортикостероиды для местного применения, производные витамина D для местного применения, антралин, системные антиметаболиты, такие как метотрексат, терапия с использованием псоралена-ультрафиолетового света (PUVA), этретинат, изотретиноин, циклоспорин и производное витамина D кальципотриол для местного применения. Эти антагонисты, в частности, растворимый рецептор или антитела, которые связываются с IL-20 или рецептором IL-20, могут вводиться индивидууму подкожно, внутривенно и трансдермально с использованием крема или трансдермального пластыря, который содержит антагонист IL-20. При подкожном введении антагонист может быть введен инъекцией в одну или несколько псориатических бляшек. При трансдермальном введении эти антагонисты могут вводиться непосредственно на бляшки с использованием крема, содержащего антагонист к IL20. Применение антагонистов к IL-20 для лечения воспалительных состояний легкого Растворимый рецептор IL-20 данного изобретения может вводиться лицу, имеющему астму, бронхит или муковисцидоз или другое воспалительное заболевание легких, для лечения этого заболевания.- 13005496 Антагонисты могут вводиться любым подходящим способом, в том числе внутривенным, подкожным,бронхиальным лаважем и с использованием ингалируемого агента, содержащего антагонист к IL-20. Введение растворимого рецептора IL-20 Количество растворимого рецептора IL-20, необходимое для эффективной терапии, будет зависеть от многих различных факторов, в том числе от способа введения, участка-мишени, физиологического состояния пациента и других вводимых лекарственных средств. Таким образом, дозы для лечения должны титроваться для оптимизации безопасности и эффективности. Обычно дозы, используемые in vitro,могут обеспечивать полезное руководство в отношении количеств, применимых для введения in vivo этих реагентов. Испытание на животных эффективных доз для лечения конкретных нарушений обеспечит дополнительное прогностическое указание дозы для человека. Способы введения включают в себя пероральное, внутрибрюшинное, внутримышечное, трансдермальное введение или введение в легкое или трахею в форме спрея с использованием распылителя или пульверизатора. Фармацевтически приемлемые носители включают в себя воду, солевой раствор, буферы, если называть лишь немногие. Диапазоны доз обычно ожидаются от 1 до 1000 мкг на килограмм веса тела в день. Доза рецептора IL-20 для среднего взрослого могла бы быть приблизительно 25 мг, предоставляемая дважды в неделю в виде подкожной инъекции. Инъекции могли бы производиться в участке псориатических повреждений для лечения псориаза. Для подкожного или внутривенного введения антагонист к IL-20, антитело или растворимый рецептор может находиться в забуференном фосфатом солевом растворе. Для кожных заболеваний,таких как псориаз, антагонист к IL-20 может вводиться через мазь или трансдермальный пластырь. Дозы могут быть более высокими или более низкими, как может быть определено врачом с обычной квалификацией в данной области. В отношении полного обсуждения форм лекарственных средств и диапазонов доз см. Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Co., Easton, Penn., 1996) и Goodmanand Gilman's:The Pharmacological Bases of Therapeutics, 9th Ed. (Pergamon Press 1996). Далее данное изобретение иллюстрируется следующими неограничивающими примерами. Пример 1. Повышающая регуляция IL-8 при помощи IL-20 Способы Эпидермальные неонатальные кератиноциты здорового человека (NHEK) (из Clonetics) при 2-ом пассаже высевали и выращивали до конфлюэнтности в 12-луночных планшетах для культуры ткани. Среду для выращивания кератиноцитов (KGM) покупали в Clonetics. При достижении клетками конфлюэнтности их промывали средой KGM минус факторы роста = КВМ (основная питательная среда для кератиноцитов). Клетки голодали в бессывороточной среде КВМ в течение 72 ч перед добавлением тестсоединений. В качестве положительных контролей использовали тромбин при 1 МЕ/мл и трипсин при 25 нМ. Добавляли 1 мл среды на лунку. Только КВМ использовали в качестве отрицательного контроля.IL-20 готовили в среде КВМ и добавляли при варьирующихся концентрациях от 2,5 мкг/мл до 618 нг/мл в первом эксперименте и от 2,5 мкг/мл до 3 нг/мл во втором эксперименте. Клетки инкубировали при 37 С, 5% СО 2 в течение 48 ч. Супернатанты удаляли и замораживали при -80 С в течение нескольких дней до анализа на уровниIL-8 и GM-CSF. Набор для иммуноанализа IL-8 человекаD8050 (RandD Systems, Inc.) и набор для иммуноанализа GM-CSF человекаHSGMO (RandD Systems, Inc.) использовали для определения продукции цитокинов в соответствии с инструкциями изготовителя. Результаты. Результаты показали, что экспрессия IL-8 и GM-CSF индуцировалась IL-20. Пример 2. Клонирование IL-20RB Клонирование кодирующего района IL-20RB. Конструировали два ПЦР-праймера на основе последовательности из Международной патентной заявкиPCT/US99/03735 (публикацияWO 99/46379), поданной 8 марта 1999 г. SEQ ID NO:38 содержит кодон ATG (Met) с сайтом рестрикции EcoRI, SEQ ID NO:37 содержит стоп-кодон (TAG) с сайтом рестрикции Xhol. ПЦР-амплификацию проводили с использованием ДНК библиотеки кДНК кератиноцитов человека (НаСаТ) в качестве матрицы и SEQ ID NO:37 и SEQ ID NO:38 в качестве праймеров. ПЦР-реакцию выполняли следующим образом: инкубирование при 94 С в течение 1 мин с последующими 30 циклами 94 С в течение 30 с и 68 С в течение 2 мин, после дополнительных 68 С в течение 4 мин реакционную смесь хранили при 4 С. Продукты ПЦР подвергали электрофорезу на 1% агарозном геле и наблюдали полосу ДНК 1 т.п.н. Продукты ПЦР вырезали из геля и ДНК очищали с использованием набора для экстракции гелей QIAquick (Qiagen). Очищенную ДНК расщепляли EcoRI и Xhol и клонировали в вектор pZP, который был назван pZP7N. Плазмида pZP является экспрессирующим вектором млекопитающих, содержащим экспрессионную кассету, имеющую промотор мышиного металлотионеина-1, лидерный пептид tPA человека, множественные сайты рестрикции для инсертирования кодирующих последовательностей, метку Glu-Glu и терминатор гормона роста человека. Эта плазмида имеет также сайт инициации репликации Е. coli, экспрессионную единицу селектируемого маркера млекопитающих,имеющую промотор, энхансер и сайт инициации репликации SV40, а также ген DHFR и терминаторSV40. Несколько клонов IL-20RB-pZP7N секвенировали. Все они содержат три неконсервативные мутации в сравнении с последовательностью IL-20RB в PCT/US99/03735: (последовательность IL-20RBpZP7N), 146 Pro (CCC)Thr (ACC), 148 His (CAT)Asp (GAT) и 171 Thr (ACG) Arg (AGG). Для подтверждения этих трех мутаций в клоне IL-20RB-pZP7N ПЦР-амплификацию проводили с использованием трех различных источников кДНК-marathon (марафон)-кДНК, ДНК кДНК-библиотеки НаСаТ и ДНК кДНК-библиотеки гладких мышц предстательной железы - в качестве матриц. Продукты ПЦР очищали из геля и секвенировали. Последовательность каждого из трех продуктов ПЦР согласовалась с последовательностью клона IL-20RB-pZP7N. IL-20RB соответствует SEQ ID NO:22 и 23, а зрелый внеклеточный домен является SEQ ID NO:21. Пример 3. Связывание IL-20 с гетеродимером IL-20RB/IL-22R Для подтверждения, что IL-20 связывается с гетеродимером IL-22R-IL-20RB, использовали анализ связывания на основе клеток. Экспрессирующие векторы, содержащие известные и orphan-рецепторы цитокинов класса II (в том числе IL-22R и IL-20RB) транзиторно (нестабильно) трансфицировали в клетки Baf3. Клетки высевали при 5000 клеток на лунку, обрабатывали их IL-20 (zcyto10), MDA-7 и растворимыми белками. Клетки инкубировали при 37 С в течение 3 дней (72 ч). Добавляли 20 мкл на лунку красителя Alamar Blue, инкубировали при 37 С в течение ночи (24 ч). Считывали на fMax (Molecular Devices) в помещении Robotics при установке возбуждение 544 нм/испускание 590 нм. Результаты: Положительная реакция пролиферации с обработками IL-20 (zcyto10) и MDA-7 от 0,1 нг/мл до 100 нг/мл на клеточной линии Baf3/DIRS1/cytoR11. Пример 4. Положительная регуляция воспалительных цитокинов посредством IL-20 Обработка клеток Клеточную линию кератиноцитов человека, НаСаТ выращивали при 37 С до нескольких дней после конфлюэнтности в колбах Т-75 для культуры ткани. В этот момент нормальную среду для выращивания(DMEM + 10% ФТС) удаляли и заменяли бессывороточной средой. Затем клетки инкубировали в течение двух дней при 37 С. Затем DMEM удаляли и четыре колбы клеток на каждую обработку обрабатывали одним из следующих условий в течение 4 ч при 37 С: рекомбинантный человеческий (rh) IL-1 альфа при 5 нг/мл, rh IL-1 альфа при 20 нг/мл, rh IL-1 альфа при 5 нг/мл + IL-20 при 1 мкг/мл, IL-20 при 1 мкг/мл или rh IL-10 альфа при 10 нг/мл. Выделение РНК После обработки цитокинами среды удаляли и клетки лизировали с использованием раствора тиоцианата гуанидиния. Тотальную РНК выделяли из клеточного лизата откручиванием в течение ночи на градиенте хлорида цезия. На следующий день осадок РНК ресуспендировали в растворе ТЭ/ДСН и осаждали этанолом. Затем РНК определяли количественно с использованием спектрофотометра с последующей обработкой ДНКазой, как описано в Section V.B. of Clontech's Atlas cDNA Expression Arrays UserManual (version PT3140-1/PR9X390, published 11/5/99). Качество проб РНК подтверждали расчетами чистоты на основе считываний спектрофотометра и визуализацией на агарозном геле. Геномное загрязнение этих проб РНК исключали ПЦР-анализом гена бета-актина. Протоколы Clontech для поли А+ обогащения, синтез зондов и гибридизацию выполняли в соответствии с матрицами Atlas (см. выше, плюс Atlas Pure Total RNA Labeling System User Manual, PT32311/PR96157, published 6/22/99). Вкратце, полиА+ РНК выделяли из 50 мг тотальной РНК с использованием покрытых стрептавидином магнитных гранул (Clontech, Palo Alto, СА) и сепаратора магнитных частиц Затем полиА+ РНК метили альфа-32 Р-dАТР через ОТ-ПЦР. Праймеры CDS Clontech, специфические для 268 генов на матрице цитокин человека/рецептор Atlas (Cat7744-1), использовали в этой реакции. Меченый зонд выделяли колоночной хроматографией и считали в сцинтилляционной жидкости. Гибридизация на мембранах с матрицами Матрицы Atlas предгибридизовали с Clontech ExpressHyb плюс 100 мг/мл денатурированной нагреванием ДНК спермы лосося в течение по меньшей мере тридцати минут при 68 С при непрерывном встряхивании. Затем мембраны гибридизовали с 1,9 х 106 имп/мин/мл (всего 1,14 х 107 имп/мин) в течение ночи при 68 С при непрерывном встряхивании. На следующий день мембраны промывали в течение тридцати минут 4 х в 2 х SSC, 1% ДСН при 68 С, плюс в течение тридцати минут 1 х в 0,1 х SSC, 0,5% ДСН при 68 С затем одной конечной промывкой при комнатной температуре в течение пяти минут в 2 хSSC. Затем мембраны с матрицами помещали в пластиковые мешочки Kodak, герметизировали и экспонировали с экраном для прибора, визуализирующего фосфор, в течение ночи при комнатной температуре. На следующие день экраны с изображением фосфора сканировали на приборе для визуализации фосфора и анализировали с использованием программного обеспечения Clontech Atlaslmage 1,0.- 15005496 Результаты Гены, положительно регулируемые IL-20. 1. Фактор некроза опухолей (TNF) положительно регулировался в 1,9-2,4 раза IL-20. 2. Факторы роста плаценты 1 и 2 (PLGF) положительно регулировались в 1,9-2,0 раза IL-20. 3. Рецептор фактора свертывания II положительно регулировался в 2,0-2,5 раза IL-20. 4. Рецептор кальцитонина положительно регулировался в 2,2-2,3 раза IL-20. 5. Индуцируемый TNF гиалуронатсвязывающий белок TSG-6 положительно регулировался в 2,1-2,2 раза IL-20. 6. Предшественник рецептора-1 васкулярного эндотелиального фактора (VEGF), рецептор тирозинпротеинкиназы (FLT-1) (SFLT) положительно регулировался в 2,1-2,7 раза IL-20. 7. MRP-8 (кальцийсвязывающий белок в макрофагах MIF-родственный) положительно регулировался в 2,9-4,1 раза IL-20. 8. MRP-14 (кальцийсвязывающий белок в макрофагах, MIF-родственный) положительно регулировался в 3,0-3,8 раза IL-20. 9. Релаксин Н 2 положительно регулировался в 3,14 раза IL-20. 10. Рецептор III 300 кДа трансформирующего фактора роста бета (TGFB) положительно регулировался в 2,4-3,6 раза IL-20. Гены, обнаруживающие синергизм с обработкой IL-20 + IL-1 1. Костный морфогенетический белок 2 а положительно регулировался в 1,8 раза обработкой однимIL-20, в 2,5 раза обработкой одним IL-1 и в 8,2 раза обработкой обоими IL-20 и IL-1 вместе. 2. MRP-8 положительно регулировался в 2,9 раза обработкой одним IL-20, в 10,7 раза обработкой одним IL-1 и в 18,0 раз обработкой обоими IL-20 и IL-1 вместе. 3. Белок дифференцировки эритроидов (EDF) положительно регулировался в 1,9 раза обработкой одним IL-20, в 9,7 раза обработкой одним IL-1 и в 19,0 раз обработкой обоими IL-20 и IL-1 вместе. 4. MRP-14 (кальцийсвязывающий белок в макрофагах MIF-родственный) положительно регулировался в 3,0 раза обработкой одним IL-20, в 12,2 раза обработкой одним IL-1 и в 20,3 раза обработкой обоими IL-20 и IL-1 вместе. 5. Гепаринсвязывающий EGF-подобный фактор роста положительно регулировался в 2,0 раза обработкой одним IL-20, в 14,0 раз обработкой одним IL-1 и в 25,0 раз обработкой обоими IL-20 и IL-1 вместе. 6. Подобный бета-тромбоглобулину белок положительно регулировался в 1,5 раза обработкой одним IL-20, в 15,0 раз обработкой одним IL-1 и в 27,0 раз обработкой обоими IL-20 и IL-1 вместе. 7. Полученный из мозга нейротрофический фактор (BDNF) положительно регулировался в 1,7 раза обработкой одним IL-20, в 25,0 раз обработкой одним IL-1 и в 48,0 раз обработкой обоими IL-20 и IL-1 вместе 8. Моноцитарный хемотактический и активирующий фактор MCAF положительно регулировался в 1,3 раза обработкой одним IL-20, в 32,0 раза обработкой одним IL-1 и в 56,0 раз обработкой обоими IL20 и IL-1 вместе. Пример 5. Трансгенный фенотип IL-20 Как человеческий, так и мышиный IL-20 сверхэкспрессировали в трансгенных мышах с использованием различных промоторов Первоначально использовали специфический для печени мышиный промотор альбумина, управляющий экспрессией IL-20 человека, в попытке получения уровней белка в кровотоке. Последующие исследования проводили с использованием промотора кератина 14 (К 14), который прежде всего запускает экспрессию в эпидермисе и другом многослойном плоском эпителии; мышиного промотора металлотионеина-1, который дает широкое распределение экспрессии, и промотор ЕLСК,который запускает экспрессию в клетках лимфоидного направления дифференцировки. Во всех четырех случаях получали сходные результаты, возможно, вследствие того, что все эти промоторы приводят к появлению циркулирующих в кровотоке уровней IL-20. Во всех случаях трансгенные детеныши, экспрессирующие трансген IL-20, были меньше, чем нетрансгенные детеныши того же помета, имели блестящий вид с плотной, сморщенной кожей и умирали в пределах нескольких дней после рождения. Детеныши имели молоко в их желудках, что свидетельствовало о том, что они были способны сосать молоко. Эти мыши имели опухшие конечности, хвост, участки ноздрей и рта и имели затруднения в передвижении. Кроме того, эти мыши были слабыми, не имели видимой жировой ткани и имели задержанное развитие ушей и пальцев. Низкие уровни экспрессии в печени (менее 100 молекул мРНК-на клетку) были достаточными как для неонатальной летальности, так и кожных аномалий. Трансгенные мыши без видимого фенотипа либо не экспрессировали этот трансген,либо не экспрессировали его при достаточных уровнях, либо были мозаичными. Гистологический анализ кожи IL-20-трансгенных мышей показал утолщенный эпидермис, гиперкератоз и компактный роговой слой в сравнении с нетрангенными однопометными мышами. Иногда наблюдались сероклеточные струпья (корки). Электронно-микроскопический анализ (ЕМ) кожи трансгенных мышей показал интрамитохондриальные липоидные включения, пестрые кератогиалиновые гранулы- 16005496 и относительно небольшие тонофиламенты, сходные с наблюдаемыми в псориатической коже человека и мышиных моделях заболеваний кожи. Кроме того, многие из трансгенных мышей имели апоптотические лимфоциты тимуса. Другие аномалии не были обнаружены гистопатологическим анализом. Эти гистологические и ЕМ-результаты подтверждают и развивают наблюдаемые макроскопические изменения кожи. Пример 6. Экспериментальные процедуры: Анализ с использованием люциферазы Люциферазные репортерные анализы выполняли с использованием клеток ВНК, стабильно трансфицированных IL-22R и IL-20RB и использующих STAT-регулируемую люциферазную репортерную кассету. Клетки переключали на бессывороточную среду в течение ночи перед обработкой серийными разведениями IL-19, IL-20 и MDA-7 в присутствии или в отсутствии растворимого рецептора IL20RB/IL-22R. Клетки лизировали и считывали на приборе Berthold MicroLumat Plus на люциферазную репортерную активность. Анализ пролиферации BaF3 В анализах пролиферации использовали краситель Alamar Blue, который добавляли к клеткам за 24 ч перед считыванием результатов на планшет-ридере fmax (Molecular Devices, Sunnyvale, CA) с использованием программы Softmax Pro. ОТ-ПЦР-анализ на тканях человека. ОТ-ПЦР выполняли на панели экспрессии генов человека Rapid-Scan (Origene Technologies, Inc.) с использованием праймеров 5'-ccccagacacggtctacagcat-3' и 5'-gggtcaggccgaagaactcatat-3' для амплификации фрагмента 440 п.н. IL-22R человека. Условия ПЦР были следующими 94 С в течение 2 мин, затем 35 циклов 94 С в течение 15 с 72 С в течение 90 с, затем конечная стадия удлинения при 72 С в течение 2 мин. Результаты Поскольку IL-22R является общей альфа-субъединицей, авторы изобретения оценивали панель Origene на экспрессию мРНК IL-22R. Наивысшую экспрессию IL-22R детектировали в поджелудочной железе причем кожа и легкое также обнаруживали сильную экспрессию. Для испытания возможности, что подсемейство IL-20 может активировать другие комбинации рецепторов класса II, клетки BaF3 стабильно трансфицировали субъединицами рецепторов класса II отдельно или в комбинации и обрабатывали лигандами. Этот анализ показал что как IL-20, так и MDA-7 стимулируют дополнительный комплекс рецепторов, состоящий из IL-22R/IL-20RB (табл. 1). Затем авторы изобретения хотели определить, какие растворимые рецепторы могли бы блокировать активность лиганда. Как упоминалось выше, гетеродимерный растворимый рецептор IL-20RA/IL-20RB блокировал пролиферацию, стимулируемую IL-20, IL-19 и MDA-7. Кроме того, один растворимый рецептор IL-20RB блокировал активность IL-19 и MDA-7, но не IL-20. Поскольку IL-22R является общей альфа-субъединицей, авторы изобретения оценивали панель Origene на экспрессию мРНК IL-22R (табл. 2). Наивысшую экспрессию детектировали в поджелудочной железе, причем кожа и легкое также обнаруживали сильную экспрессию. Таким образом, в целом, IL20R, IL-20R и IL-22R имеют сильную экспрессию в коже и легких. Поскольку IL-20R, IL-20R и IL-22R, - все экспрессируются в легком, авторы изобретения использовали гибридизацию in situ для оценки, экспрессировали ли те же самые типы клеток все три рецептора. Фиг. 3 показывает, что как эпителиальные клетки, так и иммунные инфильтраты проявляют положительное окрашивание в срезах легкого, испытываемых на экспрессию мРНК с использованием гибридизацииin situ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный растворимый рецептор, состоящий из субъединицы IL-22R и субъединицы IL-20RB,где субъединица IL-22R состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:12, 13, 25, 26, 31 и 32, а субъединица IL-20RB состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQID NO:15-21, 23, 28, 29, 34 и 35. 2. Растворимый рецептор по п.1, где субъединица IL-22R и субъединица IL-20RB связаны вместе полипептидным линкером. 3. Растворимый рецептор по п.2, где полипептидный линкер имеет приблизительно 100-240 аминокислотных остатков. 4. Растворимый рецептор по п.3, где полипептидный линкер имеет приблизительно 170 аминокислотных остатков. 5. Растворимый рецептор по п.1, где субъединица IL-22R и субъединица IL-20RB, каждая, имеют полипептидный линкер, слитый с данной субъединицей, и каждый из этих полипептидных линкеров имеет по меньшей мере один остаток цистеина, где по меньшей мере одна дисульфидная связь образуется с цистеином из полипептидного линкера субъединицы IL-22R и с цистеином из полипептидного линкера субъединицы IL-20RB.- 17005496 6. Растворимый рецептор по п.5, где субъединица IL-22R слита со всей константной областью или частью константной области тяжелой цепи молекулы иммуноглобулина (Ig), а субъединица IL-20RB слита со всей константной областью или частью константной области легкой цепи молекулы иммуноглобулина, где эта легкая цепь и эта тяжелая цепи связаны между собой дисульфидной связью. 7. Растворимый рецептор по п.6, где константная область тяжелой цепи состоит из домена СН 1, домена СН 2 и шарнирной последовательности, которая соединяет домен СН 1 с доменом СН 2. 8. Растворимый рецептор по п.6, где субъединица IL-22R, слитая с константной областью тяжелой цепи, состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ IDNO:25, 26, 31 и 32, а субъединица IL-20RB, слитая с константной областью легкой цепи молекулы Ig,состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:28, 29,34 и 35. 9. Растворимый рецептор по п.5, где субъединица IL-20RB слита со всей константной областью или частью константной области тяжелой цепи молекулы иммуноглобулина (Ig), а субъединица IL-22R слита со всей константной областью или частью константной области легкой цепи молекулы иммуноглобулина, где эта легкая цепь и эта тяжелая цепи связаны между собой дисульфидной связью. 10. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL20RB, предусматривающий (а) введение в клетку-хозяина первой последовательности ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-22R, и ДНК, которая кодирует константную область легкой цепи иммуноглобулина, (b) введение в клетку-хозяина второй конструкции ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-20RB, и последовательности ДНК, которая кодирует домен константной области тяжелой цепи иммуноглобулина; (с) выращивание этой клетки-хозяина в подходящей для выращивания среде при физиологических условиях, позволяющих продуцирование слитого белка, состоящего из внеклеточных доменов IL-22R и IL20RB, и (d) выделение этого полипептида из клетки-хозяина. 11. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL20RB, предусматривающий (а) введение в клетку-хозяина первой последовательности ДНК, состоящей из ДНК, которая кодирует внеклеточную часть IL-20RB, и ДНК, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клетку-хозяина второй конструкции ДНК, состоящей из последовательности ДНК, которая кодирует внеклеточную часть IL-22R, и последовательности ДНК,которая кодирует константную область тяжелой цепи иммуноглобулина; (с) выращивание этой клеткихозяина в подходящей для выращивания среде при физиологических условиях, позволяющих продуцирование димеризованного гетеродимерного слитого белка, состоящего из внеклеточных доменов IL-22R и IL-20RB; и (d) выделение этого димеризованного полипептида из клетки-хозяина. 12. Способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-22R и IL20RB, предусматривающий (а) введение в клетку-хозяина конструкции ДНК, содержащей конструкцию ДНК, которая кодирует внеклеточную часть IL-20RB, и конструкцию ДНК внеклеточной части IL-22R,(b) выращивание этой клетки-хозяина в подходящей среде при физиологических условиях, позволяющих продуцирование внеклеточного домена IL-22R и внеклеточного домена IL-20RB; и (d) выделение этих полипептидов из клетки-хозяина. 13. Клетки-хозяева, трансформированные или трансфицированные конструкцией ДНК, которая кодирует внеклеточный домен IL-22R, и конструкцией ДНК, которая кодирует внеклеточный домен IL20RB.
МПК / Метки
МПК: C12N 15/00, C07K 14/00
Метки: гетеродимерный, растворимый, рецептор, цитокина
Код ссылки
<a href="https://eas.patents.su/30-5496-rastvorimyjj-geterodimernyjj-receptor-citokina.html" rel="bookmark" title="База патентов Евразийского Союза">Растворимый гетеродимерный рецептор цитокина</a>
Предыдущий патент: Способ поэтапного присоединения частей полиэтиленгликоля к полипептиду
Следующий патент: Применение фармацевтической композиции, содержащей бривудин, для лечения герпесвирусных инфекций
Случайный патент: Способ получения эфиров арилиминометилкарбаминовой кислоты