Производные нодулиспоровой кислоты
Формула / Реферат
1. Соединение формулы I
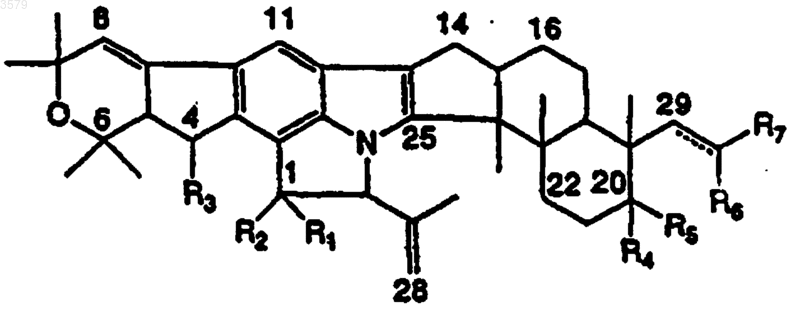
где R1 представляет собой
(1) водород;
R2 и R4 независимо представляют собой ORa, OC(O)NRcRd, либо
R1 и R2 представляют собой =O или =NORa;
R3 представляет собой OH;
R5 и R6 представляют собой H; или
R5 и R6 вместе представляют собой -O-;
R7 представляет собой
(1) CHO или
(2) фрагмент
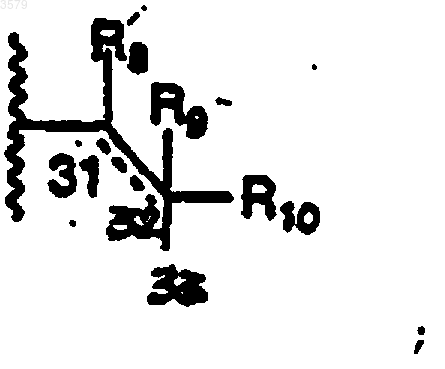
R8 представляет собой
(1) H;
(2) ORa;
R9 представляет собой
(1) водород или
(2) ORa;
R10 представляет собой
(1) C(O)ORb;
(2) C(O)NRcRd;
(3) C(O)NRcNRcRd;
- - - представляет собой простую или двойную связь;
Ra представляет собой
(1) водород;
(2) необязательно замещенный C1-C10алкил;
Rb представляет собой
(1) водород;
(2) необязательно замещенный арил;
(3) необязательно замещенный C1-C10алкил;
(4) необязательно замещенный C3-C10алкенил;
(5) необязательно замещенный C3-C10алкинил;
(6) необязательно замещенный C3-C15циклоалкил;
(7) необязательно замещенный гетероцикл, содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота;
и где заместители на группах Rb (1)-(7) представлены группами, независимо выбранными из
(i) гидрокси,
(ii) C1-C6 алкила,
(iii) оксо,
(iv) SO2NRgRh,
(v) гидрокси C1-C6алкила,
(vi) C1-C12алкокси,
(vii) гидрокси C1-C6алкокси,
(viii) амино C1-C6алкокси,
(ix) циано,
(x) меркапто,
(xi) C1-C6алкил-S(O)m,
(xii) C3-C7циклоалкила, необязательно замещенного группами в количестве от 1 до 4, независимо выбранных из Re,
(xiii) галогена,
(xiv) C1-C5алканоилокси,
(xv) C(O)NRgRh,
(xvi) NRgRh,
(xvii) 5-9-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами от 1 до 5, независимо выбранных из Re,
(xviii) необязательно замещенного арила, где заместителями арила являются 1,2-метилендиокси или группы, независимо выбранные из Re,
(xix) C1-C5перфторалкила,
(xx) C1-C6алкоксикарбонила;
Rc и Rd независимо выбраны из Rb; или
Rc и Rd вместе с азотом, к которому они присоединены, образуют от 3- до 10-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, который необязательно замещен группами, независимо выбранными из Rg, гидрокси;
Re представляет собой
(1) галоген,
(2) C1-C7алкил,
(3) C1-C3перфторалкил,
(4) -S(O)mRi,
(5) нитро,
(6) RiO(CH2)v-,
(7) необязательно замещенный арил, где от 1 до 3 заместителей, выбраны из галогена, C1-C6алкила, C1-C6алкокси или гидрокси;
Rg и Rh независимо представляют собой
(1) водород,
(2) C1-C6алкил, необязательно замещенный такими группами, как гидрокси, амино,
(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7алкокси, C1-C7алкилом или C1-C3перфторалкилом,
(4) арил C1-C6алкил, где арил необязательно замещен C1-C3перфторалкилом или 1,2-метилендиокси,
(5) C1-C5алкоксикарбонил,
(6) C1-C5алканоил,
(7) арил C1-C5алкоксикарбонил,
(8) аминокарбонил,
(9) C1-C5моно- или диалкиламинокарбонил, или Rg и Rh вместе с азотом, к которому они присоединены, образуют от 3 до 7-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;
Ri представляет собой
(1) водород,
(2) C1-C3перфторалкил,
(3) C1-C6алкил,
(4) необязательно замещенный арил C0-C6алкил, где заместители на ариле независимо выбраны из галогена, C1-C6алкила, C1-C6алкокси и гидрокси;
m равно 0-2, а
v равно 0-3; или
их фармацевтически приемлемые соли, исключая нодулиспоровую кислоту, 29,30-дигидро-20,30-оксанодулиспоровую кислоту и 31-гидрокси-20,30-окса-29,30,31,32-тетрагидронодулиспоровую кислоту,
при условии, что арил означает моно- и бициклическое ароматическое и гетероароматическое кольцо, содержащее от 0 до 5 гетероатомов, независимо выбранные из азота, кислорода и серы, или бензоконденсированный циклоалкил, бензоконденсированный циклоалкенил и бензоконденсированные гетероциклические группы.
2. Соединение по п.1, где
R1 представляет собой водород,
R8 и R9 независимо представляют собой
(1) H,
(2) ORa;
R10 представляет собой
(1) C(O)ORb,
(2) C(O)NRcRd,
(3) C(O)NRcNRcRd;
Ra представляет собой
(1) водород,
(2) необязательно замещенный C1-C6алкил,
Rb представляет собой
(1) водород,
(2) необязательно замещенный арил,
(3) необязательно замещенный C1-C7алкил,
(4) необязательно замещенный C3-C7алкенил,
(5) необязательно замещенный C3-C7алкинил,
(6) необязательно замещенный C5-C7циклоалкил,
(7) необязательно замещенный гетероцикл, содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота;
и где заместители на группах Rb представлены группами, независимо выбранными из
(i) гидрокси,
(ii) C1-C3алкила,
(iii) оксо,
(iv) SO2NRgRh,
(v) гидрокси C1-C3алкила,
(vi) C1-C7алкокси,
(vii) гидрокси C1-C3алкокси,
(viii) амино C1-C6алкокси,
(ix) циано,
(x) меркапто,
(xi) C1-C3алкил-S(O)m,
(xii) C5-C6циклоалкила, необязательно замещенного группами в количестве от 1 до 4, независимо выбранных из Re,
(xiii) галогена,
(xiv) C1-C3алканоилокси,
(xv) C(O)NRgRh,
(xvi) NRgRh,
(xvii) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательэю замещенного группами от 1 до 5, независимо выбранных из Re,
(xviii) необязательно замещенного арила, где заместителями арила являются 1,2-метилендиокси группы или группы, независимо выбранные из Re,
(xix) C1-C5перфторалкила;
Re представляет собой
(1) галоген,
(2) C1-C3алкил,
(3) C1-C3перфторалкил,
(4) -S(O)mRi,
(5) RiO(CH2)v-,
(6) необязательно замещенный арил, где от 1 до 3 заместителей, выбраны из галогена, C1-C3алкила, C1-C3алкокси или гидрокси;
Rg и Rh независимо представляют собой
(1) водород,
(2) C1-C6алкил, необязательно замещенный такими группами, как гидрокси или амино,
(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7алкокси, C1-C7алкилом или C1-C3перфторалкилом,
(4) арил C1-C6алкил, где арил необязательно замещен C1-C3перфторалкилом или 1,2-метилендиокси,
(5) C1-C5алкоксикарбонил,
(6) C1-C5алканоил,
(7) арил C1-C5алкоксикарбонил,
(8) аминокарбонил,
(9) C1-C5моно- или диалкиламинокарбонил, или Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, необязательно замещенный группами, независимо выбранными из Re;
R1 представляет собой
(1) водород,
(2) C1-C3перфторалкил,
(3) C1-C4алкил,
(4) необязательно замещенный арил C0-C4алкил, где заместители на ариле независимо выбраны из галогена, C1-C4алкила, C1-C4алкокси и гидрокси; а все другие группы имеют указанное в п.1 значение.
3. Соединение по п.1, где
R1 представляет собой водород,
R8 и R9 независимо представляют собой
(1) H,
(2) OH,
R10 представляет собой
(1) C(O)ORb,
(2) C(O)NRcRd,
(3) C(O)NRcNRcRd;
Ra представляет собой
(1) водород,
(2) необязательно замещенный C1-C4алкил,
Rb представляет собой
(1) водород,
(2) необязательно замещенный арил,
(3) необязательно замещенный C1-C6алкил,
(4) необязательно замещенный C3-C6алкенил,
(5) необязательно замещенный C3-C6алкинил,
(6) необязательно замещенный C5-C6циклоалкил,
(7) необязательно замещенный гетероцикл, содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота;
и где заместители на группах Rb представлены группами, независимо выбранными из
(i) гидрокси,
(ii) C1-C3алкила,
(iii) оксо,
(iv) SO2NRgRh,
(v) гидрокси C1-C4алкила,
(vi) C1-C4алкокси,
(vii) гидрокси C1-C4алкокси,
(viii) амино C1-C4алкокси,
(ix) циано,
(x) меркапто,
(xi) C1-C4алкил-S(O)m,
(xii) C5-C6циклоалкила, необязательно замещенного группами в количестве от 1 до 4, независимо выбранных из Re,
(xiii) галогена,
(xiv) C1-C3алканоилокси,
(xv) C(O)NRgRh,
(xvi) NRgRh,
(xvii) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами от 1 до 5, независимо выбранных из Re,
(xviii) необязательно замещенного арила, где заместителями арила являются 1,2-метилендиоксигруппы или группы, независимо выбранные из Re,
(xxiv) C1-C3перфторалкила;
Re представляет собой
(1) галоген,
(2) C1-C3алкил,
(3) C1-C3перфторалкил,
(4) -S(O)mRi,
(5) RiO(CH2)v-,
(6) необязательно замещенный арил, где от 1 до 3 заместителей выбраны из галогена, C1-C3алкила, C1-C3алкокси или гидрокси;
Rg и Rh независимо представляют собой
(1) водород,
(2) C1-C6алкил, необязательно замещенный такими группами, как гидрокси, амино,
(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7алкокси, C1-C7алкилом или C1-C3перфторалкилом,
(4) арил C1-C6алкил, где арил необязательно замещен C1-C3перфторалкилом или 1,2-метилендиокси,
(5) C1-C5алкоксикарбонил,
(6) C1-C5алканоил,
(7) арил C1-C5алкоксикарбонил,
(8) аминокарбонил,
(9) C1-C5моно- или диалкиламинокарбонил, или Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, необязательно замещенный группами, независимо выбранными из Re;
Ri представляет собой
(1) водород,
(2) C1-C3перфторалкил,
(3) C1-C4алкил,
(4) необязательно замещенный арил C0-C6алкил, где заместители на ариле независимо выбраны из галогена, C1-C6алкила, C1-C6алкокси и гидрокси; а все другие группы имеют указанное в п.1 значение.
4. Соединение по п.1, где R7 представляет собой CHO.
5. Соединение по п.1, где R7 представляет собой фрагмент

где R10 представляет собой
(1) C(O)ORb,
(2) C(O)NRcRd,
(3) C(O)NRcNRcRd;
а группы R8, R9, Rb, Rc и Rd имеют определенные в п.1 значения.
6. Соединение по п.5, где
R10 представляет собой C(O)ORb,
Rb представляет собой
(1) необязательно замещенный арил,
(2) необязательно замещенный C1-C6алкил,
(3) необязательно замещенный C3-C6алкенил,
(4) необязательно замещенный C3-C6алкинил,
(5) необязательно замещенный C3-C6циклоалкил,
(6) необязательно замещенный гетероцикл, содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота;
и где заместители на группах Rb представлены группами, независимо выбранными из
(i) гидрокси,
(ii) C1-C6алкила,
(iii) оксо,
(iv) SO2NRgRh,
(v) гидрокси C1-C4алкила,
(vi) C1-C4алкокси,
(vii) гидрокси C1-C4алкокси,
(viii) амино C1-C4алкокси,
(ix) циано,
(x) C1-C4алкил-S(O)m,
(xi) C5-C6циклоалкила, необязательно замещенного группами в количестве от 1 до 4, независимо выбранных из Re,
(xii) галогена,
(xiii) C1-C3алканоилокси,
(xiv) C(O)NRgRh,
(xv) NRgRh,
(xvi) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами от 1 до 5, независимо выбранных из Re,
(xvii) необязательно замещенного арила, где заместителями арила являются 1,2-метилендиокси или группы, независимо выбранные из Re,
(xviii) C1-C3перфторалкила;
Re представляет собой
(1) галоген,
(2) C1-C7алкил,
(3) C1-C3перфторалкил,
(4) нитро,
(5) RiO(CH2)v-, где v равно 0,
Rg и Rh независимо представляют собой
(1) водород,
(2) C1-C6алкил, необязательно замещенный гидрокси,
(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7алкилом или C1-C3перфторалкилом,
(4) C1-C5алканоил, или
Rg и Rh вместе с азотом, к которому они присоединены, образуют от 3- до 7-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, необязательно замещенный группами, независимо выбранными из Re;
Ri представляет собой
(1) водород,
(2) C1-C6алкил,
m равно 0-2, а все другие группы имеют определенное в п.5 значение.
7. Соединение по п.5, где R10 представляет собой
(1) C(O)NRcRd,
(2) C(O)NRcNRcRd;
где Rb, Rc и Rd имеют определенные в п.5 значения.
8. Соединение по п.5, где R10 представляет собой C(O)NRcRd,
где Rc и Rd имеют определенные в п.3 значения.
9. Соединение по п.5, где R10 представляет собой C(O)NRcRd,
Rb представляет собой
(1) водород,
(2) необязательно замещенный арил,
(3) необязательно замещенный C1-C6алкил,
(4) необязательно замещенный C3-C6алкенил,
(5) необязательно замещенный C3-C6алкинил,
(6) необязательно замещенный C5-C6циклоалкил,
(7) необязательно замещенный гетероцикл, содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота;
и где заместители на группах Rb представлены группами, независимо выбранными из
(i) гидрокси,
(ii) C1-C3 алкила,
(iii) оксо,
(iv) SO2NRgRh,
(v) гидрокси C1-C4алкила,
(vi) C1-C12алкокси,
(vii) гидрокси C1-C4алкокси,
(viii) амино C1-C4алкокси,
(ix) циано,
(x) C1-C4алкил-S(O)m,
(xi) C5-C6циклоалкила, необязательно замещенного группами в количестве от 1 до 4, независимо выбранных из Re,
(xii) галогена,
(xiii) C(O)NRgRh,
(xiv) NRgRh,
(xv) 5-9-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами от 1 до 3, независимо выбранных из Re,
(xvi) необязательно замещенного арила, где заместителями арила являются 1,2-метилендиоксигруппы или группы, независимо выбранные из Re, в количестве от 1 до 5,
Rc и Rd независимо выбраны из Rb; или
Rc и Rd вместе с азотом, к которому они присоединены, образуют от 3- до 10-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, который необязательно замещен группами от 1 до 3, независимо выбранными из Rg и гидрокси;
Re представляет собой
(1) галоген,
(2) C1-C3алкил,
(3) C1-C3перфторалкил,
(4) RiO(CH2)v-, где v равно 0,
Rg и Rh независимо представляют собой
(1) водород,
(2) C1-C6алкил, необязательно замещенный такими группами, как гидрокси или амино,
(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7алкокси, C1-C7алкилом или C1-C3 перфторалкилом,
(4) арил C1-C6алкил, где арил необязательно замещен C1-C3перфторалкилом или 1,2-метилендиокси,
(5) C1-C5алкоксикарбонил,
(6) C1-C5алканоил,
(7) арил C1-C5алкоксикарбонил,
(8) аминокарбонил, или
Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из O, S(O)m и N, необязательно замещенный группами, независимо выбранными из Re;
Ri представляет собой
(1) водород,
(2) необязательно замещенный арил C0-C6алкил, где от 1 до 3 заместителей на ариле независимо выбраны из галогена, C1-C6алкила, C1-C6алкокси и гидрокси; а все другие группы имеют указанное в п.5 значение.
10. Соединение по п.1, где R7 представляет собой фрагмент
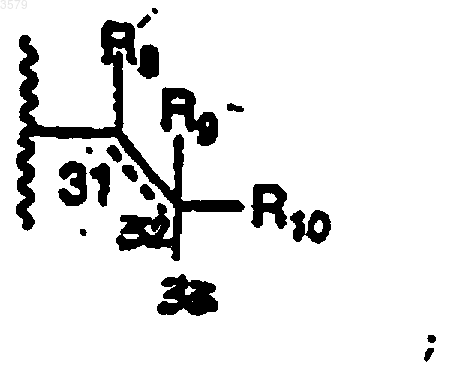
R8 и R9 имеют определенные в п.1 значения,
R10 представляет собой CO2H,
- - - представляет собой простую или двойную связь.
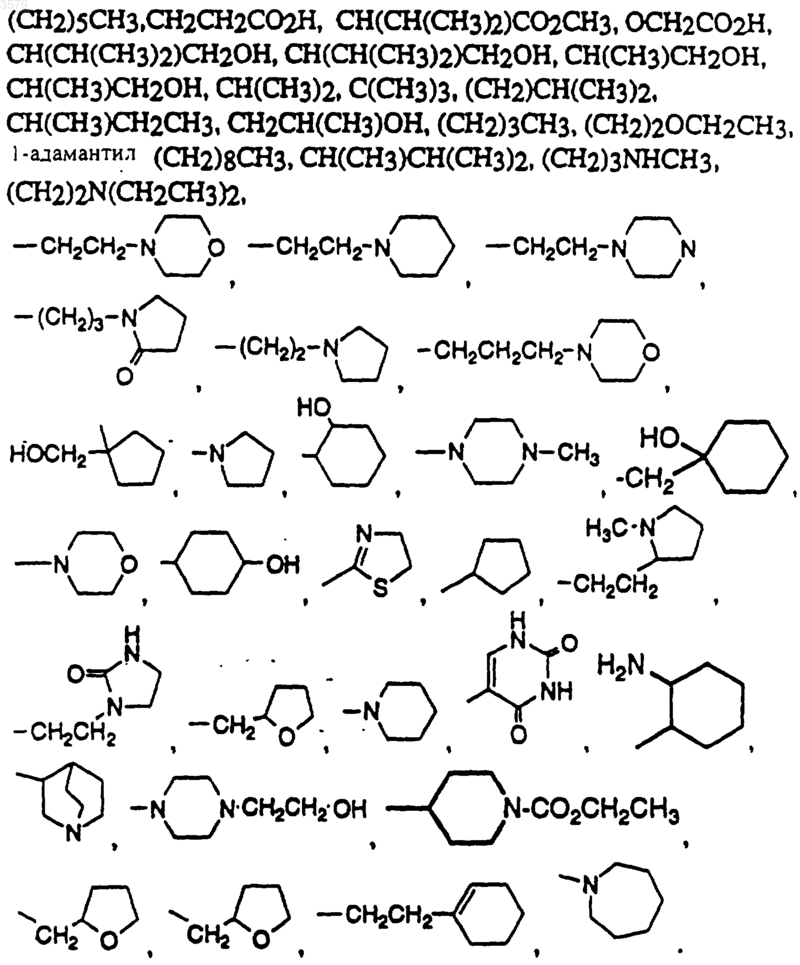
11. Соединение по п.1 формулы
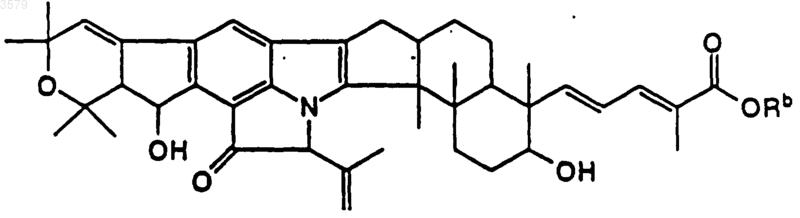
где Rb выбран из группы, состоящей из
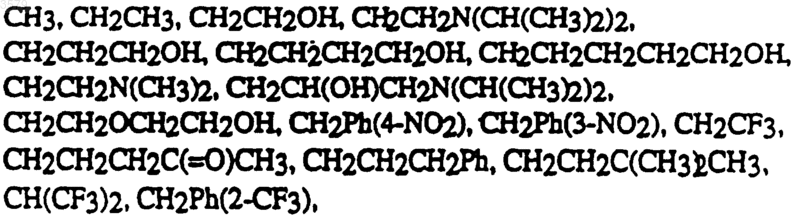
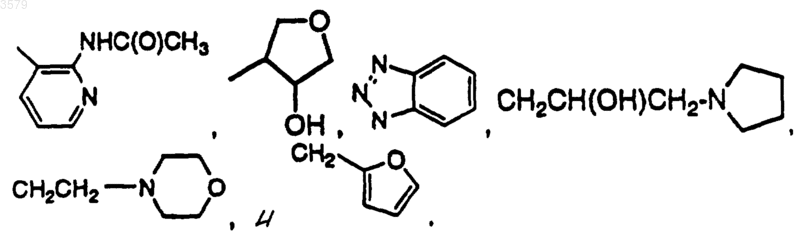
12. Соединение по п.1 формулы
где Rx выбран из группы, состоящей из

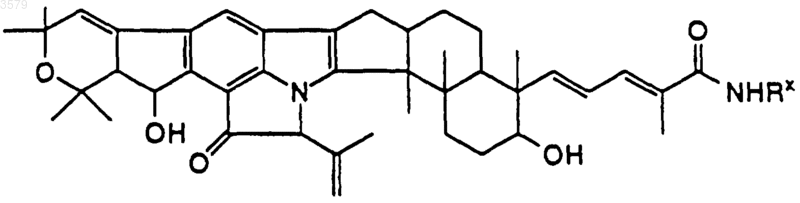
13. Соединение по п.1 формулы
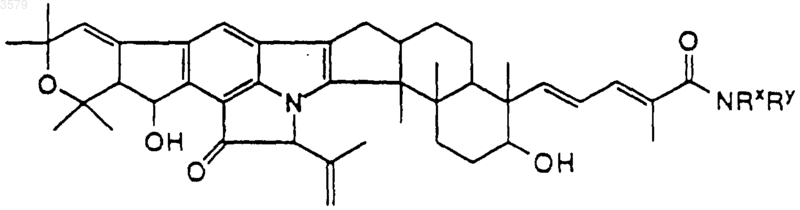
где NRxRy выбран из группы, состоящей из

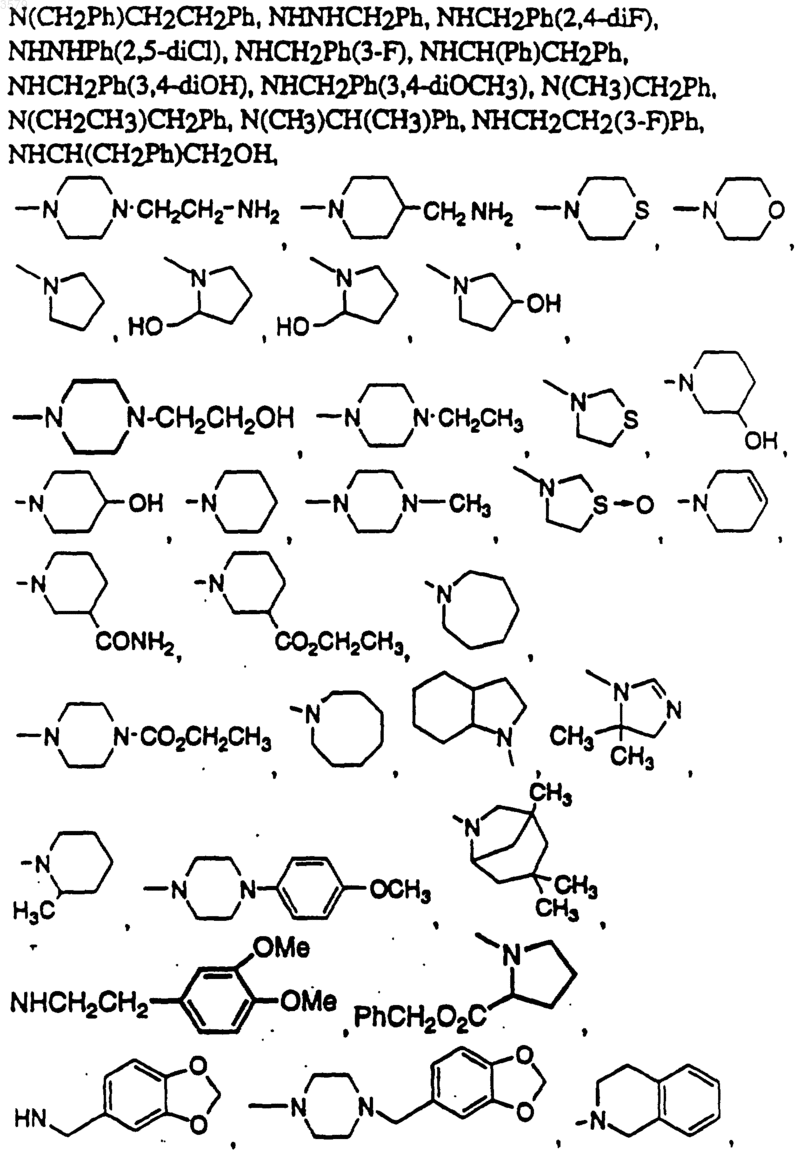
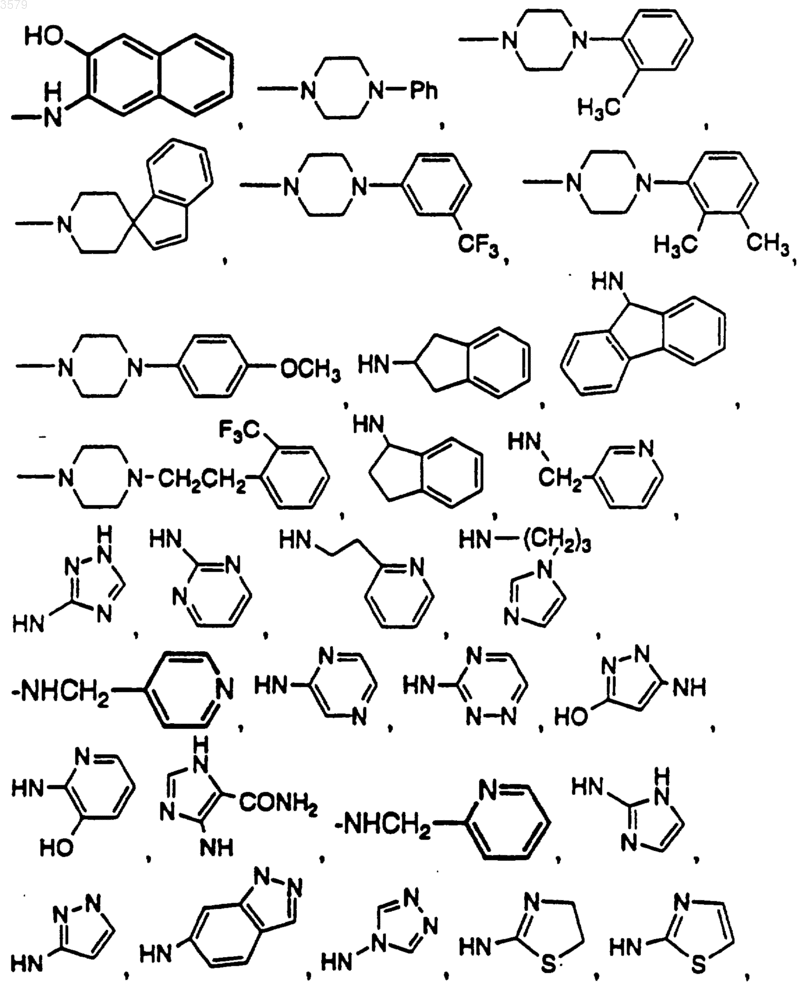
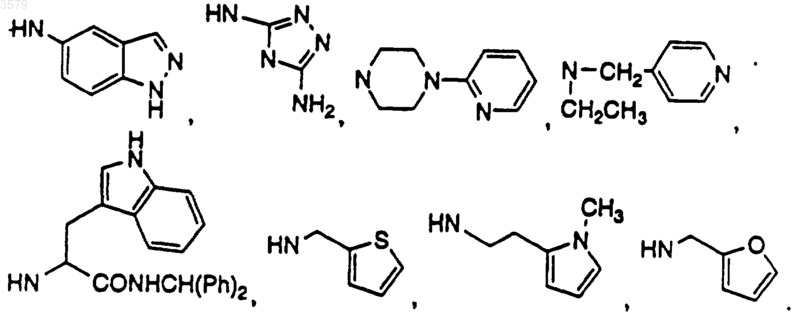
14. Соединение по п.1, имеющее формулу
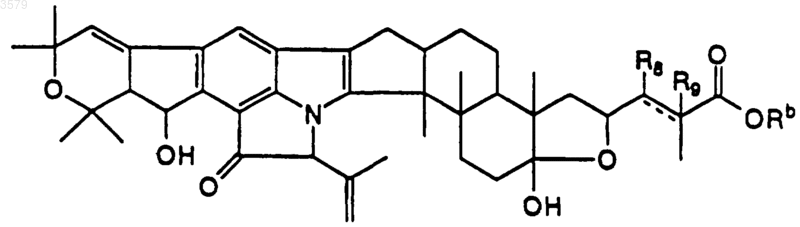
где R8 и R9 представляют собой водород и разделены двойной связью, или R8 представляет собой гидроксигруппу, R9 - водород и разделены одинарной связью, a Rb такой, как определен в п.11.
15. Соединение по п.1, имеющее формулу
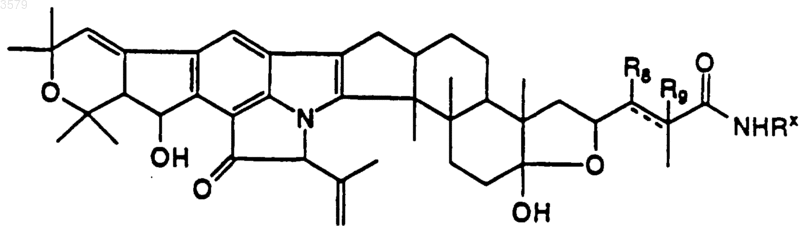
где R8 и R9 представляют собой водород и разделены двойной связью, или R8 представляет собой гидроксигруппу, R9 - водород и разделены одинарной связью, a Rx такой, как определен в п.12.
16. Соединение по п.1, имеющее формулу
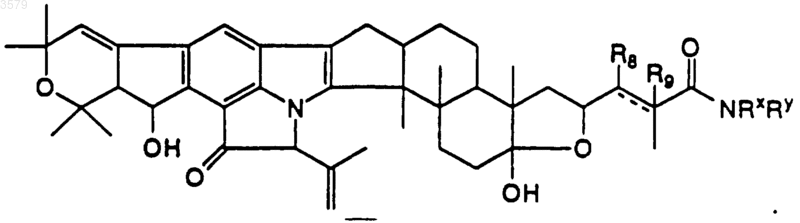
где R8 и R9 представляют собой водород и разделены двойной связью, или R8 представляет собой гидроксигруппу, R9 - водород и разделены одинарной связью, a NRxRy такой, как определен в п.13.
17. Соединение по п.1, имеющее формулу

где Rx такой, как определен в п.12.
18. Соединение по п.1, имеющее формулу
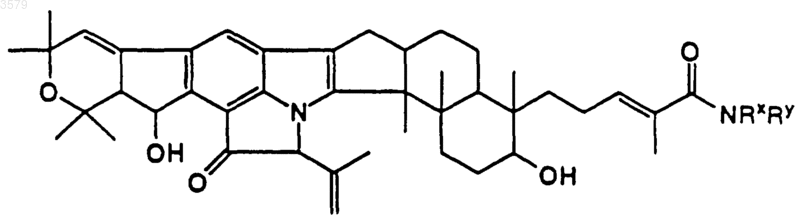
где NRxRy такой, как определен в п.13.
19. Соединение по п.1, имеющее формулу
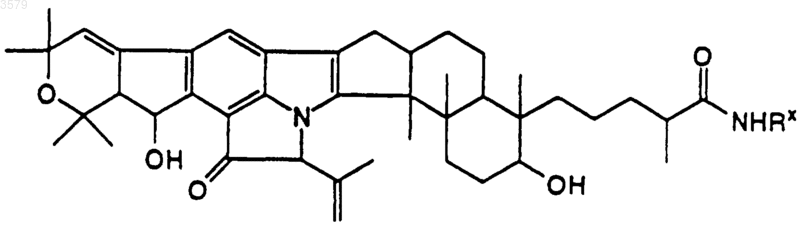
где Rx такой, как определен в п.12.
20. Соединение по п.1, имеющее формулу
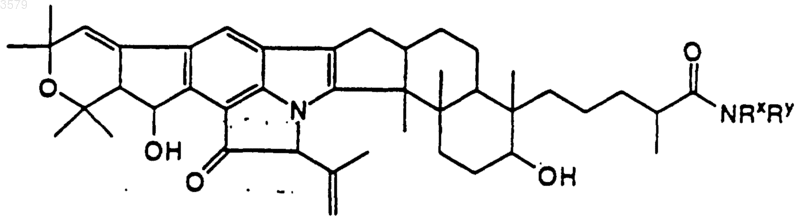
где NRxRy такой, как определен в п.13.
21. Соединение по п.1, имеющее формулу
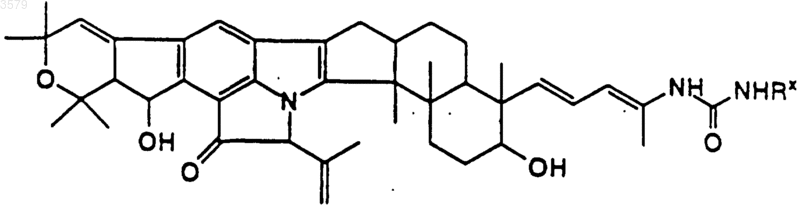
где Rx такой, как определен в п.12.
22. Соединение по п.1, имеющее формулу
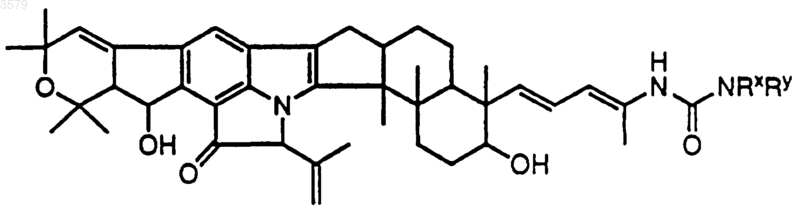
где NRxRy такой, как определен в п.13.
23. Соединение, имеющее формулу
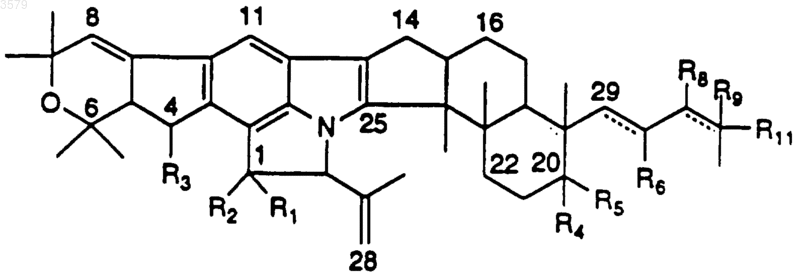
где R1-R6, R8 и R9 такие, как определены в п.1;
R11 представляет собой
(1) COCl,
(2) CON3 или
(3) NCO.
24. Фармацевтическая композиция, включающая активный компонент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного компонента включает соединение по п.1 в эффективном количестве.
25. Композиция по п.24, включающая дополнительно антигельминтный агент.
26. Композиция по п.25, где упомянутый антигельминтный агент выбран из ивермектина, авермектина, абамектина, эмамектина, эпринамектина, дорамектина, фулладектина, моксидектина, интерцептора и немадектина, тиабендазола, камбендазола, парбендазола, оксибендазола, мебендазола, флубендазола, фенбендазола, оксфендазола, альбендазола, циклобендазола, фебантела, тиофаната, тетрамизола-левамизола, бутамизола, пирантела, памоата, аоксантела или морантела.
27. Композиция по п.24, включающая дополнительно фипронил, луфенурон или агонист экдозина.
28. Способ лечения паразитических заболеваний у млекопитающих, который включает введение упомянутым млекопитающим эффективного антипаразитического количества активного соединения, отличающийся тем, что в качестве указанного соединения используют соединение по п.1.
29. Способ по п.28, включающий дополнительное введение антигельминтного агента.
30. Способ по п.28, включающий дополнительное введение фипронила или луфенурона.
Текст
1 Эта заявка является частичным продолжением одновременно рассматриваемой заявкиU.S.S.N. 08/406,619, поданной 20 марта 1995 г.,которая включена здесь в качестве ссылки. Предпосылки создания изобретения Нодулиспоровая кислота и два родственных по структуре компонента являются антипаразитическими агентами и эктопаразитицидными агентами, выделенными из ферментационной культуры Nodulisporium sp. MF5954 (ATCC 74245). Эти три соединения имеют следующие структуры: нодулиспоровая кислота (соединение А) Краткое содержание изобретения Это изобретение представляет новые акарицидные, антипаразитические, инсектицидные и антигельминтные агенты, являющиеся родственными соединениями нодулиспоровой кислоты, способы их приготовления, их композиции,использование в лечении паразитических инфекций, включая гельминтозы, у людей и животных, и их использование в лечении паразитических инфекций растений и растительных продуктов. Подробное описание изобретения Настоящее изобретение представляет соединения, имеющие формулу IR5 и R6 вместе представляют собой -О-;- - - представляет собой простую или двойную связь;(1) водород,(2) необязательно замещенный арил,(3) необязательно замещенный C1-С 10 алкил,(4) необязательно замещенный С 3-С 10 алкенил,(5) необязательно замещенный С 3-С 10 алкинил,(6) необязательно замещенный С 3-С 15 циклоалкил,(7) необязательно замещенный гетероцикл,содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb (1)-(7) представлены группами, независимо выбранными из(i) гидрокси,(ii) C1-C6 алкила,(iii) оксо,(iv) SO2NRgRh,(v) гидрокси C1-C6 алкила,(vi) C1-C12 алкокси,(vii) гидрокси C1-C6 алкокси,(viii) амино C1-C6 алкокси,(ix) циано,(х) меркапто,(xi) C1-C6 алкил-S(O)m,(xii) С 3-С 7 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xiii) галогена,(xiv) C1-C5 алканоилокси,(xv) C(O)NRgRh,(xvi) NRgRh,(xvii) 5-9-членного гетероцикла, который может быть насыщенным или частично нена 3 сыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами,от 1 до 5, независимо выбранных из Re,(xviii) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиокси или группы, независимо выбранные из Re,(xix) C1-C5 перфторалкила,(хх) C1-С 6 алкоксикарбонила;Rc и Rd независимо выбраны из Rb; или Rc и Rd вместе с азотом, к которому они присоединены, образуют от 3- до 10-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m и N, который необязательно замещен группами, независимо выбранными из Rg, гидрокси;(1) водород,(2) C1-С 6 алкил, необязательно замещенный такими группами, как гидрокси, амино,(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7 алкокси, C1-C7 алкилом или C1-С 3 перфторалкилом,(4) арил C1-С 6 алкил, где арил необязательно замещен C1-С 3 перфторалкилом или 1,2 метилендиокси,(5) C1-C5 алкоксикарбонил,(6) C1-C5 алканоил,(7) арил C1-C5 алкоксикарбонил,(8) аминокарбонил,(9) C1-C5 моно- или диалкиламинокарбонил,или Rg и Rh вместе с азотом, к которому они присоединены, образуют от 3- до 7-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) C1-С 3 перфторалкил,(3) C1-С 6 алкил,(4) необязательно замещенный арил С 0-С 6 алкил, где заместители на ариле независимо выбраны из галогена, C1-С 6 алкила, C1-C6 алкокси и гидрокси;v равно 0-3; или их фармацевтически приемлемые соли, исключая нодулиспоровую кислоту, 29,30-дигидро 20,30-оксанодулиспоровую кислоту и 31 003579 4 гидрокси-20,30-окса-29,30,31,32-тетрагидронодулиспоровую кислоту,при условии, что арил означает моно- и бициклическое ароматическое и гетероароматическое кольцо, содержащее от 0 до 5 гетероатомов, независимо выбранные из азота, кислорода и серы, или бензоконденсированный циклоалкил, бензоконденсированный циклоалкенил и бензоконденсированные гетероциклические группы. Предпочтительным является соединение I,где(1) водород,(2) необязательно замещенный арил,(3) необязательно замещенный C1-C7 алкил,(4) необязательно замещенный С 3-С 7 алкенил,(5) необязательно замещенный С 3-С 7 алкинил,(6) необязательно замещенный C5-C7 циклоалкил,(7) необязательно замещенный гетероцикл,содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb представлены группами, независимо выбранными из(i) гидрокси,(ii) C1-С 3 алкила,(iii) оксо,(iv) SO2NRgRh,(v) гидрокси C1-С 3 алкила,(vi) C1-C7 алкокси,(vii) гидрокси C1-С 3 алкокси,(viii) амино C1-C6 алкокси,(ix) циано,(х) меркапто,(xi) C1-С 3 алкил-S(O)m,(xii) C5-C6 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xiii) галогена,(xiv) C1-С 3 алканоилокси,(xv) C(O)NRgRh,(xvi) NRgRh,(xvii) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы 5 и азота, и необязательно замещенного группами,от 1 до 5, независимо выбранных из Re,(xviii) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиоксигруппы или группы, независимо выбранные из Re,(xix) C1-С 5 перфторалкила;(1) водород,(2) C1-C6 алкил, необязательно замещенный такими группами, как гидрокси или амино,(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7 алкокси, C1-C7 алкилом или C1-С 3 перфторалкилом,(4) арил C1-С 6 алкил, где арил необязательно замещен C1-С 3 перфторалкилом или 1,2 метилендиокси,(5) C1-C5 алкоксикарбонил,(6) C1-C5 алканоил,(7) арил C1-C5 алкоксикарбонил,(8) аминокарбонил,(9) C1-C5 моно- или диалкиламинокарбонил,или Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл,содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) C1-С 3 перфторалкил,(3) C1-C4 алкил,(4) необязательно замещенный арил С 0-С 4 алкил, где заместители на ариле независимо выбраны из галогена, C1-C4 алкила, C1-C4 алкокси и гидрокси; а все другие группы имеют ранее указанное значение. Еще более предпочтительны соединения I,где R1 представляет собой водород,R8 и R9 независимо представляют собой(6) необязательно замещенный C5-C6 циклоалкил,(7) необязательно замещенный гетероцикл,содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb представлены группами, независимо выбранными из(i) гидрокси,(ii) C1-С 3 алкила,(iii) оксо,(iv) SO2NRgRh,(v) гидрокси C1-C4 алкила,(vi) C1-C4 алкокси,(vii) гидрокси C1-C4 алкокси,(viii) амино C1-C4 алкокси,(ix) циано,(х) меркапто,(xi) C1-C4 алкил-S(O)m,(xii) C5-C6 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xiii) галогена,(xiv) C1-С 3 алканоилокси,(xv) C(O)NRgRh,(xvi) NRgRh,(xvii) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами,от 1 до 5, независимо выбранных из Re,(xviii) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиоксигруппы или группы, независимо выбранные из Re,(xxiv) C1-С 3 перфторалкила;(1) водород,(2) C1-С 6 алкил, необязательно замещенный такими группами, как гидрокси, амино,(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7 алкокси, C1-C7 алкилом или C1-С 3 перфторалкилом,(4) арил C1-C6 алкил, где арил необязательно замещен C1-С 3 перфторалкилом или 1,2 метилендиокси, 7(5) C1-C5 алкоксикарбонил,(6) C1-C5 алканоил,(7) арил C1-C5 алкоксикарбонил,(8) аминокарбонил,(9) C1-C5 моно- или диалкиламинокарбонил,или Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл,содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) C1-С 3 перфторалкил,(3) C1-C4 алкил,(4) необязательно замещенный арил С 0-С 6 алкил, где заместители на ариле независимо выбраны из галогена, C1-С 6 алкила, C1-C6 алкокси и гидрокси; а все другие группы имеют ранее указанное значение. Особенно предпочтительны соединения I,где R7 представляет собой СНО, либо где R7 представляет собой фрагмент(1) С(О)ORb,(2) C(O)NRcRd,(3) C(O)NRcNRcRd; а группы R8, R9, Rb, Rc и Rd имеют определенные выше значения. Из указанной группы соединений, где R7 представляет собой СНО, предпочтительны соединения где(1) необязательно замещенный арил,(2) необязательно замещенный C1-C6 алкил,(3) необязательно замещенный С 3-С 6 алкенил,(4) необязательно замещенный С 3-С 6 алкинил,(5) необязательно замещенный С 3-С 6 циклоалкил,(6) необязательно замещенный гетероцикл,содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb представлены группами, независимо выбранными из(vii) гидрокси C1-C4 алкокси,(viii) амино C1-C4 алкокси,(ix) циано,(х) C1-C4 алкил-S(O)m,(xi) C5-C6 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xii) галогена,(xiii) C1-С 3 алканоилокси,(xiv) C(O)NRgRh,(xv) NRgRh,(xvi) 5-6-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами,от 1 до 5, независимо выбранных из Re,(xvii) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиокси или группы, независимо выбранные из Re,(xviii) C1-С 3 перфторалкила;Rg и Rh вместе с азотом, к которому они присоединены, образуют от 3- до 7-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) C1-С 6 алкил,m равно 0-2,а все другие группы имеют вышеопределенное значение. Из указанной группы предпочтительными являются соединения, где R10 представляет собой(1) C(O)NRcRd,(2) C(O)NRcNRcRd; где Rb, Rc и Rd имеют определенные выше значения, а также соединения, где(6) необязательно замещенный C5-C6 циклоалкил,(7) необязательно замещенный гетероцикл,содержащий от 5 до 6 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb представлены группами, независимо выбранными из(i) гидрокси,(ii) C1-С 3 алкила,(iii) оксо,(iv) SO2NRgRh,(v) гидрокси C1-C4 алкила,(vi) C1-C12 алкокси,(vii) гидрокси C1-C4 алкокси,(viii) амино C1-C4 алкокси,(ix) циано,(х) C1-C4 алкил-S(O)m,(xi) C5-C6 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xii) галогена,(xiii) C(O)NRgRh,(xiv) NRgRh,(xv) 5-9-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами,от 1 до 3, независимо выбранных из Re,(xvi) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиоксигруппы или группы, независимо выбранные из Re, в количестве от 1 до 5,Rc и Rd независимо выбраны из Rb; или Rc и Rd вместе с азотом, к которому они присоединены, образуют от 3- до 10 членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m,и N, который необязательно замещен группами,от 1 до 3, независимо выбранными из Rg и гидрокси;(1) водород,(2) C1-С 6 алкил, необязательно замещенный такими группами, как гидрокси или амино,(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7 алкокси, C1-C7 алкилом или C1-С 3 перфторалкилом,(4) арил C1-C6 алкил, где арил необязательно замещен C1-С 3 перфторалкилом или 1,2 метилендиокси, 003579Rg и Rh вместе с азотом, к которому они присоединены, образуют 5-6-членный цикл,содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) необязательно замещенный арил С 0-С 6 алкил, где от 1 до 3 заместителей на ариле независимо выбраны из галогена, C1-C6 алкила, C1-C6 алкокси и гидрокси; а все другие группы имеют указанное выше значение. Еще одной предпочтительной группой соединений являются соединения, где R7 представляет собой фрагментR8 и R9 имеют любые из определенных ранее значений,R10 представляет собой СО 2 Н,- - - представляет собой простую или двойную связь. где R1-R6, R8 и R9 такие, как определены для формулы I; a R11 представляет собой(3 ) NCO. Соединения формулы Х полезны в качестве промежуточных продуктов при получении ряда соединений формулы I из соединений А, В и С. Настоящее изобретение предоставляет также фармацевтические композиции, включающие соединение формулы I и фармацевтически приемлемый носитель. Кроме того, такие композиции могут включать один или более других активных ингредиентов, таких как антигельминтные агенты, средства, уничтожающие насекомых, агонисты экдозина и фипронил. Настоящее изобретение предоставляет также метод для лечения паразитических заболеваний у млекопитающих, который включает в себя введение антипаразитического количества соединения формулы I. Лечение может также включать в себя одновременное введение одного или более других активных ингредиентов,таких как антигельминтные агенты, средства,уничтожающие насекомых, агонисты экдозина и фипронил."Алкил", так же, как другие группы,имеющие префикс "алк", такие как алкокси, алканоил, алкенил, алкинил и подобные, обозна 11 чают углеродные цепи, которые могут быть линейными или разветвленными, или их комбинациями. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил и тому подобное. "Алкенил", "алкинил" и другие подобные термины включают углеродные цепи, содержащие, как минимум, одну ненасыщенную С-С связь. Термин "циклоалкил" обозначает углеродные циклы, не содержащие гетероатомов, и включающие моно-, би- и трициклические насыщенные карбоциклы, также как бензоконденсированные карбоциклы. Примеры циклоалкилов включают циклопропил, циклобутил, циклопентил, циклогексил, декагидронафталин,адамантан, инданил, инденил, флюоренил,1,2,3,4-тетрагидронафталин и тому подобное. Аналогично, "циклоалкенил" обозначает углеродные циклы, не содержащие гетероатомов и имеющие, как минимум, одну не ароматическую С-С двойную связь и включающие моно-,би- и трициклические частично ненасыщенные карбоциклы, также как бензоконденсированные циклоалкены. Примеры циклоалкенилов включают циклогексенил, инденил и тому подобное. Термин "галоген" подразумевает атомы галогенов фтор, хлор, бром и йод. Термин "гетероцикл", если специально не оговорено, обозначает моно- и бициклические соединения, насыщенные или частично ненасыщенные также, как бензо- или гетероароматические циклы, конденсированные насыщенные гетероциклы и частично ненасыщенные гетероциклы и содержащие от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота. Примеры насыщенных гетероциклов включают морфолин, тиоморфолин, пиперидин,пиперазин, тетрагидропиран, тетрагидрофуран,диоксан, тетрагидротиофен, оксазолидин, пирролидин; примеры частично ненасыщенных гетероциклов включают дигидропиран, дигидропиридазин, дигидрофуран, дигидрооксазол,дигидропиразол, дигидропиридин, дигидропиридазин и им подобные. Примеры бензо- или гетероароматических циклов включают 2,3 дигидробензофуранил, бензопиранил, тетрагидрохинолин, тетрагидроизохинолин, бензоморфолинил, 1,4-бензодиоксанил, 2,3-дигидрофуро(2,3-b)пиридил и им подобные. Под термином "арил" подразумеваются моно- и бициклические ароматические и гетероароматические кольца, содержащие от 0 до 5 гетероатомов, независимо выбранные из азота,кислорода и серы. Термин "арил" также обозначает бензоконденсированный циклоалкил, бензоконденсированный циклоалкенил и бензоконденсированные гетероциклические группы. Примеры "арильных" групп включают фенил,пирролил, изоксазолил, пиразинил, пиридинил,оксазолил, тиазолил, имидазолил, триазолил,тетразолил, фуранил, триазинил, тиенил, пири 003579 12 мидинил, пиридазинил, пиразинил, нафтил, бензоксазолил, бензотиазолил, бензимидазолил,бензофуранил, фуро(2,3-B)пиридил, 2,3-дигидрофуро(2,3-b)пиридил, бензоксазинил, бензотиофенил,хинолинил,индолил,2,3 дигидробензофуранил,бензопиранил,1,4 бензодиоксанил, инданил, инденил, фторенил,1,2,3,4-тетрагидронафталин и им подобные. Ароил обозначает арилкарбонил, в котором арил описан выше. Примерами НRcRd или NRgRh, образующих от 3- до 10-членные циклы, содержащие от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m и N, являются азиридин, азетидин,пирролидин, пиперидин, тиоморфолин, морфолин, пиперазин, октагидроиндол, тетрагидроизохинолин и подобные. Термин "необязательно замещенные" подразумевает как замещенные, так и не замещенные соединения; например, необязательно замещенный арил может представлять пентафторфенил или фенил. Некоторые из определенных ранее терминов могут встречаться более чем один раз в выше упомянутой формуле, при этом каждый термин должен быть определен независимо от других; так, например, ORa в С 4 может представлять ОН, а в С 20 - O-ацил. Соединения, описанные здесь, содержат один или более асимметрических центров и,следовательно, могут давать диастереомеры и оптические изомеры. Настоящее изобретение включает все возможные диастереомеры так же,как их рацематы и разделенные энантиомерно чистые формы и все возможные геометрические изомеры. Кроме того, настоящее изобретение включает все фармацевтически приемлемые соли этих соединений. Термин "фармацевтически приемлемые" относится к солям, приготовленным из фармацевтически приемлемых нетоксических оснований, включающих неорганические и органические основания. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди,соли трехвалентного и двухвалентного железа,лития, магния, соли трехвалентного и двухвалентного марганца, калия, натрия, цинка и подобные. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксических оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, такие как аргинин, бетаин, кофеин,холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин,лизин, метилглюкамин, морфолин, пиперазин, 13 пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин,трипропиламин, трометамин и подобные. В том случае, когда соединения настоящего изобретения носят основной характер, соли могут быть приготовлены из фармацевтически приемлемых органических и неорганических кетоксических кислот. Такие кислоты включают уксусную, бензолсульфоновую, бензойную,камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глютаминовую,бромисто-водородную, хлористо-водородную,изетионовую, молочную, малеиновую, яблочную, манделовую, метансульфоновую, муциновую, азотную, памоевую, пантотеновую, фосфорную, янтарную, сернистую, винную, птолуолсульфоновую и подобные. Особенно предпочтительными являются лимонная, бромисто-водородная, хлористо-водородная, малеиновая, фосфорная, серная и винная кислоты. Названия соединений настоящего изобретения базируются на тривиальном названии исходного соединения, нодулиспоровой кислоты(соединение А), а их нумерация является такой,как определено для формулы I. Соединения настоящего изобретения приготовляются из трех нодулиспоровых кислот(соединения А, В и С), которые в свою очередь получаются из ферментационной культурыNodulisporium sp. MF-5954 (ATCC 74245). Вид продуцирующего микроорганизма, процесс ферментации, выделение и очистка трех нодулиспоровых кислот раскрыты в US Patent 5,399,582, опубликованном 21 марта 1995 г.,который здесь полностью включен в качестве ссылки. Упомянутая выше структурная формула приведена без определения стереохимии в соответствующих позициях. Однако продукты, полученные в результате ряда синтетических процессов или процессов рацемизации и эпимеризации, известных специалистам в этой области,могут представлять собой смесь стереоизомеров. В частности, стереоизомеры при С 1, С 4, С 20, С 26, С 31 и С 32 могут быть ориентированы как в альфа-, так и в бетаположении, что соответствует ориентации групп заместителей соответственно выше или ниже плоскости молекулы. В каждом таком случае и в других позициях в молекуле, подразумевается, что, как альфа, так и бета конфигурации включены в сферу этого изобретения. Соединения формулы I, где аллильные группы в позиции 26 в эпиконфигурации могут быть получены обработкой соответствующего предшественника основаниями, такими как гидроксид, метоксид, имидазол, триэтиламин, гидрид калия, диизопропиламид лития в протонных и апротонных растворителях (в зависимости от потребности), таких как вода, метанол, этанол,метиленхлорид, хлороформ, тетрагидрофуран,диметилформамид и т.п. Реакция полностью 14 проходит при температурах от -78 С до температуры флегмы раствора в течение от 15 мин до 12 ч. Соединения формулы I, где R2 (и R1 является водородом), R3, R4 и R8 независимо являются гидроксигруппой, могут быть инвертированы обработкой соответствующим спиртом по схемам, известным специалистам. Например,спирт может реагировать при условиях Митцунобу с карбоновой кислотой (муравьиной, пропионовой, 2-хлоруксусной, бензойной, паранитробензойной кислотой и подобными), тризамещенным фосфином (трифенилфосфин, трин-бутилфосфин, трипропилфосфин и подобные) и диалкил диазокарбоксилатом (диэтил диазодикарбоксилат, диметил диазодикарбоксилат,диизопропил диазодикарбоксилат и подобные) в апротонных растворителях, таких как метиленхлорид, тетрагидрофуран, хлороформ, бензол и другие. Реакции Митцунобу завершаются в течение от 1 до 24 ч при температуре раствора от 0 С до температуры флегмы. Полученные в результате эфиры могут быть гидролизованы обработкой гидроокисью или гидроокисью аммония в протонных растворителях, таких как метанол, этанол, вода, тетрагидрофуран/вода или диметилфорамид/вода и им подобные при температуре раствора от 0 С до температуры флегмы. Альтернативно полученные в результате эфиры могут быть гидролизованы обработкой кислотой Льюиса, например, хлоридом магния,хлоридом алюминия, тетраизопропоксидом титана и подобными, в протонных растворителях,таких как метанол, этанол, изопропанол и подобные, и реакция полностью завершается в течение от 1 до 24 ч при температуре от 0 С до температуры флегмы раствора. В ходе ряда реакций, описанных ниже,может возникнуть необходимость защиты групп при R2, R3, R4, R8, R9 и R10. После защиты этих позиций, реакция проводится по другим положениям без влияния на остальную часть молекулы. После проведения описанных реакций защитные группы могут быть удалены и выделен продукт. Защитные группы, применяемые в позициях при R2, R3, R4, R8, R9 и R10, должны легко синтезироваться, не подвергаться воздействию в ходе реакции по другим позициям, при их удалении не должны затрагиваться другие функциональные группы молекулы. Предпочтительный тип защитных групп представляет собой трехзамещенные силильные группы, преимущественно тринизший алкил силил, или динизший алкил-арил силил. Особенно предпочтительны триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил и диметилфенилсилил. Защищенные соединения могут быть синтезированы с помощью соответственно замещенного силил трифторметансульфоната или силил галогенида, предпочтительно силилхлорида. Реакцию проводят в апротонном раство 15 рителе, таком как метиленхлорид, бензол, толуол, этилацетат, изопропилацетат, тетрагидрофуран, диметилформамид и им подобные. Чтобы минимизировать побочные реакции, в реакционную смесь добавляют основание для нейтрализации выделяющейся в процессе реакции кислоты. Предпочтительными основаниями являются амины, такие как имидазол, пиридин, триэтиламин или диизопропилэтиламин и им подобные. Основание требуется в количествах,эквимолярных количеству высвобождающегося галогенводорода, однако, обычно используют несколько эквивалентов амина. Реакция проводится при перемешивании при температуре реакционной смеси от 0 С до температуры флегмы и полностью завершается в течение от 1 до 24 ч. Силильную группу удаляют путем обработки силильного производного безводным гидрофторидом пиридина в тетрагидрофуране или диметилсульфоксиде, или фторидом тетраалкиламмония в тетрагидрофуране. Реакция полностью завершается в течение от 1 до 24 ч при температуре от 0 до 50 С. Альтернативно силильные группы можно удалить при перемешивании раствора силилированного производного в низкопротонных растворителях, таких как метанол, этанол, изопропанол и подобные, в присутствии катализатора, в качестве которого используют кислоты, преимущественно моногидраты сульфоновых кислот, таких как паратолуолсульфоновая, бензолсульфоновая, или карбоновые кислоты, такие как уксусная, пропионовая, монохлоруксусная, дихлоруксусная,трихлоруксусная и им подобные. Реакция полностью завершается в течение от 1 до 24 ч при температуре от 0 до 50 С. Защитные группы, которые также пригодны для использования при получении соединений настоящего изобретения, можно найти в стандартных справочниках, таких как Green andWutz, Protective Groups in Organic Synthesis,1991, John WileySons, Inc. Соединения формулы I, где R1 и R2 вместе представляющие оксим, =NORa, могут быть получены путем обработки соответствующего оксо аналога H2NORa. Образование оксима проводят, используя методы, известные специалистам, включая применение Н 2NОRa, а также свободного основания или солей некоторых кислот, например солей НСl, или Oзащищенных гидроксиламинов, например Oтриалкилсилилгидроксиламина, в протонных растворителях, таких как метанол, этанол, изопропанол и подобные, или в апротонных растворителях, таких как метиленхлорид, хлороформ, этилацетат, изопропилацетат, тетрагидрофуран, диметилформамид, бензол, толуол и подобные, в зависимости от потребностей. В реакции могут применяться катализаторы, такие как сульфоновые кислоты, карбоновые кислоты или кислоты Льюиса, включая моногидрат бензол 003579=NNRcRd, могут быть получены путем обработки соответствующего оксо аналога с помощьюH2NNRcRd, при условиях, аналогичных описанным для образования оксима. Соединения формулы I, где одна или обе- - - связи представляют простую связь, могут быть приготовлены из соответствующего соединения, где - - - является двойной связью, с помощью подходящей реакции гидрирования. Гидрирование двойной связи проводят с помощью любого стандартного катализатора гидрирования из ряда драгоценных металлов, таких как катализатор Вилкинсона, катализатор Перлмана, 1-25% палладий на угле, 1-25% платина на угле и другие. Реакцию обычно проводят в невосстанавливаемых растворителях (как протонных, так и апротонных), таких как метанол, этанол, изопропанол, тетрагидрофуран, этилацетат,изопропилацетат, бензол, толуол, диметилформамид и другие. Источником водорода может быть газ под давлением от 1 до 50 атм или такие источники, как формиат аммония, циклогексен,циклогексадиен и другие. Восстановление проводят с помощью дитионита натрия и бикарбоната натрия в присутствии катализатора фазового переноса, в частности, тетраалкиламмониевого катализатора и других. Эти реакции могут проводиться от 0 до 100 С и полностью завершаются в течение от 5 мин до 24 ч. Соединения формулы I, где R8 и R9 обе являются гидроксильными группами, получают с помощью реакции, представленной на схеме I. Схема I Таким образом, соединение II обрабатывают тетраоксидом осмия в условиях, известных специалистам в этой области, получая в результате продукт III, являющийся диолом. В результате реакции получается также альдегид IV. Тетраоксид осмия также используют стехиометрически или каталитически в присутствии оксиданта, включая, но не ограничиваясь этим,морфолин-N-оксид,триметиламин-N-оксид,перекись водорода, трет-бутилгидропероксид и другие. Реакции дигидроксилирования проводят в различных растворителях или их смесях. Они включают как протонные, так и апротонные растворители, такие как вода, метанол, этанол,трет-бутанол, эфир, тетрагидрофуран, бензол,пиридин, ацетон и подобные. Эти реакции проводятся при температуре от -78 до 80 С и полностью завершаются в течение от 5 мин до 24 ч. Соединения формулы I, где R8 представляет собой NRcRd, a R9 - водород, получают с по 17 мощью обработки соответствующего предшественника, содержащего С 31-С 32 ненасыщенную связь, HNRcRd или HClHNRcRd в соответствующих протонных или апротонных растворителях, таких как метанол, этанол, бензол, толуол, диметилформамид, диоксан, вода и другие. Реакция облегчается при добавлении оснований,таких как пиридин, триэтиламин, карбонат натрия и другие, или кислот Льюиса, например,хлорид цинка, хлорид магния и подобные им. Реакции полностью завершаются в течение от 1 до 24 ч при температуре от 0 С до температуры флегмы раствора. Соединения формулы I, где R2 представляет собой ОН, a R1 - водород, получают из соответствующего кетона обработкой подходящего оксо аналога стандартными восстанавливающими агентами, включающими боргидрид натрия, боргидрид лития, литийалюминийгидрид,три-втор-бутилборгидрид калия, гидрид диизобутилалюминия, диборан оксазаборолидины и алкилбораны (как хиральные, так и не хиральные). Эти реакции проводятся с помощью методик, известных специалистам в этой области, в невосстанавливаемых растворителях, например,в метаноле, этаноле, диэтиловом эфире, тетрагидрофуране, гексане, пентане, метиленхлориде и других. Реакции полностью завершаются в течение от 5 мин до 24 ч в интервале температур от -78 до 60 С. Соединения формулы I, где R2 представляет собой ОН, R1 представляет собой Н и R10 представляет собой СН 2 ОН, получают путем реакции соответствующих карбоновой кислоты или эфира (например, где R10 представляет собой CO2H или CO2Ra) как описано выше,с более активными восстанавливающими агентами, включающими литийалюминийгидрид,боргидрид лития и другие. Соединения формулы I, где R2 и R1 вместе являются оксогруппой,и R10 представляет собой CH2OH, получают путем реакции соответствующей карбоновой кислоты (например, где R10 представляет собой СO2 Н) с менее активными восстанавливающими агентами, такими как диборан и подобные. Соединения формулы I, где R2 представляет собой ОН, а R1 отличен от Н, получают из соответствующего кетона обработкой соответствующего оксоаналога реагентом ГриньяраR1MgBr или с литиевым реагентом R1Li. Эти реакции проводятся известным способом, преимущественно в апротонных растворителях,таких как диэтиловый эфир, тетрагидрофуран,гексаны или пентаны. Реакции полностью завершаются в течение от 5 мин до 24 ч в интервале температур от -78 до 60 С. Соединения формулы I, где R10 представляет собой C(O)N(ORb)Rc или C(O)NRcRd, получают из соответствующей карбоновой кислоты,используя стандартные амид-образующие реагенты, известные специалистам. При проведении реакции используют как минимум один эквивалент нуклеофильного амина, HN(ORb)Rc 18 или HNRcRd, хотя желательно использовать от десяти до ста эквивалентов нуклеофильного амина. Амид-образующие реагенты включают дициклогексилкарбодиимид,1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид(пентаметилен)урония и иодид 2-хлор-1-метилпиридиния. Реакции амидирования могут протекать более легко при добавлении Nгидроксибензотриазола или N-гидрокси-7-азабензотриазола. При реакции амидирования обычно используют как минимум один эквивалент (хотя можно применять и несколько эквивалентов) основных аминов, таких как триэтиламин, диизопропилэтиламин, пиридин, N,Nдиметиламинопиридин и другие. Карбоксильная группа может быть активирована для образования амидной связи с помощью соответствующего хлорангидрида или смешанного ангидрида при известных условиях. Такие амидобразующие реакции проводят в апротонных растворителях, таких как метиленхлорид, тетрагидрофуран, диэтиловый эфир, диметилформамид, N-метилпирролидин и другие при температуре от -20 до 60 С и завершаются в течение от 15 мин до 24 ч. Соединения формулы I, где R10 представляет собой циано, получают обработкой соответствующего карбоксиамида обычными дегидратирующими реагентами, такими как паратолуолсульфонилхлорид, метансульфонилхлорид,ацетилхлорид, тионилхлорид, оксихлорид фосфора или боркатехолхлорид в апротонных растворителях, таких как метиленхлорид, хлороформ, тетрагидрофуран, бензол, толуол и другие. Реакции завершаются в течение от 15 мин до 24 ч при температурах от -78 С до температуры флегмы раствора. Соединения формулы I, где R10 представляет собой С(О)ORb, получают из соответствующей карбоновой кислоты, используя стандартные эфир-образующие реагенты, известные специалистам. При проведении реакции этерификации используют как минимум один эквивалент спирта, HORb, хотя лучше использовать от десяти до ста эквивалентов; этерификацию также проводят, используя спирт как растворитель. Этерифицирующие реагенты включают дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид(РуВrоР), дифенилфосфорилазид (DPPA), 2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HBTU), O-бензотриазол-1-илN,N,N',N'-бис(пентаметилен)уроний гексафторфосфат и 2-хлор-1-метилпиридиний йодид. Протекание эфир-образующих реакций можно облегчить добавлениемN-гидроксибензотриазола, N-гидрокси-7-азабензотриазола, 4(N,N-диметиламино)пиридина или 4-пирролидинопиридина. При проведении реакции обычно используют один эквивалент (хотя можно применять несколько эквивалентов) основных аминов, таких как триэтиламин, диизопропилэтиламин, пиридин и другие. Карбоксильные группы активируют для образования эфирной связи с помощью соответствующего хлорангидрида кислоты или смешанного ангидрида, используя известные специалистам условия. Эти эфир-образующие реакции проводят в апротонных растворителях, таких как метиленхлорид, тетрагидрофуран, диэтиловый эфир,диметилформамид, N-метилпирролидин и другие в интервале температур от -20 до 60 С и завершаются в течение от 15 мин до 24 ч. Соединения формулы I, где один или более из R2, R3, R4, R8 и R9 являются ORa, OCO2Rb илиCH2ORa, CH2OCO2Rb или CH2OC(O)NRcRd, получают, используя известные методы ацилирования, сульфонирования и алкилирования спиртов. Так, ацилирование проводят, используя такие реагенты, как ангидриды кислот, хлорангидриды кислот, хлорформиаты, карбомоилхлориды, изоцианаты и основные амины, согласно обычным методикам, известным специалистам. Сульфонирование проводят, используя сульфонилхлориды или ангидриды сульфоновой кислоты. Реакции ацилирования и сульфонирования проводят в апротонных растворителях, таких как метиленхлорид, хлороформ, пиридин,бензол, толуол и другие. Реакции ацилирования и сульфонирования завершаются в течение от 15 мин до 24 ч и протекают в интервале температур от -20 до 80 С. Степень ацилирования,сульфонирования и алкилирования зависит от количества используемых реагентов. Так, например, при использовании одного эквивалента ацилирующего реагента и одного эквивалента нодулиспоровой кислоты получается смесь продуктов, содержащая 4- и 20-ацилированную нодулиспоровую кислоту; такую смесь разделяют с помощью соответствующих методов, таких как хроматография. 20 Соединения формулы I, где один или более из R2, R3, R4, R8 и R9 являются ORa и/или R10 представляет собой CH2ORa, получают, используя известные специалистам методы алкилирования спиртов. Алкилирование проводят, используя реагенты, включающие галогениды IRa,BrRa, ClRa, диазореагенты N2Ra, трихлорацетимидаты RaOC(NH)ССl3, сульфаты RaOSO2Me,RaOSO2CF3 и другие. Протекание реакций ацилирования облегчается при добавлении кислот,оснований или кислот Льюиса, в зависимости от необходимости. Реакции проводят в апротонных растворителях, таких как метиленхлорид,хлороформ, тетрагидрофуран, бензол, толуол,диметилформамид, N-метилпирролидин, диметилсульфоксид, гексаметилфосфорамид и протекают в интервале температур от 0 С до температуры флегмы раствора в течение от 15 мин до 48 ч. Соединения формулы I, где R10 представляет собой NHC(O)ORb или C(O)NRcRd, получают из соответствующей карбоновой кислоты через соответствующий азид кислоты (VI) и изоцианат (VII), как показано на схеме II. Схема II В схеме II R8, R9, Rb, Rc, Rd и - - - имеют такие же значения, как те, которые определены формулой I. Таким образом, карбоновую кислоту (соединение V) обрабатывают дифенилфосфорил азидом, получая в результате азид кислоты (соединение VI). Нагревание соединения VI в апротонных растворителях, таких как бензол,толуол, диметилформамид и другие, приводит к перегруппировке, в результате которой образуется соединение VII, изоцианат. Соединение VII может реагировать в апротонных растворителях,таких как бензол, толуол, метиленхлорид, 1,2 дихлорэтилен, диметилформамид и другие, со спиртами RbOH, такими как метанол, этанол,бензиловый спирт, 2-триметилсилилэтанол,2,2,2-трихлорэтанол, метилгликолят, фенол и другие, с образованием соединения VIII, карбамата. Добавление одного или более эквивалентов основных аминов, таких как триэтиламин,диизопропилэтиламин, пиридин и другие, можно использовать для ускорения образования карбамата. Карбаматобразующие реакции про 21 текают при температуре от 0 до 100 С и завершаются в течение от 15 мин до 24 ч. Соединения формулы IX получают из соединений формулы VII взаимодействием с соответствующим амином HNRcRd в апротонном растворителе, например метиленхлориде, тетрагидрофуране, диметилформамиде, диметилсульфоксиде, бензоле, толуоле и других. Мочевинообразующие реакции протекают при температуре от 0 до 100 С и завершаются в течение от 15 мин до 24 ч. Настоящие соединения являются мощными эндо- и эктоантипаразитическими агентами против паразитов, особенно гельминтов, эктопаразитов, насекомых и акарид, поражающих человека, животных и растения, и, таким образом, применимы в лечении человека и животных, в сельском хозяйстве и подавлении паразитов, в домашней и коммерческой областях. Заболевание или группа заболеваний, описываемые обычно как гельминтозы, возникают в результате инфицирования организма животного паразитическими червями, известными как гельминты. Гельминтозы являются распространенной и серьезной экономической проблемой при разведении домашних животных, таких как свиньи, овцы, лошади, крупный рогатый скот,козы, собаки, кошки, рыбы, буйволы, верблюды,ламы, северные олени, лабораторные животные,пушные животные, животные, принадлежащие зоопаркам, экзотические животные и домашняя птица. Среди гельминтов группа червей, называемых нематодами, вызывают широко распространенные и зачастую серьезные инфекции у различных особей животных. Наиболее распространенными видами нематод, инфицирующих животных, как указано выше, являются Haemonchus, Trichostrongylus, Ostertagia, Nematodirus, Cooperia, Ascaris, Bunostomum, Oesophagostomum, Chabertia, Trichuris, Strongylus,Trichonema, Dictyocaulus, Capillaria, Habronema,Druschia, Heterakis, Toxocara, Ascaridia, Oxyuris,Ancylostoma, Uncinaria, Toxascaris и Parascaris. Некоторые из них, такие как Nematodirus, Cooperia и Oesophagostomum, поражают в основном кишечный тракт, тогда как другие, такие как Haemonchus и Ostertagia, более распространены в желудке, а такие как Dictuocaulus, обнаружены в легких. Кроме того, другие паразиты могут быть локализованы в других тканях и органах организма, например в сердце и кровеносных сосудах, подкожных тканях, лимфатических тканях и других. Паразитические инфекции, такие как гельминтозы, приводят к анемии,недоеданию, слабости, потери веса, серьезным повреждениям стенок кишечного тракта и других тканей и органов и, при отсутствии лечения,могут привести к смерти инфицированного организма. Соединения, представляемые данным изобретением, имеют активность против этих паразитов, и, кроме того, они также активны против Dirofilaria у собак и кошек, Nematospi 003579roides, Syphacia, Aspiculuris у кроликов, членистоногих эктопаразитов животных и птиц, таких как клещи, чесоточные вши, блохи, синие мухи,и других кусающих насекомых у домашних животных и птиц, таких как Tenophalides, Ixodes,Psoroptes and Hemotobia у овец Lucilia sp., кусающих насекомых и таких мигрирующих двукрылых личинок, как Hypoderma sp. у овец,Gastrophilus у лошадей и Cuterebra sp. у кроликов, и досаждающих мух, включая питающихся кровью мух и навозных мух. Настоящие соединения могут быть также использованы против паразитов, инфицирующих человека. Наиболее распространенными видами паразитов, поражающих желудочнокишечный тракт человека, являются Ancylostoma, Necator, Ascaris, Strongyloides, Trichinella,Capillaria, Trichuris и Enterobius. Другими важными с точки зрения медицины видами паразитов, обнаруженными в крови или других тканях и органах помимо желудочно-кишечного тракта,являются нитевидные черви, такие как Wuchereria, Brugia, Onchocerca и Loa, Dracunuculus, а также внекишечные стадии кишечных червейStrongyloides и Trichinella. Эти соединения могут также применяться против членистоногих,паразитирующих на человеке, кусающих насекомых и других двукрылых паразитов, вызывающих раздражение у человека. Представляемые соединения обладают также активностью против домашних вредителей, таких как тараканы, Blatella sp., платяная моль, Tineola sp., ковровые жуки, Attagenus sp.,домашняя муха Musca domestica, а также блохи,домашние клещи, термиты и муравьи. Эти соединения могут также применяться против насекомых, повреждающих хранящееся зерно, таких как Tribolium sp., Tenebrio sp. и сельскохозяйственные растения, такие как тля(Acyrthiosiphon sp.); против кочующих прямокрылых насекомых, таких как саранча и неполовозрелые стадии насекомых, живущие на тканях растений. Эти соединения могут применяться как нематоциды для контроля за почвенными нематодами и паразитами растений, таких какMeloidogyne sp., что важно для сельского хозяйства. Представляемые соединения могут быть полезны при обработке областей, зараженных гнездами муравья-соленопсиса парного. Эти соединения распыляются на зараженной паразитами территории в низких дозах в сочетании с приманкой, которая приносится обратно в гнездо. Вдобавок к непосредственному, но медленному атакующему токсическому влиянию на муравья-соленопсиса, эти соединения оказывают долгодействующее воздействие на гнезда путем стерилизации королевы, что эффективно разрушает гнезда. Соединения, представленные данным изобретением, могут быть введены в композиции,где активное соединение находится в однородной смеси с одним или более инертными ингре 23 диентами, и с необязательно включенными одним или более дополнительными активными ингредиентами. Эти соединения могут использоваться в любой композиции, известной квалифицированным специалистам в области введения препаратов людям и животным, для применения к растениям, а также для предварительного или полного контроля домашних насекомых, как в жилых помещениях, так и в коммерческих учреждениях. Для подавления внутренних и внешних паразитов у человека и животных могут использоваться рецептуры для орального применения, в жидком или твердом виде, парентеральная жидкость, импланты и формы депо инъекций. Для местного применения могут быть использованы раствор, спрей,порошок, дуст, полив, посыпание, распыляемая под давлением жидкость, шампуни, ошейники,повязки или упряжи. Для сельскохозяйственного предварительного или полного применения могут быть использованы жидкий спрей, порошки, пыль или приманки. Кроме того, против вредных мух, питающихся и размножающихся в испражнениях животных, могут использоваться формы препарата, проходящие через желудочно-кишечный тракт. В этом случае соединения капсулируются так, что остаток активного агента выделяется с испражнениями животного, после чего и оказывает действие на навозных мух и других членистоногих вредителей. Эти соединения могут быть введены орально в таких единичных дозированных формах, как капсулы, пилюли или таблетки, или в виде жидкости при использовании в качестве антигельминтного препарата у млекопитающих. Жидкий препарат обычно представляет собой раствор, суспензию или дисперсию активного ингредиента, как правило, в воде вместе с суспендирующим агентом, таким как бентонит и увлажняющим агентом или эксципиентом. Обычно жидкие препараты содержат также агенты, препятствующие пенообразованию. В состав жидких препаратов, как правило, входит от 0,001 до 0,5 мас.% активного соединения. Предпочтительная концентрация - от 0,01 до 0,1 мас.%. Капсулы и пилюли включают в себя активный ингредиент, смешанный с носителем,таким как крахмал, тальк, стеарат магния или дикальцийфосфат. Когда желательно вводить растворимое соединение в форме сухой, твердой единичной дозированной формы, то применяют капсулы,пилюли или таблетки, содержащие необходимое количество активного компонента. Эти дозированные формы приготовляют при помощи однородного и равномерного перемешивания активного ингредиента с соответствующими мелко измельченными разбавителями, наполнителями, дезинтегрирующими агентами и/или связующими, такими как крахмал, лактоза, тальк,стеарат магния, растительные смолы и тому подобное. Такие рецепты дозированных единиц 24 могут широко варьировать в зависимости от их общего веса и содержания антипаразитического агента, что, в свою очередь, определяется такими факторами, как тип животного-хозяина, подвергающегося лечению, степень тяжести и тип инфекции, а также вес организма-хозяина. Когда активное соединение вводят животному с пищей, его тщательно перемешивают с едой или используют в качестве добавки, или в форме шариков, или в виде жидкости, которую можно принимать после еды, или независимо от приема пищи. Альтернативно в качестве дозированных форм могут быть использованы жевательные формы. Альтернативно антипаразитические соединения этого изобретения могут быть введены животным парентерально, например, внутрь рубца жвачных животных, путем внутримышечных, внутрисосудистых, внутритрахейных, подкожных инъекций, в которых активный ингредиент растворен или диспергирован в жидкой среде для лекарства. При парентеральном введении активное вещество смешивается с подходящей средой,преимущественно различными растительными маслами, такими как масло земляного ореха,семян хлопка и другими. Для парентерального введения также используются среды для лекарств, включающие в себя солкеталь, глицеринформаль, пропиленгликоль, и водные парентеральные среды. Активное соединение или соединения растворяются или суспендируются в парентеральном составе для введения, такие составы обычно содержат от 0,0005 до 5 мас.% активного соединения. Агенты, представляемые данным изобретением, могут использоваться в лечении и предупреждении заболеваний, вызываемых паразитами, например, членистоногими паразитами,такими как клещи, вши, блохи и другие кусающие членистоногие, паразитирующие на домашних животных и птице. Эти вещества также могут использоваться в лечении и предупреждении заболеваний, вызываемых гельминтами. Они также эффективны при лечении паразитических заболеваний, встречающихся у других животных, включая человека. Оптимальное количество препарата, необходимое для получения наилучшего результата, зависит от применяемого соединения, от вида животного, подвергающегося лечению, а также от типа и степени тяжести паразитической инфекции или инвазии. Обычно хорошие результаты достигаются при оральном введении этих новых соединений в количестве от 0,001 до 500 мг/кг веса животного, эта доза может вводиться как одноразовая или разделяться на несколько приемов со сравнительно небольшими интервалами времени 1-5 дней. С предпочтительными соединениями этого изобретения замечательный эффект, оказываемый на паразитов, достигается при введении одноразовой дозы от 0,025 до 100 мг/кг веса животного. Повторные курсы лече 25 ния проводят, если требуется преодолевать реинфицирование, что зависит от вида паразита и применяемой хозяйственной техники. Повторные курсы лечения могут проводиться ежедневно, еженедельно, раз в две недели, раз в месяц,или в любых других комбинациях этих схем, в зависимости от потребностей. Методика введения этих веществ животным известна специалистам в области ветеринарии. Когда описываемые здесь соединения вводятся животным как компонент пищи или растворяются или суспендируются в питьевой воде,то составляются композиции, в которых активное соединение или соединения однородно диспергируются в инертном носителе или растворителе. Под инертным носителем подразумеваются те, которые не реагируют с антипаразитическим агентом, и те, которые при введении не приносят вреда животному. При введении с пищей желательно, чтобы носитель являлся ингредиентом рациона животного. Подходящие рецепты включают пищевые смеси и добавки, в которых активный ингредиент присутствует в относительно больших количествах, и которые подходят для непосредственно питания животных, или для добавления к еде, либо сразу, либо после предварительного разбавления или смешивания. Типичные носители или растворители, используемые для таких композиций, включают, например, высушенные зерна (distillers dried grains), кукурузную муку,цитрусовую муку, ферментационные остатки,раковины земляных устриц, пшеничные отруби,растворимые ингредиенты патоки, муку из стержня початка кукурузы, молотые съедобные бобы, соевые крупы, толченный известняк и тому подобное. Активные соединения однородно диспергируются в носителе методами дробления, перемешивания, перемалывания, переворачивания (tumbling). Составы, содержащие от 0,005 до 2,0 мас.% активного вещества, применяются для предварительно приготовленных смесей, добавляемых в пищу. Пищевые добавки, которые непосредственно идут в пищу животным, содержат от 0,0002 до 0,3 мас.% активного соединения. Такие добавки вносятся в пищу животных в таких количествах, чтобы обеспечить конечную концентрацию активного соединения, необходимую для лечения и контроля паразитических заболеваний. Хотя требуемые концентрации активного соединения варьируют в зависимости от факторов, упомянутых ранее, также как от конкретно применяемого вещества, соединения этого изобретения обычно употребляются в концентрациях от 0,00001 до 0,002% в пище для того, чтобы достигнуть желаемого антипаразитического результата. В применении соединений этого изобретения могут быть приготовлены и использованы индивидуальные вещества в форме составов. Альтернативно могут использоваться смеси ин 003579 26 дивидуальных соединений, или они могут комбинироваться с другими веществами, не имеющими отношения к данному изобретению. Соединения данного изобретения также используются в борьбе с сельскохозяйственными вредителями, которые наносят ущерб урожаю в процессе его выращивания или хранения. В применении этих соединений для защиты растущего или хранящегося урожая от сельскохозяйственных вредителей используются такие известные методы, как спрей, распыление,эмульсии и тому подобное. Соединения данного изобретения могут вводиться одновременно с антигельминтными агентами. Эти агенты предположительно включают в себя соединения, относящиеся к классам авермектинов и милбемицинов, такие как ивермектин, авермектин, абамектин, эмамектин, эпринамектин, дорамектин, фулладектин, моксидектин, интерцептор и немадектин, но не ограничиваются ими. Кроме того, антигельминтные агенты включают в себя бензимидазолы, такие как тиабендазол, камбендазол, парбендазол,оксибендазол, мебендазол, флюбендазол, фенбендазол, оксфендазол, альбендазол, циклобендазол, фебантел, тиофанат и тому подобные. Кроме того, антигельминтные агенты включают в себя имидазотиазолы и тетрагидропиримидины, такие как тетрамизоллевамизол, бутамизол,пирантел, памоат, аоксантел или морантел. Соединения этого изобретения могут вводиться вместе с фипронилом. Соединения этого изобретения могут вводиться вместе с регуляторами роста насекомых,обладающих способностью ингибировать линьку, такими как люфенурон и тому подобные. Соединения этого изобретения могут вводиться вместе с агонистами экдизона, такими как тебуфенозид и подобные, которые вызывают преждевременную линьку и прекращение питания. Вводимые совместно вещества даются путями и в дозах, которые обычно используются для этих соединений. В настоящее изобретение также включены фармацевтические составы, содержащие соединение данного изобретения в сочетании с антигельминтным агентом, фипронилом, регулятором роста насекомых или агонистом экдизона. Следующие примеры помогают более полно иллюстрировать настоящее изобретение и не должны рассматриваться как ограничивающие его объем каким бы то ни было образом. Пример 1. Метил нодулиспорат. К 5,4 мг нодулиспоровой кислоты в 5 мл метанола при комнатной температуре добавляют 0,5 мл 10% триметилсилилдиазометана в гексане. Через 15 мин добавляют три капли ледяной уксусной кислоты и раствор разбавляют лиофилизированным (высушенным вымораживанием) бензолом. Чистый метиловый эфир получают последующей очисткой с помощью об 27 ращенно-фазовой ВЭЖХ, используя в качестве элюента 85:15 метанол:вода; продукт характеризуют с помощью методов 1 Н ЯМР и массспектрометрии. Пример 2. Метил 29,30-дигидро-20,30 оксанодулиспорат. К 0,8 мг соединения В в 1 мл метанола при комнатной температуре добавляют 0,2 мл 1 М триметилсилилдиазометана в гексане. Через 5 мин добавляют 0,1 мл ледяной уксусной кислоты, раствор перемешивают в течение 3 мин и добавляют 2 мл насыщенного NаНСО 3 (возможно пенообразование). Раствор экстрагируют этилацетатом, высушивают с помощью Na2SO4,фильтруют и концентрируют в вакууме. Концентрат очищают с помощью обращеннофазовой ВЭЖХ, используя в качестве элюента 85:15 метанол:вода; очищенный продукт характеризуют с помощью метода 1H ЯМР. Пример 3. Метил 31-гидрокси-20,30-окса 29,30,31,32-тетрагидронодулиспорат. К 1 мг соединения С в 1 мл метанола при комнатной температуре добавляют 0,2 мл 1 М триметилсилилдиазометана в гексане. Через 5 мин добавляют 0,1 мл ледяной уксусной кислоты, раствор перемешивают в течение 3 мин и добавляют 2 мл насыщенного NаНСО 3 (возможно пенообразование). Раствор экстрагируют этилацетатом, высушивают с помощью Na2SO4,фильтруют и концентрируют в вакууме. Концентрат очищают с помощью обращеннофазовой ВЭЖХ, используя в качестве элюента 17,5:82,5 вода:метанол; очищенный продукт характеризуют с помощью метода 1H ЯМР. Пример 4. Этил нодулиспорат. К раствору, содержащему 20 мг нодулиспоровой кислоты в 2 мл метиленхлорида, при комнатной температуре добавили 0,11 мл этанола, 0,008 мл диизопропилэтиламина, 1 мгN,N-диметиламинопиридина (ДМАП) и затем 13 мг реагента ВОР. Через 50 ч при комнатной температуре раствор наливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор и экстрагируют метиленхлоридом. Объединенные органические слои высушивают над сульфатом натрия, твердые частицы удаляют фильтрацией и раствор концентрируют при пониженном давлении. Чистый продукт получают в результате препаративной ТСХ на силикагеле (одна пластинка 1000 мкм), используя в качестве элюента 1/3 ацетон/гексан. Очищенный продукт(15 мг) характеризуют с помощью протонного ЯМР и масс-спектрометрии (m/z: 708,4 (М+1. Общую процедуру, описанную в примере 4, повторяли, используя спирты, перечисленные в табл. 1, приведенной ниже, с целью получения соответствующих производных нодулиспоровой кислоты. Эти соединения были охарактеризованы методами протонного ЯМР и/или массспектрометрии (m/z приведено для (М+1), если не обозначено иначе). 28 Таблица 1 Эфирные производные нодулиспоровой кислоты Пример 28. Общая процедура для приготовления дополнительных эфирных производных соединений А, В и С. К раствору, содержащему 20 мг соединения А, В или С в 2 мл метиленхлорида, при комнатной температуре добавляют 110 мг спирта, выбранного из табл. 2, 0,008 мл диизопропилэтиламина и 1 мг ДМАП с последующим добавлением 13 мг реагента ВОР. После интервала времени от 1 ч до 3 дней при комнатной температуре раствор наливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор и экстрагируют метиленхлоридом. Объединенные органические слои высушивают над сульфатом натрия, твердые частицы удаляют фильтрацией. Раствор концентрируют при пониженном давлении. Чистый продукт получают с помощью последующей флэш-хроматографии или препаративной ТСХ на силикагеле, или обращеннофазовой жидкостной хроматографии. Очищен 29 ный продукт характеризуют с помощью протонного ЯМР и/или масс-спектрометрии. Таблица 2 Спирты для получения дополнительных эфирных производных соединений А, В и С 3-(метилтио)пропанол, 1 Н,1H-пентафторпропанол, 2-пентин-1-ол, 3-пентин-1-ол, 4 пентин-1-ол, пропанол, 2-гидроксиэтанол, метилгликолят, гликолевая кислота, 4-(метокси) бензиловый спирт, 3-(диметиламино)пропанол,3-(4-морфолинил)пропанол, 2-(гидроксиметил) пиридин,1-(2-гидроксиэтил)пиперазин,2 гидрокси-3-фенилпропанол, 2-(гидроксиэтокси) этанол,4-(2-гидроксиэтил)морфолин,1-(2 гидроксиэтил)пиперидин,3-(гидроксиметил) пиридин,1-(гидроксиметил)пиримидин,3 гидроксипропанол, 4-гидроксибутанол, 1-(2 гидроксиэтил)-4-метилпиперазин, 2-(2-гидроксиэтил)пиридин, 1-(3-гидроксипропил)-2-пирролидинон, 1-(2-гидроксиэтил)пирролидин, 1-(3 гидроксипропил)имидазол, 2-гидроксибутанол,4-(гидроксиметил)пиридин, 2-гидроксипиразин,гидроксиасетонитрил, 6-гидроксигексанол, 4-(3 гидроксипропил)морфолин, 2-гидрокси-, пропанол, 2-гидроксипентанол, 1-гидрокси-1-(гидроксиметил)циклопентан, 2-(метилтио)этанол, 3 гидрокси-1,2,4-триазин,2-амино-3-гидроксипиридин, 2-(этилтио)этанол, гликольамид, 2 гидрокси-2-(гидроксиметил)пропанол, транс-2 гидроксициклогексанол,2-гидрокси-4-метилфенол, 2-(гидроксиметил)пиридин, 1-гидроксиметил-1-циклогексанол, 2-гидроксигексанол, 2 гидрокси-1-метоксипропан, 2-(гидроксиметил) имидазол, 3-гидроксиметилпиразол, транс-4 гидроксициклогексанол, N-ацетил-4-гидроксибутиламин, гидроксициклопентан, 2-(метилсульфонил)этанол, 2-(метилсульфинил)этанол,4-(2-гидроксиэтил)фенол,2-(2-гидроксиэтил) фенол,2-гидрокси-3-метилбутанол,3-(Nацетиламино)пропанол, 3-(диэтиламино)пропанол, 3-(диметиламино)пропанол, аллиловый спирт, 2-(диметиламино)этанол, глицерин, 2 метоксиэтанол, 2-(N-ацетиламино)этанол, D(гидроксиметил)пирролидин,3-гидроксипирролидин, 2-(гидроксиэтил)бензол, 2-гидроксиэтил-1-метилпирролидин, 2-гидрокси-2-метилпропанол, циклопропанол, циклогексанол, 3 гидроксипропанол, 3-этоксипропанол, пропаргиловый спирт, этил гликолят, 2-фтороэтанол, 3(додецилокси)пропанол, 4-гидроксибутанол, 5 гидроксипентанол, 2-(диметиламино)этанол, 2(2-гидроксиэтокси)этанол, 1-(2-гидроксиэтил) имидазолон,2-(2-гидроксиэтокси)этиламин,изопропанол, 2,2,2-трифторэтанол, 4-нитробензиловый спирт, 3-нитробензиловый спирт, 2 метоксиэтанол, 4-(гидроксиэтил)фенол, 4-(3 гидроксипропил)-1-сульфонамидобензол, D,L-2(гидроксиметил)тетрагидрофуран, метил лактат,5-гидроксигексановая кислота, метиловый эфир,3-метоксипропанол, 3-гидроксипиперидин, пентанол, 4-гидроксигептан, 4-(2-гидроксиэтил)1,2-диметоксибензол,4-гидроксиметил-1,2 003579 30 метилендиоксибензол, 4-(трифторметил)бензиловый спирт, 4-(метилтио)фенол, 2-(гидроксиметил)фуран,5-гидроксипентан-2-он,2 гидрокси-3-метилбутановая кислота, метиловый эфир, 2-гидрокси-3-фенилпропановая кислота,этиловый эфир, 1-(гидроксиметил)нафталин, 3 фенилпропанол,3,3-диметилбутанол,3-(2 гидроксиэтил)фторбензол, 4-гидрокси-1-карбоэтоксипиперидин, (R)-2-(гидроксиметил)тетрагидрофуран, (S)-2-(гидроксиметил)тетрагидрофуран, (S)-2-гидрокси-3-метилбутанол, (R)-2 гидрокси-3-метилбутанол, (S)-2-гидроксипропанол, 3,4-дигидрокситетрагидрофуран, 1,1,1,3,3,3-гексафторизопропанол, 2-фторбензиловый спирт, трет-бутанол, 2-гидрокси-1-фенилэтанол,изобутанол, 4-(2-гидроксиэтил)фторбензол, 3(гидроксиметил)толуол,2-хлорбензиловый спирт, 2,4-дихлорбензиловый спирт, вторбутанол, R-2-гидроксипропанол, бутанол, 4 хлорбензиловый спирт, 2-этоксиэтанол, 2-(2 гидроксиэтил)хлорбензол, 2-(N-метил-N-фениламино)этанол,3-(трифторметил)бензиловый спирт, 2-(трифторметил)бензиловый спирт, 2(гидроксиэтил)тетрагидрофуран,4-фенилбутанол, нониловый спирт, 2,6-дифторбензиловый спирт, 2-(гидроксиметил)тиофен, 2-(гидроксиэтил)-1-метилпиррол, 2-гидрокси-3-метилбутан,4-гидроксиметил-1,2-дихлорбензол, 3-(метиламино)пропанол, 1,4-дифторбензиловый спирт,(2-гидроксиметил)фуран. Пример 29. N-метил нодулиспорамид и 26 эпи-N-метил нодулиспорамид. К 1 мг нодулиспоровой кислоты в 1 мл диметилформамида при комнатной температуре добавляют 2 мг HClH2NMe, 2 мг N-гидроксибензотриазола и 10 мкл диизопропилэтиламина,к которому добавлено 2 мг EDCHCl. Через 30 мин реакцию гасят, добавляя метанол и 1 каплю ледяной уксусной кислоты. Раствор разбавляют солевым раствором, экстрагируют этилацетатом, высушивают с помощью Na2SO4,фильтруют и концентрируют при пониженном давлении. Продукты реакции частично очищаются с помощью препаративной ТСХ (10,5 мм пластинка с силикагелем), используя 6:3:1EtOAc/ацетон/метанол. N-метил нодулиспорамид и 26-эпи-N-метил нодулиспорамид очищают до гомогенного состояния с помощью обращенно-фазовой ВЭЖХ, используя 60-минутный линейный градиент от 25:75 до 100:0 ацетонитрил/вода. Очищенный продукт характеризуют методами протонного ЯМР и массспектрометрии. Пример 30. N-(н-пропил)нодулиспорамид. К 0,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 2 капли диизопропилэтиламина, 5 мг Н 2NСН 2 СН 2 СН 3, 3 мг N-гидроксилбензотриазола и 3 мг РуВОР. Через 30 мин при комнатной температуре реакцию гасят, добавляя 2 мл насыщенного NаНСО 3, экстрагируют этилацета 31 том, высушивают (Na2SO4), фильтруют и концентрируют под вакуумом. Сырой остаток предварительно очищают методом флэшхроматографии на силикагеле, используя в качестве элюента 0,5:5:95 NH4OH/MeOH/CHCl3, с последующей очисткой методом обращеннофазовой ВЭЖХ, используя в качестве элюента 20:80 вода/метанол. Продукт характеризуют методом 1H ЯМР. Пример 31. 4-Морфолинилнодулиспорамид. К 1,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина, 1 каплю морфолина и 2 мг N-гидроксибензотриазола. Затем добавляют 2 мг РуВОР. Через 1 ч при комнатной температуре раствор фильтруют через 2-дюймовый слой силикагеля в пипетке без обработки, используя этилацетат в качестве элюента. Полученный раствор концентрируют при пониженном давлении и затем очищают методом обращенно-фазовой ВЭЖХ, используя в качестве элюента 20:80 вода:МеОН. Продукт характеризуют методом 1H ЯМР. Пример 32. N-(2-гидроксиэтил)нодулиспорамид. К 0,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 2 капли диизопропилэтиламина, 5 мгH2NCH2CH2OH, 3 мг N-гидроксибензотриазола и 3 мг РуВОР. Через 30 мин при комнатной температуре реакцию гасят, добавляя 2 мл насыщенного NаНСО 3, экстрагируют этилацетатом, высушивают (Na2SO4), фильтруют и концентрируют под вакуумом. Сырой остаток очищают методом обращенно-фазовой ВЭЖХ, используя в качестве элюента 20:80 вода:метанол и продукт характеризуют методом 1H ЯМР и масс-спектрометрии. Пример 33.N-(1-метоксикарбонил-2 гидроксиэтил)нодулиспорамид. К 1,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 2 капли диизопропилэтиламина, 5 мгHClH2NCH(CH2OH)CO2Me, 3 мг N-гидроксибензотриазола и 3 мг РуВОР. Через 30 мин при комнатной температуре реакцию гасят, добавляя 2 мл насыщенного NаНСО 3, экстрагируют этилацетатом, высушивают (Na2SO4), фильтруют и концентрируют под вакуумом. Чистый продукт получают в результате последующей очистки на обращенно-фазовой ВЭЖХ, используя в качестве элюента 20:80 вода/метанол и продукт характеризуют методом 1H ЯМР. Пример 34. Нодулиспорамид и 31-амино 31,32-дигидронодулиспорамид. К 1,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина, 1 каплю NH4OH и 2 мг N-гидроксибензотриазола. К этому добавляют 3 мг РуВОР и раствор перемешивают 15 мин. Реакцию гасят, добавляя 2 мл 32 насыщенного NaHCO3, экстрагируют этилацетатом, высушивают (Na2SO4), фильтруют и концентрируют под вакуумом. Чистый нодулиспорамид получают в результате препаративной ТСХ (10,5 мм силикагеля), используя в качестве элюента 1:9 метанол/хлороформ. Нодулиспорамид характеризуют методом 1H ЯМР и масс-спектрометрии. В результате этой реакции также получают 31-амино-31,32 дигидронодулиспорамид. Пример 35. N-(метоксикарбонилметил) нодулиспорамид. К 1,5 мг нодулиспоровой кислоты в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина, 2 мг N-гидроксибензотриазола и 2 мг HClH2NCH2CO2Me. К этому раствору добавляют 2 мг РуВОР. Через 30 мин реакцию гасят, добавляя 2 мл насыщенного NаНСО 3, экстрагируют этилацетатом, высушивают, используя Na2SO4,фильтруют и концентрируют при пониженном давлении. Чистый продукт получают в результате последующей очистки методом обращеннофазовой ВЭЖХ, используя в качестве элюента 17,5:82,5 вода/метанол. Продукт характеризуют методом 1H ЯМР и масс-спектрометрии. Пример 36. N,N-тетраметиленнодулиспорамид. К 125 мг нодулиспоровой кислоты в 10 мл метиленхлорида при 0 С добавляют 0,18 мл диизопропилэтиламина, 0,15 мл пирролидина и затем 108 мг РуВОР. Через 5 мин раствор нагревают до комнатной температуры. Через 1,5 ч раствор выливают в 25 мл насыщенногоNаНСО 3, экстрагируют метиленхлоридом, высушивают, используя Na2SO4, фильтруют и концентрируют при пониженном давлении. ЧистыйN,N-тетраметиленнодулиспорамид получают в результате последующей очистки методом обращенно-фазовой ВЭЖХ, используя в качестве элюента 50:50 ацетонитрил/вода (изократно в течение 10 мин) с последующим 30-минутным линейным градиентом до 75:25 ацетонитрил/вода. Чистый продукт (26 мг) характеризуют методом 1 Н ЯМР и масс-спектрометрии. Пример 37. N-этил 29,30-дигидро-20,30 оксанодулиспорамид. К 1 мг соединения В в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина,1 каплю СН 3 СН 2NН 2, 3 мг N-гидроксибензотриазола и 3 мг РуВОР. Через 15 мин реакцию гасят, добавляя 2 мл насыщенного NaHCO3, экстрагируют этилацетатом, высушивают с помощью Na2SO4,фильтруют и концентрируют под вакуумом. Остаток очищают методом обращенно-фазовой ВЭЖХ, используя в качестве элюента 15:85 вода/метанол и чистый продукт характеризуют методом 1H ЯМР. Пример 38. N-(2-гидроксиэтил)-29,30 дигидро-20,30-оксанодулиспорамид. 33 К 0,7 мг соединения В в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина,1 каплюNa2SO4, фильтруют и концентрируют под вакуумом. Остаток очищают методом обращеннофазовой ВЭЖХ, используя в качестве элюента в начале 20:80 вода/метанол и затем 15:85 вода/метанол, очищенный продукт характеризуют методом 1H ЯМР. Пример 39. N-(2-гидроксиэтил)-31-гидрокси-20,30-оксо-29,30,31,32-тетрагидронодулиспорамид. К 1 мг соединения С в 1 мл метиленхлорида при комнатной температуре добавляют 1 каплю диизопропилэтиламина,1 каплюNa2SO4, фильтруют и концентрируют под вакуумом. Остаток очищают методом обращеннофазовой ВЭЖХ, используя в качестве элюента в начале 20:80 вода/метанол, и очищенный продукт характеризуют методом 1 Н ЯМР. Пример 40. N-трет-бутилнодулиспорамид. К раствору 30 мг нодулиспоровой кислоты в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг N-гидроксибензотриазола, затем добавляют 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и затем добавляют 0,05 мл трет-бутиламина. Раствор оставляют перемешиваться на ночь при 4 С и затем выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор, экстрагируют метиленхлоридом и объединенные органические слои высушивают над сульфатом натрия. Твердые частицы удаляют фильтрацией и раствор упаривают досуха при пониженном давлении. Осадок предварительно очищают методом препаративной ТСХ на силикагеле (одна 1000-микронная пластинка), используя 1/2 ацетон/гексан как элюент. Дополнительная очистка с помощью ВЭЖХ (6/4 ацетонитрил/вода в течении 15 мин, затем в течение 45 мин линейный градиент до 7/3 ацетонитрил/вода) дает чистый продукт (17 мг). Продукт характеризуют методом протонного ЯМР и масс-спектрометрии(m/z: 735,7 (М+1. Общую процедуру, описанную в примере 40, повторяли, используя амины, перечисленные в табл. 3, приведенной ниже, с целью получения соответствующих монозамещенных нодулиспорамидов. Эти соединения были охарактеризованы методами протонного ЯМР и/или массспектрометрии (m/z приведено для (М+1), если не обозначено иначе). 34 Таблица 3 Монозамещенные алифатические производные нодулиспорамида Общую процедуру, описанную в примере 40, повторяли, используя амины, перечисленные в табл. 4, приведенной ниже, с целью получения соответствующих производных нодулиспорамидов. Эти соединения были охарактеризованы методами протонного ЯМР и/или массспектрометрии (m/z приведено для (М+1), если не обозначено иначе). Таблица 4 Производные нодулиспорамида Пример 303. Общая процедура получения дополнительных амидных производных нодулиспоровой кислоты. К раствору 30 мг нодулиспоровой кислоты в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг N-гидроксибензотриазола, затем 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и добавляют 50 мг амина, выбранного из табл. 5. Раствор оставляют перемешиваться на ночь при 4 С и затем выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор, экстрагируют метиленхлоридом и высушивают объединенные органические слои над сульфатом натрия. Твердые частицы удаляют фильтрацией и упаривают раствор досуха при пониженном давлении. Чистый продукт получают в результате флэшхроматографии или препаративной ТСХ на силикагеле или методом обращенно-фазовой жидкостной хроматографии. Очищенный продукт может быть охарактеризован методами протонного ЯМР и масс-спектрометрии. Таблица 5 Амины для получения дополнительных производных нодулиспорамида 42 метилсульфонамид,изопропилсульфонамид,этилсульфонамид, бензилсульфонамид, вторбутилсульфонамид, N-метилэтилсульфонамид,N,1,1-триметилпропаргиламин,N-этил-1,1 диметилпропаргиламин,N,1-диметилпропаргиламин, 1-метилпропаргиламин, 1-трифторметилпропаргиламин,N,1,1-триметилпропаргиламин,N-этил-1,1-диметилпропаргиламин,N,1-диметилпропаргиламин,N,1,1-триметилпропаргиламин, 1-метилпропаргиламин, 1 трифторметилпропаргиламин,N-этилпропаргиламин, N-(2-метоксиэтил)пропаргиламин, 1 амино-2-пентин, 1-амино-3-пентин, 1-амино-4 пентин, 1-метиламино-2-пентин, 1-метиламино 3-пентин, 1-метиламино-4-пентин, 1-этиламино 4-пентин, 1-трифторметиламино-2-пентин, 1 трифторметиламино-3-пентин, 1-трифторметиламино-4-пентин,N-(2-метоксиэтил)-2-амино 1,1-диметил-2-бутин, 1-амино-2-бутин, 1-амино 3-бутин, N-метиламино-2-бутин, N-метиламино 3-бутин, 1-этиламино-3-бутин, 2-(аминометил) диоксан, 2-(2-аминоэтил)диоксан, 2-(3-аминопропил)диоксан, 2-(2-аминопропил)диоксан, 2(метиламинометил)диоксан,2-(1-аминоэтил) диоксан, 2-аминометил-2 Н-тетрагидропиран, 2(2-аминоэтил)-2 Н-тетрагидропиран, 2-(3-аминопропил)-2 Н-тетрагидропиран,2-(2-аминопропил)-2 Н-тетрагидропиран,2-(2-аминоэтил)-5 этил-2 Н-тетрагидропиран, 2-метиламинометил 2 Н-тетрагидропиран, 2-(1-аминоэтил)-2 Н-тетрагидропиран, 2-(2-аминопропил)тетрагидрофуран, 2-аминометил-5-этилтетрагидрофуран, 2 метиламинометилтетрагидрофуран,2-(этиламинометил)тетрагидрофуран, 2-(1-аминоэтил) тетрагидрофуран, 4-(метоксиметил)бензиламин,4-(2-метоксиэтил)бензиламин, 4-(этоксиметил) бензиламин, 4-(ацетоксиоксиметил)бензиламин,3-(диметиламинометил)бензиламин, 4-(сульфонамидометил)бензиламин,2-хлор-6-фторбензиламин, 3-хлор-4-фторбензиламин, 2-хлор 4-фторбензиламин, 3,5-дифторбензиламин, 2,4 дифторбензиламин, пентафторбензиламин, 4 метокси-2,3,5,6-тетрафторбензиламин, 4-(метил) бензиламин, бензиламин, 4-(этил)бензиламин,4-(этокси)бензиламин,4-(изопропил)бензиламин, 4-(изобутил)бензиламин, 4-(изопропропокси)бензиламин, 4-(изобутокси)бензиламин,4-(аллил)бензиламин, 4-(аллилокси)бензиламин,4-(3,3,1,1-тетрафтораллилокси)бензиламин, 4(трифторметокси)бензиламин, 4-(2,2,2-трифторэтокси)бензиламин,3,4-этилендиоксибензиламин, 4-метоксиметил-2-хлорфенетиламин, 4-(2 метоксиэтил)фенетиламин,4-(этоксиметил) фенетиламин, 4-(ацетоксиоксиметил)фенетиламин, 3-(диметиламинометил)фенетиламин, 1 фенил-2,2,2-трифторэтиламин,4-(трифторметокси)анилин, 4-метоксианилин, 4-этоксианилин, 3-хлор-4-фторанилин, 4-хлор-2-фторанилин, 4-(ацетокси)анилин, 4-(бутокси)анилин, 3 хлоранилин, 4-(метилтио)анилин, 5-(аминометил)бензофуран,5-(метиламинометил)бензофуран,4-(1-аминоэтил)бензофуран,5-(2 43 аминоэтил)бензофуран,5-аминометил-2,3 дигидробензофуран,5-метиламинометил-2,3 дигидробензофуран, 4-1-аминоэтил-2,3-дигидробензофуран,5-2-аминоэтил-2,3-дигидробензофуран, 5-аминометил-2 Н-тетрагидробензопиран, 5-метиламинометил-2 Н-тетрагидробензопиран,4-1-аминоэтил-2 Н-тетрагидробензопиран,5-2-аминоэтил-2 Н-тетрагидробензопиран,5-аминометил-2 Н-тетрагидробензопиран, 5-метиламинометил-2 Н-тетрагидробензопиран,4-(1-аминоэтил)-2 Н-тетрагидробензопиран, 5-(2-аминоэтил)-2 Н-тетрагидробензопиран, 5-аминометилбензо-1,4-диоксан, 5-метиламинометилбензо-1,4-диоксан, 4-1-аминоэтилбензо-1,4-диоксан,5-2-аминоэтилбензо-1,4 диоксан, 5-аминометилбензо-1,4-диоксан, 5 метиламинометилбензо-1,4-диоксан,4-(1 аминоэтил)бензо-1,4-диоксан, 5-(2-аминоэтил) бензо-1,4-диоксан, 3-амино-5-метокситиофен, 2 амино-5-хлортиофен, 2-(2-аминоэтил)тиофен, 2(3-аминопропил)тиофен,3-(3-аминопропил) тиофен, 3-(2-метиламиноэтил)тиофен, 2-хлор-3(2-аминоэтил)тиофен, 2-аминоэтил-4-метокситиофен, 2-амино-3-этилтиофен, 2-(метиламинометил)тиофен, 3-(аминометил)тиофен, 2-(2 аминоэтил)-4-метокситиофен, 1-(аминометил) тетразол, 1-(1-аминоэтил)тетразол, 1-(3-аминопропил)тетразол, 5-амино-3-метилизоксазол, 3 аминопиридин,4-аминометилтиазол,2-(2 аминоэтил)пиразин, 2-(1-аминоэтил)имидазол,2-(аминометил)изоксазол, 3-(2-аминоэтил)пиразол, 2-(аминометил)-1,3,4-тиадиазол. Пример 304. Общая процедура синтеза амидных производных соединений В и С. К раствору 30 мг соединения В или С в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг N-гидроксибензотриазола, затем 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и добавляют 50 мг амина, выбранного из табл. 6. Оставляют перемешиваться на ночь при 4 С и затем при комнатной температуре на 2 ч. Раствор выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор. Раствор экстрагируют метиленхлоридом и высушивают объединенные органические слои над сульфатом натрия. Твердые частицы удаляют фильтрацией и концентрируют раствор при пониженном давлении. Чистый продукт получают в результате флэшхроматографии или препаративной ТСХ, или методом обращенно-фазовой жидкостной хроматографии. Очищенный продукт может быть охарактеризован методами протонного ЯМР и/или масс-спектрометрии. Таблица 6 Дополнительные амидные производные соединений В и С 2-(2-гидроксиэтокси)этиламин,4-(2 аминоэтил)морфолин, 1-(2-аминоэтил)пиперидин, 6-амино-2-метилгептан-2-ол, 3-(аминометил)пиридин, 3-аминопропанол, 4-аминобутанол, 5-аминопентанол, 2-(2-аминоэтил) 47 К 1,3 мг метил нодулиспората в 2 мл 1:1 бензол/вода при комнатной температуре добавляют 1 каплю Адогена 464 (Aldrich ChemicalCo., Milwaukee, Wisconsin), 10 мг NаНСО 3 и 10 мг Na2S2O4. Раствор нагревают до 80 С в течение 10 мин. Реакцию охлаждают до комнатной температуры, экстрагируют этилацетатом, высушивают, используя Na2SO4, фильтруют и концентрируют при пониженном давлении. Очищенный продукт получают в результате последующей очистки методом препаративной ТСХEtOAc/гексан как элюент. Продукт характеризуют методом протонного ЯМР. Пример 306. N-(2-тетрагидрофуранилметил)-29,30,31,32-тетрагидронодулиспорамид. К 40 мг N-(2-тетрагидрофуранилметил) нодулиспорамида в 2 мл метанола при комнатной температуре добавляют 20 мг 10% Pd на угле. Устанавливают давление водорода в 1 атм и поддерживают его в течение 2 ч с помощью баллона. После удаления катализатора фильтрацией через целит с метанолом в качестве элюента раствор концентрируют при пониженном давлении и 3 мг чистого продукта получают в результате последующей препаративной ТСХ на силикагеле (две 1000-микронных пластинки). Продукт характеризуют методами ЯМР и массспектрометрии (m/z: 767(M+1. Пример 307. N-этил-N-метил-29,30,31,32 тетрагидронодулиспорамид. К 23 мг N-этил-N-метилтетрагидронодулиспорамида в 2 мл метанола при комнатной температуре добавляют 40 мг 10% Pd на угле. Устанавливают давление водорода в 1 атм и поддерживают его в течение 3 ч с помощью баллона. После удаления катализатора фильтрацией через целит с метанолом в качестве элюента раствор концентрируют при пониженном давлении и 9,5 мг восстановленного продукта получают в результате последующей жидкостной хроматографией среднего давления (93/7 метанол/вода в качестве элюента). Продукт характеризуют методами протонного ЯМР и массспектрометрии (m/z: 723(М+1. Пример 308. Общая процедура получения производных 29,30,31,32-тетрагидронодулиспоровой кислоты. 50 мг нодулиспорамида или аналога нодулиспората, полученного из аминов, перечисленных в табл. 6, или спиртов, перечисленных в табл. 2, помещают в 4 мл метанола при комнатной температуре. Гидрирование проводят с помощью 10% Pd на угле при давлении водорода 1 атм в течение от 15 мин до 24 ч. Катализатор удаляют фильтрацией через слой целита, используя метанол в качестве элюента. Раствор концентрируют при пониженном давлении, затем очищают на силикагеле как методами флэшхроматографии и препаративной ТСХ, так и с помощью обращенно-фазовой жидкостной хро 003579 48 матографии,получая соответствующее 29,30,31,32-тетрагидропроизводное. Альтернативно, 50 мг нодулиспоровой кислоты помещают в 4 мл метанола при комнатной температуре. Добавляют от 1 до 50 мг 10%Pd на угле и устанавливают давление водорода,используя баллон, в течение от 15 мин до 24 ч. Катализатор впоследствии удаляют фильтрацией через слой целита, используя метанол в качестве элюента. Раствор концентрируют при пониженном давлении, затем очищают на силикагеле как методами флэш-хроматографии и препаративной ТСХ, так и с помощью обращеннофазовой жидкостной хроматографии, получая соответственно 29,30,31,32-тетрагидронодулиспоровую кислоту. Полученная таким образом 29,30,31,32-тетрагидронодулиспоровая кислота может взаимодействовать с аминами из табл. 6 или со спиртами, перечисленными в табл. 2, с образованием желаемых 29,30,31,32 тетрагидроамидных и эфирных производных. Пример 309. 29,30-Дигидронодулиспоровая кислота. К 1 мг нодулиспоровой кислоты в 1 мл дихлорметана добавляют 1,6 мг катализатора Вилкинсона. Смесь оставляют перемешиваться под давлением водорода на ночь (18 ч). Разделение на ВЭЖХ проводят, используя колонку с обращенной фазой Magnum 9-ODS и градиент от 85:15 метанол:вода до 100% метанола. Растворитель упаривают и очищенный продукт характеризуют методом 1H ЯМР. Пример 311. Общая процедура получения производных 29,30-дигидронодулиспоровой кислоты. К раствору 30 мг 29,30-дигидронодулиспоровой кислоты в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг N-гидроксибензотриазола, затем 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и добавляют 50 мг амина или спирта,выбранного из табл. 6. Оставляют перемешиваться на ночь при 4 С и затем при комнатной температуре на 2 ч. Раствор выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор. Раствор экстрагируют метиленхлоридом и высушивают объединенные органические слои над сульфатом натрия. Твердые частицы удаляют фильтрацией и концентрируют раствор при пониженном давлении. Чистый продукт получают в результате флэш-хроматографии,препаративной ТСХ, или методом обращеннофазовой жидкостной хроматографии. Продукты могут быть охарактеризованы методами протонного ЯМР и/или масс-спектрометрии. Пример 312. Общая процедура получения производных 31,32-дигидросоединения В. 50 мг эфирного или амидного аналога, полученного из соединения В и аминов, перечисленных в табл. 6, или спиртов, перечисленных в табл. 2, помещают в 4 мл метанола при комнатной температуре. Гидрирование 31,32-двойной 49 связи проводят с помощью 10% Pd, на угле при давлении водорода 1 атм в течение от 15 мин до 24 ч. Катализатор удаляют фильтрацией через слой целита, используя метанол в качестве элюента. Раствор концентрируют при пониженном давлении, затем очищают на силикагеле как методами флэш-хроматографии и препаративной ТСХ, так и с помощью обращенно-фазовой жидкостной хроматографии, получая целевое 31,32-дигидропроизводное соединения В. Альтернативно, 50 мг соединения В помещают в 4 мл метанола при комнатной температуре. Добавляют от 1 до 50 мг 10% Pd на угле и устанавливают атмосферное давление водорода на время от 15 мин до 24 ч. Катализатор может быть впоследствии удален фильтрацией через слой целита, используя метанол в качестве элюента. Раствор концентрируют при пониженном давлении, затем очищают на силикагеле как методами флэш-хроматографии и препаративной ТСХ, так и с помощью обращенно-фазовой жидкостной хроматографии, получая соответствующее 31,32-дигидропроизводное соединения В. Полученное таким образом 31,32-дигидропроизводное соединения В может взаимодействовать с аминами, перечисленными в табл. 6 и спиртами, перечисленными в табл. 2, образуя искомые амиды и эфиры 31,32-дигидросоединения В. Пример 313. Нодулиспорил азид. К 1 мг нодулиспоровой кислоты в 0,2 мл хлороформа добавляют 50 мкл триэтиламина и 20 мкл дифенилфосфорил азида. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч перед очисткой на силикагеле(препаративная ТСХ, 10,5 мм силикагель) с использованием 1:1 EtOAc/гексан, в результате получают 0,8 мг чистого продукта, который характеризуют методами 1H ЯМР и массспектрометрии. Пример 314. 29,30-Дигидро-20,30-оксанодулиспорил азид. К 1 мг 29,30-дигидро-20,30-оксанодулиспоровой кислоты в 0,2 мл хлороформа добавляют 0,05 мл триэтиламина и 20 мкл дифенилфосфорил азида. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч перед очисткой методами флэшхроматографии или препаративной ТСХ на силикагеле. Полученный продукт характеризуют методами протонного ЯМР и массспектрометрии. Пример 315. 29,30-Дигидро-20,30-окса-32 дезкарбокси-32-изоцианатонодулиспоровая кислота. Нагревают 20 мг 29,30-дигидро-20,30-оксанодулиспорилазида в 8 мл толуола до 90 С в течение 2 ч. Растворитель упаривают и полученный продукт характеризуют методами протонного ЯМР и масс-спектрометрии. Пример 316. 32-Дезкарбокси-32-изоцианатонодулиспоровая кислота. 50 Раствор 54 мг нодулиспорил азида в толуоле нагревают при 90 С в течение 2 ч. Затем растворитель упаривают и получают изоцианат с количественным выходом, полученный продукт характеризуют методами 1 Н ЯМР и массспектрометрии. Пример 317. 32-Дезкарбокси-32-(1-карбометоксиамино)нодулиспоровая кислота. К 1,3 мг изоцианата из примера 313 в 1 мл метанола добавляют 20 мкл триэтиламина. Реакционную смесь нагревают 45 мин при 75 С,полученный карбамат (0,7 мг) выделяют с помощью препаративной ТСХ на силикагеле (10,5 мм) и характеризуют методами 1H ЯМР и масс-спектрометрии. Пример 318. 32-Дезкарбокси-32-(1-(3 бензил)карбамид)нодулиспоровая кислота. К 1 мг изоцианата, приготовленного по методике примера 313, в 0,2 мл толуола добавляют 40 мкл бензиламина. Реакционную смесь перемешивают при 20 С в течение 20 мин, полученное производное мочевины (0,2 мг) выделяют с помощью препаративной ТСХ (10,5 мм силикагель, 1:3 гексан:ЕtOАс) и характеризуют методами 1H ЯМР и масс-спектрометрии. Общую процедуру, описанную в примере 318, повторяют, используя соответствующий амин, для получения карбамидных соединений,указанных в табл. 7. Таблица 7 Производные 32-дезкарбокси-32(карбамид)нодулиспоровой кислоты Пример Карбамид 319NНС(O)NНСН 2 СН 2-пиперазинил Пример 337. Общая процедура синтеза производных 32-дезкарбокси-32-[карбамид]или 32-дезкарбокси-32-[карбамат]нодулиспоровой кислоты. К 1 мг изоцианата, приготовленного по методике примера 313, в 0,2 мл толуола добавляют 40 мг амина, выбранного из табл. 6, или спирта,выбранного из табл. 2. Реакционную смесь перемешивают при 20 С в течение интервала времени от 20 мин до 24 ч. Полученный карбамид или карбамат можно выделить в чистом виде методом флэш-хроматографии, препаративной ТСХ или обращенно-фазовой жидкостной хроматографии. Очищенные продукты можно охарактеризовать методами протонного ЯМР и масс-спектрометрии. 51 Пример 338. 29,30-Дигидро-20,30-окса-32 дезкарбокси-32-изоцианатонодулиспоровая кислота. Раствор 54 мг 29,30-дигидро-20,30-оксанодулиспорил азида в толуоле нагревают при 90 С в течение 2 ч. Растворитель упаривают и полученный изоцианат характеризуют методами 1 Н ЯМР и масс-спектрометрии. Пример 339. Общая процедура синтеза производных 29,30-дигидро-20,30-окса-32 дезкарбокси-32-[карбамид]- или 29,30-дигидро 20,30-окса-32-дезкарбокси-32-[карбамат]нодулиспоровой кислоты. К 1 мг 29,30-дигидро-20,30-окса-32 дезкарбокси-32-изоцианата нодулиспоровой кислоты в 0,2 мл толуола добавляют 40 мг амина, выбранного из табл. 6, или спирта, выбранного из табл. 2. Смесь перемешивают при 20 С в течение интервала времени от 20 мин до 24 ч. Полученный карбамид или карбамат можно выделить в чистом виде с помощью методов флэшхроматографии, препаративной ТСХ или обращенно-фазовой жидкостной хроматографии. Очищенные продукты можно охарактеризовать методами протонного ЯМР и массспектрометрии. Пример 340. 31-Гидрокси-20,30-окса 29,30,31,32-тетрагидронодулиспорил азид. К 1 мг 31-гидрокси-20,30-окса-29,30,31,32 тетрагидронодулиспоровой кислоты в 0,2 мл хлороформа добавляют 0,05 мл триэтиламина и 0,02 мл дифенилфосфорил азида. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем выделяют чистый продукт методами флэш-хроматографии или препаративной ТСХ на силикагеле. Полученный продукт характеризуют методами протонного ЯМР и масс-спектрометрии. Пример 341. 31-Гидрокси-20,30-окса 29,30,31,32-тетрагидро-32-дезкарбокси-32-изоцианатонодулиспоровая кислота. Раствор 54 мг 31-гидрокси-20,30-окса 29,30,31,32-тетрагидронодулиспорил азида в толуоле нагревают при 90 С в течение 2 ч. Растворитель упаривают и полученный изоцианат характеризуют методами 1H ЯМР и массспектрометрии. Пример 342. Общая процедура синтеза производных 31-гидрокси-20,30-окса-32-дезкарбокси-32-[карбамид]-29,30,31,32-тетрагидроили 31-гидрокси-20,30-окса-32-дезкарбокси-32[карбамат]-29,30,31,32-тетрагидронодулиспоровой кислоты. К 1 мг 31-гидрокси-20,30-окса-29,30,31,32 тетрагидро-32-дезкарбокси-32-изоцианата нодулиспоровой кислоты в 0,2 мл толуола добавляют 40 мг амина, выбранного из табл. 6, или спирта, выбранного из табл. 2. Смесь перемешивают при 20 С в течение интервала времени от 20 мин до 24 ч. Полученный карбамид или карбамат можно выделить в чистом виде с помощью методов флэш-хроматографии, препара 003579 52 тивной ТСХ или обращенно-фазовой жидкостной хроматографии. Очищенные продукты можно охарактеризовать методами протонного ЯМР и масс-спектрометрии. Пример 343. 1-Гидроксинодулиспоровая кислота. К 2,8 мг нодулиспоровой кислоты в 0,8 мл ТГФ при 0 С в атмосфере аргона добавляют 100 мкл 2,0 М боргидрида лития в ТГФ. Через 5 мин реакцию гасят добавлением 400 мкл 2 н. НСl и продукты экстрагируют EtOAc. Экстракты высушивают над сульфатом натрия и концентрируют в вакууме. Остаток очищают методом препаративной ТСХ (10,5 мм пластинка силикагеля,95:5:0,5 дихлорметан:метанол: уксусная кислота), получая в результате 0,8 мг изомера А и 0,6 мг изомера В, охарактеризованных с помощью 1H ЯМР и масс-спектрометрии. Пример 344. Метиловый эфир 1-гидроксинодулиспоровой кислоты. К 0,5 мг метил нодулиспората в 1 мл метанола при 0 С добавляют 1 мг боргидрида натрия. Через 10 мин при 0 С раствор подвергают очистке методом обращенно-фазовой ВЭЖХ без предварительной обработки, используя системы растворителей от 30:70 до 15:85 (25-минутный линейный градиент) вода/метанол и получая в результате чистый продукт. Продукт характеризуют методом 1H ЯМР. Пример 345. N-этил-N-метил-1-гидроксинодулиспорамид. К 30 мг N-этил-N-метилнодулиспорамида в 2 мл тетрагидрофурана при комнатной температуре добавляют 1 мл диизобутилалюминий гидрида (1,0 М раствор в гексане). После выдерживания в течение трех дней при комнатной температуре реакцию гасят добавлением уксусной кислоты. Раствор промывают насыщенным раствором бикарбоната натрия и солевым раствором, высушивают над сульфатом натрия и упаривают досуха. Остаток очищают методом флэш-хроматографии на силикагеле, используя 1/1 ацетон/гексан как элюент. Очищенный продукт характеризуют методами протонного ЯМР и масс-спектрометрии (m/z: 723(М+1. Пример 346. 1-Гидроксисоединение В или С. К 5 мг соединения В или С в 2 мл метанола при 0 С в атмосфере аргона добавляют 5 мг боргидрида натрия. После 10 мин инкубации при 0 С продукты экстрагируют метиленхлоридом. Высушивают объединенные экстракты над сульфатом натрия и концентрируют раствор под вакуумом. Твердый остаток очищают методами флэш-хроматографии, препаративной ТСХ или обращенно-фазовой жидкостной хроматографией, получая 1-гидроксисоединение В или С как смесь стереоизомеров, которая может быть охарактеризована методами протонного ЯМР и масс-спектрометрии. 53 Пример 347. Общая процедура синтеза 1 гидроксиамидных и эфирных производных соединений А, В или С. К раствору 30 мг 1-гидроксисоединения А,В или С в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг Nгидроксибензотриазола, затем 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и добавляют 50 мг амина, выбранного из табл. 6,или спирта, выбранного из табл. 2. Оставляют перемешиваться на ночь при 4 С и затем при комнатной температуре на 2 ч. Раствор выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой раствор. Раствор экстрагируют метиленхлоридом и высушивают объединенные органические слои над сульфатом натрия. Твердые частицы удаляют фильтрацией и концентрируют раствор при пониженном давлении. Чистый продукт получают в результате последующей очистки методами флэшхроматографии, препаративной ТСХ, или методом обращенно-фазовой жидкостной хроматографии. Продукты могут быть охарактеризованы методами протонного ЯМР и/или массспектрометрии. Пример 348. 1-Гидрокси-1-метилнодулиспоровая кислота. К 0,5 мл 1,4 М метилмагнийбромида в ТГФ/толуол при 0 С добавляют 1 мг нодулиспоровой кислоты в 0,6 мл ТГФ. Через 10 мин реакцию гасят добавлением 2 н. НСl и экстрагируют EtOAc. Препаративная ТСХ (10,5 мм пластинка силикагеля, 95:5:0,5 дихлорметан:метанол:уксусная кислота) дает 0,8 мг продукта, охарактеризованного 1H ЯМР. Пример 349. Метиловый эфир 1-гидрокси 1-метилнодулиспоровой кислоты. К 1,2 мг метил нодулиспората в 1 мл ТГФ в атмосфере аргона при -78 С добавляют 0,5 мл 1,4 М метилмагнийбромида в ТГФ/толуол. Смесь перемешивают в течение 15 мин перед добавлением водного раствора хлорида аммония. Смесь экстрагируют EtOAc. С помощью препаративной ТСХ (10,5 мм пластинки силикагеля, 2:3 гексан:EtOAc) получают 1 мг указанного в заголовке продукта, охарактеризованного 1H ЯМР. Пример 350. 1-Гидрокси-1-алкил или 1 гидрокси-1-арил - соединения А, В или С. К 0,5 мл раствора 1,0 М реагента Гриньяра,выбранного из табл. 8, в 1/1 ТГФ/толуол при 0 С добавляют 1 мг соединения А, В или С, растворенного в 0,6 мл ТГФ. После 10 мин выдерживания при 0 С реакцию гасят 2 н. НСl и экстрагируют метиленхлоридом. Объединенные органические слои высушивают над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Чистый продукт получают в результате последующей флэш-хроматографии,препаративной ТСХ или обращенно-фазовой жидкостной хроматографии. Очищенные про 003579 54 дукты могут быть охарактеризованы методами протонного ЯМР или масс-спектрометрии. Таблица 8 Реагенты Гриньяра Метилмагнийбромид Этилмагнийхлорид Изопропил магний бромид Фенилмагнийиодид Бензилмагнийбромид Аллилмагнийбромид Пропаргилмагний бромид Ацетилидмагнийбромид Пример 351. 1-Гидрокси-32-дезкарбокси 32-гидроксиметилнодулиспоровая кислота. К 1,2 мг метил нодулиспората в 1,2 мл тетрагидрофурана при -78 С добавляют 20 мкл 1 М литий алюминий гидрида в тетрагидрофуране. Желтый цвет быстро исчезает. Через 10 мин реакцию гасят при -78 С, добавляя по каплям насыщенный Na2SO4. Раствор экстрагируют этилацетатом, высушивают над Na2SO4, фильтруют и концентрируют при пониженном давлении. Чистый продукт получают в результате последующей препаративной ТСХ (10,25 мм пластинка силикагеля),используя 85:15EtOAc/гексан в качестве элюента. Очищенный продукт характеризуют методом 1H ЯМР. Пример 352. 31,32-Дигидро-31,32-дигидроксинодулиспоровая кислота и альдегид (соединение IV). К 3 мг нодулиспоровой кислоты добавляют 1 мл метанола и 100 мкл 0,04 М ОsO4 в третбутаноле, стабилизированном 1% трет-бутил гидропероксидом. После 50 мин инкубации при комнатной температуре к реакционной смеси добавляют 400 мг сульфита натрия в 2 мл воды и продолжают перемешивать еще 20 мин. Затем смесь экстрагируют EtOAc и сырой остаток очищают с помощью препаративной ТСХ (10,5 мм пластинка силикагеля), элюируя смесью 95:5:0,5 дихлорметан:метанол:уксусная кислота,получая в результате соединение, указанное в заголовке (1 мг изомера А и 0,6 мг изомера В) и 0,5 мг альдегида, производного нодулиспоровой кислоты (соединение IV), каждое соединение характеризуют методом 1H ЯМР. Пример 353. Общая процедура получения эфирных и амидных производных 31,32 дигидро-31,32-дигидроксинодулиспоровой кислоты. К раствору 30 мг 31,32-дигидро-31,32 дигидроксинодулиспоровой кислоты в 3 мл метиленхлорида при 0 С добавляют 0,03 мл триэтиламина и 12 мг N-гидроксибензотриазола,затем 28 мг реагента ВОР. Раствор перемешивают в течение 10 мин и добавляют 50 мг амина из перечисленных в табл. 6 или спирта из перечисленных в табл. 2. Оставляют перемешиваться на ночь при 4 С и затем выливают в смесь 1/1 насыщенный бикарбонат натрия/солевой рас 55 твор, экстрагируют метиленхлоридом и высушивают объединенные органические слои над сульфатом натрия. Твердые частицы удаляют фильтрацией и концентрируют раствор при пониженном давлении. Чистый продукт получают в результате очистки методами флэшхроматографии или препаративной ТСХ на силикагеле или методом обращенно-фазовой жидкостной хроматографии. Очищенный продукт может быть охарактеризован методами протонного ЯМР и/или масс-спектрометрии. Пример 354. 4,20-бис-О-ацетил-нодулиспоровая кислота. К 1,2 мг нодулиспоровой кислоты добавляют 300 мкл уксусного ангидрида и 100 мкл пиридина. Реакционную смесь нагревают при 65 С в течение 1 ч и избыток растворителя удаляют под вакуумом. Твердый остаток очищают с помощью препаративной ТСХ на силикагеле,элюируя системой растворителей 95:5 дихлорметан:метанол, и получают в результате 1,2 мг бис-ацетата, который характеризуют методом 1H ЯМР. Пример 355. N-этил-N-метил-20-диметиламинокарбонилоксинодулиспорамид. К 30 мг N-этил-N-метилнодулиспорамида в 3 мл метиленхлорида при 4 С добавляют 60 мг карбонилдиимидазола. После инкубации в течение трех дней при 4 С добавляют 1 мл диметиламина (25% в воде) и раствор перемешивают в течение еще 4 дней. Раствор выливают в солевой раствор, экстрагируют метиленхлоридом,высушивают над сульфатом натрия и упаривают досуха. Продукт частично очищают методом флэш-хроматографии на силикагеле, используя в качестве элюента систему растворителей 4/6 ацетон/гексан. В результате дополнительной очистки с помощью жидкостной хроматографии среднего давления (92/8 метанол/вода как элюент) получают 18 мг чистого продукта. Очищенный продукт характеризуют методами протонного ЯМР и масс-спектрометрии (m/z: 792(М+1. Пример 356. N-этил-N-метил-1-дезоксо-1 метоксиминонодулиспорамид. К раствору 30 мг N-этил-N-метилнодулиспорамида и 30 мг гидрохлорида метоксиламина в 4 мл этанола добавляют 0,1 мл пиридина. Раствор нагревают при температуре флегмы в течение 2 дней, охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в метиленхлориде, промывают солевым раствором,сушат над сульфатом натрия и концентрируют досуха. Остаток очищают методом препаративной ТСХ на силикагеле (две 1000-микронные пластинки), используя в качестве элюента систему растворителей 1/9 метанол/метиленхлорид. Очищенные продукты (26 мг), представляющие собой смесь Е- и Z-метоксимов,характеризуют методами протонного ЯМР и масс-спектрометрии (m/z: 732(М+1 - 1H2O. 56 Пример 357. N-этил-N-метил-1-дезоксо-1 оксиминонодулиспорамид. К раствору 20 мг N-этил-N-метилнодулиспорамида и 20 мг гидрохлорида гидроксиламина в 2 мл этанола при комнатной температуре добавляют 0,02 мл пиридина. Раствор нагревают при температуре флегмы в течение 15 ч, охлаждают до комнатной температуры и разбавляют метиленхлоридом. Раствор промывают солевым раствором, сушат над сульфатом натрия и концентрируют досуха. Остаток очищают методом препаративной ТСХ на силикагеле (две 1000-микронные пластинки), используя в качестве элюента систему растворителей 1/9 метанол/метиленхлорид, и получают в результате 17 мг целевого продукта в виде смеси изомеров Е- и Z-оксимов. Очищенные продукты характеризуют методами протонного ЯМР и масс-спектрометрии (m/z: 718(М+1 - 1 Н 2 О. Пример 358. Общая процедура получения 1-оксиминопроизводных соединений А, В и С. К раствору 20 мг соединения А, В или С и 20 мг производного гидроксиламина, выбранного из табл. 9, в 2 мл этанола при комнатной температуре добавляют 0,02 мл пиридина. Раствор нагревают до температуры флегмы в течение интервала времени от 15 мин до 24 ч, затем охлаждают до комнатной температуры и разбавляют метиленхлоридом. Раствор промывают солевым раствором, органические слои высушивают над сульфатом натрия и концентрируют при пониженном давлении. Чистый продукт получают в результате последующей очистки методами флэш-хроматографии или препаративной ТСХ на силикагеле, или обращенно-фазовой жидкостной хроматографии в виде смеси изомеров Е- и Z-оксимов. Очищенные продукты характеризуют методами протонного ЯМР и масс-спектрометрии. Подобным образом, амидные и эфирные производные соединений А, В и С, полученные из аминов, перечисленных в табл. 6, и спиртов, перечисленных в табл. 2, могут использоваться вместо соединений А, В и С в вышеописанной процедуре. Таблица 9 Оксимы ГидроксиламинO-изобутилгидроксиламин О-(2-хлор-6-фторбензил)гидроксиламин О-(4-метоксибензил)гидроксиламин Пример 359. Общая процедура получения гидразиновых производных соединений А, В и С. 57 К раствору 20 мг соединения А, В или С и 20 мг гидразина, выбранного из табл. 10, в 2 мл этанола при комнатной температуре добавляют 0,02 мл пиридина. Раствор нагревают до температуры флегмы в течение интервала времени от 15 мин до 24 ч, затем охлаждают до комнатной температуры и разбавляют метиленхлоридом. Раствор промывают солевым раствором, органические слои высушивают над сульфатом натрия и концентрируют при пониженном давлении. Чистый продукт получают в результате последующей очистки методами флэшхроматографии или препаративной ТСХ на силикагеле, или обращенно-фазовой жидкостной хроматографии в виде смеси изомеров Е- и Zоксимов. Очищенные продукты характеризуют методами протонного ЯМР и массспектрометрии. Подобным образом, амидные и эфирные производные соединений А, В и С,полученные из аминов, перечисленных в табл. 6, и спиртов, перечисленных в табл. 2, могут использоваться вместо соединений А, В и С в вышеописанной процедуре. Таблица 10 Гидразины МетилгидразинN,N-диметилгидразин трет-Бутилгидразин 4-Аминоморфолин 1-Аминопирролидин 1-Аминопиперидин Фенилгидразин 4-(Метил)фенилгидразин Бензилгидразин Этил гидразиноацетат 2-(Фтор)фенилгидразин 1-Амино-4-метилпиперазин 1-Амино-4-(2-гидроксиэтил)пиперазин 2,5-Дихлорфенилгидразин Метансульфонил гидразид Изопропилсульфонил гидразид Бензилсульфонил гидразид Пример 360. N-этил-N-метил-26-эпинодулиспорамид. К раствору 5 мг N-этил-N-метилнодулиспорамида в 2 мл ацетонитрила добавляют 1 мл триэтиламина. Раствор нагревают при температуре флегмы в течение 20 ч. Раствор концентрируют досуха при пониженном давлении. Остаток очищают методом флэшхроматографии на силикагеле, используя в качестве элюента систему растворителей 1/9 метанол/метиленхлорид, и получают в результате целевой продукт, который характеризуют методом протонного ЯМР. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR5 и R6 вместе представляют собой -О-;- - - представляет собой простую или двойную связь;(7) необязательно замещенный гетероцикл,содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb (1)-(7) представлены группами, независимо выбранными из(vii) гидрокси C1-C6 алкокси,(viii) амино C1-C6 алкокси,(ix) циано,(х) меркапто,(xi) C1-C6 алкил-S(O)m,(xii) С 3-С 7 циклоалкила, необязательно замещенного группами в количестве от 1 до 4,независимо выбранных из Re,(xiii) галогена,(xiv) C1-C5 алканоилокси,(xv) C(O)NRgRh,(xvi) NRgRh,(xvii) 5-9-членного гетероцикла, который может быть насыщенным или частично ненасыщенным, содержащего от 1 до 4 гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенного группами от 1 до 5, независимо выбранных из Re,(xviii) необязательно замещенного арила,где заместителями арила являются 1,2 метилендиокси или группы, независимо выбранные из Re,(xix) C1-C5 перфторалкила,(хх) C1-C6 алкоксикарбонила;Rc и Rd независимо выбраны из Rb; илиRc и Rd вместе с азотом, к которому они присоединены, образуют от 3- до 10-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, который необязательно замещен группами, независимо выбранными из Rg, гидрокси;(1) водород,(2) C1-С 6 алкил, необязательно замещенный такими группами, как гидрокси, амино,(3) арил, необязательно замещенный галогеном, 1,2-метилендиокси, C1-C7 алкокси, C1C7 алкилом или C1-С 3 перфторалкилом,(4) арил C1-C6 алкил, где арил необязательно замещен C1-С 3 перфторалкилом или 1,2 метилендиокси,(5) C1-C5 алкоксикарбонил,(6) C1-C5 алканоил,(7) арил C1-C5 алкоксикарбонил,(8) аминокарбонил,(9) C1-C5 моно- или диалкиламинокарбонил, или Rg и Rh вместе с азотом, к которому они присоединены, образуют от 3 до 7-членный цикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, S(O)m, и N, необязательно замещенный группами, независимо выбранными из Re;(1) водород,(2) C1-С 3 перфторалкил,(3) C1-C6 алкил,(4) необязательно замещенный арил С 0 С 6 алкил, где заместители на ариле независимо выбраны из галогена, C1-C6 алкила, C1-C6 алкокси и гидрокси;v равно 0-3; или их фармацевтически приемлемые соли, исключая нодулиспоровую кислоту, 29,30-дигидро 20,30-оксанодулиспоровую кислоту и 31 гидрокси-20,30-окса-29,30,31,32-тетрагидронодулиспоровую кислоту,при условии, что арил означает моно- и бициклическое ароматическое и гетероароматическое кольцо, содержащее от 0 до 5 гетероатомов, независимо выбранные из азота, кислорода и серы, или бензоконденсированный циклоалкил, бензоконденсированный циклоалкенил и бензоконденсированные гетероциклические группы. 2. Соединение по п.1, где(1) водород,(2) необязательно замещенный арил,(3) необязательно замещенный C1-C7 алкил,(4) необязательно замещенный С 3-С 7 алкенил,(5) необязательно замещенный С 3-С 7 алкинил,(6) необязательно замещенный С 5-С 7 циклоалкил,(7) необязательно замещенный гетероцикл,содержащий от 5 до 10 атомов, из которых от 1 до 4 гетероатомов независимо выбраны из кислорода, серы и азота; и где заместители на группах Rb представлены группами, независимо выбранными из
МПК / Метки
МПК: A61P 33/00, C07D 405/06, A61K 31/403
Метки: кислоты, производные, нодулиспоровой
Код ссылки
<a href="https://eas.patents.su/30-3579-proizvodnye-nodulisporovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные нодулиспоровой кислоты</a>
Предыдущий патент: Способ полимеризации в газовой фазе
Следующий патент: Фармацевтическая композиция
Случайный патент: Устройство и способ для дезинфекции воды












