Конъюгаты пирролбензодиазепина направленного действия
Номер патента: 24118
Опубликовано: 31.08.2016
Авторы: Сентер Питер, Ховард Филип Вилсон, Бурке Патрик, Джефри Скот
Формула / Реферат
1. Конъюгат, имеющий формулу I
L-(LU-D)p (I)
или его фармацевтически приемлемая соль или сольват,
где L представляет собой белок, полипептид или пептид, который специфично связывается с молекулой-мишенью,
LU представляет собой линкер, который имеет формулу Ia
-A1-L1- (Ia)
где -А1- выбран из
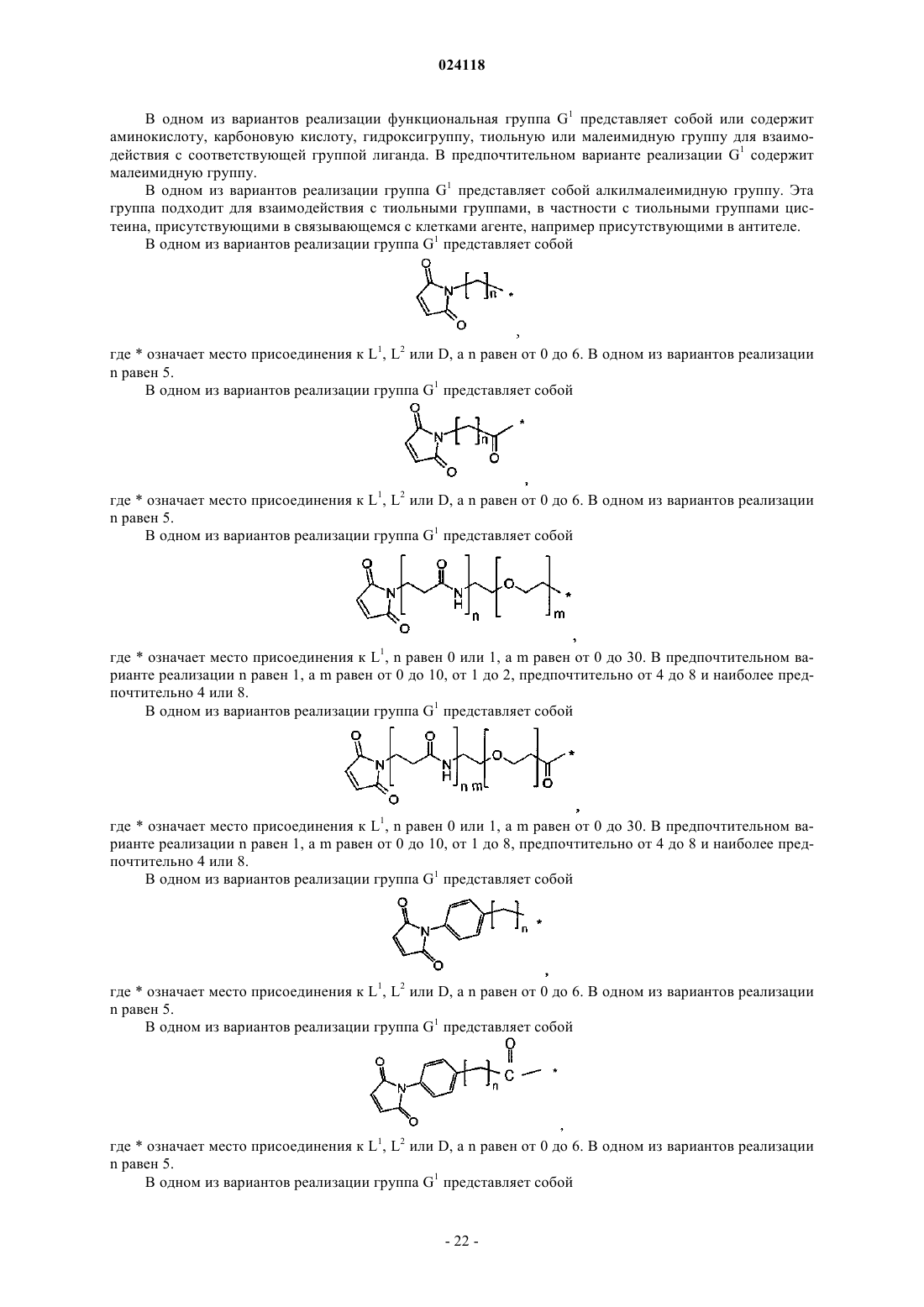
где * означает место присоединения к L1, волнистая линия означает место присоединения к L, а n равен от 0 до 6;
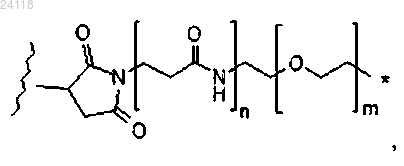
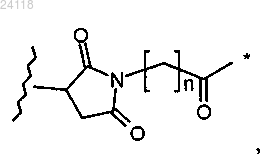
где * означает место присоединения к L1, волнистая линия означает место присоединения к L, n равен 0 или 1, a m равен от 0 до 30; и

где * означает место присоединения к L1, волнистая линия означает место присоединения к L, n равен 0 или 1, a m равен от 0 до 30;
L1- представляет собой последовательность аминокислот, расщепляемую под действием ферментов, присутствующих в клетке-мишени;
или LU представляет собой линкер, который имеет формулу X
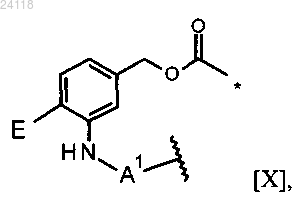
где * означает место присоединения к D, волнистая линия означает место присоединения к L;
-А1- выбран из
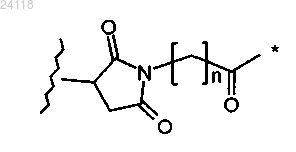
где * означает место присоединения к NH, волнистая линия означает место присоединения к L, а n равен от 0 до 6;
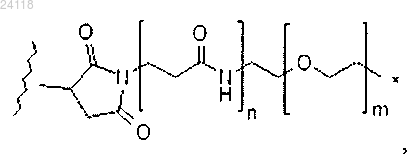
где * означает место присоединения к NH, волнистая линия означает место присоединения к L, n равен 0 или 1, a m равен от 0 до 30;
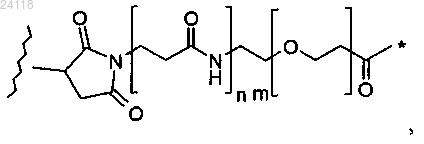
где * означает место присоединения к NH, волнистая линия означает место присоединения к L, n равен 0 или 1, a m равен от 0 до 30;

где * означает место присоединения к NH, волнистая линия означает место присоединения к L;
Е представляет собой остаток глюкуроновой кислоты;
p равен от 1 до 20,
D представляет собой фрагмент лекарственного соединения, содержащий димер пирролбензодиазепина (ПБД), имеющий следующую формулу II:
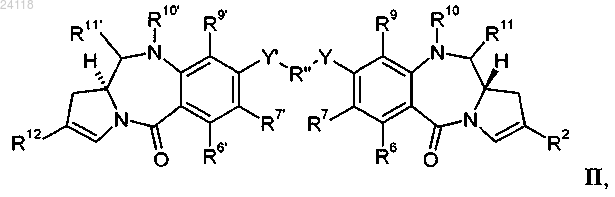
где R2 имеет формулу III
где А представляет собой фенильную группу, X представляет собой -NH, Q1 представляет собой простую связь, a Q2 выбран из простой связи и -O-(СН2)n-, где n равен от 1 до 3;
R12 представляет собой фенильную или тиофенильную группу, замещенную одним заместителем, выбранным из группы, состоящей из простой эфирной группы, диметиламинопропилокси и пиперазинила;
R6, R6', R9 и R9' представляют собой Н;
R7 и R7' независимо представляют собой С1-4 алкилоксигруппу;
R10 и R11 образуют азот-углеродную двойную связь между атомами азота и углерода, к которым они присоединены;
R" представляет собой С3-7 алкиленовую группу и
Y и Y' представляют собой О;
R10' и R11' являются такими же, как R10 и R11.
2. Конъюгат по п.1, отличающийся тем, что Q2 представляет собой простую связь.
3. Конъюгат по п.1, отличающийся тем, что Q2 представляет собой -О-(СН2)n-, где n равен от 1 до 3.
4. Конъюгат по любому из пп.1-3, отличающийся тем, что R7', R10' и R11' являются такими же, как R7, R10 и R11 соответственно.
5. Конъюгат по любому из пп.1-4, отличающийся тем, что линкер (LU) имеет формулу Ia.
6. Конъюгат по п.1, отличающийся тем, что А1 представляет собой
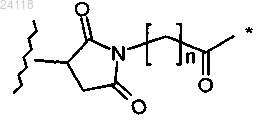
где * означает место присоединения к L1, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6.
7. Конъюгат по п.6, отличающийся тем, что n равен 5.
8. Конъюгат по п.1, отличающийся тем, что L1 представляет собой дипептид.
9. Конъюгат по п.8, отличающийся тем, что L1 выбран из группы, состоящей из дипептидов валин-аланин, валин-цитруллин и фенилаланин-лизин.
10. Конъюгат по п.1, отличающийся тем, что D выбран из
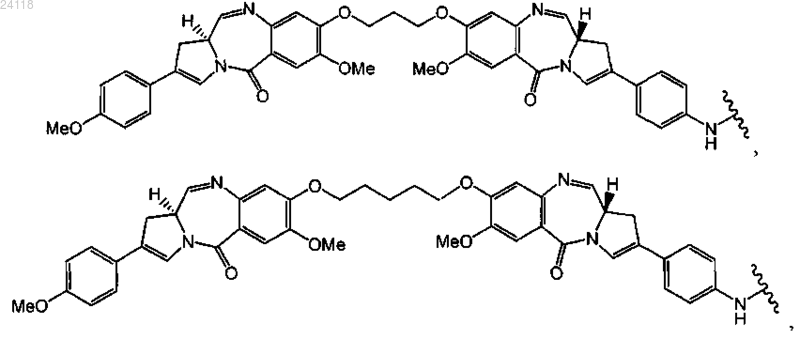
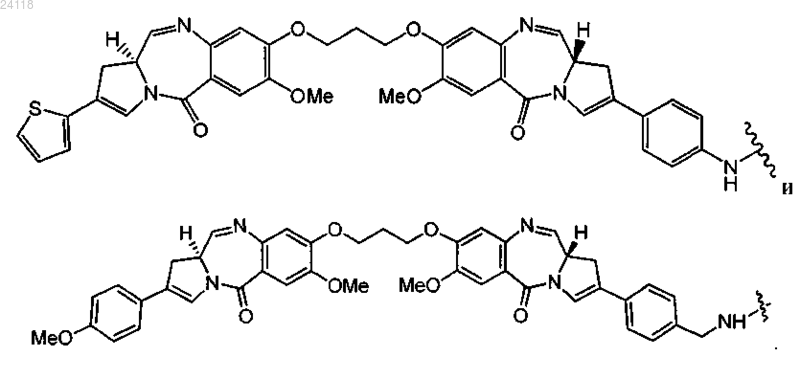
11. Конъюгат по п.1, отличающийся тем, что LU-D представляет собой
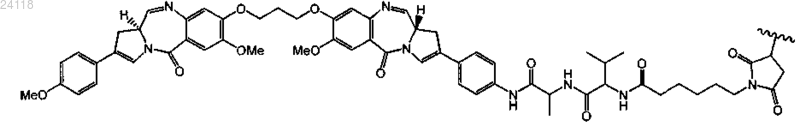
12. Конъюгат по п.1, отличающийся тем, что LU-D представляет собой
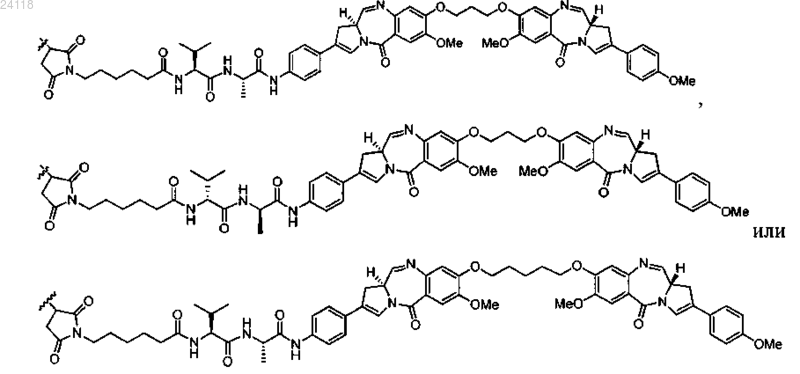
13. Конъюгат по любому из пп.1-12, отличающийся тем, что р равно 2.
14. Фармацевтическая композиция, содержащая конъюгат по любому из пп.1-13 и фармацевтически приемлемый наполнитель, носитель, буфер или стабилизатор.
15. Фармацевтическая композиция по п.14, отличающаяся тем, что средняя нагрузка лекарственного соединения в коньюгате в композиции равна 2.
16. Применение конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.1-13 для получения лекарственного средства для лечения пролиферативного заболевания или аутоиммунного заболевания.
17. Применение конъюгата или его фармацевтически приемлемой соли или сольвата по любому из пп.1-13 для лечения пролиферативного заболевания или аутоиммунного заболевания.
18. Способ лечения млекопитающего, имеющего пролиферативное заболевание или аутоиммунное заболевание, включающий введение эффективного количества конъюгата по любому из пп.1-13 или его фармацевтически приемлемой соли или сольвата.
19. Лекарственное соединение, имеющее формулу
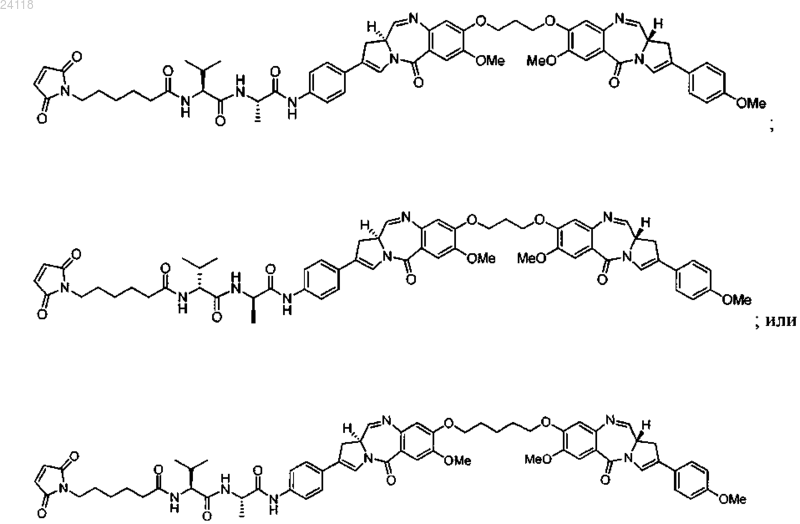
или его фармацевтически приемлемая соль или сольват.
Текст
КОНЪЮГАТЫ ПИРРОЛБЕНЗОДИАЗЕПИНА НАПРАВЛЕННОГО ДЕЙСТВИЯ Предложены конъюгаты, содержащие пирролбензодиазепины (ПБД), конъюгированные с нацеливающим агентом, и способы применения указанных ПБД. Ховард Филип Вилсон (GB), Джефри Скот, Бурке Патрик, Сентер Питер Настоящее изобретение относится к конъюгатам пирролбензодиазепина (ПБД) направленного действия, в частности к димерам пирролбензодиазепина, которые конъюгированы с нацеливающим агентом через С 2 положение одного из мономеров. Уровень техники Некоторые пирролбензодиазепины (ПБД) способны распознавать конкретные последовательности ДНК и связываться с ними; предпочтительной последовательностью является PuGPu. Первый противоопухолевый антибиотик на основе ПБД, антрамицин, был открыт в 1965 г. (Leimgruber, et al., J. Am.Chem. Soc, 87, 5793-5795 (1965); Leimgruber, et al., J. Am. Chem. Soc, 87, 5791-5793 (1965. После этого появились сообщения о ряде природных ПБД, и были разработаны более 10 способов синтеза для получения ряда их аналогов (Thurston, et al., Chem. Rev. 1994, 433-465 (1994. Члены данного семейства включают эббимицин (abbeymycin) (Hochlowski, et al., J. Antibiotics, 40, 145-148 (1987, чикамицин (chicamycin) (Konishi, et al., J. Antibiotics, 37, 200-206 (1984, DC-81 (патент Японии 58-180 487; Thurston, et(1982); Langley and Thurston, J. Org. Chem., 52, 91-97 (1987, сибаномицин (DC-102) (Hara, et al., J. Antibiotics, 41, 702-704 (1988); Itoh, et al., J. Antibiotics, 41, 1281-1284 (1988, сибиромицин (sibiromycin) (Leber, et al., J. Am. Chem. Soc, 110, 2992-2993 (1988 и томамицин (tomamycin) (Arima, et al., J. Antibiotics,25, 437-444 (1972. ПБД имеют следующую общую структуру: Они различаются числом, типом и положением заместителей в ароматических кольцах А и пиррольных кольцах С, а также степенью насыщения кольца С. В кольце В присутствуют иминная (N=C),карбиноламинная группа (NH-CH(OH или группа, представляющая собой метиловый эфир карбиноламина (NH-CH(OMe, в положении N10-C11, которое представляет собой электрофильный центр, ответственный за алкилирование ДНК. Все известные природные продукты имеют (S)-конфигурацию хирального центра С 11 а, что обеспечивает правозакрученную форму, если смотреть от кольца С в направлении кольца А. Такая форма придает им подходящую трехмерную конфигурацию для изоспиральности с малой бороздкой В-формы ДНК, что приводит к плотному соединению в месте связывания (Kohn, In Antibiotics III. Springer-Verlag, New York, pp. 3-11 (1975); Hurley and Needham-VanDevanter, Acc. Chem. Res.,19, 230-237 (1986. Способность ПБД образовывать продукты присоединения в малой бороздке позволяет указанным соединениям влиять на процессинг ДНК, а следовательно, и применять их в качестве противоопухолевых агентов. Биологическую активность этих молекул можно усиливать путем объединения двух звеньев ПБД посредством их С 8/С'-гидроксильных функциональных групп через гибкие алкиленовые линкерные группы (Bose, D.S., et al., J. Am. Chem. Soc, 114, 4939-4941 (1992); Thurston, D.E., et al., J. Org. Chem., 61,8141-8147 (1996. Полагают, что димеры ПБД вызывают селективные повреждения последовательностей ДНК, такие как поперечные сшивки палиндромных участков 5'-Pu-GATC-Py-3' цепей ДНК (Smellie,M., et al., Biochemistry, 42, 8232-8239 (2003); Martin, C, et al., Biochemistry, 44, 4135-4147), что считается основной причиной их биологической активности. Одним из примеров димера ПБД является SG2000(2004); Hartley, J.A., et al., Cancer Research, 64, 6693-6699 (2004. Благодаря особенности поведения этих высокоактивных соединений при поперечной сшивке ДНК были получены симметричные димеры ПБД, т.е. оба мономера в димере являются одинаковыми. Этот способ синтеза представляет собой прямой синтез, заключающийся либо в получении димерного фрагмента ПБД, уже содержащего линкерную группу димера, либо во взаимодействии синтезированных мономерных фрагментов ПБД с линкерной группой димера. Такие способы синтеза ограничивали возможность получения конъюгатов направленного действия, содержащих ПБД. Тем не менее, поскольку димеры ПБД обладают биологической активностью, существует необходимость в димерах ПБД, которые можно конъюгировать с нацеливающими агентами для применения в направленной терапии. Настоящее изобретение относится к конъюгатам, содержащим димеры ПБД, связанные с нацеливающим агентом, где мономер ПБД содержит заместитель в С 2 положении, который обеспечивает место связывания данного соединения с нацеливающим агентом. Настоящее изобретение также относится к конъюгатам, содержащим димеры ПБД, конъюгированные с нацеливающим агентом, где мономеры ПБД в димере являются разлными. Один из мономеров ПБД содержит заместитель в С 2 положении, который обеспечивает место связывания данного соединения с нацеливающим агентом. Конъюгаты, описанные в настоящей заявке, имеют высокую цитотоксическую и/или цитостатическую активность в отношении клеток, экспрессирующих молекулу-мишень, таких как раковые клетки или клетки иммунной системы. Такие конъюгаты имеют более высокую активность и сниженную токсичность по сравнению с соответствующими лекарственными средствами, не содержащими димеров ПБД. В некоторых вариантах реализации конъюгаты имеют следующую формулу I: где L представляет собой белок, полипептид или пептид (т.е. нацеливающий агент), LU представляет собой линкер, a D представляет собой фрагмент лекарственного соединения, содержащий димер ПБД. Индекс р представляет собой целое число от 1 до 20. Соответственно, конъюгаты содержат лиганд, ковалентно связанный по меньшей мере с одним фрагментом лекарственного соединения при помощи линкера. Лиганд, более подробно описанный ниже, представляет собой нацеливающий агент, который связывается с фрагментом-мишенью. Лиганд может, например, специфично связываться с компонентом клетки (агент, связывающийся с клеткой) или с другими целевыми молекулами-мишенями. Соответственно,в настоящем изобретении также предложены способы лечения, например, разных типов рака и аутоиммунных заболеваний. Эти способы включают применение конъюгатов, где лиганд представляет собой нацеливающий агент, который специфично связывается с молекулой-мишенью. Лиганд может представлять собой, например, белок, полипептид или пептид, такой как антитело, антигенсвязывающий фрагмент антитела или другой связывающий агент, такой как гибридный белок Fc. Согласно первому аспекту, конъюгаты содержат конъюгат формулы I (указанной выше), где фрагмент лекарственного соединения содержит димер ПБД следующей формулы II: где А представляет собой фенильную группу, X представляет собой -NH, Q1 представляет собой простую связь, a Q2 выбран из простой связи и -O-(СН 2)n-, где n равен от 1 до 3;R12 представляет собой фенильную или тиофенильную группу, замещенную одним заместителем, выбранным из группы, состоящей из простой эфирной группы, диметиламинопропилокси и пиперазинила;R7 и R7' независимо представляют собой С 1-4 алкилоксигруппу;R10 и R11 образуют азот-углеродную двойную связь между атомами азота и углерода, к которым они присоединены;R10' и R11' являются такими же, как R10 и R11. Согласно второму аспекту предложено применение конъюгата формулы I для изготовления лекарственного средства для лечения пролиферативного заболевания или аутоиммунного заболевания. Согласно родственному третьему аспекту предложено применение конъюгата формулы I для лечения пролиферативного заболевания или аутоиммунного заболевания. Согласно другому аспекту предложено применение конъюгата формулы I для обеспечения доставки димера ПБД или его соли или сольвата в место действия. Специалисты в данной области техники могут легко определить, подходит ли исследуемый конъюгат для лечения пролиферативного состояния для любого конкретного типа клеток. Например, исследования, которые можно без труда применять для определения активности, обеспечиваемой конкретным соединением, описаны ниже в примерах. Термин "пролиферативное заболевание" относится к нежелательной или неконтролируемой клеточной пролиферации с избыточным содержанием клеток в организме или атипичных клеток, что представляет собой нежелательный процесс, например неопластический или гиперпластический рост in vitro или in vivo. Примеры пролиферативных состояний включают, но не ограничиваются ими, доброкачественную,предопухолевую и злокачественную пролиферацию клеток, включая, но не ограничиваясь ими, неоплазмы и опухоли (например, гистиоцитому, глиому, астроцитому, остеому), раковые заболевания (например, рак легких, мелкоклеточный рак легких, рак желудочно-кишечного тракта, колоректальный рак, рак толстой кишки, карциному молочной железы, карциному яичников, рак простаты, рак яичек, рак печени,рак почек, рак мочевого пузыря, рак поджелудочной железы, рак мозга, саркому, остеосаркому, саркому Капоши, меланому), лейкозы, псориаз, заболевания костей, фибропролиферативные нарушения (например, соединительных тканей) и атеросклероз. Другие раковые заболевания, представляющие интерес,включают, но не ограничиваются ими, гематологические злокачественные опухоли, такие как лейкозы и лимфомы, например неходжкинскую лимфому и ее подтипы, такие как ДКВКЛ (диффузная крупноклеточная В-клеточная лимфома), лимфому маргинальной зоны, мантийной зоны и фолликулярную лимфому, лимфому Ходжкина, ОМЛ (острый миелобластный лейкоз) и другие раковые заболевания В- или Тклеток. Примеры аутоиммунных заболеваний включают следующие: ревматоидный артрит, аутоиммунные демиелинизирующие нарушения (например, рассеянный склероз, аллергический энцефаломиелит), псориатический артрит, эндокринную офтальмопатию, увеоретинит, системную красную волчанку, тяжелую миастению, болезнь Грейвса, гломерулонефрит, аутоиммунные нарушения печени, воспалительное заболевание кишечника (например, болезнь Крона), анафилаксию, аллергические реакции, синдром Шегрена,сахарный диабет I типа, первичный билиарный цирроз, гранулематоз Вегенера, фибромиалгию, полимиозит, дерматомиозит, множественную эндокринную недостаточность, синдром Шмидта, аутоиммунный увеит, болезнь Аддисона, адреналит, тироидит, тироидит Хашимото, аутоиммунный тироидит, пернициозную анемию, атрофию желудка, хронический гепатит, волчаночный гепатит, атеросклероз, подострую кожную красную волчанку, гипопаратиреоз, синдром Дресслера, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопеническую пурпуру, гемолитическую анемию, вульгарную пузырчатку, пузырчатку, герпетиформный дерматит, алопецию Ареата, пемфигоид, склеродермию, прогрессирующий системный склероз, CREST-синдром (кальциноз, синдром Рейно, нарушение моторики пищевода, склеродактилия и телеангиэктазия), мужское и женское аутоиммунное бесплодие, анкилозирующий спондилит, язвенный колит, смешанное заболевание соединительной ткани, нодозный полиартериит,системный некротизирующий васкулит, атопический дерматит, атопический ринит, синдром Гудпасчера,болезнь Шагаса, саркоидоз, ревматическую лихорадку, астму, привычный выкидыш, антифосфолипидный синдром, легкое фермера, мультиформную эритему, посткардиотомный синдром, синдром Кушинга, аутоиммунный хронический активный гепатит, "легкое птицевода", токсический эпидермальный некролиз, синдром Альпорта, альеволит, аллергический альвеолит, фиброзный альвеолит, интерстициальное заболевание легких, нодозную эритему, гангренозную пиодермию, трансфузионную реакцию,артериит Такаясу, ревматоидную полимиалгию, темпоральный артериит, шистосомоз, гигантоклеточный артериит, аскариаз, аспергиллез, синдром Самптера, экзему, лимфоматоидный гранулематоз, болезньБехчета, синдром Каплана, болезнь Кавасаки, лихорадку денге, энцефаломиелит, эндокардит, фиброз эндомиокарда, эндофтальмит, стойкую возвышающуюся эритему, псориаз, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филариаз, циклит, хронический циклит, гетерохромный циклит, циклит Фукса, нефропатию IgA, пурпуру Геноха-Шенлейна, реакцию "трансплантат против хозяина", отторжение трансплантата, кардиомиопатию, синдром Итона-Ламберта, рецидивирующий полихондрит, криоглобулинемию, макроглобулинемию Вальденстрема, синдром Эванса и аутоиммунную гонадную недостаточность. В некоторых вариантах реализации аутоиммунное заболевание представляет собой нарушение, связанное с В лимфоцитами (например, системную красную волчанку, синдром Гудпасчера, ревматоидный артрит и диабет I типа), Th1-лимфоцитами (например, ревматоидный артрит, рассеянный склероз, псориаз, синдром Шегрена, тироидит Хашимото, болезнь Грейвса, первичный билиарный цирроз, гранулематоз Вегенера, туберкулез или реакцию "трансплантат против хозяина") или Th2-лимфоцитами (например,атопический дерматит, системную красную волчанку, атопическую астму, риноконъюнктивит, аллергический ринит, синдром Оменна, системный склероз или хроническую реакцию "трансплантат против хозяина"). В целом, нарушения, связанные с дендритными клетками, включают нарушения, связанные сTh1-лимфоцитами и Th2-лимфоцитами В некоторых вариантах реализации аутоиммунное нарушение представляет собой нарушение иммунной системы, опосредованное Т-клетками. Согласно четвертому аспекту настоящее изобретение включает способ получения конъюгатов формулы I. Димеры ПБД для применения согласно настоящему изобретению получают при помощи способов,отличающихся от применявшихся ранее для получения симметричных димеров ПБД. В частности, авторами настоящего изобретения разработан способ, заключающийся во введении каждого арильного заместителя при С 2 в ядро симметричного димера ПБД на разных стадиях. Соответственно, согласно шестому аспекту настоящего изобретения предложен способ получения конъюгата формулы I, включающий по меньшей мере одну стадию, описанную в настоящем тексте. Краткое описание чертежей На фиг. 1-6 показано действие конъюгатов на опухоли согласно настоящему изобретению. Определения Если в настоящем описании используется название торговой марки, то ссылка на название торговой марки также относится к составу, содержащему продукт, дженерику и активному(ым) фармацевтическому(им) ингредиенту(ам), входящему(им) в состав продукта с указанным торговым названием, если в контексте не указано иное. Связывающий агент и нацеливающий агент. Термины "связывающий агент" и "нацеливающий агент", используемые в настоящем описании, относятся к молекуле, например, белка, полипептида или пептида, которая специфично связывается с молекулой-мишенью. Примеры могут включать непосредственно антитело, антигенсвязывающий фрагмент антитела, другой агент (белок, полипептид или пептид), который включает вариабельную область тяжелых и/или легких цепей антител, которая специфично связывается с молекулой-мишенью, или гибридный белок Fc, содержащий внеклеточный домен белка, пептида, полипептида, который связывается с молекулой-мишенью и который присоединен к Fc области, домену или фрагменту антитела. Специфичноее связывание. Термины "специфично связывается" и "специфичное связывание" относятся к связыванию антитела или другого белка, полипептида или пептида с целевой молекулой (например, с антигеном). Как правило,антитело или другая молекула связывается с аффинностью, составляющей по меньшей мере примерно 1107 М-1, при этом аффинность связывания с целевой молекулой по меньшей мере в два раза выше аффинности связывания с другими молекулами (например, БСА, казеина), отличными от целевой молекулы или родственной ей молекулы. Фармацевтически приемлемые катионы. Примеры фармацевтически приемлемых одновалентных и бивалентных катионов приводятся в публикации Berge, et al., J. Pharm. Sci., 66, 1-19 (1977), содержание которой включено в настоящую заявку посредством ссылки. Фармацевтически приемлемый катион может быть неорганическим или органическим. Примеры фармацевтически приемлемых одновалентных неорганических катионов включают, но не ограничиваются ими, ионы щелочных металлов, такие как Na+ и K+. Примеры фармацевтически приемлемых бивалентных неорганических катионов включают, но не ограничиваются ими, катионы щелочноземельных металлов, такие как Са 2+ и Mg2+. Примеры фармацевтически приемлемых органических катионов включают, но не ограничиваются ими, ион аммония (т.е. NH4+) и замещенные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами некоторых подходящих замещенных ионов аммония являются ионы, полученные из этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина,меглумина и трометамина, а также из аминокислот, таких как лизин и аргинин. Примером распространенного четвертичного иона аммония является N(СН 3)4+. Заместители. Выражение "возможно замещенный", используемое в настоящем описании, относится к исходной группе, которая может быть незамещенной или замещенной. Если не указано иное, термин "замещенный", используемый в настоящем описании, относится к исходной группе, которая содержит один или более заместителей. Термин "заместитель" используется в настоящем описании в традиционном значении и относится к химическому фрагменту, который ковалентно присоединен или, если это возможно, конденсирован с исходной группой. Хорошо известен широкий ряд заместителей, и способы их получения и введения в разнообразные исходные группы также хорошо известны. Примеры заместителей более подробно описаны ниже.C1-12 алкил. Термин "С 1-12 алкил", используемый в настоящем описании, относится к одновалентному фрагменту, полученному в результате удаления атома водорода от атома углерода в углеводороде,содержащем от 1 до 12 атомов углерода, который может быть алифатическим или алициклическим и который может быть насыщенным или ненасыщенным (например, частично ненасыщенным, полностью ненасыщенным). Таким образом, термин "алкил" включает подклассы алкенил, алкинил, циклоалкил и т.д., описанные ниже. Примеры насыщенных алкильных групп включают, но не ограничиваются ими, метил (C1), этил(С 2), пропил (С 3), бутил (С 4), пентил (C5), гексил (С 6) и гептил (С 7). Примеры насыщенных линейных алкильных групп включают, но не ограничиваются ими, метил(C1), этил (С 2), н-пропил (С 3), н-бутил (С 4), н-пентил (амил) (C5), н-гексил (С 6) и н-гептил (С 7). Примеры насыщенных разветвленных алкильных групп включают изопропил (С 3), изобутил (С 4),втор-бутил (С 4), трет-бутил (С 4), изопентил (C5) и неопентил (C5). С 2-12 алкенил. Термин "С 2-12 алкенил", используемый в настоящем описании, относится к алкильной группе, содержащей одну или более двойных углерод-углеродных связей. Примеры ненасыщенных алкенильных групп включают, но не ограничиваются ими, этенил (винил,-4 024118-СН=СН 2), 1-пропенил (-СН=СН-СН 3), 2-пропенил (аллил, -СН-СН=СН 2), изопропенил (1-метилвинил,-С(СН 3)=СН 2), бутенил (С 4), пентенил (C5) и гексенил (С 6). С 2-12 алкинил. Термин "С 2-12 алкинил", используемый в настоящем описании, относится к алкильной группе, содержащей одну или более тройных углерод-углеродных связей. Примеры ненасыщенных алкинильных групп включают, но не ограничиваются ими, этинил(-ССН) и 2-пропинил (пропаргил, -СН 2-ССН). С 3-12 циклоалкил. Термин "С 3-12 циклоалкил", используемый в настоящем описании, относится к алкильной группе, которая также является циклической группой; т.е. представляет собой одновалентный фрагмент, полученный в результате удаления атома водорода от атома алициклического кольца циклического углеводорода (карбоциклического соединения), содержащий от 3 до 7 атомов углерода, включая от 3 до 7 атомов в кольце. Примеры циклоалкильных групп включают, но не ограничиваются ими, группы, полученные из насыщенных моноциклических углеводородов: циклопропана (С 3), циклобутана (С 4), циклопентана(С 7); и насыщенных полициклических углеводородов: норкарана (С 7), норпинана (С 7), норборнана (С 7). С 3-20 гетероциклил. Термин "С 3-20 гетероциклил", используемый в настоящем описании, относится к одновалентному фрагменту, полученному в результате удаления атома водорода от атома кольца гетероциклического соединения, при этом фрагмент содержит от 3 до 20 атомов в кольце, среди которых от 1 до 10 атомов представляют собой гетероатомы кольца. Предпочтительно каждое кольцо содержит от 3 до 7 атомов, среди которых от 1 до 4 представляют собой гетероатомы кольца. В указанном контексте префиксы (например, С 3-20, С 3-7, C5-6 и т.д.) обозначают количество атомов в кольце или диапазон числа атомов в кольце, включая атомы углерода и гетероатомы. Например, термин"C5-6 гетероциклил", используемый в настоящем описании, относится к гетероциклильной группе, содержащей 5 или 6 атомов в кольце. Примеры моноциклических гетероциклильных групп включают, но не ограничиваются ими, группы, полученные изN1O1S1: оксатиазина (С 6). Примеры замещенных моноциклических гетероциклильных групп включают группы, полученные из сахаридов в циклической форме, например из фураноз (C5), таких как арабинофураноза, ликсофураноза, рибофураноза и ксилофураноза, и пираноз (С 6), таких как аллопираноза, альтропираноза, глюкопираноза, маннопираноза, гулопираноза, идопираноза, галактопираноза и талопираноза. С 5-20 арил. Термин "С 5-20 арил", используемый в настоящем описании, относится к одновалентному фрагменту, полученному в результате удаления атома водорода от атома ароматического кольца ароматического соединения, который содержит от 3 до 20 атомов в кольце. Предпочтительно каждое кольцо содержит от 5 до 7 атомов в кольце. В указанном контексте префиксы (например, С 3-20, C5-7, C5-6 и т.д.) обозначают количество атомов в кольце или диапазон числа атомов в кольце, включая атомы углерода и гетероатомы. Например, термин"C5-6 арил", используемый в настоящем описании, относится к арильной группе, содержащей 5 или 6 атомов в кольце. Все атомы в кольце могут представлять собой атомы углерода, как в случае "карбоарильных групп". Примеры карбоарильных групп включают, но не ограничиваются ими, группы, полученные из бензола (т.е. фенил) (С 6), нафталина (С 10), азулена (С 10), антрацена (С 14), фенантрена (С 14), нафтацена (C18) и пирена (C16). Примеры арильных групп, которые содержат конденсированные кольца, по меньшей мере одно из которых представляет собой ароматическое кольцо, включают, но не ограничиваются ими, группы, полученные из индана (например, 2,3-дигидро-1H-индена) (С 9), индена (С 9), изоиндена (С 9), тетралина(1,2,3,4-тетрагидронафталина (С 10), аценафтена (С 12), флуорена (С 13), феналена (С 13), ацефенантрена (C15) и ацеантрена (C16). В качестве альтернативы атомы кольца могут включать один или более гетероатомов, как в случае"гетероарильных групп". Примеры моноциклических гетероарильных групп включают, но не ограничиваются ими, группы, полученные изN3: триазола (C5), триазина (С 6); и N4: тетразола (C5). Примеры гетероарильных групп, содержащих конденсированные кольца, включают, но не ограничиваются ими,С 9 (содержащие 2 конденсированных кольца), полученные из бензофурана (O1), изобензофурана(N1S1), бензотиадиазола (N2S); С 10 (содержащие 2 конденсированных кольца), полученные из хромена (O1), изохромена (O1), хромана (O1), изохромана (O1), бензодиоксана (О 2), хинолина (N1), изохинолина (N1), хинолизина (N1), бензоксазина (N1O1), бензодиазина (N2), пиридопиридина (N2), хиноксалина (N2), хиназолина (N2), циннолина (N2), фталазина (N2), нафтиридина (N2), птеридина (N4); С 11 (содержащие 2 конденсированных кольца), полученные из бензодиазепина (N2); С 13 (содержащие 3 конденсированных кольца), полученные из карбазола (N1), дибензофурана (O1),дибензотиофена (S1), карболина (N2), перимидина (N2), пиридоиндола (N2); и С 14 (содержащие 3 конденсированных кольца), полученные из акридина (N1), ксантена (O1), тиоксантена (S1), оксантрена (О 2), феноксатиина (O1S1), феназина (N2), феноксазина (N1O1), фенотиазина(N1S1), тиантрена (S2), фенантридина (N1), фенантролина (N2), феназина (N2). Представленные выше группы, как таковые или как часть другого заместителя, могут быть возможно замещены одной или более группами, выбранными из таких же указанных групп и дополнительных заместителей, перечисленных ниже. Галогены: -F, -Cl, -Br и -I. Гидроксил: -ОН. Простая эфирная группа: -OR, где R представляет собой заместитель простого эфира, например C1-7 алкильную группу (в этом случае группу также называют C1-7 алкоксигруппой, описана ниже), С 3-20 гетероциклильную группу (также называют С 3-20 гетероциклилоксигруппой) или С 5-20 арильную группу (также называют С 5-20 арилоксигруппой), предпочтительно C1-7 алкильную группу. Алкокси: -OR, где R представляет собой алкильную группу, например C1-7 алкильную группу. Примеры C1-7 алкоксигрупп включают, но не ограничиваются ими, -ОМе (метокси), -OEt (этокси), -O(nPr) (нпропокси), -O(iPr) (изопропокси), -O(nBu) (н-бутокси), -O(sBu) (втор-бутокси), -O(iBu) (изобутокси) и-O(tBu) (трет-бутокси). Ацеталь: -CH(OR1)(OR2), где R1 и R2 независимо представляют собой заместители ацеталя, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительноC1-7 алкильную группу, или в случае "циклической" ацетальной группы R1 и R2, взятые совместно с двумя атомами кислорода, к которым они присоединены, и атомами углерода, к которым они присоединены,образуют гетероциклическое кольцо, содержащее от 4 до 8 атомов в кольце. Примеры ацетальных групп включают, но не ограничиваются ими, -СН(ОМе)2, -CH(OEt)2 и -CH(OMe)(OEt). Гемиацеталь: -CH(OH)(OR1), где R1 представляет собой заместитель гемиацеталя, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры гемиацетальных групп включают, но не ограничиваются ими, -СН(ОН)(ОМе) и -CH(OH)(OEt). Кеталь: -CR(OR1)(OR2), где R1 и R2 такие же, как определены для ацеталей, a R представляет собой заместитель кеталя, отличный от водорода, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры кеталей включают,но не ограничиваются ими, -С(Ме)(ОМе)2, -C(Me)(OEt)2, -C(Me)(OMe)(OEt), -C(Et)(OMe)2, -C(Et)(OEt)2 и-C(Et)(OMe)(OEt). Гемикеталь: -CR(OH)(OR1), где R1 такой же, как определен для гемиацеталей, a R представляет собой заместитель гемикеталя, отличный от водорода, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры гемикеталей включают, но не ограничиваются ими, -С(Ме)(ОН)(ОМе), -C(Et)(OH)(OMe), -C(Me)(OH)(OEt) и-C(Et)(OH)(OEt). Оксогруппа (кето-, -он): =O. Тион (тиокетон): =S. Имино (иминная группа): =NR, где R представляет собой заместитель имина, например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно водород или C1-7 алкильную группу. Примеры иминов включают, но не ограничиваются ими, =NH, =NMe, =NEt и=NPh. Формил (карбальдегид, карбоксальдегид): -С(=О)Н. Ацил (кето-): -C(=O)R, где R представляет собой заместитель ацила, например C1-7 алкильную группу (в этом случае группу также называют C1-7 алкилацилом или C1-7 алканоилом), С 3-20 гетероциклильную группу (также называют С 3-20 гетероциклилацилом) или С 5-20 арильную группу (также называют С 5-20 арилацилом), предпочтительно C1-7 алкильную группу. Примеры ацильных групп включают, но не ограничиваются ими, -С(=О)СН 3 (ацетил), -С(=О)СН 2 СН 3 (пропионил), -С(=О)С(СН 3)3 (т-бутирил) и-C(=O)Ph (бензоил, фенон). Карбоксигруппа (карбоновая кислота): -С(=О)ОН. Тиокарбоксигруппа (тиокарбоновая кислота): -C(=S)SH. Тиолокарбоксигруппа (тиолокарбоновая кислота): -C(=O)SH. Тионокарбоксигруппа (тионокарбоновая кислота): -C(=S)OH. Имидокислота: -C(=NH)OH. Гидроксамовая кислота: -C(=NOH)OH. Сложноэфирная группа (карбоксилат, сложный эфир карбоновой кислоты, оксикарбонил):-C(=O)OR, где R представляет собой заместитель сложноэфирной группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сложноэфирных групп включают, но не ограничиваются ими, -С(=О)ОСН 3,-С(=О)ОСН 2 СН 3, -С(=О)ОС(СН 3)3 и -C(=O)OPh. Ацилокси ("обращенный" сложный эфир): -OC(=O)R, где R представляет собой заместитель ацилокси, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры ацилоксигрупп включают, но не ограничиваются ими,-ОС(=О)СН 3 (ацетокси), -ОС(=О)СН 2 СН 3, -ОС(=О)С(СН 3)3, -OC(=O)Ph и -OC(=O)CH2Ph. Оксикарбонилокси: -OC(=O)OR, где R представляет собой заместитель сложноэфирной группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сложноэфирных групп включают, но не ограничиваются ими,-ОС(=О)ОСН 3, -ОС(=О)ОСН 2 СН 3, -ОС(=О)ОС(СН 3)3 и -OC(=O)OPh. Аминогруппа: -NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, например водород, C1-7 алкильную группу (в этом случае группу называют C1-7 алкиламиногруппой или диС 1-7 алкиламиногруппой), С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно Н или C1-7 алкильную группу, или в случае "циклической" аминогруппы R1 и R2 совместно с атомом азота,к которому они присоединены, образуют гетероциклическое кольцо, содержащее от 4 до 8 атомов в кольце. Аминогруппы могут быть первичными (-NH2), вторичными (-NHR1) или третичными(-NHR1R2), а также в случае катионной формы, могут быть четвертичными (-+NR1R2R3). Примеры аминогрупп включают, но не ограничиваются ими, -NH2, -NHCH3, -NHC(CH3)2, -N(CH3)2, -N(СН 2 СН 3)2 и-NHPh. Примеры циклических аминогрупп включают, но не ограничиваются ими, азиридино, азетидино,пирролидино, пиперидино, пиперазино, морфолино и тиоморфолино. Амидная группа (карбамоил, карбамил, аминокарбонил, карбоксамид): -C(=O)NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определенные для аминогрупп. Примеры амидогрупп включают, но не ограничиваются ими, -C(=O)NH2, -C(=O)NHCH3, -C(=O)N(CH3)2,-C(=O)NHCH2CH3 и -C(=O)N(CH2CH3)2, а также амидогруппы, в которых R1 и R2 совместно с атомом азота, к которому они присоединены, образуют гетероциклическую структуру, как, например, в случае пиперидинокарбонила, морфолинокарбонила, тиоморфолинокарбонила и пиперазинокарбонила. Тиоамид (тиокарбамил): -C(=S)NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определенные для аминогрупп. Примеры амидных групп включают, но не ограничиваются ими, -C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2 и -C(=S)NHCH2CH3. Ациламидогруппа (ациламиногруппа): -NR1C(=O)R2, где R1 представляет собой заместитель амидной группы, например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 ариль-7 024118 ную группу, предпочтительно водород или C1-7 алкильную группу, a R2 представляет собой заместитель ацильной группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно водород или C1-7 алкильную группу. Примеры ациламидогрупп включают, но не ограничиваются ими, -NHC(=O)CH3, -NHC(=O)CH2CH3 и -NHC(=O)Ph. R1 и R2, взятые вместе, могут образовывать циклическую структуру, например, в сукцинимидиле, малеимидиле и фталимидиле Аминокарбонилокси: -OC(=O)NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определенные для аминогрупп. Примеры аминокарбонилоксигрупп включают, но не ограничиваются ими, -OC(=O)NH2, -OC(=O)NHMe, -OC(=O)NMe2 и -OC(=O)NEt2. Уреидогруппа: -N(R1)CONR2R3, где R2 и R3 независимо представляют собой заместители аминогруппы, определенные для аминогрупп, a R1 представляет собой заместитель уреидогруппы, например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно водород или C1-7 алкильную группу. Примеры уреидогрупп включают, но не ограничиваются ими,-NHCONH2, -NHCONHMe, -NHCONHEt, -NHCONMe2, -NHCONEt2, -NMeCONH2, -NMeCONHMe,-NMeCONHEt, -NMeCONMe2 и -NMeCONEt2. Гуанидин: -NH-C(=NH)NH2. Тетразолил: пятичленное ароматическое кольцо, содержащее четыре атома азота и один атом углерода Иминогруппа: =NR, где R представляет собой заместитель иминогруппы, например водород, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно Н илиC1-7 алкильную группу. Примеры иминогрупп включают, но не ограничиваются ими, =NH, =NMe и =NEt. Амидин (амидино): -C(=NR)NR2, где каждый R представляет собой заместитель амидиногруппы,например водород, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу,предпочтительно Н или C1-7 алкильную группу. Примеры амидиногрупп включают, но не ограничиваются ими, -C(=NH)NH2, -C(=NH)NMe2 и -C(=NMe)NMe2. Нитрозо: -NO. Азидо: -N3. Изоциано: -NC. Цианато: -OCN. Изоцианато: -NCO. Тиоциано (тиоцианато): -SCN. Изотиоциано (изотиоцианато): -NCS. Сульфгидрильная группа (тиол, меркаптогруппа): -SH. Простой тиоэфир (сульфид): -SR, где R представляет собой заместитель простого тиоэфира, например C1-7 алкильную группу (в этом случае группу называют C1-7 алкилтиогруппой), С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры C1-7 алкилтиогрупп включают, но не ограничиваются ими, -SCH3 и -SCH2CH3. Дисульфид: -SS-R, где R представляет собой заместитель дисульфида, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу (в этом случае группу называют C1-7 алкилдисульфидом). Примеры C1-7 алкилдисульфидных групп включают, но не ограничиваются ими, -SSCH3 и -SSCH2CH3. Сульфин (сульфинил, сульфоксид): -S(=O)R, где R представляет собой заместитель сульфиногруппы, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфиновых групп включают, но не ограничиваются ими,-S(=O)CH3 и -S(=O)CH2CH3. Сульфон (сульфонил): -S(=O)2R, где R представляет собой заместитель сульфоновой группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу, включая, например, фторированную или перфторированную C1-7 алкильную группу. Примеры сульфоновых групп включают, но не ограничиваются ими, -S(=О)2 СН 3 (метансульфонил, мезил), -S(=O)2CF3 (трифлил), -S(=O)2CH2CH3 (эзил), -S(=O)2C4F9 (нонафлил), -S(=O)2CH2CF3 зил), 4-хлорфенилсульфонил (хлозил), 4-бромфенилсульфонил (брозил), 4-нитрофенил (нозил), 2 нафталинсульфонат (напсил) и 5-диметиламинонафталин-1-илсульфонат (дансил). Сернистая кислота (сульфино): -S(=O)OH, -SO2H. Сульфокислота (сульфо): -S(=O)2OH, -SO3H. Сульфинат (сложный эфир сернистой кислоты): -S(=O)OR; где R представляет собой заместитель сульфинатной группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфинатных групп включают, но не ограничиваются ими, -S(=O)OCH3 (метоксисульфинил; метилсульфинат) и -S(=О)ОСН 2 СН 3 (этоксисульфинил; этилсульфинат). Сульфонат (сложный эфир сульфокислоты): -S(=O)2OR, где R представляет собой заместитель сульфонатной группы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфонатных групп включают, но не ограничиваются ими, -S(=О)2 ОСН 3 (метоксисульфонил; метилсульфонат) и -S(=O)2OCH2CH3 (этоксисульфонил; этилсульфонат). Сульфинилокси: -OS(=O)R, где R представляет собой заместитель сульфинилоксигруппы, напримерC1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфинилоксигрупп включают, но не ограничиваются ими, -OS(=O)CH3 и-OS(=O)CH2CH3. Сульфонилокси: -OS(=O)2R, где R представляет собой заместитель сульфонилоксигруппы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительноC1-7 алкильную группу. Примеры сульфонилоксигрупп включают, но не ограничиваются ими,-OS(=O)2CH3 (мезилат) и -OS(=O)2CH2CH3 (эзилат). Сульфат: -OS(=O)2OR; где R представляет собой заместитель сульфатной группы, например С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфатных групп включают, но не ограничиваются ими, -OS(=O)2OCH3 и-SO(=O)2OCH2CH3. Сульфамил (сульфамоил; амид сернистой кислоты; сульфинамид): -S(=O)NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определенные для аминогрупп. Примеры сульфамильных групп включают, но не ограничиваются ими, -S(=O)NH2, -S(=O)NH(CH3), -S(=O)N(CH3)2,-S(=O)NH(CH2CH3), -S(=O)N(CH2CH3)2 и -S(=O)NHPh. Сульфонамидо (сульфинамоил, амид сульфокислоты, сульфонамид): -S(=O)2NR1R2, где R1 и R2 независимо представляют собой заместители аминогруппы, определенные для аминогрупп. Примеры сульфонамидных групп включают, но не ограничиваются ими, -S(=O)2NH2, -S(=O)2NH(CH3),-S(=O)2N(CH3)2, -S(=O)2NH(CH2CH3), -S(=O)2N(CH2CH3)2 и -S(=O)2NHPh. Сульфамино: -NR1S(=O)2OH, где R1 представляет собой заместитель аминогруппы, определенный для аминогрупп. Примеры сульфаминогрупп включают, но не ограничиваются ими, -NHS(=O)2OH и-N(CH3)S(=O)2OH. Сульфонамино: -NR1S(=O)2R, где R1 представляет собой заместитель аминогруппы, определенный для аминогрупп, a R представляет собой заместитель сульфонаминогруппы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфонаминогрупп включают, но не ограничиваются ими, -NHS(=O)2CH3 и-N(CH3)S(=O)2C6H5. Сульфинамино: -NR1S(=O)R, где R1 представляет собой заместитель аминогруппы, определенный для аминогрупп, a R представляет собой заместитель сульфинаминогруппы, например C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно C1-7 алкильную группу. Примеры сульфинаминогрупп включают, но не ограничиваются ими, -NHS(=O)CH3 и-N(CH3)S(=O)C6H5. Фосфино (фосфин): -PR2, где R представляет собой заместитель фосфиногруппы, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно -Н, C1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфиновых групп включают, но не ограничиваются ими, -РН 2, -Р(СН 3)2, -Р(СН 2 СН 3)2, -P(t-Bu)2 и -P(Ph)2. Фосфогруппа: -Р(=О)2. Фосфинил (фосфиноксид): -P(=O)R2, где R представляет собой заместитель фосфинила, напримерC1-7 алкильную группу, С 3-20 гетероциклильную группу или C5-20 арильную группу, предпочтительно C1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфинильных групп включают, но не ограничиваются ими, -Р(=О)(СН 3)2, -Р(=О)(СН 2 СН 3)2, -P(=O)(t-Bu)2 и -P(=O)(Ph)2. Фосфоновая кислота (фосфоно): -Р(=О)(ОН)2. Фосфонатная группа (сложный эфир фосфоновой кислоты): -P(=O)(OR)2, где R представляет собой заместитель фосфонатной группы, например -Н, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, C1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфонатных групп включают, но не ограничиваются ими, -Р(=О)(ОСН 3)2, -Р(=О)(ОСН 2 СН 3)2,-P(=O)(O-t-Bu)2 и -P(=O)(OPh)2. Фосфорная кислота (фосфоноокси): -ОР(=О)(ОН)2. Фосфатная группа (сложный эфир фосфоноокси): -OP(=O)(OR)2, где R представляет собой заместитель фосфатной группы, например -Н, C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, C1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфатных групп включают, но не ограничиваются ими, -ОР(=О)(ОСН 3)2, -ОР(=О)(ОСН 2 СН 3)2,-OP(=O)(O-t-Bu)2 и -OP(=O)(OPh)2. Фосфористая кислота: -ОР(ОН)2. Фосфит: -OP(OR)2, где R представляет собой заместитель фосфитной группы, например -Н, С 1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, С 1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфитных групп включают, но не ограничиваются ими, -ОР(ОСН 3)2, -ОР(ОСН 2 СН 3)2, -OP(O-t-Bu)2 и -OP(OPh)2. Фосфорамидит: -OP(OR1)-NR22, где R1 и R2 представляют собой заместители фосфорамидитной группы, например -Н, (возможно замещенную) C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, C1-7 алкильную группу или С 5-20 арильную группу. Примеры фосфорамидитных групп включают, но не ограничиваются ими, -OP(OCH2CH3)-N(CH3)2,-OP(OCH2CH3)-N(i-Pr)2 и -OP(OCH2CH2CN)-N(i-Pr)2. Фосфорамидат: -OP(=O)(OR1)-NR22, где R1 и R2 представляют собой заместители фосфорамидатной группы, например -Н, (возможно замещенную) C1-7 алкильную группу, С 3-20 гетероциклильную группу или С 5-20 арильную группу, предпочтительно -Н, C1-7 алкильную группу или C5-20 арильную группу. Примеры фосфорамидатных групп включают, но не ограничиваются ими, -OP(=O)(OCH2CH3)-N(CH3)2,-OP(=O)(OCH2CH3)-N(i-Pr)2 и -OP(=O)(OCH2CH2CN)-N(i-Pr)2 Алкилен. С 3-7 алкилен. Термин "С 3-7 алкилен", используемый в настоящем описании, относится к бидентатному фрагменту, полученному в результате удаления двух атомов водорода, обоих от одного атома углерода или по одному от каждого из двух разных атомов углерода, в углеводороде, содержащем от 3 до 7 атомов углерода (если не указано иное), который может быть алифатическим или алициклическим и который может быть насыщенным, частично ненасыщенным или полностью ненасыщенным. Таким образом, термин "алкилен" включает такие подклассы, как алкенилен, алкинилен, циклоалкилен и т.д., описанные ниже. Примеры линейных насыщенных С 3-7 алкиленовых групп включают, но не ограничиваются ими,-(СН 2)n-, где n представляет собой целое число от 3 до 7, например -СН 2 СН 2 СН 2- (пропилен),-СН 2 СН 2 СН 2 СН 2- (бутилен), -СН 2 СН 2 СН 2 СН 2 СН 2- (пентилен) и -CH2CH2CH2CH2CH2CH2CH2- (гептилен). Примеры разветвленных насыщенных С 3-7 алкиленовых групп включают, но не ограничиваются ими, -СН(СН 3)СН 2-, -СН(СН 3)СН 2 СН 2-, -СН(СН 3)СН 2 СН 2 СН 2-, -СН 2 СН(СН 3)СН 2-, -СН 2 СН(СН 3)СН 2 СН 2-,-СН(СН 2 СН 3)-, -СН(СН 2 СН 3)СН 2- и -СН 2 СН(СН 2 СН 3)СН 2-. Примеры линейных частично ненасыщенных С 3-7 алкиленовых групп (С 3-7 алкениленовых и алкиниленовых групп) включают, но не ограничиваются ими, -СН=СН-СН 2-, -СН 2-СН=СН 2-, -СН=СН-СН 2 СН 2-, -СН=СН-СН 2-СН 2-СН 2-, -СН=СН-СН=СН-, -СН=СН-СН=СН-СН 2-, -СН=СН-СН=СН-СН 2-СН 2-,-СН=СН-СН 2-СН=СН-, -СН=СН-СН 2-СН 2-СН=СН- и -CH2-CC-СН 2-. Примеры разветвленных частично ненасыщенных С 3-7 алкиленовых групп (С 3-7 алкениленовых и алкиниленовых групп) включают, но не ограничиваются ими, -С(СН 3)=СН-, -С(СН 3)=СН-СН 2-, -СН=СНСН(СН 3)- и -СС-СН(СН 3)-. Примеры алициклических насыщенных С 3-7 алкиленовых групп (С 3-7 циклоалкиленов) включают,но не ограничиваются ими, циклопентилен (например, циклопент-1,3-илен) и циклогексилен (например,циклогекс-1,4-илен). Примеры алициклических частично ненасыщенных С 3-7 алкиленовых групп (С 3-7 циклоалкиленов) включают, но не ограничиваются ими, циклопентенилен (например, 4-циклопентен-1,3-илен), циклогексенилен (например, 2-циклогексен-1,4-илен; 3-циклогексен-1,2-илен; 2,5-циклогексадиен-1,4-илен). Защитные группы атома кислорода: термин "защитные группы атома кислорода" относится к фрагменту, который защищает гидроксигруппу, и такие группы хорошо известны в данной области техники. Большое число подходящих групп описано в источнике Greene, T.W. and Wuts, G.M., Protective Groups inOrganic Synthesis, 3rd Edition, John WileySons, Inc., 1999, стр. 23-100, содержание которого включено в настоящую заявку посредством ссылки. Классы защитных групп, представляющие наибольший интерес,включают простые силильные эфирные группы (например, триметилсилильную группу (TMS), третбутилдиметилсилильную группу (TBDMS, замещенные простые метиловые эфирные группы (например, тетрагидропиранильную группу (ТНР и сложноэфирные группы (например, ацетатную). Карбаматные защитные группы атома азота: термин "карбаматные защитные группы атома азота" относится к фрагменту, который защищает атом азота иминной связи, и такие группы хорошо известны в данной области техники. Указанные группы имеют следующую структуру: где R'10 представляет собой R, определенный выше. Большое число подходящих групп описано в источнике Greene, T.W. and Wuts, G.M., Protective Groups in Organic Synthesis, 3rd Edition, John WileySons,Inc., 1999, стр. 503-549, содержание которого включено в настоящую заявку посредством ссылки. Гемиаминальные защитные группы атома азота: термин "гемиаминальные защитные группы атома азота" относится к группе, имеющей следующую структуру: где R'10 представляет собой R, определенный выше. Большое число подходящих групп описано в источнике Greene, T.W. and Wuts, G.M., Protective Groups in Organic Synthesis, 3rd Edition, John WileySons,Inc., 1999, стр. 633-647, содержание которого включено в настоящую заявку посредством ссылки. Подробное описание изобретения В настоящем изобретении предложены конъюгаты, содержащие димер ПБД, связанный с лигандом при помощи линкера. В одном из вариантов реализации линкер включает удлиняющий фрагмент (А),специфичный фрагмент (L1) и фрагмент-спейсер (L2). Линкер связан одним концом с лигандом, а другим концом с димером ПБД. Согласно одному аспекту указанный конъюгат представлен ниже формулой Ia где L представляет собой лиганд и-A1a-L1S-L2y представляет собой линкер (LU), где-А 1- представляет собой удлиняющий фрагмент,а равен 1 или 2,L1- представляет собой специфичный фрагмент,s представляет собой целое число в диапазоне от 1 до 12,-L2- представляет собой фрагмент-спейсер,y равен 0, 1 или 2;-D представляет собой димер ПБД иp равен от 1 до 20. Нагрузка лекарственного соединения определяется индексом р, числом молекул лекарственного соединения на один лиганд (например, антитела). Нагрузка лекарственного средства может находиться в диапазоне от 1 до 20 фрагментов лекарственного соединения (D) на один лиганд (например, Ab илиmAb). В случае композиций р представляет собой среднюю нагрузку лекарственного средства в конъюгатах, входящих в состав композиции, и р находится в диапазоне от 1 до 20. В некоторых вариантах реализации р составляет от примерно 1 до примерно 8 фрагментов лекарственного соединения на один лиганд. В некоторых вариантах реализации р равен 1. В некоторых вариантах реализации р равен 2. В некоторых вариантах реализации р составляет от примерно 2 до примерно 8 фрагментов лекарственного соединения на один лиганд. В некоторых вариантах реализации р составляет от примерно 2 до примерно 6, от примерно 2 до примерно 5 или от примерно 2 до примерно 4 фрагментов лекарственного соединения на один лиганд. В некоторых вариантах реализации р равен примерно 2,примерно 4, примерно 6 или примерно 8 фрагментам лекарственного соединения на один лиганд. Среднее число фрагментов лекарственного соединения на один лиганд, достигаемое в результате конъюгации, можно характеризовать при помощи традиционных способов, таких как массспектрометрия, ELISA и ВЭЖХ. Также можно определять количественное распределение конъюгатов,выраженное при помощи индекса р. В некоторых случаях разделение, очистку и исследование гомогенных конъюгатов, где р имеет конкретное значение, от конъюгатов с другими нагрузками лекарственного средства можно осуществить при помощи таких способов, как обращенно-фазовая ВЭЖХ или электрофорез. Предпочтительные варианты реализации изобретения Представленные ниже предпочтительные варианты реализации можно применять для всех аспектов настоящего изобретения, как описано выше, или они могут относиться к одному аспекту. Предпочтительные варианты реализации можно объединять в любых комбинациях. В одном из вариантов реализации указанный конъюгат имеет следующую формулу: где L, A1, a, L1, s, L2, D и р такие, как описано выше. В одном из вариантов реализации лиганд (L) представляет собой связывающийся с клетками агент(СВА), который специфично связывается с молекулой-мишенью на поверхности клетки-мишени. Ниже приведена формула соединения в качестве примера гдеозначает место присоединения к фрагменту лекарственного соединения (D), СВА представляет собой связывающийся с клетками агент, L1 представляет собой специфичный фрагмент, А 1 представляет собой удлиняющий фрагмент, соединяющий L1 и связывающийся с клетками агент, L2 представляет собой фрагмент-спейсер, который представляет собой ковалентную связь, саморасщепляющуюся группу,или совместно с -ОС(=О) образует саморасщепляющуюся группу, при этом наличие L2 является необязательным. В другом варианте реализации лиганд (L) представляет собой связывающийся с клетками агент(СВА), который специфично связывается с молекулой-мишенью на поверхности клетки-мишени. Ниже представлена формула соединения в качестве примера гдеозначает место присоединения к фрагменту лекарственного соединения (D), СВА представляет собой связывающийся с клетками агент, L1 представляет собой специфичный фрагмент, А 1 представляет собой удлиняющий фрагмент, соединяющий L1 и связывающийся с клетками агент, L2 представляет собой фрагмент-спейсер, который представляет собой ковалентную связь или саморасщепляющуюся группу, а равен 1 или 2, s равен 0, 1 или 2 и у равен 0, 1 или 2. В вариантах реализации, проиллюстрированных выше, L1 может представлять собой способный к расщеплению специфичный фрагмент и может именоваться "триггер", который при расщеплении активирует саморасщепляющуюся группу (или саморасщепляющиеся группы) в L2, в случае, если саморасщепляющаяся(иеся) группа(ы) присутствует(ют). Когда специфичный фрагмент L1 расщепляется или линкер (т.е. ковалентная связь) между L1 и L2 расщепляется, то саморасщепляющаяся группа высвобождает фрагмент лекарственного соединения (D). В другом варианте реализации лиганд (L) представляет собой связывающийся с клетками агент(СВА), который специфично связывается с молекулой-мишенью на поверхности клетки-мишени. Ниже приведена формула соединения в качестве примера гдеозначает место присоединения к фрагменту лекарственного соединения (D), СВА представляет собой связывающийся с клетками агент, L1 представляет собой специфичный фрагмент, связанный с L2, А 1 представляет собой удлиняющий фрагмент, соединяющий L2 и связывающийся с клетками агент, L2 представляет собой саморасщепляющуюся группу, а равен 1 или 2, s равен 1 или 2 и у равен 1 или 2. В различных вариантах реализации, описанных в настоящем описании, природа L1 и L2 может изменяться в широких пределах. Эти группы выбирают с учетом их характеристик, которые могут частично определяться условиями в том месте, в которое доставляется конъюгат. Если специфичный фрагментL1 способен к расщеплению, то структуру и/или последовательность L1 выбирают таким образом, чтобы указанный фрагмент расщеплялся под действием ферментов, присутствующих в целевом участке (например, в клетке-мишени). Также можно применять фрагменты L1, которые способны расщепляться в результате изменений рН (например, фрагменты, лабильные к действию кислоты или основания), температуры или под действием облучения (например, фотолабильные фрагменты). Фрагменты L1, способные расщепляться в восстановительных или окислительных условиях, также можно использовать в указанных конъюгатах. В некоторых вариантах реализации L1 может содержать одну аминокислоту или непрерывную последовательность аминокислот. Последовательность аминокислот может представлять собой субстратмишень для фермента. В одном из вариантов реализации L1 способен расщепляться под действием ферментов. В одном из вариантов реализации фермент представляет собой эстеразу или пептидазу. Например, L1 может расщепляться лизосомной протеазой, такой как катепсин. В одном из вариантов реализации L2 присутствует и совместно с -С(=О)О- образует саморасщепляющуюся группу или саморасщепляющиеся группы. В некоторых вариантах реализации -С(=О)О- также представляет собой саморасщепляющуюся группу. В одном из вариантов реализации, где L1 способен расщепляться под действием фермента, и L2 присутствует, фермент расщепляет связь между L1 и L2, в результате чего саморасщепляющаяся(иеся) группа(ы) высвобождает(ют) фрагмент лекарственного соединения.L1 и L2, в случае если присутствуют, могут быть связаны с помощью связывающей группы, вы- 12024118-О- (гликозидная связь). Аминогруппа в L1, которая связана с L2, может представлять собой N-конец аминокислоты или может быть получена из аминогруппы боковой цепи аминокислоты, например боковой цепи аминокислоты лизин. Карбоксильная группа в L1, которая связана с L2, может представлять собой С-конец аминокислоты или может быть получена из карбоксильной группы боковой цепи аминокислоты, например боковой цепи аминокислоты глутаминовая кислота. Гидроксигруппа в L1, которая связана с L2, может быть получена из гидроксигруппы боковой цепи аминокислоты, например боковой цепи аминокислоты серин. В одном из вариантов реализации Y представляет собой NH. В одном из вариантов реализации n равен 0 или 1. Предпочтительно n равен 0. Если Y представляет собой NH и n равен 0, то саморасщепляющуюся группу можно назвать паминобензилкарбонильным линкером (РАВС). Саморасщепляющаяся группа обеспечивает высвобождение фрагмента лекарственного соединения(т.е. несимметричного ПБД), если активируется удаленный участок линкера, при этом разложение происходит согласно представленному ниже уравнению (при n=0): гдеозначает место присоединения к фрагменту лекарственного соединения, L представляет собой активированную форму остатка линкера, высвобожденный фрагмент лекарственного соединения не показан. Эти группы обладают преимуществом, заключающимся в отделении места активации от лекарственного соединения. В другом варианте реализации -С(=О)О- и L2, взятые вместе, образуют группу, выбранную из где , волнистая линия, Y и n такие, как определено выше. Каждое фениленовое кольцо возможно замещено одним, двумя или тремя заместителями, описанными в настоящем тексте. В одном из вариантов реализации фениленовое кольцо, содержащее заместитель Y, является возможно замещенным, а фениленовое кольцо, не содержащее заместитель Y, является незамещенным. В другом варианте реализации -С(=О)О- и L2, взятые вместе, образуют группу, выбранную из где , волнистая линия, Y и n такие, как определено выше, Е представляет собой О, S или NR, D представляет собой N, СН или CR, a F представляет собой N, СН или CR. В одном из вариантов реализации D представляет собой N. В одном из вариантов реализации D представляет собой СН. В одном из вариантов реализации Е представляет собой О или S. В одном из вариантов реализации F представляет собой СН. В предпочтительном варианте реализации ковалентная связь между L1 и L2 представляет собой связь, лабильную к действию катепсина (например, способную к расщеплению). В одном из вариантов реализации L1 включает дипептид. Аминокислоты в дипептиде могут представлять собой любую комбинацию природных аминокислот и неприродных аминокислот. В некоторых вариантах реализации дипептид содержит природные аминокислоты. Если линкер представляет собой линкер, лабильный к действию катепсина, то дипептид представляет собой участок расщепления, опосредованного катепсином. Дипептид, таким образом, является участком распознавания для катепсина. В одном из вариантов реализации группа -Х 1-Х 2- в дипептиде, -NH-X1-Х 2-СО-, выбрана из-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys-, -Val-Cit-, -Phe-Cit-, -Leu-Cit-, -Ile-Cit-, -Phe-Arg- и -Trp-Cit-; где Cit представляет собой цитруллин. В указанном дипептиде -NH- представляет собой аминогруппу вX1, а СО представляет собой карбонильную группу в Х 2. Предпочтительно группа -X1-Х 2- в дипептиде, -NH-X1-X2-CO-, выбрана из-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys- и -Val-Cit-. Наиболее предпочтительно группа -X1-Х 2- в дипептиде, -NH-X1-X2-CO-, представляет собой -PheLys-, Val-Cit или -Val-Ala-. Другие важные комбинации аминокислот в дипептиде включают -Gly-Gly-, -Pro-Pro- и -Val-Glu-. Можно применять другие комбинации аминокислот в дипептиде, включая комбинации, описанные в публикации Dubowchik et al., содержание которой включено в настоящий текст посредством ссылки. В одном из вариантов реализации боковая цепь аминокислоты является химически защищенной,если это необходимо. Защитная группа боковой цепи может представлять собой группу, описанную ниже. Последовательности защищенных аминокислот способны расщепляться под действием ферментов. Например, последовательность аминокислот в дипептиде, содержащем остаток Lys с Вос-защищенной боковой цепью, способен расщепляться под действием катепсина. Защитные группы боковых цепей аминокислот хорошо известны в данной области техники и описаны в каталоге Novabiochem (Novabiochem Catalog). Дополнительные способы введения защитных групп представлены в Protective groups in Organic Synthesis, Greene and Wuts. Ниже приведены возможные защитные группы боковых цепей аминокислот, имеющих реакционноспособные функциональные группы в боковых цепяхTyr: Bzl, Z, Z-Br. В одном из вариантов реализации -Х 2- опосредованно связан с фрагментом лекарственного соединения. В указанном варианте реализации фрагмент-спейсер L2 присутствует. В одном из вариантов реализации дипептид применяют в комбинации с саморасщепляющейся(имися) группой(ами) (фрагмент-спейсер). Саморасщепляющаяся(иеся) группа(ы) может быть соединена с -Х 2-. Если саморасщепляющаяся группа присутствует, то -Х 2- связан непосредственно с саморасщепляющейся группой. В одном из вариантов реализации -Х 2- связан с группой Y саморасщепляющейся группы. Предпочтительно группа -Х 2-СО- связана с Y, где Y представляет собой NH.-X1- связан непосредственно с А 1. В одном из вариантов реализации -X1- связан непосредственно с 1 А . Предпочтительно группа -NH-X1- (N-конец X1) связана с А 1. А 1 может содержать функциональную группу -СО- и, тем самым, образовывать амидную связь с -X1-. В одном из вариантов реализации L1 и L2, взятые совместно с -ОС(=О)-, содержат группу -X1-Х 2 РАВС-. Группа РАВС связана непосредственно с фрагментом лекарственного соединения. В одном из примеров саморасщепляющаяся группа и дипептид, взятые вместе, образуют группу -Phe-Lys-PABC-,которая показана ниже гдеозначает место присоединения к фрагменту лекарственного соединения, а волнистая линия означает место присоединения к остальной части L1 или место присоединения к А 1. Предпочтительно волнистая линия означает место присоединения к А 1. В качестве альтернативы саморасщепляющаяся группа и дипептид, взятые вместе, образуют группу гдеи волнистая линия такие, как определено выше. В другом варианте реализации L1 и L2, взятые совместно с -ОС(=О)-, представляют собой гдеозначает место присоединения к фрагменту лекарственного соединения, волнистая линия означает место присоединения к A1, Y представляет собой ковалентную связь или функциональную группу, а Е представляет собой группу, которая способна к расщеплению и, тем самым, активировать саморасщепляющуюся группу. Е выбирают таким образом, чтобы группа была способной к расщеплению, например, под действием света или фермента. Е может представлять собой -NO2 или глюкуроновую кислоту (например, глюкуроновую кислоту). Первая из указанных групп может быть чувствительна к действию нитроредуктазы, а последняя - к действию -глюкуронидазы. Группа Y может представлять собой ковалентную связь. Группа Y может представлять собой функциональную группу, выбранную из-С(=О)-, -NH-, -O-, -C(=O)NH-, -С(=О)О-, -NHC(=O)-, -ОС(=O)-, -ОС(=О)О-, -NHC(=O)O-,-OC(=O)NH-, -NHC(=O)NH-, -NHC(=O)NH, -C(=O)NHC(=O)-, SO2 и -S-. Группа Y предпочтительно представляет собой -NH-, -CH2-, -О- и -S-. В некоторых вариантах реализации L1 и L2, взятые совместно с -ОС(=О)-, представляют собой гдеозначает место присоединения в фрагменту лекарственного соединения, волнистая линия означает место присоединения к A, Y представляет собой ковалентную связь или функциональную группу, а Е представляет собой глюкуроновую кислоту (например, -глюкуроновую кислоту), Y предпочтительно представляет собой функциональную группу, выбранную из -NH-. В некоторых вариантах реализации L1 и L2, взятые вместе, представляют собой гдеозначает место присоединения к остатку L2 или фрагменту лекарственного соединения, волнистая линия означает место присоединения к A1, Y представляет собой ковалентную связь или функциональную группу, а Е представляет собой глюкуроновую кислоту (например, -глюкуроновую кислоту), Y предпочтительно представляет собой функциональную группу, выбранную из -NH-, -СН 2-, -О- и -S-. В некоторых дополнительных вариантах реализации Y представляет собой функциональную группу, предложенную выше, где функциональная группа связана с аминокислотой, а аминокислота связана с удлиняющим фрагментом А 1. В некоторых вариантах реализации аминокислота представляет собой аланин. В указанном варианте реализации аминокислоту можно рассматривать в качестве эквивалента удлиняющего фрагмента. Специфичный фрагмент L1 и лиганд опосредованно связаны через удлиняющий фрагмент. L1 и А 1 могут быть связаны посредством связывающей группы, выбранной из -C(=O)NH-, -С(=О)О-, -NHC(=O)-,-ОС(=О)-, -ОС(=О)О-, -NHC(=O)O-, -OC(=O)NH- и -NHC(=O)NH-. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, am равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа А 1 представляет собой гдеозначает место присоединения к L1, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации лиганд и А 1 связаны посредством тиольного остатка лиганда и малеимидной группы в А 1. В одном из вариантов реализации лиганд и А 1 связаны посредством гдеозначает место присоединения к остатку A1, L1, L2 или D, а волнистая линия означает место присоединения к остатку лиганда. В этом варианте реализации атом S, как правило, происходит из лиганда. В каждом из вариантов реализации, предложенных выше, можно применять альтернативную функциональную группу вместо группы, полученной из малеимида, показанной ниже где волнистая линия означает место присоединения к лиганду, как указано выше, аозначает связь с остатком группы А 1 или с L1, L2 или D. В одном из вариантов реализации группа, полученная из малеимида, замещена на группу где волнистая линия означает место присоединения к лиганду, аозначает связь с остатком группы А 1 или с L1, L2 или D. В одном из вариантов реализации группа, полученная из малеимида, замещена на группу, которая,возможно взятая совместно с лигандом (например, связывающегося с клетками агента), выбрана из-C(=O)NH-, -С(=О)О-, -NHC(=O)-, -ОС(=О)-, -OC(=O)-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-,-NHC(=O)NH, -C(=O)NHC(=O)-, -S-, -S-S-, -CH2C(=O)-, -C(=O)CH2-, =N-NH- и -NH-N=. В одном из вариантов реализации группа, полученная из малеимида, замещена на группу, которая,возможно взятая совместно с лигандом, выбрана из где волнистая линия означает место присоединения к лиганду или связь с остатком группы А 1, аозна- 17024118 чает другое место присоединения к лиганду или связь с остатком группы А 1. Другие группы, подходящие для связывания L1 со связывающимся с клетками агентом, описаны вWO 2005/082023. В одном из вариантов реализации удлиняющий фрагмент А 1 присутствует, специфичный фрагмент 1L присутствует, а фрагмент-спейсер L2 отсутствует. Таким образом, L1 и фрагмент лекарственного соединения напрямую соединены посредством связи, и это эквивалентно тому, что в указанном варианте реализации L2 представляет собой связь.L1 и D могут быть связаны при помощи связывающей группы, выбранной из -C(=O)NH-, -С(=O)O-,-NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH- и -NHC(=O)NH-. В одном из вариантов реализации L1 и D предпочтительно соединены при помощи связывающей группы, выбранной из -C(=O)NH- и -NHC(=O)-. В одном из вариантов реализации L1 содержит дипептид, и один из концов дипептида связан с D. Как описано выше, аминокислоты, входящие в состав дипептида, могут представлять собой любую комбинацию природных аминокислот и неприродных аминокислот. В некоторых вариантах реализации дипептид содержит природные аминокислоты. Если линкер представляет собой линкер, лабильный к действию катепсина, то дипептид представляет собой участок расщепления, опосредованного катепсином. Дипептид, таким образом, является участком распознавания для катепсина. В одном из вариантов реализации группа -Х 1-Х 2- в дипептиде, -NH-X1-Х 2-СО-, выбрана из -Phe-Lys-,-Val-Ala-, -Val-Lys-, -Ala-Lys-, -Val-Cit-, -Phe-Cit-, -Leu-Cit-, -Ile-Cit-, -Phe-Arg- и -Trp-Cit-; где Cit представляет собой цитруллин. В указанном дипептиде -NH- представляет собой аминогруппу в X1, а СО представляет собой карбонильную группу в Х 2. Предпочтительно группа -X1-Х 2- в дипептиде, -NH-X1-X2-CO-, выбрана из -Phe-Lys-, -Val-Ala-,-Val-Lys-, -Ala-Lys- и -Val-Cit-. Наиболее предпочтительно группа -Х 1-Х 2- в дипептиде, -NH-X1-X2-CO-, представляет собой -PheLys- или -Val-Ala-. Другие важные комбинации аминокислот в дипептиде включают -Gly-Gly-, -Pro-Pro- и -Val-Glu-. Можно применять другие комбинации аминокислот в дипептиде, включая описанные выше. В одном из вариантов реализации L1-D представляет собой где -NH-X1-Х 2-СО представляет собой дипептид, -NH- является частью фрагмента лекарственного соединения,означает место присоединения к остатку фрагмента лекарственного соединения, а волнистая линия означает место присоединения к остатку L1 или место присоединения к А 1. Предпочтительно волнистая линия означает место присоединения к А 1. В одном из вариантов реализации дипептид представляет собой валин-аланин, a L1-D представляет собой где , -NH- и волнистая линия такие, как определено выше. В одном из вариантов реализации дипептид представляет собой фенилаланин-лизин, a L1-D представляет собой где , -NH- и волнистая линия такие, как определено выше. В одном из вариантов реализации дипептид представляет собой валин-цитруллин. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5.- 18024118 В одном из вариантов реализации группы A1-L1 представляют собой гдеозначает место присоединения к D, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к D, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, а m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к D, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, am равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 7, предпочтительно от 3 до 7, наиболее предпочтительно 3 или 7. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к лиганду, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, а m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы А 1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к лиган- 19024118 ду, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, а m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к D, S представляет собой серосодержащую группу лиганда, волнистая линия означает место присоединения к остальной части лиганда, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к D, S представляет собой серосодержащую группу лиганда, волнистая линия означает место присоединения к остальной части лиганда, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к D, S представляет собой серосодержащую группу лиганда, волнистая линия означает место присоединения к остальной части лиганда, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к D, волнистая линия означает место присоединения к лиганду, n равен 0 или 1, а m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 7, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к остатку лиганда, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к остатку лиганда, а n равен от 0 до 6. В одном из вариантов реализации n равен 5. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к остатку лиганда, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, аm равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации группы L-A1-L1 представляют собой гдеозначает место присоединения к L2 или D, волнистая линия означает место присоединения к остатку лиганда, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, аm равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8, наиболее предпочтительно 4 или 8. В одном из вариантов реализации удлиняющий фрагмент представляет собой ацетамидное звено,имеющее формулу гдеозначает место присоединения к остатку удлиняющего фрагмента, L1 или D, а волнистая линия означает место присоединения к лиганду. В других вариантах реализации предложены лекарственные соединения, связанные с линкером, для конъюгации с лигандом. В одном из вариантов реализации лекарственные соединения, связанные с линкером, предназначены для соединения со связывающимся с клетками агентом. В одном из вариантов реализации лекарственное соединение, связанное с линкером, имеет формулу гдеозначает место присоединения к фрагменту лекарственного соединения, G1 представляет собой удлиняющий фрагмент (А 1) для образования связи с лигандом, L1 представляет собой специфичный фрагмент, L2 (фрагмент-спейсер) представляет собой ковалентную связь или, взятый совместно с-ОС(=О)-, образует саморасщепляющуюся(иеся) группу(ы). В другом варианте реализации лекарственное соединение, связанное с линкером, имеет формулу гдеозначает место присоединения к фрагменту лекарственного соединения, G1 представляет собой удлиняющий фрагмент (А 1) для образования связи с лигандом, L1 представляет собой специфичный фрагмент, L2 (фрагмент-спейсер) представляет собой ковалентную связь или саморасщепляющуюся(иеся) группу(ы).L1 и L2 являются такими, как определено выше. Выражение "связывание с А 1" можно рассматривать в данном случае как связывание с G1. В одном из вариантов реализации, когда L1 содержит аминокислоту, боковая цепь этой аминокислоты может быть защищена. Можно использовать любые подходящие защитные группы. В одном из вариантов реализации защитные группы боковой цепи способны удаляться совместно с другими защитными группами, присутствующими в соединении. В других вариантах реализации защитные группы могут быть расположены ортогонально по отношению к другим защитным группам, присутствующим в молекуле. Подходящие защитные группы боковых цепей аминокислот включают группы, описанные в каталоге Novabiochem 2006/2007 (Novabiochem Catalog 2006/2007). Защитные группы для линкера, лабильного к действию катепсина, также описаны в источнике Dubowchik et al. В конкретных вариантах реализации группа L1 включает остаток аминокислоты Lys. Боковая цепь этой аминокислоты может быть защищена при помощи Boc- или Alloc-защитных групп. Вос-защитная группа является наиболее предпочтительной. Функциональная группа G1 образует связывающую группу в результате взаимодействия с лигандом- 21024118 В одном из вариантов реализации функциональная группа G1 представляет собой или содержит аминокислоту, карбоновую кислоту, гидроксигруппу, тиольную или малеимидную группу для взаимодействия с соответствующей группой лиганда. В предпочтительном варианте реализации G1 содержит малеимидную группу. В одном из вариантов реализации группа G1 представляет собой алкилмалеимидную группу. Эта группа подходит для взаимодействия с тиольными группами, в частности с тиольными группами цистеина, присутствующими в связывающемся с клетками агенте, например присутствующими в антителе. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, L2 или D, a n равен от 0 до 6. В одном из вариантов реализацииn равен 5. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, L2 или D, a n равен от 0 до 6. В одном из вариантов реализацииn равен 5. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 2, предпочтительно от 4 до 8 и наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8 и наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, L2 или D, a n равен от 0 до 6. В одном из вариантов реализацииn равен 5. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, L2 или D, a n равен от 0 до 6. В одном из вариантов реализацииn равен 5. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 2, предпочтительно от 4 до 8 и наиболее предпочтительно 4 или 8. В одном из вариантов реализации группа G1 представляет собой гдеозначает место присоединения к L1, n равен 0 или 1, a m равен от 0 до 30. В предпочтительном варианте реализации n равен 1, a m равен от 0 до 10, от 1 до 8, предпочтительно от 4 до 8 и наиболее предпочтительно 4 или 8. В каждом из предложенных выше вариантов реализации можно использовать альтернативную функциональную группу вместо малеимидной группы, показанной ниже гдеозначает связь с остатком группы G. В одном из вариантов реализации группа, полученная из малеимида, замещена на группу гдеозначает связь с остатком группы G. В одном из вариантов реализации малеимидная группа замещена на группу, выбранную из-С(=О)ОН, -ОН, -NH2, -SH, -С(=О)СН 2 Х, где X представляет собой Cl, Br или I, -СНО, -NHNH2,-ОСН и -N3 (азид). В одном из вариантов реализации L1 присутствует, a G1 представляет собой -NH2, -NHMe, -СООН,-ОН или -SH. В одном из вариантов реализации, когда L1 присутствует, G1 представляет собой -NH2 или -NHMe. Каждая из групп может представлять собой N-конец последовательности аминокислот в L1. В одном из вариантов реализации L1 присутствует, G1 представляет собой -NH2, a L1 представляет собой последовательность аминокислот -X1-Х 2-, как определено выше. В одном из вариантов реализации L1 присутствует, a G1 представляет собой СООН. Эта группа может представлять собой С-конец последовательности аминокислот в L1. В одном из вариантов реализации L1 присутствует, a G1 представляет собой ОН. В одном из вариантов реализации L1 присутствует, a G1 представляет собой SH. Группа G1 способна превращаться из одной функциональной группы в другую. В одном из вариантов реализации L1 присутствует, a G1 представляет собой -NH2. Эта группа способна превращаться в другую группу G1, содержащую малеимидную группу. Например, группу -NH2 можно подвергать взаимодействию с кислотами или активированной кислотой (например, с N-сукцинимидными формами кислот) тех групп G1, содержащих малеимидную группу, показанную выше. Группу G1, таким образом, можно превращать в функциональную группу, которая более подходит для взаимодействия с лигандом. Как отмечалось выше, в одном из вариантов реализации L1 присутствует, a G1 представляет собой-NH2, -NHMe, -СООН, -ОН или -SH. В дополнительном варианте реализации эти группы предложены в химически защищенной форме. Химически защищенная форма, таким образом, является предшественником линкера, который содержит функциональную группу. В одном из вариантов реализации G1 представляет собой -NH2 в химически защищенной форме. Эта группа может быть защищена карбаматной защитной группой. Карбаматная защитная группа может быть выбрана из группы, состоящей из Alloc, Fmoc, Boc, Troc, Теос, Cbz и PNZ. Предпочтительно, если G1 представляет собой -NH2, то она защищена Alloc- или Fmoc-группой. В одном из вариантов реализации, если G1 представляет собой -NH2, то она защищена Fmocгруппой. В одном из вариантов реализации защитная группа является такой же, как и карбаматная защитная группа кэппирующей группы. В одном из вариантов реализации защитная группа отличается от карбаматной защитной группы кэппирующей группы. В этом варианте реализации предпочтительно, чтобы защитная группа была способна удаляться в условиях, при которых не происходит удаление карбаматной защитной группы кэппирующей группы. Химическую защитную группу можно удалять для получения функциональной группы, связывающейся с лигандом. Эта функциональная группа затем необязательно может быть превращена в другую функциональную группу, описанную выше. В одном из вариантов реализации активная группа представляет собой амин. Этот амин предпочтительно представляет собой N-терминальный амин, входящий в состав пептида, а также может представлять собой N-терминальный амин, входящий в состав предпочтительных дипептидов согласно настоящему изобретению. Активную группу можно подвергать взаимодействию с образованием функциональной группы,предназначенной для образования связи с лигандом. В других вариантах реализации линкер представляет собой предшественник линкера, содержащего активную группу. В этом варианте реализации линкер содержит активную группу, которая защищена с помощью защитной группы. Защитную группу можно удалить для получения линкера, содержащего активную группу. Если активная группа представляет собой амин, то защитная группа может представлять собой защитную группу аминогруппы, например, описанную в источнике Green and Wuts. Защитная группа предпочтительно расположена ортогонально по отношению к другим защитным группам, присутствующим в линкере. В одном из вариантов реализации защитная группа расположена ортогонально к кэппирующей группе. Таким образом, защитная группа активной группы способна удаляться с сохранением кэппирующей группы. В других вариантах реализации защитная группа и кэппирующая группа способна удаляться в тех же условиях, что и, например, условия для удаления кэппирующей группы. В одном из вариантов реализации линкер представляет собой гдеозначает место присоединения к фрагменту лекарственного соединения, а волнистая линия означает место присоединения к остатку линкера, если он присутствует, или место присоединения к G1. Предпочтительно волнистая линия означает место присоединения к G1. В одном из вариантов реализации линкер представляет собой гдеи волнистая линия являются такими, как определено выше. Другие функциональные группы, подходящие для применения для образования связи между L1 и связывающимся с клетками агентом, описаны в WO 2005/082023. Лиганд. Лиганд может быть любым и включает белок, полипептид, пептид и непептидный агент, который специфично связывается с молекулой-мишенью. В некоторых вариантах реализации лиганд может представлять собой белок, полипептид или пептид. В некоторых вариантах реализации лиганд может представлять собой циклический полипептид. Эти лиганды могут включать антитела или фрагмент антитела,который содержит по меньшей мере один участок связывания с молекулой-мишенью, лимфокины, гормоны, факторы роста или любые другие связывающиеся с клетками молекулы или вещества, которые могут специфично связываться с мишенью. Примеры лигандов включают агенты, описанных для применения в документе WO 2007/085930,- 24024118 содержание которого включено в настоящий текст посредством ссылки. В некоторых вариантах реализации лиганд представляет собой связывающийся с клетками агент,который связывается с внеклеточной мишенью на поверхности клетки. Указанный связывающийся с клетками агент может представлять собой белок, полипептид, пептид или непептидный агент. В некоторых вариантах реализации связывающийся с клетками агент может представлять собой белок, полипептид или пептид. В некоторых вариантах реализации связывающийся с клетками агент может представлять собой циклический полипептид. Связывающийся с клетками агент также может представлять собой антитело или антигенсвязывающий фрагмент антитела. Таким образом, в одном из вариантов реализации в настоящем изобретении предложен конъюгат антитело-лекарственное средство (ADC). В одном из вариантов реализации антитело представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело, полностью человеческое антитело или одноцепочечное антитело. Один из вариантов реализации антитела представляет собой фрагмент одного из представленных антител, имеющих биологическую активность. Примеры указанных фрагментов включают фрагментыFab, Fab', F(ab')2 и Fv. Антитело может представлять собой диатело, доменное антитело (DAB) или одноцепочечное антитело. В одном из вариантов реализации антитело представляет собой моноклональное антитело. Антитела для применения в настоящем изобретении включают антитела, описанные в документеWO 2005/082023, содержание которого включено в настоящее описание посредством ссылки. Особенно предпочтительными являются антитела к опухолеассоциированным антигенам. Примеры указанных антигенов, известных в данной области техники, включают, но не ограничиваются ими, опухолеассоциированные антигены, представленные в WO 2005/082023. См., например, стр. 41-55. В некоторых вариантах реализации указанные конъюгаты предназначены для направленного действия на опухолевые клетки через антигены, расположенные на поверхности клетки. Антигены могут представлять собой антигены, расположенные на поверхности клетки, которые сверхэкспрессируются или экспрессируются с отклонениями по времени или атипичными клетками. Предпочтительно антигенмишень экспрессируется только пролиферирующими клетками (предпочтительно опухолевыми клетками); тем не менее, это явление редко наблюдают на практике. В результате, антигены-мишени, как правило, выбирают на основании дифференциальной экспрессии между пролиферирующими и здоровыми тканями. Были разработаны антитела для направленного действия на определенные опухолеассоциированные антигены, включая Cripto, CD19, CD20, CD22, CD30, CD33, гликопротеин NMB, CanAg, Her2(ErbB2/Neu), CD56 (NCAM), CD70, CD79, CD138, PSCA, ПСМА (простатспецифический мембранный антиген) (PSMA), ВСМА, Е-селектин, EphB2, меланотрансферин (Melanotransferin), Muc16 и TMEFF2. Лиганд связан с линкером. В одном из вариантов реализации лиганд связан с А, входящим в состав линкера, если А присутствует. В одном из вариантов реализации лиганд связан с линкером посредством простой тиоэфирной связи. В одном из вариантов реализации лиганд соединен с линкером посредством дисульфидной связи. В одном из вариантов реализации лиганд соединен с линкером посредством амидной связи. В одном из вариантов реализации лиганд соединен с линкером посредством сложноэфирной связи. В одном из вариантов реализации связывание лиганда и линкера осуществляется посредством связывания тиольной группы остатка цистеина в лиганде и малеимидной группы в линкере. Остатки цистеина в лиганде могут быть доступны для взаимодействия с функциональными группами линкера для образования связи. В других вариантах реализации, например, когда лиганд представляет собой антитело, тиольные группы антитела могут участвовать в образовании межцепочечных дисульфидных связей. Эти межцепочечные связи можно превращать в свободные тиольные группы, например,путем обработки антитела DTT до взаимодействия с функциональной группой линкера. В некоторых вариантах реализации остаток цистеина вводят в тяжелую или легкую цепь антитела. Положения, в которые вводят цистеин в результате реакции замещения в тяжелых или легких цепях антитела, включают положения, описанные в публикации заявки US 2007/0092940 и публикации международной заявки WO 2008070593, содержание которых включено в настоящее описание. Способы лечения. Конъюгаты согласно настоящему изобретению можно применять в способе терапии. Также предложен способ лечения, включающий введение субъекту, нуждающемуся в лечении, терапевтически эффективного количество конъюгата формулы I. Термин "терапевтически эффективное количество" означает количество, достаточное для достижения благоприятного действия для пациента. Указанное благоприятное действие может представлять собой, по меньшей мере, облегчение по меньшей мере одного симптома. Фактическое количество вводимого конъюгата, а также скорость и длительность введения будут зависеть от характера и степени тяжести состояния, подвергаемого лечению. Назначения для лечения, например выбор дозировки, входят в зону ответственности врачей общей практики и других лечащих врачей. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,01 до примерно 10 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,01 до примерно 5 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,05 до примерно 5 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,1 до примерно 5 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,1 до примерно 4 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,05 до примерно 3 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,1 до примерно 3 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,1 до примерно 2 мг/кг на дозу. В некоторых вариантах реализации количество вводимого конъюгата находится в диапазоне от примерно 0,01 до примерно 1 мг/кг на дозу. Конъюгат можно вводить индивидуально или в комбинации с другими способами лечения, например, одновременно или последовательно, в зависимости от состояния, подвергаемого лечению. Примеры способов лечения и терапий включают, но не ограничиваются ими, химиотерапию (введение активных агентов, включая, например, лекарственные средства, оперативное вмешательство и лучевую терапию). Фармацевтические композиции согласно настоящему изобретению и для применения согласно настоящему изобретению могут включать в дополнение к активному ингредиенту, т.е. к конъюгату формулы I, фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие вещества,хорошо известные специалистам в данной области техники. Указанные вещества должны быть нетоксичными и не должны снижать эффективность активного ингредиента. Конкретная природа носителя или другого вещества будет зависеть от способа введения, который может быть пероральным или представлять собой инъекцию, например кожную, подкожную или внутривенную. Фармацевтические композиции для перорального введения могут находиться в форме таблеток,капсул, порошка или в жидкой форме. Таблетка может содержать твердый носитель или адъювант. Жидкие фармацевтические композиции, как правило, содержат жидкий носитель, такой как вода, минеральные, животные или растительные масла, минеральные или синтетические масла. В такую композицию может быть включен физиологический солевой раствор, декстрозы или раствор другого сахарида, или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Капсула может включать твердый носитель, такой как желатин. В случае внутривенной, кожной или подкожной инъекции или инъекции в очаг поражения активный ингредиент должен находиться в форме водного раствора, приемлемого для парентерального введения, который является апирогенным и имеет подходящие рН, изотоничность и стабильность. Специалисты в данной области техники могут приготовить подходящие растворы с применением, например, изотонических разбавителей, таких как хлорид натрия для инъекций, раствор Рингера для инъекций, лактированный раствор Рингера для инъекций. Консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки можно вводить в состав при необходимости. Другие формы. Если не указано иное, предложенные выше заместители включают хорошо известные ионные формы, соли, сольваты и защищенные формы предложенных заместителей. Например, ссылка на карбоновую кислоту (-СООН) также включает анионную (карбоксилатную) форму (-СОО-), соль или сольват кислоты, а также традиционные защищенные формы. Аналогично, ссылка на аминогруппу включает протонированную форму (-N+HR1R2), соль или сольват аминогруппы, например гидрохлоридную соль, а также традиционные защищенные формы аминогруппы. Аналогично, ссылка на гидроксильную группу также включает анионную форму (-O-), соль или сольват указанной группы, а также традиционные защищенные формы. Соли. Могут быть удобными или желательными получение, очистка и/или обращение с соответствующей солью активного соединения (конъюгата), например фармацевтически приемлемой солью. Примеры фармацевтически приемлемых солей описаны в публикации Berge, et al., J. Pharm. Sci, 66, 1-19 (1977). Например, если соединение является анионным или содержит функциональную группу, которая может быть анионной (например, -СООН может представлять собой -СОО-), в данном случае возможно образование соли с подходящим катионом. Примеры подходящих неорганических катионов включают,но не ограничиваются ими, ионы щелочных металлов, такие как Na+ и K+, катионы щелочно-земельных металлов, такие как Са 2+ и Mg2+, и другие катионы, такие как Al3+. Примеры подходящих органических катионов включают, но не ограничиваются ими, ион аммония (NH4+) и замещенные ионы аммония (например, NH3R+, NH2R2+, NHR3+, NR4+). Примерами некоторых подходящих замещенных ионов аммония являются ионы, полученные из этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина,меглумина и трометамина, а также из аминокислот, таких как лизин и аргинин. Примером распространенного четвертичного иона аммония является N(CH3)4+. Если конъюгат является катионным или содержит функциональную группу, которая может быть- 26024118 катионной (например, -NH2 может представлять собой -NH3+), в данном случае возможно образование соли с подходящим анионом. Примеры подходящих неорганических анионов включают, но не ограничиваются ими, анионы, полученные из следующих неорганических кислот: хлороводородной, бромоводородной, йодоводородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры подходящих органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих органических кислот: 2-ацетилоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфокислоты, коричной, лимонной, этилендиаминтетрауксусной, этандисульфокислоты, этансульфокислоты, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гидроксималеиновой, гидроксинафталинкарбоновой, изетионовой, молочной, лактобионовой, лауриновой, малеиновой, яблочной, метансульфокислоты, муциновой, олеиновой, щавелевой, пальмитиновой, памовой, пантотеновой, фенилуксусной, фенилсульфокислоты, пропионовой, виноградной, салициловой, стеариновой, янтарной, сульфаниловой, винной, толуолсульфокислоты и валериановой. Примеры подходящих полимерных органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы. Сольваты. Могут быть удобными или желательными получение, очистка и/или обращение с соответствующим сольватом конъюгата(ов). Термин "сольват" используют в настоящем описании в общепринятом значении для обозначения комплекса растворенного вещества (например, активного конъюгата, соли активного конъюгата) и растворителя. Если растворитель представляет собой воду, то сольват обычно называют гидратом, например моногидратом, дигидратом, тригидратом и т.д. Карбиноламины. Изобретение включает конъюгат, в котором происходит присоединение растворителя по иминной связи фрагмента ПБД, что показано ниже для мономера ПБД, где растворитель представляет собой воду или спирт (RAOH, где RA представляет собой C1-4 алкил) Эти формы можно назвать карбиноламинной и простой эфирной карбиноламинной формой ПБД. Положение равновесия в этих реакциях зависит от формы, в которой находятся соединения, а также от природы самого фрагмента. Указанные конкретные соединения можно выделить в твердом виде, например, путем лиофилизации. Изомеры. Конкретные соединения могут существовать в одной или более конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, атропоизмерных, стереоизомерных, таутомерных, конформационных или аномерных формах, включая, но не ограничиваясь ими, цис- и транс-формы; Е- и Z-формы; с-, t- и r-формы; эндо- и экзоформы; R-, S- и мезоформы; D- и L-формы; d- и l-формы; (+)и (-)-формы; кето-, -енольные и -енолятные формы; син- и антиформы; синклинальные и антиклинальные формы; - и -формы; аксиальные и экваториальные формы; конформации "ванна", "кресло","твист", "конверт" и "полукресло"; а также их комбинации, которые далее в целом называют "изомерами" (или "изомерными формами"). Необходимо отметить, что за исключением описанного ниже для таутомерных форм из термина"изомеры", используемого в настоящем описании, специально исключены структурные (или конституционные) изомеры (т.е. изомеры, имеющие различные связи между атомами, а не только различное положение атомов в пространстве). Например, ссылку на метоксигруппу -ОСН 3 не следует рассматривать как ссылку на ее структурный изомер - гидроксиметильную группу -CH2OH. Аналогично, ссылку на ортохлорфенил не следует рассматривать как ссылку на его структурный изомер метахлорфенил. Тем не менее, ссылка на класс структур вполне может включать структурные изомерные формы, входящие в состав этого класса (например, C1-7 алкил включает н-пропил и изопропил; бутил включает н-, изо-, втори трет-бутил; метоксифенил включает орто-, мета- и параметоксифенил). Указанное выше исключение не относится к таутомерным формам, например, кето-, -енольным и-енолятным формам, как, например, в случае следующих таутомерных пар: кето/енол (показано ниже),имин/енамин, амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/аци-нитро. Следует отметить, что в термин "изомер" специально включены соединения с замещением одного или более атомов изотопами. Например, Н может представлять собой любой изотоп, включая 1 Н, 2 Н (D) и 3 Н (Т); С может представлять собой любой изотоп, включая 12 С, 13 С и 14 С; О может представлять собой любой изотоп, включая 16 О и 18 О; и т.п. Если не указано иное, ссылка на конкретное соединение или конъюгат включает все указанные изомерные формы, включая (полностью или частично) рацемические и другие смеси. Способы получения (например, асимметрический синтез) и разделения (например, фракционная кристаллизация и хроматографические методы) указанных изомерных форм известны из уровня техники или легкодоступны за счет известной адаптации способов, описанных в настоящем тексте, или известных способов. Общие способы синтеза Синтез димеров ПБД широко обсуждается в следующих источниках, содержание которых включено в настоящее описание посредством ссылки:d) WO 2005/085251 (стр.30-39). Способ синтеза. Конъюгаты согласно настоящему изобретению, где R10 и R11 образуют двойную азот-углеродную связь между атомами азота и углерода, к которым они присоединены, можно синтезировать из соединения формулы 2 Формула 2 где R2, R6, R7, R9, R6', R7', R9', R12, X, X' и R" являются такими, как определено для соединений формулыII, ProtN представляет собой защитную группу атома азота для проведения синтеза, a ProtO представляет собой защищенную кислородсодержащую группу для проведения синтеза или оксогруппу, путем снятия защиты иминной связи при помощи традиционных методов. Получаемое соединение может находиться в карбиноламинной форме или простой эфирной карбиноламинной форме в зависимости от используемых растворителей. Например, если ProtN представляет собой Alloc, a ProtO представляет собой защитную группу атома кислорода для проведения синтеза, то снятие защиты проводят с применением палладия для удаления N10-защитной группы и последующим удалением защитной группы атома кислорода для проведения синтеза. Если ProtN представляет собойTroc, a ProtO представляет собой защитную группу атома кислорода для проведения синтеза, то снятие защиты проводят с применением пары металлов Cd/Pb с получением соединения формулы (I). Если ProtN представляет собой SEM или аналогичную группу, a ProtO представляет собой оксогруппу, то оксогруппу можно удалить путем восстановления, которое приводит к образованию промежуточного защищенного карбиноламина, который затем можно обработать для удаления SEM-защитной группы, а затем удалить воду. Восстановление соединения формулы 2 можно проводить, например, при помощи тетраборгидрида лития, в то же время подходящим способом удаления SEM-защитной группы является обработка силикагелем. Соединения формулы 2 можно синтезировать из соединения формулы 3 а Формула 3 а где R2, R6, R7, R9, R6', R7', R9', X, X' и R" являются такими, как определено для соединений формулы 2,путем сочетания с металлорганическим производным, содержащим R12, например с борорганическим производным. Борорганическое производное может представлять собой боронат или бороновую кислоту. Соединения формулы 2 можно синтезировать из соединения формулы 3b- 28024118 где R12, R6, R7, R9, R6', R7', R9', X, X' и R" являются такими, как определено для соединений формулы 2,путем сочетания с металлорганическим производным, содержащим R2, например с борорганическим производным. Борорганическое производное может представлять собой боронат или бороновую кислоту. Соединения формул 3 а и 3b можно синтезировать из соединения формулы 4 Формула 4 где R2, R6, R7, R9, R6', R7', R9', X, X' и R" являются такими, как определено для соединений формулы 2,путем сочетания примерно с одним эквивалентом (например, от 0,9 или 1 до 1,1 или 1,2) металлорганического производного, например борорганического производного, содержащего R2 или R12. Реакции сочетания, описанные выше, как правило, проводят в присутствии палладиевого катализатора, например Pd(PPh3)4, Pd(OCOCH3)2, PdCl2 или Pd2(dba)3. Реакцию сочетания можно проводить в обычных условиях, но также можно проводить при микроволновом облучении. Две стадии реакции сочетания, как правило, проводят последовательно. Их можно проводить с проведением очистки между двумя стадиями или без нее. Если очистку не проводят, то две стадии можно проводить в одном реакционном сосуде. Проведение очистки обычно требуется после второй стадии реакции сочетания. Очистку соединения от нежелательных побочных продуктов можно проводить путем колоночной хроматографии или ион-обменного разделения. Синтез соединений формулы 4, где ProtO представляет собой оксогруппу, a ProtN представляет собой SEM, подробно описан в документе WO 00/12508, содержание которого включено в настоящее описание посредством ссылки. В частности, в настоящем описании приведена ссылка на схему 7 на стр. 24,где предложенное выше соединение обозначено как промежуточное вещество Р. Этот способ синтеза также описан в WO 2004/043963. Синтез соединений формулы 4, где ProtO представляет собой защищенную кислородсодержащую группу, описан в документе WO 2005/085251, в котором описан синтез, включенный в настоящее описание посредством ссылки. Соединения формулы I, где R10 и R10' представляют собой Н, a R11 и R11' представляют собой SOzM,можно синтезировать из соединений формулы I, где R10 и R11 образуют двойную азот-углеродную связь между атомами азота и углерода, к которым они присоединены, путем присоединения соответствующей бисульфитной соли или сульфинатной соли и последующей стадии соответствующей очистки. Дополнительные способы описаны в документе GB 2053894, содержание которого включено в настоящее описание посредством ссылки. Защитные группы атома азота для проведения синтеза. Защитные группы атома азот для проведения синтеза хорошо известны в данной области техники. В настоящем изобретении особое внимание уделяют карбаматным защитным группам атома азота и гемиаминальным защитным группам атома азота. Карбаматные защитные группы атома азота имеют следующую структуру: где R'10 представляет собой R, определенный выше. Большое число подходящих групп описано в источнике Greene, T.W. and Wuts, G.M., Protective Groups in Organic Synthesis, 3rd Edition, John WileySons,Inc., 1999, стр. 503-549, содержание которого включено в настоящее описание посредством ссылки. Особенно предпочтительные защитные группы включают Troc, Teoc, Fmoc, BOC, Doc, Hoc, ТсВОС,1-Adoc и 2-Adoc. Другими возможными группами являются нитробензилоксикарбонил (например, 4-нитробензилоксикарбонил) и 2-(фенилсульфонил)этоксикарбонил. Защитные группы, которые можно удалить с помощью палладиевого катализа, например Alloc, не являются предпочтительными. Гемиаминальные защитные группы атома азота имеют следующую структуру: где R'10 представляет собой R, определенный выше. Большое число подходящих групп описано в качестве защитных групп амидной группы в источнике Greene, T.W. and Wuts, G.M., Protective Groups in Or- 29
МПК / Метки
МПК: A61K 47/48, A61P 35/00, A61P 37/00
Метки: направленного, пирролбензодиазепина, действия, конъюгаты
Код ссылки
<a href="https://eas.patents.su/30-24118-konyugaty-pirrolbenzodiazepina-napravlennogo-dejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты пирролбензодиазепина направленного действия</a>
Предыдущий патент: Система сливного бачка для смывной воды мобильного туалета
Следующий патент: Дозирующий насос
Случайный патент: Гидратированные n-фуллерен-аминокислоты, способ их получения и фармацевтические композиции на их основе