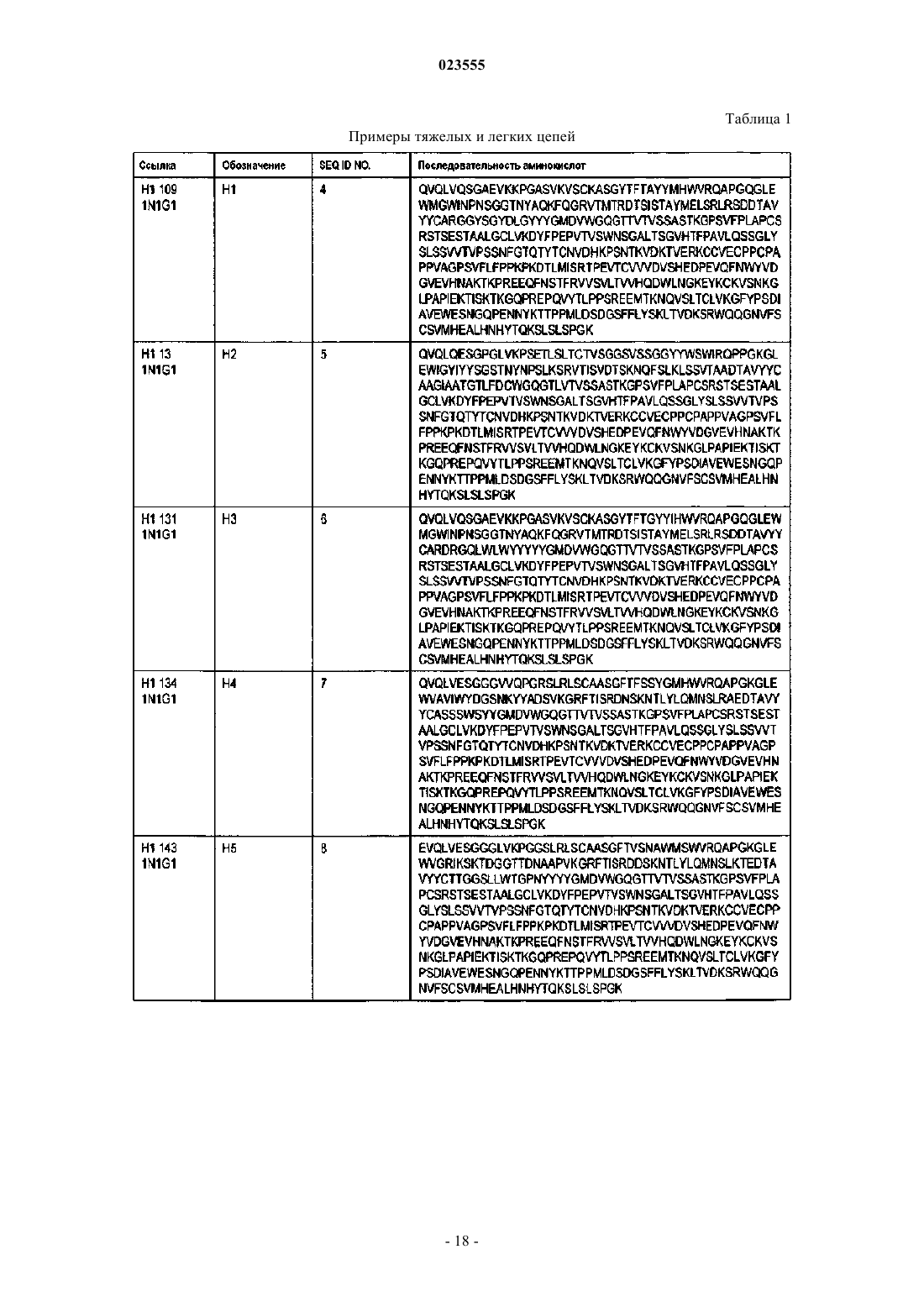
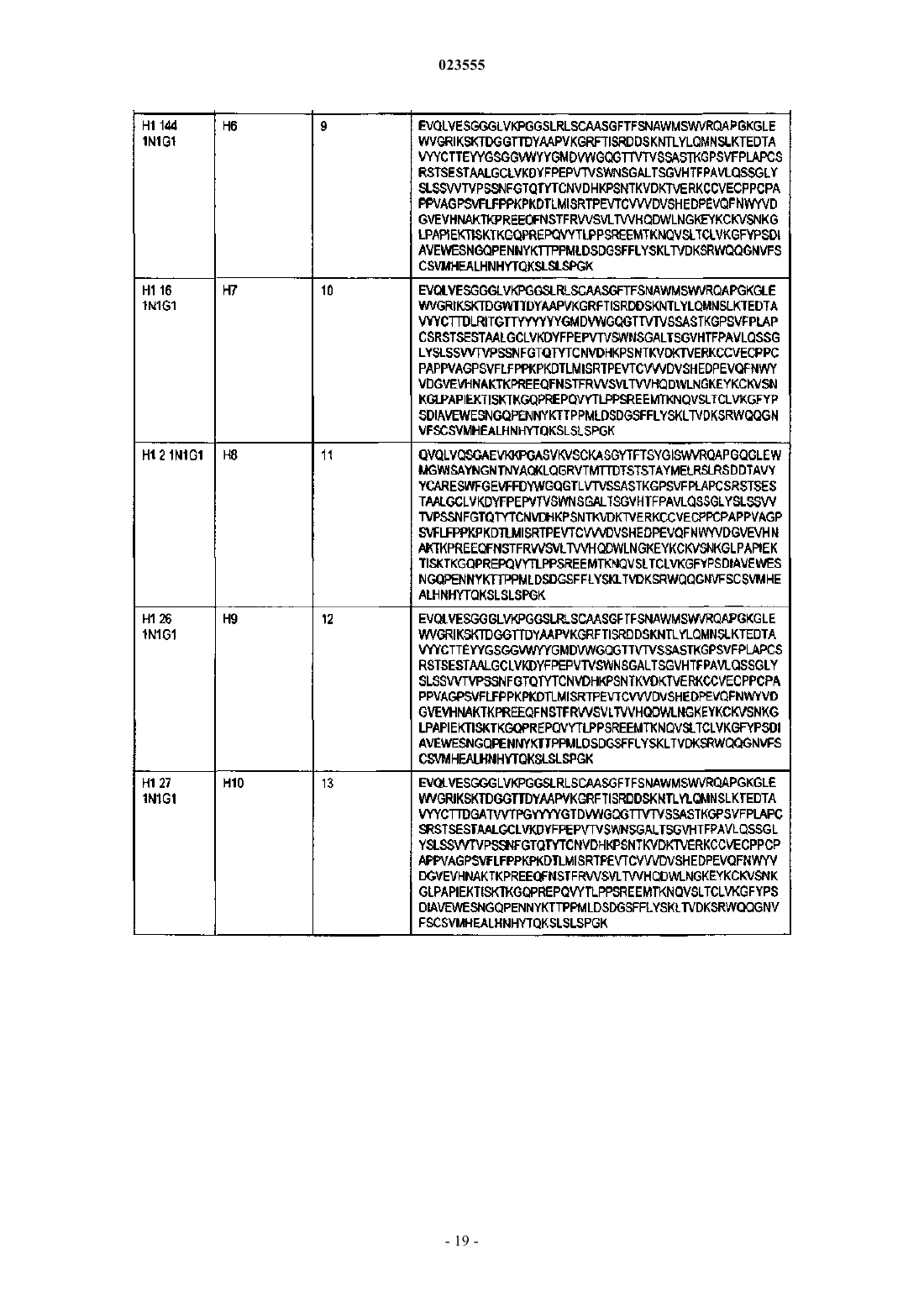
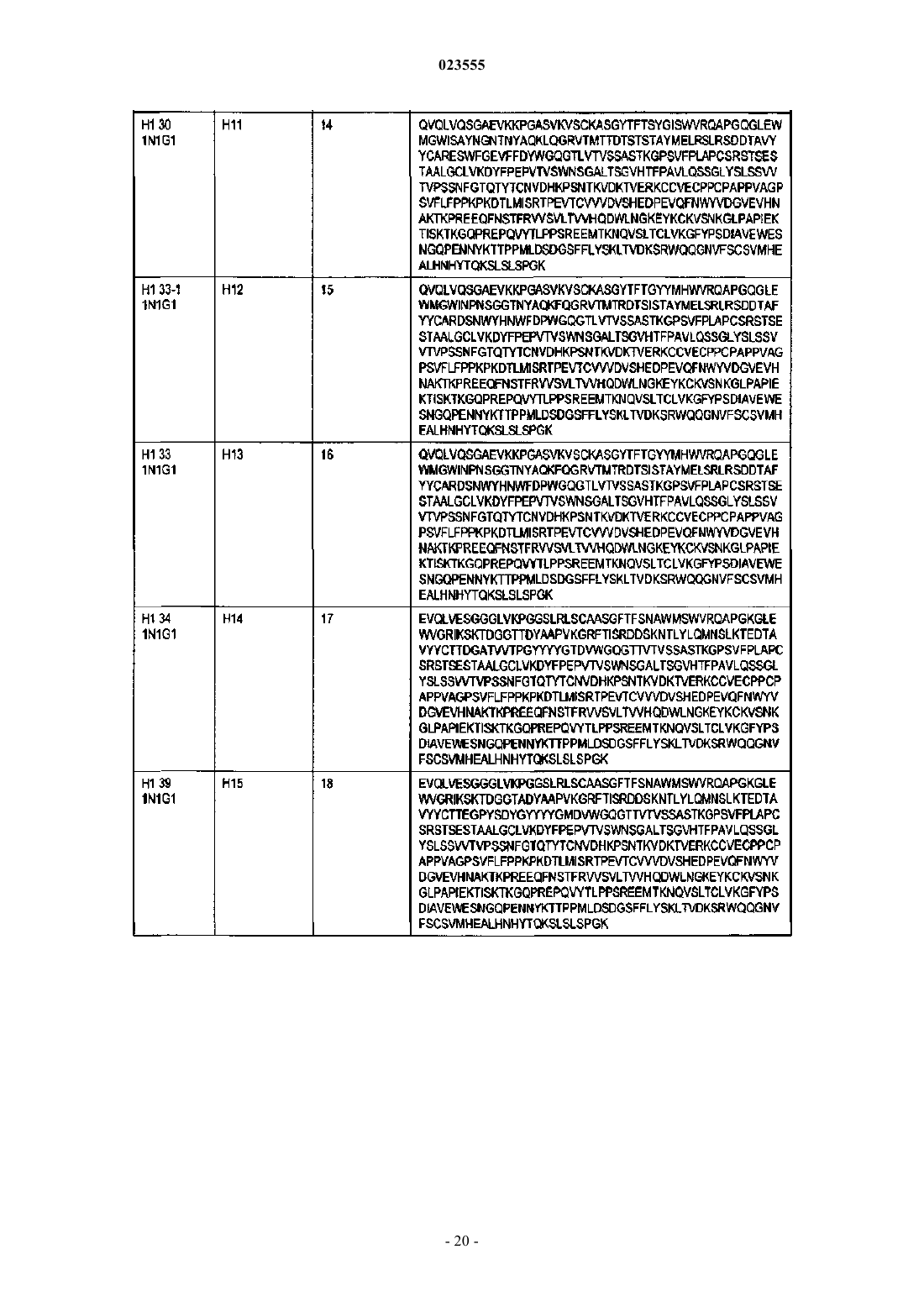
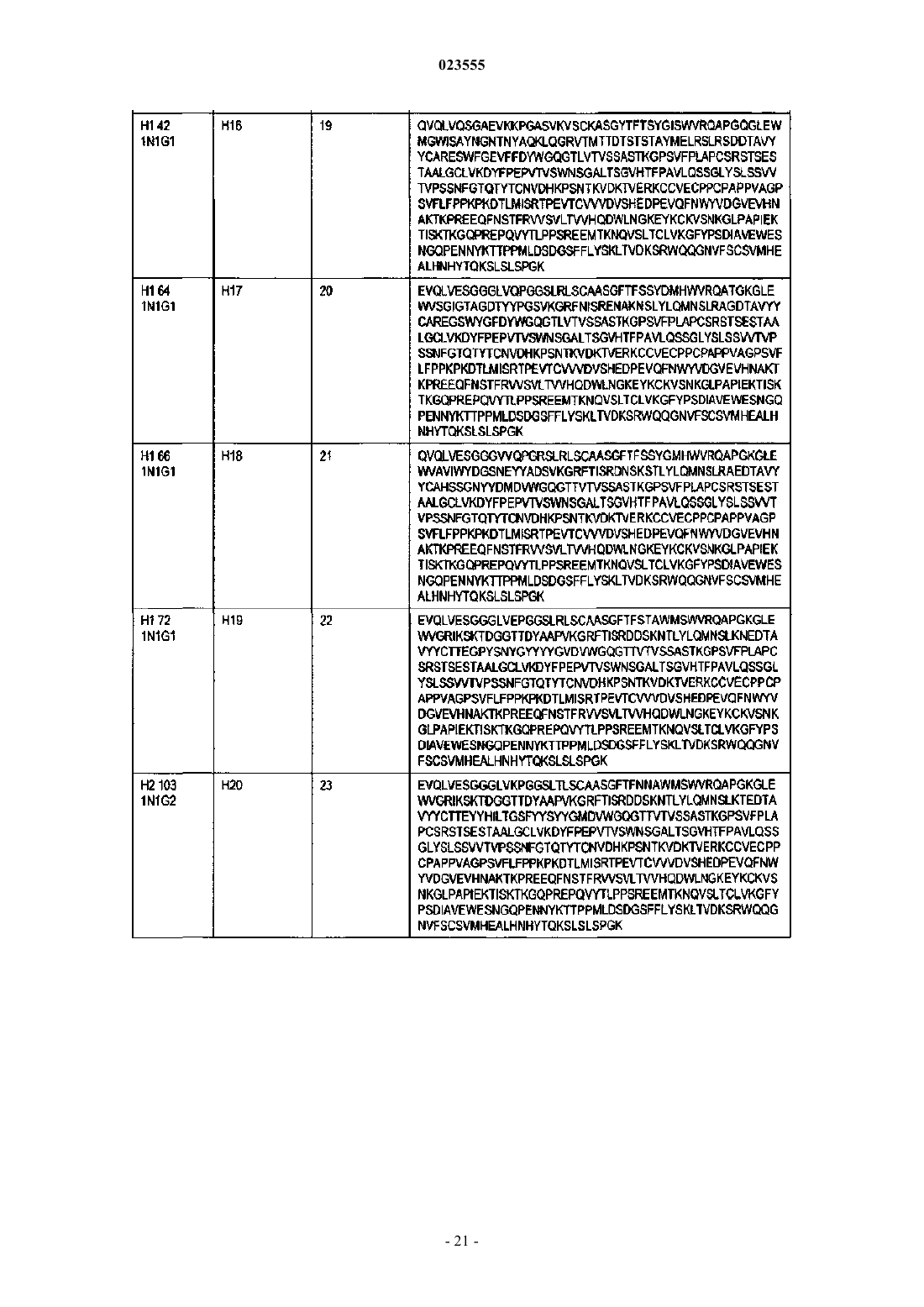
Антигенсвязывающие белки, связывающие c-fms человека
Номер патента: 23555
Опубликовано: 30.06.2016
Авторы: Фостер Стивен, Брейзел Кеннет Аллан, Сан Джилин, Серретти Дуглас Пэт, Смозерс Джеймс Ф., Мелин Кристофер
Формула / Реферат
1. Антигенсвязывающий белок, содержащий VH и VL, который связывает c-fms, отличающийся тем, что:
(a) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 77, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 109;
(b) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 77, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 110;
(c) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 78, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 133;
(d) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 79, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 111;
(e) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 80, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 112;
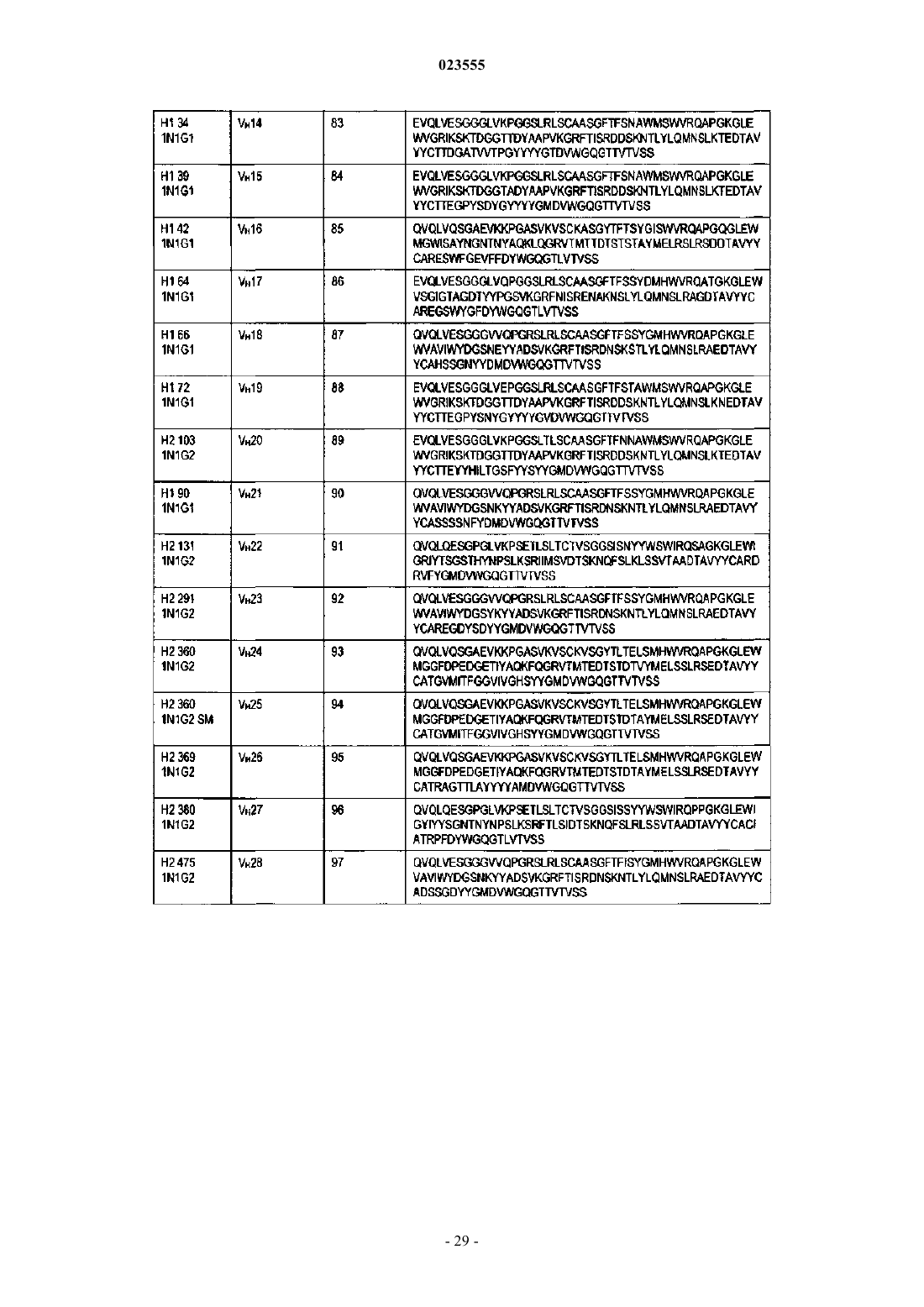
(f) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 84, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 115;
(g) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 85, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 116;
(h) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 86, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 117;
(i) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 87, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 118;
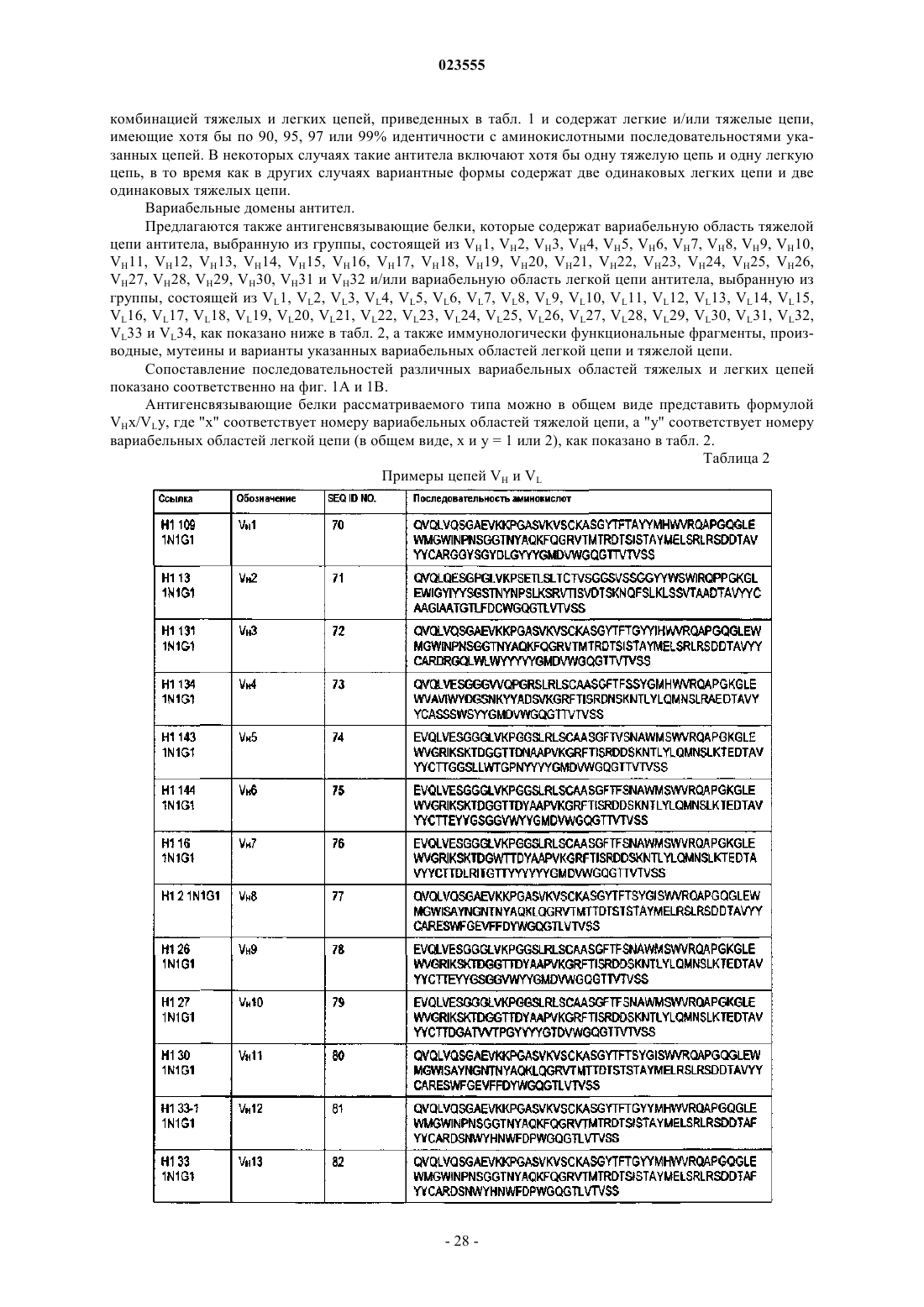
(j) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 70, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 102;
(k) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 70, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 103;
(l) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 73, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 105;
(m) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 74, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 106;
(n) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 89, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 121;
(o) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 93, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 123;
(p) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 94, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 124;
(q) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 97, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 127;
(r) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 98, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 128;
(s) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 99, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 129.
2. Антигенсвязывающий белок по п.1, включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 147, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 163, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 186, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 193, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 214, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 228; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 137, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 150, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 166, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 198, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 233; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 137, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 150, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 189, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 198, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 233; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 147, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 163, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 186, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 195, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 214, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 228; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 137, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 152, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 170, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 198, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 233; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 147, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 163, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 186, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 194, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 214, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 228; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 141, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 156, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 172, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 209, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 223, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 245; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 143, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 160, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 182, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 203, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 240; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 140, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 155, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 169, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 202, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 218, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 236; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 140, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 155, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 169, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 201, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 218, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 236; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 143, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 158, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 190, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 199, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 219, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 237; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 137, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 151, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 167, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 199, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 217, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 233; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 137, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 150, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 173, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 198, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 233; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 142, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 157, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 187, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 206, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 221, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 242; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 143, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 158, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 177, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 200, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 216, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 235; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 142, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 157, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 176, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 207, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 224, иCDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 243; или включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 136, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 149, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 171, CDRL1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 208, CDRL2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 222, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 244.
3. Антигенсвязывающий белок по п.1, содержащий VH и VL, отличающийся тем, что:
(a) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 77, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 109;
(b) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 77, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 110;
(c) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 78, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 133;
(d) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 79, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 111;
(e) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 80, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 112;
(f) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 84, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 115;
(g) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 85, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 116;
(h) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 86, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 117;
(i) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 87, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 118;
(j) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 70, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 102;
(k) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 70, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 103;
(l) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 73, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 105;
(m) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 74, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 106;
(n) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 89, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 121;
(o) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 93, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 123;
(p) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 94, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 124;
(q) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 97, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 127;
(r) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 98, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 128;
(s) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 99, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 129.
4. Антигенсвязывающий белок по п.1, в котором VH является частью тяжелой цепи, а VL является частью легкой цепи, отличающийся тем, что:
(a) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 11, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 43;
(b) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 11, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 44;
(c) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 12, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 67;
(d) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 13, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 45;
(e) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 14, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 46;
(f) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 18, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 49;
(g) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 19, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 50;
(h) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 20, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 51;
(i) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 21, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 52;
(j) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 4, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 36;
(k) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 4, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 37;
(l) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 7, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 39;
(m) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 8, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 40;
(n) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 23, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 55;
(o) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 27, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 57;
(p) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 28, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 58;
(q) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 31, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 61;
(r) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 32, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 62;
(s) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 33, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 63.
5. Антигенсвязывающий белок по любому из пп.1-4, отличающийся тем, что полипептидная структура антигенсвязывающего белка основана на:
(a) антителах и их фрагментах или
(b) моноклональных антителах, биспецифических антителах, мини-антителах, доменных антителах, синтетических антителах, химерных антителах, гуманизированных антителах, человеческих антителах, слитых антителах и их фрагментах.
6. Антигенсвязывающий белок по любому из пп.1-5, который представляет собой человеческий антигенсвязывающий белок.
7. Антигенсвязывающий белок по любому из пп.1-6, который представляет собой антитело или его фрагмент.
8. Антигенсвязывающий белок по п.7, который:
(a) представляет собой моноклональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело, химерное антитело, мультиспецифическое антитело или их фрагмент;
(b) представляет собой IgG1-, IgG2-, IgG3- или IgG4-тип;
(c) представляет собой Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, димер "диабоди", доменное антитело или одноцепочечную молекулу антитела или
(d) представляет собой иммунологически функциональный фрагмент иммуноглобулина и имеет происхождение из любого млекопитающего, выбранного из человека, мыши, крысы, верблюда или кролика.
9. Нуклеиновая кислота, кодирующая антигенсвязывающий белок по любому из пп.1-8.
10. Вектор, содержащий нуклеиновую кислоту по п.9.
11. Клетка-хозяин, содержащая вектор по п.10 и/или нуклеиновую кислоту по п.9.
12. Фармацевтическая композиция для лечения или предотвращения состояния, связанного с c-fms, содержащая эффективное количество по меньшей мере одного антигенсвязывающего белка по любому из пп.1-8 и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция по п.12, дополнительно содержащая:
(a) дополнительный активный агент, выбранный из группы, включающей радиоизотоп, радионуклид, токсин, терапевтический или химиотерапевтический препарат; или
(b) дополнительный активный агент, выбранный из группы, включающей противовоспалительный агент, агент для терапии рака, агент, усиливающий рост костей (анаболический), антирезорбтивный агент, агент, ингибирующий активность остеокластов, или агент, повышающий активность остеобластов.
14. Применение антигенсвязывающего белка по любому из пп.1-8 для лечения или предотвращения состояния, связанного с c-fms.
15. Применение антигенсвязывающего белка по любому из пп.1-8 в лечении или предотвращении состояния, связанного с c-fms, у пациента, где состояние выбирается из рака, костного заболевания и воспалительного заболевания.
16. Способ получения антигенсвязывающего белка по любому из пп.1-8, включающий культивирование клетки-хозяина по п.11 в условиях, обеспечивающих экспрессию и секрецию указанного антигенсвязывающего белка; и выделение указанного антигенсвязывающего белка.
Текст
Изобретение относится к антигенсвязывающим белкам, которые связывают c-fms человека. Раскрыты нуклеиновые кислоты, кодирующие антигенсвязывающие белки, а также векторы и клетки, кодирующие белки. Антигенсвязывающие белки способны ингибировать связывание cfms с КСФ-1, снижать миграцию моноцитов в опухоль, ингибировать накопление опухольассоциированных макрофагов в опухоли. Предпосылки создания изобретения Многие линии опухолевых клеток человека и мышей секретируют цитокин КСФ-1 (колониестимулирующий фактор-1, известный также как макрофаг-колониестимулирующий фактор, М-КСФ), который привлекает моноциты/макрофаги, а также способствует их выживанию и активации с помощью рецептора c-fms (штамма вируса кошачьей саркомы Мак-Доноу). Опухоль-ассоциированные макрофаги (ТАМ)(известные также как опухоль-инфильтрующие макрофаги (TIM могут являться основным компонентом стромы опухоли, составляющей до 50% клеточной массы опухоли. Kelly с соавт., 1988, Br. J. Cancer 57:174-177; Leek с соавт., 1994, J. Leukoc, Biol. 56:423-435. При исследованиях первичных опухолей человека получено достаточно доказательств экспрессии мРНК КСФ-1. Кроме того, многие исследования показали, что повышенный уровень КСФ-1 в сыворотке, количество ТАМ или присутствие в ткани КСФ 1 и/или c-fms связаны с плохим прогнозом для онкологических пациентов. ТАМ способствуют существованию и росту опухоли, метастазированию по различным механизмам,в том числе за счет прямого митогенного воздействия на опухолевые клетки за счет секреции тромбоцитарного фактора роста (PDGF), трансформирующего ростового фактора (TGF-), эпидермального фактора роста (EGF) и метастазы за счет продукции ферментов, вызывающих деградацию внеклеточного матрикса ЕСМ (обзор Leek and Harris, 2002, J. Mammary Gland Biol and Neoplasia 7:177-189 и Lewis and Pollard, 2006, Cancer Res 66:605-612). Еще одним важным фактором обеспечения опухоли со стороны ТАМ является участие в нео-васкуляризации опухоли за счет образования различных про-ангиогенных факторов, таких как СОХ-2, фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF), эпидермальный фактор роста (EGF), моноксид азота, ангиопоэтины и матриксные металлопротеиназы(ММР). Dranoff с соавт., 2004, Nat. Rev. Cancer 4:11-22; MacMicking с соавт., 1997, Annu. Rev. Immunol. 15:323-350; Mantovani с соавт., 1992, Immunol. Today 13:265-270. Помимо этого, макрофаги-производные КСФ-1 могут оказывать иммуносуппрессивное действие за счет продукции различных факторов, таких как простагландины, индоламин-2,3-диоксигеназа, оксид азота, IL-10 и TGFp. MacMicking с соавт., 1997,Annu. Rev. Immunol. 15:323-350; Bronte с соавт., 2001, J. Immunother. 24:431-446. Цитокин КСФ-1 экспрессируется и в мембраносвязанной, и в растворимой форме (Cerretti с соавт.,1988, Mol. Immunol. 25:761-770; Dobbin с соавт., 2005, Bioinformatics 21:2430-2437; Wong с соавт., 1987,Biochem. Pharmacol. 36:4325-4329) и регулирует выживание, пролиферацию, хемотаксис и активацию макрофагов и их предшественников (Bourette с соавт., 2000, Growth Factors 17:155-166; Cecchini с соавт.,1994, Development 120:1357-1372; Hamilton, 1997, J. Leukoc. Biol 62:145-155; Hume, 1985, Sci. Prog. 69:485-494; Sasmono and Hume, в: The innate immune response to infection (ред. Kaufmann, S., Gordon, S.CD115), представляет собой гликопротеин массой 165-кДа, проявляющий ассоциированную тирозинкиназную активность и принадлежащий к семейству тирозинкиназных рецепторов класса III, включающему PDGFR-a, PDGFR-, VEGFR1, VEGFR2, VEGFR3, Flt3 и c-kit. Blume-Jensen and Hunter, 2001, Nature 4JJ:355-365; Schlessinger and Ullrich, 1992, Neuron 9:383-391; Sherr с соавт., 1985 Cell 41:665-676; van derGeer с соавт., 1994, Annu. Rev. Cell. Biol. 10:251-337. Онкогенную форму c-fms (v-fms), которую несет линия вируса кошачьей саркомы Мак-Доноу, подвергают мутации, придавая ей конститутивно активированную протеинкиназную активность (Sherr с соавт., 1985, Cell 4J: 665-676; Roussel and Sherr, 2003,Cell Cycle 2: 5-6). Экспрессия c-fms в нормальных клетках ограничивается миеломоноцитами (к которым относятся моноциты, тканевые макрофаги, клетки Купфера, клетки Лангерганса, микроглиальные клетки и остеокласты), кроветворными клетками-предшественниками и трофобластами. Arai с соавт., 1999, J.Exp. Med. 190:1741-1754; Dai с соавт., 2002, Blood 99:111-120; Pixley and Stanley, 2004, Trends Cell Biol. 14: 628-638. Экспрессия c-fms была также обнаружена в некоторых опухолевых клетках (Kirma с соавт.,2007, Cancer Res 67:1918-1926). В ряде исследований in vitro и анализов мутантных мышей было показано, что КСФ-1 может служить лигандом для c-fms (см., например, Bourette and Rohrschneider, 2000,Growth Factors 17:155-166; Wiktor-Jedrzejczak с соавт., 1990, Proc. Natl Acad. Sci. USA, 87:4828-4832; Yoshida с соавт., 1990, Nature 345:442-444; van Wesenbeeck and van Hul, 2005, Crit. Rev. Eukaryot. Gene Expr. 15:133-162). Связывание КСФ-1 и c-fms индуцирует аутофосфорилирование рецептора в определенные положения, приводящее к активации нисходящих сигнальных путей, в том числе PI3-K/AKT иRas/Raf/MEK/MAPK, а на дифференциацию макрофагов влияет прежде всего постоянная активность МЕК-киназы (Gosse с соавт., 2005, Cellular Signaling 17:1352-1362). Недавно получены доказательства того, что интерлейкин-34 (IL-34) также является лигандом для c-fms (Lin, с соавт. 2008, Science 320:807811). Краткое изложение изобретения В данном документе описаны антигенсвязывающие белки, которые связывают c-fms, в том числе cfms человека. Было обнаружено, что антигенсвязывающие белки, связывающие c-fms человека, ингибируют, нарушают или модулируют по крайней мере один из биологических ответов, относящихся к c-fms,и в этом качестве могут служить для улучшения ситуации при заболеваниях или нарушениях, имеющих отношение к c-fms. Связывание определенных антигенсвязывающих белков с c-fms может, таким образом, оказать одно или более из следующих действий: ингибирование, нарушение или модулирование связывания или передачи сигнала c-fms-ЛСФ-1, ингибирование связывания или передачи сигнала c-fmsIL-34, снижение миграции моноцитов внутрь опухоли и/или снижение накопления опухольассоциированных макрофагов (ТАМ). Одно осуществление включает системы экспрессии, в том числе клеточные линии, для продукции антигенсвязывающих белков к рецептору c-fms, а также способы диагностики и лечения заболеваний,связанных с c-fms человека. Некоторые из выделенных антигенсвязывающих белков содержат VH и VL, которые связывают cfms, характеризующиеся тем, что:(a) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 77, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(b) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 77, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(c) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 78, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(d) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 79, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(e) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 80, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(f) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 84, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(g) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 85, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(h) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 86, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(i) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 87, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(j) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 70, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(k) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 70, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(l) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 73, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(m) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 74, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(n) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 89, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(o) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 93, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(p) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 94, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(q) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 97, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(r) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 98, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичную(s) VH содержит аминокислотную последовательность, по меньшей мере на 90% идентичную SEQID NO: 99, и VL содержит аминокислотную последовательность, по меньшей мере на 90% идентичнуюSEQ ID NO: 129. Частным вариантом является антигенсвязывающий белок, включающий CDRH1, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 147, CDRH2, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 163, CDRH3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 186, CDRL1, содержащий аминокислотную последовательность,как указано в SEQ ID NO: 193, CDRL2, содержащий аминокислотную последовательность, как указано вSEQ ID NO: 222, и CDRL3, содержащий аминокислотную последовательность, как указано в SEQ ID NO: 244. Другим частным вариантом является антигенсвязывающий белок, содержащий VH и VL, характеризующийся тем, что:(s) VH содержит аминокислотную последовательность, как указано в SEQ ID NO: 99, и VL содержит аминокислотную последовательность, как указано в SEQ ID NO: 129. Другим частным вариантом является антигенсвязывающий белок, в котором VH является частью тяжелой цепи, a VL является частью легкой цепи, отличающийся тем, что:(a) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 11, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 43;(b) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 11, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 44;(c) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 12, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 67;(d) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 13, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 45;(e) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 14, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 46;(f) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 18, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 49;(g) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 19, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 50;(h) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 20, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 51;(i) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 21, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 52;(j) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 4, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 36;(k) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 4, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 37;(l) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 7, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 39;(m) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 8, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 40;(n) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 23, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 55;(o) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 27, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 57;(р) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 28, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 58;(q) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 31, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 61;(r) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 32, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 62;(s) тяжелая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 33, и легкая цепь содержит аминокислотную последовательность, как указано в SEQ ID NO: 63. Другим частным вариантом является антигенсвязывающий белок, характеризующийся тем, что по-5 023555 липептидная структура антигенсвязывающего белка основана на:(b) моноклональных антителах, биспецифических антителах, мини-антителах, доменных антителах,синтетических антителах, химерных антителах, гуманизированных антителах, человеческих антителах,слитых антителах и их фрагментах. Другим частным вариантом является антигенсвязывающий белок, представляющий собой человеческий антигенсвязывающий белок. Другим частным вариантом является антигенсвязывающий белок, представляющий собой антитело или его фрагмент. Другим частным вариантом является антигенсвязывающий белок, который:(a) представляет собой моноклональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело, химерное антитело, мультиспецифическое антитело или их фрагмент;(c) представляет собой Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, димер "диабоди", доменное антитело, или одноцепочечную молекулу антитела; или(d) представляет собой иммунологически функциональный фрагмент иммуноглобулина и имеет происхождение из любого млекопитающего, выбранного из человека, мыши, крысы, верблюда или кролика. В другом аспекте выделенный антигенсвязывающий белок может конкурировать с антигенсвязывающим белком одного из предложенных выделенных антигенсвязывающих белков за связывание с внеклеточной частью c-fms человека. В одном осуществлении выделенный антигенсвязывающий белок при введении в организм может снижать хемотаксис моноцитов, ингибировать миграцию моноцитов в опухоль, ингибировать накопление опухоль-ассоциированных макрофагов в опухоли и ингибировать накопление макрофагов в пораженной ткани. В очередном аспекте предлагаются также выделенные молекулы нуклеиновых кислот, кодирующие антигенсвязывающие белки, которые связывают c-fms. В некоторых случаях выделенные молекулы нуклеиновых кислот функционально связаны с контрольной последовательностью. В другом аспекте предлагаются также векторы экспрессии и клетки-хозяева, трансформированные или трансфецированные векторами экспрессии, включающими вышеуказанные выделенные молекулы нуклеиновых кислот, кодирующие антигенсвязывающие белки, которые связывают c-fms. Еще один аспект - способы получения антигенсвязывающих белков, включающие стадию получения антигенсвязывающего белка из клетки-хозяина, которая секретирует антигенсвязывающий белок. Еще один аспект - предлагается фармацевтическая композиция, содержащая хотя бы один из упомянутых выше антигенсвязывающих белков и фармацевтически приемлемый носитель. В одном осуществлении фармацевтическая композиция может содержать дополнительное активное вещество, которое выбирают из группы, включающей радиоизотоп, радионуклид, токсин или терапевтический или химиотерапевтический препарат. Далее, осуществления изобретения предоставляют способ применения для лечения или профилактики состояний, связанных с c-fms, включающий введение в организм эффективного количества хотя бы одного выделенного антигенсвязывающего белка. Примером указанных состояний может служить онкологическое заболевание, выбранное из группы, куда входит рак молочной железы, рак предстательной железы, колоректальный рак, аденокарцинома эндометрия, лейкемия, лимфома, меланома, плоскоклеточный рак пищевода, рак желудка, астроцитарный рак, рак эндометрия, цервикальный рак, рак мочевого пузыря, рак почек, рак легких и рак яичников. Указанные и другие аспекты будут изложены в настоящем документе более подробно. Каждый из аспектов может включать различные осуществления, предложенные в настоящем документе. Таким образом, предполагается, что каждое осуществление, включающее один элемент или комбинацию элементов, может входить в каждый из приведенных аспектов. Другие раскрываемые признаки, объекты и преимущества очевидны из последующего подробного описания. Краткое описание чертежей Фиг. 1 А - сопоставление последовательностей вариабельных областей тяжелой цепи, предложенных в настоящем документе. Фиг. 1 В - сопоставление последовательностей вариабельных областей легкой цепи, предложенных в настоящем документе. Обозначены CDR и каркасные области. Фиг. 2 - генеалогический анализ для 29 гибридомных антител к c-fms. Аминокислотные последовательности, соответствующие вариабельным доменам тяжелой (VH) либо легкой (VL) цепи всех клонированных гибридом, выравнивали и сопоставляли друг с другом для выявления различий антител. Приведены древовидные диаграммы выравнивания, причем длина горизонтальной ветви соответствует относительному количеству замен (различий) между двумя любыми последовательностями или кладами последовательностей (группы близкородственных последовательностей). Указаны последовательности, сгруппированные для определения консенсусных последовательностей. Фиг. 3 - ингибирование пролиферации клеток AML-5 супернатантами гибридомных антител противc-fms. Фиг. 3 А - биотестирование AML-5 с супернатантами гибридомных антител к c-fms. Фиг. 3 В - биотестирование AML-5 с очищенными рекомбинантными антителами к c-fms. Клетки AML-5 инкубировали с 10 нг/мл КСФ-1 в присутствии антител при снижении их концентрации. Через 72 ч измеряли пролиферацию клеток с помощью красителя Аламар блу. Фиг. 4 - анализ костного мозга яванских макак при титровании антител к c-fms в КСФ-1. Проиллюстрировано ингибирование пролиферации клеток костного мозга яванских макак, обогащенных КСФ-1,под действием супернатантов гибридомных антител к c-fms. Клетки костного мозга яванских макак инкубировали с 10 нг/мл КСФ-1 в присутствии антител при снижении их концентрации. Через 72 ч измеряли пролиферацию клеток с помощью красителя Аламар блу. Фиг. 5 - ингибирование лиганд-индуцированного pTyr-c-fms действием МКА IgG2 (РТ, исходная форма). Клетки 293T/c-fms помещали в бессывороточную среду на 1 ч, обрабатывали МКА IgG2 1.109,1.2 или 2.360 (РТ) и контрольными МКА против c-fms 3-4 А 4 (неблокирующие) и против h-CD39 M105(неспецифические) в серии титрования (1.0-0.0001 мкг/мл) или 1.0 мкг/мл (контроль). Затем клетки стимулировали действием 50 нг/мл КСФ-1 в течение 5 мин при 37C. Лизаты цельных клеток осаждали антителом к c-fms C20, как описано. Вестерн-блот-анализ проводили с антителами к pTyr 4G10 (верхний рисунок) или к c-fms C20 (нижний рисунок) соответственно для обнаружения pTyr/c-fms и суммарного cfms. Фиг. 6 - сравнение ингибирования лиганд-индуцированного pTyr-c-fms действием МКА IgG2 (РТ форма по сравнению с SM (излеченная соматическая мутация. Клетки 293T/c-fms помещали в бессывороточную среду на 1 ч, обрабатывали МКА IgG2, 1.109, 1.2 или 2.360 (формы РТ или SM) и контрольными МКА к c-fms 3-4A4 (неблокирующие) при концентрации 1.0 и 0.1 мкг/мл. Затем клетки стимулировали действием 50 нг/мл КСФ-1 в течение 5 мин при 37C. Иммунопреципитацию лизатов цельных клеток проводили антителом против c-fms C20, как описано. Вестерн-блот анализ проводили с антителами кpTyr/c-fms и суммарного c-fms. Фиг. 7 - вестерн-блот анализ иммунопреципитации c-fms действием МКА IgG2 (форма РТ по сравнению с SM). Иммунопреципитацию лизатов нестимулированных цельных клеток 293T/c-fms проводили(оставляя на ночь при 4C) действием МКА IgG2 1.109, 1.2 или 2.360 (формы РТ и SM) и анти-c-fms С 20 при концентрации 2.5 мкг/мл. Вестерн-блоттинг проводили с антителами против c-fms C20 и с антителами против кроличьего IgG/HRP. Фиг. 8 - аминокислотная последовательность (SEQ ID NO: 1) участка внеклеточного домена c-fms человека. Фиг. 9 - вестерн-блот анализ иммунопреципитации c-fms ОНП. Конструкции экспрессии указанных ОНП c-fms собирали и проводили временную экспрессию в клетках 293T/c-fms. Проводили иммунопреципитацию нестимулированных лизатов цельных клеток каждым МКА и контрольным антителом. Вестерн-блот анализ проводили с c-fms H300 и антителами к IgG/HRP кролика. Фиг. 10 - схема внеклеточного домена (ECD) c-fms человека и укороченных конструкций. Авидинтэг слит в рамке на N-конце c-fms. Для каждой конструкции c-fms указаны первая и четыре последних аминокислоты. Фиг. 11 - связывание ФИТЦ-меченых антител против авидина 1.109, 1.2 и 2.360 и против c-fms с внеклеточным доменом c-fms и укороченным слитым белком на основе авидина. Фиг. 12 - связывание ФИТЦ-меченых антител против авидина, контрольных антител и антител против c-fms (ФИТЦ-меченые) с полноразмерным слитым белком из c-fms и Ig-подобной петли 2 (индивидуально). Фиг. 13 - конкурентный анализ с 20-кратными количествами немеченых антител 1.109, 1.2 и 2.360 против c-fms с последующим добавлением ФИТЦ-меченого 1.109 при концентрации 1 мкг/мл. Фиг. 14 - конкурентный анализ с 20-кратными количествами немеченых антител 1.109, 1.2 и 2.360 кc-fms с последующим добавлением ФИТЦ-меченого 1.2 при концентрации 1 мкг/мл. Фиг. 15 - конкурентный анализ с 20-кратными количествами немеченых антител 1.109, 1.2 и 2.360 кc-fms с последующим добавлением ФИТЦ-меченого 2.360 при концентрации 1 мкг/мл. Фиг. 16 - ингибирование роста ксенотрансплантата аденокарциномы груди MDAMB231 антителами к c-fms мыши, измеряли объем опухоли и долю некроза для каждой опухоли. Долю некроза для каждой опухоли рассчитывали на основе измерений, результаты показаны на фиг. 16. Фиг. 17 - ингибирование роста ксенотрансплантата аденокарциномы легких NCIH1975. Показаны результаты измерения опухоли и время лечения. Можно видеть, что антитела к мышиному c-fms способны ингибировать рост устойчивого ксенотрансплантата аденокарциномы легких NCIH1975. Подробное описание В настоящем документе заголовки разделов служат для структурирования и не должны считаться ограничивающими предмет изобретения. Если не указано иначе, научные и технические термины, которые используются в связи с настоящей заявкой, имеют то значение, которое обычно подразумевается специалистом среднего уровня. Далее, если контекст не подразумевает иного, термины в единственном числе подразумевают и множественное число, а термины во множественном числе также имеют в виду и единственное число. В целом номенклатура и методы, касающиеся культур клеток и тканей, молекулярной биологии,иммунологии, микробиологии, генетики, химии белков и нуклеиновых кислот и гибридизации, описанные в настоящем документе - хорошо известны и обычно используется в данной области. В данном изобретении способы и методики обычно реализуются в соответствии с обычными способами, хорошо известными в данной области, приведенными в общих и более конкретных ссылках, которые упоминаются и цитируются по ходу данного описания, если не указано иначе. См., например, Sambrook с соавт., Molecular Cloning: A Laboratory Manual, 3rd ed, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, НьюЙорк (2001), Ausubel с соавт., Current Protocols in Molecular Biology, Greene Publishing Associates (1992), иHarlow and Lane Antibodies: A Laboratory Manual Cold Spring Harbor Laboratory Press, Cold Spring Harbor,Нью-Йорк (1990), которые включены в данный документ посредством ссылки. Ферментативные реакции и процедуры очистки осуществляются в соответствии с инструкцией производителя, как это делается обычно в данной области или как описано в документе. Приведенные здесь лабораторные методики и методы аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, а также связанная с этим терминология соответствуют хорошо известным и традиционным в данной области. Стандартные методы применимы к химическим синтезам, химическим анализам, приготовлению фармацевтических препаратов, составлению рецептур, доставке препаратов и лечению пациентов. Следует иметь в виду, что настоящее изобретение не ограничено конкретной методологией, протоколом, реагентами и т.д., описанными в настоящем документами, и в этом возможны варианты. Терминология, которая здесь употребляется, предназначена только для описания конкретных осуществлений,но не для ограничения предмета изобретения, который определяется формулой изобретения. Помимо употребления в рабочих примерах и если не указано иначе, все числа, выражающие количество компонентов или условия реакций в данном документе, следует во всех случаях считать модифицированными термином "около". По отношению к процентному содержанию термин "около" может означать 1%. Определения. Термин "полинуклеотид" или "нуклеиновая кислота" относится как к одноцепочечным, так и к двухцепочечным полимерам нуклеотидов. Нуклеотидами, составляющими полинуклеотид, могут быть рибонуклеотиды или дезоксирибонуклеотиды или модифицированная форма того или другого типа нуклеотидов. Указанные модификации могут представлять собой модификацию оснований, такую как бромуридин и инозин, модификацию рибозы, такую как 2',3'-дидезоксирибоза, а также модификацию межнуклеотидных связей, такую как тиофосфат, дитиофосфат, селенофосфат, диселенофосфат, анилотиофосфат, анилофосфат и амидофосфат. Термин "олигонуклеотид" означает полинуклеотид, содержащий 200 или менее нуклеотидов. В некоторых осуществлениях олигонуклеотиды состоят из 10-60 оснований. В других осуществлениях олигонуклеотиды состоят из 12, 13, 14, 15, 16, 17, 18, 19 или от 20 до 40 нуклеотидов. Олигонуклеотиды могут быть одно- и двухцепочечными, например, для конструирования мутантного гена. Олигонуклеотиды могут быть смысловыми или антисмысловыми. Олигонуклеотид может содержать метку, в том числе радиоактивную метку, флуоресцентную метку, гаптен или антигенную метку, которые служат для их обнаружения. Олигонуклеотиды применяют, например, в качестве праймеров для ПЦР, клонирования или зондов для гибридизации."Выделенная молекула нуклеиновой кислоты" означает ДНК или РНК геномного происхождения,мРНК, кДНК синтетического происхождения, либо их комбинацию, которая не связана с полинуклеотидом, в котором выделенная молекула находится в природе, или с его частью, либо связана с полинуклеотидом, с которым она не связана в природе. Для целей данного изобретения следует понимать, что в понятие "молекула нуклеиновой кислоты, содержащая" определенную последовательность нуклеотидов не входят интактные хромосомы. Выделенные молекулы нуклеиновых кислот, "содержащие" заданные последовательности нуклеиновой кислоты, могут дополнительно включать кодирующие последовательности до десяти или даже двадцати других белков или их частей либо функционально связанные регуляторные последовательности, регулирующие экспрессию кодирующей области указанной нуклеиновой кислоты, и/или могут включать векторные последовательности. Если не указано иначе, левый конец всех обсуждаемых одноцепочечных полинуклеотидных последовательностей является 5'-концом; левое направление двухцепочечной полинуклеотидной последовательности называется 5'-направлением. Направление присоединения нового транскрипта РНК от 5' к 3' называется направлением транскрипции; участки на спирали ДНК, характеризующиеся той же последовательностью, что и транскрипт РНК, 5' к 5'-концу транскрипта РНК, называются "вышележащими по-8 023555 следовательностями"; участки на спирали ДНК, характеризующиеся той же последовательностью, что и транскрипт РНК, 3' к 3'-концу транскрипта РНК, называются "нижележащими последовательностями". Термин "контрольная последовательность" относится к полинуклеотидной последовательности, которая способна влиять на экспрессию и процессинг кодирующих последовательностей, к которым она лигирована. Природа такой контрольной последовательности может зависеть от организма-хозяина. В конкретных осуществлениях контрольные последовательности для прокариотов могут содержать промотор, участок рибосомного связывания и последовательность терминации транскрипции. Например, контрольные последовательности для эукариотов могут содержать промоторы, включающие один или много участков узнавания для факторов транскрипции, последовательности энхансеров транскрипции и последовательность терминации транскрипции. "Контрольные последовательности" могут содержать лидерные последовательности и/или последовательности партнера для присоединения. Термин "вектор" относится к любой молекуле или объекту (например, это может быть нуклеиновая кислота, плазмида, бактериофаг или вирус), который служит для переноса информации, кодирующей белок, в клетку-хозяина. Термин "вектор экспрессии" или "экспрессирующая конструкция" относится к вектору, способному трансформировать клетку-хозяина и содержащему последовательности нуклеиновой кислоты, направляющие и/или регулирующие (совместно с клеткой-хозяином) экспрессию одного или более гетерологичных кодирующих областей, оперативно с ним связанных. Экспрессирующая конструкция может включать, без ограничения, последовательности, влияющие на транскрипцию, трансляцию или регулирующие их, и при наличии интронов влияющие на сплайсинг РНК кодирующей области, функционально с ним связанной. В настоящем документе "функционально связанный" означает, что компоненты, к которым относится данный термин, находятся во взаимосвязи, которая позволяет им осуществлять присущие им функции в соответствующих условиях. Например, контрольная последовательность вектора, которая"функционально связана" с кодирующей последовательностью белка, лигирована к ней так, что экспрессия кодирующей последовательности белка достигается в условиях, совместимых с транскрипционной активностью контрольной последовательности. Термин "клетка-хозяин" относится к клетке, которая была трансформирована или способна к трансформации последовательностью нуклеиновой кислоты и за счет этого экспрессирует целевой ген. Термин заключает в себе потомство родительской клетки, независимо от того, имеет ли потомство такую же морфологию и генетическое строение, что и исходная родительская клетка, при условии, что в нем присутствует целевой ген. Термин "трансдукция" означает перенос генов от одной бактерии к другой, обычно за счет бактериофага. "Трансдукция" относится также к приобретению и переносу последовательностей клеток эукариотов при репликации дефектных ретровирусов. Термин "трансфекция" означает накопление чужеродной или экзогенной ДНК в клетке, а клетка была "трансфецирована", если экзогенная ДНК проникла внутрь клеточной мембраны. Ряд методов трансфекции хорошо известен в данной области и раскрыт в настоящем документе. См., например, Graham с соавт., 1973, Virology 52:456; Sambrook с соавт., 2001, Molecular Cloning: A Laboratory Manual, см. выше; Davis с соавт., 1986, Basic Methods in Molecular Biology, Elsevier; Chu с соавт., 1981, Gene 13:197. Такие методы позволяют ввести в подходящую клетку-хозяина один или более фрагмент экзогенной ДНК. Термин "трансформация" относится к изменению генетических характеристик клетки, а клетка была "трансформирована", если она модифицирована так, что содержит новую ДНК или РНК. Например,клетка трансформирована, если ее нативное состояние было генетически модифицировано в результате введения генетического материала за счет трансфекции, трансдукции или другого способа. После трансфекции или трансдукции трансформирующая ДНК может рекомбинировать с ДНК клетки за счет физической интеграции в хромосому клетки, либо может временно сохраняться как эписомный элемент без репликации, либо может быть реплицирована или независимо реплицироваться как плазмида. Клетка считается "стабильно трансформированной, если трансформирующая ДНК реплицируется при делении клетки. Термины "полипептид" или "белок" в данном документе взаимозаменяемы и относятся к полимеру,состоящему из остатков аминокислот. Термины также включают полимеры аминокислот, в которых один или более аминокислотный остаток является аналогом или миметиком соответствующей природной аминокислоты, а также природные полимеры аминокислот. Термины могут предполагать также полимеры аминокислот, которые были модифицированы, например, присоединением углеводных остатков с образованием гликопротеинов или фосфорилированием. Полипептиды и белки могут продуцироваться природными и нерекомбинантными клетками; либо продуцируются генетически сконструированными или рекомбинантыми клетками, и представляют собой молекулы, имеющие аминокислотную последовательность природного белка, или молекулы, содержащие делецию, присоединение и/или замену одной или более аминокислоты нативной последовательности. В понятия "полипептид" и "белок", в частности,входят антигенсвязывающие белки, связывающие c-fms, антитела или последовательности, содержащие-9 023555 делецию, присоединение и/или замену одной или более аминокислоты антигенсвязывающего белка. Термин "полипептидный фрагмент" относится к полипептиду, который имеет аминоконцевую делецию,карбоксилконцевую делецию, и/или внутреннюю делецию по сравнению с полноразмерным белком. Такие фрагменты могут также содержать модифицированные аминокислоты по сравнению с аминокислотами полноразмерного белка. В некоторых осуществлениях длина фрагментов составляет около 5-500 аминокислот. Например, длина фрагмента может составлять хотя бы 5, 6, 8, 10, 14, 20, 50, 70, 100, 110,150, 200, 250, 300, 350, 400 или 450 аминокислот. К важным полипептидным фрагментам относятся иммунологически функциональные фрагменты антител, в том числе связывающие домены. В случае c-fmsсвязывающего антитела важными фрагментами являются, без ограничения, участок CDR, вариабельный домен тяжелой или легкой цепи, часть цепи антитела или только ее вариабельный участок, включающий два CDR, и т.п. Термин "выделенный белок" означает, что данный белок (1) свободен хотя бы от части других белков, вместе с которыми он обычно обнаруживается, (2) в основном свободен от других белков из того же источника, например, из того же вида организмов, (3) экспрессирован клеткой другого вида, (4) отделен по крайней мере от около 50% полинуклеотидов, липидов, углеводов или других материалов, которые обычно сопутствуют ему в природе, (5) функционально ассоциирован (за счет ковалентного или нековалентного взаимодействия) с полипептидом, с которым он не ассоциирован в природе, или (6) в природе не существует. Как правило, на долю "выделенного белка" приходится хотя бы около 5%, хотя бы около 10%, хотя бы около 25% или хотя бы около 50% данного образца. Указанный выделенный белок может кодировать геномная ДНК, кДНК, мРНК или другая РНК синтетического происхождения либо любая их комбинация. Предпочтительно выделенный белок в основном не содержит белков, полипептидов или других примесей, которые присутствуют в его природной среде и которые препятствуют его применению в терапевтических, диагностических, профилактических или исследовательских целях."Вариант" полипептида (например, антигенсвязывающий белок или антитело) представляет собой аминокислотную последовательность, в которую введен либо из которой удален и/или в которой замещен один или более аминокислотный остаток по отношению к другой полипептидной последовательности. Слитые белки являются вариантами."Производное" полипептида представляет собой полипептид (например, антигенсвязывающий белок или антитело), химически модифицированный каким-либо образом, отличным от вариантов введения, удаления или замены, например, за счет замещения другим химическим фрагментом. Термин "природный" в том смысле, в котором он используется в данном описании в отношении биологических материалов, таких как полипептиды, нуклеиновые кислоты, клетки-хозяева и прочее относится к материалам, которые существуют в природе."Антигенсвязывающий белок" в данном документе означает белок, который специфически связывается с заданным антигеном-мишенью, таким как c-fms или c-fms человека. Антигенсвязывающий белок считается "специфически связанным" с антигеном-мишенью, если константа диссоциации (KD) 10-8 М. Антитело специфически связывается с антигеном с "высокой аффиностью", если KD 510-9 М и с "очень высокой аффиностью" если KD 510-10 М. В одном осуществлении антитело характеризуется KD 10-9 М, а скорость диссоциации около 1104/с. В другом осуществлении скорость диссоциации составляет около 110-5/с. В следующих осуществлениях антитела связывают c-fms или c-fms человека с KD от около 10-8 М до 10-10 М, и а еще в одном осуществлении они связываются с KD 210-10."Антигенсвязывающая область" означает белок или часть белка, который специфически связывается с определенным антигеном. Например, такая часть антигенсвязывающего белка, которая содержит аминокислотный остаток, взаимодействующий с антигеном и придающий антигенсвязывающему белку его специфичность и аффинность к антигену, называют "антигенсвязывающей областью". Антигенсвязывающая область обычно включает один или более "определяющий комплементарность участок"(CDR). Определенные антигенсвязывающие области также содержат одну или более "каркасную область". "CDR" - это аминокислотная последовательность, которая способствует антигенсвязывающей специфичности и аффинности. "Каркасные области" содействуют в закреплении требуемой конформации CDR, что способствует связыванию антигенсвязывающей области с антигеном. В некоторых аспектах предлагаются рекомбинантные антигенсвязывающие белки, которые связывают белок c-fms или c-fms человека. В данном контексте "рекомбинантный белок" - это белок, полученный рекомбинантными методами, т.е. при экспрессии рекомбинантной нуклеиновой кислоты, как описано в настоящем документе. Методы и процедуры получения рекомбинантных белков хорошо известны в данной области. Термин "антитело" относится к интактному иммуноглобулину любого изотипа или его фрагменту,который способен конкурировать с интактным антителом за специфическое связывание антигенамишени, и включает, например, химерные, гуманизированные антитела, полностью человеческие и биспецифические антитела. Само по себе "антитело" - это вид антигенсвязывающего белка. Интактное антитело обычно содержит хотя бы две полноразмерных тяжелых цепи и две полноразмерных легких цепи,- 10023555 но в некоторых случаях может содержать меньше цепей, например антитела, которые в природе обнаруживаются у камелидов, которые могут содержать только тяжелые цепи. Антитела могут происходить из одного источника, но могут быть и "химерными", то есть, разные части антитела могут происходить из двух разных антител, как описано ниже. Антигенсвязывающие белки, антитела или связывающие фрагменты могут получаться в гибридомах по технологии рекомбинантной ДНК или в результате ферментативного или химического расщепления интактных антител. Если не указано иначе, термин "антитело" включает, помимо антител, содержащих две полноразмерных тяжелых цепи и две полноразмерных легких цепи, также их производные, варианты, фрагменты и мутации, примеры которых приведены ниже. Термин "легкая цепь" подразумевает полноразмерную легкую цепь или ее фрагменты, имеющие достаточную последовательность вариабельной области для обеспечения специфичности связывания. В полноразмерную легкую цепь входит домен вариабельной области VL и домен константной области CL. Домен вариабельной области легкой цепи расположен на амино-конце полипептида. К легким цепям относятся каппа-цепи и лямбда-цепи. Термин "тяжелая цепь" подразумевает полноразмерную тяжелую цепь или ее фрагменты, имеющие достаточную последовательность вариабельной области для обеспечения специфичности связывания. В полноразмерную тяжелую цепь входит домен вариабельной области VH и три домена константной области CH1, CH2 и CH3. Домен VH расположен на амино-конце полипептида, а домены CH - на карбоксильном конце, причем CH3 расположен наиболее близко к карбоксильному концу полипептида. Тяжелые цепи могут относиться к любому изотипу, в том числе IgG (включая подтипы IgG1, IgG2, IgG3 и IgG4), IgA(включая подтипы IgA1 и IgA2), IgM и IgE. Термин "иммунологически функциональный фрагмент" (или просто "фрагмент") антитела или цепи иммуноглобулина (тяжелой или легкой цепи) в данном документе означает антигенсвязывающий белок,содержащий часть (независимо от того, как эта часть была получена или синтезирована) антитела, в котором недостает хотя бы некоторых из аминокислот, присутствующих в полноразмерной цепи, но который способен специфически связывать антиген. Такие фрагменты биологически активны, так как они специфически связывают антиген-мишени и способны конкурировать с другими антигенсвязывающими белками, включая интактные антитела, за специфическое связывание с определенным эпитопом. В одном аспекте в таком фрагменте сохраняется хотя бы один CDR, присутствующий в полноразмерной легкой или тяжелой цепи, и в некоторых осуществлениях в нем находится одна тяжелая цепь и/или легкая цепь либо их часть. Указанные биологически активные фрагменты могут быть получены методами рекомбинантной ДНК или в результате ферментативного или химического расщепления антигенсвязывающих белков, в том числе интактных антител. Иммунологически функциональные фрагменты иммуноглобулина подразумевают, без ограничения, Fab, Fab', F(ab')2, Fv, доменные антитела и одноцепочечные антитела, и могут иметь происхождение из любого млекопитающего, в том числе, но без ограничения человека,мыши, крысы, камелида или кролика. Далее предполагается, что функциональная часть антигенсвязывающих белков, предлагаемых здесь, например, один или более CDR, может быть ковалентно связана со вторым белком или с малой молекулой для получения лечебного средства, направленного на определенную мишень в организме, имеющего двойное терапевтическое действие или длительное время полужизни в сыворотке."Фрагмент Fab" состоит из одной легкой цепи и вариабельных и CH1 областей одной тяжелой цепи. Тяжелая цепь молекулы Fab неспособна образовать дисульфидную связь с другой молекулой тяжелой цепи. Область "Fc" содержит два фрагмента тяжелой цепи, состоящих из доменов CH1 и CH2 антитела. Оба фрагмента тяжелой цепи удерживаются вместе двумя или более дисульфидными связями и гидрофобными взаимодействиями доменов CH3."Фрагмент Fab'" состоит из одной легкой цепи и части одной тяжелой цепи, которая содержит домен VH и домен CH1, а также участок между доменами CH1 и CH2, причем между двумя тяжелыми цепями двух фрагментов Fab' может образоваться межцепная дисульфидная связь с формированием молекул"Фрагмент F(ab')2" содержит две легких цепи и две тяжелых цепи, включающих часть константной области между доменами CH1 и CH2, причем между двумя тяжелыми цепями образуется межцепная дисульфидная связь. Таким образом, фрагмент F(ab')2 состоит из двух фрагментов Fab', которые удерживаются за счет дисульфидной связи между двумя тяжелыми цепями."Область Fv" содержит вариабельные области как из тяжелой, так и легкой цепи, но не содержит константных областей."Одноцепочечные антитела" - молекулы Fv, в которых вариабельные области тяжелой и легкой цепи были связаны гибким линкером с образованием единой полипептидной цепи, которая образует антигенсвязывающую область. Одноцепочечные антитела подробно обсуждаются в опубликованной международной патентной заявкеWO 88/01649 и в патентах США 4946778 и 5260203, раскрытые объекты которых включены в данный документ посредством ссылки."Доменное антитело" - иммунологически функциональный фрагмент иммуноглобулина, содержащий только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых- 11023555 случаях два или более областей VH ковалентно связаны с пептидным линкером, в результате чего получаются двухвалентные доменные антитела. Две области VH двухвалентного доменного антитела могут иметь в качестве мишени один и тот же антиген или разные антигены."Двухвалентный антигенсвязывающий белок" или "двухвалентное антитело" имеет в своем составе два антигенсвязывающих участка. В некоторых случаях два указанных сайта связывания характеризуются специфичностью к тому же самому антигену. Двухвалентные антигенсвязывающие белки и двухвалентные антитела могут быть биспецифическими, см. ниже."Мультиспецифический антигенсвязывающий белок" или "мультиспецифическое антитело" - это объект, имеющий в качестве мишени более одного антигена или эпитопа."Биспецифический", "имеющий двойную специфичность" или "бифункциональный" антигенсвязывающий белок или антитело - это соответственно гибридный антигенсвязывающий белок или антитело,имеющее в своем составе два разных участка связывания антигенов. Биспецифические антигенсвязывающие белки и антитела - это один из видов мультиспецифических антигенсвязывающих белков или мультиспецифических антител, которые могут быть получены с помощью целого ряда способов, в том числе, но без ограничения, слиянием гибридом или связыванием фрагментов Fab', см., например, Songsivilai and Lachmann, 1990, Clin. Exp. Immunol. 79:315-321; Kostelny et al., 1992, J. Immunol. 148:15471553. Два участка связывания биспецифического антигенсвязывающего белка или антитела взаимодействуют с двумя разными эпитопами, которые могут располагаться на одной или разных мишенях. Термин "нейтрализующий антигенсвязывающий белок" или "нейтрализующее антитело" относится соответственно к антигенсвязывающему белку или антителу, которое связывается с лигандом, препятствует связыванию лиганда с партнером и прерывает биологический отклик, который в ином случае появился бы в результате связывания лиганда с партнером. При оценке связывания и специфичности антигенсвязывающего белка, например, антитела или его иммунологически функционального фрагмента,считают, что антитело или фрагмент существенно ингибирует связывание лиганда со своим партнером в том случае, если избыток антител снижает количество партнера, связанного с лигандом, хотя бы на приблизительно 20, 30, 40, 50, 60, 70, 80, 85, 90, 95, 97, 99% или более (по данным анализа конкурентного связывания in vitro). В случае антигенсвязывающих белков, связывающих c-fms, такая нейтрализующая молекула будет снижать способность c-fms связываться с КСФ-1. В некоторых осуществлениях нейтрализующий антигенсвязывающий белок ингибирует способность c-fms связывать IL-34. В других осуществлениях нейтрализующий антигенсвязывающий белок ингибирует способность c-fms связывать КСФ-1 и IL-34. Термин "конкурировать" в контексте антигенсвязывающих белков (например, нейтрализующих антигенсвязывающих белков или нейтрализующих антител), конкурирующих за один и тот же эпитоп, означает конкуренцию между антигенсвязывающими белками, определяемую в анализе, в котором испытуемый антигенсвязывающий белок (например, антитело или его иммунологически функциональный фрагмент) блокирует или ингибирует специфическое связывание эталонного антигенсвязывающего белка (например, лиганда или эталонного антитела) с обычным антигеном (например, c-fms или его фрагментом). Существует большое число типов испытаний на конкурентное связывание, например, прямой и косвенный твердофазный радиоиммуноанализ (РИА), прямой и косвенный твердофазный иммуноферментный анализ (ТИФА), конкурентный анализ сэндвич-методом (см., например, Stahli с соавт., 1983,Methods in Enzymology 9:242-253); твердофазный прямой ИФА с биотин-авидин взаимодействием (см.,например, Kirkland с соавт., 1986, J. Immunol. 137:3614-3619); твердофазный прямой анализ с использованием метки, твердофазный прямой анализ с использованием метки сэндвич-методом (см., например,Harlow and Lane, 1988, Антитела, А Laboratory Manual, Cold Spring Harbor Press); твердофазный прямой РИА с использованием метки 1-125 (см., например, Morel с соавт., 1988, Molec. Immunol. 25:7-15); твердофазный прямой ИФА с биотин-авидин взаимодействием (см., например, Cheung, с соавт., 1990, Virology 176:546-552); и прямой РИА с меченым антигеном (Moldenhauer с соавт., 1990, Scand. J. Immunol. 32:77-82). Как правило, в таком анализе используют очищенный антиген, закрепленный на твердой поверхности либо клетки, содержащий один из компонентов, немеченый испытуемый антигенсвязывающий белок и меченый эталонный антигенсвязывающий белок. Конкурентное ингибирование измеряют по количеству метки, связанной с твердой поверхностью или клетками в присутствии испытуемого антигенсвязывающего белка. Как правило, испытуемый антигенсвязывающий белок присутствует в избытке. К антигенсвязывающим белкам, которые идентифицируют на основе конкурентного анализа (конкурирующих антигенсвязывающих белков), относятся антигенсвязывающие белки, взаимодействующие с тем же эпитопом, что эталонные антигенсвязывающие белки, а также антигенсвязывающие белки, взаимодействующие с соседним эпитопом, расположенным достаточно близко к эпитопу, взаимодействующему с эталонным антигенсвязывающим белком, для создания стерических затруднений. Дополнительная информация, касающаяся способов определения конкурентного связывания, имеется в примерах, приведенных в данном документе. Как правило, если конкурирующий антигенсвязывающий белок присутствует в избытке, он ингибирует специфическое связывание эталонного антигенсвязывающего белка с общим антигеном по крайней мере на 40, 45, 50, 55, 60, 65, 70 или 75%. В некоторых случаях связывание ингибируется по крайней мере на 80, 85, 90, 95 или 97% или более.- 12023555 Термин "антиген" относится к молекуле или части молекулы, способной селективно связываться с селективным агентом, таким как антигенсвязывающий белок (в том числе, например, антитело или его иммунологический функциональный фрагмент), а также способной кроме того вырабатывать в организме животного антитела для взаимодействия с данным антигеном. Антиген может иметь один или более эпитоп, способный взаимодействовать с различными антигенсвязывающими белками, например, антителами. Термин "эпитоп" относится к части молекулы, которая взаимодействует с антигенсвязывающим белком (например, антителом). Данный термин также подразумевает все детерминанты, способные к специфическому связыванию с антигенсвязывающим белком, например, с антителом или Т-клеточным рецептором. Эпитоп может быть непрерывным или не непрерывным (например, в полипептиде аминокислотные остатки, не прилегающие друг к другу в полипептидной последовательности, в пределах молекулы связываются антигенсвязывающим белком). В определенных осуществлениях эпитопы могут быть миметиками, а именно, они представляют собой трехмерную структуру, аналогичную эпитопу, который служит для генерирования антигенсвязывающего белка, но при этом не содержит или содержит только часть аминокислотных остатков, присутствующих в самом указанном эпитопе, генерирующем антигенсвязывающий белок. Как правило, эпитопы располагаются на белках, но в некоторых случаях они могут располагаться на молекулах других типов, таких как нуклеиновые кислоты. К детерминантам эпитопов относятся химически активные поверхностные группы молекул, такие как аминокислоты, боковые цепи сахаров, фосфорильные или сульфонильные группы, они могут иметь специфические характеристики трехмерной структуры и/или специфические характеристики заряда. В общем случае антитела, специфические для определенного антигена-мишени, будет предпочтительно узнавать эпитоп антигена-мишени в сложной смеси белков и/или макромолекул. Термин "идентичность" относится к взаимосвязи последовательностей двух или более молекул полипептидов или двух или более молекул нуклеиновых кислот, которая определяется при выравнивании и сравнении последовательностей. "Процент идентичности" означает процентную долю одинаковых аминокислотных остатков или нуклеотидов в сравниваемых молекулах и рассчитывается на основе размера минимальной из сравниваемых молекул. Для указанных расчетов разрывы, обнаруживаемые при выравнивании (если таковые имеются), следует учитывать с помощью определенной математической модели или компьютерной программы (т.е. "алгоритма"). К методам, пригодным для расчета идентичности сравниваемых нуклеиновых кислот или полипептидов, относятся способы, описанные в Computational Molecular Biology (Lesk, A. M., ред.), 1988, Нью-Йорк: Oxford University Press; Biocomputing Informatics andMath. 48:1073. При расчете процента идентичности сравниваемые последовательности выравнивают таким образом, чтобы получить между ними максимальное соответствие. Для определения процента идентичности применяют компьютерную программу - пакет GCG, содержащий GAP (Devereux с соавт., 1984, Nucl.Acid Res. 12:387; Genetics Computer Group, Висконсинский университет, Мэдисон, Висконсин). Компьютерный алгоритм GAP служит для выравнивания и сопоставления двух полипептидов или полинуклеотидов, для которых нужно определить процент идентичности последовательностей. Последовательности выравнивают для получения оптимального совпадения соответствующих аминокислот или нуклеотидов("matched span" в соответствии с алгоритмом). В сочетании с алгоритмом применяются понятия штрафа за открытие делеции (gap opening penalty) (который рассчитывают как взятую трижды среднюю диагональ, где "средняя диагональ" - средняя величина диагонали используемой матрицы сравнения; "диагональ" - балл или число, присваиваемое каждому идеальному соответствию аминокислот определенной матрицей сравнения) и штраф на продолжение делеции (gap extension penalty) (обычно 1/10 от штрафа за открытие делеции), а также матрица сравнения, такая как РАМ 250 или BLOSUM 62. В определенных осуществлениях алгоритм использует стандартную матрицу сравнения (матрица сравнения РАМ 250: см., Dayhoff с соавт., 1978, Atlas of Protein Sequence and Structure 5:345-352; матрица сравнения BLOSUM 62: см. Henikoff с соавт., 1992, Proc. Natl. Acad. Sci. USA 89:10915-10919). Рекомендуемые параметры для определения процента идентичности полипептидов или последовательностей нуклеотидов с помощью программы GAP приведены ниже: алгоритм: Needleman с соавт., 1970, J. Mol. Biol. 48:443-453; матрица сравнения: BLOSUM 62 из Henikoff с соавт., 1992, supra; штраф на делецию: 12 (отсутствие штрафа для концевых делеции); штраф на длину делеции: 4; порог соответствия: 0. Некоторые схемы выравнивания двух аминокислотных последовательностей могут привести к совпадению только короткой области двух указанных последовательностей, при этом данный небольшой участок может иметь очень высокую степень идентичности последовательностей, несмотря на то, что две- 13023555 полноразмерные последовательности существенно не взаимосвязаны. Соответственно, выбранную программу выравнивания (программу GAP) можно настроить для сопоставления участков длиной хотя бы 50 смежных аминокислот целевого полипептида. В данном документе "существенно чистый" означает, что описанный вид молекул является преобладающим из присутствующих, то есть, в молярном отношении этот компонент присутствует в большем количестве, чем любой другой индивидуальный компонент той же смеси. В определенных осуществлениях существенно чистая молекула - это композиция, где на долю целевого компонента приходится по крайней мере 50% (в молярном отношении) всех макромолекулярных компонентов. В других осуществлениях существенно чистая композиция будет содержать по крайней мере 80, 85, 90, 95 или 99% всех макромолекулярных компонентов данной композиции. В других осуществлениях целевой компонент очищают до существенной однородности, при которой загрязняющие примеси не могут быть обнаружены в композиции обычными методами и таким образом композиция состоит из одного обнаруживаемого макромолекулярного компонента. Термин "лечение" обозначает любой признак успеха в терапии или уменьшение симптомов травмы,патологии или состояния, включая и объективные, и субъективные параметры, такие как ослабление; ремиссия; уменьшение симптомов или достижение лучшей переносимости травмы, патологии или состояния пациентом; снижение темпов деградации или прогрессирования заболевания; достижение менее разрушительного финального состояния деградации; улучшение физического качества жизни или психического состояния пациента. Лечение либо ослабление симптомов может быть основано на объективных или субъективных параметрах; в том числе на результатах физикальное обследования, психоневрологического обследования и/или психиатрической оценки. Например, некоторые приведенные в настоящем документе способы пригодны для успешного лечения рака за счет снижения числа случаев рака, достижения ремиссии при раке и/или ослабления симптома, связанного с онкологическим или воспалительным заболеванием."Эффективное количество" в общем случае относится к количеству, достаточному для снижения тяжести и/или частоты симптомов, устранения симптомов и/или первопричины, предотвращения появления симптомов и/или их первопричины, и/или улучшения или исправления нарушений, являющихся следствием или сопутствующих онкологическому заболеванию. В некоторых осуществлениях эффективное количество - это терапевтически эффективное количество или профилактически эффективное количество. "Терапевтически эффективное количество" - это количество, достаточное для излечения состояния болезни (напр. онкологического заболевания) или симптомов, в частности, состояния или симптомов, сопутствующих состоянию болезни, или иным образом предотвратить, замедлить, задержать или направить в обратную сторону прогрессирование состояния болезни или другого нежелательного симптома, связанного с заболеванием любым образом. "Профилактически эффективное количество" - это количество фармацевтической композиции, которое, при введении в организм объекта, окажет желаемое профилактическое действие, например, предотвращение или задержка начала (или повторного появления) онкологического заболевания, или снижение вероятности начала (или повторного появления) онкологического заболевания или его симптомов. Полное терапевтическое или профилактическое действие не должно обязательно проявляться при введении одной дозы, а может проявиться после введении ряда доз. Таким образом, терапевтически или профилактически эффективное количество можно вводить однократно или в виде нескольких доз."Аминокислота" соответствует обычному значению в данной области. Двадцать природных аминокислот и их обозначения соответствуют обычно используемым. См. Immunology-A Synthesis, издание 2,(Е.S. Golub and D.R. Green, ред.), Sinauer Associates: Sunderland, Mass. (1991), которые включены в данный документ посредством ссылки для любых целей. Пригодными компонентами полипептидов могут также быть стереоизомеры (например, D-аминокислоты) двадцати обычных аминокислот, неприродные аминокислоты, такие как альфа,альфа-дизамещенные аминокислоты, N-алкилзамещенные аминокислоты и другие необычные аминокислоты, которые также входят в понятие "аминокислоты". Примерами необычных аминокислот являются: 4-гидроксипролин, гамма-карбоксиглутамат, эпсилон-N,N,Nтриметиллизин, эпсилон-N-ацетиллизин, О-фосфосерин, N-ацетилсерин, N-формилметионин, 3 метилгистидин, 5-гидроксилизин, сигма-N-метиларгинин и другие аналогичные аминокислоты и иминокислоты (например, 4-гидроксипролин). В настоящем документе при обозначении полипептидов направление влево - направление к амино-концу, а направление вправо - направление к карбоксильному концу,что соответствует договоренности и стандартному употреблению. Общий обзор. В настоящем документе предложены антигенсвязывающие белки, которые связывают белок c-fms,в том числе c-fms человека (hc-fms) белок. Указанные антигенсвязывающие белки представляют собой полипептиды, в которые встроены и/или к которым присоединены один или более определяющий комплементарность участок (CDR), как описано в настоящем документе. В некоторых антигенсвязывающих белках CDR встроены в "каркасную" область, которая ориентирует CDR таким образом, что проявляются собственно антигенсвязывающие свойства CDR. В общем случае предложенные антигенсвязывающие белки могут нарушать, блокировать, уменьшать или модулировать взаимодействие между КСФ-1 и c- 14023555fms. Определенные антигенсвязывающие белки, описанные в настоящем документе, являются антителами или образуются из антител. В определенных осуществлениях полипептидное строение антигенсвязывающих белков основывается на антителах, в том числе, но без ограничения, моноклональных антителах, биспецифических антителах, мини-антителах, доменных антителах, синтетических антителах (называемых здесь в некоторых случаях "миметики антител"), химерных антителах, гуманизированных антителах, человеческих антителах, слитых антителах (называемых здесь в некоторых случаях "конъюгатами антител") и их фрагментов. Различные структуры описаны далее в настоящем документе. Было показано, что антигенсвязывающие белки, предложенные в настоящем документе, связываются с внеклеточным доменом c-fms, в частности, c-fms человека. Как далее описано в приведенных примерах, испытания некоторых антигенсвязывающих белков показали их способность связываться с эпитопами, отличными от эпитопов которые связывают ряд других антител к c-fms. Предложенные антигенсвязывающие белки конкурируют с КСФ-1 и таким образом препятствуют связыванию КСФ-1 с его рецептором. В определенных осуществлениях антигенсвязывающие белки ингибируют связывание IL-34 и c-fms. В других осуществлениях антигенсвязывающие белки ингибируют способность c-fms связывать как КСФ-1, так и IL-34. В результате антигенсвязывающие белки, предложенные в настоящем документе, способны ингибировать активность c-fms. Конкретно, антигенсвязывающие белки, которые связываются с указанными эпитопами, могут проявлять один или более из следующих видов активности: помимо прочего, ингибирование аутофосфорилирования c-fms; индукции сигнальных путей трансдукции cfms, индуцированного c-fms роста клеток, хемотаксиса моноцитов, накопления опухольассоциированных макрофагов в опухоли или в строме опухоли, продукцию опухоль-промотирующих факторов и других физиологических эффектов, вызванных связыванием c-fms с КСФ-1. Раскрытые в настоящем документе антигенсвязывающие белки характеризуются широким спектром полезных функций. Например, некоторые антигенсвязывающие белки могут служить для анализа специфического связывания, аффинной очистки c-fms, в частности, hc-fms или его лигандов и для скрининговых испытаний с целью идентификации антагонистов активности c-fms. Некоторые из антигенсвязывающих белков можно применять для ингибирования связывания КСФ-1 и c-fms или ингибирования аутофосфорилирования cfms. Антигенсвязывающие белки можно применять для различных видов лечения, что поясняется в настоящем документе. Например, некоторые антигенсвязывающие белки, связывающие c-fms, пригодны для лечения связанных с c-fms состояний, например, для снижения хемотаксиса моноцитов в организме,ингибирования миграции моноцитов в опухоли, ингибирования накопления опухоль-ассоциированных макрофагов в опухоли или ингибирования ангиогенеза, что ниже объясняется более подробно. В определенных осуществлениях антигенсвязывающие белки ингибируют способность ТАМ промотировать рост опухоли, прогрессирование и/или метастазирование. Кроме того, в тех случаях когда опухолевые клетки сами экспрессируют и используют c-fms, связывание антител с c-fms может ингибировать их рост/существование. К прочим областям применения антигенсвязывающих белков относится, например,диагностика заболеваний или состояний, связанных с c-fms и скрининговые пробы для определения присутствия или отсутствия c-fms. Некоторые из описанных здесь антигенсвязывающих белков пригодны для лечения последствий, симптомов и/или патологий, связанных с активностью c-fms. К таковым относятся, без ограничения, различные типы онкологических и воспалительных заболеваний, а также кахексия на фоне онкологического заболевания. В некоторых осуществлениях антигенсвязывающие белки могут служить для лечения костных патологий.C-fms. Колониестимулирующий фактор 1 (КСФ-1) способствует выживанию, пролиферации и дифференциации поколений мононуклеарных фагоцитов. КСФ-1 функционирует за счет связывания с рецепторомc-fms на поверхности клетки, что приводит к аутофосфорилированию киназой рецептора c-fms с последующим каскадом внутриклеточных сигналов. Термины "c-fms", "рецептор c-fms", "c-fms человека" и "рецептор c-fms человека" относятся к рецептору на поверхности клетки, который связывается с лигандом, в том числе, но без ограничения, КСФ 1, и таким образом инициирует путь трансдукции сигнала в клетке. В некоторых осуществлениях рецептор может связывать IL-34, либо одновременно КСФ-1 и IL-34. Предложенные здесь антигенсвязывающие белки связывают c-fms, в частности, c-fms человека. Пример внеклеточного домена аминокислотной последовательности c-fms человека приведен в SEQ ID NO: 1. Как указано ниже, белки c-fms могут также содержать фрагменты. В настоящем документе термины взаимозаменяемы и означают рецептор, в частности, человеческий рецептор, специфически связывающийся с КСФ-1. Термин "рецептор c-fms человека" (h-cfms) при использовании в настоящем документе подразумевает также природные аллели, в том числе мутации A245S, V279M и H362R. Термин c-fms относится также к посттрансляционным модификациям аминокислотной последовательности c-fms. Например,внеклеточный домен (ECD) c-fms человека (остатки 20-512 рецептора) содержит 11 возможных Nсвязанных позиций гликозилирования в последовательности. Таким образом, антигенсвязывающие белки могут связывать или генерироваться из белков, гликозилированных в одно или несколько из указанных- 15023555 положений. Положительное регулирование пути трансдукции сигнала c-fms участвует в ряде патологических состояний человека, связанных с постоянной активацией тканевых макрофагов. Повышение продукции КСФ-1 также связано с накоплением макрофагов в тканях, проявляющимся при различных воспалительных заболеваниях, например, при воспалительной болезни кишечника. Помимо этого, рост нескольких типов опухолей связан с чрезмерной экспрессией КСФ-1 и рецептора c-fms в раковых клетках и/или строме опухоли. Антигенсвязывающие белки, связывающие c-fms-рецептор. Предлагается ряд селективно связывающихся агентов, способных регулировать активность c-fms. Такие агенты включают, например, антигенсвязывающие белки, содержащие антигенсвязывающий домен (например, одноцепочечные антитела, доменные антитела, компоненты иммуноадгкзии и полипептиды с антигенсвязывающей областью) и специфически взаимодействующие с полипептидом c-fms, в частности, c-fms человека. Некоторые из таких агентов, например, способны ингибировать связывание КСФ-1 и c-fms и тем самым ингибировать, нарушать или модулировать один или более вид активности,связанный с сигнальным путем c-fms. В определенных осуществлениях антигенсвязывающие белки можно применять для ингибирования связывания IL-34 с c-fms. В некоторых осуществлениях антигенсвязывающие белки нарушают способность c-fms связывать как КСФ-1, так и IL-34. В общем случае антигенсвязывающие белки, предложенные в настоящем документе, обычно содержат один или более CDR, как здесь описано (например, 1, 2, 3, 4, 5 или 6). В некоторых случаях антигенсвязывающий белок содержит (a) полипептидную структуру и (b) один или более CDR, который внедряется в и/или объединяется с полипептидной структурой. Полипептидная структура может принимать ряд различных форм. Например, она может представлять собой или содержать каркас природного антитела или его фрагмент или вариант, или может быть полностью синтетическим по своей природе. Ниже приведены примеры различных полипептидных структур. В определенных осуществлениях полипептидная структура антигенсвязывающих белков представляет собой антитело или образуется из антитела, в том числе, но без ограничения, моноклональное антитело, биспецифическое антитело, мини-антитело, доменное антитело, синтетическое антитело (иногда называемое в настоящем документе "миметиком антитела"), химерное антитело, гуманизированное антитело, слитые антитела (иногда называемые в настоящем документе "конъюгатами антител"), а также части или фрагменты каждого из них. В некоторых случаях антигенсвязывающий белок - это иммунологический фрагмент антитела (например, Fab, Fab', F(ab')2 или scFv). Различные структуры далее определены и описаны в настоящем документе. Определенные антигенсвязывающие белки, предложенные в настоящем документе, специфически связываются с человеческим с-fms. В отдельном осуществлении антигенсвязывающий белок специфически связывается с человеческим белком c-fms, имеющим аминокислотную последовательность SEQ IDNO: 1. В тех осуществлениях, где антигенсвязывающий белок служит для терапевтических целей, антигенсвязывающий белок может ингибировать, нарушать или модулировать один или более вид биологической активности c-fms. Считается, что антигенсвязывающий белок специфически связывает и/или существенно ингибирует связывание c-fms человека с КСФ-1 в том случае, если избыток антитела снижает количество c-fms человека, связанного с КСФ-1 (или наоборот) хотя бы приблизительно на 20, 30, 40, 50,60, 70, 80, 85, 90, 95, 97, 99% или более (по данным анализа конкурентного связывания in vitro). C-fms оказывает биологическое действие разных видов, которое может быть определено разными методами анализа в различных типах клеток; примеры таких анализов приведены в настоящем документе. Строение природных антител. Некоторые из предложенных антигенсвязывающих белков имеют строение, характерное для природных антител. Структурные единицы таких антител обычно содержат один или более тетрамер, состоящий из двух одинаковых пар одинаковых полипептидных цепей, хотя в некоторых видах млекопитающих продуцируются также антитела, имеющие только тяжелую цепь. В типовом антителе каждая пара состоит из одной полноразмерной легкой цепи (в определенных осуществлениях около 25 кДа) и одной полноразмерной тяжелой цепи (в определенных осуществлениях около 50-70 кДа). Каждая индивидуальная иммуноглобулиновая цепь состоит из нескольких "иммуноглобулиновых доменов", каждый из которых содержит приблизительно 90-110 аминокислот и имеет характерную картину укладки. Указанные домены являются основными единицами, из которых состоят полипептиды антител. Аминоконцевая часть каждой цепи обычно включает вариабельный домен, ответственный за узнавания антигена. Карбокси-концевая часть более эволюционно консервативна, чем противоположный конец цепи, и называется "константной областью" или "С-областью". Человеческие легкие цепи обычно подразделяются на каппа- и лямбда-легкие цепи, и каждая из них содержит один вариабельный домен и один константный домен. Тяжелые цепи обычно подразделяют на цепи мю, дельта, гамма, альфа и эпсилон, что определяет следующие изотипы антител: соответственно IgM, IgD, IgG, IgA и IgE. Существует несколько подтипов IgG, в том числе, но без ограничения, IgG1, IgG2, IgG3 и IgG4. К подтипам IgM относятся IgM1 и IgM2. Подтипы IgA - IgA1 и IgA2. В организме человека изотипы IgA и IgD содержат четыре тяжелых- 16023555 цепи и четыре легких цепи; изотипы IgG и IgE содержат две тяжелых цепи и две легких цепи; а изотипIgM содержит пять тяжелых цепей и пять легких цепей. С-область тяжелой цепи обычно включает один или более домен, ответственный за эффекторную функцию. Количество доменов константной области тяжелой цепи зависит от изотипа. Тяжелые цепи IgG, например, содержат по три домена С-области, называемые CH1, CH2 и CH3. Предлагаемые антитела могут относиться к любому из указанных изотипов и подтипов. В определенных осуществлениях антитела c-fms относятся к подтипам IgG1, IgG2 или IgG4. В полноразмерных легких и тяжелых цепях вариабельные и константные области объединяются с помощью участка J, состоящего приблизительно из двенадцати или более аминокислот, при этом тяжелая цепь также имеет участок D, содержащий еще около десяти аминокислот. См., например, Fundamental Immunology, 2-e изд., гл. 7 (Paul, W., ред.) 1989, Нью-Йорк: Raven Press (полностью включен в данный документ посредством ссылки для любых целей). Вариабельные области каждой пары легкая/тяжелая цепь обычно образуют антигенсвязывающую область. Например, константный домен тяжелой цепи IgG2 типового моноклонального антитела c-fms имеет следующую аминокислотную последовательность:(SEQ ID NO:2; звездочкой обозначен стоп-кодон). Например, константный домен каппа-легкой цепи типового моноклонального антитела имеет следующую аминокислотную последовательность:(SEQ ID NO: 3; звездочкой обозначен стоп-кодон). Вариабельные области иммуноглобулиновых цепей обычно имеют одинаковое общее строение, куда входят сравнительно консервативные каркасные области (FR), объединенные тремя гипервариабельными областями, которые чаще называют "определяющими комплементарность участками" (CDR). Участки CDR двух цепей от каждой упомянутой выше пары тяжелая цепь/легкая цепь обычно выровнены по каркасным областям, образуя структуру, которая специфически связывается со специфическим эпитопом целевого белка (например, c-fms). От N-конца до С-конца природные вариабельные участки и легкой, и тяжелой цепи, как правило, соответствуют следующему порядку указанных элементов: FR1, CDR1, FR2,CDR2, FR3, CDR3 и FR4. Для присваивания номеров аминокислотам, занимающим позиции в каждом из доменов, была разработана система нумерации. Определение данной системы нумерации дано в KabatSequences of Proteins of Immunological Interest (1987 и 1991, NIH, Bethesda, MD), или ChothiaLesk,1987, J. Mol. Biol. 196:901-917; Chothia с соавт., 1989, Nature 342:878-883. Различные вариабельные области тяжелой цепи и легкой цепи, предложенные в настоящем документе, приведены в табл. 2. Каждая из указанных вариабельных областей может быть присоединена к упомянутым выше константным областям тяжелой и легкой цепи, образуя соответственно полную структуру тяжелой и легкой цепи антитела. Далее, сформированные таким образом последовательности тяжелой и легкой цепи комбинируют, получая полную структуру антитела. Следует иметь в виду, что вариабельные области тяжелой цепи и легкой цепи, предложенные в настоящем документе, могут также присоединяться и к другим константным доменам, имеющим иные последовательности нежели типовые последовательности, приведенные выше. Конкретные примеры некоторых полноразмерных легких и тяжелых цепей предлагаемых антител, а также их соответствующие аминокислотные последовательности приведены в табл. 1. Также и в этом случае каждая из типовых тяжелых цепей (H1, H2, H3 и т.д.), перечисленных в табл. 1, может комбинироваться с любой из типовых легких цепей, приведенных в табл. 1, образуя антитело. Примерами таких комбинаций является H1 в сочетании с любым из L1-L34; H2 в сочетании с любым изL1-L34; H3 в сочетании с любым из L1-L34 и т.д. В некоторых случаях антитела содержат хотя бы одну тяжелую цепь и одну легкую цепь из перечисленных в табл. 1. В некоторых случаях антитела содержат две разные тяжелые цепи и две разные легкие цепи, перечисленные в табл. 1. В других случаях антитела содержат две одинаковые легкие цепи и две одинаковые тяжелые цепи. В качестве примера антитело или его иммунологически функциональный фрагмент может включать в себя две тяжелых цепи H1 и две легких цепи L1, или две тяжелых цепи H2 и две легких цепи L2, или две тяжелых цепи H3 и две легких цепиL3, а также другие аналогичные сочетания пар легких цепей и пар тяжелых цепей, как это указано в табл. 1. Другие предлагаемые антигенсвязывающие белки являются вариантами антител, образованных- 27023555 комбинацией тяжелых и легких цепей, приведенных в табл. 1 и содержат легкие и/или тяжелые цепи,имеющие хотя бы по 90, 95, 97 или 99% идентичности с аминокислотными последовательностями указанных цепей. В некоторых случаях такие антитела включают хотя бы одну тяжелую цепь и одну легкую цепь, в то время как в других случаях вариантные формы содержат две одинаковых легких цепи и две одинаковых тяжелых цепи. Вариабельные домены антител. Предлагаются также антигенсвязывающие белки, которые содержат вариабельную область тяжелой цепи антитела, выбранную из группы, состоящей из VH1, VH2, VH3, VH4, VH5, VH6, VH7, VH8, VH9, VH10,VH11, VH12, VH13, VH14, VH15, VH16, VH17, VH18, VH19, VH20, VH21, VH22, VH23, VH24, VH25, VH26,VH27, VH28, VH29, VH30, VH31 и VH32 и/или вариабельную область легкой цепи антитела, выбранную из группы, состоящей из VL1, VL2, VL3, VL4, VL5, VL6, VL7, VL8, VL9, VL10, VL11, VL12, VL13, VL14, VL15,VL16, VL17, VL18, VL19, VL20, VL21, VL22, VL23, VL24, VL25, VL26, VL27, VL28, VL29, VL30, VL31, VL32,VL33 и VL34, как показано ниже в табл. 2, а также иммунологически функциональные фрагменты, производные, мутеины и варианты указанных вариабельных областей легкой цепи и тяжелой цепи. Сопоставление последовательностей различных вариабельных областей тяжелых и легких цепей показано соответственно на фиг. 1 А и 1 В. Антигенсвязывающие белки рассматриваемого типа можно в общем виде представить формулойVHx/VLy, где "x" соответствует номеру вариабельных областей тяжелой цепи, а "y" соответствует номеру вариабельных областей легкой цепи (в общем виде, x и y = 1 или 2), как показано в табл. 2. Таблица 2 Примеры цепей VH и VL
МПК / Метки
МПК: A61P 35/00, A61K 39/395, C07K 14/715, C07K 16/28
Метки: антигенсвязывающие, связывающие, белки, человека, c-fms
Код ссылки
<a href="https://eas.patents.su/30-23555-antigensvyazyvayushhie-belki-svyazyvayushhie-c-fms-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Антигенсвязывающие белки, связывающие c-fms человека</a>
Предыдущий патент: Формованный и покрытый металлический материал, композит и способ изготовления формованного и покрытого металлического материала и композита
Следующий патент: 1,2-дизамещенные-4-аминоимидазохинолины
Случайный патент: Способ уборки зерновых культур, зерноуборочный комбайн и его узлы