Белки на основе структурного домена фибронектина, связывающие pcsk9
Номер патента: 22983
Опубликовано: 29.04.2016
Авторы: Денхез Фабиенне М., Миао Боуман, Кампхаусен Рей, Ситкофф Дори Ф., Митчел Трейси С., Ло Чинг-Хсиунг Фредерик, Липовсек Даса, Лоу Чи Менг, Дэвис Джонатан Х., Паркер Рекс А., Клоад Шерон Т., Ракестроу Джинджер С., Саеед-Коте Амна, Руссо Кэти А.
Формула / Реферат
1. Полипептид, содержащий десятый домен типа III фибронектина (10Fn3), в котором FG петля содержит последовательность формулы EX4X1X5X1X1X6GYX4HR (SEQ ID NO: 451), где X1 представляет собой любую аминокислоту, Х4 представляет собой Y или F, X5 представляет собой Y, F или W, X6 представляет собой S или А и где данный полипептид связывает PCSK9 (пропротеин конвертазы субтилизин/кексин типа 9).
2. Полипептид по п.1, в котором указанный полипептид связывает PCSK9 с KD менее чем 500 нМ.
3. Полипептид по п.1 или 2, в котором FG петля содержит затемненные участки любой из SEQ ID NO: 28-38 и 142-172, как это показано в табл. 3.
4. Полипептид по любому из пп.1-3, в котором последовательность FG петли выбирается из SEQ ID NO: 28-38 и 142-172.
5. Полипептид по любому из пп.1-4, в котором последовательность петли ВС содержит последовательность формулы (X1)ZX2G (SEQ ID NO: 449), в которой X1 представляет собой любую аминокислоту, Z представляет собой число от 6-9 и Х2 представляет собой Y или Н.
6. Полипептид по любому из пп.1-5, в котором последовательность петли ВС содержит затемненную часть любой из последовательностей SEQ ID NO: 2-17, 107-135 и 301-303, как показано в табл. 3.
7. Полипептид по п.5 или 6, в котором последовательность петли ВС выбирается из группы последовательностей SEQ ID NO: 2-17, 107-135 и 301-303.
8. Полипептид по любому из пп.1-7, в котором последовательность петли DE содержит последовательность формулы X1X1X1X3 (SEQ ID NO: 450), в которой X1 представляет собой любую аминокислоту, Х3 является G или S.
9. Полипептид по любому из пп.1, 2 или 8, в котором последовательность петли DE содержит затемненную часть любой из последовательностей SEQ ID NO: 18-27 и 136-141, как показано в табл. 3.
10. Полипептид по любому из пп.8 или 9, в котором последовательность петли DE выбирается из группы последовательностей SEQ ID NO: 18-27 и 136-141.
11. Полипептид по любому из пп.1-10, в котором последовательности петель ВС, DE и FG по меньшей мере на 80% идентичны любой из последовательностей SEQ ID NO: 2-38, 106-172 и 301-303.
12. Полипептид по п.11, в котором аминокислотные последовательности ВС, DE и FG петель по меньшей мере на 80% идентичны SEQ ID NO: 14, 25 и 37.
13. Полипептид по любому из пп.1-12, в котором последовательность полипептида содержит аминокислотную последовательность, по меньшей мере на 80% идентичную любой из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309.
14. Полипептид по п.13, где полипептид содержит аминокислотную последовательность Fn3 домена, представляющую собой фрагмент последовательности с 3 по 96 позиции SEQ ID NO: 69.
15. Полипептид по п.1, где 10Fn3 содержит ВС, DE и FG петли и где ВС петля содержит SEQ ID NO: 14, DE петля содержит SEQ ID NO: 25, FG петля содержит SEQ ID NO: 37.
16. Полипептид по п.1, где полипептид содержит SEQ ID NO: 82.
17. Полипептид по любому из пп.1-16, дополнительно содержащий одну или более фармакокинетических групп (PK), выбранных из группы, содержащей полиэтиленгликоль, сиаловую кислоту, Fc-фрагмент, часть Fc-фрагмента, трансферрин, сывороточный альбумин, связывающий сывороточный альбумин белок и связывающий сывороточные иммуноглобулины белок.
18. Полипептид по п.17, в котором белок, связывающий сывороточный альбумин, содержит десятый домен III типа фибронектина (10Fn3).
19. Полипептид по п.18, в котором домен 10Fn3 связывает HSA.
20. Полипептид по п.17, в котором PK-группой является полиэтиленгликоль.
21. Фармацевтически приемлемая композиция, содержащая полипептид по любому из пп.1-20, по существу, свободная от эндотоксина.
Текст
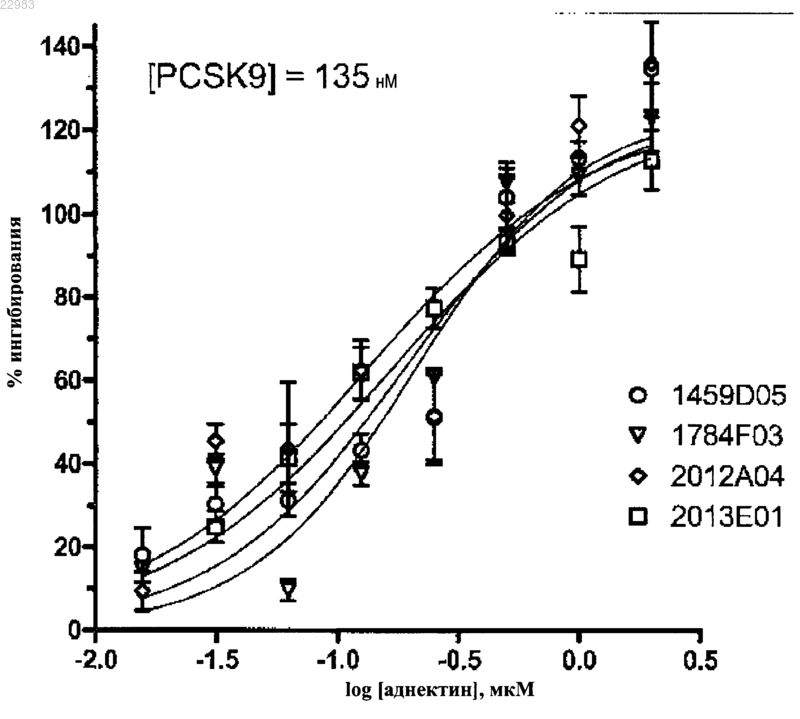
БЕЛКИ НА ОСНОВЕ СТРУКТУРНОГО ДОМЕНА ФИБРОНЕКТИНА,СВЯЗЫВАЮЩИЕ PCSK9 Настоящее изобретение относится к белкам на основе структурного домена фибронектина,которые связывают PCSK9. Изобретение также относится к применению данных инновационных белков в терапевтических приложениях для лечения атеросклероза, гиперхолистеринемии и других заболеваний, связанных с повышенным уровнем холестерина. Данное изобретение также относится к клеткам, содержащим данные белки, полинуклеотидам, кодирующим данные белки или их фрагменты, и векторам, содержащим данные полинуклеотиды, кодирующие данные инновационные белки. Область техники Данное изобретение относится к связывающим белок-предшественник конвертазы субтилизин/кексин типа 9 (PCSK9) белкам, содержащим структурный домен фибронектина. Также данное изобретение относится к применению данных оригинальных белков в терапевтических приложениях для лечения атеросклероза, гиперхолистеринемии и других заболеваний, связанных с повышенным уровнем холестерина. Также данное изобретение относится к клеткам, содержащим такие белки, полинуклеотидам, кодирующим такие белки, или их фрагментам и к векторам, содержащим полинуклеотиды, кодирующие данные оригинальные белки. Введение Атеросклероз - заболевание артерий, ответственное за развитие ишемической болезни сердца(ИБС), которая является причиной большинства случаев смерти в промышленно развитых странах (Lusis(2000. В настоящее время некоторые факторы риска развития ИБС хорошо известны: дислипидемии,артериальная гипертензия, сахарный диабет, курение, плохое питание, отсутствие физической нагрузки и стресс. Наиболее клинически значимые и распространенные дислипидемии характеризуются повышением содержания липопротеидов низкой и очень низкой плотности (ЛПНП и ЛПОНП) совместно с гиперхолестеринемией при отсутствии или наличии гипертриглицеридемии (Fredrickson et al. (1967. Отдельное повышение уровня холестерина в составе ЛПНП является одним из наиболее распространенных факторов риска развития ИБС. Белок PCSK9 (также известный как HCHOLA3, NARC-1 или FH3) является протеазой и подсемейства протеиназы K семейства секреторных субтилаз (Naureckiene et al., Arch. Biochem. Biophy., 420:55-57 (2003. Показано, что PCSK9 является ключевым регулятором гомеостаза уровня холестерина и уровня циркулирующих липопротеидов низкой плотности. Циркулирующий белокPCSK9 контролирует метаболизм ЛПНП, непосредственно связываясь с рецептором ЛПНП и обеспечивая его деградацию в гепатоцитах. PCSK9-опосредованное снижение представленности и активности рецептора ЛПНП приводит к снижению клиренса ЛПНП из кровотока и повышению уровня ЛПНП. Известно, что некоторые мутантные формы PCSK9, в том числе S127R, N157K, F216L, R218S и D374Y, сS127R, F216L и D374Y связаны с аутосомно-доминантной гиперхолестеринемией (АДГ). Считается, что дикий тип PCSK9 увеличивает скорость обмена рецепторов ЛПНП и обусловливает более низкий клиренс ЛПНП (Maxwell et al., Proc. Natl. Acad. Sci., 102(6):2069-2074 (2005), тогда как мутации, приводящие к потере функциональности PCSK9, приводят к повышению уровня рецептора липопротеидов низкой плотности (РЛПНП), увеличению клиренса циркулирующих ЛПНП и соответствующему снижению уровня холестерина в плазме (Rashid et al., Proc. Natl. Acad. Sci., 102(15):5374-5379 (2005. Таким образом, PCSK9 является потенциальной мишенью для разработки средств лечения атеросклероза, гиперхолестеринемии и других заболеваний, связанных с повышенным уровнем холестерина. Основанные на последовательности фибронектина структуры представляют собой семейство белков, способных изменять свою структуру таким образом, чтобы связать любое целевое вещество. Белки такого типа, структуры которых обычно образованы на основе фибронектинового домена III типа (Fn3) или Fn3-подобного домена, имеют схожие функциональные свойства со свойствами природных или рекомбинантных антител (поликлональных, моноклональных или одноцепочечных), а также обладают структурными преимуществами. В частности, структура таких миметиков антител создана оптимальной для пространственной укладки, стабильности и растворимости даже в условиях, которые обычно приводят к потере структуры и функции антител. Примером структурных белков на основе фибронектина являются аднектины (Adnexus, Bristol-Myers Squibb RD Company). Фибронектиновые домены III типа (Fn3) содержат следующие участки (по порядку от N-конца к Сконцу): бета- или бета-подобный участок А, петля АВ, бета- или бета-подобный участок В, бета- или бета-подобный участок С, петля CD, бета- или бета-подобный участок D, петля DE, бета- или бетаподобный участок Е; петля EF, бета- или бета-подобный участок F; петля FG и бета- или бета-подобный участок G. Любая или все петли АВ, ВС, CD, DE, EF и FG могут принимать участие в связывании целевой молекулы. Петли ВС, DE и FG являются структурными и функциональными аналогами областей определяющих комплиментарность иммуноглобулинов (CDR-участки). В патентной заявке США 7115396 описываются белки, содержащие домены Fn3, в которых изменения в ВС, DE и FG петлях приводят к высокому сродству при связывании ФНО. В патентной заявке США 2007/0148126 описываются белки, содержащие домены Fn3, в которых изменения в ВС, DE и FG петлях приводят к высокому сродству при связывании VEGFR2. Получение оптимизированных структурных белков, содержащих домены фибронектинового типа,связывающих PCSK9, для терапевтического применения таких белков при лечении атеросклероза, гиперхолистеринемии и других заболеваний, связанных с повышенным уровнем холестерина. Сущность изобретения Настоящее изобретение предлагает аднектины против PCSK9 человека. Одним из объектов данного изобретения являются полипептиды, содержащие домен Fn3, в котором одна или более петель, доступных для растворителя, имеют случайную или мутантную первичную последовательность. В некоторых вариантах исполнения такой Fn3 домен представляет собой модифицированный относительно дикого типа домен Fn3, полученный из десятого модуля фибронектинового домена III типа человека (10Fn3). В некоторых вариантах исполнения такой 10Fn3-полипептид, описанный в данном изобретении, является по меньшей мере на 40, 50, 60, 65, 70, 75, 80, 85 или 90% идентичным домену 10Fn3 человека. В некоторых вариантах исполнения одна или более петель из группы ВС, DE и FG может быть длиннее или короче соответствующей петли фибронектина человека. В некоторых вариантах исполнения полипептиды, описанные в данном изобретении, содержат десятый фибронектиновый домен III типа (10Fn3), в котором домен 10Fn3 содержит петли АВ, ВС, CD, DE,EF и FG и по меньшей мере одну петлю из группы: ВС, DE и FG с изменением в первичной последовательности относительно последовательности в соответствующей петле домена 10Fn3 человека. В некоторых вариантах исполнения полипептид, описанный в данном изобретении, содержит доменFn3, содержащий аминокислотную последовательность, по меньшей мере на 80, 85, 90, 95, 98, 99 или 100% идентичную последовательности непетлевых участков. В некоторых вариантах исполнения петля ВС белка, описываемого в настоящем изобретении, содержит аминокислотную последовательность, выбранную из группы последовательностей SEQ ID NO: 217, 106-135 и 301-303. В определенных вариантах исполнения петля ВС белка, описываемого в настоящем изобретении, содержит затемненные участки любой из последовательностей SEQ ID NO: 2-17, 106135 и 301-303, как показано в табл. 3. Например, в одном варианте исполнения, петля ВС содержит последовательность PPPSHGYG (остатки 3-10 последовательности SEQ ID NO: 2), DAPAHAYG (остатки 310 последовательности SEQ ID NO: 5), EPFSRLPGGGE (остатки 3-13 последовательности SEQ ID NO: 106) или DAPADGGYG (остатки 3-11 последовательности SEQ ID NO: 107). В некоторых вариантах исполнения петля DE белка, описываемого в настоящем изобретении, содержит аминокислотную последовательность, выбранную из следующей группы: SEQ ID NO: 18-27 и 136-141. В определенных вариантах исполнения петля DE белка, описываемого в настоящем изобретении, содержит затемненные участки любой из последовательностей SEQ ID NO: 18-27 и 136-141, как показано в табл. 3. Например, в одном варианте исполнения петля DE содержит последовательностьNO: 27) или VSKS (остатки 2-5 последовательности SEQ ID NO: 137). В некоторых вариантах исполнения петля FG белка, описываемого в настоящем изобретении, содержит аминокислотную последовательность, выбранную из следующей группы последовательностей:SEQ ID NO: 28-38 и 142-172. В определенных вариантах исполнения петля DE белка, описываемого в настоящем изобретении, содержит затененные участки любой из последовательностей SEQ ID NO: 28-38 и 142-172, как показано в табл. 3. Например, в одном варианте исполнения петля FG содержит последовательность EYPYKHSGYYHR (остатки 1-12 последовательности SEQ ID NO: 28), EYPYDYSGYYHR(остатки 1-12 последовательности SEQ ID NO: 142) или EFDFVGAGYYHR (остатки 1-12 последовательности SEQ ID NO: 167). В некоторых вариантах исполнения домен 10Fn3 может содержать измененные аминокислотные остатки в начале и/или на конце последовательности, а также инсерции или делеции. В некоторых вариантах исполнения белок, описываемый в данном изобретении, содержит одну из петель ВС SEQ ID NO: 2-17, 106-135 и 301-303; одну из последовательностей петель DE SEQ ID NO: 1827 и 136-141; одну последовательностей петли FG SEQ ID NO: 28-38 и 142-172. В определенных вариантах исполнения белок, описываемый в данном изобретении, содержит одну последовательность петли ВС, включающей затененную часть любой из последовательностей SEQ ID NO: 2-17, 106-135 и 301-303,показанных в табл. 3; одну последовательность петли DE, включающей затененную часть любой из последовательностей SEQ ID NO: 18-27 и 136-141, показанных в табл. 3; и одну последовательность петлиFG, включающей затененную часть любой из последовательностей SEQ ID NO: 28-38 и 142-172, показанных в табл. 3. В некоторых вариантах исполнения белок, описываемый в данном изобретении, содержит аминокислотные последовательности петель ВС, DE и FG, совпадающие по меньшей мере на 70, 75, 80, 85, 90,95, 98, 99 или 100% с любой из последовательностей SEQ ID NO: 2-38, 106-172 и 301-303. В определенных вариантах исполнения белок, описываемый в данном изобретении, содержит аминокислотные последовательности петель ВС, DE и FG, совпадающие по меньшей мере на 70, 75, 80, 85, 90, 95, 98, 99 или 100% с любой из затененных частей последовательностей петель ВС, DE и FG, показанных в табл. 3, как это описано ранее. В некоторых вариантах исполнения анти-PCSK9 аднектин содержит аминокислотную последовательность любой из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309. В некоторых вариантах исполнения последовательность анти-PCSK9 аднектина содержит с 3 по 96 позиции аминокислотной последовательности домена Fn3 любой из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю ВС с последовательностью SW(X1)ZX2G (SEQ ID NO: 323), в которой X1 представляет собой любую аминокислоту, Z - число от 6 до 9 и Х 2 представляет собой Y или Н. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю DE с последовательностью РХ 1 Х 1 Х 1 Х 3 Т (SEQ ID NO: 324), в которой X1 представляет собой любую аминокислоту, а Х 3 является либо G либо S. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю FG с последовательностью EX4X1X5X1X1X6GYX4HRP (SEQ ID NO: 325), в которой X1 представляет собой любую аминокислоту, X4 является Y или F, X5 является Y, F или W, X6 является либоS, либо А. В определенных вариантах исполнения Х 4 и Х 5 представляют собой ароматические остатки,каждый из которых независимо является Y, F, W или Н. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю ВС с последовательностью SW(X1)2X2G (SEQ ID NO: 323), петлю DE с последовательностью РХ 1 Х 1 Х 1 Х 3 Т (SEQ ID NO: 324) и петлю FG с последовательностью EX4X1X5X1X1X6GYX4HRP (SEQID NO: 325), как определено в данном изобретении. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю ВС с последовательностью SWEPFSRLPGGGE (SEQ ID NO: 106), петлю DE с последовательностью РХ 1 Х 1 Х 1 Х 3 Т (SEQ ID NO: 324) и петлю FG с последовательностьюEX4X1X5X1X1X6GYX4FIRP (SEQ ID NO: 325), как определено в данном изобретении. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю ВС с последовательностью (X1)ZX2G (SEQ ID NO: 449), в которой X1 представляет собой любую аминокислоту, Z - число в диапазоне 6-9, а Х 2 представляет собой Y или Н. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю DE с последовательностью Х 1 Х 1 Х 1 Х 3 (SEQ ID NO: 450), в которой X1 является любой аминокислотой, Х 3 представляет собой G или S. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю FG с последовательностью EX4X1X5X1X1X6GYX4HR (SEQ ID NO: 451), в которой X1 представляет собой любую аминокислоту, X4 представляет собой Y или F, Х 5 представляет собой Y, F, илиW, Х 6 представляет собой S или А. В определенных вариантах исполнения Х 4 и X5 представляют собой остатки ароматических аминокислот, каждая из которых, независимо, может быть Y, F, W или Н. Одним из объектов, защищаемых настоящим изобретением, является анти-PCSK9 аднектин, содержащий петлю ВС с последовательностью (X1)ZX2G (SEQ ID NO: 449), петлю DE с последовательностью Х 1 Х 1 Х 1 Х 3 (SEQ ID NO: 450) и петлю FG с последовательностью EX4X1X5X1X1X6GYX4HR (SEQ ID NO: 451), как определено в данном изобретении. В некоторых вариантах исполнения существует по меньшей мере одна аминокислотная делеция наN-конце последовательности PCSK9 аднектина. В некоторых вариантах исполнения существует по меньшей мере одна аминокислотная делеция,инсерция или замена на С-конце последовательности PCSK9 аднектина. В некоторых вариантах исполнения на С-конец последовательности PCSK9 аднектина добавлена линкерная последовательность. В некоторых вариантах исполнения PCSK9 аднектин может быть конъюгирован с другой молекулой, нежели 10Fn3, такой как сывороточный альбумин человека (HSA), как это описано в патентных заявках WO 2009/133208 и WO 2009/083804. В некоторых вариантах исполнения PCSK9 аднектин может содержать мутации в аминокислотных последовательностях петель АВ, CD и EF, как это описано в патентных заявках WO 2009/133208 и WO 2009/083804. Одним из объектов изобретения является PCSK9 аднектин, содержащий фармакокинетическую группу (PK). В одном варианте исполнения фармакокинетическая группа содержит полиэтиленгликоль(ПЭГ). В отдельных вариантах исполнения фармакокинетическая группа содержит Fc-фрагмент. В некоторых вариантах исполнения фармакокинетическая группа содержит один или несколько аднектинов,связывающих сывороточный альбумин. Примеры слитых белков анти-PCSK9 аднектин-Fc приведены в табл. 1. Примеры анти-PCSK9 аднектинов, связывающих сывороточный альбумин, содержат последовательности SEQ ID NO: 618 или 619. В определенных вариантах исполнения анти-PCSK9 аднектины, содержащие PK-группу, содержат последовательность, как указана в SEQ ID NO: 322. Другим объектом изобретения является анти-PCSK9 аднектин, не содержащий никакой PK-группы(т.е. "свободный" анти-PCSK9 аднектин). В определенных вариантах исполнения свободный анти-PCSK9 аднектин может вводиться с такой частотой, которая достаточна для достижения желаемого терапевтического эффекта. В другом варианте исполнения свободный анти-PCSK9 аднектин может вводиться в виде лекарственной формы с пролонгированным высвобождением (например, лекарственная форма для подкожного введения). В некоторых вариантах исполнения лекарственная форма с пролонгированным высвобождением увеличивает длительность фазы абсорбции, или продлевает фармакодинамическое воздействие, или оказывает оба эффекта сразу. В качестве примера, лекарственная форма с пролонгированным высвобождением содержит раствор пропиленгликоля в фосфатном буфере (PBS). Одним из объектов настоящего изобретения является применение анти-PCSK9 аднектина для лечения атеросклероза, гиперхолистеринемии и других заболеваний, связанных с повышенным уровнем холестерина. Одним из объектов данного изобретения является слитый полипептид, содержащий связывающий сывороточный альбумин десятый домен III типа фибронектина (10Fn3), и анти-PCSK9 аднектин, в котором связывающий сывороточный альбумин домен 10Fn3 связывается с сывороточным альбумином, например HSA, с Kd 1 мкМ или меньше. В определенных вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 содержит аминокислотную последовательность, по меньшей мере на 70% идентичную последовательности SEQ ID NO: 330. В одном из вариантов исполнения связывающий сывороточный альбумин домен 10Fn3 содержит петлю ВС с аминокислотной последовательностью, приведенной в последовательности SEQ ID NO: 331, петлю DE с аминокислотной последовательностью, приведенной в последовательности SEQ ID NO: 332, петлю FG с аминокислотной последовательностью,приведенной в последовательности SEQ ID NO: 333. В другом варианте исполнения связывающий сывороточный альбумин домен 10Fn3 содержит одну или более петель ВС с аминокислотной последовательностью, приведенной в последовательности SEQ ID NO: 331, петель DE с аминокислотной последовательностью, приведенной в последовательности SEQ ID NO: 332, петель FG с аминокислотной последовательностью, приведенной в последовательности SEQ ID NO: 333. В одном из вариантов исполнения данный связывающий сывороточный альбумин домен 10Fn3 из состава слитого полипептида также способен связывать один или несколько альбуминов: сывороточный альбумин макаки-резус (RhSA), сывороточный альбумин яванской макаки (CySA) или сывороточный альбумин мыши (MuSA). В других вариантах исполнения данный связывающий сывороточный альбумин домен 10Fn3 не обладает перекрестной реактивностью с одним или несколькими белками среди RhSA,CySA или MuSA. В определенных вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 в составе слитого полипептида связывает HSA с Kd 1 мкМ или менее. В некоторых вариантах исполнения данный связывающий сывороточный альбумин домен 10Fn3 связывает HSA с Kd 500 нМ или менее. В других вариантах исполнения данный связывающий сывороточный альбумин домен 10Fn3 связывает HSA сKd по меньшей мере 200, 100, 50, 20, 10 или 5 нМ. В других вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 в составе слитого полипептида связывается с доменами HSA I или II. В одном варианте исполнения связывающий сывороточный альбумин домен 10Fn3 связывает оба домена HSA (I и II). В некоторых вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 связывает HSA в диапазоне рН от 5,5 до 7,4. В других вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 связывает HSA с Kd 200 нМ или менее при рН 5.5. В других вариантах исполнения связывающий сывороточный альбумин домен 10Fn3 связывает HSA с Kd по меньшей мере 500, 200, 100, 50, 20, 10 или 5 нМ в диапазоне от рН 5.5 до 7.4. В одном варианте исполнения связывающий сывороточный альбумин домен 10Fn3 связываетHSA с Kd по меньшей мере 500, 200, 100, 50, 20, 10 или 5 нМ при рН 5.5. В некоторых вариантах исполнения период полужизни в плазме слитого полипептида в присутствии сывороточного альбумина по меньшей мере в 5 раз больше, чем период полужизни этого полипептида в отсутствие сывороточного альбумина. В определенных вариантах исполнения период полужизни в плазме слитого полипептида в присутствии сывороточного альбумина по меньшей мере в 2, 5, 7, 10, 12,15, 20, 22, 25, 27 или 30 раз выше, чем период полужизни этого полипептида в отсутствие сывороточного альбумина. В некоторых вариантах исполнения сывороточным альбумином является один из следующих альбуминов: HSA, RhSA, CySA или MuSA. В определенных вариантах исполнения период полужизни в плазме слитого полипептида в присутствии сывороточного альбумина составляет по меньшей мере 20 ч. В определенных вариантах исполнения период полужизни в плазме слитого полипептида в присутствии сывороточного альбумина составляет по меньшей мере 10, 12, 15, 20, 25, 30, 40, 50, 75, 90, 100, 110, 120, 130, 150, 170 или 200 ч. В некоторых вариантах исполнения период полужизни слитого полипептида определяется у приматов (например,человек или обезьяна) или у мышей. В любом из последующих объектов или вариантов исполнения связывающий сывороточный альбумин домен 10Fn3 содержит последовательность, выбранную из группы последовательностей SEQ ID NO: 334, 338, 342, 346 и 348-370. Краткое описание чертежей На фиг. 1 приведено выравнивание примера аминокислотной последовательности анти-PCSK9 аднектина. Аминокислотные последовательности петель ВС, DE и FG выделены подчеркиванием, курсивом и подчеркиванием или жирным шрифтом и подчеркиванием соответственно. На фиг. 2 изображена схема анализа "PCSK9: гомологичный домен предшественника эпидермального фактора роста (домен EGFA)" на основе флуоресцентного резонансного переноса энергии (FRET),который был применен для измерения способности PCSK9 аднектинов ингибировать взаимодействиеPCSK9:РЛПРП описано в примере 2. На фиг. 3 изображена кривая, полученная при FRET-анализе, при измерении ингибирования взаимодействия человеческого PCSK9:EGFA клонами 1459D05, 1784F03, 1813 Е 02, 1922G04 и 1923 В 02 (панель А) и клонами 1459D05, 2012 А 04, 2011 Н 05 и 2013 Е 01 (панель В) PCSK9 аднектина, как описано в примере 2. На фиг. 4 изображена кривая, полученная при FRET-анализе, при измерении ингибирования взаимодействия человеческого PCSK9:ATI000972 клонами 1459D05, 1784F03, 1813 Е 02, 1922G04 и 1923 В 02(панель А) и клонами 2012 А 04, 2011 Н 05 и 2013 Е 01 (панель В) PCSK9 аднектина, как описано в примере 2. На фиг. 5 показана активность клонов 1459D05, 1784F03, 1813 Е 02, 1922G04 и 1923 В 02 (панель А) и клонов 2012 А 04, 2011 Н 05 и 2013 Е 01 (панель В) PCSK9 аднектина, при прямом FRET-анализе связывания PCSK9 человека, как это описано в примере 2. На фиг. 6 приведено ингибирование активности PCSK9 в клетках линии HepG2, измеренное с помощью метода поглощения DiI-ЛПНП клетками, как это описано в примере 2. На фиг. 7 показано ингибирование индуцированного PCSK9 снижения количества РЛПНП на поверхности клеток линии HepG2 с помощью PCSK9 аднектина, экспрессируемого клонами 1459D05,1784F03, 2012 А 04 и 2011 Н 05 (панель А) и 2011 Н 05, 2012 А 04 и 2013 Е 01 (панель В), как это описано в примере 2. Показатель ЕС 50 (нМ) для клонов 1784F03, 2012 А 04, 2011 Н 05 и 2013 Е 01 составляет 15.98,7.78, 8.85 и 12.41 соответственно. Процентный уровень ингибирования PCSK9 при концентрации 75 нМPCSK9 аднектина клонов 1459D05, 1784F03, 2012 А 04, 2011 Н 05 и 2013 Е 01 составляет 66.8, 150.2, 190.1,177.4 и 152.2 соответственно. На фиг. 8 демонстрируется эффект введения PCSK9 аднектина ATI000959 (100 мг/кг) на уровень холестерина в плазме (панель А) и на уровень несвязанного hPCSK9 в плазме (панель В) мышам трансгенной линии, экспрессирующим на высоком уровне hPCSK9, как это описано в примере 3. ВариантATI000959 содержит разветвленный ПЭГ (NOF) массой 40 кДа. На фиг. 9 демонстрируется эффект введения PCSK9 аднектина ATI001114 (10 или 60 мг/кг) на уровень холестерина в плазме (панель А) и на уровень несвязанного hPCSK9 в плазме (панель В) мышам трансгенной линии, экспрессирующим на высоком уровне hPCSK9, как это описано в примере 3. На фиг. 10 демонстрируется эффект введения PCSK9 аднектинов ATI000959 (панель А) илиATI001114 (панель В), введенных в количестве 5 мг/кг внутрибрюшинно (i.p.), в однократной дозе, на уровень свободного hPCSK9 в сыворотке мышей трансгенной линии с нормальным уровнем экспрессииhPCSK9 (среднее значениеSD), как это описано в примере 3. На фиг. 11 показана дозозависимость эффекта PCSK9 аднектина ATI001114 на уровень свободногоhPCSK9 y мышей трансгенной по hPCSK9 линии с нормальным уровнем экспрессии, как это описано в примере 3. На фиг. 12 показан эффект однократного введения PCSK9 аднектина ATI001114 (5 мг/кг i.v.) на снижение количества ЛПНП-С у яванских макак (среднее +/- SEM, n=3), как это описано в примере 3. Фиг. 13 - определение аффинности и стехиометрических показателей связывания PCSK9 аднектина с hPCSK9, определенные с помощью ITC. PCSK9 аднектины связываются с hPCSK9 в соотношении 1:1. В левой части фигуры приведены данные для PCSK9 аднектина ATI001081, в правой части для PCSK9 аднектина ATI001174. Фиг. 14 - ингибирование сигнала PCSK9:EGFA (левая панель) и PCSK9:ATI-972 (правая панель)PCSK9 аднектинами при анализе с помощью FRET. Фиг. 15 - ингибирование индуцированного PCSK9 снижения количества РЛПНП на поверхности клеток линии HepG2 под влиянием анти-PCSK9 аднектинов. Фиг. 16 - ингибирование проникновения PCSK9-AF647 в клетки линии HepG2. Фиг. 17 - уровень свободного hPCSK9 в плазме у трансгенных мышей при введении PRD460 (вводимого i.p.). Фиг. 18 - эффект введения PRD460 (15 мг/кг i.v.) на уровень ЛПНП-С и свободного PCSK9 у яванских макак (среднее +/- SEM, n=3). Фиг. 19 - эффект ATI-1081 (также обозначенного ATI001081) на уровень свободного PCSK9 у яванских макак. Фиг. 20 - эффект ATI-1081 на уровень ЛПНП-С у яванских макак. Фиг. 21 - эффект ATI-1081 в PBS при введении трансгенным мышам. На данной фигуре приведены данные об уровне свободного PCSK9 в плазме у трансгенных мышей. Фиг. 22 - эффект подкожного введения ATI-1081 в полиэтиленгликоле трансгенным мышам. На данной фигуре приведены данные об уровне свободного hPCSK9 y трансгенных мышей. Фиг. 23 - время полужизни HSA у мышей (in vivo). HSA вводился бестимусным мышам в дозах 20 мг/кг (левая панель) и 50 мг/кг (правая панель). Фиг. 24 - определение времени полужизни SABA1.1 (панель A), SABA2.1 (панель В), SABA3.1 (панель С) и SABA4.1 (панель D) при введении мышам. Фиг. 25 - график, демонстрирующий увеличение времени полужизни SABA1-4 при одновременном введении с HSA мышам. Фиг. 26 - определение времени полужизни в плазме SABA1.1 (панель А) и SABA5.1 (панель В) у яванского макака. Фиг. 27 - анализ связывания SABA1.2 с альбуминами человека, мыши и крысы с помощью прямого ИФА. Определение стехиометрических показателей связывания SABA1.1 и HSA. Стехиометрия данного связывания 1:1. Фиг. 29 - анализ связывания SABA 1.2 с фрагментами рекомбинантного домена HSA с помощью системы BIACORE. Фиг. 30 - профиль фармакокинетики SABA1.2 у яванских макак при введении в дозировках 1 мг/кг и 10 мг/кг. Фиг. 31 - профиль фармакокинетики SABA1.2 у обезьян при введении внутривенно или подкожно в дозировке 1 мг/кг. Подобное описание изобретения Определения. Под термином "полипептид" подразумевается любая последовательность из двух или более аминокислот, независимо от длины, посттрансляционных модификаций или функции. Термины "полипептид","пептид" и "белок" используются в данном документе равноправно. Полипептиды могут включать как природные, так и неприродные аминокислоты, такие как описанные в заявке US Patent No. 6559126 и включенные в данное изобретение посредством ссылки. Полипептиды также могут быть модифицированы с помощью любого из разнообразных стандартных химических способов (например, аминокислота может быть модифицирована с помощью защитной группы, С-концевой карбоксил может быть трансформирован в амидную группу, N-концевой аминокислотный остаток может быть модифицирован с помощью различных групп для повышения липофильности, также полипептид может быть химически гликозилирован или модифицирован другим способом для повышения стабильности и времени полужизниin vivo). Модификации полипептидов могут включать присоединение других структур, например циклических соединений или других молекул к полипептиду. Также полипептиды могут содержать один или более аминокислотных остатков с измененной конфигурацией (например, R, или S, или L, или D). Пептиды, описанные в настоящем изобретении, представляют собой модифицированные производные десятого домена III типа фибронектина, измененные таким образом, чтобы специфически связывать PCSK9. Данные пептиды здесь обозначены следующими названиями: "анти-PCSK9 аднектин" или "PCSK9 аднектин". Термин "PK" является акронимом термина "фармакокинетический" и обозначает различные свойства химического вещества, включая, например, абсорбцию, распределение, обмен и выведение субъектом. Термины "PK модулирующий белок" или "PK-группа" обозначают любой белок, пептид или агент, которые влияют на фармакокинетические свойства биологически активной молекулы, когда они слиты вместе или вводятся в организм совместно с биологически активной молекулой. Примерами PK модулирующих белков или PK-групп являются ПЭГ, вещества, связывающие сывороточный альбумин человекаPublication No. WO 2009/083804 и WO 2009/133208, и молекулы SABA, как описано в данном изобретении), сывороточный альбумин человека, Fc-фрагмент или его части и варианты, и сахара (например, сиаловые кислоты)."Процент (%) идентичности аминокислотной последовательности" в данном изобретении определяется как процент аминокислотных остатков кандидатной последовательности, которые идентичны аминокислотным остаткам выбранной последовательности, после выравнивания последовательностей и введения, при необходимости, пробелов, для достижения максимального процента идентичности последовательности, и рассмотрения любых консервативных замен как отличающейся части сравниваемых последовательностей. Выравнивание для определения процента идентичности аминокислотной последовательности может быть построено различными способами, известными специалистам в соответствующей области, например, с помощью общедоступных компьютерных программ, таких как BLAST, BLAST-2,ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в соответствующей области могут определить подходящие параметры для оценки выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Термин "выделенный" применяется для полипептида, который был идентифицирован и выделен из состава его природного окружения. Загрязняющие компоненты природного окружения пептида представляют собой вещества, которые могут мешать диагностическим или терапевтическим применениям данного полипептида и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах исполнения полипептид будет очищен: (1) до более чем 95% по весу, при определении методом Лоури, и в наиболее предпочтительных до более чем 99% по весу; (2) до степени чистоты, достаточной для выявления, по крайней мере, N-концевой или внутренней аминокислотной последовательности при использовании секвенатора с вращающимся стаканом; или (3) до гомогенности по результатам ДСН-ПААГ электрофореза в восстанавливающих или невосстанавливающих условиях с окрашиванием кумасси синим или, предпочтительно, серебром. Термин "выделенный полипептид" включает полипептид в рекомбинантных клетках in situ, так как по крайней мере один компонент естественного окружения полипептида отсутствует. Обычно, однако, выделенный полипептид получают с применением по меньшей мере одной стадии очистки. Условное обозначение "mpk", "мг/кг" или "мг на кг" используется для обозначения дозировки вещества на 1 кг веса. Все эти условные обозначений используются равноправно на протяжении всего данного документа. Термин "время полужизни" аминокислотной последовательности или соединения может быть в целом определен как время, необходимое для снижения концентрации полипептида в сыворотке на 50% invivo, например, вследствие деградации последовательности или соединения и/или выведения или изоляции последовательности или соединения с помощью естественных механизмов. Время полужизни может быть определено любым известным способом, например, путем фармакокинетического анализа. Подходящие методы известны специалисту в соответствующей области, и могут, например, обычно, включать этапы: введения приматам подходящим способом подходящих доз исследуемой аминокислотной последовательности или соединения, описываемых в настоящем изобретении; регулярный сбор образцов крови или других образцов у указанных приматов; определения уровня или концентрации введенной аминокислотной последовательности или соединения в указанных образцах крови и вычисления, на основе полученных таким образом данных, времени, достаточного для того, чтобы уровень или концентрация аминокислотной последовательности или соединения, описываемых в данном изобретении, была снижена на 50% по сравнению с исходным уровнем при введении. Для примера см. стандартные руководства,например Kenneth, A. et al., Chemical Stability of Pharmaceuticals: A Handbook for Pharmacists и Peters etRev. Edition, Marcel Dekker (1982). Время полужизни может быть выражено с использованием таких показателей, как t1/2-alpha, t1/2-beta,HLLambdaz и площадь под кривой (AUC). В настоящем описании "увеличением времени полужизни" обозначается повышение любого из указанных показателей, любых двух из этих параметров, любых трех из этих параметров или всех четырех параметров. "Увеличение времени полужизни", в частности, обозначает повышение t1/2-beta и/или HLLambdaz, либо совместно, либо нет, с повышением t1/2-alpha и/илиAUC. Обзор. Данное изобретение описывает аднектины против PCSK9 человека. Для определения специфических антагонистов для PCSK9, молекулы PCSK9 были презентированы для большой синтетической библиотеки аднектинов. Связавшиеся с PCSK9 аднектины были охарактеризованы по связыванию с PCSK9,биофизическим свойствам и ингибиторной активности по отношению к PCSK9. Отобранные пулы аднектинов были подвергнуты мутагенезу и последующим раундам отбора при снижении концентрации связываемого агента и выделения аднектинов с низкой константой диссоциации. После осуществления описанного процесса оптимизации была отобрана группа аднектинов, специфически ингибирующихPCSK9, с желаемыми биохимическими и биофизическими свойствами. Структуры на основе фибронектина. Одним из объектов данного изобретения являются полипептиды, содержащие домен Fn3, в котором последовательности одной или нескольких петель, доступных для растворителя, подвергнуты случайному или направленному мутагенезу. В некоторых вариантах исполнения домен Fn3 представляет собойFn3 домен, полученный из последовательности дикого типа десятого домена III типа фибронектина человека (10Fn3): В указанной последовательности 10Fn3 подчеркнуты петли ВС, DE и FG. Как описано в данном изобретении, последовательности 10Fn3, не связывающие лиганды, т.е. являющиеся "структурными участками 10Fn3", могут быть изменены в такой степени, чтобы домен 10Fn3 сохранял функции связывания лигандов и/или структурную стабильность. Описано большое количество различных мутантных вариантов структурных участков 10Fn3. В одном из объектов данного изобретения один или более аминокислотных остатков из Asp 7, Glu 9 и Asp 23 заменены на другие аминокислотные остатки, например на неотрицательно заряженные (например, Asn, Lys и др.). Было показано, что такие-7 022983 замены повышают стабильность 10Fn3 при нейтральных значениях рН, по сравнению с доменом 10Fn3 дикого типа (см. РСТ Publication No. WO 02/04523). Описано большое количество дополнительных изменений структурных участков домена 10Fn3, которые либо оказывают полезный, либо нейтральный эффект. См., например, Batori et al., Protein Eng., 15(12):1015-1020 (Dec. 2002); Koide et al., Biochemistry,40(34): 10326-10333 (Aug. 28, 2001). И мутантный, и дикий тип домена 10Fn3 обладают сходной структурой, описываемой как 7 бетаучастков, обозначаемых буквами от А до G, и 6 петлевых областей (петли АВ, ВС, CD, DE и FG), соединяющих упомянутые бета-участки. Бета-участки, расположенные наиболее близко к N и С-концам молекулы могут принимать бета-подобную конформацию в растворе. В последовательности SEQ ID NO: 1 петле АВ соответствуют остатки 15-16, петле ВС соответствуют остатки 21-30. петле CD соответствуют остатки 39-45, петле DE соответствуют остатки 51-56, петле EF соответствуют остатки 60-66, петле FG соответствуют остатки 76-87 (Xu et al., ChemistryBiology, 9:933-942 (2002. В некоторых вариантах исполнения последовательность полипептида 10Fn3 может быть по меньшей мере на 40, 50, 60, 65, 70, 75, 80, 85 или 90% идентична последовательности домена 10Fn3 человека, указанной в последовательности SEQ ID NO: 1. Большая часть вариабельности будет, как правило, приходиться на одну или несколько петель. Последовательности каждого из бета и бета-подобных участков полипептида 10Fn3 могут почти полностью состоять из аминокислотной последовательности, которая по меньшей мере на 80, 85, 90, 95 или 100% идентична последовательностям соответствующих бета или бета-подобных участков последовательности SEQ ID NO: 1, таким образом, что отличия не нарушают стабильность полипептида при физиологических условиях. В некоторых вариантах исполнения, данное изобретение включает полипептиды, содержащие десятый домен III типа фибронектина (10Fn3), в котором указанный домен 10Fn3 содержит петлю АВ, петлю ВС, петлю CD, петлю DE, петлю EF и петлю FG, при этом последовательность по крайней мере одной из петель ВС, DE, и FG изменена, относительно последовательности соответствующей петли домена 10Fn3 человека. В некоторых вариантах исполнения изменены последовательности петель ВС и FG, в некоторых вариантах исполнения изменены последовательности петель ВС, DE и FG, т.е. домен Fn3 содержит петли, структура которых отличается от таковых у природного домена. В некоторых вариантах исполнения, изменены последовательности петель АВ, CD и/или EF. Под "изменением" понимается наличие одного или более отличий между данной аминокислотной последовательностью и референсной (соответствующий домен фибронектина человека). Изменение включает в себя вставки, делеции и замены аминокислотных остатков. Изменение аминокислотной последовательности может быть достигнуто через введение направленных, ненаправленных или спонтанных изменений последовательности, как правило, на уровне кодирующей последовательности, и может осуществляться любым способом, например, ПЦР,"ошибочной" ПЦР или химическим синтезом ДНК. В некоторых вариантах исполнения длина одной или более петель из группы ВС, DE и FG, может отличаться от последовательности соответствующей петли фибронектина человека в большую и меньшую сторону. В некоторых вариантах исполнения длина петли может быть увеличена на 2-25 аминокислотных остатков. В некоторых вариантах исполнения длина петли может быть уменьшена на 1-11 аминокислотных остатков. Таким образом, для оптимизации связывания антигена, длина какой-либо петли домена 10Fn3 может быть изменена по длине, а также по аминокислотной последовательности, для достижения наилучшей возможной гибкости и аффинности при связывании антигена. В некоторых вариантах исполнения полипептид содержит домен Fn3, содержащий аминокислотную последовательность, по меньшей мере на 80, 85, 90, 95, 98, 99 или 100% идентичную не петлевым участкам последовательности SEQ ID NO: 1, в которой по крайней мере одна петля из группы ВС, DE и FG является измененной. В некоторых вариантах исполнения измененная последовательность петли ВС содержит до 10 аминокислотных замен, до 4 делеций и до 10 инсерций аминокислотных остатков, или комбинации данных изменений. В некоторых вариантах исполнения измененная последовательность петли DE содержит до 6 аминокислотных замен, до 4 делеций и до 13 инсерций аминокислотных остатков, или комбинации данных изменений. В некоторых вариантах исполнения измененная последовательность петли FG содержит до 12 аминокислотных замен, до 11 делеций и до 25 инсерций аминокислотных остатков, или комбинации данных изменений. Как описано выше, аминокислотные остатки, соответствующие остаткам в позициях 21-30, 51-56 и 76-87 последовательности SEQ ID NO: 1, соответствуют петлям ВС, DE и FG соответственно. Однако следует понимать, что не каждый аминокислотный остаток в области петли должен быть изменен для того, чтобы получить высокую аффинность 10Fn3 к выбранной мишени (например, к PCSK9). Например, нет необходимости изменять остатки 21 (S) и 22 (W) петли ВС, как указано в последовательности SEQ ID NO: 1, для связывания с PCSK9. Т.е. домены 10Fn3 с высокой аффинностью связывания PCSK9 могут быть получены при изменении остатков только в позициях 23-30 петли ВС, как она показана в последовательности SEQ ID NO: 1. Это наглядно показано на примерах последовательностей петли ВС, приведенных в табл. 3, где показано, что изменены только аминокислотные остатки в затемненных позициях приведенных последовательностей. Таким образом, в некоторых вариантах исполнения, петля ВС, в соответствии с данным обозначением, содержит затемненную часть любой из последо-8 022983 вательностей SEQ ID NO: 2-17, 106-135 и 301-303, как это отражено в табл. 3. Например, в одном из вариантов исполнения петля ВС может содержать последовательность PPPSHGYG (остатки 3-10 последовательности SEQ ID NO: 2), DAPAHAYG (остатки 3-10 последовательности SEQ ID NO: 5), EPFSRLPGGGE (остатки 3-13 последовательности SEQ ID NO: 106) или DAPADGGYG (остатки 3-11 последовательности SEQ ID NO: 107). Сходным образом, нет необходимости изменять аминокислотные остатки в позициях 51 (Р) и 56 (Т) петли DE последовательности SEQ ID NO: 1 для связывания с PCSK9. Т.е. домены 10Fn3 с высокой аффинностью связывания PCSK9 могут быть получены при изменении остатков только в позициях 52-55 петли DE, как она показана в последовательности SEQ ID NO: 1. Это наглядно показано на примерах последовательностей петли DE, приведенных в табл. 3, где показано, что изменены только аминокислотные остатки в затемненных позициях приведенных последовательностей. Таким образом, в некоторых вариантах исполнения, петля DE, в соответствии с данным обозначением, содержит затемненную часть любой из последовательностей SEQ ID NO: 18-27 и 136-141, как это отражено в табл. 3. Например, в одном из вариантов исполнения, петля DE может содержать последовательность PGKG (остатки 2-5 последовательности SEQ ID NO: 18), VGVG (остатки 2-5 последовательности SEQ ID NO: 27) или VSKS (остатки 2-5 последовательности SEQ ID NO: 137). Сходным образом, нет необходимости изменять аминокислотные остатки в позиции 87 (Р) петлиFG последовательности SEQ ID NO: 1 для связывания с PCSK9. Т.е. домены 10Fn3 с высокой аффинностью связывания PCSK9 могут быть получены при изменении остатков только в позициях 76-86 петлиFG, как она показана в последовательности SEQ ID NO: 1. Это наглядно показано на примерах последовательностей петли FG, приведенных в табл. 3, где показано, что изменены только аминокислотные остатки в затемненных позициях приведенных последовательностей. Таким образом, в некоторых вариантах исполнения петля FG, в соответствии с данным обозначением, содержит затемненную часть любой из последовательностей SEQ ID NO: 28-38 и 142-172, как это отражено в табл. 3. Например, в одном из вариантов исполнения петля FG может содержать последовательность EYPYKHSGYYHR (остатки 1-12 последовательности SEQ ID NO: 28), EYPYDYSGYYHR (остатки 1-12 последовательности SEQ ID NO: 142) или EFDFVGAGYYHR (остатки 1-12 последовательности SEQ ID NO: 167). В некоторых вариантах исполнения настоящее изобретение демонстрирует, что петли ВС, DE и FG могут быть в общем виде описаны соответствующими консенсусными последовательностями. Например,петля ВС может быть в общем виде описана с помощью консенсусной последовательности SW(X1)ZX2G(SEQ ID NO: 323), в которой X1 представляет собой любую аминокислоту, Z является числом от 6 до 9,Х 2 представляет собой Y или Н. Данная консенсусная последовательность представлена в виде примеров последовательностями петель ВС в табл. 3, за исключением петли ВС, определяемой последовательностью SEQ ID NO: 106. В других вариантах исполнения Z является числом от 2 до 5. В определенных вариантах исполнения Х 2 является остатком любой ароматической аминокислоты (т.е. Y, F, W или Н). В другом варианте исполнения петля DE может в общем виде быть выражена с помощью консенсусной последовательности PX1X1X3T (SEQ ID NO: 324), в которой X1 представляет собой любую аминокислоту, Х 3 представляет собой G или S. Данная консенсусная последовательность представлена в виде примеров последовательностями петель DE в табл. 3. В другом варианте исполнения петля FG может быть в общем виде выражена с помощью консенсусной последовательности EX4X1X5X1X1X6GYX4HRP (SEQ ID NO: 325), в которой X1 представляет собой любую аминокислоту, Х 4 представляет собой Y или F, Х 5 представляет собой Y, F или W, Х 6 представляет собой S или А. В определенных вариантах исполнения X4 и X5 являются остатками ароматических аминокислот, каждый из которых, независимо, может быть Y, F, W или Н. Данная консенсусная последовательность представлена в виде примеров последовательностями петель FG в табл. 3. Соответственно, в определенных вариантах исполнения настоящее изобретение описывает связывающий PCSK9 аднектин, содержащий петлю ВС с последовательностью SW(X1)ZX2G (SEQ ID NO: 323), петлю DE с последовательностью РХ 1 Х 1 Х 1 Х 3 Т (SEQ ID NO: 324) и петлю FG с последовательностью EX4X1X5X1X1X6GYX4HRP (SEQ ID NO: 325), в соответствии с приведенным выше описанием. В других вариантах исполнения настоящее изобретение описывает связывающий PCSK9 аднектин,содержащий петлю ВС с последовательностью SWEPFSRLPGGGE (SEQ ID NO: 106), петлю DE с последовательностью PX1X1X1X3T (SEQ ID NO: 324) и петлю FG с последовательностьюEX4X1X5X1X1X6GYX4HRP (SEQ ID NO: 325), в соответствии с приведенным выше описанием. В определенных вариантах исполнения последовательность петли ВС может быть в общем виде выражена с помощью консенсусной последовательности (X1)ZX2C (SEQ ID NO: 449), в которой X1 представляет собой любую аминокислоту, Z является любым числом от 6 до 9, Х 2 представляет собой Y или Н. Данная консенсусная последовательность представлена в виде примеров последовательностями петель ВС в табл. 3, за исключением петли ВС, определяемой последовательностью SEQ ID NO: 106. В других вариантах исполнения Z является любым числом от 2 до 5. В определенных вариантах исполнения Z является любым числом от 10 до 15. В некоторых вариантах исполнения Х 2 является остатком любой ароматической аминокислоты (т.е. Y, F, W или Н). В определенных вариантах исполнения петля DE может в общем виде быть выражена с помощью консенсусной последовательности Х 1 Х 1 Х 1 Х 3 (SEQ ID NO: 450), в которой X1 представляет собой любую аминокислоту, Х 3 представляет собой G или S. Данная консенсусная последовательность представлена в виде примеров последовательностями петель DE в табл. 3. В определенных вариантах исполнения петля FG может в общем виде быть выражена с помощью консенсусной последовательности EX4X1X5X1X1X6GYX4HR (SEQ ID NO: 451), в которой X1 представляет собой любую аминокислоту, Х 4 представляет собой Y или F, X5 представляет собой Y, F или W, Х 6 представляет собой S или А. В определенных вариантах исполнения X4 и Х 5 являются остатками ароматических аминокислот, каждый из которых, независимо, может быть Y, F, W или Н. Данная консенсусная последовательность представлена в виде примеров последовательностями петель FG в табл. 3. Соответственно, в одном варианте исполнения настоящее изобретение описывает связывающийPCSK9 аднектин, содержащий петлю ВС с последовательностью (X1)ZX2G (SEQ ID NO: 449), петлю DE с последовательностью Х 1 Х 1 Х 1 Х 3 (SEQ ID NO: 450) и петлю FG с последовательностьюEX4X1X5X1X1X6GYX4HR (SEQ ID NO: 451), в соответствии с приведенным выше описанием. В определенных вариантах исполнения иммуноглобулин-подобные белки, основанные на структурной части 10Fn3, могут быть определены в общем виде следующей последовательностью: В последовательности SEQ ID NO: 328 петля АВ представлена Xa, петля CD представлена Xb, петляEF представлена Хс, петля ВС представлена Хх, петля DE представлена Ху, петля FG представлена Xz. X обозначает любую аминокислоту, индекс X обозначает целое число аминокислотных остатков. В частности, а в любом месте может составлять 1-15, 2-15, 1-10, 2-10, 1-8, 2-8, 1-5, 2-5, 1-4, 2-4, 1-3, 2-3 или 1-2 аминокислотных остатка; b, с, х, у и z, каждый независимо, в любом месте, могут составлять 2-20, 2-15,2-10, 2-8, 5-20, 5-15, 5-10, 5-8, 6-20, 6-15, 6-10, 6-8, 2-7, 5-7 или 6-7 аминокислотных остатков. В предпочтительных вариантах исполнения а составляет 2 аминокислотных остатка, b составляет 7 аминокислотных остатков, с составляет 7 аминокислотных остатков, х составляет 9 аминокислотных остатков, у составляет 6 аминокислотных остатков, z составляет 12 аминокислотных остатков. Последовательности данных бета участков могут иметь в любом месте от 0 до 10, от 0 до 8, от 0 до 6, от 0 до 5, от 0 до 4, от 0 до 3, от 0 до 2, от 0 до 1 аминокислотной замены, делеции или вставки на протяжении всех 7 структурных областей относительно соответствующих аминокислотных остатков, указанных в последовательности SEQ ID NO: 1. В определенных вариантах исполнения, аминокислотные остатки, составляющие коровую часть, фиксированы и любые замены, консервативные замены, делеции или вставки производятся с любыми другими аминокислотными остатками. В примерах осуществления петли ВС, DE и FG, представленные последовательностями (Х)х, (Х)y и(Х)z соответственно, заменены полипептидами, содержащими последовательности петель ВС, DE и FG любых вариантов белков, связывающих PCSK9, представленных в табл. 3, или затемненные области этих вариантов, или консенсусные последовательности 323-325 или 449-451. В определенных вариантах исполнения иммуноглобулин-подобные белки на основе структуры 10Fn3 могут быть в общем виде определены следующей последовательностью: В последовательности SEQ ID NO: 329 петля ВС представлена Хх, петля DE представлена Xy, петляFG представлена Xz. X обозначает любую аминокислоту, индекс X обозначает целое число аминокислотных остатков. В частности, х, у и z, каждый независимо, в любом месте, может составлять 2-20, 2-15, 210, 2-8, 5-20, 5-15, 5-10, 5-8, 6-20, 6-15, 6-10, 6-8, 2-7, 5-7 или 6-7 аминокислотных остатков. В предпочтительных вариантах исполнения х составляет 9 аминокислотных остатков, у составляет 6 аминокислотных остатков, z составляет 12 аминокислотных остатков. Последовательности данных бета участков могут иметь в любом месте от 0 до 10, от 0 до 8, от 0 до 6, от 0 до 5, от 0 до 4, от 0 до 3, от 0 до 2, от 0 до 1 аминокислотной замены, делеции или вставки на протяжении всех 7 структурных областей относительно соответствующих аминокислотных остатков, указанных в последовательности SEQ ID NO: 1. В примерах осуществления изобретения последовательности данных бета участков могут иметь в любом месте от 0 до 10, от 0 до 8, от 0 до 6, от 0 до 5, от 0 до 4, от 0 до 3, от 0 до 2, от 0 до 1 консервативной аминокислотной замены на протяжении всех 7 структурных областей относительно соответствующих аминокислотных остатков, указанных в последовательности SEQ ID NO: 1. В определенных вариантах исполнения коровью аминокислотные остатки фиксированы и любые замены, консервативные замены, делеции или вставки производятся с любыми другими аминокислотными остатками. В примерах осуществления петли ВС, DE и FG, представленные последовательностями (Х)х, (Х)у и (Х)z, соответственно, заменены полипептидами, содержащими последовательности петель ВС, DE и FG любых вариантов белков,связывающих PCSK9, представленных в табл. 3, или затемненные области этих вариантов, или консенсусные последовательности 323-325 или 449-451. В определенных вариантах исполнения, анти-PCSK9 аднектин, описанный в данном изобретении,- 10022983 может содержать последовательность как указано в SEQ ID NO: 328 или 329, в которой петли ВС, DE иFG, представленные последовательностями (Х)х, (Х)y и (X)z соответственно, заменены соответствующим набором определенных последовательностей петель ВС, DE и FG от любого из клонов в табл. 3, или последовательности, по меньшей мере на 75, 80, 85, 90, 95, 97, 98 или 99% идентичные последовательностям петель ВС, DE и FG клонов, приведенных в табл. 3. В примерах осуществления изобретения антиPCSK9 аднектин, описанный в данном изобретении, определяется последовательностью SEQ ID NO: 329 и содержит соответствующий набор последовательностей петель ВС, DE и FG из любого из клонов, приведенных в табл. 3. Например, клон 1459D05 в табл. 3 содержит такие же последовательности петель ВС,DE и FG, как в последовательностях SEQ ED NO: 2, 18 и 28 соответственно. Таким образом, анти-PCSK9 аднектин на основе данных петель может содержать последовательность SEQ ID NO: 328 или 329, в которой (Х)х содержит последовательность SEQ ID NO: 2, (Х)у содержит последовательность SEQ ID NO: 18 и (X)z содержит последовательность SEQ ID NO: 28. Схожие конструкции могут быть реализованы с использованием набора петель ВС, DE и FG других клонов, указанных в табл. 3, или консенсусных последовательностей 323-325 или 449-451. Структурные части таких вариантов анти-PCSK9 аднектина могут содержать в любой части от 0 до 20, от 0 до 15, от 0 до 10, от 0 до 8, от 0 до 6, от 0 до 5, от 0 до 4, от 0 до 3, от 0 до 2, от 0 до 1 аминокислотной замены, консервативной аминокислотной замены, делеции или вставки относительно аминокислотных остатков структурной части, указанных в последовательностиSEQ ID NO: 1. Такие структурны модификации могут осуществляться до тех пор, пока анти-PCSK9 аднектин способен связывать PCSK9 с желаемой KD. В некоторых вариантах исполнения петля ВС белка, описываемого в данном изобретении, содержит аминокислотную последовательность, выбранную из следующей группы: В последующих вариантах исполнения петля ВС белка, описываемого в данном изобретении, содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 106-135 и 301-303. В других вариантах исполнения петля ВС белка, описываемого в изобретении, содержит затемненную часть любой из последовательностей SEQ ID NO: 2-17, 106-135 и 301-303, как показано в табл. 3. Например, в одном из вариантов исполнения петля ВС содержит последовательность PPPSHGYG (остатки 3-10 последовательности SEQ ID NO: 2), DAPAHAYG (остатки 3-10 последовательности SEQ ID NO: 5), EPFSRLPGGGE (остатки 3-13 последовательности SEQ ID NO: 106) или DAPADGGYG (остатки 3-11 последовательности SEQ ID NO: 107). В некоторых вариантах исполнения петля DE белка, описываемого в настоящем изобретении, содержит аминокислотную последовательность, выбранную из следующей группы: В последующих вариантах исполнения петля DE белка, описываемого в настоящем изобретении,содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 136141. В других вариантах исполнения петля DE белка, описываемого в настоящем изобретении, содержит затемненную часть любой из последовательностей SEQ ID NO: 18-27 и 136-141, как показано в табл. 3. Например, в одном из вариантов исполнения петля DE содержит последовательность PGKG (остатки 2-5 последовательности SEQ ID NO: 18), VGVG (остатки 2-5 последовательности SEQ ID NO: 27) или VSKS(остатки 2-5 последовательности SEQ ID NO: 137). В некоторых вариантах исполнения петля FG белка, описываемого в настоящем изобретении, содержит аминокислотную последовательность, выбранную из следующей группы: В последующих вариантах исполнения петля FG белка, описываемого в настоящем изобретении,содержит аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: 142172. В других вариантах исполнения петля FG белка, описываемого в настоящем изобретении, содержит затемненную часть любой из последовательностей SEQ ID NO: 28-38 и 142-172, как показано в табл. 3. Например, в одном из вариантов исполнения петля FG содержит последовательность EYPYKHSGYYHRSEQ ID NO: 142) или EFDFVGAGYYHR (остатки 1-12 последовательности SEQ ID NO: 167). В некоторых вариантах исполнения белок, описываемый в настоящем изобретении, содержит одну последовательность петли ВС, выбранную из группы последовательностей ВС, включающих последовательности SEQ ID NO: 2-17, 106-135 и 301-303, или затемненную часть любой одной из последовательностей SEQ ID NO: 2-17, 106-135 и 301-303, как показано в табл. 3; одну последовательность петли DE,выбранную из группы последовательностей петель DE, включающих последовательности SEQ ID NO: 18-27 и 136-141, или затемненную часть любой одной из последовательностей SEQ ID NO: 18-27 и 136141 как показано в табл. 3; и одну последовательность петли FG, выбранную из группы последовательностей FG, включающих последовательности SEQ ID NO: 28-38 и 142-172, или затемненную часть любой одной из последовательностей SEQ ID NO: 28-38 и 142-172, как показано в табл. 3. В некоторых вариантах исполнения белок, описываемый в настоящем изобретении, содержит аминокислотные последовательности петель ВС, DE и FG, по меньшей мере на 70, 75, 80, 85, 90, 95, 98, 99 или 100% идентичные любой одной из последовательностей SEQ ID NO: 2-38, 106-172, 301-303. В других вариантах исполнения белок, описываемый в настоящем изобретении, содержит аминокислотные последовательности петель ВС, DE и FG, по меньшей мере на 70, 75, 80, 85, 90, 95, 98, 99 или 100% идентичные затемненной части любой из последовательностей SEQ ID NO: 2-38, 106-172, 301-303, как показано в табл. 3. В некоторых вариантах исполнения аминокислотная последовательность анти-PSCK9 аднектина содержит любую из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309. В некоторых вариантах исполнения анти-PSCK9 аднектин содержит фрагмент аминокислотной последовательности домена Fn3 с 3 по 96 позиции любой из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309. В некоторых вариантах исполнения анти-PSCK9 аднектин содержит аминокислотную последовательность, по меньшей мере на 70, 75, 80, 85, 90, 95, 98, 99 или 100% идентичную любой из последовательностей SEQ ID NO: 39-76, 173-290 и 304-309. Фибронектин связывается с интегринами различных типов за счет интегринсвязывающего мотива аргинин-глицин-аспарагиновая кислота (RGD). В некоторых вариантах исполнения белок, описываемый в данном изобретении, содержит домен 10Fn3 без интегринсвязывающего (RGD) мотива. Интегринсвязывающий мотив может быть удален путем видоизменения последовательности RGD за счет аминокислотных замен, делеций или инсерций. В определенных вариантах исполнения молекулы анти-PSCK9 аднектина, описываемые в настоящем изобретении, могут быть модифицированы за счет удлинения N- или С-концевых частей. Например,последовательность MG может быть добавлена на N-конец последовательности домена 10Fn3, определяемой последовательностью SEQ ID NO: 1. Добавочная аминокислота M обычно отщепляется, оставляя на N-конце белка аминокислотный остаток G. В другом случае первые 10 аминокислотных остатков последовательности анти-PSCK9 аднектина, приведенной в табл. 4, могут быть заменены другой Nконцевой последовательностью, называемой в данном документе N-концевым удлинением, как показано в табл. 6 (например, SEQ ID NO: 371-379). Кроме того, M, G или MG могут быть помещены на N-конец любого N-концевого удлинения, SEQ ID NO: 371-379. Анти-PSCK9 аднектины, описанные в данном изобретении, могут также содержать различные С-концевые последовательности, называемые в данном документе С-концевыми удлинениями. Например, последовательность анти-PSCK9 аднектина, показанная в табл. 4, может быть укорочена после треонина, соответствующего треонину в 94 положении последовательности SEQ ID NO: 1 (т.е. укорочена после последовательности INYRT (SEQ ID NO: 636. Такой укороченный вариант может быть использован в качестве терапевтической молекулы в укороченной форме, или может быть добавлена другая С-концевая последовательность после остатка треонина. Примеры С-концевых удлиняющих последовательностей приведены в табл. 6 как SEQ ID NO: 380-395. Примеры последовательностей анти-PSCK9 аднектина, содержащих С-концевые удлинения, приведены в табл. 4. Например, последовательность SEQ ID NO: 49 (клон 1813 Е 02) содержит естественную Сконцевую удлиняющую последовательность EIDKPSQ (SEQ ID NO: 380) с последующей последователь- 12022983 ностью His6-тэга (SEQ ID NO: 637). Однако стоит понимать, что последовательность His6-тэга полностью необязательна. В отдельных вариантах исполнения последовательности С-концевого удлинения (также называемые "хвосты"), содержат остатки Е и D и могут быть от 8 до 50, от 10 до 30, от 10 до 20, от 5 до 10 и 2 и 4 аминокислотных остатка длиной. В некоторых вариантах исполнения последовательности "хвостов" включают линкеры на основе ED, в которых последовательность состоит из тандемных повторов ED. В примерах осуществления изобретения "хвосты" содержат 2-10, 2-7, 2-5, 3-10, 3-7, 3-5, 3, 4 или 5 повторовED. В определенных вариантах исполнения "хвосты" на основе ED также могут включать дополнительные аминокислотные остатки, такие как, например, EI (SEQ ID NO: 385), EID, ES, ЕС, EGS и EGC. Эти последовательности сходны с известными последовательностями "хвостов" аднектина, такими какEIDKPSQ (SEQ ID NO: 380), в которых удалены остатки D и K. В примерах осуществления изобретения,такие ED-хвосты содержат остатки Е, I или EI (SEQ ID NO: 385) перед ED-повторами. В других вариантах исполнения N- и С-концевые последовательности могут быть комбинированы с последовательностями других известных линкеров (например, SEQ ID NO: 396-419 в табл. 6), если это необходимо при конструировании слитых вариантов анти-PSCK9 аднектина. Примеры последовательностей анти-PSCK9 аднектина, содержащих линкерные последовательности, приведены в табл. 4 (например, SEQ ID NO: 53, 55 и 57). В некоторых вариантах исполнения С-концевая последовательность может быть добавлена к последовательности домена 10Fn3 для упрощения прикрепления фармакокинетической группы. Например, цистеин-содержащая линкерная последовательность, такая как GSGC (SEQ ID NO: 77) может быть добавлена на С-конец для сайт-направленного пэгилирования данного остатка цистеина. Фармакокинетические части. Одним из объектов, описываемых данным изобретением, является анти-PCSK9 аднектин, содержащий фармакокинетическую (PK) часть. Улучшенная фармакокинетика может быть желательна в соответствии с имеющейся терапевтической необходимостью. Часто желательно повысить биодоступность и/или увеличить время между введением доз препарата, что возможно за счет увеличения периода времени, когда белок остается доступным в сыворотке крови после введения препарата. В некоторых случаях желательно поддерживать постоянную концентрацию белка в плазме (например, уменьшить различие между концентрацией белка в сыворотке вскоре после введения и незадолго до следующего введения). Анти-PCSK9 аднектин может быть присоединен к определенной группировке, которая снижает скорость выведения полипептида у млекопитающих (например, мышей, крыс или человека) более чем в три раза по сравнению с немодифицированным анти-PCSK9 аднектином. Другие показатели улучшения фармакокинетики включают в себя время полужизни в плазме, которое часто делится на альфа- и бета-фазу. Показатели каждой или обеих фаз могут быть значительно улучшены путем добавления соответствующей PK-группы. Молекулы, замедляющие выведение белка из крови, в данном документе называются "PK-группы" и включают полиоксоалкиленовые группы, например полиэтиленгликоль, сахара (например, сиаловая кислота) и хорошо переносимые белковые группы (например, Fc-фрагмент и его части и их варианты,трансферрин, сывороточный альбумин). Анти-PCSK9 аднектин может быть слит с альбумином или с его фрагментом (частью) или с одним из вариантов альбумина, как описано в US Publication No. 2007/0048282. В некоторых вариантах исполнения, анти-PCSK9 аднектин может быть слит с одним или более аднектином, связывающим сывороточный альбумин, как описано в данном изобретении. В некоторых вариантах исполнения PK-группой является белок, связывающий сывороточный альбумин, например, такие белки, как описанные в US Publication No. 2007/0178082 и 2007/0269422. В некоторых вариантах исполнения PK-группой является сывороточный белок, связывающий иммуноглобулины, например, такие белки, как описанные в US Publication No. 2007/0178082. В некоторых вариантах исполнения анти-PCSK9 аднектин содержит полиэтиленгликоль (ПЭГ). С помощью реакций с аминами, тиолами или другими подходящими реакционными группами, одна или несколько молекул ПЭГ могут быть соединены с анти-PCSK9 аднектином в различных положениях. Для этого может быть использована первичная аминогруппа на N-конце белка или боковые группы аминокислотных остатков, таких как лизин или аргинин. В некоторых вариантах исполнения ПЭГ присоединен в одном из положений, выбранных из группы: а) N-конец; b) между N-концом и наиболее близко расположенным к N-концу бета или бета-подобным участком; с) на петле, расположенной на обратной по отношению к сайту связывания поверхности полипептида; d) между С-концом и наиболее близко расположенным к С-концу бета или бета-подобным участком; и е) на С-конце полипептида. Пэгилирование может осуществляться с помощью сайт-направленного пэгилирования, при котором в белок вводится подходящая реакционная группа для создания сайта, по которому преимущественно будет происходить пэгилирование. В некоторых вариантах исполнения последовательность белка модифицируется введением остатка цистеина в необходимой позиции, что обеспечивает направленное пэгилирование по данному остатку цистеина. ПЭГ различается по молекулярному весу в широких пределах и может быть разветвленным или линейным. В одном варианте исполнения ПЭГ имеет две цепи. В другом варианте исполнения ПЭГ имеет 4 цепи. В некоторых вариантах исполнения анти-PCSK9 аднектин слит с иммуноглобулиновым Fc- 13022983 фрагментом, или его частью, или вариантом фрагмента или части. В примере осуществления изобретения используется Fc-фрагмент иммуноглобулинов подкласса IgG1, однако Fc-фрагменты других подклассов иммуноглобулинов (например, IgG2, IgG3 и IgG4) также могут быть использованы. Ниже приведена последовательность Fc-фрагмента иммуноглобулина IgG1 человека, в которой относительные положения каждой области отмечены в соответствии с номенклатурой Евросоюза (EU): Коровая последовательность шарнирной области выделена подчеркиванием, СН 1 область выделена курсивом, СН 2 и СН 3 области указаны обычным шрифтом. Следует понимать, что С-концевой остаток лизина необязателен. Указанный слитый белок может быть получен путем присоединения последовательности антиPCSK9 аднектина к любому из концов последовательности Fc-домена, т.е. могут быть получены слитые белки Fc-анти-PCSK9 аднектин или анти-PCSK9 аднектин-Fc. В определенных вариантах исполнения Fcфрагмент и анти-PCSK9 аднектин соединяются при помощи линкерной последовательности. Примеры линкерных последовательностей включают В некоторых вариантах исполнения Fc-домен, входящий в состав слитого белка с анти-PCSK9 аднектином, содержит последовательность шарнирной области Fc-домена. При использовании в данном изобретении термин "шарнирная область" включает коровые аминокислотные остатки шарнирной области молекулы IgG1 в позициях 104-119 последовательности SEQ ID NO: 315 (DKTHTCPPCPAPELLG;SEQ ID NO: 316), соответствующие участку 221-236 по номенклатуре Евросоюза. В определенных вариантах исполнения слитый белок анти-PCSK9 аднектин-Fc мультимеризуется (например, образует димер),частично за счет остатков цистеина внутри шарнирной области в позициях 109 и 112 последовательностиSEQ ID NO: 315 (позиции 226 и 229 по номенклатуре Евросоюза соответственно). В других вариантах исполнения шарнирная область, как описывается в данном изобретении, может дополнительно включать аминокислотные остатки областей СН 1 и СН 2, фланкирующих коровую последовательность шарнирной области, как показано в последовательности SEQ ID NO: 315. В некоторых вариантах исполнения шарнирная последовательность может содержать замены, придающие желаемые фармакодинамические, биофизические и/или биологические свойства. Некоторые примеры последовательностей шарнирной области включают следующие:NO: 317; коровая последовательность шарнирной области подчеркнута);(SEQ ID NO: 318; коровая последовательность шарнирной области подчеркнута);(SEQ ID NO: 319; коровая последовательность шарнирной области подчеркнута);(SEQ ID NO: 320; коровая последовательность шарнир(SEQ ID NO: 321, коровая последовательность ной области подчеркнута) и шарнирной области подчеркнута). В одном варианте исполнения остаток Р в положении 122 (238 по номенклатуре Евросоюза) последовательности SEQ ID NO: 315 заменен на остаток S для нарушения эффекторной функции Fc-фрагмента. Пример данной замены приведен в любой из последовательностейSEQ ID NO: 318, 319 и 321. В другом варианте исполнения остатки DK в положении 104-105 последовательности SEQ ID NO: 315 (221-222 по номенклатуре Евросоюза) заменены на остатки GS для удаления потенциального сайта сшивки. Пример такой замены показан в последовательности SEQ ID NO: 319. В другом варианте исполнения остаток С в положении 103 последовательности SEQ ID NO: 315 (220 по номенклатуре Евросоюза) заменен на остаток S для предотвращения формирования неправильной ди- 14022983 сульфидной связи в отсутствие легкой цепи. Пример такой замены приведен в последовательностях SEQID NO: 317-319. В определенных вариантах исполнения слитый белок анти-PCSK9 аднектин-Fc может обладать следующими конфигурациями: 1) анти-PCSK9 аднектин-шарнирная область-Fc, 2) шарнирная областьFc- анти-PCSK9 аднектин. Таким образом, любой вариант анти-PCSK9 аднектина, описываемый в настоящем изобретении, может быть введен в состав слитого белка с Fc-доменом, содержащего последовательность шарнирной области, в соответствии с данными конфигурациями. В некоторых вариантах исполнения для соединения модулей анти-PCSK9 аднектин и шарнирная область-Fc может использоваться линкер. В этом случае, слитый белок может обладать, например, следующей конфигурацией: шарнирная область- анти-PCSK9 аднектин-линкер-Fc. Кроме того, в зависимости от системы наработки слитых белков, на N-конце слитого белка может располагаться лидерная сигнальная последовательность. Например,если слитый белок продуцируется в клетках млекопитающих, следующая лидерная последовательность может быть введена на N-конец слитого белка: METDTLLLWVLLLWVPGSTG (SEQ ID NO: 326). Если слитый белок продуцируется в системе E. coli, на N-конец слитого белка будет введен остаток метионина. Пример последовательности слитого белка анти-PCSK9 аднектин-шарнирная область-Fc, продуцируемого в клетках млекопитающих: В данном примере Fc-домен содержит последовательности областей CH1, CH2 и СН 3 иммуноглобулинов G1 человека: и шарнирная область последовательности SEQ ID NO: 319. В последовательности SEQ ID NO: 322 последовательность лидерного пептида выделена жирным шрифтом, последовательность анти-PCSK9 аднектина выделена курсивом, шарнирная область подчеркнута. Следует понимать, что остаток лизина на конце последовательности SEQ ID NO: 322 необязателен. Эффективность слитого полипептида, приведенного в последовательности SEQ ID NO: 322 (также описываемого в данном изобретении как PRD460) показана в примере 4. Примеры слитых белков PCSK9 аднектин-Fc приведены в табл. 1. Все последовательности могут начинаться с метионина и лидерной сигнальной последовательности клеток млекопитающих (например,SEQ ID NO: 326). Таблица 1 Примеры последовательностей слитых белков анти-PCSK9 аднектин-Fc
МПК / Метки
МПК: C12N 9/64, C07K 14/78, A61K 38/39
Метки: связывающие, фибронектина, белки, pcsk9, основе, домена, структурного
Код ссылки
<a href="https://eas.patents.su/30-22983-belki-na-osnove-strukturnogo-domena-fibronektina-svyazyvayushhie-pcsk9.html" rel="bookmark" title="База патентов Евразийского Союза">Белки на основе структурного домена фибронектина, связывающие pcsk9</a>
Предыдущий патент: Комбинация для лечения рака или предраковых синдромов
Следующий патент: Конструкты, связывающиеся с ron, и способы их использования
Случайный патент: Наполнитель для каучуков, резин и других эластомеров












