Производные (4-фенилимидазол-2-ил)этиламина в качестве модуляторов натриевых каналов
Номер патента: 23375
Опубликовано: 31.05.2016
Авторы: Кемп Марк Иан, Багал Шаранджит Каур, Миллер Дункан Чарльз, Мурата Йошихиса
Формула / Реферат
1. Соединение формулы (I)
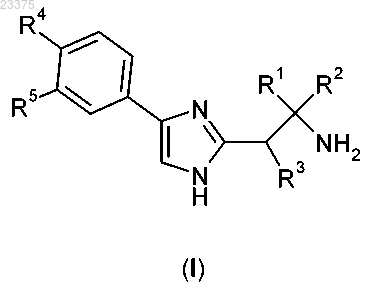
или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера, где
R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют 4-7-членное кольцо фомулы
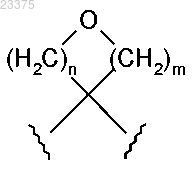
где m равен 1, 2 или 3;
n равен 1 или 2;
R3 выбирают из группы, которая содержит Н и (С1-С3)алкил;
R4 выбирают из группы, которая содержит -CF3, -OCF3, -OCHF2, Cl и -SF5;
R5 выбирают из группы, которая содержит Н и -СН3.
2. Соединение формулы (I), или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера по п.1, где m равен 1 и n равен 1.
3. Соединение формулы (I), или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера по любому из предшествующих пунктов, где R3 выбирают из группы, которая содержит Н, метил и этил.
4. Соединение формулы (I), или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера по любому из предшествующих пунктов, где R5 представляет собой Н.
5. Соединение формулы (I) по любому из предшествующих пунктов, выбираемое из следующих:
3-({4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}метил)тетрагидро-2Н-пиран-3-амин,
3-{[4-(4-хлор-3-метилфенил)-1Н-имидазол-2-ил]метил}оксетан-3-амин,
3-({4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}метил)тетрагидрофуран-3-амин,
3-({4-[4-(трифторметил)фенил]-1Н-имидазол-2-ил}метил)оксетан-3-амин,
3-({4-[4-(дифторметокси)фенил]-1Н-имидазол-2-ил}метил)оксетан-3-амин,
3-({4-[4-(пентафтор-l6-сульфанил)фенил]-1Н-имидазол-2-ил}метил)оксетан-3-амин,
4-({4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}метил)тетрагидро-2Н-пиран-4-амин,
3-({4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}метил)оксетан-3-амин,
3-(1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}этил)оксетан-3-амин,
3-[(1S)-1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}этил]оксетан-3-амин,
3-[(1R)-1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}этил]оксетан-3-амин,
3-(1-{4-[4-(трифторметил)фенил]-1Н-имидазол-2-ил}этил)оксетан-3-амин,
3-[(1S)-1-{4-[4-(трифторметил)фенил]-1Н-имидазол-2-ил}этил]оксетан-3-амин,
3-[(1R)-1-{4-[4-(трифторметил)фенил]-1Н-имидазол-2-ил}этил]оксетан-3-амин,
3-(1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}пропил)оксетан-3-амин,
3-(1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}пропил)оксетан-3-амин,
3-(1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}пропил)оксетан-3-амин,
3-((1R)-1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}пропил)оксетан-3-амин и
3-((1S)-1-{4-[4-(трифторметокси)фенил]-1Н-имидазол-2-ил}пропил)оксетан-3-амин,
или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера.
6. Соединение формулы (I), или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера по любому одному из пп.1-5 в качестве медикамента.
7. Соединение формулы (I), или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера по любому одному из пп.1-5 для лечения боли.
8. Фармацевтическая композиция, которая содержит соединение формулы (I), или его таутомер, или фармацевтически приемлемую соль упомянутого соединения или таутомера, как определено в любом одном из пп.1-5.
9. Фармацевтическая композиция по п.8, где композиция адаптирована для местного введения.
10. Фармацевтическая композиция по п.8, где композиция адаптирована для окулярного введения.
11. Фармацевтическая композиция по п.8, которая дополнительно содержит один или более дополнительных терапевтических агентов.
12. Применение соединения формулы (I), или его таутомера, или фармацевтически приемлемой соли упомянутого соединения или таутомера, как определено в любом одном из пп.1-5, для изготовления медикамента для применения при лечении боли.
13. Способ лечения расстройства, при котором показан ингибитор NaV1.8, который содержит введение субъекту, который нуждается в таком лечении, терапевтически эффективного количества соединения формулы (I), или его таутомера, или фармацевтически приемлемой соли упомянутого соединения или таутомера, как определено в любом одном из пп.1-5.
14. Способ лечения боли, который содержит введение субъекту, который нуждается в таком лечении, терапевтически эффективного количества соединения формулы (I), или его таутомера, или фармацевтически приемлемой соли упомянутого соединения или таутомера, как определено в любом одном из пп.1-5.
Текст
ПРОИЗВОДНЫЕ (4-ФЕНИЛИМИДАЗОЛ-2-ИЛ)ЭТИЛАМИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ Изобретение касается производных имидазола, их применения в медицине, содержащих их композиций, способов их получения и промежуточных соединений, которые используются в таких способах. Особенно изобретение касается новых имидазольных модуляторов NaV1.8 формулы (I) или их фармацевтически приемлемой соли, где R1, R2, R3, R4 и R5 являются такими, как определено в описании. NaV1.8 модуляторы являются перспективными при лечении широкого спектра расстройств, в частности боли. Изобретение относится к производным имидазола. Более конкретно, это изобретение относится к производным (4-фенилимидазол-2-ил)этиламина, их применения в медицине, содержащих их композиций, способов их получения и промежуточных соединений, используемых в таких способах. Предпосылки создания изобретения Производные имидазола данного изобретения являются модуляторами натриевых каналов. В частности, они являются модуляторами натриевого канала NaV1.8. Предпочтительные производные имидазола изобретения проявляют сродство в отношении NaV1.8 канала, которое выше, нежели их сродство к другим натриевым каналам, таким как NaV1.5 натриевый канал и тетродотоксин-чувствительных натриевых каналов (TTX-S). Имидазольные производные изобретения имеют ряд терапевтических применений и потенциальные терапевтические применения. В частности, они полезны при лечении боли. Потенциалзависимые натриевые каналы находят во всех легковозбудимых клетках, включая миоциты мышц и нейроны центральной и периферийной нервной системы. В нейрональных клетках, натриевые каналы являются первичными ответчиками за генерирование быстрого движения вверх потенциала действия. Таким образом, натриевые каналы являются важными для инициации и распространения электрических сигналов в нервной системе. Кроме того, правильная и соответствующая функция натриевых каналов необходима для нормального функционирования нейрона. Соответственно, аберрантная функция натриевого канала, как считают, лежит в основе различных медицинских расстройств (смотриHubner C.A., Jentsch T.J., Hum. Mol. Genet., 11(20): 2435-45 (2002) для общего ознакомления с наследственными расстройствами ионных каналов), включая эпилепсию (Yogeeswari et al., Curr. Drug Targets,5(7): 589-602 (2004, аритмию (Noble D., Proc. Natl. Acad. Sci. USA, 99(9): 5755-6 (2002, миотонию(Cannon, S.C., Kidney Int. 57(3): 772-9 (2000 и боль (Wood, J.N. et al., J. Neurobiol., 61(1): 55-71 (2004. До недавнего времени существовало по крайней мере девять известных членов семьи альфа субъединиц потенциалзависимых натриевых каналов (VGSC). Названия этой семьи включают SCNx, SCNAx иNaVx.x. VGSC семья филлогенетически делится на две субсемьи NaV1.x (за исключением SCN6A) иNaV2.x (SCN6A). NaV1.x субсемья может быть функционально разделена на две группы, одна из которых чувствительна к блокировке тетродотоксином (ТТХ-чувствительная или TTX-S) и вторая из которых стойка к блокировке тетродотоксином (ТТХ-стойкая или TTX-R).NaV1.8 канал является потенциалзависимым натриевым каналом, экспрессируемым в ноцицепторах,сенсорных нейронах, которые отвечают за передачу болевого стимула. Были клонированы канал крысы и канал человека в 1996 и 1998, соответственно (Nature 1996; 379: 257-262; Pain 1998(Nov); 78(2): 107-114).NaV1.8 канал раньше был известен как SNS (сенсорный нейрон-специфический) и PN3 (периферийный нерв типа 3). NaV1.8 канал является атипичным, поскольку, он демонстрирует резистентность к блокирующему действию токсина иглобрюхих рыб - тетродотоксина, и, как считают, лежит в основе медленных потенциалзависимых и тетродотоксинрезистентных (TTX-R) натриевых токов, зарегистрированных из дорсальных корешковых ганглиевых нейронов. Наиболее молекулярно подобным NaV1.8 каналу является Nav1.5 канал, который представляет собой сердечный натриевый канал, и с которым имеет гомологию приблизительно 60%. NaV1.8 канал экспрессируется в наибольшей степени в 'малых клетках' дорсальных корешковых ганглиев (DRG). Ими, как считается, являются С- и А-дельта клетки, которая является полимодальными ноцицепторами или болевыми рецепторами. В нормальных условиях NaV1.8 канал нигде не экспрессируется, за исключением субпопуляции DRG нейронов. Считается, что NaV1.8 каналы вносят свой вклад в процесс сенсибилизации DRG, а также в гипервозбудимость в результате нервного повреждения. Ингибирующая модуляция NaV1.8 каналов направлена на снижение возбудимости ноцицепторов, препятствуя их участию в процессе возбуждения. Исследования показали, что "нокаут" NaV1.8 приводит к фенотипу притупленной боли, преимущественно к воспалительным стимулам (A.N. Akopian et al., Nat. Neurosci. 1999; 2; 541-548) и что "нокдаун"NaV1.8 уменьшает болевые реакции, в данном случае, невропатическую боль (J. Lai et al., Pain, 2002(Jan); 95(1-2): 143-152). Coward et al. и Yiangou et al., показали, что NaV1.8 экспрессируется при состояниях боли (Pain. 2000(March); 85(1-2): 41-50 и FEBS Lett. 2000(Feb 11); 467(2-3): 249-252). Также было показано, что NaV1.8 канал экспрессируется в структурах, которые относятся к спинной и зубной пульпе, и это является доказательством его роли в каузалгии, воспалениях кишечника и рассеянном склерозе (Bucknill et al., Spine. 2002(Jan 15); 27(2):135-140: Shembalker et al., Eur J Pain. 2001; 5(3): 319-323: Laird et al., J Neurosci. 2002(Oct 1); 22(19): 8352-8356: Black et al., Neuroreport. 1999(Apr 6); 10(5): 913-918 и Proc. Natl. Acad. Sci. USA 2000: 97: 11598-11602). Примеры модуляторов NaV1.8 натриевого канала описаны в WO 2008/135826 и WO 2008/135830. Однако существует большая потребность в разработке новых ингибиторов NaV1.8 натриевого канала,которые является хорошими кандидатами в лекарственные средства. Эти кандидаты в лекарственные средства должны иметь одно или больше следующих свойств: хорошо абсорбироваться из желудочнокишечного тракта; быть метаболически стабильными; иметь хороший метаболический профиль, в частности, относительно токсичности или аллергенности любого из образованных метаболитов; или иметь предпочтительные фармакокинетические свойства и в то же время сохранить профиль активности в качестве ингибиторов NaV1.8 канала. Они должны быть нетоксичными и демонстрировать незначительные побочные эффекты. Идеальные кандидаты в лекарственные средства должны существовать в физических формах, которые являются стабильными, негигроскопичными и легко формулироваться. Краткое описание изобретения Согласно первому аспекту изобретения, обеспечивается соединение формулы (I) или его таутомер, или фармацевтически приемлемая соль упомянутого соединения или таутомера,гдеR5 выбирают из группы, которая содержит Н и -СН 3. Ниже описывается ряд воплощений (Е) этого первого аспекта изобретения, где для удобства Е 1 является идентичным ему. Е 1 Соединение формулы (I) как определенно выше, его таутомер или фармацевтически приемлемая соль упомянутого соединения или упомянутого таутомера. Такое соединение представлено формулой (Ia). Е 2 Соединение согласно Е 1, где m является 1 и n является 1. Такое соединение представлено формулой (Ib). Е 3 Соединение согласно любому из Е 1 или Е 2, где R3 выбирают из группы, которая содержит Н,метил и этил. Е 4 Соединение согласно любому из Е 1-Е 3, где R5 является Н. В следующем аспекте изобретения, обеспечивается соединение формулы (I), как описано выше, для применения в качестве медикамента. В следующем аспекте изобретения обеспечивается соединение формулы (I), как описано выше, для применения при лечении боли. В следующем аспекте изобретения обеспечивается соединение формулы (I), как описано выше, для применения при изготовлении медикамента для лечения боли. В следующем аспекте изобретения обеспечивается фармацевтическая композиция, которая содержит соединение формулы (I), как описано выше, и один или больше фармацевтически приемлемых носителей. В одном из воплощений фармацевтическая композиция адаптирована для местного введения. В другом воплощении фармацевтическая композиция адаптирована для интраокулярного введения. В следующем аспекте изобретения обеспечивается способ лечения состояния, для которого показан модулятор NaV1.8, который содержит введение субъекту терапевтически эффективного количества соединения формулы (I), как описано выше. В следующем аспекте изобретения обеспечивается способ лечения боли у субъекта, который нуждается в таком лечении, который содержит введение субъекту терапевтически эффективного количества соединения формулы (I), как описано выше. Детальное описание изобретения Алкильные группы, которые содержат необходимое количество атомов углерода, могут быть неразветвленными или разветвленными. (С 1-С 3)Алкил включает метил, этил, 1-пропил и 2-пропил. Фторалкил включает монофтор алкил, полифторалкил и перфторалкил. Примерами (С 1 С 3)фторалкила являются фторметил, дифторметил, трифторметил, 2,2,2-трифторетил, гептафтор-нпропил и 1,1,1,3,3,3-гексафтор-2-пропил. Соединения формулы (I) могут существовать как таутомерные формы. Специфически, 2,4 дизамещенный имидазол может существовать как (1 Н)-таутомер или (3 Н)-таутомер. Должно быть понятно, что 2,4-дизамещенный-(3 Н)-имидазол также может описываться как 2,5-дизамещенный-(1H)имидазол. Соединения формулы (I) могут существовать в по сути чистой (1H)-таутомерной форме, в по сути чистой (3 Н)-таутомерной форме, или как смесь таутомерных форм. Все такие таутомеры и смеси таутомеров включены в пределы рамок представленного изобретения. Ссылка здесь на определенное соединение должна пониматься как ссылка на соединение и/или его таутомер. Некоторые соединения формулы (I) включают один или больше стереогенных центров и потому могут существовать как оптические изомеры, такие как энантиомеры и диастереомеры. Все такие изомеры и их смеси включены в пределы рамок представленного изобретения. Здесь дальше все ссылки на соединения изобретения включают соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или многокомпонентные комплексы, или фармацевтически приемлемые сольваты или многокомпонентные комплексы фармацевтически приемлемых солей соединений формулы (I), как обсуждается более детально ниже. Предпочтительными соединениями изобретения являются соединения формулы (I) или их фармацевтически приемлемые соли. Пригодные кислотноаддитивные соли образуются из кислот, которые образуют нетоксичные соли. Примерами солей являются ацетат, адипат, аспартат, бензоат, бензилат, гидрокарбонат/карбонат, гидросульфат/сульфат, борат, камсилат, цитрат, цикламат, эдисилат, эсилат, формиат, фумарат, глюцептат,глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат,сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат. Также могут быть сформированы гемисоли кислот и оснований, например гемисульфатные соли. Специалист в этой отрасли должен понимать, что упомянуты выше соли включают соли, в которых противоион является оптически активным, например d-лактат или l-лизин, или рацемическим, напримерdl-тартрат или dl-аргинин. Для ознакомления с пригодными солями смотрите "Handbook of Pharmaceutical Salts: Properties, Selection, and Use", издан Stahl and Wermuth (WILEY-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемые соли соединений формулы (I) можно получить по одному или больше из трех способов:(i) реакцией соединения формулы (I) с желаемой кислотой или основанием;(ii) удалением кислото- или основолабильной защитной группы из пригодного предшественника соединения формулы (I), используя желаемую кислоту или основание; или(ш) превращением одной соли соединения формулы (I) в другую реакцией с пригодной кислотой или основанием или с помощью способов с применением пригодной ионообменной колонки. Все три реакции типично проводят в растворе. Полученную соль можно осадить и собрать фильтрованием или можно выделять упариванием растворителя. Степень ионизации полученной соли может изменяться от полностью ионизированной до почти неионизированной. Соединения изобретения (I) или их фармацевтически приемлемые соли также могут существовать в несольватированной и сольватированной форме. Термин "сольват" применен здесь для описания молекулярного комплекса, который содержит соединение формулы (I) или его фармацевтически приемлемую соль и одну или больше фармацевтически приемлемых молекул растворителя, например этанол. Термин"гидрат" применяется, когда упомянутым растворителем является вода. Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, в которых кристаллизационный растворитель может быть замещен изотопом, например, D2O, d6-ацетон и d6-DMSO. Принятая на сегодня система классификации органических гидратов является системой, которая определяет гидраты с изолированным участками, канальные гидраты или гидраты координированные с ионом металла - см. Polymorphism an Pharmaceutical Solids by K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Гидраты с изолированным сайтом являются гидратами, в которых молекулы воды изолированы от непосредственного контакта одна с другой, попадая между органическими молекулами. В канальных гидратах молекулы воды находятся в каналах решетки, где они находятся рядом с другими молекулами воды. В гидратах координированных с ионом металла молекулы воды связаны с ионом металла. Когда растворитель или вода является крепко связанным, комплекс имеет хорошо определенную независимую от влажности стехиометрию. Однако, когда растворитель или вода являются слабосвязанным, как в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и сухости. В таких случаях отсутствие стехиометрии будет нормой. Соединения изобретения могут существовать в твердых состояниях в интервале от полностью аморфного до полностью кристаллического. Термин "аморфный" касается состояния, в котором материал не имеет дальнего порядка на молекулярном уровне и в зависимости от температуры может проявлять физические свойства твердого вещества или жидкости. Типично, такие материалы не имеют характеристической рентгенограммы и в то же время проявляют свойства твердого вещества, более формально описываются как жидкости. При нагревании происходит изменение твердого состояния в жидкое, характеризующееся изменением состояния, типично второго порядка ("стеклование"). Термин "кристаллический" касается твердой фазы, в которой материал имеет регулярную упорядоченную внутреннюю структуру на молекулярном уровне и имеет характеристическую рентгенограмму с определенными пиками. Такие материалы при достаточном нагревании будут также проявлять свойства жидкости, но превращение твердого вещества в жидкость характеризуется фазовым изменением, типично первого порядка("точка плавления"). Также включенными в пределы рамок изобретения являются многокомпонентные комплексы (другие, нежели соли и сольваты) соединений формулы (I) или их фармацевтически приемлемых солей, где лекарственное средство и, по крайней мере, одна другая составляющая присутствует в стехиометрических или нестехиометрических количествах. Комплексы такого типа охватывают клатраты (комплексы включения лекарственное средство-хозяин) и сокристаллы. Последние типично определяют как кристаллические комплексы нейтральных молекул, которые связаны вместе нековалентными связями, но также могут быть комплексом нейтральной молекулы с солью. Сокристаллы можно получить кристаллизацией расплава, перекристаллизацией из растворителей или физическим размалыванием компонентов вместе смотри Chem Commun, 17, 1889-1896, by О. Almarsson и М. J. Zaworotko (2004), включенные сюда посредством ссылки. Для общего ознакомления с многокомпонентными комплексами, см. J Pharm Sci, 64(8), 1269-1288, by Haleblian (August 1975), включенную сюда посредством ссылки. Соединения изобретения также могут существовать в мезоморфном состоянии (мезофазный или жидкий кристалл), когда они подвергаются действию пригодных условий. Мезоморфное состояние является промежуточным между настоящим кристаллическим состоянием и настоящим жидким состоянием(расплав или раствор). Мезоморфизм, который возникает как результат изменения температуры, описан как "термотропный", и как результат добавления второй составляющей, такой как вода или другой растворитель, описан как "лиотропный". Соединения, которые имеют возможность образовывать лиотропные мезофазы, описаны как "амфифильные" и они состоят из молекул, которые имеют ионную (такую как -COO-Na+, -COO-K+ или -SO3 -Na+) или неионную (такую как -N-N+(СН 3)3) полярную главную группу. Для большей информации смотри Crystals and Polarizing Microscope by N. H. Hartshorne and A. Stuart, 4thEdition (Edward Arnold, 1970), включенную сюда посредством ссылки. Соединения изобретения могут вводиться как пролекарства. Таким образом, некоторые производные соединений формулы (I), которые могут иметь незначительную или сами по себе не имеют фармакологической активности, при введении в организм или при нанесении на поверхность тела, превращаются в соединения формулы (I), которые имеют желаемую активность, например, благодаря гидролитическому расщеплению. Такие производные упоминаются как "пролекарства". Дополнительную информацию о применении пролекарств можно найти в Pro-drugs as Novel Delivery Systems, vol. 14, ACS SymposiumRoche, American Pharmaceutical Association). Пролекарства можно, например, получить замещением пригодных функциональных групп, присутствующих в соединениях формулы (I), определенными заместителями, которые известны специалистам в этой области техники как 'прозаместители' как описано, например, в "Design Prodrugs" by H. Bundgaard(Elsevier, 1985). Примерами пролекарств являются фосфатные пролекарства, такие как дигидро или диалкил (например, ди-трет-бутил) фосфатные пролекарства. Дополнительные примеры заместителей в соответствии с приведенными выше примерами и примерами других типов пролекарств можно найти в приведенных выше ссылках. Также включенными в пределы рамок изобретения является метаболиты соединений формулы (I),то есть, соединения, которые образуются in vivo при введении лекарственного средства. Некоторые при-4 023375 меры метаболитов в соответствии с изобретением включают, когда соединение формулы (I) содержит фенильный (Ph) заместитель, его фенольное производное (-Ph-PhOH); Соединения изобретения, которые содержат один или больше асимметричных атомов углерода, могут существовать как два или больше стереоизомеров. Включенными в пределы рамок изобретения являются все стереоизомеры соединений изобретения и смеси одного или больше. Обычные способы получения/выделения отдельных энантиомеров включают хиральный синтез из пригодного оптически чистого предшественника или разделение рацемата (или соли или производного рацемата), используя, например, хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) может реагировать с пригодным оптически активным соединением, например, спиртом, или, в случае, когда соединение формулы (I) содержит кислотный или основный заместитель, основанием или кислотой, такой как 1-фенилэтиламин или винная кислота. Полученную диастереоизомерную смесь можно разделять хроматографически и/или фракционной кристаллизацией, и один или оба диастереоизомера превратить в соответствующий чистый энантиомер(ы) с помощью способов хорошо известных специалисту. Хиральные соединения изобретения (но их хиральные предшественники) можно получить в энантиомерно обогащенной форме, используя хроматографию, типично ВЭЖХ, на асимметрической смоле с мобильной фазой, которая состоит из углеводорода, типично гептана или гексана, который содержит 050 об.% изопропанола, типично от 2 до 20 об.%, и от 0 до 5 об.% алкиламина, типично 0,1% диэтиламина. Концентрирование элюата дает обогащенную смесь. Смеси стереоизомеров можно разделить с помощью обычных методик известных специалисту в этой отрасли; смотри, например, "Stereochemistry of Organic Compounds" by E. L. Eliel and S. H. Wilen(Wiley, New York, 1994). Рамки изобретения включают все кристаллические формы соединений изобретения, включая рацематы и их рацемические смеси (конгломераты). Стереоизомерные конгломераты также можно разделить с помощью обычных методик, которые были только что описаны выше. Рамки изобретения включают все фармацевтически приемлемые меченые изотопами соединения изобретения, в которых один или больше атомов заменены атомами, которые имеют такое же атомное число, но атомная масса или массовое число отличается от атомной массы или массового числа, которое преобладает в природе. Примеры изотопов пригодных для введения в соединения изобретения включают изотопы водорода, такие как Н и Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F, йода,такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O,17 О и 18 О, фосфора, такого как 32 Р,и серы, такого как 35S. Некоторые меченые изотопом соединения изобретения, например, те, что содержат радиоактивный изотоп, являются полезными в лекарствах и/или в исследованиях распределения субстрата в ткани. Радиоактивные изотопы трития, то есть 3 Н, и углерода-14, то есть 14 С, является особенно полезными для этой цели, потому что их легко вводить и легко детектировать. Замещение более тяжелыми изотопами,такими как дейтерий, то есть Н, может предоставлять некоторые терапевтические преимущества, полученные от большей метаболической стабильности, например, повышенного периода полураспада in vivo или снижения необходимых доз, и, поэтому, может быть предпочтительным в некоторых обстоятельствах. Замещение изотопами, которые испускают позитрон, такими как 11C, 18F, 15O и 13N, может быть полезным в Позитронной Эмиссионной Томографии (PET) для исследования занятости рецептора субстрата. Меченые изотопом соединения формулы (I), вообще, можно получать обычными способами, которые известны специалистам в этой отрасли техники, или способами, аналогичными описанным в сопроводительных примерах и приготовлениях, применяя пригодный меченый изотопом реагент вместо ранее используемого не меченого изотопом реагента. Также в пределах рамок изобретения находятся промежуточные соединения, как здесь определено дальше, все их соли, сольваты и комплексы и все их сольваты и комплексы солей как здесь определенно выше для соединений формулы (I). Изобретение включает все полиморфы упомянутых выше разновидностей и кристаллических форм. При получении соединения формулы (I) в соответствии с изобретением, специалист в этой отрасли техники может достаточно просто выбрать форму промежуточного соединения, которое обеспечит лучшую комбинацию признаков для этой цели. Такими признаками является температура плавления, растворимость, перерабатываемость и выход промежуточной формы и легкость, с которой продукт может быть очищен при выделении. Соединения изобретения можно получить по любому способу известному в этой области для получения соединений аналогичной структуры. В частности, соединения изобретения можно получить с помощью методик, описанных со ссылкой на схемы, которые приведены далее, или с помощью специфических методик, описанных в примерах, или с помощью аналогичных им методик. Средний специалист в этой отрасли должен понимать, что экспериментальные условия, приведен-5 023375 ные на схемах ниже, являются иллюстрацией пригодных условий для осуществления показанных трансформаций, и что они могут при необходимости или желании быть заменены условиями, которые используются для получения соединений формулы (I). Также должно быть понятно, что может быть необходимо или желательно проводить трансформации в другом порядке, чем тот, что описан на схемах, или модифицировать одну или больше трансформаций, для получения желаемого соединения изобретения. Кроме того, средний специалист в этой отрасли должен понимать, что может быть необходимо или желательно на любой стадии синтеза соединений изобретения защитить одну или больше чувствительных групп, для того, чтобы предупредить протекание нежелательных побочных реакций. В частности,может быть необходимо или желательно защитить амино или карбоксильные группы. Защитные группы,которые используются за получение соединений изобретения, могут использоваться обычным образом. Смотрите, например, те, что описаны в 'Greene's Protective Groups in Organic Synthesis' by Theodora WGreene and Peter G M Wuts, третье издание, (John Wiley and Sons, 1999) особенно разделы 7 ("Защита аминогруппы") и 5 ("Защита карбоксигруппы"), включенную в данный документ посредством ссылки,которая также описывает способы удаления таких групп. Все имидазольные производные формулы (I) можно получить с помощью методик, описанных в общих методиках представленных ниже или используя их обычные модификации. Представленное изобретение также охватывает любой один или больше из этих способов получения имидазольных производных формулы (I), в добавок к любому из новых промежуточных соединений, которые здесь используются. В следующих общих методиках Ar представляет и R1, R2, R3, R4 и R5, является такими как определено для имидазольного производного формулы (I),если не указано другое. Для того, чтобы облегчить понимание, на схемах показаны структуры, где R6 иR7 оба являются Н. Соединения, где R6 и/или R7 является другими нежели Н, можно получить, используя аналогичные методики. Согласно первому способу соединения формулы (I) можно получить из соединений формулы (IV),как показано на схеме 1. Схема 1X является пригодной уходящей группой, типично Br.Y является пригодной аминозащитной группой, типично трет-бутоксикарбонилом, бензилоксикарбонилом или алкилсульфинилом. Соединения формулы (II) являются или коммерчески доступными, или их можно получить с помощью методик, показанных на схемах 2 (для соединений, где Y является трет-бутоксикарбонилом или бензилоксикарбонилом) или 3 (для соединений, где Y является алкилсульфинилом). Соединения формулы (V) являются или коммерчески доступными, или их можно получить с помощью методик, показанных на схеме 4. Соединения формулы (III) можно получить из соединений формулы (II) согласно технологической стадии (i) путем алкилирования соединением формулы (V) в присутствии основания в пригодном растворителе. Типично, условия включают комбинирование кислоты формулы (II) и -галокетона формулы(V) с избытком основания в пригодном растворителе при температуре от комнатной до 50 С. Предпочтительные условия включают использование 1,05 эквивалентов -бромкетона формулы (V) и 1,5 эквивалентов карбоната цезия в ацетонитриле при комнатной температуре, или 1 эквивалента -бромкетона формулы (V) и 1,5 эквивалентов триэтиламина в ацетоне при 50 С, или 1 эквивалента -бромкетона формулы (V) и 1,5 эквивалентов триэтиламина в этилацетате при комнатной температуре. Соединения формулы (IV) можно получить из соединений формулы (III) согласно технологической стадии (ii), кристаллизацией в присутствии пригодной соли аммония, типично ацетата аммония. Типичные условия включают избыток соли аммония в пригодном органическом растворителе при температуре от 100 до 130 С. Предпочтительные условия включают 10 эквивалентов ацетата аммония в безводном толуоле при 100-130 С. Соединения формулы (I) можно получить из соединения формулы (IV) согласно технологической стадии (iii), снятием защиты с помощью гидрирования или в кислой среде. Типично условия зависят от природы защитной группы. Когда защитной группой является трет-бутоксикарбонильная группа, снятие проводят в кислой среде. Предпочтительными условиями является избыток HCl в 1,4-диоксане при комнатной температуре. Когда защитной группой является бензилоксикарбонильная группа, снятие проводят или в кислой среде, типично используя HBr в уксусной кислоте при комнатной температуре, или путем гидрирования в присутствии пригодного катализатора гидрирования, типично Pd/C или Pd(OH)2/C. Согласно второму способу соединения формулы (VI) (то есть, соединения формулы (II), где Y является трет-бутоксикарбонилом или бензилоксикарбонилом, R3 является водородом и R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют 4-7-членное кольцо формулы где m является 1, 2 или 3 и n является 1 или 2) можно получить с помощью способа, показанного на схеме 2. Схема 2Ra является пригодной алкильной защитной группой, типично метил или этил.n является 1 или 2. Соединения формулы (VII) являются коммерчески доступными или их можно получить, используя опубликованные методики. Соединения формулы (VIII) можно получить из соединений формулы (VII) с помощью реакции Виттига, согласно технологической стадии (iv), с кетоном формулы (VII) и или фосфонатным эфиром в присутствии сильного основания, или фосфораном в пригодном растворителе. В случае фосфонатного эфира, типичные условия включают фосфонатний эфир в присутствии сильного основания в безводном ТГФ при 0 С. Предпочтительные условия включают триэтилфосфоноацетат с 1,1 эквивалентом гидрида натрия в безводном ТГФ при 0 С. В случае фосфорана предпочтительные условия включают 1,01 эквивалентов (карбэтоксиметилен)трифенилфосфорана в дихлорметане при 0 С. Соединения формулы (IX) можно получить из соединений формулы (VIII) согласно технологической стадии (v), используя реакцию присоединения коньюгата с акцептором Микаэля формулы (VIII) и аммиака. Предпочтительные условия включают избыток аммиака в спиртовом растворителе при температуре от 100 до 150 С в закрытой колбе. Соединения формулы (X) можно получить из соединений формулы (IX) согласно технологической стадии (vi), используя реакцию защиты аминоэфира формулы (IX). Типично, условия зависят от природы аминозащитной группы. Когда защитной группой является бензилоксикарбонильная группа, типичные условия включают бензилхлорформиат в присутствии основания в пригодном растворителе. Предпочтительные условия содержат 1,2 экв. бензилхлорформиата и 3 экв. N,N-диизопропилэтиламина в ацетонитриле при комнатной температуре, или 1,3 экв. бензилхлорформиата и водного раствора карбоната натрия в трет-бутилметиловом эфире при 5-20 С. Соединения формулы (VI) можно получить из соединений формулы (X) согласно технологической стадии (vii) реакцией гидролиза защищенного аминоэфира формулы (X). Типично, условия включают основание в пригодном растворителе при температуре от комнатной температуры до 75 С. Предпочтительные условия включают водный раствор гидроксида натрия в метаноле при 75 С или водный раствор гидроксида натрия в трет-бутилметиловом эфире при комнатной температуре. Согласно третьему способу соединения формулы (XI) (то есть соединения формулы (II), где Y является алкилсульфинилом и R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют 4-7-членное кольцо формулы где m является 1, 2 или 3 и n является 1 или 2) можно получить с помощью способа, показанного на схеме 3. Схема 3Ra является пригодной алкильной защитной группой, типично метилом или этилом.Q является пригодной алкильной защитной группой, типично трет-бутилом.n является 1 или 2. Соединения формулы (XIII) являются коммерчески доступными. Соединения формулы (XII) можно получить из соединений формулы (VII) путем образования имина согласно технологической стадии (viii), используя кетон формулы (VII) и сульфинамид формулы(XIII) в присутствии основания в пригодном растворителе. Предпочтительные условия содержат 1,0 экв. алкилсульфинамида (XIII) и 1,0 экв. карбоната цезия в дихлорметане при комнатной температуре. Соединения формулы (XV) можно получить из соединений формулы (XII) согласно технологической стадии (ix), присоединением энолята лития формулы (XIV) к сульфинимину формулы (XII). Энолят лития получают in situ из приемлемого эфира в присутствии литиевого основания в пригодном растворителе при -78 С. Предпочтительные условия включают 2,1 экв. приемлемого эфира и 2 экв. диизопропиламина лития в безводном ТГФ при -78 С, со следующим присоединением сульфинимина формулы(XII). Соединения формулы (XI) можно получить из соединений формулы (XV) согласно технологической стадии (х), реакцией гидролиза защищенного аминоэфира формулы (XIII). Типично, условия включают основание в пригодном растворителе при комнатной температуре. Предпочтительные условия включают водный раствор гидроксида натрия в метаноле. Согласно четвертому способу соединения формулы (V) можно получить используя способы, показанные на схеме 4. Соединения формулы (V) можно получить из соединений формулы (XVIII) согласно технологической стадии (xiii) реакцией галогенирования. Преимущественно условия реакции бромирования (где X является Br) включают бромирующий агент, такой как трибромид триметилфениламмония, в пригодном растворителе при 0 С. Если не являются коммерчески доступными, соединения формулы (XVIII) можно получить из соединений формулы (XVII) согласно технологической стадии (xii), замена амида Вейнреба. Предпочтительные условия включают метиллитий в пригодном растворителе при 0 С. Соединения формулы (XVII) можно получить из соединений формулы (XVI) согласно технологической стадии (xi), образованием амидной связи. Предпочтительные условия включают гидрохлорид О,N-диметилгидроксиламина и пригодное основание, такое как триэтиламин, в пригодном растворителе при комнатной температуре. Со ссылкой на общие методики выше, среднему специалисту в этой отрасли должно быть понятно,что когда присутствуют защитные группы, они будут взаимозаменяемыми другими защитными группами подобной природы, например, когда амин защищен трет-бутоксикарбонильной группой, она может быть легко заменена любой пригодной аминозащитной группой. Пригодные защитные группы описаны в'Protective Groups in Organic Synthesis' by T. Greene and P. Wuts (3 е издание, 1999, John Wiley and Sons). Представленное изобретение также касается новых промежуточных соединений, как определенно выше, всех их солей, сольватов и комплексов и всех их сольватов и комплексов солей, как определено здесь выше для имидазольных производных формулы (I). Изобретение включает все полиморфы упомянутых выше видов и их кристаллических форм. Когда получаются имидазольные производные формулы (I) или аминокислоты формулы (VI) в соответствии с изобретением, специалисту в этой отрасли должен быть понятен выбор наилучшего порядка стадий для синтеза промежуточных соединений и выбор формы промежуточных соединений, которая обеспечит наилучшую комбинацию признаков для этих целей. Такие признаки включают температуру плавления, растворимость, перерабатываемость и выход промежуточной формы и легкость, с которой продукт может быть очищен при выделении. Соединения изобретения, предназначенные для фармацевтического применения, можно применять как кристаллические или аморфные продукты или они могут существовать в твердых состояниях в интервале от полностью аморфного до полностью кристаллического. Их можно получить, например, как твердые остатки, порошки или пленки, способами, такими как осаждение, кристаллизация, сублимация,сушка распылением или сушка упариванием. Для этой цели можно применять микроволновую или радиочастотную сушку. Их можно применять как таковые или в комбинации с одним или больше других соединений изобретения, или в комбинации с одним или больше других лекарственных средств (или как любую их комбинацию). Вообще, их следует применять как композицию в сочетании с одним или больше фармацевтически приемлемых наполнителей. Термин 'наполнитель' применен здесь для описания любого ингредиента, отличающегося от соединения(соединений) изобретения. Выбор наполнителя следует делать в широком диапазоне в зависимости от факторов, таких как конкретный способ применения, влияние наполнителя на растворимость и стабильность, и характер формы дозировки. В другом аспекте изобретения, обеспечивается фармацевтическая композиция, которая содержит соединение изобретения вместе с одним или больше фармацевтически приемлемых наполнителей. Фармацевтические композиции, пригодные для высвобождения соединений представленного изобретения, и способы их получения очевидны среднему специалисту в этой отрасли. Такие композиции и способы их получения можно найти, например, в "Remington's Pharmaceutical Sciences", 19th Edition(Mack Publishing Company, 1995). Пригодными путями введения является оральное, парентеральное, местное, ингаляцион-9 023375 ное/интраназальное, ректальное/интравагинальное и окулярное/ауральное введение. Рецептуры, пригодные для упомянутых выше способов введения, можно сформулировать для немедленного и/или модифицированного высвобождения. Рецептуры модифицированного высвобождения включают отсроченное-, длительное-, пульсирующее-, контролированное-, нацеленное и программируемое высвобождение. Соединения изобретения можно вводить перорально. Пероральное введение может включать заглатывание, так что соединение попадает в желудочно-кишечный тракт, или букальное, или сублингвальное введения, при которых соединение попадает в кровоток непосредственно из ротовой полости. Композиции, пригодные для перорального введения, включают твердые композиции, такие как таблетки, капсулы, которые содержат частицы, жидкости или порошки; лозенги (включая наполненные жидкостью),гели, твердые растворы, липосомы, пленки, овулы, спреи, жидкие рецептуры и букальные/мукоадгезивные пластыри. Жидкие композиции охватывают суспензии, растворы, сиропы и эликсиры. Такие композиции можно применять как наполнители мягких или твердых капсул и обычно они содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или пригодное масло, и один или больше эмульгаторов и/или суспендирующих агентов. Жидкие композиции также можно получить восстановлением твердого вещества, например саше. Соединения изобретения также можно применять в форме быстрорастворимых, быстрораспадаемых форм, таких как описано в Expert Opinion in Therapeutic Patents, 11 (6), 981-986, by Liang and Chen(2001). Для таблетированных дозированных форм, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.% дозированной формы, более типично от 5 до 60 мас.% дозированной формы. Дополнительно к лекарственному средству таблетки обычно содержат дезинтегрант. Примерами дезинтегрантов являются натрий крахмалгликолят, натрий карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, натрий кроскармеллоза, кросповидон, поливинилпирролидон, метилцеллюлоза, микрокристаллическая целлюлоза, замещенная низшим алкилом гидроксипропилцеллюлоза, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Вообще дезинтегрант будет составлять от 1 до 25 мас.%, преимущественно от 5 до 20 мас.% дозированной формы. Связывающие агенты обычно используются для придания качества композиции таблетки. Пригодными связывающими агентами является микрокристаллическая целлюлоза, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводную и т.д.), маннит, ксилит, декстрозу, цукрозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат дигидрофосфата кальция. Таблетки необязательно также могут содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Когда присутствуют,поверхностно-активные агенты могут составлять от 0,2 до 5 мас.% таблетки, и глиданты могут составлять от 0,2 до 1 мас.% таблетки. Таблетки также вообще содержат смазывающие агенты, такие как стеарат магния, стеарат кальция,стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие агенты обычно составляют от 0,25 до 10 мас.%, преимущественно от 0,5 до 3 мас.% таблетки. Другими возможными ингредиентами являются антиоксиданты, красители, ароматизаторы, консерванты и агенты, маскирующие вкус. Типичные таблетки содержат приблизительно до 80% лекарственного средства, от приблизительно 10 до приблизительно 90 мас.% связывающего агента, от приблизительно 0 до приблизительно 85 мас.% разбавителя, от приблизительно 2 до приблизительно 10 мас.% дезинтегрантов и от приблизительно 0,25 до приблизительно 10 мас.% лубриканта. Таблеточные смеси можно прессовать непосредственно или роликом для формирования таблеток. Таблеточные смеси или порции смесей альтернативно могут быть подвергнуты влажному, сухому гранулированию или гранулированию расплава, замораживанию расплава или экструдированию перед таблетированием. Конечные композиции могут содержать один или больше слоев и могут иметь покрытие или не иметь покрытия; они даже могут быть инкапсулированы. Составы таблеток рассмотрены в Pharmaceutical Dosage Forms: Tablets, Vol. 1, by H. Lieberman and L.Lachman (Marcel Dekker, New York, 1980). Композиции пригодного модифицированного высвобождения для целей изобретения описаны в патенте US6106864. Подробности технологий другого приемлемого высвобождение, такого как высокоэнергетические дисперсии, осмотические и покрытые частицы, можно найти в Pharmaceutical TechnologyOn-line, 25(2), 1-14, by Verma et al. (2001). Применение жвачек для обеспечения контролируемого высвобождения описано в WO 00/35298. Соединения изобретения также могут быть введены непосредственно в кровоток, в мышцу или во внутренний орган. Пригодные способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастер- 10023375 нальное, интракраниальное, внутримышечное, подкожное и внутрибарабанное введение. Пригодными устройствами для парентерального введения являются иголочные (включая микроиголочные) инжекторы, безиголочные инжекторы и техники вливания. Парентеральные композиции типично являются водными растворами, которые могут содержать наполнители, такие как соли, углеводороды и буферирующие агенты (предпочтительно до рН 3-9), но, для некоторых применений они могут быть более пригодно сформулированы как стерильный неводный раствор или как сухая форма для применения в сочетании с пригодным наполнителем, таким как стерильная свободная от пирогена вода. Получение парентеральных композиций в стерильных условиях, например, лиофилизацией, можно легко осуществить, применяя обычные фармацевтические способы, хорошо известные специалистам в этой отрасли техники. Растворимость соединений формулы (I), используемых при получении парентеральных растворов,можно повышать путем использования пригодных способов получения композиции, таких как введение средств, которые повышают растворимость. Композиции для парентерального применения можно компоновать для непосредственного и/или модифицированного высвобождения. Модифицированное высвобождение композиции охватывают отсроченное, длительное, пульсирующее, контролируемое, целевое и программируемое высвобождение. Таким образом, соединения изобретения можно формулировать как суспензии или как твердые, полутвердые средства или как тиксотропную жидкость для введения в качестве имплантированного депо, которое обеспечивает модифицированное высвобождение активного соединения. Примеры таких композиций охватывают покрытые лекарственным средством стенты и микросферы из поли(dl-молочно-согликолевой)кислоты (PGLA). Соединения изобретения также можно наносить местно на кожу или слизистую оболочку, то есть,дермально или трансдермально. Типичные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, пластыри на кожу, облатки, имплантаты,тампоны, волокна, бандажи и микроэмульсии. Также можно применять липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно вводить промоторы проникновение, смотри, например, J Pharm Sci, 88(10), 955-958, by Finnin and Morgan (October 1999). Другие способы местного применения включают введение с помощью электропорации, ионтофореза, фонофореза, сонофореза и микроиголочной или безиголочной инъекции (например, Powderject, Bioject и т.д.). Соединения изобретения также можно вводить интраназально или с помощью ингаляции, типично в форме сухого порошка (как таковые или как смесь, например, в форме сухой смеси с лактозой, или форме частицы из смешанных составляющих, например, смешанные с фосфолипидами, такими как фосфатидилхолин) из ингалятора с сухим порошком, как аэрозольный спрей из контейнера под давлением,насоса, спрея, пульверизатора (предпочтительно пульверизатора с применением электрогидродинамики для получения тонкого тумана) или распылителя, с применением или без применения пригодного пропелланта, такого как 1,1,1,2-тетрахторэтан или 1,1,1,2,3,3,3-гептафторпропан. Порошок для интраназального применения может содержать биоадгезивное средство, например хитозан или циклодекстрин. Контейнер с повышенным давлением, насос, спрей, пульверизатор или распылитель содержат раствор или суспензию соединения(соединений) изобретения, которые содержат как растворитель, например, этанол, водный этанол или пригодное альтернативное средство, для диспергирования, солюбилизации или увеличения времени высвобождения активного агента, пропеллент(ы) как растворитель, и необязательно поверхностно-активное вещество, такое как триолеатсорбита, олеиновая кислота или олигомолочная кислота. Перед применением в форме композиции сухого порошка или суспензии лекарственный продукт тонко измельчают до размера, пригодного для высвобождения ингаляцией (типично меньше чем 5 микрон). Это можно осуществить любым пригодным способом измельчение, таким как винтовая струйная мельница, измельчение в потоковой мельнице с псевдосжиженным слоем, обработка сверхкритической жидкостью с образованием наночастиц, гомогенизация при условиях высокого давления или сушка распылением. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцелюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе можно формулировать для включения порошковой смеси соединения изобретения, пригодного порошкового основания, такого как лактоза или крахмал, и модификатора распыления, такого как 1-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, преимущественно, последней. Другие пригодные наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, цукрозу и трехалозу. Композиции пригодного раствора для применения в пульверизаторе, использующего электрогидродинамику для получения тонкого тумана, могут содержать от 1 мкг до 20 мг соединения изобретения на высвобождение и объем высвобождение может изменяться от 1 до 100 мкл. Типичная композиция может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Аль- 11023375 тернативные растворители, которые можно применяться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Пригодные ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или натрий сахарин, можно добавлять к этой композиции изобретения, предназначенной для ингаляционного/интраназального введения. В случае сухих порошковых ингаляторов и аэрозолей, единичная доза определяется типом клапана,который высвобождает определенное количество. Единицы согласно изобретению, конечно, являются отрегулированными для введения отмеренной дозы или "пшика", который содержит от 1 мкг до 100 мг соединения формулы (I). Общую суточную дозу, типично в интервале от 1 мкг до 200 мг, можно вводить как единичную дозу или, более конечно, как разделенные дозы на протяжении суток. Соединения изобретения можно вводить ректально или вагинально, например, в форме суппозитория, пессария, микробицида, влагалищного кольца или клизмы. Масло какао является традиционным основанием для суппозитория, но как пригодные можно применять разные альтернативные варианты. Соединения изобретения также можно вводить непосредственно в глаз или ухо, типично в форме капель, тонко измельченной суспензии или раствора в изотоническом, рН-корегированном стерильном физрастворе. Другие композиции, пригодные для глазного и ушного введения включают мази, биоразлагаемые (например, абсорбируемые гелевые губки, коллаген) и бионеразлагаемые (например, силиконовые) имплантаты, тампоны, линзы и дольковые и пузырчатые системы, такие как ниосомы или липосомы. Полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, гелановая смола, можно вводить вместе с консервантом, таким как бензалконий хлорид. Такие композиции также можно вводить ионтофорезом. Соединения изобретения можно комбинировать из растворимыми макромолекулярными веществами, такими как циклодекстрин и его пригодные производные или полиэтиленгликольсодержащие полимеры, для того, чтобы улучшить их растворимость, скорость растворения, улучшить вкус, биоусваивание и/или стабильность для использования в любых вышеупомянутых способах применения. Например, найдено, что комплексы лекарственное средство-циклодекстрин вообще является полезным для большинства форм дозирования и путей введения. Можно использовать комплексы включения и невключения. Как альтернативу прямому комплексообразованию с лекарственным средством можно использовать циклодекстрин как вспомогательную добавку, то есть как носитель, разбавитель или солюбилизатор. С этой целью в большинстве случаев используют альфа-, бета- та гамма-циклодекстрины,например, которые можно найти в Международных патентных заявкахWO 91/11172, WO 94/02518 иWO 98/55148. Для введения людям общая суточная доза соединений изобретения типично находится в интервале от 1 мг до 10 г, например, от 10 мг до 1 г, например от 25 до 500 мг, конечно, в зависимости от пути введения и эффективности. Например, оральное введение может нуждаться в общей суточной дозе от 50 до 100 мг. Общая суточная доза может вводиться в единичной или разделенной дозах и можно, по решению врача, быть уменьшена ниже предоставленного здесь диапазона. Эти дозы базируются на среднем субъекте, который имеет среднюю массу приблизительно от 60 до 70 кг. Врач способен определить дозы для субъекта с массой вне этого диапазона, такого как дети и пожилые люди. Как отмечено выше, соединения изобретения полезны, поскольку, они проявляют фармакологическую активность у животных, то есть, является модуляторами NaV1.8 канала. Более особенно, соединения изобретения полезны при лечении расстройств, для которых показан модулятор NaV1.8. Предпочтительным животным является млекопитающее, более преимущественно человек. В следующем аспекте изобретения обеспечивается соединение изобретения для применения в качестве медикамента. В следующем аспекте изобретения обеспечивается соединение изобретения для лечения расстройства, для которого показан модулятор NaV1.8. В следующем аспекте изобретения обеспечивается применение соединения изобретения для получения медикамента для лечения расстройства, для которого показан модулятор NaV1.8. В следующем аспекте изобретения обеспечивается способ лечения расстройства у животного (преимущественно млекопитающего, более преимущественно человека), для которого показан модуляторNaV1.8, который содержит введение упомянутому животному терапевтически эффективного количества соединения изобретения. Расстройствами, для которых показан модулятор NaV1.8, является боль, в частности невропатическая, ноцицептивная и воспалительная боль. Физиологическая боль является важным защитным механизмом, предназначенным для предупреждения об опасности, исходящей от потенциально вредных стимулов из внешнего окружения. Система работает через специфический ряд первичных сенсорных нейронов и активируется посредством вредных стимулов через периферические механизмы передачи (см. обзор Millan, 1999, Prog. Neurobiol., 57, 1-164). Эти сенсорные волокна известны как ноцицепторы и они представляют собой аксоны характерно малого диаметра с медленными скоростями проводимости. Ноцицепторы кодируют силу, длительность и качество вредного стимула и, благодаря их топографически организованной проекции в спинной мозг, локализацию стимула. Ноцицепторы присутствуют на ноцицептивных нервных волокнах, которые подразделяются на два основных типа, А-дельта волокна (миелинизированные) и С волокна (немиелинизированные). Активность, генерируемая входным сигналом ноцицептора, передается после комплексного процессинга, в спинной рог, либо непосредственно, либо через переключающие ядра ствола головного мозга в вентробазальный таламус и затем в кору головного мозга, где происходит генерация ощущения боли. Боль, в основном, можно классифицировать как острую или хроническую. Острая боль начинается неожиданно и продолжается недолго (обычно двенадцать недель или меньше). Ее обычно связывают с конкретной причиной, такой как конкретное повреждение, и она часто является очень острой и сильной. Это тип боли, которая может возникать после специфических повреждений в результате хирургической операции, лечения зубов, нагрузки или растяжения. Острая боль, как правило, не приводит к какомулибо персистентному физиологическому ответу. В отличие от этого хроническая боль представляет собой продолжительную боль, типично длящуюся в течение более трех месяцев и приводящую к существенным физиологическим и эмоциональным проблемам. Типичными примерами хронической боли являются невропатическая боль (например, болезненная диабетическая невропатия, невралгия после опоясывающего лишая), запястный туннельный синдром, боль в спине, головная боль, раковая боль, артритная боль и хроническая послеоперационная боль. Когда происходит существенное повреждение ткани организма, в результате заболевания или травмы, характеристики ноцицепторной активации изменяются и происходит сенсибилизация на периферии,локально вокруг повреждения и центрально, где заканчиваются ноцицепторы. Эти эффекты приводят к усиленному ощущению боли. При острой боли эти механизмы могут быть полезными для промотирования защитных реакций, которые могут лучше способствовать процессам восстановления. Обычно ожидается, что чувствительность возвратится к норме, как только произойдет заживление раны. Однако при многих состояниях хронической боли гиперчувствительность намного продолжительней, чем процесс заживления, и это часто является результатом поражения нервной системы. Это поражение часто приводит к аномалиям в сенсорных нервных волокнах, связанных с дизадаптацией и аберрантной активностью(WoolfSalter, 2000, Science, 288, 1765-1768). Клиническая боль присутствует, когда характерными симптомами у пациента являются дискомфорт и аномальная чувствительность. Пациенты обычно являются совершено гетерогенными, и у них могут быть различные болевые симптомы. Такие симптомы включают: 1) спонтанную боль, которая может быть ноющей, жгучей или колющей; 2) гиперболизированные болевые ответы на вредные стимулы(гипералгезия) и 3) боль, вызываемую обычно безвредными стимулами (аллодиния - Meyer et al., 1994,Textbook of Pain, 13-44). Хотя пациенты, страдающие от различных форм острой и хронической боли,могут иметь одинаковые симптомы, лежащие в основе этого механизмы могут быть разными, и поэтому могут потребоваться разные стратегии лечения. Поэтому боль можно также подразделить на ряд различных подтипов в соответствии с различной патофизиологией, включающих ноцицептивную, воспалительную и невропатическую боль. Ноцицептивная боль индуцируется повреждением ткани или сильными стимулами, которые потенциально могут вызвать повреждение. Болевые афференты активируются посредством трансдукции стимулов ноцицепторами на участке поражения и активируют нейроны в спинном мозге на уровне их терминации. Затем это передается вверх по спинномозговому нервному пути в головной мозг, где происходит восприятие боли (Meyer et al., 1994, Textbook of Pain, 13-44). Активация ноцицепторов активирует два типа афферентных нервных волокон. Миелинизированные А-дельта волокна осуществляют передачу быстро и являются ответственными за острые и резкие болевые ощущения, тогда как немиелинизированные С волокна осуществляют передачу с более медленной скоростью и сообщают тупую или ноющую боль. Ноцицептивная боль от умеренной до сильной и острой является явным признаком боли в результате травмы центральной нервной системы, напряжения/растяжения, ожогов, инфаркта миокарда и острого панкреатита, послеоперационной боли (боль после любых хирургических процедур), посттравматической боли, почечных колик, раковой боли и боли в спине. Раковая боль может представлять собой хроническую боль, такую как связанная с опухолью боль (например, боль в кости, головная боль, боль в лицевой части или висцеральная боль), или боль, связанную с противораковой терапией (например, синдром после химиотерапии, хронический послеоперационный болевой синдром или синдром после лучевой терапии). Раковая боль также может возникать в ответ на химиотерапию, иммунотерапию, гормональную терапию или лучевую терапию. Боль в спине может быть в результате грыжи или разрушения межпозвоночных дисков или аномалий суставных поверхностей поясничных суставов, крестцовых суставов, околопозвоночных мышц или заднепродольной связки. Боль в спине может пройти естественным образом, но у некоторых пациентов, когда она длится более 12 недель, она становится хроническим состоянием, которое может быть особенно изнуряющим. Невропатическую боль обычно определяют как боль, инициированную или вызванную первичным повреждением или дисфункцией в нервной системе. Нервное повреждение может быть вызвано травмой и заболеванием, и, таким образом, термин "невропатическая боль" охватывает многие расстройства с различной этиологией. Эти расстройства включают, но не ограничиваются этим, периферическую невропатию, диабетическую невропатию, невралгию после опоясывающего лишая, невралгию тройничного нерва, боль в спине, невропатию при раке, ВИЧ невропатию, фантомные боли в конечностях, запястный туннельный синдром, центральную боль после удара и боль, связанную с хроническим алкоголизмом,гипотиреозом, уремией, рассеянным склерозом, повреждением спинного мозга, болезнью Паркинсона,эпилепсией и дефицитом витаминов. Невропатическая боль является патологической, поскольку она не имеет никакой защитной роли. Она часто присутствует долго после устранения изначальной причины,продолжаясь обычно в течение нескольких лет, существенно снижая качество жизни пациента (Woolfand Mannion, 1999, Lancet, 353, 1959-1964). Симптомы невропатической боли трудно лечить, поскольку они часто являются гетерогенными даже у пациентов с одним и тем же заболеванием (WoolfDecosterd,1999, Pain Supp., 6, S141-S147; Woolf and Mannion, 1999, Lancet, 353, 1959-1964). Они включают спонтанную боль, которая может быть продолжительной, и пароксисмальную или аномально возникающую боль, такую как гипералгезия (повышенная чувствительность к вредным стимулам) и аллодиния (чувствительность к обычно безвредным стимулам). Воспалительной процесс представляют собой сложную серию биохимических и клеточных событий, активирующихся в ответ на повреждение ткани или присутствие чужеродных веществ, которые приводят к опуханию и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Артритная боль является наиболее распространенной воспалительной болью. Ревматоидное заболевание представляют собой одно из самых распространенных хронических воспалительных состояний в развитых странах, и ревматоидный артрит является обычной причиной нарушения трудоспособности. Точная этиология ревматоидного артрита неизвестна, но существующие гипотезы предполагают, что важное значение могут иметь как генетические, так и микробиологические факторы (GrennanJayson, 1994, Textbook of Pain, 397-407). Было установлено, что почти 16 млн американцев имеют симптоматический остеоартрит (ОА) или дегенеративное заболевание суставов, большинство из них старше 60 лет, и это число, как ожидают, увеличится до 40 млн. с увеличением возраста населения, что делает эту проблему здоровья населения чрезвычайно важной (HougeMersfelder, 2002, Ann Pharmacother., 36, 679-686; McCarthy et al., 1994, Textbookof Pain, 387-395). Большинство пациентов с остеоартритом нуждаются в медицинской помощи из-за связанной с этим заболеванием боли. Артрит оказывает существенное влияние на психосоциальную и физическую функцию и, как известно, является основной причиной нарушения трудоспособности в последующей жизни. Анкилозирующий спондилоартрит также представляет собой ревматическое заболевание, которое вызывает артрит суставов позвоночника и крестцовых суставов. Он имеет разные формы от перемежающихся эпизодов боли в спине, которые имеют место на протяжении жизни, до тяжелого хронического заболевания, которое поражает позвоночник, периферические суставы и другие органы. Другим типом воспалительной боли является висцеральная боль, которая включает боль, связанную с воспалительным заболеванием кишечника (IBD). Висцеральная боль представляют собой боль, связанную с внутренними органами, которая охватывает органы брюшной полости. Эти органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанную с внутренними органами,можно подразделить на связанную с пищеварительной системой висцеральную боль и не связанную с пищеварительной системой висцеральную боль. Обычно встречающиеся желудочно-кишечные (GI) расстройства, которые вызывают боль, включают функциональное кишечное расстройство (FBD) и воспалительное заболевание кишечника (IBD). Эти GI расстройства включают широкий ряд различных болезненных состояний, которые в настоящее время можно лишь в умеренной степени контролировать, включающих, в том, что касается FBD, гастро-эзофагеальный рефлюкс, диспепсию, синдром раздраженной толстой кишки (IBS) и функциональный абдоминальный болевой синдром (FAPS), и в том, что касаетсяIBD, болезнь Крона, илеит и язвенный колит, которые все регулярно вызывают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, цистит и панкреатит, а также боль в области таза. Следует отметить, что некоторые типы боли имеют множественные этиологии и, таким образом,могут классифицироваться в более чем одной области, например боль в спине и раковая боль имеют как ноцицептивные, так и невропатические компоненты. Другие типы боли включают боль в результате мышечно-скелетных расстройств, включающую миалгию, фибромиалгию, спондилоартрит, серо-отрицательные (неревматоидные) артропатии, неартикулярный ревматизм, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит; сердечную и сосудистую боль, включающую боль, вызванную стенокардией, инфарктом миокарда,митральным стенозом, перикрадитом, болезнью Рейно, склеродермой и ишемией скелетных мышц; головную боль, такую как мигрень (включающую мигрень с аурой и мигрень без ауры), "гистаминовую" головную боль, головную боль при повышенном давлении и головную боль смешанного типа, а также головную боль, связанную с сосудистыми расстройствами; и боли в лицевой части и области рта, включающие зубную боль, ушную боль, синдром жжения во рту и височно-нижнечелюстную миофасциальную боль; эритермалгия и рото-лицевая боль, включая зубную боль, ушную боль, синдром жжения во рту и височнонижнечелюстная миофасциальная боль. Модулятор NaV1.8 может быть полезно объединять с другими фармакологически активными соединениями или с двумя или большим количеством других фармакологически активных соединений, особенно, при лечении боли. Такие комбинации часто имеют значительные преимущества, включая восприятие пациентами, легкость дозирования и синергическую активность. В комбинациях, которые приведены дальше, соединение изобретения могут вводиться одновременно, последовательно или раздельно в комбинации с другим терапевтическим агентом или агентами.NaV1.8 модулятор формулы (I) или его фармацевтически приемлемую соль, как определенно выше,можно вводить в комбинации с одним или большим количеством агентов, которые выбирают из: альтернативный модулятор NaV1.8 (например, как описано в WO 2008/135826, более особенно N-[6 амино-5-(2-хлор-5-метоксифенил)пиридин-2-ил]-1-метил-1H-пиразол-5-карбоксамид); альтернативный модулятор натриевого канала, такой как модулятор NaV1.3 (например, как описано в WO 2008/118758); или модулятор NaV1.7 канала, например, как описано в WO 2009/012242); ингибитор сигнального фактора роста нерва, такой как агент, связывающий NGF и ингибирующий биологическую активность NGF и/или даунстрим путь(и) опосредствованные NGF сигнализированием(например, танезумаб), TRKA антагонист или р 75 антагонист; соединение, которое увеличивает уровни эндоканабиноида, такое как соединение, ингибирующее активность гидролазы амида жирной кислоты (FAAH), в частности, описанное в WO 2008/047229 (напримерN-пиридазин-3-ил-4-(3-[5-(трифторметил)пиридин-2-ил]оксибензилиден)пиперидин-1 карбоксамид); опиоидный анальгетик, например морфий, героин, гидроморфон, оксиморфон, леворфанол, левалофан, метадон, меперидин, фентанил, кокаин, кодеин, дигидрокодеин, оксикодон, гидрокодон, пропоксифен, налмефен, налорфин, налоксон, налтрексон, бупренорфин, буторфанол, налбуфин или пентазоцин; нестероидные противовоспалительные лекарственные средства (NSAID), например аспирин, диклофенак, дифлузинал, этодолак, фенбуфен, фенопрофен, флуфенизал, флубипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамовая кислота, мефенаминовая кислота, мелоксикам, набуметон, напроксен, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин. фенилбутазон, пироксикам,сульфасалазин, сулиндак, толметин или зомепирак; седативный барбитурат, например амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобартитал, секобарбитал, талбутал, теамилал или тиопентал; бензодиазепин, имеющий седативное действие, например хлордиазепоксид, клоразепат, диазепам,флуразепам, лоразепам, оксазепам, темазепам или триазолам; антагонист H1, имеющий седативное действие, например дифенгидрамин, пириламин, прометазин,хлорфенирамин или хлорциклизин; седативное средство, такое как глутетимид, мепробамат, метахиалон или дихлоалфеназон; миорелаксант скелетных мышц, например баклофен, карисопродол, хлорзоксазон, циклобензапин,метокарбамол или орфренадин; антагонист рецептора NMDA, например декстрометорфан +)-3-гидрокси-N-метилморфинан) или его метаболит декстрорфан +)-3-гидрокси-N-метилморфинан), кетамин, мемантин, пиролохинолин хинин, цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота, будипин, EN-3231 (MorphiDex, комбинированная композиция морфия и декстрометорфана), топирамат, нерамексан или перзинфотел, включая антагонист NR2B, например, ифенпродил, траксопродил или (-)-(R)-6-2-[4-(3-фторфенил)-4-гидрокси-1 пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1 Н)-хинолинон; альфа-адренергическое средство, например доксазозин, тамсулозин, клонидин, гуанифацин, дексметатомидин, модафинил или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин; трициклический антидепрессант, например, десипрамин, имипрамин, амитриптилин или нортриптилин; антиконвульсант, например карбамазепин, ламотригин, топирамат или валпроат; антагонист тахикинина (NK), в частности антагонист NK-3, NK-2 или NK-1, например R,9R)-7[3,5-бис(триффторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7 Н-[1,4]диазоцино[2,1g][1,7]-нафтиридин-6-13-дион (ТАК-637), 5-(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3(4-фторфенил)-4-морфолинил]-метил]-1,2-дигидро-3 Н-1,2,4-триазол-3-он (МК-869), апрепитант, ланепитант, дапитант или 3-2-метокси-5-(трифторметокси)фенил]-метиламино]-2-фенилпиперидин (2S,3S); антагонист мускарина, например оксибутинин, толтеродин, пропиверин, тропсиум хлорид, дарифенацин, солифенацин, темиверин и ипратропиум; селективный ингибитор СОХ-2, например целекоксиб, рофекоксиб, парекоксиб, валдекоксиб, деракоксиб, эторикоксиб или лумиракоксиб; каменноугольный смоляной анальгетик, в частности парацетамол; нейролептик, такой как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезори- 15023375 дазин, трифлуоперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипразидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, азенапин, луразидон, амисулприд, балаперидон, палиндор, эпливансерин, озанетант, римонабант,меклинертант, Мираксион или саризотан; агонист ванилоидного рецептора (например, резинфератоксин) или антагонист (например, капсазепин); бета-адренергическое средство, такое как пропанолол; локальный анестетик, такой как мексилетин; кортикостероид, такой как дексаметазон; агонист или антагонист рецептора 5-НТ, особенно, агонист 5-НТ 1B/1D, такой как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан; антагонист рецептора 5-НТ 2 А, такой как R(+)-альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенилэтил)]4-пиперидинметанол (MDL-100907); антагонист рецептора 5-НТ 3, такой как ондансетрон; холинэргический (никотиновый) анальгетик, такой как испрониклин (ТС-1734) (Е)-N-метил-4-(3 пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлоропиридин (АВТ-594) или никотин; Трамадол; ингибитор PDEV, такой как 5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-1-метил-3-нпропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он (силденафил) (6R,12aR)-2,3,6,7,12,12 а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]-пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил), 2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)фенил]-5-метил-7-пропил-3 Н-имидазо[5,1f][1,2,4]триазин-4-он (варденафил), 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он, 5-[2-этокси-5-(4-этилпиперазин 1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он,4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2 илметил)пиримидин-5-карбоксамид, 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1H-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(1-метилпиролидин-2-ил)этил]-4-пропоксибензолсульфонамид; альфа-2-дельта-лиганд такой как габапентин, прегабалин, 3-метилгабапентин (1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусная кислота, (3S,5R)-3-аминометил-5-метилгептановая кислота,(3S,5R)-3-амино-5-метилгептановая кислота (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3 хлорофенокси)пролин, (2S,4S)-4-(3-фторбензил)пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт 6-ил]уксусная кислота,3-(1-аминометилциклогексилметил)-4 Н-[1.2.4]оксадиазол-5-он,С-[1-(1 Нтетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, (3S,5R)-3-аминометил-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота,(3S,5R)-3-амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота и(3R,4R,5R)-3-амино-4,5-диметилоктановая кислота; антагонист метаботропного глутаматного рецептора подтипа 1 (mGluRl); ингибитор повторного поглощения серотонина, такой как сертралин, метаболит сертралина деметилсертралин, флуоксетин, норфлуоксетин (десметилметаболит флуоксетини), флувоксамин, пароксетин,циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, d,1-фенфлурамин, фемоксетин,ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин и тразодон; ингибитор повторного поглощения норадреналина (норэпинефрин), такой как мапротилин, лоферамин, минтазепин, оксапротилин, фезоламин, томоксетин, мианзерин, бупроприон, гидроксибупроприон метаболит бупроприона, номифензин и вилоксазин (Vivalan), особенно селективный ингибитор повторного поглощения норадреналина, такой как ребоксетин, в частности, (S,S)-ребоксетин; двойной ингибитор повторного поглощения серотонина-норадреналина, такой как венлафаксин, Одесметилвенлафаксин метаболит венлафаксина, кломпирамин, десметилкломпирамин метаболит кломпирамина, дулоксетин, милнаципран и имипрамин; индуцибельный ингибитор синтазы окиси азота (iNOS), такой как S-[2-[(l-иминоэтил)амино]этил]b-гомоцистеин, S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1-иминоэтил)амино]этил]2-метил-L-цистеин, (2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5-гептеновая кислота, 2-(1R,3S)3-амино-4-гидрокси-1-(5-тиазолил)-бутил]тио]-5-хлор-3-пиридинкарбонитрил; 2-(1R,3S)-3-амино-4 гидрокси-1-(5-тиазолил)бутил]тио]-4-хлоробензонитрил,(2S,4R)-2-амино-4-2-хлор-5-(трифторметил)фенил]тио]-5-тиазолбутанол, 2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил)-3-пиридинкарбонитрил,2-(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлоробензонитрил, N-[4-[2-(3-хлоробензиламино)этил]фенил]тиофен-2-карбоксамидин или гуанидиноэтилдисульфид; ингибитор ацетилхолинэстеразы, такой как донепезил; антагонист простагландина Е 2 подтипа 4 (ЕР 4), такой как N-[(2-[4-(2-этил-4,6-диметил-1 Н- 16023375[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбониламино)этил]бензойная кислота; ингибитор микросомальной простагландин Е синтазы тип 1 (mPGES-1); антагонист лейкотриена В 4; такой как 1-(3-бифенил-4-илметил-4-гидроксихроман-7 ил)циклопентанкарбоновая кислота (СР-105696), 5-[2-(2-карбоксиэтил)-3-[6-(4-метоксифенил)-5 Егексенил]оксифенокси]валериановая кислота (ONO-4057) илиБРС-11870 ингибитор 5-липоксигеназы, такой как зилеутон, 6-[(3-фтор-5-[4-метокси-3,4,5,6-тетрагидро-2 Нпиран-4-ил])феноксиметил]-1-метил-2-хинолин (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил)-1,4 бензохинон (CV-6504). Также включенными в пределы рамок представленного изобретения являются комбинации соединения изобретения вместе с одним или большим количеством дополнительных терапевтических агентов,которые замедляют скорость метаболизма соединения изобретения, таким образом, увеличивая действия в пациентах. Таким образом, повышение срока действия известно под названием усиление. Польза от этого заключается в увеличении эффективности соединения изобретения или уменьшении необходимой дозы для достижения того же эффекта как и в случае неусиленной дозы. Метаболизм соединения изобретения включает протекание окислительных процессов под действием Р 450 (CYP450) ферментов, в частности, CYP 3A4, и конъюгацию под действием UDP глюкоронозилтрансферазы и сульфатирующих ферментов. Таким образом, среди агентов, которые могут быть использованные для повышения действия на пациента соединения представленного изобретения, присутствуют агенты, которые могут действовать как ингибиторы, по крайней мере, одной изоформы ферментов цитохром Р 450 (CYP450). ИзоформамиCYP450, которые могут быть ингибированы с терапевтической целью, но не ограничивается ими, являются CYP1A2, CYP2D6, CYP2C9, CYP2C19 и CYP3A4. Пригодными агентами, которые могут быть использованы для ингибирования CYP 3A4, является ритонавир, саквинавир, кетоконазол, N-(3,4 дифторбензил)-N-метил-2-[(4-метоксипиридин-3-ил)амино]сульфонилбензамид и N-(1-(2-(5-(4-фторбензил)-3-(пиридин-4-ил)-1H-пиразол-1-ил)ацетил)пиперидин-4-ил) метансульфонамид. В пределах рамок изобретения, что две или больше фармацевтических композиций, по крайней мере, одна из которых содержит соединение изобретения, может легко совмещаться в форме набора пригодного для совместного введения композиций. Таким образом, набор изобретения содержит две или больше отдельных фармацевтических композиций, по крайней мере одна из которых содержит соединение изобретения, и средство для отдельного хранения упомянутых композиций, такое как контейнер,разделенная бутылочка или разделенный пакет из фольги. Примером такого набора является обычный блистер, который используется для упаковки таблеток, капсул и подобного. Набор, в соответствии с представленным изобретением, является особенно подходящим для введения разных лекарственных форм, например пероральной и парентеральной, для введения отдельных композиций с разными интервалами введения или для титрования отдельных композиций против друг друга. Для большего удобства,набор типично включает указания по введению и может быть снабжен так называемой памяткой. В другом аспекте изобретения, обеспечивается фармацевтический продукт (такой как в форме набора), который содержит соединение изобретения вместе с одним или больше дополнительных терапевтически активных агентов как объединенную композицию для одновременного, разделенного или последовательного использования при лечении расстройства, для которого показан модулятор NaV1.8. Понятно, что все ссылки здесь на лечение включают исцеляющее, смягчающее и профилактическое лечение. В неограничивающих примерах и приготовлениях, которые приведены далее в описании, и на приведенных выше схемах, могут использоваться следующие сокращения, определения и аналитические методики: АсОН - уксусная кислотаELSD - испаряющий детектор рассеивания света;WSCDI - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида. Изобретение иллюстрируется следующими показательными примерами. Спектр 1 Н ядерного магнитного резонанса (ЯМР) во всех случаях согласуется с предложенными структурами. Характеристические химические сдвигиприведены в миллионных долях ниже тетраметилсилана с использованием традиционных аббревиатур для обозначения основных пиков: например, с синглет; д - дублет; т - триплет; кв. квартет; м - мультиплет; шир. - широкий. Масс-спектры (МС) снимали с использованием или электроспрей ионизации (ESI), или химической ионизации, при атмосферном давлении (APCI). Использовали следующие аббревиатуры и химические формулы для традиционных растворителей: CDCl3 - дейтерохлороформ; D6-DMSO дейтеродиметилсульфоксид; CD3OD - дейтерометанол; ТГФ, тетрагидрофуран. ЖХМС означает жидкостную хроматографию/масспектрометрию (Rt = время удержания). Если указаны соотношения растворителей, они указаны как объемные соотношения. Некоторые соединения в примерах и приготовлениях очищали с использованием автоматической препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ). Условия ВЭЖХ с обратной фазой включали использования систем Fractionlynx. Образцы для анализа растворяли в 1 мл DMSO. В зависимости от природы соединения и результатов предыдущего анализа очистку проводили или в кислой среде ('А-ВЭЖХ'), или в щелочной среде ('В-ВЭЖХ') при температуре окружающей среды. Очистку в кислой среде проводили на колонке Sunfire Prep C18 OBD (1950 мм, 5 мкм), очистку в щелочной среде проводили на Xterra Prep MS C18 (1950 мм, 5 мкм), обе от компании Waters. Использовали скорость потока 18 мл/мин, с подвижной фазой А: вода + 0,1% модификатора (об/об) и В: ацетонитрил + 0,1% модификатора (об/об). Для очистки в кислой среде модификатором является муравьиная кислота,для очистки в щелочной среде модификатором является диэтиламин. Бинарный ЖХ насос Waters 2525 подавал подвижную фазу с составом 5% В в течение 1 мин, со следующим увеличением от 5 до 98% В в течение 6 мин, потом с выдержкой в течение 2 мин при 98% В. Детектирования осуществляли с использованием абсорбционного детектора Waters 2487 с двойной длиной волны, установленного на 225 нм, потом установленного в ряд с ним детектора Polymer Labs PLELS 2100 и установленного параллельно масспектрометра Waters ZQ 2000 4 way MUX. Детектор PL 2100ELSD был установлен на 30 С со скоростью подачи азота 1,6 л/мин. Масс-спектрометр Waters ZQ был настроен на следующие параметры: Пусковые сигналы для сбора фракций получали с помощью MS и ELSD. Анализ контроля качества осуществляли с использованием способа ЖХМС. Опыты в кислой среде проводили на Sunfire C18 (4,650 мм, 5 мкм), опыты в щелочной среде проводили на Xterra C18 (4,650 мм, 5 мкм), все оборудование от компании Waters. Использовали скорость потока 1,5 мл/мин с подвижной фазой А: вода + 0,1% модификатора (об/об) и В: ацетонитрил + 0,1% модификатора (об/об). Для опытов кислой среде модификатором является муравьиная кислота, для опытов в щелочной среде модификатором является диэтиламин. Использовали бинарные ЖХ насос Waters 1525 с градиентным элюированием от 5 к 95% В в течение 3 мин, потом выдерживали в течение 1 мин 95% В. Детекцию осуществляли с использованием абсорбционного детектора Waters MUX UV 2488, установленного на 225 нм, потом установленного в ряд с ним детектора Polymer Labs PL-ELS 2100 и установленного параллельно масспектрометра Waters ZQ 2000 4 way MUX. Детектор PL 2100 ELSD был установлен на 30 С со скоростью подачи азота 1,6 л/мин. Масс-спектрометр Waters ZQ был настроен на следующие параметры:ES- Напряжение в конусе: -30 В Капилляре: -2,50 кВ Десольватирующий газ: 800 л/ч Температура источника: 150 С. Интервал сканирования 160-900 Da За исключением проведения Auto-ВЭЖХ (при условиях А-ВЭЖХ или В-ВЭЖХ, как только что было описано), ЖХМС условия отвечают одним из приведенных ниже (где приведены соотношение растворителей и соотношения являются объемными): 6-Минутный ЖХ-МС градиент и настройка прибора Кислотные условия: А: 0,1% муравьиной кислоты в воде В: 0,1% муравьиной кислоты в ацетонитриле Колонка: С 18 phase Phenomenex Gemini 504,6 мм с размером частиц 5 мкм. Градиент: 95-5% А в течение 3 мин, 1 мин выдерживание, 1 мл/мин. УФ: 210 нм - 450 нм DAD. Температура: 50 С 2-Минутный ЖХ-МС градиент и настройка прибора Кислотные условия: А: 0,1% муравьиной кислоты в воде В: 0,1% муравьиной кислоты в ацетонитриле Колонка: С 18 phase Fortis Pace 202,1 мм с размером частиц 3 мкм. Градиент: 70-2% А в течение 1,8 мин, 0,2 мин выдерживание, 1,8 мл/мин. УФ: 210 нм - 450 нм DAD. Температура: 75 С С 18 30-Минутный ЖХ-МС градиент и настройка прибора А: 0,1% муравьиной кислоты в Н 2 О В: 0,1% муравьиной кислоты в MECN Колонка: PhenomenexC18 phase Gemini 1504,6 мм с размером частиц 5 мкм. Градиент: 98-2% А в течение 18 мин, 2 мин выдерживание, 1 мл/мин. УФ: 210 нм - 450 нм DAD. Температура: 50 С. Фенил-гексил 30-минутный ЖХ-МС градиент и настройка прибора А: 10 мМ ацетата аммония в Н 2 О В: 10 мМ ацетата аммония в метаноле Колонка: Phenomenex Phenyl Hexyl 1504,6 мм с размером частиц 5 мкм. Градиент: 98-2% А в течение 18 мин, 2 мин выдерживание, 1 мл/мин. УФ: 210 нм - 450 нм DAD. Температура: 50 С Если не указано другое, условия ВЭЖХ анализа отвечали нижеприведенным условиям: Ультракислотный способ с ВЭЖХ градиентом и настройка прибора Проводили ВЭЖХ-анализ, используя ультракислотный способ. Zorbax SB-C18 (3,050 мм, 1,8 мкм), поставляется Crawford scientific, с температурой колонки 50 С. Скорость потока 1,2 мл/мин с подвижной фазой А: вода + 0,05% TFA (об/об) и В: ацетонитрил. Насос Agilent 1100 LC прогонял градиент элюирования от 5% до 100% В в течение 3,5 мин со следующим 1 мин. выдерживанием 100% В. Пример 1. 3-(4-[4-(Трифторметокси)фенил]-1H-имидазол-2-илметил)тетрагидро-2 Н-пиран-3-амин[3-(4-[4-(трифторметокси)фенил]-1H-имидазол-2-илметил)тетрагидро-2 Н-пиран-3 ил]карбамату (приготовление 1, 0,120 г, 0,253 ммоль) в уксусной кислоте (1 мл) добавляли раствор HBr в уксусной кислоте (48%, 2 мл) и реакцию оставляли перемешиваться при комнатной температуре 1,5 часов и потом концентрировали в вакууме. Остаток азеотропировали с циклогексаном, получая оранжевое твердое вещество. Твердое вещество очищали на ионообменной колонке Isolute SCX, которую элюировали метанолом и потом 7 М аммиаком в метаноле, получая желтое масло. Масло дополнительно очищали препаративной ВЭЖХ (В-ВЭЖХ), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 2,16 мин. МС m/z 342 [МН]+ Способ В. Бензил (3-[4-(4-хлор-3-метилфенил)-1H-имидазол-2-ил]метилоксетан-3-ил)карбамат (приготовление 3, 0,150 г, 0,364 ммоль) растворяли в метаноле (5 мл) и гидрировали при 50 С на 20% Pd(OH)2 на угле CATCART (30 мм), поставляется Thales Nanotechnology Inc, используя гидрогенатор Thales Nanotechnology Inc HC2, и скорости потока 1 мл/мин и давлении 1 бар. Реакцию концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (А-ВЭЖХ), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 1,99 мин. МС m/z 278 [МН]+ Следующие примеры 3-6 получали по способам, аналогичным способам А и В, как описано для примеров 1 и 2 выше. Если не указано другое, детали получения являются такими, как описано для способа, на который ссылаются. Пример 3. 3-(4-[4-(Трифторметокси)фенил]-1 Н-имидазол-2-илметил)тетрагидрофуран-3-амин Получали по способу А, используя бензил [3-(4-[4-(трифторметокси)фенил]-1H-имидазол-2 илметил)тетрагидрофуран-3-ил]карбамат (приготовление 2, 0,132 г, 0,286 ммоль), но без необходимости начальной очистки с помощью ионообменной колонки Isolute SCX, получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 2,23 мин. МС m/z 328 [МН]+ Пример 4. 3-(4-[4-(Трифторметил)фенил]-1H-имидазол-2-ил]метил)оксетан-3-амин Получали по способу В, используя бензил [3-(4-[4-(трифторметил)фенил]-1H-имидазол-2 илметил)оксетан-3-ил]карбамат (приготовление 5, 0,135 г, 0,310 ммоль), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 2,15 мин. МС m/z 298 [МН]+ Пример 5. 3-(4-[4-(Дифторметокси)фенил]-1 Н-имидазол-2-ил]метил)оксетан-3-амин Получали по способу В, используя бензил [3-(4-[4-(дифторметокси)фенил]-1H-имидазол-2 илметил)оксетан-3-ил]карбамат (приготовление 6, 0,133 г, 0,310 ммоль). Очищали препаративной ВЭЖХ (В-ВЭЖХ), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 2,30 мин. МС m/z 296 [МН]+ Пример 6. 3-(4-[4-(Пентафтор-6-сульфанил)фенил]-1H-имидазол-2-ил]метил)оксетан-3-амин Получали по способу В, используя бензил [3-(4-[4-(пентафтор-6-сульфанил)фенил]-1H-имидазол 2-илметил)оксетан-3-ил]карбамат (Приготовление 7, 0,100 г, 0,204 ммоль). Очищали препаративной ВЭЖХ (В-ВЭЖХ), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 2,31 мин. МС m/z 356 [МН]+ Пример 7. 4-(4-[4-(Трифторметокси)фенил]-1H-имидазол-2-ил]метил)тетрагидро-2 Н-пиран-4-амин К трет-бутил [4-(4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илметил)-тетрагидро-2 Н-пиран-4 ил]карбамату (приготовление 4, 0,166 г, 0,376 ммоль) добавляли 4 М хлороводород в 1,4-диоксане (3 мл) и реакцию оставляли перемешиваться при комнатной температуре 18 ч и потом концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (А-ВЭЖХ), получая указанное в заглавии соединение. ЖХМС (кислотный QC способ) Rt = 1,98 мин. МС m/z 342 [МН]+ Пример 8. 3-(4-[4-(Трифторметокси)фенил]-1 Н-имидазол-2-илметил)оксетан-3-амин Бензил [3-(4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илметил)оксетан-3-ил]-карбамат (приготовление 11, 311 г, 695 ммоль) растворяли в метаноле (3,2 л). Добавляли 5% палладий на угле Е 105 R/W(EVONIK) (22 г, 7 мас.%) и реакцию гидрировали при 40 С, 100 фунтов/дюйм в течение 18 ч. Контролировали поглощение водорода и реакция завершалась через 4 ч. Смесь охлаждали до комнатной температуры и фильтровали через Arbocel. Остаток на фильтре промывали метанолом (21 л) и фильтрат концентрировали в вакууме, получая твердое вещество. Твердое вещество растворяли в этилацетате (1 л) и фильтровали через таблетку из угля, для удаления следов палладия. Раствор нагревали до 50 С и добавляли гептан (1 л). Раствор медленно охлаждали и при 40 С наблюдали кристаллизацию. Смесь перемешивали при комнатной температуре 72 ч. Твердое вещество собирали фильтрованием и промывали этилацетат : гептан (1:1, 250 мл). Твердое вещество сушили в вакууме при 40 С в течение 18 ч, получая указанное в заглавии соединение, как кристаллическое твердое вещество. ВЭЖХ (ультракислотный способ) Rt = 1,996 мин. Пример 9. 3-(1-4-[4-(Трифторметокси)фенил]-1 Н-имидазол-2-илэтил)оксетан-3-амин К раствору 2-метил-N-[3-(1-4-[4-(трифторметокси)фенил]-1H-имидазол-2-илэтил)оксетан-3 ил]пропан-2-сульфинамида (Приготовление 9, 0,320 г, 0,74 ммоль) в метаноле (4 мл) при 0 С добавляли 4 М хлороводород в 1,4-диоксане (4 мл) и реакцию оставляли перемешиваться 2 ч. К реакции добавляли твердый гидрокарбонат натрия и потом насыщенный водный раствор гидрокарбоната натрия. Смесь экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение Рацемический 3-(1-4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илэтил)оксетан-3-амин (пример 9, 0,243 г, 0,743 ммоль) растворяли в этаноле (1 мл). Энантиомеры разделяли хиральной препаративной ВЭЖХ при основных условиях при комнатной температуре на колонке Chiralpak AD-H (250, 20 мм в.д),поставляется Daicel Chemical Industries. Использовали скорость потока 18 мл/мин для подвижной фазы А: гептан и В: IPA + 0,1% диэтиламин (об/об). Два насоса Agilent 1200 prep заполняли подвижной фазой с составом 20% В. Время прогонки было 10 мин на инъекцию с объемом 0,1 мл. Проводили детектирование, используя поливолновой детектор УФ абсорбции Agilent 1200 с настройкой 220 нм. Энантиомер 1: Rt = 5,89 мин. 99,5% ее (58 мг, 24%) Энантиомер 2: Rt = 8,42 мин. 99,5% ее (89 мг, 37%) Энантиомер 1: 1 Н-ЯМР (CDCl3):1,35 (д, 3 Н), 3,21 (с, 2 Н), 3,64 (к, 1H), 4,39 (д, 1H), 4,43 (д, 1H),4,52 (д, 1H), 4,66 (д, 1H), 7,13-7,22 (м, 3 Н), 7,75 (ш с, 2 Н). Энантиомер 2: 1 Н-ЯМР (CDCl3):1,35 (д, 3 Н), 3,21 (с, 2 Н), 3,64 (к, 1H), 4,39 (д, 1H), 4,43 (д, 1H),4,52 (д, 1H), 4,66 (д, 1H), 7,13-7,22 (м, 3 Н), 7,75 (ш с, 2 Н). Пример 12. 3-(1-4-[4-(Трифторметил)фенил]-1H-имидазол-2-илэтил)оксетан-3-амин Бензил [3-(1-4-[4-(трифторметил)фенил]-1 Н-имидазол-2-илэтил)оксетан-3-ил]карбамат (приготовление 8, 0,95 г, 2,13 ммоль) растворяли в метаноле (20 мл) и гидрировали при комнатной температуре и 100 фунтов/дюйм. Реакционную смесь потом фильтровали через Arbocel и полученный фильтрат концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение, как твердое вещество (0,42 г, 63%). ЖХМС (2 мин) Rt = 0,75 мин. МС m/z 312 [МН+], 310 [МН]Примеры 13 и 14. 3-[(1S)-1-4-[4-(Трифторметил)фенил]-1H-имидазол-2-илэтил]оксетан-3-амин и 3-[(1R)-1-4-[4-(трифторметил)фенил]-1H-имидазол-2-илэтил]оксетан-3-амин Рацемический 3-(1-4-[4-(трифторметил)фенил]-1H-имидазол-2-илэтил)оксетан-3-амин (пример 12, 0,410 г, 1,32 ммоль) растворяли в этаноле (8,2 мл). Энантиомеры разделяли хиральной препаративной ВЭЖХ при основных условиях при комнатной температуре на колонке Chiralpak AD-H (250, 21,2 мм в.д), поставляется Daicel Chemical Industries. Использовали скорость потока 18 мл/мин для подвижной фазы: 70% гептана + 30% ИРА + 0,3% диэтиламина (об/об), дополненную насосом Agilent 1200 prep. Использовали инъекцию объемом 1 мл на прогон. Проводили детектирование, используя поливолновой детектор УФ абсорбции Agilent 1200 с настройкой 220 нм и 254 нм. Энантиомер 1: Rt = 4,85 мин. 99,5% ее (144 мг, 35%) Энантиомер 2: Rt = 5,89 мин. 97,6% ее (142 мг, 35%) Энантиомер 1: 1 Н-ЯМР (d6-DMSO):1,25 (м, 3 Н), 3,35 (м, 1H), 4,23 (м, 1H), 4,30 (м, 1H), 4,43 (м,2H), 7,63 (м, 3 Н), 7,90 (м, 2 Н). Энантиомер 2: 1 Н-ЯМР (d6-DMSO):1,25 (м, 3 Н), 3,35 (м, 1H), 4,23 (м, 1H), 4,30 (м, 1H), 4,43 (м,2 Н), 7,63 (м, 3 Н), 7,90 (м, 2 Н). Пример 15. 3-(1-4-[4-(Трифторметокси)фенил]-1 Н-имидазол-2-илпропил)оксетан-3-амин К раствору 2-метил-N-[3-(1-4-[4-(трифторметокси)фенил]-1H-имидазол-2-илпропил)оксетан-3 ил]пропан-2-сульфинамида (приготовление 10, 0,450 г, 1,01 ммоль) в метаноле (5 мл) при 0 С добавляли 4 М хлороводород в 1,4-диоксане (1 мл) и реакцию оставляли перемешиваться 4 ч. К реакции добавляли твердый гидрокарбонат натрия и потом насыщенный водный раствор гидрокарбоната натрия. Смесь экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение Рацемический3-(1-4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илпропил)оксетан-3-амин (пример 15, 0,145 г, 1,01 ммоль) растворяли в смеси 70% гептана и 30% IPA (3 мл). Энантиомеры разделяли хиральной препаративной ВЭЖХ при основных условиях при комнатной температуре на колонке Chiralpak AD-H (250, 20 мм в.д), поставляется Daicel Chemical Industries. Использовали скорость потока 1 мл/мин с подвижной фазой: 90% гептана + 10% IPA + 0,1% диэтиламина (об/об), высвобождаемой насосом Waters 515 HPLC prep в течение времени прогонки 20 мин. Проводили детектирование, используя детектор УФ абсорбции Agilent 119 (UV), и потом расположенные в ряд детектор Polymer Labs PL-ELS 2100 (ELSD) и микромасспектрометр Waters ZQ (MC). Энантиомер 1: Rt = 7,95 мин. MC m/z 342 [MH]+ Энантиомер 2: Rt = 10,39 мин. MC m/z 342 [MH]+ Проводили QC анализ при основных условиях при комнатной температуре на колонке ChiralpakAD-H (250, 10 мм в.д), поставляется Daicel Chemical Industries. Использовали скорость потока 1 мл/мин с подвижной фазой: 80% гептана + 20% IPA + 0,2% диэтиламина (об/об) в течение 10 мин прогонки. Проводили детектирование, используя детектор Agilent 100 (DAD) и потом расположенные в ряд детектор Polymer Labs PL-ELS 2100 (ELSD) и микромасспектрометр Waters ZQ (MC). Энантиомер 1: Rt = 4,58 мин. MC m/z 342 [MH]+ 99/5% ее Энантиомер 2: Rt = 5,26 мин. MC m/z 342 [MH]+ 99/5% ее Приготовление 1. Бензил [3-(4-[4-(трифторметокси)фенил]-1H-имидазол-2-ил]метил)тетрагидро-2 Н-пиран-3-ил]карбамат Способ С. Ацетат аммония (1,58 г, 20,5 ммоль) суспендировали в безводном толуоле (10 мл) и нагревали при 100 С до полного растворения. К реакции добавляли раствор 2-оксо-2-[4-(трифторметокси)фенилэтил(3-[(бензилокси)карбонил]аминотетрагидро-2 Н-пиран-3-ил)ацетата (приготовление 20, 1,11 г, 2,046 ммоль) в безводном толуоле (10 мл). Температуру повышали до 120 С и реакцию кипятили с обратным холодильником в течение 2,5 ч. После охлаждения реакцию разделяли между дихлорметаном (35 мл) и водой (5 мл). Органический слой отделяли с помощью фазоразделяющего картриджа и концентрировали в вакууме, получая масло. Масло очищали колонковой хроматографией на силикагеле (0-50% этилацетата в гептане, градиент элюирования), получая указанное в заглавии соединение, как желтое масло (0,48 г,49% выход). 1 Н-ЯМР (CDCl3):1,45 (м, 2 Н), 1,7 (м, 1H), 2,2 (м, 1H), 2,85 (д, 1H), 3,35 (м, 3 Н), 3,75 (м, 1H), 3,85(3-[(бензилокси)карбонил]аминотетрагидрофуран-3 ил)ацетат (приготовление 13, 0,634 г, 1,317 ммоль), ацетат аммония (1,9 г, 25 ммоль) и молекулярные сита (3 А) суспендировали в безводном толуоле (5 мл) и нагревали при 110 С в течение 18 ч. После охлаждения реакцию разделяли между дихлорметаном (35 мл) и водой (5 мл) Органический слой отделяли с помощью фазоразделяющего картриджа и концентрировали в вакууме, получая масло. Реакцию не завершилась согласно 2 мин ЖХМС анализа, потому масло, ацетат аммония (1,5 г, 19 ммоль) и молекулярные сита (3 А) помещали в бутылочку для микроволновки с безводным толуолом (5 мл) и нагревали при 150 С в течение 1 ч в микроволновой печи Biotage Initiator. После охлаждения реакцию разделяли между дихлорметаном (35 мл) и водой (5 мл) Органический слой отделяли с помощью фазоразделяющего картриджа и концентрировали в вакууме, получая масло. Масло очищали колонковой хроматографией на силикагеле (0-100% этилацетата в гептане, градиент элюирования), получая указанное в заглавии соединение, как желтое масло (0,132 г, 22% выход). ЖХМС (2 мин) Rt = 1,30 мин. МС m/z 462 [МН]+, 460 [МН]Следующие приготовления 3-8 получали по способам, аналогичным способам С и D, как описано для приготовлений 1 и 2 выше. Если не указано другое, детали получения являются такими как описано для способа, на который ссылаются. Приготовление 3. Бензил (3-[4-(4-хлор-3-метилфенил)-1 Н-имидазол-2-ил]метилоксетан-3-ил)карбамат Получали по способу С, используя 2-(4-хлор-3-метилфенил)-2-оксоетил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат (приготовление 12, 0,488 г, 1,13 ммоль). Смесь разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение[4-(4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илметил)тетрагидро-2 Н-пиран-4 ил]карбамат Получали по способу D, используя 2-оксо-2-[4-(трифторметокси)фенилэтил 4-[(третбутоксикарбонил)амино]тетрагидро-2 Н-пиран-4-илацетат (приготовление 19, 0,485 г, 1,051 ммоль). Остаток очищали колонковой хроматографией на силикагеле (0-100% этилацетата + 3% триэтиламина(0,166 г, 36% выход). ЖХМС (2 мин) Rt = 1,25 мин. МС m/z 442 [МН]+, 440 [МН]Приготовление 5. Бензил [3-(4-[4-(трифторметил)фенил]-1 Н-имидазол-2-илметил)оксетан-3-ил]карбамат Получали по способу С, используя 2-оксо-2-[4-(трифторметил)фенилэтил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат (приготовление 14, 0,510 г, 1,13 ммоль). Смесь разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение(0,273 г, 56% выход). ЖХМС (2 мин) Rt = 1,32 мин. МС m/z 432 [МН]+ Приготовление 6. Бензил [3-(4-[4-(дифторметокси)фенил]-1H-имидазол-2-ил]метил)оксетан-3-ил]карбамат Получали по способу С, используя 2-[4-(дифторметокси)фенил]-2-оксоетил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат (приготовление 15, 0,508 г, 1,13 ммоль). Смесь разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение(0,269 г, 56% выход). ЖХМС (2 мин) Rt = 1,13 мин. МС m/z 430 [МН]+ Приготовление 7. Бензил [3-(4-[4-(пентафтор-6-сульфанил)фенил]-1H-имидазол-2-ил]метил)оксетан-3-ил]карбамат Получали по способу С, используя 2-оксо-2-[4-(пентафтор-6-сульфанил)фенил]этил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат (приготовление 18, 0,9 г, 1,77 ммоль). Реакцию кипятили с обратным холодильником 18 ч. Смесь разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (0,227 г, 26% выход). 1 Н-ЯМР (CDCl3):3,50 (с, 2 Н), 4,70 (д, 2 Н), 4,85 (д, 2 Н), 5,10 (с, 2 Н), 5,80 (ш с, 1H), 7,3-7,45 (м, 8 Н),- 24023375 7,65-7,8 (м, 3 Н). ЖХМС (2 мин) Rt = 1,44 мин. МС m/z 490 [МН]+, 512 [MNa]+, 488 [МН]Приготовление 8. Бензил [3-(1-4-[4-(трифторметил)фенил]-1H-имидазол-2-илэтил)оксетан-3-ил]карбамат Получали по способу С,используя 2-оксо-2-[4-(трифторметил)фенилэтил 2-(3[(бензилокси)карбонил]аминооксетан-3-ил)пропаноат (приготовление 22, 2,15 г, 4,62 ммоль). Реакцию кипятили с обратным холодильником 12 ч. Смесь разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (0,983 г, 48% выход). ЖХМС (2 мин) Rt = 0,97 мин. МС m/z 446 [МН]+, 444 [МН]Приготовление 9. 2-Метил-N-[3-(1-4-[4-(трифторметокси)фенил]-1H-имидазол-2-илэтил)оксетан-3-ил]пропан-2 сульфинамид 2-Оксо-2-[4-(трифторметокси)фенилэтил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илпропаноат (Приготовление 16, 1,4 г, 3,10 ммоль) и ацетат аммония (2,44 г, 31,0 ммоль) кипятили с обратным холодильником в толуоле (40 мл) при 130 С в течение 18 ч. После охлаждения добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над MgSO4, потом концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (0,323 г, 24% выход). ЖХМС (2 мин) Rt = 1,40 мин. МС m/z 432 [МН]+, 430 [МН]Приготовление 10. 2-Метил-N-[3-(1-4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илпропил)оксетан-3-ил]пропан-2 сульфинамид 2-Оксо-2-[4-(трифторметокси)фенилэтил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илбутаноат (приготовление 17, 3,4 г, 7,3 ммоль) и ацетат аммония (5,74 г, 73,0 ммоль) кипятили с обратным холодильником в толуоле (40 мл) при 130 С в течение 18 ч. После охлаждения добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над MgSO4, потом концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (2,527 г, 78% выход). ЖХМС (2 мин) Rt = 1,52 мин. МС m/z 446 [МН]+, 444 [МН]ЖХМС (6 мин кислотные) Rt = 2,30 мин. МС m/z 446 [МН]+, 444 [МН]Приготовление 11. Бензил [3-(4-[4-(трифторметокси)фенил]-1 Н-имидазол-2-илметил)оксетан-3-ил]карбамат Ацетат аммония (1,22 кг, 15 моль) перемешивали в толуоле (12 л) и нагревали при 100 С в течение 30 мин до расплавления твердого вещества. Быстро добавляли раствор 2-оксо-2-[4(трифторметокси)фенилэтил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетата (приготовление 21, 700 г, 1,5 моль) в толуоле (2 л) и температуру поднимали до 130 С и нагревали с интенсивным кипением в течение 4 ч. Реакцию охлаждали до комнатной температуры, добавляли воду (4 л) и смесь перемешивали в течение 10 мин и потом оставляли стоять 2 ч. Органический слой отделяли и концентрировали в вакууме, получая густое оранжевое масло. Добавляли дихлорметан (5 л) и раствор осторожно перемешивали, медленно вращая на роторе в течение 72 ч. Наблюдали образование белого осадка. Объем раствора уменьшали в вакууме до 1 л и смесь фильтровали через Arbocel. Желатинообразное вещество промывали дихлорметаном (2 л) и фильтрат концентрировали в вакууме, получая темно оранжевое подвижное масло. Масло очищали колонковой хроматографией на силикагеле, который элюировали третбутилметиловым эфиром, получая указанное в заглавии соединение, как светло-оранжевое масло (311 г,46% выход). ВЭЖХ (ультракислотный способ) Rt = 2,532 мин. Приготовление 12. 2-(4-Хлор-3-метилфенил)-2-оксоетил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат Способ Е.(3-[(Бензилокси)карбонил]аминооксетан-3-ил)уксусную кислоту (приготовление 25, 0,3 г, 1,13 ммоль), 2-бром-1-(4-хлор-3-метилфенил)этанон (0,294 г, 1,19 ммоль) и карбонат цезия (0,553 г, 1,70 ммоль) перемешивали в ацетонитриле (10 мл) при комнатной температуре 2 ч. Реакцию концентрировали в вакууме и разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая указанное в заглавии соединение, которое использовали без очистки на следующей стадии. ЖХМС (2 мин) Rt = 1,70 мин. МС m/z 432 [МН]+, 454 [MNa]+, 430 [МН]Приготовление 13. 2-Оксо-2-[4-(трифторметокси)фенилэтил(3-[(Бензилокси)карбонил]аминотетрагидрофуран-3-ил)уксусную кислоту (приготовление 24,0,311 г, 1,11 ммоль) и триэтиламин (0,233 мл, 1,67 ммоль) перемешивали в ацетоне (4 мл). Добавляли раствор 2-бром-1-[4-(трифторметокси)фенил]этанона (0,315 г, 1,11 ммоль) в ацетоне (4 мл) и реакцию нагревали при 50 С 1 ч. Наблюдали быстрое образование белого осадка. Реакцию разделяли между дихлорметаном и водой. Органический слой отделяли с помощью фазоразделяющего картриджа и концентрировали в вакууме, получая указанное в заглавии соединение, как масло, которое использовали без очистки на следующей стадии (0,634 г, 118% выход). ЖХМС (2 мин) Rt = 1,73 мин. МС m/z 482 [МН]+, 504 [MNa]+, 480 [МН]Следующие приготовления 14-20 получали по способам, аналогичным способам Е и F, как описано для приготовлений 12 и 13 выше. Если не указано другое, детали получения являются такими, как описано для способа, на который ссылаются. Приготовление 14. 2-Оксо-2-[4-(трифторметил)фенилэтил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат Получали по способу Е, используя (3-[(бензилокси)карбонил]аминооксетан-3-ил)уксусную кислоту (приготовление 25, 0,3 г, 1,13 ммоль) и 2-бром-1-[4-(трифторметил)фенил]этанон (0,317 г, 1,19 ммоль), получая указанное в заглавии соединение. ЖХМС (2 мин) Rt = 1,68 мин. МС m/z 452 [МН]+, 474 [MNa]+, 450 [МН]Приготовление 15. 2-[4-(Дифторметокси)фенил]-2-оксоетил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат Получали по способу Е, используя (3-[(бензилокси)карбонил]аминооксетан-3-ил) уксусную кислоту (приготовление 25, 0,3 г, 1,13 ммоль) и 2-бром-1-[4-(дифторметокси)фенил]этанон (0,315 г, 1,19 ммоль), получая указанное в заглавии соединение. ЖХМС (2 мин) Rt = 1,63 мин. МС m/z 472 [MNa]+, 448 [МН]Приготовление 16. 2-Оксо-2-[4-(трифторметокси)фенилэтил 2-3-[(трет-бутилсульфинил)амино]оксетан-3 илпропаноат Получали по способу Е, используя 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илпропановую кислоту (приготовление 26, 1,18 г, 4,733 ммоль) и 2-бром-1-[4-(трифторметокси)фенил]этанон (1,47 г,5,21 ммоль). Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (1,413 г, 66% выход). ЖХМС (2 мин) Rt = 1,65 мин. МС m/z 452 [МН]+, 474 [MNa]+, 450 [МН]Приготовление 17. 2-Оксо-2-[4-(трифторметокси)фенилэтил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илбутаноат Получали по способу Е, используя 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илбутановую кислоту (Приготовление 27, 2,658 г, 10,1 ммоль) и 2-бром-1-[4-(трифторметокси)фенил]этанон (3,14 г, 11,1 ммоль). Реакцию перемешивали при комнатной температуре 3 ч. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение (3,435 г, 73% выход). ЖХМС (2 мин) Rt = 1,68 мин. МС m/z 466 [МН]+, 464 [МН]Приготовление 18. 2-Оксо-2-[4-(пентафтор-6-сульфанил)фенилэтил(3-[(бензилокси)карбонил]аминооксетан-3 ил)ацетат Получали по способу Е, используя (3-[(бензилокси)карбонил]аминооксетан-3-ил) уксусную кислоту (Приготовление 25, 0,647 г, 2,44 ммоль) и 2-бром-1-[4-(пентафтор-6-сульфанил)фенил]этанон(Приготовление 40, 0,793 г, 2,44 ммоль), получая указанное в заглавии соединение. ЖХМС (2 мин) Rt = 1,74 мин. МС m/z 510 [МН]+, 532 [MNa]+ Приготовление 19. 2-Оксо-2-[4-(трифторметокси)фенилэтил [4-[(трет-бутоксикарбонил)амино]тетрагидро-2 Н-пиран 4-ил]ацетат Получали по способу F, используя 4-[(трет-бутоксикарбонил)амино]тетрагидро-2 Н-пиран-4 илуксусную кислоту (0,259 г, 1,00 ммоль) и 2-бром-1-[4-(трифторметокси)фенил]этанон (0,283 г, 1,00 ммоль). Реакцию перемешивали 50 С в течение 50 мин. Остаток выделяли как неочищенное масло, которое кристаллизуется, обеспечивая указанное в заглавии соединение, как твердое вещество (0,485 г, 105% выход). ЖХМС (2 мин) Rt = 1,73 мин. МС m/z 484 [MNa]+, 460 [МН]Приготовление 20. 2-Оксо-2-[4-(трифторметокси)фенилэтил (3-[(бензилокси)карбонил]аминотетрагидро-2 Н-пиран 3-ил)ацетат Получали по способу F, используя (3-[(бензилокси)карбонил]аминотетрагидро-2 Н-пиран-3 ил)уксусную кислоту (приготовление 23, 0,6 г, 2,05 ммоль) и 2-бром-1-[4-(трифторметокси)фенил]этанон(0,579 г, 0,205 ммоль). Реакцию перемешивали при 50 С в течение 1,5 ч. ЖХМС (2 мин) Rt = 1,75 мин. МС m/z 496 [МН]+, 518 [MNa]+, 494 [МН]Приготовление 21. 2-Оксо-2-[4-(трифторметокси)фенилэтил (3-[(бензилокси)карбонил]аминооксетан-3-ил)ацетат(1,08 кг, 3,81 моль) потом триэтиламин (585 мл, 4,19 моль). Реакция сначала полностью растворялась, но потом наблюдалось образование осадка. Реакцию промывали водой (24 л), потом концентрировали в вакууме, получая указанное в заглавии соединение, как подвижное оранжевое масло (1,903 кг, 107%,содержит остаточный этилацетат). ВЭЖХ (ультракислотный способ) Rt = 3,290 мин. Приготовление 22. 2-Оксо-2-[4-(трифторметил)фенилэтил 2-(3-[(бензилокси)карбонил]аминооксетан-3-ил)пропаноат 2-(3-[(Бензилокси)карбонил]аминооксетан-3-ил)пропановую кислоту (приготовление 28, 1,5 г,5,37 ммоль) и триэтиламин (1,12 мл, 8,06 ммоль) перемешивали в этилацетате (50 мл). Добавляли 2 бром-1-[4-(трифторметил)фенил]этанон (1,51 г, 5,64 ммоль) и реакцию перемешивали при комнатной температуре на протяжении ночи. Реакционную смесь разводили этилацетатом и промывали рассолом. Органический слой отделяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение, как масло (2,19 г, 88%). 1 Н-ЯМР (CDCl3):1,43 (м, 3 Н), 3,40 (м, 1H), 4,70 (м, 2 Н), 4,80 (м, 1H), 4,90 (м, 1H), 5,10 (м, 2 Н),5,35 (м, 2 Н), 6,05 (ш с, 1H), 7,35 (м, 5 Н), 7,80 (м, 2 Н), 8,00 (м, 2 Н). Приготовление 23. (3-[(Бензилокси)карбонил]аминотетрагидро-2 Н-пиран-3-ил)уксусная кислота Способ G. Этил (3-аминотетрагидро-2 Н-пиран-3-ил)ацетат (приготовление 32, 1,33 г, 7,109 ммоль), бензилхлорформиат (1,53 г, 8,53 ммоль) и N,N-диизопропилетиламин (3,72 мл, 21,3 ммоль) перемешивали в безводном ацетонитриле (30 мл) в течение 18 ч при комнатной температуре. Реакцию концентрировали в вакууме и потом разделяли между этилацетатом и водой. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, который элюировали гептан : этилацетат : метанол (100:0:0 - 0:90:10). Выделенное масло потом растворяли в метаноле(10 мл) и 1 М водном растворе гидроксида натрия (10 мл) и нагревали при 75 С в течение 18 ч. Метанол удаляли в вакууме и смесь разделяли между дихлорметаном (10 мл) и водой. Водный слой подкисляли 2 М водным хлороводородом и экстрагировали дихлорметаном (410 мл). Органический слой сушили над MgSO4, получая указанное в заглавии соединение, как масло (0,6 г, 29% выход после 2 стадий). 1 Н-ЯМР (CDCl3):1,5-1,6 (м, 1H), 1,6-1,7 (м, 1H), 1,7-1,8 (м, 1H), 2,3 (м, 1H), 2,7 (ш м, 1H), 3,0 (ш м,1H), 3,5-3,6 (м, 2 Н), 3,8 (м, 1H), 3,9 (д, 1H), 5,1 (с, 2 Н), 7,35-7,40 (м, 5 Н). ЖХМС (2 мин) Rt = 1,34 мин. МС m/z 292 [МН]-, 316 [MNa]+ Следующее приготовление 24 получали по способу, аналогичному способу G, как описано для приготовления 23 выше. Если не указано другое, детали получения являются такими как описано для способа, на который ссылаются. Приготовление 24.(3-[(Бензилокси)карбонил]аминотетрагидрофуран-3-ил)уксусная кислота Получали по способу, G используя этил (3-аминотетрагидрофуран-3-ил)ацетат (приготовление 31,1,43 г, 8,25 ммоль), получая указанное в заглавии соединение, как масло (0,311 г, 14% выход после 2 стадий). ЖХМС (2 мин) Rt = 1,26 мин. МС m/z 278 [МН]-, 302 [MNa]+ Приготовление 25.(3-[(Бензилокси)карбонил]аминооксетан-3-ил)уксусная кислота Перемешивали трет-бутилметиловый эфир (2,5 л) и водный раствор карбоната натрия (750 г в 2,2 л воды, 7,07 моль). К реакции добавляли этил (3-аминооксетан-3-ил)ацетат (приготовление 30, 875 г, 5,5 моль) и потом еще трет-бутилметиловый эфир (2,5 л). Реакцию охлаждали до 5 С и контролируемым образом добавляли бензилхлорформиат (1,21 кг, 7,09 моль), так что температура не превышала 20 С. Наблюдали образование осадка, потому для растворения реакции к смеси добавляли еще воду (5 л) и трет-бутилметиловый эфир (1,5 л). Бифазную смесь разделяли. Органический слой подщелачивали 2 М водным раствором гидроксида натрия (3,5 л) и интенсивно перемешивали 18 ч. Водный слой отделяли и оставшийся органический слой промывали водой (1,5 л). Водные слои объединяли и охлаждали до 15 С. Добавляли изопропилацетат (5 л) и потом контролируемым образом добавляли 6 М водный раствор хлороводорода (1,2 л), поддерживая температуру ниже 17 С. Реакцию перемешивали 30 мин. В реакторе образовывался кристаллический осадок, потому его растворяли в смеси этилацетата и метанола (20 л). Раствор перемешивали при комнатной температуре 18 ч. Реакцию концентрировали в вакууме, получая(5 л) и суспензию нагревали до кипения, получая оранжевый раствор. Раствор охлаждали до 50 С и добавляли гептан (2,5 л). Наблюдали образование густой суспензии, которую перемешивали при комнатной температуре 18 ч. Твердое вещество фильтровали и сушили на стеклянном фильтре 3 ч и потом сушили в вакууме при 40 С в течение 18 ч, получая указанное в заглавии соединение, как белое кристаллическое вещество (1,07 кг, 73% выход). 1 Н-ЯМР (CDCl3):3,1 (м, 2 Н), 4,6 (м, 2 Н), 4,7 (м, 2 Н), 5,1 (м, 2 Н), 7,2-7,4 (м, 5 Н). Приготовление 26. 2-3-[(трет-Бутилсульфинил)амино]оксетан-3-илпропановая кислота Метил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илпропаноат (приготовление 33, 1,25 г, 4,746 ммоль) перемешивали в метаноле (15 мл) и 1 М водном растворе гидроксида натрия (15 мл) в течение 3 ч при комнатной температуре. Реакцию концентрировали в вакууме и разделяли между диэтиловым эфиром и водой. рН водного слоя доводили до рН 3 гидросульфатом калия и экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая указанное в заглавии соединение, которое использовали без очистки на следующей стадии. Приготовление 27. 2-3-[(трет-Бутилсульфинил)амино]оксетан-3-илбутановая кислота Метил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илбутаноат (приготовление 35, 2,89 г, 10,42 ммоль) перемешивали в метаноле (30 мл) и 1 М водном растворе гидроксида натрия (30 мл) в течение 18 ч при комнатной температуре. Реакцию концентрировали в вакууме и разделяли между диэтиловым эфиром и водой. рН водного слоя доводили до рН 3 гидросульфатом калия и экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая указанное в заглавии соединение, которое использовали без очистки на следующей стадии. Приготовление 28. 2-(3-[(Бензилокси)карбонил]аминооксетан-3-ил)пропановая кислота Этил 2-(3-[(бензилокси)карбонил]аминооксетан-3-ил)пропаноат (приготовление 29, 43 г, 140 ммоль) перемешивали в метаноле (200 мл) и 1 М водном растворе гидроксида натрия (200 мл) в течение 18 ч при комнатной температуре. Реакцию концентрировали в вакууме и разделяли между диэтиловым эфиром и водой. рН водного слоя доводили до рН 3 гидросульфатом калия и экстрагировали дихлорметаном. Органический слой сушили над MgSO4 и концентрировали в вакууме, получая указанное в заглавии соединение, которое использовали без очистки на следующей стадии. Приготовление 29. Этил 2-(3-[(бензилокси)карбонил]аминооксетан-3-ил)пропаноат К раствору этил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илпропаноата (приготовление 34, 40 г, 140 ммоль) в метаноле (400 мл) при 0 С добавляли 4 М раствор хлороводорода в 1,4-диоксане (72 мл). Через 2 ч каплями добавляли 4 М водный раствор гидроксида натрия (400 мл) до рН 7, поддерживая температуру на 0 С. Метанол удаляли в вакууме. Полученный раствор перемешивали с тетрагидрофураном(150 мл) и 1 М водным раствором гидрокарбоната натрия (180 мл) при 0 С. Добавляли бензилхлорформиат (33,7 г, 187 ммоль) и реакционную смесь перемешивали при комнатной температуре 18 ч. Органическую часть удаляли в вакууме и полученный раствор экстрагировали дихлорметаном. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение. Приготовление 30. Этил (3-аминооксетан-3-ил)ацетат Этил оксетан-3-илиденацетат (приготовление 38, 781 г, 5,49 моль) растворяли в 2 М аммиаке в этаноле (8,24 л) и нагревали при 100 С в бомбе 5 ч. Реакцию концентрировали в вакууме, получая указанное в заглавии соединение, как подвижное масло (750 г, 100% выход). 1 Н-ЯМР (CDCl3):1,25 (т, 3 Н), 2,0 (ш с, 2 Н), 2,85 (с, 2 Н), 4,2 (к, 2 Н), 4,5 (д, 2 Н), 4,55 (д, 2 Н). Приготовление 31. Этил (3-аминотетрагидрофуран-3-ил)ацетат Этил (2Z)-дигидрофуран-3(2 Н)-илиденацетат (приготовление 36, 1,29 г, 8,25 ммоль) перемешивали в 1,4-диоксане (7 мл) в бутылочке для микроволновки. Добавляли раствор 7 М аммиака в метаноле (5 мл) и реакцию нагревали в течение 4 ч при 150 С в микроволновой печи Biotage Initiator. Реакцию концентрировали в вакууме, но позже устанавливали, что реакция не завершилась. Добавляли раствор 7 М аммиака в метаноле (7 мл) и реакцию опять нагревали 3 ч при 150 С в микроволновой печи. Добавляли еще порцию 7 М аммиака в метаноле (3 мл) и реакцию нагревали еще 2 ч. Реакцию концентрировали в вакууме, получая указанное в заглавии соединение вместе с метиловым эфиром, где имела место трансэстерификация. Материал использовали без дополнительной очистки на следующей стадии. Приготовление 32. Этил (3-аминотетрагидро-2 Н-пиран-3-ил)ацетат Этил (2Z)-дигидро-2 Н-пиран-3(4 Н)-илиденацетат (приготовление 37, 1,21 г, 7,11 ммоль) перемеши- 28023375(5 мл) и реакцию нагревали в течение 3 ч при 150 С в микроволновой печи Biotage Initiator. Добавляли еще раствор 7 М аммиака в метаноле (2 мл) и реакцию опять нагревали в течение 2 ч при 150 С в микроволновой печи. Реакцию концентрировали в вакууме и остаток растворяли в дополнительной порции 7 М аммиака в метаноле (10 мл) и нагревали в течение еще 5 ч при 150 С в микроволновой печи. Реакцию концентрировали в вакууме, получая указанное в заглавии соединение вместе с метиловым эфиром, где имела место транс-эстерификация. Материал использовали без дополнительной очистки на следующей стадии. Приготовление 33. Метил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-ил]пропаноат Метилпропионат (2,71 г, 30,8 ммоль) растворяли в безводном ТГФ (90 мл) и охлаждали до -78 С под азотом. Каплями добавляли LDA (2M раствор в ТГФ, 15 мл, 30 ммоль). После 1 ч при -78 С добавляли раствор 2-метил-N-оксетан-3-илиденпропан-2-сульфинамида (приготовление 39, 1,35 г, 7,703 ммоль) в безводном ТГФ (10 мл). Реакцию осторожно нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение, как масло (1,276 г,63% выход). 1 Н-ЯМР (CDCl3):1,25 (с, 9 Н), 1,3-1,4 (м, 3 Н), 3,25 (м, 1H), 3,7 (м, 3 Н), 4,2 (ш с, 0,4 Н), 4,45 (ш с,0,6 Н), 4,55 (м, 1,1H), 4,6 (м, 0,9 Н), 4,75 (д, 0,6 Н), 4,85-5,0 (м, 1,4 Н). Приготовление 34. Этил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-илпропаноатN,N-диизопропиламин (78 г, 770 ммоль) растворяли в безводном ТГФ (200 мл) и охлаждали до -78 С под азотом. Каплями добавляли бутиллитий (2,5 М раствор в гексане, 297 мл, 743 ммоль). Реакцию удаляли из охладительной бани на 30 мин, потом повторно охлаждали до -78 С. Каплями добавляли раствор этилпропионата (72,8 г, 713 ммоль) в безводном ТГФ (200 мл) и реакцию оставляли перемешиваться при комнатной температуре 1 ч. Реакцию опять охлаждали до -78 С и каплями добавляли раствор 2-метил-Nоксетан-3-илиденпропан-2-сульфинамида (Приготовление 39, 50 г, 285 ммоль) в безводном ТГФ (200 мл). Реакцию перемешивали в интервале от -40 до -60 С в течение 4 ч и потом гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над MgSO4 и концентрировали в вакууме. Очистка колонковой хроматографией на силикагеле (элюирование этилацетатом) не требовалась. Указанное в заглавии соединение получали как желтое масло (40 г, 51% выход) и использовали без дополнительной очистки. Приготовление 35. Метил 2-3-[(трет-бутилсульфинил)амино]оксетан-3-ил]бутаноат Метилбутират (5,67 г, 55,5 ммоль) растворяли в безводном ТГФ (100 мл) и охлаждали до -78 С под азотом. Каплями добавляли LDA (2M раствор в ТГФ 27,1 мл, 54,2 ммоль). После 1 ч при -78 С добавляли раствор 2-метил-N-оксетан-3-илиденпропан-2-сульфинамида (Приготовление 39, 2,43 г, 13,88 ммоль) в безводном ТГФ (10 мл). Реакцию осторожно нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле, получая указанное в заглавии соединение, как масло (2,89 г,75% выход). 1 Н-ЯМР (CDCl3):1,00 (м, 3 Н), 1,25 (с, 9 Н), 1,6-2,0 (м, 2 Н), 3,0 (м, 1H), 3,7 (м, 3 Н), 4,3 (ш с, 0,5 Н),4,50 (м, 1H), 4,55 (ш с, 0,5 Н), 4,6 (м, 0,5 Н), 4,65 (м, 1H), 4,9 (м, 0,5 Н), 4,95 (м, 1H). Приготовление 36. Этил (2Z)-дигидрофуран-3(2 Н)-илиденацетат Способ Н. Гидрид натрия (60% дисперсия в масле, 0,65 г, 16,3 ммоль) охлаждали до 0 С под азотом и потом добавляли безводный ТГФ (20 мл). Медленно в течение 40 мин, контролируя выделение газа, добавляли триэтилфосфоноацетат (3 мл, 15,1 ммоль). Добавляли раствор 3-оксотетрагидрофурана (1 г, 11,62 ммоль) в безводном ТГФ (2 мл) и реакцию постепенно нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию концентрировали в вакууме и остаток разделяли между этилацетатом (350 мл) и водой (30 мл). Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колонковой хроматографией на силикагеле (0-50% этилацетата в гептане, градиент элюирования), получая указанное в заглавии соединение, как масло (1,29 г, 71% выход). 1 Н-ЯМР (CDCl3):1,3 (м, 3 Н), 2,7 (м, 1H), 3,05 (м, 0,7 Н), 3,2 (м, 0,3 Н), 3,9 (т, 1H), 3,95 (т, 0,7 Н), 4,15(м, 2 Н), 4,4 (м, 0,7 Н), 4,6-4,7 (м, 0,6 Н), 4,75 (м, 1H), 5,7-5,85 (м, 1H). ЖХМС (2 мин) Rt = 1,23 мин. МС m/z 157 [МН]+ Следующее приготовление 37 получали по способу, аналогичному способу Н, как описано для приготовления 36 выше. Если не указано другое, детали получения являются такими как описано для спосо- 29
МПК / Метки
МПК: A61P 29/00, C07D 405/06, A61K 31/417
Метки: модуляторов, качестве, натриевых, 4-фенилимидазол-2-ил)этиламина, каналов, производные
Код ссылки
<a href="https://eas.patents.su/30-23375-proizvodnye-4-fenilimidazol-2-iletilamina-v-kachestve-modulyatorov-natrievyh-kanalov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные (4-фенилимидазол-2-ил)этиламина в качестве модуляторов натриевых каналов</a>
Предыдущий патент: 4-(8-метокси-1-((1-метоксипропан-2-ил)-2-(тетрагидро-2н-пиран-4-ил)-1н-имидазо[4,5-c]хинолин-7-ил)-3,5-диметилизоксазол и его применение в качестве ингибитора бромодомена
Следующий патент: Твердая дозированная форма и содержащая ее упаковка для комбинированной терапии
Случайный патент: Композиция для укладки волос












