Неорганические наночастицы высокой плотности, используемые для разрушения клеток in vivo
Номер патента: 23012
Опубликовано: 29.04.2016
Авторы: Поттье Аньес, Руэ Аннабелль, Дево Коринн, Марилл Жюли, Жермэн Маттье, Леви Лоран
Формула / Реферат
1. Способ модификации или разрушения клеток-мишеней у животного при облучении указанных клеток ионизирующим излучением, отличающийся тем, что применяют фармацевтическую композицию, содержащую наночастицу, агрегат наночастиц или их смесь, где указанные наночастица или агрегат наночастиц состоят из оксида металла, где плотность указанной наночастицы или плотность указанного агрегата наночастиц составляет более 7 г/см3 и где указанные наночастица или агрегат наночастиц имеют биологически совместимое покрытие, позволяющее указанным наночастице и/или агрегату наночастиц сохранять стабильность при рН 6,5-7,5 в физиологической жидкости.
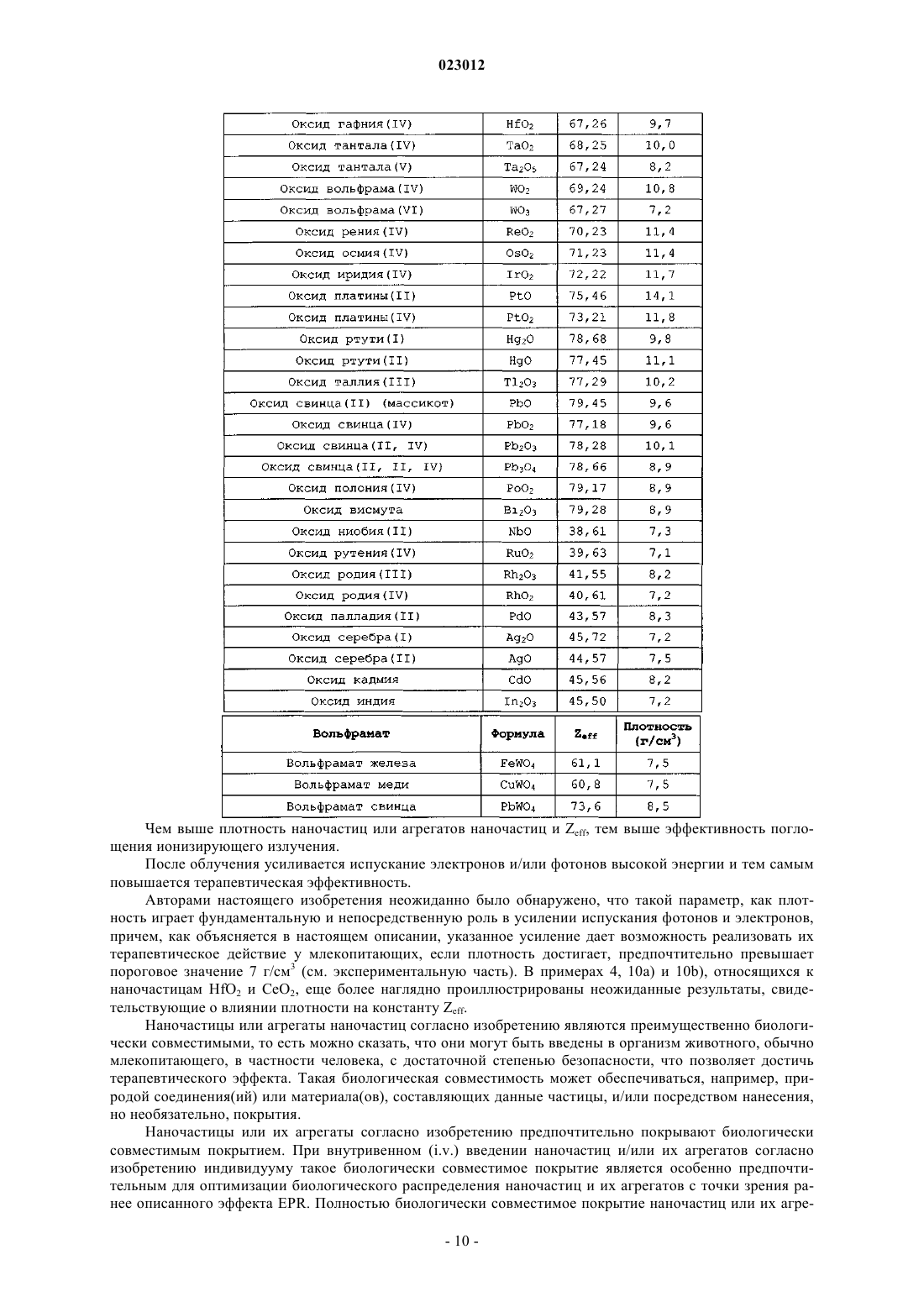
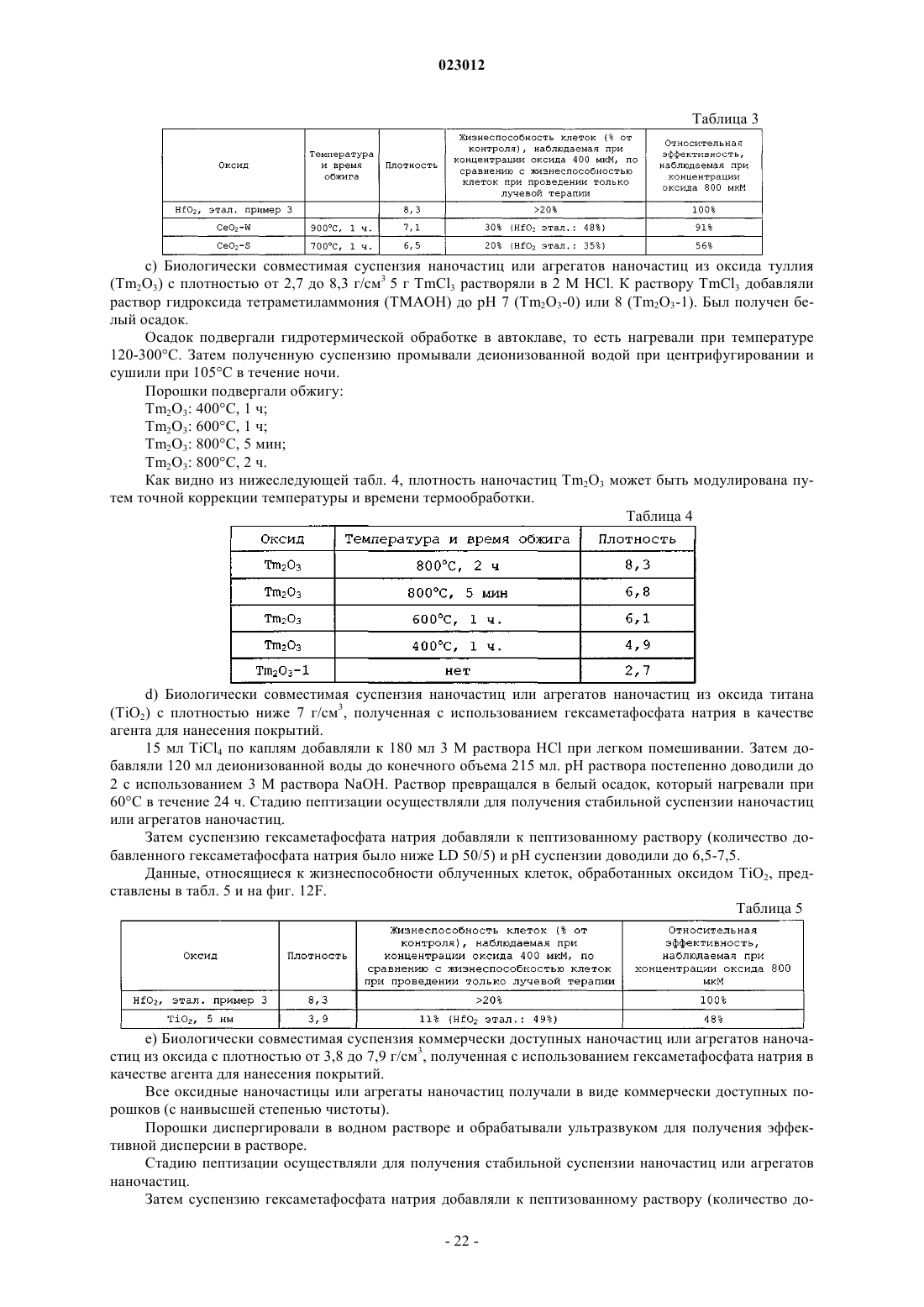
2. Способ по п.1, где указанный оксид металла выбран из группы, состоящей из СеО2, Nd2O3, Sm2O3, Eu2O3, Gd2O3, Tb2O3, Dy2O3, Ho2O3, Er2O3, Tm2O3, Yb2O3, Lu2O3, HfO2, TaO2, Ta2O5, WO2, WO3, ReO2, OsO2, IrO2, PtO, PtO2, HgO, Hg2O, Tl2O3, PbO, Pb2O3, Pb3O4, PbO2, PoO2, Bi2O3, NbO, RuO2, Rh2O3, RhO2, PdO, Ag2O, AgO, CdO, In2O3.
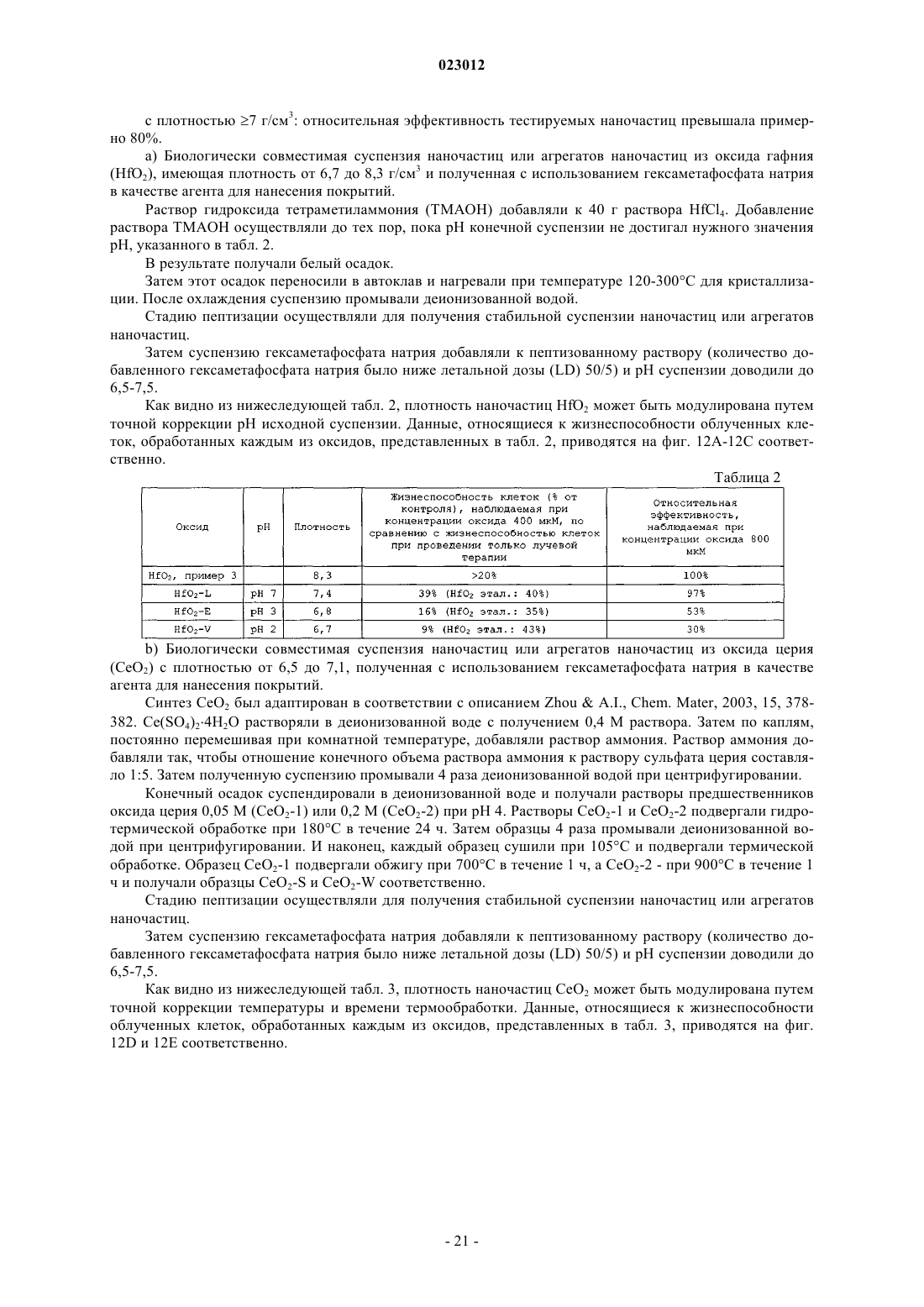
3. Способ по п.2, где указанным оксидом металла является HfO2.
4. Способ по п.1, в котором биосовместимое покрытие представляет собой биологически неразлагаемое покрытие, выбранное из группы, состоящей из двуокиси кремния, окиси алюминия, сахара, фосфата, силана, цвиттерионных соединений, липидов, насыщенных углеводородных полимеров и неорганических полимеров; или биологически разлагаемое покрытие, выбранное из группы, состоящей из биологического полимера, фосфолипида, сахарида, олигосахарида или полисахарида.
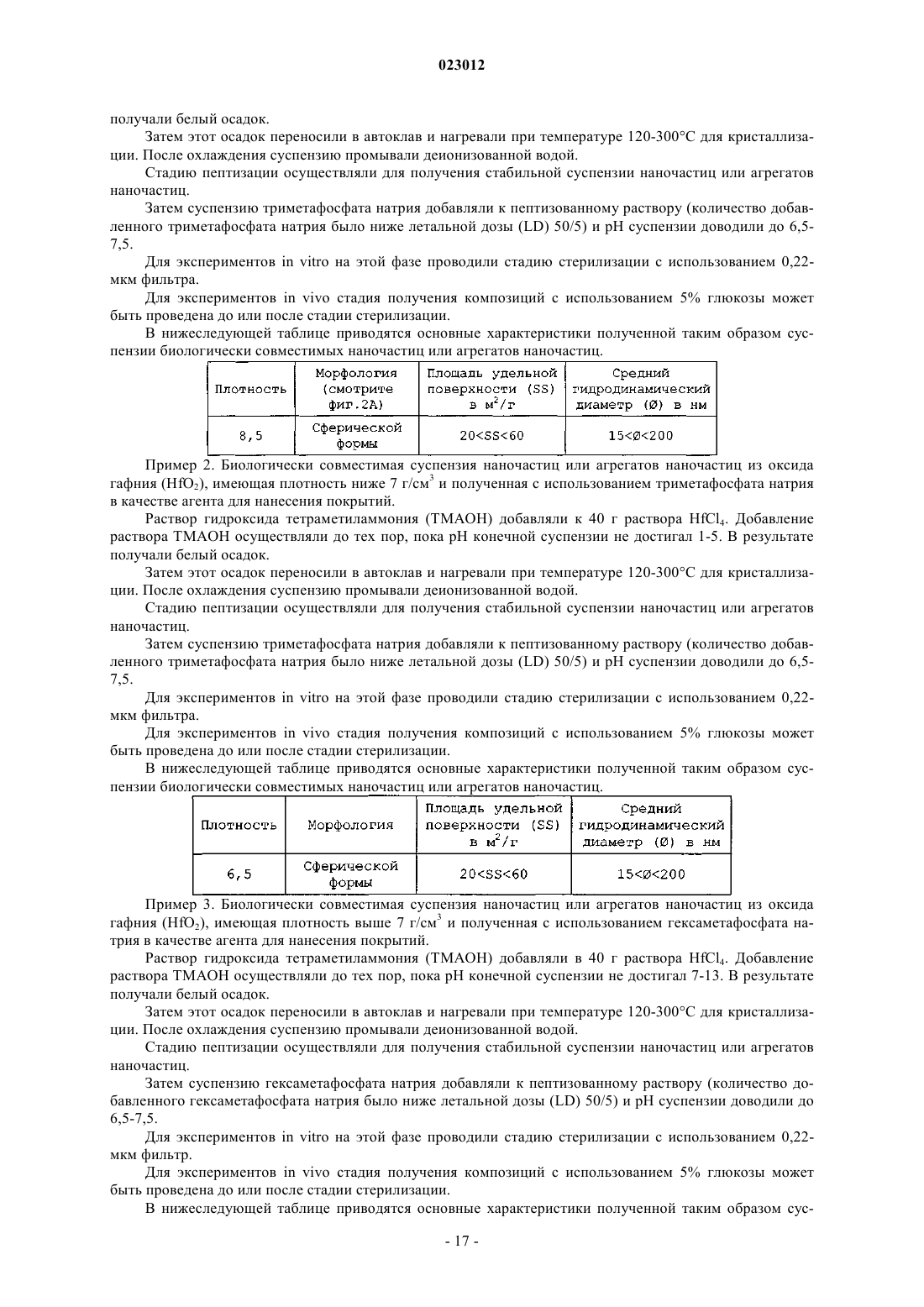
5. Способ по п.1, где размер наночастицы или агрегата наночастиц составляет 10-200 нм.
6. Способ по п.1, где указанное ионизирующее излучение выбрано из группы, состоящей из рентгеновского излучения, γ-излучения, пучков электронов и излучения радиоактивных изотопов.
7. Способ по п.1, где указанное ионизирующее излучение имеет энергию от 2 до 25000 кэВ.
8. Способ по п.7, где указанное ионизирующее излучение имеет энергию от 2 до 6000 кэВ.
9. Способ по п.7, где указанное ионизирующее излучение имеет энергию от 2 до 1500 кэВ.
10. Способ по п.1, где указанные наночастица или агрегат наночастиц состоят из оксида металла, имеющего эффективный атомный номер (Zeff) по меньшей мере 50.
11. Способ по п.1, где указанные наночастица или агрегат наночастиц имеют, по существу, сферическую форму.
12. Способ по п.1, где указанные клетки-мишени выбраны из группы, состоящей из доброкачественных клеток, предзлокачественных клеток и злокачественных клеток.
13. Способ по п.12, где указанными злокачественными клетками являются клетки опухоли из группы, состоящей из гематологической опухоли и солидной опухоли.
14. Способ по п.1, где указанная фармацевтическая композиция содержит дополнительное терапевтическое соединение, которое отличается от наночастицы или агрегата наночастиц, предназначенное для лечения рака.
15. Способ по п.1, где указанным животным является человек.
16. Фармацевтическая композиция, способная генерировать электроны и/или фотоны высокой энергии при возбуждении ионизирующим излучением, содержащая наночастицу, агрегат наночастиц или их смесь и фармацевтически приемлемый эксципиент, причем указанные наночастица или агрегат наночастиц состоят из оксида металла, где плотность указанной наночастицы или плотность указанного агрегата наночастиц составляет более 7 г/см3 и где наночастица или агрегат наночастиц имеют биологически совместимое покрытие, позволяющее указанным наночастице или агрегату наночастиц сохранять стабильность при рН 6,5-7,5 в физиологической жидкости.
17. Фармацевтическая композиция по п.16, предназначенная для модификации или разрушения клеток-мишеней у млекопитающего при облучении указанных клеток ионизирующим излучением.
18. Фармацевтическая композиция по п.16, предназначенная для детекции или визуализации и последующей модификации или разрушения клеток-мишеней у животного при облучении указанных клеток ионизирующим излучением.
Текст
НЕОРГАНИЧЕСКИЕ НАНОЧАСТИЦЫ ВЫСОКОЙ ПЛОТНОСТИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ РАЗРУШЕНИЯ КЛЕТОК IN VIVO Изобретение относится к новым возбуждаемым частицам, которые могут быть использованы в медицине. Более конкретно, изобретение относится к частицам, которые могут генерировать электроны и/или фотоны высокой энергии при их возбуждении ионизирующим излечением, таким как рентгеновское излучение, гамма-излучение (-лучи), излучение радиоактивных изотопов и/или электронов, и которые могут быть использованы в медицине, а в частности, для лечения человека. Частицы согласно изобретению изготавливают из неорганического материала, содержащего кислород, а в частности оксид, причем указанный материал обладает адекватной плотностью и может быть активирован in vitro, ex vivo или in vivo посредством регулируемого внешнего возбуждения в целях деструкции, модификации или разрушения клеток-мишеней, тканей-мишеней или органов-мишеней. Изобретение также относится к способам получения таких частиц и к фармацевтическим композициям или к медицинским устройствам, содержащим указанные частицы. Область, к которой относится изобретение Настоящее изобретение относится к новым возбуждаемым частицам, которые могут быть использованы в медицине. Более конкретно, настоящее изобретение относится к частицам, которые могут генерировать электроны и/или фотоны высокой энергии при их возбуждении ионизирующим излечением,таким как рентгеновское излучение, гамма-излучение (-лучи), излучение радиоактивных изотопов и/или пучков электронов, и которые могут быть использованы в медицине, в частности, для лечения человека. Частицы согласно изобретению изготавливают из неорганического материала, содержащего кислород, в частности оксид, причем указанный материал обладает адекватной плотностью и может быть активирован in vitro, ex vivo или in vivo посредством регулируемого внешнего возбуждения в целях разрушения,модификации или разрушения клеток-мишеней, тканей-мишеней или органов-мишеней. Настоящее изобретение также относится к способам получения таких частиц и к фармацевтическим композициям, содержащим указанные частицы. Предшествующий уровень техники Излучение различных типов, такое как рентгеновское излучение, -излучение, УФ-излучение, лазерное излучение, микроволновое излучение, излучение пучков электронов, а также пучков частиц, например нейтронов и фотонов, может быть использовано для лечения раковых заболеваний. Для этих целей были использованы некоторые из указанных типов излучения в комбинации с молекулами, чувствительными к излучению. Действительно, электромагнитное и ионизирующее излучение способно разрушать молекулы ДНК в клетке и тем самым предотвращать рост и деление указанной клетки. Такой эффект обусловлен, главным образом, повреждениями, вызываемыми электронами и/или фотонами высокой энергии (превышающей 2 кэВ), излучаемыми после ионизации. Термин "ионизирующее излучение" означает излучение высокоэнергетических частиц или волн, которые могут вызывать отрыв (ионизацию) по меньшей мере одного электрона от атома или молекулы. Способность к ионизации зависит от энергии отдельных частиц или волн, а не от их числа. В большинстве случаев большие потоки частиц или волн не вызывают ионизацию, если отдельные частицы или волны не обладают достаточной энергией. Примерами ионизирующего излучения являются излучение энергетических бета-частиц, фотонов, нейтронов,электронов и альфа-частиц. Атом или молекула могут быть ионизованы световыми волнами (фотонами) в пределах всего спектра электромагнитного излучения. Рентгеновское излучение и -излучение ионизирует почти любую молекулу или любой атом; а излучение в далекой области ультрафиолетового спектра может ионизировать многие атомы и молекулы,излучение в ближней области ультрафиолетового спектра и видимый свет способны ионизировать лишь очень небольшое число молекул; а микроволновое излучение и радиоволны не обладают ионизирующей способностью. В заявке WO 2005/120590 описаны частицы, содержащие (i) ядро, включающее первое неорганическое соединение, поглощающее рентгеновское излучение и излучающее энергию в УФ- и видимом диапазоне спектра, и (ii) второе неорганическое или органическое соединение, поглощающее энергию в УФи видимом диапазоне спектра и продуцирующее свободные радикалы после контактирования с водой или кислородом. Активированные частицы превращают кислород, присутствующий в окружающей среде, в свободные радикалы, которые представляют собой в высокой степени реакционноспособные молекулы, вызывающие необратимые повреждения в клетках. Заявка США 2007/0274909 относится к наночастицам, используемым для визуализации или для облучения биологического материала, включающего VUV- или UVC-излучающий материал, который поглощает излучение высокой энергии и испускает вакуумный УФ (VUV) или коротковолновый УФ(UVC). В VUV- или UVC-излучающие материалы, описанные в настоящем изобретении, специально или неспециально, но систематически добавляли активатор в целях индуцирования описанного VUV- илиUVC-излучения. Однако эти дополнительные агенты могут ассоциироваться с повышенной токсичностью в зависимости от их локализации в частицах или от их растворимости в дисперсионной среде. В патенте США 6955639 описан способ усиления действия рентгеновского излучения с использованием металлов, в частности золота, и наночастиц. Авторами настоящего изобретения были получены новые высокоэнергетичные наночастицы, которые могут быть получены менее трудоемким и менее дорогостоящим способом, чем способы, описанные в литературе, но что более важно и неожиданно, что эти частицы в комбинации с ионизирующим излучением, как было продемонстрировано в настоящем изобретении, способны к высокоэффективной модификации или разрушению клеток-мишеней. Другими отличительными признаками описанных здесь наночастиц является их способность сохраняться внутри опухоли в течение нескольких дней, что позволяет уменьшить число инъекций наночастиц и/или агрегатов наночастиц до минимума при проведении полного курса лучевой терапии. Описание сущности изобретения Авторами настоящего изобретения было обнаружено, что эффективное разрушение, модификация или разрушение клеток-мишеней, тканей-мишеней или органов-мишеней, в частности аномальных клеток или тканей, определенных здесь как доброкачественные клетки или ткани, или пораженных клеток или тканей, таких как предзлокачественные или злокачественные клетки (раковые клетки) или ткани(опухоли), локализованные глубоко в организме, но с минимальным повреждением окружающих здоровых тканей, могут быть осуществлены с использованием наночастиц, которые были получены из неорганического кислородсодержащего материала (другими словами, из одного неорганического материала), в частности из оксида, плотность которого составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3. Для достижения желаемого терапевтического эффекта такие наночастицы не требуют присутствия дополнительного отдельного соединения или вещества. В частности, описанные здесь наночастицы способны непосредственно преобразовывать падающее излучение в эффективное испускание электронов и/или фотонов высокой энергии, которые будут давать последующий терапевтический эффект. В отличие от наночастиц, описанных в заявке WO 2005/120590 и US 2007/0274909, наночастицы согласно изобретению не требуют присутствия двух отдельных соединений, одно из которых должно преобразовывать рентгеновское излучение в УФ-излучение в видимом диапазоне спектра. В частности, наночастицы согласно изобретению не содержат неорганического соединения, используемого в качестве первого соединения, которое поглощает рентгеновское излучение и преобразует его в УФ-излучение в видимом дианазоне спектра, поглощаемое вторым соединением, которое, в свою очередь, ответственно за необратимые поражения в клетках. Эти наночастицы также не содержат активирующей добавки, или сконструированы так, чтобы они испускали излучение, в частности, в УФ-области спектра. В отличие от металлических наночастиц наночастицы согласно изобретению имеют то преимущество, что они содержат на своей поверхности гидроксильные (ОН) группы, ответственные за совместимость с любой полярной средой при рН в широких интервалах значений. По сравнению с металлическими наночастицами наночастицы согласно изобретению, в частности наночастицы, полученные из оксида, также имеют то преимущество, что они могут быть получены менее трудоемким способом. Биологически совместимые суспензии с высокой концентрацией наночастиц или агрегатов наночастиц могут быть получены с применением описанного здесь способа. Способ синтеза не требует присутствия восстановителя и/или секвестрирующего (комплексобразующего) агента, используемого для предупреждения нежелательной агрегации полученных частиц. В описанных здесь способах добавление секвестрирующего (комплексобразующего) агента к вышеупомянутым суспензиям не является обязательным. Поэтому способ синтеза в основном включает (одновременные или последовательные) стадии осаждения химического элемента в полярной среде, кристаллизации указанного химического элемента (кислорода, который является частью структуры неорганического материала) и стабилизации (если это необходимо) в физиологической среде. Наночастицы согласно изобретению также не требуют присутствия нацеливающей молекулы для доставки этих наночастиц в клетки- или ткани-мишени. Действительно, эффект усиления способности к проникновению и удерживанию ("EPR") ответственен за пассивную аккумуляцию наночастиц в опухолевой массе через определенный период времени после внутривенной инъекции (которая является одним из возможных способов введения) наночастиц. Действительно, было обнаружено, что опухолевые сосуды в значительной степени отличаются от нормальных капилляров и что "проницаемость" этих сосудов способствует селективной экстравазации наночастиц из этих сосудов в ткани, что обычно не происходит в нормальных тканях. Отсутствие эффективного дренирования опухоли из лимфатических сосудов предотвращает клиренс пенетрантных наночастиц и способствует их аккумуляции в опухоли. Таким образом, наночастицы согласно изобретению могут быть успешно доставлены в первичные опухоли, а также в их метастазы после внутривенного введения. Наночастицы согласно изобретению могут быть также преимущественно введены внутрь опухоли,как было продемонстрировано в "Экспериментальном разделе". Однако наночастицы или агрегаты наночастиц согласно изобретению преимущественно покрывают биологически совместимым покрытием, обеспечивающим указанным наночастицам или агергатам наночастиц стабильность при рН 6,5-7,5 в физиологической жидкости, как описано ниже в настоящем изобретении. Поэтому в другом своем предпочтительном варианте настоящее изобретение относится к наночастицам, которые сами по себе не оказывают негативного воздействия и в соответствующих условиях могут быть без всякого риска использованы для функционального разрушения, модификации или разрушение клеток-мишеней, в частности раковых клеток. Действительно, желаемый терапевтический эффект наночастиц строго зависит от их возбуждения, где указанное возбуждение генерируется источником ионизирующего излучения, который сам по себе предпочтительно контролируется по качеству и количеству и используется специалистами для нацеливания, то есть для его соответствующей локализации. Таким образом, в настоящем изобретении описан новый класс частиц, которые могут быть исполь-2 023012 зованы, если это необходимо, для их целевого введения в организм любого животного, предпочтительно млекопитающего, а еще более предпочтительно человека. Частицы согласно изобретению могут быть введены в ткань или орган любого типа как на их поверхность, так и в глубину. В частности, в настоящем изобретении описаны активируемые частицы, которые могут индуцировать модификацию или декструкцию клеток in vitro, ex vivo или in vivo, если указанные клетки были подвергнуты ионизирующему облучению, такому как, в частности, облучение рентгеновскими лучами, -лучами, радиоактивными изотопами, пучками ионов и/или электронов. Применяемая стратегия заключается в преобразовании падающего ионизирующего излучения,главным образом, в эффективное испускание электронов и/или фотонов высокой энергии, которые ответственны за терапевтический эффект. Такой результат может быть получен с использованием наночастиц согласно изобретению, изготовленных из неорганического материала, содержащего кислород и имеющего плотность по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, в частности наночастицы,полученные из оксида, имеют плотность более 7 и менее 15 г/см 3. Наночастицы согласно изобретению возбуждаются или активируются посредством поглощения энергии ионизирующего излучения. Такое поглощение приводит к последующему осуществлению каскада событий, вызывающих модификацию или гибель клеток-мишеней. Из этих событий с точки зрения настоящего изобретения доминирующими и имеющими важное значение событиями являются испускание электронов и/или фотонов высокой энергии. Авторами настоящего изобретения была продемонстрирована эффективность неорганического кислородсодержащего материала, имеющего плотность по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3, в достижении желаемого терапевтического эффекта, заключающегося в модификации или разрушении клеток-мишеней, тканеймишеней или органов-мишеней, таких как злокачественные клетки или ткани. Настоящее изобретение относится к продуктам или соединениям, где описанные здесь наночастицы или агрегаты наночастиц получены из неорганического материала, содержащего кислород, и где плотность указанного неорганического материала составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3. Методы получения таких соединений описаны в настоящем изобретении. Целью настоящего изобретения является применение наночастиц или агрегатов наночастиц согласно изобретению для модификации, разрушения или элиминации клеток-мишеней, тканей-мишеней или органов-мишеней. В своем конкретном варианте настоящее изобретение относится к применению наночастиц или агрегатов наночастиц для получения фармацевтической композиции, используемой в целях модификации,разрушения или элиминации клеток-мишеней у животного, если указанные клетки были подвергнуты ионизирующему облучению, определенному в настоящем изобретении, где указанные наночастицы получены из неорганического кислородсодержащего материала, где плотность указанного неорганического материала составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц,полученных из оксида, более 7 и менее 15 г/см 3; а также к соответствующему способу лечения. В частности, настоящее изобретение относится к продуктам согласно изобретению, а более конкретно, к наночастицам или агрегатам наночастиц, используемых для лечения рака. Другой вариант настоящего изобретения относится к композиции, в частности к фармацевтической композиции, которая может быть использована в терапии или в диагностике и которая включает продукт, определенный выше, или продукт, который может быть получен вышеупомянутым способом. Такую композицию предпочтительно получают в форме препарата для инъекций. В настоящем изобретении описана фармацевтическая композиция, в частности фармацевтическая композиция, которая в соответствии с настоящим описанием может быть использована для модификации или разрушения клеток-мишеней у млекопитающеего, если указанные клетки были подвергнуты ионизирующему облучению, где указанная фармацевтическая композиция включает наночастицы или агрегаты наночастиц и фармацевтически приемлемый носитель или эксципиент, а указанные наночастицы были получены из неорганического кислородсодержащего материала, имеющего плотность по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3, где указанные наночастицы или агрегаты наночастиц предпочтительно покрыты биологически совместимым покрытием. В другом своем варианте настоящее изобретение относится к применению наночастиц или агрегатов наночастиц согласно изобретению в целях предупреждения или лечения рака или в целях ослабления симптомов рака у животного, где указанные наночастицы или агрегаты наночастиц подвергают облучению, в частности ионизирующему облучению, определенному в настоящем изобретении. Настоящее изобретение, в частности, относится к способу предупреждения или лечения рака или к ослаблению симптомов рака у индивидуума, где указанным индивидуумом является животное, в частности млекопитающее, предпочтительно человек, и где указанный способ включает введение указанному индивидууму наночастиц или агрегатов наночастиц согласно изобретению или композиции, содержащей указанные наночастицы или агерегаты наночастиц, и облучение указанного индивидуума, в частности ионизирующее облучение. В другом своем аспекте настоящее изобретение относится к наборам, содержащим любые одно или несколько описанных здесь продуктов, то есть наночастиц, агрегатов наночастиц и композиций, и этикетку, на которой имеются инструкции по применению такого(их) продукта(ов). Краткое описание графического материала На фиг. 1 проиллюстрировано временное распределение и диспергирование биологически совместимой суспензии наночастиц или агрегатов наночастиц HfO2 после их внутриопухолевой инъекции "голым" мышам Swiss, несущим опухоль НСТ 116. Микротомографию опухоли осуществляли через 2 и 15 дней после инъекции. На фиг. 2 А и 2 В представлены изображения наночастиц и агрегатов наночастиц HfO2, сделанные на просвечивающем электронном микроскопе (ПЭМ) в целях качественной характеризации формы наночастиц (масштаб равен 200 нм). Для анализа использовали JEOL 100 СХ. На фиг. 2 А проиллюстрированы наночастицы, а также агрегаты, образованные наночастицами, где указанные наночастицы и их агрегаты имеют сферическую форму. На фиг. 2 В проиллюстрированы наночастицы, полученные другим методом, и агрегаты, образованные указанными наночастицами, где указанные наночастицы и их агрегаты, по существу, имеют в основном удлиненную форму. На фиг. 3 представлены фотографии интернализованных в клетках наночастиц, сделанные на просвечивающем электронном микроскопе (ПЭМ). Культуры НСТ 116 в течение 24 ч обрабатывали либо суспензией, не содержащей наночастиц (контроль), либо 5 и 100 мкМ биологически совместимой суспензией наночастиц или агрегатов наночастиц HfO2 (масштаб 500 нм). Наночастицы пропускали через эндосомы. Исследование, проведенное на ПЭМ, со всей очевидностью показало, что наночастицы проникают в клетки через эндосомы в зависимости от концентрации. Наночастицы могут поступать или проникать в клетки в агрегированном состоянии или по отдельности в зависимости от их конструкции и/или концентрации. На фиг. 4 представлен спектр электромагнитного излучения, где ионизирующее излучение выделено. На фиг. 5 А показан уровень в греях или коэффициент констрастности биологически совместимой суспензии наночастиц и агрегатов наночастиц HfO2 в зависимости от их концентрации:HfO2 с плотностью 7: крестики. Анализы проводили на рентгеновском микротомографе (Skyscan 1076), работающем с источником напряжения 50 кВ. Для данной концентрации, чем выше величина в греях для наночастиц или для агрегатов наночастиц (которая непосредственно относится к скорости или к способности их поглощения), тем выше способность этих наночастиц или их агрегатов вызывать гибель клеток, индуцированную облучением, как показано на фиг. 5 В. На фиг. 5 В проиллюстрирован клоногенный анализ на выживаемость клеток, проводимый с использованием биологически совместимых наночастиц или агрегатов наночастиц HfO2, инкубированных с двумя различными клеточными линиями карциномы толстой кишки человека при 400 мкМ по сравнению с контролем.SFX (коэффициент выживаемости при дозе облучения X грей) определяют после облучения дозой 2 Гр для клеточной линии НСТ 116, чувствительной к радиоактивному облучению, и после облучения дозой 4 Гр для клеточной линии НТ 29, резистентной к радиоактивному облучению с использованием источника рентгеновского излучения с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи). Средние значения получали из 2 различных экспериментов. Фиг. 6 относится к биологически совместимой суспензии, которая содержит наночастицы и/или агрегаты наночастиц HfO2 и которая была введена путем внутриопухолевой инъекции "голым" мышамSwiss, несущим опухоли НСТ 116 (объем инъекции составлял 20-50% от объема опухоли). Затем опухоли указанных мышей локально облучали (в 2 раунда, также идентифицированные здесь как 2 дозы по 4 Гр; кружочки) с помощью аппликатора, подсоединенного к внешнему источнику излучения [устройство для лучевой терапии с источником иридия-192]. Ту же самую биологически совместимую суспензию вводили мышам контрольной группы (объем инъекции составлял 20-50% от объема опухоли). Животных указанной контрольной группы не облучали (крестики). Мышей вышеописанных групп сравнивали с мышами, обработанными носителем и подвергаемыми лучевой терапии (треугольники) или не подвергаемыми лучевой терапии (ромбы). Затем два раза в неделю в течение 25 дней после облучения проводили мониторинг объема опухоли у мышей каждой группы. На фиг. 7 представлены фотографии мышей с опухолевыми клетками НСТ 116, сделанные через 21 день после облучения. Фиг. 7 А - мыши, облученные после внутриопухолевой инъекции носителя (без частиц). Фиг. 7 В - мыши, облученные после внутриопухолевой инъекции наночастиц. На фиг. 8 проиллюстрированы клоногенные анализы на выживаемость, проводимые на раковых клетках НСТ 116 (модель, чувствительная к радиоактивному облучению) и НТ 29 (модель, резистентная к радиоактивному облучению), облученных с помощью рентгеновской установки, генерирующей рентгеновское излучение с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи) в отсутствие наночастиц (негативный контроль) или в присутствии 400 мкМ наночастиц или агрегатов наночастицHfO2. Дозы облучения варьировались от 0 до 4 Гр. Негативный контроль с НСТ 116: крестики. Наночастицы с НСТ 116: квадраты. Негативный контроль с НТ 29: ромбы. Наночастицы с НТ 29: кружки. На фиг. 9 проиллюстрировано изменение объема опухолей НСТ 116 после внутриопухолевой инъекции биологически совместимой суспензии наночастиц или агрегатов наночастиц HfO2 с последующим облучением опухоли дозой 24 Гр или 18 Гр с помощью аппликатора, подсоединенного к внешнему источнику облучения иридия-192, находящемуся в устройстве для лучевой терапии. Средние величины вычисляли для 8 "голых" мышей Swiss. Контрольная группа, которой вводили носитель (без облучения, без наночастиц): ромбы; группа, которой вводили наночастицы (без облучения): крестики; группа, которой вводили носители и подвергали облучению дозой 18 Гр (без наночастиц): квадраты; группа, которой вводили носители и подвергали облучению дозой 24 Гр (без наночастиц): треугольники; группа, которой вводили наночастицы и подвергали облучению дозой 18 Гр: незаштрихованные кружки; группа, которой вводили наночастицы и подвергали облучению дозой 24 Гр: кружки. На фиг. 10 проиллюстрирована жизнеспособность клеток, определенная после 24-часовой обработки в присутствии или в отсутствие наночастиц или агрегатов наночастиц HfO2 (концентрация 800 мкМ). Дозы облучения варьировались от 0 до 6 Гр. Для определения жизнеспособности использовали наборWST-1. Каждая точка означает среднюю величину из 3 экспериментов. С наночастицами и облучением: треугольники. Без наночастиц и без облучения: квадраты. На фиг. 11 А проиллюстрированы клоногенные анализы на выживаемость, проводимые на раковых клетках НТ 1080 (модель фибросаркомы, резистентная к радиоактивному облучению), облученных с помощью рентгеновской установки, излучающей рентгеновские лучи с энергией 200 кэВ (Tube CometMXR-225/22-200 кВ/15 мА/0,2 ммКи), в отсутствие наночастиц (негативный контроль) или в присутствии 400 мкМ наночастиц или агрегатов наночастиц HfO2. Дозы облучения варьировались от 0 до 4 Гр. Негативный контроль с НТ 1080: крестики; наночастицы с НТ 1080: квадраты. На фиг. 11 В проиллюстрированы клоногенные анализы, проводимые на раковых клетках НТ 1080(модель фибросаркомы, резистентная к радиоактивному облучению), облученных источником кобальта 60 в отсутствие наночастиц (негативный контроль) или в присутствии 400 мкМ наночастиц или агрегатов наночастиц HfO2. Дозы облучения варьировались от 0 до 4 Гр. Негативный контроль с НТ 1080: крестики; наночастицы с НТ 1080: квадраты. Аналогичные клоногенные анализы проводили на "человеческих фибробластах" (не-раковых клетках), используемых в качестве контроля, с применением наночастиц, и эти анализы либо не обнаруживали какого-либо эффекта, либо обнаруживали незначительный эффект. Результаты, полученные при сравнении соответствующей реакции раковых и нормальных клеток после облучения, показали высокое отношение "польза:риск". На фиг. 12 А проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц HfO2 (400 мкМ) с плотностью 7,4 г/см 3(пример 10 а). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (HfO2-L, d=7,4) и без облучения: заштрихованные треугольники; с наночастицами (HfO2-L, d=7,4) и с облучением: незаштрихованные кружки. На фиг. 12 В проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц HfO2 (400 мкМ) с плотностью 6,8 г/см 3 На фиг. 12 С проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц HfO2 или агрегатов наночастиц HfO2 (400 мкМ) с плотностью 6,7 г/см 3 (пример 10 а). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (HfO2-V, d=6,7) и без облучения: заштрихованные треугольники; с наночастицами (HfO2-V, d=6,7) и с облучением: незаштрихованные кружки. На фиг. 12D проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц СеО 2 (400 мкМ) с плотностью 7,1 г/см 3(пример 10b). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (CeO2-W, d=7,1) и без облучения: заштрихованные треугольники; с наночастицами (CeO2-W, d=7,1) и с облучением: незаштрихованные кружки. На фиг. 12 Е проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц СеО 2 или агрегатов наночастиц СеО 2 (400 мкМ) с плотностью 6,5 г/см 3 (пример 10b). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (CeO2-S, d=6,5) и без облучения: заштрихованные треугольники; с наночастицами (CeO2-S, d=6,5) и с облучением: незаштрихованные кружки. На фиг. 12F проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц TiO2 (400 мкМ) с плотностью 3,9 г/см 3(пример 10d). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (TiO2-5 нм, d=3,9) и без облучения: заштрихованные треугольники; с наночастицами (TiO2-5 нм, d=3,9) и с облучением: незаштрихованные кружки. На фиг. 12G проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц PdO (400 мкМ) с плотностью 7,9 г/см 3(пример 10 е). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (PdO-A, d=7,9) и без облучения: заштрихованные треугольники; с наночастицами (PdO-A, d=7,9) и с облучением: незаштрихованные кружки. На фиг. 12 Н проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц TiO2 (400 мкМ) с плотностью 3,8 г/см 3(пример 10 е). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (TiO2-Р 25, d=3,8) и без облучения: заштрихованные треугольники; с наночастицами (TiO2-P25, d=3,8) и с облучением: незаштрихованные кружки. На фиг. 12I проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц СеО 2 (400 мкМ) с плотностью 6,6 г/см 3 (пример 10 е). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (СеО 2-D, d=6,6) и без облучения: заштрихованные треугольники; с наночастицами (СеО 2-D, d=6,6) и с облучением: незаштрихованные кружки. На фиг. 12J проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц Nd2O3 (4 00 мкМ) с плотностью 5,4 г/см 3(пример 10 е). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (Nd2O3-Z, d=5,4) и без облучения: заштрихованные треугольники; с наночастицами (Nd2O3-Z, d=5,4) и с облучением: незаштрихованные кружки. На фиг. 12K проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц Eu2O3 (400 мкМ) с плотностью 5,6 г/см 3 с наночастицами (Eu2O3-B, d=5,6) и с облучением: незаштрихованные кружки. На фиг. 12L проиллюстрирована жизнеспособность клеток (% от контроля) после облучения дозой 2 Гр с использованием наночастиц или агрегатов наночастиц WO3 (400 мкМ) с плотностью 7,2 г/см 3(пример 10 е). С наночастицами (HfO2-этал./пример 3/d=8,3) и без облучения: заштрихованные квадраты; с наночастицами (HfO2-этал./пример 3/d=8,3) и с облучением: незаштрихованные ромбы; с наночастицами (WO3-C, d=7,2) и без облучения: заштрихованные треугольники; с наночастицами (WO3-C, d=7,2) и с облучением: незаштрихованные кружки. На фиг. 13 представлены величины относительной эффективности (способности индуцировать гибель клеток), выраженные в процентах. Указанная относительная эффективность является показателем жизнеспособности клеток (% от контроля) после облучения частицами в дозе 2 Гр, тестируемыми, как описано, в примере 10 при 800 мкМ, по сравнению с жизнеспособностью клеток, подвергаемых лишь одной лучевой терапии (без наночастиц); и показателем жизнеспособности клеток (% от контроля) после обработки наночастицами или агрегатами наночастиц HfO2 (см. пример 3), при 800 мкМ, по сравнению с жизнеспособностью клеток, подвергаемых лишь одной лучевой терапии (без наночастиц). Были использованы две группы наночастиц, значительно отличающиеся по своей эффективности: частицы с плотностью 7 г/см 3: где относительная эффективность тестируемых наночастиц была приблизительно ниже 55%; частицы с плотностью 7 г/см 3: где относительная эффективность тестируемых наночастиц превышала примерно 80%. На фиг. 14 проиллюстрированы стабильность или отсутствие стабильности наночастиц (см. СеО 2-D примера 10 е), TiO2-5 нм примера 10d) и HfO2 примера 3), имеющих концентрацию примерно 5 г/л и содержащих или не содержащих биологически совместимое HMP-покрытие в различных условиях, а именно образцы инкубировали в течение 2 ч в воде или в 5% растворе глюкозы при рН 3 или рН 7 (см. пример 11). На фиг. 15 представлены результаты тестов при фильтрации на 0,22-мкм фильтре (см. пример 11) для различных образцов (СеО 2-D примера 10 е), TiO2-5 нм примера 10d) и HfO2 примера 3), содержащих или не содержащих биологически совместимое НМР-покрытие (инкубирование проводили в течение 2 ч в воде или в 5% растворе глюкозы, рН 7). Концентрации выражали в г/л, а выход фильтрации выражали в%. Подробное описание изобретения Авторами настоящего изобретения было неожиданно обнаружено, что наночастицы, полученные из неорганического материала, содержащего кислород, предпочтительно из неорганического кристаллического материала, содержащего кислород, а еще более предпочтительно оксид, где плотность указанного неорганического материала составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 г/см 3 и менее 15 г/см 3, могут усиливать терапевтический эффект локального облучения, проводимого в целях деструкции, модификации или разрушения аномальных клеток, тканей или органов у животного. Значительное усиление эффективности лучевой терапии in vitro можно было наблюдать уже в начальный период после введения наночастиц согласно изобретению (см., например, фиг. 5 В, 8, 10, 11 А и 11 В). Авторами настоящего изобретения было подтверждено, что опухоли у животных уменьшались в размере и фактически исчезали (полная ремиссия) после инъекции им описанных здесь наночастиц, если указанные животные подвергались локальному облучению низкой дозой излучения, способного активировать указанные наночастицы (см. экспериментальную часть и фиг. 6, 7 и 9). В контексте настоящего изобретения термин "наночастицы" или "агрегаты наночастиц" означает синтетические продукты малого размера. Они могут иметь, например, круглую, плоскую, удлиненную,сферическую или овальную формы и т.п. Форма может определяться или регулироваться методом продуцирования, адаптированным специалистом в данной области в зависимости от целей применения. Форма частиц не оказывает существенного влияния на их свойства. Однако форма частиц может оказывать влияние на "биологическую совместимости" частиц. Так, например, с точки зрения фармакокинетики, наночастицы или их агрегаты предпочтительно имеют в основном удлиненную, сферическую или круглую форму. Особенно предпочтительной является сферическая или круглая форма. Предпочтительными также являются частицы, имеющие абсолютно однородную форму. В предпочтительном варианте изобретения размер частиц или агрегатов наночастиц согласно изобретению обычно составляет примерно 3-400 нм, предпочтительно примерно 5-, 10-, 15- или 20-200 нм,еще более предпочтительно примерно 20-100 нм или примерно 40-100 нм. Фактически размер частиц в идеальном случае должен быть достаточно небольшим, то есть таким,чтобы эти частицы могли диффундировать по всему организму (тканям, клеткам, кровеносным сосудам и т.п.), но в основном не захватывались макрофагами (при фагоцитозе) и не приводили к значительной закупорке. Такие эффекты могут наблюдаться преимущественно у людей, которым были введены частицы, имеющие средний размер ниже 100 нм. Агрегация может приводить к слиянию отдельных наночастиц в агрегированной структуре. Для ограничения взаимодействия частиц с окружающей средой предпочтительно, чтобы наночастицы имели небольшую площадь удельной поверхности. В соответствии с настоящим изобретением площадь удельной поверхности наночастиц составляет примерно 10-80 м 2/г. При этом предпочтительно,если площадь удельной поверхности составляет 20-60 м 2/г. Неожиданно обнаруженная эффективность наночастиц согласно изобретению обусловлена, главным образом, природой составляющего их материала, которым является неорганический материал, содержащий кислород, предпочтительно кристаллический материал, плотность которого составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3, а более конкретно 8-14 или 8-12 г/см 3. Такие наночастицы, действительно, способны поглощать ионизирующее излучение и испускать определенное количество электронов и/или фотонов высокой энергии, в частности, при использовании низко ионизирующего излучения, достаточного для непосредственной модификации или деструкции клеток-мишеней, тканей-мишеней или органовмишеней. В этой связи следует отметить, что в настоящем изобретении также преимущественно используется высокоионизирующее излучение (см. фиг. 11 В). При исследовании in vitro дозы ионизирующего излучения предпочтительно составляли от примерно 0,05 до 6 Гр. При локальном введении, в частности, в исследованиях ex vivo или in vivo дозы составляли в пределах от более чем 0,05 Гр до менее чем 16-30 Гр. В современной практике общая доза ионизирующего излучения, применяемая для человека, составляет в пределах от 1,5 Гр и примерно до 85 Гр. Общая доза излучения может подаваться в соответствии с различными схемами облучения, такими как одноразовая доза, дробные дозы, дробные дозы, разделенные на более мелкие дозы, и т.п. Как продемонстрировано в экспериментальном разделе, описанные здесь облученные наночастицы обнаруживали явно повышенный терапевтический эффект по сравнению с эффектом стандартной лучевой терапии. Вышеупомянутый неорганический материал является преимущественно неорганическим материалом. В предпочтительном варианте изобретения указанным неорганическим материалом является оксид. Оксид представляет собой химическое соединение, содержащее по меньшей мере один атом кислорода и, по меньшей мере, второй другой химический элемент. Указанный другой химический элемент может быть использован в качестве предшественника в описанных здесь способах получения наночастиц или агрегатов наночастиц. В контексте настоящего изобретения предпочтительным оксидом является оксид металла (MxOy) (см. "Metal Oxide Chemistry and Synthesis - from solution to solid state", Jean-PierreJolivet, Savoirs Actuels InterEditions/CNRS, Editions 1994) и вольфрамат (Mx(WO4)y). Оксид металла, используемый в соответствии с настоящим изобретением, может быть выбран из группы, состоящей из оксида элемента лантанидной группы и оксида химического элемента (металла) Периодической таблицы элементов (таблицы Менделеева), в частности из оксида металла периодов 5 и 6 Периодической таблицы элементов. В контексте настоящего изобретения примерами элементов, которые могут быть использованы, являются соответствующие оксиды элемента лантонидной группы, которые могут быть выбраны, например,из группы, состоящей из СеО 2, Nd2O3, Sm2O3, Eu2O3, Gd2O3, Tb2O3, Dy2O3, Ho2O3, Er2O3, Tm2O3, Yb2O3,Lu2O3 и их смесей; соответствующие оксиды металла периода 6 Периодической таблицы элементов, которые могут быть выбраны, например, из группы, состоящей из HfO2, TaO2, Ta2O5, WO2, WO3, ReO2, OsO2, IrO2, PtO,PtO2, HgO, Hg2O, Ti2O3, PbO, Pb2O3, Pb3O4, PbO2, PoO2, Bi2O3 и их смесей; соответствующие оксиды металла периода 5 Периодической таблицы элементов, которые могут быть выбраны, например, из группы, состоящей из NbO, RuO2, Rh2O3, RhO2, PdO, Ag2O, AgO, CdO, In2O3 и их смесей. В контексте настоящего изобретения в качестве неорганического материала, содержащего кислород, может быть также использован вольфрамат (Mx(WO4)y). Предпочтительные вольфраматы могут быть выбраны из группы, состоящей, например, из FeWO4,CuWO4, MnWO4, PbWO4 и их смесей. В конкретных наночастицах может также присутствовать смесь оксида(ов) и вольфрамата(ов). Как указывалось ранее, наночастицы согласно изобретению должны быть получены из неорганического материала, содержащего кислород, где плотность указанного неорганического материала составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3, в частности 8-14 или 8-12 г/см 3. Плотность представляет собой массу m на единицу объема V. В контексте настоящего изобретения повышенная терапевтическая эффективность была получена с использованием наночастиц высокой плотности. Как было определено авторами настоящего изобретения, порог плотности, необходимый для достижения повышенной терапевтической эффективности, составляет 7 г/см 3. Следует отметить, что предпочтительной является наибольшая плотность. Особенно предпочтительная плотность составляет по-8 023012 меньшей мере 7,5 г/см 3, предпочтительно по меньшей мере 8 г/см 3, а еще более предпочтительно по меньшей мере 8,5, 9, 9,5, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5 или 14 г/см 3. Плотность наночастиц или агрегатов наночастиц определяют исходя приблизительно из 1 г сухого порошка с использованием пикнометрического оборудования Accupyc 1340. Описанные здесь наночастицы предпочтительно получают из неорганического материала, имеющего эффективный атомный номер (Zeff) по меньшей мере 50, предпочтительно по меньшей мере 60 или 61,более предпочтительно по меньшей мере 65, 66, 67 или даже 68. Термин "эффективный атомный номер" аналогичен термину "атомное число", но в отличие от последнего, он используется по отношению к соединениям (например, таких как вода) и смесям различных материалов (таких как ткань или кость), но не по отношению к атомам. Эффективный атомный номер вычисляют как среднее атомное число для соединения или смеси материалов. Сокращенно, он обозначается Zeff. Эффективный атомный номер вычисляют путем умножения относительной доли электронов от каждого атома в соединении на атомный номер данного атома. Эффективный атомный номер, Zeff, вычисляют по формуле где fn представляет собой часть от общего числа электронов в каждом элементе иZn представляет собой атомный номер каждого элемента. Атомный номер (также известный как число протонов) представляет собой число протонов, присутствующих в атомном ядре. Обычно он обозначается символом Z. По атомному номеру однозначно идентифицируется химический элемент. Для атома с нейтральным зарядом атомный номер равен числу электронов. В качестве примера может служить вода (Н 2 О), которая состоит из двух атомов водорода (Z=1) и одного атома кислорода (Z=8). Общее число электронов составляет 1+1+8=10. Фракция электронов, соответствующая двум атомам водорода, составляет 2/10, а фракция электронов, соответствующая одному атому кислорода, составляет 8/10. Следовательно, Zeff воды составляетZeff определяет способность наночастиц поглощать падающее излучение. В нижеследующей таблице представлены примеры соединений, которые могут быть использованы в соответствии с настоящим изобретением, и указаны их соответствующая плотность и Zeff. Таблица 1 Чем выше плотность наночастиц или агрегатов наночастиц и Zeff, тем выше эффективность поглощения ионизирующего излучения. После облучения усиливается испускание электронов и/или фотонов высокой энергии и тем самым повышается терапевтическая эффективность. Авторами настоящего изобретения неожиданно было обнаружено, что такой параметр, как плотность играет фундаментальную и непосредственную роль в усилении испускания фотонов и электронов,причем, как объясняется в настоящем описании, указанное усиление дает возможность реализовать их терапевтическое действие у млекопитающих, если плотность достигает, предпочтительно превышает пороговое значение 7 г/см 3 (см. экспериментальную часть). В примерах 4, 10 а) и 10b), относящихся к наночастицам HfO2 и СеО 2, еще более наглядно проиллюстрированы неожиданные результаты, свидетельствующие о влиянии плотности на константу Zeff. Наночастицы или агрегаты наночастиц согласно изобретению являются преимущественно биологически совместимыми, то есть можно сказать, что они могут быть введены в организм животного, обычно млекопитающего, в частности человека, с достаточной степенью безопасности, что позволяет достичь терапевтического эффекта. Такая биологическая совместимость может обеспечиваться, например, природой соединения(ий) или материала(ов), составляющих данные частицы, и/или посредством нанесения,но необязательно, покрытия. Наночастицы или их агрегаты согласно изобретению предпочтительно покрывают биологически совместимым покрытием. При внутривенном (i.v.) введении наночастиц и/или их агрегатов согласно изобретению индивидууму такое биологически совместимое покрытие является особенно предпочтительным для оптимизации биологического распределения наночастиц и их агрегатов с точки зрения ранее описанного эффекта EPR. Полностью биологически совместимое покрытие наночастиц или их агре- 10023012 гатов необходимо, в частности, при внутривенном введении для предотвращения взаимодействия поверхности частиц с любым элементом распознавания (макрофагами, опсонинами и т.п.). Под термином"полное покрытие" подразумевается присутствие биологически совместимых молекул очень высокой плотности, обладающих способностью создавать, по меньшей мере, сплошной монослой на поверхности частиц. Такое покрытие ответственно за так называемый "скрытый эффект" наночастиц или их агрегатов. Биологически совместимое покрытие позволяет наночастицам сохранять стабильность при рН 6,5-7,5 в биологически совместимой суспензии, такой как физиологическая жидкость (кровь, плазма, сыворотка и т.п.), любая изотоническая среда или физиологическая среда, например среда, содержащая глюкозу (5%) и/или NaCl (0,9%) (см. пример 11 и фиг. 14), где указанная стабильность является необходимой для введения в фармацевтических целях. Такое биологически совместимое покрытие получают путем обработки наночастиц агентом для обработки поверхности. Стабильность может быть подтверждена путем количественной оценки сухого экстракта, проводимой на суспензии наночастиц до и после фильтрации на 0,22-мкм фильтре (см. пример 11 и фиг. 15). При этом предпочтительно, чтобы такое покрытие сохраняло целостность частиц in vivo, обеспечивало или улучшало их биологическую совместимость и облегчало введение (необязательное) функциональных групп (например, посредством спейсерных молекул, биологически совместимых полимеров, агентов для доставки, белков и т.п.). Действительно, конкретные наночастицы согласно изобретению также содержат агент для доставки, который позволяет этим частицам взаимодействовать с элементом распознавания,присутствующим на клетке-мишени. Такие агенты для доставки будут действовать сразу после аккумуляции наночастиц или их агрегатов в опухоли. Поскольку конформация агента для доставки ответственна за его взаимодействие с мишенью, то плотность такого агента для доставки необходимо тщательно регулировать. Действительно, высокая плотность частиц может нарушать конформацию агента для доставки, что будет влиять на его распознавание мишенью ("Folate-targeted, cationic liposome-mediated geneAnnapragadaa,b,T.; Journal of Controlled Release 104 (2005) 113-128). Кроме того, высокая плотность агента для доставки может благоприятствовать выводу наночастиц ретикулоэндотелиальной системой (РЭС) во время их циркуляции в сосудистой системе. Биологически совместимое покрытие может состоять из любой аморфной или кристаллической структуры. Предпочтительно, чтобы такое покрытие обеспечивало диффузию небольших молекул и свободных радикалов. В частности, важно, чтобы это покрытие пропускало воду (или O2), предпочтительно в форме радикалов (биологически совместимое покрытие не будет растворяться при рН 6,5-7,5). Это может быть достигнуто с использованием пористых материалов и/или путем добавления покрывающего слоя, имеющего низкую толщину и являющегося пористым. Таким образом, типичная пористость покрытия составляет примерно 0,05-10 нм, предпочтительно 0,1 или 0,2-5 нм. Типичная толщина покрытия обычно составляет примерно 0,2-50 нм, например примерно 0,5-5 нм или примерно 10-40 нм. В общих чертах, покрытие может быть биологически неразлагаемым или биологически разлагаемым. Для осуществления настоящего изобретения могут быть использованы оба варианта. Примерами биологически неразлагаемых покрытий являются один или несколько материалов или агентов для обработки поверхности, выбранных из группы, состоящей из двуокиси кремния, окиси алюминия, сахара (например, агарозы), фосфата, силана, цвиттерионных соединений, липидов, насыщенных углеводородных полимеров (например, полиэтиленоксида) и неорганических полимеров, образующих или не образующих сетчатую структуру, и немодифицированных или модифицированных (например, полиметакрилатом или полистиролом), а также их комбинаций. Примерами биологически разлагаемых покрытий являются один или несколько материалов или агентов для обработки поверхности, выбранных из группы, состоящей из биологической молекулы, модифицированной или немодифицированной, либо природной или неприродной, и биологической полимерной молекулы, модифицированной или немодифицированной, либо имеющей природную или неприродную форму. Биологическим полимером может быть фосфолипид, сахарид, олигосахарид или полисахарид, который является или не является полисульфированным, например декстран. Вышеупомянутые вещества, соединения или агенты для обработки поверхности могут быть использованы отдельно или в комбинациях, в виде смесей или совокупности молекул, композиционных или некомпозиционных материалов, ковалентно или нековалентно связанных материалов и, необязательно, в комбинации с другими соединениями. Кроме того, может быть также использован любой один из вышеупомянутых материалов,где указанный материал, по своей природе, обычно растворяется в воде или в липидах, либо его искусственно модифицируют так, чтобы он растворялся в воде или в липидах. Биологически совместимое покрытие предпочтительно содержит соединение или состоит из соединения, выбранного из группы, состоящей из неорганического вещества, металлсодержащего органического вещества и их смесей или комбинаций. Соответствующее неорганическое вещество может быть выбрано из группы, состоящей из оксида,- 11023012 гидроксида и оксигидроксида. Неорганическое вещество может содержать, например, кремний, алюминий, цирконий, кальций, магний и/или олово. Такие вещества могут быть использованы для сообщения наночастицам положительного или отрицательного заряда в целях модуляции взаимодействий указанных наночастиц с биологической средой. Неорганическое вещество, выбранное из группы, состоящей, например, из магния и кальция, будет сообщать поверхности наночастиц положительный заряд при рН 7. Так, например, кремний может быть использован для сообщения поверхности наночастиц отрицательного заряда при рН 7. Соответствующее металлсодержащее вещество может быть выбрано из группы, состоящей из золота, серебра и платины. Соответствующим органическим веществом может быть любое вещество, включающее функциональную группу, способную взаимодействовать с наночастицами согласно изобретению, и функциональную группу, сообщающую указанным наночастицам биологическую совместимость. Таким веществом, содержащим функциональную группу, способную взаимодействовать с наночастицами, может быть,например, карбоксилат (R-COO-), сульфат (R-SO42-), спирт (R-OH), силан (R-Si(OR)3), амин (R-NH2), четвертичный аммоний (R-NH4+), функциональная группа фосфоновой кислоты (R-PO(ОН)2) или функциональная группа фосфорной кислоты (R-O-PO(OH)2). Вещество, содержащее функциональную группу, способную сообщать биологическую совместимость наночастицам согласно изобретению, может иметь стерическую функцию и/или электростатическую функцию. Такое вещество, обладающее стерической функцией, может быть выбрано из группы,состоящей из полиэтиленгликоля (ПЭГ), полиэтиленоксида, поливинилового спирта, полиакрилата, полиакриламида (поли(N-изопропилакриламида, поликарбамида, биополимера или полисахарида, такого как декстран, ксилан, целлюлоза, коллаген, и цвиттерионного соединения, такого как полисульфобетаин и т.п. Веществом, имеющим положительный электростатический заряд, может быть амин, такой как аминопропилтриэтоксисилан или полилизин. Вещество с отрицательным электростатическим зарядом может быть выбрано из группы, состоящей из фосфата (например, полифосфата, метафосфата, пирофосфата и т.п.), карбоксилата (например,цитрата или дикарбоновой кислоты, в частности янтарной кислоты) и сульфата. Покрытие может также содержать другие функциональные группы (или линкерные сегменты), позволяющие любой представляющей интерес молекуле связываться с поверхностью частиц. Типичным примером наночастиц согласно изобретению являются наночастицы, полученные изHfO2 и содержащие фосфатное соединение, такие как триметафосфат натрия (STMP) или гексаметафосфат натрия (НМР) в качестве биологически совместимого покрытия. Другим примером наночастиц согласно изобретению являются наночастицы, полученные из HfO2 и содержащие в качестве биологически совместимого покрытия силан, несущий по меньшей мере одну функциональную группу, выбранную из группы, состоящей из металлсодержащего вещества, полиэтилена, оксида, амина, ангидрида, фосфата и любых их комбинаций. Другим объектом настоящего изобретения является способ продуцирования наночастиц или их агрегатов, таких как наночастицы или их агрегаты, определенные выше, или их смеси, где указанный способ включает получение химического элемента, из которого может быть создан неорганический материал, содержащий кислород, где плотность указанного материала составляет по меньшей мере 7 г/см 3, а предпочтительно более 7 г/см 3, а в случае наночастиц, состоящих из оксида, более 7 и менее 15 г/см 3; получение наночастиц или агрегатов наночастиц из указанного химического элемента путем осаждения указанного химического элемента в полярной среде (такой как водный раствор, спиртовой раствор и т.п.) и путем кристаллизации и, необязательно, покрытие наночастиц или их агрегатов с использованием агента для обработки поверхностей, описанного выше. При проведении стадии осаждения рН предпочтительно корректируют так, чтобы он составлял примерно 7-14; концентрацию предшественника (химического элемента) предпочтительно корректируют так, чтобы она составляла примерно 10-3-3 моль/л; ионную силу предпочтительно корректируют так, чтобы она составляла примерно 10-3-5 моль/л; а более предпочтительно примерно 10-3-3 моль/л; температуру предпочтительно корректируют так, чтобы она составляла примерно 20-350 С. Перед необязательным нанесением покрытия неорганический материал предпочтительно кристаллизуют, например, путем термообработки (после такой обработки может быть проведена стадия мокрого или сухого помола). Стадии осаждения и кристаллизации могут быть осуществлены одновременно или последовательно. Секвестрирующий (комплексобразующий) агент может быть также добавлен в полярную среду для достижения желаемой фазы кристаллизации, нужной кристалличности, нужной формы частицы, нужного размера частицы и/или нужной плотности. Кристаллизованный материал может быть также подвергнут промывке (для удаления любых примесей) и/или пептизации (для сообщения электрического заряда поверхности неорганической частицы в целях придания указанным наночастицам стабильности при данном рН). Стадия нанесения покрытия преимущественно включает осуществление контактирования наночастиц или их агрегатов с агентом для обработки поверхности (также называемого здесь "покрытием"), как было определено выше. В конкретном варианте изобретения способ получения суспензии биологически совместимых наночастиц, их агрегатов или смесей включает приведенные ниже стадии, предпочтительно проводимые в следующем порядке:a) получение в качестве предшественника химического элемента лантанидной группы или элемента периода 5 или 6 Периодической таблицы элементов, который обладает способностью образовывать неорганический материал, содержащий кислород, в частности оксид или вольфрамат, предпочтительно оксид, где плотность указанного материала составляет по меньшей мере 7 г/см 3, предпочтительно более 7 г/см 3, а в случае наночастиц, полученных из оксида, более 7 и менее 15 г/см 3, в частности 8-14 или 8-12 г/см 3;b) осаждение предшественника стадии а) в полярной среде предпочтительно путем коррекции рН,температуры, ионной силы среды и/или концентрации предшественника и, необязательно, добавления комплексобразующего агента;d) промывка, но необязательно, суспензии, полученной по окончании стадии b) или с), для удаления любых примесей, солей и/или комплексобразующего агента, присутствующих в данной суспензии;e) осуществление, но необязательно, стадии пептизации в целях сообщения заряда поверхности наночастиц или их агрегатов, присутствующих в данной суспензии; и необязательноf) нанесение покрытия на указанные наночастицы или их агрегаты. рН суспензии наночастиц или агрегатов наночастиц, полученных способом, описанным выше, может быть скорректирован с использованием физиологической среды (рН 6,5-7,5). Описанные выше суспензии перед их введением индивидууму могут быть также подвергнуты стадии составления композиций. В конкретном примере способ получения наночастиц или агрегатов наночастиц, состоящих изHfO2-сердцевины или включающих такую сердцевину, предпочтительно включает описанные ниже стадии, осуществляемые в следующем порядке: осаждение раствора предшественника гафния (такого как, в частности, раствор HfCl4 или HfOCl2) основанием, таким как, в частности, гидроксид тетраметиламмония (ТМАОН),кристаллизация полученной таким образом аморфной неорганической суспензии, например, путем обработки при температуре выше 50 С, предпочтительно по меньшей мере 100 С, при перемешивании,но необязательно, данной суспензии; промывка и/или пептизация, но необязательно, полученного таким образом кристаллизованного материала; нанесение покрытия, но необязательно, на указанный кристаллизованный материал путем осуществления контактирования указанного материала с агентом для обработки поверхности, определенным выше. Другим объектом настоящего изобретения является любая композиция, содержащая наночастицы или их агрегаты, такие как наночастицы или их агрегаты, которые были определены выше и/или которые могут быть получены описанными здесь способами. Частицы в композициях согласно изобретению предпочтительно, но необязательно, имеют абсолютно одинаковые размер и форму. Конкретным объектом настоящего изобретения является фармацевтическая композиция, содержащая частицы или агрегаты наночастиц, такие как частицы или их агрегаты, определенные выше, и, необязательно фармацевтически приемлемый наполнитель или носитель. Другим конкретным объектом настоящего изобретения является диагностическая или визуализирующая композиция, содержащая частицы или агрегаты наночастиц, такие как частицы или их агрегаты,определенные выше, и, необязательно фармацевтически приемлемый наполнитель или носитель. Указанные композиции могут быть получены в твердой форме, в виде жидкости (частиц в суспензии), аэрозоля, геля, пасты и т.п. Предпочтительными композициями являются композиции в жидкой форме. Используемым наполнителем или носителем может быть любой классический носитель, обычно применяемый для нанесения такого типа, например, такой как физиологический раствор, изотонический,стерильный, забуференный раствор и т.п. Такие растворы могут такаже содержать стабилизаторы, подсластители, поверхностно-активные вещества и т.п. Указанные растворы могут быть приготовлены, например, в ампулах, в виде аэрозолей, в виде препаратов, упакованных в бутылях, в виде таблеток и в виде капсул с применением известной техники приготовления фармацевтических препаратов. В описанных здесь композициях соответствующие или желательные концентрации наночастиц составляют примерно 10-3 мг наночастиц/г опухоли и примерно 100 мг наночастиц/г опухоли, в частности примерно 5-50 мг наночастиц/г опухоли. Эти композиции могут быть введены различными способами. В общих чертах композиции в жидкой форме содержат 0,05-300 г/л, 0,05-150 г/л, предпочтительно по меньшей мере 10, 20, 40, 45, 50, 55, 60, 80, 100, 150, 200 или 250 г/л наночастиц. В идеальном случае, после стадии сушки суспензии, содержащей наночастицы, проводят оценку сухого экстракта. Композиции, частицы и их агрегаты согласно изобретению могут быть использованы в различных целях, в частности, в медицине или ветеринарии. Целью настоящего изобретения является применение наночастиц или агрегатов наночастиц, описанных в настоящем изобретении, в целях модификации, деструкции или элиминации клеток-мишеней,тканей-мишеней или органов-мишеней. Наночастицы под действием ионизирующего излучения, рентгеновского излучения, -излучения,излучения радиоактивных изотопов и/или потоков электронов возбуждаются и продуцируют электроны и/или фотоны высокой энергии. Указанные электроны и/или фотоны высокой энергии после их контактирования с окружающей средой, водой или O2, в частности, могут генерировать свободные радикалы и/или индуцировать новые события ионизации. В зависимости от энергии ионизирующего излучения эти частицы могут вызывать деструкцию тканей и/или они могут быть использованы просто в целях визуализации и/или в диагностических целях. Следовательно, конкретной целью настоящего изобретения является применение наночастиц или агрегатов наночастиц согласно изобретению в целях получения фармацевтической композиции для модификации, деструкции или элиминации клеток-мишеней у животного, если указанные клетки были подвергнуты облучению, в частности ионизирующему облучению, соответствующими методами. Фармацевтическая композиция может также включать дополнительное терапевтическое соединение, которое отличается от наночастиц или агрегатов наночастиц и которое может быть также использовано для лечения рака. Другой конкретной целью настоящего изобретения является способ индуцирования или стимуляции лизиса, апоптоза или деструкции клеток-мишеней in vitro, ex vivo или in vivo, где указанный способ включает контактирование клеток, в частности клеток-мишеней, с одной или несколькими наночастицами или с одним или несколькими агрегатами наночастиц, определенных выше, в течение периода времени, достаточного для проникновения этих частиц или их агрегатов вовнутрь клеток-мишеней, или для их взаимодействия с указанными клетками; и обработку клеток путем их облучения соответствующим излучением, в частности ионизирующим излучением, предпочтительно рентгеновскими лучами, -лучами,радиоактивными изотопами и/или пучками электронов, где указанная обработка индуцирует или вызывает лизис, апоптоз или деструкцию указанных клеток-мишеней. Клетками-мишенями могут быть любые патологические клетки, которые, как считается, участвуют в патологическом механизме, например пролиферирующие клетки, такие как опухолевые клетки, клетки,вызывающие стеноз (фибробласты/клетки гладких мышц) или клетки иммунной системы (клоны патологических клеток). Предпочтительным применением является обработка (например, в целях деструкции или функциональной модификации) злокачественных клеток или тканей. В этой связи, конкретной целью настоящего изобретения является применение композиций, частиц или агрегатов наночастиц, таких как композиции, частицы или агрегаты наночастиц, определенные выше (в комбинации с ионизирующим излучением, определенным выше), в целях получения фармацевтической композиции, которая может быть использована для лечения рака. Настоящее изобретение также охватывает применение композиций,частиц или агрегатов наночастиц, таких как композиции, частицы или агрегаты наночастиц, определенные выше, в целях предупреждения или лечения рака или ослабления симптомов рака у животного при облучении указанных клеток, в частности, ионизирующим излучением, определенным выше. Другой конкретной целью настоящего изобретения является способ индуцирования или стимуляции лизиса или деструкции раковых клеток in vitro, ex vivo или in vivo, где указанный способ включает контактирование раковых клеток с одной или несколькими частицами или с одним или несколькими агрегатами наночастиц, определенных выше, в течение периода времени, достаточного для проникновения этих частиц или их агрегатов вовнутрь раковых клеток или для их взаимодействия с указанными клетками; и обработку этих клеток путем их облучения, в частности, ионизирующим излучением, определенным выше, где указанная обработка индуцирует или вызывает лизис или деструкцию указанных клеток. Другой целью настоящего изобретения является способ предупреждения или лечения рака или ослабления симптомов рака у индивидуума или пациента, где указанный способ включает введение пациенту, страдающему раком, композиции, наночастиц или агрегатов наночастиц, определенных выше, в условиях, благоприятствующих проникновению указанных частиц или агрегатов наночастиц вовнутрь аномальных клеток или взаимодействию с указанными клетками, в частности с раковыми клетками; и последующее проведение лечения указанного индивидуума путем его облучения источником возбуждения, в частности источником ионизирующего излучения, вызывающего модификацию, разрушение или функциональную деструкцию аномальных клеток у пациента, что благоприятствует предупреждению или лечению рака у данного пациента. Классические способы лечения рака предусматривают одновременное систематическое проведение комбинированного лечения (например, лучевой терапии в комбинации с химиотерапией). При проведении лучевой терапии описанные здесь наночастицы, подвергаемые ионизирующему облучению, могут быть использованы в комбинации с другой схемой лечения рака. Такая схема может быть выбрана из группы, состоящей из хирургической операции, хирургической операции в сочетании с лучевой терапией, химиотерапии, лечения, включающего введение цитостатического(их) средства(средств), введение цитотоксического(их) средства (средств), "прицельную" терапию, введение вакцины,радионуклидов, в частности иммунорадионуклидов и любых других биологических или неорганических продуктов, которые могут быть использованы для лечения рака. Неожиданно было обнаружено, что описанные здесь наночастицы также могут давать повышенную эффективность при их использовании для проведения лишь одной лучевой терапии. Настоящее изобретение может быть использовано для лечения злокачественных опухолей любого типа, таких как гематологические опухоли или злокачественные опухоли, и солидных опухолей, в частности опухолей эпителиального, нейроэктодермального или мезенхимного происхождения. Кроме того,наночастицы могут быть использованы для лечения предзлокачественного поражения или характерного доброкачественного заболевания, при котором обычно используется и/или показана классическая лучевая терапия. При проведении терапии настоящее изобретение может быть применено для лечения первичных опухолей или вторичных опухолевых инвазий и метастазов в местно-региональные или в периферические органы, а для профилактики настоящее изобретение может быть использовано в целях предотвращения вторичного злокачественного поражения центральной нервной системы, такого как наблюдаемые инвазии (метастазы) меланомы, рака легких, рака почек, рака молочной железы и т.п. Наночастицы могут быть использованы на любом этапе проведения противораковой терапии. Они могут быть введены, например, в качестве неоадъюванта (перед хирургической операцией по поводу удаления раковой опухоли) или в качестве адъюванта (после хирургической операции). Наночастицы могут быть также использованы для лечения запущенных опухолей, которые не могут быть удалены хирургическим путем. Как уже указывалось, в одном или нескольких случаях облучение может быть применено на любом этапе после введения частиц с использованием любой современной доступной системы лучевой терапии или терапии с применением рентгенографии. Описанные здесь наночастицы могут быть, в частности, использованы для лечения рака, при котором показана классическая лучевая терапия. Такое раковое заболевание может быть выбрано, в частности, из группы, состоящей из рака кожи, включая злокачественные новообразования, ассоциированные со СПИД'ом, и меланомы; опухолей центральной нервной системы, включая головной мозг, ствол головного мозга, мозжечок, гипофиз, позвоночный канал, глаза и глазницу; опухолей головы и шеи; рака легких; рака молочной железы; опухолей желудочно-кишечного тракта, таких как рак печени и печеночножелчных путей, толстой кишки, прямой кишки, заднего прохода, желудка, поджелудочной железы и пищевода; опухолей мочеполовых путей у мужчин, таких как рак предстательной железы, яичек, пениса и уретры; опухолей женских половых органов, таких как шейка матки, эндометрий, яичники, фаллопиевы трубы, влагалище и вульва; опухолей коры надпочечника и ретроперитонеальных опухолей; саркомы кости и мягких тканей, независимо от их локализации; лимфомы; миеломы; лейкоза; и опухолей у детей,таких как опухоль Вильмса, нейробластома, опухоли центральной нервной системы, саркома Юинга и т.п. Частицы могут возбуждаться общей дозой облучения, варьирующейся в широких пределах. Количество излучения и схемы лечения (при планировании и осуществлении облучения одной дозой или при составлении протокола раздельной терапии или раздельной терапии очень малыми дозами и т.п.) определяются в зависимости от конкретного заболевания/анатомического участка/состояния здоровья пациента на данной стадии заболевания/возраста пациента (ребенок, взрослый или пожилой человек), и составляют общую стандартную схему лечения в любой конкретной ситуации. В одном или нескольких случаях облучение может быть осуществлено в любое время после введения частиц с использованием любой современной доступной системы лучевой терапии или терапии с применением рентгенографии. Частицы могут быть введены различными способами, такими как местное введение (в частности, внутриопухолевое (IT, подкожное введение, внутривенное введение (i.v.), интрадермальное введение, внутриартериальное введение, введение в дыхательные пути (путем ингаляции), внутрибрюшинное введение, внутримышечное введение и пероральное введение (per os). Частицы могут быть также введены вовнутрь полости, такой как виртуальная полость ложа опухоли после удаления опухоли. При необходимости, инъекция или введение могут быть проведены повторно. Термин "лечение" означает любое действие, осуществляемое для коррекции аномальных функций,для предупреждения заболеваний, для ослабления патологических признаков, таких как, в частности,например, уменьшение размера или снижение роста аномальной ткани, в частности опухоли; для ограни- 15023012 чения размера или прекращения роста, подавления или деструкции аномальных клеток или тканей; для замедления прогрессирования заболевания, стабилизации ракового заболевания с замедлением его прогрессирования, подавления образования метастазов, и для достижения обратного развития заболевания или его полной ремиссии (например, рака) и т.п. Как указывалось выше, соответствующим излучением или источником возбуждения предпочтительно является ионизирующее излучение, которое может быть преимущественно выбрано из группы,состоящей из рентгеновского излучения, -излучения, излучения пучков электронов или пучков ионов и излучения радиоактивных изотопов. Особенно предпочтительным источником возбуждения является рентгеновское излучение. Энергия ионизирующего излучения обычно составляет примерно 2-25000 кэВ, в частности примерно 2-6000 кэВ (источник LINAC) или примерно 2-1500 кэВ (такой источник, как кобальт-60). В общих чертах и в различных случаях для возбуждения частиц может быть применено нижеследующее рентгеновское излучение, которым являются, но не ограничиваются ими: поверхностное рентгеновское излучение с энергией 2-50 кэВ: для возбуждения наночастиц, присутствующих поблизости от поверхности (с проникновением на несколько миллиметров); рентгеновское излучение в 50-150 кэВ: для диагностики, а также для терапии; рентгеновское излучение (в диапазоне ортовольт) 200-500 кэВ, которое может проникать в ткань толщиной 6 см; рентгеновское излучение (в диапазоне мегавольт) 1000-25000 кэВ. Так, например, возбуждение наночастиц, используемых для лечения рака предстательной железы, может быть осуществлено посредством пятикратного фокусного рентгеновского излучения с энергией 15000 кэВ. Радиоактивные изотопы могут быть, альтернативно, использованы в качестве источника ионизирующего излучения (называемого лучевой терапией или близкофокусной лучевой терапией (брахитерапией. В частности, могут быть преимущественно использованы иод I125 (t1/2=60,1 день), палладий Pd103(t1/2=17 дней), цезий Cs137 и иридий Ir192. Заряженные частицы, такие как пучки протонов, пучки ионов, таких как углерод, в частности пучки ионов высокой энергии, могут быть также использованы в качестве источника ионизирующего излучения и/или нейтронных пучков. Пучки электронов могут быть также использованы в качестве источника ионизирующего излучения с энергией 4-25 МэВ. Источник специфического монохроматического излучения может быть использован для селективного генерирования рентгеновского излучения с энергией, близкой к границе или соответствующей границе желаемого поглощения рентгеновского излучения атомами наночастиц или агрегатов наночастиц,состоящих из оксида. Предпочтительные источники ионизирующего излучения могут быть выбраны из линейного ускорителя (LINAC), кобальта 60 и источников, применяемых для брахитерапии. При применении в диагностике наночастицы согласно изобретению могут быть использованы в качестве агентов для контрастного окрашивания, для детекции и/или визуализации тканей любого типа. Таким образом, целью настоящего изобретения является применение композиций, частиц или агрегатов наночастиц, таких как композиции, частицы или агрегаты наночастиц, определенные выше, в комбинации с облучением, подаваемым рентгенографическими устройствами, в целях детекции или визуализации клеток, тканей или органов. Термин "в комбинации с " указывает на то, что наилучший эффект достигается в том случае, когда представляющие интерес клетки, ткани или органы, в которые, в частности, были введены наночастицы согласно изобретению, подвергаются возбуждению под действием определенного источника. Однако введение указанных частиц и их облучение необязательно должно быть осуществлено одновремено или по той же самой схеме. Настоящее изобретение также относится к наборам, содержащим любые одну или несколько описанных здесь наночастиц или композиций. Набор обычно содержит по меньшей мере одну наночастицу или один агрегат наночастиц согласно изобретению. В общих чертах такой набор также содержит один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций согласно изобретению. В указанном(ых) контейнере(ах) имеется этикетка с инструкциями по применению продуктов, которые могут быть использованы для получения наночастиц, агрегатов наночастиц или композиций способами согласно изобретению. Другие аспекты и преимущества настоящего изобретения будут очевидными из нижеследующих примеров, которые приводятся в целях иллюстрации и не ограничивают объема изобретения. Экспериментальный раздел. Пример 1. Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида гафния (HfO2), имеющая плотность выше 7 г/см 3 и полученная с использованием триметафосфата натрия в качестве агента для нанесения покрытий. Раствор гидроксида тетраметиламмония (ТМАОН) добавляли к 40 г раствора HfCl4. Добавление раствора ТМАОН осуществляли до тех пор, пока рН конечной суспензии не достигал 7-13. В результате получали белый осадок. Затем этот осадок переносили в автоклав и нагревали при температуре 120-300 С для кристаллизации. После охлаждения суспензию промывали деионизованной водой. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию триметафосфата натрия добавляли к пептизованному раствору (количество добавленного триметафосфата натрия было ниже летальной дозы (LD) 50/5) и рН суспензии доводили до 6,57,5. Для экспериментов in vitro на этой фазе проводили стадию стерилизации с использованием 0,22 мкм фильтра. Для экспериментов in vivo стадия получения композиций с использованием 5% глюкозы может быть проведена до или после стадии стерилизации. В нижеследующей таблице приводятся основные характеристики полученной таким образом суспензии биологически совместимых наночастиц или агрегатов наночастиц. Пример 2. Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида гафния (HfO2), имеющая плотность ниже 7 г/см 3 и полученная с использованием триметафосфата натрия в качестве агента для нанесения покрытий. Раствор гидроксида тетраметиламмония (ТМАОН) добавляли к 40 г раствора HfCl4. Добавление раствора ТМАОН осуществляли до тех пор, пока рН конечной суспензии не достигал 1-5. В результате получали белый осадок. Затем этот осадок переносили в автоклав и нагревали при температуре 120-300 С для кристаллизации. После охлаждения суспензию промывали деионизованной водой. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию триметафосфата натрия добавляли к пептизованному раствору (количество добавленного триметафосфата натрия было ниже летальной дозы (LD) 50/5) и рН суспензии доводили до 6,57,5. Для экспериментов in vitro на этой фазе проводили стадию стерилизации с использованием 0,22 мкм фильтра. Для экспериментов in vivo стадия получения композиций с использованием 5% глюкозы может быть проведена до или после стадии стерилизации. В нижеследующей таблице приводятся основные характеристики полученной таким образом суспензии биологически совместимых наночастиц или агрегатов наночастиц. Пример 3. Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида гафния (HfO2), имеющая плотность выше 7 г/см 3 и полученная с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. Раствор гидроксида тетраметиламмония (ТМАОН) добавляли в 40 г раствора HfCl4. Добавление раствора ТМАОН осуществляли до тех пор, пока рН конечной суспензии не достигал 7-13. В результате получали белый осадок. Затем этот осадок переносили в автоклав и нагревали при температуре 120-300 С для кристаллизации. После охлаждения суспензию промывали деионизованной водой. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию гексаметафосфата натрия добавляли к пептизованному раствору (количество добавленного гексаметафосфата натрия было ниже летальной дозы (LD) 50/5) и рН суспензии доводили до 6,5-7,5. Для экспериментов in vitro на этой фазе проводили стадию стерилизации с использованием 0,22 мкм фильтр. Для экспериментов in vivo стадия получения композиций с использованием 5% глюкозы может быть проведена до или после стадии стерилизации. В нижеследующей таблице приводятся основные характеристики полученной таким образом сус- 17023012 пензии биологически совместимых наночастиц или агрегатов наночастиц. Пример 4. Анализ на выживание клеток или анализ на количество выживших клеток х грей (SFx),проводимый с использованием биологически совместимой суспензии наночастиц или агрегатов наночастиц, состоящих из HfO2 и полученных, как описано в примере 1 и в примере 2 (фиг. 5 В). Материалы и методы. Перед определением SFx оценивали эффективность посева каждой клеточной линии рака толстой кишки (раковых клеток HCT116, восприимчивых к лучевой терапии и раковых клеток HT29, резистентных к лучевой терапии). Клетки высевали так, чтобы образовывалось 50-200 колоний на планшет, и эти клетки инкубировали в течение 3 ч и в течение ночи при 37 С для адгезии. Затем в течение максимального времени инкубирования, то есть 24 ч, клетки обрабатывали 400 мкМ наночастиц или агрегатов наночастиц HfO2, полученных, как описано в примере 1 (с плотностью, равной 8,5) и в примере 2 (с плотностью, равной 6,5). Раковые клетки HT29 облучали дозой 4 Гр, а раковые клетки НСТ 116 облучали дозой 2 Гр с использованием излучателя с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи). После облучения клетки инкубировали в течение более 8 дней при 37 С, а затем окрашивали 0,5% кристаллическим фиолетовым в абсолютном метаноле. При этом подсчитывали только колонии, содержащие по меньшей мере 50 клеток. SFx определяли по следующей формуле: Результаты: влияние плотности на чувствительность или резистентность клеток к радиоактивному облучению. Как показано на фиг. 5 В, облучение почти не оказывало значимого воздействия на раковые клетки,чувствительные к радиоактивному излучению (НСТ 116), и раковые клетки, резистентные к радиоактивному излучению (НТ 29), в которые были введены наночастицы или агрегаты наночастиц HfO2 или которые находились в контакте с указанными наночастицами или их агрегатами, полученными, как описано в примере 2 (с плотностью, равной 6,5), по сравнению с необработанными контрольными клетками. Однако обработка раковых клеток наночастицами или агрегатами наночастиц HfO2, полученными, как описано в примере 1 (с плотностью, равной 8,5), приводила к значимому увеличению уровня индуцированной облучением гибели раковых клеток, чувствительных к радиоактивному излучению (НСТ 116) и раковых клеток, резистентных к радиоактивному излучению (НТ 29). Пример 5. Клоногенный анализ, проводимый с использованием биологически совместимой суспензии наночастиц или агрегатов наночастиц HfO2, полученных, как описано в примере 3 (фиг. 8). Выживаемость клеток количественно оценивали с помощью стандартизированного анализа на образование колоний. Стеклянные чашки с культурой переносили в линейный ускоритель сразу после максимального 24-часового инкубирования клеток с наночастицами или агрегатами наночастиц HfO2 (400 мкМ). Клетки облучали различными дозами излучения (мощность дозы; 1 Гр/мин, 200 кэВ: Tube CometMXR-225/22-200 кВ/15 мА/0,2 ммКи, при комнатной температуре). Результаты, полученные для раковых клеток, чувствительных к радиоактивному излучению, и раковых клеток, резистентных к радиоактивному излучению (фиг. 8), позволяют определить коэффициент усиления излучения (ER) для наночастиц. Клетки НТ 29 обнаруживали ER=1,60 лишь при одной дозе 4 Гр, тогда как клетки НСТ 116 обнаруживали ER=1,33 для эквивалентной дозы. Полученные данные показали, что наночастицы в комбинации с облучением ответственны за клоногенное ингибирование, коррелирующее со снижением выживаемости клеток, а именно клеточных линий, чувствительных к радиоактивному излучению и резистентных к радиоактивному излучению. Пример 6. Анализ на жизнеспособность клеток, проводимый с использованием биологически совместимой суспензии наночастиц или агрегатов наночастиц HfO2, полученных, как описано в примере 3(фиг. 10). Жизнеспособность клеток измеряли с помощью набора WST-1 после 24-часовой обработки в отсутствие или в присутствии наночастиц (800 мкМ) различными дозами облучения (до 6 Гр), подаваемыми излучателем рентгеновских лучей с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи). Действие наночастиц проиллюстрировано на фиг. 10. Присутствие 800 мкМ наночастиц приводило к снижению жизнеспособности клеток по сравнению с жизнеспособностью контрольных клеток, не содержащих каких-либо наночастиц. Наночастицы, подвергнутые облучению рентгеновскими лучами в дозе 1 Гр, обладали эффективностью, аналогичной эффективности контроля, облученного рентгеновскими лучами в дозе 3 Гр (только лучевая терапия). При использовании только одних наночастиц каких-либо признаков токсичности не наблюдалось. Эксперименты, проведенные с использованием 10 различных концентраций, давали аналогичные результаты. Это явно свидетельствовало о том, что действие наночастиц усиливалось при увеличении дозы. Неожиданно было обнаружено, что эффективное действие наблюдалось при лучевой терапии низкими дозами, что указывает на то, что наночастицы можно использовать в стандартных схемах лучевой терапии,но, при этом, существует перспектива возможного снижения дозы, используемой при стандартной лучевой терапии, с сохранением аналогичной или даже более высокой эффективности, чем эффективность,наблюдаемая при обычной терапии. Пример 7. Дисперсия наночастиц после внутриопухолевой инъекции с использованием биологически совместимой суспензии наночастиц, полученной, как описано в примере 3 (фиг. 1). Суспензию наночастиц вводили путем внутриопухолевой инъекции "голым" мышам Swiss, несущим опухоль НСТ 116. Время пребывания наночастиц в опухоли составляло по меньшей мере 15 дней, но исследование в течение более длительного периода времени не проводили, что было обусловлено необходимостью умерщвления мышей из этических соображений. Кроме того, эти наночастицы присутствовали на высоком уровне контраста и легко детектировались с помощью рентгеновской микротомографии. Поэтому микротомографию проводили в течение 2-15 дней после инъекции наночастиц для оценки возможной утечки продукта из опухоли. Очевидно, что распределение наночастиц в опухоли оставалось эквивалентным в течение 2-15 дней и что эти наночастицы сохранялись в опухоли (более 15 дней). Пример 8. Исследование эффективности наночастиц, проводимое на модели опухоли НСТ 116 с использованием наночастиц, полученных, как описано в примере 3 (фиг. 6, 7 и 9). Суспензию наночастиц вводили путем внутриопухолевой инъекции "голым" мышам Swiss, несущим опухоли НСТ 116, трансплантированные в бок. Местное облучение опухоли осуществляли с помощью аппликатора, подсоединенного к внешнему источнику излучения, с использованием устройства для лучевой терапии, содержащего источник иридия-192. Локализация и время присутствия источника иридия-192 поблизости от опухоли оптимизировали для подачи в эту опухоль дозы излучения 4 или 8 Гр на фракцию. Затем группе мышей вовнутрь опухоли вводили наночастицы (объем инъекции составлял 2050% от объема опухоли), и этих мышей либо не облучали, либо облучали двумя дозами излучения в 4 Гр(через 24 и 48 ч после инъекции). Затем второй группе мышей вовнутрь опухоли вводили наночастицы (объем инъекции составлял 20-50% от объема опухоли), и этих мышей либо не облучали, либо облучали одной дозой излучения в 8 Гр (через 24 ч после инъекции). 4 группы мышей сравнивали с животными, обработанными носителем,которые были подвергнуты или не были подвергнутый лучевой терапии. Затем два раза в неделю проводили мониторинг объема опухоли для каждой группы. Наночастицы давали полную регрессию опухоли по сравнению с опухолями у контрольных мышей, подвергаемых только лучевой терапии. Оценка, проводимая на 20 день после облучения, обнаруживала 100% ингибирование роста опухоли у мышей, обработанных наночастицами после облучения в дозе 24 Гр или 18 Гр по сравнению с опухолью у контрольных животных, подвергаемых только лучевой терапии по той же самой схеме. Применение раздельного облучения давало лучшее отношение "польза-риск" по сравнению с группой, облученной по стандартной схеме. В соответствии с этим может быть проведена схема раздельного облучения путем лучевой терапии низкими дозами. Такая схема давала лучшее отношение "польза-риск" по сравнению со схемой стандартной лучевой терапии. Действительно, такая схема раздельного облучения позволяет снизить негативное побочное действие на здоровые ткани, наблюдаемое при проведении стандартных схем терапии, и позволяет достичь эквивалентную или даже лучшую эффективность лечения. Пример 9. Клоногенный анализ, проводимый с использованием биологически совместимой суспензии наночастиц или агрегатов наночастиц HfO2, полученных, как описано в примере 3, с использованием либо источника рентгеновского излучения с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи), либо источника кобальта 60 (фиг. 11 А и 11 В). Материалы и методы. Перед проведением анализа на жизнеспособность клеток или определением числа выживших клеток при облучении, выражаемом в греях (SFx), оценивали эффективность посева раковой клеточной линии HT1080 (раковых клеток, резистентных к лучевой терапии). Клетки высевали при плотности 50-200 колоний в соответствии со схемой лечения. При адгезии клеток добавляли 400 мкМ наночастиц или агрегатов наночастиц HfO2, полученных, как описано в примере 3 (с плотностью, равной 8,3 г/см 3), и инкубировали в течение максимум 24 ч. Облучение клеток осуществляли с использованием излучателя с энергией 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи) (фиг. 11 А) и источника кобальта-60(фиг. 11 В). После облучения, клетки инкубировали в течение примерно 8 дней при 37 С, а затем фиксировали и окрашивали раствором кристаллического фиолетового. При этом подсчитывали только колонии, содержащие по меньшей мере 50 клеток. SFx определяли по следующей формуле: Результаты: влияние облучения на клетки, резистентные к радиоактивному облучению. Как показано на фиг. 11 А и 11 В, обработка раковых клеток наночастицами или агрегатами наночастиц HfO2, полученных, как описано в примере 3 (с плотностью, равной 8,3), приводила к значимому увеличению уровня индуцированной облучением гибели раковых клеток, резистентных к радиоактивному излучению (НТ 1080) и облученных с использованием излучателя с энергией 200 кэВ (Tube CometMXR-225/22-200 кВ/15 мА/0,2 ммКи) или источника кобальта-60. Результаты позволили определить коэффициент усиления излучения (ER) для наночастиц. Клетки НТ 1080 обнаруживали ER=1,38 лишь при одной дозе 4 Гр, подаваемой источником излучения в 200 кэВ(Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи), и ER=1 для эквивалентной дозы, подаваемой источником кобальта-60. Полученные данные показали, что эти наночастицы ответственны за преимущественное клоногенное ингибирование облученных клеточных линий HT1080, резистентных к радиоактивному излучению, где указанное облучение подавалось либо источником энергии низкоионизирующего излучения, либо источником энергии высокоионизирующего излучения. Вышеуказанные результаты продемонстрировали эффективность биологически совместимых наночастиц или агрегатов наночастиц, состоящих из оксида и имеющих плотность более 7 г/см 3, в отношении индуцирования гибели клеток (даже клеток, резистентных к радиоактивному облучению), которые были облучены источником радиоактивного излучения, в частности источником излучения высокой энергии. Пример 10. Влияние плотности биологически совместимых наночастиц или агрегатов наночастиц,состоящих из оксида, на жизнеспособность клеток. Анализ WST-1 позволяет осуществлять скрининг эффективности наночастиц или агрегатов наночастиц в отношении их воздействия на жизнеспособность клеток. В данном случае были протестированы биологически совместимые неорганические наночастицы или агрегаты наночастиц с различной плотностью. Жизнеспособность клеток определяли после их 24-часовой обработки наночастицами (от 800 мкМ до 3,125 мкМ) или после обработки в отсутствие наночастиц при фиксированной дозе облучения (2 Гр) с использованием источника 200 кэВ (Tube Comet MXR-225/22-200 кВ/15 мА/0,2 ммКи) и последующего инкубирования в течение 96 ч. Жизнеспособность клеток, обработанных биологически совместимыми наночастицами или агрегатами наночастиц (400 мкМ), состоящих из оксида, определяли после подачи дозы облучения 2 Гр, а затем строили кривую (см. фиг. 12 А-L). Снижение жизнеспособности клеток более чем на 20% (20%) при 400 мкМ по сравнению с жизнеспособностью клеток, подвергнутых только лучевой терапии (в отсутствие наночастиц), рассматривалось как значимое. Действительно, если указанные биологически совместимые наночастицы или агрегаты наночастиц участвовали в клоногенных анализах, то они давали коэффициент усиления излучения (ER),равный 1,33 для клеточных линий НСТ 116 и 1,60 для клеточных линий НТ 29 (см. пример 5). В противоположность этому, снижение жизнеспособности клеток менее чем или равное 20%(20%) при 400 мкМ, по сравнению с жизнеспособностью клеток, подвергнутых только лучевой терапии(в отсутствие наночастиц), рассматривалось как незначимое. Действительно, если указанные биологически совместимые наночастицы или агрегаты наночастиц участвовали в клоногенных анализах, то облучение почти не оказывало значимого воздействия на раковые клетки, чувствительные к радиоактивному излучению (НСТ 116) и раковые клетки, резистентные к радиоактивному излучению (НТ 29) (см. пример 4). Описание методов получения различных тестируемых оксидов приводится в п.a)-d). Коммерчески доступные наночастицы описаны в п.е). Величины плотности, жизнеспособность клеток при 400 мкМ(по сравнению с жизнеспособностью клеток, подвергнутых только лучевой терапии) и относительная эффективность при 800 мкМ приводятся в нижеследующих таблицах (см. п.а)-е. На фиг. 12 проиллюстрирована жизнеспособность клеток (% от контроля) после обработки наночастицами или агрегатами наночастиц с дозой облучения 2 Гр. Как указывалось выше, на фиг. 13 представлена относительная эффективность (способность индуцировать клеточную гибель), выраженная в процентах. Указанная относительная эффективность является показателем жизнеспособности клеток (% от контроля) после облучения частицами в дозе 2 Гр, тестируемыми, как описано в примере 10 при 800 мкМ, по сравнению с жизнеспособностью клеток, подвергаемых лишь одной лучевой терапии (без наночастиц); и показателем жизнеспособности клеток (% от контроля) после обработки биологически совместимыми наночастицами или агрегатами наночастицHfO2 (см. пример 3), при 800 мкМ, по сравнению с жизнеспособностью клеток, подвергаемых лишь одной лучевой терапии (без наночастиц). Анализы на эффективность in vitro, проводимые в этом исследовании, указывали на важное значение, которое имеет плотность оксида с пороговым эффектом d7 г/см 3 (см. фиг. 13). Были использованы две группы наночастиц, значительно отличающиеся по своей эффективности: с плотностью 7 г/см 3: относительная эффективность тестируемых наночастиц была приблизительно ниже 55%;- 20023012 с плотностью 7 г/см 3: относительная эффективность тестируемых наночастиц превышала примерно 80%. а) Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида гафния(HfO2), имеющая плотность от 6,7 до 8,3 г/см 3 и полученная с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. Раствор гидроксида тетраметиламмония (ТМАОН) добавляли к 40 г раствора HfCl4. Добавление раствора ТМАОН осуществляли до тех пор, пока рН конечной суспензии не достигал нужного значения рН, указанного в табл. 2. В результате получали белый осадок. Затем этот осадок переносили в автоклав и нагревали при температуре 120-300 С для кристаллизации. После охлаждения суспензию промывали деионизованной водой. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию гексаметафосфата натрия добавляли к пептизованному раствору (количество добавленного гексаметафосфата натрия было ниже летальной дозы (LD) 50/5) и рН суспензии доводили до 6,5-7,5. Как видно из нижеследующей табл. 2, плотность наночастиц HfO2 может быть модулирована путем точной коррекции рН исходной суспензии. Данные, относящиеся к жизнеспособности облученных клеток, обработанных каждым из оксидов, представленных в табл. 2, приводятся на фиг. 12 А-12 С соответственно. Таблица 2b) Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида церия(СеО 2) с плотностью от 6,5 до 7,1, полученная с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. Синтез СеО 2 был адаптирован в соответствии с описанием ZhouA.I., Chem. Mater, 2003, 15, 378382. Ce(SO4)24 Н 2 О растворяли в деионизованной воде с получением 0,4 М раствора. Затем по каплям,постоянно перемешивая при комнатной температуре, добавляли раствор аммония. Раствор аммония добавляли так, чтобы отношение конечного объема раствора аммония к раствору сульфата церия составляло 1:5. Затем полученную суспензию промывали 4 раза деионизованной водой при центрифугировании. Конечный осадок суспендировали в деионизованной воде и получали растворы предшественников оксида церия 0,05 М (СеО 2-1) или 0,2 М (СеО 2-2) при рН 4. Растворы СеО 2-1 и СеО 2-2 подвергали гидротермической обработке при 180 С в течение 24 ч. Затем образцы 4 раза промывали деионизованной водой при центрифугировании. И наконец, каждый образец сушили при 105 С и подвергали термической обработке. Образец СеО 2-1 подвергали обжигу при 700 С в течение 1 ч, а СеО 2-2 - при 900 С в течение 1 ч и получали образцы CeO2-S и CeO2-W соответственно. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию гексаметафосфата натрия добавляли к пептизованному раствору (количество добавленного гексаметафосфата натрия было ниже летальной дозы (LD) 50/5) и рН суспензии доводили до 6,5-7,5. Как видно из нижеследующей табл. 3, плотность наночастиц СеО 2 может быть модулирована путем точной коррекции температуры и времени термообработки. Данные, относящиеся к жизнеспособности облученных клеток, обработанных каждым из оксидов, представленных в табл. 3, приводятся на фиг. 12D и 12 Е соответственно. с) Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида туллия(Tm2O3) с плотностью от 2,7 до 8,3 г/см 3 5 г TmCl3 растворяли в 2 М HCl. К раствору TmCl3 добавляли раствор гидроксида тетраметиламмония (ТМАОН) до рН 7 (Tm2O3-0) или 8 (Tm2O3-1). Был получен белый осадок. Осадок подвергали гидротермической обработке в автоклаве, то есть нагревали при температуре 120-300 С. Затем полученную суспензию промывали деионизованной водой при центрифугировании и сушили при 105 С в течение ночи. Порошки подвергали обжигу:Tm2O3: 800 С, 2 ч. Как видно из нижеследующей табл. 4, плотность наночастиц Tm2O3 может быть модулирована путем точной коррекции температуры и времени термообработки. Таблица 4d) Биологически совместимая суспензия наночастиц или агрегатов наночастиц из оксида титана(TiO2) с плотностью ниже 7 г/см 3, полученная с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. 15 мл TiCl4 по каплям добавляли к 180 мл 3 M раствора HCl при легком помешивании. Затем добавляли 120 мл деионизованной воды до конечного объема 215 мл. рН раствора постепенно доводили до 2 с использованием 3 М раствора NaOH. Раствор превращался в белый осадок, который нагревали при 60 С в течение 24 ч. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию гексаметафосфата натрия добавляли к пептизованному раствору (количество добавленного гексаметафосфата натрия было ниже LD 50/5) и рН суспензии доводили до 6,5-7,5. Данные, относящиеся к жизнеспособности облученных клеток, обработанных оксидом TiO2, представлены в табл. 5 и на фиг. 12F. Таблица 5 е) Биологически совместимая суспензия коммерчески доступных наночастиц или агрегатов наночастиц из оксида с плотностью от 3,8 до 7,9 г/см 3, полученная с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. Все оксидные наночастицы или агрегаты наночастиц получали в виде коммерчески доступных порошков (с наивысшей степенью чистоты). Порошки диспергировали в водном растворе и обрабатывали ультразвуком для получения эффективной дисперсии в растворе. Стадию пептизации осуществляли для получения стабильной суспензии наночастиц или агрегатов наночастиц. Затем суспензию гексаметафосфата натрия добавляли к пептизованному раствору (количество до- 22023012 бавленного гексаметафосфата натрия было ниже LD 50/5) и рН суспензии доводили до 6,5-7,5. Данные, относящиеся к жизнеспособности облученных клеток, обработанных каждым из оксидов,представленных в табл. 6, приводятся на фиг. 12C, 12 Н, 12I, 12J, 12K и 12L соответственно. Таблица 6 Пример 11. Важная роль нанесения биологически совместимого покрытия на поверхность для обеспечения эффективной стабильности суспензии наночастиц или агрегатов наночастиц из оксида титана (TiO2), оксида церия (СеО 2) и оксида гафния (HfO2), полученной с использованием гексаметафосфата натрия в качестве агента для нанесения покрытий. Для применения in vivo активируемые наночастицы или агрегаты наночастиц должны быть биологически совместимыми. Во избежание агрегации в кровотоке и для эффективного биологического распределения (EPR-эффект) биологически совместимые наночастицы должны иметь высокую стабильность в физиологической среде (6,5 рН 7,5). Поэтому перед инъекцией этих частиц необходимо проверить стабильность суспензии наночастиц или агрегатов наночастиц в физиологических условиях. Авторами настоящего изобретения была проведена оценка стабильности частиц с НМР-покрытием или без НМР-покрытия в воде и глюкозе (5%). Стабильность подтверждали визуально в различных средах и путем оценки выхода после фильтрации, проводимой с использованием 0,22-мкм фильтра. Результаты: стабильность. Суспензии наночастиц (TiO2-5 нм, пример 10d), коммерчески доступные частицы CeO2-D, пример 10 е) и HfO2-этал., пример 3) - пептизованную суспензию при рН 3 или суспензию при рН 7 - без НМР,используемые в качестве агента для нанесения биологически совместимого покрытия на поверхность,приготавливали в растворе глюкозы (5%). Суспензии наночастиц при рН 7 с НМР-покрытием также приготавливали в растворе глюкозы (5%). Концентрация наночастиц в каждой суспензии составляла примерно 5 г/л. Каждый образец оставляли на 2 ч и первый дискриминирующий анализ на стабильность наночастиц в суспензии проводили визуально (фиг. 14). Эта предварительная оценка показала, что все образцы без покрытия оставались стабильными при рН 3 в воде и в растворе глюкозы (5%), что было обусловлено наличием положительных зарядов на поверхности этих частиц, поскольку все частицы имели изоэлектрическую точку (IEP), наиболее соответствующую рН 6-7. При повышении рН данной суспензии (в воде или в глюкозе) до 7 наблюдалось осаждение наночастиц, и в этом случае рН соответствовал IEP. Частицы с НМР-покрытием обнаруживали резкое увеличение стабильности при рН 7 в воде и в растворе глюкозы (5%). Результаты: выход после фильтрации. Фильтры с отсечкой 0,22 мкм пропускают только в высокой степени диссоциированные наночастицы или агрегаты наночастиц. При образовании даже очень небольших агрегатов частицы остаются на фильтре и быстро его засоряют. Концентрацию частиц оценивали исходя из равновесия до и после фильтрации. Данные, представленные на фиг. 15, продемонстрировали важную роль биологически совместимого покрытия, которое оказалось совершенно необходимым для улучшения поверхностных свойств наночастиц и для повышения стабильности этих наночастиц в физиологических условиях. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ модификации или разрушения клеток-мишеней у животного при облучении указанных клеток ионизирующим излучением, отличающийся тем, что применяют фармацевтическую композицию,содержащую наночастицу, агрегат наночастиц или их смесь, где указанные наночастица или агрегат наночастиц состоят из оксида металла, где плотность указанной наночастицы или плотность указанного агрегата наночастиц составляет более 7 г/см 3 и где указанные наночастица или агрегат наночастиц имеют биологически совместимое покрытие, позволяющее указанным наночастице и/или агрегату наночастиц сохранять стабильность при рН 6,5-7,5 в физиологической жидкости. 2. Способ по п.1, где указанный оксид металла выбран из группы, состоящей из СеО 2, Nd2O3,Sm2O3, Eu2O3, Gd2O3, Tb2O3, Dy2O3, Ho2O3, Er2O3, Tm2O3, Yb2O3, Lu2O3, HfO2, TaO2, Ta2O5, WO2, WO3,- 23023012ReO2, OsO2, IrO2, PtO, PtO2, HgO, Hg2O, Tl2O3, PbO, Pb2O3, Pb3O4, PbO2, PoO2, Bi2O3, NbO, RuO2, Rh2O3,RhO2, PdO, Ag2O, AgO, CdO, In2O3. 3. Способ по п.2, где указанным оксидом металла является HfO2. 4. Способ по п.1, в котором биосовместимое покрытие представляет собой биологически неразлагаемое покрытие, выбранное из группы, состоящей из двуокиси кремния, окиси алюминия, сахара, фосфата, силана, цвиттерионных соединений, липидов, насыщенных углеводородных полимеров и неорганических полимеров; или биологически разлагаемое покрытие, выбранное из группы, состоящей из биологического полимера, фосфолипида, сахарида, олигосахарида или полисахарида. 5. Способ по п.1, где размер наночастицы или агрегата наночастиц составляет 10-200 нм. 6. Способ по п.1, где указанное ионизирующее излучение выбрано из группы, состоящей из рентгеновского излучения, -излучения, пучков электронов и излучения радиоактивных изотопов. 7. Способ по п.1, где указанное ионизирующее излучение имеет энергию от 2 до 25000 кэВ. 8. Способ по п.7, где указанное ионизирующее излучение имеет энергию от 2 до 6000 кэВ. 9. Способ по п.7, где указанное ионизирующее излучение имеет энергию от 2 до 1500 кэВ. 10. Способ по п.1, где указанные наночастица или агрегат наночастиц состоят из оксида металла,имеющего эффективный атомный номер (Zeff) по меньшей мере 50. 11. Способ по п.1, где указанные наночастица или агрегат наночастиц имеют, по существу, сферическую форму. 12. Способ по п.1, где указанные клетки-мишени выбраны из группы, состоящей из доброкачественных клеток, предзлокачественных клеток и злокачественных клеток. 13. Способ по п.12, где указанными злокачественными клетками являются клетки опухоли из группы, состоящей из гематологической опухоли и солидной опухоли. 14. Способ по п.1, где указанная фармацевтическая композиция содержит дополнительное терапевтическое соединение, которое отличается от наночастицы или агрегата наночастиц, предназначенное для лечения рака. 15. Способ по п.1, где указанным животным является человек. 16. Фармацевтическая композиция, способная генерировать электроны и/или фотоны высокой энергии при возбуждении ионизирующим излучением, содержащая наночастицу, агрегат наночастиц или их смесь и фармацевтически приемлемый эксципиент, причем указанные наночастица или агрегат наночастиц состоят из оксида металла, где плотность указанной наночастицы или плотность указанного агрегата наночастиц составляет более 7 г/см 3 и где наночастица или агрегат наночастиц имеют биологически совместимое покрытие, позволяющее указанным наночастице или агрегату наночастиц сохранять стабильность при рН 6,5-7,5 в физиологической жидкости. 17. Фармацевтическая композиция по п.16, предназначенная для модификации или разрушения клеток-мишеней у млекопитающего при облучении указанных клеток ионизирующим излучением. 18. Фармацевтическая композиция по п.16, предназначенная для детекции или визуализации и последующей модификации или разрушения клеток-мишеней у животного при облучении указанных клеток ионизирующим излучением.
МПК / Метки
МПК: A61P 35/00, A61K 41/00
Метки: разрушения, неорганические, клеток, высокой, наночастицы, плотности, используемые
Код ссылки
<a href="https://eas.patents.su/30-23012-neorganicheskie-nanochasticy-vysokojj-plotnosti-ispolzuemye-dlya-razrusheniya-kletok-in-vivo.html" rel="bookmark" title="База патентов Евразийского Союза">Неорганические наночастицы высокой плотности, используемые для разрушения клеток in vivo</a>
Предыдущий патент: Огнезащитный состав
Следующий патент: Пептид, индуцирующий противоопухолевый иммунный ответ, и его применение
Случайный патент: Способ и устройство для конденсации паров металлов и других веществ