Антагонисты рецепторов trpm8
Номер патента: 22943
Опубликовано: 31.03.2016
Авторы: Либерати Кьяра, Арамини Андреа, Лоренци Симоне, Беккари Андреа, Боволента Сильвия, Морикони Алессио, Бьянкини Джанлука, Брандолини Лаура
Формула / Реферат
1. Соединение, имеющее формулу (I)
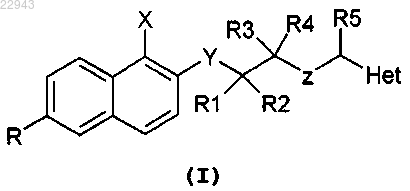
и его фармацевтически приемлемые соли, где
R выбран из Н, Br, CN, NO2, SO2NH2, SO2NHR' и SO2N(R')2, где R' выбран из линейного или разветвленного C1-С4алкила;
X выбран из F, Cl, C1-С3алкила, NH2 и OH;
Y выбран из -O-, CH2, NH и SO2;
R1 и R2, независимо друг от друга, выбраны из H, F и линейного или разветвленного C1-С4алкила;
R3 и R4, независимо друг от друга, выбраны из H, линейного или разветвленного C1-С4алкила;
Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из H, линейного или разветвленного C1-С4алкила;
R5 представляет собой остаток, выбранный из H, линейного или разветвленного C1-С4алкила;
Het представляет собой гетероарильную группу, выбранную из пирролила, N-метилпирролила, тиофенила, фурила и пиридинила, незамещенного или замещенного одним или более заместителями, выбранными из F, Cl, CH3, NH2 и OH.
2. Соединение по п.1, в котором, независимо друг от друга,
R выбран из H, Br и CN;
X выбран из F, Cl и C1-С3алкила;
Y выбран из -O-, CH2, NH и SO2;
R1 и R2, независимо друг от друга, выбраны из Н, F и CH3;
R3 и R4, независимо друг от друга, выбраны из Н и CH3;
Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из Н и CH3;
R5 выбран из Н и CH3.
3. Соединение по п.1 или 2, в котором, независимо друг от друга, R выбран из Н и CN;
X выбран из F и Cl;
Y выбран из CH2, О и SO2;
Z выбран из NH и N+(CH3)2;
R5 обозначает Н;
Het замещен по меньшей мере одним заместителем, выбранным из F, Cl и CH3.
4. Соединение по любому из пп.1-3, где Het обозначает 5-замещенный пиррол-2-ил, 5-замещенный N-метилпиррол-2-ил, 5-замещенный тиофен-2-ил или 5-замещенный фур-2-ил.
5. Соединение по любому из пп.1-4, выбранное из группы, включающей следующие соединения:
2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорид (1);
2-[(1-хлорнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]этанаминийхлорид (2);
N-[(5-хлорфуран-2-ил)метил]-2-[(1-хлорнафталин-2-ил)окси]этанаминий (3);
2-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]этанаминий (4);
2-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанаминий (5);
2-[(1-хлорнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанаминий (6);
2-[(1-хлорнафталин-2-ил)окси]-N-[(1-метил-1H-пиррол-2-ил)метил]этанаминий (7);
1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-2-метилпропан-2-амин (8);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-[(5-метилфуран-2-ил)метил]пропан-2-амин (9);
N-[(5-хлорфуран-2-ил)метил]-1-[(1-хлорнафталин-2-ил)окси]-2-метилпропан-2-амин (10);
1-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]-2-метилпропан-2-амин (11);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-(тиофен-2-илметил)пропан-2-амин (12);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-(пиридин-2-илметил)пропан-2-амин (13);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-1H-[(1-метил-1H-пиррол-2-ил)метил]пропан-2-амин (14);
2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)пропан-1-амин (15);
2-[(1-хлорнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]пропан-1-амин (16);
N-[(5-хлорфуран-2-ил)метил]-2-[(1-хлорнафталин-2-ил)окси]пропан-1-амин (17);
2-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]пропан-1-амин (18);
2-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)пропан-1-амин (19);
1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)пропан-2-амин (20);
1-[(1-хлорнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]пропан-2-амин (21);
N-[(5-хлорфуран-2-ил)метил]-1-[(1-хлорнафталин-2-ил)окси]пропан-2-амин (22);
1-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]пропан-2-амин (23);
1-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)пропан-2-амин (24);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-(фуран-2-илметил)этанамин (25);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(5-метилфуран-2-ил)метил]этанамин (26);
N-[(5-хлорфуран-2-ил)метил]-2-[(1-хлорнафталин-2-ил)сульфонил]этанамин (27);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(5-хлортиофен-2-ил)метил]этанамин (28);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-(тиофен-2-илметил)этанамин (29);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-(пиридин-2-илметил)этанамин (30);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(1-метил-1H-пиррол-2-ил)метил]этанамин (31);
3-(1-хлорнафталин-2-ил)-N-(фуран-2-илметил)пропан-1-амин (32);
3-(1-хлорнафталин-2-ил)-N-[(5-метилфуран-2-ил)метил]пропан-1-амин (33);
N-[(5-хлорфуран-2-ил)метил]-3-(1-хлорнафталин-2-ил)пропан-1-амин (34);
3-(1-хлорнафталин-2-ил)-N-[(5-хлортиофен-2-ил)метил]пропан-1-амин (35);
3-(1-хлорнафталин-2-ил)-N-(тиофен-2-илметил)пропан-1-амин (36);
3-(1-хлорнафталин-2-ил)-N-(пиридин-2-илметил)пропан-1-амин (37);
2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-N-метилэтанамин (38);
2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-N,N-диметилэтанаминий йодид (39);
N-{2-[(1-хлорнафталин-2-ил)окси]этил}-1-(5-метилфуран-2-ил)этанамин (40);
N-(1-хлорнафталин-2-ил)-N'-(фуран-2-илметил)метан-1,2-диамин (41);
N-(1-хлорнафталин-2-ил)-N'-[(5-метилфуран-2-ил)метил]этан-1,2-диамин (42);
N-[(5-хлорфуран-2-ил)метил]-N'-(1-хлорнафталин-2-ил)метан-1,2-диамин (43);
N-(1-хлорнафталин-2-ил)-N'-[(5-хлортиофен-2-ил)метил]этан-1,2-диамин (44);
N-(1-хлорнафталин-2-ил)-N'-(тиофен-2-илметил)этан-1,2-диамин (45);
N-(1-хлорнафталин-2-ил)-N'-(пиридин-2-илметил)метан-1,2-диамин (46);
N-(1-хлорнафталин-2-ил)-N'-[(1-метил-1H-пиррол-2-ил)метил]этан-1,2-диамин (47);
2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (48);
2-[(1-фторнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]этанамин (49);
N-[(5-хлорфуран-2-ил)метил]-2-[(1-фторнафталин-2-ил)окси]этанамин (50);
N-[(5-хлортиофен-2-ил)метил]-2-[(1-фторнафталин-2-ил)окси]этанамин (51);
2-[(1-фторнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанамин (52);
2-[(1-фторнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанамин (53);
2-[(1-фторнафталин-2-ил)окси]-N-[(1-метил-1H-пиррол-2-ил)метил]этанамин (54);
5-хлор-6-{2-[(пиридин-2-илметил)амино]этокси}нафталин-2-карбонитрил (55);
5-хлор-6-{2-[(фуран-2-илметил)амино]этокси}нафталин-2-карбонитрил (56);
5-хлор-6-(2-{[(5-метилфуран-2-ил)метил]амино}метокси)нафталин-2-карбонитрил (57);
5-хлор-6-(2-{[(5-хлорфуран-2-ил)метил]амино}метокси)нафталин-2-карбонитрил (58);
5-хлор-6-(2-{[(5-хлортиофен-2-ил)метил]амино}метокси)нафталин-2-карбонитрил (59);
5-хлор-6-{2-[(тиофен-2-илметил)амино]этокси}нафталин-2-карбонитрил (60);
2-[(1-этилнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (61);
2,2-дифтор-2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (62);
2-[(6-бром-1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (63).
6. Соединение по любому из пп.1-5, выбранное из группы, состоящей из следующих соединений:
2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорида (1);
2-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанаминия (5);
2-[(1-хлорнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанаминия (6);
1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-2-метилпропан-2-амина (8);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-(пиридин-2-илметил)пропан-2-амина (13);
1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-[(1-метил-1H-пиррол-2-ил)метил]пропан-2-амина (14);
2-[(1-хлорнафталин-2-ил)сульфонил]-N-(фуран-2-илметил)этанамина (25);
3-(1-хлорнафталин-2-ил)-N-(фуран-2-илметил)пропан-1-амина (32);
3-(1-хлорнафталин-2-ил)-N-[(5-метилфуран-2-ил)метил]пропан-1-амина (33);
N-[(5-хлорфуран-2-ил)метил]-3-(1-хлорнафталин-2-ил)пропан-1-амина (34);
3-(1-хлорнафталин-2-ил)-N-[(5-хлортиофен-2-ил)метил]пропан-1-амина (35);
2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамина (48);
2-[(1-фторнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанамина (52);
2-[(1-фторнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанамина (53);
5-хлор-6-{2-[(пиридин-2-илметил)амино]этокси}нафталин-2-карбонитрила (55);
5-хлор-6-{2-[(тиофен-2-илметил)амино]этокси}нафталин-2-карбонитрила (60).
7. Применение соединения по любому из пп.1-6 для предупреждения и/или лечения расстройств и/или заболеваний, связанных с активностью TRPM8 (катионного канала транзиторного рецепторного потенциала, подсемейство M, член 8).
8. Применение соединения по п.7, где указанное расстройство и/или заболевание выбрано из группы, включающей воспалительные заболевания, ишемию, боль, урологические расстройства, инсульт, психиатрические расстройства и нейродегенерацию.
9. Применение соединения по п.7 или 8, где указанные расстройства и/или заболевания выбраны из хронической боли, невропатической боли, включая холодовую аллодинию и диабетическую невропатическую боль, послеоперационной боли, боли при остеоартрите, боли при ревматоидном артрите, раковой боли, невралгии, фибромиалгии, невропатии, повышенной чувствительности к боли, повреждения нерва, мигрени, головных болей, зуда, синдрома раздраженного кишечника и заболеваний дыхательных путей, синдрома болезненного мочевого пузыря, интерстициального цистита, гиперактивности детрузора (гиперактивный мочевой пузырь), недержания мочи, нейрогенной гиперактивности детрузора (гиперфлексии детрузора), идиопатической детрузорной гиперактивности (нестабильности детрузора), доброкачественной гиперплазии предстательной железы, расстройств нижних мочевых путей и симптомов нижних мочевых путей, тревоги и депрессии.
10. Фармацевтическая композиция, предназначенная для лечения и/или предотвращения заболеваний, связанных с активностью катионного канала транзиторного рецепторного потенциала, подсемейство M, член 8 (TRPM8), содержащая в качестве активного ингредиента по меньшей мере одно соединение по любому из пп. 1-6 в комбинации с подходящими эксципиентами и/или разбавителями.
11. Фармацевтическая композиция по п.10, пригодная для введения внутрипузырным способом, внутривенно, дермальным способом, пероральным способом и посредством ингаляции.
12. Фармацевтическая композиция по п.10 или 11 в виде формы препарата с регулируемым высвобождением.
13. Способ получения соединения по любому из пп.1-6, включающий следующие стадии:
взаимодействие аминного промежуточного соединения (IA)
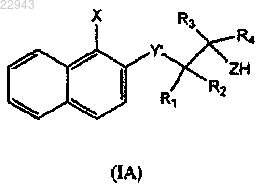
где X, R1, R2, R3, R4 и Z имеют такие же значения, как в формуле (I), и Y' означает O, CH2, NH и S, с R5CO-Het, где Het и R5 имеют такие же значения, как в формуле (I), и последующее добавление к реакционной смеси мягкого восстановителя с получением, таким образом, соединения (IB)
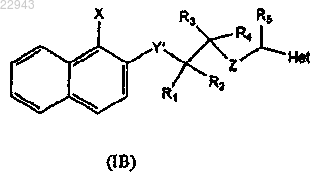
которое соответствует конечному соединению формулы (I) в случае, если Y' означает О, CH2, NH, и в случае, если Y' означает S, указанный способ дополнительно включает следующую стадию: окисление соединения (IB) с получением соединения формулы (I), имеющей Y, означающий SO2.
Текст
Соединения, действующие в качестве селективных антагонистов катионного канала транзиторного рецепторного потенциала, подсемейство M, член 8 (здесь и далее обозначен как TRPM8), имеющие формулу (I), где R выбран из Н, Br, CN, NO2, SO2NH2, SO2NHR' и SO2NR'2, где R' выбран из линейного или разветвленного С 1-С 4 алкила; X выбран из F, Cl, С 1-С 3 алкила, NH2 и OH; Y выбран из О, CH2, NH и SO2; R1 и R2, независимо друг от друга, выбраны из Н, F и линейного или разветвленного С 1-С 4 алкила; R3 и R4, независимо друг от друга, выбраны из Н и линейного или разветвленного С 1-С 4 алкила; Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга,выбраны из Н и линейного или разветвленного С 1-С 4 алкила; R5 обозначает остаток, выбранный из H и линейного или разветвленного С 1-С 4 алкила; Het обозначает гетероарильную группу,выбранную из замещенного или незамещенного пирролила, замещенного или незамещенного Nметилпирролила, замещенного или незамещенного тиофенила, замещенного или незамещенного фурила и замещенного или незамещенного пиридинила. Указанные соединения пригодны для предупреждения и лечения патологий, зависящих от активности TRPM8, таких как боль,воспаление, ишемия, нейродегенерация, инсульт, психиатрические расстройства, воспалительные состояния и урологические расстройства. Краткое описание изобретения Изобретение относится к новым производным нафтила, которые пригодны при лечении или профилактике заболеваний, связанных с активностью TRPM8 (катионного канала транзиторного рецепторного потенциала, подсемейство М, член 8), также известного как CMR-1 (холодовой и ментоловый рецептор),и, в частности, для предупреждения, снижения риска, облегчения и/или лечения воспаления, ишемии,боли, нейродегенерации, психиатрических расстройств, инсульта и урологических расстройств. Настоящее изобретение также относится к способам синтеза указанных соединений и содержащих их фармацевтических композиций. Предпосылки создания изобретения Каналы транзиторного рецепторного потенциала (TRP) представляют одну из крупнейших групп ионных каналов, которая подразделяется на 6 подсемейств (TRPV, TRPM, TRP, TRPC, TRPP и TRPML).TRP каналы являются катионселективными каналами, которые активируются некоторыми физическимиTRPM8, который был клонирован в 2002 году, является неселективным катионным каналом семействаTRP, экспрессируемым на субпопуляции соматических сенсорных нервов в дорсальном корешковом ганглии и ганглии тройничного нерва, что вызывает возбуждение сенсорных нервов. Он активируется умеренно низкими температурами и синтетическими охлаждающими соединениями, такими как ментол,эвкалиптол и ицилин [McKemy D.D. et al., Nature (2002) 416, 52-58; Peier A.M. et al. Cell (2002) 108, 705715]. Подобно некоторым другим TRP-каналам TRPM8 также управляется электрическим напряжением[Nilius В. et al., J. Physiol. (2005) 567, 35-44]. Зависимость TRPM8 от напряжения характеризуется сильной наружной ректификацией при деполяризованном трансмембранном потенциале и быстрым потенциалзависимым закрытием при отрицательных мембранных потенциалах. Применение охлаждающих агентов и ментола сдвигает кривую активации в сторону более отрицательных потенциалов, повышая возможность для открытия канала и увеличивая входящие токи при физиологических мембранных потенциалах. В регуляции каналов также участвуют другие эндогенные факторы, такие как продукты фосфолипазы A2 [Vanden Abeele F. et al., J. Biol.Chem. (2006) 281, 40174-40182], эндоканнабиноиды [De Petrocellis L. et al., Exp.Cell. Res. (2007) 313, 1911-1920] и PIP2 [Rohacs T. et al., Nat. Neurosci. (2005) 8, 626634]. Существует много прямых и косвенных доказательств роли активности канала TRPM8 при таких заболеваниях, как боль, ишемия и воспалительные заболевания. Также показано, что каналы TRP преобразовывают рефлекторные сигналы, которые вовлечены в гиперактивный мочевой пузырь у пациентов с нарушенными или анормальными путями спинномозговых рефлексов [De Groat W.C. et al., Urology(1997) 50, 36-52]. TRPM8 активируется температурой от 8 до 28C и экспрессируется на первичных ноцицептивных нейронах, включая уротелий мочевого пузыря, ганглии задних корешков, A-дельтаволокна и C-волокна. Внутрипузырное введение ледяной воды или ментола также индуцируют опосредованный C-волокнами спинальный рефлекс мочеиспускания у пациентов со срочностью позывов и недержанием мочи [Everaerts W. et al., Neurol. Urodyn. (2008) 27, 264-73]. Кроме того, известно, что TRPM8 регулирует приток концентрации Ca2+ в ответ на низкую температуру или фармакологические раздражители. В заключение, в недавней работе предполагается потенциальная роль TRPM8 при индуцируемой холодом астме и обострении астмы, предлагается также TRPM8 в качестве соответствующего объекта для контроля этих патологий [Xing H. et al., Molecular Painx (2008),4, 22-30], но до сих пор отсутствует даже клиническое испытание объекта. Непереносимость холода, индуцируемая химическим или термическим охлаждением, точно соответствует симптомам, наблюдаемым при клинических нарушениях в широком диапазоне, и, таким образом, обеспечивает веское обоснование для исследования и разработки новых ингибиторов TRPM8 в качестве новых антигипералгезивных или антиаллодинических агентов. Экспрессия канала в головном мозге, легких, мочевом пузыре, желудочно-кишечном тракте, кровеносных сосудах, предстательной железе и иммунных клетках обеспечивает дополнительную возможность для терапевтической модуляции патологий в широком диапазоне. Расстройства или заболевания, на которые, как доказано, влияет модуляция TRPM8, представляют собой хроническую боль, невропатическую боль, включая холодовую аллодинию и диабетическую невропатию, послеоперационную боль, боль при остеоартрите, боль при ревматоидном артрите, раковую боль, невралгию, невропатии, повышенную чувствительность к боли, повреждение нерва, мигрень, головные боли, ишемию, нейродегенерацию, фибромиалгию, инсульт, психиатрические расстройства, включая чувство тревоги и депрессию; и воспалительные состояния, такие как зуд,синдром раздраженного кишечника; или респираторные заболевания, такие как астма, ХОБЛ и легочная гипертензия; урологические расстройства, такие как синдром болезненного мочевого пузыря, интерстициальный цистит, гиперактивность детрузора (гиперактивный мочевой пузырь), недержание мочи, нейрогенная детрузорная гиперактивность (гиперрефлексия детрузора), идиопатическая детрузорная гиперактивность (нестабильность детрузора), доброкачественная гиперплазия предстательной железы, расстройства нижних мочевых путей и симптомы нижних мочевых путей [Nilius В. et al. Science STKEProudfoot C.J. et al., Curr. Biol. (2006), 16, 1591-1605]. За последние несколько лет раскрыто несколько классов непептидных антагонистов TRPM8. В WO 2006/040136, WO 2007/017092, WO 2007/017093, WO 2007/017094 и WO 2007/080109 описаны бензилоксипроизводные в качестве антагонистов TRPM8 для лечения урологических нарушений, в WO 2007/134107 описаны соединения, несущие фосфор, в качестве антагонистов TRPM8 для леченияTRPMS-связанных расстройств, в WO 2009/012430 описаны сульфонамиды для лечения заболеваний,связанных с TRPM8, в WO 2010/103381 описано применение спироциклических производных пиперидина в качестве модуляторов TRPM8 для предупреждения или лечения TRPM8-связанных расстройств или заболеваний; и в WO 2010/125831 описаны производные сульфамоилбензойной кислоты в качестве модуляторов рецепторов TRPM8 и их применение при лечении воспалительных, болезненных и урологических расстройств. Однако антагонисты TRPM8, активно разрабатываемые для выбранных показаний, страдают такими недостатками, как низкая селективность, что дает побочные эффекты из-за вмешательства в системы других каналов, и неблагоприятный профиль PK/ADMET, что может замедлить их дальнейшую разработку. Терапевтической областью, в которой существует особенно высокая потребность в разработке дополнительных антагонистов TRPM8, является область расстройств, связанных с урологией. Фактически,лекарственные средства и препараты, которые доступны для лечения недержания мочи и расстройств мочевой системы, характеризуются некоторыми побочными эффектами. Например, на данный момент терапия синдрома гиперактивного мочевого пузыря основана на препаратах, влияющих на механизмы периферического нейроконтроля или механизмы, действующие непосредственно на сокращение гладких мышц детрузора мочевого пузыря, при широком применении антихолинергических агентов. Эти препараты ингибируют парасимпатические нервы, оказывая прямое спазмолитическое действие на мышцы мочевого пузыря. Результатом этого действия является уменьшение внутрипузырного давления, увеличение вместимости и снижение частоты сокращений мочевого пузыря. Однако использование антихолинергических агентов связано с серьезными побочными эффектами, такими как сухость во рту, нарушение зрения, запор и расстройства ЦНС, что ухудшает общее соблюдение пациентом схемы лечения. Недостаточность фактического лечения подчеркивает потребность в новых, эффективных и безопасных препаратах с меньшим количеством побочных эффектов. Краткое содержание изобретения Авторы настоящего изобретения обнаружили новый класс соединений, действующих в качестве селективных антагонистов катионного канала транзиторного рецепторного потенциала, подсемейство M,элемент 8 (далее называемого TRPM8), имеющих формулу где R выбран из H, Br, CN, NO2, SO2NH2, SO2NHR' и SO2N(R')2, где R' выбран из линейного или разветвленного C1-С 4 алкила;R1 и R2, независимо друг от друга, выбраны из H, F и линейного или разветвленного C1-С 4 алкила;R3 и R4, независимо друг от друга, выбраны из H, линейного или разветвленного C1-С 4 алкила;Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из H, линейного или разветвленного С 1-С 4 алкила;R5 обозначает остаток, выбранный из H, линейного или разветвленного С 1-С 4 алкила;Het обозначает гетероарильную группу, выбранную из замещенного или незамещенного пирролила,замещенного или незамещенного N-метилпирролила, замещенного или незамещенного тиофенила, замещенного или незамещенного фурила и замещенного или незамещенного пиридинила. Указанные соединения пригодны для лечения патологий, зависящих от активности TRPM8. Подробное описание фигур На фиг. 1 представлена графическая схема 384-ячеечного планшета для разведения соединений, использованная для биологической оценки соединений по изобретению, как описано в примере 62, где в столбце 1 лунки содержат аналитический буфер плюс 0,5% ДМСО, в столбце 2 лунки попеременно содержат контроль с максимальным сигналом при первой инъекции (охлаждающий агент 10 при концентрации 100 мкМ, соответствующей EC100) и контроль с минимальным сигналом при первой инъекции(аналитический буфер плюс 0,5% ДМСО в конце); в столбцах 3-22 лунки содержат аналитический буфер плюс 0,5% ДМСО в конце, и к каждой из этих ячеек добавляют тестируемое соединение при 3 концентрациях; в столбце 23 лунки попеременно содержат контроль с максимальным сигналом при второй инъекции (аналитический буфер) и контроль с минимальным сигналом при второй инъекции (капсазепин при 50 мМ, что соответствует IC100); в столбце 24 лунки содержат капсазепин при 8 различных концен-2 022943 трациях в двух экземплярах, как сообщается в примере 62. На фиг. 2 представлена графическая схема 384-ячеечного планшета с активатором, используемая для биологической оценки соединений по изобретению, как описано в примере 62, где в столбце 1 лунки содержат охлаждающий агент 10 при 8 концентрациях доза-ответ в двух экземплярах при различных концентрациях, как сообщается в примере 62; в столбцах 2-24 лунки содержат охлаждающий агент 10 при EC80 (3-кратных концентрациях, самая высокая из которых равна 20 мкМ в конце). На фиг. 3 показан график с конкретной кинетической кривой отклика, полученной в тесте, описанном в примере 62, для соединений из табл. I. Приведен сигнал, выраженный в относительных световых единицах (ось y), в зависимости от времени (секунды, ось x) после инъекции определенного количества контроля/тестируемых соединений. CA относится к фазе добавления соединения, тогда как TA относится к фазе целевой активации, проводимой в присутствии агониста для увеличения максимального контрольного сигнала, с последующим введением ингибитора сравнения для полной отмены сигнала и регистрации минимального контрольного сигнала. Подробное описание изобретения Первым объектом настоящего изобретения являются соединения формулы (I) и их фармацевтически пригодные соли, гдеR выбран из Н, Br, CN, NO2, SO2NH2, SO2NHR' и SO2N(R')2, где R' выбран из линейного или разветвленного С 1-С 4 алкила;R1 и R2, независимо друг от друга, выбраны из Н, F и линейного или разветвленного С 1-С 4 алкила;R3 и R4, независимо друг от друга, выбраны из H и линейного или разветвленного С 1-С 4 алкила;Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из Н и линейного или разветвленного C1-С 4 алкила;R5 обозначает остаток, выбранный из H, линейного или разветвленного C1-С 4 алкила;Het обозначает гетероарильную группу, выбранную из замещенного или незамещенного пирролила,замещенного или незамещенного N-метилпирролила, замещенного или незамещенного тиофенила, замещенного или незамещенного фурила и замещенного или незамещенного пиридинила, и предпочтительно представляет собой замещенный или незамещенный пиррол-2-ил, замещенный или незамещенный N-метилпиррол-2-ил, замещенный или незамещенный тиофен-2-ил, замещенный или незамещенный фур-2-ил, замещенный или незамещенный пиридин-2-ил. Согласно предпочтительным вариантам изобретения также в комбинации друг с другом в указанных выше соединениях, независимо друг от другаR предпочтительно выбран из H, Br и CN, и еще более предпочтительно из Н и CN;X предпочтительно выбран из F, Cl и C1-С 3 алкила, более предпочтительно из F, Cl и С 2 Н 5, еще более предпочтительно из F и Cl;Y предпочтительно выбран из -O-, CH2, NH, SO2 и более предпочтительно из CH2, O и SO2,R1 и R2, независимо друг от друга, предпочтительно выбраны из Н, F и CH3, более предпочтительно из Н и CH3;R3 и R4, независимо друг от друга, предпочтительно выбраны из Н и CH3;Z предпочтительно выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из Н и CH3, более предпочтительно Z представляет собой NH;R5 предпочтительно выбран из Н и CH3 и более предпочтительно представляет собой Н. Согласно другому предпочтительному варианту осуществления настоящего изобретения, а также в комбинации со всеми указанными выше вариантами осуществления, если Het представляет собой замещенный пирролил, замещенный N-метилпирролил, замещенный тиофенил или замещенный фурил, он предпочтительно замещен одним или более заместителями, выбранными из F, Cl, CH3, NH2 и OH, и более предпочтительно из F, Cl и CH3, еще более предпочтительно из Cl и CH3. Указанный заместитель предпочтительно находится в положении 5. Предпочтительные соединения формулы (I) по настоящему изобретению представляют собой соединения, перечисленные в табл.I, и конкретно Особо предпочтительными соединениями формулы (I) по настоящему изобретению являются следующие: Наиболее предпочтительным соединением по изобретению является соединение 1 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорид. Как подробно описано в экспериментальной части, авторы настоящего изобретения обнаружили,что описанные выше соединения по изобретению являются сильными антагонистами активностиTRPM8. Как более подробно описано ниже, все перечисленные выше соединения демонстрируют антагонистическую активность при высокопроизводительном скрининге (HTS) в клеточном исследовании относительно человеческих TRPM8. Таким образом, второй целью настоящего изобретения являются описанные выше соединения формулы (I) для применения в качестве антагонистов TRPM8, предпочтительно человеческих TRPM8. Активность одного из указанных соединений подтверждают также in vivo на изоволюметрической модели мочевого пузыря, животной модели для оценки лекарственных препаратов, активных в отношении боли, вызываемой сокращениями мочевого пузыря. Кроме того, как описано в экспериментальной части, соединения по изобретению демонстрируют высокую селективность в отношении TRPM8 по сравнению с соединениями прототипов и, следовательно, не демонстрируют побочных эффектов, вызываемых вмешательством в системы других каналов, наблюдаемых с другими соединениями TRPM8 предшествующего уровня. Соответственно, третьей целью настоящего изобретения являются указанные выше соединения для применения в качестве лекарственных препаратов. Четвертой целью настоящего изобретения являются указанные выше соединения для применения при предупреждении, снижении риска, облегчении и/или лечении заболевания, связанного с активностью TRPM8. Согласно настоящему изобретению предпочтительными заболеваниями, которые связаны с активацией TRPM8, являются боль, ишемия, нейродегенерация, инсульт, психиатрические расстройства и воспалительные заболевания, урологические расстройства, предпочтительно боль и урологические расстройства. Соединения по изобретению предпочтительно предназначены для применения при боли, выбранной из хронической боли, невропатической боли, включая холодовую аллодинию и диабетическую невропатию, послеоперационной боли, боли при остеоартрите, боли при ревматоидном артрите, раковой боли, невралгии, невропатии, фибромиалгии, повышенной чувствительности к боли, повреждения нерва,мигрени, головной боли, еще более предпочтительно соединения по изобретению предназначены для применения при хронической и невропатической боли, включая холодовую аллодинию. Предпочтительно, указанное воспалительное заболевание выбрано из зуда, синдрома раздраженного кишечника и респираторных заболеваний, причем последние предпочтительно выбраны из легочной гипертензии, ХОБЛ и астмы. Предпочтительно соединения по изобретению предназначены для применения при урологических расстройствах, выбранных из синдрома болезненного мочевого пузыря, интерстициального цистита, гиперактивности детрузора (гиперактивный мочевой пузырь), недержания мочи, нейрогенной гиперактивности детрузора (гиперфлексии детрузора), идиопатической детрузорной гиперактивности (нестабильности детрузора), доброкачественной гиперплазии предстательной железы, расстройства нижних мочевых путей и симптомов нижних мочевых путей. Предпочтительно соединения по изобретению предназначены для применения при психиатрических расстройствах, выбранных из тревоги и депрессии. Пятой целью настоящего изобретения являются фармацевтические композиции, содержащие по меньшей мере одно из указанных выше соединений формулы I в комбинации с фармацевтически приемлемыми эксципиентами и/или разбавителями. Согласно предпочтительному варианту осуществления указанная фармацевтическая композиция предназначена для предупреждения, снижения риска, облегчения и/или лечения заболевания, связанного с активностью TRPM8. Согласно варианту осуществления указанная фармацевтическая композиция содержит по меньшей мере одно из указанных выше соединений формулы I в качестве единственного активного ингредиента(ов). Согласно альтернативному варианту осуществления указанная фармацевтическая композиция содержит по меньшей мере одно из указанных выше соединений формулы I в сочетании по меньшей мере с одним другим активным ингредиентом. Соединения по изобретению формулы (I) легко составлять в фармацевтические композиции, применяя обычные методики и используя эксципиенты, такие как описано в "Remington Pharmaceutical Sciences Handbook" Mack Publishing, New York 18th ed., 1990. Соединения по изобретению можно вводить посредством внутрипузырной инстилляции, внутривенной инъекции, болюса, в виде дерматологических препаратов (кремов, лосьонов, спреев и мазей), посредством ингаляции, а также перорально в виде капсул, таблеток, сиропов, препаратов с регулируемым высвобождением и подобного. Согласно предпочтительному варианту осуществления также в комбинации с предшествующими вариантами осуществления фармацевтические препараты по изобретению могут представлять собой препараты для внутрипузырного, внутривенного, локального и перорального введения. Шестой целью настоящего изобретения является терапевтический способ предупреждения, снижения риска, облегчения и/или лечения указанных заболеваний, связанных с активностью TRPM8, включающий введение нуждающемуся в этом субъекту указанного выше соединения формулы I. Соединения по изобретению можно вводить в виде единственных активных ингредиентов или в комбинации с другими терапевтически активными соединениями. Средняя суточная доза зависит от нескольких факторов, таких как тяжесть заболевания, состояние,возраст, пол и масса пациента. Обычно дозу варьируют от 1 до 1500 мг соединений формулы (I) в день,необязательно разделив на несколько введений. Как будет показано в экспериментальной части, соединения по изобретению имеют лучший фармакокинетический профиль по сравнению с другими антагонистами TRPM8 предшествующего уровня. Соединения по настоящему изобретению предпочтительно получают способом, включающим взаимодействие аминного промежуточного соединения I (А) где X, R1, R2, R3, R4 и Z имеют такие же значения, как в формуле (I), и Y' означает O, CH2, NH и S,с R5CO-Het, где Het и R5 имеют такие же значения, как в формуле (I), и последующее добавление к реакционной смеси мягкого восстановителя, предпочтительно боргидрида натрия, с получением, таким образом, соединения (IB) которое соответствует конечному соединению формулы (I) в случае, когда Y' означает O, CH2, NH; или в случае, когда Y' означает S, данный способ дополнительно предполагает конечное окисление,предпочтительно посредством m-СРВА (мета-хлорпербензойной кислоты), с получением соединения формулы (I), имеющей Y, означающий SO2. Промежуточное соединение формулы (IA) обычно получают синтетическими способами, описанными в данной области. Например, промежуточные соединения (IA), в которых соответственноY' означает NH2, получают, как описано в примере 41. Изобретение проиллюстрировано с помощью приведенных ниже примеров, которые не следует рассматривать как ограничивающие объем изобретения. Примеры Синтез предпочтительных соединений. Соединения, перечисленные в табл. I, синтезированы по методикам, описанным в следующих примерах. Материалы и способы. Спектры 1H ЯМР регистрировали на спектрометре Bruker Avance3 400. ЖХ-МС спектры регистрировали на приборе Surveyor (THERMO FINNIGAN) в сочетании с LCQ DECA XP-PLUS (THERMO FINNIGAN), оснащенном колонкой C18 Phenomenex Gemini. Элюирующая смесь состояла из буфера 10 мМ с pH 4,2 HCOO-NH4+/HCOOH и CH3CN и использовалась при градиенте от 90:10 до 10:90 со скоростью потока 0,100 мл/мин. Спектры ГХ-МС регистрировали на газовом хроматографе Trace GC (THERMOFINNIGAN) в сочетании с масс-спектрометром Trace DSQ (THERMO FINNIGAN). Все эксперименты с микроволновым облучением проводили с использованием Biotage Initiator 2,5. Пример 1. Синтез 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорида (1). Получение промежуточных продуктов. Трет-бутил(2-бромэтил)карбамат. В колбу, содержащую 3 г (14,64 ммоль) 2-бромэтанамина, растворенного в 40 мл смеси 1/1 дихлорметана и воды, добавляют при перемешивании 3,2 г (14,64 ммоль) ди-трет-бутилдикарбоната (BOC2O) и 1,2 гNaHCO3. Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 18 ч. Фазы разделяют и органические слои сушат над Na2SO4. Выпаривание растворителя дает трет-бутил(2 бромэтил)карбамат (82% выход) в виде светлого масла, которое используют без дополнительной очистки. 1H-ЯМР (CDCl3) : 5,20 до 4,80 (1H, ушир.с), 3,62-3,34 (4H, м), 1,47 (9H, с). 1-хлорнафталин-2-ол. К охлажденному (0-5C) раствору N-хлорсукцинимида (1,4 г, 10,4 ммоль) в 100 мл CH2Cl2 добавляют ZrCl4 (0,122 г, 5% моль) и затем 1,5 г (10,4 ммоль) нафталин-2-ола. Смесь перемешивают в течение 18 ч при комнатной температуре до полного исчезновения исходных веществ, о чем судят по данным анализа ТСХ и ГХ. Смесь гасят насыщенным водным раствором NH4Cl (30 мл) и переносят в делительную воронку. Две фазы разделяют и органическую фазу промывают водой (310 мл), сушат над Na2SO4 и упаривают в вакууме с получением желтого масла. Неочищенный продукт очищают флэшхроматографией (петролейный эфир/этилацетат, 85:15) с получением 1-хлорнафталин-2-ола (1,4 г, выход 78%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) : 8,08 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,80 (1H, ддд, J=0,76 Гц, J=1,2 Гц,J=8,24 Гц), 7,72 (1H, д, J=8,88 Гц), 7,6 (1H, ддд, J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,41 (1H, ддд, J=1,88 Гц,J=6,88 Гц, J=8,24 Гц), 7,28 (1H, д, J=8,88 Гц). ГХ-МС: m/z 178. Трет-бутил 2-[(1-хлорнафталин-2-ил)окси]этилкарбамат. К раствору 1-хлорнафталин-2-ола (1,68 ммоль) и K2CO3 (3,36 ммоль) в ацетоне добавляют третбутил(2-бромэтил)карбамат (1,85 ммоль). Полученную в результате смесь нагревают при кипячении с обратным холодильником в течение ночи. Когда ТСХ-контроль (смесь н-гексан/этилацетат 7:3) показывает исчезновение 1-хлорнафталин-2-ола, растворитель выпаривают в вакууме и остаток растворяют в 15 мл этилацетата и промывают водой (35 мл), насыщенным раствором соли (10 мл) и сушат над Na2SO4. Выпаривание растворителя дает трет-бутил 2-[(1-хлорнафталин-2-ил)окси]этилкарбамат в виде серого твердого вещества (выход 77%), которое используют без дополнительной очистки.[М+Н+]. 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорид. В охлаждаемую (0C) одногорлую колбу, содержащую раствор трет-бутил 2-[(1-хлорнафталин-2 ил)окси]этилкарбамата в 4 мл этилового эфира, добавляют 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют при пониженном давлении с получением 2-[(1-хлорнафталин-2 ил)окси]этанаминийхлорида в виде белого твердого вещества (выход 92%), которое является чистым по данным ТСХ и ЯМР анализа. 1(2H, м), 7,66 (1H, дд, J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,60 (1H, д, J=8,88 Гц), 7,51 (1H, дд, J=1,88 Гц,J=6,88 Гц, J=8,2 Гц), 4,40 (2H, т, J=5,60 Гц), 3,38-3,28 (2H, м); ВЭЖХ-МС (ESI+): m/z 222,7 [М+Н+]. Синтез соединения 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорид (1). К раствору 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида (100 мг, 0,39 ммоль) в 10 мл MeOH добавляют K2CO3 (65 мг, 0,47 ммоль). Через 10 мин добавляют 48 мкл (0,58 ммоль) фуран-2 карбальдегида. Полученный раствор перемешивают в течение 1 ч при комнатной температуре, добавляют боргидрид натрия (15 мг, 0,39 ммоль) и оставляют реакционную смесь перемешиваться еще на 2 ч при комнатной температуре. Растворитель выпаривают в вакууме, смесь разбавляют 10 мл CH2Cl2 и переносят в делительную воронку. Органический слой промывают водой, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией на силикагеле (CH2Cl2/MeOH 95:5) с получением 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2 илметил)этанамина в виде коричневого масла (выход 63%). Масло оставляют перемешиваться с 4 М диоксановым раствором HCl на 1 ч. Реакционную смесь концентрируют при пониженном давлении с получением 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорида в виде белого твердого вещества. 1(1H, дд, J=0,75 Гц, J=3,30 Гц), 6,41 (1H, дд, J=2,01 Гц, J=3,30 Гц), 4,60 (2H, т, J=5, 60 Гц), 4,53 (2H, м),3.46 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI + ): m/z 302,7 [М+Н+]. Согласно аналогичной экспериментальной методике синтезируют следующие соединения. Пример 2. 2-[(1-хлорнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]этанаминийхлорид (2). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и 5-метилфуран-2-карбальдегида с выходом 70% в виде белого твердого вещества. 1m/z 316,8 [М+Н+]. Пример 3. N-[(5-хлорфуран-2-ил)метил]-2-[(1-хлорнафталин-2-ил)окси]этанаминий (3). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и 5-хлорфуран-2-карбальдегида с выходом 72% в виде белого твердого вещества. 1(4H, м), 3,58 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI+ ): m/z 337,2 [М+Н+]. Пример 4. 2-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]этанаминий(4). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и 5-хлортиофен-2-карбальдегида с выходом 78% в виде белого твердого вещества. 1H-ЯМР (CD3OD) : 8,20 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,92-7,85 (2H, м), 7,62 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,52-7,44 (2H, м), 7,20 (1H, д, J=3,80 Гц), 7,02 (1H, д, J=3,80 Гц), 4,61 (2H,с), 4,51 (2H, т, J=5,60 Гц), 3,60 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI + ): m/z 353,3 [М+Н+]. Пример 5. 2-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанаминий (5). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и тиофен-2-карбальдегида с выходом 72% в виде белого твердого вещества. 1H-ЯМР (CD3OD) : 8,20 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,92-7,85 (2H, м), 7,65-7,55 (2H,м), 7,52-7,44 (2H, м), 7,40-7,35 (1H, м), 7,14 (1H, дд, J=3,50 Гц, J=5,30 Гц), 4,70 (2H, с), 4,51 (2H, т, J=5,6 Гц), 3,60 (2H, т, J=5,6 Гц); ВЭЖХ-МС (ESI+): m/z 318,8 [М+Н+]. Пример 6. 2-[(1-хлорнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанаминий (6). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и пиридин-2-карбальдегида с выходом 81% в виде белого твердого вещества.(2H, т, J=5,60 Гц), 3,71 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI+): m/z 313,8 [М+Н+]. Пример 7. 2-[(1-хлорнафталин-2-ил)окси]-N-[(1-метил-1H-пиррол-2-ил)метил]этанаминий (7). Получают из 2-[(1-хлорнафталин-2-ил)окси]этанаминийхлорида и 1-метил-1H-пиррол-2 карбальдегида с выходом 83% в виде белого твердого вещества. 1H-ЯМР (CD3OD) : 8,15 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,86-7,73 (2H, м), 7,56 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,47-7,32 (2H, м), 6,10 (1H, д, J=3,45 Гц), 5,85 (1H, кв.д, J=1,28 Гц, J=3,45 Гц), 4,25 (2H, т, J=5,30 Гц), 3,91 (1H, кв, J=7 Гц), 2,95 (2H, т, J=5,30 Гц), 2,18 (3H, д, J=1,28 Гц), 1,42 (3H,д, J=7 Гц); ВЭЖХ-МС (ESI+): m/z 330,7 [М+Н+]. Пример 9. Синтез 1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-2-метилпропан-2-амина (8). Получение промежуточных продуктов. Общий синтез бромэтиламино-N-BOC-производных. 16,4 ммоль соответствующего этаноламина добавляют при помощи капельной воронки к 7 мл (52 ммоль) охлаждаемой на льду 48% водной бромистоводородной кислоты. Затем смесь нагревают при 90C в течение 3 ч. Растворитель отгоняют в вакууме, неочищенный продукт повторно растворяют в 40 мл дихлорметана и добавляют 3,2 г (14,64 ммоль) ди-трет-бутилдикарбоната (ВОС 2 О). Наконец, добавляют при перемешивании 1 н. раствор NaOH до pH 10. Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 18 ч. Фазы разделяют и органические слои сушат над Na2SO4. Выпаривание растворителя дает бромамины в виде бледного масла, которое используют без дополнительной очистки. Получают следующие промежуточные соединения: трет-бутил(2-бромопропилат)карбамат выход 81%; 1H-ЯМР (CD3Cl) : 3,80 (2H, с), 1,48 (9H, с), 1,40 (6 Н, с). 1-[(1-Хлорнафталин-2-ил)окси]-2-метилпропан-2-амин. К раствору 1-хлорнафталин-2-ола (1,5 ммоль) и Cs2CO3 (3 ммоль) в ацетонитриле добавляют третбутил(1-бром-2-метилпропан-2-ил)карбамат (3 ммоль). Полученную в результате смесь нагревают при кипячении с обратным холодильником в течение ночи. Когда контроль ТСХ (смесь н-гексан/этилацетат 7:3) показывает исчезновение 1-хлорнафталин-2-ола, выпаривают растворитель в вакууме и остаток растворяют в 15 мл этилацетата, промывают водой (35 мл), насыщенным раствором соли (10 мл) и сушат над Na2SO4. Выпаривание растворителя дает трет-бутил 1-[(1-хлорнафталин-2-ил)окси]-2-метилпропан 2-илкарбамат в виде бледного масла (выход 51%), которое растворяют в 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение 18 ч. После ВЭЖХ-МС контроля растворитель отгоняют и остаток растворяют в дихлорметане и промывают два раза 1 н. NaOH с получением 1-[(1-хлорнафталин-2-ил)окси]-2-метилпропан-2-амина в виде бледного масла. ВЭЖХ-МС (ESI+): m/z 250,7 [М+Н+]. Пример 10. Следуя аналогично описанной методике, но используя различные промежуточные продукты, синтезируют следующие соединения. 1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-2-метилпропан-2-амин (8). Получают из 1-[(1-хлорнафталин-2-ил)окси]-2-метилпропан-2-амина и фуран-2-карбальдегида с выходом 34% в виде бледного масла. 1m/z 330,8 [М+Н+]. Пример 24. N-[(5-хлорфуран-2-ил)метил]-1-[(1-хлорнафталин-2-ил)окси]пропан-2-амин (22). Получают из 1-[(1-хлорнафталин-2-ил)окси]пропан-2-амина и 5-хлорфуран-2-карбальдегида с выходом 61% в виде не совсем белого масла. 1H-ЯМР (CD3OD) : 8,19 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,95-7,85 (2H, м), 7,61 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,52-7,44 (2H, м), 6,76 (1H, д, J=3,55 Гц), 6,39 (1H, д, J=3,35 Гц), 4,39 (2H,с), 4,25 (2H, м), 3,1 (1H, м), 1,29 (3H, д, J=6,95); ВЭЖХ-МС (ESI+): m/z 351,2 [М+Н+]. Пример 25. 1-[(1-хлорнафталин-2-ил)окси]-N-[(5-хлортиофен-2-ил)метил]пропан-2-амин (23). Получают из 1-[(1-хлорнафталин-2-ил)окси]пропан-2-амина и 5-хлортиофен-2-карбальдегида с выходом 61% в виде не совсем белого масла. 1(8,40 ммоль, 1,16 г), перемешивают при комнатной температуре в течение 30 мин, затем добавляют диметилтиокарбамоилхлорид (3,36 ммоль, 415 мг). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 4 ч. После полного исчезновения исходных веществ (контроль ТСХ) выпаривают растворитель при пониженном давлении, остаток обрабатывают дихлорметаном и промывают водой. Органический слой сушат над безводным сульфатом натрия. Неочищенное желтое масло, полученное после выпаривания растворителя,очищают флэш-хроматографией на силикагеле при элюировании смесью петролейный эфир/этилацетат(93:7), с получением белого твердого вещества (351 мг, 79%). 1S-1-хлор-2-нафтилдиметилтиокарбамат. Раствор O-1-хлор-2-нафтилдиметилтиокарбамата (1,13 ммоль, 300 мг) в 4 мл NMP подвергают действию СВЧ-облучения при 200C в течение 4 ч. Реакционную смесь разбавляют в эфире и промывают водой. Органический слой сушат над безводным сульфатом натрия. Неочищенное желтое масло, полу- 13022943 ченное после выпаривания растворителя, очищают флэш-хроматографией на силикагеле при элюировании смесью петролейный эфир/этилацетат (8:2), с получением слегка желтого твердого вещества (203 мг,68%). 1H-ЯМР (CDCl3) : 8,37 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,87 (1H, ддд, J=0,76 Гц, J=1,2 Гц,J=8,24 Гц), 7,78 (1H, д, J=8,80 Гц), 7,68-7,56 (3H, м), 3,30-2,90 (6 Н, ушир.с). 1-хлорнафталин-2-тиол. Раствор S-1-хлор-2-нафтилдиметилтиокарбамата (150 мг, 0,56 ммоль) в 12,6 мл 0,3 н. KOH в метаноле (4,68 ммоль) насыщают аргоном и нагревают до 80C в течение 2,5 ч. Затем реакционную смесь гасят 1 н. водным раствором HCl (12 мл) при 0C и экстрагируют дихлорметаном. Водную фазу промывают дихлорметаном. Объединенные органические фазы промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают, с получением тиола в виде желтого твердого вещества (90 мг, 83%). 1(2,25 ммоль, 311 мг), перемешивают в течение 30 мин (бесцветная смесь становится желтой), затем добавляют трет-бутил(2-бромэтил)карбамат (0,47 ммоль, 105 мг). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. После полного исчезновения исходного вещества (контроль ТСХ) выпаривают растворитель при пониженном давлении. Остаток обрабатывают дихлорметаном и промывают водой. Органический слой сушат над безводным сульфатом натрия. Неочищенное желтое масло,полученное после выпаривания растворителя, очищают флэш-хроматографией на силикагеле при элюировании смесью петролейный эфир/этилацетат (8:2), с получением белого твердого вещества (76 мг,50%). Полученное соединение растворяют в 4 мл этилового эфира и 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют при пониженном давлении с получением 2-[(1-хлорнафталин-2 ил)сульфанил]этанаминийхлорида в виде желтого масла (выход 92%), которое является чистым по данным ТСХ и ЯМР анализа. 1(2H, т, J=8,39 Гц); ВЭЖХ-МС (ESI + ): m/z 238,7 [М+Н+]. 2-[(1-хлорнафталин-2-ил)сульфанил]-N-(фуран-2-илметил)этанамин. Стадию восстановительного аминирования 2-[(1-хлорнафталин-2-ил)сульфанил]этанаминийхлорида посредством фуран-2-карбальдегида проводят, как описано для соединения 1, с получением 2-[(1-хлорнафталин-2-ил)сульфанил]-N-(фуран-2-илметил)этанамина с выходом 57%. 1H-ЯМР (CD3OD) : 8,15 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,90-7,75 (2H, м), 7,60-7,40 (4H,м), 3,42 (2H, т, J=8,39 Гц), 3,06 (2H, т, J=8,39 Гц); 6,49 (1H, дд, J=3,58), 6,32 (1H, ДД, J=2,10 Гц, J=3,58 Гц), 4,22 (2H, с), 3,38 (2H, т, J=8,39 Гц), 3,23 (2H, т, J=8,39 Гц). Синтез соединения. 2-[(1-хлорнафталин-2-ил) сульфонил]-N-(фуран-2-илметил) этанамин (25). К раствору m-СРВА (мета-хлорпербензойной кислоты) (106 мг, 0,62 ммоль) в дихлорметане (4 мл),охлажденному до 0C, добавляют по капле за 3 мин раствор 2-[(1-хлорнафталин-2-ил)сульфанил]-N(фуран-2-илметил)этанамина (100 мг, 0,31 ммоль) в дихлорметане (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и затем разбавляют холодным 4% раствором бикарбоната натрия (4 мл). Органический слой отделяют, промывают водой, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Неочищенный остаток очищают колоночной хроматографией на силикагеле, используя смесь петролейный эфир/этилацетат (8:2), с получением желтого твердого вещества (65 мг, 60%). 1H-ЯМР (CD3OD) : 8,16 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,85-7,68 (2H, м), 7,60 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,50-7,30 (3H, м), 6,81 (1H, дд, J=0,75 Гц, J=3,30 Гц), 6,44 (1H, дд, J=2,01 Гц, J=3,30 Гц), 4,10 (2H, с), 3,3-2,95 (4H, м); ВЭЖХ-МС (ESI+): m/z 350,8 [М+Н+]. Следуя аналогичной методике, описанной для синтеза соединения 25, синтезируют следующие соединения. Пример 28. 2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(5-метилфуран-2-ил)метил]этанамин (26). Получают, как описано для соединения 25, из 2-[(1-хлорнафталин-2-ил)сульфанил]-N-[(5 метилфуран-2-ил)метил]этанамина с выходом 59% в виде белого твердого вещества. 1 Получают, как описано для соединения 25, из N-[(5-хлорфуран-2-ил)метил]-2-[(1-хлорнафталин-2 ил)сульфанил]этанамина с выходом 50% в виде не совсем белого твердого вещества. 1H-ЯМР (CD3OD) : 8,16 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,85-7,68 (2H, м), 7,60 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,50-7,30 (2H, м), 6,88 (1H, д, J=3, 30 Гц), 6,46 (1H, д, J=3,30 Гц), 4,12 (2H,с), 3,32-2,95 (4H, м); ВЭЖХ-МС (ESI+): m/z 385,3 [М+Н+]. Пример 30. 2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(5-хлортиофен-2-ил)метил]этанамин (28). Получают, как описано для соединения 25, из 2-[(1-хлорнафталин-2-ил)сульфанил]-N-[(5 хлортиофен-2-ил)метил]этанамина с выходом 63% в виде не совсем белого твердого вещества. 1H-ЯМР (CD3OD) : 8,16 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,85-7,68 (2H, м), 7,60 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,50-7,30 (2H, м), 6,93 (1H, д, J=3,30 Гц), 6,48 (1H, д, J=3,30 Гц), 4,12 (2H,с), 3,32-2,95 (4H, м); ВЭЖХ-МС (ESI+): m/z 401,3 [М+Н+]. Пример 31. 2-[(1-хлорнафталин-2-ил)сульфонил]-N-(тиофен-2-илметил)этанамин (29). Получают, как описано для соединения 25, из 2-[(1-хлорнафталин-2-ил)сульфанил]-N-(тиофен-2 илметил)этанамина с выходом 68% в виде желтого твердого вещества. 1H-ЯМР (CD3OD) : 8,16 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,85-7,68 (2H, м), 7,60 (1H, ддд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,50-7,30 (3H, м), 6,81 (1H, дд, J=0,75 Гц, J=3,30 Гц), 6,44 (1H, дд, J=2,01 Гц, J=3,30 Гц), 4,25 (2H, с), 3,3-2,95 (4H, м); ВЭЖХ-МС (ESI+): m/z 366,9 [М+Н+]. Пример 32. 2-[(1-хлорнафталин-2-ил)сульфонил]-N-(пиридин-2-илметил)этанамин (30). Получают, как описано для соединения 25, из 2-[(1-хлорнафталин-2-ил)сульфанил]-N-(пиридин-2 илметил)этанамина с выходом 78% в виде желтого масла. 1H-ЯМР (CD3OD) : 8,72 (1H, м), 8,20 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 8,01 (1H, дд, J=1,70 Гц, J=7,78 Гц), 7,95-7,85 (2H, м), 7,75-7,68 (1H, м), 7,65-7,55 (2H, м), 7,52-7,42 (2H, м), 4,55 (2H, с), 3,32,95 (4H, м); ВЭЖХ-МС (ESI+): m/z 361,7 [М+Н+]. Пример 33. 2-[(1-хлорнафталин-2-ил)сульфонил]-N-[(1-метил-1H-пиррол-2-ил)метил]этанамин (31). Получают, как описано для соединения 25, из 2-[(1-хлорнафталин-2-ил)сульфанил]-N-[(1-метил-1Hпиррол-2-ил)метил]этанамина с выходом 76% в виде желтого масла. 1(2 Е)-3-(1-хлорнафталин-2-ил)проп-2-еннитрил. В пробирку для микроволнового облучения добавляют Pd(OAc)2 (3 мол.%, 11 мг), PMe2Ph (5 мол.%,11 мг), 1-хлорнафталин-2-илтрифторметансульфонат (500 мг, 1,61 ммоль), акрилонитрил (103 мг, 1,93 ммоль), триэтиламин (242 мг, 2,4 ммоль) и 15 мл ацетонитрила и смесь подвергают микроволновому облучению при 120C в течение 1 ч. По окончании взаимодействия выпаривают растворитель при пониженном давлении и остаток обрабатывают дихлорметаном и промывают водой; органический слой фильтруют через слой силикагеля, обильно промывая, концентрируют и очищают флэш-хроматографией на силикагеле, элюируя смесью петролейный эфир/этилацетат (93:7), с получением (2 Е)-3-(1-хлорнафталин 2-ил)проп-2-еннитрила в виде бесцветного масла (120 мг, выход 35%). ГХ-МС: m/z 213,7. 3-(1-хлорнафталин-2-ил)пропан-1-амин. К раствору (2 Е)-3-(1-хлорнафталин-2-ил)проп-2-еннитрила (120 мг, 0,56 ммоль) в 5 мл сухого ТГФ добавляют в атмосфере аргона LiAlH4 (85 мг, 2,24 ммоль). Реакционную смесь нагревают при кипячении с обратным холодильником в течение ночи. После полного исчезновения исходных веществ реакционную смесь гасят 1 н. водным раствором HCl при температуре 0C до pH 5 и перемешивают при комнатной температуре в течение 30 мин, затем нейтрализуют 1 н. раствором NaOH и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, с получением чистого продукта в виде желтого масла (92 мг, 75%). 1m/z 220,7 [М+Н+]. Синтез соединения 3-(1-хлорнафталин-2-ил)-N-(фуран-2-илметил)пропан-1-амин (32). Проводят восстановительное аминирование 3-(1-хлорнафталин-2-ил)пропан-1-амина и фуран-2 карбальдегида, как описано для соединения 1, с получением соединения в виде бледно-желтого масла(32 мг,0,095 ммоль) 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2 илметил)этанаминийхлорида (1) в 5 мл ТГФ обрабатывают 21 мг (0,15 ммоль) K2CO3 и 6 мкл (0,100 ммоль) MeI. Полученную в результате смесь перемешивают в течение 14 ч при комнатной температуре. Растворитель отгоняют в вакууме и неочищенный продукт растирают в течение 1 ч в 5 мл диизопропилового эфира. После декантации эфира получают чистый 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2 илметил)-N-метилэтанамин в виде бледно-желтого масла с выходом 91%. 1(39). 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-N-метилэтанамин (38) (0,05 ммоль) растворяют в 3 мл ТГФ и затем добавляют при перемешивании 0,10 ммоль MeI и подвергают взаимодействию в течение 14 ч при комнатной температуре. Растворитель выпаривают в вакууме и полученный неочищенный продукт растирают с 5 мл н-гексана в течение 2 ч. Твердое вещество отфильтровывают и сушат при 50C и пониженном давлении с получением 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-N,Nдиметилэтанаминиййодида в виде белого твердого вещества (выход 92%). 1 К раствору нафталин-2-ола (0,5 г, 2,8 ммоль) в 10 мл сухого CH2Cl2 добавляют триэтиламин (0,6 мл 4,2 ммоль). Раствор охлаждают при -10C и добавляют по капле ангидрид трифторметансульфоновой кислоты (0,5 мл, 3,1 ммоль); реакционную смесь перемешивают 20 мин при -10C и затем оставляют перемешиваться при комнатной температуре в течение 15 ч. Смесь гасят 5 мл 1 М раствора HCl и переносят в делительную воронку. Две фазы разделяют, органическую фазу промывают 1 н. раствором NaOH (5 мл) и сушат над Na2SO4. После удаления растворителя остаток очищают флэш-хроматографией (петролейный эфир в качестве элюента) с получением 1-хлорнафталин-2-илтрифторметансульфоната в виде бесцветного масла (выход 77%). 1H-ЯМР (CDCl3) : 8,34 (1H, ддд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,92 (1H, ддд, J=0,76 Гц, J=1,2 Гц,J=8,24 Гц), 7,86 (1H, д, J=8,88 Гц), 7,71 (1H, ддд, J=1,2 Гц, J=6, 88 Гц, J=8,50 Гц), 7,64 (1H, ддд, J=1,88 Гц,J=6,88 Гц, J=8,24 Гц), 7,46 (1H, д, J=8,88 Гц); ГХ-МС: m/z=310,7. трет-бутил 2-[(1-хлорнафталин-2-ил)амино]этилкарбамат. Высушенную в печи пробирку для микроволнового облучения вакуумируют и заполняют аргоном. В пробирку загружают Pd(OAc)2 (25 мг 0,113 ммоль, 10 мол.% Pd), BINAP (112 мг, 0,17 ммоль, 15 мол.%) и Cs2CO3 (733 мг, 2,25 ммоль), вакуумируют и снова заполняют аргоном. Колбу закрывают резиновой пробкой и добавляют через пробку сухой диоксан (6 мл), 1-хлорнафталин-2-илтрифторметансульфонат(350 мг, 1,13 ммоль) и трет-бутил(2-аминоэтил)карбамат (361 мг, 2,25 ммоль). Затем реакционный сосуд закрывают, помещают в микроволновый реактор и облучают в течение 2 ч при 150C до тех пор, пока полностью не израсходуются исходные вещества, о чем судят по данным ТСХ и ГХ анализа. Неочищенный продукт очищают флэш-хроматографией на силикагеле (в качестве элюента смесь петролейный эфир/этилацетат от 99:1 до 90:10),с получением трет-бутил 2-[(1-хлорнафталин-2 ил)амино]этилкарбамата в виде не совсем белого твердого вещества с выходом 48%. 1 Н-ЯМР (ацетон-d6) : 7,94 (1H, дд, J=0,76 Гц, J=1,88 Гц, J=8,50 Гц), 7,80-7,70 (2H, м), 7,48 (1H, дд,J=1,2 Гц, J=6,88 Гц, J=8,50 Гц), 7,33 7,15 (2H, м), 6,42-6,20 (1H, ушир.с), 5,60-5,40 (1H, ушир.с), 3,53 3,44(2H, м), 3,44-3,35 (2H, м), 1,4 (9H, с); ВЭЖХ-МС (ESI + ): m/z 321,8 [М+Н+]. 2-[(1-хлорнафталин-2-ил)амино]этанаминийхлорид. В охлаждаемую (0C) одногорлую колбу, содержащую раствор трет-бутил 2-[(1-хлорнафталин-2 ил)амино]этилкарбамата в 4 мл этилового эфира, добавляют 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение 7 ч. Реакционную смесь концентрируют при пониженном давлении,с получением 2-[(1-хлорнафталин-2 ил)амино]этанаминийхлорида в виде розового твердого вещества (выход 92%), которое является чистым по данным ТСХ и ЯМР анализа. 1N-(1-хлорнафталин-2-ил)-N'-(фуран-2-илметил)этан-1,2-диамин (41) К раствору 2-[(1-хлорнафталин-2-ил)амино]этанаминийхлорида (73 мг, 0,25 ммоль) в 4 мл MeOH добавляют K2CO3 (104 мг, 0,75 ммоль). Через 10 мин добавляют 21 мкл (0,253 ммоль) фуран-2 карбальдегида. Полученный в результате раствор перемешивают в течение 2 ч при комнатной температуре, добавляют боргидрид натрия (10 мг, 0,275 ммоль) и реакционную смесь оставляют перемешиваться еще на 15 ч при комнатной температуре. Смесь разбавляют 10 мл этилацетата и переносят в делительную воронку. Органический слой промывают водой, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией на силикагеле(CH2Cl2/MeOH 95:5 плюс 0,3% NH4OH), с получением N-(1-хлорнафталин-2-ил)-N'-(фуран-2 илметил)этан-1,2-диамина в виде желтого масла (выход 63%). 1(2H, м), 3,00-2,90 (2H, м), 2,80-2,60 (1H, ушир.с); ВЭЖХ-МС (ESI+): m/z 301,6 [М+Н+]. Следующие соединения получают по методике, описанной для соединения (41). Пример 43. N-(1-хлорнафталин-2-ил)-N'-[(5-метилфуран-2-ил)метил]этан-1,2-диамин (42). Получают из 2-[(1-хлорнафталин-2-ил)амино]этанаминийхлорида и 5-метилфуран-2-карбальдегида с выходом 57% в виде желтого масла. 1(2H, м), 3,10-2,70 (2H, м), 2,80-2,60 (1H, ушир.с); ВЭЖХ-МС (ESI+): m/z 314,6 [М+Н+]. Пример 49. Синтез 2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамина (48). Получение промежуточных продуктов. 1-фторнафталин-2-ол. К охлажденному (0-5C) раствору NFSI (0,82 г, 2,6 ммоль) в 30 мл CH2Cl2 добавляют ZrCl4 (0,031 г,5 мол.%) и затем 0,375 г (2,6 ммоль) нафталин-2-ола. Смесь перемешивают в течение 18 ч при комнатной температуре до полного исчезновения исходных веществ, о чем судят по данным ТСХ и ГХ анализа. Смесь гасят насыщенным водным раствором NaCO3 (30 мл) и переносят в делительную воронку. Две фазы разделяют и органическую фазу промывают водой (310 мл), сушат над Na2SO4 и упаривают в вакууме с получением желтого масла. Неочищенный продукт очищают флэш-хроматографией (петролейный эфир/этилацетат, 85:15) с получением 1-фторнафталин-2-ола (0,214 г, 51% выход) в виде белого твердого вещества. 1H-ЯМР (CDCl3) : 7,96 (1H, д), 7,83-7,77 (1H, м), 7,74-7,47 (2H, м), 7,44-7,38 (1H, м), 7,26-7,22 (1H,м); ГХ-МС: m/z 162. трет-бутил 2-[(1-фторнафталин-2-ил)окси]этилкарбамат. К раствору 1-фторнафталин-2-ола (0,162 г, 1,0 ммоль) и K2CO3 (0,300 г, 2,0 ммоль) в ацетоне добавляют трет-бутил(2-бромэтил)карбамат (0,336 г, 1,5 ммоль). Полученную в результате смесь нагревают при кипячении с обратным холодильником в течение ночи. Когда контроль ТСХ (смесь нгексан/этилацетат 6:4) показывает исчезновение 1-фторнафталин-2-ола, растворитель выпаривают в вакууме и остаток растворяют в 15 мл этилацетата, промывают водой (35 мл), насыщенным раствором соли (10 мл) и сушат над Na2SO4. Выпаривание растворителя дает трет-бутил 2-[(1-фторнафталин-2 ил)окси]этилкарбамат в виде белого твердого вещества (65% выход), которое используют без дополнительной очистки. 1(1H, м), 5,20-4,90 (1H, ушир.с), 4,26 (2H, т, 5,1 Гц), 3,57 (2H, м, 5,1 Гц), 1,47 (9H, с). 2-[(1-фторнафталин-2-ил)окси]этанаминийхлорид. В охлаждаемую (0C) одногорлую колбу, содержащую раствор трет-бутил 2-[(1-фторнафталин-2 ил)окси]этилкарбамата в 5 мл этилового эфира, добавляют 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют при пониженном давлении с получением 2-[(1-фторнафталин-2- 18022943 ил)окси]этанаминийхлорида в виде белого твердого вещества (выход 95%), которое является чистым по данным ТСХ и ЯМР анализа. 1(1H, м); 4,24 (2H, т, 5,1 Гц), 3,14 (2H, т, 5,1 Гц); ВЭЖХ-МС (ESI+): m/z 206 [М+Н+]. Синтез соединения 2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (48). Получают по методике, применяемой для соединения (1), из 2-[(1-фторнафталин-2 ил)окси]этанаминийхлорида и фуран-2-карбальдегида с выходом 65% в виде белого масла. 1(1H, д, J=8,88 Гц), 6,70 (1H, дд, J=0,75 Гц, J=3,30 Гц), 6,52 (1H, дд, J=2,01 Гц, J=3,30 Гц), 4,49 (2H, т, J=5,1 Гц), 4,45 (2H, с), 3,51 (2H, т, J=5,1 Гц); ВЭЖХ-МС (ESI + ): m/z 286,3 [М+Н+]. Следующие соединения получают по методике, описанной для соединения (48). Пример 50. 2-[(1-фторнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]этанамин (49). Получают из 2-[(1-фторнафталин-2-ил)окси]этанаминийхлорида и 5-метилфуран-2-карбальдегида с выходом 63% в виде желтого масла. 1H-ЯМР (CD3OD) : 8,00 (1H, д), 7,88-7,84 (1H, м), 7,70 (1H, д, J=8,88 Гц), 7,55 (1H, ддд, J=1,2 Гц,J=6,88 Гц, J=8,50 Гц), 7,46 (1H, ддд, J=1,88 Гц, J=6,88 Гц, J=8,2 Гц), 7,41 (1H, д, J=8,88 Гц), 6,50 (1H, д,J=3,31 Гц), 6,14 (1H, кв.д, J=0,9 Гц, J=3,31 Гц), 4,47 (2H, т, J=5,00 Гц), 4,41 (2H, с), 3,50 (2H, т, J=5,00 Гц),2,31 (3H, д, J=0,9 Гц); ВЭЖХ-МС (ESI+): m/z 300,1 [М+Н+]. Пример 51. N-[(5-хлорфуран-2-ил)метил]-2-[(1-фторнафталин-2-ил)окси]этанамин (50). Получают из 2-[(1-фторнафталин-2-ил)окси]этанаминийхлорида и 5-хлорфуран-2-карбальдегида с выходом 70% в виде слегка желтого масла. 1[М+Н+]. Пример 52. N-[(5-хлортиофен-2-ил)метил]-2-[(1-фторнафталин-2-ил)окси]этанамин (51). Получают из 2-[(1-фторнафталин-2-ил)окси]этанаминийхлорида и 5-хлортиофен-2-карбальдегида с выходом 71% в виде слегка белого масла. 1ZrCl4 (0,122 г, 5 мол.%) и затем 6-гидроксинафталин-2-карбонитрил (1,76 г, 10,4 ммоль). Смесь перемешивают в течение 18 ч при комнатной температуре до полного исчезновения исходных веществ, о чем судят по данным ГХ-анализа. Смесь гасят насыщенным водным раствором NH4Cl (30 мл) и переносят в делительную воронку. Две фазы разделяют и органическую фазу промывают водой (310 мл), сушат надNa2SO4 и упаривают в вакууме с получением желтого масла. Неочищенный продукт очищают флэш- 19022943 хроматографией (петролейный эфир/этилацетат 75:25) с получением 5-хлор-6-гидроксинафталин-2 карбонитрила (1,38 г, выход 65%) в виде слегка белого твердого вещества. 1H-ЯМР (CD3OD) : 8,40 (1H, д, J=1,88 Гц), 8,29 (1H, д, J=8,70 Гц), 8,05 (1H, д, J=8,50 Гц), 7,76 (1H,дд, J=1,88 Гц, J=8,7 Гц), 6,75 (1H, д, J=0,75 Гц, J=3,30 Гц); ГХ-МС: m/z 203,5. трет-бутил 2-[(1-хлор-6-цианонафталин-2-ил)окси]этилкарбамат. К раствору 5-хлор-6-гидроксинафталин-2-карбонитрила (1,5 ммоль) и K2CO3 (3 ммоль) в ацетоне добавляют трет-бутил(2-бромэтил)карбамат (2,1 ммоль). Полученную в результате смесь нагревают при кипячении с обратным холодильником в течение ночи. После ТСХ-контроля (смесь н-гексан/этилацетат 65:35) выпаривают растворитель в вакууме и остаток растворяют в 15 мл этилацетата, промывают водой(35 мл), насыщенным раствором соли (10 мл) и сушат над Na2SO4. Выпаривание растворителя дает трет-бутил 2-[(1-хлор-6-цианонафталин-2-ил)окси]этилкарбамат в виде коричневого твердого вещества(выход 81%), которое используют без дополнительной очистки. 1H-ЯМР (CD3OD) : 8,51 (1H, д, J=1,88 Гц), 8,28 (1H, д, J=8,70 Гц), 8,04 (1H, д, J=8,50 Гц), 7,70 (1H,дд, J=1,88 Гц, J=8,7 Гц), 6,75 (1H, д, J=0,75 Гц, J=3,30 Гц), 5,20-4,85 (1H, ушир.с), 4,60 (2H, т, J=5,60 Гц),4,44 (2H, с), 1,39 (9H, с); ВЭЖХ-МС (ESI+): m/z=347,6 [M+H+]. 2-[(1-хлор-6-цианонафталин-2-ил)окси]этанаминийхлорид. В охлаждаемую (0C) одногорлую колбу, содержащую раствор трет-бутил 2-[(1-хлор-6 цианонафталин-2-ил)окси]этилкарбамата в 3 мл этилового эфира, добавляют 5 мл 4 М раствора HCl в диоксане. Полученную в результате смесь перемешивают при комнатной температуре в течение ночи. Раствор концентрируют при пониженном давлении, с получением 2-[(1-хлор-6-цианонафталин-2 ил)окси]этанаминийхлорида в виде белого твердого вещества (выход 95%). 1(ESI+): m/z 247,7 [М+Н+]. Пример 56. 5-хлор-6-2-[(пиридин-2-илметил)амино]этоксинафталин-2-карбонитрил (55). Получают по методике, применяемой для соединения (1), из 2-[(1-хлор-6-цианонафталин-2 ил)окси]этанаминийхлорида и пиридин-2-карбальдегида с выходом 56% в виде слегка белого твердого вещества. 1H-ЯМР (CD3OD) : 8,72 (1H, м), 8,41 (1H, д), 7,95-7,84 (2H, м), 7,75-7,68 (1H, м), 7,65-7,55 (2H, м),7,52-7,42 (2H, м), 7,40-7,30 (1H, м), 4,72 (2H, с), 4,61 (2H, т, J=5, 60 Гц), 3,71 (2H, т, J=5,00 Гц); ВЭЖХМС (ESI+): m/z 338,6 [М+Н+]. Следующие соединения получают по методике, описанной для соединения (55). Пример 57. 5-хлор-6-2-[(фуран-2-илметил)амино]этоксинафталин-2-карбонитрил (56). Получают из 2-[(1-хлор-6-цианонафталин-2-ил)окси]этанаминийхлорида и фуран-2-карбальдегида с выходом 78% в виде белого твердого вещества. 1[М+Н+]. Пример 58. 5-хлор-6-(2-[(5-метилфуран-2-ил)метил]аминоэтокси)нафталин-2-карбонитрил (57). Получают из 2-[(1-хлор-6-цианонафталин-2-ил)окси]этанаминийхлорида и 5-метилфуран-2 карбальдегида с выходом 77% в виде слегка белого твердого вещества. 1-ЯМР (CD3OD) : 8,41 (1H, д, J=1,88 Гц), 8,34 (1H, д, J=8,70 Гц), 8,05 (1H, д, J=8,50 Гц), 7,78 (1H,дд, J=1,88 Гц, J=8,70 Гц), 7,64 (1H, д, J=8,50 Гц), 6,69 (1H, д, J=3,39 Гц), 6,50 (1H, д, J=3,39 Гц), 4,60 (2H,т, J=5,60 Гц), 4,44 (2H, с), 3,53 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI + ): m/z 362,2 [М+Н+]. Пример 60. 5-хлор-6-(2-[(5-хлортиофен-2-ил)метил]аминоэтокси)нафталин-2-карбонитрил (59). Получают из 2-[(1-хлор-6-цианонафталин-2-ил)окси]этанаминийхлорида и 5-хлортиофен-2 карбальдегида с выходом 63% в виде желтого твердого вещества. 1H-ЯМР (CD3OD) : 8,41 (1H, д, J=1,88 Гц), 8,34 (1H, д, J=8,70 Гц), 8,05 (1H, д, J=8,50 Гц), 7,78 (1H,дд, J=1,88 Гц, J=8,70 Гц), 7,64 (1H, д, J=8,50 Гц), 6,95 (1H, д, J=3,42 Гц), 6,60 (1H, д, J=3,42 Гц), 4,60 (2H,т, J=5,60 Гц), 4,44 (2H, с), 3,53 (2H, т, J=5,60 Гц); ВЭЖХ-МС (ESI+): m/z 378,2 [М+Н+]. Пример 61. 5-хлор-6-2-[(тиофен-2-илметил)амино]этоксинафталин-2-карбонитрил (60). Получают из 2-[(1-хлор-6-цианонафталин-2-ил)окси]этанаминийхлорида и тиофен-2-карбальдегида с выходом 35% в виде белесого твердого продукта.[М+Н+]. Пример 62. 2-[(1-этилнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (61). В одногорлую круглодонную колбу загружают 2,3 г цинка, 0,23 г HgCl2 и 4 мл воды. Затем добавляют 37% HCl (0,1 мл) и смесь перемешивают в течение 5 мин. После этого добавляют 3 мл толуола и 3,4 мл 37% HCl и, наконец, добавляют частями 1 г (5,37 ммоль) 1-(2-гидроксинафталин-1-ил)этанона. Полученную в результате смесь нагревают при 110C в течение 18 ч. Фазы разделяют и органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением 780 мг(выход 84%) 1-этилнафталин-2-ола в виде коричневого твердого вещества. К раствору 1-этилнафталин-2-ола (780 мг, 4,53 ммоль) и K2CO3 (626 мг, 4,53 ммоль) в 15 мл ацетонитрила добавляют трет-бутил(2-бромэтил)карбамат (1,015 г, 4,53 ммоль). Полученную в результате смесь нагревают при кипячении с обратным холодильником в течение ночи. Когда ТСХ контроль (нгексан/этилацетат 7:3) показывает исчезновение 1-этилнафталин-2-ола, растворитель выпаривают в вакууме и остаток растворяют в 15 мл этилацетата, промывают водой (35 мл), насыщенным раствором соли (5 мл) и сушат над Na2SO4. Выпаривание растворителя дает трет-бутил 2-[(1-этилнафталин-2 ил)окси]этилкарбамат, который растворяют в 10 мл 4 М HCl в диоксане и перемешивают в течение 1 ч. Растворитель удаляют в вакууме и остаток разбавляют н-гексаном (20 мл) и растирают при комнатной температуре в течение 2 ч. Твердое вещество отфильтровывают и сушат в вакууме при 50C с получением 2-[(1-этилнафталин-2-ил)окси]этанаминийхлорида в виде коричневого твердого вещества (821 мг,выход 72%). К раствору 2-[(1-этилнафталин-2-ил)окси]этанаминийхлорида (100 мг, 0,397 ммоль) в 10 млMeOH добавляют K2CO3 (65 мг, 0,47 ммоль). Через 10 мин добавляют 48 мкл (0,58 ммоль) фуран-2 карбальдегида. Полученный в результате раствор перемешивают в течение 1 ч при комнатной температуре, добавляют боргидрид натрия (15 мг, 0,397 ммоль) и оставляют перемешиваться еще на 2 ч при комнатной температуре. Растворитель выпаривают в вакууме. Неочищенный продукт очищают флэшхроматографией на силикагеле (CH2Cl2/MeOH 97:3) с получением 2-[(1-этилнафталин-2-ил)окси]-N(фуран-2-илметил)этанамина в виде коричневого твердого вещества (91 мг, выход 7 8%). 1(1H, м), 7,55-7,48 (1H, м), 7,42-7,32 (2H, м), 6,73 (1H, д, J=3,05 Гц), 6,56 (1H, дд, J=1,94 Гц, J=3,05 Гц),4,49 (2H, с), 4,43 (2H, д, J=5,44 Гц), 3,57 (2H, д, J=5,44 Гц), 3,20 (2H, кв, J=7,38 Гц), 1,27 (3H, т, J=7,38 Гц); ВЭЖХ-МС (ESI+): m/z 296,11 [М+Н+]. Пример 63. 2,2-дифтор-2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (62). К раствору 1-(фуран-2-ил)метанамина (1 г, 10,3 ммоль) в 15 мл сухого ДМФА добавляют этилбром(дифтор)ацетат (2,3 г, 11,3 ммоль) и K2CO3 (2,13 г, 15,4 ммоль). Раствор перемешивают в течение 18 ч при комнатной температуре. Смесь разбавляют 30 мл воды и экстрагируют 220 мл этилацетата. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением 2-бром-2,2-дифтор-N-(фуран-2-илметил)ацетамида в виде красного масла (2,3 г, выход 88%); ВЭЖХ-МС (ESI+): m/z 255,03 [М+Н+]. К раствору 1-фторнафталин-2-ола (280 мг, 1,73 ммоль) и K2CO3 (1,2 г, 8,65 ммоль) в 10 мл ацетона добавляют 2-бром-2,2-дифтор-N-(фуран-2-илметил)ацетамид (527 мг, 2,08 ммоль). Полученную в результате смесь перемешивают при 40C в течение ночи. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом (30 мл) и промывают водой. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением 2,2-дифтор-2-[(1 фторнафталин-2-ил)окси]-N-(фуран-2-илметил)ацетамида в виде красного масла (650 мг), которое используют на следующей стадии без дополнительной очистки. В пробирку для микроволнового облучения загружают 2,2-дифтор-2-[(1-фторнафталин-2-ил)окси]N-(фуран-2-илметил)ацетамид (60 мг, 0,18 ммоль), боргидрид натрия (16 мг, 0,41 ммоль) и 2 мл сухого ТГФ. К полученной смеси добавляют раствор I2 (51 мг, 0,20 ммоль) в 1 мл сухого ТГФ. Пробирку закупоривают, помещают в микроволновый реактор и облучают в течение 30 мин при 110C до тех пор, пока не будет полностью израсходованы исходные вещества, о чем судят по данным ТСХ (петролейный эфир/этилацетат, 80:20). Смесь выпаривают при пониженном давлении и неочищенный продукт очищают препаративной ВЭЖХ с получением 2,2-дифтор-2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2 илметил)этанамина в виде оранжевого масла (53 мг, выход 91%). 1H-ЯМР (CD3OD) : 8,10 (1H, д, J=8,20 Гц), 7,95 (1H, д, J=8,20 Гц), 7,75-7,55 (3H, м), 7,52-7,42 (2H,м), 6,40 (1H, дд, J=2,00 Гц, J=3,16 Гц), 6,34 (1H, дд, J=0,80 Гц, J=3,16 Гц), 3,97 (2H, с), 3,33 (2H, м); ВЭЖХ-МС (ESI+): m/z 322,21 [М+Н+]. Пример 64. 2-[(6-бром-1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (63). К раствору 400 мг (2,24 ммоль) 1-хлорнафталин-2-ола в 3 мл MeOH добавляют HBr (purum ч.д.а. 62%, 270 мкл) и Н 2 О 2 (50 мас.%, в водном растворе, 27 мкл). Полученную в результате смесь нагревают при 40C и перемешивают в течение ночи. Смесь гасят водой (10 мл) и экстрагируют этилацетатом (10 мл 2). Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме с получением 6-бром-1-хлорнафталин-2-ола в виде бледно-желтого твердого вещества, которое используют на следующей стадии без дополнительной очистки; ВЭЖХ-МС (ESI + ): m/z 258,51 [М+Н+]. К раствору 6-бром-1-хлорнафталин-2-ола (100 мг, 0,39 ммоль) и K2CO3 (108 мг, 0,7 8 ммоль) в 4 мл ацетонитрила добавляют трет-бутил(2-бромэтил)карбамат (175 мг, 0,78 ммоль). Полученную в результате смесь нагревают при 60C в течение 2 ч. Когда ТСХ-контроль (н-гексан/этилацетат, 90:10) показывает исчезновение 6-бром-1-хлорнафталин-2-ола, растворитель выпаривают в вакууме и неочищенный продукт переносят в 10 мл 4 М HCl в диоксане и перемешивают в течение 1 ч. Растворитель удаляют в вакууме, остаток разбавляют н-гексаном (10 мл) и растирают при комнатной температуре в течение ночи. Твердое вещество отфильтровывают и сушат в вакууме при 50C с получением 2-[(6-бром-1 хлорнафталин-2-ил)окси]этанаминийхлорида в виде белого твердого вещества (91 мг, выход 69%); ВЭЖХ-МС (ESI+): m/z 337,83 [М+Н+]. К раствору 2-[(6-бром-1-хлорнафталин-2-ил) окси] этанаминийхлорида (91 мг, 0,27 ммоль) в 10 млMeOH добавляют K2CO3 (41 мг, 0,30 ммоль). Через 10 мин добавляют 45 мкл (0,54 ммоль) фуран-2 карбальдегида. Полученный в результате раствор перемешивают в течение 1 ч при комнатной температуре, добавляют боргидрид натрия (10 мг, 0,27 ммоль) и затем перемешивают еще в течение 2 ч при комнатной температуре. Растворитель выпаривают в вакууме и неочищенный продукт очищают флэшхроматографией на силикагеле (CH2Cl2/MeOH, 95:5) с получением 2-[(6-бром-1-хлорнафталин-2 ил)окси]-N-(фуран-2-илметил)этанамина в виде коричневого твердого вещества (87 мг, выход 85%). 1(1H, дд, J=1,05 Гц, J=2,08 Гц), 7,78 (1H, дд, J=2,05 Гц, J=8,98 Гц), 7,67 (1H, д, J=8,98 Гц), 6,70 (1H, дд,J=1,05 Гц, J=3,34 Гц), 6,34 (1H, дд, J=2,08 Гц, J=3,34 Гц), 4,55 (2H, д, J=5,44 Гц), 4,43 (2H, с), 3,43 (2H, д,J=5,44 Гц); ВЭЖХ-МС (ESI+): m/z 381,21 [М+Н+]. Пример 65. Оценка in vivo активности. а. Клонирование, секвенирование, трансфекция и селекция положительных клонов, экспрессирующих человеческий TRPM8. Разработан функциональный клеточный анализ для идентификации антагонистов рецепторовTRPM8, оптимизированный для возможности проведения высокопроизводительного скрининга наFLIPRTETRA, на клетках HEK293 посредством отбора чистых стабильных клонов и функциональной характеристики с использованием флуоресцентного кальций-чувствительного красителя.TRPM8 клонируют в сайт множественного клонирования вектора экспрессии млекопитающегоpcDNA3; последовательность полученной конструкции pcDNA3/hTRPM8 полностью подтверждена, и ее используют для трансфекции клеточной линии HEK293. Клетки HEK293, стабильно трансфицированные геном TRPM8, содержат в минимальной питательной среде. Данные клетки трансфицируют посредством вектора pcDNA3/hTRPM8 путем электропорации и затем производят отбор, используя среду, содержащую 0,8 мг/мл G418, в течение 10-15 дней. Следующие коммерческие соединения используют в качестве контрольного соединения каналаTRPM8 для тестирования клеточной линии HEK293/hTRPM8 на агонистическую и антагонистическую активность. Активаторы: ментолWS-3,(N-этил-5-метил-2-(1 метилэтил)циклогексанкарбоксамид) (SIGMA кат.W345501). Блокатор: капсазепин (SIGMA кат.С 191). Экспериментальные действия осуществляют, используя прибор FLIPR. Функциональные клоны отбирают на FLIPR384 на основании реакции на 1 мМ ментол. Отбирают два лучших клона-респондера, разводят до плотности клеток 1 клетка/лунка и анализируют на FLIPR384 с использованием 1 мМ ментола. Анализируют реакцию рецептора TRPM8 на контрольный агонист ментол, используя кальцийзависимый сигнал флуоресценции. Также проводят пэтч-кламп регистрацию в конфигурации вольт-кламп на клонах HEK/TRPM8 с целью контроля фармакологии рецепторов и определения кривой доза агониста-реакция и значения EC50. Клетки HEK293 содержат при комнатной температуре на отполированных огнем пипетках из боросиликатного стекла, имеющего сопротивление 1,5-2,5 МОм, применяемых для регистрации токов, после использования лекарственного препарата. Применение ментола индуцирует дозазависимый внутренний ток в выбранном клоне HEK/hTRPM8 (рассчитанное значение EC50=58 мкМ). В нетрансфицированных клетках HEK293 не зарегистрировано ментолиндуцированных токов. Для определения капсазепинантагонистической активности по реакции агониста ментола и для контроля стабильности реакции антагониста на протяжении разных дней экспериментов выбранный клон TRPM8 анализируют через 24 ч наFLIPR384 в присутствии различных концентраций антагониста (от 100 нМ до 316 мкМ). Выбранный клон показывает очень хорошую стабильность и воспроизводимость антагонистической активности (рассчитанное значение IC50=20 мкМ). В итоге, лучший клон характеризуют по следующим пунктам: 1 - фармакология: определение EC50 агониста и IC50 антагониста в различных экспериментах; 2 - оптимальная плотность клеток и время посева; 3 - ДМСО-чувствительность; 4 - стабильность лиганда; 5 - пэтч-кламп анализ.b. Подготовка скрининга для идентификации TRPM8 антагонистов. В качестве лигандов используют следующие коммерческие соединения. Активатор: охлаждающий агент 10 (Takasago CAS87061-04-9). Блокатор: капсазепин (SIGMA кат.D5879). Экспериментальные действия осуществляют с использованием прибора FLIPRTETRA. КлеткиHEK293, стабильно трансфицированные геном TRPM8, содержат в минимальной питательной среде. Клеточную линию TRPM8 анализируют в отношении реакции на библиотеку соединений, используя сигнал флуоресценции, зависящий от мобилизации Ca2+, в формате 384-луночного микротитровального планшета. Анализ проводят, используя FLIPRTETRA (MDC) с камерой ICCD. Выполнение анализа включает использование трех микротитровальных планшетов. 1. Аналитический планшет, содержащий клетки, нагруженные красителем и приготовленные следующим образом. Клетки высевают с плотностью 15000 клеток/лунка на полную среду (25 мкл/лунка) на 384 луночные микротитровальные планшеты с покрытием из поли-D-лизина. Через 24 ч после посева планшеты с клетками промывают аналитическим буфером Тироде при помощи устройства для промывания микропланшетов и оставляют в каждой лунке по 10 мкл аналитического буфера Тироде. Затем клетки загружают раствором красителя Fluo-4 NW, 10 мкл/лунка, при помощи устройства для пипетирования CyBi. Каждую бутылочку с красителем Fluo-4 NW (каталог Molecular ProbesF36206, компонент A) ресуспендируют в 8 мл аналитического буфера Тироде и дополняют 100 мкл водорастворимого пробенецида(каталог Molecular ProbesF36206, компонент В). Планшеты с загруженным красителем инкубируют в течение 1 ч при комнатной температуре. 2. Планшет с разведениями соединения (фиг. 1), содержащий разведенные тестируемые соединения, приготовленные следующим образом. Столбец 1: лунки, содержащие аналитический буфер плюс 0,5% ДМСО в конце. Столбец 2: лунки с чередованием контроля с максимальным сигналом при первой инъекции (максимальная реакция: охлаждающий агент 10 при EC100, 100 мкМ) и контроля с минимальным сигналом при первой инъекции (аналитический буфер плюс 0,5% ДМСО в конце). Столбцы 3-22: лунки, содержащие аналитический буфер плюс 0,5% ДМСО в конце. В эти лунки добавляют тестируемые соединения при 3 концентрациях. Столбец 23: лунки с чередованием контроля с максимальным сигналом при второй инъекции (аналитический буфер) и контроля с минимальным сигналом при второй инъекции (антагонист капсазепинIC100 50 мкМ) в аналитическом буфере плюс 0,5% ДМСО в конце). Столбец 24: лунки, содержащие капсазепин (антагонист) при 8 концентрациях с конечными концентрациями 50, 25, 6,25, 3,15, 1,56, 780, 309 мкМ в аналитическом буфере плюс 0,5% ДМСО в конце, в двух экземплярах. 3. Планшет с активатором (фиг. 2), содержащий агонист, охлаждающий агент 10, при EC80, приготовленный следующим образом. Столбец 1: реакция на дозу охлаждающего агента 10 (агонист) при 8 концентрациях с конечными концентрациями 100, 31,6, 10, 3,16, 1, 316, 100, 31,6 мкМ в аналитическом буфере, в двух повторах. Столбцы 2-24: охлаждающий агент 10 (агонист) при EC80 (3-кратно концентрированный, в конце 20 мкМ) в аналитическом буфере. Тест проводят по методике, включающей следующие стадии. 1. Образцы, содержащиеся в лунках планшета с соединениями, добавляют в соответствующие лунки аналитического планшета на FLIPRTETRA с получением, таким образом, в столбцах 3-22 добавку тестируемых соединений при 3-кратной концентрации к клеткам аналитического планшета. В аналитических лунках не производят перемешивания и регистрируют сигнал излучаемой флуоресценции в течение 300 с. 2. Образцы, содержащиеся в лунках планшета с активатором, добавляют в соответствующие лунки аналитического планшета на FLIPRTETRA с получением, таким образом, в столбцах 3-22 аналитического планшета соединение-агонист в дополнение к тестируемым соединениям. Сигнал излучаемой флуоресценции регистрируют в течение 180 с. Столбцы 1, 2, 23 и 24 используют в качестве контроля. В частности: выражение "контроль с максимальным сигналом при первой инъекции" означает реакцию на охлаждающий агент 10 (агонист) приEC100. Выражение "контроль с максимальным сигналом при второй инъекции" означает агонист при EC80(10 мкМ) в присутствии предварительно введенного аналитического буфера. Выражение "контроль с минимальным сигналом при первой инъекции" соответствует инъекции аналитического буфера, и выражение "контроль с минимальным сигналом при второй инъекции" означает агонист при EC80 (20 мкМ) в присутствии предварительно введенного антагониста сравнения каспазепина при IC100 (50 мкМ). На фиг. 3 представлена конкретная кинетическая кривая отклика, получаемая для всех соединений из табл. I. На фазе целевой активации (ТА) инъекция агониста сравнения при EC80 дает увеличение сигнала флуоресценции в лунках, содержащих контроль с максимальным сигналом, в которые предварительно введен аналитический буфер в CA, тогда как в лунках, содержащих контроль с минимальным сигналом,реакция полностью ингибируется, благодаря предварительному введению ингибитора сравнения капсазепина. Задачей исследования было найти антагонисты TRPM8-активности; с этой целью измеряли изменение сигнала флуоресценции на фазе TA. Были рассчитаны и проанализированы некоторые параметры (коэффициент Z', вариабильность между планшетами, вариабильность внутри планшета, вариабильность день ото дня, реакция на дозу антагониста и определение IC50). Что касается реакции на дозу антагониста и определения IC50, капсазепин (антагонист сравнения) включали в качестве контроля и рассчитывали значения IC50. Для всех исследуемых соединений. Все соединения по изобретению демонстрируют значения IC5030 мкМ; предпочтительные соединения (1, 5,6, 8, 13, 14, 25, 32, 33, 34, 35, 48, 52, 53, 55, 60) характеризуются значением IC5010 мкМ; наиболее предпочтительное соединение (1) имеет значение IC50=0,07 мкМ. Пример 66. Оценка in vivo активности на изоволкметрической модели мочевого пузыря. Самок крыс анестезируют уретаном. Мочеточники перевязывают и рассекают. До наложения уретральной лигатуры через наружное отверстие мочеиспускательного канала вводят в мочевой пузырь катетер. Для тестирования соединений используют два протокола: внутривенное (i.v.) или внутрипузырное(i.ves) введение. В первом протоколе мочевой пузырь заполняют физиологическим раствором постепенно каждые 5 мин по 100 мкл до наступления ритмических сокращений мочевого пузыря (RBC). После 30-минутного контрольного периода вводят внутривенно соединение (1), растворенное в растворе солютол/NMP (2:1 мас./мас.), при дозе 10 мг/кг или носитель (1 мл за 5 мин) и наблюдают полученный в результате эффект в течение 60 мин. Для каждой группы определяют частоту мочеиспускания (MF) и амплитуду мочеиспускания (AM) в течение контрольного периода и периода обработки. Системная обработка соединением(1) значительно снижает MF, примерно на 36% в течение первых 30 мин эксперимента. Время ингибирования RBC значительно больше, примерно на 300 с, для группы, принимающей соединение (1), по сравнению с группой, принимающей носитель (непарный t-тест Стьюдента). Во втором протоколе мочевой пузырь наполняют первые 3 раза каждые 5 мин по 100 мкл раствора солютол/NMP (2,1 мас./мас.), содержащего 0,756 мг соединения (1), или 100 мкл носителя, затем 100 мкл физиологического раствора каждые 5 мин до наступления RBC. Максимальный вводимый объем составляет 3 мл. Сравнивают пороговые объемы, индуцирующие RBC в каждой группе. При тестируемой дозе соединение (1) полностью отменяет RBC. Кроме того, пороговый объем (TV) в группе животных, принимавших соединение (1), достигает 3 мл без наступления RBC, тогда как в группе животных, принимавших носитель, RBC происходят у всех крыс при среднем объеме 0,70,09 мл. Соединение не меняетAM. В обоих указанных выше in vivo экспериментах соединение проявляет активность по снижению сокращений мочевого пузыря посредством ингибирования афферентных путей мочевого пузыря, предполагая его эффективность при лечении синдрома болезненного мочевого пузыря (PBS) и гиперактивного мочевого пузыря (ОАВ). Пример 67. Анализ селективности. Целью данного исследования является оценка in vitro эффектов соединения 1 на 3 клонированных человеческих каналах, экспрессируемых в клетках HEK293 или CHO, с использованием набора для анализа кальция Fluo-8 (AAT Bioquest, Inc.) и флуориметрического планшет-ридера (FLIPRTETRA TETRA). В данном исследовании оценивали следующие 3 клонированных человеческих канала. 1. Клонированные каналы hTRPM8 (кодированные геном человека TRPM8, стабильно экспрессируемые в клетках CHO). 2. Клонированные каналы hTRPV1 (кодированные геном человека TRPV1, стабильно экспрессируемые в клетках HEK293). 3. Клонированные каналы hTRPV4 (кодированные геном человека TRPV4, стабильно экспрессируемые в клетках CHO). Эффекты 5 концентраций (0,001, 0,01, 1 и 10 мкМ) соединения (1) оценивали на этих трех каналахTRP (n3), применяя следующую экспериментальную методику для каждого тестируемого канала.TRPM8. Способность соединения (1) действовать в качестве антагониста TRPM8 оценивают посредством анализа притока кальция. Каналы активируют ментолом, агонистом-положительным контролем и рассматривают способность тестируемых веществ ингибировать этот сигнал и сравнивают с антагонистом- 24022943 положительным контролем 2-АРВ. Сигнал, выявленный в присутствии агониста-положительного контроля (10 мкМ ментола), принимают за 100%, и сигнал в присутствии антагониста-положительного контроля (200 мкМ 2-АРВ) принимают за 0. Нормированный % ингибирования для соединения (1) показан в таблице. Значения считаются значимыми и выделены желтым цветом, если среднее значение для тестируемого соединения составляет три или более стандартных отклонения от среднего значения для агониста-положительного контроля.TRPV1. Способность соединения (1) действовать в качестве антагониста TRPV1 оценивают посредством анализа притока кальция. Сигнал, выявленный в присутствии агониста-положительного контроля (0,1 мкМ капсаицин), принимают за 100%, и сигнал в присутствии антагониста (5 мкМ рутений красный) принимают за 0. Нормированный % ингибирования для соединения 1 показан в таблице. Значения считаются значимыми и не показывают существенного ингибирования ионного канала при всех исследуемых концентрациях.TRPV4. Способность соединения (1) действовать в качестве антагониста TRPV4 оценивают посредством анализа притока кальция. Сигнал, выявленный в присутствии агониста-положительного контроля (10 мкМ GSK1016790A), принимают за 100%, и сигнал в присутствии антагониста (5 мкМ рутений красный) принимают за 0. Нормированный % ингибирования для соединения 1 показан в таблице. Значения считаются значимыми, если среднее значение для тестируемого соединения составляет три или более стандартных отклонения от среднего значения для агониста-положительного контроля. Результаты для каждого канала суммированы в приведенной ниже таблице Пример 68. ADME оценка. Результаты этой оценки суммированы ниже в таблице и его фармацевтически приемлемые соли, гдеR выбран из Н, Br, CN, NO2, SO2NH2, SO2NHR' и SO2N(R')2, где R' выбран из линейного или разветвленного C1-С 4 алкила;R1 и R2, независимо друг от друга, выбраны из H, F и линейного или разветвленного C1-С 4 алкила;R3 и R4, независимо друг от друга, выбраны из H, линейного или разветвленного C1-С 4 алкила;Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из H, линейного или разветвленного C1-С 4 алкила;R5 представляет собой остаток, выбранный из H, линейного или разветвленного C1-С 4 алкила;Het представляет собой гетероарильную группу, выбранную из пирролила, N-метилпирролила,тиофенила, фурила и пиридинила, незамещенного или замещенного одним или более заместителями,выбранными из F, Cl, CH3, NH2 и OH. 2. Соединение по п.1, в котором, независимо друг от друга,R выбран из H, Br и CN;R1 и R2, независимо друг от друга, выбраны из Н, F и CH3;R3 и R4, независимо друг от друга, выбраны из Н и CH3;Z выбран из NR6 и R6R7N+, где R6 и R7, независимо друг от друга, выбраны из Н и CH3;R5 выбран из Н и CH3. 3. Соединение по п.1 или 2, в котором, независимо друг от друга, R выбран из Н и CN;Het замещен по меньшей мере одним заместителем, выбранным из F, Cl и CH3. 4. Соединение по любому из пп.1-3, где Het обозначает 5-замещенный пиррол-2-ил, 5-замещенныйN-метилпиррол-2-ил, 5-замещенный тиофен-2-ил или 5-замещенный фур-2-ил. 5. Соединение по любому из пп.1-4, выбранное из группы, включающей следующие соединения: 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорид (1); 2-[(1-хлорнафталин-2-ил)окси]-N-[(5-метилфуран-2-ил)метил]этанаминийхлорид (2);N-[(5-хлортиофен-2-ил)метил]-2-[(1-фторнафталин-2-ил)окси]этанамин (51); 2-[(1-фторнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанамин (52); 2-[(1-фторнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанамин (53); 2-[(1-фторнафталин-2-ил)окси]-N-[(1-метил-1H-пиррол-2-ил)метил]этанамин (54); 5-хлор-6-2-[(пиридин-2-илметил)амино]этоксинафталин-2-карбонитрил (55); 5-хлор-6-2-[(фуран-2-илметил)амино]этоксинафталин-2-карбонитрил (56); 5-хлор-6-(2-[(5-метилфуран-2-ил)метил]аминометокси)нафталин-2-карбонитрил (57); 5-хлор-6-(2-[(5-хлорфуран-2-ил)метил]аминометокси)нафталин-2-карбонитрил (58); 5-хлор-6-(2-[(5-хлортиофен-2-ил)метил]аминометокси)нафталин-2-карбонитрил (59); 5-хлор-6-2-[(тиофен-2-илметил)амино]этоксинафталин-2-карбонитрил (60); 2-[(1-этилнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (61); 2,2-дифтор-2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (62); 2-[(6-бром-1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамин (63). 6. Соединение по любому из пп.1-5, выбранное из группы, состоящей из следующих соединений: 2-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)этанаминийхлорида (1); 2-[(1-хлорнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанаминия (5); 2-[(1-хлорнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанаминия (6); 1-[(1-хлорнафталин-2-ил)окси]-N-(фуран-2-илметил)-2-метилпропан-2-амина (8); 1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-(пиридин-2-илметил)пропан-2-амина (13); 1-[(1-хлорнафталин-2-ил)окси]-2-метил-N-[(1-метил-1H-пиррол-2-ил)метил]пропан-2-амина (14); 2-[(1-хлорнафталин-2-ил)сульфонил]-N-(фуран-2-илметил)этанамина (25); 3-(1-хлорнафталин-2-ил)-N-(фуран-2-илметил)пропан-1-амина (32); 3-(1-хлорнафталин-2-ил)-N-[(5-метилфуран-2-ил)метил]пропан-1-амина (33);N-[(5-хлорфуран-2-ил)метил]-3-(1-хлорнафталин-2-ил)пропан-1-амина (34); 3-(1-хлорнафталин-2-ил)-N-[(5-хлортиофен-2-ил)метил]пропан-1-амина (35); 2-[(1-фторнафталин-2-ил)окси]-N-(фуран-2-илметил)этанамина (48); 2-[(1-фторнафталин-2-ил)окси]-N-(тиофен-2-илметил)этанамина (52); 2-[(1-фторнафталин-2-ил)окси]-N-(пиридин-2-илметил)этанамина (53); 5-хлор-6-2-[(пиридин-2-илметил)амино]этоксинафталин-2-карбонитрила (55); 5-хлор-6-2-[(тиофен-2-илметил)амино]этоксинафталин-2-карбонитрила (60). 7. Применение соединения по любому из пп.1-6 для предупреждения и/или лечения расстройств и/или заболеваний, связанных с активностью TRPM8 (катионного канала транзиторного рецепторного потенциала, подсемейство M, член 8). 8. Применение соединения по п.7, где указанное расстройство и/или заболевание выбрано из группы, включающей воспалительные заболевания, ишемию, боль, урологические расстройства, инсульт,психиатрические расстройства и нейродегенерацию. 9. Применение соединения по п.7 или 8, где указанные расстройства и/или заболевания выбраны из хронической боли, невропатической боли, включая холодовую аллодинию и диабетическую невропатическую боль, послеоперационной боли, боли при остеоартрите, боли при ревматоидном артрите, раковой боли, невралгии, фибромиалгии, невропатии, повышенной чувствительности к боли, повреждения нерва,мигрени, головных болей, зуда, синдрома раздраженного кишечника и заболеваний дыхательных путей,синдрома болезненного мочевого пузыря, интерстициального цистита, гиперактивности детрузора (гиперактивный мочевой пузырь), недержания мочи, нейрогенной гиперактивности детрузора (гиперфлексии детрузора), идиопатической детрузорной гиперактивности (нестабильности детрузора), доброкачественной гиперплазии предстательной железы, расстройств нижних мочевых путей и симптомов нижних мочевых путей, тревоги и депрессии. 10. Фармацевтическая композиция, предназначенная для лечения и/или предотвращения заболеваний, связанных с активностью катионного канала транзиторного рецепторного потенциала, подсемейст- 29
МПК / Метки
МПК: C07D 333/28, A61P 29/00, A61K 31/4402, C07D 307/52, C07D 307/56, A61K 31/341, C07D 207/323, C07D 213/36, A61K 31/381, C07D 333/20, A61K 31/4025
Метки: trpm8, антагонисты, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-22943-antagonisty-receptorov-trpm8.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецепторов trpm8</a>
Предыдущий патент: Противошумовой барьер и способ установки противошумового барьера
Следующий патент: Фармацевтическая композиция, содержащая дротаверин
Случайный патент: Система для удаления кислых газов












