Выделенное антитело, способное взаимодействовать с tlr3
Номер патента: 22832
Опубликовано: 31.03.2016
Авторы: Фэн Ицин, Рутц Марк, Свит Рэймонд, Сариски Роберт Т., Каннингхэм Марк, Тепляков Алексей, Сан Матео Лани, Ло Цзиньцюань, Херинга Катарина, Тэн Фан, Раухенбергер Роберт, Ву Шэн-Дзюн
Формула / Реферат
Выделенное антитело или его фрагмент, способное взаимодействовать с TLR3, содержащее вариабельные участки тяжелой и легкой цепей, при этом антитело содержит:
a) вариабельный участок тяжелой цепи SEQ ID NO: 42; или
b) вариабельный участок легкой цепи SEQ ID NO: 41; или
c) вариабельный участок тяжелой цепи SEQ ID NO: 42 и вариабельный участок легкой цепи SEQ ID NO: 41; или
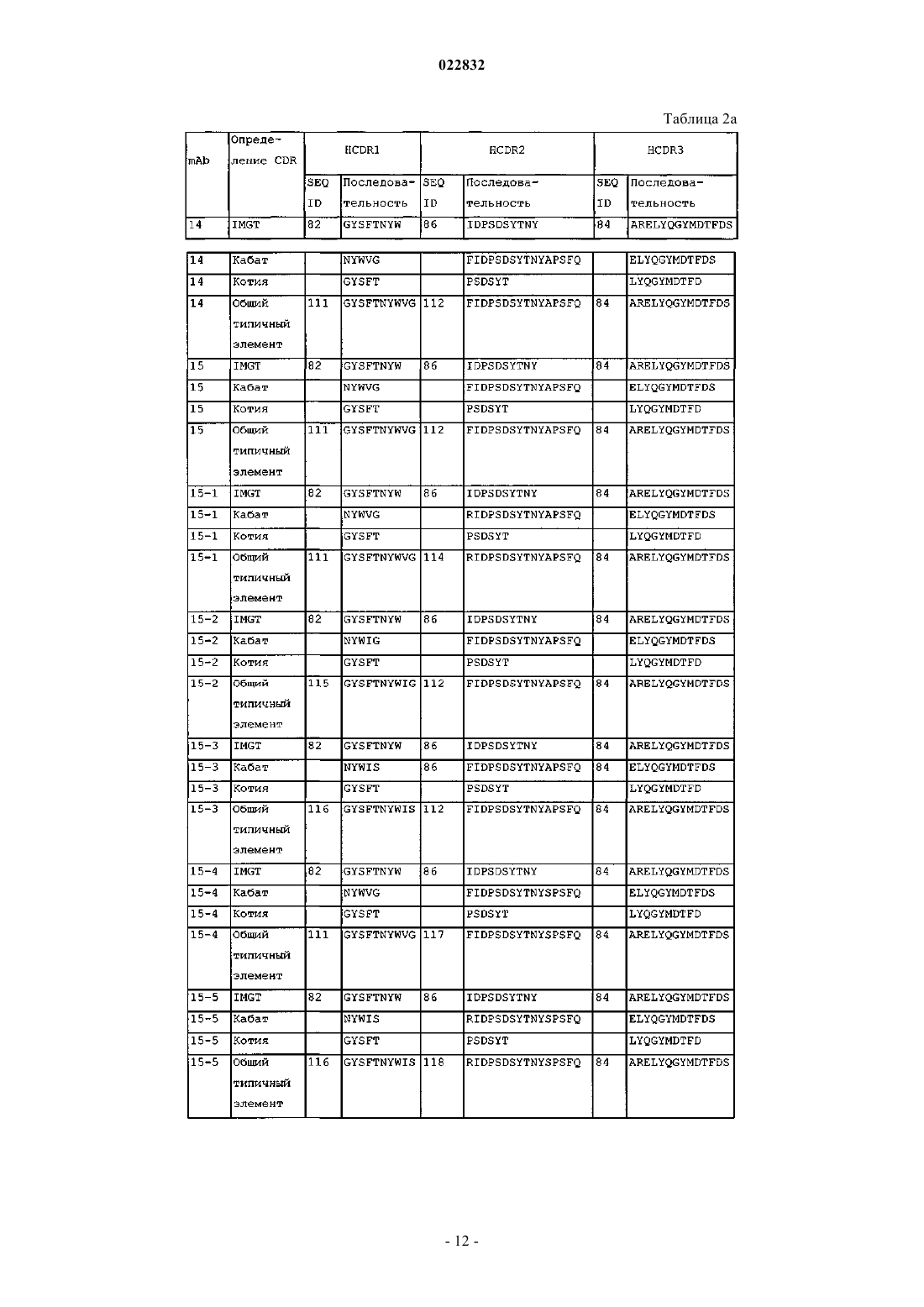
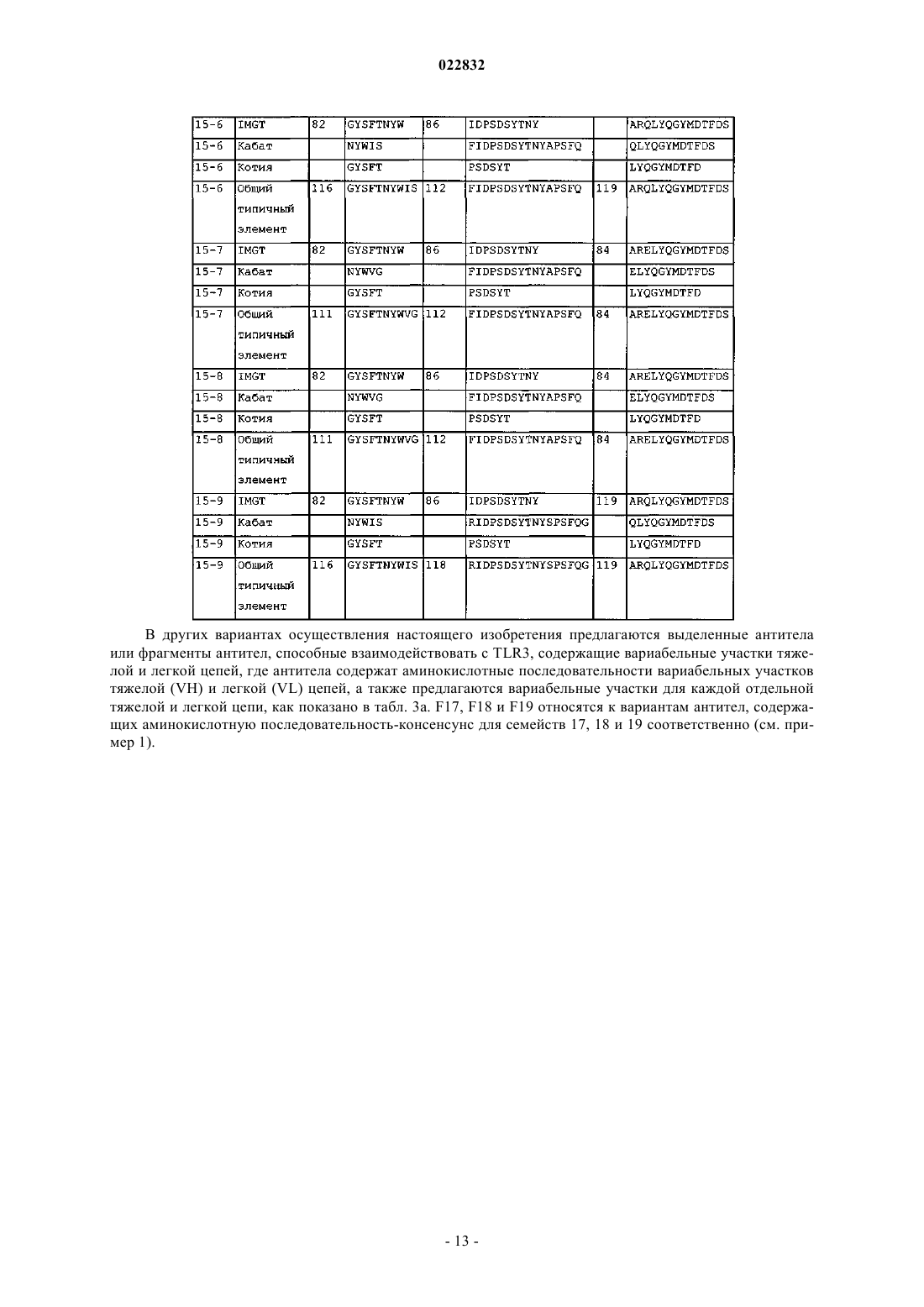
d) аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 82, 86 и 84; или
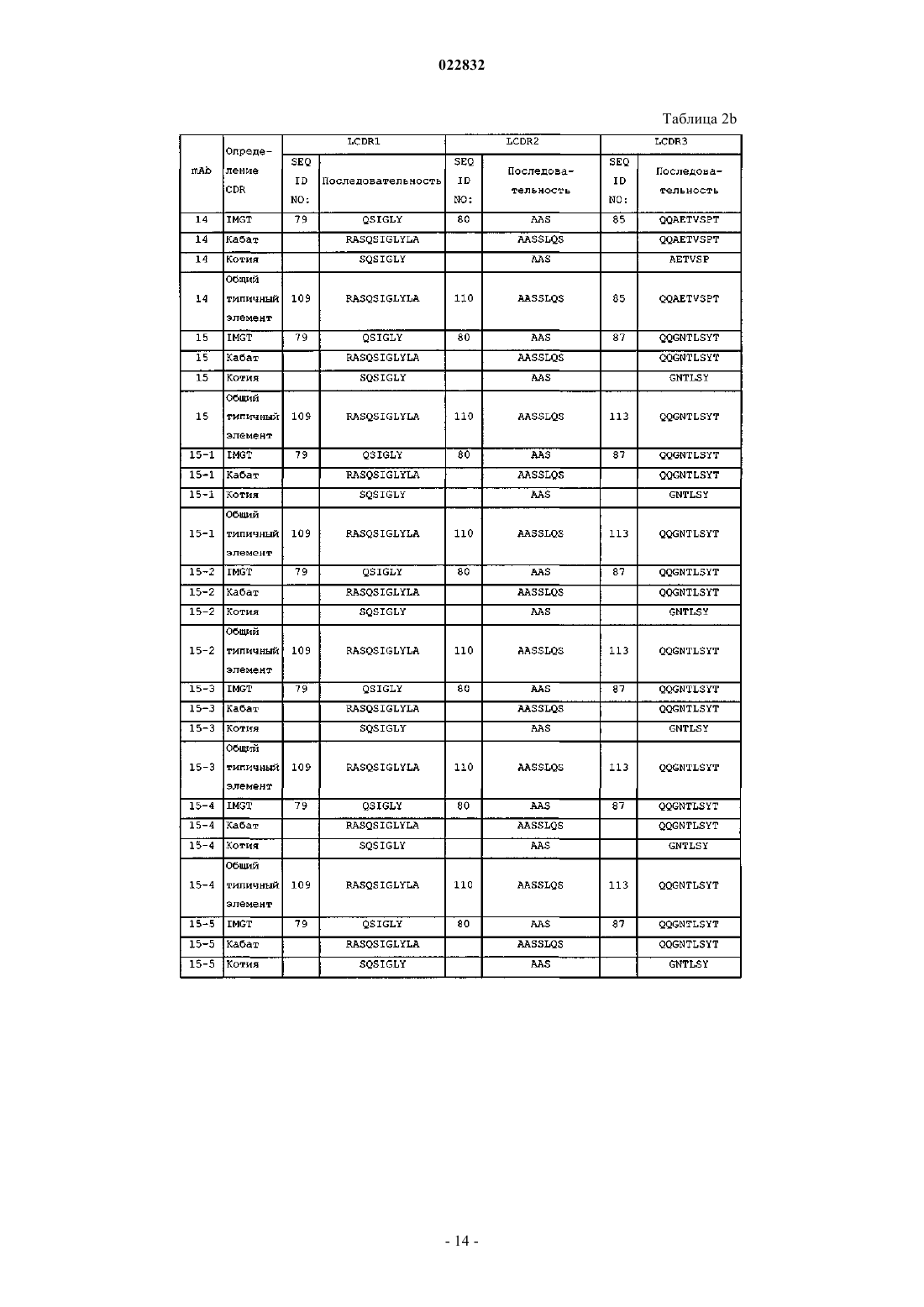
e) аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 79, 80 и 87; или
f) аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 82, 86 и 84 и аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 79, 80 и 87; или
g) вариабельный участок тяжелой цепи, который по меньшей мере на 95% идентичен вариабельному участку с аминокислотной последовательностью SEQ ID NO: 42; или
h) вариабельный участок легкой цепи, который по меньшей мере на 95% идентичен вариабельному участку с аминокислотной последовательностью SEQ ID NO: 41;
i) тяжелую цепь SEQ ID NO: 102; или
j) легкую цепь SEQ ID NO: 156; или
k) тяжелую цепь SEQ ID NO: 102 и легкую цепь SEQ ID NO: 156.
Текст
Описано выделенное антитело или его фрагмент, способное взаимодействовать с TLR3,содержащее вариабельные участки тяжелой и легкой цепи, при этом антитело содержит вариабельные участки тяжелой и легкой цепи с определенными последовательностями.(71)(73) Заявитель и патентовладелец: СЕНТОКОР ОРТО БАЙОТЕК ИНК. (US) 022832 Заявка на данный патент истребует приоритет заявок США сер.61/109974 от 31 октября 2008 г. и сер.61/161860 от 20 марта 2009 г., а также сер.61/165100 от 31 марта 2009 г. и сер.61/173686 от 29 апреля 2009 г., полное содержание которых включено в настоящее изобретение путем ссылки. Область применения изобретения Настоящее изобретение относится к антителам, являющимся антителами-антагонистами толлподобного рецептора 3 (TLR3), полинуклеотидам, кодирующим антитела-антагонисты TLR3 или их фрагменты, а также к способам получения и использования названных продуктов. Предпосылки создания изобретения Толл-подобный рецептор (TLR) регулирует активацию врожденного иммунного ответа, а также развитие адаптивного (специфического) иммунитета, активируя каскады внутриклеточной передачи сигнала в ответ на появление бактериальных, вирусных, паразитических, а в некоторых случаях и эндогенных лигандов (Lancaster et al., J. Physiol. 563:945-955, 2005). Расположенные на плазматической мембране TLR, TLR1, TLR2, TLR4 и LR6 распознают лиганды, включая белковые или липидные компоненты бактерий и грибков. Преимущественно внутриклеточные Толл-подобные рецепторы, TLR3, TLR7 иTLR9 активируются двухцепочечными РНК, одноцепочечными РНК и неметилированными CpG ДНК соответственно. Считается, что дисрегуляция сигнального пути TLR является причиной множества проблем, и терапевтические стратегии развиваются в этом направлении (Hoffman et al., Nat. Rev. DrugDiscov. 4:879-880, 2005; Rezaei, Int. Immunopharmacol. 6:863-869, 2006; Wickelgren, Science 312:184-187,2006). Например, антагонисты TLR4, а также TLR 7 и TLR 9 находятся на стадии клинических испытаний в лечении тяжелого сепсиса и системной красной волчанки соответственно (Kanzler et al., Nat. Med. 13:552-559, 2007). Сигнальный путь TLR3 активируется двухцепочечной РНК, матричной РНК или РНК, освобождаемой некротическими (погибшими) клетками в процессе воспаления или вирусной инфекции. АктивацияTLR3 индуцирует секрецию интерферонов и провоспалительных цитокинов, а также приводит к активации и увеличению числа иммунных клеток, защищая, таким образом, от некоторых микробных инфекций. Например, доминантно-негативный аллель TLR3 был ассоциирован с повышенной восприимчивостью к вирусу герпеса формы Herpes Simplex encephalitis после первичного инфицирования вирусомHSV-1 в детском возрасте (Zheng et al., Science 317:1522-1527, 2007). У мышей недостаток TLR3 связан с пониженной выживаемостью при проверочном заражении вирусом Коксаки (Richer et al., PLoS One 4:e4127, 2009). Было показано, тем не менее, что нарушенная регуляция сигнального пути TLR3 имеет отношение к заболеваемости и смертности при определенных вирусных инфекциях, включая вирус западнонильской лихорадки, флебовирус, вирус ваксиния и вирус гриппа типа A (Wang et al., Nat. Med. 10:1366-1373, 2004; Gowen et al., J. Immunol. 177:6301-6307, 2006; Hutchens et al., J. Immunol. 180:483-491,2008; Le Goffic et al., PloS Pathog. 2:E53, 2006). Также было продемонстрировано, что TLR3 определяет механизм патогенеза при целом ряде воспалительных, иммуноопосредованных и аутоиммунных заболеваний, включающих, например, септический шок (Cavassani et al., J. Exp. Med. 205:2609-2621, 2008), острое повреждение легких (Murray et al.,Am. J. Respir. Crit. Care Med. 178:1227-1237, 2008), ревматоидный артрит (Kim et al., Immunol. Lett. 124:917, 2009; Brentano et al., Arth. Rheum. 52:2656-2665, 2005), астму (Sugiura et al., Am. J. Resp. Cell Mol. Biol. 40:654-662, 2009; Morishima et al., Int. Arch. Allergy Immunol. 145:163-174, 2008; Stowell et al., Respir. Res. 10:43, 2009), воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит (Zhouet al., J. Immunol. 178:4548-4556, 2007; Zhou et al., Proc. Natl. Acad. Sci. (USA) 104:7512-7515, 2007), аутоиммунные заболевания печени (Lang et al., J. Clin. Invest. 116:2456-2463, 2006) и диабет 1 типа (Dogusanet al., Diabetes 57:1236-1245, 2008; Lien and Zipris, Curr. Мол. Med. 9:52-68, 2009). Более того, было показано, что орган-специфичное увеличение экспрессии TLR3 коррелирует со многими патологиями, которые возникают вследствие нарушения регуляции воспалительного ответа, такими как билиарный (холангиолитический) цирроз печени (Takii et al., Lab Invest. 85:908-920, 2005), ревматоидный артрит суставов(Ospelt et al., Arthritis Rheum. 58:3684-3692, 2008), и с состоянием слизистой оболочки носа у пациентов с аллергическим ринитом (Fransson et al., Respir. Res. 6:100, 2005). При некрозе освобождение клеточного содержания, включающего эндогенные матричные РНК, индуцирует секрецию цитокинов, хемокинов и других факторов, которые инициируют процесс местного воспаления, облегчают уничтожение клеточных остатков и восстановительный процесс. Некроз часто приводит к непрекращающемуся воспалительному процессу, увеличивая возможность развития хронического или острого воспаления (Bergsbaken et al., Nature Reviews 7:99-109, 2009). Активация TLR3 в месте некроза может способствовать развитию ненормального воспалительного процесса и привести к возникновению провоспалительной положительной замкнутой обратной связи за счет освобожденных лигандов TLR3. Таким образом, антагонизм к TLR3 может играть положительную роль во многих заболеваниях, сопровождающихся хроническим или острым воспалением и/или некрозом. Уменьшение активации TLR3 может рассматриваться как новая стратегия в лечении онкологических заболеваний, таких как почечно-клеточный рак и плоскоклеточный (эпидермальный) рак шеи(Morikawa et al., Clin. Cancer Res. 13:5703-5709, 2007; Pries et al., Int. J. Мол. Med. 21: 209-215, 2008). Кроме того, аллель TLR3L423F, приводящий к производству белка с уменьшенной активностью, был ассо-1 022832 циирован с защитной функцией в случае "сухой", вызываемой возрастными изменениями, макулярной дегенерацией (Yang et al., N. Engl. J. Med. 359:1456-1463, 2008), указывая на то, что антагонисты TLR3 могут играть положительную роль при этом заболевании. Заболевания, связанные с воспалением, также как и заболевания, вызываемые инфекциями, имеют значительное влияние на здоровье и, следовательно, большое экономическое значение. Тем не менее,несмотря на прогресс во многих областях медицины, существует относительно мало возможностей для лечения большинства названных заболеваний. Таким образом, существует необходимость в супрессии активности TLR3 для лечения связанных с функцией этого рецептора заболеваний. Краткое описание чертежей На фиг. 1 показан эффект моноклональных антител (mAb) к TLR3 человека (huTLR3) в эксперименте с использованием гена-репортера NF-kB. На фиг. 2 А и 2 В показан эффект (% ингибирования) или эффект mAb к huTLR3 в эксперименте с использованием гена BEAS-2 В. На фиг. 3 А и 3 В показан эффект mAb к huTLR3 в эксперименте с использованием гена NHBE. На фиг. 4 показан эффект mAb к huTLR3 в эксперименте с использованием гена РВМС. На фиг. 5 А и 5 В показан эффект mAb к huTLR3 в эксперименте с использованием гена HASM. На фиг. 6 А, 6 В и 6 С показано связывание mAb к huTLR3 с мутантами TLR3. На фиг. 7 А показаны эпитопы, распознаваемые mAb 15EVQ (черным цветом) и С 1068 (серым цветом) (верхняя часть рисунка), и эпитопы, распознаваемые mAb 12QVQ/QSV (черным цветом, нижняя часть рисунка), наложенные на изображение структуры TLR3 ECD человека. На фиг. 7 В показана пертурбационная карта избирательного замещения водорода дейтерием в случае, когда TLR3 ECD образует комплекс с mAb 15EVQ. На фиг. 8 А и 8 В показан эффект суррогатных крысиных/мышиных mAb (mAb к мышиному TLR3,mAb 5429) в экспериментах с использованием А) гена-репортера NF-kB и Б) гена-репортера ISRE. На фиг. 9 показан эффект суррогатных mAb (mAb 5429, mAb с 1811) в эксперименте с MEFCXCL10/IP-10. На фиг. 10 показана специфичность связывания суррогатных mAb с TLR3. Верхняя часть рисунка: изотипный контроль; нижняя часть рисунка: mAb c1811. На фиг. 11 показано влияние суррогатных mAb на уровень penH в модели AHR. На фиг. 12 показан эффект суррогатных mAb на общее число нейтрофилов в жидкости бронхоальвеолярного лаважа (BAL) при гиперчувствительности дыхательных путей (AHR). На фиг. 13 показан эффект влияния суррогатных mAb на уровень продукции CXCL10/IP-10 в жидкости BAL при AHR. На фиг. 14 показан эффект суррогатных mAb на гистопатологические показатели при использовании декстран сульфата натрия (DSS). На фиг. 15 показан эффект суррогатных mAb на А) гистопатологические показатели и Б) приток нейтрофилов при переносе Т-клеток. На фиг. 16 показан эффект суррогатных mAb на клинические показатели при коллагениндуцированном артрите (CIA). На фиг. 17 показан эффект суррогатных mAb на площадь под кривой, описывающей динамику клинических показателей, при CIA. На фиг. 18 показан эффект суррогатных mAb на выживаемость мышей C57BL/6 после интраназального введения вируса гриппа типа A/PR/8/34. На фиг. 19 показан эффект суррогатных mAb на клинические показатели после заражения вирусом гриппа типа A/PR/8/34. На фиг. 20 показан эффект суррогатных mAb на вес тела в течение 14 дней после заражения вирусом гриппа типа A/PR/8/34. На фиг. 21 показан эффект суррогатных mAb на уровень глюкозы в крови у животных (A) WT DIO и (В) TLR3KO DIO после пробного введения глюкозы. На фиг. 22 показан эффект суррогатных mAb на уровень инсулина у животных WT DIO. На фиг. 23 показан эффект mAb 15EVQ на (A) NTHi и (В) продукцию CXCL10/IP-10 и Краткое описание изобретения Настоящее изобретение относится к выделенному антителу или его фрагменту, способному взаимодействовать с TLR3, содержащим вариабельные участки тяжелой и легкой цепи, при этом антитело содержит:a) вариабельный участок тяжелой цепи SEQ ID NO: 42; илиb) вариабельный участок легкой цепи SEQ ID NO: 41; илиc) вариабельный участок тяжелой цепи SEQ ID NO: 42 и вариабельный участок легкой цепи SEQ IDg) вариабельный участок тяжелой цепи, который по меньшей мере на 95% идентичен вариабельному участку с аминокислотной последовательностью SEQ ID NO: 42; илиh) вариабельный участок легкой цепи, который по меньшей мере на 95% идентичен вариабельному участку с аминокислотной последовательностью SEQ ID NO: 41;k) тяжелую цепь SEQ ID NO: 102 и легкую цепь SEQ ID NO: 156. Подробное описание изобретения Все публикации, упоминаемые в данном описании, в том числе, помимо прочего, патенты и патентные заявки, включенные в настоящее описание путем ссылки, являются частью настоящего документа, как если бы они были изложены непосредственно в настоящем документе. Используемый в данном изобретении термин "антагонист" означает молекулу, которая любым способом, частично или полностью, ингибирует эффект другой молекулы, такой как рецептор или внутриклеточный медиатор. Используемый в данном изобретении термин "антитела-антагонисты TRL3" или антитела, "способные взаимодействовать с TLR3", относится к антителам, способным прямо или косвенно физически взаимодействовать, уменьшать или ингибировать биологическую активность TLR3 или активацию рецептора TLR3. Например, антитело, способное взаимодействовать с TLR3, может связываться непосредственно с TLR3 и нейтрализовывать активность TLR3, т.е. блокировать сигнальный путь TLR3, приводя к уменьшению продукции цитокинов и хемокинов либо к активации NF-kB. Используемый в данном изобретении термин "антитела" имеет широкое значение и относится к иммуноглобулинам или молекулам антител, включая поликлональные антитела, моноклональные антитела, включая мышиные/крысиные, человеческие, адаптированные к человеку, гуманизированные и химерные моноклональные антитела и фрагменты антител. В общем смысле антитела являются белками или пептидными цепочками, которые специфично связываются со специфическим антигеном. Интактные антитела являются гетеротетрамерными гликопротеинами, состоящими из двух одинаковых легких цепей и двух одинаковых тяжелых цепей. Обычно каждая легкая цепь связана с тяжелой цепью посредством одного ковалентного дисульфидного мостика,тогда как число дисульфидных связей между тяжелыми цепями различных иммуноглобулиновых изотипов может варьировать. Каждая тяжелая и каждая легкая цепь также обладает регулярно расположенными внутренними дисульфидными мостиками. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следуют несколько константных доменов. Каждая легкая цепь имеет на одном конце вариабельный домен (VL), а на другом конце константный домен. Константный домен легкой цепи находится напротив первого константного домена тяжелой цепи, а вариабельный домен легкой цепи находится напротив вариабельного домена тяжелой цепи. Исходя из аминокислотной последовательности константных доменов легкая цепь антитела любого вида позвоночных может быть отнесена к одному из двух четко различающихся типов, а именно каппаи лямбда . Иммуноглобулины могут быть разделены на пять больших классов, а именно IgA, IgD, IgE, IgG иIgM, в зависимости от аминокислотного состава константного домена тяжелой цепи. IgA и IgG в свою очередь подразделяются на изотипы IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Термин "фрагмент антитела" относится к части интактного антитела, обычно это антигенсвязывающий или вариабельный участок интактного антитела. Например, к фрагментам антитела относятся фрагменты Fab, Fab', F(ab')2 и Fv, диатела, одноцепочечные фрагменты антитела и мультиспецифичные антитела, сформированные из по меньшей мере двух интактных антител. Вариабельные участки легкой или тяжелой цепи состоят из "каркасного" участка, прерванного тремя "антигенсвязывающими участками". Антигенсвязывающие участки могут называться по-разному,например:(i) термин "определяющие комплементарность участки" (CDR) отражает вариабельность последовательности (Wu and Kabat, J. Exp. Med. 132:211-250, 1970). Как правило, антигенсвязывающий участок имеет шесть CDR; три из которых расположены на VH (HCDR1, HCDR2, HCDR3), а другие три - на VL(ii) согласно определению Котии и Леска, термин "гипервариабельный участок", "HVR", или "HV" относится к вариабельному домену антитела, который имеет гипервариабельную структуру (Chothia andLesk, Mol. Biol. 196:901-917, 1987). Как правило, антигенсвязывающий участок содержит шесть гипервариабельных участков, три из которых находятся в VH (H1, Н 2, Н 3) и три - в VL (L1, L2, L3). Котия и Леск называют структурно консервативные HV "каноническими структурами";(iii) согласно Лефранку (Lefranc et al., Dev. Comparat. Immunol. 27:55-77, 2003) термин "IMGT-CDR" основывается на сравнении пяти доменов иммуноглобулинов и рецепторов Т-клеток. В международной базе данных ImMunoGeneTics (IMGT; http://wwwimgtorg) приводится стандартизованное обозначение и определение этих участков. Соответствие между CDR, HV и IMGT подробно описано у Lefranc et al.,Dev. Comparat. Immunol. 27:55-77, 2003;(iv) согласно Альмагро, антигенсвязывающий участок также может быть определен на основании определяющей специфичность используемости групп (SDRU) (Almagro, Mol. Recognit. 17:132-143, 2004),этот автор использует термин "определяющие специфичность аминокислотные остатки" (SDR) для обозначения аминокислотных остатков иммуноглобулинов, непосредственно вовлеченных в контакт с антигеном. Согласно Альмагро, основываясь на анализе кристаллической структуры комплексов антигенантитело, SDRU являются точной мерой числа и распределения SDR, отвечающих за связывание с различными типами антигенов. Используемый в данном изобретении термин "композитные последовательности" означает антигенсвязывающий участок, включающий все аминокислотные остатки, индивидуально упомянутые у Кабата,Котии или в IMGT, или любые другие участки, определенные как антигенсвязывающие. Название "каркасный участок" или "каркасные последовательности" относится к последовательностям вариабельных участков, которые не были определены как антигенсвязывающие. Поскольку для определения антигенсвязывающего участка могут использоваться разные термины, как указано выше, определение точной последовательности аминокислот каркасного участка зависит от определения антигенсвязывающего участка. Используемый в данном изобретении термин "антиген" означает любую молекулу, которая прямо или косвенно может приводить к выработке антител. Понятие "антиген" также включает кодирующие белок нуклеиновые кислоты. Используемый в данном изобретении термин "по существу идентичный" означает, что аминокислотные последовательности двух антител или фрагментов антител при сравнении являются идентичными или имеют "незначительные отличия". Незначительными отличиями являются замещения 1, 2, 3, 4, 5 или 6 аминокислот в аминокислотной последовательности антитела или фрагмента антитела. Аминокислотные последовательности, по существу идентичные последовательностям, представленным в данном изобретении, также рассматриваются как часть данного изобретения. В некоторых случаях идентичность последовательностей может достигать 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более. Идентичность в процентном соотношении может быть вычислена, как это описано выше. Для сравнения пептидных цепочек наилучшим образом подходят вариабельные участки тяжелой или легкой цепи. Используемый в данном изобретении термин "эпитоп" означает часть антигена, с которой специфически связываются антитела. Эпитопы обычно состоят из химически активных (неполярных, полярных или гидрофобных), поверхностно расположенных функциональных групп, таких как боковые группы аминокислот или полисахаридов, и могут иметь специфическую трехмерную структуру, а также специфический заряд. Строение эпитопа может быть линейным или прерывистым, например, конформационный эпитоп, который формируется в результате пространственного взаимодействия аминокислот, не находящихся в непрерывной аминокислотной последовательности антигена, в отличие от взаимодействия линейно связанных аминокислот. Конформационный эпитоп включает эпитопы, возникающие в результате пространственного свертывания белков антигенов, при котором аминокислоты из различных участков линейной последовательности антигена оказываются в тесной близости в трехмерном пространстве. Используемый в данном изобретении термин "специфическое связывание" относится к антителам,проявляющим большую аффинность при связывании с определенными антигенами, по сравнению с другими антигенами или белками. Как правило, связывание антитела характеризуется константой диссоциации (KD) 10-7 М или менее. Связывание с предопределенным антигеном происходит при KD, в два раза меньшей, чем KD связывания с неспецифичным антигеном (например, BSA, казеин, или любой другой полипептид), отличным от предопределенного антигена. Фразы "антитело, распознающее антиген" и"антитело, специфичное к антигену" используются как взаимозаменяемые вместе с выражениями "антитело, которое специфически связывается с антигеном" или "специфичное к антигену антитело", например, антитело, специфичное к TLR3. Константа диссоциации может быть измерена с помощью стандартных способов, описанных далее. Используемые в данном изобретении термины "биологическая активность TLR3" и "активацияTLR3" относятся к любой активности, проявляющейся в результате связывания лиганда с TLR3. К лигандам TLR3 относятся двухцепочечные РНК, poly(I:С) и эндогенные матричные РНК, например эндо-4 022832 генные матричные РНК, высвобождаемые некротическими клетками. В отдельных случаях активацияTLR3 приводит к активации NF-kB в ответ на присутствие лигандов TLR3. Экспериментальная оценка активации NF-kB может быть осуществлена с использованием гена-репортера после индукции рецептора лигандом poly(I:С) (Alexopoulou et al., Nature 413:732-738, 2001; Hcker et al., EMBO J. 18:6973-6982,1999). В других случаях активация TLR3 приводит к активации факторов (IRF-3, IRF-7), участвующих в интерфероновом ответе, в ответ на присутствие лигандов TLR3. Экспериментальная оценка опосредованной рецептором TLR3 активации IRF может быть сделана с помощью гена-репортера, контролируемого интерферон-стимулированными элементами (ISRE). В отдельных случаях активация TLR3 приводит к секреции провоспалительных цитокинов и хемокинов, например ФНО-, IL-6, IL-8, IL-12,CXCL5/IP-10 и RANTES. Высвобождение цитокинов и хемокинов из клеток, тканей или в циркуляционных потоках может быть измерено с помощью хорошо известных экспериментальных тестовых систем,таких как ELISA. В данном изобретении использованы общепринятые одно- и трехбуквенные коды обозначения аминокислот. Композиции данного изобретения Настоящее изобретение относится к антителам-антагонистам, способным ингибировать биологическую активность TLR3, и к использованию этих антител. Антагонисты TLR3 могут связываться с TLR3 и ингибировать активацию TLR3. Указанные антитела могут ингибировать некоторые пути активацииTLR3, включая ингибирование in vitro, in vivo или in situ, путем связывания лигандов с TLR3, ингибирования димеризации рецептора, ингибирования TLR3 в эндосоме, ингибирования киназной активности дальнейшего сигнального пути или ингибирования транскрипции матричных РНК TLR3. Другие антитела-антагонисты, способные ингибировать активацию TLR3 за счет других механизмов, также являются частью настоящего изобретения. Данные антагонисты полезны в качестве исследовательских и диагностических реагентов, а также терапевтических агентов. Разнообразие антител достигается за счет использования многих генов клеток зародышевой линии,кодирующих вариабельные участки, и разнообразных соматических клеток. Соматические события, приводящие к образованию участка VH, включают рекомбинацию переменного (V) генного сегмента, сегмента разнообразия (D) и сегмента присоединения (J), а при образовании участка VL - рекомбинацию V и J. сегментов. Маловероятно, чтобы антитела и композиции, имеющие последовательности CDR, идентичные или сходные с предложенными в настоящем изобретении последовательностями, были созданы независимо. В результате сборки и соматических мутаций последовательность генов, кодирующих антитела, является очень вариабельной, согласно существующим оценкам, эти вариабельные гены кодируют-5 022832 1010 молекул различных антител (Immunoglobulin Genes, 2nd ed., eds. Jonio et al., Academic Press, SanDiego, Calif., 1995). В настоящем изобретении предлагаются антигенсвязывающие участки, полученные из генных библиотек гена иммуноглобулина человека. Структура, несущая антигенсвязывающий участок, обычно является тяжелой или легкой цепью антитела, или частью указанных структур, где антигенсвязывающий участок располагается на своем естественном месте, согласно приведенному выше описанию. В настоящем изобретении предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, в том числе антитела, содержащие аминокислотные последовательности 1, 2 и 3 (HCDR1, HCDR2 и HCDR3) определяющего комплементарность участка тяжелой цепи (CDR) и аминокислотные последовательности 1, 2 и 3(LCDR1, LCDR2 и LCDR3) определяющего комплементарность участка тяжелой цепи (CDR), показанные в табл. 1 а. Таблица 1 а В некоторых вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность HCDR2 SEQ ID где Хаа 6 может быть Arg или Lys; Хаа 7 может быть Tyr, His или Ser; Хаа 8 может быть Met, Arg или Tyr и Хаа 9 может быть Lys или Arg. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность HCDR2 SEQ ID NO: 194, где HCDR2 последовательности SEQ ID NO: 194 определен формулой (III)Xaa17 может быть Val или Leu. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность HCDR2 SEQ ID NO: 196, где HCDR2 последовательности SEQ ID NO: 196 определен формулой (V) где Хаа 24 может быть Phe или Arg и Хаа 25 может быть Ala или Ser. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность LCDR3 SEQ ID NO: 191, где LCDR3 последовательности SEQ ID NO: 191 определен формулой (II)Xaa5 может быть Phe, Ala или Leu. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность LCDR3 SEQ ID NO: 193, где LCDR3 последовательности SEQ ID NO: 193 определен формулой (IV)Xaa14 может быть Ser, Asn или Gln. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или их фрагменты, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, включая антитела, содержащие аминокислотную последовательность LCDR3 SEQ IDXaa21 может быть Val, Ile или Leu; Хаа 22 может быть Ser или Leu и Хаа 23 может быть Ile, Ser, Pro или Tyr. В настоящем изобретении также предлагаются выделенные антитела и их фрагменты, способные-7 022832 взаимодействовать с TLR3, содержащие аминокислотные последовательности 1, 2 и 3 (HCDR1, HCDR2 иHCDR3) определяющего комплементарность участка тяжелой цепи (CDR) и аминокислотные последовательности 1, 2 и 3 (LCDR1, LCDR2 и LCDR3) определяющего комплементарность участка легкой цепи(CDR), показанные в табл. 1 а. Антитела, чьи аминокислотные последовательности антигенсвязывающих участков не отличаются существенным образом от последовательностей, представленных в табл. 1a (SEQ ID NOs: 49-121 или 191-196), рассматриваются как часть настоящего изобретения. Как правило, это относится к аминокислотным замещениям с аминокислотами, имеющими сходный заряд, гидрофобные или стереохимические характеристики. Также могут быть сделаны дополнительные замещения в каркасных участках, в отличие от антигенсвязывающих участков, в случае, если они не изменяют свойств антитела. Могут быть осуществлены и замещения, улучшающие свойства антитела, такие, например, как стабильность или аффинность. Одно, два, три, четыре, пять или шесть замещений могут быть сделаны в антигенсвязывающем участке. Консервативные модификации приведут к созданию молекул, имеющих функциональные и химические характеристики, близкие к исходной молекуле. Существенные модификации функциональных и/или химических характеристик молекул могут быть достигнуты путем тех замещений в аминокислотной последовательности, которые приводят к изменениям (1) в структуре каркаса молекулы в районе замещения, например, к плоской или спиральной конформации, (2) в заряде или гидрофобности молекулы в районе замещения или (3) в размере молекулы. Например, "консервативные аминокислотные замещения" могут означать замещения природных аминокислотных остатков на неприродные, которые не сопровождаются изменением полярности или с незначительными изменениями полярности в районе замещения. Более того, любой природный аминокислотный остаток в полипептиде может быть замещен аланином, согласно способу, описанному как аланин-сканирующий мутагенез (MacLennan et al., ActaPhysiol. Scand. Suppl. 643:55-67, 1998; Sasaki et al., Adv. Biophys. 35:1-24, 1998). Любое желательное аминокислотное замещение (консервативное или нет) может быть запланировано специалистом в случае необходимости. Например, аминокислотное замещение может быть использовано для того, чтобы идентифицировать важные аминокислотные остатки в последовательности или с целью увеличения/уменьшения аффинности молекул, предложенных в настоящем изобретении. Некоторые аминокислотные замещения показаны в табл. 1b. Таблица 1b-8 022832 В некоторых вариантах осуществления консервативные аминокислотные замещения могут быть осуществлены путем введения в молекулу неприродных аминокислотных остатков, которое обычно происходит при химическом синтезе белков. Аминокислотные замещения могут быть осуществлены, например, с помощью ПЦР мутагенеза (патент США 4683195). Могут быть созданы библиотеки новых вариантов с помощью хорошо известных способов, например, применения случайных (NNK) или неслучайных кодонов, таких как кодоны DVK, кодирующие 11 аминокислот (ACDEGKNRSYW), а также поиска вариантов с необходимыми свойствами в уже существующих библиотеках, как показано в примере 1. В табл. 1b показаны замещения, сделанные с целью улучшения характеристик антител в трех родственных антителах-антагонистах TLR3 в пределах участков LCDR3 и HCDR2. В зависимости от определения антигенсвязывающих участков аминокислотные остатки антигенсвязывающих участков антител, предложенных в настоящем изобретении и, следовательно, аминокислотные остатки каркасных участков могут слегка отличаться для каждой тяжелой и легкой цепи. В табл. 2a и 2b показаны остатки антигенсвязывающих участков некоторых антител, предложенных в настоящем изобретении, согласно Кабату, Котии и IMGT, а также их композитные последовательности. Таблица 1 с общий типичный элемент на основе mAb 10, 11, 12. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или фрагменты антител, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, где антитела содержат аминокислотные последовательности вариабельных участков тяжелой (VH) и легкой (VL) цепей, а также предлагаются вариабельные участки для каждой отдельной тяжелой и легкой цепи, как показано в табл. 3 а. F17, F18 и F19 относятся к вариантам антител, содержащих аминокислотную последовательность-консенсунс для семейств 17, 18 и 19 соответственно (см. пример 1). Хотя варианты осуществления, проиллюстрированные в примерах, содержат вариабельные участки,один для тяжелой и один для легкой цепи, специалисты поймут, что альтернативные варианты осуществления могут содержать различные вариабельные участки тяжелой или легкой цепи. Определенный ва- 15022832 риабельный участок может использоваться для поиска доменов, формирующих двудоменный специфичный антигенсвязывающий фрагмент, способный, например, связываться с TLR3. Поиск может быть осуществлен путем комбинаторных фаговых способов поиска с помощью, например, иерархического двойного комбинаторного метода, предложенного в публикации РСТWO 92/01047. Согласно указанному методу индивидуальная колония, содержащая клон Н или L цепей, используется для инфицирования всей библиотеки клонов, кодирующих другую цепь (L или Н), а появляющийся в результате двухцепочечный специфический антигенсвязывающий домен селективно отбирается в соответствии с комбинаторными фаговыми способами. В других вариантах осуществления настоящего изобретения предлагаются выделенные антитела или фрагменты антител, способные взаимодействовать с TLR3, содержащие вариабельные участки тяжелой и легкой цепей, имеющие по меньшей мере 95%-ное сходство с аминокислотной последовательностью определенного вариабельного участка, как показано в табл. 3 а. Следующий аспект настоящего изобретения заключается в выделенных антителах, имеющих определенную аминокислотную последовательность тяжелой и легкой цепей, как показано в табл. 3b. Следующий аспект данного изобретения заключается в выделенных полинуклеотидах, кодирующих любое из антител, представленных в настоящем изобретении и его дополнениях. Некоторые полинуклеотиды описываются в настоящем изобретении, однако, другие полинуклеотиды, которые, принимая во внимание вырожденность генетического кода или предпочтительность использования кодонов в данной экспрессионной системе, кодируют предложенные в настоящем изобретении антитела-антагонисты, также рассматриваются как часть настоящего изобретения. Некоторыми антителами-антагонистами могут быть антитела изотипов IgG, IgD, IgG, IgA или IgM. Кроме того, эти антитела-антагонисты могут модифицироваться на постранскрипционном уровне за счет таких процессов, как гликозилирование, изомеризация, дегликозилирование или ненатуральная ковалентная модификация, такая как добавление активной группы полиэтиленгликоля (PEG) или липидизация. Такие модификации могут происходить in vivo или in vitro. Например, предлагаемые в настоящем изобретении антитела могут быть конъюгированы с полиэтиленгликолем с целью усовершенствования их фармакокинетических характеристик. Конъюгация может быть выполнена с помощью известных специалистам способов. Было показано, что конъюгация терапевтических антител с PEG усиливает их фармакодинамику и при этом не изменяет функцию. См. Deckert et al., Int. J. Cancer 87:382-390, 2000; Knight Фармакокинетические свойства антител, описанных в настоящем изобретении, также могут быть усилены за счет модификаций Fc с применением способов, хорошо известных специалистам. Например,тяжелая цепь иммуноглобулина изотипа IgG4 в шарнирном участке содержит мотив Cys-Pro-Ser-Cys(CPSC), способный формировать дисульфидные мостики между тяжелыми цепями или внутри тяжелой- 16022832 цепи, например, два Cys остатка в мотиве CPSC могут образовывать дисульфидный мостик с двумя другими остатками в другой тяжелой цепи (между), или два остатка Cys внутри данного CPSC мотива могут образовывать дисульфидный мостик друг с другом (внутри). Считается, что in vivo энзимы, осуществляющие изомеризацию, способны конвертировать дисульфидные мостики между тяжелыми цепями во внутрицепочечные мостики и vice versa (Aalberse and Schuurman, Immunology 105:9-19, 2002). Соответственно, поскольку пара тяжелая:легкая цепи (H:L) в молекулах иммуноглобулина IgG4 с внутрицепочечными мостиками в шарнирном участке тяжелой цепи не связаны друг с другом ковалентной связью, она может диссоциировать на H:L мономеры, а вслед за этим реассоциировать, формируя биспецифичную,гетеродимерную молекулу иммуноглобулина IgG4. В биспецифичных антителах IgG два участка Fabs молекулы антитела отличаются эпитопами, с которыми они связываются. Замещение аминокислотного остатка Ser в мотиве CPSC шарнирного участка IgG4 на остаток Pro приводит к "IgG1-подобному поведению", например, молекулы формируют стабильные дисульфидные мостики между тяжелыми цепями и, следовательно, не могут участвовать в обмене H:L с другой молекулой иммуноглобулина IgG4. В одном из вариантов осуществления описанные в данном изобретении антитела составляют Fc домен иммуноглобулина IgG4 с мутацией S в Р в мотиве CPSC. Мотив CPSC, как правило, расположен в позиции остатка 228 зрелой тяжелой цепи, но расположение этого мотива может изменяться в зависимости от длины CDR. Кроме того, в антителах, описанных в настоящем изобретении, участки, влияющие на связывание с рецепторами Fc, отличными от рецептора FcRn, могут быть удалены. Например, в антителах, описанных в настоящем изобретении, участки, связывающие рецептор Fc, вовлеченный в активность ADCC, могут быть удалены. Например, мутация Leu234/Leu235 в шарнирном участке IgG1 в L234A/L235A или мутация Phe235/Leu236 в шарнирном участке IgG4 в P235A/L236A минимизирует связывание FcR и уменьшает способность иммуноглобулина опосредовать комплементарно зависимую цитотоксичность иADCC. В одном варианте осуществления настоящего изобретения описанные антитела содержат Fc домен иммуноглобулина IgG4 с мутацией P235A/L236A. Расположение этих аминокислотных остатков в зрелых тяжелых цепях указано выше, но может изменяться в зависимости от длины CDR. Некоторые антитела с мутациями P235A/L236A являются антителами, чьи тяжелые цепи кодируются последовательностью SEQ ID NOs: 218, 219 или 220. Полностью человеческие, адаптированные к человеку, гуманизированные и аффинно-зрелые молекулы антител или фрагменты антител являются частью настоящего изобретения, также как гибридные и химерные белки. Аффинность антитела к антигену может быть улучшена с помощью продуманной конструкции или случайного созревания аффинности с использованием хорошо известных способов случайного или направленного мутагенеза или комбинаторных фаговых библиотек. Например, вариация расположенных в каркасном сегменте аминокислотных остатков зоны Верньера может быть использована для модулирования аффинности антитела согласно патенту США 6639055. Недавно Almagro et al. описали"определяющие аффинность аминокислотные остатки", ADR, которые расположены в CDR. Биоинженерное вмешательство в архитектуру этих участков может увеличить аффинность (Cobaugh et al., J. MolBiol. 378: 622-633, 2008). Частью настоящего изобретения являются полностью человеческие, адаптированные к человеку,гуманизированные, аффинно-зрелые молекулы антител или фрагментов антител, модифицированные с целью улучшения стабильности, селективности, перекрестной реактивности, аффинности, иммуногенности или достижения других желательных биологических характеристик. Стабильность антитела определяется целым рядом факторов, включая (1) свертывание индивидуальных доменов, влияющее на естественную стабильность, (2) поверхностное взаимодействие белков, определяющее спаривание НС и LC, (3) глубину расположения полярных и заряженных аминокислотных остатков, (4) сеть водородных мостиков между полярными и заряженными аминокислотными остатками; а также (5) поверхностный заряд и распределение полярных аминокислотных остатков наряду с другими внутри- и межмолекулярными взаимодействиями (Worn et al., J. Mol. Biol., 305:989-1010, 2001). Способные дестабилизировать структуру аминокислотные остатки могут быть идентифицированы на основании кристаллической структуры антитела или путем молекулярного моделирования, а эффект определенных аминокислотных оснований на стабильность антитела может быть проверен путем создания мутаций и оценки их влияния. Один из способов увеличить стабильность антитела заключается в том, чтобы увеличить срединную точку термоперехода (Tm), измеряемую путем дифференциальной сканирующей калориметрии (DSC). Как правило,Tm белка имеет положительную корреляцию с его стабильностью и отрицательную корреляцию с подверженностью нарушениям третичной структуры и денатурации в растворах, а также деградации, которая также зависит от склонности белка к нарушению третичной структуры (Remmele et al., Biopharm.,13:36-46, 2000). Многие исследования свидетельствуют о корреляции между степенью физической стабильности, измеренной как термостабильность путем DSC, и измерениями, проведенными с помощью других способов (Gupta et al., AAPS PharmSci. 5E8, 2003; Zhang et al., J. Pharm. Sci. 93:3076-3089, 2004;al., Pharm. Res., 15:200-208, 1997). Исследования различных формул лекарственных композиций позволяют предположить, что Tm фрагмента Fab имеет значение для долгосрочной физической стабильности- 17022832 соответствующих mAb. Различия в аминокислотной последовательности либо в каркасном сегменте,либо в пределах сегментов CDR могут оказывать значительное влияние на термостабильность доменаFab (Yasui, et al., FEBS Lett. 353:143-146, 1994). Предложенные в настоящем изобретении антитела-антагонисты могут связывать TLR3 с Kd, меньшей либо равной 10-7, 10-8, 10-9, 10-10, 10-11 или 10-12 М. Аффинность данной молекулы к TLR3, например,такой как антитело, может быть определена экспериментально с помощью любого подходящего способа. Такие способы могут включать использование аппаратуры Biacore или KinExA, набора реагентов ELISA или способов конкурентно-связывающего анализа, хорошо известных специалистам. Антитела-антагонисты, с необходимой аффинностью связывающиеся с данным гомологом TLR3,могут быть выбраны в библиотеках вариантов или фрагментов с помощью способов, основанных на созревании аффинности антитела. Антитела-антагонисты могут быть идентифицированы с помощью соответствующих способов на основе их способности ингибировать биологическую активность TLR3. Такие способы могут включать тестовую систему с геном-репортером или измерение с помощью уже известных способов производства цитокинов, как показано в приложении. Другой вариант осуществления настоящего изобретения заключается в векторе, содержащем по меньшей мере один предложенный в данном изобретении полинуклеотид. Такие векторы могут быт плазмидными, вирусными, бакуловирусными экспрессионными векторами, векторами на основе транспозонов или любыми другими векторами, пригодными для интродукции предложенных в настоящем изобретении полинуклеотидов в данный организм или в данное генетическое окружение. Другой вариант осуществления настоящего изобретения заключается в клетках-хозяевах, имеющих любой из предложенных в настоящем изобретении полинуклеотидов, кодирующих полипептид, содержащий вариабельный участок тяжелой цепи иммуноглобулина с аминокислотной последовательностьюSEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 124, 125, 126, 127, 128, 129,159, 198, 200, 202, 164, 212, 213, 214, 215 или 216 или вариабельный участок легкой цепи иммуноглобулина с аминокислотной последовательностью SEQ ID NO: 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31,33, 35, 37, 39, 41, 122, 123, 197, 199, 201, 163, 209 или 210. Другой вариант осуществления настоящего изобретения заключается в клетках-хозяевах, имеющих любой из предложенных в настоящем изобретении полинуклеотидов, кодирующих полипептид, содержащий тяжелую цепь иммуноглобулина с аминокислотной последовательностью, представленной в SEQID NO: 102, 130, 131, 132, 133, 134, 135, 160, 204, 206, 208, 220, 166 или 168, или легкую цепь иммуноглобулина с аминокислотной последовательностью, представленной в SEQ ID NO: 155, 156, 157, 158, 203,205, 207, 165 или 167. Такими клетками-хозяевами могут быть эукариотические, бактериальные, растительные клетки или клетки архей. Как правило, используются эукариотические клетки млекопитающих,насекомых, птиц или другие клетки животного происхождения. Эукариотические клетки млекопитающих включают бессмертные клеточные линии, такие как гибридомы или клеточные линии миеломы, например, SP2/0 (Американская коллекция типовых культур (АТСС), Манассас, VA, CRL-1581), NS0 (Европейская коллекция клеточных культур (ЕСАСС), Солсбери, Уилтшир, Великобритания, ЕСАСС 85110503), FO (АТСС CRL-1646) и Ag653 (АТСС CRL-1580) мышиные клеточные линии. Обычно используется линия клеток миеломы человека U266 (АТТС CRL-TIB-196). Другие полезные клеточные линии включают линии, полученные из яичников китайского хомячка (СНО), например, линии CHOK1SV (Lonza Biologies, Walkersville, MD), CHO-K1 (ATCC CRL-61) или DG44. Другой вариант осуществления настоящего изобретения заключается в способе получения антител,способных взаимодействовать с TLR3, включающем культивирование предложенных в настоящем изобретении клеток-хозяев, и отборе антител, производимых клетками-хозяевами. Способы создания и очистки антител хорошо известны специалистам в данной области. Другой вариант осуществления настоящего изобретения заключается в клеточной линии гибридомы, производящей предложенные в настоящем изобретении антитела. Другой вариант осуществления настоящего изобретения заключается в выделенных антителах или их фрагментах, способных взаимодействовать с TLR3, причем данные антитела связываются по меньшей мере с одним принадлежащим TLR3 аминокислотным остатком из группы (а) аминокислотные остатки(d) аминокислотные остатки K467 в R489 из последовательности SEQ ID NO: 2; (е) аминокислотные остатки K467, R488 и R489 в SEQ ID NO: 2. Выделенные антитела могут связываться с по меньшей мере одним аминокислотным остатком TLR3, выбранным из аминокислотных остатков Y465, Y468, N517,D536, Q538, Н 539, N541, Е 570 или K619 в SEQ ID NO:2. Другой вариант осуществления настоящего изобретения заключается в описании выделенных антител или их фрагментов, причем антитела связывают по меньшей мере один аминокислотный остаток рецептора TLR3, выбранный из группы остатков D116 или K145 в SEQ ID NO: 2. Несколько хорошо известных способов могут быть использованы для определения эпитопа антител,предложенных в настоящем изобретении. Например, в случае, когда известна структура каждого из компонентов, может быть использован анализ in silico прикрепления одного белка к другому с целью иден- 18022832 тификации способных к взаимодействию участков. Может быть проведено избирательное замещение водорода дейтерием в антигене и антителе с целью определения участков антигена, способных связываться с антителом. Сегментный и точечный мутагенез, модифицирующие антиген, могут быть использованы для локализации необходимых для связывания антитела аминокислот. Для таких больших белков, как TLR3, картирование путем точечного мутагенеза может быть облегчено предварительным определением участка связывания с помощью компьютерного анализа соединения белков, сегментного мутагенеза или избирательного замещения водорода дейтерием. Другой аспект настоящего изобретения относится к выделенным антителам или их фрагментам,способным взаимодействовать с TLR3, которые конкурируют за связывание с TLR3 с моноклональными антителами, причем эти моноклональные антитела состоят из аминокислотных последовательностей участков 1, 2 и 3, определяющих комплементарность (CDR) определенных тяжелых цепей, аминокислотных последовательностей CDR 1, 2 и 3 определенных легких цепей, а также из аминокислотных последовательностей вариабельных участков определенных тяжелых цепей (VH) или аминокислотных последовательностей вариабельных участков определенных легких цепей (VL) Как правило, моноклональные антитела, представленные в настоящем изобретении, являются выделенными антителами, содержащими вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 216, и аминокислотную последовательность вариабельного участка легкой цепи SEQ ID NO: 41, а также антитела, содержащие аминокислотную последовательность вариабельного участка тяжелой цепи SEQ IDNO: 214 и аминокислотную последовательность вариабельного участка легкой цепи SEQ ID NO: 211. Анализ конкуренции за связывание с TLR3 может быть проведен in vitro с помощью уже известных способов. Например, оценка связывания MSD Sulfo-Tag NHS-эфир-меченого антитела с TLR3 в присутствии немеченого антитела может быть проведена с помощью ELISA. Как правило, в настоящем изобретении используются антитела mAb 12, mAb 15 и mAb c1811 (см. табл. 3 а). Ранее известные антитела с 1068 против TLR3 и их производные (см. описание в публ. РСТWO 06/060513A2), TLR3.7 (eBiosciences, cat no 14-9039) и Imgenex IMG-315A (Imgenex IMG-315A; созданный против аминокислот аминокислотной последовательности 55-70, VLNLTHNQLRRLPAAN, TLR3 человека) не конкурируют за связывание с TLR3 с mAb 12, 15 или с mAb c1811, как показано в примере 5. Следующий аспект настоящего изобретения заключается в выделенных антителах, способных взаимодействовать с TLR3, причем антитела имеют по меньшей мере одно из следующих свойств:a) уменьшают биологическую активность TLR3 при анализе in vitro с использованием генарепортера poly(I:С) NF-kB 50% при концентрации 1 мкг/мл;f) ингибируют 20% poly(I:С)-индуцированную продукцию IFN-, IL-6 или IL-12 в клетках РВМС при 1 мкг/мл.g) ингибируют биологическую активность TLR3 яванского макака в тестовой системе in vitro, с использованием гена-репортера при IC50 10 мкг/мл; илиh) ингибируют биологическую активность TLR3 яванского макака в тестовой системе in vitro, с использованием гена-репортера ISRE при IC50 5 мкг/мл. Способы лечения. Предложенные в настоящем изобретении антагонисты TLR3, например антитела-антагонистыTLR3, могут использоваться для воздействия на иммунную систему. Опуская теоретическое обоснование, авторы утверждают, что предложенные в настоящем изобретении антагонисты могут модулировать иммунную систему, предотвращая или уменьшая связывание лиганда с TLR3, димеризацию TLR3, интернационализацию TLR3 или перенос TLR3. Предложенные в настоящем изобретении способы могут быть использованы для лечения любого животного. Например, это могут быть млекопитающие, в том числе человек, грызуны, собаки, кошки и сельскохозяйственные животные. Например, представленные в настоящем изобретении антитела могут быть полезны в качестве антагонистов активности TLR3 при лечении воспаления, воспалительных заболеваний и метаболических расстройств, а также в изготовлении медикаментозных препаратов для лечения указанных заболеваний, причем настоящее изобретение также предлагает предназначенную для введения дозу. В целом воспалительные, инфекционные или иммуноопосредованные воспалительные заболевания,которые могут быть предотвращены или вылечены введением предложенных в настоящем изобретении антител-антагонистов TLR3, включают заболевания, опосредованные действием цитокинов или хемокинов, а также заболевания, которые целиком или частично возникают в результате активации TLR3 или- 19022832 сигнального пути TLR3. Примерами таких воспалительных заболеваний являются связанные с сепсисом заболевания, воспалительные заболевания пищеварительного тракта, аутоиммунные, воспалительные и инфекционные заболевания. Также считается, что рак, сердечно-сосудистые заболевания, нарушения метаболизма, невралгические и фиброзные заболевания могут быть предотвращены или вылечены введением предложенных в настоящем изобретении антител-антагонистов TLR3. Воспаление может затрагивать одну ткань или быть системным. Как правило, поражаются ткани дыхательных путей, легкие, желудочно-кишечный тракт, тонкий и толстый кишечник, толстая кишка, прямая кишка, сердечнососудистая система, ткань сердца, кровеносные сосуды, суставы, мозг, синовиальные ткани, хрящевая ткань, эпителий, эндотелий, печень и жировая ткань. Типичными системными воспалительными заболеваниями являются цитокиновый шторм или гиперцитокинемия, синдром системного воспалительного ответа (SIRS), реакция "трансплантат против хозяина" (GVHD), синдром острой дыхательной недостаточности (ARDS), синдром острой тяжелой дыхательной недостаточности (SARS), катастрофический антифосфолипидный синдром, тяжелые вирусные инфекции, грипп, пневмония, шок или сепсис. Воспаление является защитной реакцией организма на атаку проникающего агента. Воспаление состоит из последовательности событий, в которой участвуют многие клеточные или гуморальные медиаторы. С другой стороны, супрессия воспалительного ответа может приводить к ослаблению иммунитета; тем не менее, при отсутствии контроля, воспаление может приводить к серьезным осложнениям, таким,как хронические воспалительные заболевания, (например, астма, псориаз, артрит, ревматоидный артрит,рассеянный склероз, воспалительное заболевание пищеварительного тракта и тому подобные), септическому шоку и полиорганной недостаточности. Важно, что все эти заболевания имеют общие воспалительные медиаторы, такие, как цитокины, хемокины, воспалительные клетки и другие медиаторы, секретируемые этими клетками. Активация TLR3 лигандами poly(I:С), двухцепочечной РНК или эндогенными матричными РНК ведет к активации сигнального пути, приводящего к синтезу и секреции провоспалительных цитокинов,активации и рекрутингу участвующих в воспалительной реакции клеток, таких как макрофаги, гранулоциты, нейтрофилы и эозинофилы, а также к клеточной смерти и разрушению ткани. TLR3 индуцирует секрецию IL-6, IL-8, IL-12, ФНО-, MIP-1, CXCL5/IP-10 и RANTES, a также провоспалительных цитокинов и хемокинов, участвующих в рекрутинге и активации иммунокомпетентных клеток, приводя к разрушению ткани в случае аутоиммунных и других воспалительных заболеваний. Эндогенные матричные РНК, являющиеся лигандами TLR3, освобождаются из некротических клеток в процессе воспаления,и могут приводить к возникновению замкнутой положительной обратной связи, которая активируетTLR3, приводя к продолжению воспалительного процесса и дальнейшему разрушению ткани. Антагонисты TLR3, такие как антитела-антагонисты TLR3, могут участвовать в нормализации секреции цитокинов, уменьшать рекрутинг участвующих в воспалительном процессе клеток, а также уменьшать повреждение ткани и клеточную смерть. Следовательно, антагонисты TLR3 имеют терапевтический потенциал в лечении воспаления и целого спектра воспалительных заболеваний. Примером воспалительных заболеваний являются связанные с сепсисом заболевания, к которым относится синдром системного воспалительного ответа (SIRS), септический шок или синдром полиорганной недостаточности (MODS). Двухцепочечные РНК, освобождаемые при вирусных, бактериальных,грибковых или паразитарных инфекциях, а также некротическими клетками, могут способствовать возникновению сепсиса. Опуская теоретическое обоснование, утверждается, что лечение антагонистамиTLR3 может дать положительный терапевтический эффект, увеличивая время жизни пациентов, страдающих от связанных с сепсисом воспалительных заболеваний, или предотвратит распространение местного воспалительного процесса (например, в легких) и превращения воспаления в системное заболевание за счет естественной антимикробной активности, а также за счет взаимодействия с антимикробными агентами, минимизируя локальное воспаление, участвующее в развитии патологии, или за счет любой комбинации указанных эффектов. Такое вмешательство может быть достаточным для возможности проведения необходимого для выживания пациента дополнительного лечения (например, лечения основной инфекции или уменьшения уровня цитокинов). Сепсис может исследоваться на животных моделях, например, у мышей, введением D-галактозамина и poly(I:C). В данных моделях D-галактозамин является гепатотоксином, который функционирует как агент, увеличивающий вероятность возникновения сепсиса, тогда как poly(I:С) является индуцирующим сепсис соединением, которое имитирует двухцепочечную РНК, и активирует TLR3. Лечение антагонистами TLR3 может увеличить показатели выживаемости при сепсисе у мышей, и, следовательно, антагонисты TLR3 могут быть полезны в лечении сепсиса. Воспаление желудочно-кишечного тракта является воспалением слизистой оболочки и включает острое и хроническое состояние. Острое воспаление обычно характеризуется коротким начальным периодом и инфильтрацией или притоком нейтрофилов. Хроническое воспаление обычно характеризуется относительно более длинным начальным периодом и инфильтрацией или притоком мононуклеарных клеток. Слизистая оболочка может быть слизистой оболочкой пищеварительного тракта (включая тонкий и толстый кишечник), прямой кишки, выстилающего слоя желудка или ротовой полости. Типично к хроническим желудочно-кишечным воспалительным заболеваниям относятся воспалительное заболевание пищеварительного тракта (IBD), индуцированные внешними воздействиями колиты (например, желу- 20022832 дочно-кишечное воспаление (например, колиты), вызванное или сопутствующее (например, в качестве побочного эффекта) терапевтическим режимам, таким как химиотерапия, радиотерапия и т.п.), инфекционный колит, ишемический, коллагеновый или лимфоцитный колит, некротический энтероколит, колиты, вызванные другими заболеваниями, такими как хроническая грануломатозная болезнь или целиакия,пищевые аллергии, гастриты, инфекционные гастриты или энтероколиты (например, хронический гастрит, вызванный инфекцией Helicobacter pylori), а также другие формы желудочно-кишечного воспаления,вызванные инфекционным агентом. Воспалительные заболевания пищеварительного тракта (IBD) включают группу хронических воспалительных заболеваний обычно неизвестной этиологии, например язвенный колит (UC) и болезнь Крона (CD). Клинические и экспериментальные наблюдения позволяют предположить, что патогенезIBD основан на многих факторах, включающих генетическую предрасположенность и влияние окружающей среды. При воспалении пищеварительного тракта повреждение ткани является результатом неправильного или чрезмерного иммунного ответа на антиген или микрофлору кишечника. Существует несколько животных моделей воспалительных заболеваний пищеварительного тракта. Наиболее широко используемыми являются модель колита, индуцированного введением 2,4,6-тринитробензолсульфоновой кислоты/этанола (TNBS), и модель с использованием оксазалона, который индуцирует хроническое воспаление и изъязвление прямой кишки (Neurath et al., Intern. Rev. Immunol 19:51-62, 2000). Другая модель использует декстран сульфата натрия (DSS), который индуцирует острый колит, сопровождающийся такими симптомами, как кровавая диарея, потеря веса, сокращение прямой кишки и вызываемое инфильтрацией нейтрофилов изъязвление слизистой оболочки. DSS-индуцированные колиты гистологически характеризуются инфильтрацией участвующих в воспалении клеток в собственную пластинку слизистой оболочки, лимфоидной гиперплазией, поражением центральной крипты и изъязвлением эпителия(Hendrickson et al., Clinical Microbiology Reviews 15:79-94, 2002). Другая модель основана на адоптивном переносе наивных CD45RBhigh CD4 Т-клеток мышам линий RAG или SCID. В данной модели наивные Тклетки донора атакуют кишечник реципиента, вызывая хроническое воспаление пищеварительного тракта и симптомы, сходные с воспалительным заболеванием пищеварительного тракта человека (Read andPowrie, Curr. Protoc. Immunol. Chapter 15 unit 15.13, 2001). Введение предложенных в настоящем изобретении антагонистов в любую из названных моделей может быть использовано для оценки потенциальной эффективности указанных антагонистов в облегчении симптомов и изменении течения болезней, связанных с воспалительным процессом в пищеварительном тракте, например, воспалительного заболевания пищеварительного тракта. Существуют несколько возможностей лечения IBD, например, лечение антителами против ФНО- уже в течение десятилетия используется для лечения болезни Крона (Van Asscheet al., Eur. J. Pharmacol. Epub Oct 2009). Тем не менее, значительная часть пациентов невосприимчива к используемым в настоящее время способам лечения (Hanauer et al., Lancet 359:1541-1549, 2002; Hanaueret al., Gastroenterology 130:323-333, 2006) и, следовательно, необходима выработка новых подходов для лечения указанных пациентов. Другим примером воспалительного заболевания является воспаление легких. Типично, воспаление легких включает вызванные инфекцией заболевания легких, в том числе связанные с вирусными, бактериальными, грибковыми, паразитарными и прионовыми инфекциями; индуцированные аллергеном заболевания легких; индуцированные загрязнением окружающей среды заболевания легких, такие как асбестоз, силикоз и бериллиоз; вызванные аспирацией желудочного содержимого, а также вызванные иммунной дисрегуляцией заболевания, воспалительные заболевания, зависящие от генетической предрасположенности, такие как кистозный фиброз, заболевания, индуцированные физической травмой легких,например, нарушение легочной вентиляции. Указанные воспалительные заболевания также включают астму, эмфизему, бронхиты, хронические обструктивные заболевания легких (COPD), саркоидозы, гистиоцистозы, лимфоангиоматозы, острое повреждение легких, синдром острого нарушения дыхания, хроническое заболевание легких, бронхопульмональная дисплазия, внебольничная пневмония, госпитальная пневмония, вызванная искусственной вентиляцией легких пневмония, сепсис, вирусная пневмония, инфекции гриппа, парагриппозные инфекции, инфекции ротавируса, инфекции человеческого метапневмовируса, респираторно-синциальные инфекции, легочный аспергиллез и другие грибковые инфекции. Как правило, связанные с инфекцией воспалительные заболевания могут включать вирусную или бактериальную пневмонию, в том числе тяжелую пневмонию, кистозный фиброз, бронхит, обострения заболеваний дыхательных путей и синдром острого нарушения дыхания (ARDS). Такие связанные с инфекцией заболевания могут вовлекать множественные инфекции, такие как первичную вирусную и вторичную бактериальную инфекции. Астма является воспалительным заболеванием легких, которое характеризуется гиперчувствительностью дыхательных путей (AHR), бронхостенозом, хрипами в легких, эозинофильным или нейтрофильным воспалением, гиперсекрецией слизи, субэпителиальным фиброзом и увеличением уровня иммуноглобулина IgE. Больные астмой пациенты испытывают "приступы", ухудшение симптомов, чаще всего вследствие инфекций респираторного тракта (например, риновирус, грипп, гемофильная палочка Haemophilus influenza, и пр.). Астматические атаки могут провоцироваться факторами окружающей среды (например, аскариды, насекомые, животные (например, кошки, собаки, кролики, мыши, крысы, хомячки,- 21022832 морские свинки и птицы), грибки, загрязнение воздуха (например, табачный дым), раздражающие газы,запахи, испарения, аэрозоли, химикаты, пыльца, физические упражнения или холодный воздух). Кроме астмы, некоторые хронические, поражающие легкие воспалительные заболевания характеризуются нейтрофильной инфильтрацией дыхательных путей, например хроническое обструктивное заболевание легких (COPD), бактериальная пневмония и кистозный фиброз (Linden et al., Eur. Respir. J. 15:973-977, 2000;Rahman et al., Clin. Immunol. 115:268-276, 2005), а такие заболевания, как COPD, аллергические риниты и кистозный фиброз характеризуются гиперчувствительностью дыхательных путей (Fahy and О'Byrne, Am.J. Respir. Crit. Care Med. 163:822-823, 2001). В качестве животных моделей для изучения астмы и воспаления дыхательных путей обычно используют модель провокационного введения овальбумина, а также модели, в которых сенсибилизация животного достигается введением метахолина (Hessel et al., Eur. J.Pharmacol. 293:401-412, 1995). Ингибирование продукции цитокинов и хемокинов в культурах эпителиальных бронхиальных клеток человека, бронхиальных фибробластов или клеток гладкой мускулатуры дыхательных путей может быть использовано в качестве экспериментальных моделей in vitro. Введение предложенных в настоящем изобретении антагонистов в любую из указанных моделей может быть использовано для оценки эффективности данных антагонистов в облегчении симптомов и изменении течения астмы, воспалений дыхательных путей, COPD и других подобных заболеваний. Другие воспалительные заболевания и нейропатии, которые могут быть предупреждены или вылечены представленными в настоящем изобретении способами, являются болезнями, вызванными аутоиммунными заболеваниями. Эти заболевания и нейропатии включают рассеянный склероз, системную красную волчанку и нейродегенеративные заболевания и расстройства центральной нервной системы(CNS), например болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, биполярное аффективное расстройство и амиотрофический боковой склероз (ALS), болезни печени, например первичный билиарный цирроз, первичный склерозирующий холангит, неалкогольная жировая инфильтрация (жировой метаморфоз) печени/стеатогепатит, фиброз, гепатит С (HCV) и гепатит В (HBV), диабет и резистентность к инсулину, сердечно-сосудистые расстройства, например, атеросклероз, церебральные кровотечения, инсульт и инфаркт миокарда, артрит, ревматоидный артрит, псориатический артрит и ювенильный ревматоидный артрит (JRA), остеопороз, остеоартрит, панкреатит, фиброз, энцефалит, псориаз, гигантоклеточный артериит, анкилозный спондилит, аутоиммунный гепатит, вирус иммунодефицита человека(HIV), воспалительные заболевания кожи, трансплантаты, рак, аллергии, эндокринные заболевания, заживление ран, другие аутоиммунные заболевания, гиперчувствительность дыхательных путей, а также клеточные, вирусные или опосредованные прионами инфекции и заболевания. Артрит, включая остеоартрит, ревматоидный артрит, возникший в результате повреждения артрит суставов, и другие подобные заболевания, являются обычными воспалительными заболеваниями, лечение которых может быть улучшено за счет терапевтического использования противовоспалительных белков, таких, как представленные в настоящем изобретении антагонисты. Например, ревматоидный артрит (RA) является системным заболеванием, поражающим все тело, и одной из самых часто встречаемых форм артрита. Поскольку ревматоидный артрит приводит к поражению тканей, лиганды TLR3,скорее всего, присутствуют в том месте, где происходит воспаление. Активация сигнального пути TLR3 может приводить к непрекращающемуся воспалению и повреждению других тканей в воспаленном суставе. Существуют животные модели для изучения ревматоидного артрита. Например, при моделировании коллагениндуцированного артрита (CIA) у мыши развивается хронический воспалительный артрит,который сильно напоминает человеческий ревматоидный артрит. Введение представленных в настоящем изобретении антагонистов TLR3 модельной мыши CIA может быть использовано для оценки применения указанных антагонистов для облегчения симптомов и изменения течения болезни. Сахарный диабет (лат. Diabetes mellitus) является многофакторным заболеванием и характеризуется гипергликемией (LeRoith et al., (eds.), Diabetes Mellitus, Lippincott-Raven Publishers, Philadelphia, Pa.U.S.A. 1996, а также все упомянутые в работе ссылки). Неконтролируемая гипергликемия может приводить к увеличению преждевременной смертности вследствие увеличения риска микро- и макроангиопатий, включая нефропатии, нейропатии, ретинопатии, гипертензии, цереброваскулярные заболевания и ишемическую болезнь сердца. Следовательно, контроль гомеостаза глюкозы является критически важным в лечении диабета. Диабеты могут быть разделены на две большие группы, основываясь на вызывающих заболевание дефектах: диабет типа 1 (инсулинозависимый сахарный диабет, IDDM), возникающий при отсутствии в поджелудочной железе пациента производящих инсулин бета-клеток, и диабет типа 2 (инсулиннезависимый сахарный диабет, NIDDM), возникающий у пациентов с нарушением секреции инсулина бетаклетками и/или резистентностью к действию инсулина. Диабет типа 2 характеризуется устойчивостью к инсулину, сопровождаемой относительной, но не абсолютной, инсулиновой недостаточностью. У инсулинрезистентных индивидуумов секретируется аномально высокое количество инсулина, что имеет компенсаторный эффект. При наличии неадекватного количества инсулина для компенсации резистентности к инсулину и контроля уровня глюкозы развивается состояние нарушения толерантности к глюкозе. У значительного числа индивидуумов во время- 22022832 болезни секреция инсулина уменьшается, и уровень глюкозы в плазме возрастает, приводя к клиническому диабету. Связанные с жировой тканью воспаления в значительной степени связаны с развитием резистентности к инсулину, диабетом типа 2, дислипидемией и сердечно-сосудистыми заболеваниями. У страдающих ожирением пациентов макрофаги перемещаются в жировую ткань и накапливаются там,приводя к выработке провоспалительных цитокинов, таких как ФНО- и IL-6, свободных жирных кислот и адипокинов, способных оказывать влияние на инсулиновый сигнальный путь и индуцировать развитие резистентности к инсулину. Активация рецепторов TLR3 на макрофагах может приводить к возникновению провоспалительного состояния жировой ткани. Существует несколько моделей для изучения резистентности к инсулину. Например, модельные животные, страдающие алиментарным ожирением (DIO),развивают гипергликемию и резистентность к инсулину, сопровождаемые потерей веса. Введение представленных в настоящем изобретении антагонистов TLR3 модельным животным DIO может быть использовано для оценки эффективности антагонистов в облегчении осложнений, связанных с диабетом типа 2, и изменении течения болезни. К раковым заболеваниям относятся злокачественные изменения в клетке, ткани, органе, организме,будь то животное или человек, включая, помимо прочего, такие заболевания, как лейкемия, острая лейкемия, острый лимфобластный лейкоз (лимфолейкоз) (ALL), В-лимфобластный, либо Т-лимфобластныйALL, острый мелиелоидный лейкоз (AML), хронический мелиелоидный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL), волосатоклеточный лейкоз, миелодиспластический синдром (MDS), лимфома, болезнь Ходжкина (лимфогранулематоз), злокачественная лимфома, неходжкинская лимфома,лимфома Беркитта, множественная миелома, саркома Капоши, колоректальная карцинома, карцинома поджелудочной железы, рак почки, рак молочной железы, назофарингеальная карцинома, злокачественный гистиоцитоз, паранеопластический синдром/гиперкальциемия, связанная со злокачественным ростом, твердые (локализованные) опухоли, аденокарциномы, плоскоклеточные карциномы, саркомы, злокачественная меланома, в особенности метастатическая меланома, гемангиома, метастазирующая опухоль, связанная с раком резорбция костной ткани и связанная с раком боль. Примеры сердечно-сосудистых заболеваний включают сердечно-сосудистые заболевания в клетках,ткани, органе, организме, будь то животное или человек, включая, помимо прочего, такие заболевания,как синдром внезапной смерти, инфаркт миокарда, застойная сердечная недостаточность, инсульт, ишемический инсульт, кровотечение, артериосклероз, атеросклероз, рестеноз, атеросклероз на фоне сахарного диабета, гипертензия, артериальная гипертензия, вазоренальная гипертензия, обморок, шок, сифилис сердечно-сосудистой системы, остановка сердца, легочное сердце (лат. cor pulmonale), первичная легочная гипертензия, сердечные аритмии, суправентрикулярная эктопическая систола, трепетание предсердий, мерцание предсердий (хроническое или приступообразное/пароксизмальное), реперфузионный синдром, воспалительный ответ на искусственное кровообращение, хаотическая или политопная предсердная тахикардия, тахикардия с узкими комплексами QRS, специфические аритмии, фибрилляция желудочков, аритмии связанные с нарушением функции пучка Гиса, атриовентрикулярный блок, атриовентрикулярная блокада, ишемии миокарда, заболевания коронарной артерии, стенокардия (лат. angina pectoris), инфаркт миокарда, кардиомиопатия, дилатационная (застойная) кардиомиопатия, рестриктивная кардиомиопатия, порок сердца, эндокардит, перикардит, опухоли сердца, аневризм аорты и периферическая аневризма, расслаивающая аневризма аорты, воспаление аорты, окклюзия абдоминальной аорты и ее ответвлений, заболевания периферических кровеносных сосудов, окклюзии артериальных сосудов,атеросклероз периферических артерий, тромбоангиит (лат. thromboangiitis obliterans), функциональные расстройства периферических артерий, феномен Рейно и виброболезнь, акроцианоз, эритромелалгия,венозные заболевания, тромбоз вен, варикозное расширение вен, артериовенозная фистула, лимфедема,липедема, нестабильная стенокардия, реперфузионное повреждение, постперфузионный синдром и ишемически-реперфузионное повреждение. Примеры неврологических заболеваний включают неврологические заболевания в клетках, ткани,органе, организме, будь то животное или человек, включая, помимо прочего, такие заболевания, как нейродегенеративные болезни, рассеянный склероз, мигрень, СПИД-деменция, демиелинизирующие заболевания, такие как рассеянный склероз и острый поперечный миелит; экстрапирамидный синдром и церебеллярные расстройства, такие как поражения кортико-спинальной системы; заболевания, поражающие базальные ганглии или церебеллярные расстройства; гиперкинетические синдромы, такие как хорея Гентингтона и сенильная хорея; медикаментозные нарушения движения, такие как нарушения, вызываемые блокировкой допаминовых рецепторов; гипокинетические нарушения движения, такие как болезнь Паркинсона; прогрессирующий супрануклеарный паралич; структурные нарушения мозжечка; спиноцеребеллярные дегенерации, такие как спинальная атаксия, атаксия Фридрейха, мозжечковые кортикальные дегенерации, мультисистемные дегенерации (Менцеля, Дежерина-Тома, Ши-Драгера и МачадоДжозефа); системные расстройства (болезнь Рефсума, абеталипопротеинемия, атаксия, телеангиэктазия и митохондриальные мультисистемные расстройства); демиелинизирующие заболевания, такие как рассеянный склероз, острый поперечный миелит; и расстройства моторной функции, такие как нейрогенные мышечные атрофии (дегенерация моторных нейронов, например, амиотрофический боковой склероз,детская и юношеская спинальные мышечные атрофии); болезнь Альцгеймера; синдром Дауна в зрелом- 23022832 возрасте; деменция с тельцами Леви; сенильная деменция с тельцами Леви; синдром Вернике-Корсакова; хронический алкоголизм; болезнь Крейтцфельда-Якоба; подострый склерозирующий лейкоэнцефалит,болезнь Галлервордена-Шпатца и деменция боксеров. Примеры фиброзных заболеваний включают фиброз печени (включая, помимо прочего, такие заболевания, как вызванный алкоголем цирроз, цирроз, индуцированный вирусной инфекцией, аутоиммунный гепатит); фиброз легких (включая, помимо прочего, такие заболевания, как склеродермия, идиопатический фиброз легких); фиброз почек (включая, помимо прочего, такие заболевания, как склеродермия, вызванный диабетом нефрит, гломерулонефрит, вызванный системной красной волчанкой нефрит); фиброзы кожи (включая, помимо прочего, такие заболевания, как склеродермия, гипертрофические и келлоидные рубцы); миелофиброз; нейрофиброматоз; фиброму; фиброзные изменения кишечника; и фиброзные спайки, возникающие в результате хирургического вмешательства. В этих способах фиброз может быть органоспецифическим или системным. Органоспецифический фиброз может быть связан по меньшей мере с одним из следующих заболеваний: фиброз легких, фиброз печени, фиброз почек, фиброз сердца, фиброз сосудов, фиброз кожи, фиброз глаза, фиброз костного мозга и пр. Фиброз легких может быть связан по меньшей мере с одним из следующих заболеваний: идиопатический легочный фиброз,медикаментозный легочный фиброз, астма, саркоидоз или хроническая обструктивная болезнь легких. Фиброз печени может быть связан по меньшей мере с одним из следующих заболеваний: цирроз, шистосомоз или холангит. Цирроз может быть либо алкогольным, либо возникшим после гепатита С или первичным билиарным циррозом. Холангит является склерозирующим холангитом. Фиброз почек может быть связан с диабетической нефропатией или с вызванным системной красной волчанкой гломерулосклерозом. Фиброз сердца может быть связан с инфарктом миокарда. Фиброз сосудов может быть связан с повторным сужением артерий после ангиопластии или атеросклерозом. Фиброз кожи может быть связан с возникшими в результате ожога рубцами, гипертрофическими рубцами, келлоидными рубцами или нефрогенной фиброзирующей дермопатией. Фиброз глаза может быть связан с ретроорбитальным фиброзом, с хирургическим вмешательством при лечении катаракты или пролиферативной витреоретинопатией. Фиброз костного мозга может быть связан с идиопатическим миелофиброзом или медикаментозным миелофиброзом. Другие фиброзы могут быть выбраны из таких заболеваний, как болезнь Пейрони,контрактура Дюпюитрена (синдром) или дерматомиозит. Системные фиброзы могут быть системными склерозами или реакцией "трансплантат против хозяина". Введение/Составление фармацевтических композиций."Терапевтически эффективное количество" агента, эффективного в лечении или профилактике заболевания, при котором желательна активность TLR3, может быть определено путем стандартных исследовательских способов. Например, доза агента, эффективная в лечении или профилактике воспалительных заболеваний, таких как астма, болезнь Крона, язвенных колит иди ревматоидный артрит, может быть определена введением агента в соответствующую модель, такую как представленные здесь модели. Кроме того, в случае необходимости, для оптимизации дозы могут быть использованы тестовые системы in vitro. Точное определение эффективной дозы (например, с помощью клинических испытаний) может быть осуществлено специалистами на основании нескольких факторов. Такими факторами являются: подлежащее лечению или профилактике заболевание, симптомы заболевания, масса тела пациента,иммунологический статус пациента и другие известные специалистам факторы. Точная доза, предназначенная для применения в формуле композиции, зависит от способа введения препарата, а также от тяжести болезни, и должна определяться на основании врачебного решения и состояния каждого пациента. Эффективная доза может быть экстраполирована исходя из кривой динамики доза-ответ, полученной в животных модельных тестовых системах in vitro. В представленных в настоящем изобретении способах антагонисты TLR3 могут вводиться по одному или в сочетании по меньшей мере с одной дополнительной молекулой. В качестве дополнительных молекул могут выступать другие молекулы-антагонисты TLR3 или молекулы, имеющие терапевтическое значение, не опосредованное сигнальным путем рецептора TLR3. Уменьшающие производство или активность цитокинов компаунды, состоящие из антибиотиков, противовирусных, паллиативных или прочих веществ, являются примерами таких дополнительных молекул. Для введения агента, предназначенного для терапевтического использования, может быть использован любой приемлемый путь введения, который обеспечивает попадание агента к пациенту. Фармацевтические композиции данных агентов являются особенно полезными при парентеральном введении, например, внутрикожном, внутримышечном, внутрибрюшном, внутривенном, подкожном или интраназальном. Предложенный в данном изобретении агент может быть изготовлен в виде фармацевтической композиции, содержащей эффективное количество агента в качестве активного компонента вместе с фармацевтически приемлемым носителем. Термин "носитель" относится к растворителям, адъювантам, связывающим веществам или среде, вместе с которыми активное соединение будет вводиться. Фармацевтическая среда может быть жидкой, как, например, вода или масла, включая масла, получаемые из нефти,масла растительного, животного или синтетического происхождения, например, арахисовое, соевое, минеральное, кунжутное и другие подобные масла. Например, могут быть использованы 0,4% раствор по- 24022832 варенной соли и 0,3% раствор глицина. Указанные растворы стерильны и обычно не содержат твердых примесей. Стерилизация проводится с использованием общепринятых, хорошо известных способов стерилизации (например, фильтрации). Композиции могут содержать принятые в фармацевтике вспомогательные вещества, необходимые для приближения к физиологическим условиям, например, вещества,необходимые для контроля и изменения рН, стабилизаторы, увеличивающие плотность, увлажняющие и придающие окраску агенты, и т.д. Концентрация предложенного в данном изобретении агента в таких фармацевтических формулировках может значительно варьировать, т.е., от менее, чем 0,5% (обычно по меньшей мере 1%) до 15-20% от веса и определяется, в первую очередь, на основании необходимой дозы, объеме, вязкости и т.д., в соответствии с выбранным способом введения. Таким образом, предложенные в настоящем изобретении фармацевтические композиции, предназначенные для внутримышечного введения, могут содержать 1 мл стерильного буферного раствора, а также приблизительно от 1 нг до 100 мг, например, приблизительно от 50 нг до 30 мг, или предпочтительнее приблизительно от 5 до 25 мг предложенного в настоящем изобретении антитела-антагонистаTLR3. Сходным образом, предложенная в настоящем изобретении фармацевтическая композиция для внутривенного введения может содержать приблизительно 250 мл стерильного раствора Рингера и приблизительно от 1 до 30 мг, или предпочтительнее приблизительно от 5 до 25 мг предложенного в настоящем изобретении антагониста. Способы изготовления парэнтерально вводимых композиций хорошо известны и их детальное описание может быть найдено, например, в "Remington's PharmaceuticalScience", 15th ed., Mack Publishing Company, Easton, PA. Предложенные в настоящем изобретении антитела-антагонисты могут быть лиофилизированы для хранения и впоследствии перед использованием восстановлены (растворены) в подходящем носителе. Было показано, что этот способ эффективен для обычно используемых иммуноглобулинов и белковых препаратов, при этом могут быть использованы известные специалистам способы лиофилизации и восстановления. Настоящее изобретение сейчас будет охарактеризовано с помощью нижеприведенных примеров,описывающих настоящее изобретение, но не ограничивающих его. Пример 1. Идентификация и получение антагонистов mAb против huTLR3. Комбинаторная библиотека антител человека MorphoSys и библиотека фаговых антител (HuCAL)Gold (Morphosys AG, Мартинсрид, Германия) были использованы для поиска фрагментов антител человека и их сравнения с очищенным TLR3 антигеном, созданным в результате экспрессии аминокислот 1703 TLR3 человека (huTLR3) (SEQ ID NO: 4), содержащим меченый полигистидином С-конец; очистка антигена была осуществлена с помощью иммобилизованной металл-аффинной хроматографии. Аминокислоты 1-703 соответствуют предсказанному внеклеточному домену (ECD) рецептора человекаhuTLR3. Фрагменты Fab, специфически связывающиеся с huTRL3 ECD, были отобраны на основе различных форм белка TLR3 так, что различные фрагменты антител могли быть выбраны, секвенированы и объявлены уникальными. Используя различные стратегии, было отобрано 62 белка-кандидата (с различными последовательностями V-сегмента), способных связываться исключительно с huTLR3 ECD. Эти 62 белка, идентифицированные как способные связываться исключительно с huTLR3 ECD, были проверены на способность нейтрализовать активность с помощью целого ряда работающих на клеточном уровне тестовых систем, пригодных для анализа противовоспалительной активности. Используя предварительные показатели активности (см. далее пример 2), из 62 были отобраны четыре кандидата(Fab 16-19), определяющие семейства 16-19, в качестве исходного материала для созревания тяжелой цепи CDR2 (HCDR2) и легкой цепи CDR3 (LCDR3). Один из исходных кандидатов (кандидат 19) имелN-связанный гликозилированный участок в HCDR2; с целью избавиться от гликозилированного участка в гене, кодирующем названный белок-кандидат, была индуцирована мутация заменяющая Ser на Ala (S на А). После созревания CDR четырех исходных кандидатов было выбрано 15 дочерних кандидатов(кандидаты 1-15) для дальнейшей характеризации, согласно описанию, приведенному ниже в примере 2. Перечисление вариабельных участков легкой и тяжелой цепей каждого из 19 кандидатов показано в табл. 3. Указанные кандидаты будут далее называться mAb 1-19 или Fabs 1-19, в зависимости от того,являются ли они фрагментами антител Fab, или представляют собой полную клонированную последовательность антитела (пример 3). Вследствие особенности дизайна экспрессионного вектора крайними сегментами вариабельных участков зрелых антител у всех кандидатов являются QVE для тяжелой цепи иDI для легкой цепи. Предпочтительными последовательностями для указанных сегментов являются последовательности генов клеток зародышевой линии, имеющие высокую степень сходства с последовательностью кандидата. Для семейств 17 и 18 последовательность генов клеток зародышевой линии былаVH и DI для VL. Последовательность SY является уникальной для лямбды подгруппы 3, и существуют свидетельства гетерогенности S или Y в отношении конечного остатка. Таким образом, было решено, что консенсус-последовательности терминального участка QSV подгруппы лямбда 1 лучше всего подходят для замещения DIE в VL семействах 17 и 18. Данные изменения были введены в последовательностикандидаты 9, 10 и 12 из семейства 18, а также в кандидаты 14 и 15 из семейства 19. В процессе этого бы- 25022832 ли оптимизированы кодоны в участках VH и VL данных антител. Варианты N-конца аминокислотных последовательностей вариабельного участка легкой цепи, полученные из клеток зародышевой линии,которые являются вариантами кандидатов 9, 10 и 11, показаны в SEQ ID NO: 209-211, а варианты Nконца аминокислотных последовательностей вариабельного участка тяжелой цепи, полученные из клеток зародышевой линии, которые являются вариантами кандидатов 9, 10, 12, 14, и 15 показаны в SEQ IDNO: 212-216 соответственно. Варианты N-конца данных кандидатов называются в настоящем изобретении кандидат/mAb/Fab 9QVQ/QSV, 10QVQ/QSV, 12QVQ/QSV, 14EVQ или 15EVQ. Варианты N-конца,полученные из клеток зародышевой линии, экспрессированные как mAb, не оказывают влияния на связывание TLR3 или на способность антител ингибировать биологическую активность TLR3 по сравнению с исходными белками (данные не показаны). Пример 2. Определение активности антагониста TLR3 in vitro. 15 охарактеризованных выше кандидатов с созревшим CDR были отобраны, как потенциально пригодные для лечения человека, была определена эффективность связывания и способность оказывать нейтрализующий эффект на активность рецептора. Результаты исследования активности и результаты для четырех исходных Fab, Fab 16-19 и фрагментов Fab 15, содержащих созревшие CDR, Fab 1-15, либо ихV-участки, не заимствованные из клеток зародышевой линии, приводятся далее. Ингибирование NF-kB и сигнальный каскад ISRE. Клетки 293 Т культивировали в средах DMEM и GlutaMax (Invitrogen, Карлсбад, Калифорния), содержащих инактивированный с помощью термического воздействия FBS, затем клетки были трансфицированы введением 30 нг pNF-kB или плазмидой-репортером ISRE, содержащей ген люциферазы светлячка, 13,5 нг вектора pcDNA3.1, 5 нг вектора phRL-TK и 1,5 нг вектора pCDNA, кодирующего FL TLR3(SEQ ID NO: 2). Плазмида phRL-TK содержит ген люциферазы Renilla (люцифераза коралла, Renilla reniformis), регулируемый HSV-1 промотором тимидинкиназы (Promega, Мадисон, Висконсин). АнтителаTLR3 инкубировали в течение 30-60 мин перед добавлением poly(I:C) (GE Healthcare, Пискатауэй, НьюДжерси). Планшеты инкубировались в течение 6 или 24 ч при 37 С перед добавлением люциферазного реагента Dual-Glo; последующий анализ планшет проводился с помощью прибора FLUOstar. Нормализацию значений (относительная интенсивность сигнала) получили делением RLU (интенсивность сигнала,измеренная в относительных единицах люминесценции) люциферазы светлячка на RLU коралловой люциферазы (Renilla). После стимуляции агентом poly(I:C), являющимся агонистом TLR3 (1 мкг/мл), добивались специфического ингибирования каскада передачи сигнала с участием NF-kB или ISRE, стимулирующего производство люциферазы светлячка, что достигалось за счет инкубации клеток с антителами против TLR3 (0,4, 2,0 и 10 мкг/мл). Результаты анализа NF-kB показаны на фиг. 1, как выраженное в процентах относительное ингибирование люцифераз Firefly/Renilla, рассматривая 5465 в качестве положительного контроля (нейтрализация mAb против TLR3 человека) и mAb против тканевого фактора человека (859) в качестве контроля для изотипа человека IgG4. 50% ингибирование было достигнуто при концентрации mAb 0,4-10 мкг/мл с 1068 и TLR3.7 ингибируют около 38 и 8% биологической активностиTLR3 при концентрации 10 мкг/мл. Сходные результаты были получены при использовании генарепортера ISRE (данные не показаны). Производство цитокинов клетками BEAS-2B. Клетки BEAS-2B (SV-40 трансформированные нормальные клетки бронхиального эпителия человека) высевали на чашки, покрытые коллагеном типа 1, и перед добавлением poly(I:C) инкубировали с антителами против TLR3 человека или без них. 24 ч спустя после обработки супернатанты были собраны и проанализированы на уровень содержания цитокинов или хемокинов с помощью адаптированной мультиплекс-тестовой системы, использующей микрочастицы и направленной на детекцию IL-6, IL-8,CCL-2/MCP-1, CCL5/RANTES и CXCL10/IP-10. Результаты приведены на фиг. 2 как выраженное в процентном соотношении ингибирование индивидуальных цитокинов/хемокинов, полученное в результате обработки mAb при 0,4, 2,0 и 10 мкг/мл. 5465 - положительный контроль; 859 - изотипный контроль. Производство цитокинов клетками NHBE. Производство цитокинов может быть также изучено в нормальных клетках эпителия человека(NHBE) (Lonza, Уолкерсвиль, Мэриленд). Клетки NHBE были размножены, а затем перенесены на покрытые коллагеном чашки и инкубировались в течение 48 ч, после чего удалили использованную среду и добавили 0,2 мл свежей среды. Клетки инкубировались с mAb против TLR3 человека или без них в течение 60 мин перед добавлением poly(I:С). Спустя 24 ч супернатанты собрали и затем либо сохраняли при-20 С, либо анализировали на уровень содержания IL-6. Результаты приведены в графиках, представленных на фиг. 3, как выраженное в процентном соотношении ингибирование секреции IL-6 в результате обработки mAb дозами в диапазоне от 0,001 до 50 мкг/мл. 5465 положительный контроль, 859 - изотипный контроль. Большинство mAb ингибировали по меньшей мере 50% производства IL-6 при 1 мкг/мл и достигали 75% ингибирования при 5 мкг/мл. Производство цитокинов клетками РВМС. Производство цитокинов также было изучено в мононулеарных клетках периферической крови человека (РВМС). Кровь, полученная от доноров, собиралась в содержащие гепарин пробирки, к которым- 26022832 осторожно, в качестве нижнего слоя, добавляли раствор Фиколл Пак Плюс. Пробирки центрифугировались и клетки РВМС, формирующие белый слой непосредственно над слоем Ficoll, были собраны и высеяны на планшеты. После чего, клетки РВМС культивировали с mAb против TLR3 человека или без них перед добавлением 25 мкг/мл poly(I:С). Супернатанты были собраны спустя 24 ч, и уровень цитокинов был определен с помощью технологии Luminex. Результаты представлены в графике на фиг. 4, где показано выраженное в процентном соотношении суммарное ингибирование IFN-, IL-12 и IL-6 при использовании единичной дозы mAb (0,4 мкг/мл) с 5465 в качестве положительного контроля; huIgG4 использован в качестве контроля изотипа. Производство цитокинов клетками HASM. Коротко говоря, клетки гладкой мускулатуры дыхательных путей человека (HASM) инкубировались с mAb против TLR3 человека или без них, после чего к клеткам была добавлена комбинация 500 нг/мл poly(I:C) и 10 нг/мл ФНО-. Спустя 24 ч супернатанты собрали и определили уровень цитокинов с помощью технологии Luminex. Результаты показаны в графиках на фиг. 5 в виде уровней хемокинаCCL5/RANTES при трех дозах mAb (0,4, 2 и 10 мкг/мл). 5465 использован в качестве положительного контроля; huIgG4 использован в качестве контроля изотипа. Результаты исследования клеток человека in vitro подтверждают способность предложенных в настоящем изобретении антител уменьшать производство цитокинов и хемокинов в результате связывания с huTLR3. Пример 3. Конструкции имеющих полную длину антител. Четыре исходных фрагмента Fab (кандидаты 16-19) и 15 дочерних Fabs (кандидаты 1-15) тяжелых цепей были клонированы в клетках, содержащих мутацию в гене иммуноглобулина IgG4 (мутация S229P Fc). Кандидаты 9QVQ/QSV, 10QVQ/QSV, 12QVQ/QSV, 14EVQ или 15EVQ были клонированы в клетках, содержащих мутации в гене иммуноглобулина IgG4, мутации F235A/L236A и S229P Fc. Зрелые, имеющие полную длину аминокислотные последовательности тяжелых цепей, показаны в Для экспрессии данные последовательности тяжелых цепей могут содержать на N-конце лидерную последовательность, такую как MAWVWTLLFLMAAAQSIQA (SEQ ID NO: 103). Нуклеотидные последовательности, кодирующие тяжелую цепь кандидатов 14EVQ и 15EVQ с лидерной последовательностью, а также зрелая форма (без лидерной последовательности) показаны в SEQ ID NO: 104 и 105 соответственно. Аналогичным образом, последовательности легких цепей предложенных в настоящем изобретении антител могут включать на N-конце лидерную последовательность, такую какMGVPTQVLGLLLLWLTDARC (SEQ ID NO: 106). Отдельные легкие цепи кандидата 15 с оптимизированными кодонами, имеющие лидерную последовательность, и зрелая форма (без лидерной последовательности) показаны в SEQ ID NO: 107 и 108 соответственно. Пример 4. Характеристика связывания mAb против TLR3. Значения ЕС 50 при связывании mAb с внеклеточным доменом (ECD) TLR3 человека определяли способом ELISA. Белок ECD TLR3 человека разводили до 2 мкг/мл в ФБР, и аликвоты по 100 мкл вноси- 27022832 ли в каждую лунку 96-луночного планшета (Corning Inc., Эктон, Массачусетс). После инкубации в течение ночи при 4 С планшету трижды промывали отмывочным буфером, содержащим 0,05% Твин-20(Applied Biosystems, Фостер-Сити, Калифорния) и 0,05% Твин-20 в ФБР. После блокирования в течение 2 ч при комнатной температуре планшету промывали 3 раза, затем добавляли серийные разведения кандидатов mAb против TLR3 в отношении 1 к 19 в блокирующем буферном растворе. MAb против TLR3 инкубировали при комнатной температуре в течение 2 ч и трижды промывали. Затем добавляли конъюгированные с пероксидазой овечьи антитела против IgG человека (GE Healthcare, Пискатауэй, НьюДжерси), разведенные в соотношении 1:4000 в блокирующем буферном растворе, инкубировали при комнатной температуре в течение 1 ч, затем трижды промыли в отмывочном буфере. Связывание выявляли путем 10-15-минутной инкубации в TMB-S (Fitzgerald Industries International, Inc., Конкорд, Массачусетс). Реакцию остановили 25 мкл 2N H2SO4 и измерили поглощение при 450 нм (вычитая поглощение при 650 нм) с помощью спектрофотометра SPECTRA Max (Molecular Devices Corp., Саннивейл, Калифорния). Значения ЕС 50 определяли способом нелинейной регрессии с помощью программного обеспечения GraphPad Prism (GraphPad Software, Inc., Сан-Диего, Калифорния). Значения ЕС 50 определяли в реакции связывания, инкубируя huTLR3 (табл. 4) со 100 мкл 4 кратных серийных разведений mAb: от 2,5 мкг/мл до 0,6 пг/мл. Отрицательными контрольными образцами служили античеловеческий тканевой фактор mAb 859 и hu IgG4K. Таблица 4 Аффинность связывания для huTLR3 ECD определяли также с помощью Biacore-анализа. Полученные данные (не показаны) продемонстрировали, что Kd mAb 1-19 при связывании с huTLR3 ECD составляет менее 10-8 М. Пример 5. Конкурентное связывание с эпитопами. Эксперименты по связыванию с эпитопами проводили с целью определения конкурентных групп или "групп эпитопов" антител против TLR3. При конкурентном ELISA 5 мкл очищенного белка TLR3 ECD человека (20 мкг/мл), синтезированного в соответствии с описанием в примере 1, наносили в лунки планшета MSD HighBind (Meso ScaleDiscovery, Гейтерсбург, Мэриленд) и выдерживали 2 ч при комнатной температуре. В каждую лунку добавляли 150 мкл 5% блокирующего буфера A MSD и инкубировали в течение 2 ч при комнатной температуре. Планшеты трижды промывали буфером 0,1 М HEPES, рН 7,4, затем добавляли смесь меченыхmAb против TLR3 с разными конкурирующими агентами. Меченые антитела (10 нМ) инкубировали с увеличивающимися концентрациями (от 1 нМ до 2 мкМ) немеченых антител против TLR3, затем смесь добавляли в обозначенные лунки в объеме 25 мкл. После 2 ч инкубации с осторожным встряхиванием при комнатной температуре планшеты трижды промывали буфером 0,1 М HEPES (рН 7,4). Буферный- 28022832 раствор MSD Read Buffer T разбавляли дистиллированной водой (4-кратно), разливали по 150 мкл/лунку и анализировали с помощью SECTOR Imager 6000. Антитела метили MSD Sulfo-Tag NHS-эфиром в соответствии с инструкциями производителя. Оценивали следующие антитела против TLR3: mAb 1-19, полученные из комбинаторной библиотеки антител человека Morphosys (показаны в табл. 3a); с 1068 (описанные в WO 06/060513A2), с 1811 (крысиные mAb против мышиных TLR3, полученные из гибридомы крыс, иммунизированных мышиным белком TLR3), TLR3.7 (eBiosciences, Сан-Диего, Калифорния, кат. номер 14-9039) и IMG-315A (против аминокислот TLR3 человека аминокислот 55-70 (VLNLTHNQLRRLPAAN) от Imgenex, Сан-Диего, Калифорния). Для mAb 9, 10, 12, 14 и 15 в данном исследовании использовали варианты 9QVQ/QSV,10QVQ/QSV, 12QVQ/QSV, 14EVQ или 15EVQ. При количественной оценке конкуренции антитела против TLR3 взаимодействовали с пятью различными группами. Группа A: mAb 1, 2, 13, 14EVQ, 15EVQ, 16, 19; группа В: mAb 3, 4, 5, 6, 7, 8,9QVQ/QSV, 10QVQ/QSV, 11, 12QVQ/QSV, 17, 18; группа С: антитело Imgenex IMG-315A; группа D: антитела TLR3.7, с 1068; и группа Е: антитело с 1811. Пример 6. Картирование эпитопов. Для дальнейшего картирования эпитопов в соответствии с описанием, приведенным в примере 5,отбирали репрезентативные антитела различных эпитопов. Картирование эпитопов проводили с помощью различных способов, в числе которых эксперименты по замене сегментов TLR3, мутагенез, заменаH/D (водорода на дейтерий) и компьютерное моделирование белок-белкового докинга (The Epitope Mapping Protocols, Methods in Molecular Biology, Volume 6, Glen E. Morris ed., 1996). Замена сегментов TLR3. Для определения местоположения антителосвязывающих доменов наTLR3 использовали химерные белки TLR3 мышь/человек. Внеклеточный домен белка TLR3 человека делили на три сегмента (аа 1-209, аа 210-436, аа 437-708 в соответствии с нумерацией аминокислот вTLR3 человека, GenBank Acc. No. NP003256). Химерный белок MT5420 был создан путем замены аминокислот TLR3 человека 210-436 и 437-708 на соответствующие мышиные аминокислоты (мышиныйTLR3, GenBank Acc. No. NP569054, аминокислоты 211-437 и 438-709). Химера МТ 6251 была создана путем замены аминокислот человека в положениях 437-708 на аминокислоты мышиного TLR3 (мышиный TLR3, GenBank Acc. No. NP569054, аминокислоты 438-709). Все конструкты были созданы на основе вектора рСЕР 4 (Life Technologies, Карлсбад, Калифорния) с помощью стандартных процедур клонирования. Белки экспрессировали в HEK293 клетках как белки с V5-His6, присоединенным к С-концу, и очищали в соответствии с описанием в примере 1.mAb c1068. mAb c1068 с высокой аффинностью связывается с TLR3 ECD человека, однако не связывается надлежащим образом с мышиным TLR3. с 1068 утеряло способность связываться как с МТ 5420,так и с МТ 6251, из чего можно сделать вывод, что сайт связывания располагался в пределах последовательности аминокислот 437-708 WT белка TLR3 человека.mAb 12QVQ/QSV. mAb 12QVQ/QSV связывалось с обеими химерами, указывая на то, что сайт связывания mAb 12QVQ/QSV располагался в пределах последовательности аминокислот 1-209 белка TLR3 человека с последовательностью SEQ ID NO:2. Компьютерное моделирование белок-белкового докинга. Кристаллическая структура mAb 15EVQ(см. ниже) и опубликованная структура TLR3 человека (Bell et al., J. Endotoxin Res. 12:375-378, 2006) были минимизированы по энергии в CHARMm (Brooks et al., J. Computat. Chem. 4:187-217, 1983) для использования в качестве стартовых моделей для докинга. Белковый докинг проводился с ZDOCKpro 1.0(Accelrys, Сан-Диего, Калифорния), эквивалентным ZDOCK 2.1 (Chen и Weng, Proteins 51: 397-408, 2003) с угловым гридом 6 градусов. Известный сайт N-гликозилирования по остатку Asn в TLR3 человека (Asn 52, 70, 196, 252, 265, 275, 291, 398, 413, 507 и 636) (Sun et al., J. Biol. Chem. 281:11144-11151, 2006) блокировали так, чтобы он не участвовал в формировании интерфейса комплекса антитело-антиген (по энергии) по алгоритму ZDOCK. Были просчитаны и сгруппированы 2000 начальных положений, положения с докингом были уточнены и заново просчитаны в RDOCK (Li et al., Proteins 53:693-707, 2003). Визуально проверили 200 положений с наиболее высокими начальными оценками по ZDOCK и 200 лучших положений по RDOCK. Кристаллизация mAb 15EVQ проводилась способом диффузии пара при 20 С (Benvenuti и Mangani,Nature Protocols 2:1633-51, 2007). Начальный скрининг проводили с помощью робота Hydra на 96 луночных планшетах. В эксперименте капли по 0,5 мкл раствора белка смешивали с 0,5 мкл резервуарного раствора. Капли уравновешивали против 90 мкл резервуарного раствора. Раствор Fab в 20 мМ Трисбуфера, рН 7,4, содержащий 50 мМ NaCl, концентрировали до 14,3 мг/мл с помощью ячеек Amicon Ultra5 kDa. Скрининг проводили с помощью Wizard III (Emerald BioSystems, Бейнбридж Айленд, Вашингтон) и производственных экранов для кристаллизации. Данные по дифракции рентгеновских лучей собирали и обрабатывали с помощью микрофокусного генератора рентгеновских лучей Rigaku MicroMax-007HF, снабженного конфокальной оптикой Osmic VariMax, детектором Saturn 944 CCD и системой криоохлаждения X-stream 2000 (Rigaku, Вуд- 29
МПК / Метки
МПК: C12P 21/06
Метки: выделенное, способное, взаимодействовать, антитело
Код ссылки
<a href="https://eas.patents.su/30-22832-vydelennoe-antitelo-sposobnoe-vzaimodejjstvovat-s-tlr3.html" rel="bookmark" title="База патентов Евразийского Союза">Выделенное антитело, способное взаимодействовать с tlr3</a>
Следующий патент: Емкостный датчик на основе мэмс для использования в системе сейсмической разведки
Случайный патент: Композиция для укрепления иммунитета и ее применение