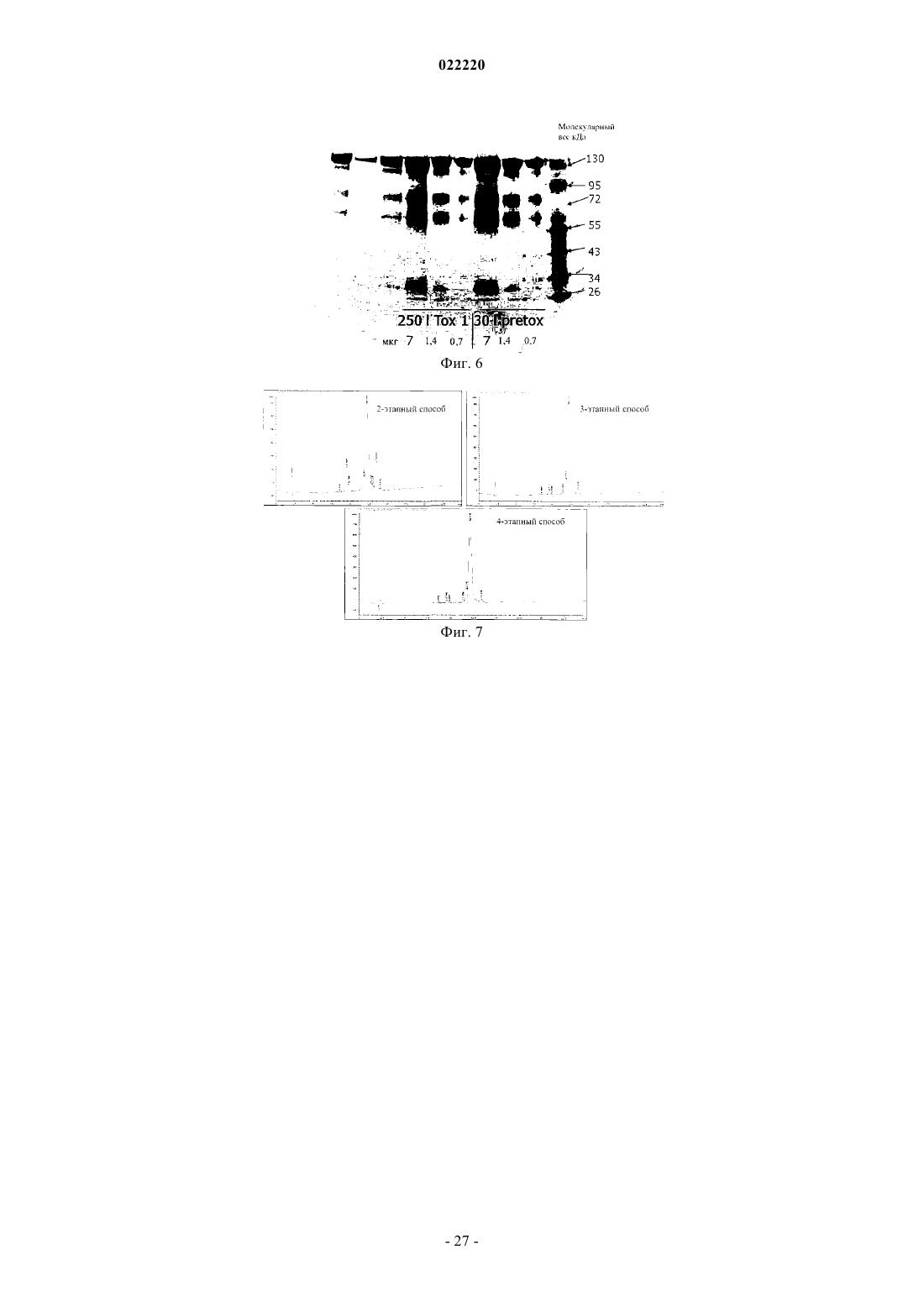
Способ получения и очистки рекомбинантной лизосомальной альфа-маннозидазы
Номер патента: 22220
Опубликовано: 30.11.2015
Авторы: Андерссон Клаэс, Реутервалль Хелена, Фогх Йенс, Веигельт Сесилиа, Хюден Пиа, Нильссон Стефан
Формула / Реферат
1. Способ очистки рекомбинантной альфа-маннозидазы из культуры клеток, где фракцию указанной культуры клеток, включающую рекомбинантную альфа-маннозидазу, подвергают хроматографии на смоле, включающей мультимодальный лиганд.
2. Способ по п.1, где указанная фракция культуры клеток, включающая рекомбинантную альфа-маннозидазу, представляет собой осветленный неразбавленный сбор.
3. Способ по любому из пп.1, 2, где указанный мультимодальный лиганд, связанный со смолой, представляет собой вещество с группой карбоновой кислоты или группой сульфоновой кислоты.
4. Способ по любому из пп.1-3, где мультимодальный лиганд, связанный со смолой, представляет собой вещество формул (I), (II) или (III)
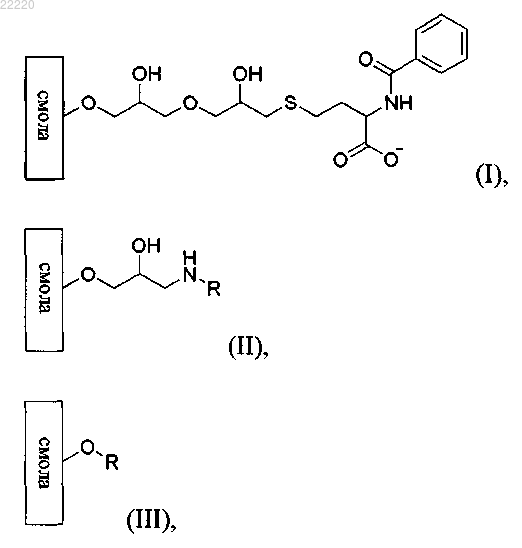
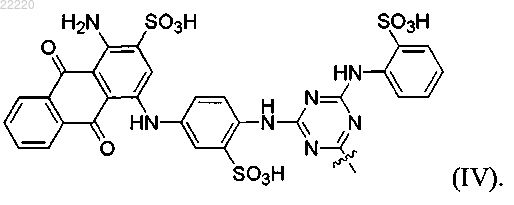
где R веществ формул (II) и (III) представляет собой функциональную группу формулы (IV)
5. Способ по любому из пп.1-4, где фракцию указанной культуры клеток, загруженную на смолу, включающую мультимодальный лиганд, подвергают по меньшей мере одной стадии отмывки раствором, включающим изопропанол, предпочтительно по меньшей мере 1% (об./об.) изопропанола, как, например, по меньшей мере 2, 3, 4, 4,5% (об./об.) изопропанола, предпочтительно по меньшей мере 5% (об./об.) изопропанола.
6. Способ по любому из пп.1-5, где первый элюат, включающий рекомбинантную альфа-маннозидазу, элюируют со смолы, включающей мультимодальный лиганд, с помощью водного раствора, включающего этиленгликоль или пропиленгликоль.
7. Способ по любому из пп.1-6, где первый элюат, включающий альфа-маннозидазу, полученный со смолы, включающей мультимодальный лиганд, дополнительно подвергают способу, включающему стадии, на которых:
i) наносят фракцию, включающую альфа-маннозидазу, на смолу для хроматографии с гидрофобным взаимодействием с получением элюата, включающего рекомбинантную альфа-маннозидазу;
ii) пропускают фракцию, включающую альфа-маннозидазу, через ионообменную смолу смешанного действия для удерживания загрязняющих примесей с получением фильтрата, включающего рекомбинантную альфа-маннозидазу;
iii) подвергают фракцию, включающую альфа-маннозидазу, хроматографии на анионообменной смоле с получением элюата, включающего рекомбинантную альфа-маннозидазу.
8. Способ по любому из пп.1-7, где альфа-маннозидаза имеет последовательность, выбранную из:
A) последовательности, изложенной в SEQ ID NO: 2;
B) аналога последовательности в А);
C) подпоследовательности последовательности в А) или В).
9. Композиция, включающая альфа-маннозидазу, получаемую посредством способа очистки по любому из пп.1-8.
10. Способ периодического или непрерывного получения рекомбинантной альфа-маннозидазы, включающий следующие стадии, на которых:
a) инокулируют промышленный реактор, включающий основную среду, клетками, способными продуцировать рекомбинантную альфа-маннозидазу, в день 0 с получением культуры клеток;
b) добавляют питательную среду к указанной культуре клеток по меньшей мере один раз от дня 1;
c) корректируют температуру указанной культуры клеток до самое большее 35°С, как, например, 34, 33, 32°С, предпочтительно самое большее 31°С, либо после дня 3, либо когда плотность жизнеспособных клеток будет выше 2,1 млн жизнеспособных клеток/мл, в зависимости от того, что наступит раньше;
d) осуществляют способ очистки по любому из пп.1-8.
11. Применение композиции по п.9 для получения лекарственного препарата для лечения альфа-маннозидоза.
12. Способ лечения альфа-маннозидоза и/или уменьшения или облегчения симптомов, связанных с альфа-маннозидозом, причем указанный способ включает стадию, на которой вводят композицию, включающую очищенную рекомбинантную альфа-маннозидазу по п.9 субъекту, нуждающемуся в этом.
Текст
СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОЙ ЛИЗОСОМАЛЬНОЙ АЛЬФА-МАННОЗИДАЗЫ Изобретение относится к способу очистки рекомбинантной альфа-маннозидазы, способу получения альфа-маннозидазы, композиции, включающей альфа-маннозидазу, применению композиции в качестве лекарственного препарата, применению в качестве лекарственного препарата для лечения альфа-маннозидоза и способу лечения альфа-маннозидоза и/или облегчения симптомов альфа-маннозидоза. Область техники настоящего изобретения Настоящее изобретение относится к способу очистки рекомбинантной альфа-маннозидазы, способу получения альфа-маннозидазы, композиции, включающей альфа-маннозидазу, применению композиции в качестве лекарственного препарата, применению в качестве лекарственного препарата для лечения альфа-маннозидоза и способу лечения альфа-маннозидоза и/или облегчения симптомов альфаманнозидоза. Уровень техники настоящего изобретения Альфа-маннозидоз. Альфа-маннозидоз является рецессивным, аутосомным заболеванием, которое встречается по всему миру с частотой от 1/1000000 и до 1/500000. Маннозидоз обнаруживают во всех этнических группах в Европе, Америке, Африке и также Азии. Его выявляют во всех странах с хорошей диагностической сферой для лизосомальных болезней накопления с аналогичной частотой. Они рождаются практически здоровыми, однако симптомы заболевания являются прогрессирующими. Альфа-маннозидоз проявляет клиническую разнородность, изменяющуюся в диапазоне от очень тяжелых до очень легких форм. Типичными клиническими симптомами являются умственная отсталость, изменения скелета, ослабленная иммунная система, что приводит к рецидивирующим инфекциям, нарушению слуха, и часто заболевание связано с типичными характерными чертами лица, такими как грубое лицо, выступающий лоб, уплощенная переносица, маленький нос и широкий рот. В наиболее тяжелых случаях (маннозидоз типа I) дети страдают от гепатоспленомегалии, и они умирают в первые годы жизни. Возможно, эту раннюю смерть вызывают тяжелые инфекции из-за иммунодефицита, вызванного заболеванием. В более легких случаях(маннозидоз типа 2) пациенты обычно достигают совершеннолетия. Слабость скелета пациентов приводит к потребностям в креслах на колесах в возрасте от 20 до 40. Заболевание вызывает диффузную дисфункцию мозга, часто приводящую к слабой умственной деятельности, что исключает все, кроме самых базовых навыков простого чтения и письма. Эти проблемы, связанные с неспособностью слышать и другими клиническими проявлениями заболевания, препятствуют независимой жизни пациента, при этом последствием является то, что необходим пожизненный уход. Лизосомальная альфа-маннозидаза. Альфа-маннозидоз возникает в результате недостаточной активности лизосомальной альфаманнозидазы (LAMAN, КФ 3.2.1.24). Заболевание характеризуется массивным внутриклеточным аккумулированием богатых маннозой олигосахаридов, а именно олигосахаридов, несущих 1,2-, 1,3- и 1,6-маннозильные остатки на их нередуцирующем конце. Эти олигосахариды в основном образованы в результате внутрилизосомального разрушения гликопротеинов с N-связанными олигосахаридами. Однако некоторые образованы в результате катаболизма связанных с долихолом олигосахаридов и из неправильно свернутых гликопротеинов, перенаправляемых в цитозоль для разрушения с помощью протеасомы (Hirsch et al. EMBO J., 22, 1036-1046, 2003 и Saint-Pol et al. J. Biol. Chem., 274, 13547-13555, 1999). Лизосомальное накопление наблюдают в широком диапазоне типов клеток и тканей, включая нейроны во всех областях мозга. LAMAN представляет собой экзогликозидазу, которая гидролизует эти концевые нередуцирующие альфа-D-маннозные остатки в альфа-D-маннозидах от нередуцирующего конца во время упорядоченного разрушения N-связанных гликопротеинов (Aronson and Kuranda, FASEB J., 3:26152622, 1989). Предшественник фермента человека синтезируется в виде одного полипептида из 1011 аминокислот, включая сигнальный пептид из 49 остатков. Предшественник подвергается протеолитическому процессингу в три гликопептида из 15, 42 и 70 кДа до зрелого фермента в лизосоме. 70 кДа гликопептид в дальнейшем расщепляется на субъединицы, связанные дисульфидными мостиками (Berg et al. Mol.U60885-U60899; Riise et al. Genomics, 42:200-207, 1997). Транскрипт LAMAN представляет собой " 3500 нуклеотидов (nts) и содержит открытую рамку считывания, кодирующую 1011 аминокислот (GenBankU60266.1). Клонирование и секвенирование человеческой кДНК, кодирующей LAMAN, было опубликовано в трех статьях (Nilssen et al. Hum. Mol. Genet., 6, 717-726, 1997; Liao et al. J. Biol. Chem., 271, 28348-28358,1996; Nebes et al. Biochem. Biophys. Res. Commun., 200, 239-245, 1994). Любопытно, что три последовательности не являются идентичными. При сравнении с последовательностью из Nilssen и соавт. (номер доступа U60266.1) Liao и соавт. и Nebes и соавт. была обнаружена замена ТА на AT в положениях 1670 и 1671, приводящая к замене валина на аспарагиновую кислоту. Также была обнаружена замена С на А в положении 1152, которая не приводит к каким-либо изменениям в аминокислотной последовательности. Диагностика. Диагностика альфа-маннозидоза в настоящее время основывается на клинической оценке, обнаружении богатых маннозой олигосахаридов в моче и прямых измерениях активности альфа-маннозидазы в различных типах клеток, таких как лейкоциты, фибробласты и амниоциты (Chester et al., в Durand P.,-1 022220Beaudet. In: Scriver C.R., Beaudet A.L., Sly W.A., Valle D. (eds) The metabolic and molecular bases of inherited disease, Vol. 5, McGraw-Hill, New York, p. 2529-2562, 1995). Поскольку симптомы первоначально часто являются легкими, и биохимическая диагностика затруднительна, то диагностику часто проводят на поздних стадиях заболевания. Очевидно, что пациенты и их семьи получили бы значительную пользу от ранней диагностики. Экспериментальные модели на животных. Альфа-маннозидоз был описан у крупного рогатого скота (Hocking et al. Biochem J., 128:69-78,1972), кошек (Walkley et al. Proc. Nat. Acad. Sci., 91:2970-2974, 1994) и морских свинок (Crawley et al. Pediatr Res, 46:501-509, 1999). Недавно была создана мышиная модель путем целенаправленного разрушения гена альфа-маннозидазы (Stinchi et al. Hum Mol Genet, 8:1366-72, 1999). Как и у людей, альфа-маннозидоз, по-видимому, вызван специфическими мутациями в гене, кодирующем лизосомальную альфа-маннозидазу. Berg и соавт. (Biochem J., 328:863-870, 1997) описали очистку лизосомальной альфа-маннозидазы кошачьей печени и определение последовательности ее кДНК. Активный фермент состоит из 3 полипептидов с молекулярными массами, как было сообщено, 72, 41 и 12 кДа. По аналогии с человеческим ферментом было показано, что кошачий фермент синтезируется в виде одноцепочечного предшественника с предполагаемым сигнальным пептидом из 50 аминокислот, за которым следует полипептидная цепь из 957 аминокислот, которая расщепляется на 3 полипептида зрелого фермента. Выведенная аминокислотная последовательность была на 81,1 и 83,2% идентичной последовательностям человека и быка соответственно. Была идентифицирована делеция 4 п.о. у пораженной персидской кошки; делеция приводила к сдвигу рамки считывания с кодона 583 и преждевременной терминации на кодоне 645. Выявить активность фермента в печени кошки было невозможно. Домашняя длинношерстная кошка, экспрессирующая фенотип с более легкой формой заболевания, имела активность фермента 2% от нормальной; эта кошка не имела делеции 4 п.о. Tollersrud и соавт. (Eur. J.Biochem., 246:410-19, 1997) очистили фермент из почки быка до гомогенности и клонировали этот ген. Ген был организован в 24 экзона, которые охватывали 16 т.п.о. На основе последовательности гена они идентифицировали две мутации у крупного рогатого скота. Медицинская необходимость терапии альфа-маннозидоза. Ввиду тяжелых клинических проявлений заболевания, возникающих в результате аккумуляции богатых маннозой олигосахаридов, хорошо известно отсутствие эффективного лечения альфа-маннозидоза. На сегодняшний день основным возможным методом лечения данного заболевания является трансплантация костного мозга, однако целью настоящего изобретения является добиться дальнейшего развития ферментозаместительной терапии как потенциальной будущей альтернативы. Трансплантация костного мозга. В 1996 Walkley и соавт. (Proc. Nat. Acad. Sci., 91:2970-2974, 1994) опубликовали статью о 3 котятах с маннозидозом, которых лечили трансплантацией костного мозга (ВМТ) в 1991. У 2 животных, которых умертвили, была видна нормализация не только в отношении тела, но, что более важно, также в мозге. Третья кошка чувствовала себя хорошо после 6 лет. В норме, кошка без лечения умирает за 3-6 месяцев. В 1987 ребенка с маннозидозом лечили с применением ВМТ (Will et al. Arch Dis Child, 1987 Oct; 62(10):1044-9). Он умер спустя 18 недель из-за осложнений, связанных с процедурой. Была обнаружена очень малая активность фермента в мозге. Этот разочаровывающий результат можно объяснить тяжелой иммуносупрессивной терапией перед смертью или тем, что требуется время для повышения активности фермента в мозге после ВМТ. Донором была мать (которая, как следовало ожидать, как носитель имела активность фермента менее 50%), или, возможно, ВМТ у человека не влияет на функционирование фермента в мозге. Несмотря на наличие переменных результатов, несколько попыток трансплантации костного мозга, таким образом, показали, что успешное приживление трансплантата может корректировать клинические проявления альфа-маннозидоза, по меньшей мере, частично. Однако проблему сокращения серьезных связанных с процедурой осложнений при применении трансплантации костного мозга в терапии у человека еще предстоит преодолеть. Ферментозаместительная терапия. Когда были открыты заболевания лизосомального накопления, появились надежды, что их можно лечить с помощью замещения фермента. Ферментозаместительная терапия оказалась эффективной при болезни Гоше. Если пациенту вводят инъекцией экзогенную лизосомальную глюкоцереброзидазу, этот фермент поглощается клетками с недостаточностью фермента (Barton et al. N. Engl. J. Med., 324:14641470). Такое поглощение регулируется определенными рецепторами на поверхности клетки, таким рецептором маннозо-6-фосфата, который практически повсеместно встречается на поверхности клеток, и другими рецепторами, такими как асиалогликопротеиновый рецептор и маннозный рецептор, которые ограничены определенными типами клеток, такими как клетки моноцитарно-макрофагальной клеточной линии и гепатоциты. Поглощение фермента клеткой, таким образом, сильно зависит от его профиля гликозилирования. При надлежащем планировании дефектный фермент можно было бы заменить с помощью регулярных инъекций экзогенного фермента тем же образом, как пациенты с сахарным диабетом получают инсулин. Исследования in vitro с очищенной активной лизосомальной альфа-маннозидазой,-2 022220 добавленной в питательные среды фибробластов с недостаточностью фермента, выявили коррекцию аккумуляции лизосомального субстрата. Лечение in vivo, с другой стороны, было затруднено частично проблемами получения достаточного количества ферментов, вследствие сложных процедур крупномасштабного получения и очистки и осложнениями, возникающими в результате иммунных реакций на экзогенный фермент. Наиболее важно, однако, особые соображения применяют в отношении болезней лизосомального накопления с главным неврологическим компонентом, таких как альфа-маннозидоз, где клинические проявления связаны с повышенным лизосомальным отложением в пределах центральной нервной системы. Таким образом, ферментозаместительная терапия не доказала свою эффективность против острого нейропатического варианта болезни Гоше (Prows et al. Am J. Med. Genet., 71:16-21). Доставке терапевтических ферментов в мозг препятствует отсутствие транспорта этих больших молекул через гематоэнцефалический барьер. Исходя из общепринятых представлений, что гематоэнцефалический барьер необходимо обойти для того, чтобы увидеть эффект терапевтических средств в мозге,было рассмотрено применение ряда разнообразных систем доставки. Они включают инвазивные методики, такие как осмотическое открытие гематоэнцефалического барьера с помощью, например, маннита, и неинвазивные методики, такие как рецептор-опосредованный эндоцитоз химерных ферментов. Поскольку, как ожидается, для замещения фермента необходимо регулярное введение фермента, применения инвазивных методик следует избегать. Применение неинвазивных методик только недавно обеспечило многообещающие результаты в экспериментальных моделях на животных (для альфа-маннозидоза смотри ниже, для других лизосомальных болезней смотри, например, Grubb et al. PNAS, 2008, 105(7) p. 26162621). Предполагалось, что уменьшенное накопление во внутренних органах и в оболочках головного мозга может уменьшить количество олигосахаридов, которые переносятся в мозг. Такие соображения,однако, не считаются применимыми в отношении лизосомальных болезней, при которых неврологическое повреждение является первичным и тяжелым (Neufeld, Е.F. Enzyme replacement therapy, в "Lysosomal disorders of the brain" (Platt, F.M. Walkley, S.V: eds Oxford University Press). Однако, как описано в Roces et al. Human Molecular Genetics, 2004, 13(18), p. 1979-1988, Blanz et al.Human Molecular Genetics, 2008, 17(22), p. 3437-3445 и документе WO 05/094874, была доказана возможность увеличения уровней LAMAN в центральной нервной системе животных с применением, например,внутривенной инъекции состава, включающего альфа-маннозидазу, тем самым снижая внутриклеточные уровни нейтральных богатых маннозой олигосахаридов в пределах одной или нескольких областей центральной нервной системы. Это показывает, что рекомбинантная альфа-маннозидаза является пригодной при ферментозаместительной терапии пациентов, страдающих от альфа-маннозидоза. Таким образом,одним главным оставшимся препятствием на пути обеспечения эффективного лечения альфаманнозидоза с применением замещения фермента является обеспечение достаточных количеств чистой рекомбинантной альфа-маннозидазы экономически эффективным способом. Получение и очистка альфа-маннозидазы. Документ WO 02/099092 раскрывает способ мелкомасштабного получения rhLAMAN в СНО клетках с применением бессывороточной питательной среды при 37 С. Также описан способ мелкомасштабной очистки, включающий диафильтрацию неочищенного фермента и слабую ионообменную хроматографию со слабыми анионообменниками с применением DEAE-сефарозных FF колонок на этапе захвата с последующим рядом этапов хроматографической очистки, включая хроматографию гидрофобных взаимодействий и хроматографию на наполнителях смешанного типа. Документ WO 05/094874 раскрывает способ мелкомасштабного получения rhLAMAN в клетках яичника китайского хомячка (СНО) с применением бессывороточной питательной среды при 37 С. Также описывается способ мелкомасштабного получения, аналогичный таковому из документа WO 02/099092. Документ WO 05/077093 описывает производство сильно фосфорилированных лизосомальных ферментов. В примере IV описан способ очистки для кислой альфа-глюкозидазы (GAA) с помощью мультимодальной смолы (голубая сефароза). GAA, хотя и является лизосомальным ферментом, полностью отличается от rhLAMAN. GAA является сильно фосфорилированной, тогда как rhLAMAN имеет низкую степень фосфорилирования. Более того, оценка идентичности последовательностей между GAA и rhLAMAN составляет менее 12%, и, наконец, их теоретические изоэлектрические точки отличаются более чем на одну единицу рН (5,42 и 6,48 соответственно). Таким образом, способ, который описан в документе WO 05/077093 для очистки GAA, не применим для rhLAMAN. Был раскрыт способ мелкомасштабного получения для rhLAMAN в СНО клетках с применением 0,25% (об./об.) сыворотки и добавлением ДМСО (Berg et al. Molecular Genetics and Metabolism, 73, p. 1829, 2001). В нем также описываются два способа очистки, включающие а) трехэтапную процедуру,включающую ультрафильтрацию, анионообменную хроматографию и гель-фильтрацию; или b) одноэтапную иммуноаффинную хроматографию. Дополнительно раскрыто, как способ а) приводит в результате к полной фрагментации 130 кДа фермента на фрагменты 55 и 72 кДа, тогда как способ b) приводит в результате к частичной фрагментации 130 кДа предшественника на значительное количество 55 и 72 кДа фрагментов. Следовательно, улучшенный способ получения и очистки рекомбинантной альфа-3 022220 маннозидазы был бы преимущественным. В частности, улучшенный способ крупномасштабного культивирования клеточной линии, способной экспрессировать альфа-маннозидазу, и более эффективный способ крупномасштабной очистки для выделения чистой альфа-маннозидазы с высокой ферментативной активностью из культуры клеток будут преимущественными. Краткое описание изобретения Таким образом, цель настоящего изобретения относится к способу получения и очистки рекомбинантной альфа-маннозидазы. В частности, целью настоящего изобретения является обеспечение масштабируемого способа получения и очистки, который решает вышеупомянутые задачи известного уровня техники путем обеспечения достаточных количеств альфа-маннозидазы высокой чистоты с высокой ферментативной активностью, таким образом обеспечивая лечение пациентов, страдающих от альфа-маннозидоза. Таким образом, один аспект настоящего изобретения относится к способу очистки рекомбинантной альфа-маннозидазы из культуры клеток, где фракцию указанной культуры клеток, включающую рекомбинантную альфа-маннозидазу, подвергают хроматографии на смоле, включающей мультимодальный лиганд. Неожиданно было обнаружено, что данный способ очистки давал в результате композицию,включающую рекомбинантную альфа-маннозидазу с более высокой степенью чистоты и более высокой долей желаемой 130 кДа разновидности гликопротеина, чем ранее было достигнуто. Достижение постоянных высоких долей (таких как более чем 80%) нефрагментированного 130 кДа гликопротеина после очистки является преимущественным, так как это обеспечивает более однородный продукт по сравнению с фрагментированным ферментом, что, в свою очередь, повышает возможность получения фармацевтического качественного продукта. Другой аспект настоящего изобретения относится к способу периодического или непрерывного получения рекомбинантной альфа-маннозидазы, включающему следующие стадии, на которых:a) инокулируют промышленный реактор, включающий основную среду, клетками, способными продуцировать рекомбинантную альфа-маннозидазу, в день 0 с получением культуры клеток;b) добавляют питательную среду к указанной культуре клеток по меньшей мере один раз от дня 1;c) корректируют температуру указанной культуры клеток до самое большее 35 С, как, например,34, 33, 32 С, предпочтительно самое большее 31 С, либо после дня 3, либо когда плотность жизнеспособных клеток будет выше 2,1 млн жизнеспособных клеток/мл, в зависимости от того, что наступит раньше. Неожиданно было обнаружено, что вышеупомянутый способ получения давал в результате культуру клеток, включающую рекомбинантную альфа-маннозидазу с высокими выходами, которая была легко переносимой в колонку очистки настоящего изобретения без какого-либо разведения. Еще один другой аспект настоящего изобретения заключается в обеспечении композиции, включающей очищенную рекомбинантную альфа-маннозидазу, где по меньшей мере 80% альфа-маннозидазы присутствует в качестве 130 кДа гликопротеина. Еще один аспект настоящего изобретения представляет собой композицию, включающую очищенную рекомбинантную альфа-маннозидазу, для применения при лечении альфа-маннозидоза. Еще один другой аспект настоящего изобретения представляет собой способ лечения альфаманнозидоза и/или уменьшения или облегчения симптомов, связанных с альфа-маннозидозом, причем указанный способ включает стадию введения композиции, включающей очищенную рекомбинантную альфа-маннозидазу, субъекту, нуждающемуся в этом. Краткое описание фигур На фиг. 1 показаны основные принципы предпочтительной в настоящее время схемы способа очистки альфа-маннозидазы от сбора до регистрации лекарственного средства; на фиг. 2 показан пример хроматограммы на колонке Capto MMC для альфа-маннозидазы; на фиг. 3 показан пример хроматограммы на колонке butyl Sepharose FF для альфа-маннозидазы; на фиг. 4 показан пример хроматограммы на колонке СНТ типа 1 для альфа-маннозидазы; на фиг. 5 показан пример хроматограммы на колонке Q Sepharose HP для альфа-маннозидазы; на фиг. 6 показана SDS-page хроматограмма композиции очищенной альфа-маннозидазы с указанием распределения 130, 75 и 55 кДа разновидностей гликопротеина; на фиг. 7 показаны три HPLC графика для очищенной альфа-маннозидазы, где количество 130 кДа разновидности изображено в сравнении с 55 и 75 кДа разновидностями. Первый пик слева представляет собой 55 кДа разновидность, за ним следуют 130 и 75 кДа разновидности соответственно. 2-этапный способ происходит без применения этапа хроматографии с мультимодальным лигандом, между тем как в 3 и 4-этапных способах применяют этап хроматографии с мультимодальным лигандом. Настоящее изобретение будет теперь более детально описано в следующих разделах. Детальное описание настоящего изобретения Определения. Перед обсуждением настоящего изобретения более детально сначала будут определены следующие термины и условные обозначения. Рекомбинантная альфа-маннозидаза В контексте настоящего изобретения рекомбинантную альфа-маннозидазу определяют как альфаманнозидазу, которая в силу ее происхождения или манипуляции не является одинаковой по отношению ко всем или части альфа-маннозидаз дикого типа, обнаруживаемым в природе. Таким образом, она сконструирована с применением рекомбинантных техник, которые вовлекают молекулы рекомбинантной ДНК, то есть гибридные последовательности ДНК, включающие по меньшей мере две последовательности гибридной ДНК, причем первая последовательность в норме в природе не гибридизована со второй последовательностью. Белок рекомбинантной альфа-маннозидазы может быть человеческого или нечеловеческого происхождения. В частности, это может быть рекомбинантная лизосомальная альфаманнозидаза (rhLAMAN) человека. Продукт-альфа-маннозидаза может представлять собой одиночный полипептид или смесь одиночного полипептида и его фракций. Альфа-маннозидаза также может подвергаться посттрансляционным модификациям и может, таким образом, находится в форме гликопротеина. Культивирование клеток. Культивирование клеток представляет собой процесс, с помощью которого клетки выращивают в контролируемых условиях. В данном контексте клетки, полученные в результате культивирования клеток, специально сконструированы для экспрессии представляющего интерес белка, такого как рекомбинантная альфа-маннозидаза. Культивирование клеток может происходить в биореакторе, который специально разработан, для того чтобы позволить контроль химических и физических условий. Фракция. В данном контексте фракция относится к фракции культуры клеток. Фракция может составлять цельную культуру клеток, но зачастую представляет собой обработанную фракцию культуры, такую как очищенная, отфильтрованная, концентрированная, разведенная или частично очищенная фракция. Смола. В контексте настоящего изобретения смола составляет основу стационарной фазы в хроматографической системе, на которую присоединены различные химические группы или вещества для обеспечения определенной степени сродства для данной молекулы или представляющего интерес белка. Смолы часто представляют собой полимерные гранулы с ковалентно присоединенными лигандами, причем указанные смолы являются нерастворимыми в применяемых жидких мобильных фазах. Мультимодальные лиганды. Под мультимодальным лигандом подразумевают любой лиганд, который сконструирован для взаимодействия с молекулой или интересующим белком по меньшей мере двумя способами. Отдельные взаимодействия могут независимо представлять собой гидрофобные, гидрофильные, ионные, Ван-дерВаальсовы взаимодействия, водородные связи или любое другое межмолекулярное химическое или физическое взаимодействие. В данном контексте лигандом является органическое химическое вещество,присоединенное к смоле, как определено выше. Мультимодальный лиганд будет иметь разные степени сродства к разным веществам, растворенным в мобильной фазе, которые пропускают через хроматографическую колонку. Различия в степени сродства приводят к изменениям во времени удержания разных веществ на хроматографической колонке, делая возможным разделение веществ. Время удержания также зависит от других факторов, таких как, например, компоненты мобильной фазы, рН и температура. Смолы, включающие мультимодальные лиганды, иногда называют также смолами "смешанного действия",но в данном контексте смолы, включающие мультимодальный лиганд, не следует путать с так называемыми "ионообменными смолами смешанного действия", которые включают несколько разных "лигандов" на одной смоле, которые могут иметь противоположные заряды, такие как, например, -ОН, -Са+ и РО 42- в случае смолы керамического гидроксиапатита (СНТ). В этих смолах отдельные лиганды не являются мультимодальными. Загрузка. В данном контексте загрузка относится к переносу сбора, элюата или другого раствора на хроматографическую систему, такую как хроматографическая колонка, включающая смолу в качестве стационарной фазы. Буфер. Термин "буфер" хорошо известен в качестве общего описания раствора, содержащего либо слабую кислоту и/или ее соответствующую соль, либо слабое основание и/или его соответствующую соль, который устойчив к изменениям рН. В контексте настоящего изобретения применяемые буферы являются подходящими для применения в хроматографических системах, такие буферы включают, но без ограничений: фосфатные буферы, например, гидрофосфат натрия (Na2HPO4), фосфат натрия или фосфат калия,ацетатные буферы, например, ацетат натрия или ацетат калия, сульфатные буферы, например, сульфат натрия или сульфат калия, сульфат аммония или Hepes, или другие буферы, например, борат натрия или трис-HCl буфер. Ультрафильтрация. Ультрафильтрация представляет собой способ разделения, в котором применяют гидравлическое давление для принудительного продвижения молекул и растворителя через мембрану, включающую поры определенного размера, также известного как пороговый размер или значение. Только молекулы, которые имеют молекулярную массу меньше порогового значения мембраны, способны пересекать мембрану, в то время как молекулы с большей молекулярной массой не пересекают мембрану и образуют так называемый ретентат. Молекулы, присутствующие в ретентате, можно таким образом концентрировать,по мере того как растворитель проникает через мембрану. В отдельных вариантах осуществления концентрирование раствора или композиции, включающей полипептид, такой как альфа-маннозидаза, может быть выполнено посредством тангенциальной поточной фильтрации (TFF). Этот способ является, в частности, пригодным для крупномасштабного концентрирования, т.е. для концентрирования растворов с объемом от 1 л до нескольких сотен литров. Таким образом, данный способ является, в частности, пригодным для получения концентрированных растворов представляющего интерес полипептида в промышленном масштабе. Методика TFF основана на применении особого устройства, которое заставляет раствор, который следует отфильтровать, протекать через полупроницаемую мембрану; только молекулы, меньшие, чем поры мембраны, пройдут через мембрану, образуя фильтрат, оставляя большее количество материала для сбора (ретентат). В TFF способе прилагают два разных давления; одно для закачивания раствора в систему и для его циркуляции в системе (давление на входе) и другое давление прилагают через мембрану(мембранное давление) для принудительного продвижения малых молекул и растворителя через мембрану. Давление на входе, как правило, может находиться в диапазоне 1-3 бар, как, например, 1,5-2 бар. Трансмембранное давление (ТМР), как правило, может составлять более 1 бар. Концентрированная композиция представляющего интерес полипептида может быть собрана в виде ретентата, если для концентрирования композиции применяют TFF. Мембраны, пригодные для TFF, как правило, могут быть выполнены из регенерированной целлюлозы или полиэфирсульфона (PES). Диафильтрация. В данном контексте диафильтрация представляет собой способ фильтрации, где представляющая интерес разновидность присутствует в ретентате, т.е. она не может пройти через фильтр, в то время как другие компоненты, такие как, например, буферы и соли, все-таки проходят через фильтр. Таким образом, диафильтрацию можно, например, применять для замены одного буфера другим или для концентрирования растворов, содержащих представляющую интерес разновидность, такую как рекомбинантная альфа-маннозидаза. Первым аспектом настоящего изобретения является обеспечение способа очистки рекомбинантной альфа-маннозидазы из культуры клеток, где фракцию указанной культуры клеток, включающую рекомбинантную альфа-маннозидазу, подвергают хроматографии на смоле, включающей мультимодальный лиганд. Преимуществом применения смол, включающих мультимодальный лиганд, в данном контексте является то, что эти смолы позволяют связывание альфа-маннозидазной разновидности в растворах с высокими уровнями проводимости. Это имеет то преимущество, что можно применять неразбавленный сбор с высокими уровнями проводимости, и нет необходимости заменять буфер для сбора. Этап хроматографии, включающий мультимодальный лиганд, может, таким образом, предпочтительно являться первым этапом хроматографии после выделения фракции из культуры клеток. Указанный этап хроматографии, включающий мультимодальный лиганд, могут часто называть "этапом захвата", поскольку представляющий интерес белок первоначально удерживается на колонке (т.е. захвачен), в то время как многие примеси проходят через колонку в течение этапов отмывки. Белок впоследствии элюируют с применением специфического элюирующего буфера. Таким образом, в одном варианте осуществления настоящего изобретения приведен способ, где фракция культуры клеток, включающая рекомбинантную альфа-маннозидазу, представляет собой очищенный неразбавленный сбор. В контексте настоящего изобретения термин "очищенный неразбавленный сбор" означает сбор культуры клеток, не содержащий нерастворенный материал или твердые частицы, т.е. он представляет собой прозрачный раствор. Сбор мог быть подвергнут обработке для превращения его в прозрачный раствор. Такие обработки могут включать, но без ограничений: фильтрацию и центрифугирование. Кроме того, сбор не подвергают значительному разбавлению перед проведением этапов хроматографии. Следовательно, сбор разбавляют менее чем на 10%, как, например, менее чем на 7%,менее чем на 5%, менее чем на 2%, менее чем на 1%, менее чем на 0,5%, как, например, менее чем 0,1%. В наиболее предпочтительных вариантах осуществления сбор не разбавляют. В другом варианте осуществления приведен способ, где осветленный неразбавленный сбор имеет проводимость 10-20 мСм/см, такую как 12-17 мСм/см, предпочтительно 15 мСм/см. Проводимость измеряют до загрузки сбора на хроматографическую систему. В одном варианте осуществления указанную хроматографию осуществляют на смоле, включающей мультимодальный лиганд с группой карбоновой кислоты или сульфоновой кислоты. Карбоновые и/или сульфоновые кислоты, входящие в состав этих лигандов, могут находиться в протонированной форме или в депротонированной (соль) форме, в зависимости от условий в хроматографической системе, осо-6 022220 бенно рН мобильной фазы. В еще одном, другом варианте осуществления приведен способ, где мультимодальный лиганд, связанный со смолой, представляет собой вещество формул (I), (II) или (III) где R веществ формул (II) и (III) представляет собой функциональную группу формулы (IV) Мультимодальный лиганд, представленный функциональной группой формулы (IV), обычно называют "Cibracon Blue 3G", и примерами коммерческих продуктов, представленных веществами формул(I), (II) и (III), являются "Capto MMC", "Capto Blue" и "Blue sepharose fast flow" соответственно. Другие пригодные смолы мультимодального типа включают Capto Adhere, МЕР HyperCel, НЕА HyperCel и РРА HyperCel. В контексте настоящего изобретения такие смолы оказались особенно эффективными в первоначальной очистке неразбавленного сбора, включающего рекомбинантную альфаманнозидазу. Дополнительный вариант осуществления настоящего изобретения обеспечивает способ, где фракцию указанной культуры клеток, загруженную на смолу, включающую мультимодальный лиганд, подвергают по меньшей мере одному этапу отмывки раствором, включающим изопропанол, предпочтительно по меньшей мере 1% (об./об.) изопропанол, такой как по меньшей мере 2, 3, 4, 4,5% (об./об.) изопропанол, предпочтительно по меньшей мере 5% (об./об.) изопропанол. Преимуществом применения раствора, включающего изопропанол, является то, что он обеспечивает лучшее удаление нежелательных белков клетки-хозяина (НСР), особенно это помогает удалить протеазу, отвечающую за протеолитическое расщепление желаемой 130 кДа разновидности rhLAMAN. НСР следует понимать как белки, эндогенные по отношению к клетке-хозяину, применяемой в культуре клеток в ходе получения. Хотя изопропанол является предпочтительным, другие пригодные спирты для данного способа включают этанол, нпропанол и н-бутанол. В еще одном, другом варианте осуществления приведен способ, где рН раствора, применяемого для этапа отмывки, находится в диапазоне рН 3,5-6,5, таком как рН 4,0-6,0, рН 4,5-5,5, предпочтительно рН 4,7-5,0. Другой вариант осуществления обеспечивает способ, где раствор, применяемый для этапа отмывки,включает ацетатный буфер предпочтительно в концентрации в диапазоне 0,05-1,6 М, таком как 0,1-1,5 М, 0,5-1,4 М, 0,7-1,3 М, 0,8-1,2 М, 0,9-1,1 М, предпочтительно 0,95 М. Ацетатный буфер можно предпочтительно выбрать из группы, включающей ацетат натрия, ацетат калия, ацетат лития, ацетат аммония. Другой еще вариант осуществления обеспечивает способ, где первый элюат, включающий рекомбинантную альфа-маннозидазу, элюируют из смолы, включающей мультимодальный лиганд, с помощью водного раствора, включающего этиленгликоль или пропиленгликоль. Добавление этиленгликоля к элюирующему буферу, как было обнаружено, значительно повышает выход элюируемой рекомбинантной альфа-маннозидазы. Пропиленгликоль также повышал выход, но этиленгликоль является предпочтительным. Один вариант осуществления обеспечивает способ, где концентрация этиленгликоля или пропиленгликоля в водном растворе составляет 20-60, 20-50, 25-50, 30-50, 35-45%, как, например, 40%. В предпочтительном варианте осуществления приведен способ, где водный раствор, включающий этиленгликоль или пропиленгликоль, включает хлорид натрия. Добавление хлорида натрия к данному раствору, как было обнаружено, значительно повышает выходы, способствуя элюированию ферментаrhLAMAN. В другом варианте осуществления концентрация хлорида натрия в водном растворе, включающем этиленгликоль или пропиленгликоль, находится в диапазоне от 0,2 до 2,4 М, как, например, в диапазоне от 0,4 до 2,2 М, от 0,6 до 2,0 М, от 0,8 до 1,9 М, от 1,0 до 1,8 М, от 1,2 до 1,7 М, от 1,4 до 1,6 М, предпочтительно 1,5 М. Альтернативно, концентрация хлорида натрия может находиться в диапазоне от 0,2 до 1,6 М или в диапазоне от 1,4 до 2,4 М. В предпочтительном варианте осуществления водный раствор, включающий этиленгликоль или пропиленгликоль, включает буфер. Указанный буфер может предпочтительно являться фосфатным буфером, таким как фосфат натрия или фосфат калия. Хотя фосфатные буферы являются предпочтительными, дополнительные пригодные буферы для водного раствора включают цитратные и боратные буферы, Трис, MES, MOPS и Hepes буферы. В другом предпочтительном варианте осуществления концентрация буферных солей в водном растворе, включающем этиленгликоль или пропиленгликоль, составляет 50-350, 55-300, 65-2800, 70-250, 75200, 80-200, 85-150, предпочтительно 90 мМ. В еще другом предпочтительном варианте осуществления рН водного раствора, включающего этиленгликоль или пропиленгликоль, составляет рН 7,0-9,0, такой как рН 7,1-8,5, рН 7,2-8,3, рН 7,5-8,0,предпочтительно рН 7,7. В одном варианте осуществления приведен способ, где первый элюат, включающий альфаманнозидазу, полученную со смолы, включающей мультимодальный лиганд, дополнительно подвергают способу, включающему этапы, на которых:i) наносят фракцию, включающую альфа-маннозидазу, на смолу для хроматографии с гидрофобным взаимодействием с получением элюата, включающего рекомбинантную альфа-маннозидазу;ii) пропускают фракцию, включающую альфа-маннозидазу, через ионообменную смолу смешанного действия для удерживания загрязняющих примесей с получением фильтрата, включающего рекомбинантную альфа-маннозидазу;iii) подвергают фракцию, включающую альфа-маннозидазу, хроматографии на анионообменной смоле с получением элюата, включающего рекомбинантную альфа-маннозидазу. В одном варианте осуществления приведен способ, включающий этапы i)-iii), как описано выше,где фракцию этапа i) подвергли очистке на указанной смоле, включающей мультимодальный лиганд,фракцию этапа ii) получают из элюата из этапа i) и фракцию этапа iii) получают из фильтрата из этапа ii). Другими словами, этапы i)-iii) выполняют в том порядке, в котором они перечислены, однако без исключения промежуточных этапов между этапами i)-iii). Они могут представлять собой этапы промежуточной очистки и/или этапы снижения количества вируса или удаления вируса. В предпочтительном варианте осуществления смола для хроматографии гидрофобного взаимодействия этапа i) представляет собой алкилзамещенную смолу, предпочтительно бутилсефарозную смолу. Алкилзамещенные смолы могут включать этил-, бутил- и октилсефарозные смолы. Кроме того, также применимы фенилсефарозные смолы. Примерами таких смол являются Butyl-S Sepharose 6 Fast Flow,Butyl Sepharose 4 Fast Flow, Octyl Sepharose 4 Fast Flow, Phenyl Sepharose 6 Fast Flow (high sub) иPerformance. Преимуществом этапа очистки, задействующего гидрофобно взаимодействующие смолы, и особенно бутилсефарозную смолу, является эффективное удаление белков клетки-хозяина и остатков ДНК, в то время как сохраняется хороший выход фермента rhLAMAN. В еще другом варианте осуществления этап i) включает по меньшей мере один этап отмывки, где применяемый для отмывки раствор включает фосфатный буфер и ацетатный буфер, предпочтительно фосфат натрия и ацетат натрия. Этот этап отмывки двойным буфером оказался особенно эффективным при удалении примесей, таких как белки клетки-хозяина и остатки ДНК. В еще другом варианте осуществления концентрация фосфатного буфера при отмывке двойным буфером этапа i) находится в диапазоне 5-40 мМ, таком как 10-30, 15-25, предпочтительно 20 мМ, и концентрация ацетатного буфера находится в диапазоне 0,9-1,5 М, таком как 1,0-1,4, 1,1-1,3, предпочтительно 1,2 М. В другом варианте осуществления этап i) включает по меньшей мере один этап отмывки, где применяемый для отмывки раствор включает не более одного буфера, предпочтительно фосфатный буфер,предпочтительно фосфат натрия. В другом варианте осуществления один буфер по меньшей мере одного этапа отмывки, включающий не более одного буфера, присутствует в концентрации в диапазоне 0,4-0,8 М, таком как 0,5-0,7 М,предпочтительно 0,6 М. В одном варианте осуществления приведен способ, где ионообменная смола смешанного действия этапа iii) представляет собой смолу на основе керамического гидроксиапатита или фтороапатита, пред-8 022220 почтительно смолу на основе керамического гидроксиапатита типа I (CHT I). Применение этого этапа хроматографии, как было показано, эффективно отделяет значительное количество ДНК-примесей от композиции рекомбинантной альфа-маннозидазы и связывает белки клетки-хозяина, в то время как ферментный продукт rhLAMAN проходит колонку без связывания. В другом варианте осуществления анионообменная смола этапа iii) представляет собой сильную анионообменную смолу, такую как сильная анионообменная смола на основе четвертичного аммония. Такие смолы включены в следующие примеры: Q-sepharose HP, Q-sepharose FF, DEAE-sepharose,Capto Q, Uno Q, ANX sepharose, но не ограничиваются ими. В еще другом варианте осуществления приведен способ, где выполняют этап инактивации вируса,предпочтительно между этапом ii) и этапом iii). В предпочтительном варианте осуществления этап инактивации вируса включает смешивание фильтрата этапа ii) с водным раствором изопропанола (1:1 об./об. фильтрат/водный изопропанол) в течение по меньшей мере 2 ч, предпочтительно с последующим концентрированием ультрафильтрацией и удалением изопропанола с помощью диафильтрации. Водный изопропанол во время инактивации может находиться в диапазоне 10-50% изопропанола, таком как 20-40, 25-35, 28-32, предпочтительно 30% изопропанола. Раствор 1:1 об./об. фильтрата и водного изопропанола, таким образом, имеет конечную концентрацию изопропанола 15%. Другой предпочтительный вариант осуществления представляет собой способ, где выполняют этап снижения количества вируса, предпочтительно после этапа хроматографии iii). В одном варианте осуществления этап снижения количества вируса включает фильтрацию раствора, включающего рекомбинантную альфа-маннозидазу, предпочтительно элюат этапа iii), через фильтр,предпочтительно фильтр для удаления вируса, такой как фильтр ultipor VF grade DV20 или фильтр planova 15N или 20N, предпочтительно применяют фильтр Planova 15N. Способ очистки по настоящему изобретению можно преимущественно выполнять в крупном масштабе, таким образом в предпочтительных вариантах осуществления способ выполняют на хроматографических колонках с объемом колонки по меньшей мере 0,5 л, таким как по меньшей мере 1,0, 2,0, 5,0,10 л, предпочтительно по меньшей мере 13,0 л. В другом варианте осуществления настоящего изобретения приведен способ очистки, как описано выше, где альфа-маннозидаза имеет последовательность, выбранную из:C) подпоследовательности последовательности в А) или В). Где последовательность, описанная посредством SEQ ID NO: 2, представляет аминокислотную последовательность рекомбинантной лизосомальной альфа-маннозидазы человека (rhLAMAN), приведенную в документе WO 02/099092. Под "подпоследовательностью" подразумевают фрагмент исходной последовательности с размером не менее 50% от исходной последовательности, таким как не менее 55, 60, 65, 70, 75, 80, 85, 90 или не менее 95% от исходной последовательности. Соответственно подпоследовательности, о которых идет речь, могут иметь длину от 505 до 1009 идущих подряд аминокислотных остатков, такую как от 525 до 1009, от 550 до 1009, от 575 до 1009, от 600 до 1009, от 625 до 1009, от 650 до 1009, от 675 до 1009, от 700 до 1009, от 725 до 1009, от 750 до 1009, от 775 до 1009, от 800 до 1009, от 825 до 1009, от 850 до 1009, от 875 до 1009, от 900 до 1009, от 925 до 1009, от 950 до 1009, от 975 до 1009, от 980 до 1009, от 990 до 1009 или такую как от 1000 до 1009 идущих подряд аминокислотных остатков. Кроме того, релевантные подпоследовательности SEQ ID NO: 2 или их аналоги должны сохранять каталитический участок. Хотя трехмерная структура LAMAN человека неизвестна, трехмерная структура LAMAN быка была опубликована, и на основании тех данных был сделан вывод, что следующие аминокислоты участвуют в образовании активного центра, и/или отвечают за координирование Zn2+ атома, необходимого для активности также LAMAN человека: АК 72=Н, АК 74=D, АК 196=D, АК 446=Н (база данных UniProtKB/Swiss-Prot: 000754, MA2B1HUMAN, Heikinheimo et al. J. Mol. Biol., 327, 631-644, 2003). Было показано, что мутации в АК 72 и 196 в LAMAN человека приводят к почти полной потере ферментативной активности (Hansen et al., Biochem. J., (2004), 381, p. 537-567). Для того чтобы проявлять активность,подпоследовательность белка rhLAMAN должна сохранять, по меньшей мере, участки, содержащие четыре вышеупомянутые аминокислоты. Предпочтительно подпоследовательности rhLAMAN также включают одну или несколько дополнительных конформационных частей, включая, например, сайты связывания, бета-изгибы, дисульфидные мостики, стоп-кодоны и другие. У формы LAMAN человека существует несколько вызывающих заболеваний мутаций, указывающих на важность данной конкретной аминокислоты, например, АК 53,72, 77, 188, 200, 355, 356, 359, 402, 453, 461, 518, 563, 639, 714, 750, 760, 801, 809, 916 (The human genemutation database, HMDG professional, Cardiff University, 2009), и существуют также аминокислоты,которые представляют важность для гликозилирований, включая АК 133, 310, 367, 497, 645, 651, 692,766, 832, 930 и 989, и аминокислоты, вовлеченные в образование дисульфидных мостиков, такие как АК 55+358, 268+273, 412+472 и 493+501. Под "аналогом" подразумевают последовательность с определенным процентом идентичности последовательности с исходной последовательностью, это может быть по меньшей мере 60% идентичности последовательности, как, например, по меньшей мере 70, 80, 85, 90, 95, 98 или предпочтительно 99% идентичности последовательности. Будет понятно, что аналоги и подпоследовательности, изложенные выше, являются предпочтительно функционально эквивалентными альфа-маннозидазе с аминокислотной последовательностью, изложенной в SEQ ID NO: 2, в том смысле, что они способны проявлять, по существу, такую же ферментативную активность. Термин "по существу, такая же ферментативная активность" относится к эквивалентной части или аналогу по меньшей мере с 50%, предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%,более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% активностью природного фермента. Примером функционально эквивалентного аналога фермента может быть химерный белок, который включает каталитический участок фермента в функциональной форме, но он также может представлять собой гомологичный вариант фермента, полученного из другого вида. Также полностью искусственные молекулы, которые имитируют специфическую ферментативную активность соответственного фермента, будут составлять"функционально эквивалентные аналоги". Не свойственные человеку аналоги LAMAN обычно не применимы для терапии, так как они могут потенциально индуцировать образование антител в организме пациента и вызывать заболевание. Свойственные человеку аналоги, однако, могут быть пригодными в ферментозаместительной терапии, если мутации не вызывают заболевание и значительно не ослабляют желаемую активность фермента. Примерами таких мутаций являются His70Leu, Gln240Arg, Ser250Ala,Leu278Val, Ser282Pro, Thr312Ile, Ala337Arg, Ser413Asn, Ser481Ala, Gln582Glu, Arg741Glu, Thr873Pro(источник: http://www.ensembl.org; ID транскрипта ENST00000456935). Также Pro669Leu и Asp402Lys,как известно настоящим изобретателям, не вызывают заболевание. В общем, специалист будет в состоянии легко разработать соответствующие анализы для определения ферментативной активности. Для LAMAN соответствующий анализ ферментативной активности раскрыт в документе WO 02/099092, с. 26, строки 8-28. Вкратце, можно выполнить следующую процедуру с целями скрининга с применением плоскодонных 96-луночных планшетов: 75 мкл 4-кратного буфера для анализа (8 мМ п-нитрофенил-альфа-D-маннопиранозида, 2 мг/мл BSA, 0,4 М Na-ацетата (рН 4,5) добавляют к 75 мкл образца или его соответствующего разведения (в 10 мМ Трис, рН 7,4, содержащем 150 мМ NaCl + 10% superblock). Планшеты инкубируют при 37 С в течение 30 мин и останавливают реакцию 75 мкл 1,8 М Na2CO3 и абсорбцию регистрируют при 405 нм на планшет-ридере. 96-луночные планшеты считывают на спектрофотометре. Специфическую активность определяют как мкмоли гидролизированного п-нитрофенил-альфа-D-маннопиранозида в мин на 1 мг белка. Обычно определяемую "идентичность" в данном документе определяют как идентичность последовательности между генами или белками на нуклеотидном или аминокислотном уровне соответственно. Таким образом, в данном контексте "идентичность последовательности" является мерой идентичности между белками на аминокислотном уровне и мерой идентичности между нуклеиновыми кислотами на нуклеотидном уровне. Идентичность белковых последовательностей можно определить путем сравнения аминокислотной последовательности в данном положении у каждой последовательности при выравнивании последовательностей. Аналогично, идентичность последовательностей нуклеиновой кислоты можно определить путем сравнения нуклеотидной последовательности в данном положении у каждой последовательности при выравнивании последовательностей. Для определения процента идентичности двух аминокислотных последовательностей или двух нуклеиновых кислот последовательности выравнивают для целей оптимального сравнения (например, гэпы можно вводить в последовательность первой аминокислотной или последовательности нуклеиновой кислоты для оптимального выравнивания со второй аминокислотной или последовательностью нуклеиновой кислоты). Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих аминокислотных положениях или нуклеотидных положениях. Если положение в первой последовательности занято таким же аминокислотным остатком или нуклеотидом как в соответствующем положении второй последовательности, тогда молекулы являются идентичными в данном положении. Процент идентичности между двумя последовательностями представляет собой функцию количества идентичных положений, являющихся общими для последовательностей (т.е. % идентичности = кол-во идентичных положений/общее кол-во положений (например, перекрывающиеся положения)100). В одном варианте осуществления две последовательности имеют одинаковую длину. Можно вручную выровнять последовательности и посчитать количество идентичных аминокислот. Альтернативно, выравнивание двух последовательностей для определения процента идентичности можно выполнить с применением математического алгоритма. Такой алгоритм включен в программыNBLAST, score = 100, wordlength = 12, с тем, чтобы получить нуклеотидные последовательности, гомологичные молекулам нуклеиновой кислоты настоящего изобретения. Белковые поиски BLAST можно осуществлять с помощью программы XBLAST, score = 50, wordlength = 3, с тем, чтобы получить аминокислотные последовательности, гомологичные белковой молекуле настоящего изобретения. Для получения выравниваний с гэпами для целей сравнения можно использовать Gapped BLAST. Альтернативно,можно применять PSI-Blast для осуществления поиска с итеративным углублением, который обнаруживает взаимосвязь между молекулами. При использовании программ NBLAST, XBLAST и Gapped BLAST можно применять параметры соответствующих программ по умолчанию; смотриhttp://www.ncbi.nlm.nih.gov. Альтернативно, идентичность последовательностей можно рассчитать после того, как последовательности были выровнены, например с помощью программы BLAST в базе данныхEMBL (www.ncbi.nlm.gov/cgi-bB/BLAST). В общем, для выравнивания можно применять стандартные настройки в отношении, например, "матрицы замен" и "штрафа за гэп". В контексте настоящего изобретения преимущественными могут быть стандартные настройки BLASTN и PSI BLAST. Процент идентичности между двумя последовательностями можно определить с применением методик, аналогичных описанным выше, с или без учета гэпов. При вычислении процента идентичности считают только точные совпадения. Другой вариант осуществления настоящего изобретения представляет собой композицию, включающую альфа-маннозидазу, получаемую посредством способа очистки, описанного выше. Во втором аспекте настоящего изобретения приведен способ периодического или непрерывного получения рекомбинантной альфа-маннозидазы, включающий следующие стадии, на которых:a) инокулируют промышленный реактор, включающий основную среду, клетками, способными продуцировать рекомбинантную альфа-маннозидазу, в день 0 с получением культуры клеток;b) добавляют питательную среду к указанной культуре клеток по меньшей мере один раз от дня 1;c) корректируют температуру указанной культуры клеток до самое большее 35 С, как например 34,33, 32 С, предпочтительно самое большее 31 С, либо после дня 3, либо когда плотность жизнеспособных клеток будет выше 2,1 MVC/мл, в зависимости от того, что наступит раньше. В упомянутом выше способе день инокуляции определяют как день 0 и следующий день представляет собой день 1 и так далее. Начальная температура, применяемая от дня 0 до корректировки, описанной в пункте с), находится в диапазоне 36-37 С, предпочтительно составляет 36,5 С. Следует понимать,что вышеупомянутые температуры являются действительными измеренными температурами, а не заданными значениями, т.е. в настройках биореактора, применяемых для настоящего изобретения, вышеупомянутая температура 31 С нуждалась в заданном значении температуры 32 С. Таким же образом температура 36,5 С требует температуру с заданным значением 37 С. Подходящие клетки-хозяева для экспрессии и продукции рекомбинантной альфа-маннозидазы получают из многоклеточных организмов, предпочтительно из млекопитающих. В частности, клетки, применяемые для продуцирования рекомбинантной альфа-маннозидазы, можно выбрать из группы, включающей линию клеток почки обезьяны CVI, трансформированную SV40 (COS-7); линию человеческих эмбриональных клеток почки (293 или клетки 293, субклонированные для роста в суспензионной культуре); клетки почки новорожденного хомяка (ВНК); клетки яичника китайского хомячка /-DHFR (СНО); клетки Сертоли мыши (ТМ 4); клетки почки обезьяны (CV I); клетки почки африканской зеленой мартышки (VERO-76); клетки цервикальной карциномы человека (HELA); клетки почки собаки (MDCK); клетки печени крыс Буффало (BRL 3 А); клетки легкого человека (W138); клетки печени человека (HepG2, НВ 8065); опухоль молочной железы мыши (ММТ 060562); клетки TRI; клетки MRC 5; клетки FS4 и клетки гепатомы человека (Hep G2). Линии клеток насекомых или фибробласты человека также доступны в качестве подходящих клеток-хозяев. Продуцирование рекомбинантной альфа-маннозидазы достигают с помощью клеток, трансфицированных соответствующим конструктом нуклеиновой кислоты, с применением методик, известных специалисту. В частности, конструкт нуклеиновой кислоты может включать последовательность нуклеиновой кислоты, выбранную из группы, включающей:ii) последовательность нуклеиновой кислоты, кодирующая подпоследовательность или аналог последовательности, изложенной в SEQ ID NO: 2, как представлено выше. Клетки могут предпочтительно представлять собой линию клеток яичника китайского хомячкаrLAMAN (CHO), специально разработанную с целью продуцирования рекомбинантного фермента, как описано в документе WO 02/099092. Культуру этой линии клеток, у которой DSM ACC2549, депонировали в DSMZ GmbH, Maschroderweg lb, D-38124 Braunschweig, Germany с целью патентного депонирования согласно Будапештскому договору от 6 июня 2002 г. Эту клетку можно получить с применением плазмиды экспрессии pLamanExpl с последовательностю, показанной в SEQ ID NO: 1. Способ этапов а)-с) может дополнительно включать следующий этап, на которомd) осуществляют способ очистки рекомбинантной альфа-маннозидазы из культуры клеток, где фракцию указанной культуры клеток, включающую рекомбинантную альфа-маннозидазу, подвергают хроматографии на смоле, включающей мультимодальный лиганд с группой карбоновой кислоты или группой сульфоновой кислоты, как описано выше. В еще другом варианте осуществления культура клеток, применяемая в способе получения, по существу, не содержит каких-либо добавок, полученных из животных, таких как добавки на основе рыбьего жира. Уход от применения таких добавок снижает риск вирусной контаминации конечного ферментного продукта. В одном предпочтительном варианте осуществления способа получения неразбавленный сбор из периодического или непрерывного получения имеет концентрацию альфа-маннозидазы по меньшей мере 0,1 г/л, такую как по меньшей мере 0,2, 0,3, 0,4 г/л, предпочтительно по меньшей мере 0,5 г/л. В другом варианте осуществления неразбавленный сбор из периодического или непрерывного получения имеет активность фермента в диапазоне 3-35 ед/мл, такую как 5-35, 7-35 ед/мл, предпочтительно в диапазоне 10-35 ед/мл. Следует понимать, что при дополнительной оптимизации способа активность фермента сбора может стать даже выше 35 ед/мл. Способ получения можно преимущественно осуществлять в крупном масштабе. Таким образом, в одном варианте осуществления способ периодического или непрерывного получения осуществляют в объеме по меньшей мере 30 л, таком как по меньшей мере 50, 75, 100, 150, 200 л, предпочтительно по меньшей мере 250 л. В другом варианте осуществления настоящего изобретения приведен способ получения, как описано выше, где альфа-маннозидаза имеет последовательность, выбранную из:B) аналога последовательности в А; С) подпоследовательности последовательности в А) или В). Другой вариант осуществления настоящего изобретения представляет собой композицию, включающую альфа-маннозидазу, получаемую посредством способа получения, описанного выше. Такие композиции в предпочтительных вариантах осуществления могут включать ингредиенты дополнительных активных продуктов (API), вспомогательные вещества и/или наполнители. В третьем аспекте настоящего изобретения приведена композиция, включающая очищенную рекомбинантную альфа-маннозидазу, где по меньшей мере 80% альфа-маннозидазы присутствует в качестве 130 кДа гликопротеина. В предпочтительном варианте осуществления приведена композиция, включающая очищенную рекомбинантную альфа-маннозидазу, где рекомбинантная альфа-маннозидаза остается стабильной в жидком растворе в течение по меньшей мере 4 дней при хранении при 5 С или в течение по меньшей мере 24 месяцев при хранении при -20 С. Ниже описана предпочтительная в настоящее время композиция для раствора буферного состава для ферментного продукта rhLAMAN, а также перечислены достигнутые стабильности:Na2HPO4 3,50 мМ (двухосновный фосфат натрия),NaH2PO4 0,17 мМ (одноосновный фосфат натрия),глицин 27 мМ,маннит 250 мМ,рН 7,70, 290 мОсм/кг (изотонический раствор),стабильность при использовании: стабильный раствор 5 С - 4 дня, 20 С - 6 ч, -20 С - 24 месяца,лиофилизированный 5 С - 24 месяца. В другом варианте осуществления настоящего изобретения приведена композиция, описанная выше, где альфа-маннозидаза имеет последовательность, выбранную из:A) последовательности, изложенной в SEQ ID NO: 2,B) аналога последовательности в А,C) подпоследовательности последовательности в А) или В). Другой предпочтительный вариант осуществления представляет собой вышеупомянутую композицию, включающую очищенную рекомбинантную альфа-маннозидазу для применения в качестве лекарственного препарата. В дополнительном варианте осуществления вышеупомянутая композиция, включающая очищенную рекомбинантную альфа-маннозидазу, предназначена для применения в лечении альфа-маннозидоза. Еще другой вариант осуществления представляет собой применение вышеупомянутой композиции,включающей очищенную рекомбинантную альфа-маннозидазу, для получения лекарственного препарата для лечения альфа-маннозидоза. Другой еще вариант осуществления представляет собой способ лечения альфа-маннозидоза и/или уменьшения или облегчения симптомов, связанных с альфа-маннозидозом, причем указанный способ включает стадию введения композиции, включающей очищенную рекомбинантную альфа-маннозидазу,как приведено выше, субъекту, нуждающемуся в этом. Следует отметить, что варианты осуществления и признаки, описанные в контексте одного из аспектов настоящего изобретения, также применимы к другим аспектам настоящего изобретения. Все ссылки на патенты и на непатентные публикации, цитируемые в настоящем изобретении, полностью включены в настоящее изобретение посредством ссылки. Настоящее изобретение теперь будет описано более подробно в следующих неограничивающих примерах. Примеры Применяемые сокращения:CIP - очистка на месте,CV - объем колонки,Cv - плотность жизнеспособных клеток,DF - диафильтрация,DO - растворенный кислород,IPA - изопропанол,MVC/мл - 106 жизнеспособных клеток /мл,NaPi - фосфат натрия,NaAc - ацетат натрия,OD - оптическая плотность,EG - этиленгликоль,TFF - тангенциальная поточная фильтрация,ТМР - трансмембранное давление,UF - ультрафильтрация. Пример 1. Предпочтительная в настоящее время полная процедура очистки. Процедура очистки для получения оптимальных выходов и степеней чистоты для альфаманнозидазы в контексте настоящего изобретения описывается ниже. Применяют стандартные условия для регенерации и очистки смол, как прописано для отдельной смолы (смотри также примеры 2-5). Применяемые смолы являются доступными в GE healthcare life sciences и BioRad. Обеспечение фракции сбора из получения альфа-маннозидазы и очистка фракции без значительного разведения. Предпочтительно совсем не осуществляют разведение. Осуществление этапа захвата, включающего колоночную хроматографию вышеупомянутой фракции, на смоле, включающей мультимодальный лиганд. Эти смолы выбирают из группы, включающейHyperCel, HEA HyperCel и РРА HyperCel. Несколько отмывок выполняют при рН 4,5-8,5, отмывочные буферы выбирают из группы, включающей ацетат натрия, ацетат калия, ацетат аммония, фосфат натрия, фосфат калия, сульфат натрия,сульфат калия, сульфат аммония, MES, MOPS, Hepes, борат натрия, трис-HCl, цитратный буфер или их комбинации (буферной группы А, в дальнейшем). По меньшей мере в одной отмывке, однако, отмывочный раствор включает изопропанол и рН находится между рН 4-6. Элюирующий буфер выбирают из буферной группы А, и элюирующий раствор включает этиленгликоль. рН элюирования поддерживают на уровне рН 7,0-8,5. Осуществление активного промежуточного этапа, включающего колоночную хроматографию композиции, включающей альфа-маннозидазу, на смоле с гидрофобным взаимодействием. Эти смолы выбирают из группы, включающей Butyl-S Sepharose 6 Fast Flow, Butyl Sepharose 4 Fast Flow, Octyl Sepharose 4 Fast Flow, Phenyl Sepharose 6 Fast Flow (high sub) и Phenyl Sepharose 6 Fast Flow (low sub),Butyl Sepharose High Performance, Phenyl Sepharose High Performance. Несколько отмывок выполняют при рН 7-8. Отмывочные буферы выбирают из буферной группы А. Элюирующий буфер также выбирают из буферной группы А, и рН элюирования находится между рН 78. Осуществление пассивного промежуточного этапа, включающего колоночную хроматографию композиции, включающей альфа-маннозидазу, на ионообменной смоле смешанного действия с получением фильтрата. Эти смолы выбирают из группы, включающей смолу на основе керамического гидроксиапатита типа I или II (предпочтительно типа I) или фторапатит. Одну отмывку осуществляют для получения фильтрата при рН 7-8. Отмывочный буфер выбирают из буферной группы А. Осуществление этапа доочистки, включающего колоночную хроматографию композиции, включающей альфа-маннозидазу, на анионообменной смоле. Эти смолы выбирают из группы, включающейQ-sepharose HP, Q-sepharose FF, DEAE-sepharose, CaptoQ, Uno Q, ANX sepharose. Несколько отмывок выполняют при рН 7-8. Отмывочные буферы выбирают из буферной группы А и Трис-HCl буфера. Элюирующий буфер также выбирают из буферной группы А и рН элюирования поддерживают на уровне рН 7,0-8,5. Осуществление этапа инактивации вируса путем приведения раствора альфа-маннозидазы в контакт с изопропанолом. Осуществление этапа удаления вируса с применением нанофильтрации. Выходы и соотношения компонентов продукта для очищенной композиции, включающей альфа- 13022220 маннозидазу согласно настоящему изобретению, показаны ниже в табл. 1 в сравнении с предыдущими способами, где способ 1 представляет собой предпочтительный в настоящее время способ согласно настоящему изобретению; способ 2 представляет собой похожий на способ 1 без этапа доочистки. Он также не имеет этапов отмывки, включающих изопропанол для этапа захвата, и имеет меньшее количество отмывок в активном промежуточном этапе, и, наконец, он не имеет этапов инактивации/удаления вируса; способ 3 представляет собой такой, как описано в документе WO 02/099092 (без применения мультимодальных лигандов). Таблица 1 Выходы и чистота, получающиеся в результате прошлых и настоящих процедур очистки Смотри также пример 10 и фиг. 7. Пример 2. Этап хроматографического захвата с помощью мультимодального лиганда. Очищенный неразбавленный сбор, включающий альфа-маннозидазу, связывается путем взаимодействия смешанного типа со смолой по типу мультимодального лиганда, такой как ММС Capto, применяемой в данном примере. Увеличением соли и добавлением этиленгликоля элюируют продукт. Емкость ММС Capto составляла 260 ед/мл смолы. Стадию захвата осуществляли с помощью следующих этапов: регенерация колонки 1-2 объемами колонки (CV) 3 М NaCl, pH 10-12 при 300 см/ч,уравновешивание посредством 5 CV 50 мМ натрий-фосфатного буфера (NaPi), 0,15 М NaCl pH 7,5 при 300 см/ч,загрузка очищенного, неразбавленного сбора (проводимость 15 мСм/см) при 300 см/ч,отмывка 1: 4 CV равновесного буфера,отмывка 2: 3 CV 0,95 М NaAc, 5% (об./об.) изопропанола, рН 4,9 при 300 см/ч,отмывка 3: 4 CV равновесного буфера (до стабильного базового уровня, 0,06 ЕА с 5-мм проточной ячейкой) равновесного буфера при 300 см/ч,элюирование продукта посредством 6 CV 1,5 М NaCl, 40% этиленгликоля в 90 мМ NaPi, pH 7,7 с максимальным значением 120 см/ч. Начало сбора при увеличении абсорбции (около 10 мЕА от нового базового уровня). Собрать 4 CV, регенерировать колонку, как указано выше посредством 3 CV, с направлением потока вниз, максимальное значение 120 см/ч,очистка на месте (CIP) и санация предпочтительно с направлением потока вверх посредством 3 CV Н 2 О, 3 CV 1 M NaOH (время контакта 60 мин), 2-3 CV фосфатного буфера, рН 7, 3 CV 20 мМ фосфата натрия + 20% этанола. Хранение в 20 мМ фосфата натрия + 20% этанола. Табл. 2 демонстрирует пример схемы очистки. В табл. 3 кратко изложен данный этап. Фиг. 2 демонстрирует пример хроматограммы для данного этапа. Таблица 2 Схема очистки со стадией захвата: ММС Capto, упакованная в 13,52 мл (27 мл) ХК 16 колонке Таблица 3 Краткое изложение условий для стадии захвата с ММС Capto Пример 3. Хроматографический промежуточной активный этап с помощью гидрофобного взаимодействия. Продукт из стадии захвата, включающий альфа-маннозидазу, связывается с помощью гидрофобных взаимодействий после добавления сульфата натрия со смолами, действующими по типу гидрофобного взаимодействия, такими как 4 FF Butyl Sepharose, применяемыми в данном примере. Снижением концентрации соли элюируют продукт. Емкость составляла 195 ед/мл смолы. Применяли следующие этапы в промежуточной активной стадии: регенерация колонки посредством 1 CV 20 мМ натрий-фосфатного (NaPi) буфера, рН 7,5 при 100 см/ч,уравновешивание колонки посредством 5 CV 0,5 М Na2SO4, 20 мМ NaPi, рН 7,5 при 150 см/ч,смешение пула продуктов из этапа 1 с таким же объемом 20 мМ NaPi, 0,8 М Na2SO4, pH 7,5 и загрузка этого на колонку при 70 см/ч. Смешивание можно осуществлять поточно или максимум за 3 ч перед началом загрузки. Смесь 1:1 об./об. соответствует приблизительно 1,11:1, вес./вес. (элюат:натриево-сульфатный буфер). При необходимости кондиционированный загружаемый образец следует профильтровать через 0,45-мкм фильтр (гидрофильный PES или PVDF) перед загрузкой,отмывание колонки посредством 3 CV равновесного буфера при 70 см/ч для удаления этиленгликоля, помимо белков клетки-хозяина, из предыдущего этапа,отмывание посредством 3,5 CV 20 мМ NaPi, 1,2 М NaAc, pH 7,5 при 100 см/ч,отмывание посредством 3,5 CV 0,6 М NaPi, pH 7,0 при 150 см/ч,элюирование продукта посредством 4 CV 60 мМ NaPi, pH 7,5 при 150 см/ч. Сбор пика от первоначального увеличения абсорбции до достижения базового уровня, 2 CV,регенерирование колонки посредством 2 CV 20 мМ NaPi, pH 7,5 с последующими 3 CV Н 2 О при 150 см/ч,очистка и санирование посредством 3 CV 1 M NaOH (время контакта 60 мин), 1 CV Н 2 О, 1-3 CV фосфатного буфера и 2 CV 20 мМ фосфата натрия + 20% этанола. Хранение в 20 мМ фосфате натрия + 20% этанола. Табл. 4 демонстрирует пример схемы очистки. В табл. 5 кратко изложен данный этап. Фиг. 3 демонстрирует пример хроматограммы для данного этапа. Таблица 4 Схема промежуточной активной очистки с помощью 4FF Butyl Sepharose,упакованной в 13,5 см 2 см 2 (27 мл) ХК 16 колонке Таблица 5 Краткое изложение условий для этапа с 4FF Butyl Sepharose Пример 4. Хроматографический промежуточный пассивный этап с помощью ионного обмена смешанного действия. Два элюата, включающих альфа-маннозидазу, из промежуточного активного этапа объединяли в пул и смешивали 1:1 (вес./вес.) с водой для уменьшения проводимости и загружали на ионообменную смолу смешанного действия, такую как в данном примере смолу на основе керамического гидроксиапатита I (СНТ I). Продукт проходит без связывания, в то время как белки клетки-хозяина связываются с колонкой. Собрали фильтрат, содержащий продукт. Емкость составляла 550 ед/мл смолы. Применяли следующие этапы в данном примере промежуточной пассивной стадии: регенерация колонки посредством 2 CV 0,6 М NaPi pH 7,0 при 300 см/ч,уравновешивание колонки посредством 5 CV 60 мМ NaPi, pH 7,5 при 300 см/ч,загрузка кондиционированного элюата из этапа 2 при 300 см/ч и сбор фильтрата, содержащего продукт. Проводимость и рН загружаемого образца будет составлять 10 мСм/см и 7,3 соответственно. Сбор фильтрата, содержащего продукт, от увеличения ОП от 20 мЕА до возвращения ОП до 20 мЕА, приблизительно объем загрузки и 2 CV отмывки. На заключительном этапе профильтровать пул продукта через 0,45-мкм гидрофильный PES или PVDF фильтр,промывка колонки посредством 4 CV равновесного буфера при 300 см/ч,регенерация колонки посредством 3 CV 0,6 М NaPi, pH 7,0 при 300 см/ч,очистка и санация посредством 3 CV 1 M NaOH (время контакта 60 мин), 1 CV 60 мМ NaPi, pH 7,5 и 2 CV 20 мМ фосфата натрия + 20% этанола. Хранение в 20 мМ фосфата натрия + 20% этанола. Табл. 6 демонстрирует пример схемы очистки. В табл. 7 кратко изложен данный этап. Фиг. 4 демонстрирует пример хроматограммы для данного этапа. Таблица 6 Схема очистки для промежуточной пассивной стадии с помощью CHT I,упакованной в 10 см 2 см 2 (20 мл) ХК 16 колонке Таблица 7 Краткое изложение условий для этапа с СНТ I Пример 5. Этап инактивации вируса. Инактивацию вируса можно осуществлять на разных стадиях способа. В данном примере инактивацию вируса осуществляли после промежуточного пассивного этапа и до этапа доочистки. Инактивацию вируса пула промежуточного пассивного этапа, включающего альфа-маннозидазу, получают с помощью 13515 мин инкубации при 215 С с 15% изопропанолом (1:1 смесь с 30% водным раствором изопропанола). Резервуар можно охладить с помощью охлаждающей рубашки при 4 С для поддержания процесса при 215 С. Применяли тангенциальную поточную фильтрацию (TFF) с мембраной из полиэфирсульфона на 100 кДа, Screen А (от Millipore или Sartorius), для удаления изопропанола и замены на натрийфосфатный буфер. В данном примере применяли следующие этапы для инактивации вирусов: смешение продукта (фильтрат) из промежуточного пассивного этапа с 30% изопропанолом в 60 мМ фосфате натрия, 1:1 (об./об.), что соответствует 1:0:94 (вес./вес.). Смешать, например, с помощью рециркуляционного насоса. Концентрация белка-продукта будет составлять 0,3-1 мг/мл,инкубация пула растворитель/продукт при комнатной температуре в течение 13515 мин,уравновешивание TFF мембраны посредством 60 мМ натрий-фосфатного буфера,концентрирование пула до заданной концентрация 2 мкг/мл (0,5-3 мкг/мл) путем ультрафильтрации при трансмембранном давлении (ТМР) 1,1 бар, при 215 С, давлении на входе =1,4-1,5 бар и давлении на выходе =0,7-0,8 бар,замена 6 об. путем диафильтрации относительно 60 мМ натрий-фосфатного буфера. Начинать при ТМР 1 бар (1,4 бар на входе/0,6 бар на выходе). После замены первого объема можно увеличить ТМР до 1,1,сбор ретентата. Промывание мембраны 2-3 системными объемами буфера для разведения для удаления слабосвязанного продукта. Сбор данной жидкости для промывки вместе с ретентататом. Конечная концентрация белка-мишени составляет 2 мкг/мл (0,5-3 мкг/мл),очистка мембраны посредством Н 2 О с последующим 0,5 М NaOH (время контакта 60 мин). Хранение в 0,1 М NaOH. Табл. 10 демонстрирует условия для этапа инактивации вируса/TFF. Таблица 10 Краткое изложение условий для этапа инактивации вируса/TFF Пример 6. Этап хроматографической доочистки с помощью анионного обмена. Проводимость ретентата, включающего альфа-маннозидазу, из промежуточной пассивной стадии уменьшали путем разбавления в 6 раз буфером для кондиционирования (20 мМ Трис-НС 1, 10 мМ NaCl,75 мМ маннит, 0,005% tween 80, рН 7,5) для того, чтобы связать с помощью ионного взаимодействия с анионообменной смолой, такой как в данном примере высокоэффективной сильной анионообменной смолой на основе четвертичного аммония (смола Q Sepahrose HP). Ретентат либо разбавляли прямо перед нагрузкой, либо путем поточного разбавления. Продукт элюировали в контейнер, предварительно наполненный 1CV элюирующего буфера, путем добавления хлорида натрия. Емкость составляет 400 ед/мл смолы. В данном примере для стадии доочистки применяли следующие этапы: регенерирация колонки посредством 1 CV 50 мМ NaPi, 1 M хлорида натрия, рН 7,5 при 120 см/ч,уравновешивание колонки посредством 5 CV 20 мМ Трис-НС 1, 10 мМ хлорида натрия, рН 7,5 при 120 см/ч,загрузка разбавленного ретентата из этапа 4 при 120 см/ч,промывка колонки посредством 5 CV равновесного буфера и 1 CV 20 мМ фосфата натрия, рН 7,5 при 120 см/ч,элюирование продукта посредством 4 CV 50 мМ фосфата натрия, 0,2 М хлорида натрия, рН 7,5 при 120 см/ч в предварительно наполненный (1 CV элюирующего буфера) контейнер. Сбор пика от первоначального увеличения (начать собирать при 10-20 мЕА) абсорбции до 30-50 мЕА (2 мМ проточная ячейка), 0,5-1,5 CV,регенерация колонки посредством 3 CV 50 мМ NaPi, 1 M хлорида натрия, рН 7,5 при 120 см/ч,очистка и санирование посредством 3 CV 1 M NaOH (время контакта 60 мин) и 3 CV 10 мМ NaOH. Хранение в 10 мМ NaOH. Табл. 8 демонстрирует пример схемы очистки. В табл. 9 кратко изложен данный этап. Фиг. 5 демонстрирует пример хроматограммы. Таблица 8 Пример схемы очистки для этапа доочистки с помощью смолы Таблица 9 Краткое изложение условий для этапа с Q Sepharose HP Пример 7. Этап сокращения количества вируса. Сокращение количества вируса можно осуществлять на разных стадиях способа. В данном примере сокращение количества вируса осуществляли после этапа доочистки. Элюат из этапа доочистки после предварительной фильтрации через 0,1 мкм подвергают нанофильтрации через фильтр Pianova 15N. Применяли следующие этапы: элюат из этапа доочистки предварительно фильтруют через 0,1-мкм фильтр. Фильтр промывают небольшим объемом 50 мМ фосфата натрия, 0,2 М хлорида натрия, рН 7,5 для удаления слабосвязанного продукта,элюат фильтруют при давлении 0,8 бар, при комнатной температуре. За фильтрацией следует последующая отмывка приблизительно тремя объемами системы Pianova 15 посредством 50 мМ фосфата натрия, 0,2 М хлорида натрия, рН 7,5. Пример 8. Состав и хранение. При тангенциальной поточной фильтрации (TFF) с мембраной из полиэфирсульфона, Screen А, на 100 кДа (Sartorius или Millipore) меняют буфер на буферную смесь. Резервуар можно охладить с помощью охлаждающей рубашки при 4 С для поддержания процесса при 215 С. Рассчитанная емкость составляет 100 л/м 2. Применяли следующие стадии для составления и хранения: уравновешивание мембраны 3,5 мМ Na2HPO4, 0,17 мМ NaHPO4, 250 мМ маннита, 27 мМ глицина,рН 7,7 (буферная смесь),разбавление очищенного продукта, включающего альфа-маннозидазу, приблизительно 1 об. буферной смеси до заданной концентрации 2-3 мкг/мл. Если концентрация белка в продукте низкая, можно (но не обязательно) концентрировать до 4-6 мкг/мл для уменьшения объема перед разбавлением буферной смесью,концентрирование дважды до заданной концентрации 6 мкг/мл путем ультрафильтрации при ТМР 0,8 и при 215 С,замена 6 об. путем диафильтрации против буферной смеси при ТМР 0,8, 215 С,концентрирование 1,5 раза путем ультрафильтрации и сбор ретентата. Промыть мембрану 1 системным объемом буферной смеси для удаления слабосвязанного продукта. Собрать полученный в результате промывки раствор вместе с ретентатом. Альтернатива заключается в измерении ОП 280 в полученном в результате промывки растворе и пуле, только если он содержит продукт. Конечная заданная концентрация белка составляет 72 мкг/мл,очистка мембраны посредством Н 2 О с последующим 0,5 М NaOH (время контакта 60 мин). Хранить в 0,1 М NaOH. Таблица 11 Краткое изложение условий для этапа составления с TFF Продукт разбавляли до 5 мкг/мл и стерильно фильтровали. Наполняли бутылки профильтрованным лекарственным веществом и замораживали. Пример 9. Способ периодического культивирования для альфа-маннозидазы. После оттаивания клеток размножали клетки во встряхиваемых колбах в 10-л биореакторе для выращивания посевного материала и 50-л биореакторе для выращивания посевного материала перед их перемещением в продукционный биореактор (250 л). В день инокуляции продукционного биореактора плотность клеток в 50-л биореакторе для выращивания посевного материала составляла 2-2,5 MVC/мл. Клетки инокулировали в продукционный реактор из биореактора для выращивания посевного материала при плотности клеток 0,5 MVC/мл, так что объем клеточной суспензии составил 100 л по завершении инокуляции. День инокуляции называют день 0, день после называют день 1 и так далее. От дня 1 до конца серии опытов ежедневно добавляли питательную среду с увеличением объема согласно определенной заранее норме (смотри ниже). От дня 1 до конца серии опытов ежедневно добавляли глутамин и глюкозу с увеличением объема согласно определенным заранее нормам и правилам (смотри ниже). Когда плотность жизнеспособных клеток составляла 2,2 MVC/мл или в день 3, что наступит раньше, температуру снижали до температуры продуцирования. Таблица 12 Фактические температуры и экспериментальные условия Между днем 0 и днем 2 только СО 2 автоматически добавляли путем контроля рН. Щелочь не добавляли, если рН не был 6,60.ACF среда (ЕхСе 11302, SAFC), дополненная 2 мМ глутамином и содержащая 11,1 мМ (2 г/л) глюкозы. Основную среду без глутамина можно переносить в продукционный биореактор вплоть до 3 дней и хранить при 36,5 С, т.е. в течение тестирования биореактора на стерильность. В противном случае среду хранят при 4 С. Питательные среды. Питательная среда, Е 35, представляла собой 35% СНО CD Efficient Feed В (кат. номер InVitrogenSKU A10240-01) питательный концентрат, разбавленный в ACF среде без глутамина и содержащий 11,1 мМ глюкозы. Питательную среду хранили в темноте при 4 С. Питательная среда может находиться в темноте в течение вплоть до 96 ч, т.е. четыре дня при комнатной температуре в течение культивирования. Таблица 13 Объем питательной среды, добавляемый в деньb. Исходный раствор 200 мМ глутамина. с. Щелочь 0,5 М Na2CO3. Доставка питательной среды, глюкозы и глутамина. Питательную среду накачивали ежедневно с увеличением объема. Глюкозу и глутамин добавляли ежедневно для поддержания их концентраций в пределах данных целевых значений путем добавления с увеличением объема исходных растворов глюкозы и глутамина в количествах, согласно нижеуказанным. Правила добавления глутамина: от дня 1 до дня 3: добавлять объем исходного раствора глутамина, так чтобы концентрация глутамина в биореакторе составляла 2 мМ,от дня 4: добавлять объем исходного раствора глутамина, так чтобы концентрация глутамина в биореакторе составляла 1 мМ. Правила добавления глюкозы: от дня 0 дня 8: не добавлять исходный раствор глюкозы,от дня 9, если концентрация глюкозы в продукционном биореакторе 8 мМ, добавить объем исходного раствора глюкозы, так чтобы концентрация глюкозы в биореакторе составляла 8 мМ. Обзор способа. Таблица 15 Обзор способа культивирования день за днем Пример 10. Характеристика очищенного продукта, включающего альфа-маннозидазу. Табл. 16 ниже демонстрирует, как схема очистки настоящего изобретения обеспечила альфаманнозидазу с высокой долей 130 кДа разновидности гликопротеина по сравнению с продуктами распада 75 и 55 кДа соответственно. В ней также продемонстрировано, как 250-л способ с применением 4 этапного способа очистки с улучшенными этапами отмывки как для этапа захвата, включающего мультимодальные лиганды, так и для промежуточного активного этапа, а также этапа доочистки с помощью Распределение разновидностей видно на HPLC-диаграмме фиг. 7 для трех способов, где верхние представляют 4-этапный и 3-этапный способы соответственно. Показанный 2-этапный способ осуществляют без помощи этапа с мультимодальным лигандом. Первый пик слева представляет собой 55 кДа разновидность, за которым следуют 130 и 75 кДа разновидности соответственно. Ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ очистки рекомбинантной альфа-маннозидазы из культуры клеток, где фракцию указанной культуры клеток, включающую рекомбинантную альфа-маннозидазу, подвергают хроматографии на смоле, включающей мультимодальный лиганд. 2. Способ по п.1, где указанная фракция культуры клеток, включающая рекомбинантную альфаманнозидазу, представляет собой осветленный неразбавленный сбор. 3. Способ по любому из пп.1, 2, где указанный мультимодальный лиганд, связанный со смолой,представляет собой вещество с группой карбоновой кислоты или группой сульфоновой кислоты. 4. Способ по любому из пп.1-3, где мультимодальный лиганд, связанный со смолой, представляет собой вещество формул (I), (II) или (III) где R веществ формул (II) и (III) представляет собой функциональную группу формулы (IV) 5. Способ по любому из пп.1-4, где фракцию указанной культуры клеток, загруженную на смолу,включающую мультимодальный лиганд, подвергают по меньшей мере одной стадии отмывки раствором,включающим изопропанол, предпочтительно по меньшей мере 1% (об./об.) изопропанола, как, например,по меньшей мере 2, 3, 4, 4,5% (об./об.) изопропанола, предпочтительно по меньшей мере 5% (об./об.) изопропанола. 6. Способ по любому из пп.1-5, где первый элюат, включающий рекомбинантную альфаманнозидазу, элюируют со смолы, включающей мультимодальный лиганд, с помощью водного раствора,включающего этиленгликоль или пропиленгликоль. 7. Способ по любому из пп.1-6, где первый элюат, включающий альфа-маннозидазу, полученный со смолы, включающей мультимодальный лиганд, дополнительно подвергают способу, включающему стадии, на которых:i) наносят фракцию, включающую альфа-маннозидазу, на смолу для хроматографии с гидрофобным взаимодействием с получением элюата, включающего рекомбинантную альфа-маннозидазу;ii) пропускают фракцию, включающую альфа-маннозидазу, через ионообменную смолу смешанного действия для удерживания загрязняющих примесей с получением фильтрата, включающего рекомбинантную альфа-маннозидазу;iii) подвергают фракцию, включающую альфа-маннозидазу, хроматографии на анионообменной смоле с получением элюата, включающего рекомбинантную альфа-маннозидазу. 8. Способ по любому из пп.1-7, где альфа-маннозидаза имеет последовательность, выбранную из:C) подпоследовательности последовательности в А) или В). 9. Композиция, включающая альфа-маннозидазу, получаемую посредством способа очистки по любому из пп.1-8. 10. Способ периодического или непрерывного получения рекомбинантной альфа-маннозидазы,включающий следующие стадии, на которых:a) инокулируют промышленный реактор, включающий основную среду, клетками, способными продуцировать рекомбинантную альфа-маннозидазу, в день 0 с получением культуры клеток;b) добавляют питательную среду к указанной культуре клеток по меньшей мере один раз от дня 1;c) корректируют температуру указанной культуры клеток до самое большее 35 С, как, например,34, 33, 32 С, предпочтительно самое большее 31 С, либо после дня 3, либо когда плотность жизнеспособных клеток будет выше 2,1 млн жизнеспособных клеток/мл, в зависимости от того, что наступит раньше;d) осуществляют способ очистки по любому из пп.1-8. 11. Применение композиции по п.9 для получения лекарственного препарата для лечения альфаманнозидоза. 12. Способ лечения альфа-маннозидоза и/или уменьшения или облегчения симптомов, связанных с альфа-маннозидозом, причем указанный способ включает стадию, на которой вводят композицию,включающую очищенную рекомбинантную альфа-маннозидазу по п.9 субъекту, нуждающемуся в этом.
МПК / Метки
МПК: A61K 38/46, C07K 1/16
Метки: способ, очистки, альфа-маннозидазы, лизосомальной, получения, рекомбинантной
Код ссылки
<a href="https://eas.patents.su/30-22220-sposob-polucheniya-i-ochistki-rekombinantnojj-lizosomalnojj-alfa-mannozidazy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения и очистки рекомбинантной лизосомальной альфа-маннозидазы</a>
Предыдущий патент: Способ получения полипептида или вируса, представляющих интерес, в непрерывной клеточной культуре
Следующий патент: Применение источника l3 и/или l5 в качестве вакцины или диагностического средства для паразитарного заболевания
Случайный патент: Способ обработки шлама с частицами, содержащими металл, оксид металла или гидроокись металла, и аппарат для осуществления данного способа