Клетка насекомого, пригодная для продуцирования рекомбинантных парвовирусных векторов, и способ получения рекомбинантных парвовирусных вирионов
Номер патента: 22169
Опубликовано: 30.11.2015
Авторы: Баккер Андре Кристиан, Херменс Вильхельмус Теодорус Йоханнес Мария Кристиан
Формула / Реферат
1. Клетка насекомого, пригодная для продуцирования рекомбинантных парвовирусных векторов, включающая первую нуклеотидную последовательность, кодирующую первую аминокислотную последовательность, и вторую нуклеотидную последовательность, кодирующую вторую аминокислотную последовательность, причем первая и вторая аминокислотные последовательности включают общую аминокислотную последовательность по крайней мере из 100 аминокислот по крайней мере с 90% аминокислотной идентичностью между первой и второй аминокислотными последовательностями, причем нуклеотидные последовательности, кодирующие общую аминокислотную последовательность в первой и второй аминокислотных последовательностях, идентичны менее чем на 90%, причем первая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белка Rep52 или 40, а вторая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белка Rep78 или 68, причем общие аминокислотные последовательности включают аминокислотные последовательности от второй аминокислоты до самой С-концевой аминокислоты парвовирусного белка Rep52 или 40.
2. Клетка насекомого по п.1, в которой нуклеотидные последовательности, которые кодируют общую аминокислотную последовательность в первой и второй аминокислотных последовательностях, идентичны друг другу менее чем на 80%.
3. Клетка насекомого по п.1 или 2, в которой последовательности, соответствующие общей аминокислотной последовательности в первой и второй аминокислотных последовательностях, идентичны по крайней мере на 99%, предпочтительно на 100%.
4. Клетка насекомого по любому из предшествующих пунктов, в которой нуклеотидная последовательность, кодирующая общую аминокислотную последовательность в первой нуклеотидной последовательности, имеет смещение частот использования кодонов в сторону улучшения для клетки насекомого по сравнению с нуклеотидной последовательностью, кодирующей общую аминокислотную последовательность во второй нуклеотидной последовательности, или в которой нуклеотидная последовательность, кодирующая общую аминокислотную последовательность во второй нуклеотидной последовательности, имеет смещение частот использования кодонов в сторону улучшения для клетки насекомого по сравнению с нуклеотидной последовательностью, кодирующей общую аминокислотную последовательность в первой нуклеотидной последовательности.
5. Клетка насекомого по п.4, в которой разница между индексами адаптации кодонов нуклеотидной последовательности, кодирующей общую аминокислотную последовательность в первой и второй нуклеотидных последовательностях, составляет по крайней мере 0,2.
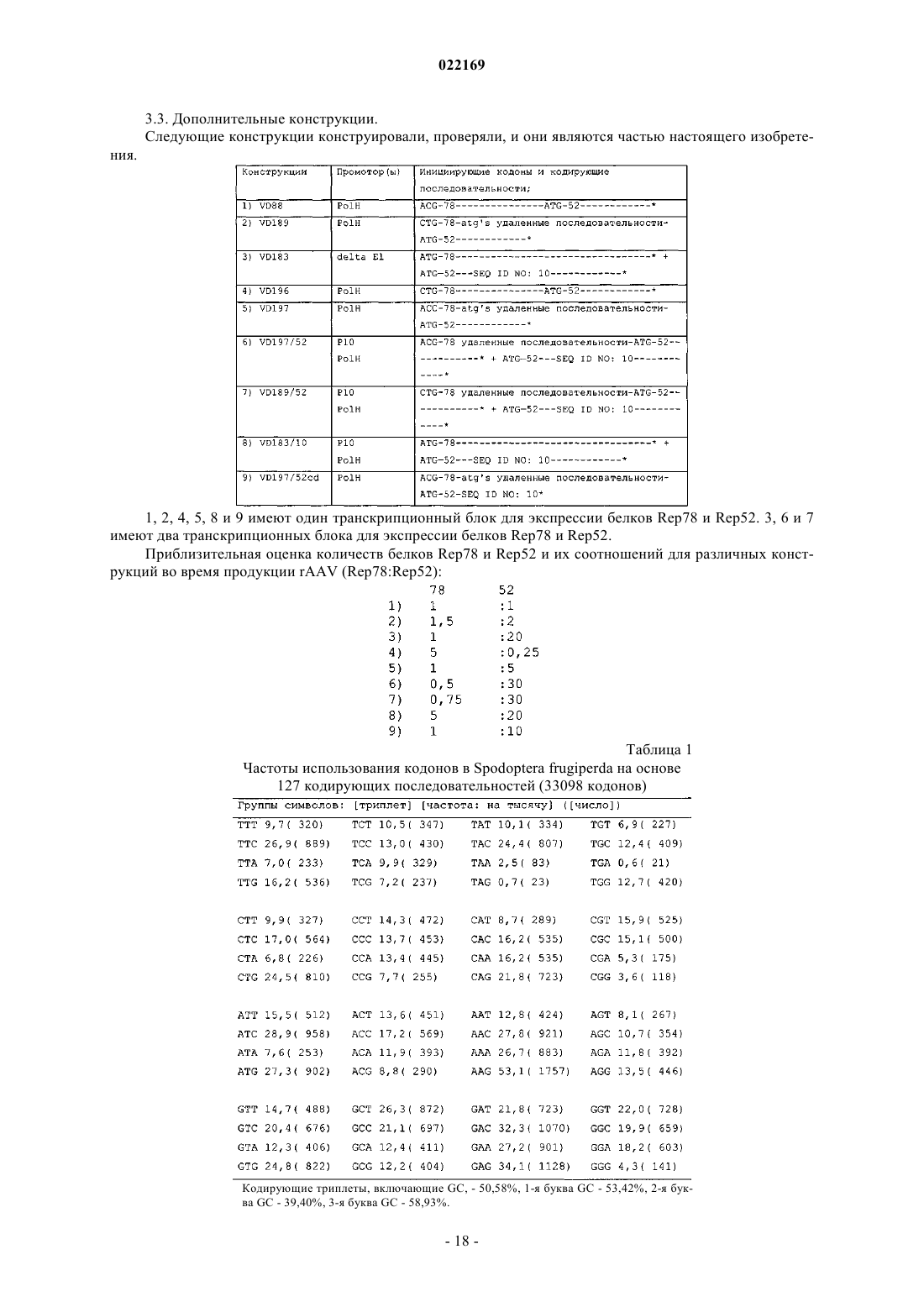
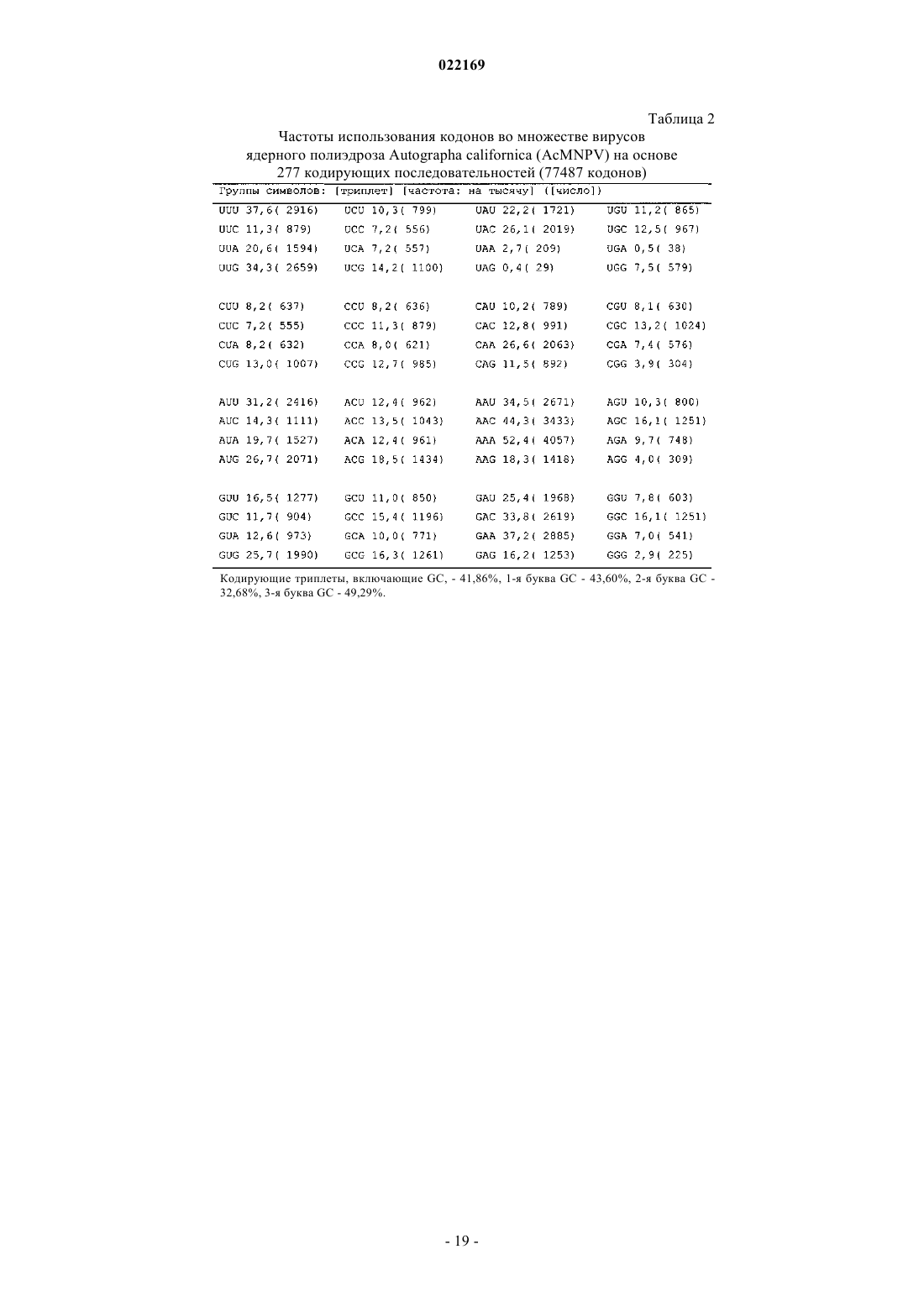
6. Клетка насекомого по любому из предшествующих пунктов, в которой нуклеотидная последовательность, кодирующая общую аминокислотную последовательность в нуклеотидной последовательности со смещением частот использования кодонов в сторону улучшения, включает непрерывный участок по крайней мере из 25 кодонов, все из которых являются часто встречающимися кодонами в соответствии с табл. 1 или 2.
7. Клетка насекомого по п.6, в которой все кодоны в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность в нуклеотидной последовательности со смещением частот использования кодонов в сторону улучшения, являются часто встречающимися кодонами в соответствии с табл. 1 или 2, и в которой предпочтительно все кодоны в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность в другой нуклеотидной последовательности, являются вторыми наиболее частыми кодонами в соответствии с табл. 1 или 2.
8. Клетка насекомого по любому из пп.1-6, в которой по крайней мере 50% кодонов в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность во второй нуклеотидной последовательности, изменены по сравнению с соответствующим кодоном в первой нуклеотидной последовательности для максимизации содержания AT или GC во второй нуклеотидной последовательности.
9. Клетка насекомого по любому из предшествующих пунктов, в которой первая и вторая нуклеотидные последовательности являются частью конструкции, в которой каждая из первой и второй нуклеотидных последовательностей функционально связана с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого.
10. Клетка насекомого по п.9, в которой первая и вторая нуклеотидные последовательности являются частью одной конструкции.
11. Клетка насекомого по любому из пп.1-9, в которой парвовирусными белками Rep являются белки Rep аденоассоциированного вируса (AAV).
12. Клетка насекомого по п.11, в которой парвовирусные белки Rep, кодируемые первой и второй нуклеотидными последовательностями, являются белками одного и того же серотипа.
13. Клетка насекомого по любому из пп.1-12, в которой первая нуклеотидная последовательность, кодирующая парвовирусный белок Rep52, выбрана из группы, состоящей из:
a) нуклеотидной последовательности, которая кодирует полипептид, включающий аминокислотную последовательность, которая по крайней мере на 50% идентична аминокислотной последовательности SEQ ID NO: 6;
b) нуклеотидной последовательности, которая идентична по крайней мере на 50% любой из нуклеотидных последовательностей SEQ ID NO: 1-5 и 10;
c) нуклеотидной последовательности, комплементарная цепь которой гибридизуется с последовательностью молекулы нуклеиновой кислоты а) или b);
d) нуклеотидной последовательности, которая отличается от последовательности с) вследствие вырожденности генетического кода и в которой вторая нуклеотидная последовательность, кодирующая парвовирусный белок Rep78, выбрана из группы, состоящей из:
a) нуклеотидной последовательности, которая кодирует полипептид, включающий аминокислотную последовательность, которая по крайней мере на 50% идентична аминокислотной последовательности SEQ ID NO: 8;
b) нуклеотидной последовательности, которая идентична по крайней мере на 50% нуклеотидной последовательности с 11 до 1876 положения SEQ ID NO: 7;
c) нуклеотидной последовательности, комплементарная цепь которой гибридизуется с нуклеотидной последовательностью а) или b);
d) нуклеотидной последовательности, которая отличается от последовательности с) вследствие вырожденности генетического кода.
14. Клетка насекомого по любому из пп.1-13, дополнительно включающая:
a) третью нуклеотидную последовательность, включающую по крайней мере одну нуклеотидную последовательность инвертированного концевого повтора (ITR) парвовируса;
b) четвертую нуклеотидную последовательность, включающую кодирующие капсидные белки парвовируса последовательности, функционально связанные с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого.
15. Клетка насекомого по п.14, в которой одна или более из первой, второй, третьей и четвертой нуклеотидных последовательностей являются частью конструкции нуклеиновой кислоты, которая представляет собой совместимый с клеткой насекомого вектор, предпочтительно бакуловирусный вектор.
16. Клетка насекомого по п.14 или 15, в которой третья нуклеотидная последовательность дополнительно включает по крайней мере одну нуклеотидную последовательность, кодирующую представляющий интерес продукт.
17. Клетка насекомого по п.16, в которой третья нуклеотидная последовательность включает две последовательности IRT парвовируса и в которой по крайней мере одна нуклеотидная последовательность, кодирующая представляющий интерес продукт, расположена между двумя нуклеотидными последовательностями IRT парвовируса.
18. Клетка насекомого по любому из пп.14-17, в которой по крайней мере одна из первой, второй, третьей и четвертой нуклеотидных последовательностей устойчиво интегрирована в геном клетки насекомого.
19. Клетка насекомого по любому из пп.14-18, в которой парвовирусом является AAV.
20. Способ получения рекомбинантного парвовирусного вириона в клетке насекомого, включающий стадии:
(a) культивирования клетки насекомого по любому из пп.14-19 в условиях, обеспечивающих продуцирование рекомбинантного парвовирусного вириона;
(b) выделения рекомбинантного парвовирусного вириона.
21. Способ по п.20, дополнительно включающий стадию очистки по сродству вириона с использованием иммобилизованного антитела против парвовируса, предпочтительно одноцепочечного антитела семейства верблюдовых или его фрагмента.
22. Способ по п.20 или 21, в котором рекомбинантным парвовирусным вирионом является рекомбинантный AAV-вирион.
23. Конструкция нуклеиновой кислоты, включающая первую и вторую нуклеотидные последовательности, раскрытые в любом из пп.1-13.

Текст
КЛЕТКА НАСЕКОМОГО, ПРИГОДНАЯ ДЛЯ ПРОДУЦИРОВАНИЯ РЕКОМБИНАНТНЫХ ПАРВОВИРУСНЫХ ВЕКТОРОВ, И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ ПАРВОВИРУСНЫХ ВИРИОНОВ Изобретение относится к продукции белков в клетках насекомых, в силу чего в бакуловирусных векторах используются повторные кодирующие последовательности. В частности, изобретение относится к продукции парвовирусных векторов, которые могут использоваться в генной терапии, и к увеличениям экспрессии вирусных белков Rep, которые увеличивают продуктивность парвовирусных векторов. Баккер Андре Кристиан, Херменс Вильхельмус Теодорус Йоханнес Мария Кристиан (NL) Область техники Настоящее изобретение относится к областям медицины, молекулярной биологии и генной терапии. Более конкретно, настоящее изобретение относится к клетке насекомого, пригодной для продуцирования рекомбинантных парвовирусных векторов, которые могут использоваться в генной терапии, и к способу получения рекобинантных парвовирусных вирионов. Предпосылки создания изобретения Бакуловирусная экспрессионная система широко известна для ее использования в качестве вектора для клонирования и экспрессии в эукариотических клетках (King, L.A. and R.D. Possee, 1992. "The baculovirus expression system", Chapman and Hall, United Kingdom; O'Reilly, D.R. et al., 1992. Baculovirus Expression Vectors: A Laboratory Manual. New York: W.H. Freeman). Достоинства бакуловирусной экспрессионной системы состоят, среди прочих, в том, что экспрессируемые белки являются почти всегда растворимыми, правильно свернутыми и биологически активными. Дополнительные достоинства включают высокие уровни экспрессии белков, более быструю продукцию, пригодность для экспрессии больших количеств и пригодность для крупномасштабной продукции. Однако при крупномасштабной или длительной продукции гетерологичных белков, используя бакуловирусную экспрессионную систему, в биореакторах с клетками насекомых основной помехой является нестабильность уровней экспрессии, также известная как эффект пассажей. Этот эффект, по крайней мере, отчасти обусловлен рекомбинацией между повторными гомологичными последовательностями в бакуловирусной ДНК. Бакуловирусную экспрессионную систему также успешно использовали для продукции рекомбинантных векторов на основе аденоассоциированного вируса (AAV) (Urabe et al., 2002, Hum. Gene Ther.,13: 1935-1943; патент США 6723551 и заявка на патент США US20040197895). AAV может считаться одним из самых перспективных вирусных векторов для генной терапии человека. AAV обладает способностью к эффективному инфицированию делящихся, а также неделящихся клеток человека, геном вируса AAV интегрируется в один хромосомный сайт в геноме клетки-хозяина, и, что наиболее важно, даже хотя AAV присутствует у многих людей, он никогда не ассоциировался с каким-либо заболеванием. Ввиду этих достоинств рекомбинантный аденоассоциированный вирус (rAAV) в настоящее время оценивают в клинических испытаниях генной терапии гемофилии В, злокачественной меланомы, муковисцидоза, гиперлипопротеинемии типа I и других заболеваний. Для преодоления проблем с системами продукции AAV в клетках млекопитающих Urabe и др.(2002, выше) разработали систему продукции AAV в клетках насекомых. Для продукции AAV в клетках насекомых были необходимы некоторые модификации для достижения правильной стехиометрии трех капсидных белков AAV (VP1, VP2 и VP3), которые обуславливаются комбинацией альтернативного использования двух акцепторных сайтов сплайсинга и субоптимального использования инициирующего кодона ACG для VP2, который не точно воспроизводится клетками насекомых. Для имитации правильной стехиометрии капсидных белков в клетках насекомых Urabe и др. (2002, выше) используют конструкцию, которая транскрибируется в одну полицистронную мРНК, которая способна к экспрессии всех трех белков VP без необходимости сплайсинга и в которой самый "левый" (5') инициирующий кодон замещен субоптимальным инициирующим кодоном ACG. В заявке WO 2007/046703 описывается дальнейшее увеличение инфективности продукции на основе продуцируемых в бакуловирусной экспрессионной системе рекомбинантных AAV (rAAV) векторов путем оптимизации стехиометрии капсидных белков AAV, продуцируемых в клетках млекопитающих. Для экспрессии белков Rep AAV в системе экспрессии AAV в клетках насекомых, первоначально разработанной Urabe и др. (2002, выше), используют рекомбинантную бакуловирусную конструкцию,которая содержит два независимых блока для экспрессии Rep (один для Rep78 и один для Rep52), при этом каждый из них находится под контролем отдельного промотора клеток насекомых, промоторовIE1 и PolH соответственно. Однако Kohlbrenner и др. (2005, Mol. Ther., 12: 1217-1225; WO 2005/072364) опубликовали данные о том, что бакуловирусная конструкция для экспрессии двух белков Rep, использованная Urabe и др., страдает внутренней нестабильностью. Путем разъединения палиндромной установки двух генов Rep в первоначальном векторе Urabe и конструирования двух отдельных бакуловирусных векторов для экспрессии Rep52 и Rep78 Kohlbrenner и др. (2005, выше) увеличили стабильность вектора при пассажах. Однако, несмотря на стойкую экспрессию Rep78 и Rep52 с двух независимых конструкций бакуловирус-Rep в клетках насекомых в пределах по крайней мере 5 пассажей, выход rAAV вектора в 5-10 раз ниже по сравнению с первоначальной конструкцией бакуловирус-Rep, разработанной Urabe и др. (2002, выше). В WO 2007/148971 авторы настоящего изобретения значительно увеличили стабильность продукции rAAV вектора в клетках насекомых путем использования одной кодирующей последовательности для белков Rep78 и Rep52, причем для белка Rep78 используется субоптимальный инициирующий кодон, который отчасти пропускается осуществляющими поиск рибосомами для допущения происхождения инициации трансляции также "правее" (3') в инициирующем кодоне белка Rep52. Однако все еще существует необходимость в дальнейших улучшениях крупномасштабной (промышленной) продукции гетерологичных белков, в том числе rAAV векторов, в клетках насекомых. Таким образом, целью настоящего изобретения является обеспечение средств и способов, которые делают возможной стабильную и с высоким выходом (крупномасштабную) продукцию гетерологичных белков и парвовирусных векторов. Описание изобретения Определения. Используемый здесь термин "функционально связанный" относится к установлению функциональной связи полинуклеотидных (или полипептидных) элементов. Нуклеиновая кислота "функционально связана", когда установлена ее функциональная связь с другой последовательностью нуклеиновой кислоты. Например, регулирующая транскрипцию последовательность функционально связана с кодирующей последовательностью, если она влияет на транскрипцию кодирующей последовательности. Функционально связанный означает, что связываемые последовательности ДНК обычно являются смежными и,если необходимо соединить две кодирующие белки области, смежными и находятся в рамке считывания."Контролирующая экспрессию последовательность" относится к последовательности нуклеиновой кислоты, которая регулирует экспрессию нуклеотидной последовательности, с которой она функционально связана. Контролирующая экспрессию последовательность "функционально связана" с нуклеотидной последовательностью, когда контролирующая экспрессию последовательность контролирует и регулирует транскрипцию и/или трансляцию нуклеотидной последовательности. Таким образом, контролирующая экспрессию последовательность может включать промоторы, энхансеры, участки внутренней посадки рибосомы (IRES), терминаторы транскрипции, инициирующий кодон перед кодирующим белок геном, сигнал сплайсинга для интронов и стоп-кодоны. Предполагается, что термин "контролирующая экспрессию последовательность" включает, как минимум, последовательность, присутствие которой предназначено для оказания влияния на экспрессию, и может также включать дополнительные полезные компоненты. Например, контролирующими экспрессию последовательностями являются лидерные последовательности и последовательности партнеров по слиянию. Этот термин может также включать конструирование последовательности нуклеиновой кислоты из условия, чтобы нежелательные, возможные инициирующие кодоны в рамке и вне нее были удалены из последовательности. Он может также включать конструирование последовательности нуклеиновой кислоты из условия, чтобы были удалены нежелательные возможные сайты сплайсинга. Он включает последовательности или последовательности полиаденилирования (рА), которые управляют добавлением концевой последовательности поли-А, т.е. цепи содержащих аденин остатков, на 3'-конец мРНК, последовательности, упоминаемые как последовательности поли-А. Она также предназначена для усиления стабильности мРНК. Контролирующие экспрессию последовательности, которые влияют на стабильность транскрипции и трансляции, например промоторы, а также последовательности, которые воздействуют на трансляцию, например последовательности Козак, известны в клетках насекомых. Контролирующие экспрессию последовательности могут обладать таким свойством в отношении модулирования нуклеотидной последовательности, с которой они функционально связаны, так что достигаются более низкие уровни экспрессии или более высокие уровни экспрессии. Используемый здесь термин "промотор" или "регулирующая транскрипцию последовательность" относится к фрагменту нуклеиновой кислоты, который функционирует для контроля транскрипции одной или нескольких кодирующих последовательностей, находится относительно направления транскрипции выше сайта инициации транскрипции кодирующей последовательности и структурно идентифицируется по присутствию сайта связывания для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и любых других последовательностей ДНК, включающих, но без ограничения, сайты связывания факторов транскрипции, сайты связывания белков-репрессоров и -активаторов и любые другие последовательности нуклеотидов, известные квалифицированному в данной области техники специалисту, оказывающие непосредственное или опосредованное действие на регулирование степени транскрипции с промотора. "Конститутивным" промотором является промотор, который является активным в большинстве тканей в наиболее физиологических и связанных с развитием условиях."Индуцибельным" промотором является промотор, который регулируется физиологически или в процессе развития, например, при использовании химического индуктора. "Тканеспецифический" промотор активен только в специфических типах тканей или клеток. Термины "в значительной степени идентичные", "значительная идентичность", или "по существу,схожие", или "существенная схожесть" означают, что две пептидные или две нуклеотидные последовательности после оптимального совмещения, например, с помощью программ GAP или BESTFIT с использованием параметров по умолчанию разделяют, по крайней мере, определенный процент идентичности последовательностей, определяемый здесь в другом месте. В GAP используется алгоритм общего совмещения Needleman и Wunsch для совмещения двух последовательностей в пределах их полной длины, максимизирующий число соответствий и минимизирующий число пропусков в последовательностях. Как правило, используемыми в GAP параметрами по умолчанию являются штраф за создание пропуска в последовательности = 50 (нуклеотидов)/8 (белков) и штраф за расширение на каждый последующий пропуск в последовательности = 3 (нуклеотида)/2 (белка). Для нуклеотидов используемой по умолчанию матрицей замен является nwsgapdna, а для белков используемой по умолчанию матрицей замен является ности РНК, по существу, схожи или обладают определенной степенью идентичности последовательностей с последовательностями ДНК, тимин (Т) в последовательности ДНК считается равным урацилу (U) в последовательности РНК. Совмещения последовательностей с определением показателей идентичности последовательностей в процентах можно выполнить, используя компьютерные программы, такие какGCG Wisconsin Package, версию 10.3, доступную от Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, США, или программный продукт с открытым исходным текстом Emboss для Windows (находящуюся в обращении версию 2.7.1-07). В альтернативном случае схожесть или идентичность в процентах можно определить при поиске на фоне баз данных, таком как FASTA, BLAST и т.п. Кодирующие парвовирусные белки Rep нуклеотидные последовательности настоящего изобретения можно также установить по их способности к гибридизации с нуклеотидными последовательностямиSEQ ID NO: 1-4 соответственно, в умеренных или предпочтительно жестких условиях гибридизации. Жесткие условия гибридизации определяют здесь как условия, делающие возможной гибридизацию последовательности нуклеиновой кислоты по крайней мере из приблизительно 25, предпочтительно приблизительно 50 нуклеотидов, 75 или 100 или наиболее предпочтительно из приблизительно 200 или более нуклеотидов, при температуре, составляющей приблизительно 65C, в растворе, содержащем приблизительно 1 М соль, предпочтительно 6SSC, или любом другом растворе, имеющем сопоставимую ионную силу, и отмывку при 65C в растворе, содержащем приблизительно 0,1 М соль или меньше,предпочтительно 0,2SSC, или любом другом растворе, имеющем сопоставимую ионную силу. Предпочтительно гибридизацию проводят в течение ночи, т.е. в течение по крайней мере 10 ч, и предпочтительно отмывку проводят в течение по крайней мере 1 ч по крайней мере с двумя заменами раствора для отмывки. Эти условия будут обычно допускать специфическую гибридизацию последовательностей, идентичных приблизительно на 90% или больше. Умеренные условия определяют здесь как условия, делающие возможной гибридизацию последовательностей нуклеиновых кислот по крайней мере из 50 нуклеотидов, предпочтительно из приблизительно 200 или более нуклеотидов, при температуре, составляющей приблизительно 45C, в растворе,содержащем приблизительно 1 М соль, предпочтительно 6SSC, или любом другом растворе, имеющем сопоставимую ионную силу, и отмывку при комнатной температуре в растворе, содержащем приблизительно 1 М соль, предпочтительно 6SSC, или любом другом растворе, имеющем сопоставимую ионную силу. Предпочтительно гибридизацию проводят в течение ночи, т.е. в течение по крайней мере 10 ч, и предпочтительно отмывку проводят в течение по крайней мере 1 ч по крайней мере с двумя заменами раствора для отмывки. Эти условия будут обычно допускать специфическую гибридизацию последовательностей, имеющих идентичность последовательностей вплоть до 50%. Квалифицированный в данной области техники специалист будет способен модифицировать эти условия гибридизации для того, чтобы специфическим образом идентифицировать последовательности с идентичностью, варьирующей между 50 и 90%. Подробное описание изобретения В некоторых аспектах настоящее изобретение относится к использованию парвовирусов животных,в частности депендовирусов, таких как AMV инфекционных заболеваний человека или обезьян, и их компонентов (например, генома парвовируса животных) в качестве векторов для введения и/или экспрессии нуклеиновых кислот в клетках млекопитающих. В частности, настоящее изобретение относится к увеличениям продуктивности таких парвовирусных векторов после продуцирования в клетках насекомых. Вирусы семейства Parvoviridae представляют собой небольшие ДНК-содержащие вирусы животных. Семейство Parvoviridae можно разделить на два подсемейства: Parvovirinae, которое инфицирует позвоночных, и Densovirinae, которое инфицирует насекомых. Члены подсемейства Parvovirinae упоминаются здесь как парвовирусы и включают род Dependovirus. Как можно сделать вывод из названия их рода, члены Dependovirus уникальны тем, что для эффективного инфицирования культуры клеток требуется их котрансфекция с вирусом-помощником, таким как аденовирус или герпесвирус. Род Dependovirus включает AAV, который обычно инфицирует людей (например, серотипы 1, 2, 3 А, 3 В, 4, 5 и 6) или приматов (например, серотипы 1 и 4), и родственные вирусы, которые инфицируют других теплокровных животных (например, аденоассоциированные вирусы быка, собаки, лошади и овцы). Дополнительная информация о парвовирусах и других членах Parvoviridae приведена в Kenneth I., Berns, "Parvoviridae:The Viruses and Their Replication", Chapter 69 in Fields Virology (3rd Ed. 1996). Для удобства настоящее изобретение далее иллюстрируется и описывается здесь со ссылкой на AAV. Однако предполагается, что настоящее изобретение не ограничивается AAV, а может в равной степени применяться к другим парвовирусам. Геномная организация всех известных серотипов AAV является очень простой. Геном AAV представляет собой линейную, одноцепочечную ДНК-молекулу, длина которой составляет менее приблизительно 5000 нуклеотидов. Инвертированные концевые повторы (ITR) фланкируют уникальные нуклеотидные последовательности, кодирующие неструктурные, участвующие в репликации белки (Rep) и структурные белки (VP). Белки VP (VP1, -2 и -3) образуют капсид. Концевые 145 нуклеотидов являются самокомплементарными и упорядочены так, что может образовываться энергетически стабильный внутримолекулярный дуплекс, образующий Т-образную шпильку. Эти шпилечные структуры функционируют в качестве начала репликации ДНК вируса, служа в качестве праймеров для клеточного комплекса ДНК-полимераза. После инфицирования клеток млекопитающих AAV дикого типа гены Rep (т.е. Rep78 и Rep52) экспрессируются с промотора Р 5 и промотора Р 19 соответственно, и оба белка Rep функционируют при репликации вирусного генома. Явление сплайсинга в ORF Rep приводит к экспрессии фактически четырех белков Rep (т.е. Rep78, Rep68, Rep52 и Rep40). Однако было установлено, что не подвергнутая сплайсингу мРНК, кодирующая белки Rep78 и Rep52, в клетках млекопитающих достаточна для продукции вектора AAV. Также в клетках насекомых белки Rep78 и Rep52 достаточны для продукции вектора AAV."Рекомбинантный парвовирусный или AAV вектор" (или "rAAV вектор") относится здесь к вектору, включающему одну или несколько представляющих интерес полинуклеотидных последовательностей, представляющих интерес генов или "трансгенов", которые фланкированы последовательностями инвертированных концевых повторов (ITR) парвовируса или AAV. Такие rAAV векторы могут реплицироваться и упаковываться в инфекционные вирусные частицы при их присутствии в хозяине-клетке насекомого, который экспрессирует продукты генов rep и cap AAV (т.е. белки Rep и Сар (капсида) AAV). При включении rAAV вектора в большую конструкцию нуклеиновой кислоты (например, в хромосому или в другой вектор, такой как плазмида или бакуловирус, используемый для клонирования или трансфекции) rAAV вектор обычно упоминается как "провектор", который может быть "спасен" путем репликации и инкапсулирования при наличии у AAV функций упаковки и необходимых хелперных функций. В первом аспекте настоящее изобретение относится к клетке насекомого. Клетка насекомого включает, по крайней мере, первую нуклеотидную последовательность, кодирующую первую аминокислотную последовательность, и вторую нуклеотидную последовательность, кодирующую вторую аминокислотную последовательность. Предпочтительно каждая из первой и второй аминокислотных последовательностей включает общую аминокислотную последовательность по крайней мере из 50, 80, 100, 200,300, 350 или 398 аминокислот, идентичных по крайней мере на 80, 85, 90, 95, 98, 99 или 100% между первой и второй аминокислотными последовательностями. В противоположность, нуклеотидные последовательности, кодирующие общие аминокислотные последовательности в первой и второй аминокислотных последовательностях (присутствующие в первой и второй нуклеотидных последовательностях соответственно) идентичны менее чем на 95, 90, 89, 88,4, 85, 80, 75, 70, 65, 60 или 55%. Как правило, первая и вторая аминокислотные последовательности будут гетерологичны клетке насекомого. Предпочтительно по крайней мере одна из общих аминокислотных последовательностей в первой и второй аминокислотных последовательностях является встречающейся в природе аминокислотной последовательностью. Более предпочтительно, когда по крайней мере одна из первой и второй аминокислотных последовательностей является встречающейся в природе аминокислотной последовательностью. Наиболее предпочтительно, когда как первая, так и вторая аминокислотные последовательности являются встречающими в природе аминокислотными последовательностями. В предпочтительном варианте осуществления нуклеотидная последовательность, кодирующая общую аминокислотную последовательность в первой нуклеотидной последовательности, имеет смещение частот использования кодонов в сторону улучшения для клетки насекомого по сравнению с нуклеотидной последовательностью, кодирующей общую аминокислотную последовательность во второй нуклеотидной последовательности. Здесь предполагается, что, где бы не приводилась ссылка на смещение частот использования кодонов для клетки насекомого, оно включает смещение частот использования кодонов для клетки насекомого, инфицированной бакуловирусом, включающее, в частности, смещение частот использования кодонов для клетки, инфицированной множеством нуклеополиэдровирусов (вирусов ядерного полиэдроза) Autographa californica (AcMNPV). Частоты использования кодонов первой нуклеотидной последовательности, кодирующей общую аминокислотную последовательность, предпочтительно адаптируют или оптимизируют к частотам использования кодонов в хозяине-клетке насекомого. Адаптивность нуклеотидной последовательности, кодирующей общую аминокислотную последовательность, к частотам использования кодонов в клетке-хозяине можно представить в виде индекса адаптации кодонов (CAI). Предпочтительно частоты использования кодонов адаптируют к клетке насекомого, в которой присутствуют первая и вторая нуклеотидные последовательности. Обычно она будет представлять собой клетку рода Spodoptera, более предпочтительно клетку Spodoptera frugiperda. Следовательно,частоты использования кодонов предпочтительно адаптируют к Spodoptera frugiperda или к клетке, инфицированной вирусом ядерного полиэдроза Autographa californica (AcMNPV). Индекс адаптации кодонов определяют здесь как показатель относительной адаптивности частот использования кодонов в гене к частотам использования кодонов в высокой степени экспрессируемых генов. Относительная адаптивность каждого кодона представляет собой отношение частоты использования каждого кодона к частоте использования самого распространенного кодона для одной и той же аминокислоты. Индекс CAI определяют как среднее геометрическое этих значений относительных адаптивностей. Несмысловые кодоны и стоп-кодоны (зависящие от генетического кода) исключают. Значения CAI находятся в диапазоне от 0 до 1, при этом большие величины означают большую долю наиболее распространенных кодонов (смот-4 022169 ри, Sharp and Li, 1987, Nucleic Acids Research 15: 1281-1295; также смотри Kim et al., Gene. 1997, 199: 293-301; zur Megede et al., Journal of Virology, 2000, 74: 2628-2635). В предпочтительной клетке насекомого разница между CAI нуклеотидной последовательности, кодирующей общую аминокислотную последовательность в первой и второй нуклеотидных последовательностях, составляет по крайней мере 0,1,0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8. Кроме того, предпочтительно, когда CAI нуклеотидной последовательности,кодирующей общую аминокислотную последовательность в первой нуклеотидной последовательности,составляет по крайней мере 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0. Предпочтительной нуклеотидной последовательностью, кодирующей общую аминокислотную последовательность в первой нуклеотидной последовательности, является кодирующая последовательность, в которой по крайней мере 50, 75, 90, 95, 98 или 99% и предпочтительно все не часто встречающиеся кодоны или менее часто встречающиеся кодоны замещены часто встречающимся кодоном, кодирующим ту же самую аминокислоту, намеченным в табл. 1 или 2. Здесь предполагается, что часто встречающимся кодоном является наиболее часто используемый кодон, кодирующий каждый конкретный аминокислотный остаток в высокой степени экспрессируемых генах Spodoptera frugiperda, представленный в табл. 1, или в высокой степени экспрессируемых генах клеток, инфицированных MNPV Autographa californica, представленный в табл. 2. Все кодоны, отличные от часто встречающихся кодонов, и менее часто встречающиеся кодоны являются "не часто встречающимися кодонами". Не часто встречающиеся кодоны включают "вторые наиболее частые кодоны", под которыми подразумеваются кодоны,имеющие частоту, кроме самой высокой частоты в табл. 1 или 2. Предпочтительно нуклеотидная последовательность, кодирующая общую аминокислотную последовательность в первой нуклеотидной последовательности, имеет непрерывный участок по крайней мере из 25, 50, 100, 200 или 300 кодонов, все из которых являются часто встречающимися кодонами. Кодирующую последовательность можно дополнительно адаптировать для увеличения экспрессии в хозяине-клетке насекомого с помощью способов, описанных в WO 2004/059556, и с помощью изменения процента CpG в кодирующей последовательности,как описано в WO 2006/015789. Предполагается, что результатом таких дополнительных адаптаций является то, что не все кодоны в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность в первой нуклеотидной последовательности, будут часто встречающимися кодонами. В предпочтительном варианте клетки насекомого все кодоны в нуклеотидной последовательности,кодирующей общую аминокислотную последовательность в первой нуклеотидной последовательности,являются часто встречающимися кодонами в соответствии с (или любой из двух) табл. 1 или 2. Более предпочтительно в такой клетке насекомого все кодоны в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность во второй нуклеотидной последовательности, являются вторыми наиболее частыми кодонами в соответствии с (или любой из двух) табл. 1 или 2, в силу чего предполагается, что, если в первой нуклеотидной последовательности часто встречающимися кодонами являются кодоны в соответствии с табл. 1, вторыми наиболее частными кодонами во второй нуклеотидной последовательности являются кодоны также в соответствии с табл. 1, или, если в первой нуклеотидной последовательности часто встречающимися кодонами являются кодоны в соответствии с табл. 2,вторыми наиболее частными кодонами во второй нуклеотидной последовательности являются кодоны также в соответствии с табл. 2. Оптимизацию кодонов можно выполнить на основе частот использования кодонов в организмеSpodoptera frugiperda, которые можно найти в базе данных, касающихся частот использования кодонов(смотри, например, http://www.kazusa.or.jp/codon). В распоряжении квалифицированного специалиста находятся подходящие компьютерные программы для оптимизации кодонов (смотри, например, Jayarajet al., 2005, Nucl. Acids Res., 33(9): 3011-3016 и в Интернете). В альтернативном случае оптимизацию можно выполнить вручную, используя ту же базу данных, касающихся частот использования кодонов. В одном варианте клетки насекомого настоящего изобретения по крайней мере 50, 60, 80, 90 или 100% кодонов в нуклеотидной последовательности, кодирующей общую аминокислотную последовательность во второй нуклеотидной последовательности, изменяют по сравнению с соответствующим кодоном в первой нуклеотидной последовательности для максимизации содержания AT или GC во второй нуклеотидной последовательности. Таким образом, в предпочтительном варианте осуществления настоящего изобретения различие в нуклеотидной последовательности между первой и второй нуклеотидными последовательностями, кодирующими общие аминокислотные последовательности, максимизируют (т.е. минимизируют идентичность нуклеотидных последовательностей) с помощью одного или нескольких изменений: а) изменения неоднозначности кодонов первой нуклеотидной последовательности, кодирующей общую аминокислотную последовательность; b) изменения неоднозначности кодонов второй нуклеотидной последовательности, кодирующей общую аминокислотную последовательность; с) изменения процента GC в первой нуклеотидной последовательности, кодирующей общую аминокислотную последовательность; и d) изменения процента GC во второй нуклеотидной последовательности, кодирующей общую аминокислотную последовательность. Предпочтительный вариант осуществления настоящего изобретения, связанный с клеткой насеко-5 022169 мого, относится к продукции парвовирусных белков в клетках насекомых настоящего изобретения. В частности, парвовирусные белки продуцируют в клетках насекомых в соединении с продукцией рекомбинантных парвовирусных векторов, более предпочтительно рекомбинантных векторов на основе парвовирусов животных и наиболее предпочтительно рекомбинантных AAV векторов. Следовательно, в этом предпочтительном варианте клеток насекомых настоящего изобретения первая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белка Rep52 или 40, а вторая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белкаRep78 или 68. Однако предполагается, что в настоящее изобретение прямо включены варианты осуществления, в которых первая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белка Rep78 или 68, а вторая нуклеотидная последовательность кодирует аминокислотную последовательность парвовирусного белка Rep52 или 40. Для удобства в вариантах осуществления нуклеотидная последовательность, кодирующая парвовирусный белок Rep52 или 40, будет использоваться в качестве первой нуклеотидной последовательности, а нуклеотидная последовательность,кодирующая парвовирусный белок Rep78 или 68, будет использоваться в качестве второй нуклеотидной последовательности, но реверсирование этих вариантов осуществления прямо включено в настоящее изобретение. Общие аминокислотные последовательности, кодируемые первой и второй нуклеотидными последовательностями, включают аминокислотные последовательности, по крайней мере, от второй аминокислоты до самой С-концевой аминокислоты парвовирусного белка Rep52 или 40 или состоят из таких последовательностей. Предпочтительно общие аминокислотные последовательности включают аминокислотные последовательности от первой аминокислоты до самой С-концевой аминокислоты парвовирусного белка Rep52 или 40 или состоят из таких последовательностей. Идентичности между парвовирусными общими аминокислотными последовательностями являются идентичностями, определенными выше для общих аминокислотных последовательностей. Предпочтительно в клетке насекомого парвовирусными белками Rep являются белки Rep аденоассоциированного вируса (AAV). Более предпочтительно парвовирусными белками Rep, кодируемыми первой и второй нуклеотидными последовательностями, являются белки Rep одного и того же серотипа. Под нуклеотидной последовательностью, кодирующей парвовирусные белки Rep, здесь подразумевается нуклеотидная последовательность, кодирующая неструктурные белки Rep, которые необходимы и достаточны для продукции парвовирусных векторов в клетках насекомых, такие как белки Rep78 илиRep68 и Rep52 или Rep40. Предпочтительно нуклеотидная последовательность парвовируса животных происходит из депендовируса, более предпочтительно из аденоассоциированного вируса (AAV) человека или обезьяны и наиболее предпочтительно из AAV, который обычно инфицирует людей (например, серотипов 1, 2, 3 А, 3 В, 4, 5 и 6) или приматов (например, серотипов 1 и 4). Пример нуклеотидной последовательности, кодирующей белки Rep парвовируса животных, приведен в SEQ ID NO: 7, которая представляет часть геномной последовательности AAV серотипа 2, кодирующую белки Rep. КодирующаяRep78 последовательность включает нуклеотиды 11-1878, а кодирующая Rep52 последовательность включает нуклеотиды 683-1876, также представленные отдельно в SEQ ID NO: 1 и 5. Предполагается,что точная молекулярная масса белков Rep78 и Rep52, а также точные положения кодонов инициации трансляции могут различаться между различными парвовирусами. Однако квалифицированный специалист будет знать, как определить соответствующее положение в нуклеотидной последовательности из парвовирусов, отличных от AAV-2. Таким образом, (первую) нуклеотидную последовательность, кодирующую парвовирусный белокRep52, можно также определить как нуклеотидную последовательность:a) которая кодирует полипептид, включающий аминокислотную последовательность, которая идентична по крайней мере на 50, 60, 70, 80, 88, 89, 90, 95, 97, 98 или 99% аминокислотной последовательности SEQ ID NO: 6;b) которая идентична по крайней мере на 50, 60, 70, 80, 81, 82, 85, 90, 95, 97, 98 или 99% нуклеотидной последовательности любой из SEQ ID NO: 1-5 и 10;c) комплементарная цепь которой гибридизуется с последовательностью молекулы нуклеиновой кислоты а) или b);d) последовательность которой отличается от последовательности молекулы нуклеиновой кислоты с) вследствие вырожденности генетического кода. Таким образом, (вторую) нуклеотидную последовательность, кодирующую парвовирусный белокRep78, можно также определить как нуклеотидную последовательность:a) которая кодирует полипептид, включающий аминокислотную последовательность, которая идентична по крайней мере на 50, 60, 70, 80, 88, 89, 90, 95, 97, 98 или 99% аминокислотной последовательности SEQ ID NO: 8;b) которая идентична по крайней мере на 50, 60, 70, 80, 81, 82, 85, 90, 95, 97, 98 или 99% нуклеотидной последовательности с 11 до 1876 положения SEQ ID NO: 7;c) комплементарная цепь которой гибридизуется с последовательностью молекулы нуклеиновой кислоты а) или b);d) последовательность которой отличается от последовательности молекулы нуклеиновой кислоты с) вследствие вырожденности генетического кода. Предпочтительно нуклеотидная последовательность кодирует белки Rep парвовирусов животных,которые необходимы и достаточны для продукции парвовирусных векторов в клетках насекомых. Различные модификации первой и второй кодирующих нуклеотидных последовательностей, определенных выше, включающих, например, последовательности парвовирусов дикого типа, для надлежащей экспрессии в клетках насекомых успешно выполняют путем применения широко известных методов генетической инженерии, таких как методы, описанные, например, в Sambrook and Russell (2001) "Molecular Cloning: A Laboratory Manual (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, New York. Квалифицированному специалисту известны различные дополнительные модификации кодирующих областей, которые могли бы увеличить выход кодируемых белков. Эти модификации находятся в пределах объема настоящего изобретения. В клетках насекомых настоящего изобретения первая и вторая нуклеотидные последовательности являются предпочтительно частью конструкции нуклеиновой кислоты. Клетка насекомого может содержать две отдельные конструкции нуклеиновых кислот, одну для каждой из первой и второй нуклеотидных последовательностей, или клетка насекомого может содержать один тип конструкции нуклеиновой кислоты, включающей как первую, так и вторую нуклеотидные последовательности. В дальнейшем аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты,включающей первую и/или вторую нуклеотидную последовательность, кодирующую первую и вторую аминокислотные последовательности соответственно, которые включают общую аминокислотную последовательность, определенную выше. Предпочтительно первая и/или вторая нуклеотидные последовательности в конструкции кодируют парвовирусные белки Rep, определенные выше. Предпочтительно в конструкции нуклеотидные последовательности, кодирующие первую и вторую аминокислотные последовательности, функционально связаны с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого. Эти контролирующие экспрессию последовательности будут, по крайней мере, включать промотор, который активен в клетках насекомых. Для осуществления на практике настоящего изобретения можно использовать известные квалифицированному в данной области техники специалисту методы экспрессии чужеродных генов в хозяевах-клетках насекомых. Методология молекулярного конструирования и экспрессии полипептидов в клетках насекомых приведена, например, вAgricultural Experimental Station Bull. No. 7555, College Station, Tex.; Luckow, 1991, In Prokop et al., Cloning and Expression of Heterologous Genes in Insect Cells with Baculovirus Vectors' Recombinant DNA Technology and Applications, 97-152; King, L.A. and R.D. Possee, 1992, The baculovirus expression system, Chapman and Hall, United Kingdom; O'Reilly, D.R., L.K. Miller, V.A. Luckow, 1992, Baculovirus Expression Vectors: A Laboratory Manual, New York; W.H. Freeman and Richardson, C.D., 1995, Baculovirus Expression Protocols, Methods in Molecular Biology, volume 39; в патенте 4745051; заявках US 2003148506 и WO 03/074714. Подходящие для транскрипции первой и второй нуклеотидных последовательностей настоящего изобретения промоторы включают, например, промоторы полиэдрина (PolH), p10, p35, IE-1 илиIE-1 и дополнительные промоторы, описанные в приведенных выше ссылках. Поскольку известно, что в клетках млекопитающих экспрессия Rep78 в меньшей степени по сравнению с экспрессией Rep52 благоприятствует высоким выходам векторов (Li et al., 1997, J. Virol., 71: 5236-5243; Grimm et al., 1998, Hum.Gene Ther., 9, 2745-2760), предпочтительно для управления экспрессией белка Rep78 или 68 используют промотор, который слабее промотора, используемого для экспрессии белка Rep52 или 40. Например, для экспрессии белка Rep52 или 40 можно использовать более сильный промотор полиэдрина, а для управления экспрессией белка Rep78 или 68 можно выбрать промотор IE1, промотор, который намного слабее промотора PolH. Предпочтительно выбор промоторов для белка Rep52 или 40 и белка Rep78 или 68 соответственно является таковым, чтобы в клетке насекомого продуцировались Rep78/68 и Rep52/40 в молярном соотношении в диапазоне от 1:10 до 10:1, от 1:5 до 5:1 или от 1:3 до 3:1, предпочтительно через приблизительно 20-40 ч после инфицирования, более предпочтительно через приблизительно 30-40 ч после инфицирования, используя бакуловирусную экспрессию. Молярное соотношение Rep78 и Rep52 можно определить посредством вестерн-блоттинга, предпочтительно используя моноклональное антитело, узнающее эпитоп, общий для Rep78/68 и Rep52/40, или используя, например, мышиное антитело против Rep (303.9, Progen, Германия, в разведении 1:50). Предпочтительно конструкция нуклеиновой кислоты для экспрессии первой и второй нуклеотидных последовательностей настоящего изобретения в клетках насекомых представляет собой совместимый с клеткой насекомого вектор. Предполагается, что "совместимый с клеткой насекомого вектор" или"вектор" представляет собой молекулу нуклеиновой кислоты, способную к эффективной трансформации или трансфекции насекомого или клетки насекомого. Приводимые в качестве примеров биологические векторы включают плазмиды, линейные молекулы нуклеиновых кислот и рекомбинантные вирусы. Можно использовать любой вектор, если он совместим с клеткой насекомого. Вектор может интегрироваться в геном клеток насекомых, но вектор может быть также эписомным. Присутствие вектора в клетке насекомого необязательно является постоянным, и также включены временные эписомные векторы. Вектор можно ввести с помощью любого известного способа, например с помощью химической обработки клеток, электропорации или инфицирования. В предпочтительном варианте осуществления вектором является бакуловирус, вирусный вектор или плазмида. В более предпочтительном варианте осуществления вектором является бакуловирус, т.е. конструкцией является бакуловирусный вектор. Бакуловирусные векторы и способы их применения описываются в упоминаемых выше ссылках на молекулярное конструирование клеток насекомых. Конструкции нуклеиновых кислот настоящего изобретения могут, кроме того, включать контролирующую экспрессию последовательность, включающую девятую нуклеотидную последовательностьSEQ ID NO: 9 или нуклеотидную последовательность, в значительной степени гомологичную SEQ IDNO: 9, 3' от инициирующих кодонов нуклеотидной последовательности, кодирующей первую и/или вторую аминокислотные последовательности. Последовательностью со значительной идентичностью нуклеотидной последовательности SEQ ID NO: 9, которая будет содействовать увеличению экспрессии первой и/или второй аминокислотных последовательностей, является, например, последовательность, которая идентична по крайней мере на 60, 70, 80 или 90% девятой нуклеотидной последовательности SEQ IDNO: 9. Клеткой насекомого может быть любая клетка, которая подходит для продукции гетерологичных белков. Предпочтительно клетка насекомого допускает репликацию бакуловирусных векторов и может сохраняться в культуре. Более предпочтительно клетка насекомого допускает репликацию рекомбинантных парвовирусных векторов, включающих rAAV векторы. Например, используемая линия клеток может происходить из линий клеток Spodoptera frugiperda, Drosophila или линий клеток комаров, например линий клеток, происходящих из Aedes albopictus. Предпочтительными клетками насекомых или линиями клеток являются клетки видов насекомых, которые восприимчивы к инфицированию бакуловирусами,включающие, например, Se301, SeIZD2109, SeUCRl, Sf9, Sf900+, Sf21, BTI-TN-5B1-4, MG-1, Tn368,HzAml, Ha2302, Hz2E5, High Five (Invitrogen, CA, США) и expresSF+ (патент США 6103526, ProteinSciences Corp., CT, США). Предпочтительной клеткой насекомого в соответствии с настоящим изобретением является клетка насекомого для продукции рекомбинантных парвовирусных векторов. Помимо описанных выше "первой" и "второй" нуклеотидных последовательностей или конструкций нуклеиновых кислот, включающих первую и вторую нуклеотидные последовательности, клетка насекомого дополнительно включает:a) третью нуклеотидную последовательность, включающую по крайней мере одну нуклеотидную последовательность инвертированного концевого повтора (ITR) парвовируса;b) четвертую нуклеотидную последовательность, включающую кодирующие белки Сар парвовируса последовательности, функционально связанные с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого. Предполагается, что в контексте настоящего изобретения "по крайней мере одна нуклеотидная последовательность ITR парвовируса" означает палиндромную последовательность, включающую почти полностью комплементарные, симметрично расположенные последовательности, также упоминаемые как участки "А", "В" и "С". ITR функционирует в качестве начала репликации, сайта, играющего цисрегуляторную роль в репликации, т.е. являющегося сайтом распознавания действующими в трансположении белками, участвующими в репликации, такими как, например, Rep78 (или Rep68), которые распознают палиндром и специфические последовательности внутри палиндрома. Одним исключением из симметрии последовательности ITR является участок "D" ITR. Он является уникальным (не имеющим комплемента внутри одного ITR). Разрыв одноцепочечной ДНК происходит в месте соединения участков А и D. Оно является участком, в котором инициируется синтез новой ДНК. Участок D обычно располагается с одной стороны палиндрома и задает направленность стадии репликации нуклеиновой кислоты. Парвовирус, реплицирующийся в клетке млекопитающего, обычно имеет две последовательности ITR. Однако можно сконструировать ITR так, чтобы сайты связывания находились на обеих цепях участков А, а участки D располагались симметрично, по одному с каждой стороны палиндрома. На матрице (например, плазмиде) в виде двухцепочечной кольцевой ДНК репликация ДНК, выполняемая с помощьюRep78 или Rep68, затем осуществляется в обоих направлениях, и один ITR является достаточным для репликации парвовирусного кольцевого вектора. Таким образом, в контексте настоящего изобретения можно использовать одну нуклеотидную последовательность ITR. Предпочтительно, однако, когда используют две или даже другое число обычных ITR. Наиболее предпочтительно, когда используют две последовательности ITR. Предпочтительной парвовирусной ITR является AAV ITR. С целью безопасности может быть желательным конструирование рекомбинантного парвовирусного (rAAV) вектора, который не способен к дальнейшему размножению после первоначального введения в клетку в присутствии второго AAV. Такой механизм безопасности для ограничения нежелательного размножения вектора в реципиенте может быть обеспечен путем использования rAAV с химерными ITR, как описано вUS2003148506. Число конструкций нуклеиновых кислот, используемых в клетке насекомого для продукции рекомбинантного парвовирусного (rAAV) вектора, не ограничивается в настоящем изобретении. Например, для продукции rAAV в клетках насекомых в соответствии со способами настоящего изобретения можно использовать одну, две, три, четыре, пять или более отдельных конструкций. При использовании пяти конструкций одна конструкция кодирует VP1 AAV, другая конструкция кодирует VP2 AAV, еще одна конструкция кодирует VP3 AAV, еще одна конструкция кодирует белок Rep, определенный выше, а пятая конструкция включает по крайней мере один ITR AAV. При использовании менее пяти конструкций конструкции могут включать различные комбинации по крайней мере из одного ITR AAV и последовательностей, кодирующих VP1, VP2, VP3 или белок Rep. Предпочтительно, когда используют две, три или четыре конструкции. При использовании двух конструкций предпочтительно, когда клетка насекомого включает (А) первую конструкцию нуклеиновой кислоты для экспрессии определенных выше белков Rep, дополнительно включающую четвертую нуклеотидную последовательность, определенную в b) выше (включающую кодирующие белки Сар парвовируса последовательности, функционально связанные по крайней мере с одной контролирующей экспрессию последовательностью для экспрессии в клетке насекомого; смотри также ниже); и (В) третью конструкцию нуклеиновой кислоты, включающую третью нуклеотидную последовательность, определенную в а) выше (включающую по крайней мере одну нуклеотидную последовательность ITR парвовируса/AAV). При использовании трех конструкций предпочтительно, когда используют конфигурацию,одинаковую с используемой для двух конструкций конфигураций, за исключением того, что отдельные конструкции используют для экспрессии капсидных белков и для экспрессии белков Rep. При использовании четырех конструкций предпочтительно, когда используют конфигурацию, одинаковую с используемой для трех конструкций конфигураций, за исключением того, что отдельные конструкции используют для экспрессии белков Rep78/68 и для экспрессии белков Rep52/40. Последовательности в каждой конструкции могут располагаться в любом порядке относительно друг друга. Например, если одна конструкция включает повторы ITR и включающие ORF нуклеотидные последовательности, кодирующие капсидные белки VP, ORF VP может иметь в конструкции такое месторасположение, что при репликации ДНК между последовательностями ITR ORF VP реплицируется или не реплицируется. Ради другого примера кодирующие Rep последовательности и/или включающие ORF нуклеотидные последовательности, кодирующие капсидные белки VP, могут располагаться в конструкции в любом порядке. Предполагается, что третья, четвертая и дальнейшие конструкции нуклеиновых кислот также предпочтительно являются совместимыми с клеткой насекомого векторами, предпочтительно бакуловирусными векторами, описанными выше. В альтернативном случае в клетке насекомого настоящего изобретения одна или несколько из первой нуклеотидной последовательности, третьей нуклеотидной последовательности, четвертой нуклеотидной последовательности и пятой нуклеотидной последовательности и необязательных дальнейших нуклеотидных последовательностей могут быть устойчиво интегрированы в геном клетки насекомого. Специалист со средним уровнем компетентности в данной области техники знает, как осуществить устойчивое включение нуклеотидной последовательности в геном насекомого и как идентифицировать клетку, имеющую в геноме такую нуклеотидную последовательность. Включению в геном может содействовать, например, использование вектора, включающего нуклеотидную последовательность,в высокой степени гомологичную областям генома насекомого. Использование специфических последовательностей, таких как транспозоны, является другим способом включения нуклеотидной последовательности в геном. Здесь предполагается, что в настоящем изобретении четвертая нуклеотидная последовательность,включающая кодирующие белки капсида (Сар) парвовируса последовательности, включает последовательности, кодирующие каждый из трех капсидных белков парвовируса, VP1, -2 и -3. Четвертая нуклеотидная последовательность, включающая кодирующие капсидные белки последовательности, может присутствовать в различных формах. Например, могут использоваться отдельные кодирующие последовательности для каждого из капсидных белков VP1, -2 и -3, в силу чего каждая кодирующая последовательность функционально связана с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого. Однако более предпочтительно, когда четвертая нуклеотидная последовательность включает одну открытую рамку считывания, кодирующую все три капсидных белка парвовируса животных (AAV) VP1, -2 и -3, причем кодон инициации трансляции капсидного белка VP1 является субоптимальным инициирующим кодоном, который не является ATG, как, например, описано Urabe и др.(2002, выше) и в WO 2007/046703. Субоптимальный инициирующий кодон для капсидного белка VP1 можно выбрать из ACG, TTG, CTG и GTG, из которых CTG и GTG являются наиболее предпочтительными. Четвертая нуклеотидная последовательность для экспрессии капсидных белков может, кроме того,включать по крайней мере одну из модификаций, описанных в WO 2007/046703. Квалифицированному специалисту известны различные дополнительные модификации кодирующих VP областей, которые могли бы увеличить выход VP и вириона или обладать другими желательными эффектами, такими как измененный тропизм, или уменьшать антигенность вириона. Эти модификации находятся в пределах объема настоящего изобретения. Предпочтительно нуклеотидная последовательность настоящего изобретения, кодирующая парвовирусные капсидные белки, функционально связана с контролирующими экспрессию последовательностями для экспрессии в клетке насекомого, которые будут, по крайней мере, включать промотор, который активен в клетках насекомых. Такие контролирующие последовательности и дополнительные методы и материалы (например, векторы) для экспрессии парвовирусных капсидных белков в хозяевах-клетках насекомых уже описаны выше для белков В предпочтительном варианте осуществления настоящего изобретения третья нуклеотидная последовательность, присутствующая в клетках насекомых настоящего изобретения, т.е. последовательность,включающая по крайней мере один ITR парвовируса (AAV), дополнительно включает по крайней мере одну нуклеотидную последовательность, кодирующую представляющий интерес продукт гена, в силу чего по крайней мере одна нуклеотидная последовательность, кодирующая представляющий интерес продукт гена, становится включенной в геном рекомбинантного парвовирусного (rAAV) вектора, продуцируемого в клетке насекомого. Предпочтительно по крайней мере одна нуклеотидная последовательность, кодирующая представляющий интерес продукт гена, является последовательностью для экспрессии в клетке млекопитающего. Предпочтительно третья нуклеотидная последовательность включает две нуклеотидные последовательности ITR парвовируса (AAV), при этом по крайней мере одна нуклеотидная последовательность, кодирующая представляющий интерес продукт гена, располагается между двумя нуклеотидными последовательностями ITR парвовируса (AAV). Предпочтительно нуклеотидная последовательность, кодирующая представляющий интерес продукт гена (для экспрессии в клетке млекопитающего), будет включаться в рекомбинантный парвовирусный (rAAV) вектор, продуцируемый в клетке насекомого, если она располагается между двумя обычными ITR или располагается с одной из двух сторон ITR, сконструированного с двумя участками D. Определенная здесь выше третья нуклеотидная последовательность может, таким образом, включать нуклеотидную последовательность, кодирующую по крайней мере один "представляющий интерес продукт гена", для экспрессии в клетке млекопитающего, расположенную так, что она будет включаться в рекомбинантный парвовирусный (rAAV) вектор, реплицируемый в клетке насекомого. Любая нуклеотидная последовательность может быть включена для последующей экспрессии в клетке млекопитающего, трансфецированной рекомбинантным парвовирусным (rAAV) вектором, продуцированным в соответствии с настоящим изобретением. Нуклеотидная последовательность может, например, кодировать белок, она может экспрессировать агент для интерференции РНК, т.е. молекулу РНК, которая способна к интерференции РНК, такую как малая шпилечная РНК или малая интерферирующая РНК. "Малая интерферирующая РНК" означает малую интерферирующую РНК, которая представляет собой двухцепочечную РНК небольшой длины, которая не является токсичной в клетках млекопитающих (Elbashir et al.,2001, Nature 411: 494-498; Caplen et al., 2001, Proc. Natl. Acad. Sci., USA, 98: 9742-9747). В предпочтительном варианте осуществления третья нуклеотидная последовательность может включать две нуклеотидные последовательности, и каждая из них кодирует один представляющий интерес продукт гена для экспрессии в клетке млекопитающего. Каждая из двух нуклеотидных последовательностей, кодирующая представляющий интерес продукт гена, расположена так, что она будет включаться в рекомбинантный парвовирусный (rAAV) вектор, реплицируемый в клетке насекомого. Представляющий интерес продукт гена для экспрессии в клетке млекопитающего может быть терапевтическим генным продуктом. Терапевтический генный продукт может быть полипептидом или молекулой РНК (малой интерферирующей РНК) или другим продуктом гена, который после экспрессии в целевой клетке обеспечивает желательный терапевтический эффект, такой как, например, удаление нежелательной активности, например удаление инфицированной клетки, или комплементация генетического дефекта, например, вызывающего недостаток ферментативной активности. Примеры полипептидных продуктов генов включают CFTR, фактор IX, липопротеинлипазу (LPL, предпочтительно LPLS447X; смотри WO 01/00220), аполипопротеин А 1, уридиндифосфат-глюкуронозилтрансферазу (UGT),относящийся к ГТФазам регуляторный взаимодействующий белок при пигментной дегенерации сетчатки(PBGD) и аланин-глиоксилат-аминотрансферазу. Альтернативно или дополнительно, в качестве третьего продукта гена определенная здесь выше третья нуклеотидная последовательность может включать нуклеотидную последовательность, кодирующую полипептид, который служит в качестве маркерных белков для оценки трансформации клетки и экспрессии в ней. Подходящими для этой цели маркерными белками являются, например, флуоресцентный белок GFR и гены селектируемых маркеров: тимидинкиназы HSV (для отбора с использованием среды HAT), бактериальной гигромицин В-фосфотрансферазы (для отбора с использованием гигромицина В), Tn5-аминогликозид-фосфотрансферазы (для отбора с использованием G418) и дигидрофолатредуктазы (DHFR) (для отбора с использованием метотрексата), CD20, ген фактора роста нервов с низкой аффинностью. Источники получения этих маркерных генов и способы их применения предоставлены вSambrook and Russel (2001) "Molecular Cloning: A Laboratory Manual (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, New York. Кроме того, определенная здесь выше третья нуклеотидная последовательность может включать нуклеотидную последовательность, кодирующую полипептид, который может служить в качестве надежного механизма, позволяющего излечить субъектов от клеток, трансдуцированных рекомбинантным парвовирусным (rAAV) вектором настоящего изобретения, если это считается необходимым. Такая нуклеотидная последовательность, часто упоминаемая как ген "самоубийства", кодирует белок, который способен к превращению пролекарства в токсическое вещество, которое способно вызывать гибель трансгенных клеток, в которых экспрессируется белок. Подходящие примеры таких генов "самоубийства" включают, например, ген цитозин-дезаминазы E. coli или один из генов тимидинкиназ из вируса простого герпеса, цитомегаловируса и вируса ветряной оспы,при этом в качестве пролекарства может использоваться ганцикловир для вызова гибели трансгенных клеток у субъекта (смотри, например, Clair et al., 1987, Antimicrob. Agents Chemother. 31: 844-849). В другом варианте осуществления одним из представляющих интерес продуктов генов может быть белокAAV, в частности белок Rep, такой как Rep78 или Rep68, или его функциональный фрагмент. Нуклеотидная последовательность, кодирующая Rep78 и/или Rep68, если она присутствует в геноме рекомбинантного парвовирусного (rAAV) вектора настоящего изобретения и экспрессируется в клетке млекопитающего, трансдуцированной этим вектором, допускает интеграцию рекомбинантного парвовирусного(rAAV) вектора в геном трансдуцированной клетки млекопитающего. Экспрессия Rep78 и/или Rep68 вrAAV-трансдуцированной или -инфицированной клетке млекопитающего может обеспечить преимущество некоторым применениям рекомбинантного парвовирусного (rAAV) вектора путем дозволения долгосрочной или постоянной экспрессии любого другого представляющего интерес продукта гена, введенного в клетку с помощью вектора. В рекомбинантных парвовирусных (rAAV) векторах настоящего изобретения по крайней мере одна нуклеотидная последовательность, кодирующая представляющий интерес продукт гена, для экспрессии в клетке млекопитающего предпочтительно функционально связана по крайней мере с одной совместимой с клеткой млекопитающего контролирующей экспрессию последовательностью, например промотором. Множество таких промоторов известно в данной области техники (смотри Sambrook and Russel, 2001,выше). Могут использоваться конститутивные промоторы, которые более или менее экспрессируются во многих типах клетках, такие как промотор CMV. Однако более предпочтительными будут промоторы,которые являются индуцибельными, тканеспецифическими, специфичными в отношении типа клеток или специфичными для клеточного цикла. Например, для специфичной для печени экспрессии промотор можно выбрать из промотора 1-антитрипсина (ААТ), промотора связывающегося с гормоном щитовидной железы глобулина, промотора альбумина, промотора LPS (связывающегося с тироксином глобулина), гибридного промотора HCR-ApoCII, гибридного промотора HCR-hAAT, промотора ААТ, объединенного с энхансерным элементом гена альбумина мыши (Ealb) и промотора аполипопротеина Е. Другие примеры включают промотор E2F для опухолевоспецифической и, в частности, специфической в отношении опухолей из клеток нервной системы экспрессии (Parr et al., 1997, Nat. Med., 3: 1145-1149) или промотор IL-2 для использования в мононуклеарных клетках крови (Hagenbaugh et al., 1997, J. Exp. Med.,185: 2101-2110).AAV может инфицировать ряд клеток млекопитающих; смотри, например, Tratschin и др. (1985,Mol. Cell Biol. 5: 3251-3260) и Grimm и др. (1999, Hum. Gene Ther. 10: 2445-2450). Однако трансдукцияAAV синовиальных фибробластов человека является значительно более эффективной, чем аналогичных клеток мыши (Jennings et al., Arthritis Res., 3:1 (2001, а тропность AAV к клеткам отличается среди серотипов; смотри, например, Davidson и др. (2000, Proc. Natl. Acad. Sci. USA, 97: 3428-3432), которые обсуждают различия среди AAV2, AAV4 и AAV5 в отношении тропизма к клеткам ЦНС млекопитающих и эффективности трансдукции. Последовательности AAV, которые могут использоваться в настоящем изобретении для продукции рекомбинантных AAV векторов в клетках насекомых, могут происходить из генома любого серотипаAAV. Как правило, серотипы AAV имеют геномные последовательности со значительной гомологией на аминокислотном уровне и уровне нуклеиновой кислоты, обуславливают идентичный ряд генетических функций, обеспечивают вирионы, которые, по существу, физически и функционально эквиваленты, и реплицируются и собираются с помощью практически идентичных механизмов. Ради геномной последовательности различных серотипов AAV и обзора геномных сходств смотри, например, входящий номер вet al. (2000, J. Vir., 74: 8635-8647). Серотипы 1, 2, 3, 4 и 5 AAV являются предпочтительным источником нуклеотидных последовательностей AAV для использования в контексте настоящего изобретения. Предпочтительно последовательности ITR AAV для использования в контексте настоящего изобретения происходят из AAV1, AAV2 и/или AAV4. Также кодирующие Rep (Rep78/68 и Rep52/40) последовательности предпочтительно происходят из AAV1, AAV2 и/или AAV4. Последовательности, кодирующие капсидные белки VP1, VP2 и VP3, для использования в контексте настоящего изобретения могут, однако,быть получены из любого из 42 известных серотипов, более предпочтительно из AAV1, AAV2, AAV3,AAV4, AAV5, AAV6, AAV7, AAV8 или AAV9 или вновь разработанных AAV-подобных частиц, полученных, например, с использованием методов перетасовки капсидных белков и библиотек капсидных белков AAV. Последовательности Rep и ITR AAV являются особенно консервативными среди большинства серотипов. Белки Rep78 различных серотипов AAV, например, идентичны более чем на 89%, и идентичность нуклеотидных последовательностей в целом на геномом уровне между AAV2, AAV3A, AAV3B и комплементами (т.е. функционально заменяют) для соответствующих последовательностей из других серотипов при продукции частиц AAV в клетках млекопитающих. В заявке US2003148506 публикуются данные о том, что последовательности Rep и ITR AAV также являются эффективными встречными комплементами для других последовательностей Rep и ITR AAV в клетках насекомых. Известно, что белки VP AAV определяют тропность вириона AAV к клеткам. Кодирующие белкиVP последовательности значительно менее консервативны, чем гены и белки Rep среди различных серотипов AAV. Способность последовательностей Rep и ITR служить встречными комплементами для соответствующих последовательностей других серотипов допускает продукцию псевдотиповых частицrAAV, включающих капсидные белки одного серотипа (например, AAV1) и последовательности Rep и/или ITR другого серотипа AAV (например, AAV2). Такие псевдотиповые частицы rAAV являются частью настоящего изобретения. Модифицированные последовательности "AAV" можно также использовать в контексте настоящего изобретения, например, для продукции rAAV векторов в клетках насекомых. Такие модифицированные последовательности, например, включают последовательности, идентичные по крайней мере приблизительно на 70%, по крайней мере приблизительно на 75%, по крайней мере приблизительно на 80%, по крайней мере приблизительно на 85%, по крайней мере приблизительно на 90%, по крайней мере приблизительно на 95% или более на уровне нуклеотидной и/или аминокислотной последовательности (например, последовательность, идентичная на уровне нуклеотидной последовательности приблизительно на 75-99%) последовательностям ITR, Rep или VP AAV дикого типа. Последовательности ITR, Rep илиVP AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8 или AAV9 можно использовать вместо последовательностей ITR, Rep или VP AAV дикого типа. Схожий во многих отношениях с другими серотипами AAV серотип AAV5 отличается от других серотипов AAV человека и обезьяны больше, чем другие известные серотипы человека и обезьяны. Ввиду этого продукция rAAV5 может отличаться от продукции других серотипов в клетках насекомых. Если способы настоящего изобретения используются для продукции rAAV5, предпочтительно, чтобы в случае одной или более конструкций, включающих в совокупности в случае более одной конструкции нуклеотидную последовательность, включающую ITR AAV5, нуклеотидная последовательность включала последовательность, кодирующую Rep AAV5 (т.е. чтобы нуклеотидная последовательность включалаRep78 AAV5). Такие последовательности ITR и Rep можно модифицировать согласно требованиям для получения эффективной продукции rAAV5 или псевдотиповых rAAV5 векторов в клетках насекомых. Например, можно модифицировать инициирующий кодон последовательностей Rep, можно модифицировать или элиминировать сайты сплайсинга VP и/или можно модифицировать инициирующий кодонVP1 и близлежащие нуклеотиды для увеличения продукции rAAV5 векторов в клетке насекомого. В другом аспекте настоящее изобретение относится к способу продукции рекомбинантного парвовирусного (rAAV) вириона (включающего определенный выше рекомбинантный парвовирусный (rAAV) вектор) в клетке насекомого. Предпочтительно способ включает стадии (а) культивирования определенной здесь выше клетки насекомого в таких условиях, что продуцируется рекомбинантный парвовирусный (rAAV) вектор, и (b) выделения рекомбинантного парвовирусного (rAAV) вектора. Здесь предполагается, что продуцируемый этим способом рекомбинантный парвовирусный (rAAV) вектор предпочтительно представляет собой инфекционный парвовирусный или AAV-вирион, который включает нуклеиновые кислоты рекомбинантного парвовирусного (rAAV) вектора. Условия выращивания клеток насекомых в культуре и продукция гетерологичных продуктов в клетках насекомых в культуре широко известны в данной области техники и описываются, например, в приведенных выше ссылках на молекулярное конструирование клеток насекомых (смотри, например, WO 2007/046703). Предпочтительно способ, кроме того, включает стадию очистки по сродству рекомбинантного парвовирусного (rAAV) вектора (включающих его вирионов), используя антитело против AAV, предпочтительно иммобилизованное антитело. Антитело против AAV предпочтительно является моноклональным антителом. Особенно подходящим антителом является одноцепочечное антитело семейства верблюдовых или его фрагмент, например, получаемых из верблюдов или лам (смотри, например, Muyldermans,2001, Biotechnol., 74: 277-302). Предпочтительно антителом для очистки по сродству rAAV является антитело, которые специфически связывается с эпитопом капсидного белка AAV, в силу чего предпочтительно эпитопом является эпитоп, который присутствует в капсидном белке более чем одного серотипаAAV. Например, можно индуцировать или отобрать антитело на основе специфического связывания с капсидом AAV2, но в то же самое время оно может также специфически связываться с капсидами AAV1,AAV3 и AAV5. В еще одном аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты,включающей первую и вторую нуклеотидные последовательности, определенные здесь выше. В отличном аспекте настоящее изобретение относится к способу продукции рекомбинантного парвовирусного (rAAV) вириона (включающего определенный выше рекомбинантный парвовирусный(rAAV) вектор) в клетке насекомого. Предпочтительно способ включает стадии (а) культивирования определенной здесь выше клетки насекомого в таких условиях, что продуцируется рекомбинантный парвовирусный (rAAV) вектор, причем клетка насекомого включает по крайней мере одну конструкцию нук- 12022169 леиновой кислоты для экспрессии парвовирусных белков Rep78/68 и Rep52/40 (такую как, например,конструкцию нуклеиновой кислоты, включающую первую и вторую нуклеотидные последовательности,определенные здесь выше) и, кроме того, включает третью и четвертую нуклеотидные последовательности, определенные здесь выше, и где конструкция(и) нуклеиновой кислоты для экспрессии парвовирусных белков Rep78/68 и Rep52/40 дает уровень экспрессии Rep52/40 в клетке насекомого, который превышает уровень экспрессии Rep78/68 на молярной основе; и (b) выделения рекомбинантного парвовирусного (rAAV) вектора. Предпочтительно в способе молярное соотношение белков Rep52/40 и Rep78/68 в клетке насекомого превышает 10:1, предпочтительно оно составляет по крайней мере 11:1, 15:1, 20:1,30:1, 40:1, 50:1 или 60:1. Превышающее 10:1 молярное соотношение белков Rep52/40 и Rep78/68 в клетке насекомого предпочтительно приводит к большей доли полноценных вирионов (т.е. включающих геномrAAV) по отношению к пустым вирионам (смотри, например, фиг. 8). Однако слишком высокое молярное соотношение белков Rep52/40 и Rep78/68 может приводить к меньшему титру продуцируемыхrAAV, определяемому по числу копий генов. Поэтому в одном варианте осуществления молярное соотношение белков Rep52/40 и Rep78/68 составляет менее чем 100:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1 или 20:1. Молярное соотношение белков Rep52/40 и Rep78/68 можно определить посредством вестернблоттинга, как описано в WO 2007/148971, предпочтительно используя моноклональное антитело, которое узнает эпитоп, общий для Rep78/68 и Rep52/40, или используя антитело, описанное в WO 2007/148971. Предпочтительно минимальное молярное соотношение белков Rep52/40 и Rep78/68, указанное выше, достигается через приблизительно 20-40 ч после инфицирования, более предпочтительно через приблизительно 30-40 ч после инфицирования, используя бакуловирусную или схожую экспрессионную систему. Существуют различные способы увеличения относительного уровня экспрессии белков Rep52/40 по сравнению с белком Rep78/68. В случае использования одного транскрипционного блока для экспрессии белков и Rep78/68, и Rep52/40 последовательность, кодирующую белки Rep78/68 и Rep52/40, можно адаптировать следующим образом для получения молярного соотношения белков Rep52/40 и Rep78/68 в клетке насекомого, превышающего 10:1: а) кодон инициации трансляции белка Rep78/68 можно преобразовать в субоптимальный инициирующий кодон и/или его субоптимальное окружение, как описано в WO 2007/148971;b) исключением одной или более или всех (9) последовательностей ATG, которые встречаются между началами трансляции генов Rep78/68 и Rep52/40, соответственно предпочтительно с помощью изокодонных замен в нуклеотидной последовательности. Это успешно выполнено, например, в кодирующейc) оптимизацией окружения кодона инициации трансляции белка Rep52/40 в соответствии с оптимальным окружением инициирующего кодона 5'-NNNNNNAUGA a/c/g N-3' для эффективной инициации трансляции в клетках чешуекрылых (как описано Chang et al., 1999, Virology, 259: 369-383);d) включением контролирующей экспрессию последовательности, включающей девятую нуклеотидную последовательность SEQ ID NO: 9 или нуклеотидную последовательность, в значительной степени гомологичную SEQ ID NO: 9, 5' от инициирующих кодонов белка Rep52/40;e) смещением частот использования кодонов в части последовательности, кодирующей белокRep52/40, в сторону улучшения для экспрессии в клетках насекомых (как описано выше);f) изменением частот использования кодонов в части кодирующей последовательности между началами трансляции белков Rep78/68 и Rep52/40, вследствие чего она становится менее адаптированной к экспрессии в клетках насекомых (как описано выше). Комбинации способов a)-f) включены в настоящее изобретение и в предпочтительном варианте осуществления а) объединяют по крайней мере с одним из способов b)-f). Альтернативно и/или дополнительно, для экспрессии белка Rep52/40 можно использовать второй транскрипционный блок. Экспрессию белка Rep52/40 с этого второго транскрипционного блока можно увеличить с помощью одного или более следующих способов: а) использование промотора для блока для транскрипции Rep52/40, более сильного по сравнению с промотором для блока для Rep78/68 (смотри ниже);b) увеличение числа копий блока для транскрипции Rep52/40 по сравнению с числом копий блока для Rep78/68;c) смещение частот использования кодонов в последовательности, кодирующей белок Rep52/40, в сторону улучшения для экспрессии в клетках насекомых (как описано выше, например, SEQ ID NO: 2 или 10);d) оптимизация окружения кодона инициации трансляции белка Rep52/40 в соответствии с оптимальным окружением инициирующего кодона 5'-NNNNNNAUGA a/c/g N-3' для эффективной инициации трансляции в клетках чешуекрылых (как описано Chang et al., выше);e) включение контролирующей экспрессию последовательности, включающей девятую нуклеотидную последовательность SEQ ID NO: 9 или нуклеотидную последовательность, в значительной степени гомологичную SEQ ID NO: 9, 5' от инициирующих кодонов белка Rep52/40. Примером конструкции, в которой для экспрессии белков Rep78/68 и Rep52/40 используются два отдельных транскрипционных блока, является конструкция pVD183, описанная здесь в примерах 2 и 3. Конструкции нуклеиновых кислот для использования в способе продукции рекомбинантного парвовирусного вириона (и получения уровня экспрессии Rep52/40 в клетке насекомого, превышающего уровень экспрессии Rep78/68 на молярной основе) являются дальнейшим аспектом настоящего изобретения. Здесь предполагается, что рекомбинантный парвовирусный (rAAV) вектор, продуцируемый указанным способом, предпочтительно является парвовирусным или AAV-вирионом, который включает нуклеиновые кислоты рекомбинантного парвовирусного (rAAV) вектора. Условия выращивания клеток насекомых в культуре и продукция гетерологичных продуктов в клетках насекомых в культуре широко известны в данной области техники и описываются, например, в приведенных выше ссылках на молекулярное конструирование клеток насекомых (смотри также WO 2007/046703). Предпочтительно способ,кроме того, включает стадию очистки по сродству рекомбинантного парвовирусного (rAAV) вектора(включающих его вирионов), используя антитело против AAV, описанное выше. Первый промотор, являющийся таким же сильным, как и второй промотор, или сильнее него для использования в настоящем изобретении можно определить следующим образом. Силу промотора можно определить по экспрессии, которую получают в условиях, используемых в способе настоящего изобретения. В предпочтительном варианте осуществления первый промотор или второй промотор выбирают из группы, состоящей из промотора PolH, промотора р 10, промотора основного белка, индуцибельного промотора, или промотора deltaE1, или промотора Е 1, или промотора любого другого позднего или очень позднего бакуловирусного гена. Более предпочтительно, когда первый промотор выбирают из группы, состоящей из промотора PolH, промотора р 10 или промотора основного белка, а вторым промотором является промотор deltaE1, или промотор Е 1, или промотор любого другого раннего или позднего бакуловирусного гена. Предпочтительно первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор р 10, а вторым промотором является промотор PolH или промотор 4xHsp27 EcRE+минимальный Hsp70. В другом варианте осуществления первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор 4xHsp27EcRE+минимальный Hsp70, а вторым промотором является промотор PolH. В еще одном варианте осуществления первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор PolH, а вторым промотором является промотор р 10, deltaE1 или Е 1. В еще одном варианте осуществления первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор PolH, а вторым промотором является промотор deltaE1 или Е 1. В еще одном варианте осуществления первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор р 10, а вторым промотором является промотор deltaE1 или Е 1. В еще одном варианте осуществления первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор PolH и вторым промотором является PolH. Наиболее предпочтительно, когда первым промотором в конструкции нуклеиновой кислоты настоящего изобретения является промотор PolH, а вторым промотором является deltaE1. Подразумевается, что "энхансерный элемент" или "энхансер" определяет последовательность, усиливающую активность промотора (т.е. увеличивающую степень транскрипции последовательности, расположенной 3' от промотора), которая не обладает, в противоположность промотору, промоторной активностью и может, как правило, функционировать независимо от ее местонахождения относительно промотора (т.е. 5' или 3' от промотора). Энхансерные элементы широко известны в данной области техники. Не ограничивающие примеры энхансерных элементов (или их частей), которые могли бы использоваться в настоящем изобретении, включают энхансеры бакуловируса и энхансерные элементы, обнаруживаемые в клетках насекомых. Предпочтительно, чтобы энхансерные элементы увеличивали в клетке экспрессию мРНК с гена, с промотором которого они функционально связаны по крайней мере на 25%,более предпочтительно по крайней мере на 50%, даже более предпочтительно по крайней мере на 100% и наиболее предпочтительно по крайней мере на 200% по сравнению с экспрессией мРНК с гена в отсутствие энхансерного элемента. Экспрессию мРНК можно определить, например, с помощью количественной ОТ-ПЦР. Предпочтительным здесь является использование энхансерного элемента для усиления экспрессии парвовирусного белка Rep. Таким образом, в дальнейшем предпочтительном варианте осуществления первая экспрессионная кассета включает по крайней мере один бакуловирусный энхансерный элемент и/или по крайней мере один реагирующий на экдизон элемент. Предпочтительно энхансерный элемент выбирают из группы, состоящей из hr1, hr2, hr3, hr4 и hr5. В этом документе и в его формуле изобретения глагол "включать" или его спряжения используется в его неограниченном смысле со значением, что следующие за этим словом объекты включены, но не исключаются объекты, прямо не упомянутые. Кроме того, ссылка на элемент с использованием неопределенного артикля "а" или "an" не исключает возможность того, что представлено более одного элемента, если только в контексте не настаивается на одном или только одном из элементов. Следовательно,неопределенный артикль "а" или "an", как правило, означает "по крайней мере один". Все приведенные в описании настоящего изобретения ссылки на патенты и литературные ссылки тем самым полностью включены посредством ссылки. Следующие примеры предлагаются только для иллюстративных целей и, как предполагается, не ограничивают никоим образом объем настоящего изобретения. Описание чертежей Фиг. 1 - физическая карта pVD183. Фиг. 2 - соотношение чисел геномных копий гена ORF 1629 и гена Rep в образцах бакуловирусов,отобранных при различных пассажах бакуловирусной конструкции Bac.FBDSLR (Urabe et al., 2002, HumGene Ther., 13(16): 1935-1943). Число геномных копий определяли с помощью количественной ПЦР(кПЦР). Фиг. 3 - соотношение чисел геномных копий гена ORF 1629 и гена Rep в образцах бакуловирусов,отобранных при различных пассажах бакуловирусной конструкции pVD183 настоящего изобретения. Число геномных копий определяли с помощью кПЦР. Фиг. 4 - продукция rAAV с использованием Bac.VD183. Понижение продукции вызвано уменьшением количества присутствующих бакуловирусов. Фиг. 5 - кПЦР для определения числа копий ORF в зависимости от пассажей Bac.VD183. Фиг. 6 - проанализированная с помощью вестерн-блоттинга экспрессия Rep для нескольких пассажей Bac.VD183. "88" означает конструкцию Bac.VD88, которая упоминается как REP-ACG/PSC в WO 2007/148971, которую используют в качестве контроля. Степень экспрессии Rep связана с концентрациейBac.VD183. Фиг. 7 - кПЦР с использованием неочищенной клеточной массы от продукций rAAV1 при использовании трех различных конструкций для белков Rep: VD88, VD183 и VD189. 5:1:1 относится к пропорции различных бакуловирусов, используемых при продукции, 5 относится к Bac.VD88, BacVD183 илиBac.VD189, первая 1 относится к Bac.VD88 (содержащему ген капсидного белка AAV1), а вторая 1 относится к бакуловирусу, содержащему ITR-конструкцию, Bac.VD43. Фиг. 8 - неочищенную клеточную массу от трех различных продукций rAAV1 подвергали очистке в колонке Llama, специфичной для капсида AAV, и в очищенных партиях определяли число копий генома и всех частиц rAAV. Деление числа всех частиц rAAV на определенное с помощью кПЦР число копий дает в результате упоминаемое здесь соотношение числа всех вирионов rAAV и числа полноценных вирионов rAAV. 5:1:1 относится к пропорции различных бакуловирусов, используемых при продукции, 5 относится к Bac.VD88, BacVD183 или Bac.VD189, первая 1 относится к Bac.VD88 (содержащему ген капсидного белка AAV), a вторая 1 относится к бакуловирусу, содержащему ITR-конструкцию,Bac.VD43. Фиг. 9 - вестерн-блоттинг для анализа Rep. Образцы отбирали при нескольких пассажах бакуловируса Bac.VD88 или Bac.VD189 и выполняли вестерн-блоттинг. Количество Rep52 относительно количества Rep78 неизменно больше в случае Bac.VD189. Фиг. 10 - вестерн-блоттинг для анализа Rep. Образцы отбирали при нескольких пассажах размножения бакуловируса Bac.VD183 и выполняли вестерн-блоттинг для анализа Rep. Количество Rep52 относительно количества Rep78 намного больше в случае Bac.VD183, чем в случае Bac.VD189 и Bac.VD88. Примеры 1. Пример 1. 1.1. Материалы и методы. 1.1.1. Бакуловирусная плазмидная конструкция.pFBDSLR (Urabe et al., 2002, выше) является экспрессионным вектором pFastBacDual (Invitrogen),включающим 2 отдельные экспрессионные кассеты для белков Rep78 и Rep52 AAV2, в силу чего экспрессией белков Rep52 управляет промотор polH, a экспрессия белка Rep78 происходит с промотора IE. Эту конструкцию субклонировали в pPSC10, совместимую с GeneXpress BaculoKIT (Protein SciencesCorporation) плазмиду. Кодирующую Rep52 последовательность дикого типа в кассете для экспрессии Rep52 замещают оптимизированной в отношении кодонов Rep52-кодирующей последовательностью SEQ ID NO: 2 с получением pPSC10Rep-52CD. Кодирующую Rep52 последовательность дикого типа в кассете для экспрессии Rep78 pPSC10Rep52CD замещают оптимизированной в отношении AT Rep52-кодирующей последовательностью SEQ IDNO: 3 с получением pPSC10Rep-52CD/78AT. Кодирующую Rep52 последовательность дикого типа в кассете для экспрессии Rep78 pPSC10Rep52CD замещают оптимизированной в отношении GC Rep52-кодирующей последовательностью SEQ IDNO: 4 с получением pPSC10Rep-52CD/78GC. 1.1.2. Продукция рекомбинантных бакуловирусов. Рекомбинантные бакуловирусы, происходящие из множества вирусов ядерного полиэдроза Autographa californica (AcMNPV), продуцируют, используя GeneXpress BaculoKIT (Protein Sciences Corporation). Трансфекцию выполняют следующим образом: в круглодонной пробирке на 14 мл 200 мкл средыGRACE смешивают с 6 мкл селлфектина (Invitrogen) и в эппендорфной пробирке 200 мкл среды GRACE смешивают с 50 мкл вирусной ДНК (Protein Sciences) и 2 мкг плазмиды для переноса (REP). Содержимое эппендорфной пробирки добавляют в пробирку и осторожно перемешивают. После инкубационного пе- 15022169 риода, составляющего 30 мин, при комнатной температуре 1300 мкл среды GRACE добавляют в смесь для трансфекции. Клетки насекомых в Т 25-флаконе промывают средой GRACE и смесь для трансфекции добавляют по каплям на слой клеток. После инкубации в течение 6 ч при 28C осторожно добавляют сыворотку SF900II, дополненную 10% FBS, и Т 25-флакон помещают в термостат при 28C на 5 дней,после чего рекомбинантные бакуловирусы собирают. 1.2. Результаты. Эффективность вновь сконструированных pPSC10Rep.pPSC10Rep-52CD, pPSC10Rep-52CD/78AT и pPSC10Rep-52CD/78GC сравнивают с исходными Repконструкциями pFBDSLR Urabe et al. (2002, выше). Все четыре конструкции последовательно пассируют до пассажа 5. Эксперименты, касающиеся продукции рекомбинантного AAV1, проводят с использованием Rep-конструкций пассажей 2, 3, 4 и 5 в комбинации с бакуловирусом, содержащим кассету с репортерным геном между ITR AAV (AAV-LPL) для экспрессии в клетках млекопитающих, и бакуловирусом,содержащим кассету с AAV1-Cap (AAV-Cap) для экспрессии в клетках насекомых, соответственно пассажа 2, 3, 4 и 5. Используемые здесь рекомбинантные бакуловирусы AAV-LPL и AAV-Cap описываются в WO 2007/046703. Выходы продукции AAV1-LPL определяют с помощью кПЦР. Исходный бакуловирус, разработанный Urabe et al., 2002 (исходный REP/Bac-to-Bac), дает в результате быстрое снижение продукции AAV в пределах 5 пассажей. Однако бакуловирус с блоками для экспрессии REP pPSC10Rep52CD, pPSC10Rep-52CD/78AT и pPSC10Rep-52CD/78GC дает в результате стабильную продукцию AAV в пределах по крайней мере 5 пассажей. Следовательно, воспроизводимые выходы продукции AAV-LPL в пределах нескольких пассажей (например, 2-5) получают только, используя бакуловирусы, содержащие конструкции pPSC10Rep-52CD, pPSC10Rep-52CD/78AT и pPSC10Rep-52CD/78GC. 2. Пример 2. Ранее сообщалось, что бакуловирусные экспрессионные векторы, содержащие 2 отдельные кассеты для экспрессии белков Rep78 и Rep52 AAV, генетически нестабильны в бакуловирусах (смотри, например, WO 2007/148971 и Kohlbrenner et al., 2005, Mol. Ther., 12(6): 1217-1225). Теперь авторы настоящего изобретения задались целью применить оптимизацию в отношении частот использования кодонов (в отношении частот использования кодонов во множестве вирусов ядерного полиэдроза Autographa californica (AcMNPV для только кодирующей Rep52 последовательности, но некодирующей Rep78 последовательности, чтобы внести достаточные различия между ранее идентичными частями кодирующихRep52 и Rep78 последовательностей для уменьшения явлений рекомбинации. Теперь демонстрируется,что это в действительности было достигнуто. 2.1. Клонирование. Плазмиду, содержащую первоначальные две кассеты для экспрессии Rep в плазмиде pPSC10 (Protein Sciences Corporation), pVD42 модифицировали. pVD42 содержит ген Rep78, управляемый промотором deltaE1, и ген rep52, управляемый промотором PolH, как в исходной конструкции pFBDSLR (Urabe etal., 2002, Hum. Gene Ther., 13(16): 1935-1943). Кодирующую Rep52 последовательность в pVD42 замещали синтетической кодирующей Rep52 последовательностью, частоты использования кодонов которой были адаптированы к частотам использования кодонов во множестве вирусов ядерного полиэдроза AutographaRep52 последовательность изображена в SEQ ID NO: 10. Физическая карта результирующей плазмидыpVD183, включающей оптимизированную в отношении кодонов AcMNPV кодирующую Rep52 последовательность, управляемую промотором PolH, и кодирующую Rep78 AAV2 последовательность дикого типа, управляемую промотором deltaE1, продемонстрирована на фиг. 1. 2.2. Результаты. Клон рекомбинантного бакуловируса был получен с использованием плазмиды pVD183, и полученный клон пассировали 10 раз для анализа его генетической стабильности. Генетическую стабильность конструкции анализировали с помощью кПЦР для определения числа копий генома бакуловируса и генаRep52, вестерн-блоттинга и по эффективности бакуловируса в отношении продукции rAAV. Для сравнения в то же самое время пассировали до пассажа 7 исходный бакуловирус Bac.VD42. В WO 2007/148971 также ранее приведена информация о стабильности Bac.VD42 (или Bac.FBDSLR) (упоминаемого как первоначальный REP/Bac-to-Bac). 2.2.1. кПЦР. Стабильность определяли с помощью кПЦР на геномах бакуловирусов. Число копий гена, необходимого для репликации бакуловируса и используемого при продукции Bac.VD183 из pVD183 путем рекомбинации в ORF1629 и ORF603 между pVD183 и каркасом бакуловируса от Protein Sciences, ORF1629(ORF), определяли с помощью кПЦР и число копий генов Rep также определяли с помощью кПЦР. Соотношение этих 2 генов должно оставаться одинаковым в течение последующих пассажей бакуловируса. На фиг. 2 для сравнения демонстрируется, что Вас.FBDSLR является довольно нестабильным. На фиг. 3 демонстрируется, что Bac.VD183 является значительно более стабильным. Авторы настоящего изобретения отмечают, что эффективность 2 наборов праймеров, используемых в кПЦР, необязательно является равной, поэтому можно получить соотношение, отличное от 1. Однако более важным показателем ста- 16022169 бильности является сохранение соотношения на относительно постоянном значении на протяжении множества пассажей. Пассаж 3 Вас.FBDSLR уже является субоптимальным, поскольку соотношение составляет приблизительно 0,25 и только уменьшается. Для Bac.VD183 соотношение вначале составляет приблизительно 0,3, но оно колеблется вокруг этого значения, что указывает на стабильную ситуацию. Результатом делеций в геноме бакуловируса является бакуловирус, который растет быстрее бакуловируса, имеющего полноразмерный геном, поэтому, когда происходит делеция, эти клоны будут перерастать другие. Изменения в способе кПЦР могут приводить к колебаниям, наблюдаемым на фиг. 3. 2.2.2. Продукция rAAV. На фиг. 4 демонстрируется продукция rAAV с использованием стабильной конструкцииBac.VD183. Понижение продукции при пассажах с большими порядковыми номерами вызвано уменьшением количества бакуловирусов, использованных при продукции rAAV (смотри фиг. 5). На фиг. 5 демонстрируется кПЦР для определения числа копий ORF Bac.VD183, которое напрямую связано с количеством бакуловирусов, присутствующих в образце. Число бакуловирусов, использованных при продукции rAAV, коррелирует с количеством продуцированных rAAV. 2.2.3. Вестерн-блоттинг для анализа Rep. На фиг. 6 демонстрируется экспрессия белка Rep во время пассажей Bac.VD183, анализируемая с помощью вестерн-блоттинга. 3. Пример 3. Определяли эффект уровня экспрессии Rep52 на два показателя продукции rAAV. В частности, определяли эффект уровня экспрессии Rep52 относительно уровня экспрессии белка Rep78 на 1) уровень продукции rAAV, выраженный в виде числа копий генома на 1 мл неочищенной клеточной массы, и 2) соотношение числа всех вирионов rAAV и числа полноценных вирионов rAAV (полноценными вирионами rAAV являются вирионы, включающие копию генома rAAV). Сравнивали эти показатели для трех различных Rep-конструкций rAAV, каждая из которых приводит к различным уровням экспрессии Rep52 и различным соотношениям между уровнями Rep52 и Rep78. Тремя конструкциями были pVD88 (упоминаемая как REP-ACG/PSC в WO 2007/148971), pVD183 (описанная здесь в примере 2) и pVD189(смотри ниже). 3.1. Конструирование pVD189. Конструкцию pVD189 реконструировали путем удаления 9 последовательностей ATG между началами трансляции генов Rep78 и Rep52 и замены кодона инициации трансляции Rep78 - ACG на CTG; см. последовательность ниже. Baseclear (Leiden, Нидерланды) синтезировал новый ген и клонировал его вpVD88, замещая существующий ген Rep, с получением pVD189. Нуклеотидная последовательность Repкодирующей последовательности в pVD189 изображена в SEQ ID NO: 11. 3.2. Продукция rAAV. Бакуловирусы получали с использованием конструкций VD88, VD183 и VD189 и их использовали для продукции rAAV1. Результатом сравнения конструкций VD88, VD183 и VD189 при продукции rAAV явилась большая продукция rAAV (число копий генома), определяемая с помощью кПЦР в неочищенной клеточной массе. На фиг. 7 демонстрируется, что стандартная Rep-конструкция VD88, которая дает в результате наименьшее количество Rep52 (фиг. 9), приводит к продукции 41010 копий генома/мл, измеряемой в неочищенной клеточной массе. VD189, которая дает в результате немного большее количествоRep52 (фиг. 9), приводит к измеряемой в неочищенной клеточной массе продукции rAAV, составляющей приблизительно 9,51010 копий генома/мл. VD183, которая дает в результате явно большее количествоRep52 (фиг. 10), приводит к измеряемой в неочищенной клеточной массе продукции rAAV, составляющей приблизительно 61010 копий генома/мл. Очень важным качественным показателем является соотношение числа всех вирионов rAAV и числа полноценных вирионов rAAV в партии. На фиг. 8 демонстрируется, что наибольшее соотношение числа всех вирионов rAAV и числа полноценных вирионов rAAV получают при использовании конструкции VD183, для которой демонстрируется наибольшее количество Rep52 относительно количества 3.3. Дополнительные конструкции. Следующие конструкции конструировали, проверяли, и они являются частью настоящего изобретения. 1, 2, 4, 5, 8 и 9 имеют один транскрипционный блок для экспрессии белков Rep78 и Rep52. 3, 6 и 7 имеют два транскрипционных блока для экспрессии белков Rep78 и Rep52. Приблизительная оценка количеств белков Rep78 и Rep52 и их соотношений для различных конструкций во время продукции rAAV (Rep78:Rep52): Таблица 1 Частоты использования кодонов в Spodoptera frugiperda на основе 127 кодирующих последовательностей (33098 кодонов) Таблица 2 Частоты использования кодонов во множестве вирусов ядерного полиэдроза Autographa californica (AcMNPV) на основе 277 кодирующих последовательностей (77487 кодонов)
МПК / Метки
МПК: C12N 15/864
Метки: получения, клетка, пригодная, вирионов, способ, векторов, продуцирования, парвовирусных, рекомбинантных, насекомого
Код ссылки
<a href="https://eas.patents.su/30-22169-kletka-nasekomogo-prigodnaya-dlya-producirovaniya-rekombinantnyh-parvovirusnyh-vektorov-i-sposob-polucheniya-rekombinantnyh-parvovirusnyh-virionov.html" rel="bookmark" title="База патентов Евразийского Союза">Клетка насекомого, пригодная для продуцирования рекомбинантных парвовирусных векторов, и способ получения рекомбинантных парвовирусных вирионов</a>
Предыдущий патент: Способ получения уплотненного промежуточного продукта дималеата bibw 2992 и твердые таблетки, полученные из такого продукта
Следующий патент: Батарейное устройство для транспортного средства с разделяемыми соединениями
Случайный патент: Способ химико-механического получения функциональных коллоидов, функциональные коллоиды, полученные этим способом, и их применение