Антитела человека с киллерной активностью в отношении энтерококков и стафилококков и их применение
Номер патента: 21767
Опубликовано: 31.08.2015
Авторы: Тросби Марк, Крамер Роберт Арьен, Де Крэйф Корнелис Адриан
Формула / Реферат
1. Моноклональное антитело человека, где указанное антитело содержит
район CDR1 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:314;
район CDR2 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:315;
район CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:316;
район CDR1 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:317;
район CDR2 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:318;
район CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:319,
отличающееся тем, что указанное антитело обладает опсонизирующей фагоцитарной киллерной активностью в отношении по меньшей мере одного штамма, принадлежащего по меньшей мере двум разным видам Enterococcus, и в отношении по меньшей мере одного штамма Staphylococcus aureus.
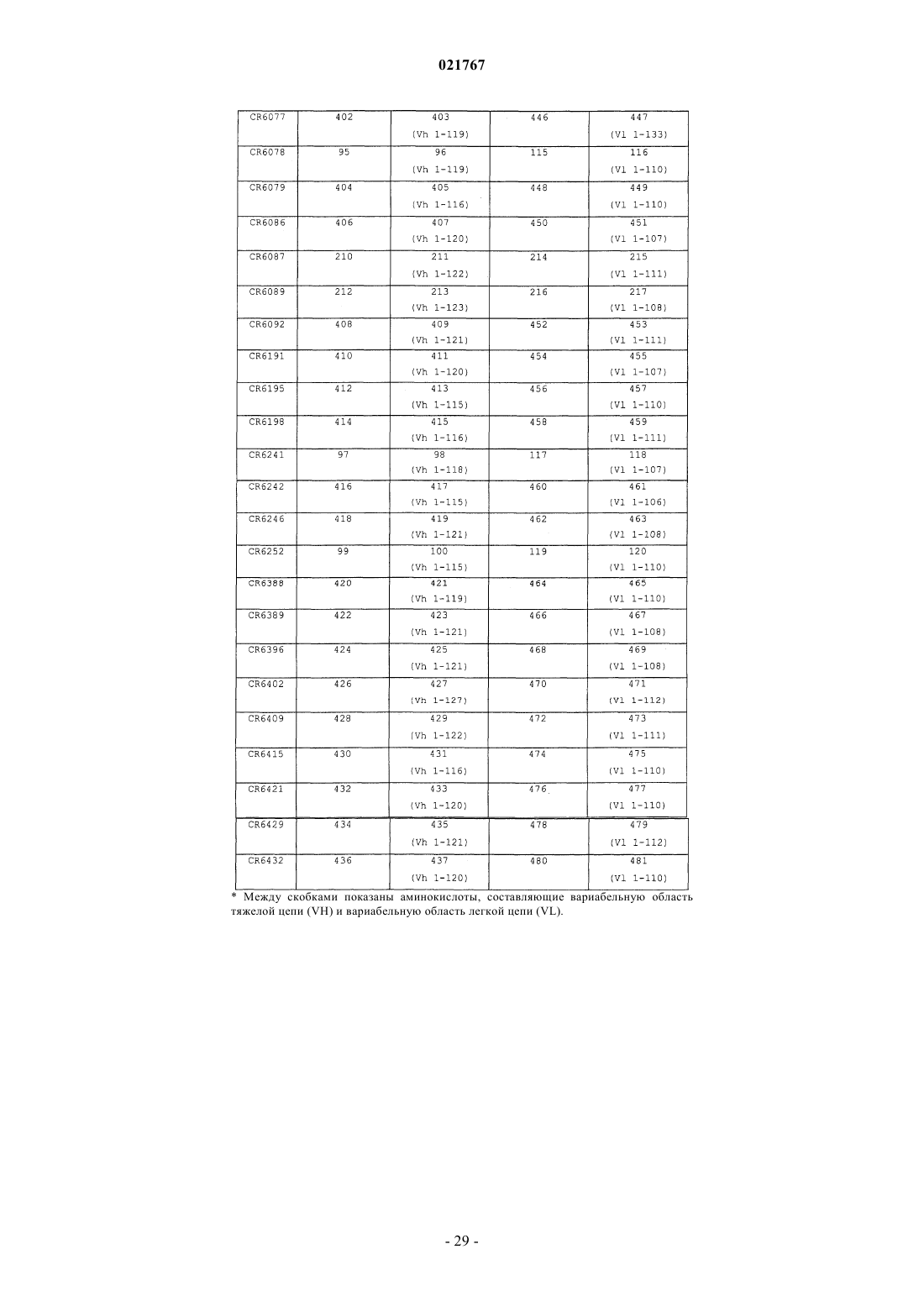
2. Моноклональное антитело человека, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:427, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:471, отличающееся тем, что указанное антитело обладает опсонизирующей фагоцитарной киллерной активностью в отношении по меньшей мере одного штамма, принадлежащего по меньшей мере двум разным видам Enterococcus, и в отношении по меньшей мере одного штамма Staphylococcus aureus.
3. Моноклональное антитело человека по любому из пп.1 или 2, отличающееся тем, что виды Enterococcus включают Е. faecalis и Е. faecium.
4. Иммуноконъюгат, содержащий моноклональное антитело человека по любому из пп.1-3, где иммуноконъюгат дополнительно содержит по меньшей мере одну метку.
5. Молекула нуклеиновой кислоты, кодирующая моноклональное антитело человека по любому из пп.1-3.
6. Вектор, содержащий по меньшей мере одну молекулу нуклеиновой кислоты по п.5.
7. Клетка-хозяин, содержащая по меньшей мере один вектор по п.6.
8. Способ получения моноклонального антитела человека по любому из пп.1-3, включающий стадии:
a) культивирования клетки-хозяина по п.7 в условиях, способствующих экспрессии моноклонального антитела человека; и, при необходимости,
b) выделения экспрессированного моноклонального антитела.
9. Фармацевтическая композиция, содержащая моноклональное антитело человека по любому из пп.1-3 или иммуноконъюгат по п.4, дополнительно содержащая по меньшей мере один фармацевтически приемлемый эксципиент.
10. Фармацевтическая композиция по п.9, дополнительно содержащая по меньшей мере одно антибактериальное средство.
11. Применение моноклонального антитела человека по любому из пп.1-3 для диагностики, профилактики и/или лечения инфекции, вызванной энтерококками, и/или инфекции, вызванной стафилококками.
12. Применение иммуноконъюгата по п.4 для диагностики, профилактики и/или лечения инфекции, вызванной энтерококками, и/или инфекции, вызванной стафилококками.
13. Применение фармацевтической композиции по п.9 или 10 для диагностики, профилактики и/или лечения инфекции, вызванной энтерококками, и/или инфекции, вызванной стафилококками.
Текст
Изобретение относится к человеческим антителам, специфически связывающимся с энтерококками и обладающим киллерной активностью в отношении энтерококков, молекулам нуклеиновых кислот, кодирующим указанные антитела, композициям, содержащим антитела, и способам получения антител. Полученные антитела могут быть использованы в диагностике, профилактике и/или лечении состояния, вызываемого Enterococcus. Тросби Марк, Крамер Роберт Арьен,Де Крэйф Корнелис Адриан (NL) Медведев В.Н. (RU) Область техники, к которой относится изобретение Данное изобретение относится к медицине. В частности, оно относится к диагностике, профилактике и/или лечению инфекции энтерококками. Уровень техники Энтерококки являются грамположительными, факультативно анаэробными бактериями семействаEnterococcaceae. Они классифицировались ранее как стрептококки группы D. Энтерококки обнаружены в кишечниках большинства людей и обычно их выделяют из стула, мочи и мест внутрибрюшной инфекции и инфекции нижних конечностей. Бактерии рода Enterococcus часто рассматриваются как безвредные симбиониты желудочно-кишечного тракта, но в последние 10 лет они стали важной причиной нозокомиальных (внутрибольничных) инфекций не вследствие увеличенной вирулентности, а вследствие устойчивости к антибиотикам. Согласно оценке в Соединенных Штатах Америки 800000 случаев энтерококковой инфекции имеют место каждый год, приводя к расходам около 500 млн. Для инфицирования хозяев энтерококки первично колонизируют поверхности слизистых оболочек. Энтерококки являются этиологическими агентами бактериемии, инфекций хирургических ран, инфекций мочевых путей и эндокардита. Они ассоциированы также с облигатными анаэробами в смешанных инфекциях, которые приводят к внутрибрюшным абсцессам. В общем и целом имеются приблизительно семнадцать видов энтерококков, среди которых Enterococcus faecalis и Enterococcus faecium, по-видимому, наиболее часто детектируются в фекалиях человека. Е. faecalis является ответственным за большинство энтерококковых инфекций людей, обычно составляя 80-90% клинических изолятов. Е. faecium детектируется гораздо менее часто, но тем не менее имеет значение вследствие высокой частоты устойчивости к множественным антибактериальным агентам. Энтерококковые инфекции обычно лечат антимикробными агентами и до недавнего времени они удовлетворительно контролировались с использованием этих агентов. Однако возникают лекарственно-устойчивые (антибиотикорезистентные) энтерококковые штаммы, и инфекция,вызываемая штаммами, устойчивыми ко всем доступным в настоящее время антибиотикам, может стать серьезной проблемой в ближайшем будущем. Некоторые энтерококки уже приобрели наследственную резистентность к антибиотикам на основе -лактама (пенициллинам), а также многим аминогликозидам. В последние два десятилетия в нозокомиальных инфекциях госпитализированных пациентов появились особенно вирулентные штаммы Enterococcus, которые устойчивы даже к антибиотику ванкомицину(ванкомицинорезистентный Enterococcus или VRE). Несмотря на настоятельную потребность в развитии новых антибиотиков, основные фармацевтические компании, по-видимому, потеряли интерес в отношении рынка антибиотиков. В 2002 г. только 5 из более чем 500 лекарственных средств в клиническом развитии фазы II или фазы III были новыми антибиотиками. В последние 6 лет были зарегистрированы только 10 антибиотиков, и только 2 из них не проявляли перекрестной реактивности с существующими лекарственными средствами (и, следовательно, не подвергались тем же самым картинам устойчивости к лекарственным средствам). Эта тенденция была отнесена к нескольким факторам: стоимости развития новых лекарственных средств и относительно малому возврату инвестирования, которые дают лечение инфекционных заболеваний, в сравнении с лекарственными средствами против гипертензии, артрита и лекарственных средств, влияющих на образ жизни, например против импотенции. Другим способствующим этому фактором является увеличивающаяся трудность нахождения новых мишеней, дополнительно повышающая затраты на развитие. Таким образом, исследование новых терапий или превентивных мер для (полирезистентных) бактериальных инфекций срочно необходимо для удовлетворения этого надвигающегося кризиса здравоохранения. Активная иммунизация вакцинами и пассивная иммунизация иммуноглобулинами являются многообещающими альтернативами классической терапии малыми молекулами. Несколько бактериальных заболеваний, которые когда-то вызывали широко распространенные болезнь, потерю трудоспособности и смерть, могут быть теперь предотвращены с использованием вакцин. Эти вакцины основаны на ослабленных (аттенуированных) или мертвых бактериях, компонентах бактериальной поверхности или на инактивированных токсинах. Иммунная реакция, индуцируемая вакциной, в основном направлена на иммуногенные структуры, ограниченное количество белков или сахарные структуры на бактериях, которые активно процессируются иммунной системой. Поскольку эти иммуногенные структуры являются очень специфическими для конкретного организма, эта вакцина должна содержать иммуногенные компоненты всех вариантов бактерий, против которых должна защищать эта вакцина. Вследствие этого,вакцины являются очень комплексными, занимают продолжительное время и являются дорогими для их развития. Дополнительным осложнением создания вакцин является феномен "замещения антигена". Это происходит, когда становятся преобладающими новые штаммы, которые являются серологически и, следовательно, антигенно отличающимися от штаммов, охватываемых этими вакцинами. Иммунный статус популяций при риске нозокомиальных инфекций дополнительно усложняет создание вакцин. Эти пациенты являются неотъемлемо нездоровыми и могут даже быть иммунодефицитными (иммунокомпрометированными) (вследствие действия иммуносупрессивных лекарственных средств), что приводит к замедленному или недостаточному иммунитету против инфицирующих патогенов. Кроме того, за исключением ситуации в случае определенных элективных (избирательных) процедур, может возникнуть невозможность идентификации и вакцинации находящихся при риске пациентов во время предоставления им достаточной иммунной защиты от инфекции. Прямое введение терапевтических иммуноглобулинов, также называемое пассивной иммунизацией,не требует иммунной реакции от пациента и, следовательно, дает немедленную защиту. Кроме того, пассивная иммунизация может быть направлена на бактериальные структуры, которые не являются иммуногенными и которые являются менее специфическими для конкретного организма. Пассивная иммунизация против патогенных организмов основывалась на иммуноглобулинах, полученных из сывороток людей-доноров или доноров, не являющихся людьми. Однако полученные из крови продукты имели потенциальные риски для здоровья, неотъемлемо связанные с этими продуктами. Кроме того, иммуноглобулины могут проявлять вариацию от партии к партии и могут иметь ограниченную доступность в случае неожиданных массовых воздействий. Рекомбинантно полученные антитела не имеют этих недостатков и, следовательно, предоставляют возможность замены иммуноглобулинов, полученных из сывороток. Мышиные моноклональные антитела, направленные против энтерококковых антигенов, известны в данной области (см. WO 03/072607). Однако мышиные антитела являются ограниченными в отношении их применения in vivo вследствие проблем, связанных с введением мышиных антител людям, таких как короткий полупериод существования в сыворотке, неспособность запуска некоторых эффекторных функций человека и индукция нежелательной разительной иммунной реакции против мышиного антитела в человеке (НАМА).WO 99/18996 относится к энтерококковым антигенам и вакцинам и описывает дополнительно кроличью антисыворотку против конъюгированных очищенных антигенов из энтерококков и опсонизирующую активность такой антисыворотки. Хотя WO 99/18996 относится к антителам человека в качестве желаемых молекул, антитела, фактически описанные и используемые в этом патенте, являются антителами кроличьего происхождения, и этот документ фактически не описывает действительно никаких антител человека и их последовательностей. Ввиду их терапевтического преимущества в людях, все еще имеется потребность в моноклональных антителах человека против энтерококков. Кроме того, существует потребность в данной области в антителах человека, которые могут убивать более широкий диапазон бактерий, таких как энтерококки и стафилококки. Данное изобретение обеспечивает эти антитела и показывает, что они могут быть использованы в медицине, в частности, для диагностики, предотвращения и/или лечения энтерококковых инфекций. Описание чертежа Чертеж показывает данные эксперимента in vivo. На Y-оси показана величина КОЕ/мл в крови мышей, тогда как на Х-оси изображены соответствующие антитела. Эти антитела использовали в количестве 15 мг/кг, за исключением CR6016 и CR6241, которые использовали в количестве 7,5 мг/кг. За исключением CR6043 и CR6071, все эти антитела имели медиану, которая значимо отличалась от медианы контрольного IgG (P0,05 против контрольного IgG1). Описание изобретения Здесь ниже представлены определения терминов, использованных в этом изобретении. Определения Аминокислотная последовательность. Термин "аминокислотная последовательность" относится в данном контексте к природновстречающимся или синтетическим молекулам, таким как последовательность пептида, олигопептида,полипептида или белка. Связывающая молекула. В данном контексте термин "связывающая молекула" относится к интактному иммуноглобулину, в том числе моноклональным антителам, таким как химерные, гуманизированные или моноклональные антитела человека, или к содержащему антигенсвязывающий и/или вариабельный домен фрагменту иммуноглобулина, который конкурирует с интактным иммуноглобулином за специфическое связывание с партнером связывания этого иммуноглобулина, например, энтерококками. Независимо от структуры,этот антигенсвязывающий фрагмент связывается с тем же самым антигеном, который узнается интактным иммуноглобулином. Антигенсвязывающий фрагмент может содержать пептид или полипептид, содержащий аминокислотную последовательность по меньшей мере 2 смежных аминокислотных остатков,по меньшей мере 5 смежных аминокислотных остатков, по меньшей мере 10 смежных аминокислотных остатков, по меньшей мере 15 смежных аминокислотных остатков, по меньшей мере 20 смежных аминокислотных остатков, по меньшей мере 25 смежных аминокислотных остатков, по меньшей мере 30 смежных аминокислотных остатков, по меньшей мере 35 смежных аминокислотных остатков, по меньшей мере 40 смежных аминокислотных остатков, по меньшей мере 50 смежных аминокислотных остатков, по меньшей мере 60 смежных аминокислотных остатков, по меньшей мере 70 смежных аминокислотных остатков, по меньшей мере 80 смежных аминокислотных остатков, по меньшей мере 90 смежных аминокислотных остатков, по меньшей мере 100 смежных аминокислотных остатков, по меньшей мере 125 смежных аминокислотных остатков, по меньшей мере 150 смежных аминокислотных остатков, по меньшей мере 175 смежных аминокислотных остатков, по меньшей мере 200 смежных аминокислотных остатков или по меньшей мере 250 смежных аминокислотных остатков аминокислотной последовательности этой связывающей молекулы. Термин "связывающая молекула" в данном контексте включает в себя все классы и подклассы иммуноглобулинов, известные в данной области. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей связывающие молекулы могут быть разделены на пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Антигенсвязывающие фрагменты включают в себя, в частности, Fab, F(ab'), F(ab')2, Fv, dAb, Fd,фрагменты определяющего комплементарность района (CDR), одноцепочечные антитела (scFv), бивалентные одноцепочечные антитела, одноцепочечные фаговые антитела, диатела, триатела, тетратела,(поли)пептиды, которые содержат по меньшей мере один фрагмент иммуноглобулина, который является достаточным для придания специфическому антигену связывания с этим (поли)пептидом, и т.д. Приведенные выше фрагменты могут быть получены синтетическим, или ферментативным, или химическим расщеплением интактных иммуноглобулинов либо они могут быть сконструированы генной инженерией способами рекомбинантных ДНК. Эти способы получения хорошо известны в данной области и описаны, например, в справочнике Antibodies: A Laboratory Manual, Edited by: E. Harlow and D, Lane (1988),Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, который включен здесь в качестве ссылки. Связывающая молекула или ее антигенсвязывающий фрагмент могут иметь один или несколько сайтов связывания. Если имеются более чем один сайт связывания, эти сайты связывания могут быть идентичными друг другу или они могут быть различными. Связывающая молекула может быть "голой" или неконъюгированной связывающей молекулой, но может быть также частью иммуноконъюгата. Голой или неконъюгированной связывающей молекулой называют связывающую молекулу, которая не является конъюгированной, функционально связанной или иным образом физически или функционально ассоциированной с эффекторной частью или меткой,такой, в частности, как токсичное вещество, радиоактивное вещество, липосома, фермент. Должно быть понятно, что голые или неконъюгированные связывающие молекулы не исключают связывающие молекулы, которые были стабилизированы, мультимеризованы, гуманизированы или подвергнуты иной манипуляции, отличающейся от присоединения эффекторной части молекулы или метки. Таким образом,все посттрансляционно модифицированные голые и неконъюгированные связывающие молекулы включены здесь, в том числе, когда произведены модификации в природном окружении клетки, продуцирующей связывающую молекулу, рекомбинантной клеткой, продуцирующей связывающую молекулу,или введены рукой человека после получения исходной связывающей молекулы. Конечно, термин голая или неконъюгированная связывающая молекула не исключает способности этой связывающей молекулы образовывать функциональные ассоциации с эффекторными клетками и/или молекулами после введения в тело, так как некоторые из этих взаимодействий являются необходимыми для проявления биологического действия. Таким образом, отсутствие ассоциированных эффекторных групп или метки применимо в определении голой или неконъюгированной связывающей молекулы in vitro, но не in vivo. Биологическая проба. В данном контексте термин "биологическая проба" включает в себя различные типы проб, в том числе пробы крови или других жидкостей биологического происхождения, пробы твердых тканей, такие как проба биопсии (биоптат) или культуры тканей, или клеток, полученных из них, и их потомства. Этот термин включает в себя также пробы, которые были подвергнуты манипуляциям каким-либо путем после их заготовки, например обработкой реагентами, солюбилизацией или обогащением в отношении некоторых компонентов, таких как белки или полинуклеотиды. Этот термин включает в себя различные типы клинических проб, полученных из любых видов, а также включает в себя клетки в культуре, супернатанты клеток и лизаты клеток. Определяющие комплементарность районы (CDR). Термин "определяющие комплементарность районы" означает в данном контексте последовательности в вариабельных областях связывающих молекул, таких как иммуноглобулины, которые обычно способствуют в значительной степени образованию антигенсвязывающего сайта, который является комплементарным по форме и распределению зарядов эпитопу, узнаваемому на антигене. Эти CDR-районы могут быть специфическими в отношении линейных эпитопов, прерываемых эпитопов или конформационных эпитопов белков или фрагментов белков, либо когда они присутствуют на белке в его нативной конформации, либо, в некоторых случаях, когда они присутствуют на белках, денатурированных, например, солюбилизацией в ДСН. Эпитопы могут также состоять из посттрансляционных модификаций белков. Делеция. Термин "делеция" означает в данном контексте изменение либо в аминокислотной, либо в нуклеотидной последовательности, в которой один или несколько аминокислотных остатков или нуклеотидных остатков соответственно отсутствуют в сравнении с исходной, часто природно-встречающейся, молекулой. Регулирующая экспрессию последовательность нуклеиновой кислоты. Термин "регулирующая экспрессию последовательность нуклеиновой кислоты" относится в данном контексте к полинуклеотидным последовательностям, необходимым для экспрессии функционально связанной кодирующей последовательности или влияющим на экспрессию функционально связанной кодирующей последовательности в конкретном организме-хозяине. Эти регулирующие экспрессию последовательности нуклеиновых кислот, такие, в частности, как последовательности, подходящие для инициации транскрипции, терминации, промоторные последовательности, энхансерные последовательности; репрессорные или активаторные последовательности; сигналы эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматические мРНК; последовательности, которые усиливают эффективность трансляции (например, сайты связывания рибосом); последовательности, которые увеличивают стабильность белка; и, когда желательно, последовательности, которые усиливают секрецию белка, могут быть любой последовательностью нуклеиновой кислоты, обнаруживающей активность в выбранном организме-хозяине, и могут быть получены из генов, кодирующих белки, которые являются либо гомологичными, либо гетерологичными относительно организма-хозяина. Идентификация и использование регулирующих экспрессию последовательностей является рутиной для специалиста в данной области. Функциональный вариант. Термин "функциональный вариант" в данном контексте относится к связывающей молекуле, которая содержит нуклеотидную и/или аминокислотную последовательность, которая изменена одним или несколькими нуклеотидами и/или аминокислотами в сравнении с нуклеотидной и/или аминокислотной последовательностями исходной связывающей молекулы и которая все еще способна конкурировать за связывание с партнером связывания, например, энтерококками с исходной связывающей молекулой. Другими словами, эти модификации в аминокислотной и/или нуклеотидной последовательности исходной связывающей молекулы не влияют значимо или не изменяют характеристики связывания связывающей молекулы, кодируемой этой нуклеотидной последовательностью или содержащей эту аминокислотную последовательность, т.е. эта связывающая молекула все еще способна узнавать и связывать ее мишень. Функциональный вариант может иметь консервативные модификации последовательности, включающие в себя нуклеотидные и аминокислотные замены, добавления и делеции. Эти модификации могут быть введены стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и случайный ПЦР-опосредованный мутагенез, и могут содержать как природные, так и неприродные нуклеотиды и аминокислоты. Консервативные аминокислотные замены включают в себя замены, в которых аминокислотный остаток заменяют аминокислотным остатком, имеющим сходные структурные или химические свойства. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин,аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, аспарагин, глутамин, серин, треонин,тирозин, цистеин, триптофан), неполярными боковыми цепями (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например,треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин,триптофан). Специалисту в данной области будет ясно, что могут быть также использованы другие классификации семейств аминокислотных остатков, чем классификация, использованная выше. Кроме того,некоторый вариант может иметь неконсервативные аминокислотные замены, например замену аминокислоты аминокислотным остатком, имеющим отличающиеся структурные или химические свойства. Сходные минорные вариации могут также включать в себя аминокислотные делеции или инсерции или и то и другое. Руководство в определении, какие аминокислотные остатки могут быть заменены, инсертированы или делетированы без уничтожения иммунологической активности, может быть найдено с использованием компьютерных программ, хорошо известных в данной области. Мутация в нуклеотидной последовательности может быть единственным изменением, произведенным в локусе (точковой мутацией), такой как транзиционная или трансверсионная (заместительная) мутация, или, альтернативно, множественные нуклеотиды могут быть инсертированы, делетированы или изменены в единственном локусе. Кроме того, одно или несколько изменений могут быть произведены в любом количестве локусов в одной нуклеотидной последовательности. Эти мутации могут быть получены любым подходящим способом, известным в данной области. Хозяин. Термин "хозяин" в данном контексте относится к организму или клетке, в которую был введен вектор, такой как клонирующий вектор или экспрессирующий вектор. Этот организм или эта клетка могут быть прокариотическими или эукариотическими. Должно быть понятно, что этот термин относится не только к конкретному рассматриваемому организму и конкретной рассматриваемой клетке, но также и к потомству такого организма или такой клетки. Поскольку некоторые модификации могут иметь место в генерациях-потомствах вследствие мутации или влияний окружающей среды, такое потомство может быть, фактически, идентичным исходному организму или исходной клетке, но все еще они будут вклю-4 021767 чены в объем термина "хозяин" в данном контексте. Человек (человеческий). Термин "человек" ("человеческий") при применении к связывающим молекулам относится к молекулам, которые либо непосредственно получены из человека, либо основаны на человеческой последовательности. При получении связывающей молекулы из человека или на основе человеческой последовательности и последующей модификации эта молекула все еще должна рассматриваться как человеческая,как это делается во всем этом описании. Другими словами, термин "человеческая" в применении к связывающим молекулам предназначен для включения связывающих молекул, имеющих вариабельные и константные области, встречающиеся в человеке или лимфоцитах человека и модифицированных в некоторой форме. Таким образом, связывающие молекулы человека могут включать в себя аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека, содержать замены и/или делеции (например, мутации, введенные, например, неспецифическим или сайтнаправленным мутагенезом in vitro, или соматической мутацией in vivo). Термин "на основе" относится в данном контексте к ситуации, когда последовательность нуклеиновой кислоты может быть точно копирована из матрицы или с минорными мутациями, например, при использовании способов склонной к ошибкам ПЦР или получена синтетически для точного соответствия матрице или с минорными модификациями. Полусинтетические молекулы на основе последовательностей нуклеиновых кислот человека также рассматриваются в данном контексте как последовательности человека. Инсерция. Термин "инсерция", также известный как термин "добавление", означает изменение в аминокислотной или нуклеотидной последовательности, приводящее к добавлению одного или нескольких аминокислотных или нуклеотидных остатков соответственно в сравнении с исходной последовательностью. Внутренняя (эндогенная) активность. Термин "внутренняя (эндогенная) активность" при применении к связывающим молекулам, определенным здесь, относится к связывающим молекулам, которые способны связывать определенные белковые или углеводные антигены на поверхности патогенов, таких как бактерии, и которые могут ингибировать способность этого патогена нормально расти и делиться. Такие связывающие молекулы могут,например, блокировать вхождение специфических нутриентов, требуемых для роста или транспорта элементов токсичных отходов из бактерий. Посредством последнего действия они могут также увеличивать чувствительность бактерий к действию антибиотических лекарственных средств. Выделенные. Термин "выделенные" при применении к связывающим молекулам, определенным здесь, относится к связывающим молекулам, которые являются, по существу, свободными от других белков или полипептидов, в частности свободны от других связывающих молекул, имеющих отличающиеся антигенные специфичности, а также, по существу, свободны от другого клеточного материала и/или химикалиев. Например, когда эти связывающие молекулы получают рекомбинантно, они являются предпочтительно,по существу, свободными от культуральной среды, а когда эти связывающие молекулы получают химическим синтезом, они предпочтительно, по существу, свободны от химических предшественников или других химикалиев, т.е. они отделены от химических предшественников или других химикалиев, которые участвуют в синтезе этого белка. Термин "выделенные" в применении к молекулам нуклеиновых кислот, кодирующим связывающие молекулы, определенные здесь, относится к молекулам нуклеиновых кислот, в которых нуклеотидные последовательности, кодирующие эти связывающие молекулы, свободны от других нуклеотидных последовательностей, в частности нуклеотидных последовательностей, кодирующих молекулы, которые связывают партнеры связывания, другие чем энтерококки. Кроме того,термин "выделенные" относится к молекулам нуклеиновых кислот, которые, по существу, отделены от других клеточных компонентов, которые природно сопутствуют нативной молекуле нуклеиновой кислоты в ее природном хозяине, например от рибосом, полимераз или геномных последовательностей, с которыми она природно ассоциирована. Кроме того, "выделенные" молекулы нуклеиновых кислот, такие как кДНК-молекулы, могут быть, по существу, свободными от другого клеточного материала или культуральной среды при получении рекомбинантными способами или, по существу, свободны от химических предшественников или других химикалиев при химическом синтезе. Моноклональное антитело. Термин "моноклональное антитело" относится в данном контексте к препарату молекул антител единого молекулярного состава. Моноклональное антитело проявляет единственную специфичность связывания и аффинность в отношении конкретного эпитопа. Таким образом, термин "моноклональное антитело человека" относится к антителу, проявляющему единственную специфичность связывания, которое имеет вариабельную и константную области, полученные из последовательностей иммуноглобулина зародышевой линии человека или основанные на последовательностях иммуноглобулина зародышевой линии человека либо полученные из полностью синтезированных последовательностей. Способ получения моноклонального антитела не является ограниченным. Природно-встречающиеся. Термин "природно-встречающиеся" в применении к объекту относится к тому факту, что объект может быть обнаружен в природе. Например, последовательность полипептида или последовательность полинуклеотида, которая присутствует в организме, которая может быть выделена из природного источника и которая не была преднамеренно модифицирована человеком в лаборатории, является природновстречающейся. Молекула нуклеиновой кислоты. Термин "молекула нуклеиновой кислоты" в контексте данного изобретения относится к полимерной форме нуклеотидов и включает в себя как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК и синтетические формы и смешанные полимеры вышеуказанных молекул. Нуклеотидом называют рибонуклеотид, дезоксинуклеотид или модифицированную форму любого типа нуклеотида. Этот термин также включает в себя одноцепочечные и двухцепочечные формы ДНК. Кроме того, полинуклеотид может включать в себя любой или оба из природно-встречающегося и модифицированного нуклеотида, связанных вместе природно-встречающимися и/или не встречающимися в природе нуклеотидными связями. Молекулы нуклеиновых кислот могут быть модифицированы химически или биохимически или могут содержать неприродные или дериватизованные нуклеотидные основания, как будет вполне понятно специалистам в данной области. Такие модификации включают в себя, например, метки,метилирование, замену одного или нескольких природно-встречающихся нуклеотидов аналогом, межнуклеотидные модификации, такие как незаряженные связи (например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.), заряженные связи (например, фосфоротиоаты, фосфородитиоаты и т.д.), группы боковых цепей (например, полипептидов), интеркаляторы (например, акридин, псорален и т.д.), хелаторы, алкилирующие группы и модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.д.). Приведенный выше термин включает в себя также любую топологическую конформацию, в том числе одноцепочечную, двухцепочечную, частично дуплексную, триплексную, в виде шпильки, кольцевую конформации и запертую "висячим замком" конформацию. Включены также синтетические молекулы, которые имитируют полинуклеотиды в их способности связываться со сконструированной последовательностью через образование водородной связи и другие химические взаимодействия. Такие молекулы известны в данной области и включают в себя, например, молекулы, в которых пептидные связи заменяют фосфатные связи в скелете этой молекулы. Ссылка на последовательность нуклеиновой кислоты включает в себя комплементарную ей последовательность, если нет другого указания. Таким образом, при ссылке на молекулу нуклеиновой кислоты, имеющей конкретную последовательность, должно быть понятно, что эта ссылка включает в себя ее комплементарную цепь с ее комплементарной последовательностью. Эта комплементарная цепь применима также, например, для антисмысловой терапии, гибридизационных зондов и ПЦР-праймеров. Функционально связанные. Термин "функционально связанные" относится к двум или более элементам последовательности нуклеиновой кислоты, которые обычно физически связаны и находятся в функциональной взаимосвязи друг с другом. Например, промотор функционально связан с кодирующей последовательностью, если этот промотор способен инициировать или регулировать транскрипцию или экспрессию кодирующей последовательности, причем в этом случае кодирующая последовательность должна пониматься как последовательность, находящаяся "под контролем" этого промотора. Опсонизирующая активность."Опсонизирующей активностью" называют способность опсонина (обычно либо связывающей молекулы, например антитела, либо факторов комплемента сыворотки) связываться с поверхностью патогенна либо посредством специфического узнавания антигена (в случае антител), либо через каталитическое действие связанных с поверхностью молекул (например, уменьшенного отложения С 3b как результата действия связанных с поверхностью антител). Фагоцитоз опсонизированных патогенов усиливается вследствие специфического узнавания рецепторов на фагоците для опсонина (Fc-рецептора в случае,когда сами антитела являются опсонинами, и рецептора комплемента в случае, когда комплемент является опсонином). Некоторые бактерии, особенно инкапсулированные бактерии, которые устойчивы к фагоцитозу вследствие присутствия капсулы, становятся чрезвычайно аттрагируемыми фагоцитами, такими как нейтрофилы и макрофаги, при покрытии опсонизирующим антителом, и их скорость клиренса из кровотока и инфицированных органов поразительно усиливается. Опсонизирующая активность может быть измерена общепринятым способом (например, анализом опсонизирующого фагоцитарного убивания). Фармацевтически приемлемый эксципиент. Под "фармацевтически приемлемым эксципиентом" имеют в виду инертное вещество, которое объединено с активной молекулой, такой как лекарственное средство, агент или связывающая молекула, для приготовления приемлемой или удобной лекарственной формы. "Фармацевтически приемлемым эксципиентом" является эксципиент, который является нетоксичным в отношении реципиента в используемых дозах и концентрациях и является совместимым с другими ингредиентами готовой формы, содержащей лекарственное средство, агент или связывающую молекулу. Специфически связывающие. Термин "специфически связывающие" в данном контексте при ссылке на взаимодействие связывающей молекулы, например антитела, и его партнера связывания, например антигена, означает, что это взаимодействие зависит от присутствия конкретной структуры, например антигенной детерминанты или эпитопа, на партнере связывания. Другими словами, это антитело преимущественно связывает или узнает партнер связывания, даже когда партнер связывания присутствует в смеси других молекул или организмов. Это связывание может быть опосредовано ковалентными или нековалентными взаимодействиями или комбинацией обоих. Другими словами, термин "специфически связывающиеся" означает иммуноспецифическое связывание с антигеном или его фрагментом и неспецифическое связывание с другими антигенами. Связывающая молекула, которая иммуноспецифически связывается с антигеном, может связываться с другими пептидами или полипептидами с более низкой аффинностью, как определено, например, радиоиммуноанализами (RIA), твердофазными иммуноферментными анализами (ELISA),BIACORE или другими анализами, известными в данной области. Связывающие молекулы или их фрагменты, которые иммуноспецифически связываются с антигеном, могут быть перекрестно реактивными с родственными антигенами. Предпочтительно связывающие молекулы или их фрагменты, которые иммуноспецифически связываются с антигеном, не реагируют перекрестно с другими антигенами. Замены."Замена" в данном контексте означает замену одной или нескольких аминокислот или нуклеотидов отличающимися аминокислотами или нуклеотидами соответственно. Терапевтически эффективное количество. Термин "терапевтически эффективное количество" означает количество связывающей молекулы,определенной здесь, которое является эффективным для предотвращения, ослабления и/или лечения состояния, возникающего из инфекции Enterococcus. Лечение. Термин "лечение" относится к терапевтическому лечению, а также профилактическим или превентивным мерам для лечения или прекращения или, по меньшей мере, замедления прогрессирования заболевания. Лица, нуждающиеся в лечении, включают в себя лиц, уже пораженных состоянием, проявляющимся в результате инфекции Enterococcus, а также лица, в которых должна быть предотвращена инфекция Enterococcus. Субъекты, частично или полностью выздоровевшие от инфекции Enterococcus, могут также нуждаться в лечении. Предотвращение включает в себя ингибирование или уменьшение распространения Enterococcus или ингибирование или уменьшение проявления, развития или прогрессирования одного или нескольких симптомов, ассоциированных с инфекцией Enterococcus. Вектор. Термин "вектор" означает молекулу нуклеиновой кислоты, в которую может быть встроена другая молекула нуклеиновой кислоты для введения в хозяина, где она будет реплицироваться и в некоторых случаях экспрессироваться. Другими словами, вектор способен транспортировать молекулу нуклеиновой кислоты, с которой он был связан. Клонирующие, а также экспрессирующие векторы рассматриваются под термином "вектор" в данном контексте. Векторы включают в себя, но не ограничиваются ими, плазмиды, космиды, бактериальные искусственные хромосомы (ВАС) и дрожжевые искусственные хромсомы (YAC) и векторы, произведенные из бактериофагов или вирусов растений или животных (в том числе человека). Векторы содержат сайт инициации репликации, узнаваемый предполагаемым хозяином, и в случае экспрессирующих векторов промотор и другие регуляторные районы, узнаваемые этим хозяином. Вектор, содержащий вторую молекулу нуклеиновой кислоты, вводят в клетку трансформацией, трансфекцией или с использованием механизмов вирусного вхождения. Некоторые векторы способны к автономной репликации в организме хозяина, в который их вводят (например, векторы, имеющие бактериальный сайт инициации репликации, могут реплицироваться в бактериях). Другие векторы могут быть интегрированы в геном хозяина после введения в этого хозяина и посредством этого реплицироваться вместе с геномом хозяина. Сущность изобретения Данное изобретение относится к связывающим молекулам человека, способным специфически связываться с энтерококками и проявляющими киллерную и/или ингибирующую рост активность в отношении энтерококков. Изобретение относится также к молекулам нуклеиновых кислот, кодирующих по меньшей мере связывающий район связывающих молекул человека. Изобретение дополнительно обеспечивает применение связывающих молекул человека согласно изобретению в профилактике и/или лечении субъекта, имеющего инфекцию Enterococcus или находящегося при риске развития инфекции Enterococcus. Наряду с этим, изобретение относится к применению связывающих молекул человека согласно изобретению в диагностике/детектировании Enterococcus. Подробное описание изобретения В первом аспекте изобретение относится к моноклональному антителу человека, где указанное антитело содержит район CDR1 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:314; район CDR2 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:315; район CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:316; район CDR1 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:317; район CDR2 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:318; район CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:319. Указанное антитело обладает опсонизирующей фагоцитарной киллерной активностью в отношении по меньшей мере одного штамма, принадлежащего по меньшей мере двум разным видам Enterococcus, и в отношении по меньшей мере одного штамма Staphylococcus aureus. В другом аспекте изобретение относится к моноклональному антителу человека, содержащему тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:427, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:471. Указанное антитело обладает опсонизирующей фагоцитарной киллерной активностью в отношении по меньшей мере одного штамма, принадлежащего по меньшей мере двум разным видам Enterococcus, и в отношении по меньшей мере одного штамма Staphylococcus aureus. В одном из предпочтительных вариантов указанных аспектов штаммы Enterococcus включают Е.faecalis и Е. faecium. В третьем аспекте изобретение относится к иммуноконъюгату, содержащему моноклональное антитело человека предыдущих аспектов. Иммуноконъюгат дополнительно содержит по меньшей мере одну метку. В четвертом аспекте изобретение относится к молекуле нуклеиновой кислоты, кодирующей моноклональное антитело человека предыдущих аспектов изобретения. В пятом аспекте изобретение относится к вектору, содержащему по меньшей мере одну молекулу указанной нуклеиновой кислоты. В шестом аспекте изобретение относится к клетке-хозяину, содержащему по меньшей мере один указанный вектор. В седьмом аспекте изобретение относится к способу получения указанных выше моноклональных антител человека. Способ предусматривает культивирование указанной клетки-хозяина в условиях, способствующих экспрессии моноклонального антитела человека, и, при необходимости, выделение экспрессированного моноклонального антитела. Также изобретение относится к фармацевтической композиции, содержащей указанные моноклональные антитела человека или указанный иммуноконъюгат, дополнительно содержащей по меньшей мере один фармацевтически приемлемый эксципиент. В одном из вариантов осуществления фармацевтическая композиция может содержать по меньшей мере одно антибактериальное средство. Наконец, изобретение относится к применению указанных моноклональных антител человека, а также указанного иммуноконъюагата и фармацевтической композиции для диагностики, профилактики и/или лечения инфекции, вызванной энтерококками, и/или инфекции, вызванной стафилококками. Примеры Для иллюстрации согласно изобретению обеспечены следующие примеры. Эти примеры не предназначены для ограничения каким-либо образом объема согласно изобретению. Пример 1. Конструирование библиотек scFv фагового дисплея с использованием РНК, экстрагированной из доноров, подвергнутых скринингу на опсонизирующую активность. Пробы крови брали из доноров, сообщающих о недавней грамположительной бактериальной инфекции, а также здоровых взрослых в возрасте 25-50 лет. Лейкоциты периферической крови выделяли центрифугированием и сыворотку крови сохраняли и замораживали при -80 С. Сыворотку доноров подвергали скринингу на киллерную активность с использованием анализа опсонофагоцитарного убивания(Huebner et al. 1999) и сравнивали с нормальной сывороткой кроликов. Сыворотки из доноров, имеющих фагоцитарную активность, большую, чем в нормальной сыворотке, выбирали для применения в генерировании библиотек фагового дисплея. Тотальную РНК получали из лейкоцитов периферической крови этих доноров с использованием отделения органической фазы и последующего осаждения этанолом. Полученную РНК растворяли в не содержащей РНКаз воде и определяли концентрацию измерением OD 260 нм. После этого эту РНК разбавляли до концентрации 100 нг/мл. Затем 1 мкг РНК превращали в кДНК следующим образом: к 10 мкл тотальной РНК добавляли 13 мкл DEPC-обработанной ультрачистой воды и 1 мкл случайных гексамеров (500 нг/мкл) и полученную смесь нагревали при 65 С в течение 5 мин и быстро охлаждали на увлажненном льду. Затем к этой смеси добавляли 8 мкл 5 Х буфера первой цепи, 2 мкл dNTP (10 мМ каждый), 2 мкл ДТТ (0,1 М), 2 мкл ингибитора РНКаз (40 Е/мкл) и 2 мкл обратной транскриптазы SuperscriptIII MMLV (200 Е/мкл), инкубировали при комнатной температуре в течение 5 мин и инкубировали в течение 1 ч при 50 С. Реакцию останавливали инактивацией нагреванием, т.е. инкубированием этой смеси в течение 15 мин при 75 С. Полученные кДНК-продукты разбавляли до конечного объема 200 мкл DEPC-обработанной ультрачистой водой. Для определения концентрации кДНК использовали OD 260 нм разбавленного в 50 раз раствора (в 10 мМ трис-буфере) разведения полученных кДНК-продуктов. Для каждого донора 5-10 мкл разведенных кДНК-продуктов использовали для ПЦР-амплификации последовательностей семейства тяжелых цепей и легких цепей каппа или лямбда иммуноглобулина гамма с использованием специфических олигонуклеотидный праймеров (см. табл. 1-7). Кроме того, для одного донора проводили ПЦР-амплификацию последовательностей семейства тяжелых цепей мю и легкой цепи каппа или лямбда. Реакционные смеси ПЦР содержали, наряду с разбавленными кДНК-продуктами, 25 пмоль смысловой праймер и 25 пмоль антисмысловой праймер в конечном объеме 50 мкл 20 мМ Трис-HCl (рН 8,4), 50 мМ KCl, 1,5 мМ MgCl2, 250 мкМ dNTP и 1,25 единиц полимеразы Taq. В термоциклере с нагретой крышкой, имеющем температуру 96 С, полученные смеси быстро расплавляли в течение 2 мин с последующими 30 циклами: 30 с при 96 С, 30 с при 55 или 60 С и 60 с при 72 С. Наконец, эти пробы инкубировали 10 мин при 72 С и помещали в холодильник при 4 С до последующего использования. В первом раунде амплификации каждый из восемнадцати смысловых праймеров вариабельной области легкой цепи (двенадцать для легкой цепи лямбда (см. табл. 1; смысловые праймеры HuVL1A-Back,HuVL1IB-Back и HuVL1C-Back смешивали до эквимолярности перед использованием так же, как и смысловые праймеры HuVL9-Back и HuVL10-Back) и шести для легкой цепи каппа (см. табл. 2 объединяли с антисмысловым праймером, узнающим константную область С-каппа, названным HuCK-FOR 5'-ACACTCTCCCCTGTTGAAGCTCTT-3' (см. SEQ ID NO:121) или константной областью С-лямбдаHuCL7-FOR смешивали до эквимолярности перед использованием) с получением 15 продуктов приблизительно 650 п.н. Эти продукты очищали на агарозном геле и выделяли из геля с использованием колонок для экстракции гелей Qiagen. 1/10 каждого из этих выделенных продуктов использовали в идентичной ПЦР-реакции, описанной выше, с использованием восемнадцати смысловых праймеров, посредством которой каждый смысловой праймер легкой цепи лямбда комбинировали с одним из трехJ-лямбда-область-специфических антисмысловых праймеров и каждый смысловой праймер легкой цепи каппа комбинировали с одним из пяти J-каппа область-специфических антисмысловых праймеров (см. табл. 3; смысловые праймеры HuVL1A-Back-SAL, HuVL1B-Back-SAL и HuVL1C-Back-SAL смешивали до эквимолярности перед использованием так же, как и смысловые праймеры HuVL9-Back-SAL иHuVL10-Back-SAL). Смысловые праймеры, используемые во второй амплификации, были такими же праймерами, которые использовали в первой амплификации, но были удлинены сайтами рестрикции (см. табл. 3) для возможности направленного клонирования в вектор фагового дисплея PDV-C06 (см. SEQ IDNO:124). Это приводило к 57 продуктам приблизительно 400 п.н., которые объединяли, как показано в табл. 4, для сохранения природного распределения разных J-сегментов и семейств легких цепей в этой библиотеке, но не представления завышенно или заниженно определенных семейств. Эти объединенные продукты очищали с использованием колонок для ПЦР-очистки Qiagen. В следующей стадии 3 мкг объединенных продуктов и 100 мкг вектора PDV- С 06 расщепляли SalI и NotI и очищали из геля. После этого выполняли лигирование в течение ночи при 16 С следующим образом. К 500 нг вектора PDV-C06 добавляли 35, 70 или 140 нг объединенных продуктов в общем объеме 50 мкл смеси для лигирования, содержащей 50 мМ Трис-HCl (рН 7,5), 10 мМ MgCl2, 10 мМ ДТТ, 1 мМ АТФ, 25 мкг/мл БСА и 2,5 мкл ДНК-лигазы Т 4 (400 Е/мкл). Эти смеси для лигирования очищали экстракцией смесью фенол/хлороформ с последующей экстракцией хлороформом и осаждением этанолом, способами, хорошо известными специалисту в данной области. Полученную ДНК растворяли в 50 мкл 10 мМ Трис-HCl рН 8,5 и 1 или 2 мкл каждой смеси для лигирования электропорировали в 40 мкл TG1-компетентных бактерий Е. coli в соответствии с протоколом изготовителя (Stratagene). Трансформанты выращивали в течение ночи при 37 С на 2TY-агаре, дополненном 50 мкг/мл ампициллина и 4,5% глюкозой. Колонии считали для определения оптимального отношения вектора к инсерту. Из смеси для лигирования с оптимальным соотношением множественные аликвоты 1 или 2 мкл электропорировали, как описано выше, и трансформанты росли в течение ночи при 37 С, давая обычно 107 колоний. (Суб)библиотеку вариабельных областей легкой цепи получали выскабливанием трансформантов из чашек с агаром. Эту (суб)библиотеку использовали непосредственно для получения ДНК плазмиды с использованием набора Qiagen QIAFilter MAXI prep. Последовательности тяжелых цепей иммуноглобулина амплифицировали из тех же самых кДНКпрепаратов в сходной процедуре ПЦР с двумя раундами и идентичными параметрами реакции, как описано выше для областей легкой цепи, при условии, что использовали праймеры, представленные в табл. 5 и 6. Первую амплификацию выполняли с использованием серии из восьми смысловых праймеров (см. табл. 5; смысловые праймеры HuVH1B/7A-Back и HuVH1C-Back смешивали до эквимолярности перед использованием), каждый, в комбинации с IgG-специфическим антисмысловым праймером константной области, названным HuCIgG 5'-GTCCACCTTGGTGTTGCTGGGCTT-3' (SEQ ID NO:125) с получением семи продуктов приблизительно 650 п.н. Для одного донора использовали IgM-специфический антисмысловой праймер константной области, названный HuCIgM 5'-TGGAAGAGGCACGTTCTTTTCTTT-3'(SEQ ID NO:126) вместо праймера HuCIgG. Эти продукты очищали на агарозном геле и выделяли из геля с использованием колонок для экстракции гелей Qiagen. 1/10 каждого из этих выделенных продуктов использовали в идентичной ПЦР-реакции, описанной выше, с использованием восьми смысловых праймеров, посредством которой каждый смысловой праймер тяжелой цепи комбинировали с одним из четырех JH-цепь-специфических антисмысловых праймеров (см. табл. 6; смысловые праймеры HuVH1B/7ABack-Sfi и HuVH1C-Back-Sfi смешивали до эквимолярности перед использованием). Смысловые праймеры, используемые в этом втором раунде, были теми же самыми праймерами, которые использовали в первой амплификации, но удлиненными сайтами рестрикции (см. табл. 6) для возможности направленного клонирования в векторе (суб)библиотеки легкой цепи. Это приводило к 28 продуктам приблизительно 400 п.н., которые объединяли, как показано в табл. 7, для сохранения природного распределения разныхJ-сегментов и семейств тяжелых цепей в этой библиотеке, но не представления завышено или занижено определенных семейств. Эти объединенные продукты очищали с использованием колонок для ПЦРочистки Qiagen. Затем 3 мкг очищенных продуктов расщепляли SfiI и XhoI и лигировали в вектор(суб)библиотеки легких цепей, который был разрезан теми же самыми рестрикционными ферментами, с использованием процедуры лигирования и объемов, описанных выше для (суб)библиотеки легких цепей. Очистку смеси для лигирования и последующую трансформацию полученной окончательной библиотеки выполняли, как описано выше для (суб)библиотеки легких цепей. Все бактерии, обычно 107, собирали в культуральной среде 2TY, содержащей 50 мкг/мл ампициллин и 4,5% глюкозу, смешивали с глицерином до 15% (об./об. и замораживали в виде аликвот 1,5 мл при -80 С. Спасение и отбор каждой библиотеки выполняли, как описано ниже. Различные библиотеки были названы GPB-05-M01, GPB-05-G01,GPB-05-G02, GPB-05-G03, GPB-05-G04 и GPB-05-G05. Две другие библиотеки, RAB-03-G01 и RAB-04G01, конструировали с использованием способа, сходного с вышеописанной процедурой, как описано ранее в международной заявке на патент WO 2005/118644. Пример 2. Конструирование библиотек scFv фагового дисплея с использованием РНК, экстрагированной из В-клеток памяти. Периферическую кровь собирали из нормальных здоровых доноров, выздоровевших доноров или вакцинированных доноров венопункцией с использованием обработанных ЭДТА антикоагуляционных пробирок для крови. Пробу крови (45 мл) разбавляли в 2 раза ЗФР, аликвоты 30 мл наносили на 10 млFicoll-Hypaque (Pharmacia) и центрифугировали при 900g in vivo 20 мин при комнатной температуре без прерываний. Супернатант осторожно удаляли до положения выше белого слоя, содержащего фракцию лимфоцитов и тромбоцитов. Затем этот слой осторожно удаляли (10 мл), переносили в свежую пробирку на 50 мл, промывали три раза 40 мл ЗФР и откручивали при 400g в течение 10 мин при комнатной температуре для удаления тромбоцитов. Полученный осадок, содержащий лимфоциты, ресуспендировали в среде RPMI, содержащей 2% ФТС, и количество клеток определяли подсчетом клеток. Приблизительно 1103 лимфоцитов окрашивались для сортинга флуоресцентных клеток с использованием CD24,CD27 и поверхностного IgM в качестве маркеров для выделения В-клеток переключенной памяти и памяти IgM. Устройство Becton Dickinson Digital Vantage, установленное в режиме Yield Mode, использовали для физического сортинга и выделения В-клеток памяти. Лимфоциты дискриминировали в виде малой компактной популяции из окна FSC/SSC. Затем В-клетки (CD24+/CD27+) отделяли от необученных В-клеток (CD24+/CD27-) и Т-клеток памяти (CD24-/CD27+). В следующей стадии В-клетки памятиIgM (IgM+) отделяли от В-клеток переключенной памяти (IgM-) с использованием экспрессии IgM. В этой стадии В-клетки памяти IgM и В-клетки переключенной памяти подвергали сортингу в отдельных пробирках для проб. 1105-1106 клеток каждой популяции собирали в DMEM/50% ФТС и после завершения сортинга клетки каждой популяции центрифугировали при 400g в течение 10 мин. Затем отсортированные В-клетки использовали в качестве исходного материала для конструирования библиотек согласно способу, описанному в примере 1, с использованием праймера HuCIgM в первом раунде амплификации последовательностей тяжелой цепи иммуноглобулина. Разные библиотеки были названы МЕМ 05-М 01, МЕМ-05-М 02, МЕМ-05-М 03, МЕМ-05-М 04, МЕМ-05-М 05, МЕМ-05-М 06, МЕМ-05-М 07, МЕМ 05-М 08, МЕМ-05- М 09 и МЕМ-05-М 10. Пример 3. Отбор фагов, несущих одноцепочечные Fv-фрагменты, специфически связывающиеся с энтерококками. Фрагменты антител отбирали с использованием библиотек фагового дисплея антител общей технологии фагового дисплея и технологии MAbstract, в основном описанной в патенте США 6265150 и вWO 98/15833 (оба из которых включены здесь в качестве ссылки). Эти используемые фаговые библиотеки антител, полученные, как описано в примере 1, и библиотеки памяти IgM, полученные, как описано в примере 2. В данном изобретении использовали способы и хелперные фаги, описанные в WO 02/103012(включенном здесь в качестве ссылки). Для идентификации фаговых антител, узнающих энтерококки,выполняли эксперименты отбора фагов с использованием живых бактерий в суспензии или бактерий,иммобилизованных в иммунопробирках. Используемые штаммы описаны в табл. 8. Все фаговые антитела выделяли из отобранных фагов, причем по меньшей мере в одной стадии в суспензии был использован Е. faecalis 12030. Фаговые антитела, названные SC05-159 и SC05-166, были первоначально выделены из отобранных фагов с использованием иммобилизованного Е. faecalis 12030, но позднее они были выде- 10021767 лены также с использованием Е. faecalis 12030 в суспензии. Отборы с использованием бактерий в суспензии выполняли следующим образом. Бактерии выращивали в течение ночи при 37 С на чашках с кровяным агаром и соскабливали в ЗФР, содержащий 2% БСА или 2% ELK, при концентрации 5109 бактерий/мл и инкубировали в течение 30 мин при комнатной температуре. Аликвоту фаговой библиотеки (приблизительно 10 КОЕ, амплифицированной с использованием хелперного фага СТ (см. WO 02/103012, блокировали в блокирующем буфере (2% ELK или 2% БСА в ЗФР) в течение 0,5-2 ч при комнатной температуре. Эту блокированную фаговую библиотеку добавляли к блокированной бактериальной суспензии с получением общего объема 1 мл и инкубировали в течение 2 ч при комнатной температуре в роторе с переворачиванием пробирок с донышка на крышку (5 об/мин). Эту суспензию центрифугировали при 6800g в течение 3 мин при комнатной температуре и супернатант выбрасывали. Бактерии промывали три-восемь раз блокирующим буфером, содержащим 0,05% (об./об.) Твин-20, затем три-восемь раз блокирующим буфером для удаления несвязанных фагов. Связанные фаги элюировали из антигена инкубацией с 1 мл 0,1 М триэтиламина в течение 7 мин при комнатной температуре в роторе с переворачиванием пробирок с донышка на крышку (5 об/мин). Эту суспензию центрифугировали в течение 3 мин при 1700g и затем супернатант смешивали с 0,5 мл 1 М Трис-HCl рН 7,5 для нейтрализации рН. Эту смесь использовали для инфицирования 5 мл культурыXLl-Blue E. coli, которую выращивали при 37 С до OD 600 нм приблизительно 0,3. Фагам давали расти для инфицирования бактерий XLl-Blue в течение 30 мин при 37 С. Затем эту смесь центрифугировали в течение 10 мин при 3200g при комнатной температуре и бактериальный осадок ресуспендировали в 0,5 мл среды 2-триптон-дрожжевой экстракт (2TY). Полученную бактериальную суспензию делили на две чашки с 2TY-агаром, дополненным тетрациклином, ампициллином и глюкозой. После инкубации в течение ночи этих чашек при 37 С колонии выскабливали из чашек и использовали для получения обогащенной фаговой библиотеки в основном, как описано De Kruif et al. (1995a) и WO 02/103012. Вкратце,соскобленные бактерии использовали для инокуляции среды 2TY, содержащей ампициллин, тетрациклин и глюкозу, и выращивали при температуре 37 С до OD 600 нм 0,3. Добавляли хелперные фаги СТ и давали им инфицировать бактерии, после чего эту среду заменяли на среду 2TY, содержащую ампициллин, тетрациклин и канамицин. Инкубацию продолжали в течение ночи при 30 С. На следующий день бактерии удаляли из среды 2TY центрифугированием, после чего эти фаги в среде осаждали с использованием полиэтиленгликоля (ПЭГ) 6000/NaCl. Наконец, фаги растворяли в 2 мл ЗФР с 1% бычьим сывороточным альбумином (БСА), стерильно фильтровали и использовали для следующего раунда отбора. Отборы с использованием бактерий, иммобилизованных в иммунопробирках, выполняли следующим образом. Бактерии выращивали в течение ночи при 37 С на чашках с кровяным агаром и соскабливали в карбонатный буфер при концентрации 5109 бактерий/мл. 2 мл добавляли в MaxiSorp NuncImmuno Tube (Nunc) и инкубировали в течение ночи при 4 С в роторе с переворачиванием с донышка на крышку (5 об/мин). Пробирку опустошали и промывали три раза ЗФР. Как пробирку, так и аликвоту фаговой библиотеки (приблизительно 1013 КОЕ, амплифицированной с использованием хелперного фага СТ (см. WO 02/103012 блокировали в блокирующем буфере (2% ELK, 2% БСА или 1% Protifar в ЗФРБ) в течение 0,5-2 ч при комнатной температуре. Пробирку опустошали, добавляли блокированную фаговую библиотеку и эту пробирку инкубировали в течение 2 ч при комнатной температуре в роторе с переворачиванием пробирок с донышка на крышку (5 об/мин). Эту пробирку промывали пять-пятнадцать раз ЗФР, содержащим 0,1% (об./об.) Твин-20, затем пять-пятнадцать раз ЗФР для удаления несвязанных фагов. Связанные фаги элюировали из антигена инкубированием с 1,5 мл 0,1 М триэтиламина или 50 мМ глицина-HCl, рН 2,2 в течение 10 мин при комнатной температуре в роторе с переворачиванием пробирки с донышка на крышку (5 об/мин). Элюированные фаги смешивали с 0,5 мл 1 М Трис-HCl рН 7,5 для нейтрализации рН. Последующее инфицирование бактерий XLl-Blue E. coli, выращивание инфицированных бактерий и получение обогащенной фаговой библиотеки выполняли, как описано выше для отборов с использованием бактерий в суспензии. Обычно выполняли два раунда отборов перед выделением индивидуальных фаговых антител. Отбор мог проводиться дважды на одном и том же штамме бактерий или разные штаммы могли использоваться последовательно. После второго раунда отбора отдельные колонии Е. coli использовали для получения моноклональных фаговых антител. В основном отдельные колонии выращивали до log-фазы и инфицировали хелперными фагами СТ или VCSM13, после чего образованию фаговых антител давали протекать в течение ночи. Полученные фаговые антитела осаждали PEG/NaCl, стерильно фильтровали и тестировали в ELISA на связывание с Enterococcus, приготовленным, как описано supra. Пример 4. Валидизация энтерококковых специфических одноцепочечных фаговых антител. Отобранные одноцепочечные фаговые антитела, которые получали в скринингах, описанных выше,валидизировали в ELISA на специфическую энтерококковую связывающую активность, т.е. связывание с одним или несколькими энтерококковыми штаммами, полученными, как описано supra. 2,5108 бактерий наносили в течение ночи при 4 С на планшеты Maxisorp ELISA в 50 мкл 50 мМ карбонатного буфера,рН 9,6. В качестве отрицательных контролей наносили комплексные антигены 2% ELK и 1% БСА, оба в ЗФР (рН 7,4). Лунки промывали в ЗФР, содержащем 0,1% (об./об.) Твин-20, и блокировали 300 мкл ЗФР,- 11021767 содержащего 2% ELK, для получения блокированных фаговых антител. Планшеты опустошали и в лунки добавляли блокированные одноцепочечные фаговые антитела. Инкубации давали протекать в течение 1 ч при комнатной температуре, планшеты промывали в ЗФР, содержащем 0,1% (об./об.) Твин-20 и связанные фаговые антитела детектировали с использованием анти-М 13-антитела, конъюгированного с пероксидазой. Поглощение при 492 нм измеряли с использованием спектрофотометра. В качестве контроля эту процедуру выполняли одновременно без одноцепочечного фагового антитела и с отрицательным контрольным одноцепочечным фаговым антителом, направленным против белка оболочки вируса лихорадки Западного Нила (SC04-374). Как показано в табл. 9, выбранные фаговые антитела, названные SC05140, SC05-157, SC05-159, SC05-166, SC05-179, SC05-187, SC06-016, SC06-043, SC06-049, SC06-050,SC06-071, SC06-077, SC06-078, SC06-079, SC06-086, SC06-087, SC06-089, SC06-092, SC06-191, SC06-195,SC06-198, SC06-241, SC06-242, SC06-246, SC06-252, SC06-388, SC06-389, SC06-396, SC06-402, SC06-409,SC06-415, SC06-421, SC06-429 и SC06-432, специфически связывались со штаммом Enterococcus faecalis 12030. За исключением SC05-140 и SC06-421, ни одно из выбранных фаговых антител не проявляло какого-либо детектируемого связывания с антигенами отрицательного контроля ELK и БСА. Пример 5. Характеристика энтерококковых специфических scFv. Из выбранных клонов специфического одноцепочечного фагового антитела (scFv) получали плазмидную ДНК и определяли нуклеотидные последовательности в соответствии со стандартными способами. Нуклеотидные последовательности scFv (в том числе сайты для клонирования), названных SC05140, SC05-157, SC05-159, SC05-166, SC05-179, SC05-187, SC06-016, SC06-043, SC06-049, SC05-050,SC06-071, SC06-077, SC06-078, SC06-079, SC06-086, SC06-087, SC06-089, SC06-092, SC06-191, SC06-195,SC06-198, SC06-241, SC06-242, SC06-246, SC06-252, SC06-388, SC06-389, SC06-396, SC06-402, SC06-409,SC06-415, SC06-421, SC06-429 и SC06-432, показаны в SEQ ID NO:350, SEQ ID NO:352, SEQ ID NO:61,SEQ ID NO:63, SEQ ID NO:354, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ IDNO:392 соответственно. Аминокислотные последовательности этих scFv, названных SC05-140, SC05157, SC05-159, SC05-166, SC05-179, SC05-187, SC06-016, SC06-043, SC06-049, SC05-050, SC06-071,SC06-077, SC06-078, SC06-079, SC06-086, SC06-087, SC06-089, SC06-092, SC06-191, SC06-195, SC06-198,SC06-241, SC06-242, SC06-246, SC06-252, SC06-388, SC06-389, SC06-396, SC06-402, SC06-409, SC06-415,SC06-421, SC06-429 и SC06-432, показаны в SEQ ID NO:351, SEQ ID NO:353, SEQ ID NO:62, SEQ IDCDR-последовательности этих scFvs, специфически связывающих энтерококки, изображены в табл. 10 и 11 соответственно. Пример 6. Конструирование полных человеческих молекул иммуноглобулина (моноклональных антиэнтерококковых антител человека) из отобранных антиэнтерококковых одноцепочечных scFv. Вариабельные области тяжелой цепи и легкой цепи scFv, названных SC05-140, SC05-157, SC05-159,SC05-166, SC05-179, SC05-187, SC06-016, SC06-043, SC06-049, SC05-050, SC06-071, SC06-077, SC06-078,SC06-079, SC06-086, SC06-087, SC06-089, SC06-092, SC06-191, SC06-195, SC06-198, SC06-241, SC06-242,SC06-246, SC06-252, SC06-388, SC06-389, SC06-396, SC06-402, SC06-409, SC06-415, SC06-421, SC06-429 и SC06-432, клонировали непосредственно с использованием рестрикционного продукта расщепления для экспрессии в векторах экспрессии IgG pIg-C911-HCgamma1 (см. SEQ ID NO:127), pIg-C909-Ckappa(см. SEQ ID NO:128) и pIg-C910-Clambda (см. SEQ ID NO:129). Вариабельные области тяжелой цепиscFv, названных SC05-140, SC05-157, SC05-159, SC05-166, SC05-179, SC05-187, SC06-016, SC06-043,SC06-049, SC05-050, SC06-071, SC06-077, SC06-078, SC06-079, SC06-086, SC06-087, SC06-089, SC06-092,SC06-191, SC06-195, SC06-198, SC06-241, SC06-242, SC06-246, SC06-252, SC06-388, SC06-389, SC06-396,SC06-402, SC06-409, SC06-415, SC06-421, SC06-429 и SC06-432, клонировали в вектор pIg-C911HCgamma1 с использованием рестрикционного продукта расщепления ферментами SfiI и XhoI. Вариабельную область легкой цепи scFv, названных SC06-016, SC06-050, SC06-077, SC06-086, SC06-191,SC06-241, SC06-396 и SC06-429, клонировали в вектор pIg-C909-Ckappa с использованием рестрикционного продукта расщепления ферментами SalI, XhoI и NotI. Вариабельную область легкой цепи scFv, названных SC05-140, SC05-157, SC05-159, SC05-166, SC05-179, SC05-187, SC06-043, SC06-049, SC06-071,SC06-078, SC06-079, SC06-087, SC06-089, SC06-092, SC06-195, SC06-198, SC06-242, SC06-246, SC06-252,SC06-388, SC06-389, SC06-402, SC06-409, SC06-415, SC06-421 и SC06-432, клонировали в вектор pIgC910-Clambda с использованием рестрикционного продукта расщепления ферментами SalI, XhoI и NotI. После этого нуклеотидные последовательности подтверждали в соответствии со стандартными способами, известными специалисту в данной области. Полученные экспрессирующие pgG105-140C911, pgG105-157C911, pgG105-159C911, pgG105166C911, pgG105-179C911, pgG105-187C911, pgG106-016C911, pgG106-043C911, pgG106-049C911,pgG106-050C911, pgG106-071C911, pgG106-077C911, pgG106-078C911, pgG106-079C911, pgG106086C911, pgG106-087C911, pgG106-089C911, pgG106-092C911, pgG106-191C911, pgG106-195C911,pgG106-198C911, pgG106-0241C911, pgG106-242C911, pgG106-246C911, pgG106-252C911, pgG106388C911, pgG106-389C911, pgG106-396C911, pgG106-402C911, pgG106-409C911, pgG106-415C911,pgG106-421C911, pgG106-429C911 и pgG106-432C911, кодирующие тяжелые цепи антиэнтерококковогоIgG1 человека, и pgG105-140C910, pgG105-157 С 910, pgG105-159C910, pgG105-166C910, pgG105179C910, pgG105-187C910, pgG106-016C909, pgG106-043C910, pgG106-049C910, pgG106-050C909,pgG106-071C910, pgG106-077C909, pgG106-078C910, pgG106-079C910, pgG106-086C909, pgG106087C910, pgG106-089C910, pgG106-092C910, pgG106-191C909, pgG106-195C910, pgG106-198C910,pgG106-0241C909, pgG106-242C910, pgG106-246C910, pgG106-252C910, pgG106-388C910, pgG106389C910, pgG106-396C909, pgG106-402C910, pgG106-409C910, pgG106-415C910, pgG106-421C910,pgG106-429C909 и pgG106-432C910, кодирующие легкие цепи антиэнтерококкового Ig человека, транзиторно экспрессировали в комбинации в клетках 293 Т и получали супернатанты, содержащие IgG1 антитела человека. Нуклеотидные последовательности тяжелых цепей антител, названных CR5140,CR5157, CR5159, CR5166, CR5179, CR5187, CR6016, CR6043, CR6049, CR6050, CR6071, CR6077,CR6078, CR6079, CR6086, CR6087, CR6089, CR6092, CR6191, CR6195, CR6198, CR6241, CR6242,CR6246, CR6252, CR6388, CR6389, CR6396, CR6402, CR6409, CR6415, CR6421, CR6429 и CR6432, показаны в SEQ ID NO:394, SEQ ID NO:396, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:398, SEQ ID NO:85,SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:400, SEQ ID NO:93, SEQ ID NO:402, SEQ IDNO:430, SEQ ID NO:432, SEQ ID NO:434 и SEQ ID NO:436 соответственно. Аминокислотные последовательности тяжелых цепей антител, названных CR5140, CR5157, CR5159, CR5166, CR5179, CR5187,CR6016, CR6043, CR6049, CR6050, CR6071, CR6077, CR6078, CR6079, CR6086, CR6087, CR6089,CR6092, CR6191, CR6195, CR6198, CR6241, CR6242, CR6246, CR6252, CR6388, CR6389, CR6396,CR6402, CR6409, CR6415, CR6421, CR6429 и CR6432, показаны в SEQ ID NO:395, SEQ ID NO:397, SEQNO:437 соответственно. Нуклеотидные последовательности легкой цепи антител CR5140, CR5157, CR5159, CR5166,CR5179, CR5187, CR6016, CR6043, CR6049, CR6050, CR6071, CR6077, CR6078, CR6079, CR6086,CR6087, CR6089, CR6092, CR6191, CR6195, CR6198, CR6241, CR6242, CR6246, CR6252, CR6388,CR6389, CR6396, CR6402, CR6409, CR6415, CR6421, CR6429 и CR6432 показаны в SEQ ID NO:438, SEQNO:476, SEQ ID NO:478 и SEQ ID NO:480 соответственно. Аминокислотные последовательности легкой цепи антител CR5140, CR5157, CR5159, CR5166, CR5179, CR5187, CR6016, CR6043, CR6049, CR6050,CR6071, CR6077, CR6078, CR6079, CR6086, CR6087, CR6089, CR6092, CR6191, CR6195, CR6198,CR6241, CR6242, CR6246, CR6252, CR6388, CR6389, CR6396, CR6402, CR6409, CR6415, CR6421,CR6429 и CR6432 показаны в SEQ ID NO:439, SEQ ID NO:441, SEQ ID NO:102, SEQ ID NO:104, SEQ IDNO:473, SEQ ID NO:475, SEQ ID NO:477, SEQ ID NO:479 и SEQ ID NO:481 соответственно. Специалист в данной области сможет определить вариабельные области тяжелой и легкой цепей вышеописанных антител по Kabat et al. (1991), как описано Sequences of Proteins of Immunological Interest. Вариабельные области этих антител представлены в табл. 12. Эти антиэнтерококковые IgG1-антитела человека проверяли на их способность связываться с энтерококками при помощи ELISA, по существу, как описано для scFv выше; IgG1 анализировали при концентрации 5 г/мл, за исключением следующих IgG1: CR6191 анализировали при 1,6 г/мл, CR6195 при 3,1 г/мл, CR6198 при 4,1 г/мл, CR6241 при 2,1 г/мл, CR6246 при 2,6 г/мл и CR6252 при 3,0 г/мл. Отрицательным контролем было антитело против вируса лихорадки Западного Нила (CR4374). Кроме того, антиэнтерококковые IgG1-антитела человека испытывали на их способность связываться с разными клиническими изолятами Enterococcus faecalis и Enterococcus faecium (см. табл. 13). Считалось, что антитело связывается с изолятом, когда эта величина в отдельном эксперименте была по меньшей мере в три раза большей в сравнении с величиной отрицательного контроля в этом отдельном эксперименте. Величина отрицательного контроля в табл. 13 является средней величиной из 6 экспериментов. Все антитела, за исключением CR5157, CR5179, CR6016, CR6043, CR6050, CR6246, CR6388, CR6409, и антитела отрицательного контроля специфически связывались со штаммом Enterococcus faecalis 12030 и все IgG1, за исключением CR5157, CR6016, CR6043, CR6050, CR6241, CR6242, CR6246, CR6388 и CR6409, связывались более чем с одним клиническим изолятом. Антитела CR5187, CR6049, CR6396, CR6402 и CR6421 связывались со всеми испытанными штаммами Enterococcus faecalis и с двумя испытанными штаммамиEnterococcus faecium. Альтернативно, получали партии больше чем 1 мг каждого антитела и очищали их при помощи стандартных процедур. Пример 7. In vitro опсонизирующая фагоцитарная активность энтерококковых специфических IgG,измеренная при помощи анализа опсонофагоцитарного убивания. Опсонофагоцитарный анализ проводили для количественного определения киллерной активности антиэнтерококкового IgG1 человека в отношении энтерококкового клинического изолята 12030. Свежевзятую кровь человека (10-30 мл) смешивали с равным объемом декстран-гепаринового буфера (4,5 г декстрана, Sigma Chemical, St. Louis; 28,4 мг натрий-гепарина в 500 мл дистиллированной воды) и эту смесь инкубировали при 37 С в течение 1 ч. Верхний слой, содержащий лейкоциты, собирали центрифугированием и выполняли гипотонический лизис оставшихся эритроцитов суспендированием осадка клеток в 1% (мас./об.) NH4Cl. Затем популяцию лейкоцитов промывали в RPMI с 15% фетальной телячьей сывороткой. Для определения концентрации живых лейкоцитов использовали окрашивание трипановым синим и счет в гемоцитометре и конечную концентрацию лейкоцитов доводили до 2107 клеток/мл. Анализ фагоцитоза выполняли в двух повторностях с добавлением или без добавления 100 мкл суспензии лейкоцитов к 100 мкл бактерий (концентрацию доводили спектрофотометрически до 2107 на 1 мл и подтверждали подсчетом жизнеспособных бактерий), 100 мкл антиэнтерококковых IgG1 человека, разведенных в RPMI, и 100 мкл комплемента детеныша кролика. Эту реакционную смесь инкубировали на роторном штативе при 37 С в течение 90 мин; брали пробы в точке 0 и после 90 мин, разбавляли в 1%Proteose Peptone (Difco Laboratories, Detroit, Mich.) и высевали на чашки с триптическим соевым агаром. Киллерную активность (%) антител рассчитывали вычитанием среднего количества КОЕ, выживающих в пробе, содержащей лейкоциты, из среднего количества КОЕ, выживающих в пробе без лейкоцитов, деления на последнюю величину и умножения на 100. Четыре концентрации антиэнтерококкового IgG1 человека (2500, 250, 25, 2,5 нг/мл) испытывали в двух независимых экспериментах. Обычный регрессионный анализ, использующий пробит-модель, использовали для расчета концентраций, необходимых для 50% убивания бактерий, в этом анализе (см. табл. 14). Пример 8. In vivo активность энтерококковых специфических IgG в мышиной модели сепсиса. Мышиную модель сепсиса Enterococcus (see Hufnagel et al. 2004) использовали для количественного определения активности антиэнтерококкового IgG1 человека в клиренсе энтерококкового клинического изолята 12030 из кровотока. Очищенные IgG1-молекулы CR5159, CR5187, CR6016, CR6043, CR6049,CR6071, CR6089 и CR6241, имеющие, как было продемонстрировано, in vitro киллерную активность в отношении Enterococcus, и один IgG1 отрицательного контроля, не имеющий киллерной активности в отношении Enterococcus, готовили, как описано выше, и инъецировали i.p. (0,5-1 мл в ЗФР) в группы из восьми мышей BALB/c в дозе 15 мг/кг, за исключением CR6016 и CR6241, которые инъецировали в дозе 7,5 мг/кг. Кроме того, одну группу мышей инъецировали ЗФР. Спустя 24 ч животных инокулировали i.v. 6108 КОЕ штамма Enterococcus 12030. Спустя 4 ч после заражения мыши получали вторую i.p. инъекцию CR5159, CR5187, CR6016, CR6043, CR6049, CR6071, CR6089 и CR6241 в той же самой дозе. Спустя три дня после системного инфицирования животных эвтанизировали и собирали 0,5 мл крови сердечной пункцией. Пробы крови культивировали количественно на элективной для энтерококков агаровой среде; 100 мкл крови, разбавленной в 900 мкл ТНВ, распределяли на чашки в двух повторностях. После ночного инкубирования количество КОЕ считывали на чашке и умножали на 10 с получением КОЕ/мл крови. Это величина непосредственно относится к количеству циркулирующих бактерий в момент умерщвления. Начальной точкой в этой модели является КОЕ Enterococcus в крови спустя 3 дня после инокуляции. Как показано на чертеже, все животные, получавшие ЗФР или контрольный IgG1, имели 102 КОЕ/мл, Enterococcus в их крови после 3 дней и медиана была равна 103 КОЕ/мл. В противоположность этому, все группы, которые получали антиэнтерококковые антитела, содержали животных с 10 КОЕ/млEnterococcus в крови. Кроме того, во всех, кроме одного случая, CR5187, медиана была на один log ниже медианы контролей. Одно антитело, CR6089, имело медиану ниже уровня чувствительности в этом анализе (10 КОЕ/мл), и в 6 из 8 животных не было детектируемых бактерий в крови. CR6016 и CR6241, ко- 14021767 торые использовали в более низкой дозе, все еще имели медианы, близкие к 10 КОЕ/мл крови, свидетельствуя о том, что они имеют высокую активность. Непараметрический дисперсионный анализ (Крускала-Уоллиса) показал, что эти различия были высоко значимыми (р 0,001). Парные сравнения между испытуемым IgG1 и IgG1 отрицательного контроля выполняли с использованием критерия Манна-Уитни с поправкой Бонферрони. Антитела CR5159, CR5187, CR6043, CR6049, CR6089 и CR6241 были, все, значимо отличающимися (р 0,05) от контрольного антитела, в то время как различие медиан антителCR6043 и CR6071 не достигало значимости в сравнении с контрольным антителом. Пример 9. Конкурентный анализ IgG1. Для установления, конкурируют ли антитела в этой панели за связывание с той же самой мишенью,был разработан конкурентный ELISA. Энтерококковый штамм 12030 распределяли на поверхности чашки с кровяным агаром и инкубировали в течение ночи при 37 С. Колонии соскабливали из этой чашки с использованием 5 мл 50 мМ карбонатного буфера (8 об. 0,2 М Na2CO3, 17 об. 0,2 М NaHCO3 и 75 об. дистиллированной воды) и центрифугировали в течение 3 мин при 4000 об/мин. Полученный осадок ресуспендировали в 500 мкл карбонатного буфера, опять центрифугировали и осадок ресуспендировали в 500 мкл карбонатного буфера. Плотность клеток определяли измерением OD600 серии разведений этих бактерий. Этот штамм энтерококка разбавляли до плотности 5109 клеток/мл и 100 мкл (5108 клеток) на лунку наносили в течение ночи при 4 С на планшеты Nunc-Immuno Maxisorp F96. После инкубации эти клетки промывали три раза ЗФР и блокировали в течение 1 ч при комнатной температуре 300 мкл 2%(об./об.) ELK в ЗФР на лунку. В отдельных пробирках 25 мкл каждого из максипрепаратов scFv (полученных, как описано выше), разведенных до субнасыщающих уровней (как определено посредствомELISA выше), смешивали с 25 мкл блокирующего буфера (4% (об./об.) ELK в ЗФР и 50 мкл IgG1 супернатанта, разбавленного до 10 мкг/мл в ЗФР. Эту смесь инкубировали в течение 20 мин на льду. После удаления блокирующего раствора из лунок в каждую лунку добавляли 100 мкл этой смеси и инкубировали в течение 1 ч при комнатной температуре. Затем эти лунки промывали три раза смесью ЗФР/0,01% (об./об.) Твин и один раз ЗФР. После промывания добавляли 100 мкл анти-М 13-HRP (1:5000 в 2% (об./об.) ELK в ЗФР) на лунку и инкубировали при комнатной температуре в течение 60 мин. Лунки опять промывали и окрашивание визуализировали добавлением 100 мкл OPD-раствора в каждую лунку. Реакцию визуализации останавливали после 5-10 мин добавлением 50 мкл 1 М H2SO4 в каждую лунку иOD измеряли при 492 нм. Этот эксперимент повторяли дважды со всей панелью антител и контрольнымIgG1 CR4374. Результаты показали, что эти антитела могут быть разделены на несколько отличающихся групп: группа А состояла из CR6089 и CR6092; группа В состояла из CR5157, CR5187, CR6043, CR6049,CR6388, CR6389, CR6396, CR6402, CR6409, CR6421 и CR6429; группа С состояла из CR5159, CR5166,CR6050, CR6077, CR6078, CR6086 и CR6191, а остальные из антител CR5140, CR5179, CR6016, CR6071,CR6079, CR6087, CR6195, CR6198, CR6241, CR6242, CR6246, CR6252, CR6415 и CR6432 не конкурировали с каким-либо другим антителом за связывание. Пример 10. In vitro опсонизирующая фагоцитарная активность антиэнтерококковых IgG1-молекул против различных штаммов Е. faecalis, Е. faecium и S. aureus, измеренная анализом опсонофагоцитарного убивания. Для определения широты киллерной активности панели моноклональных антиэнтерококковых антител очищенные партии IgG1, приготовленные, как описано выше, анализировали на киллерную активность в анализе опсонофагоцитарного убивания, описанном выше. Испытывали дополнительный штамм Е. faecalis, тип 2; два разных клинических изолята Е. faecium, 740220 и 838970; и клинический изолят S.aureus 502. Восемнадцать антител выбирали из исходной панели 34 антител на основе неконкурентной связывающей способности и активности в анализе опсонофагоцитарного убивания. Как показано в табл. 15, выбранная панель обнаруживала киллерную активность в отношении штаммов Е. faecium при двух концентрациях, 2,5 и 0,025 мкг/мл, хотя активность CR5140, CR6016 и CR6078 была более низкой, чем 20%, против штамма 838970 при наивысшей концентрации. Все, кроме одного антитела, имели измеряемую активность против штамма Е. faecalis, типа 2, хотя 11 из 18 антител имели киллерную активность менее 25% при наивысшей испытанной концентрации. Неожиданно все антитела этой панели имели киллерную активность в отношении штамма S. aureus 502, что указывает на то, что эти антитела узнают перекрестно-реактивные мишени. Авторы испытывали, связывается ли какое-либо из этих антител с липотейхоевой кислотой (LTA) S. aureus, и, по-видимому, ни одно из этих тел не обнаруживает этого. Три из этих антител (CR6252, CR6415 и CR6421) испытывали на опсонизирующую фагоцитарную киллерную активность в отношении другого штамма Staphylococcus aureus (Newman) и против штамма Staphyloccoccus epidermidis (RP62A) и все три испытанных антитела обнаруживали киллерную активность в отношении этих разных видов и штаммов Staphylococcus. Таблица 1 Праймеры вариабельной области человеческой лямбда-цепи (смысловые) Таблица 2 Праймеры вариабельной области человеческой каппа-цепи (смысловые) Таблица 3 Праймеры вариабельной области человеческой каппа-цепи,удлиненные сайтами рестрикции SalI (смысловые), праймеры J-области человеческой каппа-цепи, удлиненные сайтами рестрикции NotI(антисмысловые), праймеры вариабельной области человеческой лямбда-цепи,удлиненные сайтами рестрикции SalI (смысловые), и праймеры J-области человеческой лямбда-цепи, удлиненные сайтами рестрикции NotI (антисмысловые) Таблица 4 Процент разных продуктов легкой цепи в конечной смеси на основе концентраций, определяемых путем анализа в агарозном геле Таблица 5 Праймеры вариабельной области тяжелой цепи человека (смысловые) Таблица 6 Праймеры вариабельной области тяжелой цепи IgG человека, удлиненные сайтами рестрикции SfiI/NcoI (смысловые), и праймеры J-области тяжелой цепи IgG человека, удлиненные сайтами рестрикции XhoI/BstEBII (антисмысловые) Таблица 7 Процент разных продуктов тяжелой цепи в конечной смеси Таблица 8 Энтерококковые штаммы, используемые для отбора и скрининга антиэнтерококковых одноцепочечных (scFv) фаговых антител Таблица 9 Энтерококковая специфическая связывающая активность одноцепочечных (scFv) фаговых антител, измеренная при помощи ELISA Между скобками показаны аминокислоты, составляющие вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL). Между скобками показаны аминокислоты, составляющие вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL).
МПК / Метки
МПК: A61K 39/116, C07K 16/12
Метки: антитела, применение, киллерной, активностью, отношении, человека, энтерококков, стафилококков
Код ссылки
<a href="https://eas.patents.su/30-21767-antitela-cheloveka-s-killernojj-aktivnostyu-v-otnoshenii-enterokokkov-i-stafilokokkov-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела человека с киллерной активностью в отношении энтерококков и стафилококков и их применение</a>
Предыдущий патент: Способ и устройство для нанесения покрытия на стеклянную подложку
Следующий патент: Устройство для изготовления предмета одежды одноразового использования
Случайный патент: δd - кристаллическая форма гидрохлорида ивабрадина, способ её получения и фармацевтические композиции, которые её содержат