Индуцирование клеточной гибели путем ингибирования адаптивной реакции теплового шока
Номер патента: 21331
Опубликовано: 29.05.2015
Авторы: Гудков Андрей В., Гурова Катерина, Незнанов Николай
Формула / Реферат
1. Композиция, содержащая терапевтически эффективное количество ингибитора адаптивной реакции теплового шока для применения в качестве лекарственного средства у млекопитающего, у которого адаптивная реакция теплового шока индуцируется или индуцирована при помощи средства, индуцирующего тепловой шок, где
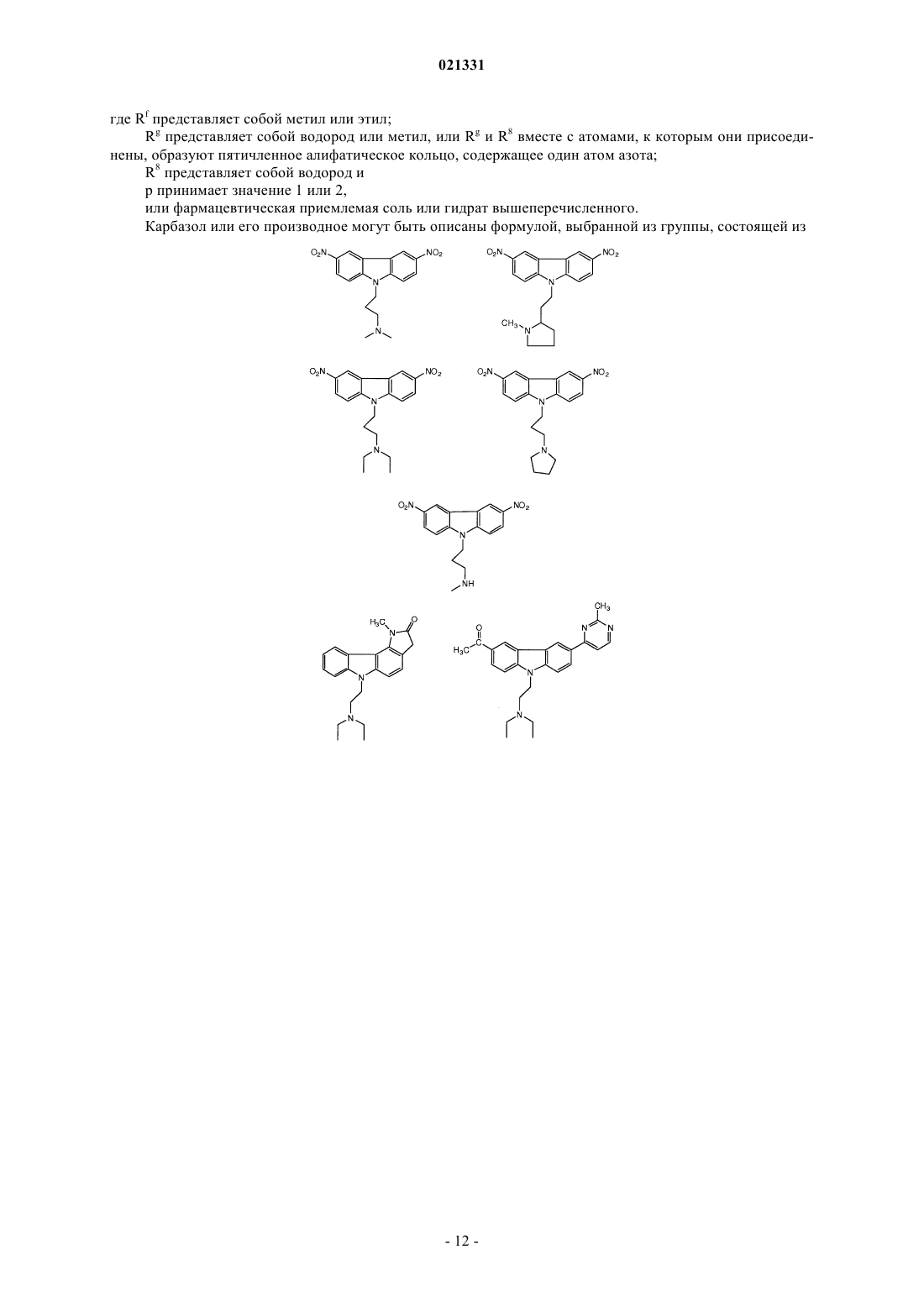
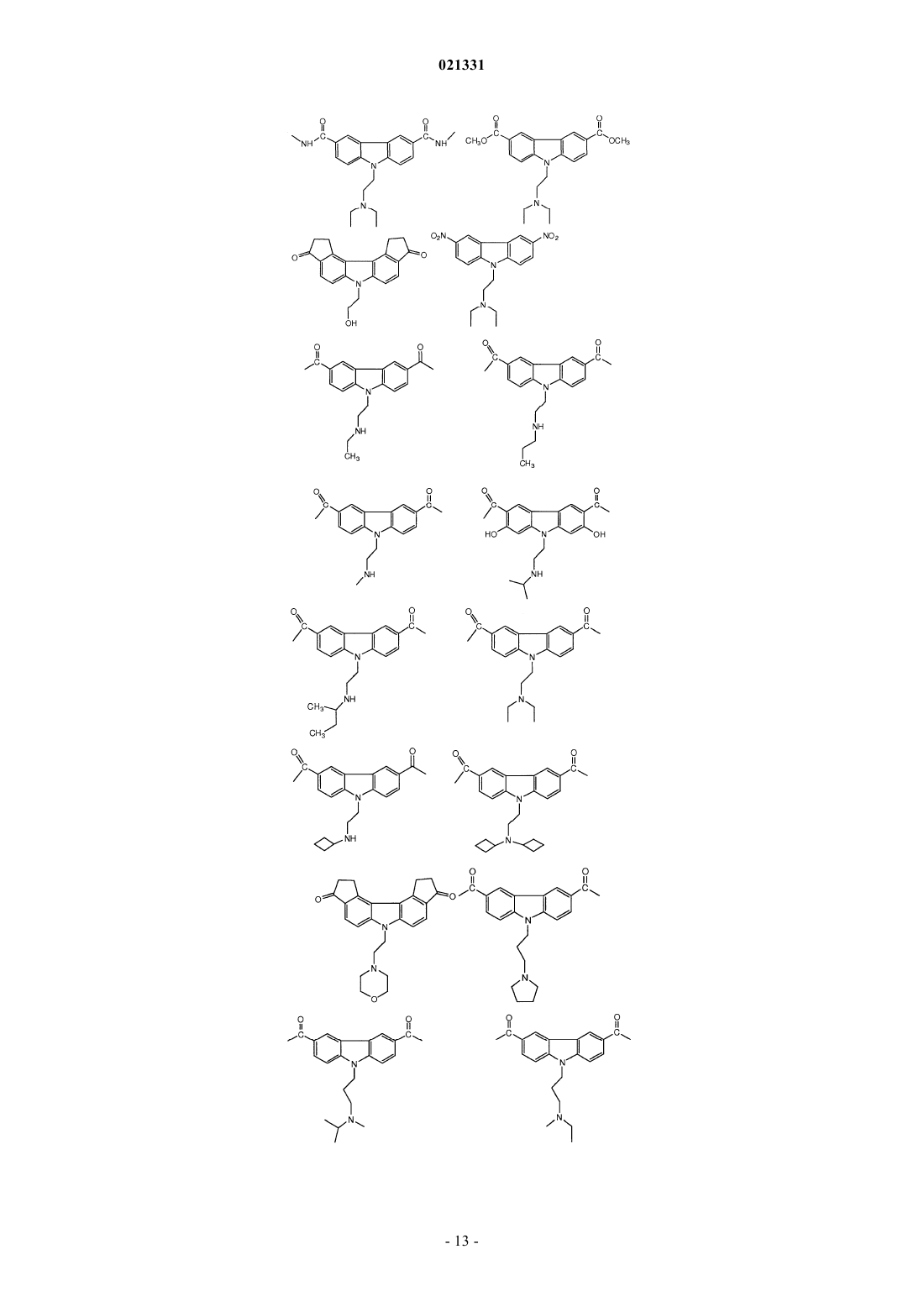
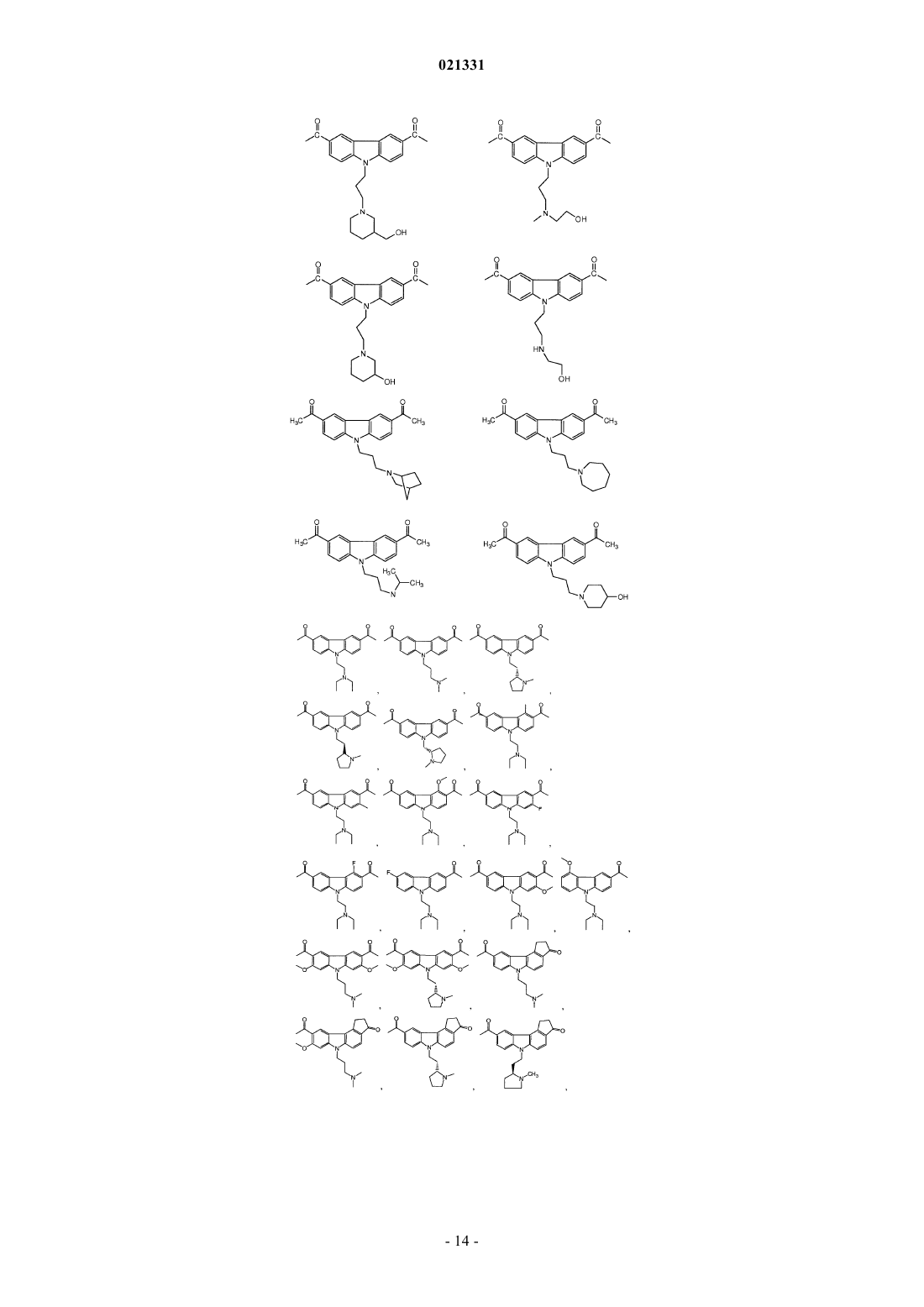
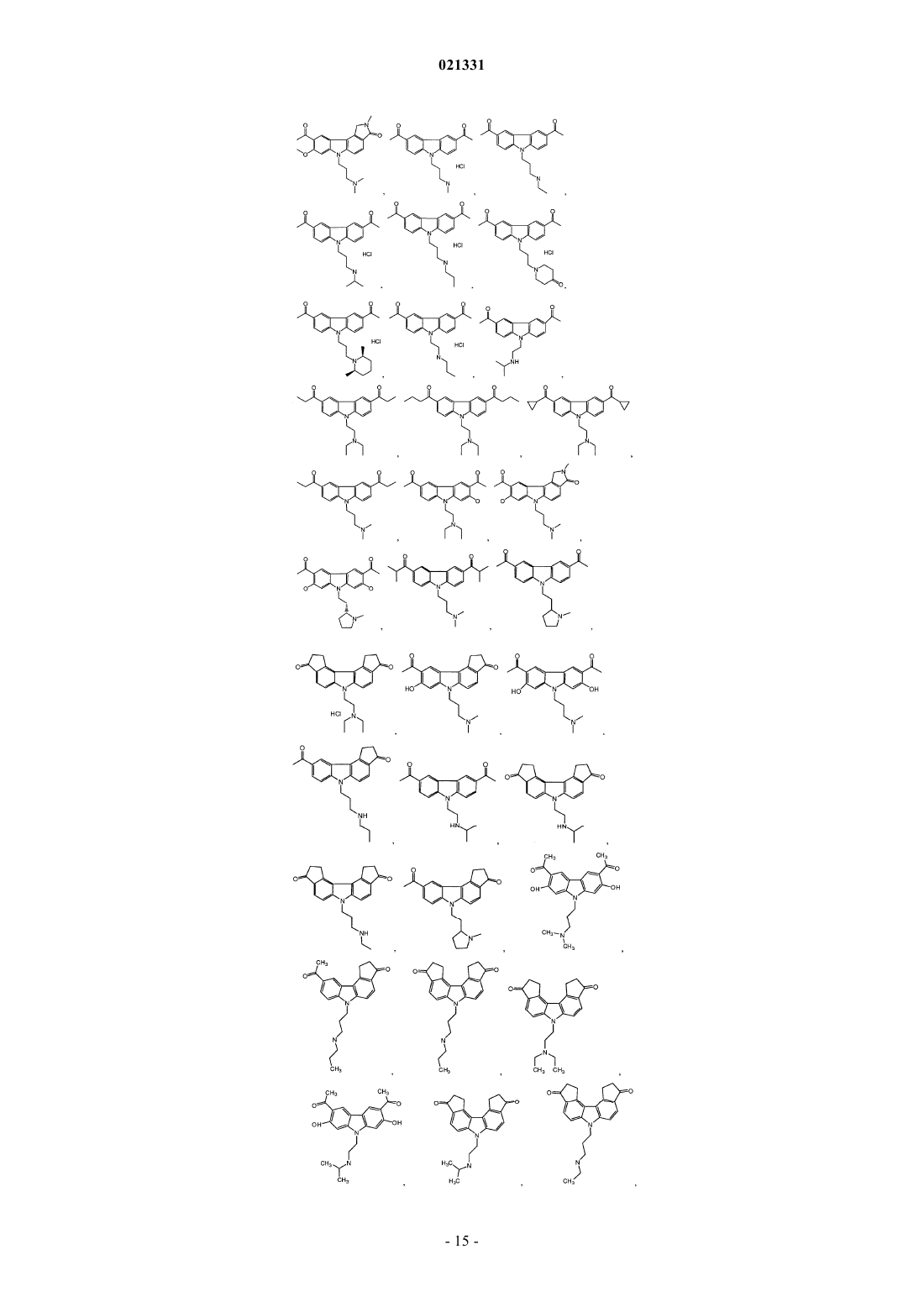
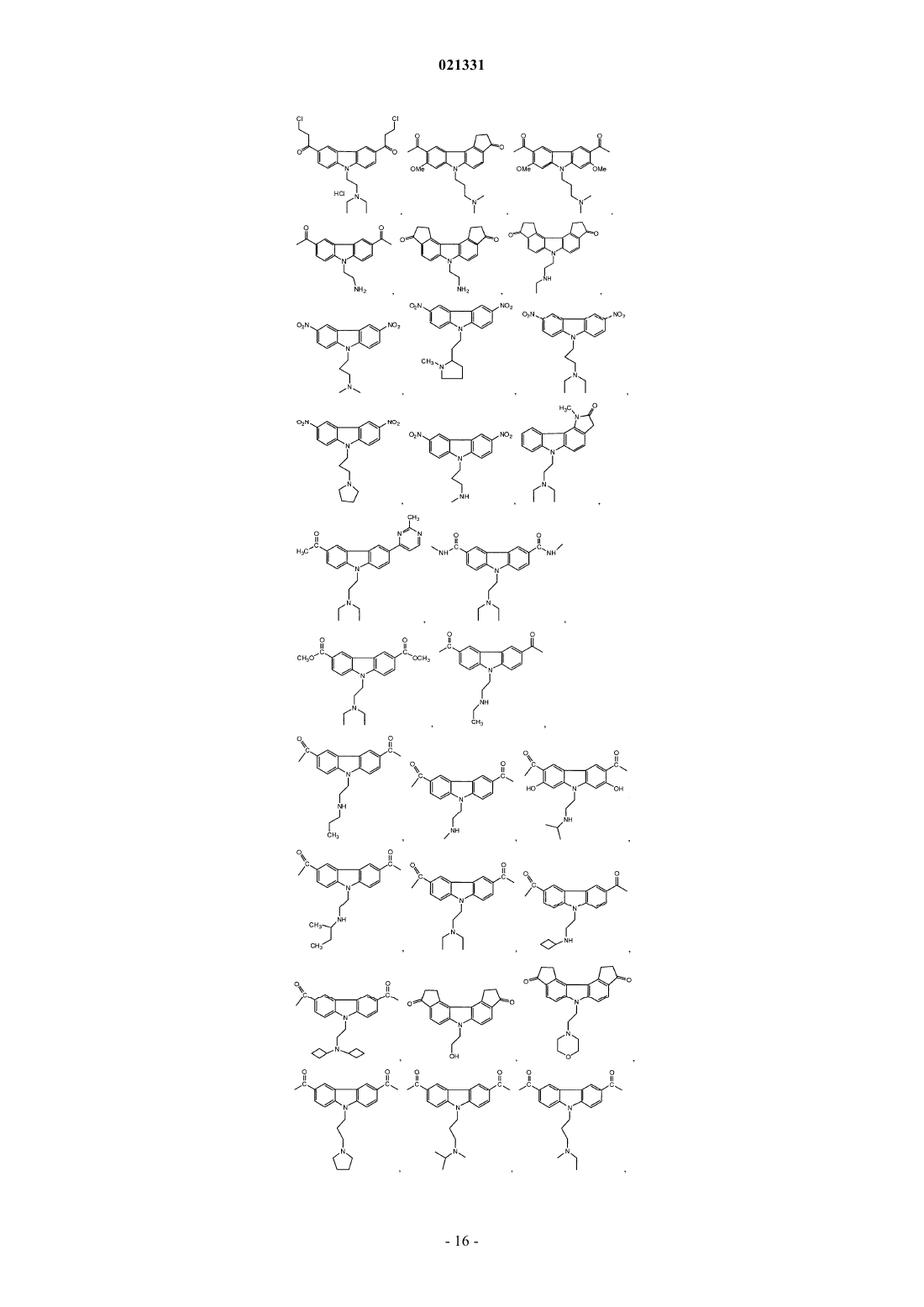
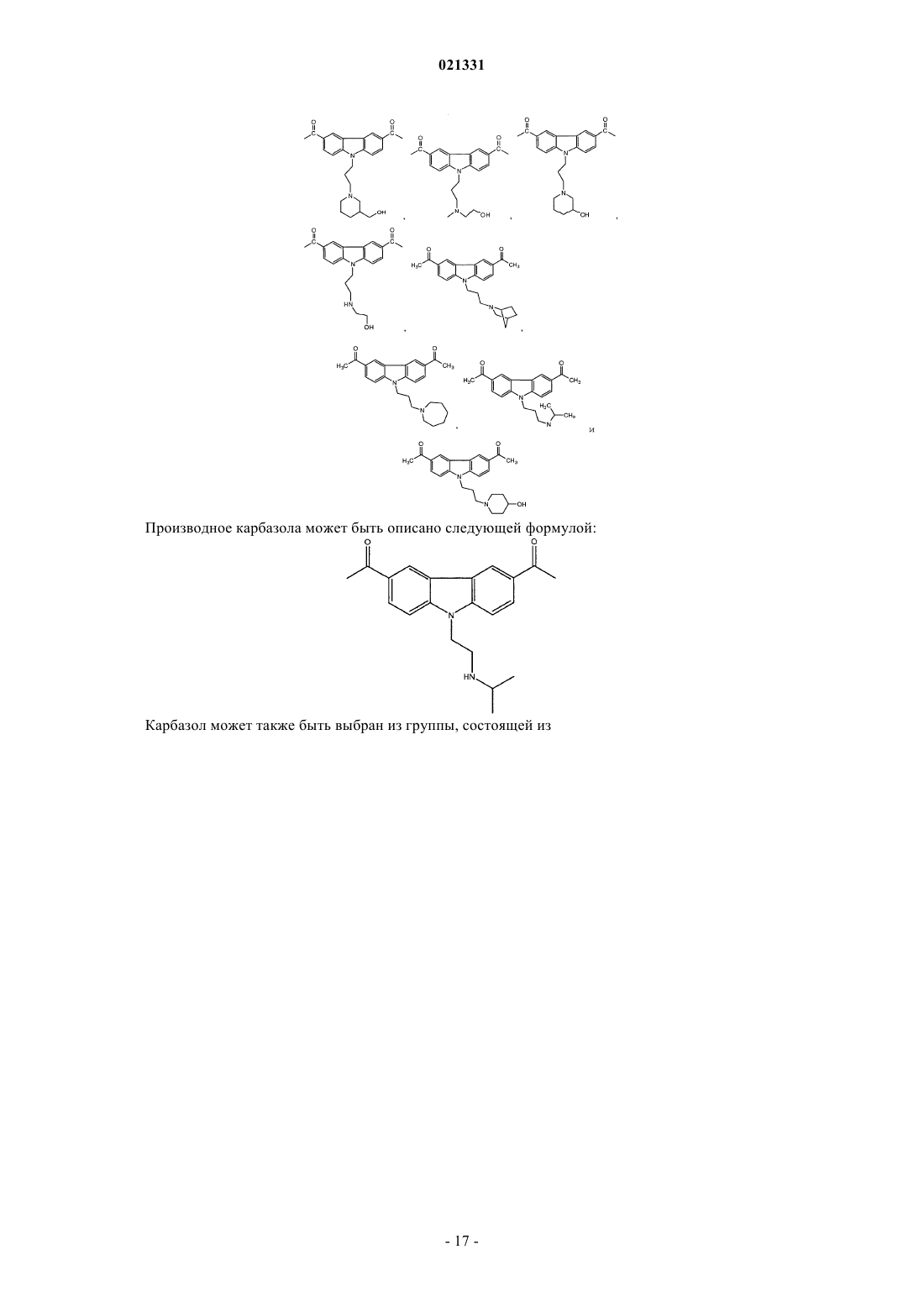
ингибитором адаптивной реакции теплового шока является аминоакридин или карбазол и
ингибитор адаптивной реакции теплового шока вызывает клеточную гибель посредством ингибирования адаптивной реакции теплового шока у млекопитающего, у которого реакция теплового шока индуцирована при помощи средства, индуцирующего тепловой шок.
2. Композиция по п.1, где средством, индуцирующим тепловой шок, является гелданамицин, ингибитор протеасом, соединение арсенита или этанол.
3. Композиция по п.2, где ингибитором протеасом является бортезомиб.
4. Композиция по п.1, где средство, индуцирующее тепловой шок, индуцирует повышение температуры внутри клетки.
5. Композиция по п.4, где средство, индуцирующее тепловой шок, представляет собой средство нагревания.
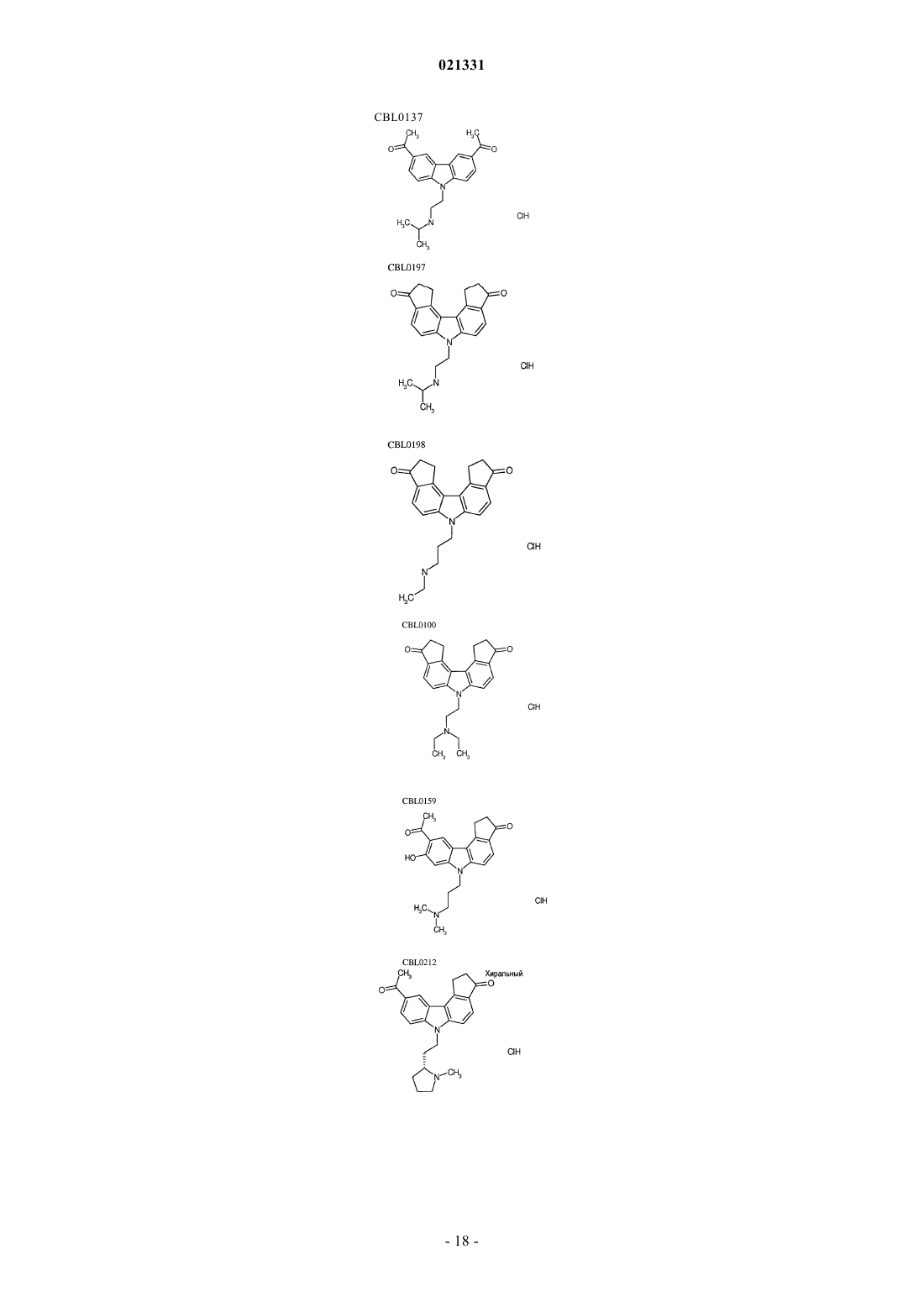
6. Композиция по п.1, где карбазол выбран из группы, состоящей из CBL0137, CBL0197, CBL0198, CBL0100, CBL0159, CBL0212, CBL0174 и CBL0175.
7. Композиция по п.1, где аминоакридин выбран из группы, состоящей из хинакрина и 9-аминоакридина.
8. Композиция по любому из пп.1-7, где клетка является раковой клеткой.
9. Композиция по п.8, где рак выбран из группы, состоящей из метастатического рака молочной железы, рака мочевого пузыря, карциномы легких, рака пищевода, базально-клеточной карциномы, злокачественной меланомы, глазной опухоли и рака головы и шеи.
10. Композиция по п.1, дополнительно включающая терапевтически эффективное количество противоракового средства для введения вместе со средством, индуцирующим тепловой шок.
11. Композиция по п.5, где температуру повышают по меньшей мере до 39-60°С.
12. Композиция по п.5, где средство нагревания представляет собой инфракрасное излучение.
13. Композиция по п.12, где излучение имеет длину волны, равную 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,1, 10,2, 10,3, 10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11, 11,1, 11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9, 12, 12,1, 12,2, 12,3, 12,4, 12,5, 12,6, 12,7, 12,8, 12,9, 13, 13,1, 13,2, 13,3, 13,4, 13,5, 13,6, 13,7, 13,8, 13,9, 14, 14,1, 14,2, 14,3, 14,4, 14,5, 14,6, 14,7, 14,8, 14,9 или 15 мкм.
14. Композиция по п.5, где средство нагревания выбрано из группы, состоящей из электролюминесцентного прибора, лазерного диода, полупроводникового лазера с вертикальным резонатором и поверхностным излучением, светодиода и резистивной лампы накаливания.
15. Композиция по п.1, где терапевтически эффективное количество ингибитора адаптивной реакции теплового шока составляет от 1 нг/кг до 200 мг/кг.
16. Композиция по п.10, где терапевтически эффективное количество противоракового средства составляет от 1 нг/кг до 200 мг/кг.
Текст
ИНДУЦИРОВАНИЕ КЛЕТОЧНОЙ ГИБЕЛИ ПУТЕМ ИНГИБИРОВАНИЯ АДАПТИВНОЙ РЕАКЦИИ ТЕПЛОВОГО ШОКА По данному изобретению представлен способ индуцирования клеточной гибели путем индуцирования реакции теплового шока в клетке в сочетании с ингибированием адаптивной реакции теплового шока. Также представлены методы предотвращения рака, лечения внутриклеточных паразитарных инфекций и связанных с воспалением патологических состояний. Перекрестные ссылки Для данной заявки испрашивается приоритет по предварительным заявкам США 61/054785,поданной 20 мая 2008 г., 61/102913, поданной 6 октября 2008 г., и 61/179674, поданной 19 мая 2009 г.,содержания которых включены в данное описание посредством ссылки. Область изобретения Данное изобретение относится к способу индуцирования клеточной гибели путем стимуляции реакции теплового шока в клетке в сочетании с ингибированием адаптивной реакции теплового шока. Предпосылки создания изобретения Рак является одной из основных проблем общественного здравоохранения. На его долю приходится около одной четверти случаев со смертельным исходом в США, и он является основной причиной смерти среди мужчин и женщин до 85 лет. Вероятность развития рака составляет 46% у мужчин и 38% у женщин. Многие способы лечения по борьбе с раком осложняются появлением побочных эффектов,включая тошноту, рвоту, выпадение волос, повышение температуры тела и риск инфицирования. Химиотерапия и лучевая терапия приводят к выраженным воспалениям слизистой оболочки ротовой полости и желудочно-кишечного тракта у проходящих лечение пациентов, и эти эффекты могут являться дозолимитирующей токсичностью при применении некоторых способов лечения. В опухолевых клетках достигается высокий уровень адаптивной реакции теплового шока. Реакция теплового шока является адаптивным механизмом, используемым всеми живущими клеточными организмами для выживания в условиях так называемого протеотоксического стресса - состояния, приводящего к накоплению неправильно уложенных белков, которые имеют склонность к агрегации, приводя к клеточной гибели из-за глобальной белковой денатурации, инициированной такой агрегацией. Клетки могут активировать этот защитный механизм, индуцируя синтез дополнительных белковых шаперонов,известных как белки теплового шока (HSP). Выживаемость опухолевых клеток может зависеть от реакции теплового шока, поскольку они имеют более высокий уровень неправильно уложенных белков. Однако эффективность способов термотерапии для лечения рака ограничена индукцией адаптивной реакции теплового шока, которая в значительной степени может снижать чувствительность опухолевой клетки к лечению и ограничивать использование термотерапии и других способов лечения, регулирующих процесс теплового шока. Соответственно существует необходимость в усовершенствованных способах индуцирования клеточной гибели. Сущность изобретения В настоящем документе представлен способ индуцирования клеточной гибели, который может включать ингибирование адаптивной реакции теплового шока в клетке и индуцирование реакции теплового шока в данной клетке. Реакция теплового шока может быть индуцирована введением индуктора теплового шока в клетку. Индуктором теплового шока может быть гелданамицин, ингибитор протеасом,соединение арсенита или этанол. Реакция теплового шока может быть также индуцирована повышением температуры внутри клетки, что может быть выполнено средствами нагревания. Температура может быть повышена по меньшей мере до 39-60 С и может быть повышена с помощью инфракрасного излучения. Длина волны излучения может составлять 5-15 мкм. Температура может также быть увеличена с помощью источника нагревания, выбранного из группы, состоящей из электролюминесцентного прибора, лазерного диода, полупроводникового лазера с вертикальным резонатором и поверхностным излучением, светодиода и резистивной лампы накаливания. Ингибитором адаптивной реакции теплового шока может быть аминоакридин, такой как хинакрин или 9-аминоакридин или карбазол. Клетка может представлять собой раковую клетку, и рак может быть выбран из группы, состоящей из метастатического рака молочной железы, рака мочевого пузыря, карциномы легких, рака пищевода,базально-клеточной карциномы, злокачественной меланомы, глазной опухоли и рака головы и шеи. Дополнительная терапия может быть назначена вместе с индуцированием реакции теплового шока в клетке. Дополнительная терапия может включать противораковое средство. Краткое описание чертежей Фиг. 1 демонстрирует, что хинакрин (QC) и 9 АА предотвращают индукцию белка HSP70 в клетках,обработанных ингибиторами протеасом. Фиг. 2 демонстрирует, что QC и 9 АА ингибируют транскрипцию гена HSP70 в ответ на действие ингибиторов протеасом. Фиг. 3 демонстрирует, что DMAG17-индуцированный синтез HSP70 чувствителен к QC и 9 АА. Фиг. 4 демонстрирует, что QC и 9 АА подавляют транскрипцию гена HSP70A1/B', индуцированнуюDMAG17 и MG132. Фиг. 5 демонстрирует токсическое действие DMAG17 в сочетании с QC в клетках HeLa. Фиг. 6 демонстрирует токсический эффект воздействия теплового шока (43 С, 30 мин) в сочетании с QC. Фиг. 7 демонстрирует, что чувствительность к нагреванию у опухолевых клеток, но не у нормальных клеток, повышается при обработке QC и CZ (соединение CBL0137). Фиг. 8 демонстрирует, что миРНК-опосредованный нокдаун компонента ядерного комплексаFACT, SSPT1 и CKII киназы FACT повышает чувствительность клетки к тепловому шоку. Фиг. 9 демонстрирует, что хинакрин и 9 АА предотвращают синтез HSP70 в клетках, обработанных ингибиторами протеасом. На фиг. 9 А приведены результаты иммуноблоттинга с антителом анти-HSP70 для анализа белковых экстрактов из клеток HeLa, обработанных в течение 5 ч ингибитором протеасомMG132 (MG) (5 мкМ) в сочетании с антималярийными лекарственными средствами эметином (ЕМ) (1 мкМ), хлорохином (CQ) (20 мкМ), хинином (Q) (20 мкМ) или хинакрином (QC) (20 мкМ). В дорожке 1 содержится экстракт из необработанных клеток HeLa. Экспрессия пирина была проанализирована для контроля нанесения белка (L.c). На фиг. 9 В представлены белковые экстракты из клеток HeLa, обработанных в течение 5 ч одним только MG132 (5 мкМ) или в сочетании с 20 мкМ QC или 9 АА, при исследовании методом иммуноблоттинга с использованием антитела, специфичного для HSP70. Отрицательные контроли включали необработанные клетки HeLa (дорожка 1) и клетки, обработанные QC или 9 АА в отсутствие MG132 (дорожки 6 и 7). Экспрессия пирина была проанализирована для контроля нанесения белка (L.c). Фиг. 9 С демонстрирует, что эметин, но не QC или 9 АА, ингибирует общий синтез белка.S35-меченые белки из клеток HeLa, необработанных (дорожка 1) или обработанных в течение 4 ч QC (20 мкМ), 9 АА (20 мкМ) или эметином (ЕМ) (1 мкМ), были проанализированы с помощью электрофореза и авторадиографии. Фиг. 9D демонстрирует, что аминоакридины не влияют на ингибирование протеасом под действием MG132, на что указывают результаты анализа активности протеасом in vitro, используя экстракты клеток HeLa, обработанных в течение 4 ч указанными комбинациями MG132 (5 мкМ), QC (20 мкМ) и 9 АА (20 мкМ). Активность протеасом представлена относительно таковой в необработанных клетках (принимается за 100%). Фиг. 9 Е демонстрирует, что QC ингибирует активацию транскрипцииHSP70A1 под действием ингибиторов протеасом в клетках HeLa. 10 мкг суммарной РНК из необработанных клеток HeLa (дорожка 1) или обработанных в течение 5 ч 0,1 мкМ бортезомибом (BZ) или 5 мкМMG132 (MG) в отдельности или в комбинации с 20 мкМ QC были проанализированы Нозерн-блоттингом с использованием зондов к HSP70A1 (верхняя панель) и GAPDH (нижняя панель). GAPDH был использован для контроля специфичности ингибиторной активности QC и нанесения РНК. Фиг. 9F демонстрирует, что аминоакридины не предотвращают индукцию экспрессии гена металлотионеина под действиемZnCl2. Клетки HeLa оставались необработанными (дорожка 1) или были обработаны в течение 5 ч 200 мкМ ZnCl2 (Zn) в отдельности или в комбинации с 20 мкМ QC или 9 АА. 10 мкг суммарной РНК были проанализированы Нозерн-блоттингом с использованием зондов к металлотионеину МТ 1 (МТ),HSP70A1 и GAPDH. Фиг. 10 демонстрирует, что индукция HSR под действием либо MG132, либо 17-DMAG, либо теплового шока чувствительна к аминоакридинам. На фиг. 10 А представлены результаты иммуноблоттинга с антителом анти-HSP70 для анализа белковых экстрактов (10 мкг) из клеток HeLa, обработанных в течение 5 ч 5 мкМ MG132 (MG) или 1 мкМ 17-DMAG (GM) в отдельности или в комбинации с 20 мкМ QC или 9 АА. В дорожке 1 содержится экстракт из необработанных клеток HeLa. Экспрессия K18 была проанализирована для контроля нанесения белка (L.c). Фиг. 10 В демонстрирует, что QC и 9 АА подавляют транскрипцию гена HSP70A1, индуцированную действием 17-DMAG или MG132. Нозерн-гибридизация РНК из необработанных клеток HeLa (дорожка 1, обработанных в течение 5 ч 1 мкМ 17-DMAG (GM) или 5 мкМ MG132 (MG) в отдельности и в комбинации с 20 мкМ QC или 9 АА. мРНК GAPDH была проанализирована с целью контроля специфичности ингибитора и нанесения РНК. Фиг. 10 С демонстрирует,что QC и 9 АА не меняют накопление мРНК генов, которые не подвергаются индукции под действием 17-DMAG, как показано Нозерн-гибридизацией РНК из клеток HeLa, обработанных в течение 5 ч 1 мкМ 17-DMAG (GM) в отдельности или в комбинации с 20 мкМ QC или 9 АА. GAPDH, p65Re1A и GRP94 представляют собой гены, на экспрессию которых не влияет 17-DMAG. HSP70A1 был использован в качестве положительного контроля для 17-DMAG-индуцибельного гена. Фиг. 10D демонстрирует, что QC подавляет HSF1-зависимую экспрессию репортерного гена EGFP, индуцированную протеотоксическим стрессом. Клетки HeLa, несущие репортерный конструкт HSF1-EGFP, оставались необработанными или были обработаны 0,1 мкМ бортезомибом (BZ), 1 мкМ 17-DMAG (GM) или 43 С в течение 1 ч теплового шока (HS) в отдельности или в комбинации с 20 мкМ QC. Экспрессия EGFP была проанализирована в 8 часовой временной точке с помощью флуоресцентной микроскопии. Фиг. 11 демонстрирует, что аминоакридины действуют после активации и транслокации в ядроHSF1. Фиг. 11 А демонстрирует, что обработка клеток HeLa MG132, 17-MAG или тепловым шоком индуцирует ДНК-связывающую активность HSF1. Анализы изменения электрофоретической подвижности(EMSA) были выполнены на цитоплазматических экстрактах из клеток HeLa, необработанных, обработанных 5 мкМ MG132 (MG) или 1 мкМ 17-DMAG (GM) в течение 4 ч или обработанных тепловым шоком (43 С) в течение 1 ч. Образование комплекса между HSF1 и 32 Р-меченым олигонуклеотидным зондом, содержащим сайт связывания HSF1, подавлялось 50-кратным избытком такого же немеченого олигонуклеотида (дорожка 3), но не подобным избытком немеченого олигонуклеотида, содержащего сайт связывания NFkB (дорожка 4). Специфичность выявляемого комплекса была дополнительно подтверждена смещением полосы вверх в присутствии антитела анти-HSF1 (дорожка 7). Фиг. 11 В демонстрирует, что QC не влияет на ДНК-связывающую активность ядерного HSF1, индуцированную протеотоксическим стрессом. EMSA был выполнен как в А с использованием меченого HSF1-специфичного олигонуклеотидного зонда и ядерных экстрактов из клеток HeLa, необработанных (дорожка 1) или обработанныхQC. Фиг. 11 С демонстрирует, что бафиломицин увеличивает ядерную концентрацию QC. Клетки HeLa были обработаны 5 мкМ QC в отдельности или в комбинации с 0,5 мкМ бафиломицином в течение 1 ч. Внутриклеточная локализация QC была проанализирована с помощью УФ-микроскопии с использованием голубого фильтра. Фиг. 11D демонстрирует, что бафиломицин увеличивает HSR-ингибиторную активность QC. Клетки HeLa были необработанными (дорожка 1) или обработанными в течение 5 ч указанными комбинациями 5 мкМ MG132 (MG), 0,5 мкМ бафиломицина (Baf) и различными количествамиQC. Общий белок клеточных экстрактов был проанализирован Вестерн-блоттингом с использованием антитела анти-NSP70. Пирин был проанализирован для контроля нанесения белка (L.c). Фиг. 12 демонстрирует, что QC повышает цитотоксичность индукторов протеотоксического стресса. Фиг. 12 А демонстрирует токсичность комбинаций лекарственных средств, измеренную с помощью анализа выживаемости клеток. Клетки HeLa были обработаны в течение 4 ч указанными комбинациями 17-DMAG (1 мкМ) и QC (10 или 20 мкМ). Выживаемость клеток оценивали спустя 72 ч путем окрашивания метиленовым синим. Данные представлены в виде среднего по трем экспериментам. Фиг. 12 В демонстрирует токсичность обработки бортезомибом/QC, которую оценивали с помощью анализа выживаемости клеток, как на фиг. 12 А. Клетки HeLa были обработаны в течение 4 ч 0,1 мкМ бортезомибом(BZ) в отдельности или в комбинации с 10 мкМ QC. Данные представлены в виде среднего по 2 экспериментам. На фиг. 12 С представлен иммуноблоттинг-анализ апоптоза в клетках HeLa, обработанных комбинациями бортезомиба (BZ) (0,1 мкМ), 17-DMAG (GM) (1 мкМ) и QC (10 мкМ). Указаны полноразмерные белки PARP и K18, а также апоптоз-специфичные протеолитические фрагменты (PARP/апопт иK18/апопт). Фиг. 12D демонстрирует, что миРНК-опосредованный нокдаун HSP70 сенсибилизирует клетки к бортезомибу и 17-DMAG, как показано методом иммуноблоттинга белков из экспрессирующих миРНК HSP70 (миРНК) клеток HeLa, обработанных указанными концентрациями 0,1 мкМ бортезомиба(BZ), 20 мкМ QC и 1 мкМ 17-DMAG (GM). Белковые экстракты были приготовлены из клеток, трансфицированных миРНК HSP70 в течение 24 ч и обработанных бортезомибом и DMAG в течение ночи. Экспрессия HSP70 и апоптоз-специфичное расщепление K18 оценивали с использованием соответствующих антител. Контрольные клетки HeLa не были обработаны лекарственными препаратами (дорожка 1) или были обработаны в течение ночи указанными выше количествами лекарственных препаратов (дорожки 5-9). Фиг. 12 Е демонстрирует, что каспазный ингибитор ZVAD-FMK защищает клетки от апоптоза, индуцированного комбинациями протеотоксического стресса и аминоакридинов, как показано иммуноблоттинг-анализом уровней белка HSP70 и апоптоз-специфичного расщепления K18 в клетках HeLa, обработанных в течение ночи указанными комбинациями 1 мкМ 17-DMAG (GM), 0,1 мкМ бортезомибом(BZ), 20 мкМ QC и 20 мкМ ZVAD-FMK (ZVAD). Обработка клеток антителом анти-Fas (Fas, дорожка 9) и комбинацией антитела анти-Fas и ZVAD-FMK (дорожка 10) представляли собой положительные контроли индукции апоптоза и защитного действия ZVAD-FMK соответственно. Фиг. 13 демонстрирует воздействие 17-DMAG и хинакрина на рост опухолевой клетки in vitro и invivo. Фиг. 13 А демонстрирует, что QC подавляет синтез HSP70 в ответ на протеотоксический стресс в МСА 205 и В-16 клетках. РНК из контрольных клеток и клеток, обработанных в течение 5 ч 1 мкМ 17DMAG (GM) в присутствии и в отсутствие 20 мкМ QC, была проанализирована Нозерн-гибридизацией с использованием зондов к HSP70A1 и GAPDH. На фиг. 13 В представлены результаты анализа выживаемости клеток МСА 205 и В-16, обработанных в течение 4 ч 1 мкМ 17-DMAG (GM) в комбинации с 20 мкМ QC. Клетки были собраны, разведены 1:50 и проанализированы на их жизнеспособность путем окрашивания метиленовым синим спустя 72 ч. Данные представлены как среднее по двум экспериментам. Фиг. 13 С демонстрирует, что внутриопухолевая инъекция QC блокирует 17-DMAC-индуцированную экспрессию HSP70. Мышам C57BL/6, имеющим опухоли МСА 205, однократно была введена инъекцияPBS (контроль), 25 мкг 17-DMAG (GM) или 1,25 QC+25 мкг 17-DMAG. Спустя 5 ч мыши были умерщвлены. РНК, выделенная из опухолей, была проанализирована Нозерн-гибридизацией с использованием зонда, специфичного к HSP70A1. Гибридизация с зондом к GAPDH была использована в качестве контроля нанесения РНК (L.c). Представленные данные получены из одной опухоли для каждого вида лечения. Они представляют собой репрезентативные данные по двум экспериментам. На фиг. 13D и Е отображены результаты инъецирования мышей C57BL/6 клетками МСА 205 (D) или В-16 (Е). Показан средний объем опухоли в каждой группе. Фиг. 14 демонстрирует противоопухолевое комбинированное воздействие неэффективных доз хинакрина и локальной гипертермии в мышиной модели. Фиг. 15 демонстрирует влияние CRBZ на экспрессию гена HSP70 в ответ на PS, как показано методом Нозерн-гибридизации РНК из контрольных клеток HeLa, клеток, обработанных в течение 5 ч MG132 и комбинациями MG132 с 10 мкМ 9 АА или 1 мкМ CRBZ (Crbz) 159, 188 и 198, с использованием зонда к генам HSP70A1/B. GAPDH является контролем нанесения. Фиг. 16 демонстрирует, что CRBZ 198 воздействует на HSF1-специфичную экспрессию GFPрепортера. Клетки HeLa, инфицированные экспрессирующим репортерный ген лентивирусом, были обработаны 0,1 мкМ бортезомибом (Brtz) в отдельности и в комбинации с 1 мкМ CRBZ 188 (неактивным) или CRBZ 198 (активным). Экспрессия GFP была проанализирована микроскопически через 10 ч после обработки. Фиг. 17 демонстрирует влияние теплового шока (HS) и AA/CRBZ на HSF1-специфичную экспрессию GFP. Клетки HeLa, инфицированные экспрессирующим HSF1-специфичный GFP лентивирусом,были обработаны HS при 43 С в течение 30 мин или HS в комбинации с 20 мкМ 9 АА или 1 мкМ CRBZ 198 или CRBZ 159. н/о - необработанные клетки HeLa. Экспрессия GFP показана в 12 ч временной точке восстановления при 37 С. Подробное описание изобретения Авторы изобретения сделали удивительное открытие того, что индуцирование реакции теплового шока в сочетании с ингибированием адаптивной реакции теплового шока может индуцировать гибель клетки. Несмотря на отсутствие связи с теорией, ингибиторы адаптивной реакции теплового шока могут предотвращать способность клетки быть толерантной к индукции реакции теплового шока путем подавления HSF-1, основного медиатора индуцируемой транкрипции, инициируемой тепловым шоком. Белки теплового шока являются шаперонами, которые предотвращают фатальные последствия действия повреждающих стимулов путем диссоциации агрегирующих белков, повторной укладки и ренатурации неправильно уложенных белков. Защитный эффект белков теплового шока может также лежать в их способности подавлять некоторые формы клеточной гибели, включая апоптоз. В отсутствие белков теплового шока клетка оказывается менее способной отвечать на химический, обусловленный воздействием окружающей среды и физиологический стресс. В частности, опухолевые клетки могут быть более чувствительными к ингибированию реакции теплового шока, поскольку они обычно экспрессируют более высокие уровни белков теплового шока и могут зависеть от этих повышенных уровней в качестве механизма подавления воздействия кумулятивных мутаций, что, в противном случае, приведет к экспрессии повреждающих белков. Соответственно, сочетание ингибирования адаптивной реакции теплового шока и индуцирование реакции теплового шока определяет простой и гибкий способ индуцирования клеточной гибели. 1. Определения. Терминология в том смысле, в котором она здесь используется, приведена только с целью описания частных вариантов осуществления изобретения и не является лимитирующей. Используемые в описании изобретения и прилагаемой формуле изобретения слова в единственном числе включают слова, стоящие во множественном числе, за исключением случаев, когда по контексту определено иное. Для перечисления числовых диапазонов в настоящем документе однозначно рассматривается каждое промежуточное число диапазона с той же самой степенью точности. Например, для диапазона 6-9 рассматриваются числа 7 и 8 наряду с 6 и 9, и для диапазона 6,0-7,0 однозначно рассматриваются числа 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 и 7,0.a. Акрил. Термин "акрил" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к группе, представленной в виде СН 2=С(Q)С(О)О-, где Q представляет собой алифатическую или ароматическую группу.b. Ацил. Термин "ациламино" может означать R(=O)N-, где R представляет собой алкил или арил.c. Назначать. Термин "назначать" в том смысле, в котором он здесь используется, когда описывают дозировку соединения, может означать дозу для однократного или многократного приема соединения.d. Алифатический. Термин "алифатический" в том смысле, в котором он здесь используется, может относиться к неразветвленной, разветвленной или циклической углеводородной группе, которая может быть замещенной или незамещенной и которая может быть насыщенной или ненасыщенной, но которая не является ароматической. Термин "алифатический" может дополнительно включать алифатические группы, которые содержат атомы кислорода, азота, серы или фосфора, замещающие один или несколько углеродов углеводородного каркаса.e. Алкокси. Термин "алкокси" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к алкильной, алкенильной или алкинильной группе, связанной посредством одинарной концевой простой эфирной связи. Примеры алкоксигрупп могут включать метокси, этокси, н-пропокси,изопропокси, н-бутокси, 2-бутокси, трет-бутокси, н-пентокси, 2-пентокси, 3-пентокси, изопентокси, неопентокси, н-гексокси, 2-гексокси, 3-гексокси, 3-метилпентокси, фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси и трихлорметокси. Алкокси может также означать -OR, где R представляет собой алкил.f. Алкоксиалкил. Термин "алкоксиалкил" означает алкильную группу, где водород замещен алкоксигруппой.g. Алкенил. Термин "алкенил" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к разветвленной или неразветвленной, ненасыщенной алифатической группе, содер-4 021331 жащей по меньшей мере одну двойную связь углерод-углерод, которая может располагаться в любой стабильной точке вдоль цепи. Репрезентативные примеры алкенильных групп могут включать этенил, Еи Z-пентенил, деценил и т.п.h. Алкил. Термин "алкил" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к сцепленным или разветвленным углеводородным группам, содержащим указанное количество атомов углерода, обычно метил, этил, неразветвленную цепь и разветвленные пропиловые и бутиловые группы. Термин "циклоалкил" означает циклическую углеводородную группу, содержащую указанное количество атомов углерода, например циклопропил, циклобутил, циклогексил и циклопентил.j. Алкинил. Термин "алкинил" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к разветвленной или неразветвленной, ненасыщенной алифатической группе, содержащей по меньшей мере одну тройную связь углерод-углерод, которая может располагаться в любой стабильной точке вдоль цепи. Репрезентативные примеры алкинильных групп могут включать этинил,пропинил, пропаргил, бутинил, гексинил, децинил и т.п.k. Амино. Термин "амино" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к группе, содержащей атом азота основной цепи. Репрезентативные примеры аминогрупп включают, без ограничения, алкиламино, диалкиламино, ариламино, диариламино, алкилариламино, алкилкарбониламино, арилкарбониламино, карбамоил, уреидо и т.п. Амино может также означать-NH2, и термин "алкиламино" может означать -NR2, где по меньшей мере один R представляет собой алкил и второй R представляет собой алкил или водород. 1. Ароматический. Термин "ароматический" в том смысле, в котором он здесь используется, может относиться к ненасыщенной циклической углеводородной группе, имеющей 4 п+2 делокализованные п(пи)-электроны, которая может быть замещенной или незамещенной. Термин "ароматический" может дополнительно включать ароматические группы, которые содержат атом азота, замещающий один или несколько углеродов углеводородного каркаса. Примеры ароматических групп могут включать фенил, нафтил, тиенил, фуранил, пиридинил, (из)оксазоил и т.п.r. Арил. Термин "арил" в том смысле, в котором он здесь используется в отдельности или в комбинации,может относиться к замещенной или незамещенной ароматической группе, которая дополнительно может быть соединена с другой ароматической или неароматической циклической группой. Репрезентативные примеры арильных групп могут включать фенил, бензил, нафтил, бензилидин, ксилил, стирил, фенэтил, фенилен, бензентриил и т.п.s. Арилокси. Термин "арилокси" в том смысле, в котором он здесь используется в отдельности или в комбинации, может относиться к арильной группе, связанной посредством одинарной концевой простой эфирной связи.t. Разветвленный. Термин "разветвленный" в том смысле, в котором он здесь используется, может относиться к группе, содержащей от 1 до 24 атомов основной цепи, где основная цепь группы содержит одну или несколько второстепенных ветвей, исходящих из основной цепи. Группа с разветвленной цепью может содержать от 1 до 12 атомов основной цепи. Примеры групп с разветвленной цепью могут включать изобутил,трет-бутил, изопропил, СН 2 СН 2 СН(СН 3)СН 2 СН 3, СН 2 СН(СН 2 СН 3)СН 2 СН 3, СН 2 СН 2 С(СН 3)2 СН 3,СН 2 СН 2 С(СН 3)3 и т.п.u. Рак. Термин "рак" в том смысле, в котором он здесь используется, может означать любое состояние, характеризуемое устойчивостью к апоптотическим стимулам.v. Лечение рака. Термин "лечение рака" в том смысле, в котором он здесь используется, может означать любой вид лечения рака, известный в данной области техники, включая химиотерапию и лучевую терапию.w. Карбонил. Термин "карбонил" или "карбокси" в том смысле, в котором он здесь используется в отдельности или в комбинации, может относиться к группе, которая содержит двойную связь углерод-кислород. Репрезентативные примеры групп, которые содержат карбонил, включают, без ограничения, альдегиды(т.е. имидо), сложные эфиры, ангидриды и т.п. х. Комбинация. Термин "комбинация с" или "совместно назначенный", когда используется для описания назначения аминоакридина и дополнительного лечения, может означать, что аминоакридин может быть назначен до, вместе с или после дополнительного лечения или комбинацию вышеперечисленного.y. Циано. Термин "циано", "цианат" или "цианид" в том смысле, в котором он здесь используется в отдельности или в комбинации, может относиться к двойной связи углерод-азот. Репрезентативные примеры цианогрупп включают, без ограничения, изоцианат, изотиоцианат и т.п. Термин "циано" означает -CN.z. Циклический. Термин "циклический" или "цикло" в том смысле, в котором он здесь используется в отдельности или в комбинации, может относиться к группе, имеющей одно или несколько замкнутых колец, будь то ненасыщенные или насыщенные, обладающей кольцами из 3-12 атомов основной цепи или 3-7 атомов основной цепи. аа. Эффективное количество. Термин "эффективное количество", когда используется в отношении соединения, продукта или композиции, как предусмотрено в настоящем документе, может означать достаточное количество соединения, продукта или композиции для обеспечения желаемого результата. Точное требуемое количество будет варьировать в зависимости от конкретного используемого соединения, продукта или композиции,способа его назначения и т.п. Таким образом, не всегда представляется возможным указать точное "эффективное количество". Однако подходящее эффективное количество может быть определено специалистом в данной области техники, информированным настоящим описанием изобретения, используя стандартную постановку эксперимента.bb. Галогеналкил. Термин "галогеналкил" означает алкильную группу, замещенную одним или несколькими, например от 1 до 3, галогеновыми заместителями, либо фтором, хлором, бромом, йодом, либо их комбинациями. Подобным образом под "галогенциклоалкилом" понимают циклоалкильную группу, имеющую один или несколько галогеновых заместителей. Термин "арил" в отдельности или в комбинации означает моноциклическую или полициклическую ароматическую группу, предпочтительно моноциклическую или бициклическую ароматическую группу,например фенил или нафтил. Если не указано иное, "арильная" группа может быть незамещенной или замещенной, например, одним или несколькими, в частности от одного до трех, галогенами, алкилами,гидроксиалкилами, алкокси, алкоксиалкилами, галогеналкилами, нитро, амино, алкиламино, ациламино,алкилтио, алкилсульфинилами и алкилсульфонилами. Типичные арильные группы включают фенил,нафтил, тетрагидронафтил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-метилфенил, 4-метоксифенил, 3 трифторметилфенил, 4-нитрофенил и т.п.cc. Галоген. Термин "галоген", "галогенид" или "галогено" в том смысле, в котором он здесь используется в отдельности или в комбинации, может относиться к фтору F, хлору Cl, брому Br, иоду I и астату At. Репрезентативные примеры галогеновых групп могут включать хлорацетамидо, бромацетамидо, иодацетамидо и т.п.dd. Гетеро. Термин "гетеро" в том смысле, в котором он здесь используется в комбинации, может относиться к группе, которая включает один или несколько атомов любого элемента, отличного от углерода или водорода. Репрезентативные примеры гетерогрупп могут включать те группы, которые содержат гетероатомы, включая азот, кислород, серу и фосфор. ее. Гетероарил. Термин "гетероарил" означает моноциклическую или бициклическую кольцевую структуру, содержащую один или два ароматических кольца и содержащую по меньшей мере один атом азота, кислорода или серы в ароматическом кольце, и которая может быть незамещенной или замещенной, например, одним или несколькими, в частности от одного до трех, заместителями, такими как галоген, алкил, гидрокси, гидроксиалкил, алкокси, алкоксиалкил, галогеналкил, нитро, амино, алкиламино, ациламино, алкилтио, алкилсульфинил и алкилсульфонил. Примеры гетероарильных групп включают, без ограничения,тиенил, фурил, пиридил, оксазолил, хинолил, изохинолил, индолил, триазолил, изотиазолил, изоксазолил, бензотиазолил, пиразинил, пиримидинил, тиазонил и тиадиазолил. Термин "алкилен" означает алкильную группу, имеющую заместителя. Например, термин "С 1-3 алкиленарил" относится к алкильной группе, содержащей от одного до трех атомов углерода и замещенной арильной группой.ff. Гетероцикл. Термин "гетероцикл" в том смысле, в котором он здесь используется, может относиться к циклической группе, содержащей гетероатом. Репрезентативные примеры гетероциклов включают, без ограничения, пиридин, пиперадин, пиримидин, пиридазин, пиперазин, пиррол, пирролидинон, пирролидин,морфолин, тиоморфолин, индол, изоиндол, имидазол, триазол, тетразол, фуран, бензофуран, дибензофуран, тиофен, тиазол, бензотиазол, бензоксазол, бензотиофен, хинолин, изохинолин, азапин, нафтопиран,фуранобензопиранон и т.п.gg. Гетероциклоалкил. Термин "гетероциклоалкил" означает моноциклические, бициклические и трициклические циклоалкильные группы, содержащие один или несколько гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы в кольцевой структуре. "Гетероциклоалкильная" группа также может содержать оксогруппу (=O), присоединенную к кольцу. Неограничивающие примеры гетероциклоалкильных групп включают, без ограничения, 1,3-диоксолан, 2-пиразолин, пиразолидин, пирролидин, пиперазин, пирролин, 2 Н-пиран, 4 Н-пиран, морфолин, тиофолин, пиперидин, 1,4-дитиан и 1,4-диоксан.ii. Гидроксиалкил. Термин "гидроксиалкил" означает алкильную группу, где водород замещен гидроксигруппой.jj. Низший. Термин "низший" в том смысле, в котором он здесь используется, относится к группе с атомами основной цепи в количестве от 1 до 6.ll. Необязательный. Термин "необязательный" или "необязательно" в том смысле, в котором он здесь используется, может означать, что последовательно описываемое событие или обстоятельство может происходить или может не происходить, и что описание включает примеры, где указанное событие или обстоятельство происходит, и примеры, где этого не происходит. Например, фраза "необязательно замещенный алкил" может означать, что алкильная группа может быть замещенной или незамещенной и что описание включает как незамещенный алкил, так и алкил, где имеет место замещение."Пептид" или "полипептид" представляет собой последовательность из связанных аминокислот и может быть естественного происхождения, искусственной или модификацией или комбинацией последовательности естественного происхождения и искусственной последовательности.nn. Фосфатсодержащая группа. Термин "фосфатсодержащая группа" в том смысле, в котором он здесь используется, может относиться к группе, содержащей по меньшей мере один атом фосфора в окисленном состоянии. Репрезентативные примеры включают, без ограничения, фосфоновые кислоты, фосфиновые кислоты, фосфатные эфиры, фосфинидены, фосфино, фосфинилы, фосфинилидены, фосфо, фосфоно, фосфоранилы, фосфоранилидены, фосфоросо и т.п. оо. Насыщенный. Термин "насыщенный" в том смысле, в котором он здесь используется, может относиться к группе,где все имеющиеся валентные связи атомов основной цепи соединены с другими атомами. Репрезентативные примеры насыщенных групп могут включать бутил, циклогексил, пиперидин и т.п. рр. Замещенный. Термин "замещенный" в том смысле, в котором он здесь используется, может относиться к группе,имеющей один или несколько водородов или других атомов, отщепленных от углерода или подходящего гетероатома и замещенных дополнительной группой. Замещенные группы могут быть замещены заместителями в количестве от одного до пяти или от одного до трех. Атом с двумя заместителями обозначается "ди", в то время как атом с более чем двумя заместителями обозначается "поли". Репрезентативные примеры таких заместителей могут включать алифатические группы, ароматические группы, алкил, алкенил, алкинил, арил, алкокси, галогено, арилокси, карбонил, акрил, циано, амино,нитро, фосфатсодержащие группы, серосодержащие группы, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, ациламино, амидино, имино, алкилтио, арилтио, тиокарбоксилат, алкилсульфинил, трифторметил, азидо, гетероциклил,алкиларил, гетероарил, семикарбазидо, тиосемикарбазидо, малеимидо, оксимино, имидат, циклоалкил,циклоалкилкарбонил, диалкиламино, арилциклоалкил, арилкарбонил, арилалкилкарбонил, арилциклоалкилкарбонил, арилфосфинил, арилалкилфосфинил, арилциклоалкилфосфинил, арилфосфонил, арилалкилфосфонил, арилциклоалкилфосфонил, арилсульфонил, арилалкилсульфонил, арилциклоалкилсульфонил, их комбинации и к тому же замены.qq. Серосодержащая группа. Термин "серосодержащая группа" в том смысле, в котором он здесь используется, может относиться к группе, содержащей атом серы. Репрезентативные примеры включают, без ограничения, сульфгидрил, сульфено, сульфино, сульфинил, сульфо, сульфонил, тио, тиоксо и т.п.rr. Лечить. Термин "лечить" или "лечение" в том смысле, в котором он здесь используется, когда речь идет о защите млекопитающего от возникновения патологического состояния, может означать предотвращение,подавление, сдерживание или устранение патологического состояния. Предотвращение патологического состояния включает лечение млекопитающего до возникновения патологического состояния. Подавление патологического состояния включает лечение млекопитающего после индуцирования патологического состояния, но до его клинического проявления. Сдерживание патологического состояния включает лечение млекопитающего после клинического проявления патологического состояния таким образом,что происходит ослабление или поддержание патологического состояния. Устранение патологического состояния включает лечение млекопитающего после клинического проявления патологического состояния таким образом, что млекопитающее больше не страдает патологическим состоянием.uu. Опухолевая клетка. Термин "опухолевая клетка" в том смысле, в котором он здесь используется, может означать любую клетку, характеризуемую устойчивостью к апоптотическим стимулам.vv. Неразветвленный. Термин "неразветвленный" в том смысле, в котором он здесь используется, относится к группе, содержащей от 1 до 24 атомов основной цепи, где основная цепь группы простирается в виде прямой линии. Неразветвленная группа может содержать от 1 до 12 атомов основной цепи.ww. Ненасыщенный. Термин "ненасыщенный" в том смысле, в котором он здесь используется, может относиться к группе, где по меньшей мере одна имеющаяся валентная связь двух соседних атомов основной цепи не соединена с другими атомами. Репрезентативные примеры ненасыщенных групп могут включать-СН 2 СН 2 СН=СН 2, фенил, пиррол и т.п. хх. Незамещенный. Термин "незамещенный" в том смысле, в котором он здесь используется, может относиться к группе, которая не имеет никаких дополнительных групп, к ней присоединенных или замещающих ее. 2. Способ индуцирования клеточной гибели. В настоящем документе представлен способ индуцирования клеточной гибели. Гибель клетки может быть индуцирована путем ингибирования адаптивной реакции теплового шока в комбинации с индуцированием реакции теплового шока в клетке. Реакция теплового шока может быть индуцирована введением в клетку индуктора реакции теплового шока или повышением температуры внутри клетки средствами нагрева. а) Ингибирование адаптивной реакции теплового шока. Ингибитором адаптивной реакции теплового шока может быть вещество, способное действовать в качестве ДНК-интеркалирующего, негенотоксичного средства, которое может подавлять HSF-1 опосредованную транскрипцию. Ингибитором адаптивной реакции теплового шока может быть аминоакридин, карбазол или их производные.(1) Аминоакридин. Аминоакридин может быть описан следующей формулой:R2 представляет собой Н или необязательно замещенный алкокси;R3 представляет собой Н или необязательно замещенный алкокси иR4 представляет собой Н или необязательно замещенное алифатическое, ароматическое или гетероциклическое соединение. Аминоакридин может представлять собой 9-аминоакридин или мепакрин, который в других случаях известен как хинакрин. Аминоакридин может также представлять собой соединения, описанные в международной публикации патентаWO 06/12419, содержание которой включено в настоящий документ посредством ссылки.(2) Производное карбазола. Ингибитор адаптивной реакции теплового шока может представлять собой карбазол или его производное. Карбазол и его производное могут представлять собой соединения, описанные в предварительной патентной заявке США 61/102913, поданной 6 октября 2008 г., содержание которой включено в настоящий документ посредством ссылки. Карбазол или его производное могут быть описаны формулой (I) где Ra выбран из группы, состоящей из водорода, С 1-6 алкила, C1-6 галогеналкила, циклоалкила, гетероциклоалкила, арила, гетероарила, ORe, N(Re)2 и SRe, или либо Ra и R1, либо NRe и R1 вместе с атомами углерода, к которым они присоединены, образуют пяти- или шестичленное алифатическое карбоциклическое или гетероциклическое кольцо;Rb выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, циклоалкила, гетероциклоалкила, арила, гетероарила, ORe, N(Re)2 и SRe, или либо Rb и R6, либо NRe и R6 вместе с атомами углерода, к которым они присоединены, образуют пяти- или шестичленное алифатическое карбоциклическое кольцо или пяти- или шестичленное алифатическое карбоциклическое или гетероциклическое кольцо;Rc выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 гидроксиалкила, циклоалкила, гетероциклоалкила, арила, гетероарила и C(=O)Re, или Rc и Rd взяты вместе для образования пяти-, шести- или семичленного алифатического кольца, необязательно содержащего атом кислорода;Rd выбран из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила,гетероарила и C(=O)Re, или Rd и R7 вместе с атомами, к которым они присоединены, образуют пяти- или шестичленное алифатическое кольцо;Re независимо выбран из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила и гетероарила, или две Re группы взяты вместе с азотом, к которому они присоединены, для образования пяти- или шестичленного алифатического кольца;R1, R2, R3, R4, R5 и R6 независимо выбраны из группы, состоящей из водорода, С 1-6 алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, галогена, ORe, C(=O)Re, C(=O)ORe, OC(=O)Re, C(=O)N(Re)2,С(=O)NReSO2Re, N(Re)2, NReC(=O)Re, NReC(=O)N(Re)2, CN, NO2, CF3, OCF3, SRe, SORe, SO2Re, SO2N(Re)2 и OSO2CF3;n принимает значения 0, 1, 2, 3, 4 или 5,или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны общей структурной формулой (Ia) где Ra представляет собой C1-3 алкил, С 1-4 галогеналкил, С 3-5 циклоалкил, N(Re)2 или ORe, или Ra и R1 вместе с атомами углерода, к которым они присоединены, образуют пяти- или шестичленное алифатическое карбоциклическое кольцо;Rb представляет собой С 1-4 алкил, С 1-4 галогеналкил, С 3-6 циклоалкил, N(Re)2 или ORe, или Rb и R6 вместе с атомами углерода, к которым они присоединены, образуют пяти- или шестичленное алифатическое карбоциклическое кольцо или пяти- или шестичленное алифатическое кольцо, содержащее один атом азота;Rd представляет собой водород, С 1-4 алкил или С 3-5 циклоалкил или Rd и R7 вместе с атомами, к которым они присоединены, образуют пяти- или шестичленное алифатическое кольцо, содержащее один атом азота, или Rc и Rd взяты вместе для образования шести- или семичленного алифатического кольца,дополнительно содержащего атом кислорода;Re независимо представляет собой водород или C1-3 алкил;R1 представляет собой водород или C1-3 алкил;R3 и R4 независимо представляют собой водород или C1-3 алкил;R7 представляет собой водород или C1-3 алкил иn принимает значения 0, 1, 2, 3, 4 или 5,или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны общей структурной формулой (Ib) где Ra представляет собой метил, этил, н-пропил, циклопропил, NH(CH3) или ОСН 3, или Ra и R1 вместе с атомами углерода, к которым они присоединены, образуют пятичленное алифатическое карбоциклическое кольцо;Rb представляет собой метил, этил, н-пропил, циклопропил, NH(СН 3) или ОСН 3, или Rb и R6 вместе с атомами углерода, к которым они присоединены, образуют пятичленное алифатическое карбоциклическое кольцо или пятичленное алифатическое кольцо, содержащее один атом азота;Rd представляет собой водород, метил, этил или циклобутил, или Rd и R7 вместе с атомами, к которым они присоединены, образуют пятичленное алифатическое кольцо, содержащее один атом азота, илиRc и Rd, взятые вместе, образуют морфолиновую группу, тетрагидрофуриловую группу, пиперидиниловую группу или группу,группу;R7 представляет собой водород и или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны структурной формулой (II) где Rf выбран из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила,гетероарила и C(=O)Rh, или Rf и Rg взяты вместе для образования пяти-, шести- или семичленного алифатического кольца, необязательно содержащего атом кислорода;Rg выбран из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила,гетероарила и C(=O)Rh,или Rg и Rh вместе с атомами, к которым они присоединены, образуют пяти-, шести- или семичленное алифатическое кольцо;Rh независимо выбран из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила и гетероарила, или две Rh группы взяты вместе с азотом, к которому они присоединены, для образования пяти- или шестичленного алифатического кольца;R9, R10, R11, R12, R13 и R14 независимо выбраны из группы, состоящей из водорода, C1-6 алкила, циклоалкила, гетероциклоалкила, арила, гетероарила, галогена, ORh, C(=O)Rh, C(=O)ORh, OC(=O)Rh,C(=O)N(Rh)2, С (=O)NRhSO2Rh, N(Rh)2, NRhC(=O)Rh, NRhC(=O)N(Rh)2, CN, NO2, CF3, OCF3, SRh, SORh,SO2Rh, SO2N(Rh)2 и OSO2CF3;R отличен от этила,или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны общей структурной формулой (IIa)Rg представляет собой водород или С 1-4 алкил, или Rg и R8 вместе с атомами, к которым они присоединены, образуют пяти- или шестичленное алифатическое кольцо, содержащее один атом азота;R9 представляет собой водород или C1-3 алкил;R11 и R12 независимо представляют собой водород или C1-3 алкил;R8 представляет собой водород или C1-3 алкил и р принимает значение 0, 1, 2, 3, 4 или 5 при условии, что когда р представляет собой 2, один из Rf иR отличен от этила,или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны структурной формулой (IIb)- 11021331 где Rf представляет собой метил или этил;Rg представляет собой водород или метил, или Rg и R8 вместе с атомами, к которым они присоединены, образуют пятичленное алифатическое кольцо, содержащее один атом азота;R8 представляет собой водород и р принимает значение 1 или 2,или фармацевтическая приемлемая соль или гидрат вышеперечисленного. Карбазол или его производное могут быть описаны формулой, выбранной из группы, состоящей из Производное карбазола может быть описано следующей формулой: Карбазол может также быть выбран из группы, состоящей из(3) Ингибитор транскрипции или трансляции. Ингибитор адаптивной реакции теплового шока может также быть ингибитором транскрипции или трансляции. Например, ингибитором может быть актиномицин D или циклогексимид.b. Вещества или условия, индуцирующие реакцию теплового шока.(l) Вещества, индуцирующие реакцию теплового шока. Реакция теплового шока может быть индуцирована в клетке с помощью веществ, индуцирующих реакцию теплового шока. Вещество может представлять собой ингибитор синтеза белка, такой как пуромицин или азетидин. Вещество может также являться ингибитором HSP90, таким как гелданамицин(DMAG17), радицикол или 17-AAG. Вещество также может являться ингибитором протеасом, таким какMG132, бортезомиб или лактацистин. Вещество также может являться ингибитором сериновой протеазы,таким как DCIC, TPCK или TLCK. Вещество также может являться медиатором воспаления, таким как циклопентенон, простагландин, арахидонат или фосфолипаза А 2. Вещество также может являться тритерпеноидом, таким как целастрол. Вещество также может быть коиндуктором, таким как нестеродные противовоспалительные лекарственные средства, как, например, салицилат натрия или индометацин или производное гидроксиламина, как, например, бимокломол или аримокломол. Вещество также может являться флавоноидом, таким как кверцетин, или соединением лактама бензилидена, таким как KNK437. Вещество может также являться соединением арсенита или этанолом.(2) Средства нагревания. Реакция теплового шока может также быть индуцирована в клетке средством нагревания. Средства нагревания могут быть фотоэлектрическими, механическими или химическими. Средства нагревания могут доставлять тепло в клетку неинвазивным способом, например чрескожным способом. Средства нагревания могут также включать провод, канал, приемный датчик, зонд или катетер, как описано в публикации патента США 20070288075. Средства нагревания могут включать оптические волокна, нить накала или имплантированное устройство. Средства нагревания могут быть теми, что описаны в патенте США 5814008, содержание которого включено в настоящий документ посредством ссылки. Средства нагревания могут также включать сенсор для измерения температуры клетки или ткани в участке лечения и могут генерировать сигнал, показывающий температуру. Температура может быть измерена термопарой, резистивным температурным детектором или термистором. Сенсор может представлять собой температурный игольчатый датчик или температурный зонд. Температуру средств нагревания можно контролировать в ответ на сигнал. Температуру можно контролировать, варьируя величиной мощности, подаваемой к источнику нагревания, чтобы поддерживать температуру на заданном уровне или чтобы предотвратить изменения температуры обработанной клетки или ткани выше заданного уровня.(а) Фотоэлектрические. Средства нагревания могут представлять собой источник излучения света, такой как набор из светоизлучающих полупроводниковых приборов. Например, источником света может быть светоизлучающий диод, электролюминесцентный прибор, лазерная установка, лазерный диод, полупроводниковый лазер с вертикальным резонатором и излучением или лампа накаливания. Свет может быть определенной длины волны, которая может быть видимого, ближнего инфракрасного или инфракрасного диапазона. Например, длина волны может составлять от 750 нм до 1 мм. Длина волны может также составлять 750,- 19021331 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970,980, 990 или 1000 нм. Длина волны может также составлять 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5,2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2,5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8,7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,1, 10,2, 10,3,10,4, 10,5, 10,6, 10,7, 10,8, 10,9, 11, 11,1, 11,2, 11,3, 11,4, 11,5, 11,6, 11,7, 11,8, 11,9, 12, 12,1, 12,2, 12,3,12,4, 12,5, 12,6, 12,7, 12,8, 12,9, 13, 13,1, 13,2, 13,3, 13,4, 13,5, 13,6, 13,7, 13,8, 13,9, 14, 14,1, 14,2, 14,3,14,4, 14,5, 14,6, 14,7, 14,8, 14,9 или 15 мкм. Длина волны может также составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50,51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80,81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 мкм. Длина волны может также составлять 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150,160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370,380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590,600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810,820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 мкм. Источник света может быть интенсивным лазерным и может включать в себя использование двухфотонного метода. Лазер может включать в себя высококоллимированный луч. Источник света может также быть низкой мощности, некогерентный источник света. Свет может также излучаться в меньшем количестве частиц на квадратный метр (т.е. при более низкой плотности потока) по сравнению с лазером высокой интенсивности. Например, плотность потока может составлять 30-25000 Дж. Интенсивность света может быть менее чем 500 мВт/см 2. Средства нагревания могут также излучать микроволновую или радиочастотную энергию, как описано в патентах США 6904323 и 5549638, содержание которых включено в настоящий документ посредством ссылки. Средства нагревания могут включать антенну такую как антенная решетка. Средства нагревания также могут включать ультразвуковой трансдуцер.(b) Механические. Средства нагревания могут включать резистивный элемент. Резистивный элемент может представлять собой резистивную лампу накаливания. Средства нагревания могут также включать разогретую жидкость или газ, которые могут содержаться внутри баллона, как описано в публикации патента США 2007/0288075, содержание которой включено в настоящий документ посредством ссылки.(c) Химические. Средства нагревания могут включать химическое вещество, способное повышать температуру внутри клетки. Например, химическое вещество может включать частицу метагидроокиси декстранового железа или комплекс железа. Химическое вещество может представлять собой галлий, индий, технеций,стронций, йод и другие соединения, совместимые с живой тканью. Химическое вещество может повышать температуру внутри клетки путем увеличения скорости метаболизма или окисления химического вещества в клетке как, например, путем повышения уровней оксигенации крови, как описано в патенте США 4569836, содержание которого включено в настоящий документ посредством ссылки.(d) Температура. Температура внутри клетки может быть увеличена по меньшей мере до 39, 40, 41, 42, 43, 44, 45, 46,47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76,77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 С. Температура внутри клетки может быть также повышена в пределах до 1-38 С, 39-45 С, 45-60 С, 60-85 С или 85100 С. Температура может быть достаточной, чтобы повредить или уничтожить обработанную аминоакридином клетку, но слишком низкой, чтобы повредить или уничтожить нормальную клетку, которая может быть необработанной. Температура может также быть достаточной для индуцирования теплового шока. Температура внутри клетки может быть повышена по меньшей мере за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41,42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 мин или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41,42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 или 72 ч. с. Введение. Соединения, химические вещества и средства, описанные в настоящем документе, могут быть введены в клетку путем абсорбции и диффузии в сосудистой системе пациента. Введение пациенту может быть пероральным, парентеральным, трансдермальным или с использованием суппозиторий. Введение в клетку может осуществляться посредством прикрепленной к шприцу иглы или катетера, соединенного с внутривенной системой доставки или местно. 3. Лечение пациента. Представленный здесь способ может быть использован для лечения заболевания или патологического состояния у нуждающегося в лечении пациента. Ингибитор адаптивной реакции теплового шока может быть назначен пациенту, и реакция теплового шока может быть индуцирована у пациента либо локально, либо системно. Например, средство, способное индуцировать реакцию теплового шока, может быть введено в клетку, такую как инфицированная клетка, или в ткань. Средство, индуцирующее реакцию теплового шока, может также быть введено пациенту системно. Температура внутри клетки может быть повышена местным применением средств нагрева в клетке. Температура тела пациента также может быть повышена системно, как, например, при физиологически допустимой гипертермии. а. Рак. Рак или предраковое состояние могут быть подвергнуты лечению, используя способ, рассмотренный в настоящем документе. Рак может представлять собой опухоль, которая может быть подкожной или кожной. Опухоль может иметь малый или большой объем. Опухоль может располагаться в головном мозге, например, как глиальная опухоль, глиобластома, астроцитома, анапластическая астроцитома, астроцитома-олигодендроглиома, аденома гипофиза. Рак может представлять собой пульмональный или плевральный мезотелиальный рак, такой как рак легкого, карцинома легкого, немелкоклеточный рак легкого, рак трахеобронхиального дерева, рак легкого начальной стадии, эндобронхиальная метастатическая опухоль, периферический рак легкого или злокачественная плевральная мезотелиома. Рак может также представлять собой гастроэнтерологический рак, такой как предраковое или раковое поражение, расположенное в пищеводе, желудке, желчном протоке или ободочной и прямой кишке. Рак может представлять собой рак головы и шеи, рак пищевода, рак пищевода начальной стадии, пищевод Баррета, прикорневую холангиокарциному, солидное поражение печени или поджелудочной железы,метастазы в печень при раке ободочной и прямой кишки или рак поджелудочной железы. Рак также может представлять собой урологическое заболевание, такое как рецидивирующая аденопапиллярная опухоль, рак мочевого пузыря, поверхностный рак мочевого пузыря, рак простаты или доброкачественная гиперплазия предстательной железы. Рак также может представлять собой гинекологический рак, такой как карцинома или дисплазия шейки матки, рак шейки матки или внутриэпителиальная неоплазия шейки матки. Рак может представлять собой рак кожи, который может являться плоскоклеточной карциномой(SCC), базальноклеточной карциномой (ВСС), злокачественной меланомой, ВИЧ-ассоциированной саркомой Капоши, средиземноморской саркомой Капоши, базалоидной фолликулярной гамартомой, болезнью Боуэна, кожной Т-клеточной лимфомой или гиперплазией сальной железы. Рак может также представлять собой предраковое или злокачественное поражение кожи. Рак может также представлять собой рак молочной железы, такой как метастатический рак молочной железы, рак толстой кишки, рак эндометрия, глазную опухоль или рак головы и шеи, как, например, рак в ротовой полости, глотке, карцинома губы, рак в носовой полости или гортани.(1) Комбинированное лечение. Способ лечения рака или предракового состояния, соединение или композиция, рассмотренные в настоящем документе, могут быть скомбинированы или совместно назначены с противораковым лечением. Противораковое лечение может представлять собой применение противораковых средств, лучевую терапию, хирургическую операцию или PDT.(а) Противораковое лечение. Противораковое лечение может представлять собой лучевую терапию, такую как рентгенотерапия,радиочастотная или микроволновая, ультразвуковая, радиоизотопная терапия, ионизирующая радиация,внешняя дистанционная лучевая терапия или телетерапия, брахитерапия или радиотерапия с введением герметичного источника излучения внутрь пораженного органа или радиотерапия с использованием негерметичного источника излучения. Противораковое лечение может также представлять собой хирургическую операцию, такую как операция по уменьшению объема опухоли, криотерапия или экстирпация.PDT может включать облучение видимым светом обработанной аминоакридином клетки, которая также может быть обработана фотосенсибилизирующим средством. Свет может быть определенной длины волны и может активировать фотосенсибилизирующее средство. Активированное фотосенсибилизирующее средство может образовывать синглетный кислород или радикал, который может повреждать или убивать клетку. PDT может являться таковой, как описано в патентах США 6899723 и 6693093,содержание которых включено в настоящий документ посредством ссылки.b. Терапия незлокачественного показания для лечения. Незлокачественное показание для лечения нуждающегося в нем пациента может быть подвергнуто терапевтическому воздействию с помощью способа. Показанием может быть патологическое состояние кожи, такое как псориаз, обыкновенные бородавки или выпадение волос. Патологическое состояние может также представлять собой патологическое состояние глаз, такое как возрастная дегенерация желтого пятна, субфовеальная хориоидальная васкуляризация, патологическая миопия, синдром гистоплазмоза глаз или хориоидальное неоваскулярное заболевание. Показанием может быть также сердечно- 21021331 сосудистое заболевание, такое как атеросклеротическая бляшка, интимальная гиперплазия, атеросклероз или нестабильная атероматозная бляшка или рестеноз.c. Лечение инфекции. Инфекция у нуждающегося в лечении пациента может быть подвергнута терапевтическому воздействию с помощью способа. Инфекция может быть вирусной инфекцией, такой как вирус герпеса, гриппа,вирус иммунодефицита человека или гепатита А, В или С. Инфекция также может быть бактериальной инфекцией, такой как хламидиоз, туберкулез или микоплазмоз. Инфекция может также быть эукариотическим паразитом, таким как грибок, лямблия, токсоплазма или трипаносома. Грибок может быть дрожжевым. Трипаносома может вызвать малярию и может представлять собой плазмодий или может представлять собой лейшманию.d. Лечение связанного с воспалением заболевания. Связанное с воспалением заболевание или патологическое состояние может также подвергаться терапевтическому воздействию с помощью способа. Воспаление может быть хроническим, аутоиммунным заболеванием, аллергией, астмой, септическим шоком, реакцией "трансплантант против хозяина", послеоперационной раной, ожогом или ишемическим патологическим состоянием. 4. Способ скрининга. В настоящем документе также представлен способ скрининга соединения, способного регулировать адаптивную реакцию теплового шока в клетке, когда соединение комбинируют с индуцированием реакции теплового шока. Способ может включать индуцирование реакции теплового шока в популяции клеток и взаимодействие популяции с анализируемым соединением. Число клеток, гибнущих в популяции при сравнении с контролем, может быть индикаторным для соединения, которое регулирует адаптивную реакцию теплового шока. Клетки в популяции могут также включать репортер, индуцируемый реакцией теплового шока. Способ может дополнительно включать измерение уровня репортера. Уровень репортера при сравнении с контролем может быть индикаторным для соединения, которое регулирует адаптивную реакцию теплового шока. Репортер может включать транскрипт гена HSP70, такой как HSP70A1 или HSP70B'. Репортер может также включать белок HSP70. Репортер может также состоять из вектора, включающего индуцируемый реакцией теплового шока промотор, функционально связанный с репортерным геном. Репортерный ген может кодировать детектируемый маркер, который может представлять собой люциферазу, зеленый флуоресцентный белок, желтый флуоресцентный белок, красный флуоресцентный белок или хлорамфениколацетилтрансферазу. 5. Композиция. Настоящее изобретение относится к композиции, которая может включать ингибитор адаптивной реакции теплового шока. Композиция может также включать индуктор реакции теплового шока. Композиция может также включать терапевтическое средство, которое может представлять собой противораковое вещество или фотосенсибилизирующее вещество. Композиция может быть использована в терапии путем индуцирования реакции теплового шока в обработанной композицией клетке, которая может повреждать или убивать клетку. а. Противораковое средство. Противораковое средство может представлять собой любое фармакологическое средство или соединение, которое индуцирует апоптоз. Фармакологическое средство или соединение может представлять собой, например, небольшую органическую молекулу, пептид, полипептид, нуклеиновую кислоту или антитело. Противораковое средство может представлять собой цитотоксическое средство, или цитостатическое средство, или их комбинацию. Цитотоксические средства предотвращают размножение раковых клеток, (1) препятствуя способности клетки реплицировать ДНК и (2) индуцируя клеточную гибель и/или апоптоз в раковых клетках. Цитостатические вещества действуют путем регуляции, противодействия или ингибирования процесса передачи клеточного сигнала, который регулирует пролиферацию клетки, и в ряде случаев при низких постоянных уровнях. Цитотоксические средства могут представлять собой алкилирующий агент (включая азотистый иприт, производные этиленимина, алкилсульфонаты, нитрозомочевину или триазен); урамустин, хлорметин, циклофосфамид (Цитоксан), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин или темозоломид; антиметаболит (включая антагонист фолиевой кислоты, аналог пиримидина, аналог пурина и ингибитор аденозиндезаминазы); метотрексат, 5-фторурацил, флоксуридин, цитарабин, 6-меркаптопурин,6-тиогуанин, флударабина фосфат, пентостатин и гемцитабин; природный продукт или его производные(например, алкалоид барвинка, противоопухолевый антибиотик, фермент, лимфокин или эпипофиллотоксин) винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин,эпирубицин, идарубицин, ара-ц, паклитаксел (Таксол), митрамицин, дезоксикоформицин, митомицинц, 1-аспарагиназа, интерферон (предпочтительно IFN-), этопозид или тенипозид. Цитотоксическое средство может также представлять собой навелбин, СРТ-11, анастразол, летра- 22021331 зол, капецитабин, релоксафин, циклофосфамид, ифосамид или дролоксифен. Цитотоксическое вещество может также представлять собой воздействующее на микротрубочки вещество, которое может противодействовать клеточному митозу. Воздействующее на микротрубочки вещество может представлять собой аллоколхицин (NSC 406042), галихондрин В (NSC 609395), колхицин (NSC 757), производное колхицина (например, NSC 33410), доластатин 10 (NSC 376128), майтанзин(NSC 153858), ризоксин (NSC 332598), паклитаксел (Taxol, NSC 125973), производное Taxol (например, NSC 608832), тиоколхицин (NSC 361792), тритилцистеин (NSC 83265), винбластина сульфат (NSC 49842), винкристина сульфат (NSC 67574) , природный или искусственный эпотилон, такой как эпотилон А, эпотилон В или дискодермолид (см. Service, (1996) Science, 274:2009), эстрамустин, нокодазол, МАР 4 и т.п. Воздействующее на микротрубочки вещество может также представлять собой таковое, как описано в Bulinski (1997) J. Cell. Sci. 110:3055-3064; Panda (1997) Proc. Natl. Acad. Sci. USA 94:10560-10564;Cell. 8:973-985 и Panda (1996) J. Biol. Chem. 271:29807-29812. Цитотоксическое вещество может представлять собой эпидофиллотоксин; антинеопластический фермент; ингибитор топоизомеразы; прокарбазин; митоксантрон; координационный комплекс платины,такой как цисплатин или карбоплатин; модификатор биологического отклика; ингибитор роста; противогормональное терапевтическое средство; лейковорин; тегафур или гемопоэтический ростовой фактор. Цитостатическое вещество может представлять собой гормон или стероид (включая синтетический аналог): 17 этинилэстрадиол, диэтилстилбестрол, тестостерон, преднизон, флуоксиместерон, дромостанолон пропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон,триамцинолон, хлоротрианизен, гидроксипрогестерон, аминоглутетимид, эстрамустин, медроксипрогестеронацетат, лейпролид, флутамид, торемифен или золадекс. Цитостатическое вещество также может быть антиангиогенным, таким как ингибитор матриксной металлопротеиназы, или ингибитором VEGF, таким как антитело анти-VEGF, или небольшой молекулой, такой как ZD6474 и SU6668. Цитостатическое вещество может также представлять собой антитело анти-Her-2 от Genentech, ингибитор EGFR, такой как EKB-569 (необратимо действующий ингибитор),или Imclone антитело С 225, которое может быть иммуноспецифичным для EGFR, или ингибитор src. Цитостатическое вещество может также представлять собой Казодекс (бикалутамид, AstraZeneca), который может превращать андрогензависимую карциному в непролиферативную; антиэстроген Тамоксифен, который может ингибировать пролиферацию или рост эстрогензависимого рака молочной железы; или ингибитор передачи клеточного пролиферативного сигнала, такой как ингибитор эпидермального ростового фактора, ингибитор Her-2, ингибитор киназы MEK-1, ингибитор киназы MAPK, ингибитор PI3-киназы, ингибитор киназы Src или ингибитор PDGF. Противораковым может также являться соединение, перечисленное в табл. 1 предварительной патентной заявки США 61/102913, поданной 6 октября 2008 г., содержание которой включено в настоящий документ посредством ссылки.b. Фотосенсибилизирующее вещество. Фотосенсибилизирующее вещество может представлять собой соединение, которое абсорбируется клеткой и которое под действием света активируется и вызывает образование субстанции, которое повреждает или убивает клетку. Субстанция может представлять собой синглетный кислород или радикал. Фотосенсибилизирующее вещество может поглощать свет, чья длина волны составляет от 500 нм до 1,1 мкм. Фотосенсибилизирующее вещество может быть таковым, что рассмотрено в патенте США 6693093 или 7018395, содержание которых включено в настоящий документ посредством ссылки. Например, фотосенсибилизирующее вещество может представлять собой зеленый порфирин; полипиррольное макроциклическое фоточувствительное соединение, которое является гидрофобным; ангелицин; липофусцин; реакционный центр фотосистемы II; реакционный центр фотосистемы II D1-D2-cyt b559; халкогенопирилиевый краситель; хлорин; хлорофилл; кумарин; цианин; относящееся к ДНК соединение, такое как аденозин, цитозин, 2'-дезоксигуанозин-5'-монофосфат, дезоксирибонуклеиновая кислота, гуанин, 4-тиоуридин; 2'-тимидин, 5'-монофосфат, тимидилил(3'-5')-2'-дезоксиаденозин, тимидилил(3'5')-2'-дезоксигуанозин, тимин или урацил; лекарственное средство, такое как адриамицин; афлоквалон,амодиаквин дигидрохлорид, хлороквин дифосфат, хлорпромазин гидрохлорид, дауномицин, дауномицинон, 5-иминодауномицин, доксициклин, фуросемид, гилвокарцин М, гилвокарцин V, гидроксихлороквин сульфат, люмидоксициклин, мефлоквин гидрохлорид, меквитазин, мербромин (меркурохром), примаквин дифосфат, квинин сульфат или тетрациклина гидрохлорид; флавин или имеющее к нему отношение соединение, такое как аллоксазин, флавин мононуклеотид, 3-гидроксифлавон, лимихром, лимифлавин, 6 метилаллоксазин, 7-метилаллоксазин, 8-метилаллоксазин, 9-метилаллоксазин, 1-метиллимихром, метил 2-метоксибензоат, 5-нитросалициловая кислота, профлавин или рибофлавин; фуллерен; металлопорфирин; металлофталоцианины; производное метиленового синего; нафталимид; нафталоцианин; природное соединение, такое как бис(4-гидрокси-3-метоксифенил)-1,6-гептадиен-3,5-дион, 4-(4-гидрокси-3 метоксифенил)-3-бутен-2-он,N-формилкинуренин,кинуреновая кислота,кинуренин,3 гидроксигинуренин, DL-3-гидроксикинуренин, сангвинарин, берберин, кармин или 5;7;9(11);22 эргостатетраен-3-ол; производное нильского синего; NSAID (нестероидное противовоспалительное ле- 23021331 карственное средство); периленхинон; фенол; феофорбид; феофитин; димер или конъюгат фотосенсибилизатора; фталоцианин; порфицен; порфирин; псорален; пурпурин; хинон; ретиноид; родамин; тиофен; вердин; витамин или ксантеновый краситель (Redmond and Gamlin, Photochem. Photobiol., 70 (4):391-475(1999. с. Лекарственный состав. Композиция может дополнительно включать один или несколько фармацевтически приемлемых дополнительных ингредиентов, таких как алюминий, стабилизаторы, антимикробные средства, буферы,красители, ароматизаторы, адъюванты и т.п. Композиция может быть в форме таблеток или пастилок, составленных стандартным способом. Например, таблетки и капсулы для перорального применения могут содержать стандартные эксципиенты,включая, без ограничения, связующие вещества, наполнители, смазки, разрыхлители и увлажнители. Связующие вещества включают, без ограничения, сироп, камедь, желатин, сорбитол, трагакант, слизь крахмала и поливинилпирролидон. Наполнители включают, без ограничения, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция и сорбитол. Смазки включают, без ограничения, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль и двуокись кремния. Разрыхлители включают, без ограничения, картофельный крахмал и натриевую соль гликолята крахмала. Увлажнители включают, без ограничения, лаурилсульфат натрия. Таблетки могут иметь покрытие в соответствии со способами, хорошо известными в данной области техники. Композиция может также быть жидким лекарственным составом, включая, без ограничения, водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры. Композиция может также быть составлена в виде сухого продукта для разбавления водой или другим подходящим разбавителем перед использованием. Такие жидкие препараты могут содержать добавки, включая, без ограничения, суспендирующие вещества, эмульгирующие вещества, неводные разбавители и консерванты. Суспендирующие вещества включают, без ограничения, сорбитовый сироп, метилцеллюлозу, глюкозо/сахарный сироп,желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия и гидрированные пищевые жиры. Эмульгирующие вещества включают, без ограничения, лецитин, сорбитан моноолеат и камедь. Неводные разбавители включают, без ограничения, пищевые масла, миндальное масло, фракционированное кокосовое масло, эфиры жирных кислот, пропиленгликоль и этиловый спирт. Консерванты включают, без ограничения, метил- или пропил-п-гидроксибензоат и сорбиновую кислоту. Композиция может также быть составлена в виде суппозиторий, которые могут содержать основу суппозиторий, включая, без ограничения, масло какао или глицериды. Композиция также может быть составлена для ингаляции, которая может быть в виде, включая, без ограничения, раствора, суспензии или эмульсии, которые могут быть назначены в виде сухого порошка, или в виде аэрозоли, используя газ-вытеснитель, такой как дихлордифторметан или трихлорфторметан. Композиция может также быть составлена в виде лекарственного состава для трансдермального введения, включающей водные или неводные разбавители, включая, без ограничения, кремы, мази, лосьоны, пасты, медикаментозный пластырь, повязку или мембрану. Композиция может также быть составлена для парентерального применения, включая, без ограничения, инъекцию или непрерывную инфузию. Лекарственные составы для инъекции могут быть в виде суспензий, растворов или эмульсий в масляном или водном разбавителе и могут содержать формообразующие вещества, включая, без ограничения, суспендирующие, стабилизирующие и диспергирующие вещества. Композиция также может быть представлена в порошковой форме для растворения в подходящем разбавителе, включая, без ограничения, стерильную апирогенную воду. Композиция может также быть составлена в виде депонированного препарата, который может быть введен путем имплантации или внутримышечной инъекции. Композиция может быть составлена с использованием подходящих полимерных или гидрофобных материалов (как, например, эмульсия в приемлемом масле), ионообменных смол или в виде трудно растворимых производных (как, например,трудно растворимая соль). Композиция также может быть составлена в виде липосомного препарата. Липосомный препарат может включать липосомы, которые проникают внутрь клетки-мишени или рогового слоя и соединяются с клеточной мембраной, что обеспечивает доставку содержимого липосом в клетку. Например, липосомы могут быть использованы таким образом, как описано в патенте США 5077211, патенте США 4621023 или патенте США 4508703, которые включены в настоящий документ посредством ссылки. Композиция, нацеленная воздействовать на патологические состояния кожи, может быть применена до,во время или после обработки кожи млекопитающего УФ-излучением или средствами, вызывающими окислительное повреждение. В других подходящих лекарственных составах могут использоваться ниосомы. Ниосомы представляют собой липидные везикулы, подобные липосомам, с мембранами, состоящими в основном из неионных липидов, некоторые формы которых эффективны для транспортировки соединений через роговой слой.d. Дозирование. Терапевтически эффективное количество вещества, необходимое для использования в терапии, варьирует в зависимости от природы патологического состояния, подлежащего лечению, продолжительно- 24021331 сти времени требуемой активности и возраста и состояния пациента и, в конечном счете, определяется лечащим врачом. Необходимая доза может быть удобно введена в виде однократной дозы или многократных доз, применяемых с подходящими интервалами, например, как одна, две, три, четыре или более субдоз в день. Зачастую желательны или необходимы дозы для многократного применения. В условиях комбинирования с другими терапевтическими средствами композицию могут вводить в относительно более низких дозах. При этом использование веществ направленного действия может обеспечить относительное снижение необходимой дозы. Определенные композиции могут быть введены в относительно высоких дозах благодаря факторам, включая, без ограничения, низкую токсичность, высокий клиренс, низкую скорость расщепления третичного амина. В результате дозирование композиции может составлять от приблизительно 1 нг/кг до приблизительно 200 мг/кг, от приблизительно 1 мкг/кг до приблизительно 100 мг/кг или от приблизительно 1 до приблизительно 50 мг/кг. Дозирование композиции может быть в любой дозировке, включая, без ограничения, приблизительно 1 мкг/кг - 1 мг/кг или 1100 мг/кг. Настоящее изобретение имеет множество аспектов, проиллюстрированных следующими неограничивающими примерами. Пример 1. Ингибирование адаптивной реакции теплового шока в комбинации с индуцированием реакции теплового шока может индуцировать гибель клетки. Этот пример демонстрирует, что эффективности терапии, ориентированной на тепловой шок, могут в значительной степени содействовать вещества, блокирующие индукцию адаптивной реакции теплового шока, таким образом, предотвращая опухолевые клетки от мобилизации природных механизмов устойчивости посредством пополнения индуцибельных шаперонов. Адаптивная реакция теплового шока может быть селективно заблокирована путем подавления HSF-1, основного медиатора индуцибельной транскрипции, инициируемой тепловым шоком. Вещества, ингибирующие адаптивную реакцию теплового шока, могут быть использованы в комбинации с соединениями, индуцирующими тепловой шок, или условиями, которые должны привести к их повышенной цитотоксичности. Предполагается, что эта цитотоксичность более выражена в опухолевых, нежели в нормальных клетках, вследствие более высокой степени зависимости опухолевых клеток от шаперонов. Этот пример также демонстрирует, что антималярийное лекарственное средство хинакрин (QC),имеющее к нему отношение соединение 9-аминоакридин (9 АА) и другие химические вещества, принадлежащие семейству карбазолов (CZ), действуют в качестве ДНК-интеркалирующих негенотоксичных веществ, которые воздействуют на функцию определенных классов промоторов генов, которые являются индуцибельными при активации метаболических путей передачи сигнала. Анализ реакции теплового шока в клетках в присутствии этих соединений показал, что эти соединения могут подавлять HSF-1 опосредованную транскрипцию дозозависимым способом независимо от лечения или средства, используемого для индукции реакции теплового шока. Хинакрин и 9 АА были добавлены к опухолевым клеткам в культуре с целью исследования влияния этих соединений на активацию HSP70 в ответ на воздействие, индуцирующее тепловой шок. Реакция теплового шока была индуцирована с помощью известных ингибиторов протеасом MG132 и бортезомиба, DMAG17-ингибитора HSP90 (гелданамицин) и тепловой обработки (42-45 С, 10-60 мин). Для наблюдения за реакцией теплового шока индуцибельная изоформа HSP70 была определена Вестерниммуноблоттингом, используя антитела, которые узнают индуцибельную форму белка HSP70, и Нозернгибридизацией с использованием зонда, который специфически распознает мРНК индуцибельных геновHSP70A1 и HSP70B', но не распознает мРНК, кодирующую конститутивно экспрессирующийся белокHSC70. QC и 9 АА предотвращали индукцию белка HSP70 (фиг. 1 А). Хинакрин и 9 АА не влияли на способность MG132 и бортезомиба ингибировать активность протеасом (фиг. 1 В), указывая на то, что воздействие QC и 9 АА не связано с инактивацией индуцирующих тепловой шок способов обработки. Более того, индуцибельные транскрипты HSP70 накапливались в клетках, обработанных вышеперечисленными способами, индуцирующими реакцию теплового шока, но транскрипция была заблокирована в присутствии хинакрина и 9 АА (фиг. 2). В дополнение к аминоакридинам подобный эффект наблюдали при обработке клеток эметином, который является основным ингибитором трансляции (фиг. 2). Это подтверждает то, что наблюдаемый эффект QC и 9 АА был результатом отсутствия индукции белка теплового шока. Фиг. 1 демонстрирует, что QC и 9 АА предотвращают индукцию белка HSP70 в клетках, обработанных ингибиторами протеасом. Белковые экстракты из клеток HeLa, обработанных 5 мкМ ингибитором протеасом MG132 в течение 8 ч в отдельности или в комбинации с QC или 9 АА, были проанализированы, используя антитело к индуцибельной форме HSP70 и к пирину (контролю нанесения образцов в гель)(фиг. 1 А). Результаты анализа активности протеасом in vitro из экстрактов клеток, обработанных MG132 в отдельности или в комбинации с хинакрином и 9 АА, показывают, что QC и 9 АА не влияют на ингибирование протеасом под действием MG132 (фиг. 1 В). Фиг. 2 демонстрирует, что QC и 9 АА ингибируют транскрипцию гена HSP70 в ответ на ингибиторы протеасом. 10 мкг суммарной РНК из клеток HeLa были обработаны в течение 5 ч 0,1 мкМ бортезомибом(Brtz) или 5 мМ MG132 (MG) в отдельности или в комбинации с 20 мМ QC (Quin), 20 мкМ 9 АА или 1 мкМ эметином (ЕМ). Результаты были проанализированы Нозерн-блоттингом с использованиемHSP70A1/B'-специфичного гибридизационного зонда. GAPDH служил контролем нанесения РНК.HSP70(x) означает индукцию транскрипции HSP70. Фиг. 3 демонстрирует, что DMAG17-индуцированный синтез HSP70 чувствителен к QC и 9 АА. Иммуноблоттинг с антителами анти-HSP70 для анализа 10 мкг белковых экстрактов из клеток HeLa, обработанных в течение 5 ч 5 мкМ MG132 (MG) или DMAG17 в отдельности или в комбинации с хинакрином (Quin) или 9 АА. Указана относительная индукция экспрессии HSP70 (инд) (результаты денситометрии). Фиг. 4 демонстрирует, что QC и 9 АА подавляют транскрипцию гена HSP70A1/B', индуцированную действием DMAG17 и MG132, как показано Нозерн-гибридизацией 10 мкг суммарной РНК из клетокHeLa, обработанных 1 мкМ DMAG17 в течение 5 ч в отдельности или в комбинации с 9 АА. GAPDH использовали в качестве контроля нанесения РНК. HSP70(x) означает относительную индукцию транскрипции HSP70. Фиг. 5 демонстрирует токсический эффект комбинации лекарственных средств в клетках HeLa, как показывают результаты анализа колониеобразования клеток HeLa, обработанных в течение 6 ч протеотоксичным лекарственным средством DMAG17 (1 мкМ) в комбинации с различными концентрациями хинакрина (10 или 20 мкМ). Клетки были собраны, разведены 1:50 и проанализированы на способность к колониеобразованию. Число колоний было посчитано с помощью окрашивания бромфеноловым синим после 7 дней роста и фиксации 10% формальдегидом. Данные представлены в виде среднего по трем экспериментам. Индуцирующие тепловой шок вещества и QC демонстрируют синергичную цитотоксичность. Фиг. 6 демонстрирует результаты эксперимента, подобного таковому, показанному на фиг. 5, но вместо DMAG17 была использована обработка тепловым шоком (43 С, 30 мин). Наблюдали синергичную цитотоксичность, когда QC комбинировали с нагреванием. Фиг. 7 демонстрирует, что чувствительность к нагреванию у раковых клеток, но не у нормальных клеток, повышалась при обработке QC и CZ (соединение CBL0137). RCC45 (клетки почечно-клеточной карциномы) и NKE-hTERT (клетки нормального почечного эпителия, иммортализованные трансдукцией теломеразы) были обработаны различными концентрациями QC или соединения CBL0137 и затем мгновенно помещены на водяную баню при 45 С (суспендированы в культуральной среде). Время инкубации на водяной бане показано различными цветовыми оттенками. После нагревания клетки были помещены в 96-луночные плашки и инкубированы в течение 24 ч в присутствии лекарственного средства и затем в течение дополнительных 48 ч в среде без лекарственного средства. Выживаемость клеток оценивали путем анализа клеточного титра синим окрашиванием (Alamar Blue, Promega). Фиг. 8 демонстрирует, что миРНК-опосредованный нокдаун компонента ядерного комплексаFACT, SSPT1 и CKII киназы FACT повышает чувствительность клетки к тепловому шоку. Клетки НТ 1080 были трансфицированы пулами миРНК, созданными против белковой казеин-киназы II (CKII),SSPT1 и GAPDH (контроля) (Dharmacon) в соответствии с рекомендациями фирмы-производителя. Спустя 24 ч все клетки были распределены по шестилуночным плашкам. После дополнительных 24 ч клетки в плашках были размещены на водяной бане для прогрева до 45 С в течение 10, 15 и 20 мин. Выживаемость клеток оценивали через 48 ч после нагревания путем анализа клеточного титра синим окрашиванием (Promega). Эти результаты означают, что комбинированная обработка опухолевых клеток нетоксичными или незначительно токсичными веществами, индуцирующими реакцию теплового шока, в присутствии нетоксичных или слегка токсичных концентраций соединений, ингибирующих HSF-1-опосредованную транскрипцию, приводит к синергичной цитотоксичности, которая превалирует в опухолевых клетках при сравнении с нормальными клетками. Молекулярный механизм ингибирования HSF-1 опосредованной транскрипции под действием соединений QC, 9AA и CZ связан с их способностью ингибировать активность ядерного хроматин-ремоделирующего комплекса FACT, который, по-видимому,существенно важен для JSF-1 и NF-В-управляемой транскрипции (фиг. 8). Пример 2. Аминоакридины предотвращают активацию HSP70 в ответ на ингибирование протеасом. Этот пример свидетельствует о том, что аминоакридины предотвращают активацию HSP70 в ответ на ингибирование протеасом. Положительная регуляция индуцибельной формы HSP70 является отличительным признаком HSR вслед за протеотоксическим стрессом, как, например, такого, что возникает при ингибировании протеасом. Воздействие ряда антималярийных лекарственных средств на синтез HSP70,активированного ингибированием протеасом под действием низкомолекулярного ингибитора MG132,было проанализировано в культивируемых клетках Hela. Эметин и хинакрин (QC) подавляли синтезHSP70 в ответ на MG132 (фиг. 9 А). 9-Аминоакридин (9 АА), который тесно связан по структуре с QC,обладал подобным ингибиторным воздействием на MG132-индуцированную экспрессию HSP70 (фиг. 9 В). Эметин является ингибитором общей трансляции; таким образом, его способность подавлять индуцибельный синтез HSP70, по-видимому, является отражением данного свойства. Однако QC и 9 АА не оказывали никакого воздействия на общий синтез белка (как показывает включение 35S-метионина и 35Sцистеина) в концентрациях, которые достаточны для полного подавления индукции HSP70 (фиг. 9 С). Это свидетельствует о том, что эти основанные на аминоакридине соединения подавляют индуцибельный синтез HSP70 посредством иного, более специфичного, механизма. Ни QC, ни 9 АА не влияли на способность MG132 ингибировать активность протеасом (фиг. 9D). Таким образом, данные лекарственные средства не блокируют индукцию HSP70, лишь препятствуя формированию протеотоксического стресса посредством ингибирования протеасом. Ингибиторное воздействие QC на индукцию hSP70 было обнаружено на уровне мРНК, как показано Нозерн-гибридизацией РНК из клеток HeLa, обработанных MG132 или другим ингибитором протеасом,бортезомибом, в присутствии или в отсутствие QC (фиг. 9 Е). Зонд для гибридизации, используемый в этом эксперименте, был специфичен к индуцибельной мРНК HSP70A1 и не распознавал мРНК, кодирующую конститутивный белок HSC70. Результаты свидетельствуют о том, что QC подавлял накопление мРНК HSP70 в условиях ингибирования протеасом. Этот эффект был результатом репрессии транскрипции, а не стимуляции распада мРНК HSP70, поскольку добавление QC после индукции HSR не влияло на избыток мРНК HSP70. Ингибиторный эффект QC и 9 АА на экспрессию индуцибельного гена не являлся универсальным. Например, на ZnCl2-индуцированную активацию транскрипции гена металлотионеина не оказывали влияния данные соединения в условиях, при которых они отменяли индукцию мРНКHSP70 (фиг. 9F). Более того, QC и 9 АА вызывали значительную индукцию транскрипции генов-мишеней р 53. Пример 3. Хинакрин блокирует индукцию реакции теплового шока, вызванную ингибированиемHSP90 или гипертермией. Этот пример демонстрирует, что хинакрин блокирует реакцию теплового шока, индуцированную ингибированием HSP90 или гипертермией. Функциональная инактивация HSP90 гелданамицином или его производным 17-DMAG индуцирует протеотоксический стресс и активирует HSR, включая синтезHSP70. Как показано на фиг. 9 в отношении протеотоксического стресса, индуцированного ингибиторами протеасом, QC и 9 АА также подавляли индукцию HSP70 в ответ на ингибирование HSP90, и это происходило на транскрипционном уровне (фиг. 10 А и В). Хотя QC и 9 АА эффективно подавляли 17DMAG-активированную транскрипцию гена HSP70A1, они не оказывали влияния на уровни ряда другихQC был также эффективен в блокировании HSR, индуцированной гипертермией, как проиллюстрировано на фиг. 10D. В этом эксперименте активность транскрипционного фактора HSF1, который, как известно, является существенно важным для индукции экспрессии HSP70 во время HSR, была напрямую проанализирована. HSF1-репортерные клетки были получены путем инфицирования клеток HeLa лентивирусным репортерным конструктом, содержащим кДНК EGFP под контролем HSF1-чувствительного промотора. В результате лечения бортезомибом, 17-DMAG или гипертермией происходила индукцияHSF1-зависимого синтеза EGFP, выявленного при флуоресцентной микроскопии. Совместная обработка репортерных клеток QC вместе с любым из трех различных индукторов протеотоксического стресса блокировала накопление EGFP. Результаты этого примера демонстрируют, что противомалярийное лекарственное средство QC является мощным ингибитором HSR. Пример 4. Хинакрин влияет на функцию HSF1 после его ядерной транслокации и ДНК-связывания. Этот пример демонстрирует, что хинакрин влияет на функцию HSF1 после его ядерной транслокации и ДНК-связывания. Для активации HSF1-опосредованной транскрипции необходимо высвобождениеHSF1 из его комплекса с HSP90 в цитоплазме. Вслед за этим происходит образование гомодимеров и гомотримеров HSF1, которые транслоцируются в ядро и связываются со специфическими сайтами узнавания HSF1 в промоторах индуцибельных тепловым шоком генов. Было изучено воздействие QC и 9 АА на данный процесс, чтобы определить тот момент, когда эти соединения воздействуют, ингибируя функцию HSF1. Для оценки внутриклеточной локализации и ДНК-связывающей способности комплексовHSF1 были проведены анализы изменения электрофоретической подвижности (EMSA), используя белковые экстракты, очищенные из цитоплазмы или ядер клеток, подвергнутых действию протеотоксического стресса в отдельности или в комбинации с QC или 9 АА. Результаты этих экспериментов показаны на фиг. 11. Обработка клеток HeLa MG132 тепловым шоком или 17-DMAG привела к активации специфической ДНК-связывающей активности HSF1 как в цитоплазме (фиг. 11 А), так и в ядерных экстрактах(фиг. 11 В). QC и 9 АА не препятствовали силе этих воздействий или не модифицировали ее в любой проанализированной концентрации (вплоть до 100 нМ) (данные не представлены на фиг. 11 В). Эти результаты свидетельствуют о том, что ингибирование HSF1-зависимой транскрипции под действием QC и 9 АА происходит после его цитоплазматической активации, ядерной транслокации и связывания с ДНК. Данные о том, что QC и 9 АА воздействуют на HSF1 после его ядерной транслокации, предполагают, что сами по себе соединения локализованы, по крайней мере частично, в ядре. Это подтверждается результатами, полученными в ходе экспериментальной модуляции их внутриклеточного распределения. Бафиломицин, антибиотик направленного действия на лизосому, может в значительной степени изменить внутриклеточное распределение соединений, тропных к лизосоме, включая хинакрин и хлороквин,путем ингибирования лизосомальной Н+-АТФазы. Обработка клеток HeLa бафиломицином приводила к изменению внутриклеточной локализации QC, от преимущественно лизосомальной к преимущественно ядерной локализации (фиг. 11 С), согласно данным флуоресцентной микроскопии (как QC, так и 9 АА являются природными флуоресцентными соединениями). Было исследовано воздействие обработки бафиломицином на чувствительность индукции HSP70 к QC. Бафиломицин повышал эффективность QC в качестве ингибитора HSR в MG132-обработанных клетках HeLa, как показано на фиг. 11D. В присутствии антибиотика 5 мМ QC ингибировал синтез HSP70 с той же эффективностью, с какой ингибировал 20 мМ QC в отсутствие данного антибиотика. Эти результаты свидетельствуют о том, что ингибиторная активность QC в отношении HSF1-опосредованной транскрипции зависит от его ядерной концентрации. Пример 5. Комбинирование хинакрина с протеотоксическим стрессом индуцирует апоптоз. Этот пример демонстрирует, что комбинирование хинакрина с протеотоксическим стрессом индуцирует апоптоз. Реакция теплового шока (HSR) является адаптивной реакцией для выживания клетки,которая защищает клетки от различных токсических состояний. Было показано, что быстрое накопление индуцибельных форм шаперонов, таких как HSP70 и HSP27, предотвращает гибель клетки в условиях теплового шока или обработки ингибиторами протеасом или HSP90. Таким образом, способность QC или 9 АА предотвращать индукцию белков, кодируемых HSF1-чувствительными генами, может в значительной степени повышать цитотоксичность протеотоксических стрессов. Клетки HeLa были обработаны 17-DMAG или бортезомибом в отдельности или в комбинации с QC, и было проанализировано их воздействие на клеточную выживаемость и индукцию апоптоза. Как показано на фиг. 4 А и 4 В, QC значительно повышал токсичность 17-DMAG и бортезомиба соответственно. Комбинированная обработка концентрациями QC, вызывающими менее чем 50% снижение клеточной выживаемости, вместе с практически нетоксичными концентрациями 17-DMAG или бортезомиба приводила к значительному падению числа растущих клеток. Было исследовано, играет ли роль индукция апоптоза в воздействии лекарственных средств на число жизнеспособных клеток. За апоптозом наблюдали по появлению продуктов специфического расщепления каспазами кератина 18 и PARP. Согласно результатам оценки клеточной выживаемости комбинированная обработка QC и либо бортезомибом, либо 17-DMAG в значительной степени активировала белковое расщепление, опосредованное каспазами, которое было едва уловимо, когда были использованы лекарственные средства по отдельности (фиг. 12 С и D). Каспазный ингибитор ZVAD-FMK полностью блокировал данный эффект, указывая на то, что процессы протеолитического расщепления были каспазо-специфичными (фиг. 12 Е). Чтобы выяснить, играет ли важную роль ингибирование индукции HSP70 в QC-опосредованной клеточной сенсибилизации к бортезомибу и 17-DMAG, эффект QC сравнили с таковым альтернативного способа подавления HSP70. Клетки HeLa были трансфицированы миРНК, специально нацеленной против индуцибельной формы HSP70. Трансфицированные клетки были не способны синтезировать индуцибельный HSP70 при обработке ингибиторами протеасом или HSP90 (фиг. 12D). Отсутствие способности синтезировать HSP70 в условиях протеотоксического стресса приводило к активации апоптотического ответа подобного тому, что был вызван комбинированной обработкой QC и индуцирующими протеотоксический стресс веществами (фиг. 12D). Сходные биологические эффекты ми-РНК-опосредованного нокдауна HSP70 и обработки QC в отношении клеточной чувствительности к бортезомибу и 17-DMAG предполагает то, что комбинированная токсичность QC и индукторов протеотоксического стресса опосредована подавлением HSR действием QC. Пример 6. Противоопухолевое воздействие комбинирования хинакрина с ингибитором HSP90. Этот пример демонстрирует, что комбинирование хинакрина с ингибитором HSP90 оказывает противоопухолевое воздействие. Данные о том, что комбинирование QC с индуцирующими протеотоксический стресс лекарственными средствами оказывает сильное токсическое воздействие на клетки HeLa invitro, предполагают, что такого рода комбинирование может обладать значительным потенциалом в качестве противораковых методов лечения. Для исследования данной возможности было проанализировано воздействие комбинированной обработки QC/17-DMAG на опухолевый рост in vivo, используя две сингенные мышиные модели опухоли: фибросаркому МСА 205 и меланому В-16. Был использован 17DMAG, поскольку он является индуктором протеотоксического стресса, демонстрирующим ограниченное противоопухолевое действие в виде монотерапии. Было проанализировано влияние 17-DMAG и QC на индукцию HSR (фиг. 13 А) и клеточную выживаемость (фиг. 13 В) в клетках МСА 205 и В-16 in vitro. Обе клеточные линии реагировали на данные лекарственные средства в подобной клеткам HeLa манере,указывая на то, что эти модели правомерно использовать для анализа противоопухолевой активности комбинирования QC/17-DMAG. Чтобы подтвердить то, что лекарственные средства обладают схожим воздействием на индукцию HSR в опухолях, растущих in vivo, мышам C57BL/6 были имплантированы клетки МСА 205, и образующиеся опухоли были обработаны однократной внутриопухолевой инъекциейPBS (контроль), 25 мг 17-DMAG в отдельности или 1,25 мг QC вместе с 25 мкг 17-DMAG. Спустя 5 ч мыши были умерщвлены, и РНК, полученная из вырезанных опухолей, была проанализирована на предмет индукции HSP70. Как показано на фиг. 13 С, обработка 17-DMAG индуцировала синтез HSP70 в опухолях, растущих in vivo, a QC предотвращал данную индукцию. Для оценки влияния комбинирования лекарственных средств на опухолевый рост in vivo мышам, имеющим опухоли МСА 205 (фиг. 13D) или В-16 (фиг. 13 Е), была введена внутриопухолевая инъекция QC и 17-DMAG по отдельности или в комбинации. После инъекции лекарственного средства регулярно (каждые 2 дня) измеряли размер опухолей. В обеих экспериментальных моделях QC и 17-DMAG, применяемые в качестве монотерапии, оказывали незначительное противоопухолевое действие (задержка опухолевого роста), в то время как при их комбинировании полностью предотвращался опухолевый рост. Опухолевые размеры измеряли вплоть до 24 дня с момента имплантации. Опухоли с инъекцией только одним лекарственным средством, начинали перерастать опухоли с инъекциями, основанными на комбинировании лекарственных средств, начиная с 16 дня для клеток В-16 и с 18 дня для клеток МСА 205 (фиг. 13 А и В). Комбинированное лечение QC/17DMAG не только предотвращало опухолевый рост, но фактически приводило к регрессии опухоли с уменьшением размера опухоли от 50 мм 3 до недетектируемого. Эти данные свидетельствуют о том, что комбинирование QC с индукторами протеотоксического стресса приводит к апоптозу. Пример 7. Способы. 1. Клеточная культура, лентивирусные векторы, трансфекция миРНК и лекарственные средства. Клетки HeLa культивировали в модифицированной по способу Дульбекко среде Игла (Invitrogen/Gibco BRL, Carlsbad, CA), дополненной 10% фетальной телячьей сывороткой. Клетки мышиной меланомы В-16 и фибросаркомы МСА 205 выращивали в полной среде RPMI-1640, дополненной 2 мМ Lглутамином, 100 мкг/мл стрептомицином, 100 ед/мл пенициллином, 50 мкг/мл гентамицином (Life Technologies, Grand Island, NY). HSFl-специфичная экспрессия EGFP была получена в результате вставки 6 копий HSF1-регуляторных элементов (HSE) 5'-CAGAACGTTCTAG-3' (SEQ ID NO: 1) выше минимального промотора CMV в лентивирусный вектор PTR-mCMV-EGFP. Клетки были инфицированы лентивирусом с использованием MOI 10 в присутствии 4 мкг/мл полибрена в течение ночи. Эффективность инфицирования была определена по экспрессии EGFP в ответ на тепловой шок при 43 С в течение 60 мин. От 70 до 90% клеток было инфицировано вирусом, и в них обнаруживали экспрессию GFP в ответ на тепловой шок. Клетки HeLa были трансфицированы миРНК HSP70 (Santa Cruz Biotechnology, Santa Cruz, CA) в течение 24 ч с целью ингибирования экспрессии HSP70 во время дополнительной обработки лекарственными средствами. Контрольные клетки были трансфицированы миРНК-А, не специфичной для HSP70,(Santa Cruz Biotechnology, Santa Cruz, CA). Клетки были обработаны так, как описано в тексте про ингибиторы протеасом MG132 (Calbiochem, San Diego, CA) и бортезомиб (LC Laboratories, Woburn, MA), ингибитор HSP90, 17-DMAG, (LC Laboratories, Woburn, MA), хинакрин, эметин, хинин, хлороквин и 9 АА(все от Sigma, St. Louis, МО). Обработка гипертермией/тепловым шоком была выполнена посредством инкубации при 43 С в течение 1 ч. 2. Вестерн-иммуноблоттинг. Экстракты суммарного белка из клеток HeLa были приготовлены в буфере RIPA (150 мМ NaCl, 1%SDS, 10 мМ Tris (pH 8,0), 1% дезоксихолат натрия, 1% NP-40), содержащем коктейль ингибитора протеаз(Sigma, St. Louis, МО). Белковые экстракты были фракционированы электрофорезом в 4-20% градиентных полиакриламидных гелях с SDS (Invitrogen/Novex, Carlsbad, CA) и затем перенесены на нейлоновые мембраны PVDF (Amersham, Piscataway, NJ). Мембраны предварительно инкубировали в течение ночи в 5% растворе молока и затем инкубировали в течение 1 ч в 1% растворе молока с первичными антителами в разведении 1:1000. Были использованы следующие первичные антитела: кроличьи антитела против индуцибельной формы HSP70A1 (Assay Designs/StressGen, Victiria, ВС, Canada) и крысиные анти-HSF1(Assay Designs/StressGen, Victiria, ВС, Canada). Контролями нанесения белка служили антитела антипирин (Institut fr Biochemie der Ludwig-Maximilians-Universitt Munchen, Germany) и кроличьи антитела антикератин 18 (Burnham research Institute, CA). Апоптоз анализировали путем выявления каспазоспецифичного расщепления K18 (Burnham research Institute, CA) и PARP (антитело из Santa Cruz Biotechnology, Santa Cruz, CA). HRP-конъюгированные вторичные антикроличьи, антикрысиные и антимышиные антитела были приобретены в Santa Cruz Biotechnology. Реагент для детекции (ECL) был производства Perkin Elmer (Shelton, CT). 3. Нозерн-блоттинг и гибридизация. Суммарная РНК (10 мкг) из клеток HeLa, В-16 или МСА 205 была проанализирована Нозерн-блот гибридизацией с использованием зондов, специфичных к генам HSP70A1, MT1, p65RelA, GRP94 иGAPDH. ПЦР-фрагмент был синтезирован на кДНК HSP70A1 (Invitrogen, Carlsbad, CA) с использованием праймеров, специфичных к кодирующей последовательности HSP70A1 (Als: 5' CCA CCA ТСС CCACCA AGC AGA C3' (SEQ ID NO: 2); Ala: 5' CAT GAA CCA TCC TCT CCA CCT 3') (SEQ ID NO: 3). Все остальные гибридизационные зонды были получены из клонов кДНК путем эндонуклеазного расщепления рестриктазой (ORIGENE). Мечение белка 35S in vivo. Клетки HeLa были обработаны лекарственными средствами и их комбинациями в соответствии с протоколами экспериментов. Стандартная культуральная среда была заменена на среду, свободную от метионина/цистеина, дополненную 35S-метионином и 35S-цистеином (50 мКи/мл)(New England Nuclear/Perkin Elmer, Shelton, CT), и клетки инкубировали в течение дополнительных 60 мин в присутствии лекарственных средств. Экстракты цитоплазматических белков были приготовлены в соответствии с протоколом Dignam. Меченые белки были проанализированы электрофорезом в 10% полиакриламидном геле и авторадиографией. 4. Анализ активности протеасом in vitro.
МПК / Метки
МПК: C12N 13/00
Метки: индуцирование, гибели, ингибирования, теплового, адаптивной, путем, шока, клеточной, реакции
Код ссылки
<a href="https://eas.patents.su/30-21331-inducirovanie-kletochnojj-gibeli-putem-ingibirovaniya-adaptivnojj-reakcii-teplovogo-shoka.html" rel="bookmark" title="База патентов Евразийского Союза">Индуцирование клеточной гибели путем ингибирования адаптивной реакции теплового шока</a>
Предыдущий патент: Детское питание на основе жиров молочного происхождения
Следующий патент: Конструкция чехольного типа с гибким вложением
Случайный патент: Способ защиты калийного рудника от затопления