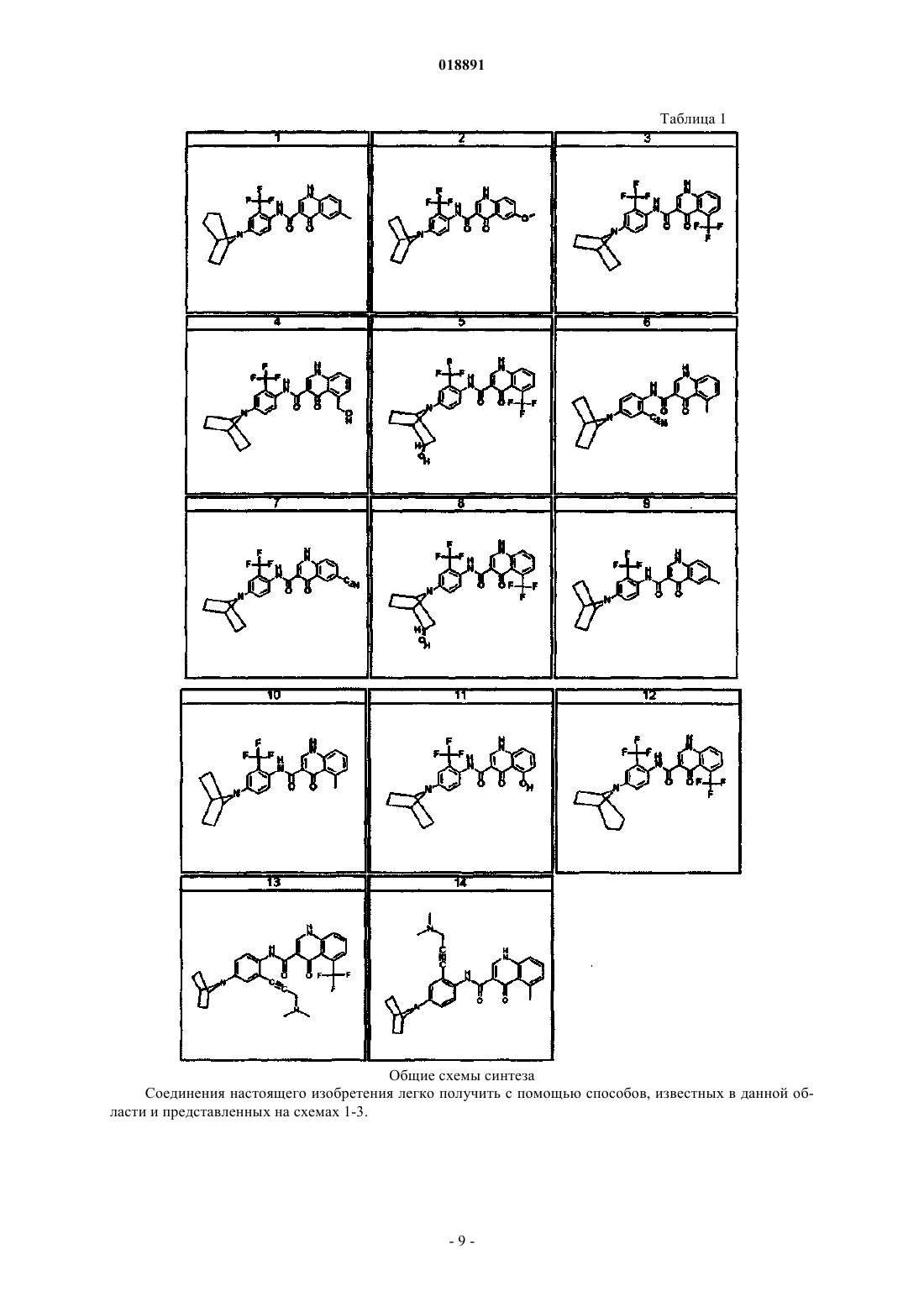
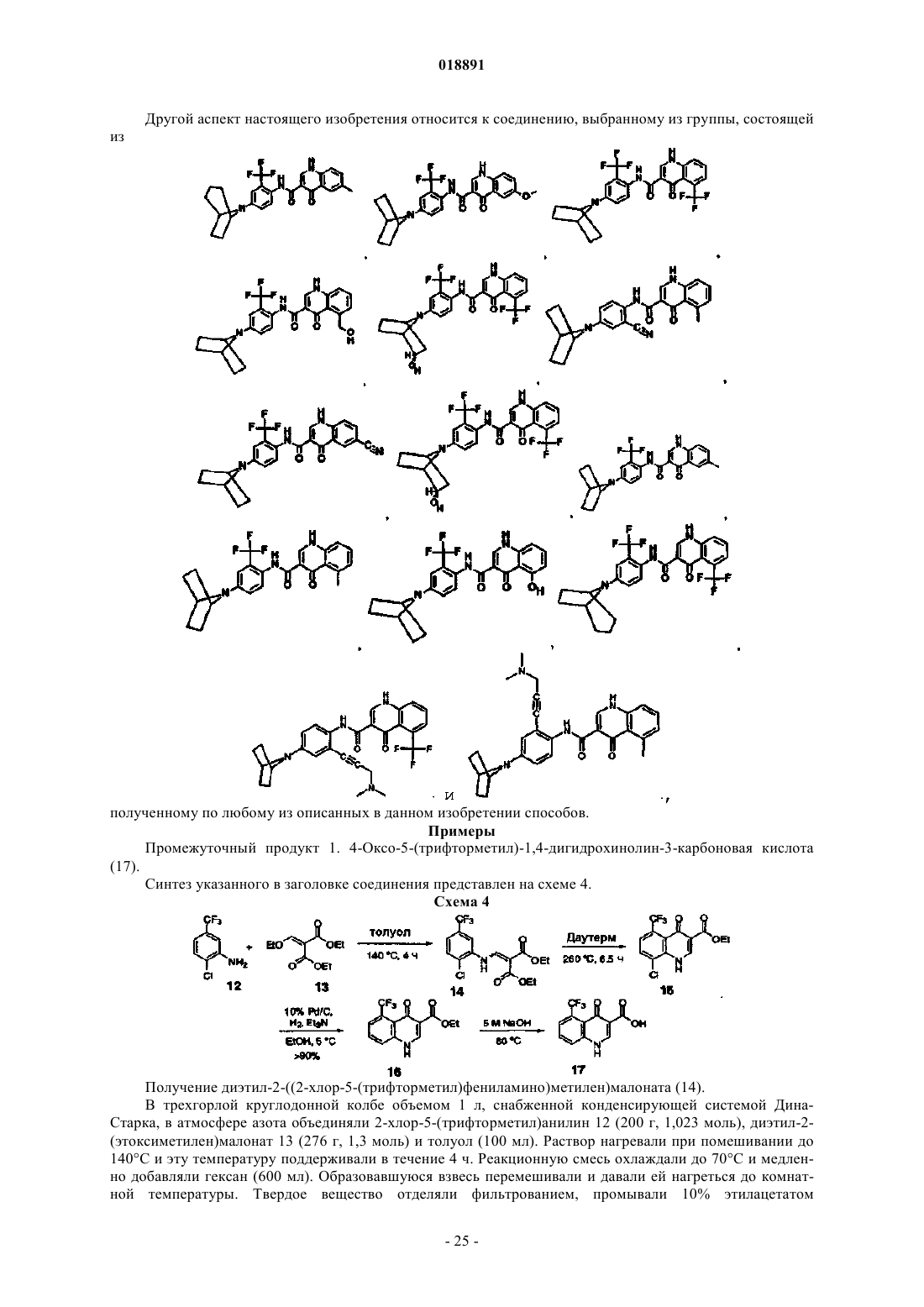
Модуляторы регулятора трансмембранной проводимости при муковисцидозе
Номер патента: 18891
Опубликовано: 29.11.2013
Авторы: Харли Деннис, Бинч Хэйли, Силина Алина, Шет Урви, Ван Гур Фредрик, Гротенхейс Петер Д.Й., Янг Сяоцин, Ботфилд Мартин, Нума Мехди Мишель Джамель, Фэннинг Лев Т.Д.
Формула / Реферат
1. Соединение формулы (I)
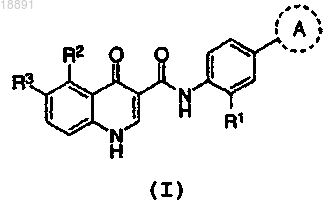
или его фармацевтически приемлемые соли,
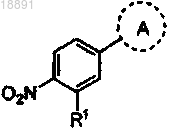
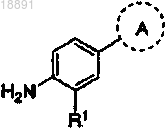
где кольцо A выбирают из
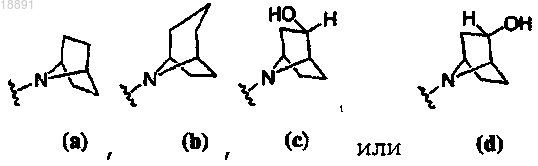
R1 представляет собой -CF3, -CN или -CºCCH2N(CH3)2;
R2 представляет собой водород, -CH3, -CF3, -OH или -CH2OH;
R3 представляет собой водород, -CH3, -OCH3 или -CN,
при условии, что оба R2 и R3 не являются одновременно водородом.
2. Соединение по п.1, где кольцо A представляет собой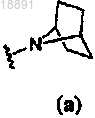 .
.
3. Соединение по п.1, где кольцо A представляет собой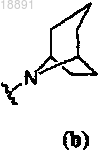 .
.
4. Соединение по п.1, где кольцо A представляет собой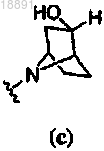 .
.
5. Соединение по п.1, где кольцо A представляет собой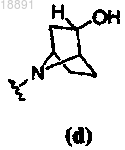 .
.
6. Соединение по любому из пп.2-5, где R1 представляет собой -CF3.
7. Соединение по любому из пп.2-5, где R1 представляет собой -CN.
8. Соединение по любому из пп.2-5, где R1 представляет собой -CºCCH2N(CH3)2.
9. Соединение по любому из пп.6-8, где R2 представляет собой водород.
10. Соединение по любому из пп.6-8, где R2 представляет собой -CH3.
11. Соединение по любому из пп.6-8, где R2 представляет собой -CF3.
12. Соединение по любому из пп.6-8, где R2 представляет собой -OH.
13. Соединение по любому из пп.6-8, где R2 представляет собой -CH2OH.
14. Соединение по любому из пп.10-13, где R3 представляет собой водород.
15. Соединение по любому из пп.9-13, где R3 представляет собой -CH3.
16. Соединение по любому из пп.9-13, где R3 представляет собой -OCH3.
17. Соединение по любому из пп.9-13, где R3 представляет собой -CN.
18. Соединение, выбранное из
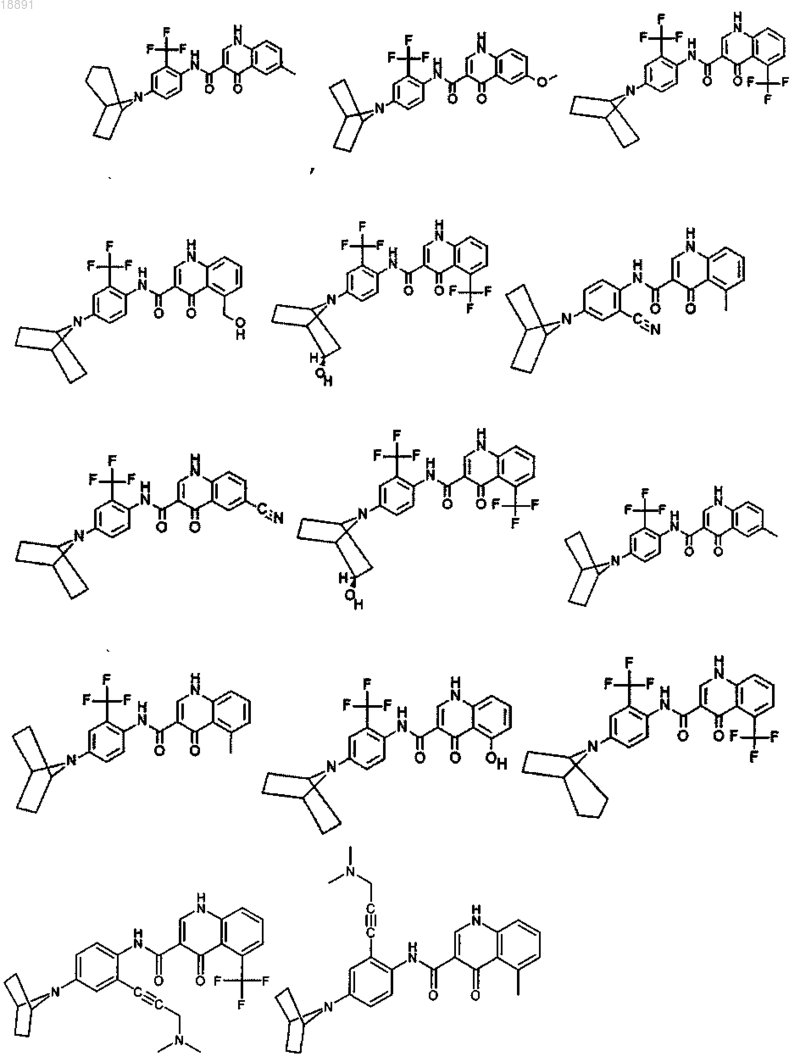
19. Соединение по п.18, где соединение представляет собой
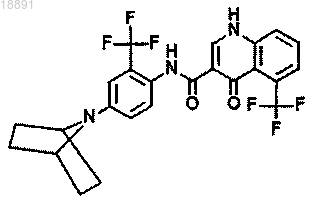
20. Фармацевтическая композиция, содержащая соединение по любому из пп.1-19 и фармацевтически приемлемый носитель или адъювант.
21. Способ лечения или ослабления тяжести заболевания у пациента, где указанное заболевание выбирают из муковисцидоза, астмы, вызванного курением хронического обструктивного легочного заболевания, хронического бронхита, риносинусита, запора, панкреатита, недостаточности поджелудочной железы, мужского бесплодия, вызванного врожденным двусторонним отсутствием семявыводящих протоков (CBAVD), заболевания легких легкой степени, идиопатического панкреатита, аллергического бронхолегочного аспергиллеза (АВРА), заболевания печени, наследственной эмфиземы, наследственного гемохроматоза, дефектов коагуляции-фибринолизиса, наследственной болезни Квинке типа 1, дефектов процессирования липидов, болезни Криглер-Наджара типа II, полиэндокринопатии/гиперинсулинемии, сахарного диабета, карликовости Ларона, дефицита миелопероксидазы, первичного гипопаратиреоза, меланомы, гликаноза CDG типа 1, врожденного гипертиреоза, остеопсатироза, наследственной гипофибриногенемии, дефицита альфа 1-антихимотрипсина (ACT), несахарного диабета (DI), синдрома Шарко-Мари-Тута, болезни Пелицеуса-Мерцбахера, нейродегенеративных заболеваний, полиглутаминовых неврологических расстройств, губчатых энцефалопатий, болезни Фабри, синдрома Герстманна-Штреусслера-Шейнкера, хронического обструктивного легочного заболевания, сухости глаз, недостаточности поджелудочной железы, остеопороза, остеопении, синдрома Горэма, нарушения каналов для ионов хлора, врожденной миотонии (формы Томсена и Беккера), синдрома Бартера типа III, болезни Дента, стартовой болезни, эпилепсии, лизосомальной болезни хранения, синдрома Ангельмана, первичной цилиарной дискинезии (PCD), PCD с обратным расположением внутренних органов (также известная как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарной аплазии и болезни Шегрена, включающий стадию введения указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-19.
22. Способ по п.21, где указанным заболеванием является муковисцидоз.
23. Способ лечения или ослабления тяжести заболевания, связанного с ослаблением функции муковисцидозного трансмембранного регулятора (CFTR) вследствие мутаций в кодирующем CFTR гене или факторов окружающей среды, у пациента, включающий стадию введения указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-19, где указанным заболеванием является муковисцидоз, хронический бронхит, рецидивирующий бронхит, острый бронхит, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыводящих протоков (CBAVD), женское бесплодие, вызванное врожденным отсутствием матки и влагалища (CAUV), идиопатический хронический панкреатит (ICP), идиопатический рецидивирующий панкреатит, идиопатический острый панкреатит, хронический риносинусит, первичный склерозирующий холангит, диабет, сухость глаз, запор, аллергический бронхолегочный аспергиллез (АВРА), костные болезни или астма.
24. Способ лечения или ослабления тяжести заболевания, связанного с нормальной функцией муковисцидозного трансмембранного регулятора (CFTR), у пациента, включающий стадию введения указанному пациенту терапевтически эффективного количества соединения по любому из пп.1-19.
25. Способ по п.24, где указанным заболеванием является хроническое обструктивное заболевание легких (COPD), хронический бронхит, рецидивирующий бронхит, острый бронхит, риносинусит, запор, хронический панкреатит, рецидивирующий панкреатит и острый панкреатит, недостаточность поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыводящих протоков (CBAVD), заболевание легких легкой степени, идиопатический панкреатит, заболевание печени, наследственная эмфизема, желчные конкременты, желудочно-пищеводный рефлюкс, желудочно-кишечные злокачественные новообразования, воспалительное заболевание кишечника, диабет, артрит, остеопороз или остеопения.
26. Способ по п.24, где указанным заболеванием является наследственный гемохроматоз, дефекты коагуляции-фибринолизиса, наследственная болезнь Квинке типа 1, дефекты процессирования липидов, лизосомальные болезни накопления, болезнь Криглер-Наджар типа II, полиэндокринопатия/гиперинсулинемия, сахарный диабет, карликовость Ларона, дефицит миелопероксидазы, первичный гипопаратиреоз, меланома, гликаноз CDG типа 1, врожденный гипертиреоз, остеопсатироз, наследственная гипофибриногенемия, дефицит альфа 1-антихимотрипсина (ACT), несахарный диабет (DI), синдром Шарко-Мари-Тута, болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, полиглутаминовые неврологические расстройства, губчатые энцефалопатии, болезнь Фабри, синдром Герстманна-Штреусслера-Шейнкера, синдром Горэма, нарушения каналов для ионов хлора, врожденная миотония (формы Томсена и Беккера), синдром Бартера типа III, болезнь Дента, стартовая болезнь, эпилепсия, лизосомальная болезнь хранения, синдром Ангельмана, первичная цилиарная дискинезия (PCD), PCD с обратным расположением внутренних органов (также известная как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарной аплазии или болезнь Шегрена.
27. Способ по п.21 или 26, где дефектами коагуляции-фибринолизиса является дефицит белка С.
28. Способ по п.21 или 26, где дефектами процессирования липидов являются семейная гиперхолестеринемия, хиломикронемия типа 1 или абеталипопротеинемия.
29. Способ по п.21 или 26, где лизосомальными болезнями накопления являются болезнь I-клеток/псевдо-Гурлера, мукополисахаридозы, болезнь Сандхоф/Тея-Сакса.
30. Способ по п.21 или 26, где несахарным диабетом является нейрогенный несахарный диабет или нефрогенный несахарный диабет.
31. Способ по п.21 или 26, где нейродегенеративными заболеваниями являются болезнь Альцгеймера, болезнь Паркинсона, боковой амитрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика.
32. Способ по п.21 или 26, где полиглутаминовыми неврологическими расстройствами являются болезнь Хантингтона, спинно-мозжечковая болезнь типа I, спинальная и бульбарная мышечная атрофия, денторубропаллидолюисова атрофия и миотоническая дистрофия.
33. Способ по п.21 или 26, где губчатой энцифалопатией является наследственная болезнь Крейтцфельдта-Якоба.
34. Набор для применения при измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, включающий:
(i) композицию, содержащую соединение формулы (I) по любому из пп.1-19 и фармацевтически приемлемый носитель или адъювант;
(ii) инструкции в отношении:
a) приведения композиции в контакт с биологическим образцом и
b) измерения активности указанного CFTR или его фрагмента.
35. Набор по п.34, дополнительно включающий инструкции в отношении:
a) приведения дополнительного соединения в контакт с биологическим образцом;
b) измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения и
c) сравнения активности CFTR или его фрагмента в присутствии дополнительного соединения с активностью CFTR или его фрагмента в присутствии соединения формулы (I) по любому из пп.1-19.
36. Набор по п.35, где стадия сравнения активности CFTR или его фрагмента обеспечивает показатель плотности CFTR или его фрагмента.
37. Способ модулирования активности CFTR в биологическом образце, включающий стадию приведения указанного CFTR в контакт с соединением по любому из пп.1-19.
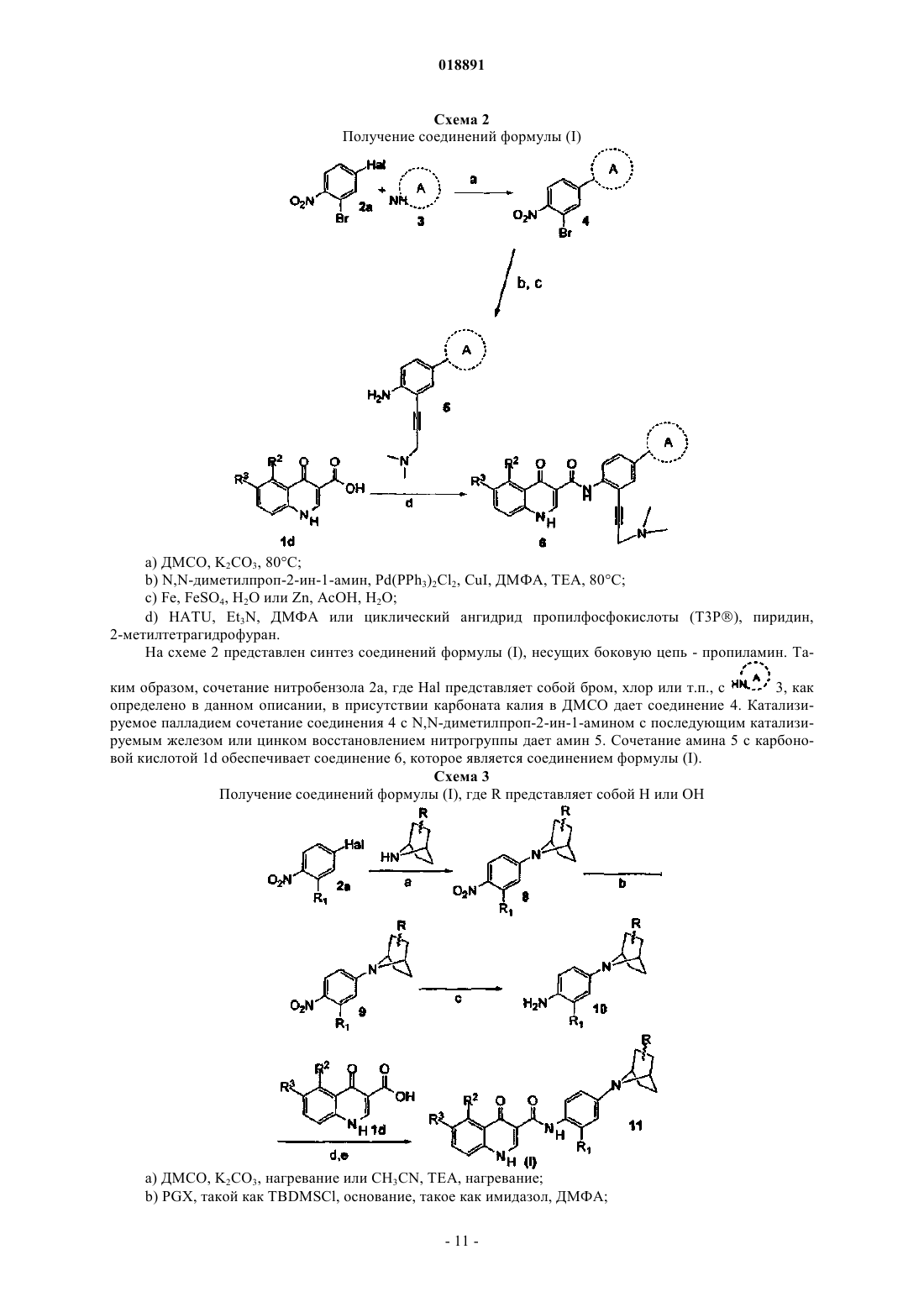
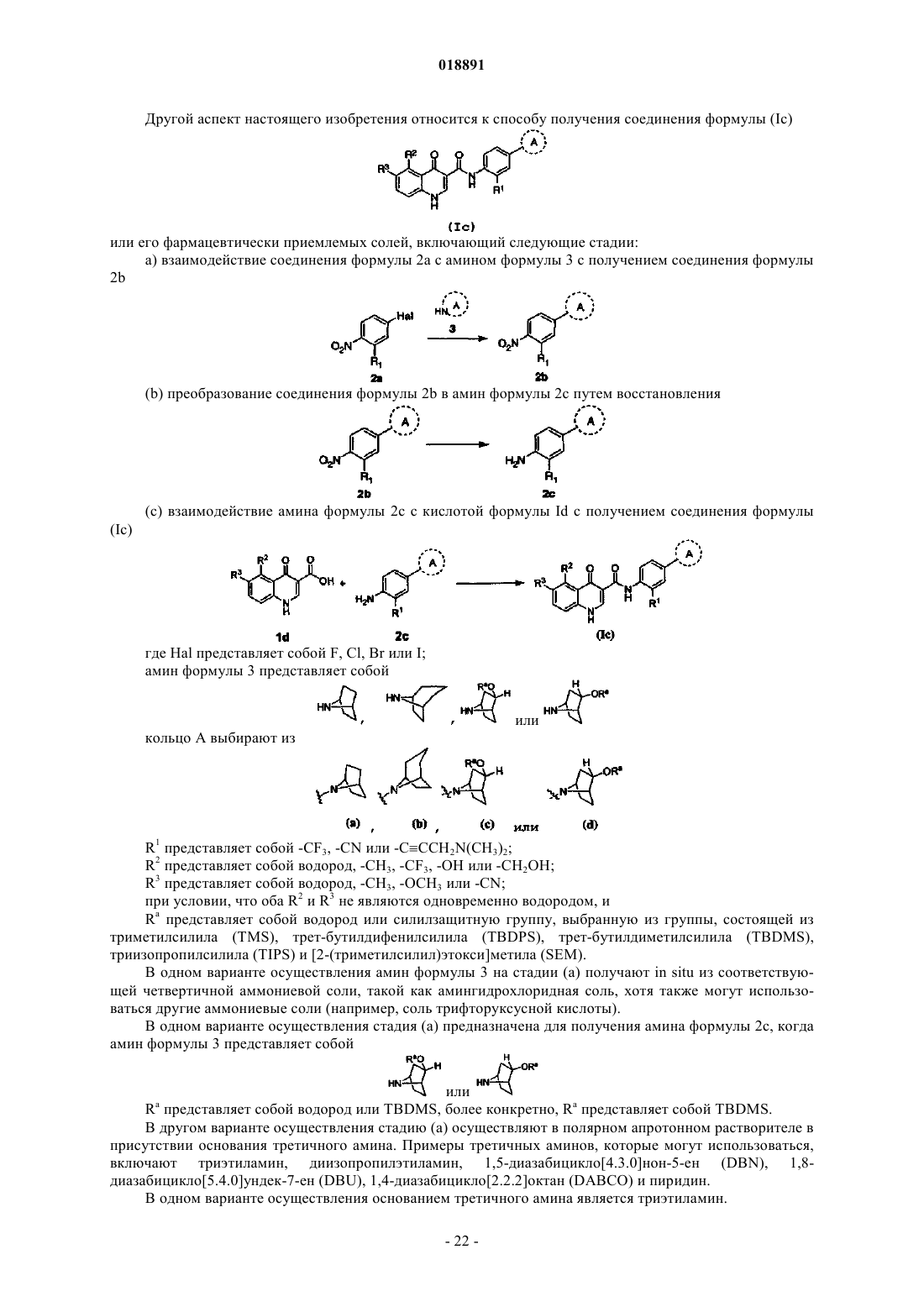
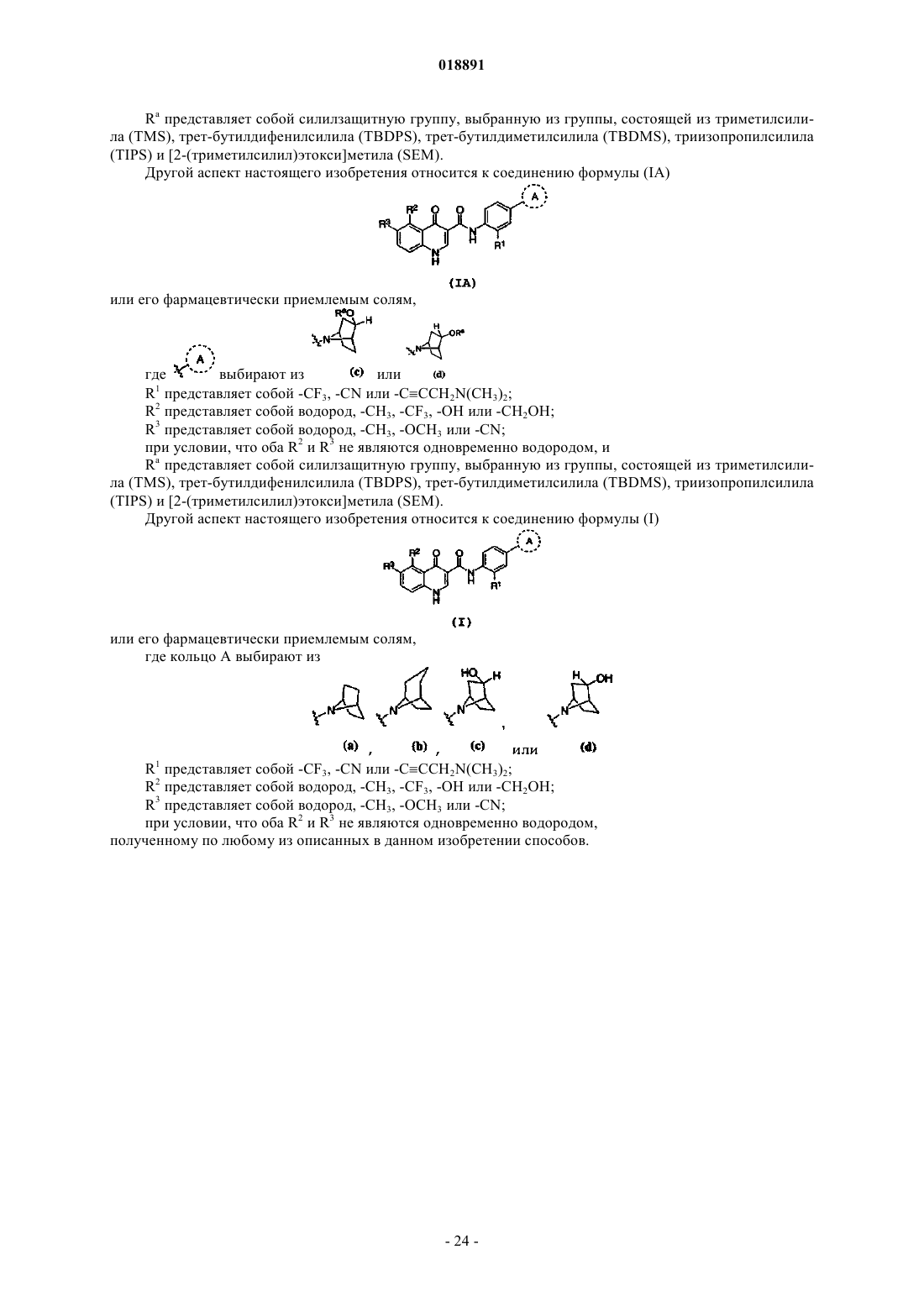
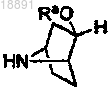
38. Способ получения соединения формулы (Ic)

или его фармацевтически приемлемых солей, включающий следующие стадии:
а) взаимодействие соединения формулы 2а с амином формулы 3 с получением соединения формулы 2b
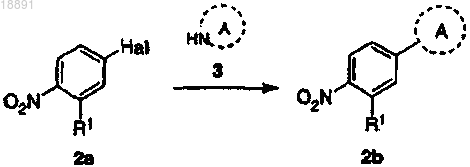
(b) преобразование соединения формулы 2b в амин формулы 2с путем восстановления
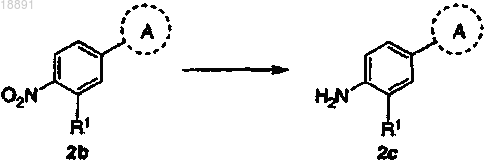
(с) взаимодействие амина формулы 2с с кислотой формулы 1d с получением соединения формулы (Ic)
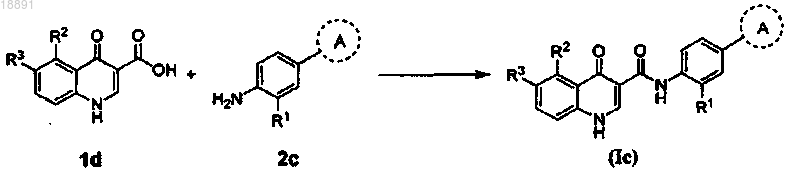
где Hal представляет собой F, Cl, Br или I;
амин формулы 3 представляет собой
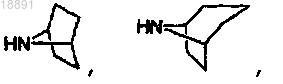
 или
или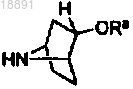 ;
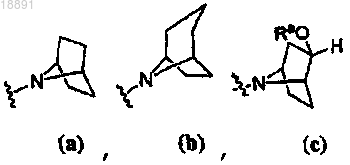
;кольцо A выбирают из
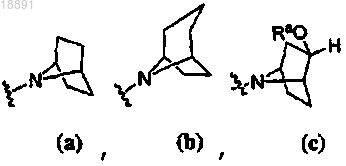 или
или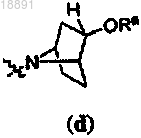
R1 представляет собой -CF3, -CN или -CºCCH2N(CH3)2;
R2 представляет собой водород, -CH3, -CF3, -OH или -CH2OH;
R3 представляет собой водород, -CH3, -OCH3 или -CN,
при условии, что оба R2 и R3 не являются одновременно водородом; и
Ra представляет собой водород или силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM).
39. Способ по п.38, где амин формулы 3 на стадии (а) получают in situ из аминогидрохлорида.
40. Способ по п.39, где Ra представляет собой трет-бутилдиметилсилил (TBDMS).
41. Способ по п.40, где стадию (а) осуществляют в ацетонитриле в присутствии триэтиламина.
42. Способ по п.38, где стадию (b) осуществляют в растворителе, выбранном из метанола или этанола в присутствии палладиевого катализатора.
43. Способ по п.38, где стадию (b) осуществляют в воде в присутствии Fe и FeSO4 или Zn и AcOH.
44. Способ по п.38, где стадию (с) осуществляют в растворителе в присутствии гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) и триэтиламина или в растворителе в присутствии циклического ангидрида пропилфосфокислоты (T3P®) и пиридина.
45. Способ по п.44, где растворитель на стадии (с) включает N,N-диметилформамид, этилацетат или 2-метилтетрагидрофуран.
46. Способ по п.45, где Ra представляет собой TBDMS.
47. Способ по п.38, дополнительно включающий стадию снятия защитной группы, когда кольцо A представляет собой
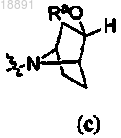 или
или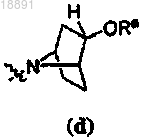 ,
,где Ra представляет собой силилзащитную группу,
с получением соединения формулы (I), где кольцо A представляет собой
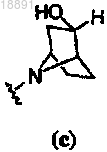 или
или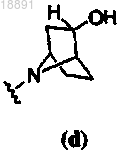 .
.48. Соединение, которое представляет собой
 ,
,где кольцо A представляет собой
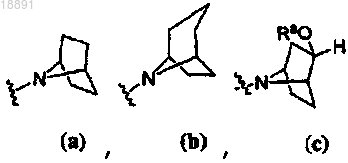 или
или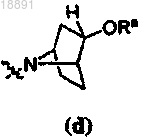 ,
,R1 представляет собой -CF3, -CN или -CºCCH2N(CH3)2 и
Ra представляет собой водород или силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM).
49. Соединение, которое представляет собой
 ,
,где кольцо A представляет собой
 или
или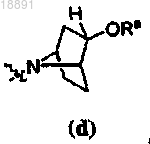 ,
,R1 представляет собой -CF3, -CN или -CºCCH2N(CH3)2 и
Ra представляет собой водород или силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM).
50. Соединение формулы (IA)

или его фармацевтически приемлемые соли,
где кольцо A выбирают из
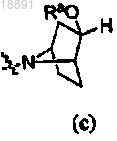 или
или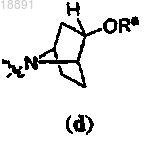 ,
,R1 представляет собой -CF3, -CN или -CºCCH2N(CH3)2;
R2 представляет собой водород, -CH3, -CF3, -OH или -CH2OH;
R3 представляет собой водород, -CH3, -OCH3 или -CN,
при условии, что оба R2 и R3 не являются одновременно водородом; и
Ra представляет собой силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM).
Текст
МОДУЛЯТОРЫ РЕГУЛЯТОРА ТРАНСМЕМБРАННОЙ ПРОВОДИМОСТИ ПРИ МУКОВИСЦИДОЗЕ Изобретение относится к модуляторам регулятора трансмембранной проводимости при муковисцидозе ("CFTR"), их композициям и способам их применения. Изобретение также относится к способам лечения заболеваний при использовании модуляторов CFTR. Бинч Хэйли, Фэннинг Лев Т.Д.,Харли Деннис, Шет Урви, Силина Алина, Янг Сяоцин, Ботфилд Мартин,Гротенхейс Петер Д.Й., Ван Гур Фредрик, Нума Мехди Мишель Джамель (US) Медведев В.Н. (RU) Перекрестная ссылка на родственные заявки По заявке на данное изобретение испрашивается приоритет согласно 35 U.S.С.119 предварительной заявки на патент США с серийным 61/107830, поданной 23 октября 2008 г. и озаглавленной "Модуляторы регулятора трансмембранной проводимости при муковисцидозе", полное содержание которой включено в настоящее описание посредством ссылки. Область техники изобретения Настоящее изобретение относится к модуляторам регулятора трансмембранной проводимости при муковисцидозе ("CFTR"), к их композициям и к способам с их использованием. Настоящее изобретение также относится к способам лечения заболеваний, использующим модуляторы CFTR. Предпосылки создания изобретения Транспортеры АТФ-связывающих кассет являются семейством мембранных белков-транспортеров,которые регулируют транспорт широкого ряда фармакологических агентов, потенциально токсичных лекарственных средств и ксенобиотиков, а также анионов. Они являются гомологичными мембранными белками, которые связываются с клеточным аденозинтрифосфатом (АТФ) и используют его для своих специфических активностей. Некоторые из этих транспортеров были открыты как белки множественной лекарственной резистентности (подобно гликопротеину MDR1-P или белку множественной лекарственной резистентности MRP1), защищающие злокачественные раковые клетки от химиотерапевтических средств. К настоящему времени было идентифицировано 48 таких транспортеров и подразделено на 7 семейств на основе идентичности их последовательностей и их функции. Одним из членов семейства транспортеров АТФ-связывающих кассет, обычно ассоциируемый с заболеванием, является цАМФ/АТФ-опосредованный анионный канал CFTR. CFTR экспрессируется во множестве типов клеток, включающих абсорбирующие и секреторные эпителиальные клетки, в которых он регулирует поток анионов через мембрану, а также активность других ионных каналов и белков. В эпителиальных клетках нормальное функционирование CFTR является важным для поддержания транспорта электролитов по всему организму, включая ткани дыхательных путей и пищеварительного тракта.CFTR состоит приблизительно из 1480 аминокислот, которые кодируют белок, состоящий из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных спиралей и нуклеотидсвязывающего домена. Два трансмембранных домена соединены посредством большого, полярного, регуляторного (R)-домена с множеством сайтов фосфорилирования, которые регулируют активность канала и направленное движение из клеток и в клетки. Кодирующий CFTR ген был идентифицирован и секвенирован (см. Gregory, R.J. et al. (1990), Nature,347:382-386; Rich, D.P. et al. (1990), Nature, 347:358-362), Riordan, J.R. et al. (1989), Science, 245:10661073). Дефект в этом гене является причиной мутаций в CFTR, приводящих к муковисцидозу ("CF"), самому распространенному летальному генетическому заболеванию у людей. Муковисцидозом поражен приблизительно один из каждых 2500 младенцев в Соединенных Штатах. В общей популяции Соединенных Штатов вплоть до 10 миллионов людей несут одну копию дефектного гена без очевидных патологических действий. Напротив, индивидуумы с двумя копиями связанного с CF гена страдают подтачивающими здоровье и летальными последствиями CF, включая хроническое заболевание легких. У пациентов с муковисцидозом мутации в CFTR, эндогенно экспрессируемом в эпителиальных тканях дыхательных путей, приводят к снижению секреции анионов в апикальной части мембраны, вызывая дисбаланс в транспорте ионов и жидкости. Результирующее снижение транспорта анионов вносит вклад в увеличение накопления слизи в легком и сопровождающие микробные инфекции, которые, в конечном счете, являются причиной смерти пациентов с CF. Помимо заболевания дыхательных путей,пациенты с CF обычно страдают связанными с желудочно-кишечным трактом проблемами и панкреатической недостаточностью, которая в случае оставления ее без лечения приводит к смерти. Кроме того,большинство мужчин с муковисцидозом являются бесплодными, а в группе женщин с муковисцидозом фертильность снижается. В противоположность тяжелым последствиям двух копий связанного с CF гена,индивидуумы с единственной копией связанного с CF гена проявляют увеличенную резистентность к холере и к обезвоживанию, являющемуся следствием диареи, что, пожалуй, объясняет относительно высокую частоту связанного с CF гена в популяции. Анализ последовательности гена CFTR хромосом при CF выявил ряд вызывающих заболевание мутаций (Cutting, G.R. et al. (1990), Nature, 346:366-369; Dean, M. et al. (1990), Cell, 67:863-870; Kerem, B.-S.et al. (1989), Science, 245:1073-1080 и Kerem, B.-S. et al. (1990), Proc. Natl. Acad. Sci. USA, 57:8447-8451). К настоящему времени было идентифицировано более 1000 вызывающих заболевание мутаций в связанном с CF гене (http://www.genet.sickkids.on.ca/cftr/). Самой широко распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности CFTR, и ее обычно называют F508-CFTR. Эта мутация встречается приблизительно в 70% случаев муковисцидоза и связана с тяжелым заболеванием. Делеция остатка 508 в F508-CFTR препятствует правильной укладке возникающего белка. Это приводит к неспособности мутантного белка к выходу из эндоплазматического ретикулума и перемещению в плазматическую мембрану. В результате, количество каналов, присутствующих в мембране, зна-1 018891 чительно меньше количества каналов, наблюдаемого в клетках, экспрессирующих CFTR дикого типа. В дополнение к нарушенному перемещению, мутация приводит к неполному открытию каналов. Вместе уменьшенное количество каналов в мембране и неполное открытие приводят к снижению транспорта анионов через эпителий, приводя к нарушенному транспорту ионов и жидкости (Quinton, P.M. (1990),FASEB. J. 4:2709-2727). Однако исследования показали, что уменьшенное количество F508-CFTR в мембране является функциональным, хотя и в меньшей степени, чем в случае CFTR дикого типаBiochem. 270:12347-12350). В дополнение к F508-CFTR, экспрессия R117H-CFTR и G551D-CFTR, других вызывающих заболевание мутаций в CFTR, которые приводят к нарушенному перемещению, синтезу и/или открытию каналов, может быть увеличена или уменьшена с изменением секреции анионов и изменением прогрессирования и/или тяжести заболевания. Хотя CFTR транспортирует множество молекул, помимо анионов, очевидно, что его роль (транспорт анионов, хлора и бикарбоната) представляет один элемент в важном механизме транспортировки ионов и воды через эпителий. Другие элементы включают эпителиальные Na+-каналы, ENaC,Na+/2Cl-/K+-котранспортер, Na+-K+-АТФазный насос и K+-каналы базолатеральной части мембраны, которые ответственны за включение иона хлора в клетку. Эти элементы работают вместе для достижения направленного транспорта через эпителий благодаря их избирательной экспрессии и локализации в клетке. Поглощение иона хлора происходит в результате согласованного действия ENaC и CFTR, которые присутствуют в апикальной части мембраны, иNa+-K+-АТФазного насоса и Cl-каналов, представленных на базолатеральной поверхности клетки. Дополнительный активный транспорт иона хлора со стороны просвета приводит к накоплению внутриклеточного иона хлора, который может затем пассивно покидать клетку через С 1 ионные каналы, что приводит к направленному транспорту. Расположение Na+/2Cl-/K+-котранспортера, Na+-K+-АТФазного насоса и K+-каналов базолатеральной части мембраны на базолатеральной поверхности мембраны и CFTR со стороны просвета координирует секрецию иона хлора через посредство CFTR со стороны просвета. Поскольку вода, видимо, никогда сама активно не транспортируется, ее поток через эпителиальные ткани зависит от небольших трансэпителиальных осмотических градиентов, создаваемых массовым передвижением натрия и хлора. Сделано предположение, что нарушенный транспорт бикарбоната вследствие мутаций в CFTR является причиной нарушений определенных секреторных функций. См., например, "Cystic fibrosis:impaired bicarbonate secretion and mucoviscidosis", Paul M. Quinton, Lancet. 2008; 372:415-417. Мутации в CFTR, которые связаны с умеренной дисфункцией CFTR, также выражены у пациентов с состояниями, которые имеют определенные проявления заболеваний, одинаковые с состояниями приCF, но не удовлетворяют диагностическим критериям в отношении CF. Такие состояния включают врожденное двустороннее отсутствие семявыводящих протоков, идиопатический хронический панкреатит,хронический бронхит и хронический риносинусит. Другие заболевания, при которых мутантный CFTR,как полагают, является фактором риска наряду с генами-модификаторами или факторами окружающей среды, включают первичный склерозирующий холангит, аллергический бронхолегочный аспергиллез и астму. Также было установлено, что сигаретный дым, гипоксия и факторы окружающей среды, которые индуцируют сигнализацию о гипоксии, ухудшают функцию CFTR и могут вносить вклад в определенные формы респираторного заболевания, такие как хронический бронхит. Заболевания, которые могут быть обусловлены нарушенной функцией CFTR, но не удовлетворяют диагностическим критериям в отношении CF, определяют как CFTR-родственные заболевания. Помимо муковисцидоза, модулирование активности CFTR может помочь в случае других заболеваний, не вызванных непосредственно мутациями в CFTR, таких как связанные с нарушением секреции заболевания и другие, связанные с нарушением укладки белков заболевания, опосредованные CFTR.CFTR регулирует поток ионов хлора и бикарбоната через эпителиальные ткани из многих клеток для контролирования движения жидкости, растворимости белков, вязкости слизи и активности ферментов. Дефекты в CFTR могут являться причиной закупоривания дыхательных путей или протоков многих органов, включая печень и поджелудочную железу. Усилителями являются соединения, которые усиливают открывающую активность CFTR, присутствующего в клеточной мембране. Любое заболевание, в которое вовлечено сгущение слизи, нарушение регуляции жидкости, нарушение выведения слизи или закупорка протоков, которые приводят к воспалению и разрушению ткани, может быть кандидатом на лечение усилителями. Они включают, но не ограничиваясь ими, хроническое обструктивное заболевание легких (COPD),астму, вызванное курением COPD, хронический бронхит, риносинусит, запор, сухость глаз и синдром Шегрена, желудочно-пищеводный рефлюкс, желчные конкременты, пролапс прямой кишки и воспалительное заболевание кишечника. COPD характеризуется ограничением воздушного потока, которое является прогрессирующим и неполностью обратимым. Ограничение воздушного потока обусловлено повышенной секрецией слизи, эмфиземой и бронхиолитом. Активаторы мутантного CFTR или CFTR дико-2 018891 го типа могут предложить возможное лечение повышенной секреции слизи и нарушенного выведения реснитчатым эпителием, которое является частым при COPD. В частности, увеличение секреции анионов через CFTR может способствовать перемещению жидкости в жидкий слой на поверхности дыхательных путей для гидратирования слизи и оптимизации вязкости перицилиарной жидкости. Это может привести к увеличению выведения реснитчатым эпителием и ослаблению симптомов, связанных с COPD. Кроме того, посредством предотвращения происходящей инфекции и воспаления благодаря улучшению очистки дыхательных путей модуляторы CFTR могут предотвращать или замедлять разрушение паренхимы дыхательных путей, которое служит отличительным признаком эмфиземы, и уменьшать или реверсировать увеличение количества секретирующих слизь клеток и размер, при котором повышенная секреция слизи недостаточно разлагается, при заболеваниях дыхательных путей. Сухость глаз характеризуется уменьшением продукции слезной жидкости и аномальными профилями липидов, белков и муцина в слезной пленке. Есть много причин сухости глаз, некоторые из которых включают возраст, лазерную коррекцию зрения методом ЛАСИК, артрит, лекарственные средства, химические/термические ожоги,аллергии и такие заболевания, как муковисцидоз и синдром Шегрена. Увеличение секреции анионов через CFTR может повысить транспорт жидкости из эндотелиальных клеток роговицы и секреторных желез, окружающих глаз, для увеличения гидратации роговицы. Это может помочь в ослаблении симптомов, связанных с сухостью глаз. Синдром Шегрена является аутоиммунным заболеванием, при котором иммунная система атакует создающие влажность железы по всему организму, включая глаз, рот, кожу,ткань дыхательных путей, печень, влагалище и кишечник. Симптомы включают сухость глаз, рта и влагалища, а также заболевание легких. Заболевание также сопровождается ревматоидным артритом, системной красной волчанкой, системной склеродермией и полимипозитом/дерматомиозитом. Полагают,что нарушенное, осуществляемое белком перемещение является причиной заболевания, для лечения которого возможности ограничены. Модуляторы активности CFTR могут увлажнять различные органы,пораженные заболеванием, и могут помочь ослабить связанные с ним симптомы. Индивидуумы с муковисцидозом имеют повторяющиеся эпизоды кишечной непроходимости и более высокие частоты выпадения прямой кишки, желчных конкрементов, желудочно-пищеводного рефлюкса, желудочно-кишечных злокачественных новообразований и воспалительного заболевания кишечника, что означает, что функции CFTR могут играть важную роль в предотвращении таких заболеваний. Как обсуждалось выше, считается, что делеция остатка 508 в F508-CFTR препятствует правильной укладке возникающего белка, приводя к неспособности такого мутантного белка к выходу из эндоплазматического ретикулума и перемещению в плазматическую мембрану. В результате, в плазматической мембране присутствуют недостаточные количества зрелого белка, и транспорт иона хлора в эпителиальных тканях значительно снижается. Между прочим, было показано, что такой клеточный процесс нарушенного процессирования CFTR эндоплазматической сетью лежит в основе не только заболевания CF,но и широкого круга других отдельных и наследственных заболеваний. Два возможных образа неправильной работы эндоплазматической сети имеют место либо при утрате связи с экспортом белков из эндоплазматического ретикулума, приводящей к их деструкции, либо при накоплении этих дефектных/неправильно уложенных белков в эндоплазматическом ретикулуме [Aridor M., et al., Nature Med.,5(7), p. 745-751 (1999); Shastry, B.S., et al., Neurochem. International, 43, p. 1-7 (2003); Rutishauser, J., et al.,Swiss Med. Wkly, 132, p. 211-222 (2002); Morello, J.P. et al. TIPS, 21, p. 466-469 (2000); Bross P., et al.,Human Mut, 14, p. 186-198 (1999)]. Заболеваниями, связанными с первым классом неправильной работы эндоплазматического ретикулума, являются муковисцидоз (из-за неправильно уложенного F508-CFTR,обсуждавшегося выше), наследственная эмфизема (из-за 1-антитрипсина; не вариантов PiZ), наследственный гемохроматоз, дефекты коагуляции-фибринолизиса, такие как дефицит белка С, наследственная болезнь Квинке типа 1, дефекты процессирования липидов, такие как семейная гиперхолестеринемия,хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезньI-клеток/псевдо-Гурлера, мукополисахаридозы (из-за лизосомального процессирования ферментов), болезнь Сандхоф/Тея-Сакса (из-за -гексозаминазы), болезнь Криглер-Наджара типа II (из-за УДФглюкуронилтрансферазы), полиэндокринопатия/гиперинсулинемия, сахарный диабет (из-за рецептора инсулина), карликовость Ларона (из-за рецептора гормона роста), дефицит миеопероксидазы, первичный гипопаратиреоз (из-за препропаратиреоидного гормона), меланома (из-за тирозиназы). Заболеваниями,связанными с последним из двух названных классов неправильной работы эндоплазматического ретикулума, являются гликаноз CDG типа 1, наследственная эмфизема (из-за l-антитрипсина (варианта PiZ вариант), врожденный гипертиреоз, остеопсатироз (из-за проколлагена типа I, II, IV), наследственная гипофибриногенемия (из-за фибриногена), дефицит альфа 1-антихимотрипсина (ACT) (из-за 1-антихимотрипсина), несахарный диабет (DI), нейрогенный DI (из-за гормона вазопрессина/V2 рецептора), нефрогенный DI (из-за аквапорина II), синдром Шарко-Мари-Тута (из-за периферического миелинового белка 22), болезнь Перлицеуса-Мерцбахера; нейродегенеративные заболевания, такие как болезнь Альцгеймера (из-за АРР и пресенилинов), болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика, несколько полиглутаминовых неврологических расстройств, таких как, болезнь Хантингтона, спиномозжечковая атаксия типа I, спинальная и бульбарная мышечная атрофия, денторубропаллидолюисова атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессирования прионных белков), болезнь Фабри (из-за лизосомальной -галактозидазы А), синдром Страусслера-Шейнкера (из-за дефекта в процессировании Prp), бесплодие и панкреатит, недостаточность поджелудочной железы, остеопороз, остеопения, синдром Горэма, нарушения каналов для ионов хлора,врожденная миотония (формы Томсена и Беккера), синдром Бартера типа III, болезнь Дента, стартовая болезнь, эпилепсия, лизосомальные болезни хранения, синдром Ангельмана, первичная цилиарная дискинезия (PCD), PCD с обратным расположением внутренних органов (также известная как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарной аплазии и заболевание печени. Другие заболевания, которые влечет за собой мутация в CFTR, включают мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыносящих протоков (CBAVD), заболевание легких легкой степени, идиопатический панкреатит и аллергический бронхолегочный аспергиллез (АВРА). См., "CFTR-opathies: disease phenotypes associated with cystic fibrosis transmembrane regulator genemutations", Peader G. Noone and Michael R. Knowles, Respir. Res. 2001, 2:328-332 (включенный в данное описание посредством ссылки). Помимо увеличения активности CFTR, снижение секреции анионов под действием модуляторовCFTR может быть полезным для лечения секреторных диарей, при которых транспорт воды из эпителия резко увеличивается в результате активированного средством, усиливающим секрецию, транспорта иона хлора. Механизм включает повышение цАМФ и стимулирование CFTR. Хотя существует множество причин диареи, основные последствия диарейных заболеваний, являющихся следствием чрезмерного транспорта иона хлора, являются общими для всех и включают обезвоживание, ацидоз, нарушение роста и смерть. Острые и хронические диареи представляют основную медицинскую проблему во многих регионах мира. Диарея является и важным фактором в недоедании, и ведущей причиной смерти (5 миллионов случаев смерти в год) у детей младше 5 лет. Секреторные диареи также являются опасным состоянием у пациентов с синдромом приобретенного иммунодефицита (СПИД) и хроническим воспалительным заболеванием кишечника (IBD). Каждый год у 16 миллионов туристов из промышленно развитых стран, приезжающих в развивающиеся страны,развивается диарея, при этом тяжесть и число случаев диареи меняются в зависимости от страны и района путешествия. Соответственно, существует потребность в мощных и избирательных усилителях CFTR: форм дикого типа и мутантных форм CFTR человека. Эти мутантные формы включают, но без ограничения,F508del, G551D, R117H, 2789+5GA. Существует потребность в модуляторах активности CFTR и их композициях, которые могут быть использованы для модулирования активности CFTR в мембране клетки млекопитающего. Существует потребность в способах лечения заболеваний, вызванных мутацией в CFTR, с использованием таких модуляторов активности CFTR. Существует потребность в способах модулирования активности CFTR в мембране клетки млекопитающего ex vivo. Краткое описание сущности изобретения В настоящее время обнаружено, что соединения настоящего изобретения и их фармацевтически приемлемые композиции могут быть использованы в качестве модуляторов активности CFTR. Соединения имеют общую формулу (I) или их фармацевтически приемлемые соли,где R1, R2, R3 и A описаны в общем и по классам и подклассам ниже. Данные соединения и фармацевтически приемлемые композиции могут быть использованы при лечении или ослаблении тяжести ряда заболеваний, нарушений или состояний, связанных с мутациями в Подробное описание изобретения Общее описание соединений настоящего изобретения Настоящее изобретение относится к соединениям формулы (I), полезным в качестве модуляторов активности CFTR: или их фармацевтически приемлемым солям,где кольцо A выбирают изR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом. Соединения и определения Соединения настоящего изобретения включают соединения, описанные в общем выше, и дополнительно проиллюстрированы классами, подклассами и типами, описанными в данном изобретении. Как использовано в данном описании, кроме случаев, указывающих иное, следует применять следующие определения. Как использовано в данном описании, термин "АВС-транспортер" означает белок ABC-транспортер или его фрагмент, включающий по меньшей мере один сайт связывания, причем указанный белок или его фрагмент присутствует in vivo или in vitro. Как использовано в данном описании, термин "домен связывания" означает домен ABC-транспортера, который может связываться с модулятором. См., например,Hwang, Т.С. et al., J. Gen. Physiol. (1998), 111(3), 477-90. Как использовано в данном описании, термин "CFTR" означает регулятор трансмембранной проводимости при муковисцидозе или проводимости с мутацией, способный к регуляции активности, включающий, но без ограничения, F508 CFTR, R117H CFTR и G551D CFTR (см., например,http://www.genet.sickkids.on.ca/cftr/, ради мутаций в CFTR). Как использовано в данном описании, термин "модулирование" означает увеличение или уменьшение измеряемого количества. Как использовано в данном описании, термин "нормальный CFTR" или "нормальная функцияCFTR" означает CFTR подобно дикому типу без какого-либо ухудшения вследствие факторов окружающей среды, таких как курение, загрязнение или что-либо, что вызывает воспаление в легких. Как использовано в данном описании, термин "ослабленный CFTR" или "ослабленная функцияCFTR. Для целей настоящего изобретения химические элементы определены в соответствии с периодической таблицей элементов, вариантом CAS, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в "Organic Chemistry, Thomas Sorrell, University Science Books,Sausalito: 1999 и "March's Advanced Organic Chemistry, 5th Ed., Ed.: Smith, M.B. and March, J., John WileySons, New York: 2001, полное содержание которых включено, тем самым, посредством ссылки. Комбинированными заместителями, предусматриваемыми настоящим изобретением, предпочтительно являются такие, которые приводят к образованию стабильных или химически возможных соединений. Как использовано в данном описании, термин "стабильные" относится к соединениям, которые не изменяются в значительной степени после подвергания условиям, делающим возможным их получение,выявление и предпочтительно их выделение, очистку и использование с одной или несколькими целями,описываемыми в данном изобретении. В некоторых вариантах осуществления стабильное соединение или химически возможное соединение представляет собой соединение, которое не изменяется в значительной степени после хранения при температуре, составляющей 40C или меньше, в отсутствие влаги или других химически активных условий, в течение по меньшей мере недели. Как использовано в данном описании, термин "защитная группа" относится к агенту, используемому временно для блокирования одного или нескольких желаемых реакционноспособных сайтов в многофункциональном соединении. В определенных вариантах осуществления защитная группа облает одним или несколькими, или предпочтительно всеми, из следующих свойств: а) взаимодействует избирательно с хорошим выходом с получением защищенного вещества, которое является устойчивым к реакциям,имеющим место в одном или нескольких других реакционноспособных сайтах; и b) является избира-5 018891 тельно удаляемой с хорошим выходом реагентами, которые не разрушают восстановленную функциональную группу. Примеры защитных группы подробно представлены в Greene, T.W., Wuts, P.G. в "Protective Groups in Organic Synthesis", Third Edition, John WileySons, New York: 1999 и других изданиях этой книги, полное содержание которых включено, тем самым, посредством ссылки. Если не указано иное, подразумевается, что представленные в данном описании структуры также включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные формы структуры", например R- и S-конфигурации для каждого асимметричного центра,(Z)- и (Е)-изомеры относительно двойной связи и (Z)- и (Е)-конформационные изомеры. Следовательно,единичные стереохимические изомеры, а также смеси энантиомерных, диастереомерных и геометрических (или конформационных) форм соединений настоящего изобретения входят в объем настоящего изобретения. Если не указано иное, все таутомерные формы соединений настоящего изобретения входят в объем настоящего изобретения, например, соединения формулы (I) могут существовать в виде таутомеров: Кроме того, если не указано иное, также подразумевается, что представленные в данном описании структуры также включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие представленные структуры, исключая замену водорода дейтерием или тритием или замену углерода обогащенным 13 С или 14 С углеродом, входят в объем настоящего изобретения. Такие соединения могут быть использованы, например, в качестве аналитических средств или зондов в биологических анализах. Такие соединения, особенно соединения, которые содержат атомы дейтерия, могут проявлять модифицированные метаболические свойства. Описание приводимых в качестве примеров соединений Настоящее изобретение предоставляет соединение формулы (I) или его фармацевтически приемлемые соли,где кольцо A выбирают изR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом. В одном варианте осуществления кольцо A представляет собой В одном варианте осуществления кольцо A представляет собой В другом варианте осуществления кольцо A представляет собой В еще одном варианте осуществления кольцо A представляет собой В одном варианте осуществления R1 представляет собой -CF3.-6 018891 В другом варианте осуществления R1 представляет собой -CN. В другом варианте осуществленияR представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R2 представляет собой -CH3. В другом варианте осуществления R2 представляет собой -CF3. В другом варианте осуществления R2 представляет собой -OH. В другом варианте осуществления R2 представляет собой -CH2OH. В одном варианте осуществления R3 представляет собой -CH3. В одном варианте осуществления R3 представляет собой -OCH3. В другом варианте осуществления R3 представляет собой -CN. В одном варианте осуществления R2 представляет собой водород и R3 представляет собой -CH3,-OCH3 или -CN. В другом варианте осуществления R2 представляет собой -CH3, -CF3, -OH или -CH2OH и R3 представляет собой водород. В нескольких вариантах осуществления настоящего изобретения 1R2 представляет собой водород иR3 представляет собой -CH3, -OCH3 или -CN. В других вариантах осуществления R1 представляет собой -CN. В других вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R3 представляет собой -CH3 или R3 представляет собой -OCH3,или R3 представляет собой -CN. В нескольких вариантах осуществления настоящего изобретения кольцо A представляет собойR3 представляет собой водород. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R2 представляет собой -CH3, или R2 представляет собой -CF3, или 2R представляет собой -OH, или R2 представляет собой -CH2OH. В нескольких вариантах осуществления настоящего изобретения кольцо A представляет собойR2 представляет собой водород иR3 представляет собой -CH3, -OCH3 или -CN. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R3 представляет собой -OCH3, или R3 представляет собой -CH3,или R3 представляет собой -CN. В следующих вариантах осуществления настоящего изобретения кольцо A представляет собойR3 представляет собой водород. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R2 представляет собой -CH3, или R2 представляет собой -CF3, или 2R представляет собой -OH, или R2 представляет собой -CH2OH. В нескольких вариантах осуществления настоящего изобретенияR2 представляет собой водород иR3 представляет собой -CH3, -OCH3 или -CN. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R3 представляет собой -CH3, или R3 представляет собой -OCH3,или R3 представляет собой -CN. В следующих вариантах осуществления настоящего изобретенияR3 представляет собой водород. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R2 представляет собой -CH3, или R2 представляет собой -CF3, или 2R представляет собой -OH, или R2 представляет собой -CH2OH. В следующих вариантах осуществления настоящего изобретения кольцо A представляет собойR2 представляет собой водород иR3 представляет собой -CH3, -OCH3 или -CN. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R3 представляет собой -CH3, или R3 представляет -OCH3, или R3 представляет собой -CN. В следующих вариантах осуществления настоящего изобретения кольцо A представляет собойR3 представляет собой водород. В других вариантах осуществления R1 представляет собой -CN. В еще дополнительных вариантах осуществления R1 представляет собой -CCCH2N(CH3)2. В одном варианте осуществления R2 представляет собой -CH3, или R2 представляет собой -CF3, или 2R представляет собой -OH, или R2 представляет собой -CH2OH. Примеры соединения настоящего изобретения представлены в табл. 1. Общие схемы синтеза Соединения настоящего изобретения легко получить с помощью способов, известных в данной области и представленных на схемах 1-3. Схема 1 Получение соединений формулы (I)b) Даутерм или дифениловый эфир, кипячение с обратным холодильником, атмосфера N2; с) удаление блокирующей галогеновой (например, -Cl) группы в случае ее присутствия, Pd/C, H2,EtOH;d) удаление защитной группы R щелочью или кислотой; е) CH3CN, Et3N, нагревание;g) HATU, Et3N, ДМФА или циклический ангидрид пропилфосфокислоты (Т 3 Р), пиридин,2-метилтетрагидрофуран. На схеме 1 представлен конвергентный подход к получению соединений формулы (I) из замещенных бензольных производных 1 а и 2 а. В конечном преобразовании образование амида через сочетание карбоновой кислоты 1d с амином 2 с с получением соединения формулы (I) может быть достигнуто при использовании либо гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) и триэтиламина в N,N-диметилформамиде (ДМФА), либо циклического ангидрида пропилфосфокислоты(T3P) и пиридина в 2-метилтетрагидрофуране. Карбоновую кислоту 1d получают из соответствующего замещенного бензольного производного 1 а путем проведения последовательности реакций с инициированной нагреванием конденсации соединения 1 а с подходящим малонатом (CO2R)2CH=CH(OR), где R представляет собой алкильную группу, такую как метил, этил или т.п., с получением соединения 1b. Соединение 1b преобразовывают в карбоновую кислоту 1d посредством трехстадийной последовательности реакций, включающей внутримолекулярную циклизацию при нагревании при кипячении с обратным холодильником в Даутерме или дифениловом эфире (стадия b), с последующим удалением(если требуется) блокирующей галогеновой группы (стадия с) в условиях катализируемого палладием дегалогенирования и катализируемого кислотой или щелочью омыления (стадия d). Порядок стадий снятия защитной группы и омыления может быть обратным, т.е. стадия с может иметь место до или после стадии d, как представлено на схеме 1. Снова обращаясь к схеме 1, аминобензольное производное 2 с можно получить из нитробензола 2 а посредством трехстадийной последовательности реакций. Таким образом, сочетание нитробензола 2 а с циклическим амином 3, как определено в данном описании, в присутствии триэтиламина дает соединение 2b. Катализируемое палладием восстановление 2b обеспечивает амин 2 с. Схема 2 Получение соединений формулы (I)d) HATU, Et3N, ДМФА или циклический ангидрид пропилфосфокислоты (T3P), пиридин,2-метилтетрагидрофуран. На схеме 2 представлен синтез соединений формулы (I), несущих боковую цепь - пропиламин. Таким образом, сочетание нитробензола 2 а, где Hal представляет собой бром, хлор или т.п., с 3, как определено в данном описании, в присутствии карбоната калия в ДМСО дает соединение 4. Катализируемое палладием сочетание соединения 4 с N,N-диметилпроп-2-ин-1-амином с последующим катализируемым железом или цинком восстановлением нитрогруппы дает амин 5. Сочетание амина 5 с карбоновой кислотой 1d обеспечивает соединение 6, которое является соединением формулы (I). Схема 3 Получение соединений формулы (I), где R представляет собой Н или OHd) HATU, Et3N, ДМФА или циклический ангидрид пропилфосфокислоты (T3P), пиридин,2-метилтетрагидрофуран; е) снятие PG, например HCl, EtOH. РС=защитная группа; Х=уходящая группа. На схеме 3 представлен синтез соединения формулы (I), где 3 представляет собой 7-азабицикло[2.2.1]гептан, необязательно несущий гидроксильную группу в экзо- или эндоположении - положение 2. Гидроксизамещенные аддукты (+)-эндо-7-азабицикло[2.2.1]гептан-2-ол,(-)-эндо-7-азабицикло[2.2.1]гептан-2-ол, (+)-экзо-7-азабицикло[2.2.1]гептан-2-ол и (-)-экзо-7-азабицикло[2.2.1]гептан-2-ол можно получить, используя методики, описанные в Fletcher, S.R. et al., "Total(1994). Сам по себе 7-азабицикло[2.2.1]гептан коммерчески доступен от Tyger Scientific Inc. 324 StokesAvenue Ewing, NJ, 08638 США. Таким образом, как и при использовании ряда преобразований, суммированных на схемах 1 и 2, сочетание соединения 2 а с бицикло[2.2.1]амином 7 обеспечивает соединение 8. Если в соединении 8 присутствует гидроксильная группа, может быть необходимой защита гидроксильной группы защитной группой до осуществления последующих преобразований. Таким образом, обработка соединения 8 третбутилдиметилсилилхлоридом с использованием известных условий обеспечивает защищенное соединение 9 до осуществления восстановления нитрогруппы с получением амина 10. Образование амида с использованием соединения 1d (см. схему 3) и удаление гидроксизащитной группы (при необходимости) обеспечивает соединение 11, которое является соединением формулы (I). Применения, составление композиций и введение. Фармацевтически приемлемые композиции. В одном аспекте настоящего изобретения предоставлены фармацевтически приемлемые композиции, которые содержат любое из соединений, раскрытых в настоящем изобретении, и необязательно содержат фармацевтически приемлемый носитель, адъювант или среду. В определенных вариантах осуществления данные композиции необязательно дополнительно включают одно или несколько дополнительных терапевтических средств. Также следует понимать, что некоторые из соединений настоящего изобретения могут находиться в свободной форме для лечения или, при необходимости, в виде фармацевтически приемлемого производного или его пролекарства. Согласно настоящему изобретению фармацевтически приемлемое производное или пролекарство включает, но без ограничения, фармацевтически приемлемые соли, сложные эфиры, соли таких эфиров или любой другой аддукт или производное, который(ое) после введения нуждающемуся в этом пациенту способен обеспечить, прямо или косвенно, соединение, описанное в данном изобретении в других случаях, или его метаболит, или остаток. Как использовано в данном описании, термин "фармацевтически приемлемая соль" относится к таким солям, которые, по результатам тщательной медицинской оценки, подходят для применения для приведения в контакт с тканями людей и низших животных без чрезмерной токсичности, раздражения,аллергической реакции и т.п. и находятся в соответствии с приемлемым соотношением польза/риск. Под"фармацевтически приемлемой солью" подразумевается любая нетоксичная соль или соль эфира соединения настоящего изобретения, которая, после введения реципиенту, способна обеспечить, прямо или косвенно, соединение настоящего изобретения или его активный в отношении ингибирования метаболит или остаток. Фармацевтически приемлемые соли хорошо известны в данной области техники. Например,S.M. Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences,1977, 66, 1-19, который включен в данное описание посредством ссылки. Фармацевтически приемлемые соли соединений настоящего изобретения включают такие, которые получают на основе подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли, образованные аминогруппой с неорганическими кислотами, такими как хлористо-водородная, бромисто-водородная, фосфорная, серная и хлорная кислоты,или с органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, лимонная, янтарная кислота или малоновая кислота, или при использования других методов, используемых в данной области техники, таких как ионообмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, эдизилат (этандисульфонат), этансульфонат, формат, фумарат,глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид,2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат,тиоцианат, паратолуолсульфонат, ундеканоат, валерат и т.п. Соли, полученные на основе подходящих оснований, включают соли щелочных металлов, щелочно-земельных металлов, аммония иN+(С 1-4 алкил)4. В настоящем изобретении также предусматривается образование четвертичных оснований на основе любых основных азотсодержащих групп соединений, раскрытых в настоящем изобретении. С помощью такого образования четвертичных оснований можно получить растворимые в воде или масле или диспергируемые продукты. Репрезентативные соли щелочных или щелочно-земельных металлов включают натрий, литий, калий, кальций, магний и т.п. Дополнительные фармацевтически приемлемые соли включает, при необходимости, нетоксичные катионы аммония, четвертичного аммония и амина, образуемые с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат,фосфат, нитрат, (низший алкил)сульфонат и арилсульфонат. Как описано выше, фармацевтически приемлемые композиции настоящего изобретения, кроме того, содержат фармацевтически приемлемый носитель, адъювант или среду, которые, как использовано в данном описании, включают любой и все растворители, разбавители или любую другую жидкую среду,диспергирующие или суспендирующие средства, поверхностно-активные вещества, агенты для придания изотоничности, загустители или эмульгаторы, консерванты, твердые связующие вещества, лубриканты и т.п., подходящие для конкретной желаемой дозированной формы. В Remington's Pharmaceutical Sciences,Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны различные носители, используемые при составлении фармацевтически приемлемых композиций, и известные способы их получения. Кроме случаев, когда какая-либо общепринятая среда-носитель несовместима с соединениями настоящего изобретения, например в результате вызова любого нежелательного биологического эффекта или иного отрицательного взаимодействия с каким-либо другим соединением(ями) фармацевтически приемлемой композиции, ее применение, как предусматривается, входит в объем настоящего изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но не ограничиваются ими, ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферирующие вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, неполные глицеридные смеси растительных насыщенных жирных кислот, воды, солей или электролитов, таких как протаминсульфат,динатрийгидрофосфат, калийгидрофосфат, хлорид натрия, соли цинка, коллоидный диоксид кремния,трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок-сополимеры полиэтиленполиоксипропилена, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразную трагакантовую камедь; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое, хлопковое, сафлоровое, кунжутное, оливковое, кукурузное и соевое масло; гликоли, такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферирующие агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор; раствор Рингера; этиловый спирт и забуференные фосфатом растворы, а также другие нетоксичные совместимые лубриканты, такие как лаурилсульфат натрия и стеарат магния, а также красящие агенты, разделяющие средства, покрывающие вещества, подсластители, корригенты и ароматизирующие агенты, консерванты и антиоксиданты могут также присутствовать в композиции, согласно оценке разработчика составления композиций. Применения соединений и фармацевтически приемлемых композиций. В еще одном аспекте настоящее изобретение предоставляет способ лечения или ослабления тяжести состояния, заболевания или нарушения, в которое вовлечена мутация в CFTR. В определенных вариантах осуществления настоящее изобретение обеспечивает способ лечения состояния, заболевания или нарушения, в которое вовлечена недостаточность активности CFTR, включающий введение композиции,содержащей соединение формулы (I), нуждающемуся в этом субъекту, предпочтительно млекопитающему. В определенных вариантах осуществления настоящее изобретение предоставляет способ лечения заболеваний, связанных с ослаблением функции CFTR вследствие мутаций в гене, кодирующем CFTR,или факторов окружающей среды (например, дыма). Такие заболевания включают муковисцидоз, хронический бронхит, рецидивирующий бронхит, острый бронхит, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыводящих протоков (CBAVD), женское бесплодие, вызванное врожденным отсутствием матки и влагалища (CAUV), идиопатический хронический панкреатит (ICP),идиопатический рецидивирующий панкреатит, идиопатический острый панкреатит, хронический риносинусит, первичный склерозирующий холангит, аллергический бронхолегочный аспергиллез, диабет,сухость глаз, запор, аллергический бронхолегочный аспергиллез (АВРА), костные заболевания (например, остеопороз) и астму. В определенных вариантах осуществления настоящее изобретение предоставляет способ лечения заболеваний, связанных с нормальной функцией CFTR. Такие заболевания включают хроническое обструктивное заболевание легких (COPD), хронический бронхит, рецидивирующий бронхит, острый бронхит, риносинусит, запор, панкреатит, включая хронический панкреатит, рецидивирующий панкреа- 13018891 тит и острый панкреатит, недостаточность поджелудочной железы, мужское бесплодие, вызванное врожденным двусторонним отсутствием семявыводящих протоков (CBAVD), заболевание легких легкой степени, идиопатический панкреатит, заболевание печени, наследственную эмфизему, желчные конкременты, желудочно-пищеводный рефлюкс, желудочно-кишечные злокачественные новообразования, воспалительное заболевание кишечника, запор, диабет, артрит, остеопороз и остеопению. В определенных вариантах осуществления настоящее изобретение предоставляет способ лечения заболеваний, связанных с нормальной функцией CFTR, включающих наследственный гемохроматоз,дефекты коагуляции-фибринолизиса, такие как дефицит белка С, наследственную болезнь Квинке типа 1, дефекты процессирования липидов, такие как семейная гиперхолестеринемия, хиломикронемия типа 1, абеталипопротеинемия, лизосомальные болезни накопления, такие как болезнь I-клеток/псевдоГурлера, мукополисахаридозы, болезнь Сандхоф/Тея-Сакса, болезнь Криглер-Наджара типа II, полиэндокринопатию/гиперинсулинемию, сахарный диабет, карликовость Ларона, дефицит миеопероксидазы,первичный гипопаратиреоз, меланому, гликаноз CDG типа 1, врожденный гипертиреоз, остеопсатироз,наследственную гипофибриногенемию, дефицит альфа 1-антихимотрипсина (ACT), несахарный диабет(DI), нейрогенный DI, нефрогенный DI, синдром Шарко-Мари-Тута, болезнь Перлицеуса-Мерцбахера,нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика, несколько полиглутаминовых неврологических расстройств, таких как болезнь Хантингтона, спиномозжечковая атаксия типа I,спинальная и бульбарная мышечная атрофия, денторубропаллидолюисова атрофия и миотоническая дистрофия, а также губчатые энцефалопатии, такие как наследственная болезнь Крейтцфельдта-Якоба (из-за дефекта процессирования прионных белков), болезнь Фабри, синдром Страусслера-Шейнкера, синдром Горэма, нарушения каналов для ионов хлора, врожденную миотонию (формы Томсена и Беккера), синдром Бартера типа III, болезнь Дента, стартовую болезнь, эпилепсию, лизосомальную болезнь хранения,синдром Ангельмана, первичную цилиарную дискинезию (PCD), PCD с обратным расположением внутренних органов (также известную как синдром Картагенера), PCD без обратного расположения внутренних органов и цилиарной аплазии или болезнь Шегрена, включающий стадию введения указанному млекопитающему эффективного количества композиции, содержащей соединение настоящего изобретения. В соответствии с альтернативным предпочтительным вариантом осуществления настоящее изобретение предоставляет способ лечения муковисцидоза, включающий стадию введения указанному млекопитающему эффективного количества композиции, содержащей соединение настоящего изобретения. В соответствии с настоящим изобретением "эффективным количеством" соединения или фармацевтически приемлемой композиции является такое количество, которое является эффективным для лечения или ослабления тяжести одного или несколько заболеваний, нарушений или состояний, приведенных выше. Соединения и композиции согласно способу настоящего изобретения можно вводить с использованием любого количества и любого пути введения, которые являются эффективными для лечения или ослабления тяжести одного или нескольких заболеваний, нарушений или состояний, приведенных выше. В определенных вариантах осуществления соединения и композиции настоящего изобретения полезны при лечении или ослаблении тяжести муковисцидоза у пациентов, у которых демонстрируется остаточная активность CFTR в апикальной мембране эпителиальных клеток дыхательных путей и недыхательных путей. Присутствие остаточной активности CFTR на эпителиальной поверхности можно легко выявить, используя известные в данной области методы, например стандартные электрофизиологические, биохимические или гистохимические методы. В таких методах активность CFTR распознают с использованием in vivo или ex vivo электрофизиологических методов, измерения концентраций Cl- в поте или слюне или ex vivo биохимических или гистохимических методов для проверки плотности CFTR на клеточной поверхности. Используя такие методы, можно легко определить остаточную активность CFTR у пациентов, гетерозиготных или гомозиготных по ряду различных мутаций, включая пациентов, гомозиготных или гетерозиготных по самой часто встречающейся мутации, F508. В другом варианте осуществления соединения и композиции настоящего изобретения полезны при лечении или ослаблении тяжести муковисцидоза у пациентов, у которых имеется остаточная активностьCFTR, индуцированная или увеличенная с использованием фармакологических способов или генной терапии. Такие способы увеличивают количество CFTR, присутствующего на клеточной поверхности, тем самым индуцируя прежде отсутствующую активность CFTR у пациента или увеличивая существующий уровень остаточной активности CFTR у пациента. В одном варианте осуществления соединения и композиции настоящего изобретения полезны при лечении или ослаблении тяжести муковисцидоза у пациентов в рамках определенных генотипов, демонстрирующих остаточную активность CFTR, например, с мутациями класса III (с нарушением регуляции или открывания), мутациями класса IV (с изменением проводимости) или мутациями класса V (с уменьшением синтеза) (Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV and V cystic fibrosisCFTR, включают пациентов, гомозиготных по одному из этих классов или гетерозиготных с любым дру- 14018891 гим классом мутаций, включая мутации класса I, мутации класса II или мутацию, которая не классифицирована. В одном варианте осуществления соединения и композиции настоящего изобретения полезны при лечении или ослаблении тяжести муковисцидоза у пациентов в рамках определенных клинических фенотипов, например, с умеренно-слабым клиническим фенотипом, который обычно находится в связи с количеством остаточной активности CFTR в апикальной мембране эпителиальных клеток. Такие фенотипы включают пациентов, демонстрирующих недостаточность поджелудочной железы, или пациентов, у которых диагностирован идиопатический панкреатит и врожденное двустороннее отсутствие семявыводящих протоков, или с заболеванием легких легкой степени. Точно требуемое количество будет меняться от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, серьезности инфекции, конкретного агента, его способа введения и т.п. Соединения настоящего изобретения предпочтительно составляют в композиции в единичной дозированной форме для облегчения введения и однородности дозы. Используемое в данном описании выражение "единичная дозированная форма" относится к физически дискретной единице агента, предназначенной для подвергаемого лечению пациента. Однако следует понимать, что решение в отношении общего суточного применения соединений и композиций настоящего изобретения будет приниматься лечащим врачом по результатам тщательной медицинской оценки. Конкретный уровень эффективной дозы для любого конкретного пациента или организма будет зависеть от ряда факторов, включающих подвергаемое лечению нарушение и тяжесть нарушения; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и питание пациента; время введения, путь введения и скорость выведения конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в комбинации или одновременно с конкретным используемым соединением, и подобные факторы, хорошо известные в области медицины. Как использовано в данном описании, термин "пациент" означает животное, предпочтительно млекопитающее и наиболее предпочтительно человека. Фармацевтически приемлемые композиции настоящего изобретения можно вводить людям и другим животным орально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей, капель или пластыря), трансбуккально, в виде аэрозоля для ротовой полости или носа и т.п., в зависимости от тяжести подвергаемой лечению инфекции. В определенных вариантах осуществления соединения настоящего изобретения могут вводиться орально или парентерально на уровнях доз, составляющих приблизительно от 0,01 до приблизительно 50 мг/кг и предпочтительно приблизительно от 0,5 до приблизительно 25 мг/кг массы тела субъекта в день, один или несколько раз в день, для получения желаемого терапевтического эффекта. Жидкие дозированные формы для орального введения включают, но без ограничения, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии и эликсиры. Кроме активных соединений, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности,хлопковое, арахисовое, кукурузное масло, масло из семени, оливковое, касторовое и кунжутное масло),глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры сорбита и жирной кислоты и их смеси. Кроме инертных разбавителей, пероральные композиции могут также содержать адъюванты, такие как смачивающие средства, эмульгаторы и суспендирующие агенты, подсластители, корригенты и ароматизирующие агенты. Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии,можно получить согласно известной технологии, используя подходящие диспергаторы или смачивающие вещества и суспендирующие средства. Стерильным инъецируемым препаратом также может быть стерильный инъецируемый раствор, суспензия или эмульсия в нетоксичном, подходящем для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых сред и растворителей, которые могут использоваться, находятся вода, раствор Рингера, U.S.Р. и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое безвкусное нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, при приготовлении инъецируемых препаратов используются жирные кислоты, такие как олеиновая кислота. Инъецируемые препараты можно стерилизовать, например, путем фильтрации через удерживающий бактерии фильтр или путем включения стерилизующих средств в форму стерильных твердых препаратов, которые можно растворить или диспергировать в стерильной воде или другой стерильной инъецируемой среде непосредственно перед применением. Для пролонгирования эффекта соединения настоящего изобретения часто требуемым является замедление абсорбции соединения из места подкожной или внутримышечной инъекции. Это можно выполнить путем использования жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции соединения далее зависит от его скорости растворения, ко- 15018891 торая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно,достигнуть замедленной абсорбции парентерально вводимой формы соединения можно путем растворения или суспендирования соединения в масляной среде. Инъецируемые формы замедленного всасывания можно создать путем образования включенных в микрокапсулы матриц соединения в биоразрушаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера и природы конкретного используемого полимера можно контролировать скорость высвобождения соединения. Примеры других биоразрушаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые препараты замедленного всасывания можно также получить путем захвата соединения в липосомы или микроэмульсии, которые совместимы с тканями организма. Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получить путем смешивания соединений настоящего изобретения с подходящими, не вызывающими раздражение эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но являются жидкими при температуре тела и поэтому расплавляются в прямой кишке или вагинальной полости и высвобождают активное соединение. Твердые дозированные формы для орального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение смешано по меньшей мере с одним инертным, фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) заполнителями или наполнителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например,карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, с) увлажнителями, такими как глицерин, d) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, е) замедлителями растворения, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и глицеролмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) лубрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль дозированная форма может также включать буферирующие агенты. Твердые композиции схожего типа могут также использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые дозированные формы в виде таблеток, драже,капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области составления фармацевтических препаратов. Они могут необязательно содержать компоненты, придающие матовость, и также могут иметь такой состав, что они высвобождают активный ингредиент(ы) только или предпочтительно в определенной части кишечника необязательно замедленным образом. Примеры составов для внедрения, которые могут использоваться, включают полимерные вещества и воски. Твердые композиции схожего типа могут также использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Активные соединения также могут быть в инкапсулированной форме вместе с одним или несколькими эксципиентами, приведенными выше. Твердые дозированные формы в виде таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождения покрытия и другие покрытия, хорошо известны в области составления фармацевтических препаратов. В таких твердых дозированных формах активное соединение может быть смешано по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также включать, как используется на практике, дополнительные вещества, отличные от инертных разбавителей, например лубриканты для изготовления таблеток и другие вещества для изготовления таблеток, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль дозированные формы также могут содержать буферирующие агенты. Они могут необязательно содержать придающие мутность агенты, а также могут быть составлены в композицию таким образом, что они высвобождают активный ингредиент(ы) только или предпочтительно в определенной части кишечника, необязательно, замедленным образом. Примеры композиций для внедрения, которые могут использоваться, включают полимерные вещества и воски. Дозированные формы для местного или чрескожного введения соединения настоящего изобретения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, аэрозоли, дозированные формы для ингаляции или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, в зависимости от требований. Также предусматривается, что в объем настоящего изобретения входят офтальмологические препараты, ушные капли и глазные капли. Кроме того, настоящим изобретением предусматривается применение чрескожных пластырей, которые обладают дополнительным преимуществом, заключающимся в обеспечении контролируемой доставки соединения в организм. Такие дозированные формы готовят пу- 16018891 тем растворения или диспергирования соединения в надлежащей среде. Могут также использоваться усилители абсорбции для увеличения проникновения соединения через кожу. Скорость можно контролировать либо обеспечением контролирующей скорости мембраны, либо диспергированием соединения в полимерной матрице или геле. Активность соединения, используемого в настоящем изобретении в качестве модулятора CFTR,можно проанализировать согласно способам, в основном описанным в данной области и в примерах настоящего описания. Также следует понимать, что соединения и фармацевтически приемлемые композиции настоящего изобретения могут быть использованы в комбинированных терапиях, т.е. соединения и фармацевтически приемлемые композиции могут вводиться одновременно с назначением одного или нескольких других требуемых терапевтических средств или медицинских процедур, до такого назначения или после него. При конкретной комбинации терапий (терапевтических средств или процедур), используемых при комбинированном введении, следует учитывать совместимость требуемых терапевтических средств и/или процедур и желаемый терапевтический эффект, который должен быть достигнут. Также следует понимать, что с помощью используемых терапий может быть достигнут желаемый эффект в отношении одного и того же нарушения (например, соединение настоящего изобретения может вводиться одновременно с другим средством, используемым для лечения того же нарушения) или с их помощью могут быть достигнуты различные эффекты (например, контроль любых неблагоприятных эффектов). Как использовано в данном описании, дополнительные терапевтические средства, которые обычно назначают для лечения или предупреждения конкретного заболевания или состояния, известны как "подходящие для заболевания или состояния, подвергаемого лечению". В одном варианте осуществления дополнительное средство выбирают из муколитического средства, бронходилататора, антибиотика, противоинфекционного агента, противовоспалительного средства,модулятора CFTR, отличного от соединения настоящего изобретения, или связанного с питанием вещества. В следующем варианте осуществления дополнительным средством является модулятор CFTR, отличный от соединения настоящего изобретения. В одном варианте осуществления дополнительным средством является антибиотик. Примеры антибиотиков, полезных в настоящем изобретении, включают тобрамицин, включая ингаляционный порошок тобрамицина (TIP), азитромицин, азтреонам, включая аэрозольную форму азтреонама, амикацин, включая его липосомальные препараты, ципрофлоксацин, включая его препараты, подходящие для ведения с помощью ингаляции, левофлоксацин, включая его препараты в виде аэрозоля, и комбинации двух антибиотиков, например фосфомицина и тобрамицина. В другом варианте осуществления дополнительным средством является муколитическое средство. Примеры муколитических средств, полезных в настоящем изобретении, включают Pulmozyme. В другом варианте осуществления дополнительным средством является бронходилататор. Примеры бронходилататоров включают альбутерол, метапротенерол сульфат, пирбутерол ацетат, салметерол или тетрабулина сульфат. В другом варианте осуществления дополнительное средство эффективно при восстановлении жидкого слоя на поверхности нижних дыхательных путей. Такие средства увеличивают перемещение соли в клетки и из них, что создает возможность для большей гидратации слизи в нижних дыхательных путях и,следовательно, более легкое очищение. Приводимые в качестве примеров такие средства включают гипертонический солевой раствор, денуфозол тетранатрий 3S,5R)-5-(4-амино-2-оксопиримидин-1-ил)-3 гидроксиоксалан-2-ил]метоксигидроксифосфорил]-(2R,3S,4R,5R)-5-(2,4-диоксопиримидин-1-ил)-3,4 дигидроксиоксалан-2-ил]метоксигидроксифосфорил]оксигидроксифосфорил]гидрофосфат) или бронхитол (ингаляционный препарат маннита). В другом варианте осуществления дополнительным средством является противовоспалительное средство, т.е. средство, которое может уменьшить воспаление в легких. Приводимые в качестве примеров такие средства, полезные в настоящем изобретении, включают ибупрофен, докозагексаноевую кислоту (DHA), силденафил, ингаляционный глутатион, пиоглитазон, гидроксихлорохин или симавастатин. В другом варианте осуществления дополнительное средство снижает активность блокатора эпителиальных натриевых каналов (ENaC), либо прямо путем блокирования канала, либо косвенно путем модуляции протеаз, которые приводят к увеличению активности ENaC (например, сериновых протеаз, активирующих каналы протеаз). Приводимые в качестве примеров такие средства включают камостат (ингибитор трипсиноподобной протеазы), QAU145, 552-02, GS-9411, INO-4995, Aerolytic и амилорид. Дополнительные средства, снижающие активность блокатора эпителиальных натриевых каналов (ENaC),можно найти, например, в публикации заявки РСТ WO 2009/074575, полное содержание которой включено в данное описание во всей своей полноте. Среди других описанных в данном изобретении заболеваний комбинации модуляторов CFTR, таких как соединения формулы (I), и средств, снижающих активность ENaC, полезны при лечении синдрома Лиддала, воспалительного или аллергического заболевания, включая муковисцидоз, первичной цилиарной дискинезии, хронического бронхита, хронического обструктивного заболевания легких, астмы, инфекций дыхательных путей, карциномы легкого, ксеростомии и сухого кератоконъюнктивита, инфекций дыхательных путей (острых и хронических; вирусных и бактериальных) и карциномы легкого. Комбинации модуляторов CFTR, таких как соединения формулы (I), и средств, снижающих активность ENaC, также полезны при лечении заболеваний, опосредованных блокировкой эпителиального натриевого канала, которые также включают отличные от респираторных заболеваний заболевания, связанные с анормальной регуляцией жидкости через эпителий, в которые возможно вовлечена анормальная физиология протективных поверхностных липидов на его поверхности, например ксеростомию (сухость во рту) или сухой кератоконъюнктивит (сухость глаз). Кроме того, блокировка эпителиального натриевого канала в почке может быть использована для стимуляции диуреза и, тем самым, вызова гипотензивного эффекта. Астма включает как врожденную (неаллергическую) астму, так и приобретенную (аллергическую) астму, астму легкой степени, астму средней степени, астму тяжелой степени, бронхиальную астму, вызванную физической нагрузкой астму, профессиональную астму и астму, вызванную после бактериальной инфекции. Лечение астмы также следует понимать как установленное для субъектов, например, в возрасте менее 4 или 5 лет, проявляющих симптомы стерторозного дыхания и диагностированных или диагностируемых как "страдающие стридором младенцы", распространяется на категорию пациентов основной медицинской проблемы и в настоящее время часто определяемых как астматики начальной или ранней стадии. (Для удобства это конкретное астматическое состояние называют "синдромом страдающего стридором младенца".) О профилактической эффективности при лечении астмы будет свидетельствовать уменьшение частоты или тяжести симптоматического приступа, например острого астматического или суживающего просвет бронхов приступа, улучшение легочной функции или снижение повышенной реактивности дыхательных путей. О ней может, кроме того, свидетельствовать снижение требования в отношении другой, симптоматической терапии, т.е. терапии, которая предназначена для ограничения или прерывания симптоматического приступа при его возникновении, например противовоспалительной(например, кортикостероида) или расширяющей бронхи терапии. Профилактическая польза при астме может быть, в частности, явной у субъектов, предрасположенных к "значительному снижению максимальной скорости выдоха в утренние часы". "Значительное снижение максимальной скорости выдоха в утренние часы" является признанным астматическим синдромом, общим у значительного процента астматиков и характеризующегося приступом астмы, например, приблизительно между 4 и 6 утра, т.е. в момент времени, обычно значительно отдаленный от любой ранее назначенной симптоматической терапии для астмы. Хроническое обструктивное заболевание легких включает хронический бронхит или связанную с ним одышку, эмфизему, а также обострение повышенной реактивности дыхательных путей после другой лекарственной терапии, в частности другой ингаляционной лекарственной терапии. В некоторых вариантах осуществления комбинации модуляторов CFTR, таких как соединения формулы (I), и средств, снижающих активность ENaC, полезны при лечении бронхита любого типа или генеза, включая, например,острый, арахисовый, катаральный, крупозный, хронический или астенический бронхит. В другом варианте осуществления дополнительным средством является модулятор CFTR, отличный от соединения формулы (I), т.е. средство, которое оказывает эффект модулирования активностиCFTR. Приводимые в качестве примеров такие средства включают аталурен ("РТС 124"; 3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]бензойная кислота), синапултид, ланковутид, депелестат (ингибитор рекомбинатной эластаты нейтрофилов человека), кобипростон (7-(2R,4aR,5R,7aR)-2-[(3S)-1,1 дифтор-3-метилпентил]-2-гидрокси-6-оксооктагидроциклопента[b]пиран-5-илгептановая кислота) или(3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпирин-2 ил)бензойную кислоту. В другом варианте осуществления дополнительным средством является(3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2 ил)бензойная кислота. В другом варианте осуществления дополнительным средством является питательное вещество. Приводимые в качестве примеров такие вещества включают панкрелипазу (замену панкреатического фермента), включающую Pancrease, Pancreacarb, Ultrase или Creon, Liprotomase (в прошломTrizytek), Aquadeks или ингаляционный глутатион. В одном варианте осуществления дополнительным питательным веществом является панкрелипаза. Количество дополнительного терапевтического средства, присутствующего в композициях настоящего изобретения, не будет превышать количество, которое обычно вводят в композицию, содержащую такое терапевтическое средство в качестве единственного активного ингредиента. Предпочтительно количество дополнительного терапевтического средства в раскрытых в настоящем изобретении композициях будет колебаться приблизительно от 50 до 100% от количества, обычно присутствующего в композиции, содержащей это средство в качестве единственного активного ингредиента. Соединения настоящего изобретения или их фармацевтически приемлемые композиции могут быть также включены в составы для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Соответственно, настоящее изобретение в другом аспекте включает композицию для покрытия имплантируемого устройства, содер- 18018891 жащую соединение настоящего изобретения, описанное выше в общем и по классам и подклассам в данном описании, и носитель, подходящий для покрытия указанного имплантируемого устройства. В еще одном аспекте настоящее изобретение включает имплантируемое устройство, покрытое композицией,содержащей соединение настоящего изобретения, описанное выше в общем и по классам и подклассам в данном описании, и носитель, подходящий для покрытия указанного имплантируемого устройства. Подходящие покровные материалы и обычное получение имплантируемых устройств с покрытием описаны в патентах США 6099562, 5886026 и 5304121. Покровными материалами обычно являются биосовместимые полимерные материалы, такие как полимер гидрогеля, полиметилдисилоксан, поликапролактон, полиэтиленгиколь, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия могут необязательно быть дополнительно покрыты подходящим верхним слоем фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинациями для придания композиции свойств контролируемого высвобождения. Другой аспект настоящего изобретения относится к способу модулирования активности CFTR в биологическом образце или у пациента (например, in vitro или in vivo), включающему введение пациенту соединения формулы (I) или композиции, содержащей указанное соединение, или приведение указанного биологического образца в контакт с указанным соединением или композицией. Как использовано в данном описании, термин "биологический образец" включает, но без ограничения, культуры клеток или их экстракты; материал, полученный с помощью биопсии от млекопитающего, или экстракты из него; и кровь, слюну, мочу, экскременты, сперму, слезы или другие жидкости организма или их экстракты. Модулирование CFTR в биологическом образце может быть использовано для множества целей,которые известны специалисту в данной области техники. Примеры таких целей включают, но без ограничения, изучение CFTR в биологических и патологических явлениях и сравнительную оценку новых модуляторов CFTR. В еще одном варианте осуществления предложен способ модулирования активности анионного канала in vitro или in vivo, включающий стадию приведения указанного канала в контакт с соединением формулы (I). В предпочтительных вариантах осуществления анионным каналом является канал для иона хлора или канал для бикарбоната. В других предпочтительных вариантах осуществления анионным каналом является канал для иона хлора. В соответствии с альтернативным вариантом осуществления в настоящем изобретении предложен способ увеличения количества функционального CFTR в мембране клетки, включающий стадию приведения указанной клетки в контакт с соединением формулы (I). В соответствии с другим предпочтительным вариантом осуществления активность CFTR определяют путем измерения трансмембранной разности потенциалов. В способах измерения трансмембранной разности потенциалов в биологическом образце может быть использован любой из известных в данной области техники способов, такой как оптическое измерение мембранного потенциала или другие электрофизиологические методы. При оптическом измерении мембранного потенциала используют чувствительные к разности потенциалов FRET-сенсоры, описанные Gonzalez и Tsien (см. Gonzalez, J.E. and R.Y. Tsien (1995), "Voltageenergy transfer", Chem. Biol. 4(4):269-1277), в комбинации с аппаратурой для измерения изменения флуоресценции, такой как считывающее устройство с вольтрометровым/ионным зондом (VIPR) (см. Gonzalez,J.Е., K. Oades, et al. (1999), "Cell-based assays and instrumentation for screening ion-channel targets",Drug Discov Today, 4(9):431-439). Такие чувствительные к разности потенциалов измерения основаны на изменении резонансного переноса энергии флуоресценции (FRET) между растворимым в мембране, чувствительным к разности потенциалов красителем, DiSBAC2 (3), и флуоресцентным фосфолипидом, CC2-DMPE, который прикреплен к наружному слою плазматической мембраны и действует в качестве донора для FRET. Изменения в мембранном потенциале (Vm) являются причиной перераспределения отрицательно заряженногоDiSBAC2 (3) по плазматической мембране и изменения степени переноса энергии из CC2-DMPE соответственно. Изменения эмиссии флуоресценции можно отслеживать, используя VIPR II, который представляет собой объединенные манипулятор с жидкостью и флуоресцентный детектор, сконструированный для проведения основанных на клетках скринингов в 96- или 384-луночных титрационных микропланшетах. В другом аспекте настоящее изобретение предоставляет набор для применения при измерении активности CFTR или его фрагмента в биологическом образце in vitro или in vivo, состоящий из (i) композиции, содержащей соединение формулы (I), или любого из вышеуказанных вариантов ее осуществления; и (ii) инструкции в отношении а) приведения композиции в контакт с биологическим образцом иb) измерения активности указанного CFTR или его фрагмента. В одном варианте осуществления набор,кроме того, включает инструкции в отношении а) приведения дополнительного соединения в контакт с биологическим образцом; b) измерения активности указанного CFTR или его фрагмента в присутствии указанного дополнительного соединения и с) сравнения активности CFTR в присутствии дополнительно- 19018891 го соединения с активностью CFTR в присутствии соединения формулы (I). В предпочтительных вариантах осуществления набор применяют для измерения плотности CFTR. Для возможности более полного понимания раскрытого в данном описании изобретения представлены следующие примеры. Следует понимать, что эти примеры представлены исключительно с иллюстративной целью и не должны рассматриваться как ограничение настоящего изобретения каким-либо образом. Способы и промежуточные продукты для получения соединений формулы (I). Другой аспект настоящего изобретения относится к способу получения соединения формулы (Ic) или его фармацевтически приемлемых солей, включающему: а) взаимодействие кислоты формулы Id с амином формулы 2 с с получением соединения формулыR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом, иRa представляет собой водород или силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS),триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM). В одном варианте осуществления взаимодействие кислоты формулы 1d с амином формулы 2 с осуществляют в растворителе в присутствии гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилурония (HATU) и триэтиламина или в растворителе в присутствии циклического ангидрида пропилфосфокислотыN,N-диметилформамид, этилацетат или 2-метилтетрагидрофуран. В другом варианте осуществления Ra представляет собой водород или TBDMS. В другом варианте осуществления Ra представляет собой TBDMS. В другом варианте осуществления способ включает дополнительную стадию снятия защитной,группы, например, когда кольцо A представляет собой где Ra представляет собой силилзащитную группу, с получением соединения формулы (Ic), где. кольцо A представляет собой Как правило, для удаления силилзащитной группы требуется обработка такой кислотой, как уксусная кислота или разбавленная минеральная кислота или т.п., хотя могут использоваться другие реагенты,такие как источник иона фтора (например, тетрабутиламмонийфторид). Способ получения амина формулы 2 с из соединения формулы 2 а включает следующие стадии:(а) взаимодействие соединения формулы 2 а с амином формулы 3 с получением соединения формулы 2b(b) восстановление соединения формулы 2b до амина формулы 2 с В одном варианте осуществления способа получения амина формулы 2 с амин формулы 3 на стадии(а) получают in situ из соответствующей четвертичной аммониевой соли, такой как амингидрохлоридная соль, хотя также могут использоваться другие аммониевые соли (например, соль трифторуксусной кислоты). В одном варианте осуществления стадия (а) предназначена для получения амина формулы 2 с, когда или и Ra представляет собой водород или амин формулы 3 представляет собойTBDMS. Более конкретно, Ra представляет собой TBDMS. В другом варианте осуществления стадию (а) осуществляют в полярном апротонном растворителе в присутствии основания третичного амина. Примеры третичных аминов, которые могут использоваться,включают триэтиламин,диизопропилэтиламин,1,5-диазабицикло[4.3.0]нон-5-ен(DBN),1,8-диазабицикло[5.4.0]ундек-7-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и пиридин. Примеры растворителей, которые могут использоваться, включают N,N-диметилформамид, диметилсульфоксид или ацетонитрил. В одном варианте осуществления основанием третичного амина является триэтиламин. В другом варианте осуществления стадию (а) осуществляют в ацетонитриле в присутствии триэтиламина. В другом варианте осуществления температура реакции на стадии (а) составляет приблизительно от 75 до приблизительно 85C. В другом варианте осуществления время реакции на стадии (а) составляет приблизительно от 2 до приблизительно 30 ч. В одном варианте осуществления способа получения амина формулы 2 с стадию (b) осуществляют в полярном протонном растворителе или в смеси полярных протонных растворителей в присутствии палладиевого катализатора. Когда палладий является катализатором, растворителем на стадии (b) обычно является полярный протонный растворитель, такой как спирт. Более конкретно, растворитель включает метанол или этанол. В другом варианте осуществления стадию (b) осуществляют в полярном протонном растворителе,таком как вода, в присутствии Fe и FeSO4 или Zn и AcOH. Другой аспект настоящего изобретения относится к способу получения соединения формулы (Ic) или его фармацевтически приемлемых солей, включающий следующие стадии: а) взаимодействие соединения формулы 2 а с амином формулы 3 с получением соединения формулы 2b(b) преобразование соединения формулы 2b в амин формулы 2 с путем восстановления(с) взаимодействие амина формулы 2 с с кислотой формулы Id с получением соединения формулы где Hal представляет собой F, Cl, Br или I; амин формулы 3 представляет собой или кольцо A выбирают изR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом, иRa представляет собой водород или силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS),триизопропилсилила (TIPS) и [2-(триметилсилил)этокси]метила (SEM). В одном варианте осуществления амин формулы 3 на стадии (а) получают in situ из соответствующей четвертичной аммониевой соли, такой как амингидрохлоридная соль, хотя также могут использоваться другие аммониевые соли (например, соль трифторуксусной кислоты). В одном варианте осуществления стадия (а) предназначена для получения амина формулы 2 с, когда амин формулы 3 представляет собой илиRa представляет собой водород или TBDMS, более конкретно, Ra представляет собой TBDMS. В другом варианте осуществления стадию (а) осуществляют в полярном апротонном растворителе в присутствии основания третичного амина. Примеры третичных аминов, которые могут использоваться,включают триэтиламин, диизопропилэтиламин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8 диазабицикло[5.4.0]ундек-7-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и пиридин. В одном варианте осуществления основанием третичного амина является триэтиламин. В другом варианте осуществления стадию (а) осуществляют в ацетонитриле в присутствии триэтиламина. В другом варианте осуществления температура реакции на стадии (а) составляет приблизительно от 75 до приблизительно 85C. В другом варианте осуществления время реакции на стадии (а) составляет приблизительно от 2 до приблизительно 30 ч. В одном варианте осуществления способа получения амина формулы 2 с стадию (b) осуществляют в полярном протонном растворителе или в смеси полярных протонных растворителей в присутствии палладиевого катализатора. Когда палладий является катализатором, растворителем на стадии (b) обычно является полярный протонный растворитель, такой как спирт. Более конкретно, растворитель включает метанол или этанол. В другом варианте осуществления стадию (b) осуществляют в полярном протонном растворителе,таком как вода, в присутствии Fe и FeSO4 или Zn и AcOH. В одном варианте осуществления стадии (с) взаимодействие кислоты формулы Id с амином формулы 2 с осуществляют в растворителе в присутствии гексафторфосфата О-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилурония (HATU) и триэтиламина или в растворителе в присутствии циклического ангидрида пропилфосфокислоты (T3P) и пиридина. Более конкретно, растворитель включаетN,N-диметилформамид, этилацетат или 2-метилтетрагидрофуран. В другом варианте осуществления Ra представляет собой водород или TBDMS. В другом варианте осуществления Ra представляет собой TBDMS. В другом варианте осуществления способ включает дополнительную стадию снятия защитной группы, например, когда кольцо A представляет,где Ra представляет собой силилзащитную группу, с получением соединения формулы (Ic), где кольцо A представляет собой. Как правило, для удаления силилзащитной группы требуется обработка такой кислотой, как уксусная кислота или разбавленная минеральная кислота или т.п., хотя могут использоваться другие реагенты,такие как источник иона фтора (например, тетрабутиламмонийфторид). Другой аспект настоящего изобретения относится к соединению, которое представляет собойRa представляет собой силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила(TIPS) и [2-(триметилсилил)этокси]метила (SEM). Другой аспект настоящего изобретения относится к соединению, которое представляет собойRa представляет собой силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила(TIPS) и [2-(триметилсилил)этокси]метила (SEM). Другой аспект настоящего изобретения относится к соединению формулы (IA) или его фармацевтически приемлемым солям, где выбирают из илиR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом, иRa представляет собой силилзащитную группу, выбранную из группы, состоящей из триметилсилила (TMS), трет-бутилдифенилсилила (TBDPS), трет-бутилдиметилсилила (TBDMS), триизопропилсилила(TIPS) и [2-(триметилсилил)этокси]метила (SEM). Другой аспект настоящего изобретения относится к соединению формулы (I) или его фармацевтически приемлемым солям,где кольцо A выбирают изR3 представляет собой водород, -CH3, -OCH3 или -CN; при условии, что оба R2 и R3 не являются одновременно водородом,полученному по любому из описанных в данном изобретении способов. Другой аспект настоящего изобретения относится к соединению, выбранному из группы, состоящей из полученному по любому из описанных в данном изобретении способов. Примеры Промежуточный продукт 1. 4-Оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновая кислота(17). Синтез указанного в заголовке соединения представлен на схеме 4. Схема 4 Получение диэтил-2-2-хлор-5-(трифторметил)фениламино)метилен)малоната (14). В трехгорлой круглодонной колбе объемом 1 л, снабженной конденсирующей системой ДинаСтарка, в атмосфере азота объединяли 2-хлор-5-(трифторметил)анилин 12 (200 г, 1,023 моль), диэтил-2(этоксиметилен)малонат 13 (276 г, 1,3 моль) и толуол (100 мл). Раствор нагревали при помешивании до 140C и эту температуру поддерживали в течение 4 ч. Реакционную смесь охлаждали до 70C и медленно добавляли гексан (600 мл). Образовавшуюся взвесь перемешивали и давали ей нагреться до комнатной температуры. Твердое вещество отделяли фильтрованием, промывали 10% этилацетатом в гексане (2400 мл) и затем сушили в вакууме с получением белого твердого вещества(350 г, 94% выход) в качестве желаемого продукта конденсации - диэтил-2-2-хлор-5(трифторметил)фениламино)метилен)малоната 14. 1 Н ЯМР (400 МГц, ДМСО-d6)11,28 (д, J=13,0 Гц, 1 Н), 8,63 (д, J=13,0 Гц, 1 Н), 8,10 (с, 1 Н), 7,80 (д,J=8,3 Гц, 1 Н), 7,50 (дд, J=1,5, 8,4 Гц, 1 Н), 4,24 (кв., J=7,1 Гц, 2 Н), 4,17 (кв, J=7,1 Гц, 2 Н), 1,27 (м, 6 Н). Получение этил-8-хлор-4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоксилата (15). В трехгорлую колбу объемом 1 л вливали Даутерм (200 мл, 8 мл/г), который подвергали дегазации при 200C в течение 1 ч. Растворитель нагревали до 260C и в него порциями загружали в течение 10 мин диэтил-2-2-хлор-5-(трифторметил)фениламино)метилен)малоат 14 (25 г, 0,07 моль). Образовавшуюся смесь перемешивали при 260C в течение 6,5 ч и образовавшийся побочный продукт - этанол удаляли дисцилляцией. Смеси давали медленно охлаждаться до 80C. Медленно в течение 30 мин добавляли гексан (150 мл) и затем дополнительные 200 мл гексана добавляли одной порцией. Взвесь перемешивали до достижения ею комнатной температуры. Твердое вещество отфильтровывали, промывали гексаном (3150 мл) и затем сушили в вакууме с получением этил-8-хлор-4-оксо-5-(трифторметил)-1,4 дигидрохинолин-3-карбоксилата 15 в виде желтовато-коричневого твердого вещества (13,9 г, 65% выход). 1 Н ЯМР (400 МГц, ДМСО-d6)11,91 (с, 1 Н), 8,39 (с, 1 Н), 8,06 (д, J=8,3 Гц, 1 Н), 7,81 (д, J=8,4 Гц,1 Н), 4,24 (кв., J=7,1 Гц, 2 Н), 1,29 (т, J=7,1 Гц, 3H). Получение этил-4-оксо-5-(трифторметил)-1 Н-хинолин-3-карбоксилата (16). В трехгорлую колбу объемом 5 л загружали этил-8-хлор-4-оксо-5-(трифторметил)-1,4 дигидрохинолин-3-карбоксилат 15 (100 г, 0,3 моль), этанол (1250 мл, 12,5 мл/г) и триэтиламин (220 мл,1,6 моль). В сосуд затем загружали 10 г 10% Pd/C (50% влаги) при 5C. Реакционную смесь энергично перемешивали в атмосфере водорода в течение 20 с при 5C, после чего реакционную смесь концентрировали до объема приблизительно 150 мл. Продукт, этил-4-оксо-5-(трифторметил)-1H-хинолин-3 карбоксилат 16, в виде взвеси с Pd/C забирали непосредственно на следующую стадию. Получение 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3-карбоновой кислоты (17). Этил-4-оксо-5-(трифторметил)-1 Н-хинолин-3-карбоксилат 16 (58 г, 0,2 моль, грубая реакционная взвесь, содержащая Pd/C) суспендировали в NaOH (814 мл 5 М, 4,1 моль) в колбе объемом 1 л с обратным холодильником и нагревали до 80C в течение 18 ч с последующим дополнительным нагреванием до 100C в течение 5 ч. Теплую реакционную смесь фильтровали через упакованный целит для удаленияPd/C и целит промывали 1 н. NaOH. Фильтрат подкисляли приблизительно до pH 1 с получением густого белого осадка. Осадок отфильтровывали, затем промывали водой и холодным ацетонитрилом. Твердое вещество затем сушили в вакууме с получением 4-оксо-5-(трифторметил)-1,4-дигидрохинолин-3 карбоновой кислоты 17 в виде белого твердого вещества (48 г, 92% выход). 1 Н ЯМР (400 МГц, ДМСО-d6)15,26 (с, 1 Н), 13,66 (с, 1 Н), 8,98 (с, 1 Н), 8,13 (дд, J=1,6, 7,8 Гц, 1 Н),8,06-7,99 (м, 2 Н). Промежуточный продукт 2. 4-(7-Азабицикло)[2.2.1]гептан-7-ил)-2-(трифторметил)анилин (20). Синтез указанного в заголовке соединения представлен на схеме 5. Схема 5 Получение 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептана (19). В колбу, содержащую гидрохлорид 7-азабицикло[2.2.1]гептана 7 а (4,6 г, 34,43 ммоль, полученный от Tyger Scientific Inc., 324 Stokes Avenue, Ewing, NJ, 08638 США) в атмосфере азота добавляли раствор 4-фтор-1-нитро-2-(трифторметил)бензола 18 (6,0 г, 28,69 ммоль) и триэтиламин (8,7 г, 12,00 мл,86,07 ммоль) в ацетонитриле (50 мл). Колбу с реакционной смесью нагревали при 80C в атмосфере азота в течение 16 ч. Реакционной смеси давали охлаждаться и затем ее распределяли между водой и дихлорметаном. Органический слой промывали 1 М HCl, сушили над Na2SO4, фильтровали и выпаривали досуха. Очистка хроматографией на силикагеле (0-10% этилацетата в гексанах) давала 7-[4-нитро-3(трифторметил)фенил]-7-азабицикло[2.2.1]гептан 19 (7,2 г, 88% выход) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)8,03 (д, J=9,1 Гц, 1 Н), 7,31 (д, J=2,4 Гц, 1 Н), 7,25 (дд, J=2,6, 9,1 Гц,1 Н), 4,59 (с, 2 Н), 1,69-1,67 (м, 4 Н), 1,50 (д, J=7,0 Гц, 4 Н). Получение 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина (20). В колбе с загруженным 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептаном 19 (7,07 г,24,70 ммоль) и 10% Pd/C (0,71 г, 6,64 ммоль) создавали вакуум и затем в нее быстро впускали азот. Добавляли этанол (22 мл) и колбу с реакционной смесью подключали к водороду из баллона. После интен- 26018891 сивного перемешивания в течение 12 ч через реакционную смесь пропускали азот и Pd/C удаляли фильтрованием. Фильтрат концентрировали до темного масла при пониженном давлении и остаток очищали хроматографией на силикагеле (0-15% этилацетата в гексанах) с получением 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(трифторметил)анилина 20 в виде пурпурового твердого вещества(5,76 д, 91% выход). 1 Н ЯМР (400 МГц, ДМСО-d6)6,95 (дд, J=2,3, 8,8 Гц, 1 Н), 6,79 (д, J=2,6 Гц, 1 Н), 6,72 (д, J=8,8 Гц,1 Н), 4,89 (с, 2 Н), 4,09 (с, 2 Н), 1,61-1,59 (м, 4 Н) и 1,35 (д, J=6,8 Гц, 4 Н). Промежуточный продукт 3. 2-Амино-5-(7-азабицикло[2.2.1]гептан-7-ил)бензонитрил (23). Синтез указанного в заголовке соединения представлен на схеме 6. Схема 6 Получение 5-(7-азабицикло[2.2.1]гептан-7-ил)-2-нитробензонитрила (22). К раствору 5-фтор-2-нитробензонитрила 21 (160 мг, 0,96 ммоль) в ацетонитриле (1 мл) медленно добавляли гидрохлорид 7-азабицикло[2.2.1]гептана 7 а (129 мг, 0,96 ммоль) и триэтиламин (244 мг,335,7 мкл, 2,41 ммоль). Реакционную смесь перемешивали при 60C в течение 4 ч. Реакцию гасили водой, подкисляли 1 н. HCl до pH 1 и экстрагировали дихлорметаном (310 мл). Объединенные органические слои промывали водой, сушили над Na2SO4, фильтровали и выпаривали с получением 5-(7-азабицикло[2.2.1]гептан-7-ил)-2-нитробензонитрила 22 (205 мг, 87% выход). ЖХ/МС (жидкостная хроматография/масс-спектрометрия) m/z (отношение массы к заряду) 244,3[М+Н]+, время удерживания 1,69 мин (RP-C18, 10-99% CH3CN/0,05% ТФУК в течение 3 мин). Получение 2-амино-5-(7-азабицикло[2.2.1]гептан-7-ил)бензонитрила (23). В колбу с загруженным 5-(7-азабицикло[2.2.1]гептан-7-ил)-2-нитробензонитрилом 22 (205 мг,0,8427 ммоль) и 10% Pd/C (41 мг, 0,39 ммоль), быстро впускали азот и затем в ней создавали вакуум. В атмосфере азота добавляли метанол (4 мл) и колбу подключали к водороду из баллона. После перемешивания в течение 15 мин Pd/C удаляли фильтрованием, растворитель удаляли при пониженном давлении с получением 2-амино-5-(7-азабицикло[2.2.1]гептан-7-ил)бензонитрила 23 (170 мг, 95% выход). 1 Н ЯМР (400 МГц, ДМСО-d6)7,02 (дд, J=2,8, 9,0 Гц, 1 Н), 6,87 (д, J=2,7 Гц, 1 Н), 6,68 (д, J=9,0 Гц,1 Н), 5,36 (с, 2 Н), 4,09 (с, 2 Н), 1,59 (д, J=6,8 Гц, 4 Н), 1,34 (д, J=6,8 Гц, 4 Н). Промежуточный продукт 4. 4-(7-Азабицикло[2.2.1]гептан-7-ил)-2-(3-(диметиламино)проп-1 инил)анилин (27). Синтез указанного в заголовке соединения представлен на схеме 7. Схема 7(8,400 мл) порциями добавляли 7-азабицикло[2.2.1]гептан 7 а (765,4 мг, 5,7 ммоль). Реакционную смесь перемешивали при 80C в течение 24 ч. Реакцию разбавляли водой для осаждения продукта. Твердое вещество снова растворяли в дихлорметане, промывали 1 н. HCl, сушили над Na2SO4, фильтровали и выпаривали с получением 7-(3-бром-4-нитрофенил)-7-азабицикло[2.2.1]гептана 25 (1,1 г, 78% выход). Неочищенный продукт использовали непосредственно на следующей стадии. ЖХ/МС m/z 299,1 [М+Н]+, время удерживания 1,97 мин (RP-C18, 10-99% CH3CN/0,05% ТФУК в течение 3 мин).N,N-диметилпроп-2-ин-1-амина (420 мг, 538 мкл, 5,05 ммоль) в подвергнутых дегазации ДМФА (5 мл) и триэтиламине (5 мл). Реакционную смесь нагревали в микроволновой печи в атмосфере N2 в течение 10 мин при 100C. Реакцию разбавляли этилацетатом, промывали 50% насыщенным раствором натрия бикарбоната (220 мл), водой и насыщенным раствором соли. Раствор сушили над безводным Na2SO4 и фильтровали с получением красного твердого вещества. Очистка хроматографией на силикагеле (0-50% дихлорметана в этилацетате) давала 3-[5-(7-азабицикло[2.2.1]гептан-7-ил)-2-нитрофенил]-N,Nдиметилпроп-2-ин-1-амин 26 (400 мг, 79% выход). ЖХ/МС m/z 300,5 [М+Н]+, время удерживания 1,11 мин (RP-C18, 10-99% CH3CN/0,05% ТФУК в течение 3 мин). Получение 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(3-диметиламинопроп-1-инил)анилина (27). 3-[5-(7-Азабицикло[2.2.1]гептан-7-ил)-2-нитрофенил]-N,N-диметилпроп-2-ин-1-амин 26 (340 мг,1,14 ммоль), железо (634 мг, 11,36 ммоль) и гептагидратсульфата железа (316 мг, 1,136 ммоль) суспендировали в воде (1 мл) и кипятили с обратным холодильником в течение 20 мин. Реакционную смесь фильтровали и твердое вещество промывали метанолом и дихлорметаном. Фильтрат концентрировали и очищали хроматографией на силикагеле с использованием (0-5% метанола в дихлорметане) с получением 4-(7-азабицикло[2.2.1]гептан-7-ил)-2-(3-диметиламинопроп-1-инил)анилина 27 (148 мг, 48% выход). ЖХ/МС m/z 270,3 [М+Н]+, время удерживания 0,25 мин (RP-C18, 10-99% CH3CN/0,05% ТФУК в течение 3 мин). Промежуточный продукт 5. Экзо-4-(2-(трет-бутилдиметилсилилокси)-7-азабицикло[2.2.1]гептан-7 ил)-2-(трифторметил)анилин (30). Синтез указанного в заголовке соединения представлен на схеме 8. Схема 8 Получение экзо-7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ола (28). В колбу, содержащую экзо-7-азабицикло[2.2.1]гептан-2-ол 7b (0,86 г, 5,74 ммоль), в атмосфере азота добавляли раствор 4-фтор-1-нитро-2-(трифторметил)бензола 18 (1 г, 4,78 ммоль) и триэтиламина(1,45 г, 2,0 мл, 14,35 ммоль) в ацетонитриле (8 мл). Реакционную смесь нагревали при 84C в атмосфере азота в течение 22 ч. Реакционной смеси давали медленно охлаждаться и затем ее распределяли между водой и этилацетатом. Слои разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали досуха. Очистка хроматографией на силикагеле (0-50% этилацетата в гексанах) давала экзо-7-[4-нитро-3-(трифторметил)фенил]-7 азабицикло[2.2.1]гептан-5-ол 28 в виде желтого твердого вещества (0,67 г, 46% выход). ЖХ/МС m/z 303,3 [М+Н]+, время удерживания 1,51 мин (RP-C18, 10-99% CH3CN/0,05% ТФУК в течение 3 мин). Получение экзо-трет-бутилдиметил 7-[4-нитро-3-(трифторметил)фенил]-7 азабицикло[2.2.1]гептан-5-ил]окси]силана 29. трет-Бутилхлордиметилсилан (197 мг, 1,267 ммоль) добавляли к раствору 4 Н-имидазола (144 мг,2,11 ммоль) в ДМФА (0,5 мл). После того как в растворе прекратилось выделение пузырьков, добавляли экзо-7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ол 28 (255 мг, 0,84 ммоль) в виде раствора в ДМФА (0,6 мл) и смесь перемешивали при комнатной температуре в течение 14 ч. Реакцию гасили водой и дважды экстрагировали диэтиловым эфиром, сушили над Na2SO4, фильтровали и концентрировали до бесцветного масла. Очистка хроматографией на силикагеле (0-40% дихлорметана в гексанах) давала экзо-трет-бутилдиметил 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5 ил]окси]силан 29 (318 мг, 90% выход) в виде желтого масла. 1 1 Н), 4,60 (т, J=4,4 Гц, 1 Н), 4,47 (д, J=5,2 Гц, 1 Н), 4,07 (дд, J=2,0, 6,8 Гц, 1 Н), 1,94 (дд, J=6,4, 12,8 Гц, 1 Н),1,71-1,47 (м, 3H), 1,39-1,32 (м, 2 Н), 0,65 (с, 9 Н), 0,03 (с, 6 Н). Получение экзо-4-[5-[трет-бутил(диметил)силил]окси-7-азабицикло[2.2.1]гептан-7-ил]-2(трифторметил)анилина (30) В колбе, содержащей палладий на активированном угле (10 мас.%, 30 мг, 0,28 ммоль), создавали вакуум, продували N2 и в колбу вливали раствор экзо-трет-бутилдиметил 7-[4-нитро-3(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ил]окси]силана 29 (301 мг, 0,72 ммоль) в этаноле(3 мл). В колбе создавали вакуум, затем подключали Н 2 из баллона и смесь перемешивали в течение 4 ч при комнатной температуре. Смесь фильтровали и выпаривали досуха с получением экзо-4-[5-[третбутил(диметил)силил]окси-7-азабицикло[2.2.1]гептан-7-ил]-2-(трифторметил)анилина 30 (268 мг, 96% выход) в виде не совсем белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)6,92 (дд, J=2,4, 8,8 Гц, 1 Н), 6,77 (д, J=2,6 Гц, 1 Н), 6,70 (д, J=8,8 Гц,1 Н), 4,84 (с, 2 Н), 4,11 (т, J=4,4 Гц, 1 Н), 3,91-3,89 (м, 2 Н), 1,82 (дд, J=7,1, 12,3 Гц, 1 Н), 1,54-1,39 (м, 3H),1,20-1,16 (м, 2 Н), 0,79 (с, 9 Н), 0,02 (с, 6 Н). Промежуточный продукт 6. Эндо-4-(2-(трет-бутилдиметилсилилокси)-7-азабицикло[2.2.1]гептан-7 ил)-2-(трифторметил)анилин (34). Синтез указанного в заголовке соединения представлен на схеме 9. Схема 9 Получение 7-азабицикло[2.2.1]гептан-5-она (31). К раствору оксалилдихлорида (165 мг, 113 мкл, 1,27 ммоль) в дихлорметане (3 мл) в атмосфере азота при -78C по каплям добавляли раствор ДМСО (199 мг, 180 мкл, 2,54 ммоль) в дихлорметане (0,7 мл). Реакционной смеси давали перемешиваться в течение 30 мин и затем по каплям добавляли раствор экзо 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ола 28 (320 мг, 1,06 ммоль) в дихлорметане (2,5 мл). Реакционную смесь перемешивали в течение еще 1 ч при -78C, затем по каплям добавляли триэтиламин (536 мг, 738 мкл, 5,30 ммоль) и реакционную смесь нагревали до комнатной температуры. Реакционную смесь разбавляли дихлорметаном, распределяли между дихлорметаном и водой и слои разделяли. Водный слой еще раз экстрагировали дихлорметаном. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали до желтого масла. Очистка хроматографией на силикагеле(0-30% этилацетата в гексанах) давала 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5 он 31 (266 мг, 84% выход) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)8,06 (д, J=9,1 Гц, 1 Н), 7,47 (д, J=2,4 Гц, 1 Н), 7,39 (дд, J=2,6, 9,1 Гц,1 Н), 4,98 (т, J=4,5 Гц, 1 Н), 4,84 (д, J=5,4 Гц, 1 Н), 2,44 (д, J=3,1 Гц, 1 Н), 2,23 (д, J=16 Гц, 1 Н), 2,00-1,92 (м,1 Н), 1,88-1,70 (м, 2 Н), 1,66-1,60 (м, 1 Н). Получение эндо-7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ола (32). К раствору 7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-она 31 (261 мг,0,87 ммоль) в ТГФ (11 мл) при -55C в атмосфере азота по каплям добавляли раствор три-вторбутилборгидрида лития (1,04 мл 1 М раствора, 1,04 ммоль). Через 30 мин реакционную смесь переносили на баню с водой со льдом и перемешивание продолжали. Реакцию гасили метанолом (1,2 мл) при 0C. Реакционную смесь распределяли между дихлорметаном и водой, слои разделяли и водный слой еще 2 раза экстрагировали дихлорметаном. Органические слои объединяли, сушили над Na2SO4, фильтровали и выпаривали досуха. Очистка хроматографией на силикагеле (0-50% этилацетата в гексанах) давала эндо-7-[4-нитро-3-(трифторметил)фенил]-7-азабицикло[2.2.1]гептан-5-ол 32 (222 мг, 84% выход) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)8,01 (д, J=9,1 Гц, 1 Н), 7,27 (д, J=3,0 Гц, 1 Н), 7,22 (дд, J=2,6, 9,1 Гц,1 Н), 5,17 (д, J=4,4 Гц, 1 Н), 4,49 (т, J=4,9 Гц, 1 Н), 4,44 (т, J=4,5 Гц, 1 Н), 4,16-4,10 (м, 1 Н), 2,20-2,06 (м, 2 Н),1,67-1,44 (м, 3H), 1,09 (дд, J=3,5, 12,4 Гц, 1 Н). Получение эндо-трет-бутилдиметил 7-[4-нитро-3-(трифторметил)фенил]-7 азабицикло[2.2.1]гептан-5-ил]окси]силана (33). трет-Бутилхлордиметилсилан (168 мг, 1,08 ммоль) добавляли к раствору 4 Н-имидазола (122 мг,1,80 ммоль) в ДМФА (425,3 мкл). После того как из раствора прекратилось выделение пузырьков, добав- 29
МПК / Метки
МПК: C07D 451/02, A61P 11/00, A61K 31/439
Метки: муковисцидозе, трансмембранной, модуляторы, регулятора, проводимости
Код ссылки
<a href="https://eas.patents.su/30-18891-modulyatory-regulyatora-transmembrannojj-provodimosti-pri-mukoviscidoze.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы регулятора трансмембранной проводимости при муковисцидозе</a>
Предыдущий патент: Способ выделения бетаина
Следующий патент: Электрод для электролизера
Случайный патент: Гравитационный градиентометр