Антитела человека, которые связывают мезотелин, и применение таких антител
Номер патента: 18396
Опубликовано: 30.07.2013
Авторы: Рао-Найк Четана, Пог Сара Л., Терретт Джонатан А., Ян Лань, Той Кристофер, Чэнь Бинлян
Формула / Реферат
1. Выделенное моноклональное антитело человека или его антигенсвязывающая часть, где антитело связывает мезотелин человека и проявляет по меньшей мере одно из следующих свойств:
(a) связывается с мезотелином человека с KD 1´10-8 М или меньше;
(b) интернализуется клетками, экспрессирующими мезотелин;
(c) ингибирует связывание мезотелина с антигеном рака яичников СА125;
(d) проявляет антителозависимую клеточную цитотоксичность (АЗКЦ) в отношении клеток, экспрессирующих мезотелин; или
(e) ингибирует рост клеток, экспрессирующих мезотелин, in vivo в случае, если данное антитело конъюгировано с цитотоксином;
где антитело содержит:
(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 2;
(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 5;
(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 8;
(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 11;
(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 14 и
(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 17;
или
(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 1;
(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 4;
(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 7;
(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 10;
(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 13 и
(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 16;
или
(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 3;
(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 6;
(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 9;
(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 12;
(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 15 и
(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 18.
2. Антитело по п.1, которое содержит:
(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 2;
(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 5;
(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 8;
(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 11;
(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 14 и
(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 17.
3. Антитело по п.1, где указанное антитело не содержит остатков фукозы.
4. Выделенное моноклональное антитело или его антигенсвязывающая часть, содержащее:
(а) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 19-21; и
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 22-24;
где антитело специфически связывается с белком мезотелина человека.
5. Конъюгат антитела с молекулой-партнером, содержащий антитело или его антигенсвязывающую часть по п.1 и молекулу-партнер, где молекула-партнер представляет собой терапевтическое средство.
6. Конъюгат антитела с молекулой-партнером по п.5, где терапевтическое средство представляет собой цитотоксин со структурой (j)
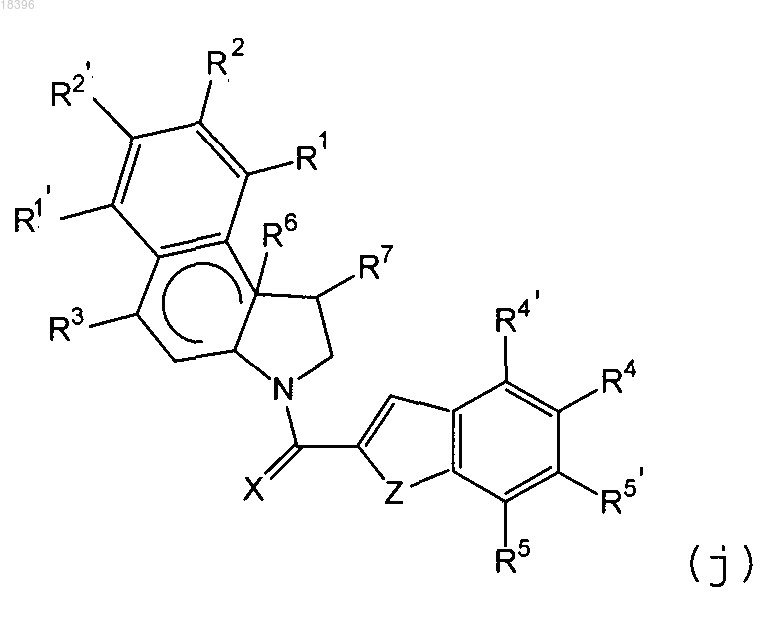
где X представляет собой элемент, выбранный из О, S и NR23; где R23 является элементом, выбранным из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и ацила;
R1 представляет собой Н, замещенный или незамещенной низший алкил, C(O)R8 или CO2R8; где R8 является элементом, выбранным из NR9R10 и OR9, в котором R9 и R10 являются элементами, независимо выбранными из Н, замещенного или незамещенного алкила или замещенного или незамещенного гетероалкила;
R1' представляет собой Н, замещенный или незамещенной низший алкил или C(O)R8;
R2 представляет собой Н, замещенный или незамещенной низший алкил или незамещенный гетероалкил или циано либо алкокси;
R2' представляет собой Н, замещенный или незамещенной низший алкил или незамещенный гетероалкил;
R3 представляет собой элемент, выбранный из SR11, NHR11 и OR11, где R11 это Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, монофосфаты, дифосфаты, трифосфаты, сульфонаты, ацил, C(O)R12R13, С(O)OR12, C(O)NR12R13, Р(O)(OR12)2, C(O)CHR12R13, SR12 или SiR12R13R14; и R12, R13 и R14 независимо представляют Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил и замещенный или незамещенный арил, где R12 и R13 вместе с атомом азота или углерода, к которому они присоединены, необязательно объединены с формированием замещенной или незамещенной гетероциклоалкильной кольцевой системы, имеющей от 4 до 6 элементов, необязательно содержащих два или более гетероатомов;
R4, R4', R5 и R5' являются элементами, независимо выбранными из Н, замещенного или незамещенного алкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного гетероциклоалкила, галогена, NO2, NR15R16, NC(O)R15, OC(O)NR15R16, ОС(О)OR15, C(O)R15, SR15, OR15, CR15=NR16 и О(CH2)nN(CH3)2, где n целое число от 1 до 20, или любая смежная пара R4, R4', R5 и R5' вместе с атомами углерода, к которым они присоединены, соединяются, формируя замещенную или незамещенную циклоалкиловую или гетероциклалкиловую кольцевую систему, имеющую от 4 до 6 элементов; где R15 и R16 независимо представляют собой Н, замещенный или незамещенный алкил, замещенный или незамещенный гетероалкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероциклоалкил и замещенный или незамещенный пептидил, где R15 и R16 вместе с атомом азота, к которому они присоединены, необязательно, объединяются с образованием замещенной или незамещенной гетероциклоалкильной кольцевой системы, имеющей от 4 до 6 элементов, необязательно, содержащих два или более гетероатомов; и
один из R3, R4, R4', R5 и R5' присоединяет цитотоксин к антителу или его антигенсвязывающей части через линкер.
7. Конъюгат антитела с молекулой-партнером по п.6, где антитело содержит:
(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 2;
(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 5;
(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 8;
(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 11;
(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 14; и
(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 17.
8. Фармацевтическая композиция, содержащая терапевтически эффективное количество конъюгата по п.5, и фармацевтически приемлемый носитель.
9. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающую часть по п.1.
10. Способ лечения рака у индивида, предусматривающий введение индивиду терапевтически эффективного количества антитела по п.1.
11. Способ по п.10, где рак представляет собой мезотелиому, рак поджелудочной железы, рак яичника, рак желудка, рак легкого или рак эндометрия.
12. Способ по п.10, где рак выбран из группы, состоящей из папиллярной серозной аденокарциномы яичника, светлоклеточной карциномы яичника, смешанной карциномы мюллерова протока и яичника, эндометриоидной муцинозной карциномы яичника, аденокарциномы поджелудочной железы, аденокарциномы протоков поджелудочной железы, серозной карциномы матки, аденокарциномы легкого, карциномы внепеченочного желчного протока, аденокарциномы желудка, аденокарциномы пищевода, аденокарциномы прямой и толстой кишки и аденокарциномы молочной железы.
13. Способ лечения рака у индивида, предусматривающий введение указанному индивиду терапевтически эффективного количества конъюгата по п.5.
14. Способ по п.13, где рак представляет собой мезотелиому, рак поджелудочной железы, рак яичника, рак желудка, рак легкого или рак эндометрия.
15. Способ по п.13, где рак выбран из группы, состоящей из папиллярной серозной аденокарциномы яичника, светлоклеточной карциномы яичника, смешанной карциномы мюллерова протока и яичника, эндометриоидной муцинозной карциномы яичника, аденокарциномы поджелудочной железы, аденокарциномы протоков поджелудочной железы, серозной карциномы матки, аденокарциномы легкого, карциномы внепеченочного желчного протока, аденокарциномы желудка, аденокарциномы пищевода, аденокарциномы прямой и толстой кишки и аденокарциномы молочной железы.
Текст
Согласно изобретению предложены изолированные моноклональные антитела, которые специфично связывают мезотелин с высокой аффинностью, в частности моноклональные антитела человека. В предпочтительном варианте антитела связывают мезотелин человека. В некоторых вариантах осуществления антитела могут интернализацизоваться в клетки,экспрессирующие мезотелин, или могут выступать в качестве медиаторов антигензависимой клеточной цитотоксичности. Далее согласно изобретению предложены антитела к мезотелину,которые способы ингибировать антиген рака яичников СА 125. Также предложены молекулы нуклеиновой кислоты, кодирующие антитела согласно изобретению, вектора экспрессии, клеткихозяева и способы экспрессии антител согласно изобретению. Далее предложены конъюгаты антитела и молекулы-партнера, биспсцифические молекулы и фармацевтические композиции,включающие антитела согласно изобретению. Согласно изобретению также предложены способы детекции мезотелина, а также способы лечения злокачественных опухолей, такие как мезотелиомы,злокачественные опухоли поджелудочной железы и злокачественные опухоли яичников, с использованием антитела к мезотелину согласно изобретению. Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет в соответствии с 119 (е) Свода законов США 35 по следующим предварительным заявкам на патент США: 60/976626, поданной 1 октября 2007 года, 60/991692,поданной 30 ноября 2007 года и 61/077397, поданной 1 июля 2008 года, описания которых включены в настоящий документ посредством ссылки. Уровень техники Мезотелин представляет собой гликопротеин, присутствующий на поверхности мезотелиальной выстилки брюшной, плевральной и перикардиальной полостей тела. Первоначально он был выделен из линии клеток раковой опухоли поджелудочной железы человека HPC-Y5, было показано, что он обладает способностью потенцировать мегакариоциты и поэтому его назвали фактором потенциации мегакариоцитов (MPF) (Yamaguchi et al. (1994) J. Biol. Chem., 269:805-808). КДНК мезотелина клонировали из библиотеки, приготовленной из линии клеток HPC-Y5 (Kojima et al. (1995) J. Biol. Chem., 270:2198421990). КДНК также клонировали с использованием моноклонального антитела K1, которое распознает мезотелиомы (Chang, Pastan (1996) Proc. Natl. Acad. Sci. USA, 93:136-40). В структурном смысле мезотелин экспрессируется на поверхность клетки в виде полипептида-предшественника массой 60 кДа, который в результате протеолиза превращается в разрезанный (shed) компонент массой 31 кДа (соответствуетMPF) и мембраносвязанный компонент массой 40 кДа (Hassan et al. (2004) Clin. Cancer. Res., 10:39373942). Помимо того, что мезотелин экспрессируется нормальными клетками мезотелия, его экспрессия повышена в некоторых опухолях человека, включая все мезотелиомы, многие злокачественные опухоли поджелудочной железы и некоторые злокачественные опухоли желудка, легкого и эндометрия. Например, мезотелин экспрессируется приблизительно в 70% всех злокачественных опухолей яичника, приблизительно 82% папиллярных серозных аденокарцином, приблизительно в 83% всех аденокарцином поджелудочной железы и приблизительно 86% всех аденокарцином протоков поджелудочной железы. Были получены мутантные мыши, в которых ген мезотелина был разрушен путем гомологичной рекомбинации (Bera, T.K., Pastan, I. (2000) Mol. Cell. Biol., 20:2902-2906). При этом не наблюдали никаких аномалий в анатомии, гематологических параметрах или репродуктивной функции, что указывает на то, что функция мезотелина не является необходимой для роста и размножения, по меньшей мере, у использованных мышей. Мезотелин специфичным образом взаимодействует с СА 125 (также известным как MUC-16), муциноподобным белком, присутствующим на поверхности клеток опухолей, который ранее идентифицировали как антиген рака яичника. Кроме того, связывание СА 125 с мембраносвязанным мезотелином опосредует гетеротипическую адгезию клеток, и СА 125 и мезотелин одновременно экспрессируются в аденокарциномах яичника на поздних стадиях (Rump, A. et al. (2004) J. Biol. Chem., 279:9190-9198). Экспрессия мезотелина в перитонеальной полости коррелирует с преимущественными участками формирования метастазов злокачественной опухоли яичников, и считают, что связывание мезотелин-СА 125 способствует метастазированию опухолей яичников (Gubbels, J.A. et al. (2006) Mol. Cancer, 5:50). В свете сказанного выше представляют интерес дополнительные агенты для модулирования активности мезотелина. Краткое описание Согласно настоящему изобретению предложены изолированные моноклональные антитела, в частности антитела человека, которые специфично связывают мезотелин и обладают желаемыми свойствами,такими как высокая аффинность связывания мезотелина человека, интернализация клетками, экспрессирующими мезотелин, ингибирование связывания мезотелина с СА 125 и/или участие в антителозависимой клеточной цитотоксичности (АЗКЦ). Антитела согласно настоящему изобретению можно применять, например, для детектирования (обнаружения) мезотелина или для ингибирования роста клеток,экспрессирующих мезотелин, таких как клетки опухоли, экспрессирующие мезотелин. Согласно одному аспекту настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть такого антитела, причем указанное антитело связывает мезотелин человека и проявляет одно из следующих свойств:(c) ингибирует связывание мезотелина с антигеном рака яичников СА 125;(e) ингибирует рост клеток, экспрессирующих мезотелин in vivo в случае, если оно конъюгировано с цитотоксином. В предпочтительном случае данное антитело демонстрирует по меньшей мере два свойства (а), (b),(с), (d) и (е). В более предпочтительном случае антитело демонстрирует по меньшей мере три из свойств(а)-(е). В более предпочтительном случае антитело демонстрирует четыре из свойств (а)-(е). В еще более предпочтительном случае антитело демонстрирует все пять свойств (а)-(е). В другом предпочтительном варианте реализации антитело связывает мезотелин KD, равное 510-9 М или меньше. В еще одном пред-1 018396 почтительном варианте реализации антитело подавляет рост клеток, экспрессирующих мезотелин, invivo, в случае, когда указанное антитело конъюгировано с цитотоксином. Согласно другому аспекту настоящего изобретения предложено моноклональное антитело человека или антигенсвязывающая часть такого антитела, причем указанное антитело конкурирует за связывание с эпитопом мезотелина человека, которые распознаются антителом, включающим:(а) вариабельную область тяжелой цепи (VH), включающую последовательность аминокислот SEQID NO: 19, и вариабельную область легкой цепи (VL), включающую последовательность аминокислот(b) VH, включающую последовательность аминокислот SEQ ID NO: 20, и VL, включающую последовательность аминокислот SEQ ID NO: 23; или(c) VH, включающую последовательность аминокислот SEQ ID NO: 21, и VL, включающую последовательность аминокислот SEQ ID NO: 24. Эталонные антитела, описанные выше, ниже в настоящем описании обозначаются как эталонные антитела (а)-(с) соответственно. В предпочтительном варианте осуществления эталонное антитело включает VH, включающую последовательность аминокислот SEQ ID NO: 19, и VL, включающую последовательность аминокислотSEQ ID NO: 22. В другом предпочтительном варианте осуществления эталонное антитело включает VH,включающую последовательность аминокислот SEQ ID NO: 20, и VL, включающую последовательность аминокислот SEQ ID NO: 23. В еще одном предпочтительном варианте осуществления эталонное антитело включает VH, включающую последовательность аминокислот SEQ ID NO: 21, и VL, включающую последовательность аминокислот SEQ ID NO: 24. Согласно другому аспекту настоящего изобретения предложено изолированное моноклональное антитело, включающее VH, которая является продуктом или получена из гена VH 3-33 человека или генаVH 3-7 человека, причем указанное антитело специфично связывает мезотелин человека. Согласно другому аспекту настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть антитела, включающее VL, которая является продуктом или получена из гена VKL6 человека или гена VK A27 человека, причем указанное антитело специфично связывает мезотелин человека. Согласно предпочтительному варианту реализации настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть антитела, включающее:(a) VH, которая является продуктом или получена из гена VH 3-33 человека, и VL, которая является продуктом или получена из гена; или(b) VH, которая является продуктом или получена из гена VH 3-7 человека, или VL, которая является продуктом или получена из гена VK A27 человека, причем указанное антитело специфично связывает мезотелии человека. Особенно предпочтительное антитело или антигенсвязывающая часть антитела ("Вариант осуществления А") включает:(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 1;(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 4;(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 7;(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 10;(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 13; и(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 16. Другое особенно предпочтительное антитело или антигенсвязывающая часть антитела ("Вариант осуществления В") включает:(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 2;(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 5;(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 8;(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 11;(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 14; и(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 17. Другое особенно предпочтительное антитело или антигенсвязывающая часть антитела ("Вариант осуществления С") включает:(a) CDR1 вариабельной области тяжелой цепи, включающий SEQ ID NO: 3;(b) CDR2 вариабельной области тяжелой цепи, включающий SEQ ID NO: 6;(c) CDR3 вариабельной области тяжелой цепи, включающий SEQ ID NO: 9;(d) CDR1 вариабельной области легкой цепи, включающий SEQ ID NO: 12;(e) CDR2 вариабельной области легкой цепи, включающий SEQ ID NO: 15; и(f) CDR3 вариабельной области легкой цепи, включающий SEQ ID NO: 18. Согласно другому аспекту настоящего изобретения предложено изолированное моноклональное антитело, или антигенсвязывающая часть антитела, включающее: (a) VH, включающую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 19-21; и (b) VL, включающую последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 22-24, причем указан-2 018396 ное антитело специфично связывает мезотелии человека. Предпочтительная комбинация включает: (a) VH, включающую последовательность аминокислотSEQ ID NO: 19; и (b) VL, включающую последовательность аминокислот SEQ ID NO: 22. Другая предпочтительная комбинация включает: (a) VH, включающую последовательность аминокислот SEQ ID NO: 20; и (b) VL, включающую последовательность аминокислот SEQ ID NO: 23. Другая предпочтительная комбинация включает: (a) VH, включающую последовательность аминокислот SEQ ID NO: 21; и (b) VL, включающая последовательность аминокислот SEQ ID NO: 24. Антитела согласно настоящему изобретению могут представлять собой, например, антитела изотипа IgG1 или IgG4. В качестве альтернативы они могут представлять собой фрагменты антител, такие как фрагменты Fab, Fab' или Fab'2 или одноцепочечные антитела. Согласно настоящему изобретению также предложен иммуноконъюгат, включающий антитело согласно настоящему изобретению или антигенсвязывающую часть такого антигена, которые связаны с молекулой-партнером. В особенно предпочтительном варианте осуществления настоящего изобретения предложен иммуноконъюгат, включающий антитело согласно настоящему изобретению или антигенсвязывающая часть такого антитела, которые связаны с соединением цитотоксином А, определение которого дано ниже, а описание можно найти в WO 2008/083312, текст которой включен в настоящее описание посредством ссылки. Согласно настоящему изобретению предложены следующие предпочтительные иммуноконъюгаты, включающие цитотоксин А, связанный с антителом согласно настоящему изобретению, причем указанное антитело (i) конкурирует с эталонным антителом (а), (b) или (с) за связывание с эпитопом мезотелина человека; (ii) соответствует варианту осуществления A; (iii) соответствует варианту осуществления В или (iv) соответствует варианту осуществления С. Некоторые из таких конъюгатов антитела и молекулы-партнера могут интернализоваться в клетки, экспрессирующие мезотелин, и обладают способностью опосредовать АЗКЦ. В одном варианте такие конъюгаты антитела и молекулы-партнера образованы при помощи химических линкеров. В некоторых вариантах реализации линкер представляет собой пептидильный линкер,обозначаемый в настоящем описании следующим образом: (L4)p-F-(L1)m. Другие линкеры включают гидразинный и дисульфидный линкеры, обозначаемые (L4)p-H-(L1)m или (L4)p-J-(L1)m соответственно. В дополнение к линкерам, присоединяемым к молекуле-партнеру, согласно настоящему изобретению также предложены расщепляемые линкерные фрагменты, которые пригодны для присоединения к, по существу, любому виду молекул. Согласно настоящему изобретению также предложена биспецифическая молекула, включающая антитело или антигенсвязывающую часть антитела согласно настоящему изобретению, связанную со вторым функциональным фрагментом, обладающим другой специфичностью связывания, чем указанное антитело или антигенсвязывающая часть антител. Также предложены композиции, включающие антитело или антигенсвязывающую часть антитела,или иммуноконъюгат, или биспецифичная молекула согласно настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также охватывает нуклеиновые кислоты, кодирующие антитела или антигенсвязывающие части антител согласно настоящему изобретению, а также векторы экспрессии, включающие такие нуклеиновые кислоты, и клетки-хозяева, включающие такие векторы экспрессии. Также предложены способы получения антител к мезотелину с использованием клеток-хозяев, включающих такие вектора экспрессии, которые могут включать следующие этапы: (i) экспрессию антитела в клеткехозяине и (ii) выделение антитела из клетки-хозяина. Согласно другому аспекту настоящего изобретения предложен способ получения антитела к мезотелину. Указанный способ включает:(b) изменение по меньшей мере одного остатка аминокислоты в последовательности VH антитела и/или в последовательности VL антитела с получением по меньшей мере одной измененной последовательности антитела и(c) экспрессию указанной измененной последовательности антитела в виде белка. Согласно другому аспекту настоящего изобретения предложен способ ингибирования роста клеток опухоли, экспрессирующих мезотелин, включающий осуществление контакта клетки опухоли, экспрессирующей мезотелин, с конъюгатом антитела и молекулы-партнера согласно настоящему изобретению,что обеспечивает ингибирование роста клетки опухоли. В предпочтительном варианте клетка опухоли,экспрессирующая мезотелин, представляет собой клетку мезотелиомы, клетку опухоли поджелудочной железы, клетку опухоли яичника, клетку опухоли желудка, клетку опухоли легкого или клетку опухоли эндометрия. В других вариантах осуществления клетка опухоли, экспрессирующая мезотелин, является клеткой раковой опухоли, выбранной из группы, состоящей из мезотелиомы, папиллярной серозной аденокарциномы яичников, светлоклеточной аденокарциномы яичника, смешанной аденокарциномы мюллерова протока и яичника, эндометриоидной карциномы яичника, аденокарциномы поджелудочной железы, аденокарциномы протока поджелудочной железы, серозной карциномы матки, аденокарциномы легкого, карциномы внепеченочных желчных протоков, аденокарциномы пищевода, аденокарциномы прямой и толстой кишки и аденокарциномы молочной железы. Согласно другому аспекту настоящего изобретения предложен способ лечения рака у субъекта. Способ включает введение субъекту конъюгата антитела и молекулы-партнера согласно настоящему изобретению, что обеспечивает лечение рака у субъекта. Особенно предпочтительным видами рака для лечения являются мезотелиомы, раковые опухоли поджелудочной железы, раковые опухоли яичников,раковые опухоли желудка и раковые опухоли эндометрия. В других вариантах осуществления рак, который лечат, выбирают из группы, состоящей из мезотелиом, папиллярных серозных аденокарцином яичника, светлоклеточных аденокарцином яичника, смешанных карцином мюллерова протока и яичника,аденокарцином поджелудочной железы, серозных карцином матки, аденокарцином легкого, карцином внепеченочных желчных протоков, аденокарцином желудка, аденокарцином пищевода, аденокарцином прямой и толстой кишки и аденокарцином молочной железы. Краткое описание чертежей На фиг. 1 А показаны нуклеотидная (SEQ ID NO: 25) и аминокислотная последовательности (SEQID NO: 19) VH моноклонального антитела 3 С 10 человека. Контуром выделены участки CDR1 (SEQ IDID NO: 22) VL моноклонального антитела человека 3 С 10. Контуром выделены участки CDR1 (SEQ IDID NO: 20) VH моноклонального антитела человека 6A4. Контуром выделены участки CDR1 (SEQ ID NO: 2), CDR2 (SEQ ID NO: 5) и CDR3 (SEQ ID NO: 8). На фиг. 2 В показаны нуклеотидная (SEQ ID NO: 29) и аминокислотная последовательности (SEQID NO: 23) VL моноклонального антитела человека 6A4. Контуром выделены участки CDR1 (SEQ ID NO: 11), CDR2 (SEQ ID NO: 14) и CDR3 (SEQ ID NO: 17). На фиг. 3 А показаны нуклеотидная (SEQ ID NO: 27) и аминокислотная последовательности (SEQID NO: 21) VH моноклонального антитела человека 7 В 1. Контуром выделены участки CDR1 (SEQ ID NO: 3), CDR2 (SEQ ID NO: 6) и CDR3 (SEQ ID NO: 9). На фиг. 3 В показаны нуклеотидная (SEQ ID NO: 30) и аминокислотная последовательности (SEQID NO: 24) VL моноклонального антитела человека 7 В 1. Контуром выделены участки CDR1 (SEQ ID NO: 12), CDR2 (SEQ ID NO: 15) и CDR3 (SEQ ID NO: 18). На фиг. 4 показано выравнивание аминокислотной последовательности VHs 3C10 (SEQ ID NO: 19) и 6 А 4 (SEQ ID NO: 20) с аминокислотной последовательностью VH 3-33 зародышевой линии человека(SEQ ID NO: 31). На фиг. 5 показано выравнивание аминокислотной последовательности VLs 3C10 (SEQ ID NO: 22) и 6 А 4 (SEQ ID NO: 23) с аминокислотной последовательностью VH L6 зародышевой линии человека (SEQID NO: 33). На фиг. 6 показано выравнивание аминокислотной последовательности VH 7B1 (SEQ ID NO: 21) с аминокислотной последовательностью VH 3-7 зародышевой линии человека (SEQ ID NO: 32). На фиг. 7 показано выравнивание аминокислотной последовательности VL 7B1 (SEQ ID NO: 24) с аминокислотной последовательностью VK A27 зародышевой линии человека (SEQ ID NO: 34). На фиг. 8 показаны результаты теста на адгезию клеток OVCAR3 опухоли яичников. На фиг. 9 А и 9 В показаны результаты исследования in vivo с использованием модели ксенографтаNCI-H226 (мезотелиома легкого) на мышах. На фиг. 10 А и 10 В показаны результаты исследования in vivo с использованием модели ксенографта НРАС (карциномы поджелудочной железы) с использованием мышей. Фиг. 11 представляет собой график, демонстрирующий, что иммуноконъюгат согласно настоящему изобретению обеспечивал уменьшение объемов раковой опухоли яичника в модели ксенографта с использованием мышей. На фиг. 12 показана АЗКЦ раковых клеток яичника (клетки OVCAR3, фиг. 12 а) и клеток NSCLC(клетки Н 226, фиг. 12B), опосредуемая нефукозилированным антителом согласно настоящему изобретению. Подробное описание изобретения Согласно настоящему изобретению предложены моноклональные антитела, в частности антитела человека, которые связываются с мезотелином человека и обладают желаемыми свойствами. В некоторых вариантах осуществления антитела согласно настоящему изобретению получены из определенных последовательностей зародышевой линии тяжелой и легкой цепей и/или включают определенные струк-4 018396 турные comprise элементы, такие как участки CDR, включающие определенные последовательности аминокислот. Согласно настоящему изобретению предложены изолированные антитела, способы получения таких антител, конъюгаты антитела и молекулы-партнера и биспецифичные молекулы. Также предложены варианты или альтернативы, такие как гомологичные антитела, антитела с консервативными изменениями, сконструированные или модифицированные антитела, фрагменты антител и миметики антител, каждый из которых описан ниже. Согласно настоящему изобретению также предложены способы применения таких антител, например, для детектирования белка мезотелина, а также способы применения антител к мезотелину согласно настоящему изобретению для ингибирования роста клеток, экспрессирующих мезотелин, таких как клетки опухоли. Соответственно согласно настоящему изобретению предложены способы применения антител к мезотелину согласно настоящему изобретению для лечения различных типов рака, например рака яичников, рака поджелудочной железы, рака желудка, рака легкого, рака эндометрия и мезотелиом. В предпочтительном варианте указанное антитело, конъюгат, биспецифичная молекула, вариант или модифицированная форма обладают одним или более из указанных свойств: связывание с мезотелином человека, интернализация клетками, экспрессирующими мезотелин,подавление связывания мезотелина с СА 125, участие в АЗКЦ в отношении клеток, экспрессирующих мезотелин, и подавление роста клеток опухоли, экспрессирующих мезотелин, in vivo. Антитела могут представлять собой антитела человека (предпочтительно), гуманизированные или химерные антитела. Для облегчения понимания настоящего описания необходимо в начале дать определение некоторым терминам. Дополнительные определения даны в тексте подробного описания. Термин "мезотелин" включает варианты, гомологи, ортологи и паралоги. Например, антитела, специфичные к белку мезотелину, возможно в некоторых случаях вступают в перекрестную реакцию с белком мезотелином из видов, отличных от человека. В других вариантах осуществления антитела могут быть полностью специфичны в отношении мезотелина человека и не проявлять кросс-реактивность в отношении других видов или кросс-реактивность других типов, или проявлять кросс-реактивность с некоторыми другими, но не всеми другими, видами (например, проявлять кросс-реактивность с мезотелином приматов, но не с мезотелином мыши). Термин "мезотелин человека" относится к последовательности мезотелина человека, такой как полная аминокислотная последовательность мезотелина человека,имеющая номер доступа в базе данных Genbank NP005814. Термин "мезотелин мыши" относится к последовательности мезотелина мыши, такой как полная аминокислотная последовательность мезотелина мыши, имеющая номер доступа в базе данных Genbank NP061345. N-концевая часть мезотелина также известна как фактор потенцирования мегакариоцитов (MPF). Последовательность мезотелина человека может отличаться от мезотелина человека, имеющего номер NP005814 в Genbank, например, консервативными мутациями или мутациями в неконсервативных участках, и при этом указанный мезотелин обладает, по существу, той же биологической функцией, что и мезотелий человека, хранящийся в Genbank под номером NP005814, такой как связывание СА 125. Конкретная последовательность мезотелина человека обычно будет по меньшей мере на 90% идентична аминокислотной последовательности мезотелина человека, хранящейся в Genbank под номеромNP005814, и содержит остатки аминокислот, позволяющие определить, что данная последовательность является последовательностью человека при сравнении с последовательностями мезотелина других видов (например, мыши). В некоторых случаях мезотелин человека может быть по меньшей мере на 95% или даже по меньшей мере на 96, 97, 98 или 99% идентичен по аминокислотной последовательности мезотелину, хранящемуся в Genbank под номером NP005814. В некоторых вариантах осуществления последовательность мезотелина человека демонстрирует различие не более чем по 10 аминокислотами с последовательностью мезотелина под номером NP005814 в Genbank. В некоторых вариантах осуществления мезотелин человека демонстрирует не более 5 или даже не более 4, 3, 2 и 1 отличий по аминокислотам от последовательностиGenbank NP005814 в Genbank. Процент идентичности может быть определен согласно настоящему описанию. Термин "СА 125" относится к антигену карциномы яичников или маркеру раковой опухоли яичника,также известному как MUC-16. Термин "СА 125 человека" относится к последовательности СА 125 человека, такой как полная аминокислотная последовательность СА 125 человека, хранящаяся в базе Genbank под номером NP078966. Последовательность СА 125 человека может отличаться от последовательности СА 125, имеющей номер NP078966 в Genbank, например, консервативными мутациями или мутациями в неконсервативных участках. Конкретная последовательность СА 125 обычно будет по меньшей мере на 90% идентична аминокислотной последовательности 90% СА 125, имеющемуNP078966 в Genbank, и содержит остатки аминокислот, позволяющие определить, что данная последовательность является последовательностью человека при сравнении с последовательностями СА 125 других видов (например,мыши) СА 125. В некоторых случая СА 125 человека может быть по меньшей мере на 95% или даже по меньшей мере на 96, 97, 98 или 99% идентичен по аминокислотной последовательности СА 125NP078966 в Genbank. В некоторых вариантах осуществления последовательность СА 125 человека демонстрирует отличие не более чем по 10 аминокислотами от последовательности СА 125NP078966 вGenbank. В некоторых вариантах реализации СА 125 человека демонстрирует не более 5 или даже не более 4, 3, 2 и 1 отличий по аминокислотам от последовательности СА 125NP078966 в Genbank. Про-5 018396 цент идентичности может быть определен согласно настоящему описанию. Термин "иммунный ответ" относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитов, гранулоцитов и растворимых макромолекул, продуцируемых указанными клетками или печенью (включая антитела, цитокины и комплемент), которое обеспечивает селективное повреждение, разрушение или устранение из организма человека попавших в него патогенов, клеток или тканей,инфицированных патогенами, раковых клеток, или, в случае аутоиммунного ответа или патологического воспаления, нормальных клеток или тканей человека. Термин "путь передачи сигнала" относится к биохимическим отношениям между различными молекулами, участвующими в передаче сигнала от одной части клетки к другой части клетки. Фраза "рецептор поверхности клетки" включает молекулы и комплексы, способные принимать сигнал и передавать сигнал по плазматической мембране клетки. Примером "рецептора поверхности клетки" является мезотелин человека. Термин "антитело" относится к целым антителам и любым антигенсвязывающим фрагментам ("антигенсвязывающая часть") или их одиночным цепям. Термин "антитело" относится к гликопротеину,включающему две тяжелые (Н) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями, или антигенсвязывающей части гликопротеина. Каждая тяжелая цепь включает вариабельную область (обозначаемую в настоящем описании сокращением VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь включает вариабельную область легкой цепи (обозначаемую в настоящем описании сокращением VL) и константную область легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH и VL можно далее подразделить на три гипервариабельных участка, называемых участками, определяющими комплементарность (CDR), между которыми расположены более консервативные участки, называемые каркасными участками (FR). Каждая VH и VL состоят из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области легкой и тяжелой цепей включают связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента. Термин "фрагмент антитела" и "антигенсвязывающая часть" антитела (или просто "часть антитела") в настоящей заявке относится к одному или более фрагментам антитела, которые сохраняют способность специфично связываться с антигеном (например, мезотелином). Было показано, что функцию антитела связывать антиген могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающая часть" антитела, включают (i) Fab-фрагмент,одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области;(iii) Fab'-фрагмент, который, по существу, представляет собой фрагмент Fab с частью шарнирной областиVH и CH1; (v) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (vi) dAb-фрагмент(Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; (vii) изолированный гипервариабельный участок (CDR) и (viii) нанотело, вариабельный участок тяжелой цепи, включающий один вариабельный домен и два константных домена. Далее, хотя указанные два домена фрагмента Fv, VL и VH кодируются различными генами, их можно соединить с использованием рекомбинантных методов синтетическим линкером, что позволяет получать их в виде единой белковой цепи, и при этом области VL и VH объединяются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см.,например, Bird et al. (1988) Science, 242:423-426 и Huston et al. (1988) Proc. Natl. Acad. Sci. USA, 85:58795883). Предполагается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающая часть" антитела. Такие фрагменты антител получают с использованием стандартных методик,известных специалистам в данной области, также проводят скрининг данных фрагментов на предмет возможности их использования таким же образом, как и интактных антител."Изолированное антитело" относится к антителу, по существу, не содержащему антител, обладающих другими антигенными специфичностями (например, изолированное антитело, которое специфично связывает мезотелин, по существу, не содержит антител, которые специфично связывают другие антигены). Изолированное антитело, которое специфично связывает мезотелин, может, однако, проявлять перекрестную реактивность в отношении других антигенов, таких как молекулы мезотелина из других видов. Более того, изолированное антитело возможно, по существу, не содержит другого клеточного материала и/или химических веществ. Термины "моноклональное антитело" или "композиция моноклонального антитела" относятся к составу, содержащему молекулы антител одной структуры. Композиция моноклонального антитела демонстрирует единственный вид специфичности связывания и аффинность в отношении конкретного эпитопа. Термин "антитело человека" относится к антителам, включающим вариабельные области, в которых и каркасные участки, и участки CDR получены из последовательностей зародышевой линии имму-6 018396 ноглобулина человека. Кроме того, в случае если антитело включает константную область, указанная константная область также получена из последовательностей зародышевой линии иммуноглобулина человека. Антитела человека согласно настоящему изобретению включают остатки аминокислот, не кодирующиеся последовательностями зародышевой линии иммуноглобулина человека (например, мутации,введенные путем случайного сайт-специфичного мутагенеза in vitro или путем соматических мутаций invivo). Однако предполагается, что "антитело человека" не включает антитела, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мышь, привиты на каркасные последовательности человека. Термин "моноклональное антитело человека" относится к антителам, проявляющим одинаковую(единственную) специфичность, которые включают вариабельные области, в которых и каркасные участки, и участки CDR получены из последовательностей зародышевой линии иммуноглобулина человека. В одном варианте осуществления моноклональные антитела человека продуцируются гибридомой, которая включает В-клетку, полученную из трансгенного животного, не являющегося человеком, например трансгенной мыши, геном которой включает трансген тяжелой цепи человека и трансген легкой цепи,слитую с иммортализованной клеткой. Термин "рекомбинантное антитело человека" в настоящем описании включает все антитела человека, которые получают, экспрессируют, создают или изолируют рекомбинантными средствами, такие как(а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам иммуноглобулина человека, или полученная из них гибридома (описана ниже), (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела человека, например из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной коллекции антител человека, и (d) антитела, полученные, экспрессированные, созданные или выделенные другими средствами, которые включают сплайсирование последовательностей генов иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека включают вариабельные области, в которых каркасные участки и CDR получены из последовательностей зародышевой линии иммуноглобулина человека. В некоторых вариантах осуществления такие рекомбинантные антитела человека могут быть подвергнуты in vitro мутагенезу (или, в случае использования животного, которое является трансгенным по последовательностям Ig человека, in vivo соматическому мутагенезу), и таким образом последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и получены из последовательностей VH и VL зародышевой линии человека и являются родственными указанным последовательностям, возможно не встречаются в природе в репертуаре зародышевой линии антитела человека in vivo. Термин "изотип" относится к классу антител (например, IgM или IgGl), который кодируется генами константной области тяжелой цепи. Фразы "антитело, распознающее антиген" и "антитело, специфичное к антигену" используются равнозначно с фразой "антитело, которое специфично связывается с антигеном". Термин "производные антитела человека" относится к любой модифицированной форме антитела человека, например к конъюгату антитела с другим агентом или антителом. Термин "гуманизированное антитело" относится к антителам, в которых последовательности CDR,полученные из зародышевой линии другого вида млекопитающих, такого как мышь, привиты на каркасные последовательности человека. Также могут быть осуществлены другие модификации каркасного участка в пределах последовательностей каркасных участков человека. Термин "химерное антитело" относится к антителам, в которых последовательности вариабельных областей получены из одного вида, а последовательности вариабельных областей получены из другого вида, такие как антитела, в которых последовательности вариабельных областей получены из антитела мыши, а последовательности константных областей получены из антитела человека. Термин "миметик антитела" относится к молекулам, способным имитировать способность антитела связывать антиген, которые не ограничены нативными структурами антител. Примеры таких антител включают, но не ограничиваются перечисленными, антитела, белки DARP, антикалины (Anticalin), авимеры (Avimer) и версатела (Versabody), каждое из которых описано ниже. Термин "молекула-партнер" относится к молекуле, конъюгированной с антителом в конъюгате антитела и молекулы-партнера. Примеры молекул-партнеров включают лекарственные средства, токсины,маркерные молекулы, белки и терапевтические агенты. В настоящем описании предполагается, что антитело, которое "специфично связывается с мезотелином человека", относится к антителу, которое связывается с мезотелином человека с KD 110-7 М или меньше, более предпочтительно 510-8 М или меньше, более предпочтительно 310-8 М или меньше, более предпочтительно 110-8 М или меньше и еще более предпочтительно с 510-9 М или меньше. Термин "по существу, не связывается" с белком или клетками в настоящем описании означает, "не связывается с белком или клетками с высокой аффинностью", т.е. связывается с белком или клетками сKD 110-6 М или выше, более предпочтительно 110-5 М или выше, более предпочтительно 110-4 М или выше, более предпочтительно 110-3 М или выше и еще более предпочтительно 110-2 М или выше. Термин "Kassoc", или "Ka", относится к скорости ассоциации определенного взаимодействия антитело-антиген, а термин "Kdis", или "Kd", в настоящем описании относится к скорости диссоциации определенного взаимодействия антитело-антиген. В настоящем описании термин "KD" относится к константе диссоциации, которую вычисляют по отношению Kd к Ka (т.е. Kd/Ka) и выражают в виде молярной концентрации (М). Значения KD для антител могут быть определены с использованием хорошо известных в данной области методов. Предпочтительный метод для определения KD антитела включает использование поверхностного плазмонного резонанса предпочтительно с использованием биосенсорной системы,такой как система BIAcore. Термин "высокая аффинность" для антитела IgG относится к антителу, обладающему KD в отношении целевого антигена 110-7 М или меньше, более предпочтительно 510-8 М или меньше, еще более предпочтительно 110-8 М или меньше, даже более предпочтительно 510-9 М или меньше и еще более предпочтительно 110-9 М или меньше. Однако "высокая аффинность" связывания для других изотипов антител может отличаться. Например, "высокая аффинность" связывания для изотипа IgM относится к антителу, имеющему KD 10-6 М или меньше, более предпочтительно 10-7 М или меньше, еще более предпочтительно 10-8 М или меньше. Термин "субъект" включает любое животное, являющееся или не являющееся человеком. Термин"животное, не являющееся человеком" включает всех позвоночных, например млекопитающих и не млекопитающих, таких как приматы, не относящихся к виду человека, овцы, собаки, кошки, лошади, коровы, куры, амфибии, рептилии и т.д. Термин "алкил", сам по себе или в качестве части другого заместителя, обозначает, если не указано другое, углеводородный радикал с прямой или разветвленной цепью или циклический, либо комбинацию указанных радикалов, причем указанные радикалы могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать одно- или двухвалентные радикалы, включающие указанное число атомов углерода (т.е. C1-С 10 означает от одного до десяти атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничиваются перечисленными, такие группы, как метил,этил, n-пропил, изопропил, n-бутил, t-бутил, изобутил, сек-бутил, циклогексил, (циклогексил)метил, циклопропилметил, гомологи или изомеры, например, n-пентила, n-гексила, n-гептила, n-октила и т.п. Ненасыщенная углеводородная группа представляет собой группу, включающую одну или более двойных или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничиваются перечисленными, винил, 2-пропенил, кротил, 2-изопентил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4 пентидиенил), этинил, 1- и 3-пропинил, 3-бутинил, а также высшие гомологи и изомеры. Предполагается, что термин "алкил", если не указано другое, включает производные алкила, которые подробно определены ниже, такие как "гетероалкил". Алкильные группы, ограниченные углеводородными группами,называются "гомоалкил". Термин "алкилен" сам по себе или как часть другого заместителя обозначает двухвалентный радикал, полученный из алкана. Примеры включают, но не ограничиваются, -СН 2 СН 2 СН 2 СН 2- и дополнительно включают группы, относящиеся к "гетероалкиленам", описанным ниже. Обычно группа алкила(или алкилена) включает от 1 до 24 атомов углерода, причем предпочтительными согласно настоящему изобретению являются группы, включающие 10 атомов углерода или меньше. "Низший алкил" или"низший алкилен" представляет собой группу алкила или алкилена с короткой цепью, обычно включающей восемь атомов углерода или меньше. Термин "гетероалкил", сам по себе или в комбинации с другим термином, обозначает, если не указано другое, стабильный углеводородный радикал с прямой или разветвленной цепью или циклический радикал, либо комбинацию указанных радикалов, которые состоят из указанного количества атомов углерода и по меньшей мере одного гетероатома, выбранного из О, N, Si и S, причем атомы азота, углерода и серы возможно окислены, а гетероатом азота возможно кватернизован. Гетероатом(ы) О, N, S и Si могут располагаться в любом внутреннем положении гетероарильной группы или в положении, в котором алкильная группа присоединена к остальной части молекулы. Примеры включают, но не ограничиваются перечисленными, -СН 2 СН 2 ОСН 3, -CH2CH2NHCH3, -CH2CH2N(CH3)2, -CH2SCH2CH3, -CH2CH2S (O)CH3,-CH2CH2S(O)2CH3, -CH=CHOCH3, -Si(CH3)3, -CH2CH=NOCH3 и -CH=CHN(CH3)2. До двух гетероатомов могут быть расположены последовательно, как, например, в -CH2NHOCH3 и -CH2OSi(СН 3)3. Аналогично,термин "гетероалкилен" сам по себе или как часть другого заместителя обозначает двухвалентный радикал, являющийся производным гетероалкила. Примеры включают, но не ограничиваются перечисленными: -CH2CH2SCH2CH2- и -CH2SCH2CH2NHCH2-. В группах гетероалкиленов гетероатомы также могут располагаться на одном или обоих концах цепи (например, алкиленокси, алкилендиокси, алкиленамино,алкилендиамино и т.д.). Термины "гетероалкил" и "гетероалкилен" охватывают поли(этиленгликоль) и его производные (см., например, каталог Shearwater Polymers, 2001). Далее, для связывающих групп,представляющих собой алкилен или гетероалкилен, порядок, в котором записана форма связующей группы, не предполагает определенной ориентации данной связующей группы. Например, формула включающему от 1 до 6 атомов углерода. Термины "алкокси", "алкиламино", "алкилсульфонил" и "алкилтио" (или тиоалкокси) используются в своем обычном смысле и относятся к алкильным группам, присоединенным к оставшейся части молекулы через атом кислорода, аминогруппу, группу SO2 или атом серы соответственно. Термин "арилсульфонил" относится к арильной группе, присоединенной к остальной части молекулы через группу SO2, а термин "сульфгидрильная" относится к группе SH. В целом "заместитель ацила" также выбирают из группы, определенной выше. В настоящем описании "заместитель ацила" относится к группам, присоединенным к и заполняющим валентность углерода карбонильной группы, который либо напрямую, либо опосредованно присоединен к полициклическому ядру соединения согласно настоящему изобретению. Термины "циклоалкил" и "гетероциклоалкил", сами по себе или в комбинации с другими терминами, обозначают, если не указано другое, циклические варианты замещенного или незамещенного "алкила" и замещенного или незамещенного "гетероалкила" соответственно. Дополнительно в случае гетероциклоалкила гетероатом занимает положение, в котором гетероцикл присоединен к остальной части молекулы. Примеры циклоалкила включают, но не ограничиваются перечисленными: циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкилов включают,но не ограничиваются перечисленными: 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил,3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п. Гетероатомы и атомы углерода возможно окислены. Термины "гало" или "галоген", самостоятельно или в качестве части другого заместителя, означают,если не указано другое, атом фтора, хлора, брома или йода. Дополнительно предполагается, что такие термины, как "галоалкил", включают моногалоалкил и полигалоалкил. Например, термин "гало(C1C4)алкил" включает, но не ограничивается перечисленными, трифторметил, 2,2,2-трифторэтил, 4 хлорбутил, 3-бромпропил и т.д. Термин "арил" означает, если не указано другое, замещенный или незамещенный полиненасыщенный углеводородный заместитель, которые может представлять собой единственное кольцо или множество колец (предпочтительно от 1 до 3 колец), которые сопряжены или связаны ковалентно друг с другом. Термин "гетероарил" относится к группам арилов (или кольцам), которые содержат от одного до трех гетероатомов, выбранных из N, О и S, причем атомы азота, углерода и серы могут быть окислены, а атом(ы) азота возможно кватернизован. Группа гетероарила может быть соединена с остальной частью молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включаютфенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил,4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изооксазолил,4-изооксазолил, 5-изооксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3 тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2 бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой из указанной выше арильной и гетероарильной системы колец выбирают из группы приемлемых заместителей, описанных ниже. "Арил" и "гетероарил" также охватывают систему колец, в которых одна или более систем неароматических колец сопряжены или связаны другим образованием арильной или гетероарильной системы колец. Для краткости, термин "арил" в случае использования в комбинации с другими терминами (например, арилокси, аритиокси, арилалкил) включает и арильные и гетероарильные кольца, определенные выше. Таким образом, термин "арилалкил" включает радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенэтил, пиридилметил и т.д.), включая алкильные группы, в которых атом углерода (например, группа метилена) заменен, например, на атом кислорода (например,феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.д.). Каждый из приведенных выше терминов (например, "алкил", "гетероалкил", "арил" и "гетероарил") включает и замещенные, и незамещенные формы указанного радикала. Предпочтительные заместители для каждого типа радикала приведены ниже. Заместители для алкильных и гетероалкильных радикалов (включая группы, часто называемые алкиленом, алкенилом, гетероалкиленом, гетероалкенилом, алкинилом, циклоалкилом, гетероциклоалкилом, циклоалкенилом и гетероциклоалкенилом) в целом называются "заместителями алкила" и "заместителями гетероалкила"соответственно и могут представлять собой одну или более из групп, выбранных из, но не ограниченных: -OR', =O, =NR', =NOR', -NR'R", -SR', -галоген, -SiR'R"R'", -OC(=O)R', -C(=O)R',-CO2R',-CONR'R",-ОС(=O)NR'R",-NR"C(=O)R',-NR'C(=O)NR"R"',-NR"C(=O)2R',-NRC(NR'R"R"')=NR, -NRC(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN и -NO2, в количестве, лежащем в диапазоне от нуля до (2m'+1), где m' представляет собой общее число атомов углевода в данном радикале. Каждый из R', R", R"' и R предпочтительно независимо относится к водороду,замещенному или незамещенному гетероарилу, замещенному или незамещенному арилу, например к арилу, замещенному 1-3 галогенами, группам алкокси и тиоалкокси или арилалкильным группам. В случае, когда соединение согласно настоящему изобретению включает более одной группы R, например,-9 018396 каждая из групп R выбрана независимо так же, как и каждая из групп R', R", R'" и R в случае, когда присутствует более одной такой группы. В случае, когда R' и R" присоединены к атому азота, они возможно объединены с указанным атомом азота с образованием 5-, 6- или 7-членного кольца. Например,предполагается что -NR'R" включает, но не ограничивается перечисленными, 1-пирролидинил и 4 морфолинил. Из приведенного выше обсуждения заместителей специалист в данной области поймет, что термин "алкил" включает группы, включающие атомы углерода, связанные с группами, отличными от групп водорода, такими как галоалкил (например, -CF3 и -CH2CF3) и ацил (например, -C(=O)CH3,-C(=O)CF3, -С(=O)СН 2 ОСН 3 и т.п.). Аналогично заместителям, описанным для алкильного радикала, заместители для арильного и гетероарильного радикалов, в общем, называются "заместителями арила" и "заместителями гетероарила" соответственно, они могут быть различными и выбраны из, например: галогена, -OR', =O, =NR', =N-OR',-NR'R", -SR', -галогена, -SiR'R"R"', -OC(=O)R', -C(=O)R', -CO2R', -C(=O)NR'R", -ОС(=O)NR'R",-NR"C(=O)R', -NR'С(=O)NR"R"', -NR"CO2R', -NRC(NR'R")=NR'", -S(=O)R', -S(=O)2R', -S(=O)2NR'R",-NRSO2R', -CN и -NO2, -R', -N3, -CH(Ph)2, фтор(С 1-С 4)алкокси и фтор(C1-C4)алкил, в количестве, лежащем в диапазоне от нуля до общего числа доступных валентностей в ароматической системе колец, и при этом R', R", R"' и R предпочтительно независимо выбраны из углевода, (C1-C8)алкила и гетероалкила,незамещенного арила и гетероарила, (незамещенный арил)-(С 1-С 4)алкила и (замещенный арил)окси-(С 1 С 4)алкила. В случае, если соединение согласно настоящему изобретению включает более одной группыR, например, каждая из групп R независимо выбрана так же, как каждая группа R', R", R'" и R в случае,если присутствует более одной такой группы. Два заместителя арила на соседних атомах возможно заменены заместителем формулы -Т-С(О)(CRR')q-U-, где Т и U независимо представляют собой -NR-, -O-, -CRR'- или одинарную связь и q представляет собой целое число от 0 до 3. В качестве альтернативы два заместителя на соседних атомах кольца арила или гетероарила могут быть возможно заменены заместителем формулы -А-(СН 2)r-В-, где А и В независимо представляют собой -CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь, и r представляет собой целое число от 1 до 4. Одна из однократных связей образованного таким образом нового кольца возможно может быть заменена двойной связью. В качестве альтернативы два заместителя на соседних атомах кольца арила или гетероарила могут быть возможно заменены заместителем формулы -(CRR')s X(CR"R'")d-, где s и d независимо представляют собой целое число от 0 до 3 и X представляет собой -O-, -NR'-, -S-, -S(=O)-, -S(=O)2- или-S (=O)2NR'-. Заместители R, R', R" и R'" предпочтительно независимо выбраны из углевода или замещенного или незамещенного (C1-С 6)алкила. В настоящей заявке термин "дифосфат" включает, без ограничения, сложный эфир фосфорной кислоты, содержащий две фосфатные группы. Термин "трифосфат" включает, без ограничения, сложный эфир фосфорной кислоты, включающий три фосфатные группы. В настоящей заявке термин "гетероатом" включает кислород (О), азот (N), серу (S) и кремний (Si). Символ "R" представляет собой сокращение, которое обозначает группу заместителя, которая выбрана из замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила и замещенного или незамещенного гетероциклила, если из контекста не следует другое. В приведенных ниже подразделах различные аспекты изобретения описаны более подробно. Антитела к мезотелину, обладающие особыми функциональными свойствами. Антитела согласно настоящему изобретению характеризуются особыми функциональными признаками или свойствами. Например, они специфично связываются с мезотелином человека, таким как мезотелин человека, экспрессируемый на поверхности клетки. В предпочтительном варианте антитело согласно настоящему изобретению связывается с мезотелином человека с KD 110-7 М или меньше, более предпочтительно с KD 510-8 М или меньше и даже более предпочтительно с KD 110-8 М или меньше. Антитела к мезотелину согласно настоящему изобретению связываются с мезотелином человека и предпочтительно проявляют одно из следующих свойств:(c) ингибируют связывание мезотелина с антигеном рака яичников СА 125;(d) демонстрируют антителозависимую клеточную цитотоксичность (АЗКЦ) в отношении клеток,экспрессирующих мезотелин; и(e) ингибируют рост клеток, экспрессирующих мезотелин, in vivo, в случае, когда антитело конъюгировано с цитотоксином. В предпочтительном случае антитело согласно настоящему изобретению связывается с белком мезотелином с KD 510-8 М или меньше, связывается с белком мезотелином с KD 310-8 М или меньше, связывается с белком мезотелином с KD 110-8 М или меньше, связывается с белком мезотелином с KD 710-9 М или меньше, связывается с белком мезотелином с KD 610-9 М или меньше или связывается с белком мезотелином с KD 510-9 М или меньше. Аффинность связывания антитела в отношении мезотелина может быть определена, например, при помощи стандартного теста (см., например, пример 3 В). Предпочтительные антитела согласно настоящему изобретению представляют собой антитела человека. Дополнительно или в качестве альтернативы антитела могут представлять собой, например, химерные или гуманизированные антитела. Моноклональные антитела 3 С 10, 6 А 4 и 7 В 1. Предпочтительные антитела согласно настоящему изобретению представляют собой антитела человека 3 С 10, 6 А 4 и 7 В 1, изолированные и охарактеризованные с точки зрения структуры, как описано в примерах 1 и 2. Аминокислотные последовательности VH 3 С 10, 6 А 4 и 7 В 1 приведены в SEQ ID NO: 19,20 и 21 соответственно. Аминокислотные последовательности VL 3C10, 6 А 4 и 7 В 1 показаны в SEQ IDNO: 22, 23 и 24 соответственно. Согласно другому аспекту настоящего изобретения предложены антитела, которые включают гипервариабельные участки легкой и тяжелой цепей CDR1s CDR2 и CDR3 антител 3 С 10, 6 А 4 или 7 В 1 или их комбинацию. Последовательности аминокислот участков CDR1 тяжелой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQ ID NO: 1-3 соответственно. Последовательности аминокислот участков CDR2 тяжелой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQ ID NO: 4-6 соответственно. Последовательности аминокислот участковCDR3 тяжелой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQ ID NO: 7-9 соответственно. Последовательности аминокислот участков CDR1 легкой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQ ID NO: 10-12 соответственно. Последовательности аминокислот участков CDR2 легкой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQ ID NO: 13-15. Последовательности аминокислот участков CDR3 легкой цепи 3 С 10, 6 А 4 и 7 В 1 показаны в SEQal. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, публикация Департамента здоровья и социального обеспечения США No. 91-3242, здесь и далее "Кабат '242"). С учетом того, что каждое из описанных антител обладает способностью связывать мезотелин человека, а специфичность связывания антигена обеспечивают в первую очередь участками CDR1, CDR2 иCDR3, можно "смешивать и сочетать" последовательности CDR1, CDR2 и CDR3 тяжелой цепи и последовательности CDR1, CDR2 и CDR3 легкой цепи (т.е. можно смешивать и сочетать участки CDR из разных антител, однако каждое антитело должно содержать CDR1, CDR2 и CDR3 тяжелой цепи и CDR1,CDR2 и CDR3 легкой цепи), с получением молекул, связывающих мезотелин, согласно настоящему изобретению. Предпочтительно в случае, когда комбинируют и сочетают CDR тяжелой цепи, последовательностьCDR1, CDR2 и/или CDR3 конкретной VH заменяют на структурно близкую последовательность(и) CDR. Аналогично, в случае когда комбинируют и сочетают последовательности CDR легкой цепи, последовательности CDR1, CDR2 и/или CDR3 определенной последовательности VL заменяют на структурно близкую последовательность(и) CDR. Для специалиста в данной области очевидно, что новые последовательности VH и VL можно получить путем замены одной или более последовательностей участков CDR тяжелой цепи и/или легкой цепи на структурно близкие последовательности из последовательностейCDR, раскрытых в настоящем описании для моноклональных антител 3 С 10, 6 А 4 и 7 В 1. Соответственно согласно другому аспекту настоящего изобретения предложено изолированное антитело или антигенсвязывающая часть такого антигена, включающие:(a) вариабельный участок тяжелой цепи CDR1, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 1-3;(b) вариабельный участок тяжелой цепи CDR2, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 4-6;(c) вариабельный участок тяжелой цепи CDR3, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 7-9;(d) вариабельный участок легкой цепи CDR1, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 10-12;(e) вариабельный участок легкой цепи CDR2, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 13-15; и(f) вариабельный участок легкой цепи CDR3, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 16-18; причем указанное антитело специфично связывает мезотелин человека. В предпочтительном варианте осуществления антитело соответствует варианту осуществления А. В другом предпочтительном варианте осуществления антитело соответствует варианту осуществления В. В еще одном предпочтительном варианте осуществления антитело соответствует варианту осуществления С. Хорошо известно, что домен CDR3, вне зависимости от домена (доменов) CDR1 и/или CDR2, один может определять специфичность связывания антитела к когнатному антигену, и на основе общей последовательности CDR можно предсказуемым образом получить множество антител, обладающих одинаковой специфичностью. Соответственно согласно настоящему изобретению предложены моноклональные антитела, включающие один или более участков CDR3 тяжелой и/или легкой цепи из антитела, полученного из животного, являющегося человеком или относящегося к другому виду, причем указанное моноклональное ан- 11018396 титело обладает способностью специфично связывать мезотелин человека. В некоторых аспектах настоящего изобретения предложены моноклональные антитела, включающие один или более участковCDR3 тяжелой и/или легкой цепи из антитела, не являющегося антителом человека, причем указанное моноклональное антитело обладает способностью специфично связывать мезотелин человека. В некоторых вариантах осуществления антитела согласно настоящему изобретению, включающие один или более участков CDR3 тяжелой и/или легкой цепи антитела, не являющегося антителом человека, (а) обладают способностью конкурировать за связывание с; (b) сохраняют функциональные характеристики; (с) связываются с тем же эпитопом, что и; и/или (d) обладают аффиностью связывания, близкой к таковой соответствующего исходного антитела, не являющегося антителом человека. В других аспектах настоящего изобретения предложены антитела, включающие один или более участков CDR3 тяжелой и/или легкой цепи из антитела человека, такого как, например, антитело человека, полученное из животных, не являющихся человеком, причем указанное моноклональное антитело обладает способностью специфично связывать мезотелин человека. В других аспектах настоящего изобретения предложены антитела, включающие один или более участков CDR3 тяжелой и/или легкой цепи из первого антитела человека, такого как, например, антитело человека, полученное из животных, не являющихся человеком, причем указанное первое моноклональное антитело обладает способностью специфично связывать мезотелин человека, и при этом указанный участок CDR3 из первого антитела человека замещает участок CDR3 в антителе человека, у которого отсутствует специфичность к мезотелину, в результате чего получают второе антитело человека, которое обладает способностью специфично связывать мезотелин человека. В некоторых вариантах осуществления антитела согласно настоящему изобретению, включающие один или более участков CDR3 из первого антитела человека, (а) обладают способностью конкурировать за связывание с; (b) сохраняют функциональные характеристики; (с) связываются с тем же эпитопом, что и; и/или (d) обладают аффиностью связывания близкой к таковой соответствующего первого исходного антитела человека. Антитела, включающие определенные последовательности зародышевой линии. В некоторых вариантах осуществления антитело согласно настоящему изобретению включают VH из определенного гена тяжелой цепи иммуноглобулина зародышевой линии и/или VL определенного гена легкой цепи иммуноглобулина зародышевой линии. Например, согласно предпочтительному варианту настоящего изобретения предложено моноклональное антитело или антигенсвязывающая часть такого антигена, включающая VH, которая является продуктом или производной VH 3-33 человека или гена VH 3-7 человека, причем указанное антитело специфично связывает мезотелин человека. В другом предпочтительном варианте осуществления настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть такого антигена, включающая VL, которая является продуктом или производным VK L6 человека или гена VK A27 человека, причем указанное антитело специфично связывает мезотелин человека. В еще одном предпочтительном варианте осуществления настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть такого антигена, причем указанное антитело включает VH, которая является продуктом или производным гена VH 3-33 человека, и включает VL, которая является продуктом или производным гена VK L6 человека, причем указанное антитело специфично связывает мезотелин человека. В еще одном предпочтительном варианте осуществления настоящего изобретения предложено изолированное моноклональное антитело, или антигенсвязывающая часть такого антигена, причем указанное антитело включает VH, которая является продуктом или производным гена VH 3-7 человека, и включает VL, которая является продуктом или производным гена VK А 27 человека, причем указанное антитело специфично связывает мезотелин человека. Такие антитела могут обладать одной или более из функциональных характеристик, подробно описанных выше, таких как высокая аффинность связывания с мезотелином человека, интернализация клетками, экспрессирующими мезотелин, ингибирование связывания мезотелина с СА 125, и способность к участию в АЗКЦ в отношении клеток, экспрессирующих мезотелин, и/или способность ингибировать рост клеток опухоли, включающей клетки, экспрессирующие мезотелин, in vivo в случае, когда указанное антитело конъюгировано с цитотоксином. Примерами антител, включающих VH и VL гена VH 3-33 и VK L6, соответственно являются антитела 3 С 10 и 6 А 4. Примером антитела, включающего VH и VL генов VH 3-7 и VK A27, соответственно является антитело 7 В 1. В настоящем описании антитело содержит вариабельные области тяжелой или легкой цепей, которые "являются продуктом" или "получены из" определенной последовательности зародышевой линии в случае, если вариабельные области антитела получены из системы, в которой использованы гены иммуноглобулина зародышевой линии человека. Такие системы включают иммунизацию трансгенной мыши,несущей гены иммуноглобулина человека, представляющим интерес антигеном или скрининг библиотеки генов иммуноглобулинов человека в виде фагового дисплея, представляющим интерес антигеном. Антитело можно идентифицировать как антитело человека, которое "является продуктом" или "получено из" последовательности зародышевой линии иммуноглобулина человека путем сравнения последовательностей аминокислот иммуноглобулинов зародышевой линии человека и отбора последовательности иммуноглобулина зародышевой линии человека, последовательность которой является наиболее близкой(т.е. обладает максимальным % идентичности) к последовательности антитела человека. Антитело человека, которое "является продуктом" или "получено из" определенной последовательности иммуноглобулина зародышевой линии человека, возможно включает отличия по аминокислотам от последовательности зародышевой линии, которые являются результатом, например, естественных соматических мутаций или намеренного введения сайт-направленных мутаций. Однако выбранное антитело обычно имеет последовательность аминокислот, по меньшей мере на 90% идентичную по последовательности аминокислот, кодируемой геном иммуноглобулина зародышевой линии человека, и содержит остатки аминокислот, которые указывают на то, что данное антитело является антителом человека, при сравнении с последовательностями аминокислот иммуноглобулинов зародышевой линии других видов (например, последовательности зародышевой линии мыши). В некоторых случаях последовательность аминокислот антитела может быть по меньшей мере на 95% или даже по меньшей мере на 96, 97, 98 или 99% идентична последовательности аминокислот гена иммуноглобулина зародышевой линии. Обычно антитело человека, полученное из конкретной последовательности зародышевой линии человека, демонстрирует не более 10 отличий по аминокислотам от последовательности аминокислот, кодируемой геном иммуноглобулина зародышевой линии человека. В некоторых случаях антитело человека возможно демонстрирует не более 5 или даже не более 4, 3, 2 или 1 отличий по аминокислотам от последовательности аминокислот, кодируемой геном иммуноглобулина зародышевой линии. Гомологичные антитела. В еще одном варианте осуществления антитело согласно настоящему изобретению включает вариабельные области тяжелой и легкой цепей, включающие последовательности аминокислот, гомологичные последовательностям аминокислот согласно настоящему описанию, и при этом антитела сохраняют желаемые функциональные свойства антител к мезотелину согласно настоящему изобретению. Например, согласно настоящему изобретению предложено изолированное моноклональное антитело, или антигенсвязывающая часть такого антигена, включающее VH и VL, причем (a) VH включает последовательность аминокислот, которая по меньшей мере на 80% гомологична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 19-21; (b) VL включает последовательность аминокислот, которая по меньшей мере на 80% гомологична последовательности аминокислот, выбранной из группы, состоящей из SEQ ID NO: 22-24; и (с) антитело специфично связывает мезотелин человека. В других вариантах осуществления последовательности аминокислот VH и/или VL возможно на 85,90, 95, 96, 97, 98 или 99% гомологична представленным выше последовательностям. Антитела, включающие области VH и VL, обладающие высокой (т.е. 80% или выше) гомологией с областями VH и VL,имеющими представленные выше последовательности, можно получить путем мутагенеза (например,сайт-направленного мутагенеза или мутагенеза, опосредуемого ПЦР) молекул нуклеиновой кислоты,кодирующих SEQ ID NO: 25-27 или 28-30, с последующим тестированием кодируемого измененного антитела на сохранение функции (т.е. функций, описанных выше) с использованием описанных в настоящем описании функциональных тестов. Процент гомологии между двумя последовательностями аминокислот является эквивалентом процента идентичности между двумя последовательностями. Процент идентичности между двумя последовательностями является функцией числа идентичных положений, которыми обладают последовательности (т.е. % гомологии = число идентичных положений/общее число положений 100), с учетом числа пробелов, которое необходимо ввести для того, чтобы оптимальным образом выровнять две последовательности. Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено с использованием математического алгоритма, описанного в неограничивающих примерах ниже. Процент идентичности двух последовательностей аминокислот может быть определен с использованием алгоритма, предложенного Е. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17 (1988, который реализован в программе ALIGN (версия 2.0), с использованием матрицы остатков весов РАМ 120, штрафа за длину пробела 12 и штрафа за пробел 4. Кроме того, процент идентичности последовательностей аминокислот может быть определен с использованием алгоритма Needleman и Wunsch (J. Mol. Biol., 48:444453 (1970, реализованного в программе GAP программного пакета GCG (доступен наhttp://www.gcg.com), с использованием либо матрицы Biossum 62, либо матрицы РАМ 250, и веса пробела, равного 16, 14, 12, 10, 8, 6 или 4, и веса длины, равного 1, 2, 3, 4, 5 или 6. Последовательности белков согласно настоящему изобретению могут также быть использованы в качестве "запрашиваемых последовательностей" ("query sequence") для поиска в общедоступных базах данных, например, для идентификации родственных последовательностей. Такие поиски можно выполнять с использованием программы XBLAST (версия 2.0), описанной в Altschul, et al. (1990) J. Mol. Biol.,215: 403-10. Можно осуществлять поиски белков по алгоритму BLAST при помощи программыXBLAST, балл = 50, длина слова = 3 для получения последовательностей аминокислот, гомологичных молекулам антител согласно настоящему изобретению. Для получения выравниваний с пробелами для целей сравнения можно использовать программу Gapped BLAST, как описано в Altschul et al. (1997) Nu- 13018396cleic Acids Res., 25(17): 3389-3402. При использовании программ BLAST и Gapped BLAST полезны заданные по умолчанию параметры данных программ (например, XBLAST и NBLAST); см.www.ncbi.nlm.nih.gov. Антитела с консервативными модификациями. В некоторых вариантах реализации антитело согласно настоящему изобретению включает VH,включающую последовательности CDR1, CDR2 и CDR3, и VL, включающую последовательности CDR1,CDR2 и CDR3, причем одна или более указанных последовательностей CDR включает указанные последовательности аминокислот на основе известных антител к мезотелину, или консервативные модификации таких последовательностей, и при этом антитела сохраняют желаемые функциональные свойства антител к мезотелину согласно настоящему изобретению. Очевидно, что могут быть сделаны такие консервативные модификации последовательностей, которые не приводят к потери способности связывать антиген. Соответственно согласно настоящему изобретению предложено изолированное моноклональное антитело или антигенсвязывающая часть такого антигена, включающая VH, включающую последовательности CDR1, CDR2 и CDR3, и VL, включающую последовательности CDR1, CDR2 и CDR3, причем(а) последовательность CDR3 вариабельной области тяжелой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ ID NO: 7-9, и консервативно модифицированных вариантов указанных последовательностей; (b) последовательностьCDR3 вариабельной области легкой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ ID NO: 16-18, и консервативно модифицированных вариантов указанных последовательностей; и (с) указанное антитело специфично связывает мезотелин человека. В предпочтительном варианте осуществления последовательность CDR2 вариабельной области тяжелой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ ID NO: 4-6, и консервативно модифицированных вариантов указанных последовательностей; и последовательность CDR2 вариабельной области легкой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ IDNO: 13-15, и консервативно модифицированных вариантов указанных последовательностей. В другом предпочтительном варианте осуществления последовательность CDR1 вариабельной области тяжелой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ ID NO: 1-3, и консервативно модифицированных вариантов указанных последовательностей; и последовательность CDR1 вариабельной области легкой цепи включает последовательность аминокислот, выбранную из группы, состоящей из последовательностей аминокислот SEQ ID NO: 10-12, и консервативно модифицированных вариантов указанных последовательностей. Термин "консервативные модификации последовательности" относится к изменениям аминокислот,которые не нарушают или не снижают существенно характеристики связывания антитела, содержащего указанные аминокислоты. Такие консервативные модификации включают замены, добавления и делеции аминокислот. Модификации могут быть введены в антитело с использованием стандартных методик,известных в данной области, таких как сайт-направленный мутагенез, или мутагенез с помощью ПЦР. Консервативными являются такие замены аминокислот, при которых остаток аминокислоты заменяется на остаток аминокислоты с аналогичной боковой цепью. В данной области определены семейства остатков аминокислот, обладающих аналогичными боковыми цепями. Указанные семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глютаминовая кислота), полярными незаряженными боковыми цепями (например, глицин, аспарагин, глютамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более остатков аминокислот в участках CDR антитела согласно настоящему изобретению можно заменить на другие остатки аминокислот с боковыми цепями из того же семейства и протестировать измененное антитело на сохранение функции с использованием описанных в настоящем описании функциональных тестов. Антитела, которые связывают тот же эпитоп, что и антитела к мезотелину. В другом варианте осуществления настоящего изобретения предложены антитела, которые связывают эпитоп, распознаваемый каким-либо из моноклональных антител к мезотелину согласно настоящему изобретению (т.е. антитела, которые обладают способностью перекрестно конкурировать за связывание с мезотелином человека с каким-либо из моноклональных антител согласно настоящему изобретению). В предпочтительных вариантах осуществления эталонное антитело для исследования перекрестной реактивности может представлять собой моноклональное антитело 3 С 10 (включающее последовательности VH и VL, показанные в SEQ ID NO: 19 и 22 соответственно), или моноклональное антитело 6 А 4 (включающее последовательности VH и VL, показанные в SEQ ID NO: 20 и 23 соответственно), или моноклональное антитело 7 В 1 (включающее последовательности VH и VL, показанные в SEQ ID NO: 21 и 24 соответственно). Такие перекрестно конкурирующие антитела могут быть идентифицированы по способности к перекрестной конкуренции с 3 С 10, 6 А 4 или 7 В 1 в стандартных тестах на связывание мезотелина, таких как средства для анализа ELISA (MOA) или BIAcore. В предпочтительном варианте осуществления антитело,которое связывается с тем же эпитопом, который распознается 3 С 10, 6 А 4 или 7 В 1, представляет собой моноклональное антитело человека. Такие моноклональные антитела могут быть получены и изолированы (выделены), как описано в примерах. Искусственно сконструированные и модифицированные антитела. Кроме того, антитело согласно настоящему изобретению можно получить путем использования антитела, содержащего одну или более последовательностей VH и/или VL известных антител к мезотелину в качестве исходного материала для конструирования модифицированного антитела, обладающего свойствами, отличающимися от свойств исходного антитела. Можно модифицировать одну или более аминокислот в одной из или обеих VH и VL, в одном или более участках CDR и/или в одном или более каркасных участках. В качестве дополнения или альтернативы могут быть модифицированы остатки в константной области (областях), что приведет к изменению эффекторной функции (функций) антитела. В некоторых вариантах осуществления можноиспользовать прививку CDR для конструирования вариабельных областей антител. Антитела взаимодействуют с антигенами-мишенями в основном за счет остатков аминокислот в участках CDR. По этой причине последовательности аминокислот в участкахCDR в большей степени различаются в различных антителах, чем последовательности за пределамиCDR. Поскольку последовательности CDR отвечают за большую часть взаимодействий антителоантиген, возможно экспрессировать рекомбинантные антитела, которые имитируют свойства специфичных природных антител путем конструирования векторов экспрессии, которые включают последовательности CDR из природных специфичных антител, привитых на каркасные последовательности из другого антитела, обладающего другими свойствами (см., например, Riechmann, L. et al. (1998) Nature,332:323-327; Jones, P. et al. (1986) Nature, 321:522-525; Queen, C. et al. (1989) Proc. Natl. Acad. See. USA,86:10029-10033; патент США 5225539, выданный Winter, и патенты США 5530101; 5585089; 5693762 и 6180370, выданные Queen et al.). Соответственно в другом варианте осуществления настоящего изобретения предложено изолированное моноклональное антитело или антигенсвязывающая часть такого антигена, включающее VH,включающую последовательности CDR1, CDR2 и CDR3, включающие последовательности аминокислот,выбранные из группы, состоящей из SEQ ID NO: 1-3, SEQ ID NO: 4-6 и SEQ ID NO: 7-9 соответственно,и VL, включающую последовательности CDR1, CDR2 и CDR3, включающие последовательности аминокислот, выбранные из группы, состоящей из SEQ ID NO: 10-12, SEQ ID NO: 13-15 и SEQ ID NO: 16-18 соответственно. Соответственно такие антитела содержат последовательности CDR VH и VL моноклональных антител 3 С 10, 6 А 4 или 7 В 1, но, возможно, содержат каркасные последовательности, отличающиеся от указанных антител. Такие каркасные последовательности можно получить из общедоступных баз данных ДНК или опубликованных источников, которые содержат последовательности генов антител зародышевой линии. Например, последовательности ДНК зародышевой линии для генов VH и VL человека можно найти в базе данных последовательностей зародышевой линии человека "VBase" (доступна в сети Интернет по адресуwww.mrc-cpe.cam.ac.uk/vbase), а также в источниках Kabat '242; Tomlinson, I.М., et al. (1992) J. Mol. Biol.,227: 776-798 и Cox, J.P.L. et al. (1994) Eur. J. Immunol., 24:827-836; каждый из которых включен в настоящее описание посредством ссылки. В качестве другого примера последовательности ДНК зародышевой лини для генов VH и VL человека можно найти в базе данных Genbank. Например, следующие последовательности тяжелой цепи зародышевой линии, входящие в состав гуманизированного моноклонального антитела НСо 7 мыши, доступны в базе Genbank под следующими номерами доступа: 1-69NT024637). В качестве другого примера следующие последовательности тяжелой цепи зародышевой линии, входящие, обнаруживаемые в мышах НСо 12 (гуманизированные мышиные моноклональные антитела) доступны в базе данных Genbank под номерами 1-69 (NG0010109, NT024637 и ВС 070333), 5-51(NG0010109 и NT024637), 4-34 (NG0010109 и NT024637), 3-30.3 (CAJ556644) и (AJ406678). Еще один источник последовательностей тяжелой и легкой цепей зародышевой линии представляет собой база данных иммуноглобулинов человека IMGT (http://imgt.cines.fr). Последовательности белков антител сравнивают с составленной базой данных последовательностей с использованием одного из методов поиска сходства под названием Gapped BLAST (Altschul et al. (1997)Nucleic Acids Research, 25:3389-3402), который хорошо известен специалистам в данной области. BLAST представляет собой эвристический алгоритм, предполагающий, что статистически значимое выравнивание между последовательностью антитела и последовательностью в базе данных должно содержать пары сегментов выровненных слов с высокими баллами (HSP). Пары сегментов, баллы для которых нельзя увеличить путем увеличения или уменьшения размера, называют hit (попадание). Вкратце, последовательности нуклеотидов, полученные из VBase (http://vbase.mrc-cpe.cam.ас.uk/vbasel/list2.php), транслируют и сохраняют участок, расположенный между и включающий каркасные участки с FR1 по FR3. Средняя длина последовательностей в базе данных составляет 98 остатков. Повторяющиеся последова- 15018396 тельности, которые полностью совпадают по всей длине, удаляют. Поиск белков по алгоритму BLAST с использованием программы с установленными по умолчанию стандартными параметрами, за исключением фильтра низкой сложности, который отключают, и матрицей замен BLOSUM62, позволяет отобрать 5 попаданий, которые имеют совпадения последовательностей. Последовательности нуклеотидов транслируют во всех шести рамках, при этом стоп-кодоны в совпадающем сегменте последовательности из базы данных не рассматривают как потенциальные "попадания". Затем снова проводят проверку с использованием программы tblastx, в которой реализован алгоритм BLAST, которая транслирует последовательность антитела во всех шести рамках и осуществляет сравнение полученных продуктов трансляции с продуктами трансляции последовательностей нуклеотидов из базы данных VBase. Поиск в других базах данных, таких как базы IMGT (http://imgt.cines.fr), можно осуществлять аналогично базе VBase, как описано выше. Идентичные положения представляют собой точные совпадения аминокислот между последовательностью антитела и белком базы данных по полной длине последовательности. Положительные положения (идентичные + совпадения с учетом замен) представляют собой положения, которые не являются идентичными, но представляют собой замены аминокислот в соответствии с матрицей замен BLOSUM62. Если последовательность антитела совпадает с двумя последовательностями из базы данных с одинаковыми значениями идентичности, попаданием, совпадающим с последовательностью, считают попадание с максимальным числом положительных положений. Предпочтительные каркасные последовательности для использования в антителах согласно настоящему изобретению представляют собой последовательности, структурно близкие каркасным последовательностям, используемым в предпочтительных антителах согласно настоящему изобретению, например близкими каркасным последовательностям VH 3-33 (SEQ ID NO: 31) или VH 3-7 (SEQ ID NO: 32) и/или каркасным последовательностям VK L6 (SEQ ID NO: 33) или VK A27 (SEQ ID NO: 34). Последовательности CDR1, CDR2 и CDR3 VH и последовательности VK CDR1, CDR2 и CDR3 можно привить на каркасные участки, имеющие последовательность, идентичную обнаруживаемой в гене иммуноглобулина зародышевой линии, из которого получена данная каркасная последовательность, либо последовательности CDR могут быть привиты на каркасные участки, которые содержат более одной мутации по сравнению с последовательностями зародышевой линии. Например, было обнаружено, что в некоторых примерах полезно осуществлять мутирование остатков в каркасных участках для сохранения или усиления способности к связыванию антигена (см., например, патенты США 5530101; 5585089; 5693762 и 6180370, выданные Queen et al.). Другой тип модификации вариабельной области представляет собой мутацию остатков аминокислот в участках CDR1, CDR2 и/или CDR3 VH и/или VK, которая позволяет улучшить одну или более характеристик связывания (например, аффинность). Введение мутации(й) и изменение связывания антитела или других представляющих интерес свойств можно осуществить с использованием сайтнаправленного мутагенеза или мутагенеза путем ПЦР. Оценку можно осуществлять при помощи in vitro или in vivo анализов, как описано в настоящем документе. В предпочтительном случае вводят консервативные модификации. Мутации могут представлять собой замены, добавления или делеции аминокислот, но предпочтительно являются заменами. Более того, обычно не изменяют больше одного, двух, трех,четырех или пяти остатков аминокислот в участке CDR. Соответственно в другом варианте осуществления настоящего изобретения предложены изолированные моноклональные антитела к мезотелину или антигенсвязывающая часть такого антитела, включающие (а) участок CDR1 вариабельной области тяжелой цепи, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 1-3, или последовательность аминокислот,содержащую одну, две, три, четыре или пять замен, делеций или добавлений аминокислот по сравнению с SEQ ID NO: 1-3; (b) участок CDR2 вариабельной области тяжелой цепи, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 4-6, или последовательность аминокислот, содержащую одну, две, три, четыре или пять замен, делеций или добавлений аминокислот по сравнению с SEQ ID NO: 4-6; (с) участок CDR3 вариабельной области тяжелой цепи, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 7-9, или последовательность аминокислот, содержащую одну, две, три, четыре или пять замен, делеций или добавлений аминокислот по сравнению с SEQ ID NO: 7-9; (d) участок CDR1 вариабельной области легкой цепи,включающий последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 10-12,или последовательность аминокислот, содержащую одну, две, три, четыре или пять замен, делеций или добавлений аминокислот по сравнению с SEQ ID NO: 10-12; (е) участок CDR2 вариабельной области легкой цепи, включающий последовательность аминокислот, выбранную из группы, состоящей из SEQID NO: 13-15, или последовательность аминокислот, содержащую одну, две, три, четыре или пять замен,делеций или добавлений аминокислот по сравнению с SEQ ID NO: 13-15; и (f) CDR3 вариабельной области легкой цепи, включающий последовательность аминокислот, выбранную из группы, состоящей изSEQ ID NO: 16-18, или последовательность аминокислот, содержащую одну, две, три, четыре или пять замен, делеций или добавлений аминокислот по сравнению с SEQ ID NO: 16-18. Искусственно сконструированные антитела согласно настоящему изобретению включают антитела,- 16018396 в которых были сделаны модификации в каркасных остатках области VH и/или VL, которые обеспечивают, например, улучшение свойств антитела. Обычно такие модификации каркасного участка осуществляют для того, чтобы снизить иммуногенность антитела. Один из подходов заключается в осуществлении "обратной мутации" одного или более остатков каркасного участка, которая приводит к переводу в последовательность зародышевой линии, из которой получено данное антитело. Такие остатки можно идентифицировать путем сравнения каркасных последовательностей антитела с последовательностями зародышевой линии, из которых получено данное антитело. В качестве примера в табл. А показаны участки, в которых какое-либо положение аминокислоты в каркасном участке (по системе нумерации Kabat) отличается от зародышевой линии, и как можно осуществить обратную мутацию данного положения к зародышевой линии путем указанных замен: Другой тип модификаций каркасного участка включает осуществление мутаций одного или более остатков в пределах каркасного участка или даже в пределах одного или более участков CDR, которые приводят к удалению эпитопов Т-клеток и соответственно к снижению иммуногенности антитела. Такой подход также называется "деиммунизацией" и описан более подробно в заявке на патент США 2003/0153043 Carr et al. В качестве дополнения или альтернативы модификациям в каркасных участках или участках CDR в антитела согласно настоящему изобретению можно ввести модификации в области Fc, обычно приводящие к изменению одного или более функциональных свойств, таких как время полужизни в сыворотке,фиксация комплемента, связывание рецептора Fc и/или антигензависимая клеточная цитотоксичность. Кроме того, антитело согласно настоящему изобретению может быть подвергнуто химической модификации (например, к антителу можно присоединить одну или более химических групп) или модификации,которая приводит к изменению гликозилирования, что опять же приводит к изменению одного или более функциональных свойств. Каждый из вариантов ниже описан более подробно. Нумерация остатков в участке Fc соответствует индексу EU по Kabat. В одном варианте осуществления осуществляют модификацию шарнирной области СН 1, заключающуюся в изменении числа остатков цистеина в шарнирной области (т.е. уменьшении или увеличении согласно патенту США 5677425; Bodmer et al.). Такие изменения могут способствовать объединению тяжелой и легкой цепей или повышению или приводить к снижению стабильности антитела. В другом варианте осуществления шарнирную область Fc подвергают мутированию, в результате чего снижается биологическое время полужизни антитела. Более конкретно, в домен на границе СН 2 СН 3 шарнирной области Fc вводят одну или более мутаций аминокислот, в результате чего ухудшается связывание антитела с белком А стафилококка (SpA) относительно связывания нативной шарнирной области Fc с SpA, как описано в патенте США 6165745 (Ward et al.). В другом варианте осуществления антитело модифицируют таким образом, чтобы увеличить их время биологической полужизни. Например, могут быть введены одна или более из следующих мутаций:T252L, T254S, T256F, как описано в патенте США 6277375, выданном Ward. В качестве альтернативы антитела могут быть изменены в участке СН 1 или CL таким образом, чтобы ввести в них эпитоп связывания рецептора "реутилизации", образованный двумя петлями домена СН 2 участка Fc IgG, как описано в патентах США 5869046 и 6121022 (Presta et al.). В других вариантах осуществления участок Fc изменяют путем замены по меньшей мере одного остатка аминокислоты, которая приводит к изменению эффекторной функции (функций). Например, один или более остатков аминокислот 234, 235, 236, 237, 297, 318, 320 и 322 могут быть заменены на другие остатки аминокислот с получением антитела, обладающего измененной аффинностью в отношении эффекторного лиганда, например рецептора Fc или компонента С 1 комплемента, но сохраняющего способность к связыванию антигена родительского антитела, как описано в патенте США 5624821 и 5648260 В другом примере один или более остатков аминокислот из 329, 331 и 322 можно заменить таким образом, чтобы получить антитело с измененным связыванием C1q и/или сниженной комплементзависимой цитотоксичностью (КЗЦ) или не обладающее комплементзависимой цитотоксичностью, как описано в патенте США 6194551 (Idusogie et al.). В другом примере один или более остатков аминокислот в положениях 231 и 239 можно изменить таким образом, чтобы это привело к изменению способности антитела фиксировать комплемент. Такой подход более подробно описан в WO 94/29351 (Bodmer et al.). В еще одном примере участок Fc модифицируют с повышением способности антитела опосредовать антителозависимую клеточную цитотоксичность (АЗКЦ) и/или с повышением аффинности антитела в отношении рецептора Fc путем модификации одной или более аминокислот в следующих положениях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289,290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331,333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Данный подход более подробно описан в WO 00/42072 (Presta). Более того, были картированы сайты связывания на IgG1 для FcR1, FcRII, FcRIII и FcRn и описаны варианты с повышенным связыванием(см. Shields, R.L. et al. (2001) J. Biol. Chem., 276:6591-6604). Было показано, что определенные мутации в положениях 256, 290, 298, 333, 334 и 339 улучшают связывание с FcRIII. Кроме того, было показано, что следующие комбинированные мутации обеспечивают улучшение связывания FcRIII: T256A/S298A,S298A/E333A, S298A/K224A и S298 А/Е 333 А/K334 А. В еще одном варианте осуществления С-конец антител согласно настоящему изобретению модифицируют путем введения остатка цистеина, как описано в PCT/US 2008/073569, которая полностью включена в настоящее описание посредством ссылки. Такие модификации включают, но не ограничены перечисленными: замену существующего остатка аминокислоты на С-конце полноразмерной последовательности тяжелой цепи или вблизи него, а также введение дополнительного участка, содержащего цистеин,в С-концевой участок полноразмерной последовательности тяжелой цепи. В предпочтительных вариантах осуществления указанный дополнительный участок, содержащий цистеин, включает последовательность цистеин-аланин-аланин (от N-конца к С-концу). В предпочтительных вариантах осуществления присутствие таких модификаций С-конца с использованием цистеина обеспечивает участок для конъюгирования с молекулой-партнером, такой как терапевтический агент или маркерная молекула. В частности, присутствие реактивной тиольной группы,обеспеченное модификацией С-конца с использованием цистеина, можно использовать для конъюгирования молекулы-партнера, включающей сульфгидрил-реактивную группу малеимида. Такое конъюгирование антитела с молекулой-партнером обеспечивает улучшенный контроль специфичного сайта присоединения. Более того, благодаря введению сайта присоединения на С-конце или вблизи него, конъюгирование может быть оптимизировано таким образом, чтобы снизить или исключить его влияние на функциональные свойства антитела и обеспечить упрощение исследования и контроль качества композиций, содержащих конъюгаты. В еще одном варианте осуществления изменяют гликозилирование антитела путем исключения гликозилирования (агликозилирование) или изменяют сайт (сайты) гликозилирования, что приводит к повышению аффинности антитела. Например, может быть сделана одна или более замен аминокислот,которые обеспечат устранение одного или более сайтов гликозилирования в каркасном участке вариабельной области. Такое агликозилирование может обеспечить увеличение аффинности антитела в отношении антигена; см. патенты США 5714350 и 6350861 (Со et al.). Дополнительные подходы к изменению гликозилирования описаны в патентах США 7214775 (Hanai et al.), 6737056 (Presta); заявке США 20070020260 (Presta); международной публикации WO 2007/084926 (Dickey et al.); WO 2006/089294 (Zhuet al.) и WO 2007/055916 (Ravetch et al.); каждый из источников полностью включен в настоящее описание посредством ссылки. В качестве дополнения или альтернативы антитело может быть получено таким образом, чтобы оно имело измененный тип гликозилирования, например гипофукозилированное антитело, содержащее сниженное количество остатков фукозы, или антитело, содержащее повышенное количество двухантенных структур GlcNac. Было показано, что такие измененные профили гликозилирования увеличивают способность антител к АЗКЦ. Такие модификации углеводородов можно осуществить, например, путем экспрессии антител в клетке-хозяине с измененным механизмом гликозилирования. Например, в клетках линий Ms704, Ms705 и Ms709 отсутствует ген фукозилтрансферазы, FUT8 (альфа(1,6)фукозилтрансфераза), благодаря чему антитела, экспрессирующиеся в данных линиях клеток, не содержат фукозу в составе углеводов; см. заявку на патент США 2004/0110704 (Yamane et al.) и YamaneOhnuki et al. (2004) Biotechnol Bioeng, 87: 614-22. В качестве другого примера в ЕР 1176195 (Hanai et al.) описана линия клеток с нарушенной функцией гена FUT8, который кодирует фукозилтрансферазу, в результате чего антитела, экспрессируемые в такой линии клеток, являются гипофукозилированными. Hanai et al. также описывают линии клеток с низкой активностью ферментов, присоединяющих фукозу к Nацетилглюкозамину, который связывается с участком Fc антитела. В публикации WO 03/035835 (Presta) описан вариант линии клеток СНО, клетки Lec13, со сниженной способностью присоединять фукозу кAsn (297)-связанным углеводам (см. также Shields, R.L. et al. (2002) J. Biol. Chem., 277:26733-26740). В публикации WO 99/54342 (Umana et al.) описаны линии клеток, модифицированные таким образом, что они экспрессируют гликозилтрансферазы, модифицирующие гликопротеины, в результате чего антитела,экспрессируемые такими клетками, содержат повышенное количество двухантенных структур GlcNac и обладают повышенной активностью АЗКЦ (см. также Umana et al. (1999) Nat. Biotech., 17: 176-180). В качестве альтернативы остатки фукозы антитела могут быть отщеплены под действием фермента фукозидазы (Tarentino, A.L. et al. (1975) Biochem., 14:5516-23). В качестве дополнения или альтернативы могут быть получены антитела с измененным типом гликозилирования, причем указанные изменения касаются уровня сиалирования. Такие изменения описаны в публикациях WO 2007/084926 (Dickey et al.) и WO 2007/055916 (Ravetch et al.), каждая из которых включена в настоящее описание посредством ссылки. Например, можно использовать ферментативную реакцию с сиалидазой, как описано в патенте США US 5831077, который включен в настоящее описание посредством ссылки. Другие примеры подходящих ферментов включают нейраминидазу и Nгликозидазу F, как описано у Schloemer et al., J. Virology, 15(4), 882-893 (1975) и у Leibiger et al., BiochemJ., 338, 529-538 (1999) соответственно. В качестве альтернативы можно использовать способы повышения уровня сиалирования, такие как применение сиалилтрансфераз, котрое описано у Basset et al., Scandinavian Journal of Immunology, 51 (3), 307-311 (2000). Другим вариантом модификации антител согласно настоящему изобретению является пегилирование. Пегилирование антитела обеспечивает, например, увеличение его биологической полужизни (например, в сыворотке). Для получения пегилированного антитела обычно осуществляют реакцию антитела или фрагмента антитела с производным полиэтиленгликоля (PEG), таким как реактивный сложный эфир или альдегид PEG. Либо пегилирование можно осуществить путем проведения реакции ацилирования или реакции алкилирования с реактивной молекулой PEG (или аналогичным водорастворимым полимером). В настоящем описании термин "полиэтиленгликоль" охватывает любую форму PEG, которая используется для получения производного других белков, такую как моно (С 1-С 10) алкокси- или арилокси полиэтиленгликоль или полиэтиленгликоль-малеимид. Антитело, которое необходимо пегилировать, может представлять собой агликозилированное антитело. Методы пегилирования белков известны в данной области и могут быть применены к антителам согласно настоящему изобретению; см., например, ЕР 0154316 (Nishimura et al.) и ЕР 0401384 (Ishikawa et al.). Фрагменты антител и миметики антител. Настоящее изобретение не ограничено традиционными антителами и может быть осуществлено с использованием фрагментов антитела и миметиков антитела. В настоящее время разработаны и широко известны в данной области различные технологии фрагментов антител и миметиков антител. Доменные антитела (dAbs) представляют собой минимальные функциональные связывающие блоки антител, соответствующие вариабельным областям либо тяжелой (VH) либо легкой (VL) цепи антител человека. Доменные антитела имеют молекулярную массу около 13 кДа. Из доменов был получен ряд обширных и очень полезных библиотек полностью человеческих dAbs на основе VH и VL (каждая библиотека содержит более миллиарда различных последовательностей). Указанные библиотеки применяют для выбора dAbs, специфичных к терапевтическим мишеням. В отличие от многих обычных антител,доменные антитела хорошо экспрессируются в системах на основе клеток бактерий, дрожжей и млекопитающих. Дополнительные подробности относительно доменных антител и способов их получения можно найти, обратившись к патентам США 6291158; 6582915; 6593081; 6172197 и 6696245; заявке на патент США 2004/0110941; европейским патентам ЕР 1433846, 0368684 и 0616640; публикациям WO 2005/035572, 2004/101790, 2004/081026, 2004/058821, 2004/003019 и 2003/002609, каждый их которых полностью включен в настоящее описание посредством ссылки. Нанотела представляют собой полученные из антител уникальные терапевтические белки, которые обладают уникальным структурными и функциональными свойствами природных антител, состоящих из тяжелой цепи. Указанные антитела, состоящие из тяжелой цепи, включают единственный вариабельный домен (VHH) и два константных домена (СН 2 и СН 3). Важно, что клонированный и изолированный домен VHH представляет собой обладающий прекрасной стабильностью полипептид, сохраняющий емкость связывания антигена, присущую исходному антителу, состоящему из тяжелой цепи. Нанотела обладают высокой степенью гомологии с доменами VH антител человека и могут быть дополнительно гуманизированы без какой-либо потери активности. Важно, что нанотела имеют низкий иммуногенный потенциал, что было подтверждено в исследованиях лидерных соединений класса нанотел на приматах. Нанотела сочетают преимущества обычных антител с важными свойствами небольших лекарственных молекул подобно обычным антителам, нанотела демонстрируют высокую специфичность нацеливания и аффинность, а также исходно низкую токсичность. В то же время, подобно небольшим лекарственным молекулам они способны ингибировать ферменты и легко проникают в "карманы" рецепторов. Более того, нанотела исключительно стабильны и их можно вводить не только путем инъекции (см., например, публикацию WO 2004/041867, полностью включенную в настоящее описание путем ссылки). К другим преимуществам нанотел относится то, что благодаря малым размерам они способны распозна- 19018396 вать необычные или скрытые эпитопы, способность к связыванию в полостях или активных сайтах белков-мишеней с высокой аффинностью и селективностью, обусловленными гибкой 3-мерной структурой,возможность варьирования времени полужизни и быстроту обнаружения лекарственных средств. Нанотело(а) кодируется единственным геном и эффективно продуцируется в большинстве прокариотических и эукариотических хозяев, например Е. coli (см., например, патент США 6765087, который полностью включен в настоящее описание посредством ссылки), плесневыми грибами (например, Aspergillus или Trichoderma) и дрожжами (например, Saccharomyces, Kluyveromyces, Hansenula или Pichia)(см., например, патент США 6838254, который полностью включен в настоящее описание посредством ссылки). Метод наноклонов (см., например, публикацию WO 06/079372, которая полностью включена в настоящее описание посредством ссылки) позволяет получить нанотела к желаемой мишени на основе автоматизированного высокоэффективного отбора В-клеток и может быть использован в контексте настоящего изобретения. Унитела (UniBodies) представляют собой еще одну технологию фрагментов антител, основанную на удалении шарнирной области из антител класса IgG4. Удаление шарнирной области дает молекулу, которая имеет размер, составляющий, по существу, половину размера обычного антитела класса IgG4, и содержит одновалентный участок связывания в отличие от двухвалентного участка связывания антитела класса IgG4. Подобно антителам IgG4, унитела инертны и не взаимодействуют с иммунной системой,что может быть полезно в лечении заболеваний, при которых иммунный ответ является нежелательным. Функция унител может заключаться в ингибировании или подавлении, но не уничтожении, клеток, с которыми они связываются. Кроме того, связывание унител с раковыми клетками не приводит к стимуляции пролиферации последних. Кроме того, поскольку размер антител несколько меньше, они демонстрируют лучшее распределение в большем количестве солидных опухолей при потенциально полезной эффективности. Унитела выводятся из организма со скоростью, близкой к антителам IgG4, и способны связывать антигены антител IgG4 с близкой аффинностью. Более подробное описание унител можно найти в публикации WO 2007/059782, которая полностью включена в настоящее описание путем ссылки. Молекулы аффител представляют собой аффинные белки на основе домена белка, состоящего из 58 остатков аминокислот, полученных из трехспирального домена стафилококкового белка А, который связывает IgG. Данный домен используют в качестве каркаса для конструирования комбинаторных фагмидных библиотек, из которых можно отобрать варианты аффител к желаемым молекулам с использованием технологии фагового дисплея (Nord et al., Nat. Biotechnol, 1997; 15:772-7; Ronmark et al., Eur J. Biochem,2002; 269:2647-55). Простая устойчивая структура и низкая молекулярная масса (6 кДа) молекул аффител обуславливают возможность их применения в разнообразных приложениях, например, в качестве детектирующих реагентов и ингибиторов рецепторных взаимодействий. Более подробно аффитела и их получение описаны в патенте США 5831012, который полностью включен в настоящее описание посредством ссылки. Также меченые аффитела можно использовать для получения изображений с целью определения распространенности изоформ. Белки DARP (Designed Ankyrin Repeat Proteins) представляют собой воплощение технологии миметиков антител DRP (Designed Repeat Protein, искусственные белки с повторами), использующей способность к связыванию полипептидов, не являющихся антителами. Содержащие повторы белки, такие как белки, богатые лейцином и акрилином, представляют собой универсальные связывающие молекулы, которые, в отличие от антител, встречаются как внутри, так и снаружи клетки. Их уникальное модульное строение характеризуется повторяющимися структурными единицами (повторами), которые вместе образуют более длинные области повторов, создающие вариабельные и различающиеся между собой поверхности связывания мишеней. С учетом модульного строения можно получить комбинаторные библиотеки полипептидов, обладающих крайне разнообразными специфичностями связывания. Указанная стратегия включает согласованную разработку совместимых повторов, имеющих различные остатки на поверхности, и случайное объединение таких доменов. Белки DARP могут быть получены в бактериальных системах экспрессии с очень высоким выходом. Они относятся к наиболее стабильным из известных белков. Были получены высокоспецифичные,высокоаффинные белки DARP, связывающие разнообразные белки-мишени, включая рецепторы, киназы и цитокины человека, протеазы человека, белки вирусов и мембран, некоторые из которых обладают аффинностью в диапазоне от единиц наномолей до пикомолей. Белки DARP используются в разнообразных приложениях, включая твердофазный ИФА, "сэндвич"ИФА, анализ методом поточной цитометрии (FACS), методы иммуногистохимии (IHC), использование чипов, аффинную очистку и анализ методом вестерн-блот. Белки DARP не только идеально блокируют белок-белковые взаимодействия, но и ингибируют ферменты. Очень быстрое проникновение в опухоль и очень благоприятное соотношение кровь/опухоль обуславливают применимость белков DARP для применения в in vivo диагностике и лечении. Дополнительную информацию относительно DARP и других технологий DRP можно найти в патенте США 2004/0132028 и публикации WO 02/20565, каждый из которых включен в настоящее описание путем ссылки. Антикалины представляют собой еще одну технологию миметиков антител, однако в этом случае источником специфичности связывания являются липокалины - семейство низкомолекулярных белков,экспрессирующихся естественным путем в тканях и жидкостях тела человека в больших количествах. Липокалины выполняют ряд функций in vivo, связанных с транспортировкой и запасанием химически чувствительных или нестабильных соединений. Липокалинам присуща устойчивая структура, включающая высококонсервативный -участок, являющийся основой для четырех петель на одном из концов белка. Указанные петли образуют вход в карман связывания, конформационные различия в этой части молекулы обуславливают различия в специфичности связывания между отдельными липокалинами. Хотя общая структура из гипервариабельных петель, поддерживаемых консервативным -листом,напоминает иммуноглобулины, липокалины значительно отличаются от антител по размеру, а также тем,что они состоят из единственной цепи из 160-180 аминокислот, что существенно превышает размер одного антитела иммуноглобулина. Липокалины можно клонировать, а их петли - модифицировать, и таким образом получать антикалины. Были получены библиотеки антикалинов разнообразной структуры. Дисплей антикалинов обеспечивает возможность отбора и скрининга функции связывания с последующей экспрессией и получением растворимого белка для дальнейшего анализа в клетках эукариот и прокариот. Проведенные исследования продемонстрировали, что возможно получить антикалины, специфичные к, по существу, любому белку-мишени человека, и при этом получить аффинность связывания в наномолярном диапазоне или выше. Антикалины также можно получить в формате белков двойной направленности (дуокалины). Дуокалины объединяют два различных терапевтических фрагмента в одном белке, легко получаемом с использованием стандартных методов получения, и при этом сохраняют специфичность к мишени и аффинность вне зависимости от структурной ориентации двух связывающих доменов. Влияние на множество мишеней при помощи одной молекулы особенно полезно при заболеваниях,о которых известно, что они вызваны более чем одним фактором, более того, двух- или мультивалентные форматы связывания, такие как дуокалины, обладают значительным потенциалом нацеливания на поверхность клетки при заболевании и оказывают агонистическое действие на пути передачи сигнала или вызывают усиленную интернализацию посредством связывания и кластеризации рецепторов клеточной поверхности. Более того, высокая стабильность, присущая дуоклинам, сравнима со стабильностью мономерных антикалинов. Дополнительную информацию относительно антикалинов можно найти в патенте США 7250297 и публикации WO 99/16873, каждый из которых включен в настоящее описание посредством ссылки. Авимеры представляют собой еще один тип технологии миметиков антител, применимый в контексте настоящего изобретения. Авимеры получены из обширного семейства внеклеточных рецепторных доменов человека путем in vitro перемешивания экзонов и применения фагового дисплея, обеспечивших получение мультидоменных белков, обладающих свойствами связывания и ингибирования. Было показано, что объединение независимых связывающих доменов приводит к возникновению авидности, улучшению аффинности и специфичности по сравнению с обычными связывающими белками, связывающими единственный эпитоп. Другие потенциальные преимущества включают простоту и эффективность получения таких мультспецифичных молекул в Escherichia coli, улучшенную термостабильность и устойчивость к действию протеаз. Были получены авимеры к различным мишеням, обладающие субнаномолярными значениями аффинности. Дополнительную информацию относительно авимеров можно найти в документах 2006/0286603, 2006/0234299, 2006/0223114, 2006/0177831, 2006/0008844, 2005/0221384,2005/0164301, 2005/0089932, 2005/0053973, 2005/0048512, 2004/0175756, каждый из которых полностью включен в настоящее описание посредством ссылки. Версатела представляют собой еще одну технологию миметиков антител, которую можно использовать в контексте настоящего изобретения. Версатела представляют собой небольшие белки массой 3-5 кДа, содержащие 15% цистеинов, которые образуют каркас с высокой плотностью дисульфидных связей, вместо гидрофобной основы, которой обычно обладают белки. Такая замена обеспечивает белок,имеющий более маленький размер и являющийся более гидрофильным (т.е. менее склонный к агрегации и неспецифичному связыванию) и более устойчивым к действию тепла и протеаз, который обладает меньшей плотностью эпитопов Т-клеток, поскольку остатки, которые вносят наибольший вклад в презентацию ГКГС являются гидрофобными. Хорошо известно, что каждое из четырех указанных свойств влияет на иммуногенность и поэтому ожидается, что вместе они обеспечат значительное снижение иммуногенности. Структура версател обеспечивает формат миметиков антител, который включает множественную валентность, множественную специфичность, разнообразные механизмы регулирования полужизни, модули тканевого нацеливания и отсутствие участка Fc-антитела. Кроме того, версатела получают в Е. coli с высоким выходом, а благодаря гидрофильности и небольшому размеру версатела хорошо растворимы,что обеспечивает возможность их получения в форме с высокой концентрацией. Версатела исключительно устойчивы к воздействию температуры и имеют увеличенное время полужизни. Дополнительную информацию относительно антител можно найти в заявке на патент США 2007/0191272, которая полно- 21018396 стью включена в настоящее описание посредством ссылки. Приведенное выше описание технологий фрагментов и миметиков антител не является полным. В контексте настоящего изобретения могут использоваться разнообразные дополнительные технологии,включая альтернативные технологии, основанные на полипептидах, например объединение гипервариабельных участков, описанное Qui et al., Nature Biotechnology, 25(8) 921-929 (2007), а также технологии,основанные на нуклеиновых кислотах, такие как технологии РНК-аптамеров, описанные в патентах США 5789157; 5864026; 5712375; 5763566; 6013443; 6376474; 6613526; 6114120; 6261774 и 6387620; каждый из которых включен в настоящее описание путем ссылки. Физические свойства антител. Антитела согласно настоящему изобретению можно описывать через различные физические свойства, что позволяет определять и/или различать различные классы. Антитела согласно настоящему изобретению могут содержать один или более сайтов гликозилирования в вариабельной области тяжелой или легкой цепи. Такие сайты гликозилирования могут обеспечивать повышенную иммуногенность антитела или изменение pK антитела вследствие изменения связывание антигена (Marshall et al. (1972) Annu Rev. Biochem, 41: 673-702; Gala and Morrison (2004) J. Immunol,172: 5489-94; Wallick et al. (1988) J. Exp. Med., 168:1099-109; Spiro (2002) Glycobiology, l2:43R-56R;Parekh et al. (1985) Nature 316:452-7; Mimura et al. (2000) Mol. Immunol., 37:697-706). Известно, что гликозилирование происходит в мотивах, содержащих последовательность N-X-S/T. В некоторых случаях предпочтительно получить антитело к мезотелину, которое не гликозилировано в вариабельной области. Этого можно достичь либо путем отбора антител, которые не содержат мотивов гликозилирования в вариабельной области, либо путем осуществления мутаций в участке гликозилирования. В предпочтительном варианте осуществления антитела согласно настоящему изобретению не содержат сайтов изомеризации аспарагина. Деамидирование аспарагина может возникать в последовательностях N-G или D-G и приводить к образованию остатка изоаспарагиновой кислоты, который вызывает перекручивание полипептидной цепи или снижение ее стабильности (эффект изаспарагиновой кислоты). Каждое антитело обладает уникальной изоэлектрической точкой (pI), которая обычно лежит в диапазоне рН от 6 до 9,5. pI для антитела IgG1 обычно лежит в диапазоне рН 7-9,5, a pI для антитела IgG4 обычно лежит в диапазоне рН 6-8. Существует предположение, что антитела, pI которых находится за пределами нормального диапазона, возможно обладают некоторой неустойчивостью и склонности к нарушению пространственной укладки in vivo. Таким образом, предпочтительно получать антитела, значение pI которых попадает в нормальный диапазон. Этого можно достичь либо путем отбора антитела с pI в нормальном диапазоне, либо путем осуществления мутаций заряженных остатков. Каждое антитело будет обладать характерной температурой плавления, причем более высокая температура плавления указывает на более высокую общую стабильность in vivo (Krishnamurthy R. and Manning M.C. (2002) Curr Pharm Biotechnol, 3:361-71). В целом предпочтительно, чтобы TM1 (температура начала разворачивания молекулы) была выше 60 С, предпочтительно выше 65 С, еще более предпочтительно выше 70 С. Точка плавления антитела может быть определена при помощи дифференциальной сканирующей калориметрии (Chen et al. (2003) Pharm Res., 20:1952-60; Ghirlando et al. (1999) ImmunolLett, 68:47-52) или методом кругового дихроизма (Murray et al. (2002) J. Chromatogr Sci, 40:343-9). В предпочтительном варианте осуществления отбирают антитела, которые не подвержены быстрому разрушению. Разрешение антител можно определить методом капиллярного электрофореза (СЕ) иA.J. and Hughes D.E. (1995) Anal Chem, 67: 3626-32). В другом предпочтительном варианте осуществления отбирают антитела, которые обладают минимальным эффектом агрегации, который может привести к нежелательному иммунному ответу и/или измененным или неблагоприятным фармакокинетическим свойствам. В целом, приемлемыми являются антитела с агрегацией 25% или меньше, предпочтительно 20% или меньше, еще более предпочтительно 15% или меньше, еще более предпочтительно 10% или меньше и еще более предпочтительно 5% или меньше. Агрегация может быть измерена с использованием нескольких методик, включая колоночную гель-хроматографию (SEC), высокоэффективную жидкостную хроматографию (ВЭЖХ) и рассеяние света. Способы конструирования антител. Как описано выше, антитела к мезотелину, включающие известные последовательности VH и VL,можно использовать для получения новых антител к мезотелину путем модификации их самих или константных областей (области), к которым они присоединены. Таким образом, в другом аспекте настоящего изобретения структурные элементы известного антитела к мезотелину, например 3 С 10, 6 А 4 или 7 В 1,используют для получения структурно близких антител к мезотелину, которые сохраняют по меньшей мере одно из функциональных свойств антител согласно настоящему изобретению, таких как связывание мезотелина человека. Например, один или более участков CDR известных антител к мезотелину или мутантов таких антител можно рекомбинантными методами объединить с каркасными участками и/или другими участками CDR с получением дополнительных рекомбинантных антител к мезотелину согласно настоящему изобретению, как обсуждалось выше. Другие типы модификации включают модификации,- 22018396 описанные в предыдущем разделе. Исходным материалом для такого метода конструирования являются одна или более последовательностей VH и/или VL, приведенных в настоящем описании, или один или более участков CDR указанных областей. Для получения сконструированного антитела необязательно фактически получать (т.е. экспрессировать в виде белка) антитело, включающее одну или более последовательностей VH и/или VL, приведенных в настоящем описании, или один или более участков CDR указанных областей. Вместо этого информацию, содержащуюся в такой последовательности (последовательностях), используют для получения последовательности (последовательностей) "второго поколения",полученной из исходной последовательности (последовательностей), а затем указанную последовательность "второго поколения" получают и экспрессируют в виде белка. Соответственно согласно одному варианту осуществления настоящего изобретения предложен способ получения антител к мезотелину, включающий:(b) изменение по меньшей мере одного остатка аминокислоты в последовательности вариабельной области VH антитела и/или последовательности VL антитела с получением по меньшей мере одной измененной последовательности антитела и(с) экспрессию указанной измененной последовательности антитела в виде белка. Для получения и экспрессии измененной последовательности антитела можно использовать стандартные методики молекулярной биологии. В некоторых вариантах осуществления возможно вводят мутации (случайным или селективным образом) во всей последовательности, кодирующей антитело к мезотелину или в ее части, полученное в результате модифицированное антитело к мезотелину можно подвергнуть скринингу на активность связывания и/или другие функциональные свойства согласно настоящему изобретению. Способы осуществления мутаций описаны в данной области. Например, в WO 02/092780 (Short) описаны способы получения и скрининга мутированных антител с использованием насыщающего мутагенез, сборки путем синтетического лигирования или комбинаций указанных методов. В качестве альтернативы в WO 03/074679(Lazar et al.) описаны способы использования методов компьютерного скрининга для оптимизации физико-химических свойств антител. Нуклеиновые кислоты, кодирующие антитела согласно настоящему изобретению. Согласно другому аспекту настоящего изобретения предложены молекулы нуклеиновой кислоты,которые кодируют антитела согласно настоящему изобретению. Такие нуклеиновые кислоты могут существовать в цельных клетках, в лизатах клеток или в частично очищенной или по существу очищенной форме. Нуклеиновая кислота является "выделенной" или "по существу очищенной", если она очищена от других компонентов клетки и других примесей, например других нуклеиновых кислот или белков клетки, стандартными способами, включая обработку смесью щелочь/SDS, разделение с использованиемWiley Interscience, New York). Нуклеиновая кислота согласно настоящему изобретению может представлять собой, например, ДНК, РНК и может содержать или не содержать интронные последовательности. В предпочтительном варианте осуществления нуклеиновая кислота представляет собой молекулу ДНК. Нуклеиновые кислоты согласно настоящему изобретению могут быть получены при помощи стандартных методик молекулярной биологии. Для антител, экспрессируемых гибридомами (например, гибридомами, полученными с использованием трансгенных мышей, несущих гены иммуноглобулина человека, как описано ниже), молекулы кДНК, кодирующие тяжелую и легкую цепи антител, продуцируемые гибридомами, можно получить путем стандартной амплификации методом ПЦР или методами клонирования кДНК. В случае антител, полученных из библиотеки генов иммуноглобулинов (например, с использованием методики фагового дисплея), кодирующую такие антитела нуклеиновую кислоту можно получить из библиотеки генов. Предпочтительные молекулы нуклеиновой кислоты представляют собой молекулы, кодирующие последовательности VH и VL моноклональных антител 3 С 10, 6 А 4 или 7 В 1. Последовательности ДНК,кодирующие VH 3 С 10, 6 А 4 и 7 В 1, показаны в SEQ ID NO: 25-27 соответственно. Последовательности ДНК, кодирующие VL 3C10, 6 А 4 и 7 В 1, показаны в SEQ ID NO: 28-30 соответственно. После получения фрагментов ДНК, кодирующих сегменты VH и VL, указанные фрагменты ДНК можно подвергнуть дальнейшим манипуляциям с применение стандартных технологий рекомбинантной ДНК, например, чтобы превратить гены вариабельных областей в гены полноразмерных антител, в гены фрагментов Fab или в гены scFv. В указанных манипуляциях фрагменты ДНК, кодирующие VL или VH,функционально связывают с другим фрагментом ДНК, кодирующим другой белок, такой как констант- 23018396 ная область или гибкий линкер. Термин "функционально связанный" в настоящем описании означает,что два фрагмента ДНК соединены таким образом, что кодируемые ими последовательности аминокислот остаются в рамке. Изолированную ДНК, кодирующую область VH, можно превратить в ген полноразмерной цепи антитела путем обеспечения функциональной связи ДНК, кодирующей VH, с молекулой ДНК, кодирующей константные участки тяжелой цепи (CH1, CH2 и СН 3). Последовательности генов константных областей тяжелой цепи человека известны в данной области (см., например, Kabat '242), а фрагменты ДНК, включающие такие участки, могут быть получены путем стандартной амплификации методом ПЦР. Константные области тяжелой цепи могут представлять собой константные области IgG1, IgG2, IgG3, IgG4,IgA, IgE, IgM или IgD, но в наиболее предпочтительном случае представляют собой константную область IgG1 или IgG4. Для гена тяжелой цепи фрагмента Fab ДНК, кодирующая VH, может быть функционально связана с молекулой ДНК, кодирующей константную область тяжелой цепи. Изолированную ДНК, кодирующую область VL, можно превратить в ген полноразмерной цепи антитела (а также в ген легкой цепи Fab) путем обеспечения функциональной связи ДНК, кодирующей VL,с другой молекулой ДНК, кодирующей константную область, CL. Последовательности генов константных областей легкой цепи человека известны в данной области (см., например, Kabat '242), а фрагменты ДНК, включающие такие участки, могут быть получены путем стандартной амплификации методом ПЦР. В предпочтительных вариантах осуществления константная область легкой цепи представляет собой константную область каппа или лямбда. Чтобы получить ген scFv, фрагменты ДНК, кодирующие VH и VL, функционально соединяют с другим фрагментом, кодирующим гибкий линкер, например кодирующий последовательность аминокислот(Gly4-Ser)3, таким образом, чтобы последовательности VH и VL экспрессировались в виде непрерывной цепи белка, и при этом VL и VH были соединены гибким ликером (см., например, Bird et al. (1988) Science, 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA, 85:5879-5883; McCafferty et al., (1990)Nature, 348:552-554). Получение моноклональных антител согласно настоящему изобретению. Моноклональные антитела (mAbs) согласно настоящему изобретению можно получать с использованием разнообразных методик, включая методику гибридизации соматических клеток, предложеннуюKohler и Milstein (1975) Nature, 256: 495. Хотя предпочтительными являются процедуры гибридизации соматических клеток, в принципе, можно использовать и другие методики, например вирусную или онкогенную трансформацию В-лимфоцитов. Предпочтительные животные с использованием клеток животных для получения гибридом представляют собой системы с использование мышей. Получение гибридом в мышах - очень хорошо разработанная процедура. Протоколы иммунизации и методики выделения иммунизированных спленоцитов для слияния известны в данной области. Партнеры для слияния (например, клетки миеломы мыши) и процедуры слияния также известны. Химерные или гуманизированные антитела согласно настоящему изобретению могут быть получены на основе последовательностей, не являющихся антителами человека антител, полученных, как описано выше. ДНК, кодирующая тяжелые и легкие цепи иммуноглобулинов, может быть получена из представляющих интерес гибридом, полученных не из клеток человека, и подвергнута модификации для включения не-мышиных последовательностей иммуноглобулинов (например, последовательностей человека) с применением стандартных методик молекулярной биологии. Например, для получения химерного антитела вариабельные области мыши можно объединить с константными областями человека (см.,например, US 4816567 (Cabilly et al Чтобы получить гуманизированное антитело, участки CDR мыши можно встроить в каркас человека (см., например, US 5225539 (Winter) и US 5530101; 5585089; 5693762 и 6180370 (Queen et al В предпочтительном случае антитела представляют собой антитела человека. Такие антитела могут быть получены с использованием трансгенных или трансхромосомных мышей, в которых часть иммунной системы мыши заменена на часть иммунной системы человека. Такие трансгенные и трансхромосомные мыши включают типы HuMAb Mouse и KM Mouse соответственно. В настоящем описании таких мышей называют общим термином "мыши, несущие Ig человека". Мыши типа HuMAb Mouse (Medarex, Inc.) несут минилокусы гена иммуноглобулина человека,которые кодируют неперемешанные последовательности тяжелой ( и ) и легкойцепи иммуноглобулина человека, а также содержат направленные мутации, инактивирующие эндогенные локусы цепии(см., например, Lonberg et al. (1994) Nature, 368 (6474): 856-859). Соответственно такие мыши демонстрируют пониженную экспрессию IgM илимыши, и в ответ на иммунизацию происходит переключение класса введенных трансгенов тяжелой и легкой цепей человека и соматическая мутация, что приводит к выработке высокоаффинных антител IgG человека (Lonberg et al. (1994), supra; обзор в Lonberg (1994)Handbook of Experimental Pharmacology, 113:49-101; Lonberg and Huszar (1995) Intern. Rev. Immunol.,13:65-93 и Harding and Lonberg (1995) Ann. N.Y. Acad. Sci., 764:536-546). Получение и использование мышей типа HuMAb Mouse и модификаций генома таких мышей описано в источниках Taylor et al.(1994) International Immunology, 6: 579-591 и Fishwild et al. (1996) Nature Biotechnology, 14: 845-851, содержание каждого из которых полностью включено в настоящее описание путем иммунизации; см. также патенты США 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429 (все Lonberg и Kay); 5545807 (Surani et al.); публикации WO 92/03918, WO 93/12227, WO 94/25585, WO 97/13852, WO 98/24884, WO 99/45962 (все Lonberg and Kay) и WO 01/14424 (Korman et al.). Также можно использовать трансгенных мышей, несущих гены легкой цепи лямбда человека, например,описанные в WO 00/26373 (Bruggemann). Например, можно скрестить мышь, несущую трансген легкой цепи лямбда человека, с мышью, несущей трансген тяжелой цепи человека (например, НСо 7) и возможно также несущей трансген легкой цепи каппа человека (например, KCo5), с получением мыши, несущей трансгены как легкой, так и тяжелой цепей (см., например, пример 1). В другом варианте осуществления моноклональные антитела человека согласно настоящему изобретению можно получать с использованием мыши, несущей последовательности иммуноглобулинов человека в виде трансгенов или трансхромосом, например мыши, несущей трансген тяжелой цепи человека и трансхромосому легкой цепи человека. В настоящем описании такая мышь обозначается как штамм или тип KM Mouse, такие мыши описаны в WO 02/43478 (Ishida et al.). Кроме того, можно использовать другие доступные альтернативные системы экспрессии генов иммуноглобулинов человека на основе трансгенных животных для получения антител к мезотелину согласно настоящему изобретению. Например, можно использовать одну из таких альтернативных трансгенных систем, обозначаемую Xenomouse (Abgenix, Inc.), которая описана, например, в US 5939598; 6075181; 6114598; 6150584 и 6162963 (Kucherlapati et al.). Кроме того, в данной области доступны альтернативные системы экспрессии генов иммуноглобулинов человека на основе трансхромосомных животных, которые можно использовать для получения антител к мезотелину согласно настоящему изобретению. Например, можно использовать трансгенных мышей, несущих и трансхромосому тяжелой цепи человека, и трансхромосому легкой цепи человека,обозначаемых "ТС мыши"; такие мыши описаны в Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA, 97: 722-727. Помимо этого, описаны коровы, несущие трансхромосомы тяжелой и легкой цепей, напримерKuroiwa et al. (2002) Nature Biotechnology, 20: 889-894 и WO 2002/092812. Антитела человека согласно настоящему изобретению можно также получать с использованием методов фагового дисплея для скрининга библиотек иммуноглобулинов человека; см., например, патенты США 5223409; 5403484 и 5571698 (Ladner et al.); патенты 5427908 и 5580717 (Dower et al.); патенты 5969108 и 6172197 (McCafferty et al.) и патенты 5885793; 6521404; 6544731; 6555313; 6582915 и 6593081(Griffiths et al.). Антитела человека согласно настоящему изобретению можно также получать с использованием мышей SCID, в которых воссозданы иммунные клетки человека, благодаря чему после иммунизации может развиться ответ антител человека. Такие мыши описаны в патентах США 5476996 и 5698767 (Wilson et al.). В другом варианте осуществления антитела человека к мезотелину получают с использованием комбинации мыши, несущей Ig человека, и методик фагового дисплея, как описано в US 6794132(Buechler et al.). Более конкретно, данный способ включает, во-первых, индукцию ответа антител к мезотелину у мышей, несущих ген Ig человека (например, мыши HuMab Mouse или KM Mouse), путем иммунизации антител одним или более антигенов мезотелина, с последующим выделением нуклеиновых кислот, кодирующих цепи антител человека, из лимфоцитов мыши и введением указанных нуклеиновых кислот в вектор дисплея (например, фаговый) с получением набора векторов для библиотеки. Таким образом, каждый член библиотеки содержит нуклеиновую кислоту, кодирующую цепь антитела человека, а каждая цепь антитела представлена в дисплее. Затем осуществляют скрининг библиотеки с белком мезотелином, что позволяет выделить члены библиотеки, специфично связывающие мезотелин. Затем вставки нуклеиновых кислот отобранных членов библиотеки выделяют и секвенируют стандартными методами, чтобы определить вариабельные последовательности тяжелой и легкой цепей. Вариабельные области можно превратить в полноразмерные цепи антител с использованием стандартных методик рекомбинантной ДНК, таких как клонирование в вектор экспрессии, который несет константные области тяжелой и легкой цепей, таким образом, чтобы область VH была функционально связана с областью CH, а областьVL была функционально связана с областью CL. Иммунизация мышей, вырабатывающих Ig человека. Если для получения антител человека согласно настоящему изобретению используют мышей, несущих ген Ig человека, таких мышей можно иммунизировать очищенной или обогащенной композиции антигена мезотелина и/или рекомбинантного белка мезотелина, клеток, экспрессирующих белок мезотелин, или белком слияния, включающем мезотелин, как описано в Lonberg, N. et al. (1994) Nature,368(6474): 856-859; Fishwild, D. et al. (1996) Nature Biotechn., 14: 845-851 и WO 98/24884 и WO 01/14424. В предпочтительном случае используют мышей в возрасте 6-16 после первой инфузии. Например, очищенный или рекомбинантный препарат (5-50 мкг) антигена мезотелина используют для интраперитонеальной и/или подкожной иммунизации мышей, несущих ген Ig человека. В наиболее предпочтительном случае иммуноген, используемый для стимуляции выработки антител согласно настоящему изобретению, представляет собой белок слияния на основе мезотелина, содержащий внеклеточный домен белка мезотелина, слитый с N-полипептида, не являющегося мезотелином (например, меткой His) (см., например, пример 1). Процедуры получения полностью человеческих моноклональных антител, которые связывают мезотелин человека, подробно описаны в примере 1. Экспериментальные данные, полученные с различными антигенами, показывают, что у трансгенных мышей типа HuMAb Mouse получали ответ путем первичной внутрибрюшинной иммунизации (IP) антигеном в полном адъюванте Фрейнда с последующими еженедельными IP иммунизациями (до 6) антигеном в неполном адъюванте Фрейнда (например, адъювант RIBI). Кроме того, обнаружили, что цельные клетки без адъюванта также высокоиммуногенны. Можно осуществлять мониторинг иммунного ответа на протяжении курса иммунизации по образцам крови, полученным из заглазничных областей. Скрининг плазмы можно осуществлять методом ИФА. Мышей с достаточным уровнем иммуноглобулинов к мезотелину можно использовать для получения слитых конструктов. Можно провести поддерживающую иммунизацию мышей антигенов, например, за 3 дня до умерщвления и извлечения селезенки. Ожидается, что для каждой иммунизации может потребоваться 2-3 слияния. Каждым антигеном обычно иммунизируют от 6 до 24 мышей. Обычно используют оба типа: НСо 7 и НСо 12. Кроме того, оба трансгена, НСо 7 и НСо 12, можно культивировать в одной мыши, несущей два разных трансгена тяжелой цепи человека (НСо 7/НСо 12). В качестве альтернативы или в дополнение можно использовать мышей KM Mouse. Получение гибридом, продуцирующих моноклональные антитела человека согласно настоящему изобретению. Для получения гибридом, продуцирующих моноклональные антитела человека согласно настоящему изобретению, выделяют спленоциты и/или лимфоциты иммунизированных мышей и осуществляют их слияние с клетками иммортализованной линии, таким как линия клеток миеломы мыши. Полученные гибридомы проверяют на предмет продуцирования антигенспецифичных антител. Например, осуществляют слияние клеточных суспензий (содержащие одну клетку) лимфоцитов селезенки из иммунизированных мышей с отношении один к шести с несекреторными клетками миеломы мыши линии Р 3 Х 63Ag8. 653 (АТСС, CRL 1580) с 50% PEG. В качестве альтернативы можно осуществить слияние суспензий лимфоцитов селезенки иммунизированных мышей методом электрослияния с использованием электропорятора для слияния клеток с большой камерой CytoPulse (CytoPulse Sciences, Inc., Glen Burnie, Maryland). Клетки наносят на плоскодонные микротитрационные планшеты в концентрации 2105, после чего инкубируют в течение двух недель в селективной среде, содержащей 20% фетальной сыворотки Cloneserum, 18% кондиционированной среды "653", 5% оригена (IGEN), 4 мМ L-глютамина, 1 мМ пирувата натрия, 5 мМ HEPES, 0,055 мМ 2-меркаптоэтанола, 50 ед./мл пенициллина, 50 мг/мл стрептомицина, 50 мг/мл гентамицина и 1X HAT (Sigma; HAT добавляют через 24 ч после слияния). Затем приблизительно в течение двух недель клетки культивируют в среде, в которой HAT заменен на НТ. Методом ИФА проводят скрининг отдельных клеток на моноклональные антитела IgM и IgG человека. После начала интенсивного роста гибридом культивирование продолжают обычно в течение 10-14 дней. Гибридомы, секретирующие антитела, пересевают, снова подвергают скринингу и, если они все еще положительны по IgG человека, по меньшей мере дважды субклонируют моноклональные антитела путем ограничивающего разбавления. Затем стабильные субклоны культивируют in vitro для получения небольших количеств антитела в среде для культивирования тканей для исследования. Для очистки моноклональных антител человека отобранные гибридомы культивируют в двухлитровых вращающихся флаконах. Супернатанты фильтруют и концентрируют, а затем подвергают аффинной хроматографии с белком А на сефарозе (Pharmacia, Piscataway, Нью-Джерси). Элюированные фракции IgG проверяют методом гель-электрофореза и ВЭЖХ, чтобы гарантировать чистоту. Буферный раствор заменяют на ФБР и определяют концентрацию по ОП 280 при коэффициенте экстинктции 1.43. Моноклональные антитела аликвотируют и хранят при -80 С. Получение трансфектом, продуцирующих моноклональные антитела согласно настоящему изобретению. Антитела согласно настоящему изобретению также можно продуцировать, используя в качестве клеток-хозяев трансфектомы, с применением, например, комбинации технологии рекомбинантной ДНК и методов трансфекции генов, хорошо известных в данной области (например, Morrison, S. (1985)Science, 229:1202). Например, для экспрессии антител или фрагментов антител при помощи стандартных методик молекулярной биологии получают молекулы ДНК, кодирующие часть или полноразмерные тяжелые и легкие цепи (например, амплификация путем ПЦР или клонирование ДНК с использованием гибридомы,которая экспрессирует представляющее интерес антитело), после чего полученные молекулы ДНК мож- 26018396 но встраивать в векторы экспрессии с обеспечением функциональной связи генов с последовательностями контроля транскрипции и трансляции. В настоящем описании термин "функционально связан" означает, что ген антитела лигирован в вектор таким образом, что последовательности контроля транскрипции и трансляции данного вектора осуществляют регуляции транскрипции и трансляции указанного гена антитела. Вектор экспрессии и контрольные последовательности выбирают таким образом, чтобы они были совместимы с используемой клеткой-хозяином. Ген легкой цепи антигена и ген тяжелой цепи антигена встраивают в разные векторы или, что более типично, оба гена встраивают в один вектор экспрессии. Встраивание генов антитела в вектор экспрессии осуществляют стандартными методами (например,лигирование комплементарных сайтов рестрикции на фрагменте гена антитела и векторе, или лигирование тупых концов при отсутствии сайта рестрикции). Вариабельные области тяжелой и легкой цепей антител согласно настоящему изобретению используют для получения полноразмерных генов антитела определенного изотипа путем встраивания их в векторы, которые уже кодируют константную область тяжелой цепи и константную область легкой цепи желаемого изотипа, таким образом, чтобы сегмент VH был функционально связан с сегментом(ами) CH в векторе, а сегмент VL был функционально связан с сегментом CL в векторе. В качестве дополнения или альтернативы рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в вектор таким образом, чтобы указанный сигнальный пептид был связан в пределах рамки с аминоконцом гена антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из белка, отличного от иммуноглобулина). В дополнение к генам цепей антитела рекомбинантные векторы экспрессии согласно настоящему изобретению несут регуляторные последовательности, которые контролируют экспрессию указанных генов цепей антитела в клетке-хозяине. Термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепей антитела. Такие регуляторные последовательности описаны, например, у Goeddel (Gene Expression Technology. Methods in Enzymology, 185, Academic Press, San Diego, CA (1990. Для специалиста в данной области очевидно, что конструкция вектора экспрессии, включая секреторные и регуляторные последовательности, может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, желаемый уровень экспрессии и т.д., предпочтительные регуляторные последовательности для клеток-хозяев млекопитающих включают вирусные элементы, которые обеспечивают высокие уровни экспрессии белка в клетках млекопитающих, например,полученные из цитомегаловируса (CMV), вируса обезьян 40 (SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP) и полиомы). В качестве альтернативы можно использовать невирусные регуляторные последовательности, такие как убикфитиновый промотор или промотор глобина. Кроме того, можно использовать регуляторные элементы, состоящие из последовательностей,полученных из разных источников, такие как промоторная система SR, которая содержит последовательности из раннего промотора SV40 и длинный концевой повтор из вируса Т-клеточной лейкемии человека типа 1 (Takebe, Y. et al. (1988) Mol. Cell. Biol., 8:466-472). В дополнение к генам цепей антитела и регуляторным последовательностям рекомбинантные векторы экспрессии согласно настоящему изобретению могут нести дополнительные последовательности,такие как последовательности, регулирующие репликацию вектора в клетке-хозяине (например, ориджины репликации) и гены маркеров отбора. Гены маркеров отбора облегчают отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США 4399216, 4634665 и 5179017, авторы Axel et al.). Например, типичный ген маркера селекции сообщает устойчивость к какому-либо лекарственному средству, такому как G418, гигромицин или метотрексат, клетке-хозяину, в которую введен данный вектор. Предпочтительные гены маркеров селекции включают ген дигидрофолетредуктазы (DHFR) (для использования dhfr-клеток-хозяев в селекции/амплицикации с метотрексатом) и ген neo (для селекции с G418). Для обеспечения экспрессии тяжелой и легкой цепей, кодирующий вектор(ы) экспрессии вводят путем трансфекции в клетку-хозяина. Предполагается, что термин "трансфекция" включает разнообразные технологии, обычно применяемые для введения экзогенной ДНК в прокариотическую или эукариотичекую клетку, например электропорацию, преципитацию кальций-фосфатом, трансфекцию с использованием DEAE-декстрана и т.п. Хотя теоретически возможно осуществлять экспрессию антител согласно настоящему изобретению либо в прокариотических, либо в эукариотических клетках, экспрессия антител в эукариотических клетках и наиболее предпочтительно в клетках млекопитающих, будет обеспечивать сборку и секрецию правильно свернутого иммунологически активного антитела скорее, чем экспрессия в прокариотических клетках. Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител согласно настоящему изобретению включают клетки яичника китайского хомячка (клетки СНО) (включая клетками миеломы NSO предпочтительной является другая система экспрессии с геном GS, описанная вWO 87/04462 (Wilson), WO 89/01036 (Bebbington) и ЕР 338841 (Bebbington). В случае если рекомбинантные векторы экспрессии, кодирующие гены антитела, вводят в клетки-хозяева млекопитающих, указанные антитела получают путем культивирования клеток-хозяев на протяжении периода времени, достаточного для обеспечения экспрессии антител в клетках-хозяевах или более предпочтительно секреции антител в культуральную среду, в которой выращивают клетки-хозяева, антитела могут быть выделены из культуральной среды с использованием обычных методов очистки белков. Исследование связывания антитела с антигеном. Антитела согласно настоящему изобретению можно тестировать на связывание мезотелином при помощи, например, стандартного твердофазного иммуноферментного анализа (ELISA). Вкратце, микротитрационные планшеты покрывают очищенным и/или рекомбинантным белком мезотелином (см., например, пример 1) в концентрации 1 мкг/мл в ФБР, а затем блокируют 5% бычьим сывороточным альбумином в ФБР. В каждую лунку добавляют разбавления антитела (например, разбавления плазмы мышей,иммунизированных мезотелином) и инкубируют в течение 1-2 ч при 37 С. Планшеты промывают смесью ФБР/Tween и инкубируют с вторичным реагентом (например, для антител человека, поликлональный реагент, специфичный к Fc IgG человека, выделенный из организма козы), конъюгированным со щелочной фосфатазой, в течение 1 ч при 37 С. После промывки стимулируют развитие цветной реакции в планшетах путем добавления субстрата pNPP (1 мг/мл) и определяют ОП на длине волны 405-650. В предпочтительном случае для получения продуктов слияния. Описанные выше средства твердофазного иммуноферментного анализа также можно использовать для скрининга на гибридомы, которые демонстрируют положительную реактивность с белком мезотелином. Из каждой гибридомы можно отобрать по одному клону, который сохраняет реактивность родительской клетки (при помощи ELISA), для получения банка клеток объемом 5-10 сосудов, хранящихся при -140 С, и для очистки антитела. Для очистки антител к мезотелину выбранные гибридомы выращивают в двухлитровых переворачиваемых сосудах для очистки моноклональных антител. Супернатанты фильтруют и концентрируют, а затем подвергают аффинной хроматографии с белком А на сефарозе (Pharmacia, Piscataway, НьюДжерси). Элюированные фракции IgG проверяют методом гель-электрофореза и ВЭЖХ, чтобы гарантировать чистоту. Буферный раствор заменяют на ФБР и определяют концентрацию по ОП 280 при коэффициенте экстинктции 1.43. Моноклональные антитела аликвотируют и хранят при -80 С. Чтобы определить, связываются ли отобранные антитела к мезотелину с уникальными эпитопами,каждое антитело биотинилируют с использованием коммерчески доступных реагентов (Pierce, Rockford,IL, США). Исследования конкуренции с использованием немеченых моноклональных антител и биотинилированных моноколональных антител осуществляют с использованием немеченых моноклональных антител и планшетов для ИФА, покрытых белком мезотелином. Связывание биотинилированного mAb можно детектировать при помощи зонда стрептавидин-щелочная фосфатаза. Для того чтобы определить изотип очищенных антител, можно осуществить ИФА на изотип с использованием реагентов, специфичных к определенному изотипу. Например, чтобы определить изотип моноклонального антитела человека, можно покрыть лунки микротитрационного планшета 1 мкг/мл антител к иммуноглобулину человека в течение ночи при 4 С. После блокирования 1% БСА осуществляют реакцию планшетов с 1 мкг/мл или меньше тестируемых моноклональных антител или очищенных контролей изотипов при комнатной температуре в течение от одного до двух. Затем проводят в лунках реакцию либо с конъюгированными со щелочной фосфатазой зондами, специфичными либо к IgG1 человека,либо к IgM человека. Затем инициируют цветную реакцию и проводят анализ, как описано выше.IgG человека к мезотелину также можно исследовать на реактивность с антигеном - мезотелином методом вестерн-блот анализа. Вкратце, готовят антиген - мезотелин и подвергают гель-электрофорезу на полиакриламидном геле с додецилсульфатом натрия. Разделенные антигены переносят на целлюлозные мембраны, блокируют 10% фетальной бычьей сывороткой, осуществляют тесты с исследуемыми моноклональными антителам. Связывание IgG человека детектируют с использованием щелочной фосфатазы к IgG и проводят цветную реакцию с использованием таблетированного субстрата BCIP/NBT(Sigma Chem. Co., St. Louis, Миссури, США). Специфичность связывания антител согласно настоящему изобретению можно также определять путем мониторинга связывания с клетками, экспрессирующими белок мезотелин, например, путем поточной цитометрии. Можно использовать клетки или линии клеток, которые в природе экспрессируют белок мезотелин, такие как клетки OVCAR3, NCI-H226, CFPAC-1 или KB, или линии клеток, такие как клетки СНО, которые можно трансфецировать вектором экспрессии, кодирующим мезотелин, что обеспечит экспрессию мезотелина на поверхность клетки. Тренсфецированный белок может содержать метку, такую как метка myc или метка his, предпочтительно на N-конце, для детектирования с использованием антитела к данной метке. Связывание антитела согласно настоящему изобретению с белком мезотелином может быть определено путем инкубирования трансфецированных клеток с антителом и детектирования связанного антитела. Связывание антитела с меткой на трансфецированном белке можно использовать в качестве положительного контроля. Биспецифичные молекулы. Согласно другому аспекту настоящего изобретения предложены биспецифичные молекулы, включающие антитело к мезотелину или фрагмент такого антитела согласно настоящему изобретению, соединенное с другой функциональной молекулой, например другим пептидом или белком, таким как другое антитело, миметик связывания или лиганд к рецептору, которая связывается по меньшей мере с двумя различными сайтами связывания или целевыми молекулами. Антитела согласно настоящему изобретению фактически могут быть связаны с более чем одной другими функциональными молекулами, в результате чего получают мультиспецифичные молекулы, которые связываются с больше чем двумя сайтами связывания и/или целевыми молекулами. Предполагается, что такие мультиспецифичные молекулы охватывает термин "биспецифичные молекулы", используемый в настоящем описании. Связывание может быть осуществлено посредством химической связи, генетического слияния, нековалентной ассоциации или другими средствами. Соответственно настоящее изобретение охватывает биспецифичные молекулы, имеющее по меньшей мере одну первую специфичность связывания к мезотелину и вторую специфичность связывания ко второму целевому эпитопу. В одном из вариантов осуществления настоящего изобретения второй целевой эпитоп представляет собой Fc-рецептор, например FcRI человека (CD64) или рецептор Fc человека(CD89). Соответственно настоящее изобретение включает биспецифичные молекулы, способные связываться с эффекторными клетками, экспрессирующими FcR или FcR (например, моноцитами, макрофагами или полиморфноядерными клетками (ПЯК, PMN, и обеспечивать нацеливание на клетки, экспрессирующие мезотелин. Такие биспецифичные молекулы нацеливают клетки, экспрессирующие мезотелин, на эффекторные клетки и запускают опосредуемую рецептором Fc активность эффекторных клеток,такую как фагоцитоз клеток, экспрессирующих мезотелин, АЗКЦ, высвобождение цитокинов или выработку супероксид-аниона. В случае, когда биспецифичная молекула является мультиспецифичной, указанная молекула может дополнительно обладать третьей специфичностью (т.е. включать третий элемент, определяющий специфичность), в дополнение к специфичности связывания в отношении Fc и специфичности связывания в отношении мезотелина. В одном варианте реализации третья специфичность связывания направлена против фактора активации (EF), часть, например, молекулы, которая связывается с белком поверхности,участвующим в цитотоксической активности, что обеспечивает усиление иммунного ответа в отношении клетки-мишени. "Направленная к фактору активации часть" может представлять собой антитело, функциональный фрагмент антитела или лиганд, который связывается с определенной молекулой, например антигеном или рецептором, что приводит к усилению эффекта детерминант связывания рецептора Fc или антигена клетки-мишени. "Направленная к фактору активации часть" обладает способностью связывать рецептор Fc или какой-либо антиген клетки-мишени. В качестве альтернативы направленная к фактору активации часть возможно обладает способностью связывать молекулу, которая отличается от молекулы,к которой направлены первая и вторая специфичности связывания. Например, направленная к фактору активации часть возможно связывается с цитотоксической Т-клеткой (например, через CD2, CD3, CD8,CD28, CD4, CD40, ICAM-1) или другой клеткой иммунной системы, что обеспечивает усиление иммунного ответа в отношении клетки-мишени). В одном варианте осуществления биспецифичные молекулы согласно настоящему изобретению включают в качестве части, отвечающей за специфичность, по меньшей мере одно антитело или фрагмент антитела, включая, например, Fab, Fab', F(ab')2, Fv, Fd, dAb или одноцепочечный Fv. Антитело также может представлять собой димер легкой или тяжелой цепи или любой минимальный фрагмент антитела, такой как Fv или одноцепочечный конструкт, описанный в патенте США 4946778 (Ladner et al.),содержание которого прямо включено в настоящее описание посредством ссылки. В одном варианте осуществления специфичность связывания в отношении рецептора Fc обеспечивает моноклональное антитело, связывание которого не блокирует иммуноглобулин G (IgG) человека. В настоящем описании термин "рецептор IgG" относится к любому из восьми генов -цепи, расположенному в хромосоме 1. Указанные гены вместе кодируют двенадцать изоформ трансмембранного или растворимого рецептора, которые делятся на три класса рецепторов Fc: FcRI (CD64), FcRII (CD32) иFcRIII (CD16). В одном предпочтительном варианте осуществления рецептор Fc представляет собой высокоаффинный рецептор FcRI человека. FcRI человека представляет собой молекулу массой 72 кДа,которая демонстрирует высокую аффинность в отношении мономерного IgG (108-109 М-1). Получение и исследование некоторых предпочтительных анти-Fc моноклональных антител описаны в публикации WO 88/00052 и патенте США 4954617 (Fanger et al.), которые полностью включены в настоящее описание посредством ссылки. Указанные антитела связываются с некоторым эпитопомFcRI, FcRII или FcRIII в сайте, который отличается от сайта связывания Fc рецептора, и, таким образом, их связывание, по существу, не блокируется физиологическими уровнями IgG. Специфичные антиFcRI антитела, которые можно применять в соответствии с настоящим изобретением, представляют собой mAb 22, mAb 32, mAb 44, mAb 62 и mAb 197. Гибридома, продуцирующая mAb 32, доступна в Американской коллекции типовых культур, АТСС,доступа НВ 9469. В других вариантах осуществления
МПК / Метки
МПК: C12P 21/08, A61K 39/00
Метки: человека, связываюt, которые, мезотелин, антитела, применение, антител, таких
Код ссылки
<a href="https://eas.patents.su/30-18396-antitela-cheloveka-kotorye-svyazyvayut-mezotelin-i-primenenie-takih-antitel.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела человека, которые связывают мезотелин, и применение таких антител</a>
Предыдущий патент: Метод экспрессного обнаружения наркотиков в конфискованных пробах веществ
Следующий патент: Огнезащитная полиамидная композиция
Случайный патент: Применение ингибиторов дипептидилпептидазы












