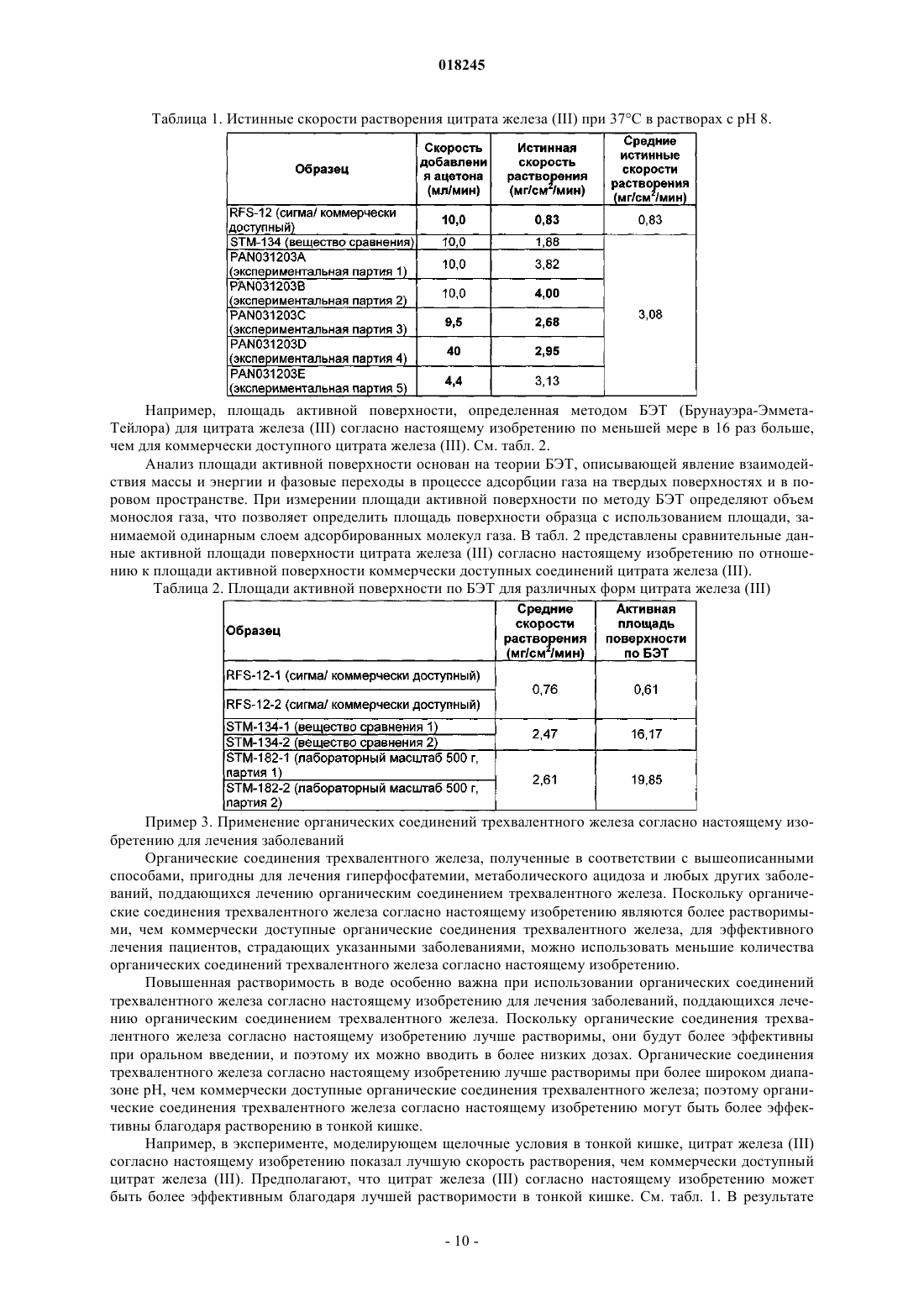
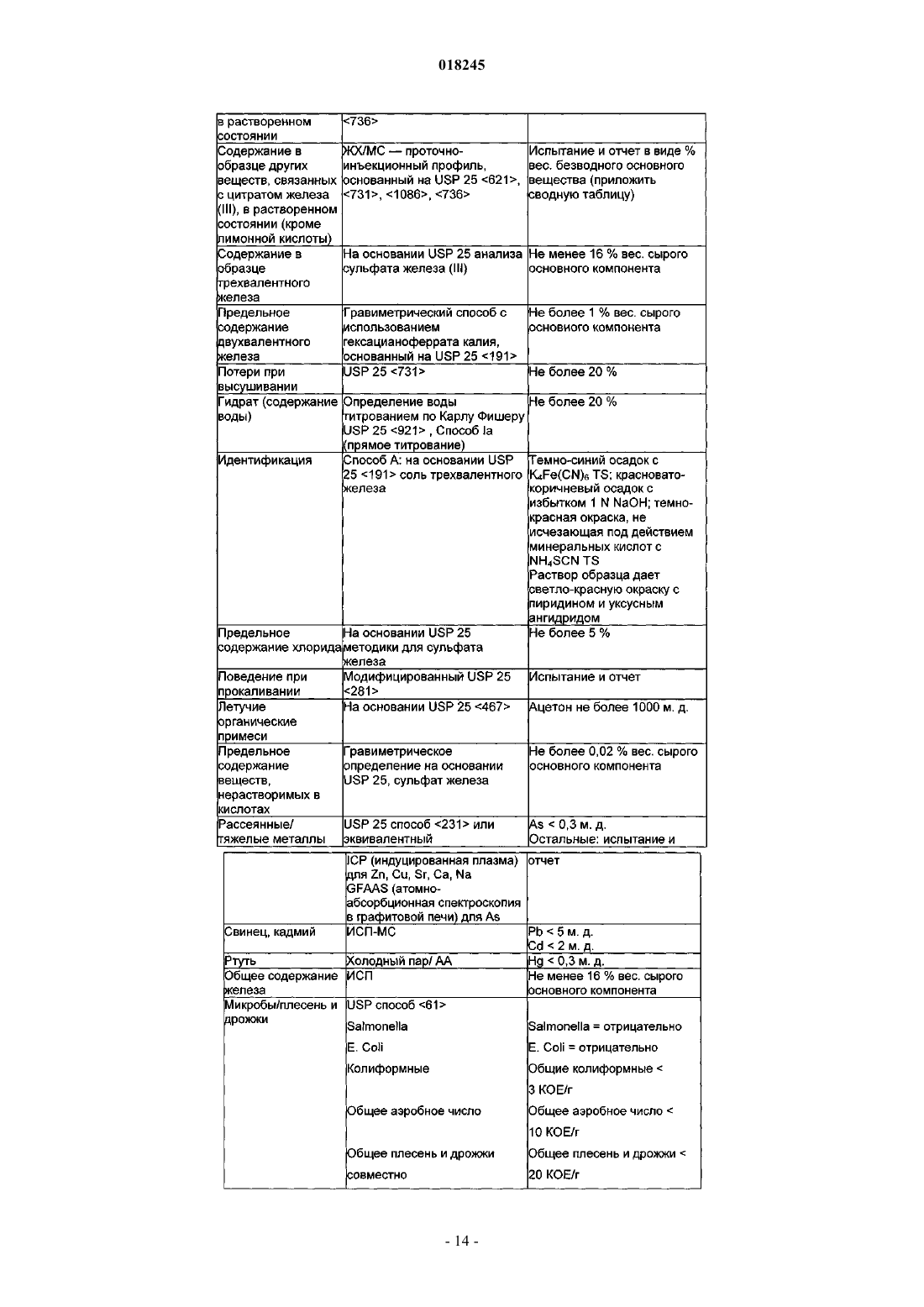
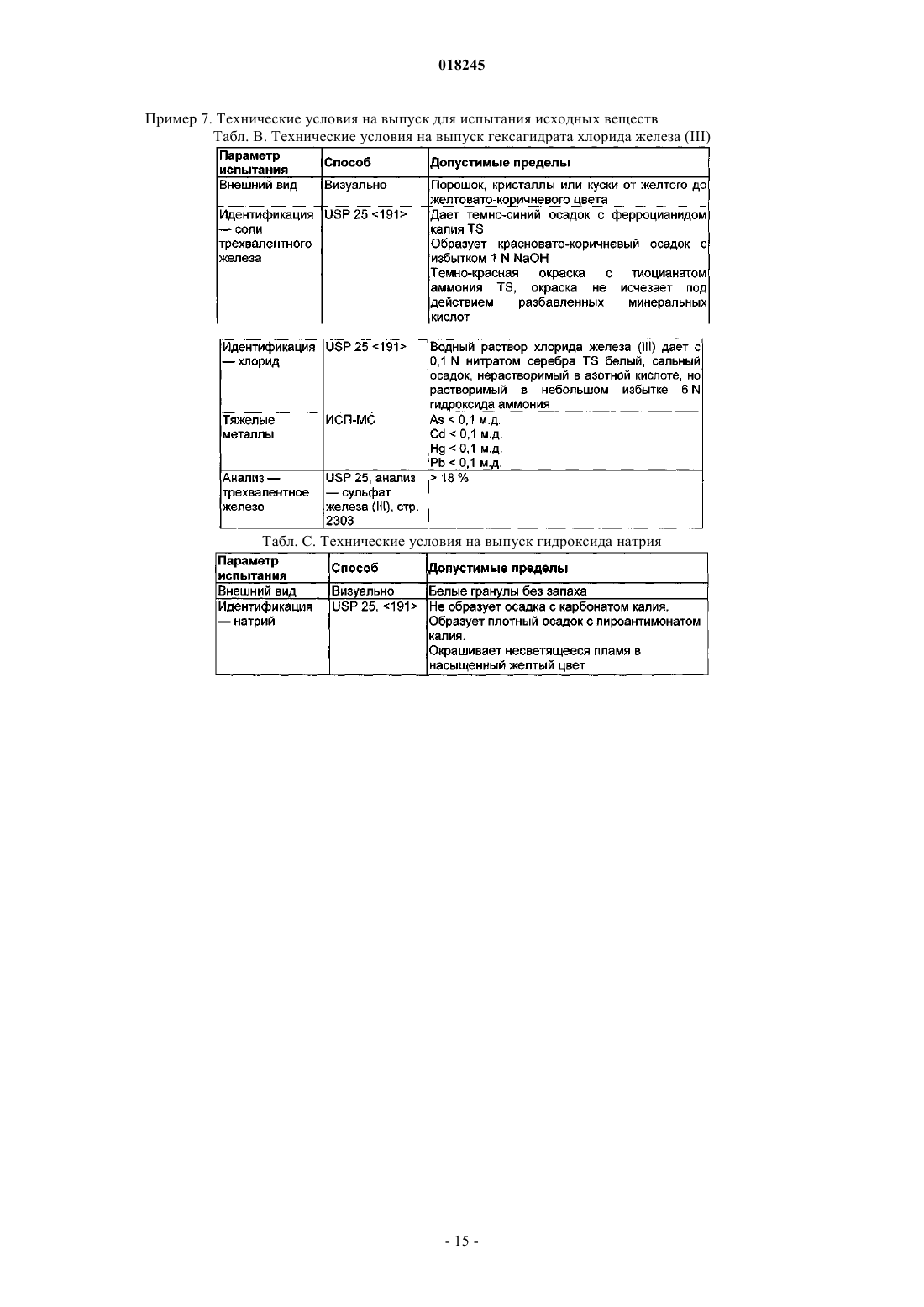
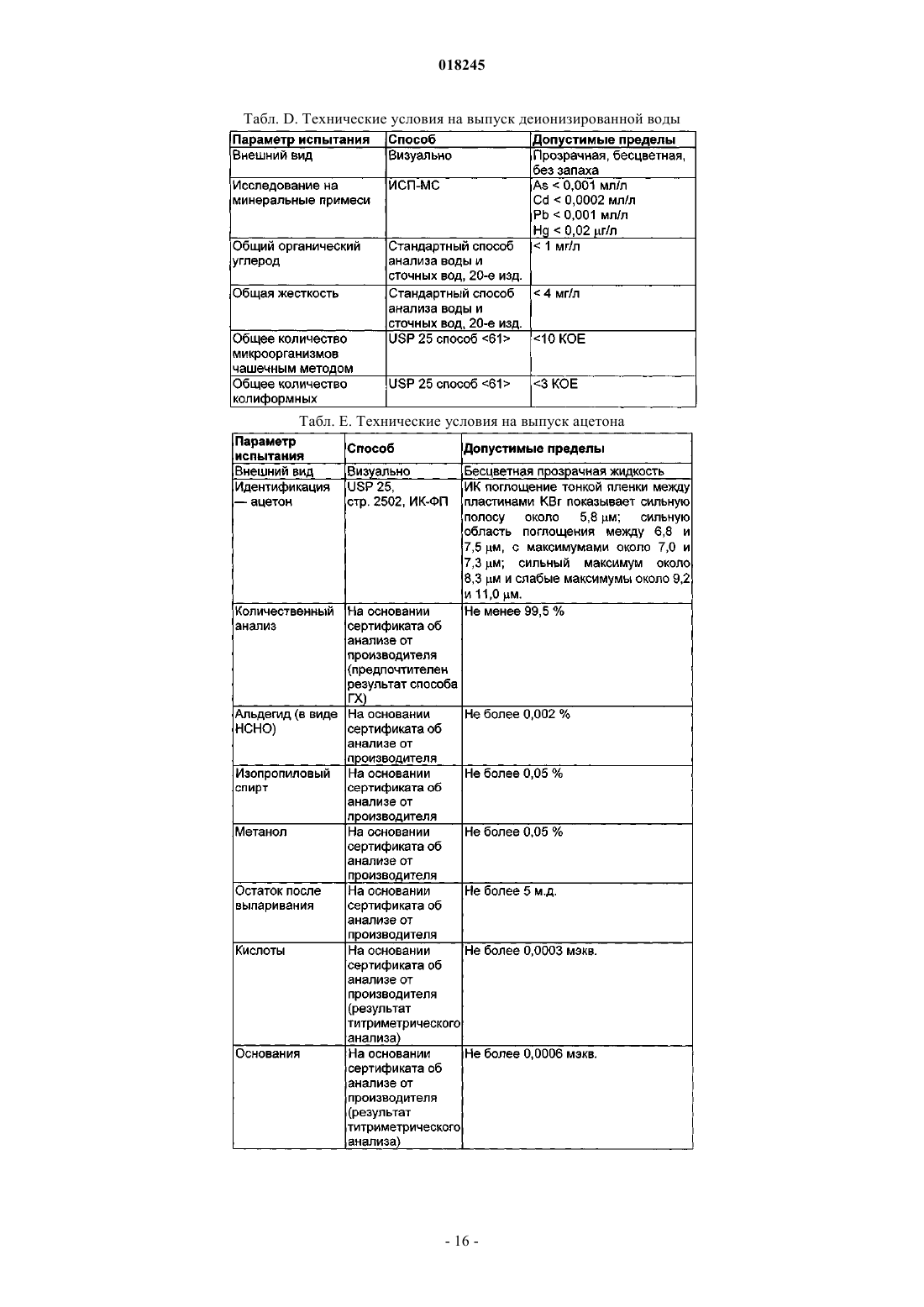
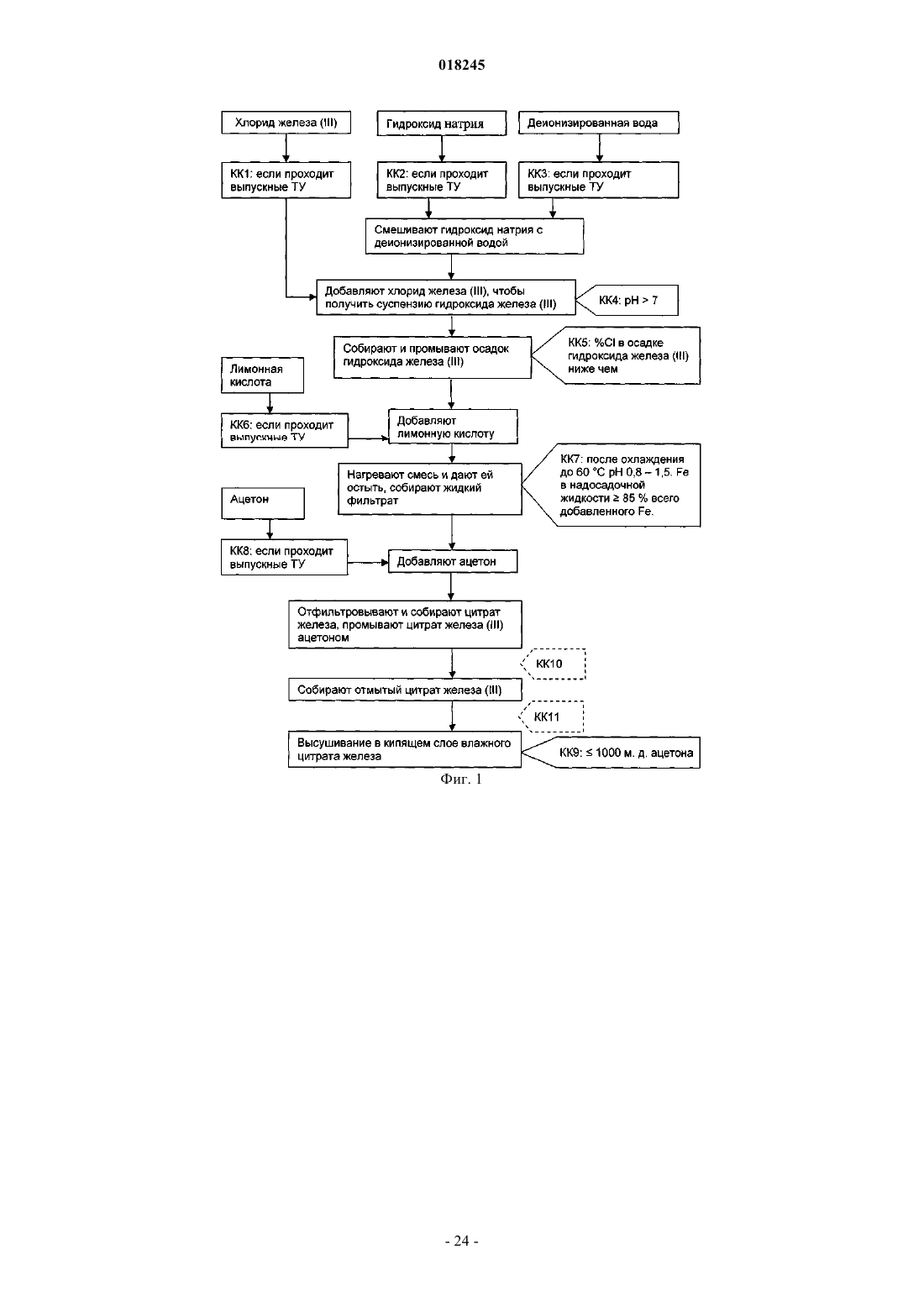
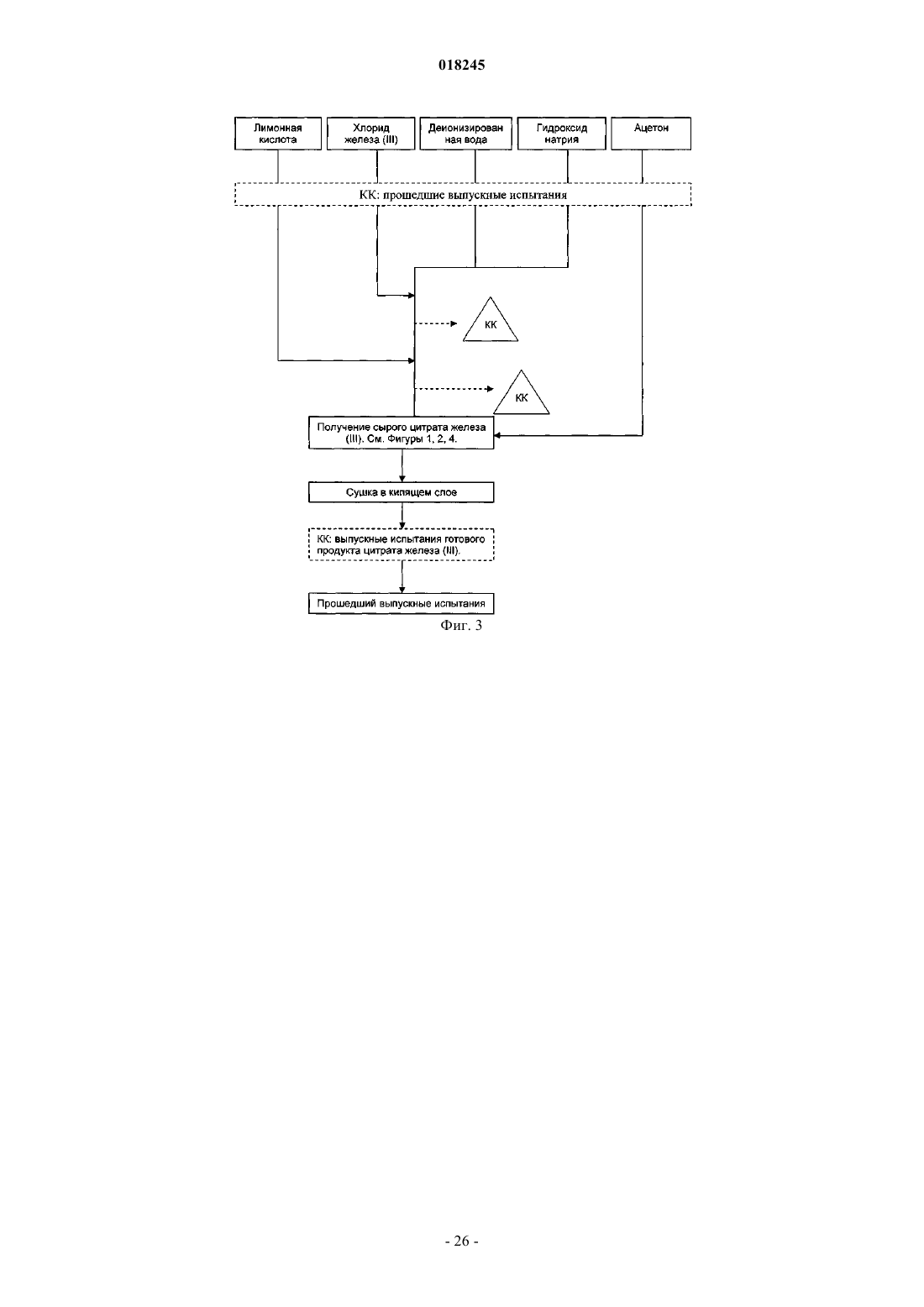
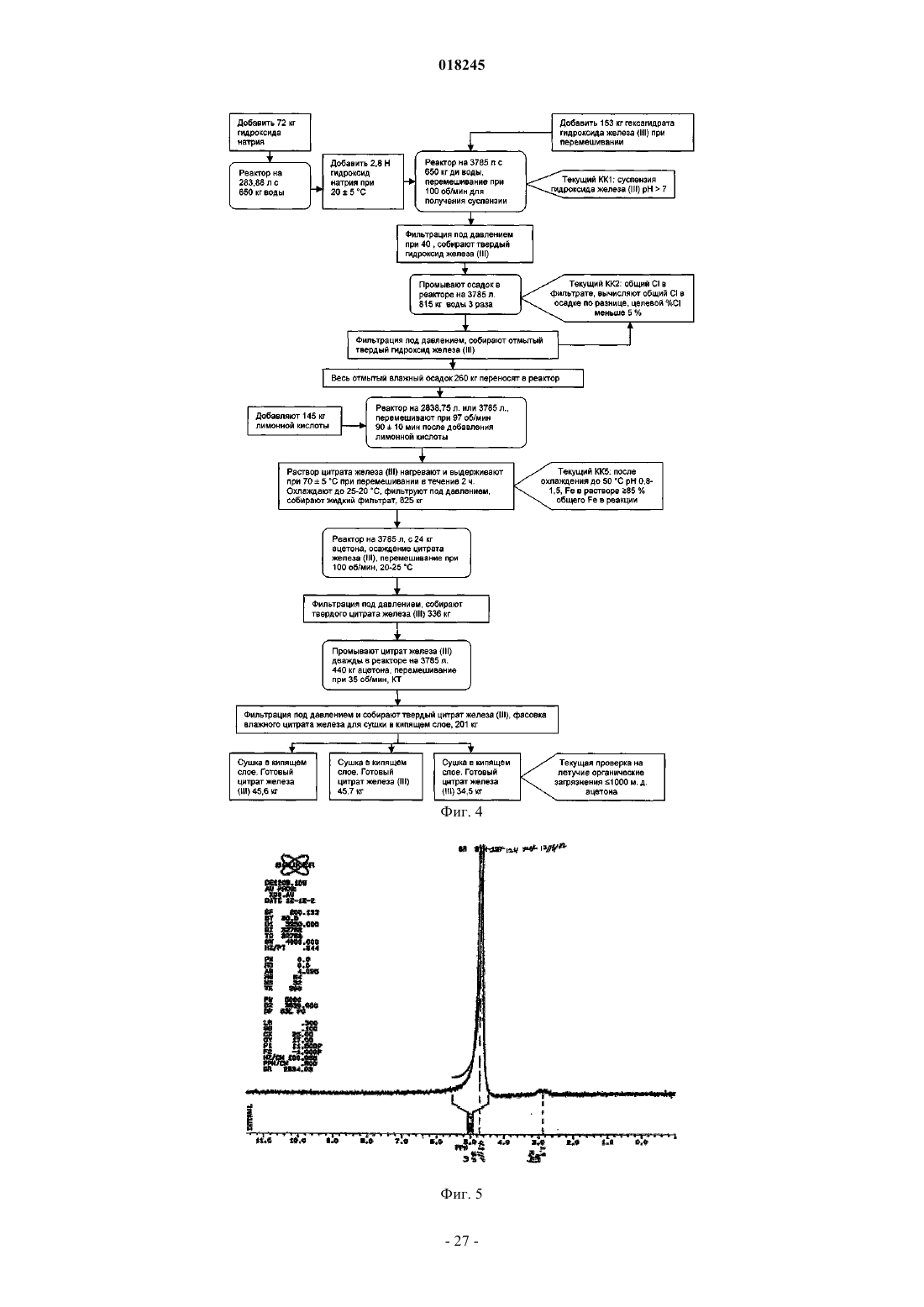
Органические соединения трехвалентного железа фармацевтического качества, их применение и способы их получения
Формула / Реферат
1. Применение состава, содержащего цитрат железа (III), для приготовления лекарственного средства для предотвращения или обратного развития кальцификации мягких тканей, причем состав содержит цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
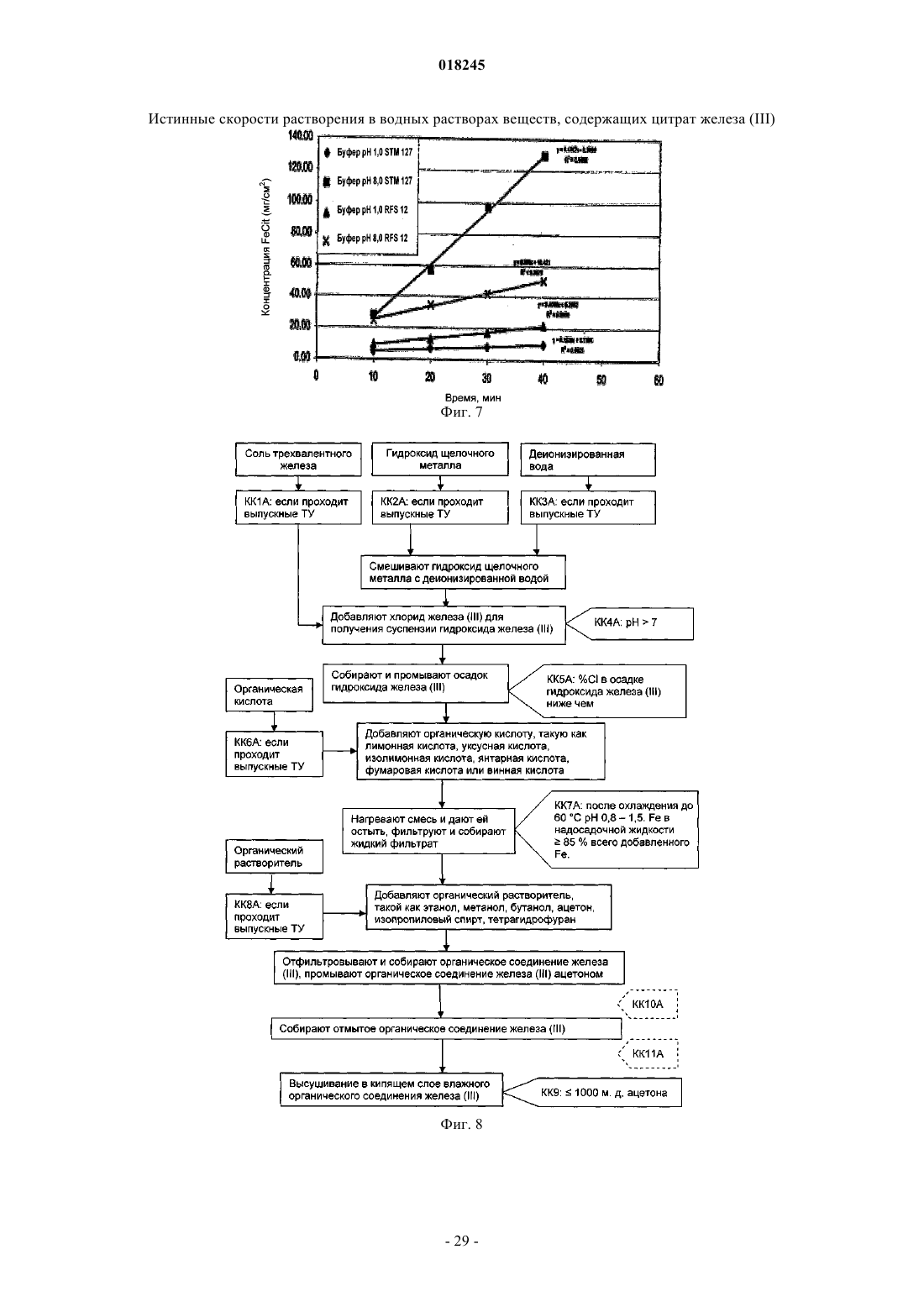
2. Применение по п.1, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см2/мин.
3. Применение по п.1, в котором указанная мягкая ткань представляет собой кровеносный сосуд.
4. Применение по п.1, в котором указанная мягкая ткань представляет собой глаз.
5. Применение по любому из пп.1-4, в котором состав предназначен для перорального введения.
6. Применение по любому из пп.1-4, в котором состав предназначен для перорального введения два или более раз в сутки.
7. Применение по любому из пп.1-6, в котором состав предназначен для перорального введения совместно с пищей.
8. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве от 2 до 30 г в сутки.
9. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве от 4 до 15 г в сутки.
10. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве от примерно 4 до примерно 8 г в сутки.
11. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве примерно 6 г в сутки.
12. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве примерно 4 г в сутки.
13. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа (III) в количестве примерно 2 г в сутки.
14. Применение по любому из пп.1-13, в котором состав подходит для введения на протяжении длительного периода времени.
15. Применение по любому из пп.1-14, в котором состав предназначен для высвобождения в желудочно-кишечном тракте ионов трехвалентного железа.
16. Применение по любому из пп.1-15, в котором состав предназначен для высвобождения в желудочно-кишечном тракте цитрата.
17. Применение по любому из пп.1-16, в котором состав находится в форме капсул.
18. Применение по любому из пп.1-17, в котором состав находится в форме таблеток.
19. Способ предотвращения или обратного развития кальцификации мягких тканей, включающий введение субъекту состава, содержащего эффективное количество цитрата железа (III), имеющего площадь активной поверхности, определенную методом БЭТ, более 16,17 м2/г.
20. Способ по п.19, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см2/мин.
21. Способ по п.19, в котором указанная мягкая ткань представляет собой кровеносный сосуд.
22. Способ по п.19, в котором указанная мягкая ткань представляет собой глаз.
23. Способ по любому из пп.19-22, в котором указанный состав предназначен для перорального введения.
24. Способ по любому из пп.19-22, в котором указанный состав предназначен для перорального введения два или более раз в сутки.
25. Способ по любому из пп.19-22, в котором состав предназначен для введения совместно с пищей.
26. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет от примерно 2 г в сутки до примерно 30 г в сутки.
27. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет от 4 до 15 г в сутки.
28. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет от 4 до 8 г в сутки.
29. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет примерно 6 г в сутки.
30. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет примерно 4 г в сутки.
31. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа (III) составляет примерно 2 г в сутки.
32. Способ по любому из пп.19-31, в котором состав подходит для введения на протяжении длительного периода времени.
33. Способ по любому из пп.19-32, в котором состав предназначен для высвобождения в желудочно-кишечном тракте ионов трехвалентного железа.
34. Способ по любому из пп.19-33, в котором состав предназначен для высвобождения в желудочно-кишечном тракте цитрата.
35. Способ по любому из пп.19-34, в котором состав находится в форме капсулы.
36. Способ по любому из пп.19-34, в котором состав находится в форме таблетки.
37. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни ионов кальция в сыворотке субъекта.
38. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни фосфат-ионов в сыворотке субъекта.
39. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни ионов кальция и фосфат-ионов в сыворотке субъекта.
40. Фармацевтический состав для обратного развития, предотвращения или стабилизации кальцификации мягких тканей, содержащий цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, по меньшей мере 16,17 м2/г, и фармацевтически приемлемый носитель, причем цитрат железа (III) присутствует в количестве, эффективном для снижения уровня фосфата в сыворотке.
41. Фармацевтический состав по п.40, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см2/мин.
42. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет от 2 до 30 г в сутки.
43. Фармацевтический состав по любому из пп.40-42, в котором эффективное количество цитрата железа составляет от 4 до 15 г в сутки.
44. Фармацевтический состав по любому из пп.38-43, в котором эффективное количество цитрата железа выбрано из 2, 4 и 6 г в сутки.
45. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет 1 г в сутки.
46. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет 500 мг на единицу лекарственной формы.
47. Фармацевтический состав для обратного развития, предотвращения или стабилизации кальцификации мягких тканей, содержащий 500 мг цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г, и фармацевтически приемлемый носитель, причем указанный состав представлен в форме капсул.
48. Способ замедления отложения фосфата кальция в организме субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
49. Способ снижения кальций-фосфатного произведения ([Са]´[Р]) у пациента, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
50. Способ снижения уровня кальция в сыворотке у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
51. Способ стимуляции растворения почечного камня у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
52. Способ снижения уровня фосфата в сыворотке у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г.
53. Способ по п.52, в котором цитрат железа вводят перорально.
54. Способ по п.52 или 53, в котором цитрат железа вводят с пищей.
55. Способ по любому из пп.52-54, в котором цитрат железа представлен в форме, выбранной из таблетки, порошка, суспензии, эмульсии, капсулы, пастилки, гранулы, леденца, пилюли, жидкости, спиртового раствора или сиропа.
56. Способ по любому из пп.52-55, в котором эффективное количество составляет от 2 до 30 г в сутки.
57. Способ по любому из пп.52-56, в котором эффективное количество выбрано из приблизительно 2, примерно 4 и примерно 6 г в сутки.
58. Способ по любому из пп.52-57, в котором субъект страдает терминальной стадией заболевания почек.
59. Способ по любому из пп.52-57, в котором субъект проходит диализ.
60. Способ по п.59, в котором диализ выбран из гемодиализа и перитонеального диализа.
61. Способ по любому из пп.52-60, в котором цитрат железа вводят в форме таблетки.
62. Способ по п.61, в котором таблетка содержит 1 г цитрата железа.
63. Способ по п.61, в котором таблетка содержит 500 мг цитрата железа.
64. Способ по любому из пп.52-63, в котором эффективное количество составляет 1 г в сутки.
65. Способ по любому из пп.52-63, в котором эффективное количество составляет 6 г в сутки.
66. Способ по любому из пп.52-63, в котором эффективное количество составляет 4 г в сутки.
67. Способ по любому из пп.52-63, в котором эффективное количество составляет 2 г в сутки.
68. Фармацевтический состав для снижения уровня фосфата в сыворотке, содержащий цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г, и фармацевтически приемлемый носитель, причем цитрат железа присутствует в количестве, эффективном для снижения уровня фосфата в сыворотке.
69. Фармацевтический состав по п.68, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см2/мин.
70. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет от 2 до 30 г в сутки.
71. Фармацевтический состав по любому из пп.68-70, в котором эффективное количество цитрата железа составляет от 4 до 15 г в сутки.
72. Фармацевтический состав по любому из пп.68-71, в котором эффективное количество цитрата железа выбрано из 2, 4 и 6 г в сутки.
73. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет 1 г в сутки.
74. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет 500 мг на единицу лекарственной формы.
75. Фармацевтический состав для снижения уровня фосфата в сыворотке, содержащий 500 мг цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м2/г, и фармацевтически приемлемый носитель, причем указанный состав представлен в форме капсул.
Текст
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТРЕХВАЛЕНТНОГО ЖЕЛЕЗА ФАРМАЦЕВТИЧЕСКОГО КАЧЕСТВА, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ Настоящее изобретение относится к получению и применению органических соединений трехвалентного железа фармацевтического качества. Согласно настоящему изобретению предложено применение состава, содержащего цитрат железа (III), для приготовления лекарственного средства с улучшенной биодоступностью для предотвращения или обратного развития кальцификации мягких тканей, причем состав содержит цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. Также охарактеризован способ предотвращения или обратного развития кальцификации мягких тканей,включающий введение субъекту состава, содержащего эффективное количество цитрата железа(III), имеющего площадь активной поверхности, определенную методом БЭТ, более 16,17 м 2/г.(71)(73) Заявитель и патентовладелец: ПАНИОН ЭНД БФ БИОТЕХ ИНК. Настоящая заявка испрашивает приоритет согласно заявке US60/709,511, поданной 19 августа 2005 г., а также заявке US 11/206,981, поданной 18 августа 2005 г.; которая является частичным продолжением заявки PCT/US 2004/004646, поданной 18 февраля 2004 г. и опубликованной под номером международной публикации WO 2004/074444 2 сентября 2004 г., которая испрашивает приоритет согласно заявке US60/447690, поданной 19 февраля 2003 г. и US 60/462684, поданной 15 апреля 2003 г.; при этом все содержание и описания изобретений предшествующих заявок включены в настоящее описание посредством ссылок. В настоящую заявку включены ссылки на многочисленные публикации. Описания данных публикаций во всей их полноте включены посредством ссылок в настоящую заявку с целью более полного описания уровня техники, к которому относится настоящее изобретение. Область технического применения Настоящее изобретение относится к получению и применению органических соединений трехвалентного железа фармацевтического качества, таких как цитрат железа (III). Описанные здесь способы применения цитрата железа (III) фармацевтического качества включают, но не ограничены этим, лечение различных нарушений у людей или иных субъектов или пациентов. Предпосылки изобретения Способы применения соединений железа Соединения, содержащие трехвалентное железо, пригодны для лечения ряда расстройств, включая,но не ограничиваясь этим, гиперфосфатемию и метаболический ацидоз. См. Hsu et al., "New PhosphateBinding Agents: Ferric Compounds", J Am Soc Nephrol, vol. 10, Pages 1274-1280, 1999 в предыдущих исследованиях и изобретениях сообщалось о применении соединений трехвалентного железа совместно с пищевыми фосфатами и о том, что указанные соединения трехвалентного железа потенциально пригодны для лечения гиперфосфатемии у пациентов с почечной недостаточностью (Патент США 5753706,1998; Патент США 6903235, 2005; CN 1315174, 2001; Yang W. С. et al., Nephrol. Dial. Transplant 17:265:270 (2002. Повышенные количества фосфата в крови можно удалить введением таких соединений, как цитрат железа (III). Находясь в растворе, ион трехвалентного железа связывает фосфат, и соединения фосфата железа осаждаются в желудочно-кишечном тракте, приводя к эффективному удалению пищевых фосфатов из организма. Также считают, что абсорбированный цитрат из цитрата железа (III) превращается в бикарбонат, который корректирует метаболический ацидоз, распространенное состояние у больных с почечной недостаточностью. Международная заявка на патентPCT/US 2004/004646, поданная 18 февраля 2004 г., опубликованная подмеждународной публикации WO 2004/074444 2 сентября 2004, раскрывает способ получения органических соединений трехвалентного железа, включая цитрат железа (III), который остается растворимым в более широком диапазоне рН, чем ранее описанные препараты, и который обладает большой площадью активной поверхности. Однако промышленно масштабируемые процессы производства с контролем качества/аналитическими мероприятиями, для того,чтобы удостовериться и/или проверить соответствие цитрата железа (III) фармацевтического качества или соединений трехвалентного железа установленным стандартам или техническим условиям, ранее не были описаны. Соответственно, существует необходимость в масштабируемом способе получения органических соединений трехвалентного железа фармацевтического качества или цитрата железа (III) в применении к человеку. Способ должен позволять единообразно производить органические соединения трехвалентного железа или цитрат железа (III) требуемого фармацевтического качества. Согласно настоящему изобретению предложены также дозы цитрата железа (III) для лечения человека или иного субъекта или пациента, нуждающегося в введении указанного соединения. Кроме того,исследованы различные пути введения. Краткое описание изобретения В соответствии с указанными и другими задачами изобретения далее представлено краткое описание настоящего изобретения. В нижеследующем кратком описании могут быть опущены некоторые подробности и упрощено изложение с тем, чтобы подчеркнуть и в более явном виде представить некоторые аспекты настоящего изобретения, но не для того, чтобы ограничить область изобретения. Подробное описание предпочтительного примера варианта реализации, достаточное для того, чтобы предоставить возможность среднему специалисту в данной области осуществить и применить принципы настоящего изобретения, будут приведены в следующем разделе. Вариант реализации настоящего изобретения представляет собой способ производства и контроля качества/анализа для получения цитрата железа (III) фармацевтического качества, соответствующего установленным техническим условиям на выпуск продукции. Способ согласно настоящему изобретению может быть реализован для производства многотоннажных партий цитрата железа (III) фармацевтического качества, и его можно легко масштабировать,чтобы обеспечить дополнительную производственную мощность для цитрата железа (III). Приведенный в качестве примера вариант реализации способа получения может быть проиллюстрирован на примере последующей неограничительной последовательности стадий получения цитрата железа фармацевтического качества, включающей следующие стадии:(а) растворение соответствующего количества гексагидрата хлорида железа (III) в воде с получени-1 018245 ем раствора гексагидрата хлорида железа (III);(б) растворение соответствующего количества NaOH в воде с получением раствора NaOH;(в) смешивание раствора гексагидрата хлорида железа (III) с раствором NaOH с получением раствора с осадком Fe(OH)3;(з) добавление лимонной кислоты к осадку Fe(OH)3 с получением раствора железа (III)органической кислоты;(и) перемешивание и нагревание раствора железа (III)-органической кислоты при 90-100 С в течение от 30 до 120 мин;(к) удаление твердого остатка из раствора железа (III)-органической кислоты путем добавления лимонной кислоты;(л) охлаждение раствора железа (III)-органической кислоты до температуры ниже 30 С;(м) обеспечение рН раствора железа (III)-органической кислоты между 0,8-1,5;(н) фильтрование раствора железа (III)-органической кислоты для получения жидкого фильтрата;(о) смешивание ацетона с жидким фильтратом для получения цитрата железа (III);(п) выделение цитрата железа (III);(p) промывание цитрата железа (III) ацетоном три раза и(с) высушивание цитрата железа (III). Другой вариант реализации представляет собой схему крупномасштабного производства цитрата железа (III) фармацевтического качества, включающую стадии:(а) смешивание соответствующего количества NaOH и гексагидрата хлорида железа (III) в подходящем реакторе с получением суспензии гидроксида железа (III) с осадком гидроксида железа (III);(б) поддержание в суспензии гидроксида железа (III) рН выше 7,0;(в) выделение осадка гидроксида железа (III) из суспензии гидроксида железа (III) с использованием фильтрации под давлением;(г) трехкратное промывание осадка гидроксида железа (III);(д) обеспечение % Cl в осадке гидроксида железа (III) ниже 5%;(е) выделение отмытого осадка гидроксида железа (III) при помощи фильтрации под давлением;(ж) смешивание лимонной кислоты с осадком гидроксида железа (III) для получения раствора железа (III)-органической кислоты;(з) перемешивание и поддержание температуры раствора железа (III)-органической кислоты 805 С в течение 2 ч;(и) охлаждение раствора железа (III)-органической кислоты до 60 С;(к) обеспечение рН раствора железа (III)-органической кислоты между 0,8 и 1,5 и количества Fe в растворе железа (III)-органической кислоты 85% от Fe, добавленного на стадии (а);(л) фильтрование раствора железа (III)-органической кислоты при помощи фильтрации под давлением для получения жидкого фильтрата;(м) смешивание жидкого фильтрата с ацетоном для получения цитрата железа (III);(н) выделение цитрата железа (III) при помощи фильтрации под давлением;(о) промывание цитрата железа (III) ацетоном;(п) выделение отмытого цитрата железа (III) при помощи фильтрации под давлением;(р) высушивание отмытого цитрата железа (III) в сушилке с кипящим слоем и(с) обеспечение летучих органических примесей 1000 м.д. ацетона. Согласно еще одному варианту реализации изобретения предложены различные промежуточные составы, которые могут быть полезны при получении цитрата железа (III) фармацевтического качества. Промежуточные составы, описанные в настоящей заявке на изобретение, включают твердые, жидкие или многофазные смеси. Жидкий промежуточный состав, содержащий цитрат железа (III) фармацевтического качества, может представлять собой состав на водной основе или состав на основе органического растворителя. Многофазный состав может включать как водные, так и органические фазы. Согласно еще одному дополнительному варианту реализации изобретения предложены способы хранения, упаковки и применения различных описанных здесь промежуточных составов. Согласно еще одному дополнительному варианту реализации изобретения предложены фармацевтически применимые составы, содержащие цитрат железа (III) фармацевтического качества. Фармацевтически применимые составы дополнительно содержат любой фармацевтически приемлемый носитель,вспомогательное вещество, наполнитель или средство доставки, подходящие для введения объекту или пациенту-человеку эффективного количества цитрата железа (III) фармацевтического качества. Другие варианты реализации фармацевтических составов включают, но не ограничены этим, твердые, жидкие или полутвердые формы, такие как гели, сиропы, жевательные таблетки или пасты. Способы применения предложенных в настоящем изобретении фармацевтически применимых составов охватывают также эффективные дозы фармацевтических составов, в дополнение к режимам приема и способам введения фармацевтических составов. Неограничительный пример способа применения фармацевтических составов включает лечение заболеваний, возникающих у субъекта или пациента-человека вследствие повышенных уровней фосфатов в крови, т.е. гиперфосфатемии. Примерами указанных заболеваний могут служить, но не ограничены этим, почечная недостаточность или прогрессирующая почечная недостаточность, минерализация мягких тканей, гиперпаратиреоидизм, а также другие осложнения. Согласно одному из вариантов реализации настоящего изобретения предложен фармацевтический состав, содержащий:(а) органическое соединение железа (III) фармацевтического качества в количестве, эффективном для достижения снижения уровня фосфата в сыворотке у субъекта или пациента; и(б) фармацевтически подходящий носитель; при этом указанное органическое соединение железа удовлетворяет по меньшей мере одному из ограничений, приведенных в технических условиях на выпуск продукции в табл. А. Фармацевтический состав, описанный в настоящей заявке на изобретение, можно приготовить при помощи способов, проиллюстрированных на фиг. 1, 2, 3 или 4. В дополнение к указанным вариантам реализации предложены составы, приготовленные из веществ, удовлетворяющих по меньшей мере одному из ограничений, указанных в каждом из технических условий на выпуск или в соответствующих табл. с В по F. Дополнительный вариант реализации включает составы цитрата железа (III) фармацевтического качества, приготовленные в соответствии со способом, включающим следующие стадии:(а) растворение соответствующего количества гексагидрата хлорида железа (III) в воде с получением раствора гексагидрата хлорида железа (III);(б) растворение соответствующего количества NaOH в воде с получением раствора NaOH;(в) смешивание раствора гексагидрата хлорида железа (III) и раствора NaOH с получением раствора с осадком Fe(OH)3;(з) добавление лимонной кислоты к осадку Fe(OH)3 с получением раствора железа (III)органической кислоты;(и) перемешивание и нагревание раствора железа (III)-органической кислоты при 90-100 С в течение от 30 до 120 мин;(к) удаление твердого остатка из раствора железа (III)-органической кислоты путем добавления лимонной кислоты;(л) охлаждение раствора железа (III)-органической кислоты до температуры ниже 30 С;(м) поддержание в растворе железа (III)-органической кислоты рН между 0,8-1,5;(н) фильтрование раствора железа (III)-органической кислоты с получением жидкого фильтрата;(о) смешивание ацетона и жидкого фильтрата с получением цитрата железа (III);(п) выделение цитрата железа (III);(р) промывание цитрата железа (III) ацетоном три раза;(с) высушивание цитрата железа (III). Одной из характерных особенностей способа получения является возможность масштабирования. Соответственно, промышленный вариант способа может быть реализован в виде способа крупномасштабного производства цитрата железа (III) фармацевтического качества, включающего следующие стадии:(а) смешивание соответствующего количества NaOH и гексагидрата хлорида железа (III) в подходящем реакторе для получения суспензии гидроксида железа (III) с осадком гидроксида железа (III);(б) поддержание в суспензии гидроксида железа (III) рН выше 7,0;(в) выделение осадка гидроксида железа (III) из суспензии гидроксида железа (III) с использованием фильтрации под давлением;(г) трехкратное промывание осадка гидроксида железа (III);(д) поддержание в осадке гидроксида железа (III) содержания Cl ниже 5%;(е) выделение отмытого осадка гидроксида железа (III) при помощи фильтрации под давлением;(ж) смешивание лимонной кислоты с осадком гидроксида железа (III) с получением раствора железа (III)-органической кислоты;(з) перемешивание и поддержание температуры раствора железа (III)-органической кислоты 805 С в течение 2 ч;(и) охлаждение раствора железа (III)-органической кислоты до 60 С;(к) обеспечение рН раствора железа (III)-органической кислоты между 0,8 и 1,5 и количества Fe в растворе железа (III)-органической кислоты 85% от Fe, добавленного на стадии (а);(л) фильтрование раствора железа (III)-органической кислоты при помощи фильтрации под давлением для получения жидкого фильтрата;(м) смешивание жидкого фильтрата с ацетоном для получения цитрата железа (III);(н) выделение цитрата железа (III) при помощи фильтрации под давлением;(о) промывание цитрата железа (III) ацетоном;(п) выделение отмытого цитрата железа (III) при помощи фильтрации под давлением;(р) высушивание отмытого цитрата железа (III) в сушилке с кипящим слоем и(с) обеспечение содержания летучих органических примесей 1000 м.д.,причем указанный цитрат железа (III) удовлетворяет по меньшей мере одному из технических условий на выпуск продукции, приведенных в табл. А. Составы, содержащие цитрат железа (III) фармацевтического качества, пригодны для лечения гиперфосфатемии или других заболеваний, характеризующихся высокими уровнями фосфата в сыворотке. Таким образом, настоящее изобретение включает способ лечения субъектов или пациентов с различными заболеваниями почек, например, терминальной стадией почечной недостаточности (ТПН), хронической почечной недостаточностью (ХПН) или другими заболеваниями, связанными с нарушениями почек, или субъектов и пациентов, находящихся на диализе,не ограничиваясь гемодиализом. В другом варианте реализации составы, содержащие цитрат железа (III) фармацевтического качества, можно использовать при лечении субъектов или пациентов с метаболическим ацидозом. Другие заболевания, которые можно облегчить благодаря превращению цитрата в бикарбонат, также включены в описанное изобретение. Вариант реализации способа применения фармацевтического состава включает лечение человека или иного субъекта, или пациента с хронической почечной недостаточностью. В общем случае, существует пять клинических стадий хронической почечной недостаточности, пронумерованных от 1 до 5, причем стадия 1 является наименее тяжелой, а стадия 5 является наиболее тяжелой. На ранних стадиях, например стадиях 1 и 2, в диализе нет необходимости, если же хроническая почечная недостаточность прогрессирует до стадии 5, пациенту может потребоваться лечение диализом трижды в неделю. Следует отметить, что повышенные уровни фосфата наблюдаются на всех стадиях хронической почечной недостаточности. Таким образом, вариантом реализации настоящего изобретения является способ лечения субъекта или пациента с ранними или промежуточными стадиями хронической почечной недостаточности при помощи состава, содержащего цитрат железа (III) фармацевтического качества, с целью добиться более низкого уровня фосфата в сыворотке. Еще одним вариантом реализации настоящего изобретения является обеспечение способа лечения человека или иного субъекта, или пациента с поздней стадией хронической почечной недостаточности,подвергающегося гемодиализу при помощи введения состава, содержащего цитрат железа (III) фармацевтического качества. Известно, что гемодиализ недостаточно эффективен для снижения уровня фосфата в сыворотке. Лечение субъекта или пациента с поздней стадией хронической почечной недостаточности применимо вне зависимости от того, подвергается ли указанный субъект или пациент лечению гемодиализом в настоящее время. Дополнительный вариант реализации настоящего изобретения представляет собой способ лечения субъекта или пациента с хронической почечной недостаточностью и подвергающегося перитонеальному диализу, при помощи описанных составов, содержащих цитрат железа (III) фармацевтического качества. Известно, что перитонеальный диализ недостаточно эффективен для снижения уровней фосфата в сыворотке. Дополнительный вариант реализации представляет собой способ применения фармацевтического состава для замедления или даже обратного развития минерализации мягких тканей, особенно кальцификации. Гиперфосфатемия может привести к повышенному отложению фосфата кальция в твердых и мягких тканях вследствие увеличения вероятности связывания свободного кальция с образованием нерастворимого фосфата кальция. Таким образом, эффективная доза состава, содержащего цитрат железа(III) фармацевтического качества, может снизить уровни фосфата в сыворотке и привести к соответствующему снижению отложения фосфата кальция. Заслуживает внимания тот факт, что, поскольку ион трехвалентного железа образует нерастворимый осадок с фосфатсодержащими соединениями в полости желудочно-кишечного тракта, цитратная составляющая всасывается и действует на кальций как хелатообразующий агент. Поскольку кальций в форме хелата не способен образовывать фосфат кальция, введение цитрата железа (III) фармацевтического качества может приводить к снижению содержания в сыворотке как кальция, так и фосфата. Это явление также можно представить как приводящее к снижению в сыворотке кальций-фосфатного произведения. Можно ожидать, что снижение кальция и фосфата в сыворотке уменьшит отложение фосфата кальция. Конечным результатом является обратное развитие заболевания, т.е. солюбилизация или растворение отложившегося фосфата кальция. Декальцификации кальцифицированной мягкой ткани, например склеры глаза, можно добиться путем введения цитрата железа (III) фармацевтического качества. Среднему специалисту в соответствую-4 018245 щих областях медицины известно, что у пациентов с почечной недостаточностью, получающих дозы цитрата железа (III), наблюдается обратное развитие отложений кальция в глазах. Таким образом, вариант реализации настоящего изобретения направлен на декальцификацию мягкой ткани, такой как глаз. Почечные камни состоят из кальциевых солей щавелевой кислоты или фосфатов и образуются под действием механизмов, подобных вышеописанным. Соответственно, применение цитрата железа (III) фармацевтического качества согласно варианту реализации настоящего изобретения обеспечивает способ лечения почечных камней, например почечных конкрементов, путем стимуляции их растворения. Возможны различные механизмы действия предложенных в настоящем изобретении составов, содержащих цитрат железа (III) фармацевтического качества. Один из возможных неограничительных механизмов действия может быть обусловлен связыванием иона трехвалентного железа с фосфатом в ЖКТ, в результате чего образуется нерастворимый осадок фосфата железа (III). Это, в свою очередь, может приводить и к уменьшению всасывания фосфата и фосфатсодержащих соединений из ЖКТ. Принимая во внимание указанный механизм, предложенные согласно настоящему изобретению способы включают пероральное введение составов, содержащих цитрат железа (III) фармацевтического качества. Согласно настоящему изобретению также предложен способ обратного развития, предотвращения или стабилизации кальцификации мягких тканей у субъекта, включающий введение указанному субъекту эффективного количества соединения цитрата железа (III). Также согласно настоящему изобретению предложен способ обратного развития, предотвращения или стабилизации кальцификации мягких тканей у субъекта, включающий введение указанному субъекту эффективного количества соединения цитрата железа (III), в котором указанное соединение цитрата железа (III) получено в соответствии со способом, показанным на фиг. 1-4. Согласно настоящему изобретению предложен способ обратного развития, предотвращения или стабилизации кальцификации мягких тканей у субъекта, включающий введение указанному субъекту эффективного количества соединения цитрата железа (III), в котором указанное соединение цитрата железа (III) получено в соответствии со способом, включающим следующие стадии. Согласно одному варианту реализации настоящего изобретения предложенный способ включает введение переносимых доз вплоть до 15 г в сутки для капсул цитрата железа (III) и до 30 г в сутки для таблеток цитрата железа (III). Составы, содержащие цитрат железа (III) фармацевтического качества, можно вводить на протяжении различных периодов времени. В некоторых вариантах реализации переносимость указанных составов, содержащих цитрат железа (III) фармацевтического качества, делает возможным длительный срок введения, если это необходимо. Подробное описание фигур Нижеследующие фигуры иллюстрируют конкретные варианты реализации настоящего изобретения, но никоим образом не ограничивают объем и сущность настоящего изобретения: Фиг. 1 представляет собой принципиальную схему, описывающую общий способ синтеза цитрата железа (III) фармацевтического качества, включая мероприятия по текущему контролю качества, направленные на то, чтобы гарантировать, что конечный продукт цитрат железа (III) удовлетворяет установленным техническим условиям на выпуск продукции, как показано в табл. А. Фиг. 2 представляет собой принципиальную схему, описывающую способ получения цитрата железа (III) фармацевтического качества согласно настоящему изобретению. Фиг. 3 дает общее представление о масштабируемом способе получения цитрата железа (III) фармацевтического качества и процессе контроля качества согласно настоящему изобретению. Фиг. 4 представляет собой принципиальную схему, описывающую масштабируемый способ получения цитрата железа (III) фармацевтического качества и процесс контроля качества согласно настоящему изобретению. На фиг. 5 показан типичный спектр протонного ЯМР цитрата железа (III) фармацевтического качества согласно настоящему изобретению. На фиг. 6 показан типичный спектр ИК-ФП цитрата железа (III) фармацевтического качества согласно настоящему изобретению. На фиг. 7 представлены сравнительные данные для истинных скоростей растворения при рН 1,0 и 8,0 цитрата железа (III) фармацевтического качества и химического качества. Фиг. 8 представляет собой принципиальную схему, описывающую общий способ синтеза органического соединения железа (III) фармацевтического качества, включая мероприятия по текущему контролю качества, направленные на то, чтобы гарантировать, что конечный продукт, представляющий собой органическое соединение железа (III), удовлетворяет установленным техническим условиям на выпуск продукции. На фиг. 9 суммированы данные клинических результатов для цитрата железа (III) фармацевтического качества. На фиг. 10 суммированы данные об эффективности цитрата железа (III) фармацевтического качества. На фиг. 11 суммированы данные о безопасности на основании клинических исследований. Фиг. 12 представляет собой сравнение профилей безопасности цитратов железа (III) фармацевтического качества и химического качества. Фиг. 13 представляет собой сравнение профилей эффективности цитратов железа (III) фармацевтического качества и химического качества. На фиг. 14 представлена гистограмма, демонстрирующая взаимосвязь между коэффициентом смертности пациентов и гиперфосфатемией. Подробное описание изобретения В нижеследующем подробном описании изобретения сделаны ссылки на фигуры, которые служат для иллюстрации конкретных вариантов реализации настоящего изобретения, но которые не следует рассматривать как ограничивающие сущность изобретения и при описании которых могут быть опущены некоторые подробности с тем, чтобы избежать излишнего затруднения понимания изобретения. Соответственно, подробное описание и фигуры следует рассматривать в иллюстративном, а не в ограничительном смысле. В настоящую заявку включены также ссылки на Фармакопею США (USP), в частности на последнее издание Фармакопеи США, USP 28, которое включено в настоящую заявку посредством ссылки во всей своей полноте. Согласно настоящему изобретению предложен способ получения цитрата железа(III) фармацевтического качества, включающий следующие стадии: (а) растворение соответствующего количества гексагидрата хлорида железа (III) в воде с получением раствора гексагидрата хлорида железа(III); (б) растворение соответствующего количества NaOH в воде с получением раствора NaOH; (в) смешивание раствора гексагидрата хлорида железа (III) с раствором NaOH с получением раствора с осадкомFe(OH)3; (г) поддержание в растворе с осадком Fe(OH)3 pH выше 7,0; (д) выделение осадка Fe(OH)3; (e) промывание осадка Fe(OH)3 водой три раза; (ж) суспендирование осадка Fe(OH)3 в воде; (з) добавление лимонной кислоты к осадку Fe(OH)3 для получения раствора железа (III)-органической кислоты; (и) перемешивание и нагревание раствора железа (III)-органической кислоты при 90-100 С в течение от 30 до 120 мин; (к) удаление твердого остатка из раствора железа (III)-органической кислоты путем добавления лимонной кислоты; (л) охлаждение раствора железа (III)-органической кислоты до температуры ниже 30 С; (м) обеспечение рН раствора железа (III)-органической кислоты между 0,8-1,5; (н) фильтрование раствора железа (III)-органической кислоты для получения жидкого фильтрата; (о) смешивание ацетона с жидким фильтратом с получением цитрата железа (III); (п) выделение цитрата железа (III); (p) промывание цитрата железа (III) ацетоном три раза и (с) высушивание цитрата железа (III). Согласно настоящему изобретению предложен способ масштабируемого или крупномасштабного получения цитрата железа(III) фармацевтического качества, включающий следующие стадии: (а) смешивание соответствующего количества NaOH и гексагидрата хлорида железа (III) в подходящем реакторе для получения суспензии гидроксида железа (III) с осадком гидроксида железа (III); (б) поддержание в суспензии гидроксида железа (III) рН выше 7,0; (в) выделение осадка гидроксида железа (III) из суспензии гидроксида железа (III) с использованием фильтрации под давлением; (г) трехкратное промывание осадка гидроксида железа(III); (д) обеспечение содержания Cl в осадке гидроксида железа (III) ниже 5%; (е) отделение промытого осадка гидроксида железа (III) при помощи фильтрации под давлением; (ж) смешивание лимонной кислоты с отмытым осадком гидроксида железа (III) для получения раствора железа (III)-органической кислоты; (з) перемешивание и поддержание температуры раствора железа (III)-органической кислоты 805 С в течение 2 ч; (и) охлаждение раствора железа (III)-органической кислоты до 60 С; (к) обеспечение рН раствора железа (III)-органической кислоты между 0,8 и 1,5 и количества Fe в растворе железа (III)органической кислоты 85% от Fe, добавленного на стадии (а); (л) фильтрование раствора железа (III)органической кислоты при помощи фильтрации под давлением для получения жидкого фильтрата; (м) смешивание жидкого фильтрата с ацетоном для получения цитрата железа (III); (н) выделение цитрата железа (III) при помощи фильтрации под давлением; (о) промывание цитрата железа (III) ацетоном; (п) выделение отмытого цитрата железа (III) при помощи фильтрации под давлением; (р) высушивание отмытого цитрата железа (III) в сушилке с кипящим слоем и (с) обеспечение содержания летучих органических примесей 1000 м.д. ацетона. В одном варианте реализации гексагидрат хлорида железа (III) соответствует техническим условиям на выпуск, указанным в табл. В; лимонная кислота соответствует техническим условиям на выпуск,указанным в табл. F; вода соответствует техническим условиям на выпуск, указанным в таблице D; ацетон соответствует техническим условиям на выпуск, указанным в табл. Е; и гидроксид натрия соответствует техническим условиям на выпуск, указанным в табл. С. В другом варианте реализации цитрат железа (III) высушивают в аппарате с кипящим слоем или высушивают в вакууме. Еще в одном варианте реализации описанный выше способ дополнительно включает проверку цитрата железа (III) на соответствие техническим условиям на выпуск, указанным в табл. А. Еще в одном варианте реализации проверка включает выполнение по меньшей мере одного анализа, выбранного среди группы, состоящей из: анализа содержания в образце и чистоты цитрата железа (III) и моногидрата цитрата железа (III); анализа содержания в образце лимонной кислоты; анализа содержания в образце обнаружимых веществ, связанных с цитратом железа (III); анализа содержания в образце иона трехвалентного железа; анализа на примесь элементного железа; анализа на предельное содержание иона двухвалентного железа; анализа на потерю массы при высушивании; анализа на гидраты (содержание воды методом дифференциальной сканирующей калориметрии); анализа на гидраты (содержание воды методом титрования по Карлу Фишеру); анализа на рассеянные или тяжелые металлы (As, Ca, Cd, Cu, Fe, Hg,Na, Pb, Sr, Zn); анализа на предельное содержание щавелевой кислоты; анализа идентификация А для солей трехвалентного железа; анализа идентификация В по ИК-ФП; анализа на нерастворимые вещества; анализа на предельное содержание аммония; анализа на предельное содержание хлорида; анализа на предельное содержание нитрата; анализа на предельное содержание тартрата; анализа на остаток при прокаливании; анализа на летучие органические примеси и анализа на микробы, плесени и дрожжи. Настоящее изобретение предлагает цитрат железа (III) фармацевтического качества, полученный в соответствии с вышеописанными способами. Настоящее изобретение предлагает состав, содержащий цитрат железа (III), полученный в соответствии с вышеописанными способами, для лечения гиперфосфатемии или метаболического ацидоза. Настоящее изобретение предлагает состав, приготовленный в соответствии с вышеописанными способами, для лечения заболеваний, чувствительных к терапии органическими соединениями трехвалентного железа. Настоящее изобретение предлагает цитрат железа (III) фармацевтического качества, полученный в соответствии с вышеописанными способами, причем указанный цитрат железа (III) при проведении анализа методом ЯМР-спектроскопии дает сигнал, показанный на фиг. 6. Настоящее изобретение предлагает цитрат железа (III) фармацевтического качества, полученный в соответствии с вышеописанными способами, причем указанный цитрат железа (III) обладает скоростями растворения, как показано на фиг. 8. Настоящее изобретение представляет цитрат железа (III) фармацевтического качества, полученный в соответствии с вышеописанными способами, причем указанный цитрат железа (III) при проведении анализа методом инфракрасной спектрометрии с преобразованием Фурье (ИК-ФП) дает спектральные данные, как показано на фиг. 7. Настоящее изобретение предлагает состав, содержащий цитрат железа (III) фармацевтического качества, как описано выше, для лечения гиперфосфатемии или метаболического ацидоза. Настоящее изобретение предлагает состав, содержащий кислую соль железа, как описано выше, для лечения заболеваний, поддающихся лечению органическим соединением трехвалентного железа. Настоящее изобретение предлагает цитрат железа (III) фармацевтического качества, полученный в соответствии со способом, включающим стадии, как показано на фиг. 1-4. Цитрат железа (III) фармацевтического качества согласно настоящему изобретению пригоден для лечения субъекта, страдающего гиперфосфатемией, метаболическим ацидозом, или заболеванием, поддающимся лечению органическим соединением железа. В одном из вариантов реализации указанный субъект представляет собой человека. Настоящее изобретение также предлагает способ применения состава, содержащего цитрат железа(III) фармацевтического качества, эффективного для одного или более следующих применений:(б) снижение коэффициента смертности у пациентов на диализе;(г) замедление отложения фосфата кальция;(е) снижение уровней кальция в сыворотке;(ж) обратное развитие кальцификации мягких тканей и(з) облегчение растворения почечного камня. Указанный способ применения дополнительно может включать применение, по меньшей мере, частично основанное на снижении содержания в сыворотке ионов кальция и фосфата. Вышеизложенные способы применения можно применять к мягким тканям, таким как кровеносный сосуд или глаз. Вышеизложенные способы применения можно осуществлять при помощи введения в течение продолжительного времени. Настоящее изобретение позволяет использовать вышеупомянутые способы применения, причем указанные способы применения сопровождаются меньшими нежелательными побочными эффектами со стороны желудочно-кишечного тракта, чем если бы указанный состав содержал цитрат железа (III) химического качества. В соответствии с вышеуказанными способами применения настоящее изобретение предлагает способ лечения заболевания, характеризующегося высоким уровнем фосфата в сыворотке, включающий введение эффективного количества состава, содержащего цитрат железа (III) фармацевтического качества. Настоящее изобретение также предлагает способ, в котором эффективное количество цитрата желе-7 018245 за (III) фармацевтического качества вводят в форме таблетки, порошка, суспензии, эмульсии, капсулы,пастилки, гранулы, леденца, пилюли, жидкости, спиртового раствора или сиропа. Настоящее изобретение также предлагает способ, в котором эффективное количество цитрата железа (III) фармацевтического качества составляет от 2 до 100 г в сутки, предпочтительно от 4 до 60 г в сутки. В некоторых вариантах реализации указанный способ может предусматривать эффективное суточное количество в 2, 4, 6 или 8 г. В общем случае, гиперфосфатемия преобладает у пациентов с хронической почечной недостаточностью и у пациентов на диализе. Также существуют данные, указывающие на то, что повышенные уровни в сыворотке фосфора, кальций-фосфорного произведения (СаР) и паратиреоидного гормона (ПТГ) вносят свой вклад в повышение заболеваемости кальцификацией сосудов внутренних органов, периферических сосудов и мягких тканей у пациентов с почечной недостаточностью. Таким образом, дополнительный элемент новизны заявленного изобретения - предотвращение или обратное развитие кальцификации у пациента с заболеванием почек или у нормального субъекта. Например, растворение почечных камней, которые могут сопровождать почечную недостаточность. Фосфор оказывает отрицательное воздействие на кальцификацию сосудов непосредственным участием в СаР и опосредованным в патогенезе и развитии гипертиреоидизма. Кальций и фосфор в сыворотке метастабильны в обычных условиях, что означает, что их концентрации недостаточны для того, чтобы привести к самопроизвольному выпадению в осадок. Однако стоит начаться процессу кальцификации, концентрации оказываются достаточными для поддержания разрастания кристаллов. Доступные данные подтверждают широкое распространение основного сосудистого заболевания и структурного заболевания сердца у пациентов с тяжелой хронической почечной недостаточностью. Указанные структурные поражения затем подвергаются действию повышенного содержания в сыворотке фосфора, СаР и ПТГ (1). Факторы, которые, как полагают, возможно, вносят свой вклад в повышение уровня фосфора в сыворотке и СаР, включают введение кальцийсодержащих препаратов, связывающих фосфор. Кальцийсодержащие препараты, связывающие фосфор, такие как ацетат кальция, прописывают многим новым пациентам на гемодиализе (ГД) и перитонеальном диализе (ПД), обеспечивая, таким образом, большой источник экзогенного кальция в ЖКТ. Кальцификация также распространена среди пациентов с болезнями почек и может затронуть любого в возрасте старше 40 лет. Хотя основными причинами смерти в Соединенных Штатах является острый инфаркт миокарда и инсульт, гиперхолистеринемия дает только 15% смертей в данной категории, а 85% вызваны кальцификацией желудочков. Было показано, что аномалии в уровнях фосфора, СаР и ПТГ в сыворотке могут привести к кальцификации сосудов, внутренних органов и/или мягких тканей. Например, кальцификация миокарда, коронарных артерий, роговицы может привести к развитию ряда клинически значимых осложнений, включая ишемию миокарда, инфаркт миокарда, нарушение функции миокарда, застойную сердечную недостаточность, недостаточность сердечных клапанов и слепоту. Соответственно, существует потребность в способах регулирования или снижения содержания фосфатов в сыворотке в качестве средства для лечения многочисленных терапевтических заболеваний. Указанный способ включает введение средства, связывающего фосфаты, которое не оказывает неблагоприятного воздействия на уровни кальция в сыворотке и не вызывает токсических побочных эффектов у пациента. Примеры В числе примеров, предназначенных для иллюстрации вариантов реализации настоящего изобретения, но не предназначенных ограничивать область действия настоящего изобретения: Пример 1. Общий способ синтеза цитрата железа (III) фармацевтического качества Ссылаясь на фиг. 1, которая показывает общий способ синтеза цитрата железа (III) фармацевтического качества согласно настоящему изобретению, технологическая схема описывает осуществление мероприятий по контролю качества на выбранных стадиях процесса синтеза, чтобы гарантировать, что конечный продукт цитрат железа (III) соответствует техническим условиям на выпуск продукции, приведенным в табл. А, или любым другим утвержденным техническим условиям на выпуск продукции для цитрата железа (III) фармацевтического качества, который разрешен к применению или предназначен для использования у человека. Другие мероприятия или процедуры по контролю качества, легко понятные среднему специалисту в данной области, можно применять или включить в процесс синтеза цитрата железа (III) фармацевтического качества для обеспечения качества и чистоты конечного продукта и для увеличения эффективности и выхода процесса синтеза. См., например, КК 10 и КК 11 на фиг. 1. Примеры мероприятий по контролю качества, применяемых в способе синтеза, включают: (КК 4) обеспечение рН суспензии гидроксида железа (III) выше 7,0; (КК 5) обеспечение % Cl в осадке гидроксида железа (III) ниже 5%; (КК 7) обеспечение рН смеси между 0,8-1,5 и содержания Fe в смеси 85% от общего добавленного Fe, после добавления лимонной кислоты к осадку гидроксида железа (III) и (КК 9) обеспечение содержания ацетона 1000 м.д. на стадии высушивания. В одном из вариантов реализации исходные вещества, т.е., хлорид железа (III), деионизированная вода, лимонная кислота, ацетон, гидроксид натрия должны пройти проверку на соответствие техническим условиям на выпуск, как это представлено в табл. В-F, прежде чем они будут использованы в способе синтеза. см. фиг. 1, КК 1-КК 3, КК 6 и КК 8. Пример 1 А. Общий способ синтеза органических соединений железа (III) фармацевтического качества. Ссылаясь на фиг. 10, которая показывает общий способ синтеза органических соединений железа(III) фармацевтического качества согласно настоящему изобретению, технологическая схема показывает осуществление мероприятий по контролю качества на выбранных стадиях способа синтеза, чтобы гарантировать, что конечный продукт цитрат железа (III) соответствует утвержденным техническим условиям на выпуск продукции для органических соединений железа (III) фармацевтического качества, которые разрешены к применению или предназначены для использования у человека. Другие мероприятия или процедуры по контролю качества, легко понятные среднему специалисту в данной области, можно применять или включить в способ синтеза продукта фармацевтического качества для обеспечения качества и чистоты конечного продукта и для увеличения эффективности и выхода способа синтеза. См., например,КК 10 А и КК 11 А на фиг. 10. Примеры мероприятий по контролю качества, применяемых в способе синтеза, включают: (КК 4 А) - обеспечение рН суспензии гидроксида железа (III) выше 7,0; (КК 5 А) - обеспечение % Cl в осадке гидроксида железа (III) ниже 5%; (КК 7 А) - обеспечение рН смеси между 0,8-1,5 и содержания Fe в смеси 85% от общего добавленного Fe, после добавления органической кислоты к осадку гидроксида железа (III) и (КК 9 А) - обеспечение содержания ацетона 1000 м.д. на стадии высушивания. В одном из вариантов реализации исходные вещества, т.е. соль трехвалентного железа, деионизированная вода, органическая кислота, органический растворитель, гидроксид щелочного металла должны пройти проверку на соответствие техническим условиям на выпуск, прежде чем они будут использованы в способе синтеза. См. фиг. 1, КК 1 А-КК 3 А, КК 6 А и КК 8 А. Органическая кислота может включать лимонную кислоту, уксусную кислоту, изолимонную кислоту, янтарную кислоту, фумаровую кислоту,винную кислоту, или любую другую подходящую органическую кислоту. Органический растворитель может включать этанол, метанол, бутанол, ацетон, изопропиловый спирт, тетрагидрофуран или любой другой подходящий органический растворитель. Пример 2. Профили растворимости органических соединений трехвалентного железа согласно изобретению. Органические соединения трехвалентного железа, полученные в соответствии с вышеописанными способами, более растворимы при более широком диапазоне значений рН, чем коммерчески доступные органические соединения трехвалентного железа. Полагают, что увеличение растворимости описанных органических соединений трехвалентного железа является результатом уникальной значительно большей площади активной поверхности органических соединений трехвалентного железа согласно настоящему изобретению. Например, при рН 8,0 истинная скорость растворения цитрата железа (III) согласно настоящему изобретению в 3,08 раза выше, чем для коммерчески доступного цитрата железа (III). См. табл. 1. Истинные скорости растворения коммерчески доступного цитрата железа (III) сравнивали с истинными скоростями растворения цитрата железа (III) согласно настоящему изобретению. Истинную скорость растворения определяли как скорость растворения чистых веществ в условиях постоянной площади поверхности. На скорость растворения и биодоступность лекарственного вещества влияют его свойства в твердом состоянии: кристалличность, аморфность, полиморфизм, гидратация, сольватация, размер частицы и площадь поверхности частицы. Измеренная истинная скорость растворения зависит от таких свойств в твердом состоянии, которые обычно определяют, подвергая постоянную площадь поверхности вещества воздействию соответствующей среды растворения, поддерживая при этом постоянную температуру, скорость перемешивания и рН. Истинные скорости растворения представлены в табл. 1. Таблица 1. Истинные скорости растворения цитрата железа (III) при 37 С в растворах с рН 8. Например, площадь активной поверхности, определенная методом БЭТ (Брунауэра-ЭмметаТейлора) для цитрата железа (III) согласно настоящему изобретению по меньшей мере в 16 раз больше,чем для коммерчески доступного цитрата железа (III). См. табл. 2. Анализ площади активной поверхности основан на теории БЭТ, описывающей явление взаимодействия массы и энергии и фазовые переходы в процессе адсорбции газа на твердых поверхностях и в поровом пространстве. При измерении площади активной поверхности по методу БЭТ определяют объем монослоя газа, что позволяет определить площадь поверхности образца с использованием площади, занимаемой одинарным слоем адсорбированных молекул газа. В табл. 2 представлены сравнительные данные активной площади поверхности цитрата железа (III) согласно настоящему изобретению по отношению к площади активной поверхности коммерчески доступных соединений цитрата железа (III). Таблица 2. Площади активной поверхности по БЭТ для различных форм цитрата железа (III) Пример 3. Применение органических соединений трехвалентного железа согласно настоящему изобретению для лечения заболеваний Органические соединения трехвалентного железа, полученные в соответствии с вышеописанными способами, пригодны для лечения гиперфосфатемии, метаболического ацидоза и любых других заболеваний, поддающихся лечению органическим соединением трехвалентного железа. Поскольку органические соединения трехвалентного железа согласно настоящему изобретению являются более растворимыми, чем коммерчески доступные органические соединения трехвалентного железа, для эффективного лечения пациентов, страдающих указанными заболеваниями, можно использовать меньшие количества органических соединений трехвалентного железа согласно настоящему изобретению. Повышенная растворимость в воде особенно важна при использовании органических соединений трехвалентного железа согласно настоящему изобретению для лечения заболеваний, поддающихся лечению органическим соединением трехвалентного железа. Поскольку органические соединения трехвалентного железа согласно настоящему изобретению лучше растворимы, они будут более эффективны при оральном введении, и поэтому их можно вводить в более низких дозах. Органические соединения трехвалентного железа согласно настоящему изобретению лучше растворимы при более широком диапазоне рН, чем коммерчески доступные органические соединения трехвалентного железа; поэтому органические соединения трехвалентного железа согласно настоящему изобретению могут быть более эффективны благодаря растворению в тонкой кишке. Например, в эксперименте, моделирующем щелочные условия в тонкой кишке, цитрат железа (III) согласно настоящему изобретению показал лучшую скорость растворения, чем коммерчески доступный цитрат железа (III). Предполагают, что цитрат железа (III) согласно настоящему изобретению может быть более эффективным благодаря лучшей растворимости в тонкой кишке. См. табл. 1. В результате пациент может принимать более низкие дозы лекарства с меньшей частотой побочных эффектов. В одном варианте реализации настоящего изобретения цитрат железа (III) согласно настоящему изобретению обладает значительно большей величиной растворимости в воде в физиологических условиях, чем коммерчески доступные формы цитрата железа (III), и поэтому полагают, что цитрат железа(III) согласно настоящему изобретению имеет значительное преимущество при орально эффективном применении цитрата железа (III) в пониженной дозировке. Благодаря уменьшению орально эффективной дозы цитрата железа (III), полагают, что цитрат железа (III) согласно настоящему изобретению может обеспечить более низкую частоту нежелательных явлений со стороны желудочно-кишечного тракта, которые сопутствуют имеющимся в продаже соединениям цитрата железа (III). Кроме того, полагают, что повышенная скорость растворения цитрата железа (III) согласно настоящему изобретению может обеспечить более быстрое начало действия по связыванию пищевых фосфатов. Органические соединения трехвалентного железа согласно настоящему изобретению можно вводить в виде ряда форм, включая формы для перорального введения, которые могут содержать органические соединения трехвалентного железа согласно настоящему изобретению отдельно или в сочетании с фармацевтически приемлемым носителем. Формы для перорального введения включают, но не ограничены этим, таблетку, порошок, суспензию, эмульсию, капсулу, гранулу, леденец, пилюлю, жидкость,спиртовой раствор или сироп. Составы можно вводить человеку или животным, страдающим болезнями,поддающимися лечению органическим соединением трехвалентного железа. Пример 4. Способ получения цитрата железа (III) фармацевтического качества Настоящее изобретение описывает способ получения цитрата железа (III) фармацевтического качества, пригодного в качестве активного фармацевтического ингредиента для использования у человека. Общее представление о технологической схеме производства цитрата железа (III) приведено на фиг. 1. В качестве конкретного примера произведен цитрат железа (III) фармацевтического качества с использованием методики, описанной ниже. Также см. фиг. 2. 4.1. Приготовление раствора хлорида железа (III).Отвешивали 550 г гексагидрата хлорида железа (III) (соответствующего по чистоте СоА (сертификату анализа в лабораторный стакан объемом 1 л.Переносили гексагидрат хлорида железа (III) в колбу Эрленмейера объемом 4 л.Отмеряли 1,1 л деионизированной воды при помощи мерного цилиндра. Использовали небольшое количество деионизированной воды, чтобы ополоснуть стакан, и переливали эту воду в колбу Эрленмейера объемом 4 л. Приливали оставшуюся воду в колбу Эрленмейера.Перемешивали при помощи магнитной мешалки до полного растворения. Полученный раствор имел цвет от темно-желтого до темно-коричневого. 4.2. Приготовление раствора гидроксида натрия.Отвешивали 244 г гидроксида натрия (соответствующего по чистоте СоА) в лабораторный стакан объемом 500 мл.Переносили гидроксид натрия в колбу Эрленмейера объемом 2 л.Отмеряли 1,1 л деионизированной воды при помощи мерного цилиндра. Использовали небольшое количество деионизированной воды, чтобы ополоснуть стакан, и переливали эту воду в колбу Эрленмейера объемом 2 л. Медленно приливали оставшуюся воду в колбу Эрленмейера.В вытяжном шкафу перемешивали раствор при помощи магнитной мешалки во время добавления воды и до полного растворения. Полученный раствор был прозрачный и бесцветный.Охлаждали полученный раствор до температуры ниже 30 С на водяной бане. 4.3. Получение промежуточного соединения гидроксида железа (III)Помещали в раствор хлорида железа (III) якорь магнитной мешалки и помещали колбу с раствором на водяную баню. Устанавливали баню с колбой на рабочую поверхность магнитной мешалки и включали перемешивание на низкой скорости.Медленно добавляли через воронку раствор гидроксида натрия к раствору хлорида железа (III) (со скоростью менее 20 мл/мин) и поддерживали температуру реакционной смеси ниже 40 С при помощи водяной бани и регулирования скорости добавления раствора гидроксида натрия.Продолжали охлаждать полученную вязкую коричневую смесь до температуры ниже 30 С при помощи водяной бани.Окончательная величина рН должна быть выше 7. Если она была не выше 7, при помощи соответствующего объема 5 М водного раствора гидроксида натрия корректировали рН. Измеряли и записывали окончательную величину рН. Образовался темно-коричневый осадок гидроксида железа (III).При необходимости охлаждали вязкую коричневую смесь до температуры ниже 30 С при помощи холодной водяной бани и фильтровали суспензию гидроксида железа (III) через фильтр из нержавеющей стали с размером отверстий 1 мм, чтобы разрушить крупные частицы осадка.Переносили равные количества суспензии гидроксида железа (III) в четыре пробирки для центрифугирования емкостью по 500 мл. Перед центрифугированием уравновешивали вес каждой пробирки для центрифугирования при помощи весов с верхней загрузкой.Центрифугировали суспензию гидроксида железа (III) при 1500 об./мин и 255 С в течение 5 мин. Надосадочную жидкость сливали.Отмеряли 2,5 л деионизированной воды при помощи мерного цилиндра и использовали приблизительно 1 л воды для повторного суспендирования осадка гидроксида железа (III) из пробирок для центрифугирования.Переносили суспензию гидроксида железа (III) в колбу Эрленмейера объемом 4 л, снабженную фильтром из нержавеющей стали с размером отверстий 1 мм над стеклянной воронкой. Использовали оставшиеся 1,5 л деионизированной воды, чтобы ополоснуть контейнеры и промыть осадок, оставшийся на стальном фильтре.Промывали осадок еще два раза, повторяя предыдущие стадии, начиная с Переносили равные количестваПосле третьей промывки выделяли осадок, повторяя стадии начиная с Переносили равные количестваи заканчивая Центрифугировали суспензию гидроксида железа (III) .Вновь суспендировали полученный осадок в 150 мл деионизированной воды. 4.4. Получение цитрата железа (III)Гомогенизировали осадок гидроксида железа (III) при помощи механической мешалки в течение 5 мин в колбе Эрленмейера объемом 2 л.Отвешивали 490 г лимонной кислоты (соответствующей по чистоте СоА) в лабораторный стакан объемом 500 мл.Помещали якорь магнитной мешалки в колбу Эрленмейера объемом 2 л, находящуюся на масляной бане, и перемешивали на высокой скорости.Добавляли лимонную кислоту к суспензии гидроксида железа (III).Перемешивали полученный раствор в течение 30 мин.Нагревали полученную смесь при температуре от 90 до 100 С (на масляной бане) до тех пор, пока ее цвет не менялся с оранжево-коричневого на прозрачный черно-коричневый (от 30 до 120 мин) или до тех пор, пока не растворялся осадок гидроксида железа (III).Отбирали из реакционной смеси аликвоту объемом 1 мл в стеклянную пробирку объемом 6 мл и центрифугировали при 1500 об./мин и 255 С в течение 5 мин. Если не наблюдали осадка, переходили к следующей стадии. Если наблюдали выпадение некоторого количества осадка, добавляли к реакционной смеси от 10 до 34 г лимонной кислоты и продолжали нагревание в течение от 10 до 30 мин.Прекращали нагревание и охлаждали полученную смесь до температуры ниже 30 С. Измеряли величину рН реакционной смеси - она должна иметь рН от 0,8 до 1,5.Переносили равные количества реакционной смеси в четыре пробирки для центрифугирования объемом по 500 мл и уравновешивали вес каждой пробирки при помощи весов с верхней загрузкой.Центрифугировали реакционную смесь при 1500 об./мин и 255 С в течение 5 мин. Переносили и объединяли все надосадочные жидкости, содержащие цитрат железа (III), в чистую колбу Эрленмейера объемом 4 л.Повторяли предыдущие 2 стадии для всей реакционной смеси, содержащей цитрат железа (III).Помещали половину полученной надосадочной жидкости, содержащей цитрат железа (III), в колбу Эрленмейера объемом 4 л и перемешивали при помощи магнитной мешалки на высокой скорости.Медленно (в течение 20 мин) добавляли 3,5 л ацетона (точный объем ацетона вычисляли как пятикратный объем надосадочной жидкости) и перемешивали еще 10 мин. Образовывался осадок светлобежевого цвета.Переносили полученную суспензию в четыре пробирки для центрифугирования объемом по 500 мл и уравновешивали вес каждой пробирки при помощи весов с верхней загрузкой.Центрифугировали суспензию цитрата железа (III) при 1500 об./мин и 255 С в течение 5 мин.Переносили и объединяли осадки цитрата железа (III) в чистую колбу Эрленмейера объемом 4 л.Повторяли предыдущие 4 стадии для второй половины надосадочной жидкости, содержащей цитрат железа (III).Объединяли весь осадок цитрата железа (III), добавляли 1,4 л ацетона и перемешивали в течение 5 мин. Переносили полученную суспензию в четыре пробирки для центрифугирования объемом по 500 мл и уравновешивали вес каждой пробирки при помощи весов с верхней загрузкой.Центрифугировали суспензию при 1500 об./мин и 255 С в течение 5 мин.Повторяли предыдущие 2 стадии, пока не была отцентрифугирована вся суспензия.Переносили и объединяли весь осадок цитрата железа (III) в чистую колбу Эрленмейера объемом 4 л.Повторяли предыдущие 5 стадий еще два раза (всего 3 промывки).Маркировали и взвешивали лотки для высушивания, записывали их вес.Переносили осадок цитрата железа (III) на лотки для высушивания и высушивали при температуре окружающей среды (255 С) в течение 16 ч.Помещали лотки для высушивания в вакуум-сушильный шкаф и высушивали при температуре ок- 12018245 ружающей среды (255 С) и под вакуумом (около 20 мм рт.ст.) в течение от 8 до 16 ч (до тех пор, пока материал не был готов к измельчению).Измельчали цитрат железа (III) при помощи фарфоровой ступки и пестика.Помещали порошок цитрата железа (III) в вакуум-сушильный шкаф и высушивали при температуре окружающей среды (255 С) и под вакуумом (около 20 мм рт.ст.) в течение от 8 до 24 ч, до тех пор,пока материал не был готов к просеиванию.Тонко измельчали цитрат железа (III) при помощи фарфоровой ступки и пестика. Просеивали порошок цитрата железа (III) через сито с размером отверстий 45 меш (355 мкм).Переносили порошок цитрата железа (III) на лотки для высушивания, помещали указанные лотки в сушильный шкаф и сушили при 255 С и высоком вакууме до тех пор, пока материал не высыхал (от 20 до 48 ч).Переносили порошок в заранее взвешенные контейнеры из желтого пластика.Надписывали контейнеры и хранили их при комнатной температуре, защищая от света. Пример 5. Способ масштабируемого получения цитрата железа (III) фармацевтического качества. Настоящее изобретение предлагает способ масштабируемого получения цитрата железа (III) фармацевтического качества. Предпочтительно способ получения цитрата железа (III) позволяет производить по меньшей мере 125-килограммовые партии цитрата железа (III) фармацевтического качества. Общее представление о способе получения цитрата железа (III) показано на фиг. 3. Подробности способа получения цитрата железа (III) показаны на фиг. 4. Также в масштабируемом способе получения возможно использование сушилки с кипящим слоем для высушивания влажного цитрата железа (III) и для достижения соответствия техническим условиям на выпуск по летучим органическим примесям. См. в табл. А технические условия на выпуск продукции для цитрата железа (III) фармацевтического качества. Пример 6. Цитрат железа (III) фармацевтического качества. Настоящее изобретение предлагает цитрат железа (III) фармацевтического качества, соответствующий техническим условиям на выпуск продукции, как показано ниже в табл. А. Цитрат железа (III) фармацевтического качества соответствующей чистоты и качества можно получить при помощи способа получения согласно настоящему изобретению. См. на фиг. 1-4 принципиальную схему получения цитрата железа (III) и процесса контроля качества. Способ получения цитрата железа (III) и процесс контроля качества можно легко масштабировать для производства многотоннажных партий или увеличить до масштабов производства. Таблица А. Технические условия на выпуск продукции для цитрата железа (III) фармацевтического качества. Пример 7. Технические условия на выпуск для испытания исходных веществ Табл. В. Технические условия на выпуск гексагидрата хлорида железа (III) Табл. С. Технические условия на выпуск гидроксида натрия Табл. D. Технические условия на выпуск деионизированной воды Табл. Е. Технические условия на выпуск ацетона Табл. F. Технические условия на выпуск лимонной кислоты Пример 8. Способы испытаний конечного продукта на соответствие техническим условиям на выпуск продукции Последующие испытания проводят, чтобы гарантировать, что конечный продукт цитрат железа(III), полученный в соответствии со способом или процессом согласно настоящему изобретению, соответствует установленным техническим условиям на выпуск продукции, как показано в табл. А. Указанные технические условия на выпуск продукции может легко изменить или пересмотреть любой средний специалист в данной области, руководствуясь принципами настоящего изобретения, как повысить чистоту и безопасность цитрата железа (III) фармацевтического качества для использования у человека.(а) На основании USP 25 191, гравиметрический способ с использованием ферроцианида калия,стр. 1918 - Предельное содержание иона двухвалентного железа в цитрате железа (III).(б) На основании USP 25, анализ сульфата железа, стр. 728 - Предельное содержание хлорида в цитрате железа (III).(в) На основании USP 25, анализ сульфата железа, стр. 728 - Предельное содержание нерастворимых в кислотах веществ в цитрате железа (III).(г) На основании USP 25, анализ сульфата железа, стр. 728 - Анализ на содержание трехвалентного железа в цитрате железа (III).(д) На основании USP 25 467 - Определение ацетона в образцах цитрата железа (III) методом ГХ/ПИД (газовой хроматографии с пламенно-ионизационным детектором) в свободном пространстве над продуктом в таре.(е) На основании USP 25 191 - Соли трехвалентного железа; цитрат, стр. 1918 - Идентификация цитрата железа (III).(п) Микробы/плесени и дрожжи. Пример 9. Способы применения и исследования цитрата железа (III) фармацевтического качества у пациентов in vivo. А. Обработка и формы исследуемых составов Цитрат железа (III) поставляли в капсулах по 500 мг, тогда как плацебо могло быть представлено в идентичных на вид капсулах (неотличимых от тех, которые содержат активное лекарство); капсулы плацебо могли содержать сорбит и краситель, чтобы обеспечить соответствие цвету порошка в активных капсулах. Оболочки капсул плацебо могли быть идентичны оболочкам активных капсул. Хранение Все запасы исследуемых лекарств хранили в надежных условиях и не использовали после истечения срока годности, который напечатан на контейнере с исследуемым лекарством. Исследуемые лекарства хранили в контролируемых условиях (от 15 до 30 С, от 59 до 86F), в плотно закрытом контейнере,в защищенном от света месте. Дозировка Недавнее предварительное исследование имело целью сравнить цитрат железа (III) (3 г в сутки) с карбонатом кальция (3 г в сутки) в отношении снижения содержания РО 4 в сыворотке у пациентов с терминальной стадией почечной недостаточности (ТПН). Хотя цитрат железа (III) вызывает значительное снижение содержания РО 4 в сыворотке, он не так эффективен, как карбонат кальция. Указанная доза цитрата железа (III) связана со слабыми, но переносимыми симптомами со стороны ЖКТ. Как показано на фиг. 12 и 13, лечение с использованием цитрата железа (III) фармацевтического качества имело некоторые преимущества по сравнению с цитратом железа (III) химического качества. В общем случае, в то время как цитрат железа (III) фармацевтического качества проявлял эффективность,приблизительно равную эффективности цитрата железа (III) химического качества, достижение этого результата при его использовании было связано с меньшими нежелательными побочными эффектами,чем цитрат железа (III) химического качества. Фиг. 12 также показывает, что нежелательные побочные эффекты, связанные с введением цитрата железа (III) фармацевтического качества, статистически не отличались от побочных эффектов, связанных с плацебо. Преимуществом указанного профиля безопасности являлось то, что для каждого отдельного пациента можно было определить дозировку цитрата железа (III) фармацевтического качества в пределах большого диапазона доз, меньше беспокоясь о побочном действии. Таким образом, индивидуальное лечение пациента можно варьировать с учетом его конкретных потребностей и чувствительности. Дозы цитрата железа (III), выбранные для исследования или лечения, могут составлять от 1 до 30 г цитрата железа (III) в сутки. Отчасти это может зависеть от природы представленного состава. Например, капсулы цитрата железа (III) можно вводить в суточной дозе вплоть до 15 г/сутки, тогда как таблетированную форму можно вводить вплоть до 30 г/сутки. Таким образом, существует очень большой диапазон дозировочных схем, включенных в настоящее изобретение. Определение оптимальной дозировки для субъекта В контексте настоящего изобретения термин субъект относится или к человеку, или к животному. Оптимальную дозировку для отдельного пациента или для групп можно определить следующим образом. Дозу приблизительно в один или два грамма в сутки просто предлагают как иллюстративную начальную дозу. Указанную суточную дозу можно при необходимости увеличить для достижения желаемого результата. Подразумевается, что настоящее изобретение не ограничено применяемым диапазоном дозировок. Таким образом, в зависимости от субъекта(ов) суточная вводимая доза может составлять примерно тридцать, сорок, пятьдесят, шестьдесят, семьдесят, восемьдесят, девяносто или сто граммов в сутки. Профиль безопасности для цитрата железа (III) фармацевтического качества делает возможным применение большого диапазона доз. Кроме того, объект настоящего изобретения не ограничен капсулами и таблетками в качестве составов для перорального введения. В данной области известно, что для применения согласно настоящему изобретению можно модифицировать широкий спектр составов для перорального введения. Иллюстративный пример дозировочной схемы Ниже представлен неограничительный пример дозировочной схемы. Он не предназначен для ограничения настоящего изобретения относительно выбранного эффективного количества цитрата железа(III), или формы, в которой он представлен, или частоты введения состава течение суток. Нижеприведенное описание только иллюстрирует, как можно вводить цитрат железа (III) и плацебо; например, в виде капсул по 500 мг, идентичных по внешнему виду. Все пациенты могут получать (в слепом методе) по 4 капсулы с каждым из трех приемов пищи, ежесуточно, на протяжении 28 дней. Пациенты могут получить инструкцию принимать исследуемое лекарство в течение 10 мин после окончания приема пищи(завтрака, обеда и ужина). Число плацебо и активных капсул, которые следует принимать с каждым приемом пищи, следующее: Группа плацебо настоящего исследования 4 капсулы плацебо с завтраком 4 капсулы плацебо с обедом 4 капсулы плацебо с ужином Группа 2 г цитрата железа (III) в сутки настоящего исследования 1 капсула цитрата железа (III) и 3 капсулы плацебо с завтраком 1 капсула цитрата железа (III) и 3 капсулы плацебо с обедом 2 капсулы цитрата железа (III) и 2 капсулы плацебо с ужином Группа 4 г цитрата железа (III) в сутки 2 капсулы цитрата железа (III) и 2 капсулы плацебо с завтраком 3 капсулы цитрата железа (III) и 1 капсула плацебо с обедом 3 капсулы цитрата железа (III) и 1 капсула плацебо с ужином Группа 6 г цитрата железа (III) в сутки 4 капсулы цитрата железа (III) с завтраком 4 капсулы цитрата железа (III) с обедом 4 капсулы цитрата железа (III) с ужином В. Клинический режим и оценки Продолжительность лечения при исследовании Участие каждого пациента в испытаниях продолжается вплоть до 8 недель: период обследования(приблизительно 1-2 недели) 1-2-недельный период вымывания и 4-недельное лечение исследуемым лекарством. Посещение для обследования 1 (Дни исследования с -30 по -15) При первом посещении для обследования можно проводить следующие процедуры: 1. Заполнение истории болезни, включая сопутствующее лечение. 2. Сбор демографических данных. 3. Медицинский осмотр, включая рост, вес и основные показатели состояния организма. 4. Сбор информации о питании, с использованием способа припоминания за 24 ч, чтобы оценить поступление с пищей кальция и фосфора, трижды в течение периода обследования, чтобы включить один день с диализом, один день без диализа и один выходной день. Примечание: сбор информации о питании можно также проводить, частично или полностью, во время периода вымывания. 5. Лабораторные исследования:Гематология: клинический анализ крови (СВС) с подсчетом лейкоцитарной формулы и тромбоцитов.Биохимия: натрий, калий, хлорид, бикарбонат, азот мочевины крови (АМК), креатинин, глюкоза(ЩФ), общий билирубин, общий белок, альбумин, кальций в сыворотке, фосфат в сыворотке, магний.Уровни холестерина общего и ЛНП.В-ХГЧ в сыворотке для женщин детородного возраста.Группа железа: железо в сыворотке, ферритин, коэффициент насыщения трансферрина и общая железосвязывающая способность сыворотки (ЖСС). 6. ЭКГ в 12 отведениях. 7. Пациенты могут получить инструкции на период вымывания (дни исследования с -14 по -1): а) Все фосфатсвязывающие средства отменяют в День -14. б) Все лечение с использованием железа (перорально или внутривенно) отменяют в День -14. в) Пациенты, получавшие постоянные дозы витамина D или кальцитриола в течение 1 месяца перед зачислением в группу, получают указание придерживаться своей текущей дозы на протяжении исследования. г) Пациентов информируют о необходимости избегать изменений в диете, приема содержащих кальций или магний антацидов (других лекарств). Посещение для обследования 2 (Дни исследования -7 +/-1 день) 1. Лабораторные исследования: РО 4 в сыворотке Примечание: пациентов с уровнями РО 4 в сыворотке в День -75,5 мг/дл и 10 мг/дл следует распределить случайным образом до завершения 2-недельного периода вымывания. День случайного распределения автоматически станет Днем 0. Примечание: пациентов с уровнем фосфата в сыворотке в День -710 мг/дл следует исключить из исследования и рекомендовать им возобновить лечение, которое было назначено им до исследования. День исследования 0 (случайное распределение и дозировка) 1. Медицинский осмотр, включая вес и основные показатели состояния организма. 2. Опрос о нежелательных явлениях. 3. Опрос о сопутствующем лечении. 4. Лабораторные исследования нулевой линии:РО 4 в сывороткеСа в сывороткеГруппа железа: железо в сыворотке, ферритин, коэффициент насыщения трансферрина и общая железосвязывающая способность сыворотки. Примечание: лабораторные исследования нулевой линии можно выполнять в течение 3 дней перед Днем 0. 5. Пациентов с уровнем РО 45,5 мг/дл и 10 мг/дл распределяют случайным образом и выдают им 15-дневный запас исследуемого лекарства. Примечание: пациентов следует проинструктировать начать прием исследуемого лекарства в течение 10 мин после завершения следующего приема пищи в День 0. День исследования 14 (серединная оценка) Следующие процедуры можно проводить в День исследования 14 +/-1 день. 1. Медицинский осмотр, включая вес и основные показатели состояния организма. 2. Опрос о нежелательных явлениях. 3. Опрос о сопутствующем лечении. 4. Выдача дополнительного 15-дневного запаса исследуемого лекарства. Все возвращенные капсулы следует подсчитать и внести в индивидуальную регистрационную карту. 5. Лабораторные исследования: Гематология: СВС с подсчетом лейкоцитарной формулы и тромбоцитов. Биохимия: натрий, калий, хлорид, бикарбонат, АМК, креатинин, глюкоза (выборочно), ACT, АЛТ,ЩФ, общий билирубин, общий белок, альбумин, кальций, фосфат, магний. Группа железа: железо в сыворотке, ферритин, коэффициент насыщения трансферрина и общая железосвязывающая способность сыворотки. Уровни холестерина общего и ЛНП. Примечание: пациентов с уровнем фосфата в сыворотке в День 1410 мг/дл следует исключить из исследования и рекомендовать им возобновить лечение, которое было назначено им до исследования. День исследования 28 (оценка в конце исследования) Следующие процедуры можно проводить в День исследования 28 +/- 1 день или в день более раннего прекращения исследования. 1. Медицинский осмотр, включая вес и основные показатели состояния организма. 2. Опрос о нежелательных явлениях. 3. Опрос о сопутствующем лечении. 4. Лабораторные исследования: а) Гематология: СВС с подсчетом лейкоцитарной формулы и тромбоцитов. б) Биохимия: натрий, калий, хлорид, бикарбонат, АМК, креатинин, глюкоза (выборочно), ACT,АЛТ, ЩФ, общий билирубин, общий белок, альбумин, кальций, фосфат, магний. в) Уровни холестерина общего и ЛНП. г) Группа железа: железо в сыворотке, ферритин, коэффициент насыщения трансферрина и общая железосвязывающая способность сыворотки. 5. ЭКГ в 12 отведениях. 6. Пациентам рекомендуют после окончания исследования возобновить лечение, которое было назначено им до исследования. С. Обработка данных и анализ.GloboMax может являться первичным центром обработки данных, наблюдения и координирования. Индивидуальные регистрационные карты (ИРК) необходимо составить для каждого субъекта. Субъекта в ИРК нельзя обозначать именем или инициалами. ИРК следует регистрировать в помещениях клиник и собирать при помощи монитора исследования GloboMax. Проверенные ИРК следует использовать для создания электронных файлов данных. Три основных категории окончательных результатов отражают биохимические и клинические результаты, направленные вначале. Дополнительные клинические и биохимические результаты направляют по мере их получения. Таким образом, окончательные результаты не следует рассматривать как ограничение полноты соответствующих данных и измерений, собранных в настоящем или в будущих исследованиях. Первичные окончательные результаты (см. фиг. 9-10).Изменение концентрации РО 4 в сыворотке в Дни 14 и 28 относительно нулевой линии. Вторичные окончательные результаты (см. фиг. 9-10).Изменение концентрации кальция в сыворотке в Дни 14 и 28 относительно нулевой линии.Изменение содержания железа, ферритина, коэффициента насыщения трансферрина и общей железосвязывающей способности сыворотки в Дни 14 и 28 относительно нулевой линии.Изменение произведения Са и РО 4 в сыворотке в Дни 14 и 28 относительно нулевой линии. Кроме того, было отмечено, что по сравнению с цитратом железа (III) химического качества цитрат железа (III) фармацевтического качества проявляет аналогичную эффективность. См. фиг. 13. Однако профили безопасности показывают, что цитрат железа (III) фармацевтического качества в общем случае вызывает меньше неблагоприятных клинических эффектов. См. фиг. 13. Окончательные результаты по безопасности (см. фиг. 11) За безопасностью можно наблюдать, отмечая нежелательные явления (фиг. 11), результаты медицинского осмотра, основные показатели состояния организма и лабораторные исследования при каждом посещении во время исследования. Также для обеспечения безопасности пациентов были установлены конкретные правила отстранения их от исследования на основании лабораторных данных. Неограничительный пример указанных критериев можно проиллюстрировать следующим. Если уровень фосфата в сыворотке у пациента достигал 10 мг/дл в любое время на протяжении периода исследования, указанного пациента отстраняли от исследования. Конкретные исследования также показывают, что цитрат железа (III) фармацевтического качества обладает аналогичной эффективностью по сравнению с цитратом железа (III) химического качества (см. фиг. 13). Однако цитрат железа (III) фармацевтического качества в общем случае давал значительно более подходящие профили безопасности, как показано на фиг. 12. Это указывает на значительный прогресс в регулировании уровней фосфата в сыворотке. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение состава, содержащего цитрат железа (III), для приготовления лекарственного средства для предотвращения или обратного развития кальцификации мягких тканей, причем состав содержит цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 2. Применение по п.1, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см 2/мин. 3. Применение по п.1, в котором указанная мягкая ткань представляет собой кровеносный сосуд. 4. Применение по п.1, в котором указанная мягкая ткань представляет собой глаз. 5. Применение по любому из пп.1-4, в котором состав предназначен для перорального введения. 6. Применение по любому из пп.1-4, в котором состав предназначен для перорального введения два или более раз в сутки. 7. Применение по любому из пп.1-6, в котором состав предназначен для перорального введения совместно с пищей. 8. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве от 2 до 30 г в сутки. 9. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве от 4 до 15 г в сутки. 10. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве от примерно 4 до примерно 8 г в сутки. 11. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве примерно 6 г в сутки. 12. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве примерно 4 г в сутки. 13. Применение по любому из пп.1-7, в котором состав предназначен для введения цитрата железа(III) в количестве примерно 2 г в сутки. 14. Применение по любому из пп.1-13, в котором состав подходит для введения на протяжении длительного периода времени. 15. Применение по любому из пп.1-14, в котором состав предназначен для высвобождения в желудочно-кишечном тракте ионов трехвалентного железа. 16. Применение по любому из пп.1-15, в котором состав предназначен для высвобождения в желудочно-кишечном тракте цитрата. 17. Применение по любому из пп.1-16, в котором состав находится в форме капсул. 18. Применение по любому из пп.1-17, в котором состав находится в форме таблеток. 19. Способ предотвращения или обратного развития кальцификации мягких тканей, включающий введение субъекту состава, содержащего эффективное количество цитрата железа (III), имеющего площадь активной поверхности, определенную методом БЭТ, более 16,17 м 2/г. 20. Способ по п.19, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см 2/мин. 21. Способ по п.19, в котором указанная мягкая ткань представляет собой кровеносный сосуд. 22. Способ по п.19, в котором указанная мягкая ткань представляет собой глаз. 23. Способ по любому из пп.19-22, в котором указанный состав предназначен для перорального введения. 24. Способ по любому из пп.19-22, в котором указанный состав предназначен для перорального введения два или более раз в сутки. 25. Способ по любому из пп.19-22, в котором состав предназначен для введения совместно с пищей. 26. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет от примерно 2 до примерно 30 г в сутки. 27. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет от 4 до 15 г в сутки. 28. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет от 4 до 8 г в сутки. 29. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет примерно 6 г в сутки. 30. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет примерно 4 г в сутки. 31. Способ по любому из пп.19-25, в котором указанное эффективное количество цитрата железа(III) составляет примерно 2 г в сутки. 32. Способ по любому из пп.19-31, в котором состав подходит для введения на протяжении длительного периода времени. 33. Способ по любому из пп.19-32, в котором состав предназначен для высвобождения в желудочно-кишечном тракте ионов трехвалентного железа. 34. Способ по любому из пп.19-33, в котором состав предназначен для высвобождения в желудочно-кишечном тракте цитрата. 35. Способ по любому из пп.19-34, в котором состав находится в форме капсулы. 36. Способ по любому из пп.19-34, в котором состав находится в форме таблетки. 37. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни ионов кальция в сыворотке субъекта. 38. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни фосфат-ионов в сыворотке субъекта. 39. Способ по любому из пп.19-36, в котором цитрат железа снижает уровни ионов кальция и фосфат-ионов в сыворотке субъекта. 40. Фармацевтический состав для обратного развития, предотвращения или стабилизации кальцификации мягких тканей, содержащий цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, по меньшей мере 16,17 м 2/г, и фармацевтически приемлемый носитель, причем цитрат железа (III) присутствует в количестве, эффективном для снижения уровня фосфата в сыворотке. 41. Фармацевтический состав по п.40, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см 2/мин. 42. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет от 2 до 30 г в сутки. 43. Фармацевтический состав по любому из пп.40-42, в котором эффективное количество цитрата железа составляет от 4 до 15 г в сутки. 44. Фармацевтический состав по любому из пп.38-43, в котором эффективное количество цитрата железа выбрано из 2, 4 и 6 г в сутки. 45. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет 1 г в сутки. 46. Фармацевтический состав по п.40 или 41, в котором эффективное количество цитрата железа составляет 500 мг на единицу лекарственной формы. 47. Фармацевтический состав для обратного развития, предотвращения или стабилизации кальцификации мягких тканей, содержащий 500 мг цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г, и фармацевтически приемлемый носитель,причем указанный состав представлен в форме капсул. 48. Способ замедления отложения фосфата кальция в организме субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 49. Способ снижения кальций-фосфатного произведения ([Са][Р]) у пациента, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 50. Способ снижения уровня кальция в сыворотке у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 51. Способ стимуляции растворения почечного камня у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 52. Способ снижения уровня фосфата в сыворотке у субъекта, включающий введение указанному субъекту эффективного количества цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г. 53. Способ по п.52, в котором цитрат железа вводят перорально. 54. Способ по п.52 или 53, в котором цитрат железа вводят с пищей. 55. Способ по любому из пп.52-54, в котором цитрат железа представлен в форме, выбранной из таблетки, порошка, суспензии, эмульсии, капсулы, пастилки, гранулы, леденца, пилюли, жидкости, спиртового раствора или сиропа. 56. Способ по любому из пп.52-55, в котором эффективное количество составляет от 2 до 30 г в сутки. 57. Способ по любому из пп.52-56, в котором эффективное количество выбрано из приблизительно 2, примерно 4 и примерно 6 г в сутки. 58. Способ по любому из пп.52-57, в котором субъект страдает терминальной стадией заболевания почек. 59. Способ по любому из пп.52-57, в котором субъект проходит диализ. 60. Способ по п.59, в котором диализ выбран из гемодиализа и перитонеального диализа. 61. Способ по любому из пп.52-60, в котором цитрат железа вводят в форме таблетки. 62. Способ по п.61, в котором таблетка содержит 1 г цитрата железа. 63. Способ по п.61, в котором таблетка содержит 500 мг цитрата железа. 64. Способ по любому из пп.52-63, в котором эффективное количество составляет 1 г в сутки. 65. Способ по любому из пп.52-63, в котором эффективное количество составляет 6 г в сутки. 66. Способ по любому из пп.52-63, в котором эффективное количество составляет 4 г в сутки. 67. Способ по любому из пп.52-63, в котором эффективное количество составляет 2 г в сутки. 68. Фармацевтический состав для снижения уровня фосфата в сыворотке, содержащий цитрат железа (III), имеющий удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г и фармацевтически приемлемый носитель, причем цитрат железа присутствует в количестве, эффективном для снижения уровня фосфата в сыворотке. 69. Фармацевтический состав по п.68, в котором цитрат железа имеет истинную скорость растворения в диапазоне от 1,88 до 4,0 мг/см 2/мин. 70. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет от 2 до 30 г в сутки. 71. Фармацевтический состав по любому из пп.68-70, в котором эффективное количество цитрата железа составляет от 4 до 15 г в сутки. 72. Фармацевтический состав по любому из пп.68-71, в котором эффективное количество цитрата железа выбрано из 2, 4 и 6 г в сутки. 73. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет 1 г в сутки. 74. Фармацевтический состав по п.68 или 69, в котором эффективное количество цитрата железа составляет 500 мг на единицу лекарственной формы. 75. Фармацевтический состав для снижения уровня фосфата в сыворотке, содержащий 500 мг цитрата железа (III), имеющего удельную площадь активной поверхности, определенную методом БЭТ, выше 16,17 м 2/г, и фармацевтически приемлемый носитель, причем указанный состав представлен в форме капсул. Схема способа получения цитрата железа фармацевтического качества Истинные скорости растворения в водных растворах веществ, содержащих цитрат железа (III)
МПК / Метки
МПК: C07F 15/02, A01N 37/00
Метки: органические, способы, железа, трехвалентного, фармацевтического, соединения, применение, получения, качества
Код ссылки
<a href="https://eas.patents.su/30-18245-organicheskie-soedineniya-trehvalentnogo-zheleza-farmacevticheskogo-kachestva-ih-primenenie-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Органические соединения трехвалентного железа фармацевтического качества, их применение и способы их получения</a>
Предыдущий патент: Ключ и его комбинация с замком
Следующий патент: Везикулярные составы, содержащие производные органических кислот, и процесс их приготовления
Случайный патент: Игровой автомат и игровая система