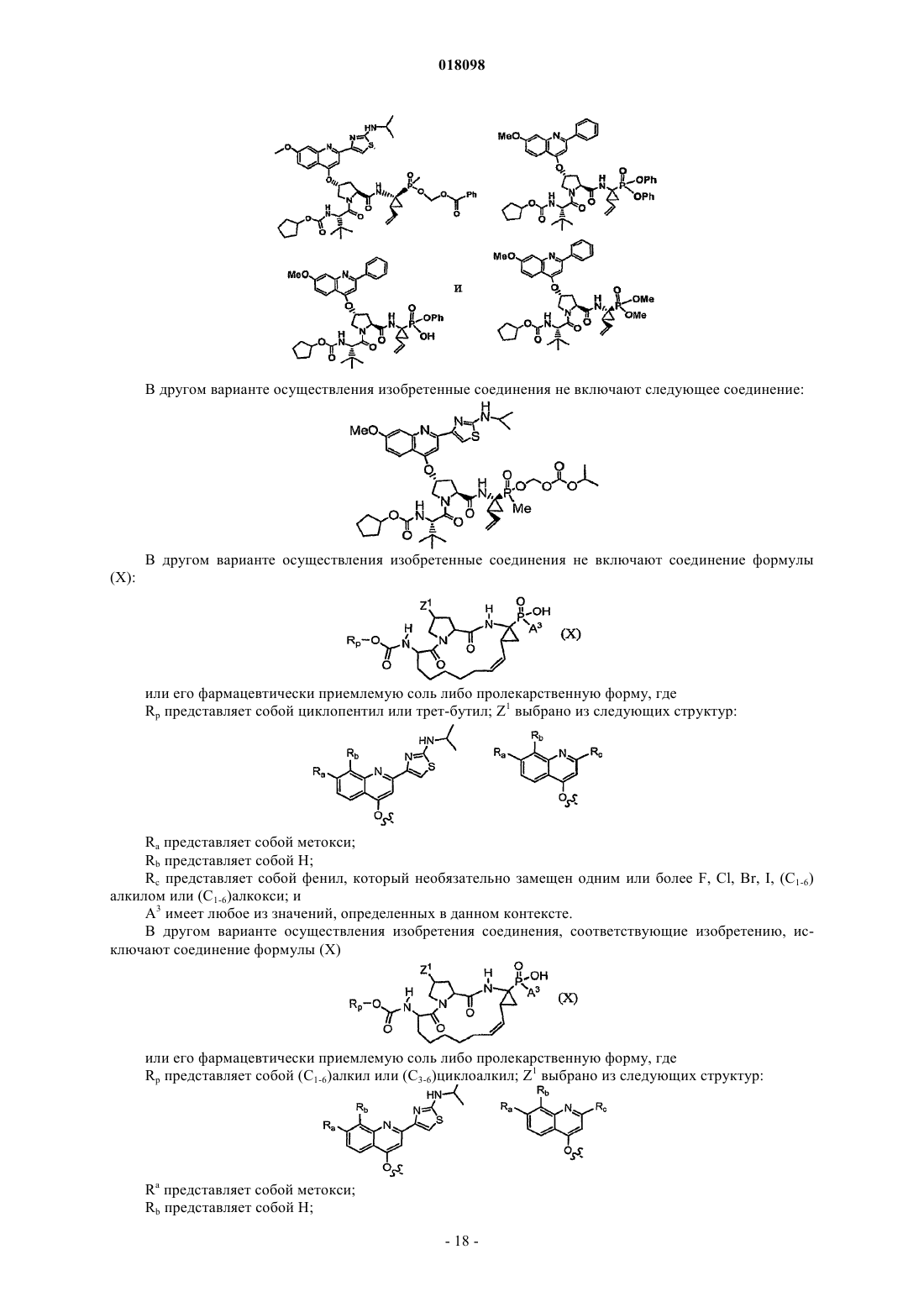
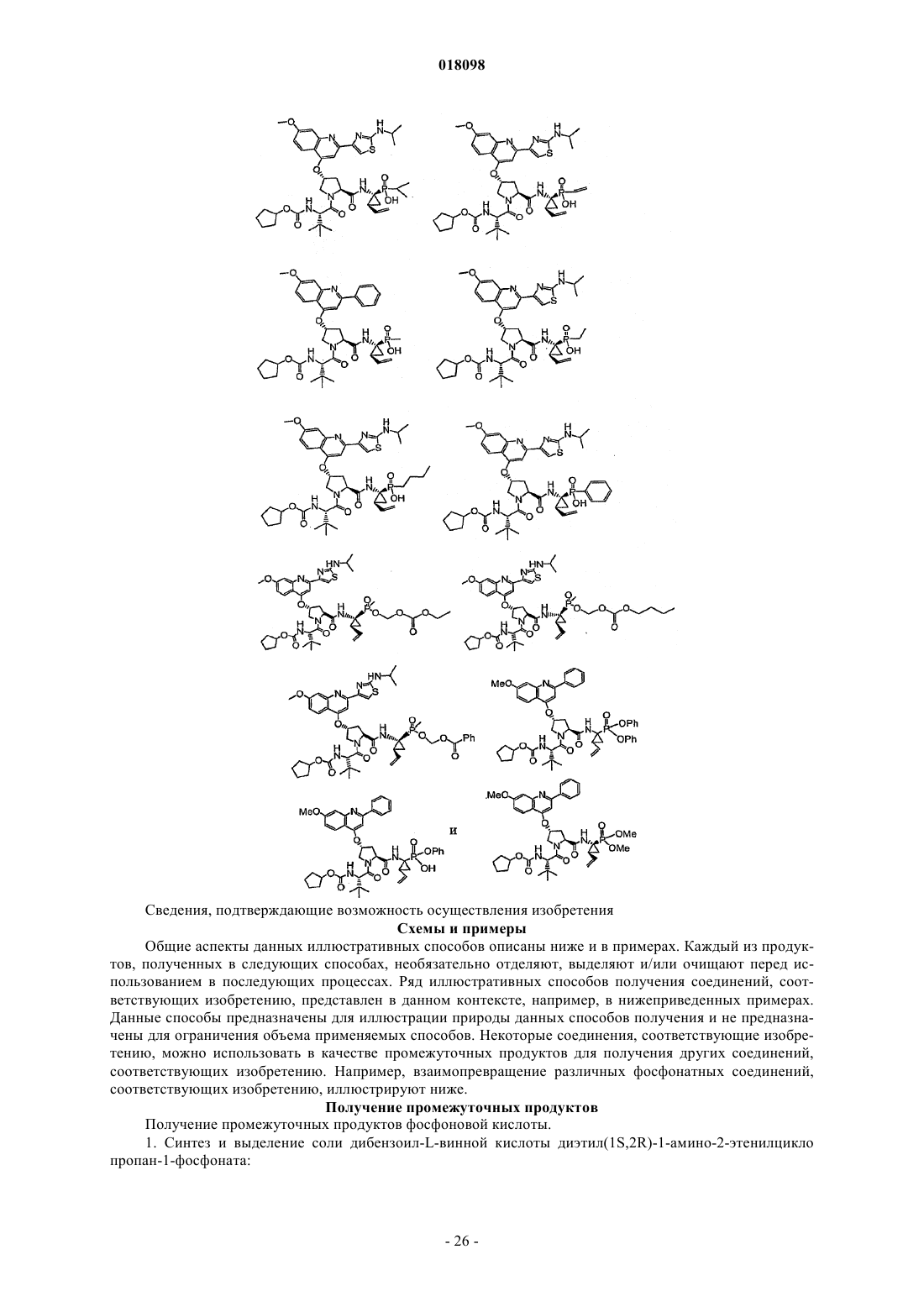
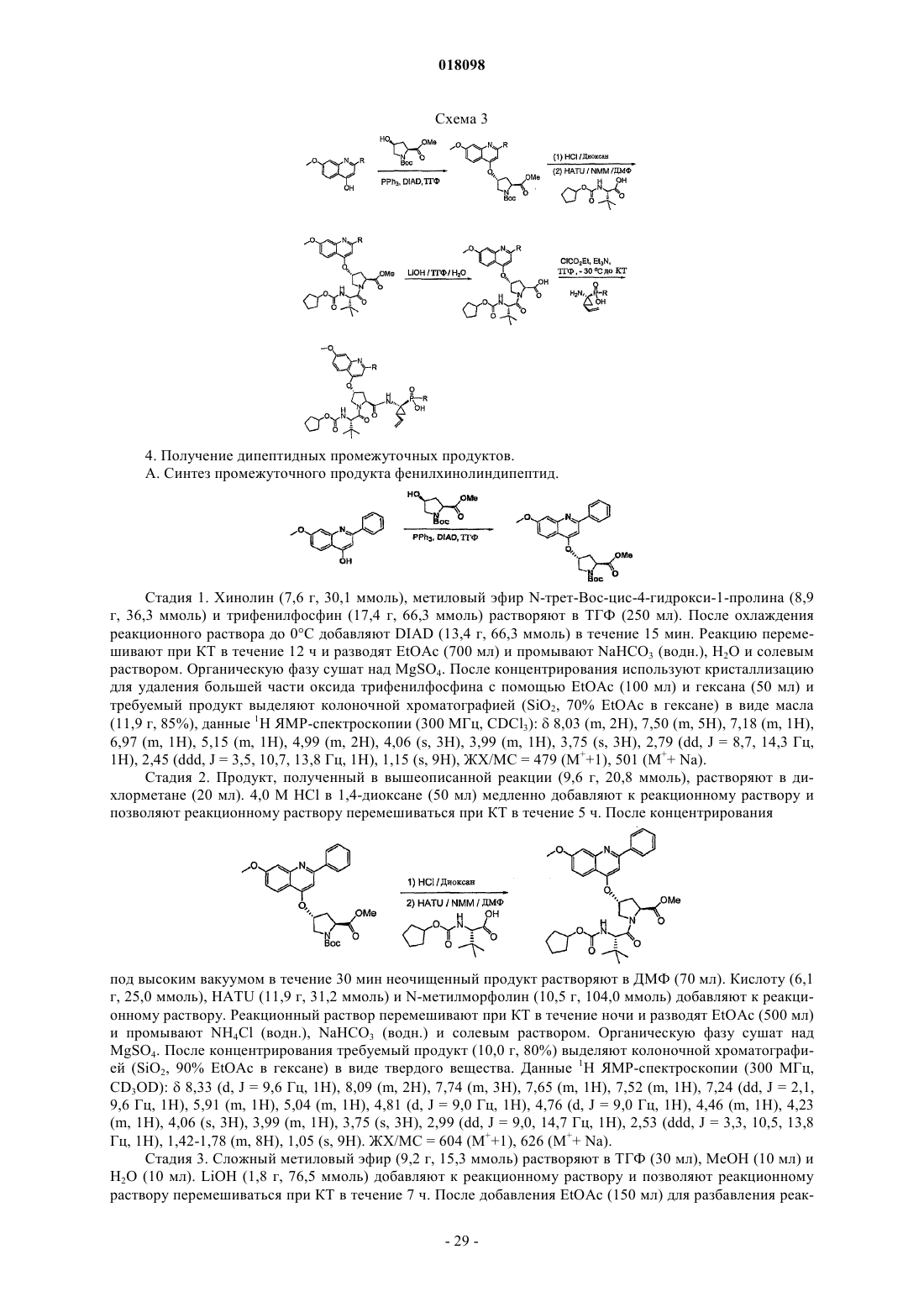
Фосфинатные соединения (варианты)
Номер патента: 18098
Опубликовано: 30.05.2013
Авторы: Фардис Мерайя, Деффлер Эдвард, Шэн Сяонин Ч., Кэсарез Энтони, Ван Цзяньин, Клэрк Майкл, Пюн Хюндзюн, Чо Исоп, Чадхэйри Клим, Ким Чанг Ю.
Формула / Реферат
1. Фосфинатные соединения формулы I
где R2 означает -C(O)OC1-С6алкил, -С(O)ОС3-С6циклоалкил, -С(O)С1-С6алкил, -С(O)С1-С6алкил, замещенный по меньшей мере одним заместителем, выбранным из группы заместителей, включающей галоген, аминогруппу, фенил, -С(O)СН2С3-С8циклоалкил, С6арил, необязательно замещенный заместителем, выбранным из группы заместителей, включающей С1-С6алкил и CF3, С3-С6-гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы гетероатомов, включающей N и S, необязательно замещенный С1-С6алкилом, -SO2-С1-С6алкил, необязательно замещенный по меньшей мере одним галогеном, -C(CH3)C=NH C1-С6алкил, необязательно замещенный по меньшей мере одним галогеном;
Y1 независимо представляет собой О;
Z представляет собой О;
Z1 означает
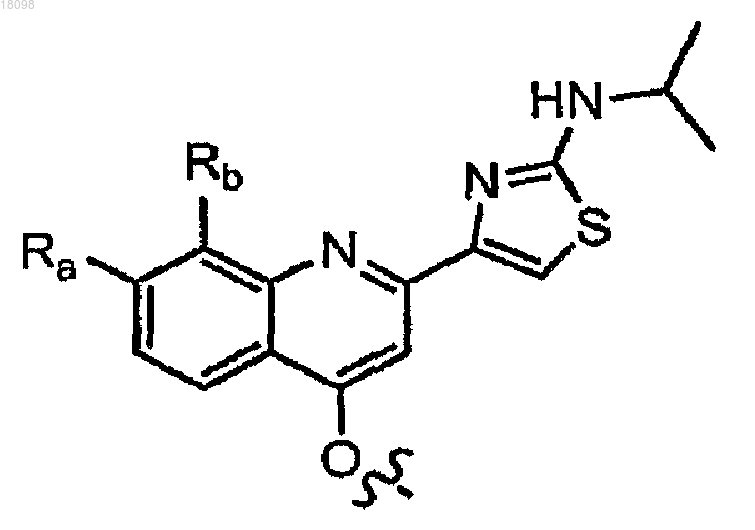
Ra представляет собой Н или (С1-6)алкокси;
Rb представляет собой Н, F, Cl, Br, I или (С1-6)алкил;
Z2b представляет собой Н, (С1-6)алкил, (С2-8)алкенил или (С2-8)алкинил;
Q1 представляет собой (С1-6)алкил, (С2-8)алкенил;
Z2a представляет собой Н; или
Q1 и Z2a вместе образуют необязательно замещенную С1-С6алкилом группу -(СН2)n-(СН=СН)m, где n=5-8, m=0-1, причем по меньшей мере одна из -СН2-групп может быть замещена по меньшей мере одной группой, выбранной из групп О, NH и -SO2-;
А3 представляет собой Н;
Rf представляет собой Н, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С6арил, С5-С6гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С3-С6циклоалкил;
Rf необязательно замещен по меньшей мере одним Rg;
каждое Rg независимо представляет собой гало, гидрокси, циано, С6арилтио, С3-С6циклоалкил, С6арил, С5-С6гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, С1-С6алкокси, NRhRi, -C(=O)NRhRi, где каждый арил и гетероарил необязательно замещены по меньшей мере одним С1-С6алкилом, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилом или галоС1-С6алкокси, и
каждый Rh и Ri независимо представляет собой Н, С1-С6алкил или С1-С6галоалкил;
или их фармацевтически приемлемая соль.
2. Соединения по п.1, в которых Z1 выбрано из группы, состоящей из
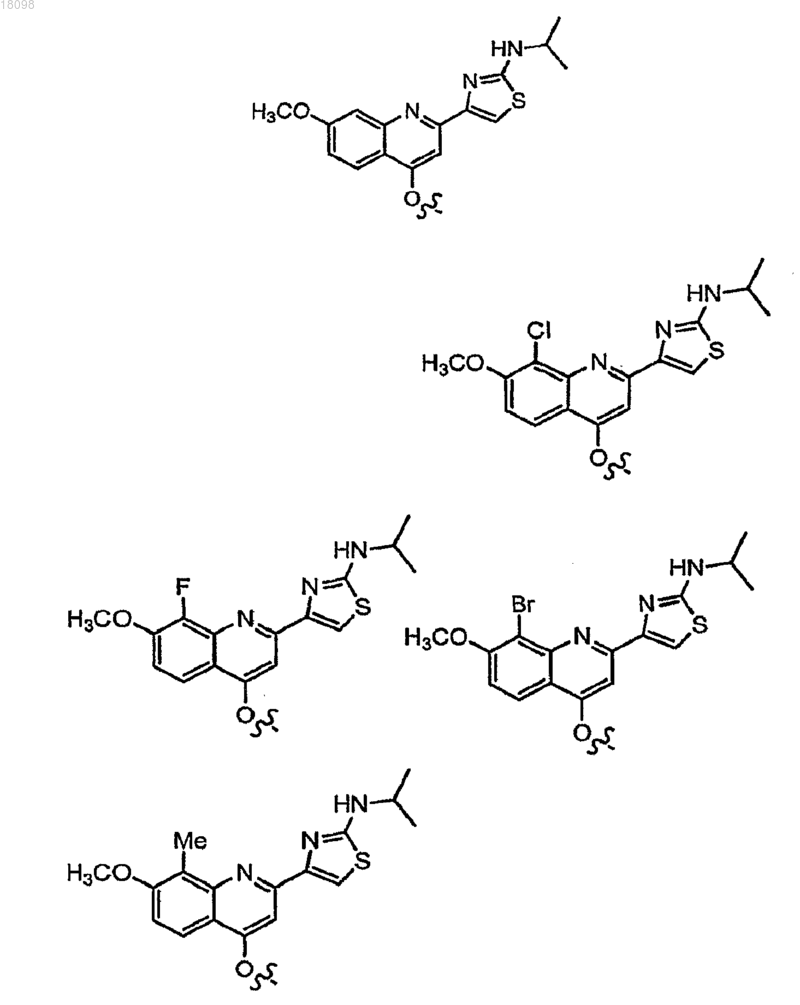
3. Соединения по п.1, в которыхм Rf представляет собой (С1-6)алкил, замещенный фенильным циклом, который необязательно замещен одним, двумя или тремя С1-С6алкилами, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилами или галоС1-С6алкокси.
4. Соединения по п.1, в которых Rf представляет собой бензил или фенетил, который необязательно замещен одним, двумя или тремя С1-С6алкилами, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилами или галоС1-С6алкокси.
5. Соединения по п.1, в которых Rf представляет собой Н, метил, этил, пропил, бутил, циклопропилметил, 3-бутенил, 2-метилпропил, изопропил, винил, цис-1-пропенил, транс-1-пропенил, цис-1-бутенил, 2-метилпропенил, 2-фенилвинил, 2-фенилетинил, 3-метил-2-бутенил, 2-гидроксиэтил, 2-гидрокси-2-метилпропил, цианометил, метоксиметил, N-(2,2,2-трифторэтил)-2-аминоэтил, фенетил, 2-хлорфенетил, 2-фторфенетил, 2-метилфенетил, 2-хлор-6-фторфенетил, фенилтиометил, бензил, 4-фторбензил, 3-фторбензил, 2-фторбензил, 4-цианобензил, 3-цианобензил, 2-цианобензил, 4-метоксибензил, 3-метоксибензил, 2-метоксибензил, 2-бромбензил, 2-трифторметоксибензил, 2-изопропоксибензил, 2-метилбензил, 3-метилбензил, 4-метилбензил, 2-этилбензил, 4-трифторметилбензил, 3-трифторметилбензил, 2-трифторметилбензил, 4-хлорбензил, 3-хлорбензил, 2-хлорбензил, 2,6-дифторбензил, 2-хлор-6-фторбензил, 2,6-дихлорбензил, 2-метокси-6-фторбензил, 2,6-диметилбензил, 2,6-дифтор-3-хлорбензил, 2,6-дифтор-4-хлорбензил, 2-хлор-3,6-дифторбензил, 2,3,6-трифторбензил, 3-хлор-2,4-дифторбензил, 2-хлор-3,6-дифторбензил, 2,3-дихлор-6-фторбензил, 2-нитробензил, 2-аминобензил, 2-тиенилметил, 2-фурилметил, 3-фурилметил, 5-трифторметилфур-2-илметил 5-пиразолилметил, 2-оксазолилметил, 4-метилтиазол-2-илметил, 3-пиридил, 2-пиридилметил, 3-гидрокси-2-пиридилметил, 6-хлор-2-пиридилметил, 2-пиразинилметил, 5-пиримидинилметил, 2-пиримидинилметил, 4-пиримидинилметил, фенил, 2-тиазолил, N,N-диметиламинокарбонилметил, N-метиламинокарбонилметил, аминокарбонилметил, 1-пропинил или 2-метилтиазол-4-илметил.
6. Соединения по п.1, охватываемые общей структурной формулой III
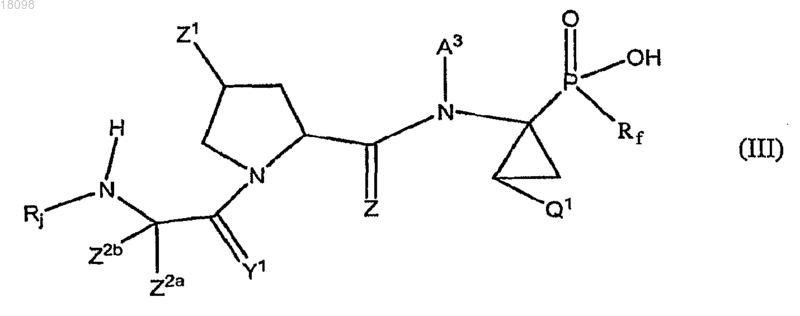
где Rj представляет собой циклопентилоксикарбонил, 1-[N-(2,2,2-трифторэтил)имино]этил, α,α-дифторфенетил, циклопентилацетил, бутаноил, 4,4,4-трифторбутаноил, 3,3,3-трифторпропилсульфонил, 3,3-диметилбутаноил, циклопентиламинокарбонил, 2-норборнанилацетил, 2-амино-3,3-диметилбутаноил, 4-метилфенил, 4-трифторметилфенил, 3-трифторметилфенил, 2-трифторметилфенил, 3,3,3-трифторпропаноил, 5,5,5-трифторпентаноил, трет-бутиламинокарбонил, 2,2-диметилпропоксикарбонил или 4-трет-бутилтиазол-2-ил,
и их фармацевтически приемлемые соли.
7. Соединения по п.1, охватываемые общей структурной формулой IX
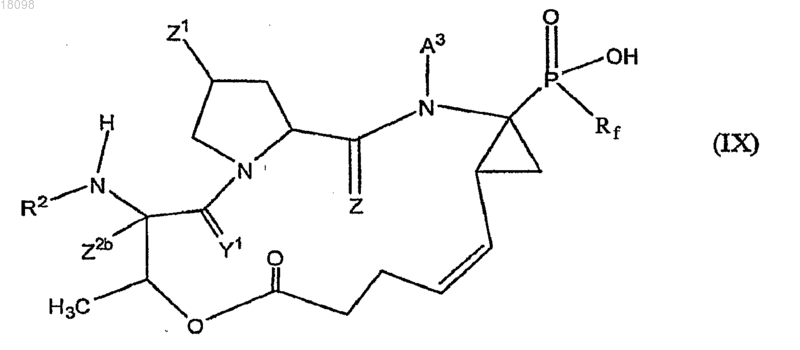
и их фармацевтически приемлемые соли.
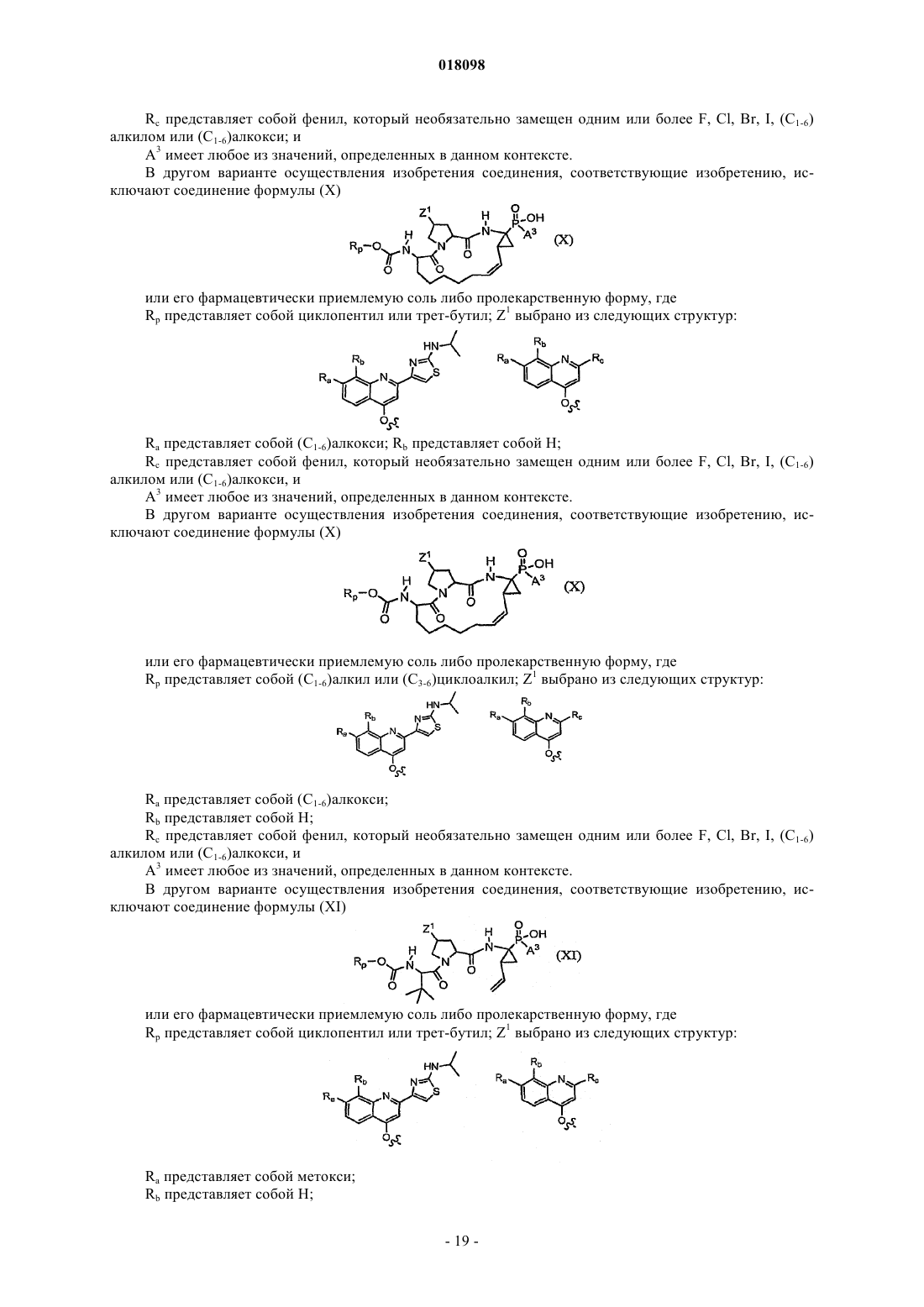
8. Соединения по п.1, охватываемые общей структурной формулой X
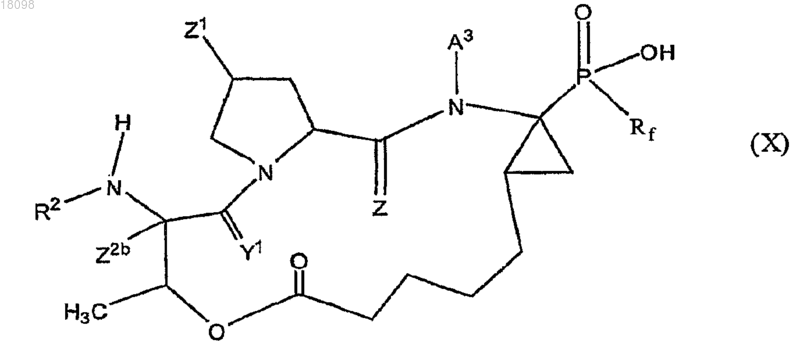
и их фармацевтически приемлемые соли.
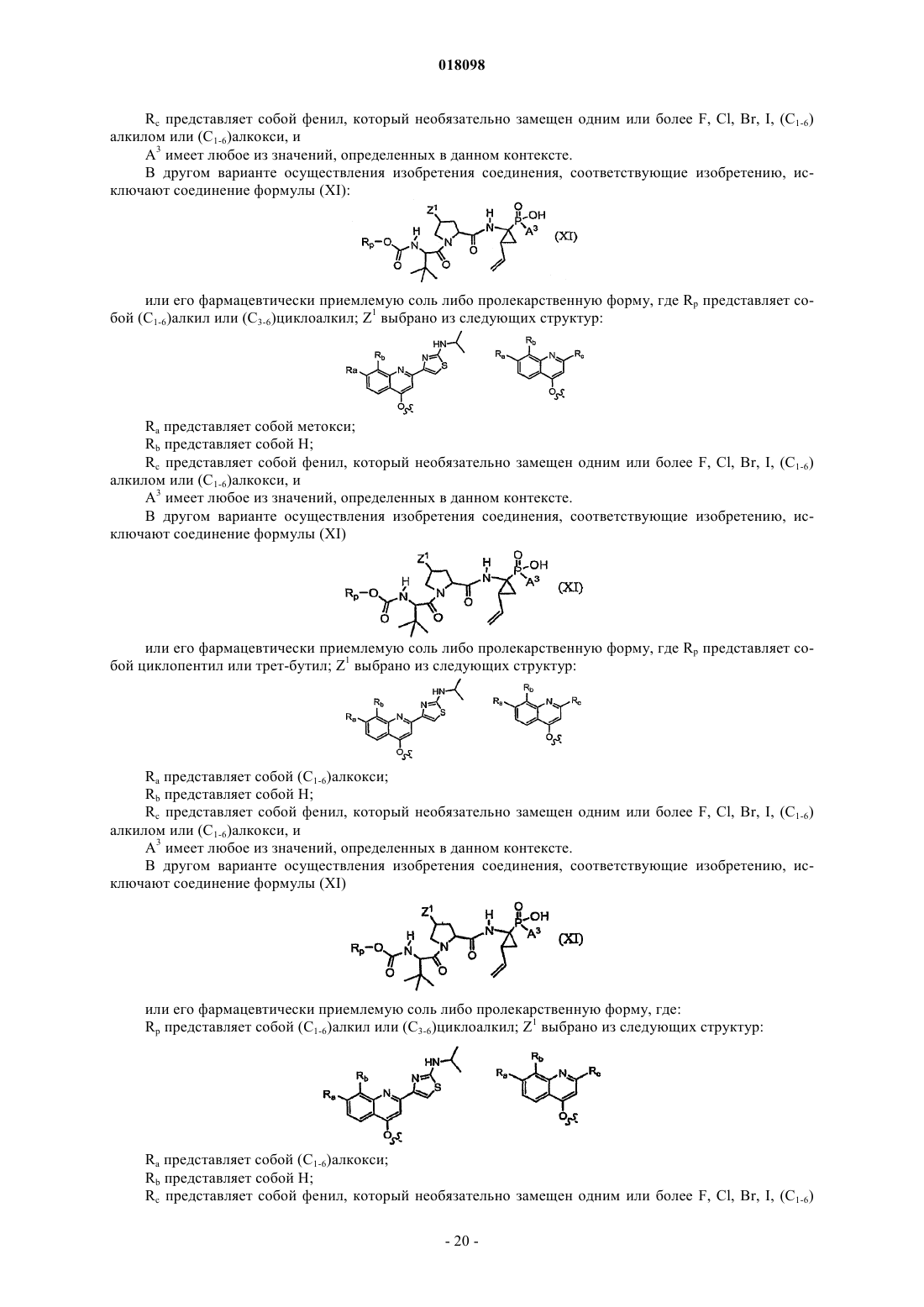
9. Соединения по п.1, охватываемые общей структурной формулой XI
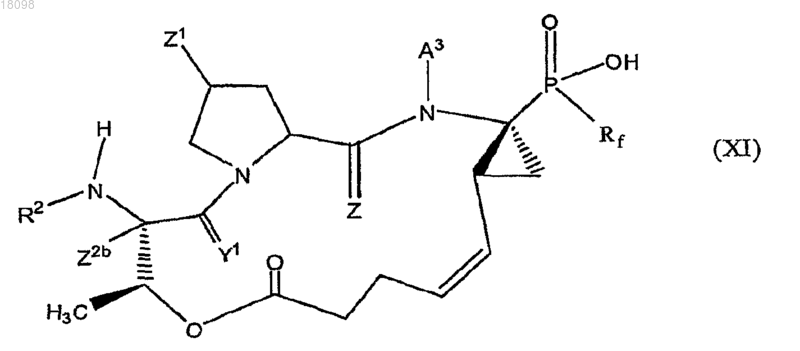
и их фармацевтически приемлемые соли или пролекарственные формы.
10. Соединения по п.1, охватываемые общей структурной формулой XII
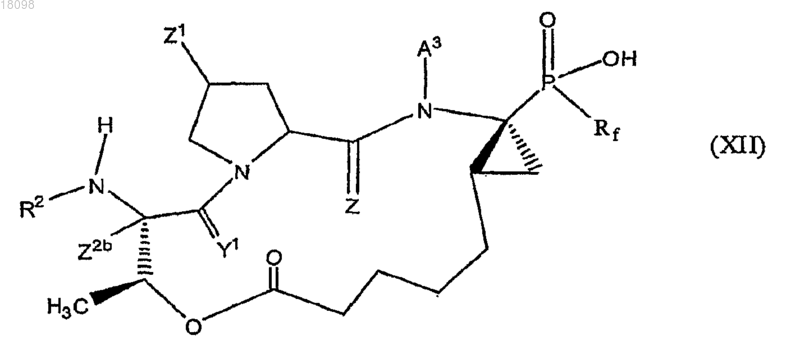
и их фармацевтически приемлемые соли.
11. Соединения по п.1, охватываемые общей структурной формулой XIII
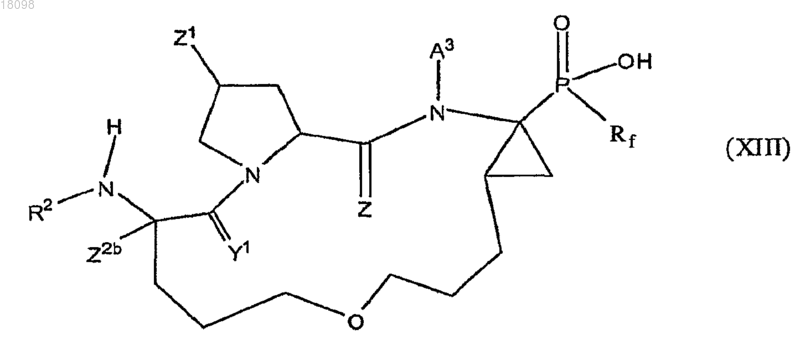
и их фармацевтически приемлемые соли.
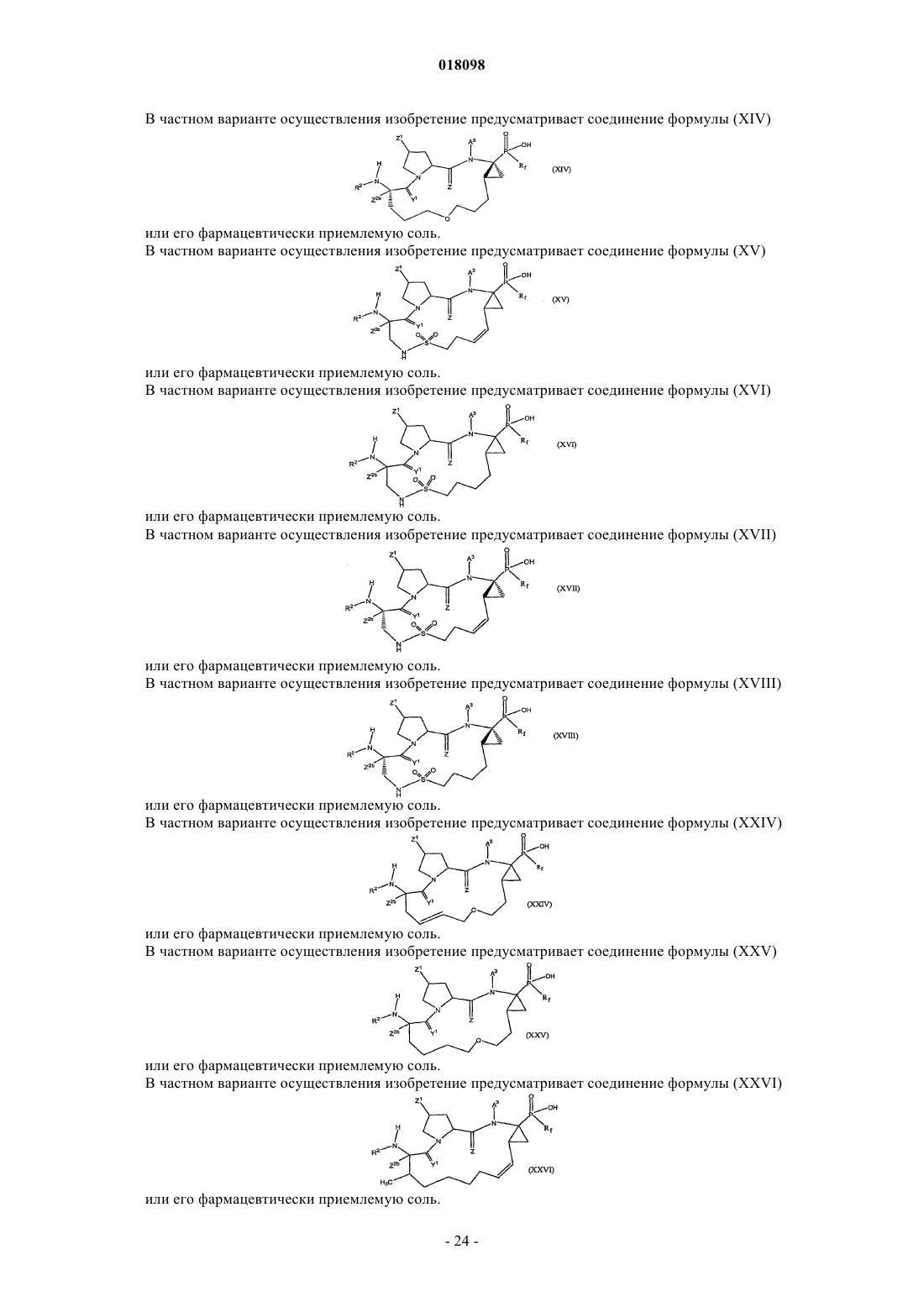
12. Соединения по п.1, охватываемые общей структурной формулой XIV
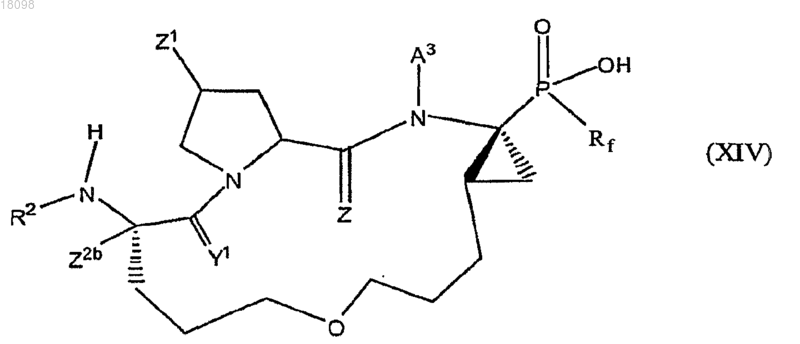
и их фармацевтически приемлемые соли.
13. Соединения по п.1, охватываемые общей структурной формулой IV
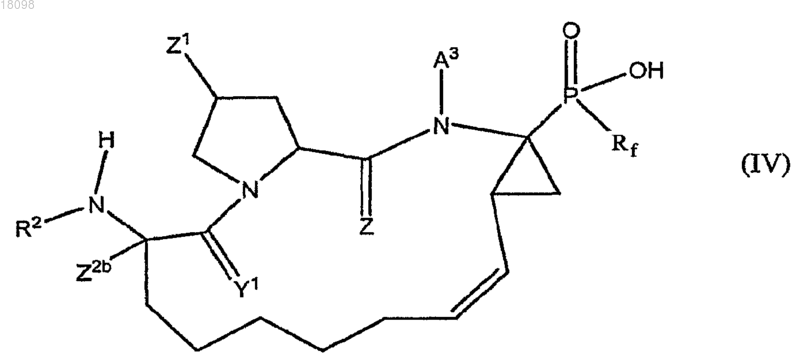
и их фармацевтически приемлемые соли.
14. Соединения по п.1, охватываемые общей структурной формулой V
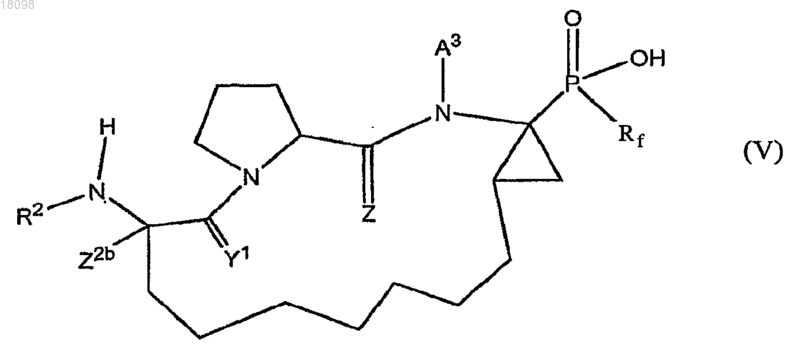
и их фармацевтически приемлемые соли.
15. Соединения по п.13, охватываемые общей структурной формулой VI
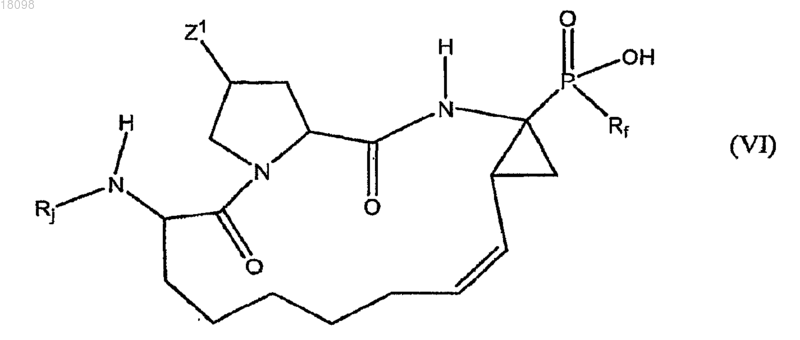
где Rj представляет собой циклопентилоксикарбонил, 1-[N-(2,2,2-трифторэтил)имино]этил, α,α-дифторфенетил, циклопентилацетил, бутаноил, 4,4,4-трифторбутаноил, 3,3,3-трифторпропилсульфонил, 3,3-диметилбутаноил, циклопентиламинокарбонил, 2-норборнанилацетил, 2-амино-3,3-диметилбутаноил, 4-метилфенил, 4-трифторметилфенил, 3-трифторметилфенил, 2-трифторметилфенил, 3,3,3-трифторпропаноил, 5,5,5-трифторпентаноил, трет-бутиламинокарбонил,2,2-диметилпропоксикарбонил или 4-трет-бутилтиазол-2-ил,
или их фармацевтически приемлемые соли.
16. Соединения по п.14, охватываемые общей структурной формулой VII
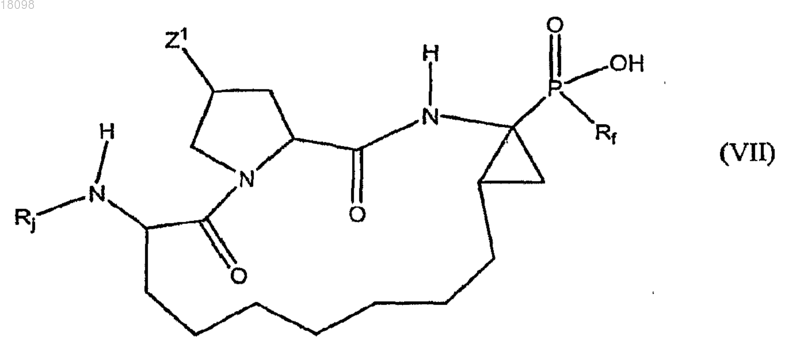
где Rj представляет собой циклопентилоксикарбонил, 1-[N-(2,2,2-трифторэтил)имино]этил, α,α-дифторфенетил, циклопентилацетил, бутаноил, 4,4,4-трифторбутаноил, 3,3,3-трифторпропилсульфонил, 3,3-диметилбутаноил, циклопентиламинокарбонил, 2-норборнанилацетил, 2-амино-3,3-диметилбутаноил, 4-метилфенил, 4-трифторметилфенил, 3-трифторметилфенил, 2-трифторметилфенил, 3,3,3-трифторпропаноил, 5,5,5-трифторпентаноил, трет-бутиламинокарбонил, 2,2-диметилпропоксикарбонил или 4-трет-бутилтиазол-2-ил,
или их фармацевтически приемлемые соли.
17. Соединения по п.1, охватываемые общей структурной формулой XV

и их фармацевтически приемлемые соли.
18. Соединения по п.1, охватываемые общей структурной формулой XVI
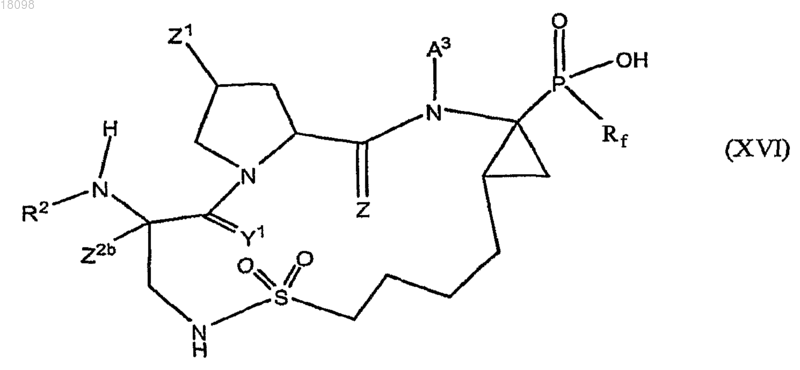
и их фармацевтически приемлемые соли.
19. Соединения по п.1, охватываемые общей структурной формулой XVII
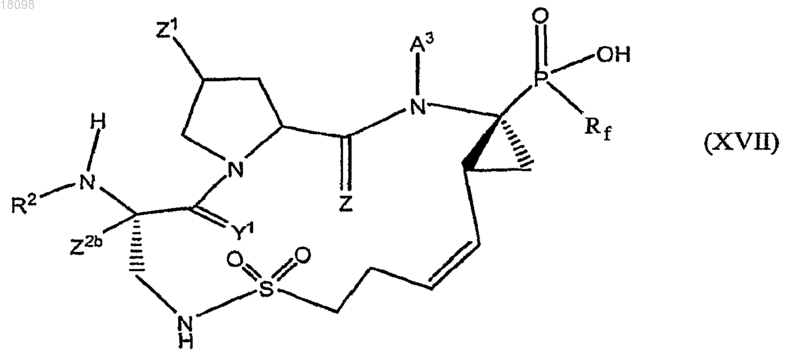
и их фармацевтически приемлемые соли.
20. Соединения по п.1, охватываемые общей структурной формулой XVIII
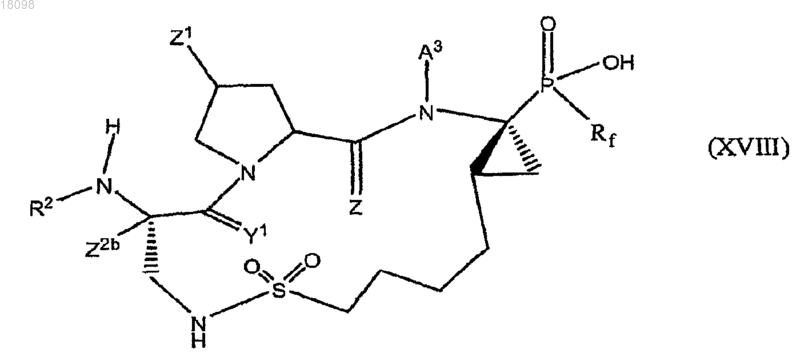
и его фармацевтически приемлемую соль.
21. Соединения по п.1, охватываемые общей структурной формулой XIX
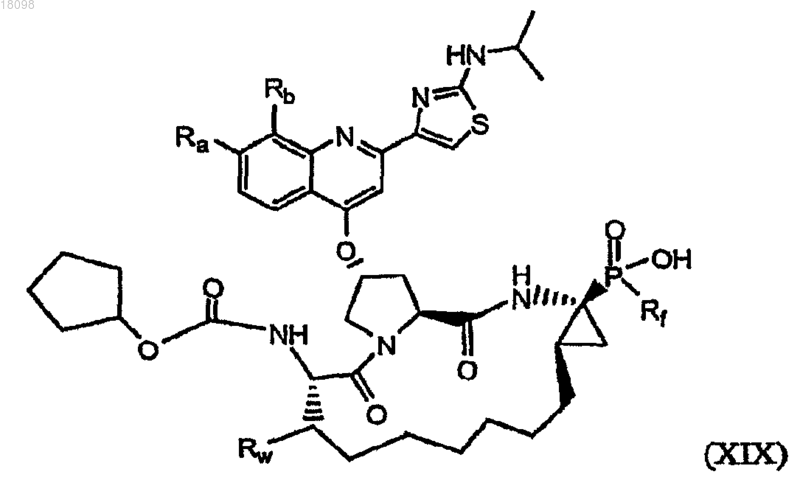
где Ra представляет собой Н или (С1-6)алкокси;
Rb представляет собой Н, F, Cl, Br, I или (С1-6)алкил;
Rf представляет собой С1-С6алкил, который замещен С6арилом, который необязательно замещен по меньшей мере одним С1-С6алкилом, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, гaлoC1-С6алкилом или галоС1-С6алкокси, и
Rw представляет собой Н или (С1-6)алкил,
и их фармацевтически приемлемые соли.
22. Соединения по п.1, охватываемые общей структурной формулой XX
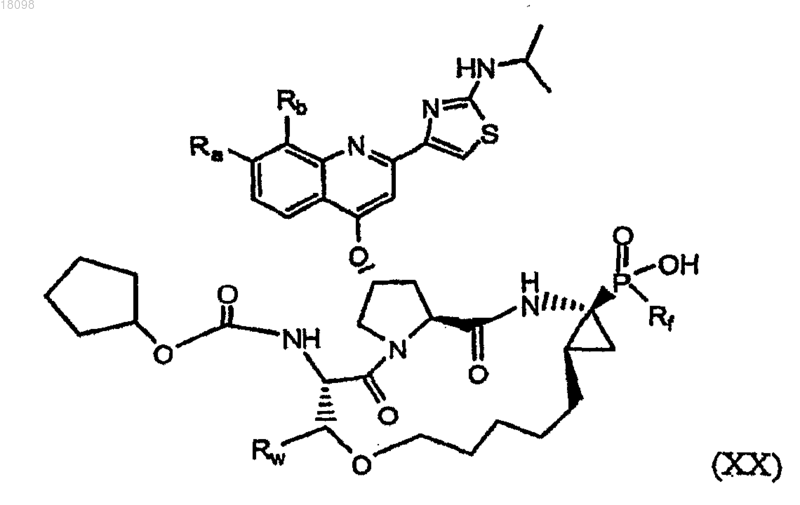
где Ra представляет собой Н или (С1-6)алкокси;
Rb представляет собой Н, F, Cl, Br, I или (С1-6)алкил;
Rf представляет собой С1-С6алкил, который замещен С6арилом, который необязательно замещен по меньшей мере одним или более С1-С6алкилом, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилом или галоС1-С6алкокси, и Rw представляет собой Н или (С1-6)алкил,
и их фармацевтически приемлемые соли.
23. Соединения по п.21 или 22, в которых Ra представляет собой (С1-6)алкокси.
24. Соединения по п.21 или 22, в которых Ra представляет собой метокси.
25. Соединения по п.21, в которых Rb представляет собой Н, F, Cl, Br, I или (С1-6)алкил.
26. Соединения по п.21, в которых Rb представляет собой Н.
27. Соединения по п.21, в которых Rb представляет собой F, Cl, Br или I.
28. Соединения по п.21, в которых Rb представляет собой Cl.
29. Соединения по п.21, в которых Rb представляет собой (С1-6)алкил.
30. Соединения по п.21, в которых Rf представляет собой (С1-6)алкил, замещенный фенильным циклом, который необязательно замещен одним, двумя или тремя С1-С6алкилами, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилами или галоС1-С6алкокси.
31. Соединения по п.21, в которых Rf представляет собой бензил или фенетил, который необязательно замещен одним, двумя или тремя С1-С6алкилами, гало, гидрокси, циано, нитро, амино, С1-С6алкокси, галоС1-С6алкилами или галоС1-С6алкокси.
32. Соединения по п. 21, в которых Rf представляет собой 2,6-дифторбензил.
33. Соединения по п.21, в которых Rw представляет собой метил.
34. Соединения по п.21, в которых Rw представляет собой водород.
35. Фосфинатное соединение, охватываемое структурной формулой XXI
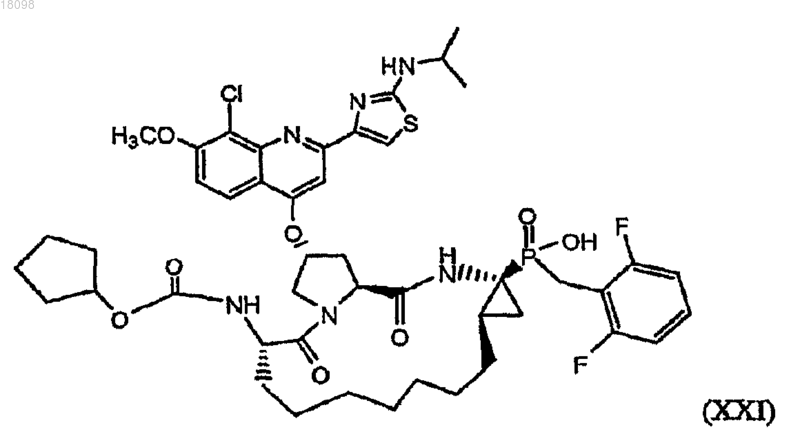
и его фармацевтически приемлемые соли.
36. Фосфинатное соединение, охватываемое структурной формулой XXII
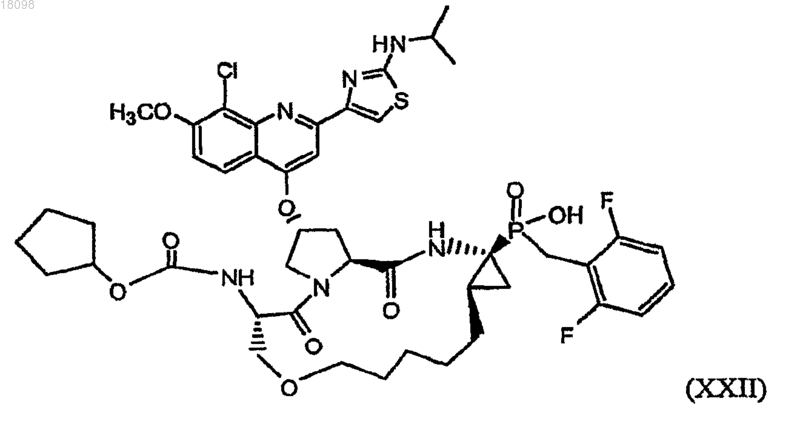
и его фармацевтически приемлемые соли.
37. Фосфинатное соединение, охватываемое структурной формулой XXIII
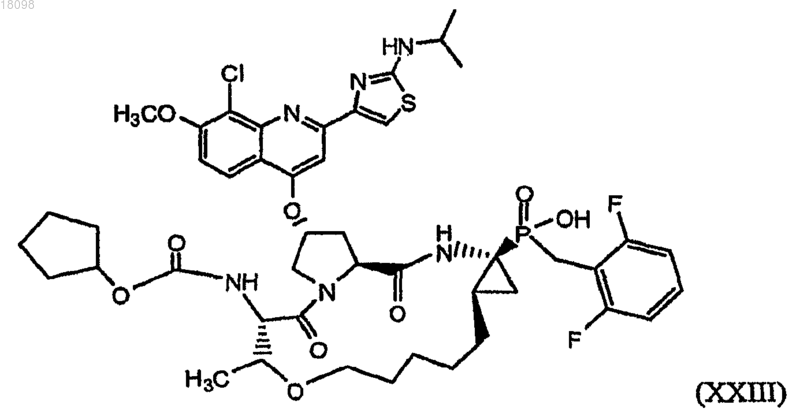
и его фармацевтически приемлемые соли.
38. Соединения по п.1, охватываемые общей структурной формулой XXIV
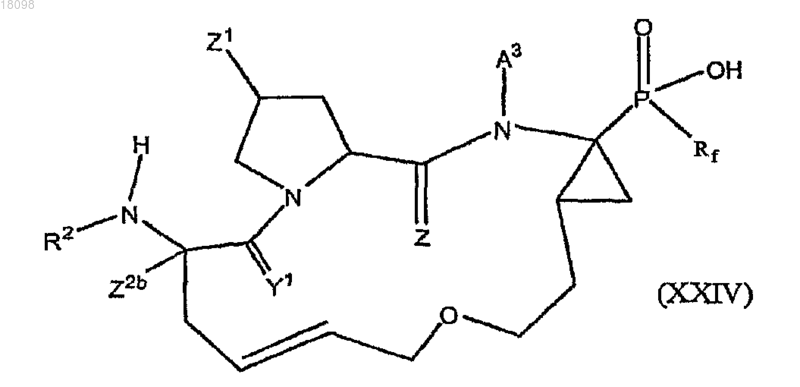
и их фармацевтически приемлемые соли.
39. Соединения по п.1, охватываемые общей структурной формулой XXV
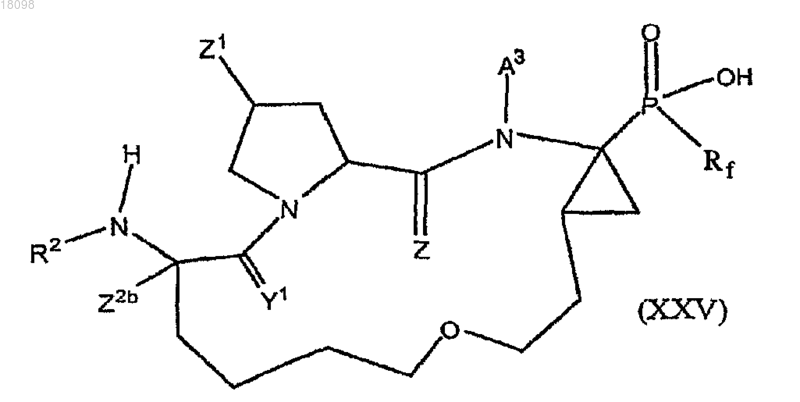
и их фармацевтически приемлемые соли.
40. Соединение по п.1, охватываемые общей структурной формулой XXVI
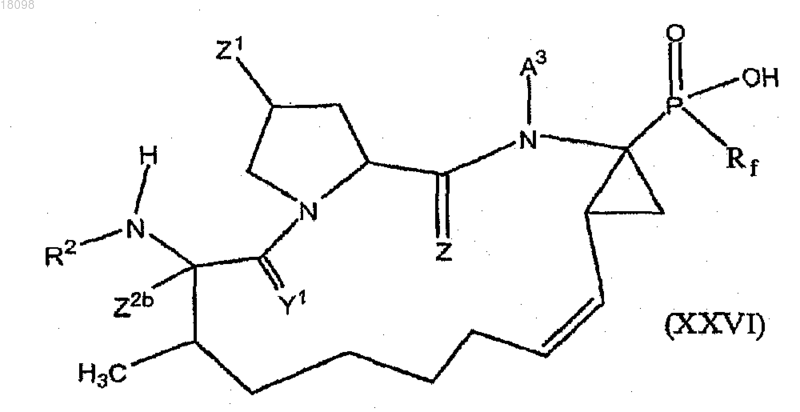
и их фармацевтически приемлемые соли.
Текст
Изобретение относится к противовирусным фосфинатным соединениям общей структурной формулы I где R2 означает -С(O)ОС 1-С 6 алкил, -С(O)ОС 3-С 6 циклоалкил, -С(O)С 1-С 6 алкил, -С(O)С 1-С 6 алкил,замещенный по меньшей мере одним заместителем, выбранным из группы заместителей,включающей галоген, аминогруппу, фенил, -С(O)СН 2 С 3-С 8 циклоалкил, С 6 арил, необязательно замещенный заместителем, выбранным из группы заместителей, включающей С 1-С 6 алкил и CF3,С 3-С 6 гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы гетероатомов,включающей N и S, необязательно замещенный С 1-С 6 алкилом, -SO2-С 1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном, -С(СН 3)С=NHC1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном; Y1 независимо представляет собой О; Z представляет собой О; Z2b представляет собой Н, (С 1-6)алкил, (С 2-8)алкенил или (С 2-8)алкинил; Область техники, к которой относится изобретение Изобретение относится в основном к фосфинатным соединениям с активностью ингибирования вируса гепатита С (ВГС). Сведения о предшествующем уровне техники Гепатит С считают хронической вирусной болезнью печени, которая характеризуется заболеванием печени. Хотя лекарственные препараты, направленные на печень, широко применяют и демонстрируют эффективность, токсичность и другие побочные эффекты ограничивают их применение. Ингибиторы ВГС (вируса гепатита С) используют для ограничения появления и развития инфекции ВГС, а также в диагностических анализах на ВГС. Все еще существует необходимость в новых факторах лечения ВГС. Сущность изобретения В одном варианте осуществления изобретение предусматривает соединение формулы I или его фармацевтически приемлемую соль, гдеR2 означает -С(O)ОС 1-С 6 алкил, -С(O)ОС 3-С 6 циклоалкил, -С(O)С 1-С 6 алкил, -С(O)С 1-С 6 алкил, замещенный по меньшей мере одним заместителем, выбранным из группы заместителей, включающей галоген, аминогруппу, фенил, -С(O)СН 2 С 3-С 8 циклоалкил, С 6 арил, необязательно замещенный заместителем,выбранным из группы заместителей, включающей С 1-С 6 алкил и CF3, С 3-С 6-гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы гетероатомов, включающей N и S, необязательно замещенный С 1-С 6 алкилом, -SO2-С 1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном,-С(СН 3)С=NHC1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном;Q1 представляет собой (С 1-8)алкил, (С 2-8)алкенил, либо Q1 и Z2a вместе образуют необязательно замещенную С 1-С 6 алкилом группу -(СН 2)n-(СН=СН)m, где n=5-8, m=0-1, причем по меньшей мере одна из-СН 2- групп может быть замещена по меньшей мере одной группой, выбранной из групп О, NH и -SO2-; А 3 представляет собой Н;Rf представляет собой Н, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С 3 С 6 циклоалкил;Rf необязательно замещен по меньшей мере одним Rg; каждое Rg независимо представляет собой гало, гидрокси, циано, С 6 арилтио, С 3-С 6 циклоалкил,С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов,включающей N, О и S, С 1-С 6 алкокси, NRhRi, -C(=O)NRhRi, где каждый арил и гетероарил необязательно замещены по меньшей мере одним С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси,галоС 1-С 6 алкилом или галоС 1-С 6 алкокси, и каждый Rh и Ri независимо представляет собой Н, С 1-С 6 алкил или С 1-С 6 галоалкил. Настоящее изобретение предусматривает также фармацевтическую композицию, включающую соединение, соответствующее изобретению, и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение предусматривает также фармацевтическую композицию, предназначенную для применения при лечении нарушений, ассоциированных с ВГС.-1 018098 Настоящее изобретение предусматривает также фармацевтическую композицию, дополнительно включающую аналог нуклеозида. Настоящее изобретение предусматривает также фармацевтическую композицию, дополнительно включающую интерферон или пегилированный интерферон. Настоящее изобретение предусматривает также фармацевтическую композицию, в которой указанный аналог нуклеозида выбран из рибавирина, вирамидина, леворина, L-нуклеозида и изаторибина, и указанный интерферон представляет собой -интерферон или пегилированный интерферон. Настоящее изобретение предусматривает также способ лечения нарушений, ассоциированных с гепатитом С, причем указанный способ включает введение пациенту фармацевтической композиции, которая включает в себя терапевтически эффективное количество соединения, соответствующего изобретению. Настоящее изобретение предусматривает также способ ингибирования ВГС, включающий введение млекопитающему, пораженному состоянием, ассоциированным с активностью ВГС, количества соединения, соответствующего изобретению, эффективного для того, чтобы ингибировать ВГС. Настоящее изобретение предусматривает также соединение, соответствующее изобретению, предназначенное для лечения (предпочтительно для применения при ингибировании ВГС или лечения состояния, ассоциированного с активностью ВГС), а также применение соединения, соответствующего изобретению, для изготовления лекарственного средства, используемого для ингибирования ВГС или лечения состояния, ассоциированного с активностью ВГС у млекопитающего. Настоящее изобретение предусматривает также способы синтеза и новые промежуточные продукты, раскрытые в данном контексте, которые используют для получения соединений по изобретению. Некоторые из соединений по изобретению используют для получения других соединений по изобретению. В другом аспекте изобретение предусматривает способ ингибирования активности ВГС в образце,включающий обработку образца изобретенным соединением. В одном варианте осуществления изобретение предусматривает соединение, обладающее улучшенными ингибирующими или фармакокинетическими свойствами, включая повышенную активность в отношении развития устойчивости вируса, улучшенную биодоступность при пероральном применении,более высокую активность или пролонгированный эффективный период полураспада in vivo. Некоторые соединения по изобретению могут иметь меньше побочных эффектов, менее сложные схемы дозирования или являться активными при пероральном введении. Ниже будут подробно описаны варианты осуществления изобретения, [конкретные] примеры [воплощений] которого проиллюстрированы в сопровождающих структурах и формулах. Хотя изобретение будет описано во взаимосвязи с многочисленными вариантами осуществления, следует иметь в виду, что они не предназначены для ограничения изобретения данными вариантами осуществления. Напротив, по замыслу изобретение охватывает все альтернативные варианты, модификации и эквивалентные решения,которые могут быть включены в объем настоящего изобретения, как определено в вариантах осуществления. Соединения, соответствующие изобретению Соединения, соответствующие изобретению, исключают соединения, известные ранее. Однако в изобретение входит применение соединений, о которых ранее не было известно, что они обладают противовирусными свойствами для противовирусных целей (например, для получения противовирусного эффекта у животного). Касательно Соединенных Штатов Америки соединения или композиции, приведенные в данном контексте, исключают соединения, которые предусматриваются по 35 USC (Свод законов США) 102 или которые очевидны в смысле 35 USC 103. Когда соединение, описанное в данном контексте, является замещенным больше чем одной из тех же указанных групп, например, "R1" или "А 3", то следует иметь в виду, что группы могут быть одинаковыми или различными, т.е. каждую группу выбирают независимо."Алкил" представляет собой С 1-С 18 углеводород, включающий нормальные, вторичные, третичные или циклические атомы углерода. Примерами являются метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил"Алкенил" представляет собой С 2-С 18 углеводород, включающий нормальные, вторичные, третичные или циклические атомы углерода по меньшей мере с одним центром ненасыщенности, т.е. угерод-2 018098 углеродную sp2-двойную связь. Примеры включают, но без ограничения перечисленным, этилен или винил (-СН=СН 2), аллил (-СН 2 СН=СН 2), циклопентенил (-С 5 Н 7) и 5-гексенил (-СН 2 СН 2 СН 2 СН 2 СН=СН 2)."Алкинил" представляет собой С 2-С 18 углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода по меньшей мере с одним центром ненасыщенности, т.е. углеродуглеродной sp-тройной связью. Примеры включают, но без ограничения перечисленным, ацетилен(-ССН) и пропаргил (-СН 2 ССН). Термин "алкилен" относится к насыщенному, имеющему разветвленную или неразветвленную цепь или циклическому углеводородному радикалу из 1-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкана. Типичные алкиленовые радикалы включают, но без ограничения перечисленным, метилен (-СН 2-) 1,2-этил (-СН 2 СН 2-), 1,3-пропил (-СН 2 СН 2 СН 2-), 1,4-бутил(-СН 2 СН 2 СН 2 СН 2-) и т.п. Термин "алкенилен" относится к ненасыщенному, имеющему разветвленную или неразветвленную цепь или циклическому углеводородному радикалу из 2-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкена. Типичные алкениленовые радикалы включают, но без ограничения перечисленным, 1,2-этилен (-СН=СН-). Термин "алкинилен" относится к ненасыщенному, имеющему разветвленную или неразветвленную цепь или циклическому углеводородному радикалу из 2-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкина. Типичные алкиниленовые радикалы включают, но без ограничения перечисленным, ацетилен (-СС-), пропаргил (-СН 2 С=С-) и 4-пентинил (-СН 2 СН 2 СН 2 С СН-)."Арил"означает одновалентный ароматический углеводородный радикал из 6-20 атомов углерода,полученный путем удаления одного атома водорода от одного атома углерода исходной ароматической циклической системы. Типичные арильные группы включают, но без ограничения перечисленным, радикалы, полученные из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п. Термин "арилалкил" относится к нециклическому алкильному радикалу, в котором один из атомов водорода, связанный с атомом углерода, как правило, концевым или sp3 атомом углерода, замещен арильным радикалом. Типичные арилалкильные группы включают, но без ограничения перечисленным,бензил, 2-фенилэтан-1-ил, нафтилметил, 2-нафтилэтан-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа включает 6-20 атомов углерода, например, алкильную часть, включающую алканильную, алкенильную или алкинильную группы арилалкильной группы из 1-6 атомов углерода и арильную часть из 5-14 атомов углерода. Термины "замещенный алкил", "замещенный арил" и "замещенный арилалкил" означают алкил,арил и арилалкил соответственно, в которых каждый из одного или более атомов водорода независимо друг от друга замещены неводородным заместителем. Типичные заместители включают, но без ограничения перечисленным, -X, -R, -О-, -OR, -SR, -S-, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O,-NCS, -NO, -NO2, =N2, -N3, NC(=O)R, -C(=O)R, -C(=O)NRR, -S(=O)2O-, -S(=O)2OH, -S(=O)2R,-OS(=O)2OR, -S(=O)2NR, -SC(=O)R, -OP(=O)O2RR, -P(=O)O2RR, -P(=O)(O-)2, -P(=O)(OH)2, -C(=O)R,-C(=O)X, -C(S)R, -C(O)OR, -C(O)O-, -C(S)OR, -C(O)SR, -C(S)SR, -C(O)NRR, -C(S)NRR, -C(NR)NRR, где каждое Х независимо друг от друга представляет собой галоген: F, Cl, Br или I и каждое R независимо друг от друга представляет собой галоген -Н, алкил, арил, гетероцикл, защитную группу или структуру пролекарственной формы. Алкиленовая, алкениленовая и алкиниленовая группы могут быть также аналогичным образом замещенными."Гетероцикл", как используют в данном контексте, включает в качестве примера, а не ограничения те гетероциклы, которые описаны в монографиях Paquette, Leo A.; Principles of Modern HeterocyclicChemistry (Принципы современной химии гетероциклов) CW.A. Benjamin, New York, 1968), особенно главы 1, 3, 4, 6, 7 и 9; The Chemistry of Heterocyclic Compounds. A Series of Monographs (Химия гетероциклических соединений. Серия монографий) (John WileySons, New York, 1950 до настоящего времени), в частности, т.т. 13, 14, 16, 19 и 28, и J. Am. Chem. Soc. (1960) 82:5566. В одном специальном варианте осуществления изобретения термин "гетероцикл" включает "углеродный цикл", как определено в данном контексте, в котором один или более (например 1, 2, 3 или 4) атомов углерода замещены гетероатомом (например, О, N или S). Примеры гетероциклов включают в качестве примера, а не ограничения пиридил, дигидропиридил,тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тионафталенил, индолил, индоленил, хинолинил, изохинилинил, бензимидазолил, пиперидинил, 4 пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил,тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6 Н-1,2,5 триадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксан-3 018098 тенил, феноксатинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил,изоиндолил, 3 Н-индолил, 1 Н-индазолил, пуринил, 4 Н-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4 Н-карбазолил, карбазолил, -карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил,изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил,индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил, изатиноил и бис-тетрагидрофуранил: В качестве примера, а не ограничения, углеродсвязанные гетероциклы связаны в положении 2, 3, 4,5 или 6 приридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, в положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена,пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3,4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Еще более типично, когда углеродсвязанные гетероциклы включают 2-пиридил, 3-пиридил, 4-пиридил, 5 пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4 пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2 тиазолил, 4-тиазолил или 5-тиазолил. В качестве примера, а не ограничения, азотсвязанные гетероциклы связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2 пирролина, 3-пирролина, имидазола, имидазолидина, 2 имидазолина, 3-имидазолина, пиразола, пиразолона, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1 Н-индазола, в положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или -карболина. Еще более типично азотсвязанные гетероциклы включают 1 азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил. Термин "углеродный цикл" относится к насыщенному, ненасыщенному или ароматическому циклу,имеющему до приблизительно 25 атомов углерода. Как правило, углеродный цикл имеет приблизительно 3-7 атомов углерода в качестве моноцикла, приблизительно 7-12 атомов углерода в качестве бицикла и до приблизительно 25 атомов углерода в качестве полицикла. Моноциклические углеродные циклы, как правило, имеют 3-6 атомов цикла, еще более типично 5-6 атомов цикла. Бициклические углеродные циклы, как правило, имеют 7-12 атомов цикла, например, организованные как бицикло [4,5], [5,5], [5,6] или[6,6] система, или 9 либо 10 атомов цикла, организованные как бицикло [5,6] или [6,6] система. Термин углеродный цикл включает "циклоалкил", который является насыщенным или ненасыщенным углеродным циклом. Примеры моноциклических углеродных циклов включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1 енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, фенил, спирил и нафтил. Когда Q1 и Z2a, взятые совместно с атомами, к которым они присоединены, образуют гетероцикл, гетероцикл, образованный Q1 и Z2a, взятыми совместно с атомами, к которым они присоединены, может, как правило, включать приблизительно 25 атомов. Термин "хиральный" относится к молекулам, которые обладают свойством неналожения зеркального партнера, тогда как термин "нехиральный" относится к молекулам, которые накладываются на своего зеркального партнера. Термин "стереоизомеры" относится к соединениям, которые имеют идентичное химическое строение, но различаются расположением атомов или групп в пространстве. Термин "диастереомер" относится к стереоизомеру с двумя или более центрами хиральности и чьи молекулы не являются зеркальными изображениями друг друга. Диастереомеры обладают различными физическими свойствами, например температурами плавления, температурами кипения, спектральными свойствами и реакционоспособностью. Смеси диастереомеров можно разделить аналитическими способами высокого разрешения, такими как электрофорез и хроматография. Термин "энантиомеры" относится к двум стереоизомерам соединения, которые представляют собой ненакладывающиеся зеркальные изображения друг друга. Термин "лечение" или "курс лечения" в той степени, в которой он относится к заболеванию или состоянию, включает предупреждение возникновения заболевания или состояния, подавление заболевания или состояния, устранение заболевания или состояния и/или облегчения одного или более симптомов заболевания или состояния. Термин "PRT" выбран из терминов "структура пролекарственной формы" и "защитная группа", как определено в данном контексте. Стереохимические определения и условные обозначения, используемые в данном контексте, в основном соответствуют приведенным в словаре под ред. S.P. Parker, McGraw-Hill Dictionary of ChemicalEliel, E. and Wilen, S., Stereochemistry of Organic Compounds (Стереохимия органических соединений),(1994) John WileySons, Inc., New York. Многие органические соединения находятся в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. В описании оптически активного соединения используют приставки D и L или R и S для обозначения абсолютной конфигурации молекулы в отношении ее хирального центра(ов). Приставки d и I или (+) и (-) используют для обозначения знака вращения соединением плоскополяризованного света, при этом (-) или I означают, что соединение является левовращающим. Соединение, обозначаемое приставкой (+) или d, является правовращающим. Для заданной химической структуры данные стереоизомеры являются идентичными за исключением того, что они являются зеркальными изображениями друг друга. Специфический стереоизомер можно также обозначить как энантиомер, и смесь данных изомеров что называют энантиомерной смесью. Смесь 50:50 энатиомеров называют рацемической смесью или рацематом,она может существовать при отсутствии стереоселективности или стереоспецифичности химической реакции или процесса. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных структур, лишенной оптической активности. Изобретение включает все стереоизомеры соединений, описанных в данном контексте. Пролекарственные формы Термин "пролекарственная форма", как используют в данном контексте, относится к любому соединению, которое при введении в биологическую систему генерирует лекарственную субстанцию, т.е. активный ингредиент как результат спонтанной химической реакции(ий), катализируемой ферментом химический реакции(ий), фотолиза и/или метаболической химической реакции(ий). Пролекарственная форма, таким образом, представляет собой ковалентно модифицированный аналог или скрытую форму терапевтически активного соединения. Термин "структура пролекарственной формы" относится к лабильной функциональной группе, которая отделяется от активного ингибирующего соединения в процессе метаболизма, системно, внутри клетки, посредством гидролиза, ферментного расщепления или путем какого-либо другого процесса (см. работы Bundgaard, Hans, "Design and Application of Prodrugs" (Создание и применение пролекарственных форм" в A Textbook of Drug Design and Development (Руководство по созданию и разработке лекарственных препаратов), (1991), под ред. P. Krogsgaard-Larsen and H. Bundgaard, Harwood Academic Publishers,стр. 113-191). Ферменты, которые способны осуществлять ферментативную активацию фосфонатных пролекарственных форм соединений, соответствующих изобретению, включают, но без ограничения перечисленным, амидазы, эстеразы, микробные ферменты, фосфолипазы, холинэстеразы и фосфазы. Пролекарственные структуры могут служить для повышения растворимости, всасывания и липофильности с целью оптимизации доставки лекарственных препаратов, биодоступности и эффективности. Пролекарственная структура может включать активный метаболит или сам лекарственный препарат. Примеры пролекарственных структур включают гидролитически чувствительные или лабильные ацилоксиметиловые сложные эфиры -CH2OC(=O)R9 и ацилоксиметиловые карбонаты -CH2OC(=O)OR9,где R9 представляет собой С 1-С 6 алкил, С 1-С 6 замещенный алкил, С 6-С 20 арил или С 6-С 20 замещенный арил. Ацилоксиалкиловый сложный эфир впервые использован в качестве стратегии пролекарственной формы для карбоновых кислот и затем применен к фосфатам и фосфонатам в работе Farquhaf et al. (1983)J. Pharm. Sci 72: 324; см. также патенты США 4816570, 4968788, 5663159 и 5792756. Впоследствии ацилоксиалкиловый сложный эфир был использован для доставки фосфоновых кислот через клеточные мембраны и для повышения биодоступности при пероральном введении. Близкий вариант ацилоксиалкилового сложного эфира, алкоксикарбонилоксиалкиловый сложный эфир (карбонат), также может повышать биодоступность при пероральном введении в качестве пролекарственной структуры в соединениях комбинаций, соответствующих изобретению. Примером ацилоксиметилового сложного эфира является пивалоилоксиметокси, (РОМ) -СН 2 ОС(=O)С(СН 3)3. Примером пролекарственной структуры ацилоксиметилкарбоната является пивалоилоксиметилкарбонат (РОС) -СН 2 ОС(=O)ОС(СН 3)3. Показано, что ариловые сложные эфиры фосфорных групп, особенно фениловые сложные эфиры,повышают пероральную биодоступность (см. статью De Lombaert et al. (1994) J. Med. Chem. 37:498). Описаны также фениловые сложные эфиры, включающие сложный эфир карбоновой кислоты в ортоположении относительно фосфата (см. статью Khamnei and Torrence, (1996) J. Med. Chem. 39: 4109-4115). Показано, что бензиловые сложные эфиры генерируют исходные фосфоновые кислоты. В ряде случаев заместители в орто- или пара-положении могут ускорять гидролиз. Бензильные аналоги с ацилированным фенолом или алкилированным фенолом могут генерировать фенольное соединение посредством действия ферментов, например эстераз, оксидах и т.п., которое, в свою очередь, подвергается расщеплению бензильной связи С-O с генерацией фосфорной кислоты и хинонметидного промежуточного соединения. Примеры данного класса пролекарственных форм описаны в статье Mitchell et al. (1992) J. Chem.Soc. Perkin Trans. II 2345; заявке Glazier WO 91/019721. Описаны еще одни бензильные пролекарственные формы, включающие группу, содержащую сложный эфир карбоновой кислоты, присоединенный к бензильному метилену (см. заявку Glazier WO 91/019721). Показаны тиосодержащие пролекарственные формы, предназначенные для использования с целью внутриклеточной доставки фосфонатных лекарственных препаратов. Данные проэфиры включают этилтиогруппу, в которой тиоловая группа либо эсте-5 018098 рифицирована ацильной группой, либо скомбинирована с другой тиоловой группой с образованием дисульфида. Деэстерификация или восстановление дисульфида генерирует свободное промежуточное тиосоединение, которое впоследствии разлагается на фосфорную кислоту и эписульфид (см. статьи Puech etal. (1993) Antiviral Res., 22: 155-174; Benzaria et al. (1996) J. Med. Chem. 39: 4958). Защитные группы В контексте настоящего изобретения защитные группы включают пролекарственные структуры и химические защитные группы. Термин "защитная группа" относится к структуре соединения, которая маскирует или изменяет свойства функциональной группы или свойства соединения в целом. Химические защитные группы и стратегии защиты/снятия защиты хорошо известны в области техники. См., например, монографию Protective Groups in Organic Chemistry (Защитные группы в органической химии), Theodora W. Greene, JohnWileySons, Inc., New York, 1991. Защитные группы часто используют, чтобы маскировать реакционность ряда функциональных групп, повышать эффективность требуемых химических реакций, например,создания и разрыва химических связей упорядоченным и предварительно заданным образом. Защита функциональных групп соединения изменяет, кроме реакционности, другие физические свойства защищенной функциональной группы, такие как полярность, липофильность (гидрофобность) и другие свойства, которые можно измерить с помощью обычных аналитических приборов. Химические защищенные промежуточные продукты сами по себе могут быть биологически активными или неактивными. Защищенные соединения также могут проявлять измененные, и в ряде случаев, оптимизированные свойства in vitro и in vivo, такие как проникновение через клеточные мембраны и устойчивость к ферментному разложению или к выведению. В данной роли защищенные соединения с планируемыми терапевтическими эффектами можно назвать пролекарственными формами. Другой функцией защитной группы является превращение исходного лекарственного препарата в пролекарственную форму, причем исходный лекарственный препарат высвобождается при превращении пролекарственной формы in vivo. Поскольку активные пролекарственные формы могут всасываться более эффективно, чем исходный лекарственный препарат, пролекарственные формы могут обладать большей активностью in vivo, чем исходный лекарственный препарат. Защитные группы удаляют либо in vitro в случае химических промежуточных продуктов, либо in vivo, в случае пролекарственных форм. При использовании химических промежуточных продуктов не является особенно важным, чтобы полученные продукты после снятия защиты, например спирты, были физиологически приемлемыми, хотя, как правило, более желательно, когда продукты являются фармакологические безвредными. Защитные группы доступны, общеизвестны и их при необходимости используют для предупреждения побочных реакций с защищенной группой во время процедур синтеза, т.е. путей или способов получения соединений, соответствующих изобретению. В большинстве случаев решение относительно того,какие из групп защитить, когда это сделать и природы химической защитной группы "PG", будет зависеть от химии реакции, в которой предусматривают защиту (например, кислых, основных, окислительных, восстановительных или других условий) и планируемого направления синтеза. PG-группы не обязательно должны быть и, как правило, не являются одинаковыми, если соединение замещено множествомPG. В основном PG будут использовать для защиты функциональных групп, таких как карбоксил, гидроксил, тио или аминогрупппы, и, таким образом, для того, чтобы предупредить побочные реакции или иным образом повысить эффективность синтеза. Порядок снятия защиты с целью получения свободных групп со снятой защитой зависит от планируемого направления синтеза и условий реакции, с которыми сталкиваются, и может осуществляться в любом порядке, как определяет специалист. Можно защитить различные функциональные группы соединения, соответствующего изобретению. Например, защитные группы для -ОН-групп (гидроксильной ли, карбоновой кислоты, фосфоновой кислоты или других функций) включают "группы, образующие простой или сложный эфир". Группы, образующие простой или сложный эфир, способны функционировать как химические защитные группы в схемах синтеза, приведенных в данном контексте. Однако ряд защитных групп гидроксила или тио не являются группами, образующими простой или сложный эфир, как будут иметь в виду компетентные специалисты в области техники, и включены с обсуждаемыми ниже амидами. Очень большое количество защитных групп гидроксила и амидобразующих групп и соответствующих химических реакций расщепления описано в монографии Защитные группы в органическом синтезе.(Защитные группы карбонила), стр. 155-184. Относительно защитных групп карбоновой кислоты, фосфоновой кислоты, фосфоната, сульфоновой кислоты и других защитных групп кислот см. Greene, как приведено ниже. Защитные группы для функций -ОН (гидрокси ли, кислотная либо другие функции) представляют-6 018098 собой варианты осуществления "групп, образующих простой или сложный эфир". Особенный интерес представляют собой группы, образующие простой или сложный эфир, которые способны действовать как защитные группы в схемах синтеза, приведенных в данном контексте. Однако, некоторые защитные группы гидроксила и тио не являются группами, образующими ни простой, ни сложный эфир, как будет понятно компетентным специалистам в области техники, и они включены с амидами, обсуждаемыми ниже, и способны защищать гидроксильные или тиогруппы, так что гидролиз с исходной молекулы дает гидроксил или тио. С 3-С 12 гетероцикл (описаный выше) или арил. Данные ароматические группы необязательно являются полициклическими или моноциклическими. Примеры включают фенил, спирил, 2- и 3-пирролил, 2 и 3-тиенил, 2- и 4-имидазолил, 2-, 4- и 5-оксазолил, 3- и 4-изоксазолил, 2-, 4- и 5-тиазолил, 3-, 4- и 5 изотиазолил, 3- и 4- пиразолил, 1-, 2-, 3- и 4-пиридинил и 1-, 2-, 4- и 5-пиримидинил, С 3-С 12 гетероцикл или арил, замещенный гало, R1, R1-O-С 1-С 12 алкилен, С 1-С 12 алкокси, CN, NO2, ОН, карбокси, сложный эфир карбокси, тиол, тиоэфир, С 1-С 12 галоалкил (1-6 атомов галогена), С 2-С 12 алкенил или С 2-С 12 алкинил. Данные группы включают 2-, 3- и 4-алкоксифенил(С 1-С 12 алкил), 2-, 3- и 4-метоксифенил, 2-, 3- и 4- этоксифенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-диэтоксифенил, 2- и 3-карбоксиэтокси-4-гидроксифенил, 2- и 3 этокси-4-гидроксифенил, 2- и 3-этокси-5-гидроксифенил, 2- и 3-этокси-6-гидроксифенил, 2-, 3- и 4-Oацетилфенил, 2-, 3- и 4-диметиламинофенил, 2-, 3- и 4-метилмеркаптофенил, 2-, 3- и 4-галофенил (включая 2-, 3- и 4-фторфенил и 2-, 3- и 4-хлорфенил), 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-диметилфенил, 2,3-, 2,4-,2,5-, 2,6-, 3,4- и 3,5-бискарбоксиэтилфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-диметоксифенил, 2,3-, 2,4-, 2,5-,2,6-, 3,4- и 3,5-дигалофенил (включая 2,4-дифторфенил и 3,5-дифторфенил), 2-, 3- и 4-галоалкилфенил (15 атомов галогена, С 1-С 12 алкил, включая 4-трифторметилфенил), 2-, 3- и 4-цианофенил, 2-, 3- и 4 нитрофенил, 2-, 3- и 4-галоалкилбензил (1-5 атомов галогена, С 1-С 12 алкил, включая 4-трифторметилбензил и 2-, 3- и 4-трихлорметилфенил и 2-, 3- и 4- трихлорметилфенил), 4-N-метилпиперидинил,3-N-метилпиперидинил, 1-этилпиперазинил, бензил, алкилсалицилфенил (C1-C4 алкил, включая 2-, 3- и 4-этилсалицилфенил), 2-,3- и 4-ацетилфенил, 1,8-дигидроксинафтил (-С 10 Н 6-ОН) и арилоксиэтил [С 6 С 9 арил (включая феноксиэтил)], 2,2-дигидроксибифенил, 2-, 3- и 4-N,N-диалкиламинофенол, -С 6 Н 4 СН 2N(СН 3)2, триметоксибензил, триэтоксибензил, 2-алкилпиридинил (С 1-4 алкил); Сложные эфиры 2-карбоксифенила и С 1-С 4 алкилен-С 3-С 6 арил (включая бензил, -СН 2-пирролил,-СН 2-тиенил, -СН 2-имидазолил, -СН 2-оксазолил, -СН 2-изоксазолил, -СН 2-тиазолил, -СН 2-изотиазолил,-СН 2-пиразолил, -СН 2-пиридинил и -СН 2-пиримидинил), замещенный в арильной части 3-5 атомами галогена, 1-2 атомами или группами, выбранными из галогена, С 1-С 12 алкокси (включая метокси и этокси),циано, нитро, ОН, С 1-С 12 галоалкила (1-6 атомов галогена, включая -CH2-CCl3), C1-С 12 алкила (включая метил и этил), С 2-С 12 алкенила или С 2-С 12 алкинила; алкоксиэтил [С 1-С 6 алкил, включая -СН 2-СН 2-O-СН 3 (метоксиэтил)]; алкил, замещенный любой из групп, приведенных выше для арила, в частности, ОН или 1-3 атомами гало (включая -СН 3, -СН(СН 3)2, -С(СН 3)3, -СН 2 СН 3, -(СН 2)2 СН 3, -(СН 2)3 СН 3, -(СН 2)4 СН 3, -(СН 2)5 СН 3,-CH2CH2F, -CH2CH2Cl, -CH2CF3 и -CH2CCl3);; -N-2-пропилморфолино, 2,3-дигидро-6 гидроксиинден, сезамол, катехоловый моноэфир, -CH2-C(O)-N(R1)2, -CH2-S(O)(R1), -CH2-S(O)2(R1), CH2- CH(OC(O)CH2R1)-CH2(OC(O)CH2R1), холестерил, енолпируват (НООС-С(=СН 2)-), глицерин, моносахарид из 5-6 атомов углерода, дисахарид или олигосахарид (3-9 моносахаридных остатков); триглицериды, такие как -Dдиглицериды (где жирные кислоты, составляющие липиды глицериднов, в основном представляют собой природные насыщенные или ненасыщенные С 6-26, С 6-18 или С 6-10 жирные кислоты, такие как линоленовая, лавровая, миристиновая, пальмитиновая, стеариновая, олеиновая, пальмитолеиновая, линоленовая и т.п. жирные кислоты), связанные с ацилом исходных соединений в данном контексте посредством глицерильного кислорода триглицерида; фосфолипиды, связанные с карбоксильной группой последством фосфата фосфолипида; фталидил (показан на фиг. 1 статьи Clayton et al., Antimicrob. Agents Chemo. 5(6):670-671 [1974]); циклические карбонаты, такие как (5-Rd-2-оксо-1,3-диоксолен 4-ил)метиловые сложные эфиры (см. статью Sakamoto et al., Chem. Pharm. Bull. 32(6)2241-2248 [1984]),где Rd представляет собой R1, R4 или арил; и Гидроксильные группы соединений, соответствующих данному изобретению, необязательно замещены одной из групп III, IV или V, описанных в заявке WO 94/021604 или изопропилом. Соединения, соответствующие изобретению, включают обладающие ингибирующей ВГС активностью, а также промежуточные соединения, которые используют для получения активных соединений. Термин "соединение, ингибирующее ВГС" включает те соединения, которые ингибируют ВГС.-7 018098 Как правило, соединения, соответствующие изобретению, имеют молекулярную массу от приблизительно 200 а.е.м. (атомных единиц массы) до приблизительно 10000 а.е.м. В частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 5000 а.е.м. В другом частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 2500 а.е.м. В другом частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 1000 а.е.м. В другом частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 800 а.е.м. В другом частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 600 а.е.м. И в другом частном варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 600 а.е.м и молекулярную массу больше чем приблизительно 400 а.е.м. Соединения, соответствующие изобретению, также, как правило, имеют logD (полярность) меньше чем приблизительно 5. В одном варианте осуществления изобретение предусматривает соединения,имеющие logD меньше чем приблизительно 4. В другом варианте осуществления изобретение предусматривает соединения, имеющие logD меньше чем приблизительно 3. В другом варианте осуществления изобретение предусматривает соединения, имеющие logD больше чем приблизительно -5. В другом варианте осуществления изобретение предусматривает соединения, имеющие logD больше чем приблизительно -3, и в другом варианте осуществления изобретение предусматривает соединения, имеющиеlogD больше чем приблизительно 0 и меньше чем приблизительно 3. Выбранные заместители в соединениях, соответствующих изобретению, присутствуют рекурсивно. В данном контексте термин "рекурсивный заместитель" означает, что заместитель может представлять свой другой вариант. Теоретически вследствие рекурсивной природы данных заместителей в любом данном варианте осуществления может присутствовать большое количество заместителей. Например, Rx включает заместитель Ry. Ry может представлять собой R2, который, в свою очередь, может представлять собой R3. Если выбирают, что R3 представляет собой R3c, то можно выбрать второй вариант Rx. Обычный специалист в области медицинской химии понимает, что общее число данных заместителей разумно ограничено требуемыми свойствами предполагаемого соединения. Данные свойства включают в качестве примера, а не ограничения физические свойства, такие как молекулярная масса, растворимость или log P,свойства, связанные с применением, такие как активность в отношении предполагаемой мишени, и практические свойства, такие как простота синтеза. В качестве примера, а не ограничения все, А 3, А 2 и R1, представляют собой рекурсивные заместители в ряде вариантов осуществления. Как правило, каждый из них независимо друг от друга может быть включен 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0 раз в данном варианте осуществления. Более типично, когда каждый из них независимо друг от друга может быть включен 12 или меньше раз в данном варианте осуществления. Всякий раз, когда соединение, описанное в данном контексте, замещено больше чем одной из одинаково обозначенных групп, например, "R1" или "А 3", будет понятно, что группы могут быть одинаковыми или различными, т.е. каждая группа выбрана независимо от другой. Волнистые линии указывают центр присоединений ковалентной связи к примыкающим группам, структурам или атомам. В одном варианте осуществления изобретения соединение находится в выделенной или очищенной форме. Как правило, термин "выделенный и очищенный" означает, что соединение в существенной степени свободно от биологических материалов (например, крови, ткани, клеток, т.п.). В одном частном варианте осуществления изобретения термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 50 мас.% свободны от биологических материалов; в другом частном варианте осуществления термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 75 мас.% свободны от биологических материалов; в другом чсатном варианте осуществления термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 90 мас.% свободны от биологических материалов; в другом частном варианте осуществления термин означает, что соединение или конъюгат,соответствующие изобретению, по меньшей мере приблизительно на 98 мас.% свободны от биологических материалов, и в другом частном варианте осуществления термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 99 мас.% свободны от биологических материалов. В другом частном варианте осуществления изобретение предусматривает соединение или конъюгат, соответствующие изобретению, которые получены синтетическим путем (например, ex vivo). Накопление в клетке В одном варианте осуществления изобретение предусматривает соединения, способные накапливаться в человеческих РВМС (мононуклеарных клетках периферической крови). РВМС относятся к клеткам крови, имеющим округлые лимфоциты и моноциты. Физиологическая роль РВМС состоит в том, что они представляют собой важные компоненты механизма, действующего против инфекции. РВМС можно выделить из гепаринизированной цельной крови нормальных здоровых доноров или лейкоцитных пленок с помощью стандартного центрифугирования в градиенте плотности и собрать из гра-8 018098 ницы раздела, промыть (например, забуференным фосфатом солевым раствором) и хранить в замораживаемой среде. РВМС можно культивировать в многолуночных планшетах. В различные периоды культивирования либо можно удалить супернатант для оценки, либо можно собрать и анализировать клетки(см. статью Smith R. et al. (2003) Blood 102(7): 2532-2540). Соединения, соответствующие данному варианту осуществления, могут далее включать фосфонат или фосфонатную пролекарственную форму. Более типично, когда фосфонат или фосфонатная пролекарственная форма может иметь структуру А 3, как описано в данном контексте. Стереоизомеры Соединения, соответствующие изобретению, могут иметь хиральные центры, например хиральные атомы углерода или фосфора. Соединения, соответствующие изобретению, таким образом, включают смеси всех стереоизомеров, в том числе энантиомеров, диастереомеров и атропоизомеров. Кроме того,соединения, соответствующие изобретению, включают обогащенные или разделенные оптические изомеры в любом из всех асимметричных хиральных атомов. Другими словами, хиральные центры, очевидные из описания, представлены как хиральные изомеры или рацемические смеси. Все, как рацемические,так и диастереомерные смеси, а также отдельные оптические изомеры, выделенные или синтезированные, в существенной степени свободные от своих энантиомерных или диастереомерных партнеров, входят в объем изобретения. Рацемические смеси разделяют на их отдельные в существенной степени оптически чистые изомеры посредством хорошо известных способов, таких как, например, разделение диастереомерных солей, образованных с оптически активными дополнительными соединениями, например кислотами или основаниями, с последующим превращением обратно в оптически активные субстанции. В большинстве случаев требуемый оптический изомер синтезируют посредством стереоспецифических реакций, начиная с подходящего стереоизомера требуемого исходного материала. Соединения, соответствующие изобретению, в ряде случаев могут также существовать как таутомерные изомеры. Хотя может быть описана только одна делокализованная резонансная структура, предусматривают, что все данные формы входят в объем изобретения. Например, могут существовать енаминные таутомеры для пуриновой, пиримидиновой, имидазоловой, гуанидиновой, амидиновой и тетразоловой систем, и все их возможные таутомерные формы входят в объем изобретения. Соли и гидраты Примеры физиологически приемлемых солей соединений, соответствующих изобретению, включают соли, полученные из соответствующего основания, такие как соли щелочного металла (например,натрия), соли щелочно-земельного металла (например, магния), аммония и NX4+ (где X означает C1C4 алкил). Физиологически приемлемые соли атома водорода или аминогруппы включают соли органических карбоновых кислот, таких как уксусная, бензойная, молочная, фумаровая, винная, малеиновая,малоновая, яблочная, изетионовая, лактобионовая и янтарная кислоты; органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая кислоты, и неорганических кислот, таких как соляная, серная, фосфорная и сульфаминовая кислоты. Физиологически приемлемые соли соединения гидроксигруппы включают анион указанного соединения в сочетании с подходящим катионом, таким как Na+ и NX4+ (где X независимо выбрано из Н или С 1 С 4 алкильной группы). Для терапевтического применения соли активных ингредиентов соединений, соответствующих изобретению, будут, как правило, физиологически приемлемыми, т.е. они будут представлять собой соли, полученные из физиологически приемлемой кислоты или основания. Однако соли кислоты или основания, которые не являются физиологически приемлемыми, также могут найти применение, например,при получении или очистке физиологически приемлемого соединения. Все соли, получены ли они или нет из физиологически приемлемой кислоты или основания, входят в объем настоящего изобретения. Соли металлов, как правило, получают реакцией гидроксида металла с соединением, соответствующим данному изобретению. Примерами солей металлов, которые получают данным путем, являются соли, содержащие Li+, Na+ и K+. Менее растворимую соль металла можно осадить из раствора более растворимой соли посредством добавления соединения подходящего металла. Кроме того, соли могут быть образованы посредством введения кислоты из ряда органических и неорганических кислот, напримерHCl, HBr, H2SO4, H3PO4, или органических сульфоновых кислот, в основные центры, как правило, амины, или в кислотные группы. Наконец, следует иметь в виду, что композиции, представленные в данном контексте, включают соединения, соответствующие изобретению, в их неионизированной, а также цвиттерионной форме, и комбинации со стехиометрическими количествами воды как в гидратах. Кроме того, в объем данного изобретения включают соли исходных соединений с одной или более аминокислот. Подходят любые из природных или неприродных аминокислот, особенно природные аминокислоты, обнаруживаемые в виде белковых компонентов, хотя аминокислота, как правило, представляет собой несущую боковую цепь с основной или кислотной группой, например лизин, аргинин или глутаминовую кислоту, или нейтральной группой, такую как глицин, серин, треонин, аланин, изолейцин или лейцин. Способы ингибирования ВГС Другой аспект изобретения относится к способам ингибирования активности ВГС, включающим стадию обработки образца, предположительно содержащего ВГС, соединением или композицией, соответствующими изобретению. Соединения, соответствующие изобретению, могут действовать как ингибиторы ВГС, как промежуточные продукты для данных ингибиторов или иметь другие применения, как описано ниже. Ингибиторы будут, как правило, связываться с положениями на поверхности или в полости печени. Соединения,связывающиеся в печени, могут связываться с различной степенью обратимости. Те соединения, которые связываются в существенной степени необратимо, являются наилучшими кандидатами для применения в данном способе, соответствующем изобретению. После введения метки в существенной степени необратимо связывающие соединения используют в качестве зондов для детекции ВГС. Соответственно изобретение относится к способам детекции NS3 в образце, предположительно содержащим ВГС, включающим стадии: обработки образца, предположительно содержащего ВГС, композицией, включающей соединение, соответствующее изобретению, связанное с меткой, и наблюдение эффекта образца на активность метки. Подходящие метки хорошо известны в области диагностики и включают стабильные свободные радикалы, флуорофоры, радиоизотопы, ферменты, хемилюминесцентные группы и хромогены. В соединения, представленные в данном контексте, вводят метку принятым образом, используя функциональные группы, такие как гидроксил или амино. В одном варианте осуществления изобретение предусматривает соединение формулы (I), которое включает или которое присоединено или связано с одной или более определяемых меток. В контексте изобретения образцы, предположительно содержащие ВГС, включают природные или искусственные материалы, такие как живые организмы, тканевые или клеточные культуры; биологические образцы, такие как образцы биологических материалов (кровь, сыворотку, мочу, спинномозговую жидкость, слезную жидкость, мокроту, слюну, образцы тканей и т.п.), лабораторные образцы, образцы продуктов питания, воды или воздуха, образцы биопродуктов, такие как клеточные экстракты, особенно рекомбинантные клетки, синтезирующие требуемый гликопротеин и т.п. Как правило, образец будет предположительно содержать ВГС. Образцы могут содержаться в любой среде, включая воду и смеси органических растворителей/воды. Образцы включают живые организмы, такие как человек, и искусственные материалы, такие как клеточные культуры. Стадия обработки, соответствующая изобретению, включает добавление соединения, соответствующего изобретению, к образцу или она включает добавление предшественника композиции к образцу. Стадия добавления включает любой способ применения, как описано выше. При необходимости активность ВГС после применения соединения можно регистрировать любым способом, включая прямые и непрямые способы определения активности ВГС. Предусматривают все количественные, качественные и полуколичественные способы определения активности ВГС. Как правило, применяют один из вышеописанных способов скрининга, однако применим также любой другой способ, такой как наблюдение за физиологическими показателями живого организма. Многие организмы содержат ВГС. Соединения, соответствующие данному изобретению, используют для лечения или профилактики состояний, ассоциированных с активацией ВГС у животного или человека. Однако при скрининге соединений, способных ингибировать ВГС, следует иметь в виду, что результаты ферментных анализов не всегда могут коррелировать с анализами на клеточных культурах. Таким образом анализ на основе клеток должен, как правило, быть основным инструментом скрининга. Способы скрининга ингибиторов ВГС Соединения, соответствующие изобретению, подвергают скринингу на ингибирующую активность в отношении ВГС посредством любого из принятых способов оценки активности ферментов. В контексте изобретения, как правило, соединения сначала подвергают скринингу на ингибирование ВГС in vitro,и соединения, демонстрирующие ингибирующую активность, затем подвергают скринингу на активность in vivo. Соединения, имеющие in vitro Ki (константы ингибирования) меньше чем приблизительно 510-6 М, как правило, меньше чем приблизительно 110-7 М и предпочтительно меньше чем приблизительно 510-8 M, являются предпочтительными для использования in vivo. Используемые способы скрининга in vitro описаны детально. Фармацевтические препараты Соединения, соответствующие данному изобретению, получают с принятыми носителями и наполнителями, которые будут выбирать в соответствии с обычной практикой. Таблетки будут включать наполнители, глиданты, инертные наполнители, связующие компоненты и т.п. Водные препараты готовят в стерильной форме и, если они предназначены для доставки путем, отличным от перорального введения,они будут изотоническими. Все препараты будут необязательно включать наполнители, такие как приведены в Handbook of Pharmaceutical Excipients (Справочник по фармацевтическим наполнителям) (1986). Наполнители включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА(этилендиаминтетрауксусная кислота), углеводы, такие как декстрин, гидроксиалкил целлюло- 10018098 за, гидроксиалкилметилцеллюлоза, стеариновая кислота и т.п. рН препаратов лежит в интервале от приблизительно 3 до приблизительно 11, но обычно составляет приблизительно 7-10. Хотя возможно введение активных ингредиентов в виде монокомпонента, может быть предпочтительным представлять их в виде фармацевтических препаратов. Препараты как для ветеринарного, так и для медицинского применения, соответствующие изобретению, включают по меньшей мере один активный ингредиент, как определено выше, вместе с одним или более приемлемых носителей и необязательно с другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и физиологическим безвредным для своего реципиента. Препараты включают подходящие для вышеописанных путей введения. Препараты могут быть удобно представлены в унифицированной лекарственной форме и могут быть получены любым из способов, хорошо известных в области фармации. Способы и препараты в основном раскрыты в справочнике Remington's pharmaceutical Sciences (Справочник по фармацевтическим наукам Ремингтона) (MackPublishing Co., Easton, PA), данные способы включают стадию контактирования активного ингредиента с носителем, который включает один или более вспомогательных ингредиентов. Как правило, препараты получают путем однородного и тесного контактирования активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями либо обоими с последующим (при необходимости) формованием продукта. Препараты, соответствующие настоящему изобретению, подходящие для перорального введения,могут находиться в виде отдельных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых включает предварительно заданное количество активного ингредиента, в виде порошка или гранул, в виде раствора или суспензии в водной или неводной жидкости или в виде жидкой эмульсии типа масло-в-воде либо жидкой эмульсии типа вода-в-масле. Активный ингредиент можно также вводить в виде болюса, электуария или пасты. Таблетку получают путем прессования или формования, необязательно с одним или более вспомогательных ингредиентов. Прессованные таблетки можно изготовить прессованием в подходящем устройстве активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанной со связующим компонентом, смазывающим веществом, инертным разбавителем, консервантом,поверхностно-активным или разрыхляющим агентом. Формованные таблетки можно изготовить формованием в подходящем устройстве смеси порошкового активного ингредиента, увлажненного инертным жидким разбавителем. Таблетки могут быть необязательно покрытыми или имеющими насечки, и они необязательно изготовлены так, чтобы обеспечивать замедленное или контролируемое высвобождение из них активного ингредиента. Для введения в глаз или другие наружные ткани, например рот и кожу, предпочтительно, когда препараты наносят в виде наружной мази или крема, включающих активный ингредиент(ы) в количестве, например, 0,075-20% мас./мас. (включая активный ингредиент(ы) в интервале от 0,1 до 20% с возрастанием 0,1% мас./мас., например, 0,6% мас./мас., 0,7% мас./мас. и т.п.), предпочтительно 0,2-15% мас./мас. и наиболее предпочтительно 0,5-10% мас./мас. При получении в виде мази активные ингредиенты можно использовать либо с вазелиновой, либо со смешивающейся с водой мазевой основой. Альтернативно активные ингредиенты можно получить в креме с кремовой основой типа масло-в-воде. При необходимости водная фаза кремовой основы может включать, например, по меньшей мере 30% мас./мас. многоатомного спирта, т.е. спирта, имеющего две или более гидроксильных групп, таких как пропиленгликоль, бутан 1,3-диол, маннитол, сорбитол, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. При необходимости местные препараты могут включать соединение, которое повышает всасывание или проникновение активного ингредиента через кожу или другие поврежденные области. Примеры данных усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги. Масляная фаза эмульсий, соответствующих данному изобретению, может быть составлена из известных ингредиентов известным образом. Хотя фаза может включать только эмульгатор (иначе называемый эмульгирующим веществом), желательно, чтобы она включала смесь по меньшей мере одного эмульгатора с жиром или маслом или обоими, жиром и маслом. Предпочтительно, когда гидрофильный эмульгатор включают вместе с липофильным эмульгатором, который действует как стабилизатор. Предпочтительно также включение как масла, так и жира. Совместно эмульгатор(ы) со стабилизатором или без него образуют так называемый эмульгирующий воск,и воск вместе с маслом и жиром образуют так называемую эмульгирующую мазевую основу, которая образует масляную дисперсную фазу кремовых препаратов. Эмульгаторы и стабилизаторы эмульсии, подходящие для использования в препарате, соответствующем изобретению, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для препарата основан на достижении требуемых косметических свойств. Крем предпочтительно должен быть нежирным, неокрашивающим и смываемым продуктом с подходящей консистенцией, чтобы избежать вытекания из тюбиков или других контейнеров. Мож- 11018098 но использовать одно- или двухосновные сложные алкилэфиры с неразветвленной или разветвленной цепью, такие как ди-изоадипат, изоцетилстеарат, диэфир пропиленгликоля и жирных кислот кокоса, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известную как Crodamol CAP, последние три являются предпочтительными сложными эфирами. Они могут быть использованы как монокомпонент или в комбинации в зависимости от требуемых свойств. Альтернативно используют липиды с высокой температурой плавления, такие как бесцветный мягкий парафин и/или вазелиновое масло или другие минеральные масла. Фармацевтические препараты, соответствующие настоящему изобретению, включают одно или более соединений, соответствующих изобретению, вместе с одним или более фармацевтически приемлемыми носителями или наполнителями и необязательно другими терапевтическими агентами. Фармацевтические препараты, включающие активный ингредиент, могут быть в форме, подходящей для намеченного способа введения. При использовании для перорального введения можно получить, например, таблетки, пастилки, лепешки, водные или масляные суспензии, диспергирующиеся порошки или гранулы,твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального применения, можно получить согласно любому способу, известному в области изготовления фармацевтических композиций, и данные композиции могут включать один или более агентов, в том числе подсластители, вкусовые добавки, красители и консерванты, чтобы получить приятный на вкус препарат. Приемлемы таблетки, содержащие активные ингредиенты в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые подходят для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза,лактозы моногидрат, натрий кроскармеллоза, повидон, фосфат кальция или натрия; гранулирующие или разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота, связующие агенты, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или акация, и смазывающие агенты,такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или могут быть покрытыми с помощью известных способов, включая микроинкапсуляцию, с целью замедления распада и всасывания в желудочно-кишечный тракт и, таким образом, получения замедленного действия в течение более длительного периода. Например, можно использовать материал для задержки во времени, такой как глицерилмоностеарат или глицерилдистеарат в виде монокомпонента или с воском. Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешивают с инертным твердым разбавителем, например фосфатом кальция или каолином, либо в виде мягких желатиновых капсул, в которых активный ингредиент смешивают с водой или масляной средой, такой как арахисовое масло, вазелиновое масло или оливковое масло. Водные суспензии, соответствующие изобретению, включают активные материалы в смеси с наполнителями, подходящими для изготовления водных суспензий. Данные наполнители включают суспендирующий агент, такой как натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации, и разрыхляющие или смачивающие агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с алифатическими спиртом с длинной цепью (например, гептадекаэтиленоксицетанол),продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гекситоловым ангидридом (например, полиоксиэтиленсорбитмоноолеат). Водная суспензия может также включать один или более консервантов, таких как этил или н-пропил п-гидроксибензоат, один или более красителей, один или более вкусовых компонентов и один или более подсластителей, таких как сахароза или сахарин. Масляные суспензии можно получить суспендированием активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как вазелиновое масло. Пероральные суспензии могут включать загуститель,такой как пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как вышеприведенные, и вкусовые компоненты можно добавить, чтобы получить приятный на вкус пероральный препарат. Данные композиции можно законсервировать добавлением антиоксиданта, такого как аскорбиновая кислота. Диспергирующиеся порошки и гранулы, соответствующие изобретению, подходящие для получения водной суспензии путем добавления воды, дают активный ингредиент в смеси с разрыхляющим или смачивающим агентом, суспендирующим агентом и одним или более консервантов. Подходящие разрыхляющие или смачивающие агенты и суспендирующие агенты проиллюстрированы вышеприведенными. Могут также присутствовать дополнительные наполнители, например подсластители, вкусовые компоненты и красители. Фармацевтические композиции, соответствующие изобретению, могут быть также в форме эмульсий типа масло в воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как вазелиновое масло, или их смесь. Подхо- 12018098 дящие эмульгаторы включают природные камеди, такие как камедь акации и камедь трагаканта, природные фосфатиды, такие как соевый лецитин, сложные эфиры или частичные сложные эфиры, полученные из жирных кислот, и гекситоловые ангидриды, такие как сорбитмоноолеат, продукты конденсации данных частичных сложных эфиров с этиленоксидом, такие как полиоксиэтиленсорибитмоноолеат. Эмульсия может также включать подсластители и вкусовые компоненты. Сиропы и эликсиры можно приготовить с подсластителями, такими как глицерин, сорбит или сахароза. Данные препараты могут также включать средство, уменьшающее раздражение, консервант, вкусовой компонент или краситель. Фармацевтические композиции, соответствующие изобретению, могут быть в форме стерильного инъекционного препарата, такого как стерильная инъекционная водная или масляная суспензия. Данную суспензию можно изготовить в соответствии с известным уровнем техники с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые упомянуты выше. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, такой как раствор в 1,3-бутандиоле, или может быть получен как лиофилизированный порошок. Из приемлемых носителей или растворителей можно использовать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла можно традиционно использовать в качестве растворителя или суспендирующей среды. Для данной цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты,такие как олеиновая кислота, могут быть аналогичным образом использованы при получении инъекционных препаратов. Количество активного ингредиента, которое можно комбинировать с носителем для получения однократной лекарственной формы, будет варьировать в зависимости от хозяина, которого лечат, и конкретного способа введения. Например, препарат с пролонгированным действием, предназначенный для перорального введения человеку, может включать приблизительно 1-1000 мг активного материала, смешанного с соответствующим и удобным количеством материала носителя, которое может варьировать от приблизительно 5 до приблизительно 95% от композиций в целом (масса:масса). Можно приготовить фармацевтическую композицию, обеспечивающую легко измеряемые количества для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может включать от приблизительно 3 до 500 мкг активного ингредиента/мл раствора, чтобы происходила инфузия подходящего объема со скоростью приблизительно 30 мл/ч. Препараты, подходящие для введения в глаз, включают глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, в частности, в водном растворителе для активного ингредиента. Предпочтительно, когда активный ингредиент находится в данных препаратах в концентрации 0,520%, преимущественно 0,5-10%, в частности приблизительно 1,5% мас./мас. Препараты, подходящие для местного применения в полости рта, включают лепешки, содержащие активный ингредиент в основе с вкусовой добавкой, обычно сахарозой, и акацию или трагакант, пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахарозу и акацию, и полоскания для рта, содержащие активный ингредиент в подходящем жидком носителе. Препараты для ректального применения могут быть представлены в виде суппозиториев с подходящей основой, содержащей, например, масло какао или салицилат. Препараты, подходящие для внутрилегочного или назального применения имеют размер частиц,например, в интервале от 0,1 до 500 мкм (включая размеры частиц в интервале от 0,1 до 500 мкм при приращении в микронах, таком как 0,5, 1, 30, 35 мкм и т.п.), которые вводят быстрой ингаляцией через носовой проход или ингаляцией через рот, чтобы достигнуть альвеолярных мешочков. Подходящие препараты включают водные или масляные растворы активного ингредиента. Препараты, подходящие для введения аэрозолем или сухим порошком, можно получить согласно принятым способам и можно доставить с другими терапевтическими агентами, такими как соединения, ранее используемые для лечения или профилактики состояний, ассоциированных с активностью ВГС. Препараты, подходящие для вагинального применения, могут находиться в виде пессариев, тампонов, кремов, гелей, паст, пен или препаратов спреев, содержащих кроме активного ингредиента такие носители, которые известны как подходящие в области техники. Препараты, подходящие для парентерального применения, включают водные и неводные стерильные инъекционные растворы, которые могут включать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают препарат изотоническим с кровью предполагемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и сгустители. Препараты представлены в однодозных или многодозных контейнерах, например запаянных ампулах и флаконах, и их можно хранить в полученном сублимационной сушкой (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций,непосредственно перед использованием. Инъекционные растворы для немедленного применения получают из стерильных порошков, гранул и таблеток ранее описанного типа. Предпочтительными унифици- 13018098 рованными лекарственными препаратами являются те, которые содержат суточную дозу или унифицированную суточную субдозу, как представлено выше в данном контексте, или ее соответствующую фракцию активного ингредиента. Следует иметь в виду, что кроме ингредиентов, особо отмеченных выше, препараты, соответствующие данному изобретению, могут включать другие агенты, принятые в области техники, имеющие отношение к типу обсуждаемого препарата, например, те, которые подходят для перорального введения,могут включать вкусовые добавки. Кроме того, изобретение предусматривает ветеринарные композиции, включающие по меньшей мере один активный ингредиент, как определено выше, вместе с ветеринарным носителем для него. Ветеринарные носители представляют собой материалы, используемые для цели введения композиции, и могут быть твердыми, жидкими или газообразными материалами, которые в других отношениях инертны или приемлемы в области ветеринарии и совместимы с активным ингредиентом. Данные ветеринарные композиции можно вводить перорально, парентерально или другим требуемым путем. Соединения, соответствующие изобретению, можно также получить, чтобы обеспечить контролируемое высвобождение активного ингредиента для получения возможности менее частого дозирования или для улучшения фармакокинетического профиля или профиля токсичности активного ингредиента. Соответственно, изобретение также предусматривает композиции, включающие одно или более соединений, соответствующих изобретению, изготовленные для замедленного или контролируемого высвобождения. Эффективная доза активного ингредиента зависит по меньшей мере от природы состояния, которое лечат, токсичности, используют ли соединение профилактически (более низкие дозы), способа доставки и фармацевтического препарата и будет определена лечащим врачом с использованием принятых исследований повышения дозы. Можно ожидать, что она будет составлять от приблизительно 0,0001 до приблизительно 100 мг/кг массы тела/день. Как правило, от приблизительно 0,01 до приблизительно 10 мг/кг массы тела/день. Более типично от приблизительно 0,01 до приблизительно 5 мг/кг массы тела/день. Более типично от приблизительно 0,05 до приблизительно 0,5 мг/кг массы тела/день. Например, суточная потенциальная доза для взрослого человека массы тела приблизительно 70 кг будет лежать в интервале от 1 до 1000 мг, предпочтительно от 5 до 500 мг и может иметь форму однократной или многократных доз. Пути введения Одно или более соединений, соответствующих изобретению (в данном контексте обозначают как активные ингредиенты), вводят любым путем, соответствующим состоянию, которое лечат. Подходящие пути включают пероральный, ректальный, назальный, местный (включая защечный и подъязычный),вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный, внутрикожный,интратекальный и эпидуральный) и т.п. Следует иметь в виду, что предпочтительный путь может изменяться в зависимости, например, от состояния реципиента. Преимущество соединений, соответствующих данному изобретению, состоит в том, что они биодоступны при пероральном введении и их можно дозировать перорально. Комбинированная терапия Активные ингредиенты, соответствующие изобретению, можно также использовать в комбинации с другими активными ингредиентами. Данные комбинации выбирают на основе состояния, которое лечат,с учетом перекрестной реактивности ингредиентов и фармакологических свойств комбинации. Возможно также объединить любое соединение, соответствующее изобретению, с одним или более других активных ингредиентов в единичной лекарственной форме для одновременного или последовательного введения пациенту. Комбинированную терапию можно применять как схему одновременного или последовательного введения. При последовательном введении комбинацию можно применять в виде двух или более введений. Комбинированная терапия может давать "синергию" и "синергический эффект", т.е. эффект, достигаемый, когда активные ингредиенты используют вместе, больше чем сумма эффектов, которые являются результатом отдельного использования соединений. Синергический эффект может достигаться, когда активные ингредиенты: (1) получают совместно и вводят одновременно в комбинированном препарате,(2) доставляют поочередно или параллельно в виде отдельных препаратов, или (3) посредством какойлибо другой схемы. При доставке в чередующейся терапии "синергический эффект может достигаться,когда соединения вводят или доставляют последовательно, например, в отдельных таблетках, пилюлях или капсулах либо посредством разных инъекций в отдельных шприцах. Как правило, во время чередующейся терапии эффективную дозу каждого активного ингредиента вводят последовательно, т.е. серийно, тогда как при комбинированной терапии эффективные дозы двух или более активных ингредиентов вводят совместно. Метаболиты соединений, соответствующих изобретению Кроме того, в объем данного изобретения входят продукты метаболизма in vivo соединений, описанных в данном контексте. Данные продукты могут быть результатом, например, окисления, восстановления, гидролиза, амидирования, эстерификации и т.п. введенного соединения, в основном вследствие- 14018098 ферментативных процессов. Соответственно изобретение включает соединения, полученные способом,включающим контактирование соединения, соответствующего данному изобретению, с млекопитающим в период времени, достаточный для получения продукта его метаболизма. Данные продукты, как правило, идентифицируют путем получения несущего радиоактивную метку (например, С 14 или Н 3) соединения, соответствующего изобретению, его парентерального введения в определяемой дозе (например,больше чем приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна или человек, предоставления достаточного времени для протекания метаболизма [метаболического превращения] (как правило, приблизительно от 30 с до 30 ч) и выделения продуктов его превращения из мочи, крови или других биологических образцов. Данные продукты легко выделить, поскольку они помечены (другие выделяют с использованием антител, способных связывать эпитопы, сохраняющиеся в метаболите). Структуры метаболитов определяют принятым способом, например, с помощью МС или ЯМР-анализа. Как правило, анализ метаболитов проводят тем же путем, что и принятые исследования метаболизма лекарственных препаратов, хорошо известные компетентным специалистам в области техники. Продукты превращения, при условии, что их иным образом не обнаруживают in vivo, используют в диагностических анализах терапевтического дозирования соединений, соответствующих изобретению,даже если они сами по себе не обладают активностью ингибирования ВГС. Известны способы определения стабильности соединений в искусственных желудочно-кишечных выделениях. Соединения определяют в данном контексте как стабильные в желудочно-кишечном тракте,когда меньше чем приблизительно 50 мол.% защищенных групп утрачивают защиту в искусственном кишечном или желудочном соке при инкубировании в течение 1 ч при 37 С. Только то, что соединения стабильны в желудочно-кишечном тракте, не означает, что они не могут гидролизоваться in vivo. Фосфонатные пролекарственные формы, соответствующие изобретению, как правило, будут стабильны в пищеварительной системе, но они в существенной степени гидролизуются до исходного лекарственного препарата в просвете пищеварительного тракта, печени или другом метаболическом органе или в клетках в целом. Иллюстративные способы получения соединений, соответствующих изобретению Изобретение также относится к способам получения композиций, соответствующих изобретению. Композиции [прим. перев. - соединения] получают любым из применимых способов органического синтеза. Многие данные способы хорошо известны в области техники. Однако многие из известных способов разработаны в работе Compendium of Organic Synthetic Methods (Сборник методов органического синтеза) (John WileySons, New York), т. 1, Ian T. Harrison and Shuyen Harrison, 1971; т. 2, Ian T. Harrison and Shuyen Harrison, 1974; т. 3, Louis S. Hegedus and Leroy Wade, 1977; т. 4, Leroy G. Wade, Jr., 1980; т. 5, Leroy G. Wade, Jr., 1984 и т. 6, Michael В. Smith; a также в монографии March, J., Advanced OrganicChemistry, Third Edition (Современная органическая химия, 3 изд.) (John WileySons, New York, 1985),Comprehensive Organic Synthesis. Selectivity, StrategyEfficiency in Modern Organic Chemistry (Полный органический синтез. Избирательность, стратегия и эффективность в современной органический химии) в 9 томах, гл. Ред. Barry M. Trost, (Pergamon Press, New York, изд. 1993). Другие способы, подходящие для получения соединений, соответствующих изобретению, описаны в публикации международной патентной заявки WO 2006/020276. Ряд иллюстративных способов получения композиций, соответствующих изобретению, представлен ниже. Данные способы предназначены для иллюстрации природы данных препаратов и не предназначены для ограничения объема применимых способов. Как правило, условия реакции, такие как температура, время реакции, растворители, процедуры обработки и т.п., будут теми, которые общеизвестны в уровне техники для определенной проводимой реакции. Приведенный ссылочный материал вместе с материалом, цитируемым в данном контексте, включает детальные описания данных условий. Как правило, температуры будут составлять от -100 до 200 С,растворители будут непротонными или протонными, время реакции будет составлять от 10 с до 10 дней. Обработка, как правило, включает в себя гашение каких-либо непрореагировавших реагентов с последующим распределением между системой водного/органического слоя (экстракцией) и выделением слоя,включающего продукт. Реакции окисления и восстановления, как правило, проводят при температурах, близких к комнатной температуре (приблизительно 20 С), хотя для восстановления гидридов металлов часто температуру снижают до 0 - -100 С, растворители, как правило, являются непротонными для восстановлений и могут быть либо протонными, либо непротонными для окислений. Время реакций подбирают так, чтобы достигнуть требуемых превращений. Реакции конденсации, как правило, проводят при температурах, близких к комнатной температуре,хотя для неравновесных кинетически контролируемых конденсаций распространены также пониженные температуры (от 0 до -100 С). Растворители могут быть либо протонными (обычно в равновесных реакциях) или непротонными (обычно в кинетически контролируемых реакциях). Стандартные способы синтеза, такие как азеотропное удаление побочных продуктов реакции и использование безводных условий реакции (например, среды инертного газа), общеприняты в области техники и будут использоваться, когда они применимы.- 15018098 Термины "обработанный", "процесс обработки", "обработка" и т.п. при использовании в связи с операцией химического синтеза означают контактирование, смешивание, проведение реакции, создание возможности реакции, приведение в контакт и другие термины, обычные для области техники, предназначенные для того, чтобы показать, что одну или более химических структур обрабатывают так, чтобы превратить ее в одну или более других химических структур. Это означает, что выражение "обработка соединения один соединением два" является синонимом выражения "создание возможности для соединения один реагировать с соединением два", "контактирование соединения один с соединением два","проведение реакции соединения один с соединением два" и других выражений, принятых в области органического синтеза для корректного обозначения того, что соединение один "обрабатывают", "вступает в реакцию", "дают возможность реагировать" и т.д. с соединением два. Например, термин обработка указывает на рациональный и эффективный способ, в котором дают возможность вступать в реакцию органическим химическим соединениям. Пока не указано иначе, предусматривают нормальные концентрации (0,01 М - 10 М, как правило, 0,1 М - 1 М), температуры (от -100 до 250 С, как правило от -78 до 150 С, более типично от -78 до 100 С, еще более типично от 0 до 100 С), реакционные емкости (как правило, стеклянные, пластиковые, металлические), растворители, давления, атмосферы (как правило, воздух для реакций, нечувствительных к кислороду и воде, или азот либо аргон для чувствительных к кислороду или воде) и т.д. Сведения о подобных реакциях, известных в области органического синтеза,используют при выборе условий и оборудования для "обработки" в заданном способе. В частности,обычный специалист в области органического синтеза выбирает условия и оборудование, которое, как обоснованно ожидают, позволяет успешно проводить химические реакции, соответствующие описанным процессам, на основе знаний в области техники. Модификации каждой из иллюстративных схем и в примерах (далее "иллюстративные схемы") приводят к получению различных аналогов специфических иллюстративных материалов. Вышеприведенные ссылки, описывающие подходящие способы органического синтеза, применимы к данным модификациям. В каждой из иллюстративных схем может быть полезным отделить продукты реакции друг от друга и/или от исходных материалов. Требуемые продукты каждой стадии или серии стадий отделяют и/или очищают (далее отделяют) до требуемой степени гомогенности способами, принятыми в области техники. Как правило, данные разделения включают многофазную экстракцию, кристаллизацию из растворителя или смеси растворителей, отгонку, сублимацию или хроматографию. Хроматография может включать любое число способов в том числе, например, способы и оборудование для обращенно-фазовой и нормально-фазовой, эксклюзионной по размеру, ионообменной, жидкостной хроматографии высокого,среднего и низкого давления, лабораторной аналитической, с искусственным подвижным слоем (SMB) и препаративной тонко- или толстослойной хроматографии, а также способы лабораторной тонкослойной и экспресс-хроматографии. Другой класс способов разделения включает обработку смеси реагентом, выбранным для того, чтобы связывать или иным образом делать отделяемым требуемый продукт, непрореагировавший исходный материал, побочный продукт реакции и т.п. Данные реагенты включают адсорбенты или абсорбенты,такие как активированный уголь, молекулярные сита, ионообменные среды и т.п. Альтернативно реагенты могут представлять собой кислоты в случае основного материала, основания в случае кислотного материала, связывающие реагенты, такие как антитела, связывающие белки, избирательные хелаторы, такие как краун-эфиры, жидкие/жидкие ионные экстракционные реагенты (LIX) или им подобные. Выбор соответствующих способов разделения зависит от природы включенных материалов. Например, температура кипения и молекулярная масса при отгонке и сублимации, наличие или отсутствие функциональных групп в хроматографии, стабильность материалов в кислой и щелочной среде в многофазной экстракции и т.п. Компетентный специалист в области техники будет применять способы, которые с наибольшей вероятностью позволяют достигнуть требуемого разделения. Отдельный стереоизомер, например энантиомер, в существенной степени свободный от своего стереоизомера, можно получить путем разделения рацемической смеси с использованием такого способа,как получение диастереомеров с помощью оптически активных разделяющих агентов (см. статью Stereochemistry of Carbon Compounds (Стереохимия углеродных соединений), (1962) Е. L Eliel, McGraw Hill;Lochmuller, С. Н., (1975) J. Chromatogr., 113:(3) 283-302). Рацемические смеси хиральных соединений,соответствующих изобретению, можно разделить и выделить подходящим способом, включая: (1) образование ионных диастереомерных солей с хиральными соединениями и разделение фракционной кристаллизацей или другими способами, (2) образование диастереомерных соединений с хиральными дериватизирующими реагентами, разделение диастереомеров и превращение в чистые стереоизомеры и (3) разделение в существенной степени чистых или обогащенных стереоизомеров непосредственно в хиральных условиях. В рамках способа (1) диастереомерные соли можно получить путем реакции энантиомерно чистых хиральных оснований, таких как бруцин, хинин, эфедрин, стрихнин, -метилфенилэтиламин (амфетамин) и т.п., с асимметричными соединениями, несущими кислотную функциональность, таким как карбоновая кислота и сульфоновая кислота. Можно вызвать разделение диастереомерных солей фракционной кристаллизацией или ионной хроматографией. Для разделения оптических изомеров аминосоедине- 16018098 ний добавление хиральных карбоновых или сульфоновых кислот, таких как камфорсульфоновая кислота,винная кислота, миндальная кислота или молочная кислота, может привести в результате к образованию диастереомерных солей. Альтернативно согласно способу (2) разделяемый субстрат реагирует с одним энантиомером хирального соединения с образованием диастереомерной пары (см. монографию Eliel, E. and Wilen, S.Sons, Inc., стр. 322). Диастереомерные соединения можно получить путем реакции асимметричных соединений с энантиомерно чистыми хиральными дериватизирующими реагентами, такими как ментильные производные, с последующим разделением диастереомеров и гидролизом с получением свободного энантиомерно чистого ксантена. Способ определения оптической чистоты включает получение хиральных сложных эфиров, таких как ментиловый сложный эфир, например (-)ментилхлорформиат, в присутствии основания или сложного эфира Мошера, -метокси(трифторметил)фенилацетата (см. статьюJacob III. (1982) J. Org. Chem. 47:4165), рацемической смеси и анализ ЯМР-спектра на присутствие двух атропизомерных диастереомеров. Стабильные диастереомеры атропизомерных соединений можно разделить и выделить нормально- и обращенно-фазовой хроматографией, следуя способам разделения атропизомерных нафтил-изохинолинов (см. Ноуе Т., WO 96/15111). Способом (3) рацемическую смесь двух энантиомеров можно разделить хроматографией с использованием хиральной стационарной фазы (см. монографию Chiral Liquid Chromatography (Хиральная жидкостная хроматография), (1989), под ред. W. J.Lough, Chapman and Hall, New York; статью Okamoto, (1990) J. of Chromatogr. 513:375-378). Обогащенные или очищенные энантиомеры можно разделить способами, используемыми для разделения других хиральных молекул с асимметрическими атомами углерода, такими как оптическое вращение и хиральный дихроизм. Частные варианты осуществления публикации международной патентной заявки No WO 2006/020276 относятся к ряду конкретных соединений. В одном частном варианте осуществления изобретенные соединения не включают следующие соединения: В другом варианте осуществления изобретенные соединения не включают следующее соединение: В другом варианте осуществления изобретенные соединения не включают соединение формулы или его фармацевтически приемлемую соль либо пролекарственную форму, гдеRp представляет собой циклопентил или трет-бутил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси; и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (X) или его фармацевтически приемлемую соль либо пролекарственную форму, гдеRp представляет собой (С 1-6)алкил или (С 3-6)циклоалкил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси; и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (X) или его фармацевтически приемлемую соль либо пролекарственную форму, гдеRp представляет собой циклопентил или трет-бутил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (X) или его фармацевтически приемлемую соль либо пролекарственную форму, гдеRp представляет собой (С 1-6)алкил или (С 3-6)циклоалкил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (XI) или его фармацевтически приемлемую соль либо пролекарственную форму, гдеRp представляет собой циклопентил или трет-бутил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (XI): или его фармацевтически приемлемую соль либо пролекарственную форму, где Rp представляет собой (С 1-6)алкил или (С 3-6)циклоалкил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (XI) или его фармацевтически приемлемую соль либо пролекарственную форму, где Rp представляет собой циклопентил или трет-бутил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6) алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В другом варианте осуществления изобретения соединения, соответствующие изобретению, исключают соединение формулы (XI) или его фармацевтически приемлемую соль либо пролекарственную форму, где:Rp представляет собой (С 1-6)алкил или (С 3-6)циклоалкил; Z1 выбрано из следующих структур:Rc представляет собой фенил, который необязательно замещен одним или более F, Cl, Br, I, (С 1-6)- 20018098 алкилом или (С 1-6)алкокси, и А 3 имеет любое из значений, определенных в данном контексте. В частном варианте осуществления изобретения Z1 выбрано из следующих структур: В частном варианте осуществления изобретение предусматривает соединение формулы (II) или его фармацевтически приемлемую соль, где Rf представляет собой Н, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С 3-С 6 циклоалкил, причем Rf является необязательно замещенным одним или более Rg; каждый Rg независимо друг от друга представляет собой гало, гидрокси, циано, С 6 арилтио, С 3-С 6 циклоалкил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, С 1-С 6 алкокси, NRhRi, -C(=O)NRhRi, где каждый арил и гетероарил необязательно замещен одним или более С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси,галоС 1-С 6 алкилом или галоС 1-С 6 алкокси; и каждый Rh и Ri независимо друг от друга представляют собой Н, С 1-С 6 алкил или С 1-С 6 галоалкил. В частном варианте осуществления изобретения Rf представляют собой С 1-С 6 алкил, С 2-С 6 алкенил или С 1-С 6 алкинил, причем Rf является замещенным С 6 арилом, который необязательно замещен одним или более С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилом или галоС 1-С 6 алкокси. В частном варианте осуществления изобретения Rf представляют собой С 1-С 6 алкил, который замещен С 6 арилом, который необязательно замещен одним или более С 1-С 6 алкилом, гало, гидрокси, циано,нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилом или галоС 1-С 6 алкокси. В частном варианте осуществления изобретения Rf представляют собой (С 1-6)алкил, замещенный фенильным циклом, который необязательно замещен 1, 2 или 3 С 1-С 6 алкилами, гало, гидрокси, циано,нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилами или галоС 1-С 6 алкокси. В частном варианте осуществления изобретения Rf представляет собой бензил или фенетил, который необязательно замещен 1, 2 или 3 С 1-С 6 алкилами, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилами или галоС 1-С 6 алкокси. В частном варианте осуществления изобретения Rf представляет собой Н, метил, этил, пропил, бутил, циклопропилметил, 3-бутенил, 2-метилпропил, изопропил, винил, цис-1-пропенил, транс-1 пропенил, цис-1-бутенил, 2-метилпропенил, 2-фенилвинил, 2-фенилетинил, 3-метил-2-бутенил, 2 гидроксиэтил, 2-гидрокси-2-метилпропил, цианометил, метоксиметил, N-(2,2,2-трифторэтил)-2 аминоэтил, фенетил, 2-хлорфенетил, 2-фторфенетил, 2-метилфенетил, 2-хлор-6-фторфенетил, фенилтиометил, бензил, 4-фторбензил, 3-фторбензил, 2-фторбензил, 4-цианобензил, 3-цианобензил, 2-циано- 21018098 бензил, 4-метоксибензил, 3-метоксибензил, 2-метоксибензил, 2-бромбензил, 2-трифторметоксибензил, 2 изопропоксибензил, 2-метилбензил, 3-метилбензил, 4-метилбензил, 2-этилбензил, 4-трифторметилбензил, 3-трифторметилбензил, 2-трифторметилбензил, 4-хлорбензил, 3-хлорбензил, 2-хлорбензил,2,6-дифторбензил, 2-хлор-6-фторбензил, 2,6-дихлорбензил, 2-метокси-6-фторбензил, 2,6-диметилбензил,2,6-дифтор-3-хлорбензил, 2,6-дифтор-4-хлорбензил, 2-хлор-3,6-дифторбензил, 2,3,6-трифторбензил, 3 хлор-2,4-дифторбензил, 2-хлор-3,6-дифторбензил, 2,3-дихлор-6-фторбензил, 2-нитробензил, 2 аминобензил, 2-тиенилметил, 2-фурилметил, 3-фурилметил, 5-трифторметилфур-2-илметил 5 пиразолилметил, 2-оксазолилметил, 4-метилтиазол-2-илметил, 3-пиридил, 2-пиридилметил, 3-гидрокси 2-пиридилметил, 6-хлор-2-пиридилметил, 2-пиразинилметил, 5-пиримидинилметил, 2-пиримидинилметил, 4-пиримидинилметил, фенил, 2-тиазолил, N,N-диметиламинокарбонилметил, N-метиламинокарбонилметил, аминокарбонилметил, 1-пропинил или 2-метилтиазол-4-илметил. В частном варианте осуществления изобретение предусматривает соединение формулы (III): или его фармацевтически приемлемую соль, гдеRj представляет собой 1-[N-(2,2,2-трифторэтил)имино]этил, ,-дифторфенетил, циклопропилацетил, бутаноил, 4,4,4-трифторбутаноил, 3,3,3-трифторпропилсульфонил, 3,3-диметилбутаноил, циклопентиламино-карбонил, циклопропилацетил, 2-норборнанилацетил, 2-амино-3,3-диметилбутаноил, 4 метилфенил, 4-трифторметилфенил, 3-трифторметилфенил, 2-трифторметилфенил или 4-третбутилтиазол-2-ил. В частном варианте осуществления изобретения для соединения формулы (III) Z представляет собой О; Y1 представляет собой О; и каждый из Z2a и Z2b представляют собой водород. В частном варианте осуществления изобретения Q1 представляет собой винил. В частном варианте осуществления изобретение предусматривает соединение формулы (IV) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (V) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (VI) или его фармацевтически приемлемую соль, гдеRf представляет собой Н, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С 3-С 6 циклоалкил, где Rf ,является необязательно замещенным одним или более Rg; каждый Rg независимо друг от друга представляет собой гало, гидрокси, циано, С 6 арилтио, С 3-С 6 циклоалкил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, С 1 С 6 алкокси, NRhRi, -C(=O)NRhRi, где каждый арил и гетероарил необязательно замещен одним или более С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилом или галоС 1 С 6 алкокси; и каждый Rh и Ri независимо друг от друга представляет собой Н, С 1-С 6 алкил или С 1-С 6 галоалкил; и- 22018098 В частном варианте осуществления изобретение предусматривает соединение формулы (VII) или его фармацевтически приемлемую соль, гдеRf представляет собой Н, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С 3 С 6 циклоалкил, причем Rf необязательно замещен одним или более Rg; каждый Rg независимо друг от друга представляет собой гало, гидрокси, циано, С 6 арилтио, С 3 С 6 циклоалкил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, С 1-С 6 алкокси, NRhRi, -C(=O)NRhRi,где каждый арил и гетероарил необязательно замещен одним или более С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси, С 1-С 6 галоалкилом или галоС 1-С 6 алкокси; и каждый Rh и Ri независимо друг от друга представляет собой Н, С 1-С 6 алкил или С 1-С 6 галоалкил; иRj представляет собой 1-[N-(2,2,2-трифторэтил)имино]этил, ,-дифторфенетил, циклопропилацетил, бутаноил, 4,4,4-трифторбутаноил, 3,3,3-трифторпропилсульфонил, 3,3-диметилбутаноил, циклопентиламинокарбонил, циклопропилацетил, 2-норборнанилацетил, 2-амино-3,3-диметилбутаноил, 4-метилфенил, 4-трифторметилфенил, 3-трифторметилфенил, 2-трифторметилфенил или 4-трет-бутилтиазол-2 ил. В частном варианте осуществления изобретение предусматривает соединение, которое представляет собой его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (IX) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (X) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XI) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XII) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XIII) или его фармацевтически приемлемую соль.- 23018098 В частном варианте осуществления изобретение предусматривает соединение формулы (XIV) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XV) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XVI) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XVII) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XVIII) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XXIV) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XXV) или его фармацевтически приемлемую соль. В частном варианте осуществления изобретение предусматривает соединение формулы (XXVI) или его фармацевтически приемлемую соль.- 24018098 В частном варианте осуществления изобретение предусматривает соединение формулы I или его фармацевтически приемлемую соль, гдеR2 означает -С(O)ОС 1-С 6 алкил, -С(O)ОС 3-С 6 циклоалкил, -С(О)С 1-С 6 алкил, -С(O)С 1-С 6 алкил, замещенный по меньшей мере одним заместителем, выбранным из группы заместителей, включающей галоген, амино группу, фенил, -С(O)СН 2 С 3-С 8 циклоалкил, С 6 арил, необязательно замещенный заместителем,выбранным из группы заместителей, включающей С 1-С 6 алкил и CF3, С 3-С 6-гетероарил, содержащий от 1 до 4 гетероатомов, выбранных из группы гетероатомов, включающей N и S, необязательно замещенный С 1-С 6 алкилом, -SO2-С 1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном,-С(СН 3)С=NHC1-С 6 алкил, необязательно замещенный по меньшей мере одним галогеном;Q1 представляет собой (С 1-8)алкил, (С 2-8)алкенил, либо Q1 и Z2a вместе образуют необязательно замещенную С 1-С 6 алкилом группу -(СН 2)n-(СН=СН)m, где n=5-8, m=0-1, причем по меньшей мере одна из-СН 2- групп может быть замещена по меньшей мере одной группой, выбранной из групп О, NH и -SO2-; А 3 представляет собой Н;Rf представляет собой Н, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов, включающей N, О и S, или С 3 С 6 циклоалкил;Rf необязательно замещен по меньшей мере одним Rg; каждое Rg независимо представляет собой гало, гидрокси, циано, С 6 арилтио, С 3-С 6 циклоалкил,С 6 арил, С 5-С 6 гетероарил, включающий от 1 до 3 гетероатомов, выбранных из группы гетероатомов,включающей N, О и S, С 1-С 6 алкокси, NRhRi, -C(=O)NRhRi, где каждый арил и гетероарил необязательно замещены по меньшей мере одним С 1-С 6 алкилом, гало, гидрокси, циано, нитро, амино, С 1-С 6 алкокси,галоС 1-С 6 алкилом или галоС 1-С 6 алкокси, и каждый Rh и Rj независимо представляет собой Н, С 1-С 6 алкил или С 1-С 6 галоалкил,при условии, что соединение не является соединением любой из следующих формул: Сведения, подтверждающие возможность осуществления изобретения Схемы и примеры Общие аспекты данных иллюстративных способов описаны ниже и в примерах. Каждый из продуктов, полученных в следующих способах, необязательно отделяют, выделяют и/или очищают перед использованием в последующих процессах. Ряд иллюстративных способов получения соединений, соответствующих изобретению, представлен в данном контексте, например, в нижеприведенных примерах. Данные способы предназначены для иллюстрации природы данных способов получения и не предназначены для ограничения объема применяемых способов. Некоторые соединения, соответствующие изобретению, можно использовать в качестве промежуточных продуктов для получения других соединений,соответствующих изобретению. Например, взаимопревращение различных фосфонатных соединений,соответствующих изобретению, иллюстрируют ниже. Получение промежуточных продуктов Получение промежуточных продуктов фосфоновой кислоты. 1. Синтез и выделение соли дибензоил-L-винной кислоты диэтил(1S,2R)-1-амино-2-этенилцикло пропан-1-фосфоната: Раствор диэтил-(N-бензилиденаминометил)-фосфоната (50 г, 196 ммоль), транс-1,4-дибром-2 бутена (50 г, 235 ммоль) и хлорида бензилтриэтиламмония (4,5 г, 19,6 ммоль) в дихлорметане (1,0 л) перемешивают при КТ (комнатной температуре), используя механическую мешалку, во время чего добавляют моногидрат гидроксида цезия (82 г, 490 ммоль). Полученную в результате смесь перемешивают в течение 18 ч, после чего добавляют другую порцию гидроксида цезия моногридрата (82 г, 490 ммоль). Полученную в результате смесь перемешивают в течение 24 ч. Затем соли отфильтровывают через слой целита 521 и позволяют фильтрату перемешиваться с 1 Н водной HCl при КТ в течение 3 ч. Полученную в результате смесь фильтруют через другой слой целита 521 и разделяют две фазы фильтрата. Органическую фракцию экстрагируют 1 Н водной HCl (250 мл 1). Водные фракции промывают дихлорметаном(250 мл 1) и объединенные водные фракции перемешивают с этилацетатом (500 мл) при осторожном добавлении 84 г (1 моль) NaHCO3, а затем избытка NaCl до насыщения. После того как полученную в результате смесь фильтруют через слой целита 521 для удаления избытка NaCl и некоторого количества черной смолы, два слоя разделяют и водную фракцию далее экстрагируют этилацетатом (250 мл 2). Органические экстракты промывают насыщенным раствором NaCl (250 мл 1), объединяют, сушат (MgSO4) и концентрируют с получением 16,5-17 г неочищенного амина. Неочищенный амин частично очищают колоночной хроматографией, используя 165-170 г силикагеля путем элюции этилацетатом (100%, 500 мл), а затем 5% метанолом в этилацетате (1200 мл). Фракции, содержащие продукт, объединяют и концентрируют, что дает в результате 11,5-12 г частично очищенного амина. К данному амину добавляют раствор 18,8-19,6 г (1 моль экв.) дибензоил-1-винной кислоты с 151,5158 мл ацетонитрила (5-кратно относительно количества соли). Смесь нагревают, пока она не становится раствором и медленно охлаждают при КТ с целью получения твердых веществ. После выдерживания в течение ночи твердые вещества собирают фильтрованием и промывают ацетонитрилом. Твердые вещества перекристаллизовывают из такого же количества ацетонитрила снова при КТ с получением 11,5 г оптически чистой соли. Данные 1 Н ЯМР-спектроскопии (300 МГц, CD3OD):8,14 (br, 2H), 8,11 (d, J = 1,2 Гц, 2 Н), 7,64 (tt, J= 7,5 и 1,2 Гц, 2 Н), 7,51 (br t, J = 7,5 Гц, 4 Н), 5,94 (s, 2 Н), 5,82 (dt, J = 17,1 и 9,9 Гц, 1 Н), 5,32 (dd, J = 17,1 и 1,2 Гц, 1 Н), 5,13 (dd, J = 10,5 и 1,2 Гц, 1 Н), 4,11-4,26 (m, 4 Н), 2,11 (m, 1 Н), 1,33-1,47 (m, 2 Н), 1,37 (dt, J = 10,2 и 7,2 Гц, 6 Н); данные 31 Р ЯМР-спектроскопии (121,4 МГц, CD3OD)22,55. Аналитические данные: оптическую чистоту амина можно определить по данным 31 Р ЯМРспектроскопии амида Мошера в ДМСО-d6. Перекристаллизованный материал (25 мг) растворяют в смеси насыщенного водного NaHCO3 (5 мл) и насыщенного водного NaCl (5 мл) и экстрагируют свободный амин с использованием дихлорметана (10 мл 2). Экстракты однократно промывают смесью насыщенного водного NaHCO3 (5 мл) и насыщенного водного NaCl (5 мл), сушат (MgSO4) и концентрируют. К раствору остатка и N,N-диметиламинопиридина (3,5 мг) в пиридине (0,1 мл) добавляют (R)-(-)-метокси(трифторметил)фенилацетилхлорид при КТ. После перемешивания в течение 1,5 ч пиридин упаривают и остаток растворяют в 0,5 Н HCl (10 мл) и этилацетате (10 мл). После разделения двух слоев органический слой промывают водой (10 мл 1) и насыщенным водным NaHCO3 (10 мл 1), сушат(MgSO4) и концентрируют. При 31 Р ЯМР-спектроскопии остатка в ДМСО-d6 желательный амид появляется при 23,00 миллионных долей, тогда как нежелательный амид появляется при 22,79 миллионных долей. 2. Получение промежуточных продуктов фосфоновой кислоты: Амин I (9,0 г, 41,1 ммоль) растворяют в 1,4-диоксане (100 мл). Раствор Na2CO3 (13,1 г, 123,3 ммоль) в H2O (50 мл) добавляют к реакционной смеси и перемешивают в течение 5 мин при КТ. После добавления бензилхлорформиата (8,4 г, 49,3 ммоль) реакционный раствор перемешивают при КТ в течение ночи. Органическую фазу разводят EtOAc и экстрагируют H2O и солевым раствором. Органическую фазу су- 27018098 шат над MgSO4. Концентрирование фильтрата, полученного при удалении MgSO4 вакуумной фильтрацией, дает масло, из которого соединение II выделяют колоночной хроматографией (SiO2, 20% EtOAc в гексане) в виде прозрачного масла (11,6 г, 80%), данные 1 Н ЯМР-спектроскопии (300 МГц, CDCl3):7,33(110 мл). Реакционный раствор нагревают до 115 С в течение 10 ч. После охлаждения снова до КТ реакционный раствор концентрируют для удаления пиридина. К неочищенному продукту добавляют Н 2 О(50 мл). Водную фазу промывают диэтиловым эфиром (2100 мл). Затем водную фазу доводят до рН = 2 добавлением 1 М HCl (водн.). Продукт III (7,5 г, 23,0 ммоль) выделяют путем экстракции дихлорметаном и используют на следующей стадии без дальнейшей очистки. Данные 1 Н ЯМР-спектроскопии (300 МГц,CDCl3):8,63 (br, 1 Н), 7,33 (s, 5 Н), 5,95 (dt, J = 9,9, 17,1 Гц, 1 Н), 5,65 (d, J = 23,7 Гц, 1 Н), 5,31 (d, J = 17,1 Гц, 1 Н), 5,06 (m, 3 Н), 4,06 (m, 2H), 2,09 (m, 1 Н), 1,73 (m, 2 Н), 1,23 (dt, J = 8,1, 26,4 Гц, 3 Н), данные 31 Р ЯМР-спектроскопии (121,4, МГц, CDCl3):24,6. ЖХ/МС = 326 (М 1), 348 (MNa). 3. Получение промежуточных продуктов фосфиновой кислоты. Общая схема получения фосфоновой кислоты показана ниже, начиная с соединения III (см. схему 1). Схема 1 Альтернативная схема (схема 2) получения фосфиновой кислоты показана ниже. Схема 2 Промежуточный продукт фосфоновой кислоты III (1,0 г, 3,1 ммоль) растворяют в толуоле (6 мл). Данный раствор затем добавляют по каплям к (COCl)2 (1,1 мл, 12,4 ммоль) и ДМФ (47 мкл, 0,6 ммоль),растворенным в 6 мл толуола при КТ. После перемешивания в течение 1 ч при КТ реакцию концентрируют и трижды подвергают азеотропному перемешиванию с толуолом с получением неочищенного соединения IV в виде масла. Полученный в результате темный вязкий остаток в ТГФ (20 мл) перемешивают при -78 С при добавлении 1,0 М LiAlH(O-tBu)3 (23,5 мл, 23,5 ммоль) в течение 10 мин. Раствор нагревают до КТ в течение 30 мин. Реакционную смесь охлаждают до 0 С и гасят 1 Н HCl температуры льда (200 мл). Продукт экстрагируют эфиром (200 мл 2) и органические фракции промывают 1 Н HCl температуры льда (100 мл) и H2O (100 мл). После сушки (MgSO4) и концентрирования органической фракции остаток очищают комбиэкспресс колоночной хроматографией, используя гексан/этил ацетат в качестве элюента с получением соединения IV (1,89 г, 78,3%), данные 1 Н ЯМР-спектроскопии (300 МГц, CDCl3):8,14 (bs, 1 Н),7,35 (s, 5 Н), 6,22 (s, 1 Н), 5,89 (m, 2 Н), 5,39 (bd, J = 11,7 Гц, 1H), 5,30 (s, 2H), 5,21-5,104 (m, 3H), 4,13 (m,2H), 2,16 (m, 1H), 1,72-1,66 (m, 2H), 1,31 (m, 3 Н). 31 Р (121,4 МГц, CD3OD):32,311, 29,241. Полученную в результате фосфиновую кислоту связывают с дипептидным промежуточным продуктом, как показано на схеме 3. 4. Получение дипептидных промежуточных продуктов. А. Синтез промежуточного продукта фенилхинолиндипептид. Стадия 1. Хинолин (7,6 г, 30,1 ммоль), метиловый эфир N-трет-Вос-цис-4-гидрокси-1-пролина (8,9 г, 36,3 ммоль) и трифенилфосфин (17,4 г, 66,3 ммоль) растворяют в ТГФ (250 мл). После охлаждения реакционного раствора до 0 С добавляют DIAD (13,4 г, 66,3 ммоль) в течение 15 мин. Реакцию перемешивают при КТ в течение 12 ч и разводят EtOAc (700 мл) и промывают NaHCO3 (водн.), H2O и солевым раствором. Органическую фазу сушат над MgSO4. После концентрирования используют кристаллизацию для удаления большей части оксида трифенилфосфина с помощью EtOAc (100 мл) и гексана (50 мл) и требуемый продукт выделяют колоночной хроматографией (SiO2, 70% EtOAc в гексане) в виде масла(11,9 г, 85%), данные 1 Н ЯМР-спектроскопии (300 МГц, CDCl3):8,03 (m, 2H), 7,50 (m, 5H), 7,18 (m, 1H),6,97 (m, 1 Н), 5,15 (m, 1 Н), 4,99 (m, 2 Н), 4,06 (s, 3 Н), 3,99 (m, 1 Н), 3,75 (s, 3H), 2,79 (dd, J = 8,7, 14,3 Гц,1 Н), 2,45 (ddd, J = 3,5, 10,7, 13,8 Гц, 1 Н), 1,15 (s, 9H), ЖХ/МС = 479 (М 1), 501 (М Na). Стадия 2. Продукт, полученный в вышеописанной реакции (9,6 г, 20,8 ммоль), растворяют в дихлорметане (20 мл). 4,0 М HCl в 1,4-диоксане (50 мл) медленно добавляют к реакционному раствору и позволяют реакционному раствору перемешиваться при КТ в течение 5 ч. После концентрирования под высоким вакуумом в течение 30 мин неочищенный продукт растворяют в ДМФ (70 мл). Кислоту (6,1 г, 25,0 ммоль), HATU (11,9 г, 31,2 ммоль) и N-метилморфолин (10,5 г, 104,0 ммоль) добавляют к реакционному раствору. Реакционный раствор перемешивают при КТ в течение ночи и разводят EtOAc (500 мл) и промывают NH4Cl (водн.), NaHCO3 (водн.) и солевым раствором. Органическую фазу сушат надMgSO4. После концентрирования требуемый продукт (10,0 г, 80%) выделяют колоночной хроматографией (SiO2, 90% EtOAc в гексане) в виде твердого вещества. Данные 1 Н ЯМР-спектроскопии (300 МГц,CD3OD):8,33 (d, J = 9,6 Гц, 1 Н), 8,09 (m, 2H), 7,74 (m, 3 Н), 7,65 (m, 1H), 7,52 (m, 1 Н), 7,24 (dd, J = 2,1,9,6 Гц, 1 Н), 5,91 (m, 1H), 5,04 (m, 1H), 4,81 (d, J = 9,0 Гц, 1 Н), 4,76 (d, J = 9,0 Гц, 1 Н), 4,46 (m, 1H), 4,23(m, 1H), 4,06 (s, 3 Н), 3,99 (m, 1 Н), 3,75 (s, 3 Н), 2,99 (dd, J = 9,0, 14,7 Гц, 1 Н), 2,53 (ddd, J = 3,3, 10,5, 13,8 Гц, 1 Н), 1,42-1,78 (m, 8H), 1,05 (s, 9H). ЖХ/МС = 604 (М 1), 626 (М Na). Стадия 3. Сложный метиловый эфир (9,2 г, 15,3 ммоль) растворяют в ТГФ (30 мл), МеОН (10 мл) иH2O (10 мл). LiOH (1,8 г, 76,5 ммоль) добавляют к реакционному раствору и позволяют реакционному раствору перемешиваться при КТ в течение 7 ч. После добавления EtOAc (150 мл) для разбавления реак- 29
МПК / Метки
МПК: A61K 31/662, A61P 31/12, C07F 9/6558, C07F 9/572
Метки: фосфинатные, соединения, варианты
Код ссылки
<a href="https://eas.patents.su/30-18098-fosfinatnye-soedineniya-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Фосфинатные соединения (варианты)</a>
Предыдущий патент: Способ предотвращения лавины напряжения в энергосистеме
Следующий патент: Улучшение клеточного роста
Случайный патент: Быстрорастворимая таблетка гидробромида галантамина