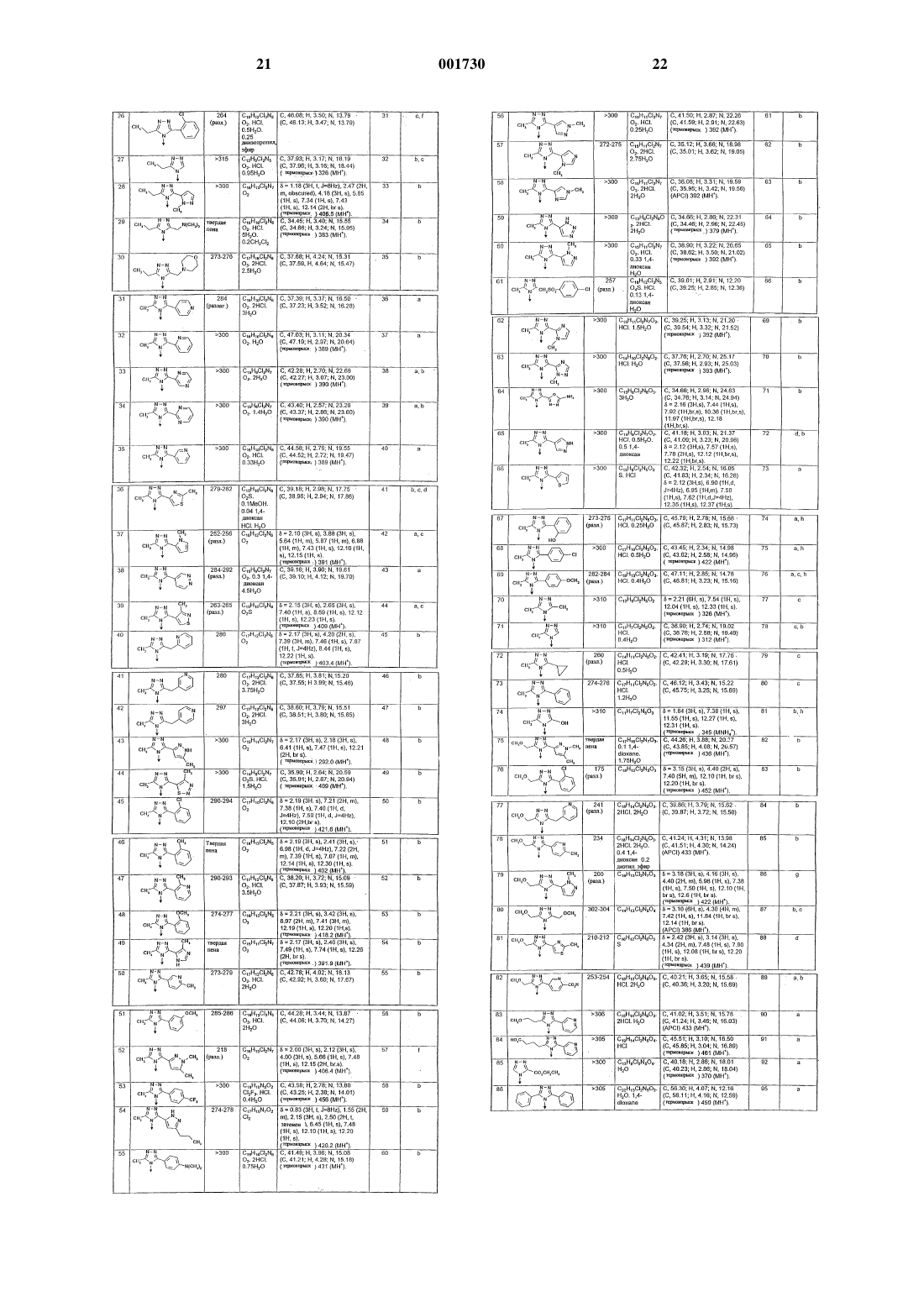
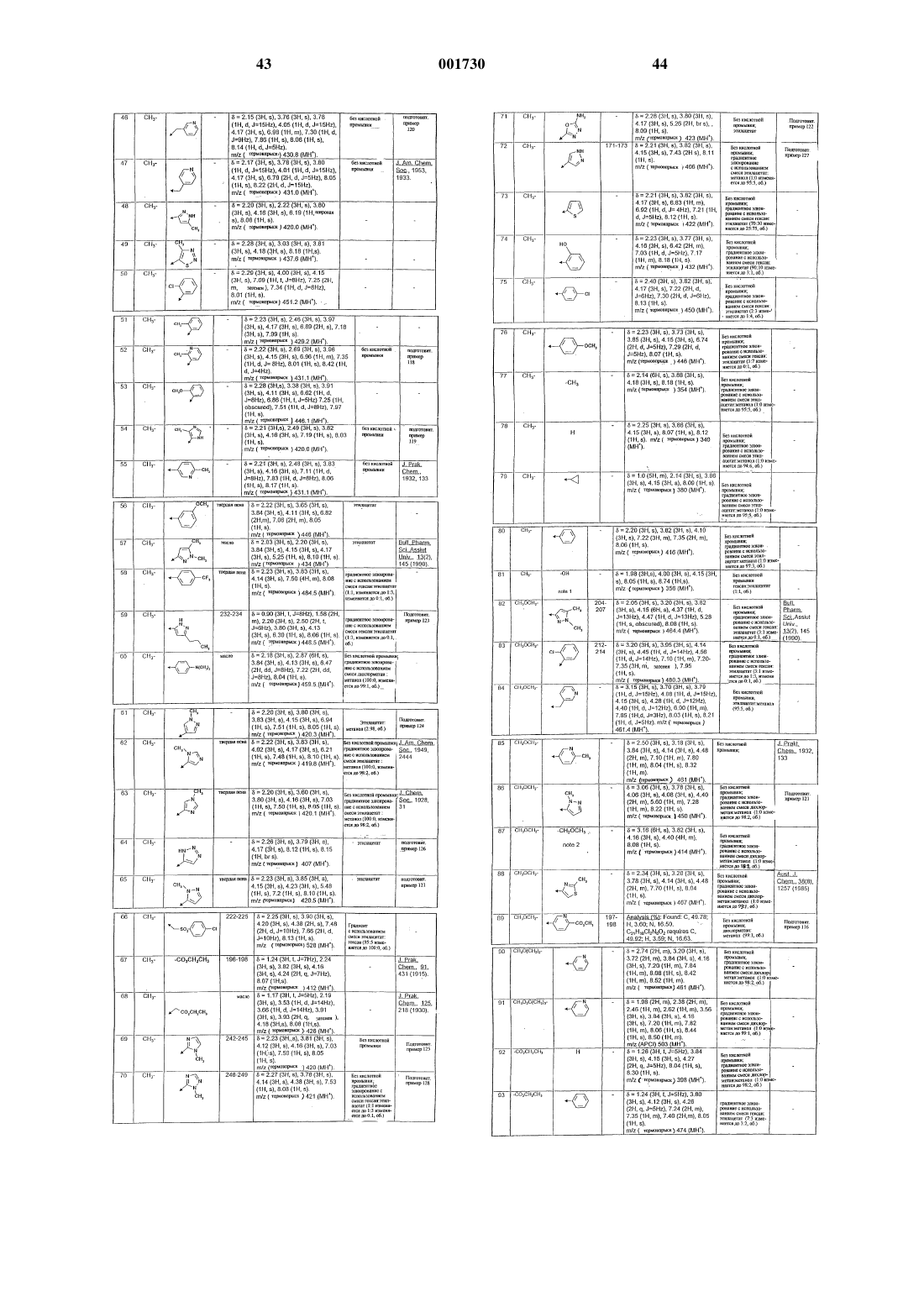
Хиноксалиндионы.
Номер патента: 1730
Опубликовано: 27.08.2001
Авторы: Булл Дэйвид Джон, Стоуби Алан, Карр Кристофер Ли, Готье Элизабет Колетт Луиз, Моубрэй Чарльз Эрик, Фрэй Майкл Джонатан
Формула / Реферат
1. Соединение формулы
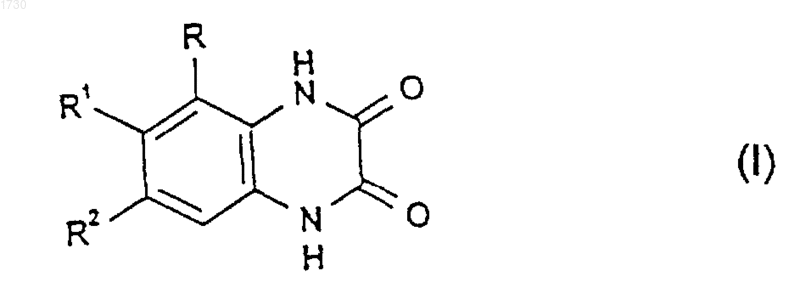
или его фармацевтически приемлемая соль, где
R представляет собой гетероарильную группу с 5 членами в кольце, содержащую 3 или 4 гетероатома азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода или азота, или представляет собой гетероарильную группу с 6 членами в кольце, содержащую от 1 до 3 гетероатомов азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода, причем любая из указанных групп является возможно бензоконденсированной и возможно замещенной, в том числе в бензоконденсированной части, 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C2-C4алкенила, C3-C7циклоалкила, галогена, гидрокси, C1-C4алкокси, C3-C7циклоалкилокси, -СООН, C1-C4алкоксикарбонила, -CONR3R4, -NR3R4, -S(O)р(C1-C4алкила), -SO2NR3R4, арила, арилокси, арил(C1-C4)алкокси и гет, причем указанный C1-C4алкил возможно замещен C3-C7 циклоалкилом, галогеном, гидрокси, C1-C4алкокси, галоген(C1-C4)алкокси, C3-C7циклоалкилокси, C3-C7циклоалкил(C1-C4)алкокси, -СООН, C1-C4 алкоксикарбонилом, -CONR3R4 -NR3R4, -S(O)р(C1-C4алкилом), -SO2(арилом), -SO2NR3R4, морфолино, арилом, арилокси, арил(C1-C4)алкокси или гет, причем указанный C2-C4алкенил возможно замещен арилом;
R1 и R2 каждый независимо выбран из Н, фтор-, хлор-, бром-, C1-C4алкила и галоген(C1-C4)алкила;
R3 и R4 либо каждый независимо выбран из Н и C1-C4алкила, либо они, взятые вместе, представляют собой C5-C7алкилен;
р равно 0, 1 или 2;
"арил", используемый в определении R и "гет", означает фенил или нафтил, каждый из которых возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C1-C4алкокси, гидрокси, галогена, галоген(C1-C4)алкила и -NR3R4;
"гет", используемый в определении R, означает фурил, тиенил, пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, причем каждый является возможно бензоконденсированным и возможно замещенным, в том числе в бензоконденсированной части, 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C3-C7циклоалкила, C1-C4алкокси, галогена, гидрокси, -СООН, C1-C4алкоксикарбонила, аллилоксикарбонила, -CONR3R4, -NR3R4, -S(O)р(C1-C4алкила), -SO2NR3R4, галоген(C1-C4)алкила, гидрокси(C1-C4)алкила, C1-C4 алкокси(C1-C4)алкила, R3R4NCO(C1-C4)aлкилa, арила, арилалкила, гет1 и гет1(C1-C4)алкила, и/или оксидо-заместителем на кольцевом гетероатоме азота, когда "гет" включает в себя пиридинильную, пиридазинильную, пиримидинильную или пиразинильную группу; и "гет1", используемый в определении "гет", означает фурил, тиенил, пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, каждый из которых возможно замещен 1 или 2 C1-C4алкильными заместителями.
2. Соединение по п.1, где R представляет собой триазолил или тетразолил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C2-C4алкенила, C3-C7циклоалкила, галогена, гидрокси, C1-C4алкоксикарбонила, арила и "гет", причем указанный C1-C4алкил возможно замещен галогеном, гидрокси, C1-C4алкокси, галоген (С1-С4)алкокси, C3-C7циклоалкил(C1-C4)алкокси, -СООН, C1-C4алкоксикарбонилом, -NR3R4, -SO2(арилом), морфолино, арилом, арилокси, арил(С1-С4)алкоксигруппой или "гет"; или представляет собой пиридинил или пиримидинил.
3. Соединение по пп.1 или 2, где R представляет собой 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-4-ил или тетразол-5-ил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C2-C4алкенила, C3-C7циклоалкила, галогена, гидрокси, C1-C4алкоксикарбонила, арила и "гет", причем указанный C1-C4алкил возможно замещен галогеном, гидрокси, C1-C4алкокси, галоген(C1-C4)алкокси, C3-C7циклоалкил(C1-C4)алкоксигруппой, -СООН, C1-C4 алкоксикарбонилом, -NR3R4, -SO2(арилом), морфолино, арилом, арилокси, арил(С1-С4) алкоксигруппой или "гет"; или представляет собой пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-2-ил или пиримидин-5-ил.
4. Соединение по любому из пп.1-3, где R3 и R4 каждый независимо выбран из Н и C1-C4 алкила.
5. Соединение по любому из пп.1-4, где "арил" означает фенил, возможно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из метила, метокси, гидрокси, хлор-, трифторметила и диметиламино.
6. Соединение по любому из пп.1-5, где "гет" означает тиенил, пирролил, пиразолил, имидазолил, триазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, причем каждый из которых является возможно бензоконденсированным и возможно замещенным 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, -СООН, -NR3R4 и фенила, и/или оксидозаместителем на кольцевом гетероатоме азота указанной пиридинильной, пиридазинильной, пиримидинильной или пиразинильной группы.
7. Соединение по любому из пп.1-6, где R представляет собой 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-4-ил или тетразол-5-ил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из метила, этила, пропила, аллила, циклопропила, циклогексила, бром-, гидрокси, этоксикарбонила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 4-диметиламинофенила, 2-гидроксифенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2-метилфенила, фенила, 4-трифторметилфенила, 2-амино-1,3,4-оксадиазол-5-ила, 2-карбоксипиридин-5-ила, 1,5-диметил-1Н-пиразол-3-ила, 1Н-имидазол-1-ила, 1-метилимидазол-2-ила, 1-метилимидазол-4-ила, 1-метилимидазол-5-ила, 3-метилизотиазол-4-ила, 4-метил-1Н-имидазол-5-ила, 3-метил-1,2,4-оксадиазол-5-ила, 1-метил-1Н-пиразол-4-ила, 5-метил-1Н-пиразол-3-ила, 1-метил-1Н-пиразол-5-ила, 1-оксидопиридин-3-ила, 2-метилпиридин-3-ила, 2-метилпиридин-5-ила, 1-фенилимидазол-4-ила, 5-фенилпиридин-3-ила, 2-фенилпиридин-5-ила, 1-метилпиррол-2-ила, 4-метил-1,2,3-тиадиазол-5-ила, 2-метилтиазол-4-ила, 1-метил-1Н-1,2,4-триазол-5-ила, 3-(проп-1-ил)-1Н-пиразол-5-ила, пиразин-2-ила, 1Н-пиразол-4-ила, пиридазин-4-ила, пиридин-2-ила, пиридин-3-ила, пиридин-4-ила, пиримидин-2-ила, тиен-2-ила, 1Н-1,2,4-триазол-5-ила, 1Н-1,2,3-триазол-5-ила, хинолин-3-ила и хинолин-6-ила, причем указанные метил, этил или пропил возможно замещены фтор-, гидрокси, метокси, этокси, 2,2,2-трифторэтокси, циклогексилметокси, циклопентилметокси, -СООН, метоксикарбонилом, диметиламино, 4-хлорфенилсульфонилом, морфолино, фенилом, фенокси, бензилокси, пиридин-2-илом, пиридин-3-илом или пиридин-4-илом; или представляет собой пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-2-ил или пиримидин-5-ил.
8. Соединение по любому из пп.1-7, где R представляет собой
1-(2-гидроксиэтил)-5-фенил-1,2,3-триазол-4-ил,
1-(2-гидроксиэтил)-4-фенил-1,2,3-триазол-5-ил,
2-(2-гидроксиэтил)-5-фенил-1,2,3-триазол-4-ил,
1-метил-5-фенил-1,2,3-триазол-4-ил,
1-метил-4-фенил-1,2,3-триазол-5-ил,
2-метил-5-фенил-1,2,3-триазол-4-ил,
5-фенил-1Н-1,2,3-триазол-4-ил,
1-метил-1Н-1,2,4-триазол-3-ил,
2-метил-2Н-1,2,4-триазол-3-ил,
4-(2-гидроксиэтил)-4Н-1,2,4-триазол-3-ил,
4-метил-4Н-1,2,4-триазол-3-ил,
3-(2-амино-1,3,4-оксадиазол-5-ил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-бензил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-бензилоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-бром-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-(3-карбоксипроп-1-ил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-(2-карбоксипиридин-5-ил)-5-метоксиметил-4Н-1,2,4-триазол-4-ил,
3-(2-хлорфенил)-5-метоксиметил-4Н-1,2,4-триазол-4-ил,
3-(2-хлорфенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(3-хлорфенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(4-хлорфенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(4-хлорфенилсульфонилметил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-циклогексилметоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-циклопентилметоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-циклопропил-5-метил-4Н-1,2,4-триазол-4-ил,
3,5-ди(метоксиметил)-4Н-1,2,4-триазол-4-ил,
3-(N,N-диметиламинометил)-5-этил-4Н-1,2,4-триазол-4-ил,
3-(N,N-диметиламинометил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-(4-диметиламинофенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(1,5-диметил-1Н-пиразол-3-ил)-5-метоксиметил-4Н-1,2,4-триазол-4-ил,
3-(1,5-диметил-1Н-пиразол-3-ил)-5-метил-4Н-1,2,4-триазол-4-ил,
3,5-диметил-4Н-1,2,4-триазол-4-ил,
3,5-дифенил-4Н-1,2,4-триазол-4-ил,
3-(2-этоксиэтил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-этоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-этоксикарбонил-4Н-1,2,4-триазол-4-ил,
3-этил-5-(2-хлорфенил)-4Н-1,2,4-триазол-4-ил,
3-этил-5-(2-метоксифенил)-4Н-1,2,4-триазол-4-ил,
3-этил-5-(1-метилпиразол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-этил-5-метил-4Н-1,2,4-триазол-4-ил,
3-этил-5-морфолинометил-4Н-1,2,4-триазол-4-ил,
3-этил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-этил-4Н-1,2,4-триазол-4-ил,
3-(2-гидроксиэтил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-гидроксиметил-5-метил-4Н-1,2,4-триазол-4-ил,
3-гидроксиметил-5-фенил-4Н-1,2,4-триазол-4-ил,
3-гидроксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-гидроксиметил-4Н-1,2,4-триазол-4-ил,
3-гидрокси-5-метил-4Н-1,2,4-триазол-4-ил,
3-(2-гидроксифенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(1Н-имидазол-1-ил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(2-метоксиэтил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(1-метил-1Н-пиразол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(2-метилпиридин-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(2-метилтиазол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(1-оксидопиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(1-фенилимидазол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(5-фенилпиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(2-фенилпиридин-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(пиридин-3-илметил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(хинолин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(хинолин-6-ил)-4Н-1,2,4-триазол-4-ил,
3-(2-метоксифенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(3-метоксифенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-(4-метоксифенил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метилимидазол-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метилимидазол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метилимидазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-(3-метилизотиазол-4-ил)-5-метил-4Н-1,2,4-триазол-4-ил,
3-метил-5-(4-метил-1Н-имидазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(3-метил-1,2,4-оксадиазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(2-метилпиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(2-метилпиридин-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метилпиразол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(5-метил-1Н-пиразол-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(2-метилфенил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метилпиррол-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(4-метил-1,2,3-тиадиазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(2-метилтиазол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метил-1Н-1,2,4-триазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1-метил-1Н-пиразол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-(3-метил-1,2,4-оксадиазол-5-ил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-фенил-4Н-1,2,4-триазол-4-ил,
3-метил-5-(3-[проп-1-ил]-1Н-пиразол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиразин-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1Н-пиразол-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-2-илметил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-3-илметил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-4-илметил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридазин-4-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиримидин-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(тиен-2-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1Н-1,2,3-триазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(1Н-1,2,4-триазол-5-ил)-4Н-1,2,4-триазол-4-ил,
3-морфолинометил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-феноксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-(2-фенилэтил)-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-(пиридин-3-ил)-5-(2,2,2-трифторэтокси)метил-4Н-1,2,4-триазол-4-ил,
3-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(4-трифторметилфенил)-4Н-1,2,4-триазол-4-ил,
1-аллилтетразол-5-ил,
1-бензилтетразол-5-ил,
1-карбоксиметилтетразол-5-ил,
1-циклогексилтетразол-5-ил,
1-этилтетразол-5-ил,
1-(2-гидроксиэтил)тетразол-5-ил,
1-(3-гидроксипропил)тетразол-5-ил,
1-метоксикарбонилметилтетразол-5-ил,
1-(2-метоксиэтил)тетразол-5-ил,
1-метилтетразол-5-ил,
1-(2-фенилэтил)тетразол-5-ил,
1-фенилтетразол-5-ил,
1-(проп-2-ил)тетразол-5-ил,
1-(2,2,2-трифторэтил)тетразол-5-ил,
пиридин-2-ил,
пиридин-3-ил,
пиридин-4-ил,
пиримидин-2-ил или
пиримидин-5-ил.
9. Соединение по п.1, где R представляет собой
1-(3-гидроксипропил)тетразол-5-ил,
4-метил-4Н-1,2,4-триазол-3-ил,
1-(2-гидроксиэтил)-5-фенил-1,2,3-триазол-4-ил,
3-метил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метил-5-(пиридин-3-илметил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(хинолин-3-ил)-4Н-1,2,4-триазол-4-ил,
3-метоксиметил-5-(хинолин-6-ил)-4Н-1,2,4-триазол-4-ил или
3-(1,5-диметил-1Н-пиразол-3-ил)-5-метил-4Н-1,2,4-триазол-4-ил.
10. Соединение по любому из пп.1-9, где R1 и R2 каждый независимо выбран из хлор- и C1-C4алкила.
11. Соединение по любому из пп.1-10, где R1 и R2 каждый представляет собой хлор-.
12. Соединение по п.1, где
(1) R представляет собой 1-(3-гидроксипропил)тетразол-5-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(2) R представляет собой 4-метил-4Н-1,2,4-триазол-3-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(3) R представляет собой 1-(2-гидроксиэтил)-5-фенил-1,2,3-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(4) R представляет собой 3-метил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(5) R представляет собой 3-метил-5-(пиридин-3-илметил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(6) R представляет собой 3-метоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(7) R представляет собой 3-(1,5-диметил-1Н-пиразол-3-ил)-5-метил-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
(8) R представляет собой 3-метоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой метил;
(9) R представляет собой 3-метоксиметил-5-(пиридин-3-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой метил и R2 представляет собой хлор-;
(10) R представляет собой 3-метоксиметил-5-(хинолин-3-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-; или
(11) R представляет собой 3-метоксиметил-5-(хинолин-6-ил)-4Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-;
либо индивидуальный стереоизомер или фармацевтически приемлемую соль любого из них.
13. Соединение по п.1, которое представляет собой R-(-)-6,7-дихлор-5-[3-метоксиметил-5-(3-пиридил)-4Н-1,2,4-триазол-4-ил]-2,3 (1Н,4Н)хиноксалиндион или его фармацевтически приемлемую соль.
14. Соединение по п.1, которое представляет собой натриевую соль R-(-)-6,7-дихлор-5-[3-метоксиметил-5-(3-пиридил)-4Н-1,2,4-триазол-4-ил]-2,3(1Н,4Н)хиноксалиндиона.
15. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по любому из пп.1-14, вместе с фармацевтически приемлемым разбавителем или носителем.
16. Соединение формулы (I) или его фармацевтически приемлемая соль либо композиция по любому из пп.1-14 и 15, соответственно, для применения в качестве лекарственного средства.
17. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо композиции по любому из пп.1-14 и 15, соответственно, для производства лекарственного средства для лечения заболевания посредством продуцирования антагонистического эффекта на NMDA рецепторе.
18. Применение по п.17, где заболевание представляет собой острое нейродегенеративное или хроническое неврологическое расстройство.
19. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо композиции по любому из пп.1-14 и 15, соответственно, для производства лекарственного средства для лечения удара, транзиторной ишемической атаки, ишемии во время хирургической операции или травматического повреждения головы.
20. Способ воздействия на млекопитающее для лечения заболевания посредством продуцирования антагонистического эффекта на NMDA рецепторе, при котором на указанное млекопитающее воздействуют эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли либо композиции по любому из пп.1-14 и 15, соответственно.
21. Способ по п.20, где заболевание представляет собой острое нейродегенеративное или хроническое неврологическое расстройство.
22. Способ воздействия на млекопитающее для лечения удара, транзиторной ишемической атаки, ишемии во время хирургической операции или травматического повреждения головы, при котором на указанное млекопитающее воздействуют эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли либо композиции по любому из пп.1-14 и 15, соответственно.
23. Соединение формулы
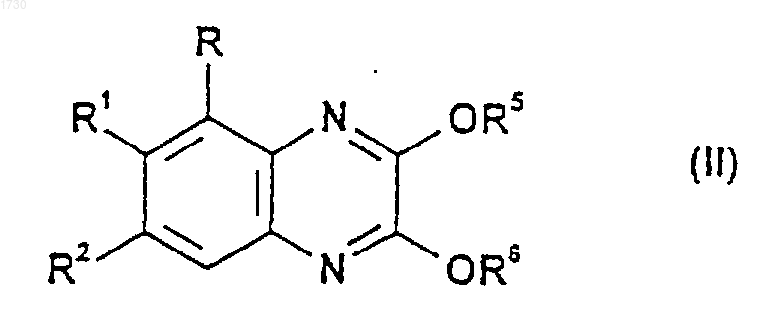
где R, R1 и R2 такие, как определено для соединения формулы (I) в п.1, a R5 и R6 либо каждый в отдельности, либо вместе представляют собой группу или группы, которые могут быть гидролитически расщеплены в кислотных или основных условиях с получением соединения формулы (I) по п.1.
24. Соединение по п.23, где R5 и R6 либо каждый независимо выбран из C1-C4алкила и бензила, возможно замещенного в кольце заместителями числом от 1 до 3, каждый из которых независимо выбран из C1-C4алкила, C1-C4алкокси, галогена, нитро и трифторметила, либо они, взятые вместе, представляют собой C1-C6алкилен, СН(фенил), СН(4-метоксифенил) или СН(3,4-диметоксифенил).
25. Способ получения соединения формулы (I) по п.1, где R, R1 и R2 такие, как определено в п.1, при котором осуществляют кислотный или основной гидролиз соединения формулы
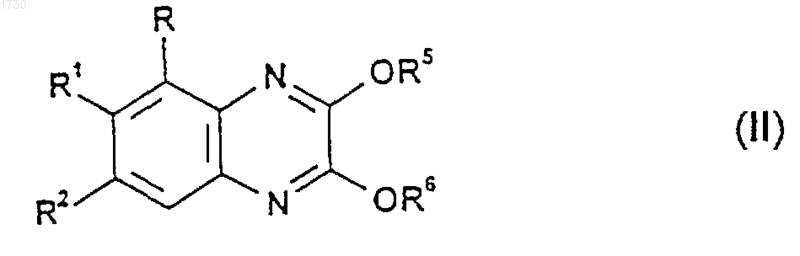
где R, R1 и R2 такие, как определено для соединения формулы (I) в этом пункте, а R5 и R6, либо каждый в отдельности, либо вместе представляют собой группу или группы, которые могут быть гидролитически расщеплены в кислотных или основных условиях с получением соединения формулы (I), причем за указанным способом возможно следует превращение соединения формулы (I) в его фармацевтически приемлемую соль.
26. Способ по п.25, где R5 и R6 либо каждый независимо выбран из C1-C4алкила и бензила, возможно замещенного в кольце заместителями числом от 1 до 3, каждый из которых независимо выбран из C1-C4алкила, C1-C4алкокси, галогена, нитро и трифторметила, либо они, взятые вместе, представляют собой C1-C6 алкилен, СН(фенил), СН(4-метоксифенил) или СН(3,4-диметоксифенил).
27. Способ по п.25 или 26, при котором взаимодействие проводят посредством кислотного гидролиза соединения формулы (II).
28. Соединение по п.1, где
R представляет собой гетероарильную группу с 5 членами в кольце, содержащую 3 или 4 гетероатома азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода или азота, или представляет собой гетероарильную группу с 6 членами в кольце, содержащую от 1 до 3 гетероатомов азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода, причем любая из указанных групп является возможно бензоконденсированной и возможно замещенной, в том числе в бензоконденсированной части, 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C2-C4алкенила, C3-C7 циклоалкила, галогена, гидрокси, C1-C4алкокси, C3-C7циклоалкилокси, -СООН, C1-C4алкоксикарбонила, -CONR3R4, -NR3R4, -S(O)р(C1-C4алкила), -SO2NR3R4, арила, арилокси, арил(C1-C4)алкокси и гет, причем указанный C1-C4алкил возможно замещен C3-C7циклоалкилом, галогеном, гидрокси, C1-C4алкокси, C3-C7циклоалкилокси, -СООН, C1-C4алкоксикарбонилом, -CONR3R4, -NR3R4, -S(O)р(C1-C4алкилоь), -SO2(арилом), -SO2NR3R4, морфолино, арилом, арилокси, арил(С1-С4)алкокси или гет, и причем указанный C2-C4алкенил возможно замещен арилом;
R1 и R2 каждый независимо выбран из Н, фтор-, хлор-, бром-, C1-C4алкила;
R3 и R4 либо каждый независимо выбран из Н, C1-C4алкила, либо они, взятые вместе, представляют собой C5-C7алкилен;
р равно 0, 1 или 2;
"арил", используемый в определении R и "гет", означает фенил или нафтил, каждый из которых возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C1-C4алкокси, гидрокси, галогена, галоген(C1-C4)алкила и -NR3R4;
"гет", используемый в определении R, означает фурил, тиенил, пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, каждый из которых возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4алкила, C3-C7циклоалкила, C1-C4алкокси, галогена, гидрокси, -СООН, C1-C4алкоксикарбонила, аллилоксикарбонила, -CONR3R4, -NR3R4, -S(O)р(C1-C4алкила), -SO2NR3R4, галоген (C1-C4)алкила, гидрокси(С1-С4)алкила, C1-C4 алкокси(C1-C4)алкила, R3R4NCO(C1-C4)aлкилa, арила, арилалкила, гет1 и гет1(C1-C4)алкила; и "гет1", используемый в определении "гет", означает фурил, тиенил, пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, каждый из которых возможно замещен 1 или 2 C1-C4алкильными заместителями.
Текст
1 Изобретение относится к производным 2,3(1 Н,4 Н)-хиноксалиндиона, которые являются селективными антагонистамиN-метил-Dаспартатных рецепторов. В частности, изобретение относится к производным 5-гетероарил 2,3(1 Н,4 Н)-хиноксалиндиона и к получению таких производных, композициям, содержащим такие производные, применениям таких производных и промежуточным соединениям, используемым в синтезе таких производных.L-Глутаминовая кислота является нейромедиатором возбуждающих аминокислот, чья физиологическая роль в мозге включает в себя взаимодействие с четырьмя рецепторами, три из которых названы по имени селективных агонистов NMDA (N-метил-D-аспартата), АМРА (2 амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) и каината. Четвертый рецептор называется метаботропным рецептором. Кроме сайта связывания с глутаминовой кислотой,NMDA рецептор обладает сайтами связывания высокого сродства с диссоциирующими анестезирующими средствами (например кетамином),полиаминами (например, спермином), глицином и некоторыми ионами металлов (например,Мg2+, Zn2+). Так как абсолютным требованием для активации NMDA рецептора является связывание глицина, антагонисты глицина могут действовать как функциональные NMDA антагонисты. В сфере церебрального инфаркта аноксия,например, приводит к освобождению аномально высоких концентраций глутаминовой кислоты. Это приводит к перевозбуждению NMDA рецепторов, в результате которого происходит дегенерация и гибель нейронов. Таким образом,антагонисты NMDA рецепторов, которые, как было показано, блокируют нейротоксическое воздействие глутаминовой кислоты in vitro и invivo, могут быть полезными при лечении и/или предотвращении любого патологического состояния, при котором считают, что активацияNMDA рецептора является важной. Примеры таких состояний включают в себя острые нейродегенеративные расстройства, являющиеся результатами таких событий, как удар, транзиторная ишемическая атака; ишемия во время хирургической операции, глобальная ишемия(после остановки сердца) и травматическое повреждение головного или спинного мозга. Кроме того, NMDA антагонисты можно применять при лечении некоторых хронических неврологических расстройств, таких как старческая деменция, болезнь Паркинсона и болезнь Альцгеймера. Они также полезны при состояниях,при которых повреждена функция периферийной нервной системы, таких как сетчаточная или макулярная дегенерация. Более того, NMDA антагонисты, как было показано, обладают противосудорожной и анксиолитической активностью и, следовательно,их можно применять для лечения эпилепсии и 2 состояния тревоги. NMDA антагонисты также могут ослаблять эффекты алкогольного синдрома физически зависимых организмов [К.А.(1992)], и, таким образом, NMDA антагонисты можно применять при лечении алкогольной зависимости и боли. NMDA антагонисты также можно применять при лечении слуховых расстройств (например, звона в ушах), мигрени и психиатрических расстройств. Описаны [ЕР-А-0572852] производные пиррол-1-ил-замещенного 2,3(1 Н,4 Н)-хиноксалиндиона, полезные для лечения нейродегенеративных заболеваний и нейротоксических расстройств центральной нервной системы. Известны [ЕР-А-0556393] inter alia производные имидазолил- или триазолил-замещенного 2,3(1 Н,4 Н)-хиноксалиндиона с антагонистической активностью по отношению к глутаматному рецептору, в особенности с антагонистическими активностями по отношению кNMDA-глициновому рецептору и к АМРА рецептору). Однако никакие 5-триазолилзамещенные соединения там конкретно не описаны. Соединения по настоящему изобретению являются сильными антагонистами NMDA (сайт глицина) рецептора. Кроме того, они являются высоко селективными антагонистами NMDA(сайт глицина) рецептора по сравнению с АМРА рецептором, по отношению к которому они если и обладают сродством, то очень небольшим. Настоящее изобретение относится к соединению формулыR представляет собой гетероарильную группу с 5 членами в кольце, содержащую 3 или 4 гетероатома азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода или азота, или представляет собой гетероарильную группу с 6 членами в кольце, содержащую от 1 до 3 гетероатомов азота, которая связана с кольцом хиноксалиндиона через кольцевой атом углерода, причем любая из указанных групп является возможно бензоконденсированной и возможно замещенной, в том числе в бензоконденсированной части, 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4 алкила, C2-C4 алкенила, C3C7 циклоалкила, галогена, гидрокси, C1-C4 алкокси, C3-C7 циклоалкилокси, -СООН, C1-C4 алкоксикарбонила, -CONR3R4, -NR3R4, -S(O)р (C1C4 алкила), -SO2NR3R4, арила, арилокси, арил(C1C4)алкокси и гет, причем указанный C1-C4 алкил возможно замещен C3-C7 циклоалкилом, галогеном, гидрокси, C1-C4 алкокси, галоген(C1C4)алкокси, C3-C7 циклоалкилокси, С 3-С 7 цикло 3 алкил(C1-C4)алкокси, -СООН, C1-C4 алкоксикар-NR3R4,-S(O)р(C1 бонилом,-CONR3R4,C4 алкилом), -SO2(арилом), -SO2NR3R4, морфолино, арилом, арилокси, арил(С 1-С 4)алкокси или гет, причем указанный С 2-С 4 алкенил возможно замещен арилом;R1 и R2 каждый независимо выбран из Н,фтор-, хлор-, бром-, C1-C4 алкила и галоген(C1C4)алкила;R3 и R4 либо каждый независимо выбран из Н и C1-C4 алкила либо они, взятые вместе,представляют собой C5-C7 алкилен; р равно 0, 1 или 2;"гет", означает фенил или нафтил, каждый из которых возможно замещен 1 или 2 заместителями, каждый из которых независимо выбран из"гет", используемый в определении R, означает фурил, тиенил, пирролил, пиразолил,имидазолил, триазолил, тетразолил, оксазолил,изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил,пиримидинил или пиразинил, причем каждый является возможно бензо-конденсированным и возможно замещенным, в том числе в бензоконденсированной части, 1 или 2 заместителями, каждый из которых независимо выбран изC1-C4 алкила, C3-C7 циклоалкила, C1-C4 алкокси,галогена,гидрокси,-СООН,C1-C4 алкоксикарбонила, аллилоксикарбонила, -CONR3R4,-NR3R4, -S(O)р(C1-C4 алкила), -SO2NR3R4, галоген(C1-C4)алкила, гидрокси(C1-C4)алкила, C1-C4 алкокси(C1-C4)алкила, R3R4NCO(C1-C4)aлкилa,арила, арилалкила, гет 1 и гет 1(C1-C4)алкила,и/или оксидо-заместителем на гетероатоме азота в цикле, когда "гет" включает в себя пиридинильную, пиридазинильную, пиримидинильную или пиразинильную группу; и "гет 1", используемый в определении "гет", означает фурил,тиенил, пирролил, пиразолил, имидазолил,триазолил, тетразолил, оксазолил, изоксазолил,тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, каждый из которых возможно замещен 1 или 2 C1-C4 алкильными заместителями. В вышеупомянутых определениях, "галоген" означает фтор-, хлор-, бром- или йод-, а алкильные, алкокси и алкиленовые группы,имеющие три или более чем три атома углерода,и алкенильные группы, имеющие четыре или более чем четыре атома углерода, могут быть прямоцепочечными или разветвленными. Определение "C1-C4 алкил" включает в себя метильную, этильную, н-пропильную, изопропильную, н-бутильную, втор-бутильную и третбутильную группы. Определение 4 Если R представляет собой гетероарильную группу с 5 членами в кольце, то это определение включает в себя 1,2,3-триазолил, 1,2,4 триазолил и тетразолил. Если R представляет собой гетероарильную группу с 6 членами в кольце, то это определение включает в себя, в частности, 2-, 3- и 4 пиридинил, 3- или 4-пиридазинил, 2-,4- или 5 пиримидинил и 2-пиразинил. Если "гет" представляет собой бензоконденсированную гетероарильную группу, то он может быть присоединен к остальной части молекулы через гетероарильную или бензоконденсированную часть группы "гет". Предпочтительно R представляет собой триазолил или тетразолил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4 алкила, C2C4 алкенила, C3-C7 циклоалкила, галогена, гидрокси, C1-C4 алкоксикарбонила, арила и гет, причем указанный C1-C4 алкил возможно замещен галогеном, гидрокси, C1-C4 алкокси, галоген(С 1 С 4)алкокси,C3-C7 циклоалкил(C1-C4)алкокси,-СООН,C1-C4 алкоксикарбонилом,-NR3R4,-SO2(арилом), морфолино, арилом, арилокси,арил(C1-C4)алкокси или гет; или представляет собой пиридинил или пиримидинил. Более предпочтительно R представляет собой 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, 1,2,4 триазол-4-ил или тетразол-5-ил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из C1-C4 алкила,C2-C4 алкенила, C3-C7 циклоалкила, галогена,гидрокси, C1-C4 алкоксикарбонила, арила и гет,причем указанный C1-C4 алкил возможно замещен галогеном, гидрокси, C1-C4 алкокси, галоген(C1-C4)алкокси, C3-C7 циклоалкил(C1-C4)алкоксигруппой, -СООН, C1-C4 алкоксикарбонилом,-NR3R4, -SO2(арилом), морфолино, арилом, арилокси, арил(C1-C4)алкокси или гет; или представляет собой пиридин-2-ил, пиридин-3-ил,пиридин-4-ил, пиримидин-2-ил или пиримидин 5-ил. Еще более предпочтительно R представляет собой 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил,1,2,4-триазол-4-ил или тетразол-5-ил, каждый из которых замещен 1 или 2 заместителями, каждый из которых независимо выбран из метила,этила, пропила, аллила, циклопропила, циклогексила, бром-, гидрокси, этоксикарбонила, 2 хлорфенила, 3-хлорфенила, 4-хлорфенила, 4 диметиламинофенила, 2-гидроксифенила, 2 метоксифенила, 3-метоксифенила, 4-метоксифенила, 2-метилфенила, фенила, 4-трифторметилфенила, 2-амино-1,3,4-оксадиазол-5-ила,2-карбоксипиридин-5-ила,1,5-диметил-1 Нпиразол-3-ила, 1 Н-имидазол-1-ила, 1-метилимидазол-2-ила, 1-метилимидазол-4-ила, 1-метилимидазол-5-ила, 3-метилизотиазол-4-ила, 4 метил-1 Н-имидазол-5-ила, 3-метил-1,2,4-оксадиазол-5-ила, 1-метил-1 Н-пиразол-4-ила, 5 метил-1 Н-пиразол-3-ила, 1-метил-1 Н-пиразол-5 5 ила, 1-оксидопиридин-3-ила, 2-метилпиридин-3 ила, 2-метилпиридин-5-ила, 1-фенилимидазол-4 ила, 5-фенилпиридин-3-ила, 2-фенилпиридин-5 ила, 1-метилпиррол-2-ила, 4-метил-1,2,3-тиадиазол-5-ила, 2-метилтиазол-4-ила, 1-метил-1 Н 1,2,4-триазол-5-ила, 3-(проп-1-ил)-1 Н-пиразол 5-ила, пиразин-2-ила, 1 Н-пиразол-4-ила, пиридазин-4-ила, пиридин-2-ила, пиридин-3-ила,пиридин-4-ила, пиримидин-2-ила, тиен-2-ила,1 Н-1,2,4-триазол-5-ила, 1 Н-1,2,3-триазол-5-ила,хинолин-3-ила и хинолин-6-ила, причем указанные метил, этил или пропил возможно замещены фтором-, гидрокси, метокси, этокси, 2,2,2 трифторэтокси, циклогексилметокси, циклопентилметокси, -СООН, метоксикарбонилом, диметиламино, 4-хлор-фенилсульфонилом, морфолино, фенилом, фенокси, бензилокси, пиридин 2-илом, пиридин-3-илом или пиридин-4-илом; или представляет собой пиридин-2-ил, пиридин 3-ил, пиридин-4-ил, пиримидин-2-ил или пиримидин-5-ил. Примеры R включают в себя: 1-(2-гидроксиэтил)-5-фенил-1,2,3-триазол 4-ил,1-(2-гидроксиэтил)-4-фенил-1,2,3-триазол 5-ил,2-(2-гидроксиэтил)-5-фенил-1,2,3-триазол 4-ил,1-метил-5-фенил-1,2,3-триазол-4-ил,1-метил-4-фенил-1,2,3-триазол-5-ил,2-метил-5-фенил-1,2,3-триазол-4-ил,5-фенил-1 Н-1,2,3-триазол-4-ил,1-метил-1 Н-1,2,4-триазол-3-ил,2-метил-2 Н-1,2,4-триазол-3-ил,4-(2-гидроксиэтил)-4 Н-1,2,4-триазол-3-ил,4-метил-4 Н-1,2,4-триазол-3-ил,3-(2-амино-1,3,4-оксадиазол-5-ил)-5 метил-4 Н-1,2,4-триазол-4-ил,3-бензил-5-(пиридин-3-ил)-4 Н-1,2,4 триазол-4-ил,3-бензилоксиметил-5-(пиридин-3-ил)-4 Н 1,2,4-триазол-4-ил,3-бром-5-(пиридин-3-ил)-4 Н-1,2,4-триазол 4-ил,3-(3-карбоксипроп-1-ил)-5-(пиридин-3-ил)4 Н-1,2,4-триазол-4-ил,3-(2-карбоксипиридин-5-ил)-5-метоксиметил-4 Н-1,2,4-триазол-4-ил,3-(2-хлорфенил)-5-метоксиметил-4 Н-1,2,4 триазол-4-ил,3-(2-хлорфенил)-5-метил-4 Н-1,2,4-триазол 4-ил,3-(3-хлорфенил)-5-метил-4 Н-1,2,4-триазол 4-ил. 3-(4-хлорфенил)-5-метил-4 Н-1,2,4-триазол 4-ил,3-(4-хлорфенилсульфонилметил)-5-метил 4 Н-1,2,4-триазол-4-ил,3-циклогексилметоксиметил-5-(пиридин-3 ил)-4 Н-1,2,4-триазол-4-ил,3-циклопентилметоксиметил-5-(пиридин 3-ил)-4 Н-1,2,4-триазол-4-ил, 001730 9 Предпочтительно R1 и R2 каждый независимо выбран из хлора- и C1-C4 алкила, особенно метила или этила. Наиболее предпочтительно R1 и R2 каждый представляет собой хлор-. Предпочтительно R3 и R4 каждый независимо выбран из водорода и C1-C4 алкила. Наиболее предпочтительно R3 и R4 каждый представляет собой метил. Предпочтительно "арил" означает фенил,возможно замещенный 1 или 2 заместителями,каждый из которых независимо выбран из метила, метокси, гидрокси, хлор-, трифторметила и диметиламино. Примеры "арила" включают в себя 2 хлорфенил, 3-хлорфенил, 4-хлорфенил, 4 диметиламинофенил,2-гидроксифенил,2 метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-метилфенил, фенил и 4-трифторметилфенил. Предпочтительно "гет" означает тиенил,пирролил, пиразолил, имидазолил, триазолил,тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, причем каждый из которых является возможно бензоконденсированным и возможно замещенным 1 или 2 заместителями,каждый из которых независимо выбран из C1-C4 алкила, -СООН, -NR3R4 и фенила, и/или оксидозаместителем на гетероатоме азота в цикле указанной пиридинильной, пиридазинильной, пиримидинильной или пиразинильной группы. Примеры "гет" включают в себя тиен-2-ил,1-метилпиррол-2-ил, 1 Н-пиразол-4-ил, 1-метил 1 Н-пиразол-4-ил, 5-метил-1 Н-пиразол-3-ил, 1 метил-1 Н-пиразол-5-ил, 1,5-диметил-1 Н-пиразол-3-ил, 3-(проп-1-ил)-1 Н-пиразол-5-ил, 1 Нимидазол-1-ил, 1-метилимидазол-2-ил, 1-метилимидазол-4-ил,1-метилимидазол-5-ил,4 метил-1 Н-имидазол-5-ил, 1-фенилимидазол-4 ил, 1 Н-1,2,3-триазол-5-ил, 1 Н-1,2,4-триазол-5 ил, 1-метил-1 Н-1,2,4-триазол-5-ил, 2-метилтиазол-4-ил, 3-метилизотиазол-4-ил, 2-амино 1,3,4-оксадиазол-5-ил,3-метил-1,2,4-оксадиазол-5-ил, 4-метил-1,2,3-тиадиазол-5-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, 2 метилпиридин-3-ил, 2-метилпиридин-5-ил, 1 оксидопиридин-3-ил, 2-карбоксипиридин-5-ил,5-фенилпиридин-3-ил,2-фенилпиридин-5-ил,пиридазин-4-ил, пиримидин-2-ил, пиразин-2-ил,хинолин-3-ил и хинолин-6-ил. Фармацевтически приемлемые соли соединений формулы (I) включают в себя их соли присоединения кислоты и основные соли. Подходящие соли присоединения кислоты получают из кислот, которые образуют нетоксичные соли, и примерами их являются гидрохлориды, гидробромиды, гидроиодиды, сульфаты, гидросульфаты, нитраты, фосфаты, гидрофосфаты, ацетаты, малеаты, фумараты, лактаты,тартраты, цитраты, глюконаты, сукцинаты, бен 001730 10 зоаты, метансульфонаты, бензолсульфонаты и п-толуолсульфонаты. Подходящие основные соли получают из оснований, которые образуют нетоксичные соли, и примерами их являются соли кальция, лития, магния, калия, натрия, цинка, этаноламина,диэтаноламина и триэтаноламина. Обзор подходящих солей см. в Berge et al,J. Pharm. Sci., 66. 1-19, 1977. Соединение формулы (I) может содержать один или более чем один асимметрический атом углерода и, следовательно, может существовать в двух или более чем двух стереоизомерных формах, или может существовать в виде таутомеров. Настоящее изобретение включает в себя отдельные стереоизомеры и таутомеры соединений формулы (I) и их смеси. Разделение диастереоизомеров можно осуществлять традиционными способами, например, фракционной кристаллизацией, хроматографией, или HPLC (высокоэффективной жидкостной хроматографией), смеси стереоизомеров соединения формулы (I) или его соответствующей соли либо производного. Индивидуальный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения либо разделением, таким как HPLC, соответствующего рацемата с использованием подходящего хирального носителя, либо фракционной кристаллизацией солей диастереоизомеров,образованных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием. Некоторые соединения формулы (I) могут существовать в форме особых стереоизомеров,известных как атропоизомеры. Атропоизомеры являются изомерами, которые могут быть разделены только благодаря тому, что вращение вокруг одинарных связей предотвращено или значительно замедлено ["Advanced OrganicWiley and Sons, (1985)]. Они могут быть разделены традиционными способами, такими как способы, описанные в предыдущем абзаце. Настоящее изобретение включает в себя индивидуальные атропоизомеры соединений формулы(I) и их смеси. Предпочтительными примерами соединений формулы (I) являются соединения, где 1) R представляет собой 1-(3-гидроксипропил)тетразол-5-ил, R1 представляет собой хлори R2 представляет собой хлор-; 2) R представляет собой 4-метил-4 Н-1,2,4 триазол-3-ил, R1 представляет собой хлор- и R2 представляет собой хлор-; 3) R представляет собой 1-(2-гидроксиэтил)-5-фенил-1,2,3-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-; 4) R представляет собой 3-метил-5(пиридин-3-ил)-4 Н-1,2,4-триазол-4-ил, R1 пред 11 ставляет собой хлор- и R2 представляет собой хлор-; 5) R представляет собой 3-метил-5(пиридин-3-илметил)-4 Н-1,2,4-триазол-4-ил, R1 представляет собой хлор- и R2 представляет собой хлор-; 6) R представляет собой 3-метоксиметил 5-(пиридин-3-ил)-4 Н-1,2,4-триазол-4-ил,R1 2 представляет собой хлор- и R представляет собой хлор-; 7) R представляет собой 3-(1,5-диметил 1 Н-пиразол-3-ил)-5-метил-4 Н-1,2,4-триазол-4 ил, R1 представляет собой хлор- и R2 представляет собой хлор-; 8) R представляет собой 3-метоксиметил 5-(пиридин-3-ил)-4 Н-1,2,4-триазол-4-ил,R1 2 представляет собой хлор- и R представляет собой метил; 9) R представляет собой 3-метоксиметил 5-(пиридин-3-ил)-4 Н-1,2,4-триазол-4-ил,R1 2 представляет собой метил и R представляет собой хлор-; 10) R представляет собой 3-метоксиметил 5-(хинолин-3-ил)-4 Н-1,2,4-триазол-4-ил,R1 2 представляет собой хлор- и R представляет собой хлор-; или 11) R представляет собой 3-метоксиметил 5-(хинолин-6-ил)-4 Н-1,2,4-триазол-4-ил,R1 2 представляет собой хлор- и R представляет собой хлор-; либо индивидуальный стереоизомер или фармацевтически приемлемая соль любого из них. Особенно предпочтительными соединениями формулы (I) являются 1) R-(-)-6,7-дихлор-5-[3-метоксиметил-5(3-пиридил)-4 Н-1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)хиноксалиндион или его фармацевтически приемлемая соль и 2) натриевая соль R-(-)-6,7-дихлор-5-[3 метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона. Все соединения формулы (I) можно получить кислотным или щелочным гидролизом соединения формулы где R, R1 и R2 такие, как определено для соединения формулы (I), a R5 и R6, либо каждый в отдельности, либо вместе, представляют собой группу или группы, которые могут быть гидролитически расщеплены в кислотных или основных условиях с получением хиноксалиндиона формулы (I). Такая группа или группы являются традиционными, и соответствующие примеры хорошо известны квалифицированному специалисту. Предпочтительно, R5 и R6 либо каждый независимо выбран из C1-C4 алкила (предпочтительно метила или этила) и бензила, возможно 12 замещенного в кольце заместителями числом от 1 до 3, каждый из которых независимо выбран из C1-C4 алкила, C1-C4 алкокси, галогена, нитро и трифторметила, либо они, вместе взятые, представляют собой C1-C6 алкилен, СН(фенил),СН(4-метоксифенил) или СН(3,4-диметоксифенил). Предпочтительно взаимодействие проводят путем кислотного гидролиза соединения формулы (II). При типичной процедуре соединение формулы (II) обрабатывают водным раствором соответствующей кислоты, например минеральной кислоты, такой как соляная кислота, возможно в присутствии подходящего органического со-растворителя, например 1,4-диоксана. Взаимодействие обычно проводят при нагревании смеси до температуры дефлегмации растворителя (растворителей). Промежуточные соединения формулы (II) могут быть получены множеством традиционных способов, например, как описано ниже.(а) Соединения формулы (II), где R представляет собой замещенную тетразол-5-ильную группу можно получить путем, показанным на схеме I. Схема I где R1, R2, R5 и R6 такие, как определено для соединения формулы (II), a Rc является подходящим заместителем, как ранее определено относительно R для соединения формулы (I). При типичной процедуре соединение формулы (III) сначала депротонируют подходящим основанием, например литийдиизопропиламидом, в подходящем растворителе, например тетрагидрофуране, затем полученный карбанион обрабатывают диоксидом углерода. Полученную карбоновую кислоту формулы (IV) превращают в соответствующий хлорангидрид,используя оксалилхлорид и каталитическое количество N,N-диметилформамида в подходящем растворителе, например, дихлорметане, который затем превращают во вторичный амид формулы(V) обработкой in situ амином формулы РcNН 2. Амид формулы (V) сначала обрабатывают пентахлоридом фосфора в подходящем растворителе, например, толуоле, и полученное промежуточное соединение подвергают взаимодействию in situ с триметилсилилазидом с получением соединения формулы (IIА).(б) Соединения формулы (II), где R представляет собой возможно бензоконденсированную/замещенную 5- или 6-членную циклическую гетероарильную группу, которая связана с кольцом хиноксалиндиона через атом углерода в цикле, можно получить путем, показанным на схеме II. Схема II где R1, R2, R5 и R6 такие, как ранее определено для соединения формулы (II), а RD представляет собой возможно бензоконденсированную/замещенную 5- или 6-членную циклическую гетероарильную группу, которая связана с кольцом хиноксалиндиона через атом углерода в цикле, как ранее определено относительно R для соединения формулы (I). При типичной процедуре соединение формулы (III) сначала депротонируют, как описано в способе (а), а затем обрабатывают in situ триметилборатом, после чего проводят кислотный гидролиз с получением бороновой кислоты формулы (VI). Эту кислоту затем подвергают взаимодействию с соединением формулыRDX,где Х представляет собой бром-, йод- или трифторметилсульфонилокси, а RD такой, как определено выше, в присутствии подходящего катализатора, например тетракис(трифенилфосфин) палладия(0), и в подходящих условиях с получением соединения формулы (IIВ).(в) Соединения формулы (II), где R представляет собой возможно 4-замещенную-4 Н 1,2,4-триазол-3-ильную группу, можно получить обработкой соединения формулы (V) сначала пентахлоридом фосфора в подходящем растворителе, например толуоле, а затем взаимодействием полученного промежуточного соединенияC1-C4 алкил)-замещенную-1,2,4-триазол-3 ильную группу, можно получить обработкой соединения формулы (V), где Rc представляет собой Н, N,N-ди(C1-C4 алкил)формамидди(C1C4 алкил)ацеталем,предпочтительноN,Nдиметилформамиддиметилацеталем, взаимодействием полученного промежуточного формамидина с гидразином в присутствии подходящей кислоты, например уксусной кислоты, и затем 14 обработкой полученной таутомерной смеси 5(1 Н- и 2 Н-1,2,4-триазол-3-ил)-замещенных хиноксалинов сначала подходящим основанием,например, гидридом натрия, в подходящем растворителе, например, N,N-диметилформамиде, а затем подходящим возможно замещенным C1C4 алкилгалогенидом (например, йодметаном) с получением N-метил-замещенных продуктов. Смесь полученных 1- и 2-(возможно замещенный C1-C4 алкил)-замещенного-1,2,4-триазол-3-ильных продуктов можно разделить традиционным способом, например, хроматографией.(д) Соединения формулы (II), где R представляет собой возможно замещенную 1,2,4 триазол-4-ильную группу можно получить путем, показанным на схеме III. Схема III где R1, R2, R5 и R6 такие, как ранее определено для соединения формулы (II), а RA и RB каждый независимо выбран из Н или подходящего заместителя, как ранее определено для соединения формулы (I). При типичной процедуре 5-аминохиноксалин формулы (VII) подвергают взаимодействию с соединением формулыRACOX1,1 где X является подходящей уходящей группой,например хлор- или бром-, в подходящем растворителе, например, толуоле или дихлорметане, и возможно в присутствии подходящего акцептора кислоты, например, пиридина, с получением амида формулы (VIII). Амид формулы (VIII) можно превратить в тиоамид формулы (IX) обработкой 2,4-бис(4 метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4 дисульфидом (реагентом Лоуссона) в подходящем растворителе, например, толуоле или тетрагидрофуране. Тиоамид формулы (IX) можно превратить в соединение формулы (IIC) обработкой соединением формулы:RBCONHNH2 в присутствии оксида ртути (II), возможно осушителя, например, молекулярных сит 4 А, и подходящего растворителя, например, нбутанола.(е) Соединения формулы (II), где R представляет собой возможно бензоконденсированную/замещенную 5- или 6-членную циклическую гетероарильную группу, которая связана 15 с кольцом хиноксалиндиона через атом углерода в цикле, можно получить присоединением соединения формулы: где R1, R2, R5 и R6 такие, как определено для соединения формулы (II), к соединению формулы:REX2 2 где X представляет собой Sn(C1-C4 алкил)3,ZnCl, ZnBr, ZnI или -В(ОН)2, a RE такой, как ранее определено для этого способа относительно(ж) Соединения формулы (II), где R представляет собой возможно замещенную 1,2,3 триазол-4-ильную группу можно получить путем, показанным на схеме IV. Схема IV где R1, R2, R5 и R6 такие, как определено для соединения формулы (II), а RF представляет собой Н, или RF и RG каждый независимо представляет собой подходящий заместитель, как ранее определено относительно R для соединения формулы (I). При типичной процедуре 5-йодхиноксалин формулы (X) присоединяют к ацетилену формулы:RF-CCH в подходящих условиях, например, используя хлорид бис(трифенилфосфин)палладия (II), йодид меди (I) и триэтиламин. Полученное соединение формулы (XI) затем подвергают взаимодействию с триметилсилилазидом с получением соединения формулы (IID), которое можно превратить в соединение формулы (IIЕ) традиционным способом, например, если RG представляет собой C1-C4 алкил, то сначала депротонированием соединения формулы (IID) с использованием подходящего основания, например гидрида натрия, а затем взаимодействием с C1-C4 алкилгалогенидом, например, йодметаном. Если получают смесь 1-, 2- и 3-замещенных-1,2,3-триазол 4-ильных изомеров соединения формулы (IIЕ),то их можно разделить традиционным способом, например, хроматографией. Следует понимать, что некоторые соединения формулы (I) или (II) могут быть превра 001730 16 щены в другие соответствующие соединения формулы (I) или (II) традиционными способами,например способами взаимного превращения функциональных групп. Все вышеупомянутые реакции и способы получения новых исходных материалов, применяемых в предыдущих способах являются традиционными, и соответствующие реагенты и условия реакций для их превращения или получения, а также методики выделения целевых продуктов, будут очевидны квалифицированным специалистам в данной области по ссылке на примеры из литературы и примеры и подготовительные примеры в этом документе. Фармацевтически приемлемая соль присоединения кислоты или основная соль соединения формулы (I) может быть легко получена путем смешивания вместе растворов соединения формулы (I) и желаемой кислоты или основания, когда как подходит. Соль можно осадить из раствора и собрать фильтрацией или можно выделить из раствора выпариванием растворителя. Сродство связывания соединений формулы (I) и их солей в отношении сайта глицинаNMDA рецептора можно измерить посредством тестирования их способности замещать селективный радиолиганд сайта глицина из мембран мозга крысы [Brit J. Pharm., 104, 74 (1991)]. В другом варианте данного способа тщательно вымытый мембранный белок инкубируют сtris-ацетатный буфер (рН 7,4) [Mol. Pharm., 41,923 (1992)]. Замещение радиолиганда, используя ряд концентраций тестируемого соединения,используют для установления величин ИK50(50% ингибиторной концентрации). Функциональный in vitro антагонизм глицина доказывают способностью соединений ингибировать деполяризации в кортикальных срезах крысы, индуцированные NMDA, способом, подобным способу, описанному в J. Med.(1985). В другом варианте данной методики ответ на стандартную концентрацию NMDA измеряют в присутствии ряда концентраций тестируемого соединения, и полученные результаты используют для установления величин EK50(50% эффективной концентрации). Сродство связывания соединений по изобретению в отношении АМРА рецептора можно измерить тестированием их способности замещать радиолиганд [3H]-AMPA из мембран мозга крыс. Мембранный гомогенат инкубируют с радиолигандом (10 нМ) в присутствии или отсутствии тестируемых соединений при разных концентрациях при 4 С в течение 45 мин. Свободную и связанную радиоактивную метку отделяют быстрым фильтрованием, а радиоактивность измеряют жидкостным сцинтилляционным счетом. 17 Соединения формулы (I) и их соли можно вводить субъекту, которого лечат, сами по себе,но обычно их вводят в смеси с фармацевтически приемлемым разбавителем или носителем, выбранным в соответствии со способом введения и традиционной фармацевтической практикой. Например, их можно вводить перорально, в том числе подъязычно, в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах или овулях либо одни либо в смеси с эксципиентами, или в форме эликсиров,растворов или суспензий, содержащих корригенты или красители. Их можно вводить парентерально, например, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего использовать в форме стерильных водных растворов, которые могут содержать другие вещества, например достаточно солей или глюкозы, чтобы сделать раствор изотоническим по отношению к крови. Соединения обладают способностью всасываться через желудочно-кишечный тракт, и поэтому введение их с помощью препаратов медленного высвобождения также возможно. Обычно терапевтически эффективная суточная пероральная доза соединений формулы(I) и их солей для лечения может колебаться от 0,1 до 100 мг/кг веса субъекта, которого лечат,предпочтительно 1 до 20 мг/кг, а суточная внутривенная доза может колебаться от 0,01-20 мг/кг веса субъекта, которого лечат, предпочтительно 0,1-20 мг/кг. Соединения формулы (I) и их соли также можно вводить путем внутривенной инфузии при дозе, которая может колебаться от 0,01-10 мг/кг/ч. Таблетки или капсулы соединений можно вводить по одной или по две или более в соответствующее время. Врач будет определять реальную дозу, которая будет наиболее подходящей для индивидуального пациента, и она будет варьироваться в зависимости от возраста, веса и реакции конкретного пациента. Вышеуказанные дозировки являются примером среднего случая. Конечно,могут существовать отдельные случаи, где заслуживают внимания более высокие или более низкие пределы дозировок, и такие случаи включены в объем данного изобретения. Альтернативно, соединения формулы (I) можно вводить ингаляцией или в форме суппозитория или пессария, либо их можно применять местно в форме лосьона, раствора, крема,мази или антисептического порошка. Альтернативным способом трансдермального введения является использование кожного пластыря. Например, они могут входить в состав крема, содержащего водную эмульсию полиэтиленгликолей или жидкий парафин. Также они при концентрации между 1 и 10 мас.% могут входить в состав мази, содержащей основу из белого воска или белого мягкого парафина вместе с такими 18 стабилизаторами и консервантами, какие могут потребоваться. Очевидно, что ссылка на лечение включает в себя как профилактику, так и облегчение установленных симптомов заболевания. Таким образом, далее в изобретении предложены: 1) фармацевтическая композиция, содержащая соединение формулы (I), или его фармацевтически приемлемую соль, вместе с фармацевтически приемлемым разбавителем или носителем; 2) соединение формулы (I), или его фармацевтически приемлемая соль либо композиция,для применения в качестве лекарственного средства; 3) применение соединения формулы (I),или его фармацевтически приемлемой соли либо композиции, для производства лекарственного средства для лечения заболевания продуцированием антагонистического эффекта наNMDA рецепторе; 4) применение как в (3), где заболевание представляет собой острое нейродегенеративное или хроническое неврологическое расстройство; 5) способ воздействия на млекопитающее для лечения заболевания продуцированием антагонистического эффекта на NMDA рецепторе,при котором на указанное млекопитающее воздействуют эффективным количеством соединения формулы (I) или его фармацевтически приемлемой соли либо композиции; 6) способ как в (5), где заболевание представляет собой острое нейродегенеративное или хроническое неврологическое расстройство; и 7) соединение формулы (II). Следующие примеры и подготовительные примеры иллюстрируют получение соединений формулы (I) вместе с промежуточными соединениями, используемыми в их синтезе. Точки плавления определяли, используя прибор Buchi, в стеклянных капиллярных трубках и не корректировали. Данные массспектроскопии низкого разрешения (LRMS) регистрировали на масс-спектрометре FisonsTrio 1000 (термовпрыск с использованием ацетата аммония в водном метаноле в качестве носителя или химическая ионизация при атмосферном давлении (APCI) с использованием смеси метанол:уксусная кислота 97,5:2,5, объемн., и газообразного азота в качестве носителя). Данные ЯМР регистрировали на ЯМР приборе Вruker АС 300 или Varian Unity 300 (оба 300 МГц) или Unity Inova-400 (400 МГц) и они соответствовали написанным структурам. Флэш-хроматографию осуществляли на Kieselgel 60 (230-400 меш) от E.Merck, Darmstadt. Для тонкослойной хроматографии (ТСХ) использовали Kieselgel 60 F254 пластинки от E.Merck, а соединения проявляли при помощи УФ света или раствора платинохлористо-водородная кислота/йодид калия. В случаях соединений, ана 19 лизируемых в виде гидратов, присутствие воды доказывали увеличенным пиком, обусловленным водой, в протонном ЯМР спектре. Чистоту соединений внимательно оценивали, используя аналитическую ТСХ и протонный ЯМР (300 МГц), а последний из указанных способов использовали для расчета количества растворителя в сольватированных образцах. В многостадийных последовательностях, чистоту и структуру промежуточных соединений проверяли с помощью протонной ЯМР спектроскопии. Сдвиги протонного ЯМР указаны в частях на миллион по отношению к тетраметилсилану. В примерах и подготовительных примерах использованы некоторые сокращения, хорошо известные квалифицированным специалистам. Пример 1. 6,7-Дихлор-5-(4-пиридил)-2,3 Смесь 6,7-дихлор-2,3-диметокси-5-(4 пиридил)хиноксалина (подготовительный пример 2, 110 мг, 0,327 ммоль), 2 М водного раствора соляной кислоты (1 мл) и 1,4-диоксана (7 мл) нагревают с обратным холодильником в течение 2 ч, охлаждают и концентрируют при пониженном давлении. Твердый остаток растирают с водой, собирают фильтрацией и промывают водой и диэтиловым эфиром с получением указанного в заголовке соединения (17 мг, 17%) в виде белого твердого вещества, т.пл.300 С.m/z (термовпрыск) 308 (МН+). Анализ (%): Найдено: С, 49.58; Н, 2.36; N,12.93. С 13 Н 7 Сl2N3O20,5 Н 2O требует С, 49.24; Н,2.54; N, 13.25. Пример 2-107. Следующие приведенные в таблице соединения общей формулы получают способом, подобным способу примера 1, с использованием соответствующих указанных производных 2,3-диметоксихиноксалина и при времени реакции, которое соответствует приблизительно полному расходованию исходного материала, контролируемому ТСХ. В примерах 8, 82 и 84 происходит гидролиз сопутствующего эфира, тогда как в примерах от 104 до 106 расщепляется тритильная группа.(пример 8, 42 мг, 0,12 ммоль) в насыщенном метанольном растворе хлороводорода (5 мл) нагревают с обратным холодильником в атмосфере азота в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении, и остаток распределяют между водой (10 мл) и дихлорметаном (10 мл). Водную фазу отделяют и экстрагируют дихлорметаном (2 х 25 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток растирают с диэтиловым эфиром и фильтруют с получением указанного в заголовке соединения (24 мг, 55%) в виде бледно-серого твердого вещества, т.пл. 281-283 С. 1 Примечания: 1) Реакцию проводят, как описано в примере 1, но при 50 С в течение 9 ч. Неочищенный продукт очищают флэш-хроматографией на силикагеле, элюируя смесью дихлорметан : метанол (95:5, объемн.) в качестве элюента, а затем смесью дихлорметан:метанол:уксусная кислота (80:20:1, объемн.). 2) Полученное твердое вещество растворяют в горячей воде (4 мл), охлаждают до 0 С и собирают фильтрацией. 3) Продукт получают в виде оранжевого масла, которое растворяют в дистиллированной воде (4 мл) и сушат замораживанием. 4) Исходный материал получают способом, подобным способу в подготовительном примере 7, промежуточное соединение гидразида получают способом, подобным способу в подготовительном примере 117. Указанное в заголовке соединение получают способом, подобным способу примера 1,используя 6-хлор-2,3-диметокси-7-метил-5-[5 метоксиметил-3-(3-пиридил)-4-1,2,4-триазол-4 ил]-2,3(1 Н,4 Н)-хиноксалин (подготовительный пример 114) вместо 6,7-дихлор-2,3-диметокси-5(4-пиридил)хиноксалина. Остаток, полученный при концентрировании реакционной смеси, растворяют в 1 М водном растворе гидроксида натрия, рН смеси доводят до 6 2 М водным раствором соляной кислоты и охлаждают до 0 С. Полученное твердое вещество собирают фильтрацией и промывают водой с образованием не совсем белого твердого вещества, т.пл. 229231 С. Анализ (%): Найдено: С, 51.33; Н, 4.16; N,19.99. Указанное в заголовке соединение получают способом, подобным способу примера 1,используя 7-хлор-2,3-диметокси-6-метил-5-[5 метоксиметил-3-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]хиноксалин (подготовительный пример 115) вместо 6,7-дихлор-2,3-диметокси-5-(4 пиридил)хиноксалина. Остаток, полученный при концентрировании реакционной смеси, растворяют в 1 М водном растворе гидроксида натрия, рН раствора доводят до 6 2 М водным раствором соляной кислоты и охлаждают до 0 С. Полученное твердое вещество собирают фильтрацией и промывают водой с получением бледно-желтого твердого вещества, т.пл. 300 С.(подготовительный пример 26, 73,8 г, 0,27 моль) и пиридина (26,4 мл, 25,8 г, 0,33 моль) в дихлорметане (1,2 л) при комнатной температуре в атмосфере азота. После 18 ч перемешивания при комнатной температуре смесь промывают 2 М водным раствором соляной кислоты, а затем рассолом, потом сушат (МgSO4) и концентрируют при пониженном давлении. Остаток растирают с метанолом и фильтруют с получением 6,7-дихлор-2,3-диметокси-5-метоксиацетамидохиноксалина (82,0 г, 88%) в виде не совсем белого твердого вещества, т.пл. 171-173 С. Анализ (%): Найдено: С, 44.97; Н, 3.75; N,12.03. 26 дихлор-2,3-диметокси-5-метоксиацетамидохиноксалина (27 г, 78 ммоль) в тетрагидрофуране (480 мл) и перемешивают смесь в течение 18 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:дихлорметан (1:1 изменяется до 1:4, объемн.) в качестве элюента, с получением 6,7 дихлор-2,3-диметокси-5-метокситиоацетамидохиноксалина (29,1 г, 100%) в виде белого твердого вещества, т.пл. 198-200 С, содержащего незначительную примесь. Анализ (%): Найдено: С, 43.06; Н, 3.65; N,11.59. С 13 Н 13 Сl2N3 О 3S требует С, 43.11; Н, 3.62;c) Смесь 6,7-дихлор-2,3-диметокси-5 метокситиоацетамидохиноксалина (25,3 г, 69,9 ммоль), гидразида никотиновой кислоты (19,3 г,140,8 ммоль), оксида ртути (II) (15,1 г, 69,7 ммоль) и 1,4-диоксана (600 мл) нагревают с обратным холодильником в течение 18 ч. После охлаждения смесь фильтруют через вспомогательный порошок для фильтрования ARBOCEL(торговая марка), и остаток промывают дихлорметаном. Фильтрат концентрируют при пониженном давлении с получением светлокоричневого твердого вещества, которое распределяют между этилацетатом и 2 М водным раствором соляной кислоты. Слои разделяют, и водный слой экстрагируют дихлорметаном(2 х 500 мл, 4 х 100 мл). Объединенные дихлорметановые экстракты сушат (MgSО 4) и концентрируют при пониженном давлении. Остаток кристаллизуют из смеси этилацетат/метанол с получением-6,7-дихлор-2,3-диметокси-5-[3 метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]-хиноксалина (11,6 г, 37%) в виде бледножелтого твердого вещества, т.пл. 189-191 С. Анализ (%): Найдено: С, 50.10; Н, 3.57; N,18.53.d) Смесь -6,7-дихлор-2,3-диметокси-5[3-метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол-4-ил]-хиноксалина (3,0 г, 6,7 ммоль), 2 М водного раствора соляной кислоты (10 мл) и 1,4 диоксана (50 мл) нагревают с обратным холодильником в течение 9 ч, охлаждают и концентрируют при пониженном давлении. Остаток растворяют в 1 М водном растворе гидроксида натрия и подкисляют до рН 4,5 концентрированной соляной кислотой с получением густого белого осадка. Осадок собирают фильтрацией и промывают водой с получением -6,7-дихлор 5-[3-метоксиметил-5-(3-пиридил)-4 Н-1,2,4 триазол-4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона (2,0 г, 68%) в виде не совсем белого твердого вещества, т.пл. 230-232 С.e) (1) (-)-N-Метилэфедрин (0,88 г, 4,9 ммоль), а затем метанол (66 мл) добавляют к перемешиваемой суспензии -6,7-дихлор-5-[3 метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона (1,9 г, 4,3 ммоль) в этилацетате (400 мл) при комнатной температуре. Смесь нагревают до ее точки кипения. Смесь фильтруют, фильтрат концентрируют до 3/4 его объема и затем охлаждают до комнатной температуры. Полученное твердое вещество собирают фильтрацией и промывают этилацетатом. Твердое вещество кристаллизуют из смеси этилацетат/метанол с получением одиночного диастереоизомера исходного материала хиноксалиндиона в виде соли (-)-N-метилэфедрина (1,28 г, 43%), т.пл. 162-164 С. Анализ (%): Найдено: С, 55.74; Н, 5.38; N,14.38. С 28 Н 29 Сl2N7O4.СН 3 СО 2 С 2 Н 5 требует C,55.98; Н, 5.43; N, 14.28.(1,2 г, 1,7 ммоль) из раздела е) (1) в воде (13 мл) при комнатной температуре подкисляют до рН 5 концентрированной соляной кислотой и перемешивают в течение 1 ч. Полученное твердое вещество собирают фильтрацией, промывают водой и кристаллизуют из смеси вода/этанол с получением (-)-6,7-дихлор-5-[3-метоксиметил-5(3-пиридил)-4 Н-1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)хиноксалиндиона (0,48 г, 62%) в виде белого твердого вещества, т.пл. 220-222 С. Анализ (%): Найдено: С, 45.49; Н, 3.21; N,18.72. С 17 Н 12 Сl2N6 О 31,5 Н 2 О требует С, 45.76; Н,3.39; N, 18.83.(3) Объединенные фильтраты из раздела е)(1) концентрируют до сухого состояния, остаток растворяют в воде (20 мл), подкисляют до рН 3 концентрированной соляной кислотой, и полученное твердое вещество собирают фильтрацией, промывают водой и сушат. (+)-N-Метилэфедрин (0,37 г, 2,06 ммоль), а затем метанол(28 мл) добавляют к перемешиваемой суспензии этого твердого вещества (0,80 г, 1,87 ммоль) в этилацетате (170 мл) при комнатной температуре, и нагревают эту смесь до ее точки кипения. Смесь фильтруют, концентрируют до 3/4 ее объема, а затем охлаждают до комнатной температуры. Полученное твердое вещество собирают фильтрацией и промывают этилацетатом. Твердое вещество кристаллизуют из смеси этилацетат/метанол с получением единственного диастереоизомера исходного материала хиноксалиндиона в виде соли (+)-N-метилэфедрина (0,93 г, 32%), т.пл. 164-167 С.(0,90, 1,35 ммоль) из раздела е) (3) в воде (10 мл) при комнатной температуре подкисляют до рН 5 концентрированной соляной кислотой и перемешивают в течение 1 ч. Полученное твердое вещество собирают фильтрацией и промывают водой с получением (+)-6,7-дихлор-5-[3 метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона (0,41 г, 69%) в виде белого твердого вещества, т.пл. 222224 С. Анализ (%): Найдено: С, 46.44; Н, 3.18; N,19.01. С 17 Н 12 Сl2N6 О 3.1,25 Н 2O требует C, 46.22; Н,3.31; N, 19.02. Указанное в заголовке соединение получают из показанного исходного материала (который получают способами, подобными способам, описанным в подготовительном примере 113, стадии с), d) и е), подготовительном примере 114 и подготовительном примере 115 из 6 хлор-7-этил-5-нитро-2,3(1 Н,4 Н)-хиноксалиндиона (см. WO-A-95/12417 способом, подобным способу примера 109. Его выделяют в виде желтой пены. Анализ (%): Найдено: С, 48.68; Н, 4.18; N,17.60. С 19 Н 17N6 О 3 СlHClH2O требует С, 48.83; Н,4.31; N, 17.98. m/z (термовпрыск) 413,0 (МН+). Пример 113. 7-Хлор-6-этил-5-[3-метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол-4-ил]2,3(1 Н,4H)-хиноксалиндион. Указанное в заголовке соединение получают из показанного исходного материала (который получают способами, подобными способам, описанным в подготовительном примере 113, стадии с), d) и е), подготовительном примере 114 и подготовительном примере 115 из 7 хлор-6-этил-5-нитро-2,3(1 Н,4 Н)-хиноксалиндиона (см. WO-A-95/12417 способом, подобным способу примера 109. Его выделяют в виде желтой пены.(0,85 г, 4,93 ммоль) в ацетоне (20 мл) одной порцией добавляют к суспензии (-)-6,7-дихлор 5-[3-метоксиметил-5-(3-пиридил)-4 Н-1,2,4 триазол-4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона (см. Пример 111) (1,0 г, 2,24 ммоль) в ацетоне (40 мл), который растворяет все твердые вещества. Реакционную смесь перемешивают при комнатной температуре в течение 40 мин, по окончании которых начинает образовываться твердое вещество. Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 3 дней. Белое твердое вещество собирают фильтрацией и очищают флэш-хроматографией на силикагеле, используя смесь дихлорметан:метанол:ледяная уксусная кислота (90:10:1,объемн.) в качестве элюента, с получением, после объединения и концентрирования соответствующих фракций, указанного в заголовке соединения (0,16 г, 17%) в виде белого твердого вещества, т.пл. 310 С.[]D25 -235 (с=0.1, этанол). Пример 115-129. Следующие приведенные в таблице соединения общей формулы: получают способом, подобным способу примера 1, используя соответствующие производные 2,3 диметоксихиноксалина, и при времени реакции,которое соответствует приблизительно полному расходованию исходного материала, контролируемому ТСХ. Таблица 2 Пример 130. Натриевая соль (-)-6,7 дихлор-5-[3-метоксиметил-5-(3-пиридил)-4 Н 1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона. Гидроксид натрия (0,959 мл 1 молярного водного раствора, 0,959 ммоль) добавляют к перемешиваемой суспензии (-)-6,7-дихлор-5-[3 метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол 4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона (см. пример 111) (0,428 г, 0,959 ммоль) в воде (10 мл), и смесь перемешивают в течение 0,5 ч. Полученный раствор фильтруют, и фильтрат сушат замораживанием с получением указанного в заголовке соединения (0,43 г, 94%) в виде белого твердого вещества, т.пл. 260 С (разл.). Анализ (%): Найдено: С, 42.90; Н, 2.89; N,17.76.[]D25-2280 (c=0.1, H2O). Пример 131. Внутривенный препарат натриевой соли (-)-6,7-дихлор-5-[3-метоксиметил 5-(3-пиридил)-4 Н-1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)хиноксалиндиона. Препарат, подходящий для введения дозы активного компонента 20 мг/мл путем внутривенной инъекции готовят, используя натриевую соль(-)-6,7-дихлор-5-[3-метоксиметил-5-(3 пиридил)-4 Н-1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)хиноксалиндиона, 1,5 Н 2 О (см. пример 130) (22,4 мг на стандартную дозу), хлорид натрия (9,0 мг на стандартную дозу) и воду для инъекций (до 1,0 мл). 31 Для того чтобы поучить препарат, хлорид натрия растворяют в 75% от суммарного объема воды в подходящем сосуде при перемешивании. Затем добавляют натриевую соль (-)-6,7-дихлор 5-[3-метоксиметил-5-(3-пиридил)-4 Н-1,2,4-триазол-4-ил]-2,3(1 Н,4 Н)-хиноксалиндиона, 1,5 Н 2O,и растворяют при перемешивании. Затем к раствору добавляют воду до объема и фильтруют через очищающий фильтр (0,2 мкм). Фильтратом заполняют стерильные 10 мл стеклянные ампулы в стерильных условиях, используя окончательно очищающие фильтры, и ампулы запаивают. Следующие подготовительные примеры иллюстрируют синтезы некоторых промежуточных соединений, используемых в предыдущих примерах. Подготовительный пример 1. 6,7-Дихлор 2,3-диметоксихиноксалин Раствор метоксида натрия (25 мас.%/об. в метаноле, 190 мл, 880 ммоль) добавляют по каплям к перемешиваемой суспензии 2,3,6,7 тетрахлорхиноксалина (106 г, 400 ммоль) в метаноле (1400 мл) при комнатной температуре в атмосфере азота. Через 3 дня добавляют раствор метоксида натрия (25 мас.%/об. в метаноле, 40 мл, 190 ммоль), а затем тетрагидрофуран (300 мл). Реакционную смесь нагревают с обратным холодильником в течение 5 мин, охлаждают,концентрируют до небольшого объема при пониженном давлении и вливают в воду (500 мл). Осадок собирают фильтрацией и промывают водой с получением указанного в заголовке соединения (97 г, 95%) в виде розового твердого вещества, т.пл. 144-146 С. 1-78 С в атмосфере азота. Через 1 ч при -78 С добавляют триметилборат (1,47 мл, 2,0 г, 19,3 ммоль). Раствор перемешивают в течение последующего 1 ч и затем оставляют нагреваться до комнатной температуры в течение 18 ч. Добавляют воду (50 мл), раствор подкисляют до рН 1 2 М раствором соляной кислоты и экстрагируют дихлорметаном (3 х 150 мл). Объеди 001730 32 ненные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле градиентным элюированием с использованием смеси дихлорметан : метанол (100:1 изменяется до 99:1, объемн.) в качестве элюента с получением 6,7-дихлор-2,3 диметоксихиноксалин-5-бороновой кислотыb) Смесь 6,7-дихлор-2,3-диметоксихиноксалин-5-бороновой кислоты (0,27 г, 0,89 ммоль), 4-бромпиридина (0,14 г, 0,89 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,031 г, 0,026 ммоль) в смеси с 2 М водным раствором карбоната натрия (1 мл), этанолом (0,5 мл) и толуолом (10 мл) нагревают с обратным холодильником в атмосфере азота в течение 24 ч. После охлаждения смесь распределяют между водой (20 мл) и дихлорметаном (20 мл). Фазы разделяют и водную фазу экстрагируют дихлорметаном (3 х 50 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении с получением коричневого твердого вещества, которое очищают флэш-хроматографией на силикагеле,элюируя смесью гексан : этилацетат (3:1, объемн.), с получением указанного в заголовке соединения (0,113 г, 38%) в виде бежевого твердого вещества. 1m/z (термовпрыск) 336 (МН+). Подготовительные примеры 3-5. Следующие указанные в таблице соединения получают способом, подобным способу в подготовительном примере 2, стадия b), используя 6,7-дихлор-2,3-диметоксихиноксалин-5 бороновую кислоту и соответствующие гетероциклические бромиды (R-Br) вместо 4 бромпиридина. Литийдиизопропиламидмоно(тетрагидрофуран) (1,5 М в циклогексане, 15,5 мл, 23,3 ммоль) добавляют к перемешиваемой суспензии 6,7-дихлор-2,3-диметоксихиноксалина (подготовительный пример 1, 5,0 г, 19,3 ммоль) в сухом тетрагидрофуране (150 мл) при -78 С в атмосфере азота. Реакционную смесь перемешивают при этой температуре в течение 1 ч, затем через раствор при -78 С барботируют безводный диоксид углерода в течение 1 ч. Добавляют насыщенный водный раствор хлорида аммония(80 мл), и полученную смесь оставляют нагреваться до комнатной температуры, подкисляют до рН 1 2 М водным раствором соляной кислоты и экстрагируют этилацетатом (3 х 50 мл). Объединенные органические экстракты затем экстрагируют 1 М водным раствором гидроксида натрия. Водный раствор подкисляют до рН 1 2 М водным раствором соляной кислоты и экстрагируют дихлорметаном (3 х 50 мл). Объединенные дихлорметановые экстракты сушат (MgSO4) и концентрируют при пониженном давлении с получением указанного в заголовке соединения К раствору 6,7-дихлор-2,3-диметоксихиноксалин-5-карбоновой кислоты (подготовительный пример 6, 0,890 г, 2,93 ммоль) в дихлорметане (25 мл) при комнатной температуре в атмосфере азота добавляют сухой N,N-диметилформамид (50 мкл, 47,2 мг, 0,64 ммоль), а затем оксалилхлорид (0,338 мл, 3,8 ммоль). Через 0,5 ч смесь концентрируют при пониженном давлении. К остатку при комнатной температуре в атмосфере азота добавляют дихлорметан (10 мл), а затем метиламин (33 мас.%/мас. раствор в этаноле, 10 мл, 80,3 ммоль). Через 10 мин смесь упаривают при пониженном давлении, и остаток распределяют между дихлорметаном (20 мл) и 1 М водным раствором соляной кислоты. Органический экстракт сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле градиентным элюированием с использованием смеси дихлорметан:метанол (100:1 изменяется до 99:1,объемн.) в качестве элюента с получением твер 001730 34 дого вещества, которое перекристаллизовывают из толуола с получением указанного в заголовке соединения (0,570 г, 61%) в виде белого твердого вещества. 1(подготовительный пример 7, 0,197 г, 0,62 ммоль) в толуоле (7 мл), и смесь нагревают с обратным холодильником в атмосфере азота в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют триметилсилилазид (123 мкл, 0,107 г, 0,93 ммоль). После перемешивания при комнатной температуре в течение 18 ч добавляют разбавленный водный раствор аммиака (20 мл), и смесь экстрагируют дихлорметаном (3 х 50 мл). Объединенные органические экстракты сушат (MgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле,элюируя дихлорметаном, с получением указанного в заголовке соединения (0,080 г, 38%) в виде белого твердого вещества. 1m/z (термовпрыск) 341 (МН+). Подготовительный примеры 9-17. Следующие указанные в таблице соединения получают способами, подобными способам в подготовительных примерах 7 и 8, используя 6,7-дихлор-2,3-диметоксихиноксалин-5-карбоновую кислоту и соответствующий первичный амин (R-NH2) вместо метиламина. Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 7, используя аллиламин вместо метиламина. 1 Н-ЯМР (300 МГц, CDCl3):= 4,10 (3 Н, s),4,14 (3 Н, s), 4,19 (2 Н, m), 5,20 (1 Н, d, J=10 Гц),5,38 (1 Н, dd, J=10 Гц), 5,85 (1 Н, br s), 6,00 (1 Н,m), 7,88 (1 Н, s). Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 8, используя 6,7-дихлор-2,3 диметокси-5-(N-аллилкарбамоил)хиноксалин 9-Борабицикло[3.3.1]нонан (0,5 М в тетрагидрофуране, 9,1 мл, 4,55 ммоль) добавляют по каплям к перемешиваемой суспензии 6,7 дихлор-2,3-диметокси-5-(1-аллил-1 Н-тетразол 5-ил)хиноксалина (подготовительный пример 19, 0,67 г, 1,82 ммоль) в сухом тетрагидрофуране (15 мл) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают с обратным холодильником в течение 18 ч, к охлажденной реакционной смеси порциями до 001730 36 бавляют триметиламин-N-оксид (1,03 г, 13,7 ммоль), и смесь нагревают с обратным холодильником в течение 2 ч, затем концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан : метанол (100:0 изменяется до 99,5:0,5, объемн.) в качестве элюента, с получением указанного в заголовке соединения (0,510 г, 73%) в виде белого твердого вещества, т.пл. 188-189 С. 1 Диизобутилалюминийгидрид (1 М в тетрагидрофуране, 0,7 мл, 0,7 ммоль) добавляют по каплям к перемешиваемому раствору 6,7 дихлор-2,3-диметокси-5-(1-метоксикарбонилметил-1 Н-тетразол-5-ил)хиноксалина (подготовительный пример 11, 0,126 г, 0,32 ммоль) в дихлорметане (15 мл) при -78 С в атмосфере азота. Через 1 ч реакционную смесь оставляют нагреваться до комнатной температуры и добавляют диизобутилалюминийгидрида (1 М в тетрагидрофуране, 0,7 мл, 0,7 ммоль), а затем через 30 мин добавляют дополнительное количество диизобутилалюминийгидрида (1 М в тетрагидрофуране, 0,7 мл, 0,7 ммоль). После дополнительных 0,25 ч к смеси добавляют насыщенный раствор хлорида аммония (20 мл), и водную фазу экстрагируют дихлорметаном (2 х 25 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат (МgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, элюируя смесью дихлорметан : метанол(99:1, объемн.), с получением указанного в заголовке соединения (93 мг, 79%) в виде белого твердого вещества. 1a) Пентахлорид фосфора (0,67 г, 3,22 ммоль) добавляют к перемешиваемой суспензии 6,7-дихлор-2,3-диметокси-5-(N-аллилкарбамоил)хиноксалина (подготовительный пример 18,1,0 г, 2,93 ммоль) в толуоле (40 мл) при комнатной температуре и затем нагревают с обратным холодильником в течение 1 ч. После охлаждения добавляют формилгидразин (0,585 г, 8,79 ммоль) и триэтиламин (0,592 г, 8,79 ммоль), и смесь нагревают с обратным холодильником в течение 1 ч. После охлаждения смесь распределяют между этилацетатом (60 мл) и 10 мас.% водным раствором карбоната калия (60 мл). Фазы разделяют, и водную фазу экстрагируют этилацетатом (2 х 40 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле,градиентным элюированием с использованием смеси толуол : этилацетат (1:0 изменяется до 1:1, объемн.) в качестве элюента, с получением 6,7-дихлор-2,3-диметокси-5-(4-аллил-4 Н-1,2,4 триазол-3-ил)хиноксалин (0,112 г, 10%) в виде белого твердого вещества, т.пл. 206-208 С. 1b) Раствор 6,7-дихлор-2,3-диметокси-5-(4 аллил-4 Н-1,2,4-триазол-3-ил)хиноксалина (0,1 г,0,273 ммоль) в дихлорметане (3 мл) охлаждают до -70 С и в течение 0,5 ч пропускают поток озона/кислорода. Потом в течение 0,25 ч пропускают поток азота и затем добавляют метанол(3 мл) и боргидрид натрия (0,026 г, 0,683 ммоль). После нагрева до комнатной температуры смесь распределяют между дихлорметаном(10 мл) и рассолом (10 мл). Фазы разделяют и водную фазу экстрагируют этилацетатом (2 х 10 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэшхроматографией на силикагеле, градиентным элюированием с использованием смеси этилацетат:метанол (100:0 изменяется до 95:5, объемн.),с получением указанного в заголовке соединения (0,042 г, 40%) в виде не совсем белого твердого вещества, т.пл. 212-214 С. 1 Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 22, стадия а), используя 6,7 дихлор-2,3-диметокси-5-(N-метилкарбамоил)хиноксалин (подготовительный пример 7) вместо 6,7-дихлор-2,3-диметокси-5-(N-аллилкарбамоил)хиноксалина. Очистка флэш-хроматографией на силикагеле посредством градиентного элюирования с использованием смеси толуол:этилацетат (1:1 изменяется до 0:1, объемн.) приводит к получению не совсем белого твердого вещества. 1 Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 7, используя газообразный аммиак вместо метиламина, и с получением бледно-желтого твердого вещества (в хроматографии нет необходимости). 1 Н-ЯМР (300 МГц, DMSO-d6):= 4,00 (3 Н,s), 4,06 (3 Н, s), 7,80 (1 Н, br.s), 7,92 (1H, br s),8,00 (1H, s). а) 6,7-Дихлор-2,3-диметоксихиноксалин-5 карбоксамид (подготовительный пример 24,1,96 г, 6,49 ммоль) в N,N-диметилформамиддиметилацетале (25 мл) нагревают с обратным холодильником в течение 2 ч. После охлажде 39 ния смесь концентрируют при пониженном давлении, и остаток растирают с диэтиловым эфиром с получением N1,N1-диметил-N2-[6,7 дихлор-2,3-диметоксихиноксалин-5-илкарбонил]формамидина (2,14 г, 92%) в виде бледножелтого твердого вещества. 1(0,599 г, 11,98 ммоль) в ледяной уксусной кислоте (80 мл) нагревают с обратным холодильником в течение 2 ч. После охлаждения твердое вещество собирают фильтрацией и промывают диэтиловым эфиром. Часть этого твердого вещества (1,108 г) суспендируют в сухом N,Nдиметилформамиде (80 мл) при комнатной температуре в атмосфере азота и обрабатывают гидридом натрия (80% мас./мас. дисперсия в масле, 0,122 г, 4,08 ммоль). После перемешивания в течение 0,25 ч добавляют йодметан (0,579 г, 4,08 ммоль), и смесь нагревают при 50 С в течение 6 ч. Смесь охлаждают, фильтруют и фильтрат концентрируют при пониженном давлении. Остаток распределяют между дихлорметаном (80 мл) и рассолом (80 мл). Фазы разделяют, и водную фазу экстрагируют дихлорметаном (2 х 80 мл). Объединенные органические экстракты сушат (МgSO4) и концентрируют при пониженном давлении. Остаток очищают флэшхроматографией на силикагеле, градиентным элюированием с использованием смеси толуол:этилацетат (4:1 изменяется до 1:1, объемн.), с получением первого элюата, изомер 1, экспериментально определенного как 6,7-дихлор-2,3 диметокси-5-(2-метил-2 Н-1,2,4-триазол-3 ил)хиноксалин (0,18 г, 10%) в виде белого твердого вещества, т.пл. 208-210 С. 1m/z (термовпрыск) 340 (МН+). Второй элюат, изомер 2, экспериментально определенный как 6,7-дихлор-2,3-диметокси-5(1-метил-1 Н-1,2,4-триазол-3-ил)хиноксалин(0,11 г, 6%) получают в виде белого твердого вещества, т.пл. 184-186 С. 1a) Смесь 6,7-Дихлор-5-нитро-2,3(1 Н,4 Н)хиноксалиндиона (пример 1 в WO-A-94/00124,84 г, 0,34 моль); тионилхлорида (840 мл) и диметилформамида (0,5 мл) нагревают с обратным холодильником в течение 3 ч, охлаждают и концентрируют при пониженном давлении. Этилацетат (300 мл) добавляют, а потом удаляют выпариванием при пониженном давлении, и затем эту процедуру повторяют с петролейным эфиром (т.кип. 100-120 С). Твердый остаток перекристаллизовывают из петролейного эфираb) Дигидрат хлорида олова (II) (346,3 г,1,54 моль) добавляют к раствору 2,3,6,7 тетрахлор-5-нитрохиноксалина(96,2 г,0,31 моль) в этилацетате (1,8 л). Смесь нагревают с обратным холодильником в течение 4 ч, охлаждают и осторожно вливают в избыток насыщенного водного раствора бикарбоната натрия. Смесь фильтруют через CELITE (торговая марка), хорошо промывают этилацетатом. Остаток на фильтре размачивают дополнительным количеством этилацетата, и твердый материал фильтруют. Объединенные этилацетатные фазы сушат (МgSO4) и концентрируют при пониженном давлении с получением 5-амино-2,3,6,7 тетрахлорхиноксалина (73,4 г, 84%) в виде желтого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):= 5,45 (2 Н, br,s), 7,47 (1 Н, s).(В альтернативном способе эту стадию восстановления выполняют с использованием железных стружек в водном растворе уксусной кислоты). с) Раствор метоксида натрия (25 мас.%/мас. раствор в метаноле, 274 мл, 1,28 моль) добавляют к суспензии 5-амино-2,3,6,7 тетрахлорхиноксалина (72,4 г, 0,256 моль) в сухом метаноле (1 л), и полученную смесь нагревают с обратным холодильником в течение 30 мин. Смесь охлаждают, концентрируют при пониженном давлении, и остаток распределяют между водой и этилацетатом (суммарный объем 8 л). Органические экстракты сушат (МgSO4) и концентрируют при пониженном давлении. Неочищенный продукт растирают с метанолом,затем растворяют в дихлорметане (2 л) и фильтруют. Фильтрат концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде желтого твердого вещества (55,0 г, 79%). 1a) Ацетилхлорид (5,71 мл, 6,30 г, 80,3 ммоль) добавляют к интенсивно перемешиваемой суспензии 5-амино-6,7-дихлор-2,3-диметоксихиноксалина (подготовительный пример 26,20,49 г, 64,8 ммоль) в толуоле (500 мл), и полученную смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения продукт собирают фильтрацией, промывают толуолом и сушат при разрежении в течение 15 ч с получением 5-ацетамидо-6,7-дихлор-2,3-диметоксихиноксалина (20,49 г, 89%) в виде бежевого твердого вещества. 1 Н-ЯМР (300 МГц, DMSO-d6):= 2,11 (3 Н,s), 4,04 (3 Н, s), 4,05 (3 Н, s), 7,91 (1H, s), 9,80 (1H,s).b) 5-Ацетамидо-6,7-дихлор-2,3-диметоксихиноксалин (20,49 г, 64,8 ммоль) добавляют к перемешиваемой суспензии 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфиду (реагент Лоуссона) (15,7 г, 38,9 ммоль) в толуоле (432 мл) при комнатной температуре в атмосфере азота. Смесь нагревают до температуры дефлегмации 25 мин и выдерживают при той температуре в течение дальнейших 90 мин. После охлаждения смесь концентрируют при пониженном давлении, и остаток очищают флэш-хроматографией на силикагеле, используя дихлорметан в качестве элюента. 6,7-Дихлор 2,3-диметокси-5-тиоацетамидохиноксалинc) Смесь 6,7-дихлор-2,3-диметокси-5-тиоацетамидохиноксалина (250 мг, 0,753 ммоль), 3 хлорбензгидразида (167 мг, 0,978 ммоль), оксида ртути (II) (163 мг, 0,753 ммоль), порошковых молекулярных сит 4 А (175 мг) и н-бутанола (7 мл) нагревают с обратным холодильником в течение 18 ч. После охлаждения смесь фильтруют через вспомогательный порошок для фильтрования ARBOCEL (торговая марка), и остаток промывают дихлорметаном. Фильтрат концентрируют при пониженном давлении с получением зеленого твердого вещества, которое растворяют в дихлорметане, два раза промывают 2 М водным раствором соляной кислоты, а потом рассолом, затем сушат (MgSO4) и концентрируют при пониженном давлении. Ос 001730m/z (термовпрыск) 450 (МН+). Подготовительный примеры 28-95. Следующие указанные в таблице соединения получают способом, подобным способу в подготовительном примере 27, используя 5 амино-6,7-дихлор-2,3-диметоксихиноксалин и соответствующий хлорангидрид (RACOCl) и гидразид (RBCONHNH2). Примечания 1) При получении используют этилкарбазат в качестве "гидразидного" исходного материала. Окончательную циклизацию осуществляют нагреванием в ксилоле. 2) Продукт является неожиданным продуктом реакции гидразида из подготовительного примера 118. Подготовительный пример 96. 6,7-Дихлор 2,3-диметокси-5-[3-(3-метил-1,2,4-оксадиазол-5 ил)-5-(3-пиридил)-4 Н-1,2,4-триазол-4-ил]хиноксалин. Ацетамидоксим (120 мг, 1,62 ммоль), а потом гидрид натрия (80% мас./мас. дисперсия в масле, 8 мг, 0,27 ммоль) добавляют к перемешиваемой суспензии 6,7-дихлор-2,3-диметокси-5[3-этоксикарбонил-5-(3-пиридил)-4 Н-1,2,4 триазол-4-ил]хиноксалину (подготовительный пример 94, 250 мг, 0,53 ммоль) в сухом толуоле(15 мл) при комнатной температуре в атмосфере азота. Смесь нагревают с обратным холодильником в течение 3,5 ч, охлаждают и раствор распределяют между этилацетатом и рассолом. Водную фазу экстрагируют этилацетатом (2 х 20 мл), объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан : этилацетат (7:3 изменяется до 1:1, объемн.), с получением указанного в заголовке соединения (210 мг, 82%) в виде белого твердого вещества. 1 Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 96, используя 6,7-дихлор-2,3 диметокси-5-(3-этоксикарбонил-5-метил-4 Н 1,2,4-триазол-4-ил)хиноксалин (подготовительный пример 67) вместо 6,7-дихлор-2,3-диметокси-5-[3-этоксикарбонил-5-(3-пиридил)-4 Н 1,2,4-триазол-4-ил]хиноксалина. Очистка флэш 001730 46 хроматографией на силикагеле градиентным элюированием с использованием смеси дихлорметан: метанол (1:0 изменяется до 95:5, объемн.) приводит к получению белого твердого вещества. 1 1 М водный раствор гидроксида натрия(17,25 мл, 17,25 ммоль) добавляют по каплям к перемешиваемому раствору 6,7-дихлор-2,3 диметокси-5-[3-этоксикарбонил-5-(3-пиридил)4 Н-1,2,4-триазол-4-ил]хиноксалину (подготовительный пример 94, 8,2 г, 17,25 ммоль) в 1,4 диоксане (68 мл) и воде (50 мл) при 10 С. Раствор нагревают до комнатной температуры и перемешивают в течение 20 ч, разбавляют водой(50 мл), подкисляют ледяной уксусной кислотой и экстрагируют этилацетатом (1 х 100 мл, 2 х 50 мл). Oбъединенные органические экстракты промывают рассолом, сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле,градиентным элюированием с использованием смеси дихлорметан: метанол (1:0 изменяется до 9:1, объемн.), с получением указанного в заголовке соединения (5,82 г, 84%) в виде белого твердого вещества, т.пл. 206-207 С. Анализ (%): Найдено: С, 50.49; Н, 3.06; N,20.44.(подготовительный пример 98, 102 мг, 0,25 ммоль) в 1,1,1 трихлорэтане (6 мл) при комнатной температуре в атмосфере азота, и смесь нагревают с обратным холодильником в течение 18 ч. Смесь концентрируют при пониженном давлении, и остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:этилацетат (7:3 изменяется до 1:1, объемн.), с получением указанного в за 47 головке соединения (87 мг, 71%) в виде белого твердого вещества. 1 а) 6,7-Дихлор-2,3-диметокси-5-(3-бром-5 метил-4 Н-1,2,4-триазол-4-ил)хиноксалин получают способом, подобным способу в подготовительном примере 99, используя 6,7-дихлор-2,3 диметокси-5-(3-метил-4 Н-1,2,4-триазол-4 ил)хиноксалин (подготовительный пример 78,50 мг, 0,147 ммоль) вместо 6,7-дихлор-2,3 диметокси-5-[3-(3-пиридил)-4 Н-1,2,4-триазол-4 ил]хиноксалина. Его получают в виде бледнокоричневого твердого вещества (53 мг, 86%). 1b) Смесь имидазола (78 мг, 1,15 ммоль) и 6,7-дихлор-2,3-диметокси-5-(3-бром-5-метил 4 Н-1,2,4-триазол-4-ил)хиноксалина (48 мг, 0,115 ммоль) нагревают при 100 С в течение 1 ч, затем при 120 С в течение 3 ч. После охлаждения смесь распределяют между водой (15 мл) и дихлорметаном (2 х 15 мл). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан:метанол (98:2 изменяется до 95:5, объемн.), с получением указанного в заголовке соединения (15 мг, 32%) в виде коричневого твердого вещества. 1 Н-ЯМР (300 МГц, DMSO-d6):= 2,27 (3 Н,s), 4,11 (6 Н, s), 7,16 (2 Н, br s), 7,79 (1H, br s),7,95 (1H, s). 48 в уксусной кислоте (14 мл) нагревают при 125 С в течение 3 ч в запаянном сосуде. После охлаждения смесь концентрируют при пониженном давлении и остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан : метанол (1:0 изменяется до 95:5, объемн.), с получением указанного в заголовке соединения(0,60 г, 56%) в виде белого твердого вещества,т.пл. 209-210 С. Анализ (%): Найдено: С, 49.86; Н, 3.31; N,19.18. С 18 Н 14 Сl2N6 О 3 требует C, 49.90; Н. 3.26; Указанное в заголовке соединение в виде белого твердого вещества получают способом,подобным способу в подготовительном примере 101, используя 6,7-дихлор-2,3-диметокси-5-(3 метил-4 Н-1,2,4-триазол-4-ил)хиноксалин (подготовительный пример 78) вместо 6,7-дихлор 2,3-диметокси-5-[3-(3-пиридил)-4 Н-1,2,4 триазол-4-ил]хиноксалина. 1(подготовительный пример 98, 101 мг, 0,25 ммоль), параформальдегида (15 мг, 0,5 ммоль) и гидрохлорида диметиламина (22 мг, 0,27 ммоль) в уксусной кислоте (5 мл) нагревают с обратным холодильником в течение 5 ч. После охлаждения смесь концентрируют при пониженном давлении, добавляют воду (20 мл), основность раствора повышают раствором карбоната калия,и экстрагируют этилацетатом (3 х 20 мл). Объединенные органические экстракты сушат(МgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан : метанол (1:0 изменяется до 95:5, объемн.), с получением указанного в заголовке соединения (75 мг,65%) в виде белого твердого вещества, т.пл. 192-194 С. Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 103, используя гидрохлорид морфолина вместо гидрохлорида диметиламина. Его получают в виде белого твердого вещества,т.пл. 178-179 С. 1 Н-ЯМР (300 МГц, СDСl3):= 2,10 (4 Н,m), 3,10 (4 Н, m), 3,56 (2 Н, m), 3,80 (3 Н, s), 4,18 Диизобутилалюминийгидрид (1 М в тетрагидрофуране, 2,5 мл, 2,5 ммоль) добавляют к раствору 6,7-дихлор-2,3-диметокси-5-(3-этоксикарбонил-5-фенил-4 Н-1,2,4-триазол-4-ил)хиноксалина (подготовительный пример 93, 237 мг, 0,5 ммоль) в дихлорметане (10 мл) при комнатной температуре в атмосфере азота. Через 1 ч добавляют дополнительное количество диизобутилалюминийгидрида (1 М в тетрагидрофуране, 1 мл, 1 ммоль), смесь перемешивают в течение еще 1 ч, затем добавляют насыщенный водный раствор хлорида аммония (10 мл). Добавляют дихлорметан (50 мл) и воду (50 мл), и смесь фильтруют через ARBOCEL (торговая марка), промывая остаток теплой смесью дихлорметан : метанол (9:1, объемн., 100 мл). Органический слой отделяют, сушат (МgSO4) и выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:этилацетат : метанол (1:1:0 изменяется до 0:1:0, объемн.), с получением указанного в заголовке соединения (70 мг, 79%) в виде не совсем белого твердого вещества. 1 Указанное в заголовке соединение в виде не совсем белого твердого вещества получают способом, подобным способу в подготовительном примере 105, используя 6,7-дихлор-2,3 диметокси-5-(3-этоксикарбонил-4 Н-1,2,4-триазол-4-ил)хиноксалин (подготовительный пример 92) вместо 6,7-дихлор-2,3-диметокси-5-(3-этоксикарбонил)-5-фенил-4 Н-1,2,4-триазол-4-ил) хиноксалина. 1 Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 105, используя 6,7-дихлор-2,3 диметокси-5-[3-этоксикарбонилметил-4 Н-1,2,4 триазол-4-ил]хиноксалин(подготовительный пример 68) вместо 6,7-дихлор-2,3-диметокси-5(3-этоксикарбонил)-5-фенил-4 Н-1,2,4-триазол-4 ил)хиноксалина. Реакцию проводят в толуоле вместо дихлорметана, а очистку осуществляют флэш-хроматографией на силикагеле градиентным элюированием с использованием смеси дихлорметан:метанол (1:0 изменяется до 95:5,объемн.). Кристаллизация из диизопропилового эфира приводит к получению не совсем белого твердого вещества. 1 К механически перемешиваемому раствору 5-амино-6,7-дихлор-2,3-диметоксихиноксалину (подготовительный пример 26, 38,12 г,0,14 моль) в ацетоне при 0 С добавляют 2 М водный раствор соляной кислоты (396 мл, 0,79 моль), а затем по каплям добавляют 1 М водный раствор нитрита натрия (208 мл, 0,28 моль). Через 0,25 ч при 0 С добавляют 5 М водный рас 51 твор йодида калия (278 мл, 1,39 моль), поддерживая температуру реакции ниже 5 С. Смесь затем нагревают до 10 С за 0,5 ч, ацетон удаляют при пониженном давлении, а остаток распределяют между водой и этилацетатом. Органический экстракт затем промывают 10%-ным водным раствором бисульфита натрия, затем насыщенным водным раствором бикарбонатата натрия, сушат (МgSO4) и концентрируют при пониженном давлении. Остаток очищают флэшхроматографией на силикагеле, используя толуол в качестве элюента, с получением указанного в заголовке соединения (16,9 г, 32%). 1(1965)] (0,077 г, 0,623 ммоль), тетракис(трифенилфосфин)палладия (0) (0,03 г, 0,026 ммоль) и карбоната калия (0,143 г, 1,038 ммоль) в 1,4-диоксане (12 мл) и воде (4 мл) нагревают с обратным холодильником в течение 16 ч. После охлаждения смесь концентрируют при пониженном давлении, и остаток распределяют между этилацетатом (20 мл) и водой (20 мл). Фазы разделяют, и водную фазу экстрагируют этилацетатом (2 х 40 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан:метанол (1:0 изменяется до 99:1,объемн.), с получением указанного в заголовке соединения (0,051 г, 29%) в виде желтого твердого вещества. 1 52 г, 1,3 ммоль) в триэтиламине (100 мл) нагревают с обратным холодильником в течение 4 ч. После охлаждения смесь концентрируют при пониженном давлении, и остаток распределяют между дихлорметаном (200 мл) и рассолом (200 мл). Фазы разделяют, и водную фазу экстрагируют дихлорметаном (2 х 100 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле,градиентным элюированием с использованием смеси гексан:дихлорметан (1:0 изменяется до 1:1, объемн.), с получением 6,7-дихлор-2,3 диметокси-5-(2-фенилэтинил)хиноксалин (3,60 г, 77%) в виде желтого твердого вещества, т.пл. 170-172 С. 1 Н-ЯМР (300 МГц, СDСl3):= 4,14 (3 Н, s),4,26 (3 Н, s), 7,39 (3 Н, m), 7,67 (2H, m), 7,87 (1H,s).b) Смесь 6,7-дихлор-2,3-диметокси-5-(2 фенилэтинил)хиноксалина (2,0 г, 5,57 ммоль) и триметилсилилазида (20 мл) нагревают при 170 С в запаянном сосуде в течение 18 ч. После охлаждения добавляют воду (20 мл), а затем насыщенный водный раствор гидрокарбоната натрия (50 мл), и смесь экстрагируют этилацетатом (3 х 50 мл). Объединенные органические экстракты сушат (МgSO4) и концентрируют при пониженном давлении. Остаток очищают флэшхроматографией на силикагеле, градиентным элюированием с использованием смеси дихлорметан : метанол (1:0 изменяется до 98:2, объемн.), с получением указанного в заголовке соединения (1,3 г, 58%) в виде коричневой пены. 1(0,194 г, 1,37 ммоль). Смесь перемешивают при 0C в течение 0,5 ч, а затем в течение 0,5 ч при комнатной температуре. Добавляют рассол (50 мл), и смесь экстрагируют дихлорметаном (3 х 50 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток очищают флэшхроматографией на силикагеле, градиентным элюированием с использованием смеси толуол:этилацетат (1:0 изменяется до 9:1, объемн.), с получением первого элюата, изомер 1, экспериментально определенного как 6,7-дихлор-2,3 диметокси-5-[2-метил-5-фенил-2 Н-1,2,3-триазол-4-ил]хиноксалин (0,19 г, 37%), в виде бледно-желтого твердого вещества, т.пл. 233-235 С. 1 Н-ЯМР (300 МГц, СDСl3):= 3,67 (3 Н, s),4,14 (3 Н, s), 4,38 (3 Н, s), 7,23 (3 Н, m), 7,38 (2 Н,m), 8,05 (1 Н, s).m/z (термовпрыск) 416 (МH+). Второй элюат, изомер 2, экспериментально определенный как 6,7-дихлор-2,3-диметокси-5[1-метил-5-фенил-1 Н-1,2,3-триазол-4-ил]хиноксалин (0,135 г, 26%), получают в виде бледножелтого твердого вещества, т.пл. 189-190 С. 1m/z (термовпрыск) 416 (МН+). Третий элюат, изомер 3, экспериментально определенный как 6,7-дихлор-2,3-диметокси-5[1-метил-4-фенил-1 Н-1,2,3-триазол-5-ил]хиноксалин (0,046 г, 9%), получают в виде оранжевого масла. 1 Указанные в заголовке соединения получают способом, подобным способу в подготовительном примере 111,используя 2(трифенилметокси)этилбромид [Liebigs Ann. 635, 3 (1960)] вместо йодметана и очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси толуол:диэтиловый эфир (1:0 изменяется до 9:1,объемн.), с получением первого элюата, изомер 1, экспериментально определенного как 6,7 дихлор-2,3-диметокси-5-[5-фенил-2-(2(трифенилметокси)этил)-2 Н-1,2,3-триазол-4 ил]хиноксалин (0,336 г, 45%), в виде белого твердого вещества. 1m/z (термовпрыск) 688 (МН+). Второй элюат, изомер 2, экспериментально определенный как 6,7-дихлор-2,3-диметокси-5[5-фенил-1-(2-(трифенилметокси)этил)-1 Н-1,2,3 триазол-4-ил]хиноксалин (0,104 г, 14%), получают в виде белого твердого вещества. 1m/z (термовпрыск) 688 (МН+). Третий элюат, изомер 3, экспериментально определенный как 6,7-дихлор-2,3-диметокси-5[4-фенил-1-(2-(трифенилметокси)этил)1 Н-1,2,3 триазол-5-ил]хиноксалин (0,037 г, 5%), получают в виде не совсем белого твердого вещества. 1 а) Смесь 1,2-диамино-4-хлор-5-метилбензола гидрохлорида (1,90 г, 9,84 ммоль), щавелевой кислоты (1,24 г, 13,8 ммоль) и 4 М водного раствора соляной кислоты (49 мл) нагревают с обратным холодильником в течение 4,5 ч. После охлаждения твердый осадок собирают фильтрацией, хорошо промывают водой и сушат при пониженном давлении при 80 С с получением 6-хлор-7-метил-2,3(1 Н,4 Н)-хиноксалиндионb) 6-Хлор-7-метил-2,3(1 Н,4 Н)-хиноксалиндион (1,26 г, 5,98 ммоль) добавляют порциями в течение 3 мин к интенсивно перемешиваемой концентрированной азотной кислоте (10 мл,d=1,42) при комнатной температуре. Полученную гетерогенную смесь затем нагревают до 40 С и перемешивают в течение 12 ч. После охлаждения желтую смесь вливают в ледяную воду (100 мл) и перемешивают в течение 30 мин. Полученный желтый осадок собирают фильтрацией, промывают водой и сушат при разрежении с получением 6-хлор-7-метил-5 нитро-2,3(1 Н,4 Н)-хиноксалиндиона и 7-хлор-6 метил-5-нитро-2,3(1 Н,4 Н)-хиноксалиндиона(молярное соотношение 1:2, 1,35 г, 88%) в виде желтого твердого вещества. 1(1,35 г, 5,73 ммоль), тионилхлорида (12,5 мл,20,4 г, 0,172 моль) и диметилформамида (44 мкл, 42 мг, 0,573 ммоль) нагревают с обратным холодильником в течение 4 ч. После охлаждения смесь осторожно добавляют к интенсивно перемешиваемой ледяной воде (300 мл). Полученный осадок собирают фильтрацией, промывают водой и сушат при разрежении с получением смеси 2,3,7-трихлор-6-метил-5-нитрохиноксалина и 2,3,6-трихлор-7-метил-5-нитрохино 001730 56 ксалина (молярное соотношение 2:1, 1,45 г,87%) в виде порошка соломенного цвета. Эту смесь можно было разделить, с трудностью в отношении целей характеристики, флэшхроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:дихлорметан (9:1 изменяется до 3:1, объемн.), с получением в качестве первого элюированного изомера,2,3,7-трихлор-6-метил-5 нитрохиноксалина, в виде белого твердого вещества, т.пл. 164-165 С. Анализ (%): Найдено: С, 36.76; Н, 1.37; N,14.43. С 9 Н 4 Сl3N3O2 требует С, 36.96; Н,1.38; N,14.37. Второй элюированный изомер, 2,3,6 трихлор-7-метил-5-нитрохиноксалин, получают в виде твердого вещества соломенного цвета,т.пл. 121-122 С. Анализ (%): Найдено: С, 39.78; Н, 2.02; N,13.23. С 9H4Cl3N3O20,22 гексан требует С, 39.80; Н, 2.29; N, 13.49.d) Вышеуказанную смесь 2,3,7-трихлор-6 метил-5-нитрохиноксалина и 2,3,6-трихлор-7 метил-5-нитрохиноксалина (250 мг, 0,855 ммоль) и дигидрата хлорида олова (II) (1,35 г,5,98 ммоль) в этилацетате (8,5 мл) нагревают с обратным холодильником в течение 3 ч в атмосфере азота. После охлаждения смесь разбавляют этилацетатом (50 мл) и промывают 10%-ным водным раствором карбоната натрия (2 х 25 мл),рассолом (25 мл), сушат (MgSO4), фильтруют и концентрируют при пониженном давлении с получением смеси 5-амино-2,3,7-трихлор-6 метилхиноксалина и 5-амино-2,3,6-трихлор-7 метилхиноксалина (молярное соотношение 2:1,217 мг, 97%) в виде оранжевого твердого вещества. 1e) 25%-ный мас./мас. раствор метоксида натрия в метаноле (433 мкл, 1,89 ммоль) по каплям добавляют к раствору вышеуказанной смеси 5-амино-2,3,7-трихлор-6-метилхиноксалина и 5-амино-2,3,6-трихлор-7-метилхиноксалина (200 мг, 0,788 ммоль) в сухом тетрагидрофуране (7,9 мл) при 0 С в атмосфере азота. Смесь перемешивают в течение 3 ч, разбавляют этилацетатом(10 мл), сушат (MgSO4), фильтруют и концентрируют при пониженном давлении. Твердый остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:этилацетат (95:5 изменяется до 1:1, объемн.), с получением в качестве первого элюированного изомера 5-амино-6 хлор-2,3-диметокси-7-метилхиноксалина в виде 57 не совсем белого твердого вещества (48 мг,25%), т.пл. 169-170 С. Анализ (%): Найдено: С, 53.80; Н, 5.16; N,16.18. С 11 Н 12 СlN3O20,15 гексан требует C, 53.61; Н, 5.33; N, 15.76. Второй элюированный изомер, 5-амино-7 хлор-2,3-диметокси-6-метилхиноксалин (85 мг,44%), получают в виде оранжевого твердого вещества, т.пл. 181-182 С. Анализ (%): Найдено: С, 52.55; Н, 4,72; N,16.61. С 11 Н 12 СlN3O20,05 гексан требует C, 52.61; Н, 4.96; N, 16.29. Подготовительный пример 114. 6-Хлор 2,3-диметокси-7-метил-5-[5-метоксиметил-3-(3 пиридил)-4 Н-1,2,4-триазол-4-ил]хиноксалин. а) Метоксиацетилхлорид (2,16 мл, 2,57 г,23,66 ммоль) добавляют к раствору 5-амино-6 хлор-2,3-диметокси-7-метилхиноксалина (подготовительный пример 113, 5 г, 19,72 ммоль) и пиридина (1,91 мл, 1,89 г, 23,66 ммоль) в дихлорметане (80 мл) при 0 С. После еще 1 ч при этой температуре смесь промывают 2 М водным раствором соляной кислоты, рассолом, сушат(MgSO4) и концентрируют при пониженном давлении. Остаток растирают с диизопропиловым эфиром и фильтруют с получением 6-хлор 2,3-диметокси-5-метоксиацетамидо-7-метилхиноксалина (6,06 г, 98%) в виде не совсем белого твердого вещества, т.пл. 170-171 С. 1(120 мл) и смесь перемешивают в течение 18 ч,затем выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле, градиентным элюированием с использованием смеси гексан:дихлорметан (1:1 изменяется до 1:4, изменяется до 0:1, объемн.), с получением 6-хлор-2,3-диметокси-5-метокситиоацетамидо-7-метилхиноксалина (5,48 г, 87%) в виде желтой пены, т.пл. 174-176 С. 1(1,16 г, 8,5 ммоль), оксида ртути (II) (1,84 г, 8,5 ммоль), порошковых молекулярных сит 4 А(1,06 г) и н-бутанола (60 мл) нагревают с обратным холодильником в течение 8 ч. После охлаждения смесь фильтруют через ARBOCEL (торговая марка), и остаток промывают дихлорметаном. Фильтрат концентрируют при пониженном давлении с получением светло-коричневого твердого вещества, которое распределяют между этилацетатом и 2 М водным раствором соляной кислоты. Водный слой экстрагируют дихлорметаном (4 х 50 мл), объединенные дихлорметановые экстракты сушат (MgSO4) и концентрируют при пониженном давлении. Остаток кристаллизуют из смеси диизопропиловый эфир/метанол с получением твердого вещества (394 мг). Маточные растворы от кристаллизации выпаривают при пониженном давлении, и остаток очищают флэш-хроматографией на силикагеле, используя этилацетат в качестве элюента, с получением, после растирания с диизопропиловым эфиром, дополнительного количества твердого вещества (364 мг). Два твердых вещества объединяют вместе с получением указанного в заголовке соединения (740 мг, 41%) в виде бледно-желтого твердого вещества, т.пл. 183-184 С. 1 Указанное в заголовке соединение получают способом, подобным способу в подготовительном примере 114, используя 5-амино-7 хлор-2,3-диметокси-6-метилхиноксалин (подготовительный пример 113) вместо 5-амино-6 хлор-2,3-диметокси-7-метилхиноксалина. Его получают в виде не совсем белого твердого вещества, т.пл. 166-168 С. 1(1968)] (0,40 г, 2,2 ммоль) и N-этоксикарбонил 2-этокси-1,2-дигидрохинолина (0,60 г, 2,4 ммоль) в дихлорметане (10 мл) перемешивают при комнатной температуре в атмосфере азота в течение 0,75 ч. Затем добавляют гидразингидрат(0,110 мл, 2,2 ммоль) и после дополнительных 5 мин образовавшийся осадок собирают фильтрацией, промывают дихлорметаном и сушат с получением указанного в заголовке соединения(0,349 г, 81%) в виде белого твердого вещества,т.пл. 177-180 С. 1 Смесь этилового эфира пиримидин-2 карбоновой кислоты [Ann. Chim., 5, 351 (1960)](0,866 г, 5,7 ммоль) и гидразингидрата (0,332 мл, 6,8 ммоль) в этаноле (20 мл) нагревают с обратным холодильником в течение 3 ч, затем концентрируют при повышенном давлении. Остаток растирают с диэтиловым эфиром, собирают фильтрацией и промывают этилацетатом с получением указанного в заголовке соединения(0,542 г, 69%) в виде желтого твердого вещества, т.пл. 173-175 С. 1m/z (термовпрыск) 139 (МН+). Подготовительные примеры 118-132. Следующие указанные в таблице соединения получают способом, подобным способу в подготовительном примере 117, используя гидразингидрат и соответствующий этиловый эфир 1) Этиловый эфир 2-бромпиридин-5 карбоновой кислоты. Смесь 2-бромпиридин-5-карбоновой кислоты [J. Org. Chem., 12, 456 (1947)] (2,32 г,11,49 ммоль) и N-этоксикарбонил-2-этокси-1,2 дигидрохинолина (3,12 г, 12,64 ммоль) в дихлорметане (30 мл) перемешивают при комнатной температуре в течение 1 ч в атмосфере азота. Добавляют абсолютный этанол (5 мл), и перемешивают смесь в течение 30 мин, затем концентрируют при пониженном давлении. Остаток распределяют между дихлорметаном (40 мл) и 10% мас./мас. водным раствором карбоната калия (40 мл). Водный слой экстрагируют дихлорметаном (25 мл), и объединенные органические слои сушат (МgSO4) и концентрируют при пониженном давлении. Очистка флэшхроматографией на силикагеле с дихлорметаном в качестве элюента приводит к получению этилового эфира 2-бромпиридин-5-карбоновой кислоты (2,18 г, 83%) в виде бесцветного масла. Анализ (%): Найдено: С, 41.57; Н, 3,45; N,5.98. C8H8NO2Br требует С, 41.77; Н, 3.50; N,6.09. 2) Этиловый эфир 2-фенилпиридин-5 карбоновой кислоты. Смесь этилового эфира 2-бромпиридин-5 карбоновой кислоты (см. раздел 1) (1,855 г,
МПК / Метки
МПК: A61K 31/498, C07D 401/04, A61P 25/28
Метки: хиноксалиндионы
Код ссылки
<a href="https://eas.patents.su/30-1730-hinoksalindiony.html" rel="bookmark" title="База патентов Евразийского Союза">Хиноксалиндионы.</a>