Способы регулирования содержания маннозы в рекомбинантных белках
Номер патента: 16153
Опубликовано: 28.02.2012
Авторы: Флинн Грегори, Ле Николь, Ву Джин, Де Ла Круз Майкл
Формула / Реферат
1. Способ получения рекомбинантного антитела или его антигенсвязывающего фрагмента с низким содержанием маннозы, включающий стадии:
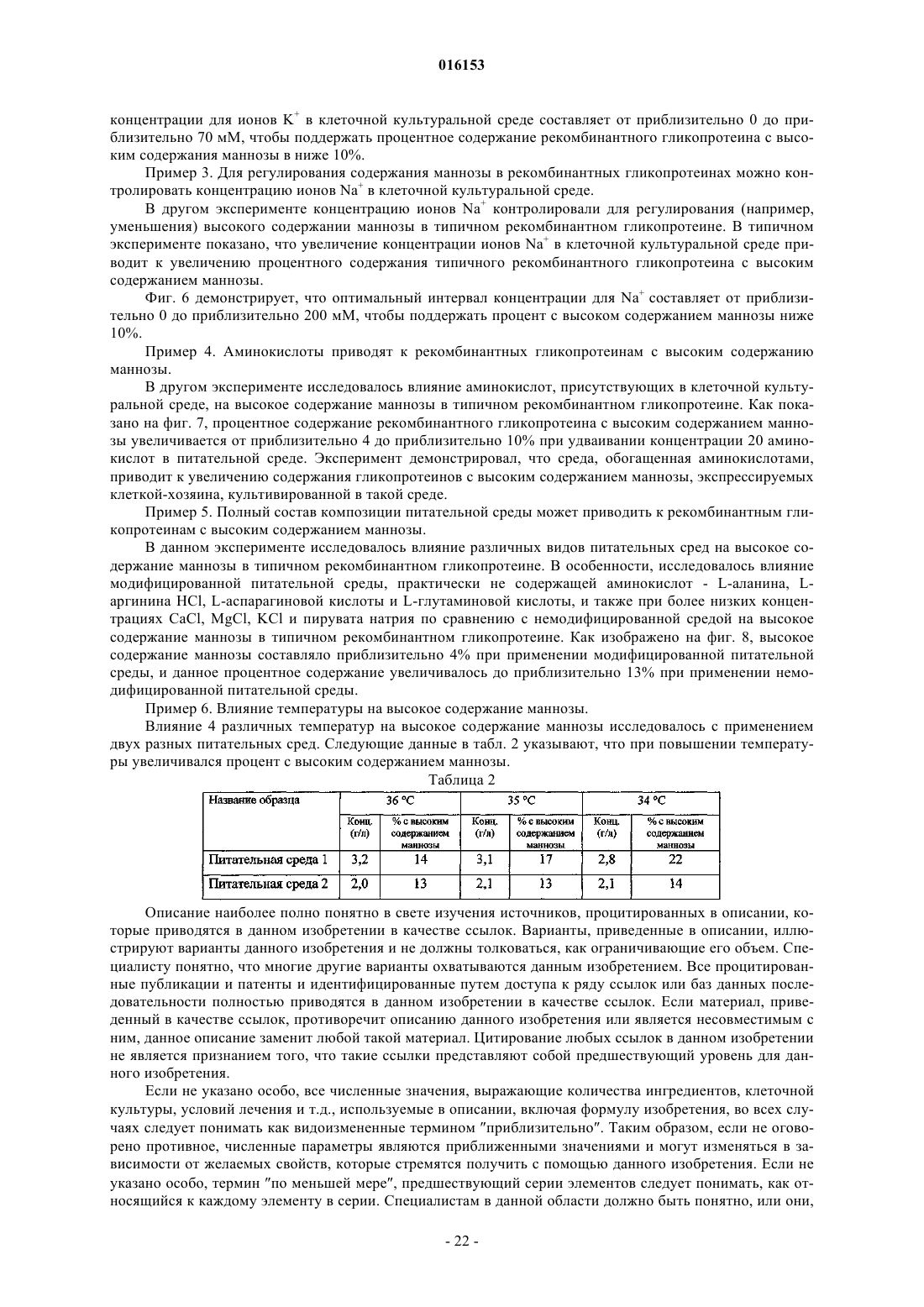
(а) культивирования клетки-хозяина, которая экспрессирует рекомбинантное антитело или его антигенсвязывающий фрагмент, в культуральной среде с осмолярностью приблизительно 600 мосмоль/кг или менее; и
(б) очистки рекомбинантного антитела или его антигенсвязывающего фрагмента от указанной культуральной среды.
2. Способ получения рекомбинантного человеческого моноклонального антитела или его антигенсвязывающего фрагмента, который связывает IL-15, включающий стадии:
(а) культивирования клетки-хозяина, которая экспрессирует антитело или его антигенсвязывающий фрагмент, в культуральной среде с осмолярностью приблизительно 600 мосмоль/кг или менее; и
(б) очистки человеческого моноклонального антитела или его антигенсвязывающего фрагмента от указанной культуральной среды,
где антитело или его антигенсвязывающий фрагмент включает вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, или ее консервативные аминокислотные замены, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2, или ее консервативные аминокислотные замены.
3. Способ по любому из пп.1 или 2, при котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 600 мосмоль/кг.
4. Способ по п.3, при котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 500 мосмоль/кг.
5. Способ по п.3, в котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 380 мосмоль/кг.
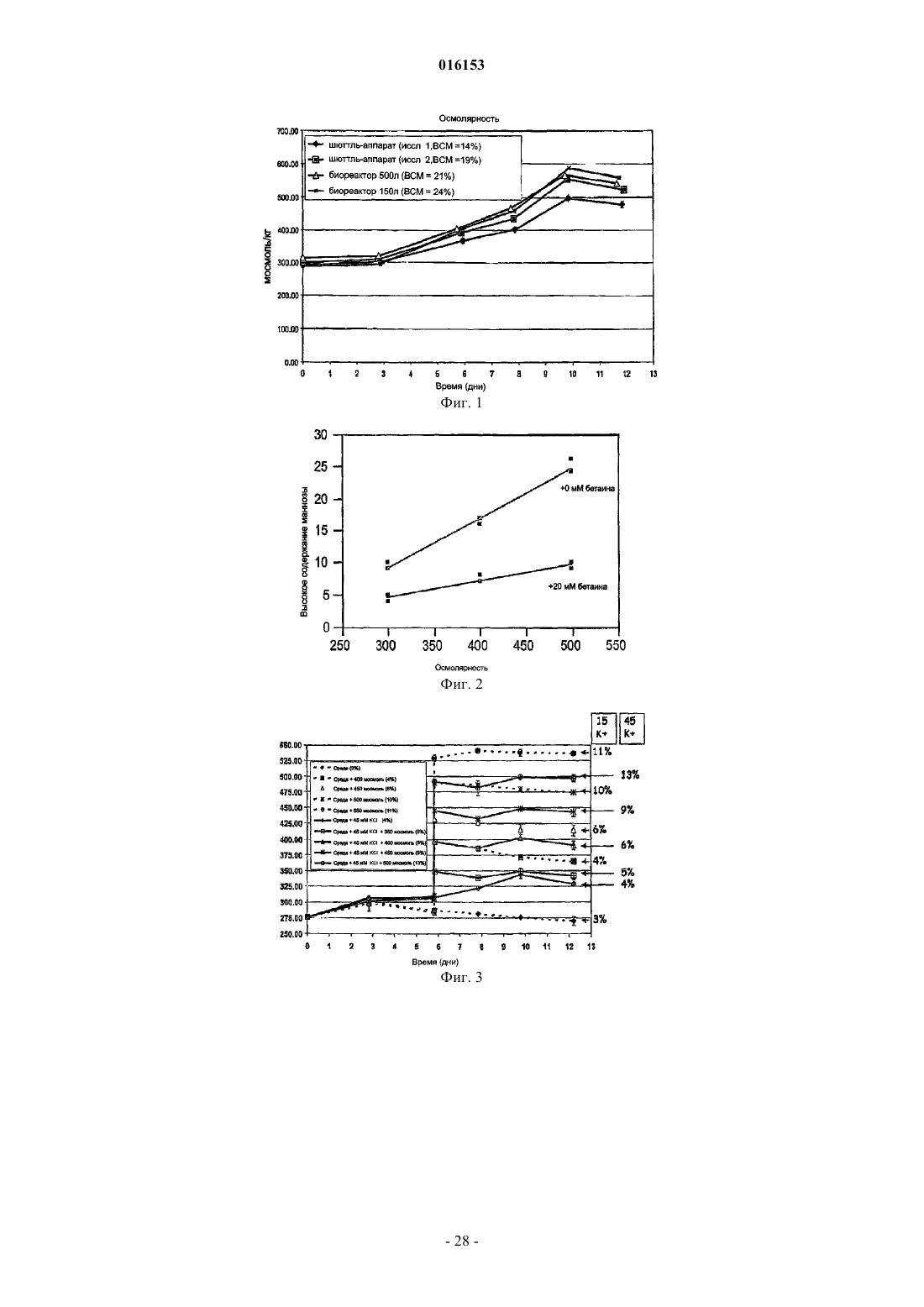
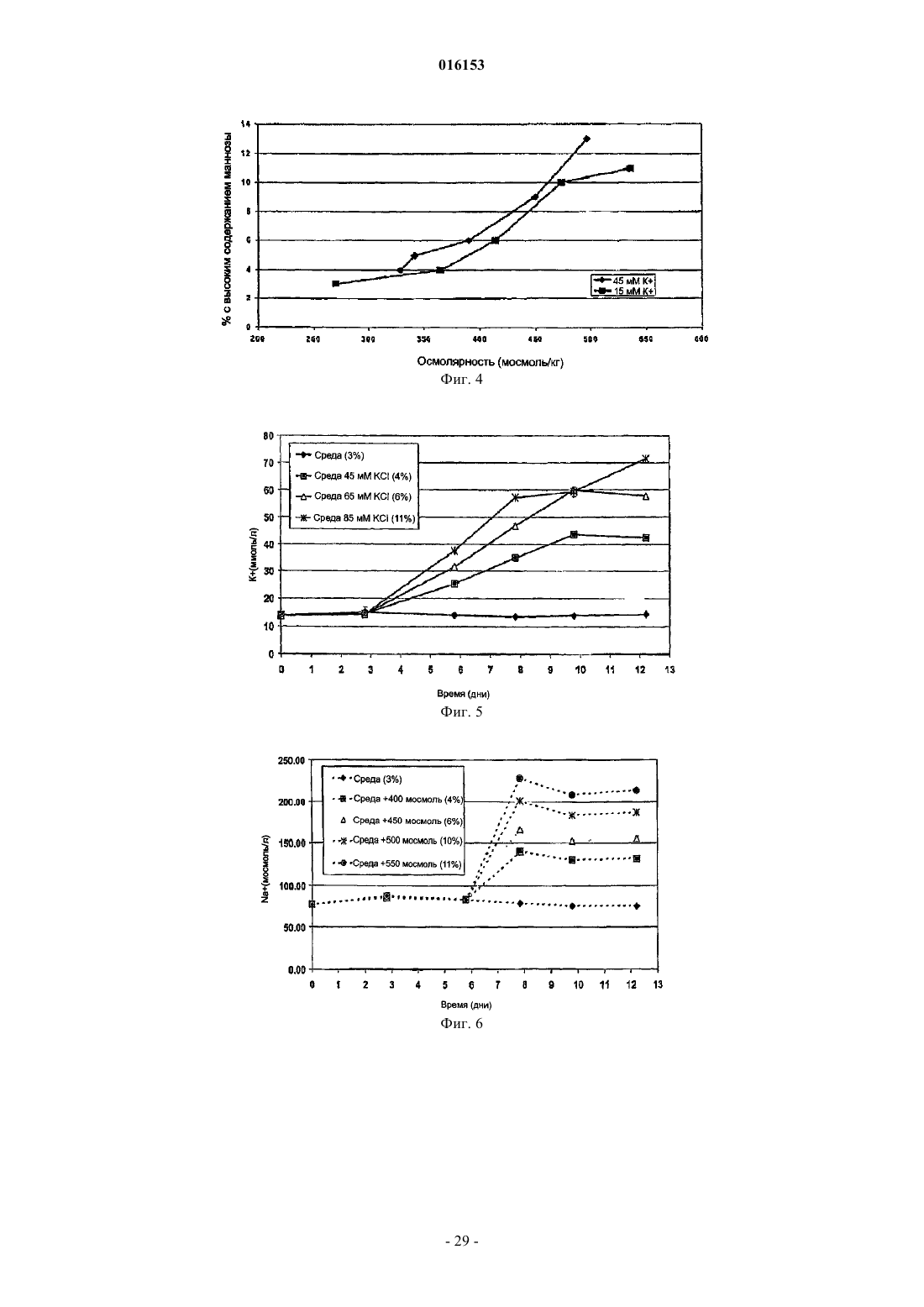
6. Способ по любому из пп.1 или 2, при котором культуральная среда содержит соль, выбранную из группы, состоящей из калиевой соли с концентрацией приблизительно 70 мМ или менее, натриевой соли с концентрацией приблизительно 200 мМ или менее и их комбинаций.
7. Способ по п.6, при котором культуральная среда содержит соль, выбранную из группы, состоящей из:
(а) калиевой соли с концентрацией от приблизительно 10 до приблизительно 50 мМ;
(б) натриевой соли с концентрацией от приблизительно 50 до приблизительно 100 мМ и
(в) комбинаций (а) и (б).
8. Способ по любому из пп.1 или 2, при котором культуральная среда практически не содержит одной или нескольких аминокислот, выбранных из группы, состоящей из аланина, аргинина, аспарагиновой кислоты и глутаминовой кислоты.
9. Способ по любому из пп.1 или 2, при котором культуральная среда содержит один или несколько витаминов, выбранных из группы, состоящей из биотина, D-пантотената кальция, холинхлорида, фолиевой кислоты, i-инозита, ниацинамида, пиридоксаля HCl, пиридоксина HCl, рибофлавина, тиамина HCl и цианокобаламина при концентрации от приблизительно 0,00005 до приблизительно 0,9 г/л.
10. Способ по любому из пп.1 или 2, при котором культуральная среда содержит глюкозу при концентрации от приблизительно 1 до приблизительно 90 мМ.
11. Способ по любому из пп.1 или 2, при котором культуральная среда содержит один или несколько пептонов, выбранных из группы, состоящей из дрожжевого экстракта, дрожжевого гидролизата, соевого пептона, соевого гидролизата, пшеничного пептона и пшеничного гидролизата при концентрации от приблизительно 0,5 до приблизительно 60 г/л.
12. Способ по любому из пп.1 или 2, при котором культуральная среда содержит по меньшей мере один осмопротектор в количестве, необходимом для поддержания осмолярности на уровне приблизительно 600 мосмоль/кг или менее.
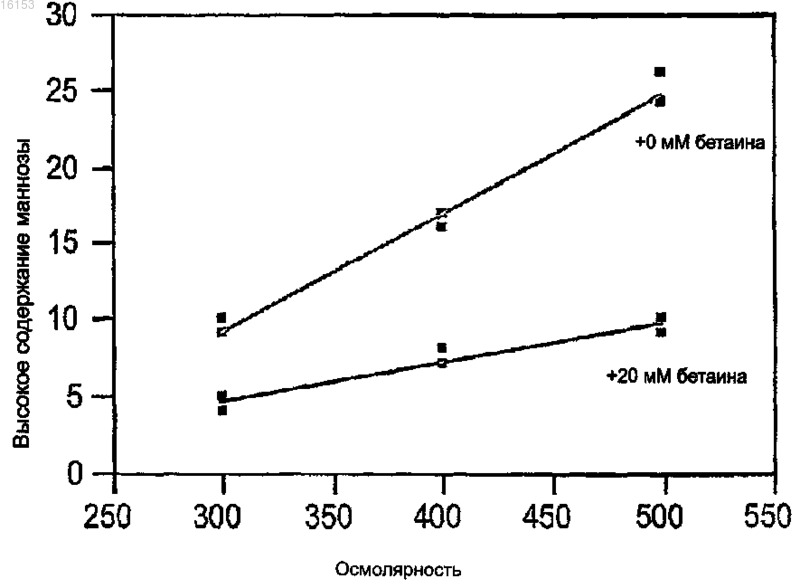
13. Способ по п.12, при котором осмопротектор выбран из группы, состоящей из бетаина, глицина, L-треонина, L-пролина и их производных.
14. Способ по п.12, при котором осмопротектор представляет собой бетаин при концентрации от приблизительно 1 до приблизительно 100 мМ.
15. Способ по п.14, в котором бетаин содержится в концентрации от приблизительно 20 до приблизительно 30 мМ.
16. Способ по любому из пп.1 или 2, при котором клетку-хозяина культивируют в течение периода времени от приблизительно 5 дней до приблизительно 14 дней.
17. Способ по любому из пп.1 или 2, при котором клетку-хозяина культивируют при температуре от приблизительно 31 до приблизительно 38°C.
18. Способ по любому из пп.1 или 2, при котором клетка-хозяин является клеткой млекопитающего.
19. Способ по п.18, при котором клетка-хозяин млекопитающего является CHO клеткой (клеткой яичника китайского хомячка).
20. Композиция человеческого моноклонального антитела, связывающегося с IL-15, имеющего низкое содержание маннозы и получаемого по способу по любому из пп.1-19.
21. Фармацевтическая композиция, содержащая композицию по п.20 и фармацевтически приемлемый носитель.
22. Применение композиции изолированного антитела, полученного способом по п.2, для производства медикамента для лечения или профилактики расстройства, связанного со сверхсинтезом человеческого IL-15, и/или в котором является полезной дезактивация или ингибирование индуцированных человеческим IL-15 влияний, при этом указанное антитело предназначено для введения субъекту.
23. Применение по п.22, в котором расстройство выбрано из группы, состоящей из васкулита, псориаза, рассеянного склероза, ревматоидного артрита, воспалительного заболевания кишечника, отторжения аллогенного трансплантата, реакции "трансплантата против хозяина", T-клеточной лимфомы, T-клеточной лейкемии, поражений кожи ревматического или подагрического происхождения, нарушений соединительной ткани, офтальмологических нарушений, нейрологических расстройств, желудочно-кишечных и печеночных расстройств, аллергических расстройств, гематологических нарушений, заболеваний кожи, легочных расстройств, злокачественных новообразований, нарушений, связанных с трансплантацией, эндокринологических расстройств, сосудистых нарушений, гинекологических расстройств и инфекционных болезней, причем возможно упомянутое воспалительное заболевание кишечника является болезнью Крона или глютеновой болезнью.
24. Композиция антитела по п.20, в которой не более чем приблизительно 10% антител имеют более четырех маннозных остатков каждое.
25. Композиция по п.24, в которой не более чем приблизительно 5% антител имеют более четырех маннозных остатков каждое.
26. Композиция по п.24, в которой приблизительно 4% антител имеют более четырех маннозных остатков каждое.
Текст
СПОСОБЫ РЕГУЛИРОВАНИЯ СОДЕРЖАНИЯ МАННОЗЫ В РЕКОМБИНАНТНЫХ БЕЛКАХ Ву Джин, Ле Николь, Де Ла Круз Майкл, Флинн Грегори (US) Вашина Г.М. (RU) Данное изобретение относится к способам регулирования (например, уменьшения) содержания маннозы, в частности, в рекомбинантных гликопротеинах с высоким содержанием маннозы. 016153 Предпосылки изобретения Высшие эукариоты претерпевают целый ряд пост-трансляционных модификаций, включая метилирование, сульфатирование, фосфорилирование, присоединение липидов и гликозилирование. Такие модификации могут быть жизненно важными для функции белка. Секретируемые белки, мембранные белки и белки, направленные к везикулам, или некоторые внутриклеточные органеллы по-видимому являются гликозилированными.N-связанное гликозилирование представляет собой форму гликозилирования, включающую присоединение олигосахаридов к остатку аспарагина, находящегося в последовательностях распознавания(например, Asn-X-Ser/Thr) в белках. N-связанные гликопротеины содержат стандартные разветвленные структуры, которые состоят из маннозы (mannose, Man), галактозы, N-ацетилглюкозамина (Nacetylglucosamine, GlcNAc) и нейраминовых кислот. N-Гликозилирование белка обычно возникает в эндоплазматическом ретикулуме (endoplasmic reticulum, ER), где N-связанный олигосахарид (например,Glc3Man9GlcNAc2), собранный на долихоле (интермедиате липидного носителя), переносится на соответствующий аспарагин (asparagine, Asn) возникающего белка. Это является общим случаем для всех эукариотических N-связанных гликопротеинов. Существует два основных типа N-связанных сахаридов: олигосахариды с высоким содержанием маннозы и комплексные (сложные) олигосахариды. Олигосахариды с высоким содержанием маннозы обычно включают два N-ацетилглюкозамина с большим количеством остатков маннозы (например, больше 4). Комплексные (сложные) олигосахариды так называются, поскольку они могут содержать почти любое количество других видов сахаридов, включая более двух первичных N-ацетилглюкозаминов. Белки могут гликозилироваться обоими видами олигосахаридов на различных частях белка. Полагают, что независимо от того является ли олигосахарид с высоким содержанием маннозы или комплексным (сложным), [гликозилирование] зависит от доступности его для сахарид-модифицированных белков в аппарате Гольджи (Golgi apparatus). Если сахарид относительно недоступен, наиболее вероятным будет то, что он останется в первоначальной форме с высоким содержанием маннозы. Если он доступен, тогда вероятно, что многие из остатков маннозы будут отщепляться и сахариды будут далее модифицироваться прибавлением других видов групп, как обсуждалось выше. После того как олигосахаридная цепь была прибавлена к белку, три остатка глюкозы и один остаток маннозы удаляются тремя разными ферментами в определенном порядке. Это происходит в ER и является сигналом к тому, что белок может переноситься в Гольджи для дальнейшего процессинга. После процессинга в ER образуется разновидность олигосахарида с высоким содержанием маннозы. Три остатка глюкозы и один специфический -1,2-связанный остаток маннозы удаляются специфическими глюкозидазами и -1,2-маннозидазой в ER, приводя к основной структуре олигосахарида - Man8GlcNAc2. Белок с этой основной сахарной структурой переносится в аппарат Гольджи, где остаток сахара претерпевает различные видоизменения. В клетках млекопитающих видоизменения сахарной цепи протекает по трем различным направлением в зависимости от белкового остатка, к которому она прибавляется. Три различные направления следующие: (1) основная цепь сахара не изменяется; (2) основная цепь сахара изменяется путем прибавления остатка N-ацетилглюкозамина-1-фосфата (N-acetylglucosamine-1-phosphate, GlcNAc-1-P) в UDP-Nацетилглюкозамине (UDP-N-acetylglucosamine, UDP-GlcNAc) к 6-положению маннозы в главной сахарной цепи, за которым следует удаление остатка GlcNAc с образованием кислой сахарной цепи в гликопротеине; или (3) основная цепь сахара первоначально превращается в Man5GlcNAc2 путем удаления трех остатков маннозы с помощью маннозидазы I; Man5GlcNAc2 далее модифицируется прибавлениемGlcNAc и удалением более 2 остатков маннозы, за которым следует последовательное прибавлениеGlcNAc, галактозы (galactose, Gal) и N-ацетилнейраминовой кислоты (также называемой сиаловой кислотой (NeuNAc с образованием различных гибридных или сложных (комплексных) цепей сахаров(1998. Содержание олигосахаридов в рекомбинантных белках может влиять на безопасность и эффективность гликопротеинов, предназначенных для лечебных целей. Таким образом, должны быть полезны способы контролирования содержания олигосахаридов, особенно содержания маннозы в таких гликопротеинах. Высокое содержание маннозы в гликопротеиновых композициях, особенно антителах, предназначенных для лечебных целей, может существенно влиять на безопасность (сохранность) и эффективность таких белков во время их терапевтического применения. Не будучи связанными с отдельной теорией,данные наводят на мысль, что гликопротеины с высоким содержанием маннозы выводятся из кровообращения быстрее, чем их аналоги с низким содержанием маннозы вследствие, например, наличия рецепторов маннозы на макрофагах и дендритных клетках. Кроме того, полагают, что гликопротеины с высоким содержанием маннозы являются более иммуногенными. Таким образом, желательно продуцировать гликопротеины, предназначенные для лечебных целей, такие как, например, антитела, предназначенные для лечебных целей, с низким содержанием маннозы.-1 016153 Авторы настоящего изобретения решают проблему в данной области, предлагая способы регулирования (например, контролирования или уменьшения) содержания маннозы в рекомбинантно продуцируемых белках и пептидах. Сущность изобретения Данное изобретение основано, по меньшей мере частично, на раскрытии факторов, которые влияют на содержание маннозы и, в частности, на высокое содержание маннозы в рекомбинантно экспрессируемых гликопротеинах. Таким образом, в одном варианте данное изобретение предлагает способ регулирования содержания маннозы (т.е. на олигосахаридной боковой цепи) в рекомбинантном гликопротеине, продуцируемом в клетке-хозяина млекопитающего, с помощью манипулирования условиями для клеточной культуры с тем, чтобы гликопротеин, продуцируемый клетками, имел низкое содержание маннозы. Как применяется в данном изобретении, термин низкое содержание маннозы относится к гликопротеиновым композициям, в которых менее чем приблизительно 10%; или менее чем приблизительно 8%; или менее чем приблизительно 5% (например, приблизительно 4% или менее) гликопротеинов в композиции имеют более 4 остатков маннозы (т.е. имеются виды M5 или более высокие). Как применяется в данном изобретении,термин низкое содержание маннозы также относится к гликопротеиновым композициям, в которых менее чем приблизительно 10%; менее чем приблизительно 9%; менее чем приблизительно 8%; менее чем приблизительно 7 %; менее чем приблизительно 6%; менее чем приблизительно 5%; менее чем приблизительно 4%; менее чем приблизительно 3%; менее чем приблизительно 2%; менее чем приблизительно 1%; или любое значение между любыми из этих предшествующих диапазонов, или даже нуль[маннозы]. В одном варианте изобретения низкое содержание маннозы достигается поддерживанием клеточной культуральной среды при низкой осмолярности (например, менее чем приблизительно 600 мосмоль/кг; или менее чем приблизительно 500 мосмоль/кг; или менее чем приблизительно 400 мосмоль/кг,например, от приблизительно 380 до 250 мосмоль/кг). Это улучшает клеточную культуру для гликопротеинов с низким содержанием маннозы, т.е. с 4 или меньшим количеством остатков маннозы на олигосахаридных боковых цепях гликопротеина. Соответственно, в конкретном варианте изобретение предлагает способ продуцирования рекомбинантного гликопротеина с низким содержанием маннозы, включающий культивирование клетки-хозяина млекопитающего (например, в фазе размножения или продуцирования культуры), которая экспрессирует гликопротеин в среду с осмолярностью приблизительно 600 мосмоль/кг или менее (например, в интервале от 200 до 600 мосмоль/кг; например приблизительно от 250 до 550 мосмоль/кг; приблизительно от 250 до 500 мосмоль/кг; приблизительно от 250 до 450 мосмоль/кг; приблизительно от 250 до 400 мосмоль/кг; приблизительно от 250 до 380 мосмоль/кг; приблизительно от 250 до 350 мосмоль/кг). Вышеприведенные интервалы осмолярности могут достигаться путем манипулирования рядом параметров клеточной культуры, включая концентрации одной или нескольких солей, витаминов, сахаров,пептонов и аминокислот в клеточной среде для культивирования, но выбор ими не ограничивается. Соответственно, в конкретном варианте изобретение предлагает способ продуцирования рекомбинантного гликопротеина с низким содержанием маннозы путем культивирования клетки-хозяина, которая экспрессирует гликопротеин в среду, содержащую ионы калия при концентрации приблизительно 70 мМ или менее (например, от приблизительно 10 до приблизительно 50 мМ); и/или ионы натрия при концентрации приблизительно 200 мМ или менее (например, от приблизительно 50 до приблизительно 100 мМ) и при поддерживании осмолярности клеточной культуры при приблизительно 600 мосмоль/кг или менее. Еще в другом варианте изобретение предлагает способ продуцирования рекомбинантного гликопротеина с низким содержанием маннозы путем культивирования клетки-хозяина, которая экспрессирует гликопротеин в среде, которая практически не содержит одну или несколько аминокислот, выбранных из группы, состоящей из аланина, аргинина, аспарагиновой кислоты и глутаминовой кислоты, и поддерживанием осмолярности клеточной культуры при приблизительно 600 мосмоль/кг или менее. Кроме того, еще в другом варианте среда может содержать один или несколько витаминов, выбранных из группы, состоящей из биотина, D-пантотената кальция, холинхлорида, фолиевой кислоты, iинозита, ниацинамида (никотинамида), пиридоксаля HCl, пиридоксина HCl, рибофлавина, тиамина HCl и цианокобаламина при концентрации от приблизительно 0,00005 до приблизительно 0,9 г/л. Еще в другом варианте среда содержит глюкозу при концентрации от приблизительно 1 мМ до приблизительно 90 мМ. В другом варианте среда содержит один или несколько пептонов, выбранных из группы, состоящей из дрожжевого экстракта, дрожжевого гидролизата, соевого пептона, соевого гидролизата, пшеничного пептона и пшеничного гидролизата при концентрации от приблизительно 0,5 до приблизительно 60 г/л. Еще в другом варианте данного изобретения клеточная культуральная среда может содержать один или несколько осмопротекторов в количестве, необходимом для поддержания осмолярности на нужном уровне, например приблизительно 600 мосмоль/кг или менее. Соответствующие осмопротекторы хорошо известны в данной области и включают, например, бетаин, глицин, L-треонин и L-пролин и их производные, такие как, например, глицинбетаин и бетаинальдегид. В конкретном варианте осмопротектор (на-2 016153 пример, бетаин) присутствует в клеточной культуральной среде при концентрации приблизительно 20 мМ или выше. В конкретных вариантах осмопротектор (например, бетаин) присутствует при концентрации от приблизительно до приблизительно 100 мМ или от приблизительно 20 мМ до приблизительно 30 мМ. Дополнительные параметры клеточной культуры, которые могут контролироваться сами по себе или вместе с одним или несколькими параметрами, описанными в данном изобретении, включают, например, температуру и продолжительность времени, в течение которого культивируются клетки. В некоторых вариантах клетка-хозяин, экспрессирующая рекомбинантный гликопротеин, культивируется при температуре от приблизительно 31 до приблизительно 38C. В некоторых других вариантах клеткахозяин, экспрессирующая рекомбинантный гликопротеин, культивируется в течение периода времени от приблизительно 5 дней до приблизительно 14 дней. Соответствующие клетки-хозяина, экспрессирующие рекомбинантные гликопротеины, согласно данному изобретению, хорошо известны в данной области и включают любые из них, описанные в изобретении, такие как CHO клетки, лимфоцитарные клетки (например, NSO клетки) и целый ряд других клеток млекопитающих. Данное изобретение может применяться для продуцирования широкого многообразия гликопротеинов с низким содержанием маннозы, как описано в данном изобретении. В конкретном варианте изобретение применяется для продуцирования рекомбинантного моноклонального антитела или антигенсвязывающего фрагмента его с низким содержанием маннозы. Соответствующие антитела могут включать,например, антитела, относящиеся к крысам или мышам, химерные, гуманизированные и полностью человеческие антитела, а также другие формы антител, известные в данной области. В другом конкретном варианте антитело связывает IL-15, которое включает антитела, описанные в патентной публикации США 2003-0138421, которая полностью включена в данное изобретение в качестве ссылки, но выбор ими не ограничивается. В другом конкретном варианте антитело является полностью человеческим моноклональным антителом, которое связывает IL-15, с вариабельной областью легкой цепи, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:4, и/или вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:2, а также гомологичные последовательности, которые связывают IL-15 (например, с аминокислотными последовательностями приблизительно на 80, 85, 90, 95% или более идентичными SEQ ID NO:4 или SEQ ID NO:2,соответственно). В другом конкретном варианте антитело является человеческим антителом, которое связывает IL-15, или антигенсвязывающим фрагментом его с вариабельной областью легкой цепи, содержащей один или несколько гипервариабельных участков (complementarity determining regions, CDRs),приведенных в SEQ ID NOs:8-10, а также гомологичные последовательности, которые связывают IL-15(например, с аминокислотными последовательностями приблизительно на 80, 85, 90, 95% или более идентичными любой из SEQ ID NOs:8-10, соответственно), и вариабельной областью тяжелой цепи, содержащей один или несколько гипервариабельных участков (CDRs), приведенных в SEQ ID NOs:5-7, а также гомологичные последовательности, которые связывают IL-15 (например, с аминокислотными последовательностями приблизительно на 80, 85, 90, 95% или более идентичными любой из SEQ ID NOs:57, соответственно). В конкретном варианте человеческое моноклональное антитело, которое связываетIL-15, или его антигенсвязывающий фрагмент, включает вариабельную область легкой цепи, содержащую все три CDRs, приведенные в SEQ ID NOs:8-10, и вариабельную область тяжелой цепи, содержащую все три CDRs, приведенные в SEQ ID NOs:5-7, или консервативные аминокислотные замены их. Еще в одном варианте данное изобретение предлагает рекомбинантные гликопротеины с низким содержанием маннозы, продуцируемые с помощью способов, описанных в данном изобретении. Соответственно, такие гликопротеины могут содержать любой из вышеупомянутых гликопротеинов, предназначенных для лечебных целей, такие как антитела, гормоны, ферменты, пептиды и другие гликопротеины. Изобретение также относится к композициям, включающим любой из вышеупомянутых гликопротеинов с низким содержанием маннозы. В конкретном варианте композиция является фармацевтической композицией, которая содержит изолированный гликопротеин (например, изолированное моноклональное человеческое антитело, которое связывает IL-15, или антигенсвязывающий фрагмент его) с низким содержанием маннозы и фармацевтически приемлемый носитель. Соответственно, еще в другом варианте данное изобретение предлагает способ лечения или профилактики нарушения, которое связано со сверхсинтезом человеческого IL-15, и/или в котором имеется деактивация или ингибирование эффектов, вызванных человеческим IL-15, путем введения субъекту изолированного IL-15 антитела с низким содержанием маннозы. Типичные нарушения включают васкулит, псориаз, рассеянный склероз, ревматоидный артрит, воспалительные заболевания кишечника (например, болезнь Крона или глютеновая болезнь), отторжение аллогенного трансплантата, реакцию"трансплантата против хозяина", T-клеточную лимфому и T-клеточную лейкемию, но выбор ими не ограничивается. Соответственно, еще в другом варианте данное изобретение предлагает способ лечения или профилактики нарушения, которое связано со сверхсинтезом человеческого IL-15, и/или, в котором имеется-3 016153 деактивация или ингибирование эффектов, вызванных человеческим IL-15, путем введения субъекту изолированного IL-15 антитела с низким содержанием маннозы. Типичные нарушения включают поражения кожи ревматического или подагрического происхождения, нарушения соединительной ткани, офтальмологические нарушения, нейрологические расстройства, желудочно-кишечные и печеночные расстройства, аллергические расстройства, гематологические нарушения, заболевания кожи, легочные расстройства, злокачественные развития, нарушения, связанные с трансплантацией, эндокринологические расстройства, сосудистые нарушения, гинекологические расстройства и инфекционные болезни. Краткое описание чертежей Фиг. 1 представляет собой график, отображающий корреляцию между осмолярностью и полностью человеческим моноклональным антителом с высоким содержанием маннозы, которое связывает IL-15,продуцируемого культивированием клеток, экспрессирующих антитело в шюттель-аппарате (50 мл) и биореакторах (150 и 500 л); фиг. 2 - график, отображающий корреляцию между прибавлением осмопротектора - бетаина и полностью человеческим моноклональным антителом с высоким содержанием маннозы, которое связываетIL-15; фиг. 3 - график, изображающий корреляцию между осмолярностью и концентрацией ионов K+ в культуральной среде; фиг. 4 - график, отображающий корреляцию между полностью человеческим моноклональным антителом с высоким содержанием маннозы, которое связывает IL-15, и осмолярностью при инкубировании клеток в среде, содержащей 15 или 45 мМ KCl; фиг. 5 - графическое отображение корреляции между концентрацией ионов K+ и высоким содержанием маннозы, показывая, что оптимальная концентрация ионов K+ для поддержания высокого содержания маннозы ниже 10% составляет от приблизительно 0 до приблизительно 70 мМ; фиг. 6 - график, отображающий корреляцию между концентрацией ионов Na+ и высоким содержанием маннозы, показывая, что оптимальная концентрация ионов Na+ для поддержания высокого содержания маннозы ниже 10% составляет от приблизительно 0 до приблизительно 200 мМ; фиг. 7 - график, отображающий корреляцию между концентрацией аминокислоты и высоким содержанием маннозы; фиг. 8 - график, отображающий корреляцию между типом применяемой питательной среды и высоким содержанием маннозы. Подробное описание изобретения Таким образом, желательно продуцировать гликопротеины, предназначенные для лечебных целей,такие как например, антитела, предназначенные для лечебных целей, с низким содержанием маннозы. Для того чтобы данное изобретение могло бы быть понятным, в начале определяются некоторые термины. Дополнительные определения приводятся на всем протяжении подробного описания.I. Определения. Углеводные остатки описываются в данном изобретении со ссылкой на обычно применяемую номенклатуру для олигосахаридов. Обзор по химии углеводов, который применяет данную номенклатуру,можно найти, например, у Hubbard, Ivatt, Ann. Rev. Biochem. 50:555-583 (1981). Данная номенклатура включает, например, Man, что обозначает маннозу; GlcNAc, что обозначает 2-N-ацетилглюкозамин; Gal,что обозначает галактозу; и Glc, что обозначает глюкозу. Сиаловые кислоты описываются со ссылкой на сокращенное обозначение NeuNAc для 5-N-ацетилнейраминовой кислоты и NeuNGc для 5 гликолилнейраминовой кислоты. Термин осмолярность, как применяется в данном изобретении, имеет отношение к измерению осмотического давления растворенных частиц в водном растворе. Растворенные частицы включают как ионы, так и неионизированные молекулы. Осмолярность выражается в виде концентрации осмотически активных частиц (т.е. осмолей), растворенных в 1 кг раствора (1 мосмоль/кг H2O при 38 эквивалентен осмотическому давлению в 19 мм Hg). Как применяется в данном изобретении, сокращение мосмоль означает миллиосмоли/кг раствора. В типичных вариантах осмолярность клеточной культуральной среды поддерживается при приблизительно 600 мосмоль/кг или менее, или при приблизительно 550 мосмоль/кг или менее, или при приблизительно 500 мосмоль/кг или менее, или при приблизительно 450 мосмоль/кг или менее, или при приблизительно 400 мосмоль/кг или менее, или при приблизительно 380 мосмоль/кг или менее, или в интервале от приблизительно 200 до приблизительно 600 мосмоль/кг, или от приблизительно 250 до приблизительно 550 мосмоль/кг, или от приблизительно 250 до приблизительно 500 мосмоль/кг, или от приблизительно 250 до приблизительно 450 мосмоль/кг, или от приблизительно 250 до приблизительно 400 мосмоль/кг, или от приблизительно 250 до приблизительно 380 мосмоль/кг, или от приблизительно 250 до приблизительно 350 мосмоль/кг. Как применяется в данном изобретении, термин гликопротеин относится к пептидам и белкам,включая антитела по меньшей мере с одной олигосахаридной боковой цепью, включающей остатки маннозы. Гликопротеины могут быть гомологичными для клетки-хозяина или могут быть гетерологичными,т.е. чужеродными для примененной клетки-хозяина, такими как, например, человеческий гликопротеин,-4 016153 продуцируемый клеткой-хозяина яичника китайского хомячка (Chinese hamster ovary, CHO). Такие гликопротеины обычно называются рекомбинантными гликопротеинами. В некоторых вариантах гликопротеины, экспрессируемые клеткой-хозяина, непосредственно выделяются в среду. Примеры гликопротеинов млекопитающих включают следующие молекулы и антитела против них, цитокины, например, отIL-1 до IL-15 и их рецепторы; хемокины, такие как TNF, TECK и их рецепторы, например, TNFRs, CCR9; гормон роста, включая человеческий гормон роста и гормон роста крупного рогатого скота; фактор, высвобождающий гормон роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1 антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; фактор свертывающей системы крови, как напримерVIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; факторы, препятствующие свертыванию,как например протеин C; предсердный натрийуретический фактор; легочное поверхностно-активное вещество (сурфактант легкого); активатор плазминогена, как например активатор плазминогена урокиназного типа или человеческого происхождения или тканевый активатор плазминогена (tissue-type plasminogen activator, t-PA); бомбезин; тромбин; гемопоэтический фактор роста; энкефалиназа; RANTES (regulated on activation normally T-cell expressed and secreted - регулятор активации, T-клеточной экспрессии и секреции); макрофагальный воспалительный белок человека (macrophage inflammatory protein, MIP-1 альфа); сывороточный альбумин, как, например, человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный пептид, ассоциированный с гонадотропином; микробиальный белок, как например, бета-лактамаза; ДНаза; ингибин; активин; васкулярный эндотелиальный фактор роста (vascular endothelial growth factor, VEGF); рецепторы гормонов или факторов роста; интегрин; протеин A или D; ревматоидные факторы; нейротропный фактор, как например нейротропный фактор костного происхождения (bone-derived neurotrophic factor,BDNF), нейротрофин-3, -4, -5 или -6 (neurotrophin -NT-3, NT-4, NT-5 или NT-6) или ростовый фактор нервов, как например NGF-бета (nerve growth factor, NGF); тромбоцитарный фактор роста (plateletderived growth factor, PDGF); фактор роста фибробластов, как например aFGF и bFGF (fibroblast growthfactor, FGF); эпидермальный фактор роста (epidermal growth factor, EGF); трансформирующий фактор роста (transforming growth factor, TGF), как например, TGF- и TGF-, включая TGF-1, TGF-2, TGF-3,TGF-4 или TGF-5; инсулиноподобный фактор роста-I и -II (insulin-like growth factor, IGF-I и IGF-II);des(1-3)-IGF-I (IGF-I мозговой ткани), белки, связывающие инсулиноподобные факторы роста; CDбелки, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (bone morphogenetic protein, BMP); интерфероны, такие как интерферон-, - и -; колониестимулирующие факторы (colony stimulating factors, CSFs), например M-CSF, GMCSF и G-CSF; интерлейкины (interleukins,ILs), например от IL-1 до IL-15; супероксиддисмутаза; Tклеточные рецепторы; белки на поверхности мембраны; фактор распада; вирусный антиген, такой как,например, часть оболочки СПИДа; транспортные белки; хоминг-рецепторы; и регуляторные белки. Как применяется в данном изобретении, термины клеточная культуральная среда (среда для культивирования клеток) и культуральная среда (среда культивирования) относятся к питательному раствору, применяемому для роста клеток млекопитающих, который обычно обеспечивает по меньшей мере один компонент из одной или нескольких из следующих категорий: 1) источник энергии, обычно в форме углевода, такого, как например, глюкоза; 2) одной или нескольких из всех незаменимых аминокислот и обычно основной набор из двадцати аминокислот плюс цистеин; 3) витамины и/или другие органические соединения, применяемые при низких концентрациях; 4) свободные жирные кислоты; 5) микроэлементы, где микроэлементы определяются как неорганические соединения или встречающиеся в природе элементы, которые обычно требуются при очень низких концентрациях, обычно на микромолярном уровне. Для оптимизации роста клеток питательный раствор возможно может дополняться дополнительными компонентами. Культура клеток млекопитающих, описанная в данном изобретении, готовится в среде, пригодной для отдельных культивируемых клеток. Соответствующая среда для культивирования клеток, которая может применяться для выращивания конкретного вида клеток, должна быть понятна специалисту в данной области. Типичные коммерчески доступные среды включают, например, Ham's F10 (SIGMA),минимальную поддерживающую среду (minimal essential medium, MEM, SIGMA), RPMI-1640 (SIGMA) и модифицированную по способу Дульбекко среду Игла (Dulbecco's Modified Eagle's Medium, DMEM,SIGMA). Любая из этих или других подходящих сред, если необходимо, может дополняться гормонами и/или другими факторами роста (как например, инсулин, трансферрин или эпидермальный фактор роста), солями (как например, хлорид натрия, кальция, магния и фосфатами), буферами (как например,HEPES), нуклеозидами (как например, аденозин и тимидин), антибиотиками (как например,Gentamycin), микроэлементами (определенными как неорганические соединения, обычно присутствующие при конечных концентрациях на микромолярном уровне), липидами (как например, линолевая кислота или другие жирные кислоты) и их соответствующими носителями и глюкозой или эквивалентным источником энергии и/или модифицированными, как описано в данном изобретении, чтобы облегчить продуцирование рекомбинантных гликопротеинов с низким содержанием маннозы. В конкретном-5 016153 варианте среда для культивирования культуры клеток является бессывороточной средой. В некоторых вариантах среду для культивирования клеток оптимизируют с тем, чтобы регулировать (например, уменьшать) высокое содержание маннозы в рекомбинантном гликопротеине, экспрессируемом клеткой-хозяина, культивированной в такой среде. В конкретном варианте клетка-хозяин млекопитающего является CHO-клеткой и соответствующая среда содержит компонент основной питательной среды, как например, состав на основе DMEM/HAM F-12 с измененными концентрациями одного или нескольких компонентов, таких как, например, аминокислот, солей, сахаров, пептонов и витаминов с тем, чтобы регулировать (например, уменьшить) высокое содержание маннозы в рекомбинатном гликопротеине, экспрессируемом CHO клеткой, культивированной в такой среде. Термин фаза роста клеточной культуры относится к периоду экспоненциального клеточного роста (т.е. логарифмическая фаза или лог-фаза), где клетки обычно быстро делятся. Клетки поддерживаются в фазе роста в течение периода приблизительно одного дня, или приблизительно двух дней, или приблизительно трех дней, или приблизительно четырех дней, или в течение более длительного периода, чем четыре дня. Продолжительность времени в течение которого клетки поддерживаются в фазе роста будет изменяться, например, в зависимости от типа клетки и скорости роста клеток и условий культивирования. Термин переходная фаза относится к периоду времени между фазой роста и фазой продуцирования. Обычно переходная фаза представляет собой время, в течение которого условия культивирования могут контролироваться для поддержки сдвига между фазой роста и фазой продуцирования. Различные параметры клеточной культуры, которые могут контролироваться, включают один или несколько из таких параметров как температура, осмолярность, витамины, аминокислоты, сахара, пептоны, ионы аммония и соли, но выбор ими не ограничивается. Термин фаза продуцирования клеточной культуры относится к периоду времени, когда клеточный рост останавливается (выходит на плато). Логарифмический клеточный рост обычно заканчивается до или во время этой фазы и продуцирование белка продолжается. Желательно дополнить клеточную культуральную среду с тем, чтобы на данной стадии достигнуть продуцирование нужного белка. Термины клетка-хозяин млекопитающего, клетка-хозяин и клетка млекопитающего относятся к клеточным линиям, полученным от млекопитающих, которые способны расти и выживать при помещении или в монослойную культуру или в суспензионную культуру в среде, содержащей соответствующие питательные вещества и факторы роста. Обычно такие клетки способны экспрессировать и секретировать большие количества конкретного представляющего интерес гликопротеина в культуральную среду. Примеры соответствующих клеток-хозяина млекопитающего включают клетки яичника китайского хомячка/DHFR (Urlaub, Chasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980; dpl2CHO клетки (EP 307247);CV1 линию почки обезьяны, трансформированную SV40 (ATCC CRL 1651); линию эмбриональной почки человека (293 или 293 клетки, субклонированные для роста в суспензионной культуре) (Graham et al.,J.Gen Virol., 36:59 (1977; клетки почки детеныша хомячка (ATCC CCL 10); клетки Сертоли мыши(TM4) (Mather, Bibl. Reprod., 23:243-251 (1980; клетки почки обезьяны (ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76) (ATCC CRL-1587); клетки цервикальной карциномы человека(HeLa) (ATCC CCL 2); клетки почки собаки (MDCK) (ATCC CCL 34); клетки печени крысы линии Буффало (BRL 3A) (ATCC CRL 1442); клетки легкого человека (W138) (ATCC CCL 75); клетки печени человека (Hep G2 HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); TRI клетки(Mather et al., Annals N.Y. Acad. Sci., 383:44-68 (1982; MRC 5 клетки; FS4 клетки; и линию гепатомы человека (Hep G2), но выбор ими не ограничивается. Термин рекомбинантная клетка-хозяин (или просто клетка-хозяин), как применяется в данном изобретении, предполагают, что он относится к клетке, в которую был введен рекомбинатный экспрессирующий вектор. Должно быть понятно, что такие термины относятся не только к клетке конкретного субъекта, но и к потомству такой клетки. Поскольку в последующих потомствах могут иметь место некоторые видоизменения вследствие или мутации, или влияний окружающей среды, такое потомство, в действительности, не может быть идентичным родительской клетке, но все же охватывается термином клетка-хозяин, как это применяется в данном изобретении. Термины экспрессия, экспрессировать и экспрессирует обычно относятся к транскрипции и трансляции, происходящей в клетке-хозяине. Уровень экспрессии генного продукта в клетке-хозяине можно определить на основе или количестве соответствующей мРНК, которая присутствует в клетке,или количества белка, кодируемого геном. Например, мРНК, считанная (транскрибированная) с продукта гена, может количественно определяться с помощью гибридизации с использованием норзерн-блоттинга.(1989. Белок, кодируемый геном, можно определить количественно или путем анализа белка на биологическую активность, или путем применения анализов, которые не зависят от такой активности, например, анализа вестерн-блоттинга или радиоиммуноанализа с помощью антител, которые способны реагировать с белком. (Sambrook et al., Molecular Cloning: A Laboratory Manual, pp. 18.1-18.88, Cold Spring Harbor Laboratory Press (1989. В некоторых вариантах термины "экспрессия", экспрессировать и экс-6 016153 прессирует применяются в отношении рекомбинантного белка с низким содержанием маннозы, полученного согласно способу, описанному в данном изобретении. Термины с низкой маннозой и с низким содержанием маннозы, как применяется в данном изобретении, относится к композиции гликопротеинов, в которой не более чем приблизительно 10% композиции содержит гликопротеины с более, чем 4 остатками маннозы, т.е. вид M5 или более высокий. Наоборот, высокое содержание маннозы относится к композиции гликопротеинов, где более чем приблизительно 10% композиции содержит гликопротеины с более чем 4 остатками маннозы. Термины с низкой маннозой и с низким содержанием маннозы также применяется в отношении композиции гликопротеинов, содержащей приблизительно более 90% или приблизительно более 95% композиции с гликопротеинами, включающими 4 или менее 4 остатков маннозы. Термин гликопротеин с низким содержанием маннозы применяется в отношении композиции рекомбинантных гликопротеинов, которая при продуцировании путем культивирования клетки-хозяина включает не более чем приблизительно 4%; не более чем приблизительно 5%; не более чем приблизительно от 4 до приблизительно 5%; не более чем приблизительно 6%; не более чем приблизительно от 5 до 6%; не более чем приблизительно 7%; не более чем приблизительно от 6 до 7%; не более чем приблизительно 8%; не более чем приблизительно от 7 до 8%; не более чем приблизительно 9%; не более чем приблизительно от 8 до 9%; не более чем приблизительно 10%; или не более, чем приблизительно от 9 до 10% гликопротеинов в композиции с более чем 4 остатками маннозы (т.е. вид M5 или более высокий), но выбор ими не ограничивается. Соответственно, термин гликопротеин с низким содержанием маннозы относится к композиции рекомбинантных гликопротеинов, которая при продуцировании путем культивирования клетки-хозяина содержит более чем приблизительно 90%; или более чем приблизительно 95% гликопротеинов в композиции с 4 или менее 4 остатков маннозы (т.е. 0-4 остатков маннозы). Высокое содержание маннозы можно определить одним или несколькими способами, хорошо известными в данной области, например, как описано в публикациях Wuhrer et al. (Journal of Chromatography B vol. 825:124-133,2005) и Dell et al. (Science Vol. 291:2351-2356), и способы, описанные в этих публикациях, включают, например, аналитический способ для картирования N-гликана гликопротеинов. В нескольких словах, N-гликаны удаляются из рекомбинантных гликопротеинов ферментативным способом, как например из рекомбинантных моноклональных антител, и на восстанавливающем конце вводится флуоресцентная метка (2-аминобензамид). Флуоресцентные N-гликаны разделяются с помощью высокощелочной анионообменной хроматографии (high pH anion exchange chromatography, HPAEC) и обнаруживаются с помощью флуоресцентной детекции. Разделение нейтральных гликанов обычно основано на увеличивающейся сложности в N-гликановых структурах. Разделение заряженных N-гликанов основано на количестве и типе сиаловой кислоты, сульфата или других имеющихся модификаций, из которых можно получить зарядовое число. Данные уровни гликанов в проверяемых образцах визуально сравниваются с соответствующим стандартом. Высокое содержание маннозы можно также определить с помощью метода тут же раскрытого в данном изобретении: высокопроизводительного метода детектирования и/или количественного определения высокого содержания маннозы в гликопротеине, включая антитело или его фрагменты, например,Fab фрагменты, слитые белки, включающие Fc фрагменты и пептидные антитела (пептибоди) при экспрессировании в эукариотных клетках-хозяина. Антитела обычно имеют единственный N-связанный гликан на Fc области. Из-за частично закрытой структуры гликана, он часто лишь частично процессируется, приводя к избыточно высокому содержанию маннозы и гибридным типам. Отбор клонов, мутация клеток или другая генетическая манипуляция или манипуляция культуры клеток может изменить типы гликанов, продуцируемых клетками. Исследуют большой набор условий/клеток, таким образом, требуется много гликановых тестов во время скрининга. Традиционное картирование гликана является медленным и трудоемким, требующим большого количества дней. Анализ с высоким содержанием маннозы/гибридного гликана, описанного в данном изобретении, дает отношения типов гликанов много быстрее при гораздо меньшем усилии лаборанта. В частности, изобретение предлагает способ детектирования и/или количественного определения гликопротеина с высоким содержанием маннозы в образце или композиции, содержащей гликопротеин,способ включает подвергание образца или композиции, содержащей гликопротеин, расщеплению эндоглюкозидазой, восстановление расщепленных гликопротеинов с помощью восстановителей (если требуется) и разделение расщепленных гликопротеинов с помощью денатурирующего электрофореза, в результате чего отношение гликана с высоким содержанием маннозы/гликану гибридного типа определяют путем вычитания фракции с негликозилированной тяжелой цепью (пиковая фракция без обработки эндогликозидазой) от фракции с дегликозилированной тяжелой цепью (пик после расщепления эндоглюкозидазой). Фракция неглюкозилированной тяжелой цепи или пиковая фракция без обработки эндоглюкозидазой генерируется путем подвергания того же самого образца или композиции тем же самым условиям расщепления при условии, что в них не присутствует эндоглюкозидаза. Данную стадию можно проводить одновременно со стадией расщепления эндоглюкозидазой или отдельно от нее. В данном изобретении могут применяться любые эндоглюкозидазы, которые селективно расщеп-7 016153 ляют гликаны с высоким содержанием маннозы и гибридные гликаны между GlcNAc1 и GlcNAc2 на остове гликана (или генерирующие короткие гликаны на белке), оставляя сложные N-связанные гликаны неповрежденными. Для соответствующего количественного определения эндоглюкозидаза не должна быть в ограниченных количествах. Конкретное условие для проведения расщепления эндоглюкозидазой,включающее концентрацию фермента, температуру инкубирования и время расщепления, зависит от типа применяемой эндоглюкозидазы. Примеры эндоглюкозидаз, относящихся к данному изобретению,включают эндоглюкозидазу H и эндоглюкозидазу F1, но выбор ими не ограничивается. В одном варианте данного изобретения образец, содержащий гликопротеины, обрабатывают эндоглюкозидазой H при 37C в течение 2 ч, восстанавливают -меркаптоэтанолом и подвергают анализу CE-SDS. Примеры способов разделения дегликозилированных гликопротеинов, например дегликозилированного антитела, от гликозилированных гликопротеинов, например гликозилированного антитела,включают следующие два способа, но выбор ими не ограничивается: 1) CE-SDS при восстанавливающих условиях. Гликозилированный гликопротеин, например антитело, денатурируют с SDS и восстановителем и тяжелую цепь (heavy chain, HC) с гликаном отделяют от расщепленной HC (дегликозилированная HC) с помощью капиллярного электрофореза-SDS (capillaryelectrophoresis -SDS, CE-SDS). Электроферограмма генерируется УФ сигналом. Площади под пиками пропорциональны относительным количествам. Таким образом количество с высоким содержанием маннозы/гибридного типа определяется из фракции, элюируемой ранее дегликозилированной HC. Поскольку GlcNAc-HC переносится одновременно с дегликозилированной HC, процент дегликозилированнойHC от нерасщепленного образца вычитается из предварительно полученного пика расщепленного образца с получением величины в процентах для высокого содержания маннозы. Разделение занимает 15-30 мин в зависимости от пространственной конфигурации. 2) CE-SDS, основанный на микрожидкостной системе. Гликопротеин денатурируют как в способе 1,но разделяют с помощью прибора "лаборатория в чипе", как например LC90 Caliper. Такой же принцип применяется при анализе и разделении, в то время как для обнаружения белка используется флуоресцентный краситель. Время разделения уменьшается приблизительно на 30 с на один анализ и отбирать образец можно из титрационного микропланшета. Способ, описанный в данном изобретении, как приведено выше, может выполняться на очищенном белке, но также и на неочищенных образцах культуры клеток. С рекомбинантными антителами сигнал является достаточно сильным, так что очистка не требуется. В некоторых вариантах гликопротеины с более чем 4 остатками маннозы включают гликопротеины с 5-9 остатками маннозы (т.е. виды M5-M9). Не связывая с какой-то конкретной теорией, специалисту в данной области должно быть понятно, что гликопротеиновая композиция, экспрессируемая клеткойхозяина, включает гликопротеины с изменяющимся количеством остатков маннозы. Например, гликопротеины с низким содержанием маннозы имеют 4 или меньше 4 остатков маннозы (например, 0-4 остатков маннозы) и гликопротеины с высоким содержанием маннозы имеют более 4 остатков маннозы(например, вид M5 или более высокий). В конкретном варианте изобретения гликопротеин с низким содержанием маннозы является рекомбинантным антителом или антигенсвязьтающим фрагментом его. В другом конкретном варианте изобретения рекомбинантный гликопротеин с низким содержанием маннозы является человеческим моноклональным антителом, которое связывает IL-15, или антигенсвязывающим фрагментом его. Термин практически не содержащая, как применяется в данном изобретении, обычно относится к препаратам клеточной культуральной среды, которая не содержит или содержит уменьшенное количество (т.е. по отношению к немодифицированной культуральной среде) некоторых компонентов. Например,в одном варианте культуральная среда, применяемая для продуцирования рекомбинантных гликопротеинов с низким содержанием маннозы, практически не содержит некоторых аминокислот (например, одной или нескольких аминокислот, выбранных из группы, состоящей из аланина, аргинина, аспарагиновой кислоты и глутаминовой кислоты). В некоторых вариантах культуральная среда, практически не содержащая одного или нескольких компонентов, модифицируется для включения менее чем приблизительно 1%, или менее чем приблизительно 3%, или менее чем приблизительно 5%, или менее чем приблизительно 10% одного или нескольких таких компонентов относительно немодифицированной культуральной среды. Термины IL-15", "IL-15 антиген" и "интерлейкин 15" применяются в данном изобретении взаимозаменяемо и включают любые варианты или изоформы, которые естественным образом экспрессируются клетками. Термин антитело, которое упоминается в данном изобретении, включает полные антитела и любой антигенсвязывающий фрагмент (т.е. "антигенсвязывающий участок") или отдельную цепь его. "Антитело" относится к гликопротеину, содержащему по меньшей мере две тяжелые (heavy, H) цепи и две легкие (light, L) цепи, связанные между собой дисульфидными связями, или антигенсвязывающему участку его. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (в данном изобретении обозначается как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит-8 016153 из трех доменов CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (в данном изобретении обозначается как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена - CL. VH и VL области можно дополнительно подразделить на области по гипервариабельности, названные гипервариабельными участками (complementarity determining regions, CDR), чередующимися с участками, которые являются более консервативными, названными остовными областями (framework region, FR). Каждая VH и VL состоит из трех CDRs и четырех FRs, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3,FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут содействовать связыванию иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (CIq) классической комплементной системы. Термины антигенсвязывающий участок" и антигенсвязывающий фрагмент" антитела (или просто"участок (детерминанта) антитела"), как применяется в данном изобретении, относится к одному или нескольким фрагментам антитела, которые селективно связываются с антигеном (например, IL-15). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами первичного антитела. Примеры антигенсвязывающих фрагментов, охватываемые термином антигенсвязывающий участок" антитела, включают (i) Fab фрагмент, одновалентный фрагмент, состоящий из VL, VH, CL, CH1 доменов; (ii) F(ab')2 фрагмент, двухвалентный фрагмент, состоящий из двух Fab фрагментов, связанных дисульфидным мостиком в шарнирной области; (iii) Fd фрагмент, состоящий из VH и CH1 доменов; (iv)Fv фрагмент, состоящий из VL и VH доменов одноплечевого антитела; (v) dAb фрагмент (Ward et al., Nature 341:544-546 (1989, который состоит из VH домена; и (vi) изолированный гипервариабельный участок (CDR) или (vii) комбинацию двух или нескольких изолированных CDRs, которые возможно могут соединяться синтетическим линкером. Кроме того, хотя два домена Fv фрагмента, VL и VH, кодируются отдельными генами, они могут соединяться с применением рекомбинантных способов с помощью синтетического линкера, который дает возможность им образовать отдельную белковую цепь, в которой VL иVH области спариваются с образованием одновалентных молекул (известных как единичная цепь Fv (single chain, scFv); см., например, Bird et al. Science 242:423-426 (1988); и Huston et al. Proc. Natl. Acad. Sci.USA 85:5879-5883 (1988). Предполагается, что такие одноцепочечные антитела также охватываются терминами "антигенсвязывающий участок" и "антигенсвязывающий фрагмент" антитела. Эти фрагменты антител получают с помощью стандартных методик, известных специалисту в данной области, и фрагменты подвергают скринингу на пригодность таким же образом, как и целые (интактные) антитела. Термин моноклональное антитело", как применяется в данном изобретении, относится к антителу,которое проявляет отдельную связывающую специфичность и аффинность для конкретного эпитопа. Соответственно, термин человеческое моноклональное антитело" относится к антителу, которое проявляет отдельную связывающую специфичность и которое имеет вариабельную и константную области,полученные из последовательностей иммуноглобулинов человеческой эмбриональной линии. В одном варианте человеческие моноклональные антитела продуцируются гибридомой, которая включает Bклетки, полученные от трансгенного животного, не относящегося к человеку, например, трансгенной мыши с геномом, содержащим тяжелую цепь человеческого трансгена и легкую цепь трансгена, слитого с иммортализованной клеткой. Термин рекомбинантное человеческое антитело", как применяется в данном изобретении, включает все человеческие антитела, которые получаются, экспрессируются, создаются или изолируются рекомбинантными способами, как например (а) антитела, изолированные из животного (например, мыши),которое является трансгенным или трансхромосомным для человеческих иммуноглобулиновых генов или гибридомы, полученной из них, (б) антитела, изолированные из клетки хозяина, трансформированной для экспрессии антитела, например, из трансфектомы, (в) антитела, изолированные из библиотеки рекомбинантных комбинаторных антител человеческого происхождения, и (г) антитела, полученные,экспрессированные, созданные или изолированные любыми другими способами, которые включают сплайсинг последовательностей человеческих иммуноглобулиновых генов с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области,полученные от иммуноглобулиновых последовательностей человеческой эмбриональной линии. Однако в некоторых вариантах такие рекомбинантные человеческие антитела могут подвергаться мутагенезу invitro (или, если применяют животное трансгенное для последовательностей Ig человека, то соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности VH и VL областей рекомбинантных антител являются последовательностями, которые, несмотря на то, что получены из и относятся к последовательностям VH и VL человеческой эмбриональной линии, могут в естественном виде не существовать в зародышевом наборе человеческого антитела in vivo. Как применяется в данном изобретении, гетерологичное антитело" определяется относительно трансгенного организма, не относящегося к человеку, продуцирующего такое антитело. Этот термин относится к антителу с аминокислотной последовательностью или последовательностью кодирующей нуклеиновой кислоты, соответствующей последовательности, найденной в организме, не содержащем не-9 016153 относящегося к человеку трансгенного животного, и обычно из вида, кроме вида не относящегося к человеку трансгенного животного. Изолированное антитело, как применяется в данном изобретении, относится к антителу, которое практически не содержит других антител с другими антигенными специфичностями (например, изолированное антитело, которое специфически связывается с IL-15, практически не содержит антител, которые специфически связывают антигены, кроме IL-15). Изолированное антитело, которое специфически связывается с эпитопом IL-15, может, однако, иметь перекрестную реактивность к другим родственным цитокинам или к другим IL-15 белкам от другого вида. Однако антитело предпочтительно всегда связывается с человеческим IL-15. Кроме того, изолированное антитело обычно практически не содержит другого клеточного материала и/или химических веществ. В конкретном варианте комбинация "изолированных" моноклональных антител с другими IL-15 специфичностями объединяются в вполне определенную композицию. Как применяется в данном изобретении специфическое связывание, селективное связывание и селективно связывается относится к антителу или его фрагменту, связывающему заданный антиген. Например, в одном варианте антитело связывается с аффинностью (KD) приблизительно менее, чем 10-7 М, как например приблизительно менее чем 10-8 М, 10-9 М или 10-10 М или даже ниже, при определении с помощью поверхностной плазмонной резонансной (surface plasmon resonance, SPR) технологии на приборе BIACORE 3000 с применением рекомбинантного человеческого IL-15 в качестве аналита и антитела в качестве лиганда, и связывается с заданным антигеном с аффинностью, которая по меньшей мере в два раза выше, чем аффинность для связывания неспецифического антигена (например, BSA, казеин) помимо заданного антигена или близкородственного антигена. Фразы антитело, распознающее антиген и антитело, специфическое для антигена в данном изобретении применяются равнозначно с термином антитело, которое селективно связывается с антигеном. Предполагают, что термин KD, как применяется в данном изобретении, относится к константе диссоциативного равновесия конкретного антитело-антиген взаимодействия. Как применяется в данном изобретении изотип относится к классу антитела (например, IgM илиIgG1), который кодируется генами константной области тяжелой цепи. Как применяется в данном изобретении переключение изотипа относится к явлению, с помощью которого класс или изотип антитела изменяется от одного класса Ig к одному из других классов Ig. Как применяется в данном изобретении, непереключенный изотип относится к изотипическому классу тяжелой цепи, которая продуцируется, когда отсутствует переключение изотипа; CH ген, кодирующий непереключенный изотип, обычно является первичным CH геном непосредственно в прямом направлении от функционально реаранжированного VDJ гена. Переключение изотипа было классифицировано как классическое или неклассическое переключение изотипа. Классическое переключение изотипа происходит с помощью явлений рекомбинации, которые включают по меньшей мере одну область последовательности переключения в трансгене. Неклассическое переключение изотипа может происходить, например, с помощью гомологичной рекомбинации между человеческойи человеческой(ассоциированная делеция). Альтернативные механизмы неклассического переключения, как, например,межтрансгенная и/или межхромосомная рекомбинация, между прочим, может происходить и приводить в исполнение переключение изотипа. Как применяется в данном изобретении, термин последовательность переключения относится к таким ДНК последовательностям, которые ответственны за рекомбинацию переключения. Последовательность переключения донор , обычнообласть переключения, будет 5' (т.е в обратном направлении) конструктивной области, которая вычеркивается (стирается) во время рекомбинации переключения. Область акцептора переключения должна быть между вычеркиваемой (стираемой) конструктивной областью и заменяемой константной областью (например, , , и т.д.). Если отсутствует специфический сайт, где всегда происходит рекомбинация, то окончательная последовательность гена обычно не будет предсказуемой из конструкции. Как применяется в данном изобретении гликозилированный участок определяется как участок из углеводных остатков, которые ковалентно присоединены к белку, точнее к белку иммуноглобулина. Гликозилированный участок гетерологичного антитела может характеризоваться как практически аналогичный гликозилированным участкам, которые естественным образом встречаются на антителам, продуцируемых видом трансгенного животного, не относящегося к человеку, если специалист в данной области распознает гликозилированный участок гетерологичного антитела, который ближе к упомянутому участку гликозилирования в разновидности трансгенного животного, не относящегося к человеку, чем к разновидности, из которой получены CH гены трансгена. Термин встречающийся в природе, как применяется в данном изобретении, когда касается объекта, относится к факту, что объект можно найти в природе. Например, полипептидная или полинуклеотидная последовательность, которая присутствует в организме (включая вирусы), которая может изолироваться от природного источника и которая специально не модифицируется человеком в лаборатории,является встречающейся в природе.- 10016153 Термин реаранжированный, как применяется в данном изобретении, относится к конфигурации тяжелой цепи или легкой цепи иммуноглобулинового локуса, где V сегмент расположен в непосредственном соседстве с D-J или J сегментом в конформации, кодирующей, по существу, полный VH или VL домен, соответственно. Реаранжированный локус иммуноглобулинового гена можно определить путем сравнения с зародышевой ДНК; реаранжированный локус будет иметь по меньшей мере один элемент рекомбинированной гомологии гептамер/нонамер. Термин нереаранжированный или зародышевая (первичная) конформация, как применяется в данном изобретении в отношении V сегмента, относится к конфигурации, где V сегмент не рекомбинируется с тем, чтобы быть в непосредственном соседстве с D или J сегментом. Термин молекула нуклеиновой кислоты, как применяется в данном изобретении, относится к молекулам ДНК и РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной,но предпочтительно является двухцепочечной ДНК. Термин изолированная молекула нуклеиновой кислоты, как применяется в данном изобретении в отношении нуклеиновых кислот, кодирующих антитела или части антител (например, VH, VL, CDR3),которые селективно связываются с IL-15, относятся к молекуле нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или часть антитела, не содержат других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связывают антигены, кромеIL-15, где другие последовательности могут естественным образом фланкировать нуклеиновую кислоту в геномной ДНК человека. SEQ ID NOS:1-4 соответствуют нуклеотидным и аминокислотным последовательностям, включающим вариабельные области тяжелой цепи (VH) И легкой цепи (VL) антитела человека против IL-15. В частности, SEQ ID NO:1 и 2 соответствуют VH антитела и SEQ ID NO:3 и 4 соответствуют VL антитела. В конкретном варианте человеческое моноклональное антитело, которое связывает IL-15, или его антигенсвязывающий фрагмент, включает вариабельную область легкой цепи, содержащую один или несколько и предпочтительно все три CDRs, приведенные в SEQ ID NOs:8-10, и вариабельную область тяжелой цепи, содержащую один или несколько и предпочтительно все три CDRs, приведенные в SEQID NOs:5-7. В конкретном варианте данное изобретение также включает модификации консервативных последовательностей или замены консервативных последовательностей, последовательностей, приведенных в SEQ ID NOs:1-10, т.е. модификации нуклеотидных и аминокислотных последовательностей, которые существенно не влияют и не изменяют связывающие характеристики антитела, кодируемого нуклеотидной последовательностью, или содержащего аминокислотную последовательность. Такие модификации консервативных последовательностей включают нуклеотидные и аминокислотные замены, прибавления и делеции. Модификации могут вводиться в SEQ ID NOs:1-10 с помощью стандартных методик,известных в данной области, такой как сайт-направленный мутагенез и PCR-опосредованный мутагенез. Консервативные аминокислотные замены включают такие замены, в которых остаток аминокислоты заменяется аминокислотным остатком со сходной боковой цепью. В данной области были определены семейства аминокислотных остатков со сходными боковыми цепями. Данные семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), -разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предсказанный остаток незаменимой аминокислоты в человеческом анти-IL-15 антителе предпочтительно заменяется другим остатком аминокислоты из того же семейства боковой цепи. Или же, в другом варианте, мутации могут вводиться произвольно во все или в часть анти-IL-15 антитела кодирующую последовательность, как например с помощью мутагенеза насыщения и полученные модифицированные анти-IL-15 антитела могут подвергаться скринингу на связывающую активность. Соответственно, антитела, кодируемые нуклеотидными последовательностями (вариабельная область тяжелой и легкой цепи), раскрытыми в данном изобретении, и/или содержащие аминокислотные последовательности (вариабельная область тяжелой и легкой цепи), раскрытые в данном изобретении(т.е. SEQ ID NOs:1-4), включают практически такие же антитела, кодируемые или содержащие сходные последовательности, которые были консервативно модифицированы. Кроме того, ниже предлагается обсуждение того, как такие практически сходные антитела могут генерироваться на основе частичных последовательностей (т.е. вариабельные области тяжелой и легкой цепи), раскрытых в данном изобретении, как SEQ ID NOs:1-4. Для нуклеиновых кислот термин существенная гомология указывает, что две нуклеиновые кислоты или их заданные последовательности при оптимальном выравнивании и сравнении, являются идентичными с соответствующими инсерциями или делециями нуклеотидов по меньшей мере на приблизительно 80% нуклеотидов, обычно по меньшей мере на приблизительно 90-95% и более предпочтительно- 11016153 по меньшей мере на приблизительно 98-99,5% нуклеотидов. Или же существенная гомология существует, если сегменты в условиях селективной гибридизации будут гибридизироваться с комплементом цепи. Для аминокислотных последовательностей термин гомология указывает на степень идентичности двух аминокислотных последовательностей при оптимальном выравнивании и сравнении с соответствующими инсерциями или делециями. Процент идентичности двух последовательностей является функцией количества идентичных позиций, разделенных последовательностями (т.е. % гомологии = количество идентичных позиций/общее количество позиций 100), принимая во внимание количество двухнитевых разрывов и длину каждого двухнитевого разрыва, которые необходимо ввести для оптимального сравнительного анализа первичной структуры двух последовательностей. Сравнение последовательностей и определение процента идентичности двух последовательностей можно достичь с помощью математического алгоритма. Процент идентичности двух нуклеотидных последовательностей можно определить с помощью программы GAP и пакета программного обеспечения GCG (доступного в http:www.gcg.com), применяяNWSgapdna CMP матрицу и вес двухнитевых разрывов 40, 50, 60, 70 или 80 и погонный вес 1, 2, 3, 4, 5 или 6. Процент идентичности двух нуклеотидных или аминокислотных последовательностей можно также определить с помощью алгоритма E.Meyers, W.Miller (CABIOS, 4:11-17 (1989, который был включен в программу ALIGN (версия 2), используя таблицу веса остатков PAM120, штраф несоответствия длины 12 и штраф за пропуск в последовательности 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определить с применением алгоритма Needleman, Wunsch (J.Mol. Biol. (48):444-453 (1970, который был включен в программу GAP в пакете программного обеспечения GCG (доступного в http:www.gcg.com), применяя матрицу Blossum 62 или матрицу PAM250, и вес двухнитевых разрывов 16, 14, 12, 10, 8, 6 или 4 и погонный вес 1, 2, 3, 4, 5 или 6. Последовательности нуклеиновых кислот и белков, описанные в данном изобретении, могут далее применяться в качестве сомнительной последовательности (query sequence) для проведения исследования с общедоступными базами данных, например, для определения родственных последовательностей. Такие исследования можно выполнить с помощью программ NBLAST и XBLAST (версия 2.0) (Altschul,et al. J. Mol.Biol. 215:403-10 (1990. Исследования нуклеотидов по программе BLAST можно выполнить с программой NBLAST, показатель=100, длина слова = 12 с получением нуклеотидных последовательностей гомологичных молекулам нуклеиновых кислот, описанных в изобретении. Исследования белков по программе BLAST можно выполнить с помощью программы XBLAST, показатель = 50, длина слова = 3 с получением аминокислотных последовательностей гомологичных белковым молекулам, описанным в изобретении. Для получения содержащих разрывы выравниваний для целей сравнения можно применятьGapped BLAST, как описано в публикации Altschul et al., Nucleic Acids Res. 25(17):3389-3402 (1997). При применении программ BLAST и Gapped BLAST можно использовать значения параметров по умолчанию соответствующих программ (например, XBLAST и NBLAST). (См. (http://www.ncbi.nlm.nih.gov). Нуклеиновые кислоты могут присутствовать в целых клетках, в клеточном лизате или в частично очищенной форме или практически чистой форме. Нуклеиновая кислота является изолированной (выделенной) или практически чистой, если она очищена от других клеточных компонентов или других контаминантов, например других клеточных нуклеиновых кислот или белков, с помощью стандартных методик, включая щелочную/SDS обработку, CsCl бэндинг, колоночную хроматографию, электрофорез на агарозном геле и другие хорошо известные в данной области методики. См. F.Ausubel, et al., ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, New York (1987). Композиции нуклеиновых кислот, описанные в данном изобретении, хотя часто в нативной последовательности (за исключением модифицированных сайтов рестрикции и других), из или кДНК, геномной или их смесей могут мутироваться в соответствии со стандартными методиками для обеспечения генных областей. Что касается кодирующих областей, данные мутации по желанию могут затрагивать аминокислотную последовательность. В частности, рассматриваются последовательности ДНК практически гомологичные нативным V, D, J, константным последовательностям, последовательностям переключения и другим таким последовательностям, описанным в данном изобретении, или полученным из них (где полученные указывают, что последовательность является идентичной или модифицированной другой последовательностью). Нуклеиновая кислота является операбельно связанной, если она помещается в функциональную зависимость с последовательностью другой нуклеиновой кислоты. Например, промотор или энхансер операбельно связывается с кодирующей последовательностью, если она затрагивает транскрипцию последовательности. Что касается регуляторных последовательностей транскрипции, операбельно связанная означает, что связанные последовательности ДНК являются соседними и, где необходимо соединить две кодирующие области белка, соседними и в рамке считывания. Для переключения последовательностей операбельно связанная указывает, что последовательности способны осуществлять рекомбинацию на этапе переключения. Предполагают, что термин вектор, как применяется в данном изобретении, относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она была- 12016153 связана. Один тип вектора представляет собой плазмиду, которая относится к петли кольцевой двухцепочечной ДНК, в которую могут лигироваться дополнительные сегменты ДНК. Другой тип вектора является вирусным вектором, где дополнительные сегменты ДНК могут лигироваться в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяина, в которую они вводятся (например, бактериальные векторы с бактериальным происхождением репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина при введении в клетку-хозяина и, тем самым, реплицироваться наряду с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они операбельно соединяются. Такие векторы в данном изобретении называются рекомбинантными векторами экспрессии (или просто векторы экспрессии). Действительно, полезные векторы экспрессии в технологиях рекомбинантных ДНК часто имеются в форме плазмид. В данном описании "плазмида и "вектор" могут применяться взаимозаменяемо, поскольку плазмида является наиболее часто применяемой формой вектора. Однако предполагают, что данное изобретение включает такие другие формы векторов экспрессии, как например, вирусные векторы (например, репликативные поврежденные ретровирусы, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции. Как применяется в данном изобретении, термин субъект включает человека или любое не относящееся к человеку животное. Например, способы и композиции, описанные в данном изобретении, могут применяться для лечения субъекта с воспалительным заболеванием, таким как артрит, например,ревматоидный артрит. Термин не относящееся к человеку животное включает всех позвоночных, например млекопитающих и немлекопитающих, таких как не относящееся к человеку приматы, овца, собака, корова, цыплята, земноводные, пресмыкающиеся и т.д. Различные аспекты изобретения далее описываются подробно в следующих подразделах.II. Факторы, влияющие на содержание маннозы.(а) Осмолярность. Различные параметры клеточных культур могут влиять на содержание маннозы в рекомбинантном гликопротеине, экспрессируемом в культуре клеток млекопитающих. В частности, с помощью данного изобретения было раскрыто, что чем выше осмолярность клеточной культуральной среды, тем выше процентное содержание в композиции гликопротеинов с более чем 4 остатками маннозы (т.е. вид M5 или более высокий). Соответственно, в одном варианте данного изобретения, для уменьшения или контролирования содержания маннозы в экспрессированных гликопротеинах осмолярность клеточной культуральной среды поддерживается на уровне менее чем приблизительно 600 мосмоль/кг (например, от приблизительно 250 до приблизительно 600 мосмоль/кг). Для культуры клеток млекопитающих осмолярность клеточной культуральной среды поддерживается на уровне менее чем приблизительно 550 мосмоль/кг, или менее чем приблизительно 500 мосмоль/кг, или менее чем приблизительно 450 мосмоль/кг, или менее чем приблизительно 400 мосмоль/кг,или менее чем приблизительно 380 мосмоль/кг или от приблизительно 200 до приблизительно 600 мосмоль/кг, или от приблизительно 250 до приблизительно 550 мосмоль/кг или от приблизительно 250 до приблизительно 500 мосмоль/кг, или от приблизительно 250 до приблизительно 450 мосмоль/кг, или от приблизительно 250 до приблизительно 400 мосмоль/кг, или от приблизительно 250 до приблизительно 380 мосмоль/кг, или от приблизительно 250 до приблизительно 350 мосмоль/кг. Для того чтобы получить осмолярность в нужном интервале, можно регулировать концентрацию различных составных частей в клеточной среде. Например, растворенные вещества, которые могут прибавляться в клеточную среду с тем, чтобы увеличить ее осмолярность, включают белки, пептиды, аминокислоты, гидролизованные животные белки, такие как пептоны, неметаболизированные полимеры, витамины, ионы, соли, сахара, метаболиты, органические кислоты, липиды и другие. Однако должно быть понятно, что концентрация(и) других составных частей в культуральной среде может изменяться с целью достижения нужной осмолярности. В другом варианте осмолярность может регулироваться в упомянутых выше интервалах прибавлением к культуральной среде одного или нескольких осмопротекторов. Типичные осмопротекторы хорошо известны в данной области и включают бетаин, глицин, L-треонин, L-пролин и их производные, но выбор ими не ограничивается, включая глицин, бетаин, бетаинальдегид, но выбор ими не ограничивается. В конкретном варианте клеточная культуральная среда содержит бетаин при концентрации приблизительно 20 мМ или выше или от приблизительно 1 до приблизительно 100 мМ, и более предпочтительно от приблизительно 20 до приблизительно 30 мМ. Осмолярность может измеряться любыми способами, которые хорошо известны в данной области и которые описаны в данном изобретении. Например, осмометр, такой как продается фирмой Fisher Scientific, Pittsburgh, PA под торговым (фирменным) названием OSMETTE, может применяться для измерения осмолярности клеточной культуральной среды. Или же, может применяться Osmette model 2007 (Precision Systems, Inc., Natick, MA). В других вариантах изобретения осмолярность в клеточной культуральной среде может регулироваться путем изменения концентрации одной или нескольких солей, сахаров, пептонов, аминокислот и- 13016153 ионов аммония. В еще других вариантах изобретения для изменения (например, уменьшения) содержания маннозы вышеупомянутые параметры, влияющие на осмолярность, могут сочетаться с воздействием температуры и продолжительности времени, в течение которого клетки культивируются. Соответственно, следует иметь в виду, что для изменения содержания маннозы в рекомбинантных гликопротеинах различные параметры клеточного культивирования, описанные в данном изобретении, могут регулироваться как таковые или регулироваться в их комбинации.(i) Концентрации ионов калия и натрия. В экспериментах, приведенных в данном изобретении, было продемонстрировано, что увеличение концентрации ионов калия (K+) в культуральной среде содействует высокому содержанию маннозы в гликопротеинах. Соответственно, в одном варианте изобретение применяет клеточную культуральную среду с концентрацией K+ приблизительно 70 мМ или менее (например, от приблизительно 10 до приблизительно 50 мМ). Как обсуждалось выше, в клеточной культуральной среде может контролироваться только концентрация ионов калия или она может контролироваться в комбинации с одним или несколькими другими факторами, описанными в данном изобретении, которые влияют на осмолярность. В конкретном варианте культуральная среда дополнительно включает концентрацию ионов натрия приблизительно 200 мМ или менее (например, от приблизительно 50 до приблизительно 100 мМ).(ii) Аминокислоты. Другими факторами, которые влияют на осмолярность клеточной культуральной среды и/или приводят к высокому содержанию маннозы в рекомбинантно экспрессируемых белках, являются концентрация и тип аминокислот в среде. Например, в конкретном варианте удвоение концентрации всех 20 аминокислот в среде приводит к увеличению содержания маннозы. Соответственно, в конкретном варианте,описанном в данном изобретении, клеточную культуральную среду регулируют так, чтобы она имела пониженную концентрацию аминокислот. В конкретной среде концентрация аминокислот уменьшается приблизительно в два раза. В другом конкретном варианте клеточная культуральная среда практически не содержит одной или нескольких аминокислот, выбранных из группы, состоящей из аланина, аргинина, аспарагиновой кислоты и глутаминовой кислоты.(iii) Сахара. Другими факторами, которые влияют на осмолярность клеточной культуральной среды и/или приводят к высокому содержанию маннозы в рекомбинантно экспрессируемых белках, являются концентрация и тип сахаров в среде. В конкретном варианте клеточная культуральная среда содержит глюкозу при концентрации от приблизительно 1 до приблизительно 90 мМ.(iv) Ионы аммония. Другим фактором, который может влиять на осмолярность клеточной культуральной среды и/или приводить к высокому содержанию маннозы в рекомбинантно экспрессируемых белках, является концентрация ионов аммония приблизительно равная 30 мМ или менее (например, от приблизительно 0 до приблизительно 10 мМ). В одном варианте концентрация ионов аммония составляет приблизительно 10 мМ или менее.(v) Пептоны. Другими факторами, которые влияют на осмолярность клеточной культуральной среды и/или приводят к высокому содержанию маннозы в рекомбинантно экспрессируемых белках, являются концентрация и тип пептонов, используемых в среде. Пептоны представляют собой добавки сред, которые получаются из гидролизованных животных белков. Источники пептонов хорошо известны в данной области и включают, например, побочные продукты животного происхождения, желатины и вещества растительного происхождения. Типичные пептоны включают дрожжевой экстракт, дрожжевой гидролизат, соевый пептон, соевый гидролизат, пшеничный пептон и пшеничный гидролизат при концентрации от приблизительно 0,5 до приблизительно 60 г/л.(vi) Витамины. Другими факторами, которые влияют на осмолярность клеточной культуральной среды и/или приводят к высокому содержанию маннозы в рекомбинантно экспрессируемых белках, являются концентрация и тип витаминов, используемых в среде. В конкретном варианте клеточная культуральная среда включает один или несколько витаминов, выбранных из группы, состоящей из биотина, D-пантотената кальция, хлоридхолина, фолиевой кислоты, i-инозита, ниацинамида, пиридоксаля HCl, пиридоксина HCl,рибофлавина, тиамина HCl, цианокобаламина при концентрации от приблизительно 0,00005 до приблизительно 0,9 г/л.(б) Температура. Другим фактором, который влияет на высокое содержание маннозы в рекомбинантно экспрессируемых белках, является температура, при которой выдерживается клеточная культура. Соответственно,в другом варианте данного изобретения температура, при которой культивируются клетки-хозяина, также регулируется сама по себе или вместе с предшествующими факторами (например, регулирование периода инкубации клеточной культуры и факторов, влияющих на осмолярность) для изменения (напри- 14016153 мер, уменьшения) содержания маннозы в рекомбинантно экспрессируемых гликопротеинах. В отдельных вариантах клетки-хозяина культивируются при приблизительно 31C, или при приблизительно 32C,или при приблизительно 33C, или при приблизительно 34C, или при приблизительно 35C, или при приблизительно 36C, или при приблизительно 37C, или при приблизительно 38C.III. Процедуры для культуры клеток Согласно способам, описанным в данном изобретении, клетки-хозяина культивируются в среде, которая позволяет экспрессию рекомбинантных гликопротеинов с низким содержанием маннозы. Соответствующие процедуры для клеточных культур и условия хорошо известны в данной области. Клеткихозяина (например, CHO и NSO клетки) могут культивироваться при широком разнообразии форматов и сосудов для культивирования. Например, клетки-хозяина могут культивироваться в формате, предназначенном для крупномасштабного продуцирования гликопротеинов или для продуцирования гликопротеинов в малом масштабе. Или же клетки-хозяина могут культивироваться прилипанием ко дну колб или чашек для культивирования, или они могут находиться в суспензии в перемешиваемых колбах, биореакторах или в культурах вращающихся флаконов. В некоторых вариантах для продуцирования рекомбинантных гликопротеинов в коммерчески соответствующих количествах клетки-хозяина могут выращиваться в биореактарах и предпочтительно в биореакторах с емкостью приблизительно 2 л или более, или приблизительно 5 л или более, или приблизительно 10 л или более, или приблизительно 50 л или более,или приблизительно 100 л или более, или приблизительно 500 л или более, или приблизительно 1000 л или более, или приблизительно 1500 л или более, или приблизительно 2000 л или более. В некоторых вариантах клетки-хозяина могут культивироваться (например, поддерживаться и/или выращиваться) в жидкой среде и предпочтительно культивироваться непрерывно или периодически с помощью стандартных методов культивирования, таких как неподвижная культура, культура в анализируемых пробирках, перемешиваемая культура (например, культура при вращательном перемешивании,культура во встряхиваемой колбе, и т.д.), культура с постоянным перемешиванием с аэрированием или ферментация. В некоторых вариантах клетки-хозяина культивируются во втряхиваемых колбах. Еще в других вариантах клетки-хозяина культивируются в ферментере (например, в ферментативном процессе). Ферментативные процессы включают периодические, непрерывно-периодические и непрерывные способы ферментации, но выбор ими не ограничивается. Термины периодический процесс и периодическая ферментация относятся к закрытой системе, в которой состав из среды, питательных веществ,вспомогательных добавок и других помещается вначале ферментации и не подвергается изменению во время ферментации; однако могут предприниматься попытки контролировать такие факторы, как pH и концентрация кислорода для предотвращения избыточного подкисления сред и/или смерти микроорганизмов. Термины непрерывно-периодический процесс или непрерывно-периодическая ферментация относится к периодической ферментации, за исключением того, что добавляются один или несколько субстратов или добавок (например, добавляются порциями или непрерывно) или условия для клеточной культуры изменяются по мере протекания ферментативного процесса. Термины непрерывный процесс и непрерывная ферментация относятся к системе, в которой определенная ферментационная среда прибавляется в ферментер непрерывно и равное количество использованной или кондиционированной среды одновременно удаляется, например, для извлечения нужного продукта (например, рекомбинантного гликопротеина). Был разработан целый ряд таких процессов и они хорошо известны в данной области. В конкретном варианте клетка-хозяин, экспрессирующая рекомбинантное человеческое моноклональное антитело, которое связывает IL-15, выращивается во вращающихся флаконах, 2-литровых вращающихся колбах или другой пригодной для культивирования системе.IV. Извлечение гликопротеина После фазы продуцирования полипептида нужный рекомбинантный гликопротеин можно извлечь из культуральной среды с помощью методов хорошо известных в данной области. Нужный гликопротеин предпочтительно извлекают из культуральной среды в виде секретируемого полипептида, хотя его также можно выделить из лизатов клетки-хозяина. В некоторых вариантах культуральную среду или лизат центрифугируют для удаления частиц клеточного дебриса. Гликопротеин затем очищают от контаминантных растворимых белков и полипептидов с помощью соответствующих методик очистки. Типичные методики очистки включают фракционирование (разделение) на иммунноаффинных или ионообменных колонках; осаждение этанолом; ВЭЖХ с обращенной фазой; хроматографию на силикагеле или катионно-обменных смолах, таких как DEAE; хроматофокусирование; SDS-PAGE; фракционирование сульфатом аммония; гель-фильтрацию с применением, например сефадекса G-75 (Sephadex G-75); сефарозные колонки с белком A для удаления контаминантов, таких как IgG. Для ингибирования протеолитической деградации во время очистки также может быть пригоден ингибитор протеазы, такой как фенилметилсульфонилфторид (phenyl methyl sulfonyl fluoride, PMSF). Специалисту должно быть понятно, что способы очистки, пригодные для нужного рекомбинантного гликопротеина, могут нуждаться в модификации для внесения изменений в свойства гликопротеина при экспрессии в рекомбинантной клеточной культуре. В конкретном варианте данного изобретения рекомбинантный гликопротеин, экспрессируемый с- 15016153 помощью способов, описанных в данном изобретении, является человеческим моноклональным антителом или его антигенсвязывающим фрагментом. Обычно антитела первоначально характеризуются с помощью ELISA. Например, титрационные микропланшеты можно покрыть очищенным антигеном, таким как, например, IL-15 в PBS, и затем блокировать посторонними белками, таким как бычий сывороточный альбумин (bovine serum albumin, BSA), разбавленный в PBS. Разведения экстрактов от культивированных клеток прибавляются к каждой ячейке и инкубируются в течение 1-2 ч при 37C. Планшеты промываются PBS/Tween 20 и затем инкубируются с козьим Fc-специфическим поликлональным реагентом противIgG человека, конъюгированным со щелочной фосфатазой в течение 1 ч при 37C. После промывания планшеты проявляли субстратом ABTS и анализировали при оптической плотности (optical density, OD) при 405. Чтобы определить, связываются ли антитела, продуцируемые способами, описанными в данном изобретении, с уникальными эпитопами, каждое антитело могло биотинилироваться с помощью коммерчески доступных реагентов (Pierce, Rockford, IL). Связывание биотинилированного MAb можно обнаружить меченым стрептавидином зондом. Чтобы определить изотип очищенных антител, ELISAs изотипов можно выполнять с помощью общепризнанных в данной области методик. Например, лунки титрационных микропланшетов могут покрываться 10 мкг/мл анти-IgG человека в течение ночи при 4C. После блокирования 5% BSA микропланшеты реагируют с 10 мкг/мл антител или контролями очищенных изотипов при комнатной температуре в течение двух часов. Лунки могут затем реагировать или с человеческим IgG1 или другими человеческими изотип-специфическими коъюгированными зондами. Микропланшеты проявлялись и анализировались как описано выше. В конкретном варианте рекомбинантный гликопротеин, продуцируемый с помощью способов, описанных в данном изобретении, является человеческим моноклональным антителом, которое связываетIL-15, или его антигенсвязывающим фрагментом. Для проверки связывания IL-15 моноклональных антител с жизнеспособными клетками, экспрессирующими IL-15, можно применять проточную цитометрию. В нескольких словах, клеточные линии и/или человеческие PBMCs, экспрессирующие связанный с мембраной IL-15 (выращенный при стандартных условиях роста), смешиваются с различными концентрациями моноклональных антител в PBS, содержащем 0,1% BSA и 0,01% NaN3, при 4C в течение 1 ч. После промывания клетки реагируют с меченым флуоресцеином антителом против IgG человека при тех же самых условиях, что и окрашивание первичным антителом. Образцы могут анализироваться с помощью прибора FACScan, используя свойства света и бокового рассеяния для проникновения на отдельные клетки и определяется связывание меченых антител. В дополнение к анализу проточной цитометрии или вместо его может использоваться альтернативный анализ с применением флуоресцентной микроскопии. Клетки могут окрашиваться точно также, как описано выше, и исследоваться с помощью флуоресцентной микроскопии. Данный способ позволяет сделать видимыми индивидуальные клетки, но может иметь уменьшенную чувствительность в зависимости от плотности антигена.IgGs человека против IL-15 далее могут проверяться на реакционную способность с IL-15 антигеном с помощью вестерн-блоттинга. В нескольких словах, клеточные экстракты из клеток-хозяина, экспрессирующих IL-15, можно приготовить и подвергнуть электрофорезу в натрий додецилсульфат - полиакриламидном геле. После электрофореза выделенные антигены будут переноситься в нитроцеллюлозные мембраны, блокироваться 20% сывороткой мыши и зондироваться проверяемыми моноклональными антителами. Связывание человеческого IgG можно детектировать с помощью щелочной фосфатазы против IgG человека и проявлять таблетками BCIP/NBT субстрата (Sigma Chem. Co., St. Louis, MO).V. Фармацевтические композиции В другом варианте данное изобретение предлагает композицию, например фармацевтическую композицию, содержащую один или комбинацию рекомбинантных глюкопротеинов с низким содержанием маннозы. В конкретном варианте фармацевтическая композиция включает по меньшей мере один белок,предназначенный для лечебных целей, с низким содержанием маннозы, такой, как например антитело,предназначенное для лечебных целей, или его антигенсвязывающий фрагмент с низким содержанием маннозы (например, человеческое моноклональное антитело, которое связывает IL-15, или его антигенсвязывающий фрагмент). В другом конкретном варианте фармацевтическая композиция, описанная в данном изобретении, включает один или несколько рекомбинантных гликопротеинов с низким содержанием маннозы, входящих в состав вместе с фармацевтически приемлемым носителем. Фармацевтические композиции, описанные в данном изобретении, также могут назначаться при комбинированной терапии, т.е. комбинироваться с другими средствами. Например, комбинированная терапия может включать композицию, описанную в данном изобретении, с по меньшей мере одним или несколькими дополнительными терапевтическими средствами, такими как противовоспалительные средства, DMARDs (disease-modifying anti-rheumatic drags, симптом-модифицирующие противоревматические лекарственные препараты), иммуносупрессоры (иммунодепресанты), химиотерапевтические средства и средства против псориаза. Фармацевтические композиции, описанные в данном изобретении,можно также назначать вместе с лучевой терапией. Совместные введения с другими антителами, такими как CD4 специфические антитела и IL-2 специфические антитела, также охватываются данным изобре- 16016153 тением. Полагают, что такие комбинации с CD4 специфическими антителами или IL-2 специфическими антителами особенно пригодны при лечении аутоиммунных болезней и отторжений трансплантатов. Как применяется в данном изобретении, фармацевтически приемлемый носитель включает любой и все растворители, дисперсные среды, покрытия (пленки), антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию средства и другие, которые являются физиологически совместимыми. Предпочтительно, когда носитель пригоден для внутривенного, внутримышечного,подкожного, парентерального, спинального или эпидермального введения (например, с помощью инъекции или инфузии). В зависимости от пути введения рекомбинантный гликопротеин, например, антитело,биспецифическая и мультиспецифическая молекула может иметь оболочку из вещества для защиты соединения от действия кислот и других природных условий, которые могут инактивировать соединение. Фармацевтически приемлемая соль относится к соли, которая сохраняет нужную биологическую активность исходного соединения и не придает никаких нежелательных токсикологических воздействий(см., например, Berge, S.M., et al., J. Pharm. Sci. 66:1-19 (1977. Примеры таких солей включают соли,полученные присоединением кислоты, и соли, полученные присоединением основания. Соли, полученные присоединением кислоты, включают соли, полученные присоединением нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромисто-водородная, иодисто-водородная,фосфористая и другие, а также присоединением нетоксичных органических кислот, таких как алифатических моно- и дикарбоновых кислот, фенилзамещенных алкановых кислот, гидроксиалкановых кислот,ароматических кислот, алифатических и ароматических сульфокислот и других. Соли, полученные присоединением основания, включают соли, полученные присоединением оснований, содержащих щелочноземельные металлы, такие как натрий, калий, магний, кальций и другие, а также присоединением нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлорпрокаин,холин, диэтаноламин, этилендиамин, прокаин и другие. Композиция, описанная в данном изобретении, может вводиться с помощью целого ряда способов,известных в данной области. Как должно быть понятно специалисту путь и/или способ введения будет изменяться в зависимости от достижения желаемых результатов. Активные соединения можно приготовить с носителями, которые будут защищать соединение от быстрого высвобождения, как например, состав контролируемого высвобождения, включая импланты, трансдермальные пластыри и микроинкапсулированные системы доставки. Могут применяться биораспадающиеся биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полиакриловая кислота. Многие способы приготовления таких составов патентуются или они обычно известны специалисту в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems(Системы доставки лекарственных препаратов с поддерживаемым (пролонгированным) и контролируемым высвобождением), J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. Чтобы ввести соединение, описанное в данном изобретении, определенным способом введения,может возникнуть необходимость в защитном покрытии соединения веществом для предотвращения инактивации или соединение совместно вводят с веществом для предотвращения инактивации. Например, соединение может вводиться субъекту в соответствующем носителе, например липосомах или разбавителе. Фармацевтически приемлемые разбавители включают физиологический раствор и водные буферные растворы. Липосомы включают CGF эмульсии вода-масло-вода, а также обычные липосомы(Strejan et al., J. Neuroimmunol. 7:27 (1984. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. Применение таких сред и агентов для фармацевтически активных субстанций известно в данной области. Если какая-либо стандартная среда или агент несовместим с активным соединением,применение его в фармацевтических композициях, описанных в изобретении, не рассматривается. В композиции могут также вводиться дополнительные активные соединения. Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Композиции могут быть в виде раствора, микроэмульсии, липосомы или другой прописанной структуры, пригодной для высокой концентрации лекарственного препарата. Носитель может быть растворителем или дисперсной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и другие) и их соответствующие смеси. Надлежащую текучесть можно поддержать, например, применением защитного покрытия, такого как лецитин, сохранением требуемого размера частиц в случае дисперсии и применением поверхностноактивных веществ. Во многих случаях будет предпочтительным включить в композиции изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может осуществляться включением в композицию агента, который задерживает абсорбцию, например, солей моностеарата и желатина. Стерильные инъецируемые растворы можно приготовить путем введения активного соединения в требуемом количестве в соответствующем растворителе с одним или комбинацией нескольких ингредиентов, перечисленных выше, если требуется, за которым следует стерилизация микрофильтрацией.- 17016153 Обычно дисперсии готовят введением активного соединения в стерильный наполнитель, который содержит основную дисперсную среду и другие нужные ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов предпочтительными способами приготовления являются вакуумная сушка и сушка вымораживанием (лиофилизация),которые дают порошок активного ингредиента плюс любой нужный дополнительный ингредиент из предварительно стерильно-отфильтрованного раствора его. Схему приема лекарственного средства приспосабливают для обеспечения оптимального желаемого ответа (например, терапевтического ответа). Например, может вводиться отдельным болюсом (шариком), могут вводиться несколькими разделенными на несколько частей дозами через определенные интервалы времени или доза может быть пропорционально уменьшена или увеличена, что указывается острой необходимостью при терапевтической ситуации. Например, человеческие антитела, описанные в изобретении, при подкожной инъекции могут вводиться один раз или два раза в неделю или один раз или два раза в месяц. Особенно предпочтительно создать парентеральные композиции в виде стандартных лекарственных форм для легкости введения и равномерности дозирования. Стандартная лекарственная форма, как применяется в данном изобретении, относится к физически дискретным единицам, пригодным в качестве унитарных лекарственных форм для субъектов, которых лечат; каждая разовая доза содержит заранее определенное рассчитанное количество активного соединения для получения желаемого терапевтического эффекта вместе с нужным фармацевтическим носителем. Описание стандартных лекарственных форм, раскрытых в изобретении, диктуется и непосредственно зависит от а) уникальных свойств активного соединения и конкретного достигаемого терапевтического эффекта, и (б) ограничений, присущих приготовлению такого активного соединения при лечении чувствительности у индивидов. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и другие; (2) растворимые в масле антиоксиданты, такие как аскорбилпальмитат,бутилированный гидроксианизол (butylated hydroxyanisole, BHA), бутилированный гидрокситолуол (butylated hydroxytoluene, BHT), лецитин, пропилгаллат, альфа-токоферол и другие; и (3) металлохелатообразователи, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ethylenediamine tetraaceticacid, EDTA), сорбит, винная кислота, фосфорная кислота и другие. Составы для терапевтических композиций, описанные в данном изобретении, включают составы,пригодные для перорального, назального, местного (включая трансбуккальное и сублингвальное), ректального, вагинального и/или парентерального введения. Для удобства составы могут присутствовать в стандартной лекарственной форме и могут быть приготовлены любыми способами, известными в фармацевтической области. Количество активного ингредиента, которое может объединяться с веществом носителя для получения разовой лекарственной формы, будет изменяться в зависимости от субъекта,которого лечат, и конкретного способа введения. Количество активного ингредиента, которое может смешиваться с веществом носителя для получения разовой лекарственной формы, обычно будет тем количеством композиции, которое дает терапевтический эффект. Обычно, из расчета 100% это количество будет варьироваться от приблизительно 0,001 до приблизительно 90% активного ингредиента, предпочтительно от приблизительно 0,005 до приблизительно 70%, наиболее предпочтительно от приблизительно 0,01% до приблизительно 30%. Составы, описанные в данном изобретении, которые пригодны для вагинального введения, также включают вагинальные суппозитории, тампоны, крема, гели, пасты, пенные или аэрозольные составы,содержащие такие носители, о которых известно, что они пригодны для данных целей. Лекарственные формы для местного или трансдермального введения композиций, описанных в данном изобретении,включают порошки, аэрозоли, мази, пасты, крема, лосьоны, гели, растворы, пластыри и аэрозоли для ингаляции. Активное вещество можно смешать в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут быть необходимы. Фразы парентеральное введение и введенный парентерально, как применяется в данном изобретении, означает способы введения помимо энтерального и местного введения, обычно с помощью инъекции, и включает без ограничения внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, интраперитонеальную, интратрахеальную, подкожную, субэпителиальную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную (надчревную) инъекцию и инфузию. Примеры соответствующих водных и неводных носителей, которые могут применяться в фармацевтических композициях, описанных в изобретении, включают воду, этанол, полиолы (как например,гликоль, пропиленгликоль, полиэтиленгликоль и другие) и соответствующие смеси их, растительные масла, как например оливковое масло, и инъецируемые органические сложные эфиры, как например этилолеат. Соответствующее текучее состояние можно поддерживать, например, с помощью применения защитных веществ, таких как лецитин, поддерживания нужного размера частиц в случае дисперсий и применения поверхностно-активных веществ.- 18016153 Данные композиции могут также содержать вспомогательные вещества, такие как консерванты, увлажнители, эмульгаторы и диспергаторы. Недопущение присутствия микроорганизмов может обеспечиваться как с помощью способов стерилизации, о чем говорилось ранее, так и путем включения различных антибактериальных и протигрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и других. Также желательным может быть включение в композицию изотонических средств, таких как сахара, хлорид натрия и другие. Кроме того, пролонгированная абсорбция инъецируемой фармацевтической формы может достигаться включением агентов, которые задерживают абсорбцию, как например, моностеарата алюминия и желатина. Когда соединения, описанные в данном изобретении, вводятся в виде фармацевтических препаратов людям и животным, они могут приниматься как таковые, или в виде фармацевтической композиции,содержащей, например, от 0,001 до 90% (более предпочтительно от 0,005 до 70%, как например от 0,01 до 30%) активного ингредиента вместе с фармацевтически приемлемым носителем. Несмотря на выбранный путь введения, соединения, описанные в данном изобретении, которые могут применяться в соответствующей гидратированной форме и/или фармацевтические композиции, описанные в данном изобретении, создаются в фармацевтически приемлемых лекарственных формах с помощью стандартных способов, известных специалисту в данной области. Фактические уровни дозирования активных ингредиентов в фармацевтических композициях, описанных в данном изобретении, могут изменяться с тем, чтобы получить количество активного ингредиента, которое является эффективным для достижения нужного терапевтического ответа для конкретного больного, композиции и пути введения, при этом не являясь токсичным для больного. Выбранный уровень дозы будет зависеть от целого ряда фармакокинетических факторов, включая активность примененных конкретных композиций, описанных в данном изобретении, или сложного эфира, соли или амида,путь введения, время введения, скорость выделения конкретного примененного соединения, продолжительность лечения, другие лекарственные препараты, соединения и/или вещества, применяемые вместе с конкретно примененными композициями, возраст, пол, вес, состояние, общее состояние здоровья и предшествующую историю болезни больного, которого лечат, и другие факторы, хорошо известные в данной области медицины. Врач или ветеринар с опытом работы может легко определить и прописать эффективное количество нужной фармацевтической композиции. Например, врач или ветеринар может начать с доз соединений, описанных в изобретении, применяемых в фармацевтической композиции, отвечающих более низким уровням, чем те, которые требуются, чтобы достигнуть желаемого терапевтического эффекта, и постепенно увеличить дозировку до достижения желаемого эффекта. Обычно соответствующая дневная доза композиции, описанной в данном изобретении, может быть тем количеством соединения, которое является самой низкой дозой, эффективной для обеспечения терапевтического эффекта. Такая эффективная доза обычно будет зависеть от описанных выше факторов. Предпочтительно, чтобы введение было бы внутривенным, внутримышечным, интраперитонеальным или подкожным, предпочтительно введенным близко к месту лечения. Если требуется, эффективная дневная доза терапевтической композиции может вводиться в виде двух, трех, четырех, пяти, шести или более мелких доз, введенных раздельно в соответствующие интервалы на протяжении дня, возможно в виде стандартных лекарственных форм. Хотя для соединения, описанного в данном изобретении, возможно введение его как такового, но предпочтительно вводить соединение в виде фармацевтического состава (композиции). Терапевтические композиции могут вводиться с помощью медицинского устройства, известного в данной области. Например, в предпочтительном варианте терапевтическая композиция, описанная в изобретении, может вводиться с помощью безыгольного устройства для подкожной инъекции, как например устройств, описанных в патентах США 5399163, 5383851, 5312335, 5064413, 4941880, 4790824 или 4596556. Примеры хорошо известных имплантов и модулей, пригодных в данном изобретении, включают патент США 4487603, который раскрывает имплантированный микроинфузионный насос для дозирования препарата при контролируемой скорости; патент США 4486194, который раскрывает терапевтическое устройство для введения медикаментов через кожу; патент США 4447233, который раскрывает инфузионный насос для медикаментозного лечения для доставки препарата с определенной скоростью инфузии; патент США 4447224, который раскрывает имплантированный инфузионный аппарат с изменяемым потоком для непрерывной доставки лекарственного препарата; патент США 4439196, который раскрывает осмотическую систему доставки лекарственного препарата с многокамерными отделениями; и патент США 4475196, который раскрывает осмотическую систему доставки лекарственного препарата. Специалистам в данной области известны многие другие импланты, системы доставок и модули. В некоторых вариантах гликопротеины, предназначенные для лечебных целей, описанные в данном изобретении, могут создаваться для обеспечения надлежащего распеределения in vivo. Например, гематоэнцефалический барьер (blood-brain barrier, BBB) исключает многие соединения с высокой гидрофильностью. Для обеспечения того, чтобы терапевтические соединения, описанные в изобретении, пересекали BBB (если необходимо), они могут входить в состав, например, липосом. Способы получения липосом, см., например, в патентах США 4522811; 5374548, 5399331. Липосомы могут содержать один или несколько остатков, которые селективно транспортируются в конкретные клетки или органы, таким об- 19016153 разом увеличивают направленную доставку препарата (см., например, V.V.Ranade, J. Clin. Pharmacol.,29:685 (1989). Типичные остатки для направленной доставки препарата включают фолат или биотин (см.,например, патент США 5416016 от Low et al.); маннозиды (Umezawa et al., Biochem. Biophys. Res.Commun. 153:1038 (1988); антитела (P.G. Bloeman et al. FEBS Lett. 357:140 (1995); M.Owais et al. Antimicrob. Agents Chemother. 39:180 (1995; рецептор поверхностного протеина A (Briscoe et al. Am. J.Physiol. 1233:134 (1995, различные разновидности которого могут содержать составы, описанные в изобретении, а также компоненты изобретенных молекул; p120 (Schreier et al. J. Biol. Chem. 269:9090(1994; см. также К. Keinanen; M.L. Laukkanen FEBS Lett. 346:123 (1994); J.J. Killion; I.J. Fidler Immunomethods 4:273 (1994). В одном варианте изобретения терапевтические соединения, описанные в данном изобретении, входят в состав липосом; в более предпочтительном варианте липосомы содержат остаток,обеспечивающий направленную доставку препарата. В наиболее предпочтительном варианте терапевтические соединения в липосомах доставляются с помощью болюсного вливания (инъекции ударной дозы вещества) в место близкое к опухоли или инфекции. Композиция должна быть жидкой до такой степени,чтобы ее можно было бы легко ввести с помощью шприца. Она должна быть стабильна в условиях производства и хранения и должна предохраняться от загрязняющего действия микроорганизмов, таких как бактерии и грибы. В другом варианте рекомбинантный гликопротеин, описанный в данном изобретении, может входить в состав, чтобы предотвратить или уменьшить транспорт через плаценту. Это можно осуществить с помощью способов, известных в данной области, например, с помощью ПЭГилирования антитела или с помощью применения F(ab)2' фрагментов. Другие ссылки можно привести из "Cunningham-Rundles C.,Zhuo Z., Griffith B., Keenan J. (1992) Bilogical activities of polyethylene-glycol immunoglobulin conjugates".Resistance to enzymatic degradation (Биологические активности полиэтиленгликолевых конъюгатов иммуноглобулина." Устойчивость к ферментативному расщеплению). J.Immunol Methods. 152:177-190; и Landor M. (1995) Maternal-fetal transfer of immunoglobulins - Трансплацентарный перенос иммуноглобулинов,Ann.Allergy Asthma Immunol 74:279-283. Это особенно уместно, когда гликопротеин является антителом,применяемым для лечения или профилактики рецидивного самопроизвольного аборта. Терапевтически эффективное дозирование при ревматоидном артрите предпочтительно приведет к ACR20 предварительного определения улучшения состояния у пациентов (Preliminary Definition of Improvement), более предпочтительно к ACR50 предварительного определения улучшения состояния и даже более предпочтительно к ACR70 предварительного определения улучшения состояния.ACR20 предварительного определения улучшения состояния определяется как 20% улучшение в болезненном общем показателе (Tender Joint Count, TCJ) и непомерно высоком общем показателе (Swollen Joint Count, SWJ) и 20% улучшение в трех из следующих 5 оценок: оценка боли пациентом (PatientPain Assessment (VAS, общая оценка состояния пациентом (Patient Global Assessment (VAS, общая оценка состояния врачом (Physician Global Assessment (VAS, самооценка нетрудоспособности пациентом (Patient Self-Assessed Disability (HAQ, острофазовый реагент (Acute Phase Reactant (CRP или ESR.ACR20 и ACR70 определяются таким же образом с 50% и 70% улучшениями, соответственно. Более подробно см. Felson et al. in American College of Rheumatology Preliminary Definition of Improvementin Rheumatoid Arthritis (Предварительное определение улучшения при ревматоидном артрите в американском университете ревматологии); Arthritis Rheumatism 38:727-735 (1995). Способность соединения ингибировать рак можно оценить на системе модельных животных, прогнозирующей эффективность на опухолях человека. Или же, это свойство композиции можно оценить путем исследования способности соединения к ингибированию, такое ингибирование in vitro с помощью анализов, известных практикующему специалисту. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли или другими словами уменьшить интенсивность симптомов у субъекта. Специалист в данной области будет способен определить такие количества на основе таких факторов, как вес субъекта, тяжесть симптомов и выбранная конкретная композиция или путь введения. Способность антител лечить или предупреждать псориаз также можно оценить в соответствии со способами, хорошо известными в данной области. Композиция должна быть стерильной и жидкой до такой степени, чтобы композицию можно было бы доставить с помощью шприца. Кроме воды носителем может быть изотонический буферный физиологический раствор, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и другие) и соответствующие их смеси. Надлежащую текучесть можно поддерживать, например,применением защитного покрытия, такого как лецитин, сохранением нужного размера частиц в случае дисперсии и применением поверхностно-активных частиц. Во многих случаях в композицию предпочтительно включить изотонические агенты, например сахара, полиспирты, такие как маннит или сорбит, и хлорид натрия. Продолжительная абсорбция инъецируемой композиции может осуществляться путем включения в композицию агента, который задерживает абсорбцию, например, моностеарата алюминия или желатина. Если активное вещество соответствующим образом защищено, как описано выше, соединение мо- 20016153 жет вводиться перорально, например, с инертным разбавителем или усвояемым, пригодным в пищу носителем. Другие варианты данного изобретения описываются в следующих примерах, которые нельзя рассматривать, в качестве ограничивающих. Содержание перечня последовательностей, рисунки и все ссылки, патенты и опубликованные патентные заявки, процитированные на протяжении данной заявки,специально приведены в данном изобретении в качестве ссылки. Примеры Во всех примерах, рассмотренных ниже, полностью человеческое моноклональное антитело, которое связывает IL-15, с вариабельной областью легкой цепи, включающей аминокислотную последовательность, приведенную в SEQ ID NO:4, и вариабельной областью тяжелой цепи, включающей аминокислотную последовательность, приведенную в SEQ ID NO:2, применяли в качестве типичного рекомбинантного гликопротеина (в примерах называется "типичным рекомбинантным гликопротеином"). Однако для каждого специалиста в данной области должно быть ясно, что содержание маннозы в любом рекомбинантном гликопротеине может регулироваться, как обсуждалось в данном изобретении. Пример 1. Влияния осмолярности на содержание маннозы в рекомбинантных гликопротеинах. Для того чтобы исследовать влияние осмолярности на содержание маннозы в гликопротеинах, содержание маннозы в типичном рекомбинантном гликопротеине анализировали при различных осмолярностях в культурах во встряхиваемой колбе и биореакторе. Как продемонстрировано на фиг. 1 высокое содержание маннозы увеличивалось от приблизительно 14 до приблизительно 24% при увеличении осмолярности среды от приблизительно 500 до приблизительно 580 мосмоль/кг. В другом эксперименте к клеточной культуре для обеспечения дополнительного доказательства относительно зависимости между осмолярностью и высоким содержанием маннозы прибавляли 20 мМ осмопротектора - бетаина. Следующая таблица суммирует результаты одного такого эксперимента. Таблица 1 Еще другое доказательство корреляции между высоким содержанием маннозы и осмолярностью изображено на фиг. 2. Прибавление приблизительно 20 мМ бетаина к клеточной культуральная среде разительно уменьшало высокое содержание маннозы в типичном рекомбинантном гликопротеине. Например, если осмолярность составляла приблизительно 300 мосмоль/кг, высокое содержание маннозы уменьшалось от приблизительно 9,5% при 0 мМ бетаина до приблизительно 4,5% при прибавлении 20 мМ бетаина (т.е. приблизительно 5%-ное уменьшение в высоком содержании маннозы). Аналогично,если осмолярность составляла приблизительно 400 мосмоль/кг, высокое содержание маннозы уменьшалось от приблизительно 16,5% при 0 мМ бетаина до приблизительно 7,5% при прибавлении 20 мМ бетаина (т.е. приблизительно 9%-ное уменьшение в высоком содержании маннозы). Кроме того, при осмолярности приблизительно 500 мосмоль/кг высокое содержание маннозы уменьшалось от приблизительно 25% при 0 мМ бетаина до приблизительно 9,5% при прибавлении 20 мМ бетаина (т.е. приблизительно 15,5%-ное уменьшение в высоком содержании маннозы). Пример 2. Для регулирования содержания маннозы в рекомбинантных гликопротеинах можно контролировать концентрацию ионов K+ в культуре. В другом эксперименте концентрацию одной или нескольких солей в клеточной культуральной среде контролировали для регулирования (например, уменьшения) содержания маннозы (например, при высоком содержании маннозы) в типичном рекомбинантном гликопротеине. В типичном эксперименте концентрацию ионов K+ в клеточной культуральной среде контролировали и демонстрировали влияние содержания маннозы и, особенно, при высоком содержании маннозы в типичном рекомбинантном гликопротеине. В особенности, исследовалось высокое содержание маннозы (т.е. вид M5 или более высокий) в типичном рекомбинантном гликопротеине, продуцируемом путем культивирования клеткихозяина, экспрессирующей гликопротеин при 15 или 45 мМ. Как показано на фиг. 3 и 4, процент с высоким содержанием маннозы увеличивался от приблизительно 3 до приблизительно 13% с сопутствующим увеличением осмолярности. Осмолярность от приблизительно 370 до приблизительно 500 мосмоль/кг приводила к увеличению высокого содержания маннозы, что превышало 10% от гликопротеиновой композиции. В другом эксперименте демонстрировалось, как показано на фиг. 5, что оптимальный интервал- 21016153 концентрации для ионов K+ в клеточной культуральной среде составляет от приблизительно 0 до приблизительно 70 мМ, чтобы поддержать процентное содержание рекомбинантного гликопротеина с высоким содержания маннозы в ниже 10%. Пример 3. Для регулирования содержания маннозы в рекомбинантных гликопротеинах можно контролировать концентрацию ионов Na+ в клеточной культуральной среде. В другом эксперименте концентрацию ионов Na+ контролировали для регулирования (например,уменьшения) высокого содержании маннозы в типичном рекомбинантном гликопротеине. В типичном эксперименте показано, что увеличение концентрации ионов Na+ в клеточной культуральной среде приводит к увеличению процентного содержания типичного рекомбинантного гликопротеина с высоким содержанием маннозы. Фиг. 6 демонстрирует, что оптимальный интервал концентрации для Na+ составляет от приблизительно 0 до приблизительно 200 мМ, чтобы поддержать процент с высоком содержанием маннозы ниже 10%. Пример 4. Аминокислоты приводят к рекомбинантных гликопротеинам с высоким содержанию маннозы. В другом эксперименте исследовалось влияние аминокислот, присутствующих в клеточной культуральной среде, на высокое содержание маннозы в типичном рекомбинантном гликопротеине. Как показано на фиг. 7, процентное содержание рекомбинантного гликопротеина с высоким содержанием маннозы увеличивается от приблизительно 4 до приблизительно 10% при удваивании концентрации 20 аминокислот в питательной среде. Эксперимент демонстрировал, что среда, обогащенная аминокислотами,приводит к увеличению содержания гликопротеинов с высоким содержанием маннозы, экспрессируемых клеткой-хозяина, культивированной в такой среде. Пример 5. Полный состав композиции питательной среды может приводить к рекомбинантным гликопротеинам с высоким содержанием маннозы. В данном эксперименте исследовалось влияние различных видов питательных сред на высокое содержание маннозы в типичном рекомбинантном гликопротеине. В особенности, исследовалось влияние модифицированной питательной среды, практически не содержащей аминокислот - L-аланина, Lаргинина HCl, L-аспарагиновой кислоты и L-глутаминовой кислоты, и также при более низких концентрациях CaCl, MgCl, KCl и пирувата натрия по сравнению с немодифицированной средой на высокое содержание маннозы в типичном рекомбинантном гликопротеине. Как изображено на фиг. 8, высокое содержание маннозы составляло приблизительно 4% при применении модифицированной питательной среды, и данное процентное содержание увеличивалось до приблизительно 13% при применении немодифицированной питательной среды. Пример 6. Влияние температуры на высокое содержание маннозы. Влияние 4 различных температур на высокое содержание маннозы исследовалось с применением двух разных питательных сред. Следующие данные в табл. 2 указывают, что при повышении температуры увеличивался процент с высоким содержанием маннозы. Таблица 2 Описание наиболее полно понятно в свете изучения источников, процитированных в описании, которые приводятся в данном изобретении в качестве ссылок. Варианты, приведенные в описании, иллюстрируют варианты данного изобретения и не должны толковаться, как ограничивающие его объем. Специалисту понятно, что многие другие варианты охватываются данным изобретением. Все процитированные публикации и патенты и идентифицированные путем доступа к ряду ссылок или баз данных последовательности полностью приводятся в данном изобретении в качестве ссылок. Если материал, приведенный в качестве ссылок, противоречит описанию данного изобретения или является несовместимым с ним, данное описание заменит любой такой материал. Цитирование любых ссылок в данном изобретении не является признанием того, что такие ссылки представляют собой предшествующий уровень для данного изобретения. Если не указано особо, все численные значения, выражающие количества ингредиентов, клеточной культуры, условий лечения и т.д., используемые в описании, включая формулу изобретения, во всех случаях следует понимать как видоизмененные термином приблизительно. Таким образом, если не оговорено противное, численные параметры являются приближенными значениями и могут изменяться в зависимости от желаемых свойств, которые стремятся получить с помощью данного изобретения. Если не указано особо, термин по меньшей мере, предшествующий серии элементов следует понимать, как относящийся к каждому элементу в серии. Специалистам в данной области должно быть понятно, или они,- 22016153 применяя какое-нибудь рутинное экспериментирование, способны установить много равноценных эквивалентов для отдельных вариантов, описанных в данном изобретении. Полагают, что такие равноценные эквиваленты охватываются следующей формулой изобретения. Перечень последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения рекомбинантного антитела или его антигенсвязывающего фрагмента с низким содержанием маннозы, включающий стадии:(а) культивирования клетки-хозяина, которая экспрессирует рекомбинантное антитело или его антигенсвязывающий фрагмент, в культуральной среде с осмолярностью приблизительно 600 мосмоль/кг или менее; и(б) очистки рекомбинантного антитела или его антигенсвязывающего фрагмента от указанной культуральной среды. 2. Способ получения рекомбинантного человеческого моноклонального антитела или его антигенсвязывающего фрагмента, который связывает IL-15, включающий стадии:(а) культивирования клетки-хозяина, которая экспрессирует антитело или его антигенсвязывающий фрагмент, в культуральной среде с осмолярностью приблизительно 600 мосмоль/кг или менее; и(б) очистки человеческого моноклонального антитела или его антигенсвязывающего фрагмента от указанной культуральной среды,где антитело или его антигенсвязывающий фрагмент включает вариабельную область легкой цепи,содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, или ее консервативные аминокислотные замены, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2, или ее консервативные аминокислотные замены. 3. Способ по любому из пп.1 или 2, при котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 600 мосмоль/кг. 4. Способ по п.3, при котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 500 мосмоль/кг. 5. Способ по п.3, в котором осмолярность культуральной среды составляет от приблизительно 250 до приблизительно 380 мосмоль/кг. 6. Способ по любому из пп.1 или 2, при котором культуральная среда содержит соль, выбранную из группы, состоящей из калиевой соли с концентрацией приблизительно 70 мМ или менее, натриевой соли- 26016153 с концентрацией приблизительно 200 мМ или менее и их комбинаций. 7. Способ по п.6, при котором культуральная среда содержит соль, выбранную из группы, состоящей из:(а) калиевой соли с концентрацией от приблизительно 10 до приблизительно 50 мМ;(б) натриевой соли с концентрацией от приблизительно 50 до приблизительно 100 мМ и(в) комбинаций (а) и (б). 8. Способ по любому из пп.1 или 2, при котором культуральная среда практически не содержит одной или нескольких аминокислот, выбранных из группы, состоящей из аланина, аргинина, аспарагиновой кислоты и глутаминовой кислоты. 9. Способ по любому из пп.1 или 2, при котором культуральная среда содержит один или несколько витаминов, выбранных из группы, состоящей из биотина, D-пантотената кальция, холинхлорида, фолиевой кислоты, i-инозита, ниацинамида, пиридоксаля HCl, пиридоксина HCl, рибофлавина, тиамина HCl и цианокобаламина при концентрации от приблизительно 0,00005 до приблизительно 0,9 г/л. 10. Способ по любому из пп.1 или 2, при котором культуральная среда содержит глюкозу при концентрации от приблизительно 1 до приблизительно 90 мМ. 11. Способ по любому из пп.1 или 2, при котором культуральная среда содержит один или несколько пептонов, выбранных из группы, состоящей из дрожжевого экстракта, дрожжевого гидролизата, соевого пептона, соевого гидролизата, пшеничного пептона и пшеничного гидролизата при концентрации от приблизительно 0,5 до приблизительно 60 г/л. 12. Способ по любому из пп.1 или 2, при котором культуральная среда содержит по меньшей мере один осмопротектор в количестве, необходимом для поддержания осмолярности на уровне приблизительно 600 мосмоль/кг или менее. 13. Способ по п.12, при котором осмопротектор выбран из группы, состоящей из бетаина, глицина,L-треонина, L-пролина и их производных. 14. Способ по п.12, при котором осмопротектор представляет собой бетаин при концентрации от приблизительно 1 до приблизительно 100 мМ. 15. Способ по п.14, в котором бетаин содержится в концентрации от приблизительно 20 до приблизительно 30 мМ. 16. Способ по любому из пп.1 или 2, при котором клетку-хозяина культивируют в течение периода времени от приблизительно 5 дней до приблизительно 14 дней. 17. Способ по любому из пп.1 или 2, при котором клетку-хозяина культивируют при температуре от приблизительно 31 до приблизительно 38C. 18. Способ по любому из пп.1 или 2, при котором клетка-хозяин является клеткой млекопитающего. 19. Способ по п.18, при котором клетка-хозяин млекопитающего является CHO клеткой (клеткой яичника китайского хомячка). 20. Композиция человеческого моноклонального антитела, связывающегося с IL-15, имеющего низкое содержание маннозы и получаемого по способу по любому из пп.1-19. 21. Фармацевтическая композиция, содержащая композицию по п.20 и фармацевтически приемлемый носитель. 22. Применение композиции изолированного антитела, полученного способом по п.2, для производства медикамента для лечения или профилактики расстройства, связанного со сверхсинтезом человеческого IL-15, и/или в котором является полезной дезактивация или ингибирование индуцированных человеческим IL-15 влияний, при этом указанное антитело предназначено для введения субъекту. 23. Применение по п.22, в котором расстройство выбрано из группы, состоящей из васкулита, псориаза, рассеянного склероза, ревматоидного артрита, воспалительного заболевания кишечника, отторжения аллогенного трансплантата, реакции "трансплантата против хозяина", T-клеточной лимфомы, Tклеточной лейкемии, поражений кожи ревматического или подагрического происхождения, нарушений соединительной ткани, офтальмологических нарушений, нейрологических расстройств, желудочнокишечных и печеночных расстройств, аллергических расстройств, гематологических нарушений, заболеваний кожи, легочных расстройств, злокачественных новообразований, нарушений, связанных с трансплантацией, эндокринологических расстройств, сосудистых нарушений, гинекологических расстройств и инфекционных болезней, причем возможно упомянутое воспалительное заболевание кишечника является болезнью Крона или глютеновой болезнью. 24. Композиция антитела по п.20, в которой не более чем приблизительно 10% антител имеют более четырех маннозных остатков каждое. 25. Композиция по п.24, в которой не более чем приблизительно 5% антител имеют более четырех маннозных остатков каждое. 26. Композиция по п.24, в которой приблизительно 4% антител имеют более четырех маннозных остатков каждое.
МПК / Метки
МПК: A61K 39/395, C07K 16/24, C12P 21/00
Метки: способы, регулирования, рекомбинантных, содержания, белках, маннозы
Код ссылки
<a href="https://eas.patents.su/30-16153-sposoby-regulirovaniya-soderzhaniya-mannozy-v-rekombinantnyh-belkah.html" rel="bookmark" title="База патентов Евразийского Союза">Способы регулирования содержания маннозы в рекомбинантных белках</a>