Бензиламины, способ их получения и их применение в качестве противовоспалительных средств
Номер патента: 15258
Опубликовано: 30.06.2011
Авторы: Ревинкель Хартмут, Шэкке Хайке, Ярох Штефан, Бергер Маркус, Дамен Ян
Формула / Реферат
1. Стереоизомеры общей формулы (I)

где R1-R3независимо друг от друга выбраны из группы, включающей атом водорода, метоксигруппу, гидроксигруппу, фтор, хлор и метил,
или R1и R2 вместе означают группу, которая выбрана из групп -O-СН2-O-, -СН2-СН2-O- и -(СН2)-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R4 выбран из группы, включающей фенильную, нафтильную, хинолин-5-ильную, фталазинильную, хиназолинильную группы, которые необязательно могут быть независимо замещены 1-3 радикалами, выбранными из группы, включающей карбонил, (С1-С3)алкил, хлор и фтор;
R5 означает CF3;
R6 выбран из группы, включающей бензил, хлорметил, бромметил, этилсульфанилметил, (имидазол-2-ил)сульфанилметил, (имидазол-2-ил)сульфонил метил, 1,2,4-триазол-3-илсульфанилметил, 1,2,4-триазол-3-илсульфонилметил, (1-метилимидазол-2-ил)сульфанилметил, (1-метилимидазол-2-ил)сульфонилметил, (1Н-имидазол-2-ил)сульфанилметил, (1Н-имидазол-2-ил)сульфонилметил, пиримидин-2-илсульфанилметил, пиримидин-2-илсульфонилметил, 2-пропилсульфанилметил, 2-пропилсульфонилметил, цианометил, метилсульфанилметил, метилсульфонилметил, диметиламинометил, этоксиметил, гидроксиметил, метоксиметил.
2. Стереоизомеры по п.1, где по меньшей мере один из R1-R3 выбран из группы, включающей метил, метоксигруппу, фтор, хлор, гидроксигруппу, -O-СН2-O-, -O-СН2-СН2-.
3. Стереоизомеры по п.1, где по меньшей мере один из R1-R3 выбран из группы, включающей гидроксигруппу, метоксигруппу, фтор, хлор, или где 2 связанные группы R1-R3 образуют -O-СН2-O-, -СН2-СН2-O- или -СН2-С(СН3)2-O-группу.
4. Стереоизомеры по п.1, где циклическая система, содержащаяся в R4, замещена 1-3 одинаковыми или различными радикалами, выбранными из группы, включающей C1-С3-алкил, карбонил, фтор и хлор.
5. Стереоизомеры по п.4, где циклическая система, содержащаяся в R4, замещена метилом, хлором или фтором.
6. Стереоизомеры по п.1, где
по меньшей мере один из R1-R3выбран из метоксигруппы, гидроксигруппы, фтора, хлора, метила,
или R1и R2 вместе означают группу -O-СН2-O-, -СН2-СН2-O- или -СН2-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R4 выбран из хинолин-5-ила, фталазинила, хиназолинила, который может быть замещен независимо один раз или дважды карбонилом, метилом или фтором;
R5 означает -CF3;
R6 выбран из бензила, хлорметила, бромметила, этилсульфанилметила, (имидазол-2-ил)сульфанилметила, (имидазол-2-ил)сульфонилметила, 1,2,4-триазол-3-илсульфанилметила, (1-метилимидазол-2-ил)сульфанилметила, (1Н-имидазол-2-ил)сульфанилметила, пиримидин-2-илсульфанилметила, 2-пропилсульфанилметила, цианометила, метилсульфанилметила, диметиламинометила, этоксиметила, гидроксиметила, метоксиметила.
7. Соединения по любому из пп.1-6 в энантиомерно чистой форме.
8. Применение стереоизомеров по любому из пп.1-7 для изготовления фармацевтических агентов.
9. Применение стереоизомеров по любому из пп.1-7 для изготовления фармацевтических агентов для лечения воспалительных заболеваний.
10. Способ получения соединений общей формулы (I), отличающийся тем, что амины общей формулы (V) реагируют в условиях ароматического аминирования с арилгалогенидами формулы R4-Hal

где R1-R6 имеют значения, которые указаны в п.1, и Hal означает хлор, бром или йод.
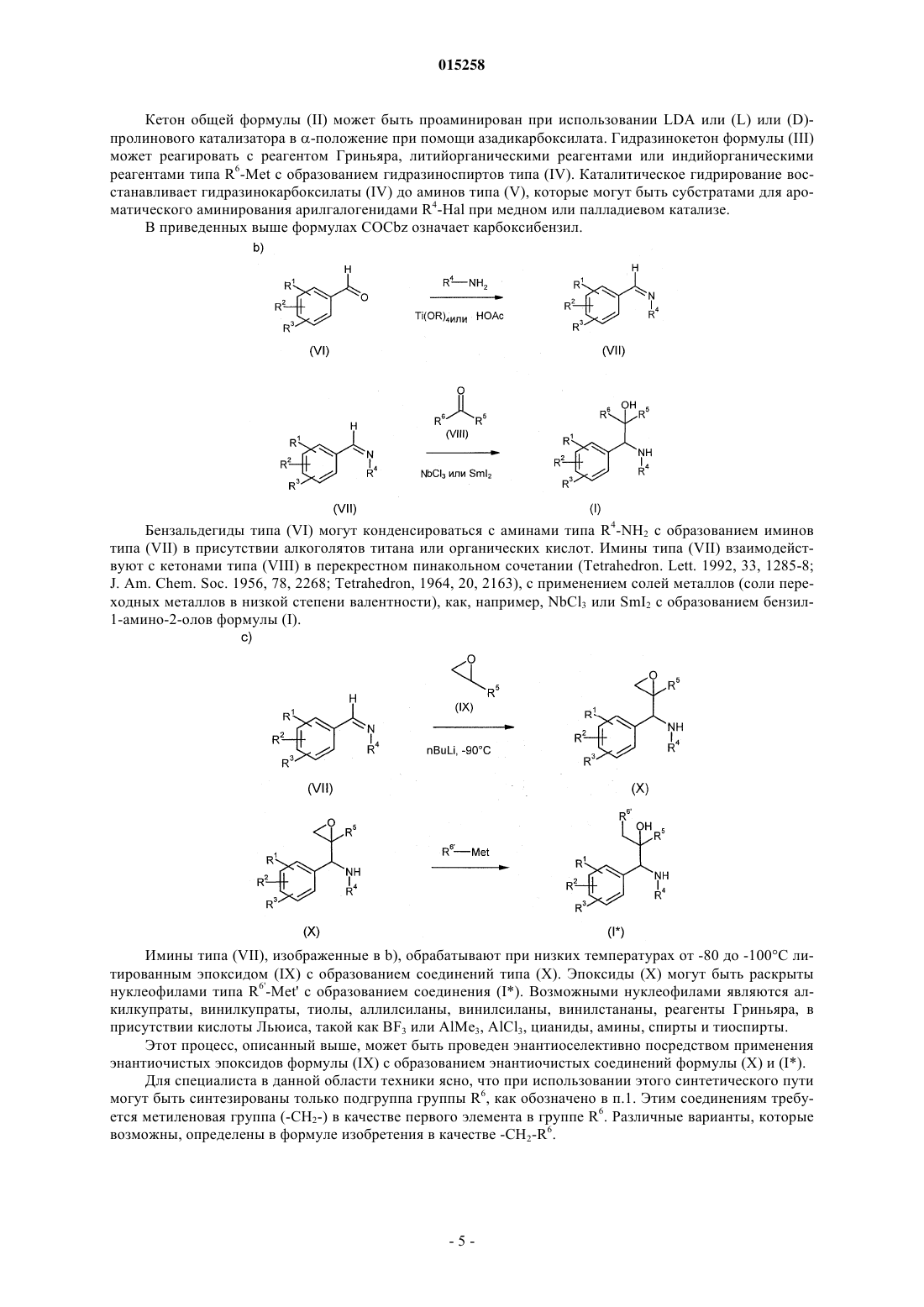
11. Способ получения соединений общей формулы (I), отличающийся тем, что имины общей формулы (VII) взаимодействуют с кетонами формулы (VIII) в присутствии в качестве катализаторов солей переходных металлов в низкой степени валентности
где R1-R6 имеют значения, которые указаны в п.1.
12. Способ получения интермедиатов общей формулы (VII), определенных в п.7, отличающийся тем, что бензальдегиды общей формулы (VI) взаимодействуют с аминами формулы R4-NH2с образованием иминов общей формулы (VII)

где R1-R6 имеют значения, которые указаны в п.1.
13. Способ получения соединений общей формулы (I*), отличающийся тем, что эпоксиды общей формулы (X) взаимодействуют с соединениями общей формулы R6'-Met'

где R1-R5 имеют значения, которые указаны в п.1;
группа R6' означает группу, выбранную из водорода, бензила, хлорметила, бромметила, этилсульфанилметила, (имидазол-2-ил)сульфанилметила, (имидазол-2-ил)сульфонилметила, 1,2,4-триазол-3-илсульфанилметила, (1-метилимидазол-2-ил)сульфанилметила, (1Н-имидазол-2-ил)сульфанилметила, пиримидин-2-илсульфанилметила, 2-пропилсульфанилметила, цианометила, метилсульфанилметила, диметиламинометила, этоксиметила, гидроксиметила, метоксиметила;
Met' означает алкилкупрат, винилкупрат, тиол, аллилсилан, винилсилан, винилстанан или реагент Гриньяра.
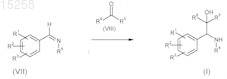
14. Способ получения интермедиатов общей формулы (X), определенных в п.13, отличающийся тем, что имины общей формулы (VII) взаимодействуют с эпоксидами формулы (IX) в присутствии литийорганических (R10-Li) соединений при температуре ниже -80°С с образованием эпоксидов формулы (X)
где R1-R6 имеют значения, которые указаны в п.1;
R10 означает С1-С4-алкильную группу.
15. Способ получения соединений общей формулы (I), отличающийся тем, что эфир a-кетофосфорной кислоты формулы (XII) расщепляют на a-гидроксикетон и конденсируют с образованием имина в присутствии титанатов и уксусной кислоты, с последующим восстановлением борогидридом натрия или водородом в каталитических условиях с получением соединения формулы (I)

где R1-R5 имеют значения, которые указаны в п.1.
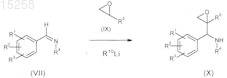
16. Способ получения интермедиатов общей формулы (XII), определенных в п.15, отличающийся тем, что a-кетофосфонат (XI) конденсируют с кетоном формулы (VIII) на цианидном катализаторе с получением эфира a-кетофосфорной кислоты (XII)
где R1-R6 имеют значения, которые указаны в п.1.
17. Соединения общей формулы (V)
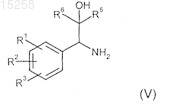
где R1-R3 независимо друг от друга выбраны из группы, включающей атом водорода, метоксигруппу, гидроксигруппу, фтор, хлор и метил,
или R1и R2 вместе означают группу, которая выбрана из групп -O-СН2-O-, -СН2-СН2-O- и -(СН2)-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R5 означает CF3;
R6 выбран из группы, включающей бензил, хлорметил, бромметил, этилсульфанилметил, (имидазол-2-ил)сульфанилметил, (имидазол-2-ил)сульфонилметил, 1,2,4-триазол-3-илсульфанилметил, 1,2,4-триазол-3-илсульфонилметил, (1-метилимидазол-2-ил)сульфанилметил, (1-метилимидазол-2-ил)сульфонилметил, (1Н-имидазол-2-ил)сульфанилметил, (1Н-имидазол-2-ил)сульфонилметил, пиримидин-2-илсульфанилметил, пиримидин-2-илсульфонилметил, 2-пропилсульфанилметил, 2-пропилсульфонилметил, цианометил, метилсульфанилметил, метилсульфонилметил, диметиламинометил, этоксиметил, гидроксиметил, метоксиметил.
18. Соединения общей формулы (V) по п.17
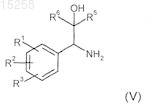
где по меньшей мере один из R1-R3выбран из метоксигруппы, гидроксигруппы, фтора, хлора, метила,
или R1и R2 вместе означают группу -О-СН2-О-, -CH2-CH2-O- или -СН2-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R5 означает -CF3;
R6 выбран из бензила, пропила, хлорметила, бромметила, этилсульфанилметила, (имидазол-2-ил)сульфанилметила, (имидазол-2-ил)сульфонилметила, 1,2,4-триазол-3-илсульфанилметила, (1-метилимидазол-2-ил)сульфанилметила, (1Н-имидазол-2-ил)сульфанилметила, пиримидин-2-илсульфанилметила, 2-пропилсульфанилметила, цианометила, метилсульфанилметила, диметиламинометила, этоксиметил-, гидроксиметила, этоксиметила.
19. Соединения общей формулы (X)
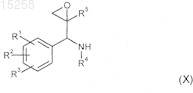
где R1-R3 независимо друг от друга выбраны из группы, включающей атом водорода, метоксигруппу, гидроксигруппу, фтор, хлор и метил,
или R1и R2 вместе означают группу, которая выбрана из групп -O-СН2-O-, -CH2-CH2-O- и -(СН2)-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R4 выбран из группы, включающей фенильную, нафтильную, хинолин-5-ильную, фталазинильную, хиназолинильную группы, которые необязательно могут быть независимо замещены 1-3 радикалами, выбранными из группы, включающей карбонил, (С1-С3)алкил, хлор и фтор;
R5 означает CF3.
20. Соединения общей формулы (X) по п.19
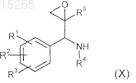
где по меньшей мере один из R1-R3выбран из метоксигруппы, гидроксигруппы, фтора, хлора, метила,
или R1и R2 вместе означают группу -O-СН2-O-, -СН2-СН2-О- или -СН2-С(СН3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);
R4 выбран из хинолин-5-ила, фталазинила, хиназолинила, который может быть замещен независимо один раз или дважды карбонилом, метилом или фтором;
R5 означает -CF3.
21. Применение соединений общей формулы (V) или (X) по любому из пп.17-20 для получения соединений общей формулы (I).
Текст
БЕНЗИЛАМИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ Настоящее изобретение относится к соединениям формулы (I) способу их получения и их применению в качестве противовоспалительных средств.(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE); АСТРАЗЕНЕКА АБ (SE) 015258 Настоящее изобретение относится к соединениям формулы (I), способу их получения и их применению в качестве противовоспалительных средств. Эта формула заявки на патент имеет приоритет согласно с Парижской конвенцией европейской патентной заявкиЕР 06014665.1, поданной 14 июля 2006 г., так же как и предварительной заявки US 60/830671, поданной 14 июля 2006 г. Из предыдущего уровня техники, DE 10038639 и WO 02/10143, известны противовоспалительные средства следующей общей формулы: в которой радикал Ar включает фталиды, тиофталиды, бензоксазиноны или фталазиноны. На практике,эти соединения показывают диссоциацию действия между противовоспалительным и нежелательным метаболическим действием и являются лучшими по сравнению с ранее описанными нестероидными глюкокортикоидами или оказывают, по меньшей мере, такое же действие. Соединения, схожие по структуре с описанными в этой патентной заявке, раскрыты вWO 2005/035518. Вследствие промышленных способов эти соединения всегда содержат группу где связь между а и b или между b и с может быть ненасыщенной (другими словами они содержат-СН 2-СН(СН 3)2, -СН=С(СН 3)2 или -СН 2-С(СН 3)=СН 2 группу). Соединения такой композиции исключаются конкретным указанием в настоящей заявке. Дальнейшие ссылки, которые могли бы быть релевантными для настоящей заявки, процитированы ниже.US 2005/131226 A1 (Rehwinkel et al.). Несмотря на все усилия, селективность соединений предыдущего уровня техники по отношению к глюкокортикоидному рецептору (GR) по сравнению с другими стероидными рецепторами все еще требует усовершенствования. Исходя из этого, задача настоящего изобретения - создать доступные соединения, селективность которых по отношению к глюкокортикоидному рецептору (GR) является улучшенной по сравнению с другими стероидными рецепторами. Эта задача была решена при помощи соединений согласно формуле изобретения. Это изобретение поэтому относится к стереоизомерам общей формулы (I) где R1 и R2 независимо друг от друга означают атом водорода, гидроксигруппу, атом галогена, необязательно замещенную (С 1-С 10)алкильную группу, необязательно замещенную (С 1-С 10)алкоксигруппу, (С 1 С 10)алкилтиогруппу, (С 1-С 5)перфторалкильную группу, цианогруппу, нитрогруппу,или R1 и R2 вместе означают группу, которая выбрана из групп -O-(СН 2)р-O-, -O-(СН 2)р-СН 2-,-O-СН=СН-, -(СН 2)р+2-, -NH-(CH2)р+1, -N(С 1-С 3-алкил)-(CH2)p+1 и -NH-N=CH-, где р=1 или 2, и терминальные атомы кислорода, и/или атомы углерода, и/или атомы азота связаны с непосредственно примыкающими циклическими атомами углерода, или NR7R8, где R7 и R8 независимо друг от друга означают водород, С 1-С 5-алкил или (СО)-(С 1-С 5)алкил;R3 означает атом водорода, гидроксигруппу, атом галогена, цианогруппу или необязательно замещенную (С 1-С 10)алкильную группу, (С 1-С 10)алкоксигруппу, (С 1-С 10)алкилтиогруппу или (С 1 С 5)перфторалкильную группу;R4 означает моноциклическую или бициклическую, ароматическую, частично ароматическую или неароматическую циклическую систему, которая необязательно содержит 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы и необязательно замещенную в одном или нескольких местах радикалом,выбранным из группы карбонил, галоген, гидрокси или (С 1-С 5)алкил, который необязательно может быть замещен 1-3 гидроксигруппами, 1-3 (С 1-С 5)алкоксигруппами, 1-3 COOR6 группами, 1-3 СООН группами,1-3 (С 1-С 5)алкоксигруппами, 1-3 (С 1-С 5)алкилтиогруппами, 1-3 (С 1-С 5)перфторалкилами, 1-3 цианогруппами и/или 1-3 нитрогруппами, или два заместителя вместе формируют группу, которая выбрана из групп -O-(СН 2)р-O-, -O-(СН 2)р-СН 2-, -O-СН=СН-, -(СН 2)р+2-, -NH-(CH2)p+1-, -N(C1-С 3-алкил)-(СН 2)р+1- и-NH-N=CH-, где р=1 или 2, и терминальные атомы кислорода и/или атомы углерода и/или атомы азота связаны с непосредственно примыкающими циклическими атомами углерода; NR7R8, где R7 и R8 незави-1 015258 симо друг от друга могут означать водород, С 1-С 5-алкил или (СО)-С 1-С 5-алкил; (CO)NR11R12, где R11 иR12 независимо друг от друга означают водород, или С 1-С 5-алкильную группу, или (С 1-С 5-алкилен)-O(СО)-(С 1-С 5)алкильную группу;R5 означает частично или полностью фторированную С 1-С 3-алкильную группу;R6 означает группу, выбранную из -(С 1-С 10)алкила, который может быть необязательно частично или полностью галогенирован, -(С 2-С 10)алкенила, -(С 2-С 10)алкинила, -(С 1-С 8)алкил-(С 3-С 7)циклоалкила,-(С 2-С 8)алкенил-(С 3-С 7)циклоалкила, -(С 1-С 8)алкилгетероциклила, -(С 2-С 8)алкенилгетероциклила, -R9,-(С 1-С 8)алкил-R9, -(С 2-С 8)алкенил-R9, -(C2-C8)алкинил-R9, -СН 2-S-(С 1-С 10)алкила, -СН 2-S-R9, -CH2-SO2-R9,-(CH2)n-R9, -СН 2-SO2-(С 1-С 10)алкила, -(CH2)n-CN, -(CH2)n-Hal, где Hal означает F, Cl или I, -СН 2-O-(С 1 С 10)алкила, -(CH2)n-NR7R8, где R7, R8 имеют значения, определенные выше, -CH2-O-R9, за исключением-СН 2-СН(СН 3)2, -СН=С(СН 3)2 или -СН 2-С(СН 3)=СН 2, где R9 означает арил, который может необязательно быть замещен 1-3 алкилами, гидроксигруппой, галогеном, цианогруппой или С 1-С 5-алкоксигруппой или гетероарильной группой, где гетероарильная группа может содержать 1-3 гетероатома, которая может необязательно быть замещена 1-3 алкилами, гидроксигруппой, галогеном, цианогруппой или C1-C5 алкоксигруппой; n означает целое число, выбранное из 1, 2, 3, 4, 5. Соединения общей формулы (I), где по меньшей мере один из R1, R2 или R3 является отличным от водорода, являются предпочтительным вариантом воплощения изобретения. Кроме того, соединения общей формулы (I), где R4 является отличным от фенила или нафтила в незамещенной форме, являются другим предпочтительным вариантом воплощения изобретения. Особый объект изобретения представляет собой соединения общей формулы (I), где R1 и R2 означают атомы углерода, связанные со смежным кольцом, и вместе означают -O-(СН 2)р-O-, -O-(СН 2)р-СН 2-,-O-СН=СН-, -(СН 2)р+2-, -NH-(CH2)р+1-, -N(С 1-С 3-алкил)-(СН 2)р+1- или -NH-N=CH- (где р=1 или 2) и таким образом образуют конденсированную циклическую систему. Термин "частично ароматическая циклическая система" относится к бициклическим системам, которые содержат ароматическое кольцо и неароматическое кольцо, таким как, например, бензоксазиноны или дигидроиндолон. Соединения общей формулы (I), где R4 означает необязательно замещенную фталидильную, индолильную, изоиндолильную, дигидроиндолильную, дигидроизоиндолильную, дигидроизохинолинильную,дигидрохинолинильную, тиофталидильную, бензоксазинонильную, фталазинонильную, хинолинильную,изохинолинильную, хинолонильную, изохинолонильную, индазолильную, бензотиазолильную, хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7- или 1,8-нафтиридинильную,индолонильную, изоиндолонильную, дигидроиндолонильную, дигидроизоиндолонильную, бензимидазолильную, кумаринильную, изокумаринильную, пиразолопиримидинильную или индолильную группу,которая связана при помощи любого положения. Они являются другим объектом изобретения, если эти гетероциклические системы замещены. Они являются другим объектом изобретения, если они замещены 1-3 одинаковыми или различными радикалами из группы C1-С 3-алкил, гидрокси, карбонил или галоген,особенно, если они замещены метилом, хлором или фтором. Другим объектом изобретения являются соединения общей формулы (I), где R4 означает фенил,нафтил, хинолин-5-ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо 1-3 радикалами, выбранными из группы карбонил, C1-С 3-алкил, хлор или фтор. Предпочтительно только одна карбонильная группа находится в R4. Другим объектом изобретения являются соединения общей формулы (I), где R4 означает хинолин-5 ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо 1-3 радикалами,выбранными из группы карбонил, C1-С 3-алкил, хлор или фтор. Другим объектом изобретения являются соединения общей формулы (I), где R4 означает фенил,нафтил, хинолин-5-ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо один раз или дважды карбонилом, метилом или фтором. Другим объектом изобретения являются соединения общей формулы (I), где R4 означает хинолин-5 ил, фталазинил, хиназолинил, который может быть замещен независимо один раз или дважды карбонилом или метилом. Другим объектом изобретения являются соединения общей формулы (I), где R4 означает фенил,нафтил, 2-метилхинолин-5-ил, хинолин-5-ил, 2-метилфталазин-1-он-ил, 2-метил-2 Н-фталазин-1-он-ил, 7 фтор-2-метилхиназолин. Еще другим объектом изобретения являются соединения общей формулы (I), где R4 означает 2 метилхинолин-5-ил, хинолин-5-ил, 2-метилфталазин-1-он-ил, 2-метил-2 Н-фталазин-1-он-ил, 7-фтор-2 метилхиназолин. Одной группой соединений общей формулы (I) является такая, где R4 означает гетероцикл, содержащий один или более атомов азота, такой как пиридин, пиримидин, индолизин, индол или изоиндол,пиразол, имидазол, триазол, хинолин, изохинолин, циннолин, фталазин, или хиназолин. Другой группой соединений общей формулы (I) является такая, где R4 означает кислородсодержащий гетероцикл, такой как кумарон (бензофуран) или хроман. Дополнительной группой соединений общей формулы (I) является такая, где R4 означает гетероцикл, содержащий один или более различных гетероатомов, такой как-2 015258 тиазол, изотиазол, оксазол или бензотиазол. Соединения формулы (I), которые в качестве R4 несут кумаринильный или изокумаринильный радикал, в частности изокумаринильный радикал, который необязательно может быть замещен 0-3 одинаковыми или различными радикалами из группы С 1-С 3-алкил, гидрокси, карбонил или галоген, в частности метилом, хлором или фтором, являются дополнительным объектом изобретения.R4 может быть замещен в одном или более положениях радикалом, выбранным из группы, включающей карбонильную группу, галоген, гидроксигруппу, (С 1-С 6)алкил, (С 1-С 5)алкоксигруппу, (С 1 С 5)алкилтиогруппу, (С 1-С 5)перфторалкил, цианогруппу, нитрогруппу, NR7R8COOR9(CO)NR7R8 или (С 1 С 5-алкилен)-O-(СО)-(С 1-С 5)алкильную группу, предпочтительно из группы C1-С 3-алкил, C1-С 3-алкокси,гидрокси, галоген или карбонил; предпочтительно метилом, хлором или фтором. Заместители могут быть одинаковыми или различными. Карбонильный заместитель для группы R4 должен быть определен таким образом, чтобы карбонильный атом углерода представлял собой атом углерода кольца, с которым атом кислорода связан двойной связью. Соединения общей формулы (I), где радикал R4 не замещен или замещен одним или несколькими одинаковыми или различными радикалами из группы C1-С 3-алкил, C1-С 3-алкокси, гидрокси, галоген или карбонил, предпочтительно не замещен или замещен одним или несколькими одинаковыми или различными радикалами из группы C1-С 3-алкил, гидрокси, карбонил или галоген, в частности одним или несколькими одинаковыми или различными радикалами из группы метил, хлор или фтор, особенно метилом, хлором или фтором, являются объектом изобретения. Необязательно атом азота радикала R4 общей формулы по п.1 (такой как в индазоле, хинолоне, изохинолоне и фталазине) может также быть алкилирован C1-С 3-алкильной группой. Соединения общей формулы (I), где R4 означает моноциклическую 5- или 6-членную циклическую систему, которая связана при помощи любого положения, такую как, например, фуран или тиофен, являются объектом изобретения. Соединения общей формулы (I), где R4 означает замещенное фенильное кольцо или замещенное нафтильное кольцо, являются объектом изобретения. В качестве заместителей для колец, содержащихся в R4, подходящими являются такие же, которые уже раскрыты для R1 и R2. Соединения по п.1, где R5 означает трифторметил или пентафторэтил, представляют собой отдельный объект изобретения. Соединения общей формулы (I), где фенильная группа замещена 1-3 одинаковыми или различными заместителями, выбранными из группы карбонил, С 1-С 3-алкокси, гидрокси и галоген, в частности карбонилом, метоксигруппой, гидроксигруппой, фтором, хлором или бромом, и где R4 означает дигидроизоиндолонил, изохинолонил, хиназолинил, индазолил, кумаринил, изокумаринил, который может быть замещен 0-2 заместителями, которые выбраны из группы карбонил, C1-С 3-алкил и галоген, в частности метилом и фтором, и R5 означает CF3 или C2F5, в частности CF3, являются предпочтительным объектом изобретения. Наиболее предпочтительный вариант воплощения такой, где:I) по меньшей мере один из R1, R2, R3 выбран из метоксигруппы, гидроксигруппы, фтора, хлора, метила, или R1 и R2 вместе означают группу -O-СН 2-O-, -СН 2-СН 2-O- или -СН 2-С(СН 3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);II) R4 выбран из хинолин-5-ила, фталазинила, хиназолинила, который может быть замещен независимо один раз или дважды карбонилом, метилом или фтором;IV) R6 выбран из бензила, пропила, хлорметила, бромметила, этилсульфанилметила, (имидазол-2 ил)сульфанилметила,(имидазол-2-ил)сульфонилметила,1,2,4-триазол-3-илсульфанилметила,(1 метилимидазол-2-ил)сульфанилметила,(1 Н-имидазол-2-ил)сульфанилметила,пиримидин-2 илсульфанилметила, 2-пропилсульфанилметила, цианометила, метилсульфанилметила, диметиламинометила, этоксиметил-, гидроксиметила, этоксиметила,и все комбинации I)-IV). К тому же, изобретение относится к применению соединений общей формулы (I) для изготовления фармацевтических агентов, так же как и их применению для изготовления фармацевтических агентов для лечения воспалительных заболеваний. Если не отмечено иначе, термин "алкил" относится к неразветвленным или разветвленным производным. Например, термин "пропил" включает н-пропил и изопропил, термин "бутил" включает н-бутил,изобутил и трет-бутил. С 1-С 5-алкильные группы могут быть неразветвленными или разветвленными и означают метильную,этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, трет-бутильную или нпентильную группу или 2,2-диметилпропил, 2-метилбутил или 3-метилбутил. Предпочтительными являются метильная или этильная группы. Они необязательно могут быть замещены 1-3 гидроксигруппами, 1-3 С 1-С 5-алкоксигруппами и/или 1-3 COOR6 группами. Предпочтительными являются гидроксигруппы.-3 015258 С 1-С 5-алкоксигруппы в R1, R2, R3 и R4 могут быть неразветвленными или разветвленными и означают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу или н-пентоксигруппу, 2,2-диметилпропоксигруппу, 2-метилбутоксигруппу или 3-метилбутоксигруппу. Метоксигруппа или этоксигруппа являются преимущественными. С 1-С 5-алкилтиогруппы могут быть неразветвленными или разветвленными и означают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, трет-бутилтиогруппу или н-пентилтиогруппу, 2,2-диметилпропилтиогруппу, 2-метилбутилтиогруппу или 3-метилбутилтиогруппу. Метилтиогруппа или этилтиогруппа являются преимущественными. Для частично или полностью галогенированной С 1-С 10-алкильной группы следующие частично или полностью галогенированные группы включают, например, фторметил, дифторметил, трифторметил,фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, тетрафторэтил и пентафторэтил, хлорметил, дихлорметил, трихлорметил, хлорэтил, 1,1-дихлорэтил, 1,2-дихлорэтил, 1,1,1-трихлорэтил, 1,1,1 трихлорпропил, хлорпропил, бромметил, дибромметил, бромэтил, 1,1-дибромэтил, 1,2-дибромэтил,бромпропил, бромбутил и бромпентил, йодметил, дийодметил, йодэтил, 1,1-дийодэтил, 1,2-дийодэтил,йодпропил, йодбутил и йодпентил. Предпочтительными вариантами воплощения являются фторметил,трифторметил, фторэтил, 1,1,1-трифторэтил, пентафторэтил, хлорметил, хлорэтил, хлорпропил, бромметил, бромэтил, бромпропил. Для частично или полностью фторированной C1-С 3-алкильной группы могут учитываться следующие частично или полностью фторированные группы: фторметил, дифторметил, трифторметил, фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, тетрафторэтил и пентафторэтил. Из последнего трифторметильная группа или пентафторэтильная группа являются предпочтительными. Термины "атом галогена" или "галоген" означают атом фтора, хлора, брома или йода. Предпочтительным является атом фтора, хлора или брома.NR7R8 группа включает, например, NH2, N(H)CH3, N(CH3)2, N(H)(CO)CH3, N(CH3)(CO)CH3,N[(CO)CH3]2, N(H)CO2CH3, N(CH3)CO2CH3) или N(CO2CH3)2. Вследствие наличия асимметрического центра соединения общей формулы (I) согласно изобретению могут иметь несколько стереоизомеров. Объекты этого изобретения представляют собой все возможные диастереомеры как рацематы, так и энантиомерно чистую форму. Соединения согласно изобретению могут также находиться в виде солей с физиологически приемлемыми анионами, например в форме гидрохлоридов, сульфатов, нитратов, фосфатов, пивалатов, малеатов, фумаратов, тартратов, бензоатов, мезилатов, цитратов или сукцинатов. Соединения могут быть получены разными методами, которые изображены ниже [a)-d)].-4 015258 Кетон общей формулы (II) может быть проаминирован при использовании LDA или (L) или (D)пролинового катализатора в -положение при помощи азадикарбоксилата. Гидразинокетон формулы (III) может реагировать с реагентом Гриньяра, литийорганическими реагентами или индийорганическими реагентами типа R6-Met с образованием гидразиноспиртов типа (IV). Каталитическое гидрирование восстанавливает гидразинокарбоксилаты (IV) до аминов типа (V), которые могут быть субстратами для ароматического аминирования арилгалогенидами R4-Hal при медном или палладиевом катализе. В приведенных выше формулах COCbz означает карбоксибензил. Бензальдегиды типа (VI) могут конденсироваться с аминами типа R4-NH2 с образованием иминов типа (VII) в присутствии алкоголятов титана или органических кислот. Имины типа (VII) взаимодействуют с кетонами типа (VIII) в перекрестном пинакольном сочетании (Tetrahedron. Lett. 1992, 33, 1285-8;J. Am. Chem. Soc. 1956, 78, 2268; Tetrahedron, 1964, 20, 2163), с применением солей металлов (соли переходных металлов в низкой степени валентности), как, например, NbCl3 или SmI2 с образованием бензил 1-амино-2-олов формулы (I). Имины типа (VII), изображенные в b), обрабатывают при низких температурах от -80 до -100 С литированным эпоксидом (IX) с образованием соединений типа (X). Эпоксиды (X) могут быть раскрыты нуклеофилами типа R6'-Met' с образованием соединения (I). Возможными нуклеофилами являются алкилкупраты, винилкупраты, тиолы, аллилсиланы, винилсиланы, винилстананы, реагенты Гриньяра, в присутствии кислоты Льюиса, такой как BF3 или AlMe3, AlCl3, цианиды, амины, спирты и тиоспирты. Этот процесс, описанный выше, может быть проведен энантиоселективно посредством применения энантиочистых эпоксидов формулы (IX) с образованием энантиочистых соединений формулы (X) и (I). Для специалиста в данной области техники ясно, что при использовании этого синтетического пути могут быть синтезированы только подгруппа группы R6, как обозначено в п.1. Этим соединениям требуется метиленовая группа (-СН 2-) в качестве первого элемента в группе R6. Различные варианты, которые возможны, определены в формуле изобретения в качестве -CH2-R6.-Кетофосфонат (XI) конденсируется при катализе цианидами в эфир -кетофосфорной кислоты(XII). Эфир -кетофосфорной кислоты (XII) расщепляется на -гидроксикетон и конденсируется в имин в присутствии титанатов и уксусной кислоты. Восстановление имина борогидридом натрия или каталитическим гидрированием дает соединение (I). Дополнительным объектом изобретения являются соединения общей формулы (V), (VII), (X) и где R1, R2, R3, R4, R5 и R6 имеют значения, описанные выше, и их используют для изготовления соединений общей формулы (I). Заместители R1, R2, R3, R4, R5 и R6 соединений общей формулы (V), (VII), (X) и (XII) имеют в основном такое же значение, как описано выше для заместителей общей формулы (I). Понятно, что не все из R1, R2, R3, R4, R5 и R6 присутствуют в каждой формуле (V), (VII), (X) и (XII). Формула (XII), например,не содержит R4, формула (V), например, не содержит ни R5, ни R6. Определения, данные в пояснении формулы (I), должны пониматься как такие, что только некоторые заместители из группы R1, R2, R3, R4,R5 и R6 присутствуют в соединении общей формулы (V), (VII), (X) и (XII). Соединения общей формулы (VII) или (X), где R4 означает необязательно замещенную фталидильную, индолильную, изоиндолильную, дигидроиндолильную, дигидроизоиндолильную, дигидроизохинолинильную, дигидрохинолинильную, тиофталидильную, бензоксазинонильную, фталазинонильную, хинолинильную, изохинолинильную, хинолонильную, изохинолонильную, индазолильную, бензотиазолильную, хиназолинильную, хиноксалинильную, циннолинильную, фталазинильную, 1,7- или 1,8 нафтиридинильную, индолонильную, изоиндолонильную, дигидроиндолонильную, дигидроизоиндолонильную, бензимидазолильную, кумаринильную, изокумаринильную, пиразолопиримидинильную или индолильную группу, которая связана при помощи любого положения. Они являются другим объектом изобретения, если эти гетероциклические системы замещены. Они являются другим объектом изобретения, если они замещены 1-3 одинаковыми или различными радикалами из группы С 1-С 3-алкил, гидрокси,карбонил или галоген, особенно, если они замещены метилом, хлором или фтором. Другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает-6 015258 фенил, нафтил, хинолин-5-ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо 1-3 радикалами, выбранными из группы карбонил, C1-С 3-алкил, хлор или фтор. Предпочтительно только одна карбонильная группа находится в R4. Другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает хинолин-5-ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо 1-3 радикалами, выбранными из группы карбонил, C1-С 3-алкил, хлор или фтор. Другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает фенил, нафтил, хинолин-5-ил, фталазинил, хиназолинил, который может быть необязательно замещен независимо один раз или дважды карбонилом, метилом или фтором. Другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает хинолин-5-ил, фталазинил, хиназолинил, который может быть замещен независимо один раз или дважды карбонилом, метилом или фтором. Другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает фенил, нафтил, 2-метилхинолин-5-ил, хинолин-5-ил, 2-метилфталазин-1-он-ил, 2-метил-2 Н-фталазин-1 он-ил, 7-фтор-2-метилхиназолин. Еще другим объектом изобретения являются соединения общей формулы (VII) или (X), где R4 означает 2-метилхинолин-5-ил, хинолин-5-ил, 2-метилфталазин-1-он-ил, 2-метил-2 Н-фталазин-1-он-ил, 7 фтор-2-метилхиназолин. Одной группой соединений общей формулы (I) является такая, где R4 означает гетероцикл, содержащий один или более атомов азота, такой как пиридин, пиримидин, индолизин, индол или изоиндол,пиразол, имидазол, триазол, хинолин, изохинолин, циннолин, фталазин или хиназолин. Другой группой соединений общей формулы (VII) или (X) является такая, где R4 означает кислородсодержащий гетероцикл, такой как кумарон (бензофуран) или хроман. Дополнительной группой соединений общей формулы (VII) или (X) является такая, где R4 означает гетероцикл, содержащий один или более различных гетероатомов, такой как тиазол, изотиазол, оксазол или бензотиазол. Соединения формулы (VII) или (X), которые в качестве R4 несут кумаринильный или изокумаринильный радикал, в частности изокумаринильный радикал, который необязательно может быть замещен 0-3 одинаковыми или различными радикалами из группы C1-С 3-алкил, гидрокси, карбонил или галоген, в частности метилом, хлором или фтором, являются дополнительным объектом изобретения.R4 в соединениях общей формулы (VII) или (X) может быть замещен в одном или более положениях радикалом, выбранным из группы карбонил, галоген, гидрокси, (С 1-С 5)алкил, (С 1-С 5)алкокси, (С 1 С 5)алкилтио, (С 1-С 5)перфторалкил, циано, нитро, NR7R8COOR9(CO)NR7R8 или (С 1-С 5-алкилен)-O-(СО)(С 1-С 5)алкильная группа, предпочтительно из группы C1-С 3-алкил, С 1-С 3-алкокси, гидрокси, галоген или карбонил; предпочтительно метилом, хлором или фтором. Заместители могут быть одинаковыми или различными. Карбонильный заместитель для группы R4 в соединениях формулы (VII) или (X) должен быть определен таким образом, чтобы карбонильный атом углерода представлял собой атом углерода кольца, с которым атом кислорода связан двойной связью. Соединения общей формулы (VII) или (X), где радикал R4 не замещен или замещен одним или несколькими одинаковыми или различными радикалами из группы С 1-С 3-алкил, C1-С 3-алкокси, гидрокси,галоген или карбонил, предпочтительно не замещен или замещен одним или несколькими одинаковыми или различными радикалами из группы C1-С 3-алкил, гидрокси, карбонил или галоген, в частности одним или несколькими одинаковыми или различными радикалами из группы метил, хлор или фтор, особенно метилом, хлором или фтором, являются объектом изобретения. Необязательно атом азота радикала R4 формул (VII) или (X) в формуле изобретения (такой как в индазоле, хинолоне, изохинолоне и фталазине) может также быть алкилирован С 1-С 3-алкильной группой. Соединения общей формулы (VII) или (X), где R4 означает моноциклическую 5- или 6-членную циклическую систему, которая связана при помощи любого положения, такую как, например, фуран или тиофен, являются объектом изобретения. Соединения общей формулы (VII) или (X), где R4 означает замещенное фенильное кольцо или замещенное нафтильное кольцо, являются объектом изобретения. В качестве заместителей для колец, содержащихся в R4, подходящими являются такие же, которые уже раскрыты для R1 и R2. Особенно предпочтительными являются соединения общих формул (V), (VII), (X) и (XII), где:I) по меньшей мере один из R1, R2, R3 выбран из метоксигруппы, гидроксигруппы, фтора, хлора, метила, или R1 и R2 вместе означают группу -O-СН 2-O-, -СН 2-СН 2-O- или -СН 2-С(СН 3)2-O- (формирующую вместе с фенильной группой, к которой они присоединены, 5-членное кольцо);II) R4 выбран из хинолин-5-ила, фталазинила, хиназолинила, который может быть замещен независимо один раз или дважды карбонилом, метилом или фтором;IV) R6 выбран из бензила, пропила, хлорметила, бромметила, этилсульфанилметила, (имидазол-2 ил)сульфанилметила,(имидазол-2-ил)сульфонилметила,1,2,4-триазол-3-илсульфанилметила,(1-7 015258 метилимидазол-2-ил)сульфанилметила,(1 Н-имидазол-2-ил)сульфанилметила,пиримидин-2 илсульфанилметила, 2-пропилсульфанилметила, цианометила, метилсульфанилметила, диметиламинометила, этоксиметил-, гидроксиметила, этоксиметила,и все комбинации I)-IV). Если различные соединения согласно изобретению присутствуют как рацемические смеси, они могут быть разделены на чистые, оптически активные формы согласно методам разделения рацематов, которые знакомы специалисту в данной области техники. Например, рацемические смеси могут быть разделены хроматографией на оптически активном носителе (CHIRALPAK AD) на чистые изомеры. Также возможно эстерифицировать свободную гидроксигруппу в рацемическом соединении общей формулы (I) при помощи оптически активной кислоты и разделить диастереоизомерные эфиры, что достигается фракционной кристаллизацией или хроматографией, и гидролизовать разделенные эфиры в каждом случае на оптически чистые изомеры. В качестве оптически активной кислоты могут быть применены,например, миндальная кислота, камфорсульфокислота или винная кислота. Связывание веществ глюкокортикоидным рецептором и другими рецепторами стероидных гормонов (минеральный кортикоидный рецептор (MP), прогестероновый рецептор (ПР) и андрогеновый рецептор (АР проверено с помощью рекомбинантно созданных рецепторов. Для изучения связывания применялись цитозольные препараты клеток Sf9, которые были заражены рекомбинантными бакуловирусами, кодированные для GR. В сравнении с контрольным веществом [3 Н]-дексаметазоном вещества показывают от высокой до очень высокой аффинность к GR. В качестве молекулярного механизма для противовоспалительного действия глюкортикоидов рассмотрено GR-промежуточное ингибирование транскрипции цитокинов, адгезионных молекул, ферментов и других противовоспалительных факторов. Этот ингибитор производится путем взаимодействия GR с другими транскрипционными факторами, например, АР-1 и NF-kappa-B (для обзора, см. Cato, А.С.В.,and Wade, E., BioEssays 18, 371-378, 1996). Соединения общей формулы (I) согласно изобретению ингибируют секрецию цитокина IL-8 в человеческой моноцитарной клеточной линии ТНР-1, которая инициирована липополисахаридом (ЛПС). Концентрация цитокинов была определена в супернатанте при помощи коммерчески доступных ELISA наборов. Противовоспалительное действие соединений общей формулы (I) проверяли в экспериментах с животными при помощи анализа воспаления, вызванного кротоновым маслом, у крыс и мышей (J. Exp.Med. (1995), 182, 99-108). С этой целью кротоновое масло в этанольном растворе применяли локально на ушах животных. Исследуемые вещества были также применены локально или систематично в то же время или за 2 ч до кротонового масла. После 16-24 ч измеряли вес уха в качестве критерия воспалительного отека, пероксидную активность - в качестве критерия инвазии гранулоцитов и эластазную активность - в качестве критерия инвазии нейтрофильных гранулоцитов. В этом тесте соединения общей формулы (I) ингибируют три вышеупомянутых параметра воспаления как после локального введения, так и после систематического введения. Одним из наиболее частых нежелательных действий глюкокортикоидной терапии являются так называемые "стероидные диабеты" [например, Hatz, H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien [Glucocorticoids: Immunological Bases, Pharmacology and Therapy Guidelines], Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, 1998]. Причиной этого является стимуляция глюконеогенеза в печени индукцией ферментов, ответственных в этом отношении, и свободными аминокислотами, которые продуцируются из разложения протеинов (катаболическое действие глюкокортикоидов). Ключевым ферментом катаболического метаболизма в печени является тирозинаминотрансфераза (ТАТ). Активность этого фермента может быть определена из гомогенатов печени путем фотометрии и представляет собой хороший показатель нежелательных метаболических действий глюкокортикоидов. Для измерения индукции ТАТ животных умерщвляли через 8 ч после того, как было введено исследуемое вещество, печенки удаляли и активность ТАТ измеряли в гомогенате. В этом тесте соединения общей формулы (I) при дозах, в которых они имеют противовоспалительное действие, стимулируют малое количество или отсутствие тирозинаминотрансферазы. Вследствие их противовоспалительного и, кроме того, противоаллергического, иммуносуппресорного и антипролиферативного действия соединения общей формулы (I) соответственно изобретению могут быть применены в качестве лекарственных средств для лечения или профилактики следующих патологических состояний у млекопитающих и людей. В этом случае, термин "заболевание" означает следующие признаки.(i) Заболевания легкого, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: хронические, обструктивные заболевания легкого любого происхождения, главным образом бронхиальная астма; бронхиты любого происхождения; все формы рестриктивных заболеваний легкого, главным образом аллергические альвеолиты; все формы отека легких, главным образом токсический отек легких;-8 015258 саркоидозы и гранулематозы, главным образом болезнь Бека.(ii) Ревматические заболевания/аутоиммунные заболевания/заболевания суставов, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, особенно ревматоидные артриты, ревматический полиартрит, ревматическая полимиалгия; реактивные артриты; воспалительные заболевания мягких тканей; симптомы артрических заболеваний суставов у пациентов с дегенеративными заболеваниями суставов (артрозы); травматические поражения кожи ревматического происхождения; коллагенозы любого происхождения, например системные красные волчанки, склеродермии, полимиозиты, дерматомиозиты, синдром Шегрена, синдром Стила, синдром Фелти.(iii) Аллергии, которые сопровождаются воспалительными, и/или пролиферативными процессами: все формы аллергических реакций, например отек Квинке, сенная лихорадка, укусы насекомых, аллергические реакции на фармацевтические агенты, производные крови, контрастные среды и т.п., анафилактический шок, уртикария, контактные дерматиты.(v) Заболевания кожи, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: атопические дерматиты (главным образом у детей); псориаз; красный волосистый питириаз; эритемные заболевания, вызванные различными пагубными для здоровья факторами, например радиация, химические вещества, ожоги и т.п.; буллезные дерматозы; заболевания лихеноидной группы; зуд (например, аллергической природы); себорейная экзема; розацеа; обыкновенная пузырчатка; эритема экссудативная многообразная; баланиты; вульвиты; выпадение волос, такое как очаговая алопеция; кожная Т-клеточная лимфома.(vii) Заболевания печени, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: острое разложение клеток печени; острый гепатит различной природы, например вирусный, токсический, вызванный фармацевтическими агентами; хронический агрессивный гепатит и/или хронический интермиттирующий гепатит.(viii) Желудочно-кишечные заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: регионарный энтерит (болезнь Крона); язвенный колит; гастрит; рефлюксный эзофагит; язвенный колит другой природы, например природный спру.(xi) Заболевания области уха-носа-горла, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенная лихорадка; отит наружного уха, например вызванный контактным дерматитом, инфекцией и т.п.; отит среднего уха.(xii) Неврологические заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: церебральный отек, главным образом церебральный отек вызванный опухолью; множественный склероз; острый энцефаломиелит; менингит; различные формы конвульсий, например младенческие кивательные судороги.(xvii) Тяжелые шоковые патологические состояния, например анафилактический шок, систематический вызывающий воспалительную реакцию синдром (SIRS).(xviii) Заместительная терапия при врожденной первичной надпочечной недостаточности, например врожденный адреногенитальный синдром I; приобретенной первичной надпочечной недостаточности, например болезнь Аддисона, аутоиммунный адреналит, мета-инфекционные опухоли, метастазы и т.п.; врожденной вторичной надпочечной недостаточности, например врожденный гипопитуитаризм; приобретенной вторичной надпочечной недостаточности, например мета-инфекционные опухоли и т.п.(xix) Рвота, которая сопровождается воспалительными аллергическими и/или пролиферативными процессами: например, в комбинации с 5-НТ 3 антагонистами при рвоте, вызванной цитостатиком.(хх) Боли воспалительной природы, например люмбаго. Кроме этого, соединения общей формулы (I) согласно изобретению могут применяться для лечения и профилактики дополнительных патологических состояний, которые не упоминались выше, для которых сейчас применяются синтетические глюкокортикоиды (см. в этом аспекте Hatz, H.J., Glucocorticoide:mbH, Stuttgart, 1998). Все прежде упомянутые показания с (i) по (хх) описаны более детально в Hatz, H.J., Glucocorticoide:mbH, Stuttgart, 1998. Для терапевтической активности в вышеупомянутых патологических заболеваниях подходящая доза изменяется и зависит от, например, активной силы соединения общей формулы (I), носителя заболевания, типа введения и типа и трудности заболеваний, которые лечатся, так же как и от применения в качестве профилактического агента или в качестве терапевтического агента.- 10015258 К тому же изобретение предусматривает:(i) применение одного из соединений формулы (I) согласно изобретению или их смеси для производства лекарственного средства для лечения заболевания;(ii) способ лечения заболевания, упомянутый способ включает введение количества соединения согласно изобретению, в котором количество подавляет заболевание и в котором количество соединения дают пациенту, который нуждается в таком лечении;(iii) фармацевтическую композицией для лечения заболевания, упомянутое лечение охватывает одно из соединений согласно изобретению или их смесь и по меньшей мере один фармацевтический адъювант и/или наполнитель. Как правило, удовлетворительные результаты можно ожидать у животных, когда дневные дозы охватывают интервал от 1 до 100,000 мкг соединения согласно изобретению на 1 кг массы тела. В случае крупного млекопитающего, например человека, рекомендованная дневная доза лежит в интервале от 1 до 100,000 мкг на 1 кг массы тела. Предпочтительной является доза от 10 до 30,000 мкг на 1 кг массы тела и более предпочтительной является доза от 10 до 10,000 мкг на 1 кг массы тела. Например, эта доза подходящим образом вводится несколько раз ежедневно. Для лечения острого шока (например, анафилактический шок) могут даваться индивидуальные дозы, которые значительно больше вышеупомянутых доз. Приготовление фармацевтических препаратов на основе новых соединений осуществляют путем,который известен в уровне техники, при этом активный компонент перерабатывают с наполнителями,которые широко используются в галеновых препаратах, с наполнителями, веществами, которые вызывают декомпозицию, связывающими агентами, увлажнителями, лубрикантами, абсорбентами, разбавителями, корректировщиками аромата, красителями и т.п., и превращают в форму, требуемую для введения. В этом случае, ссылка сделана на Remington's Pharmaceutical Science, 15th Edition, Mack Publishing Company, East Pennsylvania (1980). Для орального введения в особенности являются подходящими таблетки, таблетки с оболочкой,капсулы, пилюли, порошки, гранулы, пастилки, суспензии, эмульсии или растворы. Для парентерального введения являются возможными инъекционные и инфузионные препараты. Для внутрисуставной инъекции могут применяться соответственно приготовленные кристаллические суспензии. Для внутримышечной инъекции могут применяться водные и масляные инъекционные растворы или суспензии и соответствующие препараты пролонгированного действия. Для ректального введения новые соединения могут применяться в форме суппозиториев, капсул,растворов (например, в форме клизмы) и мазей как для систематического, так и для локального лечения. Для пульмонального введения новых соединений последние могут применяться в форме аэрозолей и ингаляторов. Для локального применения на глаза, внешние ушные каналы, среднее ухо, носовые каналы и околоносовые пазухи новые соединения могут применяться в виде капель, мазей и настоек в соответствующих фармацевтических составах. Для местного применения возможны составы в гелях, мазях, жирных мазях, кремах, пастах, порошках, молочке и настойках. Дозировка соединений общей формулы (I) в этих препаратах может составлять 0.01-20% для достижения достаточного фармацевтического действия. Изобретение также охватывает соединения общей формулы (I) согласно изобретению в качестве терапевтически активных компонентов. Кроме того, соединения общей формулы (I) согласно изобретению являются частью изобретения в качестве терапевтически активных компонентов вместе с фармацевтически совместимыми и приемлемыми адъювантами и наполнителями. Изобретение также охватывает фармацевтическую композицию, которая содержит одно из фармацевтически активных соединений согласно изобретению или его смеси или его фармацевтически совместимую соль и фармацевтически совместимую соль или фармацевтически совместимые адъюванты и наполнители. Соединения общей формулы (I) согласно изобретению могут также необязательно быть составлены и/или введены в комбинации с другими активными компонентами. Следовательно, изобретение также относится к комбинационным терапиям или комбинированным композициям, в которых соединение общей формулы (I) или его фармацевтически приемлемую соль либо фармацевтическую композицию, которая содержит соединение общей формулы (I) или его фармацевтически приемлемую соль, вводят или одновременно (необязательно в такой же композиции), или в последовательности вместе с одним или более фармацевтическими агентами для лечения одного из выше упомянутых патологических состояний. Например, для лечения ревматоидного артрита, остеоартрита,ХОЗЛ (хроническое обструктивное заболевание легкого), астмы или аллергического ринита соединение общей формулы (I) этого изобретения может быть скомбинировано с одним или более фармацевтическими агентами для лечения такого заболевания. Когда такая комбинация вводится путем ингаляции,фармацевтический агент, который комбинируется, может быть выбран из следующего списка: ингибитор PDE4, включающий изоформу ингибитора PDE4D;- 11015258 селективный антагонист .sub2. адреноцептора, такой как, например, метапротеренол (алупент),изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол мезилат, пирбутерол или индакатерол; антагонист рецептора мускарина (например, антагонист М 1, М 2 или М 3, такой как, например, более селективный антагонист М 3), такой как, например, ипратропий бромид, тиотропий бромид, окситропий бромид, пирензепин или телензепин; модулятор функции рецептора цитокинов (такой как, например, антагонист рецептора CCR1) или ингибитор функции р 38 киназы. Для другой задачи этого изобретения такая комбинация с соединением общей формулы (I) или его фармацевтически приемлемой солью применяется для лечения ХОЗЛ, астмы или аллергического ринита и может быть введена путем ингаляции или орально в комбинации с ксантином (таким как, например,аминофиллин или теофиллин), которая также может быть введена путем ингаляции или орально. Экспериментальная часть. Различные аспекты изобретения, описанные в данном изобретении, проиллюстрированы следующими примерами, которые ни в коей мере не ограничивают данное изобретение. Пример 1.N-Фенил[2-(трифторметил)оксиранил]метиланилин 0.63 мл (7.4 ммоль) 1,1,1-трифторэпоксипропана в 35 мл THF охлаждали до -104 С и прибавляли 5.1 мл 1.6 М раствора н-бутиллития в гексане в течение 3 ч, в то время как температура не превышала-99 С. Через 10 мин после полного прибавления прибавляли 2.0 г (11 ммоль) н-бензилиденанилина в 10 мл THF в течение 0.5 ч, в то время как температура не превышала -99 С. После 10 мин при -100 С прибавляли 7.4 мл диэтилового эфира и реакционную смесь нагревали до 20 С в течение 1 ч. Реакцию останавливали прибавлением насыщенного раствора хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом,сушили над сульфатом натрия и затем упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 30-40%) дает 1.8 г желаемого эпоксида. 1 Н-ЯМР (CDCl3) =2.58 (m, 1H), 3.06 (d, 1H), 3.77 (s, 3 Н), 4.42 (d, 1H), 5.06 (d, 1 Н), 6.56 (d, 2 Н), 6.71(t, 1 Н), 7.09-7.56 (m, 5 Н), 7.89 (d, 2 Н). К 0.49 г (3.9 ммоль) хлористого алюминия в 3 мл бензола при 5 С прибавляли 0.9 мг (3.1 ммоль)N-фенил[2-(трифторметил)оксиранил]метиланилина в 3 мл бензола. Реакционную смесь перемешивали 2 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия со льдом. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэшхроматография на силикагеле (этилацетат в гексане 25%) дает 250 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CD3OD) =3.59 (d, 1H), 3.76 (d, 1H), 4.77 (br, 1H), 4.96 (s, 1H), 6.65 (d, 2H), 6.75 (t, 1H),7.10-7.20 (m, 4H), 7.30-7.42 (m, 6H), 7.46 (d, 2H). Пример 2.-Пропил[(фенил)амино](трифторметил)бензолэтанол К 175 мг (0.92 ммоль) йодида меди (I) в 4 мл THF при -30 С прибавляли 4 мл 3 М этилмагнийбромида в диэтиловом эфире. Через 30 мин при -30 С прибавляли 0.9 г (3.1 ммоль) н-фенил-[2(трифторметил)оксиранил]метиланилина в 3 мл THF. Реакционную смесь перемешивали 4 ч при -30 С и затем выливали в насыщенный раствор хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфа- 12015258 том натрия и упаривали. Флэш-хроматография на силикагеле (этилацетат в гексане 5-30%) дает 335 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CD3OD) =0.86 (t, 3 Н), 1.44-1.53 (m, 3 Н), 1.70 (ddd, 1H), 4.65 (d, 1 Н), 4.72 (d, 1K), 6.58 (d,2 Н), 6.68 (t, 1H), 7.07 (d, 2H), 7.26-7.57 (m, 5H). Пример 3.[3-Метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин К 1.17 г (7.4 ммоль) 5-амино-2-метилхинолина и 1 г (7.4 ммоль) 3-метоксибензальдегида в 39 мл толуола прибавляли 1 мл уксусной кислоты. Смесь нагревали в течение 3 ч при кипении до тех пор, пока вода не соберется в насадке Дина-Старка. Растворитель упаривали и остаток дважды азеотропно упаривали с небольшими порциями толуола. В качестве продукта получили 2.1 г [(3-метоксифенил)метилен]2-метилхинолин-5-амина. 0.31 мл (3.6 ммоль) 1,1,1-трифторэпоксипропана в 17 мл THF охлаждали до-104 С и прибавляли 1.59 мл 2.5 М раствора н-бутиллития в гексане в течение 3 ч, в то время как температура не превышала -99 С. Через 10 мин после полного прибавления прибавляли 1.5 г (5.4 ммоль) [(3 метоксифенил)метилен]-2-метилхинолин-5-амина в 5 мл THF в течение 0.5 ч, в то время как температура не превышала -99 С. Через 0.5 ч при -100 С прибавляли 4 мл диэтилового эфира и реакционную смесь нагревали до 20 С в течение 1 ч. Реакцию останавливали прибавлением насыщенного раствора хлорида аммония. Слои разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем упаривали. Флэшхроматография на силикагеле (ацетон в гексане 30-40%) дает 800 мг желаемого эпоксида. 1 Н-ЯМР (CDCl3) =2.64 (m, 1H), 2.72 (s, 3 Н), 3.13 (d, 1H), 3.77 (s, 3 Н), 5.14 (d, 1H), 5.20 (d, 1H), 6.38(d, 1H), 6.84 (d, 1H), 6.90 (s, 1H), 6.95 (d, 1H), 7.26-7.29 (m, 2H), 7.35 (t, 1H), 7.41 (d, 1H), 8.19 (d, 1H). К 128 мг (0.96 ммоль) хлористого алюминия в 4 мл бензола при 5 С прибавляли 310 мг (0.8 ммоль)(3-метоксифенил)[2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в 2 мл бензола. Реакционную смесь перемешивали 3 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 0-35%) дает 140 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.13 (dq, 1H), 3.68 (d, 1H), 3.73 (s, 3 Н), 5.12 (s, 1H), 6.49 (d, 1H),6.85 (d, 1H), 7.18-7.24 (m, 4H), 7.35 (d, 1H), 7.36 (t, 1H), 8.42 (d, 1H). Пример 4.(3-Метоксифенил)[2-(трифторметил)оксиранил]метилнафталин-1-амин Аналогично примеру 3 соответствующий имин получен из 5.0 г (34.9 ммоль) 1-аминонафталина и 4.24 мл (34.9 ммоль) 3-метоксибензальдегида в толуоле. К 2.11 г (8.1 ммоль) [(3 метоксифенил)метилен]нафталин-1-амина в THF прибавляли 0.63 мл (7.4 ммоль) литированного 1,1,1 трифторэпоксипропана при -100 С аналогично примеру 3. Обычная обработка и хроматографическая очистка на силикагеле (этилацетат в гексане 5%) дают 1.29 г [3-метоксифенил][2-(трифторметил)оксиранил]метилнафталин-5-амина в виде желтого масла. 1 Н-ЯМР (CDCl3) =2.68 (m, 1H), 3.14 (d, 1H), 3.77 (s, 3 Н), 5.22 (s, 2H), 6.40 (d, 1H), 6.84 (d, 1H), 6.94(s, 1H), 6.99 (d, 1H), 7.16-7.28 (m, 3H), 7.50 (m, 2H), 7.79 (d, 1H), 7.95 (d, 1H). К 30 мг (0.16 ммоль) йодида меди(I) в 2 мл THF при -30 С прибавляли 0.71 мл 3 М этилмагнийбромида в диэтиловом эфире. Через 30 мин при -30 С прибавляли 200 мг (0.54 ммоль) [3-метоксифенил][2(трифторметил)оксиранил]метилнафталин-5-амина в 0.5 мл THF. Реакционную смесь перемешивали 2 ч при 0 С, 14 ч при 25 С и затем выливали в насыщенный раствор хлорида аммония. Фазы разделяли и- 13015258 водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (этилацетат в гексане 5%) дает 50 мг желаемого соединения и 4 мг -хлорметил-3-метокси[(нафт-1-ил)амино]-(трифторметил)бензолэтанола (пример 6). 1 Н-ЯМР (CDCl3) =3.57 (d, 1H), 3.77 (d, 1H), 3.78 (s, 3 Н), 5.15 (s, 1H), 5.55 (br, 1H), 6.52 (d, 1H), 6.86-Бромметил-3-гидрокси[(нафт-1-ил)амино](трифторметил)бензолэтанол К 20 мг (0.04 ммоль) -бромметил-3-метокси[(нафт-1-ил)амино](трифторметил)бензолэтанола в 2 мл дихлорметана при -20 С прибавляли 0.44 мл 1 М раствора трибромида бора в дихлорметане под аргоном. Реакционную смесь перемешивали 16 ч в интервале температур между 0 и 25 С. Реакционную смесь перемешивали при 0 С с насыщенным раствором бикарбоната натрия. После разбавления этилацетатом смеси дали нагреться до комнатной температуры, перемешивали 10 мин и экстрагировали дважды этилацетатом. Объединенные органические экстракты промывали насыщенным раствором NaCl и сушили над сульфатом натрия. Растворитель упаривали и остаток очищали при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат в гексане 33%). Получали 6.5 мг желаемого соединеня. 1 Н-ЯМР (CDCl3) =3.56 (d, 1H), 3.77 (d, 1H), 4.98 (br, 1H), 5.14 (s, 1H), 6.48 (d, 1H), 6.78 (d, 1H), 7.02-Хлорметил-3-метокси-3-[(нафт-1-ил)амино](трифторметил)бензолэтанол Выделен как побочный продукт в примере 4. 1 Н-ЯМР (CDCl3) =3.76 (s, 3 Н), 3.80 (d, 1H), 4.87 (d, 1H), 5.35 (s, 1H), 6.54 (d, 1H), 6.86 (d, 1H), 7.09[2-Метоксифенил][2-(трифторметил)оксиранил]метилнафталин-1-амин Аналогично примеру 3 соответствующий имин получен из 1-аминонафталина и 2 метоксибензальдегида в толуоле. К 2.11 г (8.1 ммоль) [(2-метоксифенил)метилен]нафталин-1-амина вTHF прибавляли 0.63 мл (7.4 ммоль) литированного 1,1,1-трифторэпоксипропана при -100 С аналогично примеру 3. Обычная обработка и хроматографическая очистка на силикагеле (этилацетат в гексане 1020%) дают 438 мг [2-метоксифенил][2-(трифторметил)оксиранил]метилнафталин-5-амина в виде желтого масла. 1 Н-ЯМР (CDCl3) =2.40 (m, 1H), 3.08 (d, 1H), 3.95 (s, 3 Н), 5.23 (d, 1H), 5.78 (d, 1H), 6.33 (d, 1H), 6.82(t, 1H), 6.92-7.05 (m, 2H), 7.20 (m, 2H), 7.28 (m, 1 Н), 7.50 (m, 2 Н), 7.84 (d, 1H), 7.98 (d, 1H). К 30 мг (0.16 ммоль) йодида меди(I) в 2 мл THF при -30 С прибавляли 0.71 мл 3 М этилманийбромида в диэтиловом эфире. Через 30 мин при -30 С прибавляли 200 мг (0.54 ммоль) [2-метоксифенил][2(трифторметил)оксиранил]метилнафталин-5-амина в 0.5 мл THF. Реакционную смесь перемешивали 2 ч, пока она не нагрелась до -10 С, и затем выливали в насыщенный раствор хлорида аммония. Фазы разделяли и водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы про- 14015258 мывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (этилацетат в гексане 10-50%) дает 12 мг желаемого соединения. 1 Н-ЯМР (CDCl3) =0.84 (t, 1H), 1.44 (m, 1H), 1.61 (m, 2H), 1.83 (ddd, 1H), 3.98 (s, 3 Н), 5.37 (s, 1H),5.67 (br, 1H), 6.39 (m, 1H), 6.91 (t, 1H), 6.95 (d, 1H), 7.18 (m, 2 Н), 7.26 (d, 1 Н), 7.40 (d, 1 Н), 7.49 (m, 2 Н),7.76 (d, 1H), 7.91 (d, 1H). Пример 8.[3,5-Дифтор-2-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин К 2.0 г (12.6 ммоль) 5-амино-2-метилхинолина и 2.2 г (12,6 ммоль) 3,5-дифтор-2 метоксибензальдегида в 38 мл толуола прибавляли 0.1 мл уксусной кислоты и 5 г молекулярных сит. Смесь нагревали в течение 5 ч при кипении и после охлаждения фильтровали через цеолиты. Растворитель упаривали и остаток дважды азеотропно упаривали с небольшими порциями толуола. Получали 3,43 г [(3,5-дифтор-2-метоксифенил)метилен]-2-метилхинолин-5-амина в виде желтого порошка. 1,93 мл(22.3 ммоль) 1,1,1-трифторэпоксипропана в 40 мл THF и 10 мл гексана охлаждали до -100 С и прибавляли 14 мл 1,6 М раствора н-бутиллития в гексане в течение 2 ч, в то время как температура не превышала-96 С. Через 10 мин после полного прибавления прибавляли 3,44 г (11.2 ммоль) [(3,5-дифтор-2 метоксифенил)метилен]-2-метилхинолин-5-амина в 50 мл THF в течение 1.5 ч, в то время как температура не превышала -95 С. Через 1 ч при -100 С реакционную смесь нагревали до 0 С в течение 2 ч. Реакцию останавливали прибавлением насыщенного раствора хлорида аммония. Слои разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем упаривали. Флэш-хроматография на силикагеле (изопропанол в гексане 5-20%) дает 1,68 г желаемого эпоксида. 1 Н-ЯМР (CDCl3) =2.48 (m, 1H), 2.75 (s, 3 Н), 3.17 (d, 1H), 4.07 (s, 3 Н), 5.08 (d, 1H), 5.68 (d, 1H), 6.31(d, 1H), 6.73 (dd, 1H), 6.83 (ddd, 1H), 7.31 (d, 1H), 7.40 (t, 1H), 7.46 (d, 1H), 8.20 (d, 1H). К 94 мг (0.74 ммоль) хлористого алюминия в 3 мл бензола при 5 С прибавляли 250 мг (0.59 ммоль)[3,5-дифтор-2-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в 2 мл бензола. Реакционную смесь перемешивали 3 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 20-50%) дает 53 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.73 (s, 3 Н), 3.70 (d, 1H), 3.81 (d, 1H), 4.04 (s, 3 Н), 5.50 (d, 1H), 5.55 (d, 1H), 6.44[2,4-Дифтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин К 2.0 г (12,6 ммоль) 5-амино-2-метилхинолина и 2,18 г (13,6 ммоль) 2,3-дифтор-3 метоксибензальдегида в 38 мл толуола прибавляли 36 мкл уксусной кислоты и 5 г молекулярных сит. Смесь нагревали в течение 4 ч при кипении и после охлаждения фильтровали через цеолиты. Растворитель упаривали и остаток дважды азеотропно упаривали с небольшими порциями толуола. Получали 3,74 г [(2,4-дифтор-3-метоксифенил)метилен]-2-метилхинолин-5-амина в виде желтого порошка. 2,06 мл 1,1,1-трифторэпоксипропана в 35 мл THF и 10 мл гексана охлаждали до -100 С и прибавляли 15 мл 1,6 М раствора н-бутиллития в гексане в течение 2 ч, в то время как температура не превышала -95 С. Через 10 мин после полного прибавления прибавляли 3,74 г (12 ммоль) [1-(2,4-дифтор-3- 15015258 метоксифенил)метилен]-2-метилхинолин-5-амина в 45 мл THF в течение 1 ч, в то время как температура не превышала -95 С. Через 1 ч при -100 С прибавляли 11 мл диэтилового эфира и реакционную смесь нагревали до -10 С в течение 1 ч. Реакцию останавливали прибавлением насыщенного раствора хлорида аммония. Слои разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем упаривали. Флэшхроматография на силикагеле (этилацетат в гексане 10-50%) дает 3,66 г [2,4-дифтор-3-метоксифенил][2(трифторметил)оксиранил]метил-2-хинолин-5-амина в виде желтого порошка. 1 Н-ЯМР (CDCl3) =2.60 (m, 1H), 2.74 (s, 3 Н), 3.20 (d, 1H), 4.06 (s, 3 Н), 5.03 (d, 1H), 5.60 (d, 1H), 6.36(d, 1H), 6.81 (dd, 1H), 6.89 (dd, 1H), 7.30 (d, 1H), 7.40 (t, 1 Н), 7.45 (d, 1 Н), 8.18 (d, 1H). К 98 мг (0.74 ммоль) хлористого алюминия в 3 мл бензола при 5 С прибавляли 261 мг (2,4-дифтор 3-метоксифенил)[2-(трифторметил)оксиранил]метил-(2-метилхинолин-5-ил)амина в 2 мл бензола. Реакционную смесь перемешивали 16 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 10%) дает 184 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.72 (s, 3 Н), 3.76 (d, 1H), 3.85 (d, 1H), 4.02 (s, 3 Н), 5.42 (d,1H), 5.56 (s, 1H), 6.46-Хлорметил-2,4-дифтор-3-гидрокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанол К 50 мг (0.11 ммоль) -хлорметил-2,4-дифтор-3-метокси[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанола в 4.9 мл дихлорметана при 0 С прибавляли 2.1 мл 1 М раствора трибромида бора в дихлорметане под аргоном. Реакционную смесь перемешивали 16 ч в интервале температур между 0 и 25 С. Реакционную смесь перемешивали при 0 С с насыщенным раствором бикарбоната натрия. После разбавления этилацетатом смеси дали нагреться до комнатной температуры, перемешивали 10 мин и экстрагировали дважды этилацетатом. Объединенные органические экстракты промывали насыщенным раствором NaCl и сушили над сульфатом натрия. Растворитель частично упаривали и остаток пропускали через короткую колонку с силикагелем (этилацетат 100%). Получали 43 мг желаемого соединеня. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.25 (d, 1H), 3.72 (d, 1 Н), 5.45 (s,1H), 6.53 (d, 1H), 6.85 (dd, 1H), 7.13[4-Фтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен выходя из 2.0 г (12,6 ммоль) 5-амино-2 метилхинолина и 1.95 г (13,6 ммоль) 4-фтор-3-метоксибензальдегида в толуоле. К 3.49 г [(4-фтор-3 метоксифенил)метилен]-2-метилхинолин-5-амина в THF прибавляли 2.04 мл литированного 1,1,1 трифторэпоксипропана при -100 С аналогично примеру 9. Обычная обработка и хроматографическая очистка на силикагеле (изопропанол в гексане 10-20%) дают 3.59 г (4-фтор-3-метоксифенил)[2(трифторметил)оксиранил]метилхинолин-5-иламина в виде желтого порошка. 1 Н-ЯМР (CDCl3) =2.63 (m, 1H), 2.77 (s, 3 Н), 3.16 (d, 1H), 3.84 (s, 3 Н), 5.14 (d, 1H), 5.17 (d, 1H), 6.34(d, 1H), 6.92 (ddd, 1H), 6.96 (dd, 1H), 7.06 (dd, 1H), 7.29 (d, 1H), 7.35 (t, 1H), 7.42 (d, 1H), 8.18 (d, 1H). К 98 мг (0.74 ммоль) хлористого алюминия в 3 мл бензола при 5 С прибавляли 250 мг (0.62 ммоль)[4-фтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-(2-метилхинолин-5-ил)амина в 2 мл бен- 16015258 зола. Реакционную смесь перемешивали 16 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 10%) дает 125 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.69 (s, 3 Н), 3.49 (d, 1H), 3.79 (d, 1H), 3.87 (s, 3 Н), 5.09 (d, 1H), 5.78 (d, 1H), 6.43-Хлорметил-4-фтор-3-метокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанол К 50 мг (0.11 ммоль) -хлорметил-4-фтор-3-метокси[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанола в 5.1 мл дихлорметана при -20 С прибавляли 1.9 мл 1 М раствора трибромида бора в дихлорметане под аргоном. Реакционную смесь перемешивали 16 ч в интервале температур между -20 С и 25 С. Реакционную смесь перемешивали при 0 С с насыщенным раствором бикарбоната натрия. После разбавления этилацетатом смеси дали нагреться до комнатной температуры, перемешивали 15 мин и экстрагировали дважды этилацетатом. Объединенные органические экстракты промывали насыщенным раствором NaCl и сушили над сульфатом натрия. Растворитель упаривали и остаток очищали при помощи препаративной тонкослойной хроматографии на силикагеле (ацетон в гексане 50%). Получали 19 мг желаемого соединеня. 1 Н-ЯМР (CD3OD) =2.67 (s, 3 Н), 3.14 (d, 1H), 3.70 (d, 1H), 5.06 (s, 1H), 6.48 (d, 1H), 7.00 (dd, 1H),7.08 (m, 1H), 7.20 (d, 2H), 7.36 (d, 1H), 7.37 (t, 1H), 8.42 (d, 1H). Пример 13.[4-Хлор-2-фтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен из 0.84 г (5.3 ммоль) 5-амино-2 метилхинолина и 1.0 г (5.0 ммоль) 4-хлор-2-фтор-3-метоксибензальдегида в толуоле. 1.35 г [(4-хлор-2 фтор-3-метоксифенил)метилен]-2-метилхинолин-5-амина в THF прибавляли к 0.71 мл литированного 1,1,1-трифторэпоксипропана при -100 С аналогично примеру 9. Обычная обработка и хроматографическая очистка на силикагеле (этилацетат в гексане 10-50%) дают 1.11 г [4-хлор-2-фтор-3 метоксифенил][2-(трифторметил)оксиранил]метилхинолин-5-иламина в виде желтого порошка. 1 Н-ЯМР (CDCl3) =2.63 (m, 1H), 2.74 (s, 3H), 3.21 (d, 1H), 4.02 (s, 3 Н), 5.04 (d, 1H), 5.61 (d, 1H), 6.34(d, 1H), 6.91 (dd, 1H), 7.07 (d, 1H), 7.29 (d, 1H), 7.40 (t, 1H), 7.46 (d, 1H), 8.17 (d, 1H). К 90 мг (0.68 ммоль) хлористого алюминия в 2.8 мл бензола при 5 С прибавляли 250 мг(0.57 ммоль) (4-хлор-2-фтор-3-метоксифенил)[2-(трифторметил)оксиранил]метил-(2-метилхинолин-5 ил)амина в 2 мл бензола. Реакционную смесь перемешивали 4 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 10%) дает 115 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.72 (s, 3 Н), 3.81 (s, 2H), 3.98 (s, 3 Н), 5.45 (d, 1H), 5.56 (d, 1H), 6.46 (d, 1H), 7.12-Бромметил-3,5-дифтор-2-метокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанол К 151 мг (0.57 ммоль) бромида алюминия в 2.3 мл бензола при 5 С прибавляли 200 мг (0.47 ммоль)[3,5-дифтор-2-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в 2 мл бензола. Реакционную смесь перемешивали 3 ч при 25 С и затем выливали в насыщенный раствор гидрокарбоната натрия. Смесь энергично перемешивали, слои разделяли, водный слой дважды экстрагировали этилацетатом. Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 20-50%) дает 44 мг желаемого продукта в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.75 (s, 3 Н), 3.63 (d, 1H), 3.72 (d, 1H), 4.07 (s, 3 Н), 5.51 (d, 1H), 5.56 (d, 1H), 6.42(2,6-Дифторфенил)[2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен из амино-2-метилхинолина и 2,6 дифторобензальдегида в толуоле. К 3.08 г (10.9 ммоль) [(2,6-дифторфенил)метилен]-2-метилхинолин-5 амина в THF прибавляли 1.88 мл (21.8 ммоль) литированного 1,1,1-трифторэпоксипропана при -100 С аналогично примеру 9. Обычная обработка и хроматографическая очистка на силикагеле (этилацетат в гексане 10-50%) дают 3.1 г [2,6-дифторфенил][2-(трифторметил)оксиранил]метилхинолин-5-амин в виде коричневого порошка. 1 Н-ЯМР (CDCl3) =2.72 (s, 3 Н), 2.86 (m, 1H), 3.21 (d, 1H), 5.05 (d, 1H), 5.17 (d, 1H), 5.87 (d, 1H), 6.64[2,4-дифторфенил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 203 мг (0.76 ммоль) бромида алюминия в бензоле. Обычная обработка после 3 ч и хроматография на силикагеле (ацетон в гексане 10-50%) дает 141 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.75 (s, 3 Н), 3.85 (d, 1H), 3.96 (d, 1H), 5.60 (d, 1H), 5.71 (d, 1H), 6.63 (d, 1H), 6.88[4-фтор-3-метоксифенил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 197 мг (0.74 ммоль) бромида алюминия в бензоле. Обычная обработка после 3 ч и хроматография на силикагеле (ацетон в гексане 10-50%) дает 112 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.71 (s, 3H), 3.37 (d, 1H), 3.66 (d, 1H), 3.88 (s, 3 Н), 5.11 (d, 1H), 5.77 (d, 1H), 6.44-Бромметил-2,4-дифтор-3-метокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанол Аналогично примеру 14 261 мг (0.63 ммоль) [2,4-дифторфенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 197 мг (0.76 ммоль) бромида алюминия в бензоле. Обычная обработка после 3 ч и хроматография на силикагеле (изопропанол в гексане 5-20%) дает 121 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.74 (s, 3H), 3.67 (s, 2H), 4.02 (s, 3 Н), 5.45 (d, 1H), 5.58 (d, 1H), 6.46 (d, 1H), 6.86-Бромметил-4-хлор-2-фтор-3-метокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанол Аналогично примеру 14 250 мг (0.57 ммоль) [4-хлор-2-фторфенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 181 мг (0.68 ммоль) бромида алюминия в бензоле. Обычная обработка после 3 ч и хроматография на силикагеле (изопропанол в гексане 10-50%) дает 129 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.74 (s, 3 Н), 3.67 (s, 2H), 4.02 (s, 3 Н), 5.45 (d, 1H), 5.58 (d, 1H), 6.46 (d, 1H), 6.86[2-Фтор-3-метоксифенил][2-(трифторметил)оксиранил]метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен из 2.0 г (12,6 ммоль) 5-аминохинолина и 1.95 г (13,6 ммоль) 2-фтор-2-метоксибензальдегида в толуоле, который взаимодействует с литированным 1,1,1-трифторэпоксипропаном при -100 С. 1 Н-ЯМР (DMSO-d6) =2.92 (m, 1H), 3.29 (d,1H), 3.85 (s, 3 Н), 5.64 (d, 1H), 6.53 (d, 1 Н), 6.59 (d, 1 Н,NH), 7.07-7.23 (m, 3 Н), 7.31 (d, 1H), 7.45 (t, 1H), 7.49 (d, 1H), 8.76 (dm, 1H), 8.83 (dd, 1H).(97 мг,0.25 ммоль) растворяли в DMF (0.5 мл). Прибавляли карбонат цезия (161 мг, 0.5 ммоль), а затем этантиол(75 мкл, 1 ммоль). Смесь интенсивно перемешивали при комнатной температуре в течение 90 мин. Реакционную смесь распределяли между диэтиловым эфиром и водой. Органический слой промывали дважды водой и затем рассолом и упаривали. Остаток растворяли в хлористом метилене, фильтровали через стекловолокно для удаления остаточного NaCl и снова упаривали. Сырой продукт растворяли в хлористом метилене и флеш-хроматографировали на колонке с силикагелем, используя градиент гептан-этилацетат(1090% этилацетата) и получали желаемый продукт (60 мг, 53%) в виде аморфного порошка. 1 Н-ЯМР (DMSO-d6) =1.09 (t, 3 Н), 2.47 (dd, 1H), 2.93 (d, 1H), 3.82, (s, 3 Н), 5.43 (d, 1 Н), 6.39 (d, 1 Н,NH), 6.47 (d, 1H), 7.04-7.12 (m, 3 Н, incl. ОН), 7.24 (d, 1 Н), 7.30 (m, 1H), 7.45 (t, 1H), 7.50 (dd, 1H), 8.55 (d,1H), 8.83 (dd, 1H). 19(100 мг,0.25 ммоль) растворяли в DMF (0.5 мл). Прибавляли карбонат цезия (136 мг, 0.4 ммоль), а затем 1 Нимидазол-2-тиол (98 мг, 0.5 ммоль). Смесь перемешивали в течение 90 мин и затем распределяли между этилацетатом и водой. Органический слой промывали водой, затем рассолом и затем упаривали. Флэшхроматография с применением SiO2 и градиента гептан-этилацетат (1090% этилацетата) дает слегка грязный желаемый продукт (113 мг). Часть вещества (75 мг) подвергли препаративной HPLC (RP С-18 колонка, градиент CH3CN/Вода, 0.1% трифторуксусной кислоты), и последующая лиофилизация дает чистое, аморфное желаемое соединение в виде дитрифторуксусно-кислой соли в виде отдельного диастереомера (77 мг, 55%). 1 Н-ЯМР (DMSO-d6, с добавлением D2O) =3.42 (d, 1H), 3.72 (d, 1H), 3.81 (s, 3 Н), 5.40 (s, 1 Н), 6.62,(d, 1 Н), 7.07 (s, 1 Н), 7.09 (m, 1 Н), 7.26 (m, 2 Н), 7.38 (d, 1 Н), 7.46 (s, 2 Н), 7.75 (t, 1 Н), 7.85 (d, 1 Н), 9.08 (dd,1 Н), 9.20 (m, 1 Н). 19(0.5 мл). Прибавляли карбонат цезия (135 мг, 0.4 ммоль) и 1 Н-имидазол-2-тиол (100 мг, 0.5 ммоль), смесь перемешивали в течение 90 мин при комнатной температуре и затем распределяли между этилацетатом и водой. Органический слой промывали водой, затем рассолом и затем упаривали, получая чистое желаемое соединение в виде белого аморфного порошка (диастереомерная смесь, соотношение 1:3.3). 1 Н-ЯМР (DMSO-d6) =3.19 (d, 1H), 3.49 (d, 0.77H), 3.82 (d, 0.23H), 4.86 (d, 1H), 5.95 (d, 0.77H, NH),6.14 (d, 0.23H, NH), 6.48 (t, 1H), 6.59-6.67 (m, 2H), 6.88-7.02 (m, 3H), 7.04-7.31 (m, 4H), 7.49 (t, 1H), 8.48 (d,1H), 8.43 (s, 0.77H), 8.54 (s, 0.23H), 12.44 (s, 1H). 19-[(Имидазол-2-ил)сульфанил]метил(фениламино)(трифторметил)бензолэтанола (диастереомерная смесь 1:3.3, 50 мг, 0.13 ммоль) растворяли в этилацетате (10 мл). Прибавляли насыщенный водный гидрокарбонат натрия (2.4 мл), а затем м-хлорнадбензойную кислоту (74%, 70 мг, 0.3 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч и затем прибавляли диметилсульфид (100 мкл). Перемешивание продолжали еще несколько мин и затем слои разделяли. Органический слой промывали дважды водой, рассолом и затем упаривали. Флэш-хроматография (SiO2, градиент гептан-этилацетат) дает чистое желаемое соединение в виде бледно-желтого порошка (45 мг, 83%, диастереомерное соотношение 1:3.3).-[(Этилсульфанил)метил]-2-фтор-3-метокси[(хинолин-5-ил)амино](трифторметил)бензолэтанол (36 мг, 0.08 ммоль) растворяли в этилацетате (15 мл). Прибавляли насыщенный водный гидрокарбонат натрия (2.5 мл), а затем м-хлорнадбензойную кислоту (74%, 51 мг, 0.22 ммоль). Смесь перемешивали при комнатной температуре в течение 2.5 ч и прибавляли диметилсульфид (100 мкл). Перемешивание продолжали в течение 20 мин и затем слои разделяли. Органический слой промывали дважды водой,рассолом и затем упаривали. Флэш-хроматография (SiO2, градиент гептан-этилацетат) и лиофилизация из диоксана дает желаемое соединение в виде отдельного диастереомера (15 мг, 39%). 1 Н-ЯМР (DMSO-d6) =1.24 (t, 3 Н), 3.72 (s, 2H), 3.83 (s, 3 Н), 5.52 (d, 1H), 6.36 (d, 1H), 6.79 (d, 1H),7.06-7.16 (m, 2H), 7.21 (dd, 1H), 7.28 (d, 1H), 7.46 (t, 1 Н), 7.55 (dd, 1H), 7.62 (s, 1H), 8.68 (d, 1H), 8.86 (dd,1H). 1 Н-ЯМР (DMSO-d6),c добавлением D2O) =5=1.19 (t, 3 Н), 3.29 (m, 2H), 3.67 (s, 2H), 3.83 (s, 3 Н), 5.53(10 мл). Прибавляли насыщенный водный гидрокарбонат натрия (2.5 мл) и смесь охлаждали до 0 С. Прибавляли м-хлорнадбензойную кислоту (74%, 35 мг, 0.15 ммоль) и смесь перемешивали при 0 С 1 ч и затем прибавляли диметилсульфид (100 мкл). Охлаждающую баню удаляли и перемешивание продолжали дополнительно 10 мин. Прибавляли этилацетат и слои разделяли. Органический слой промывали дважды водой, рассолом и затем упаривали. Флэш-хроматография (SiO2, градиент гептан-этилацетат) и лиофилизация из диоксана дает желаемое соединение в виде отдельного диастереомера (24 мг, 63%). 1 Н-ЯМР (DMSO-d6) =3.83 (s, 3 Н), 3.86 (d, 1H), 4.27 (d, 1H), 5.45 (d, 1H), 6.37 (d, 1 Н), 6.40 (d, 1 Н,NH), 7.03-7.14 (m, 2 Н), 7.15-7.59 (7 Н), 8.71 (d, 1H), 8.85 (dd, 1H), 13.74 (s, 1H, имидазол NH). 19-[(Этилсульфанил)метил][(фенил)амино](трифторметил)бензолэтанол (46 мг, 0.13 ммоль,диастереомерная смесь, соотношение 1:5) растворяли в этилацетате (10 мл). Прибавляли насыщенный водный гидрокарбонат натрия (2.5 мл) и затем м-хлорнадбензойную кислоту (74%, 70 мг, 0.3 ммоль). После перемешивания в течение 70 мин при комнатной температуре, прибавляли дополнительное количество м-хлорнадбензойной кислоты (10 мг) и смесь дополнительно перемешивали 10 мин. Прибавляли диметилсульфид (100 мкл) и перемешивание продолжали еще 5 мин. Слои разделяли и органический слой промывали дважды водой, рассолом и затем упаривали. Флэш-хроматография (SiO2, градиент гептан-этилацетат) дает желаемое соединение в виде диастереомерной смеси (19 мг, 38%, диастереомерное соотношение 1:5). 1 Н-ЯМР (DMSO-d6) =1.03 (t, 0.5H), 1.12 (t, 2.5H), 3.01-3.22 (m, 3H), 3.64 (d, 0.84H), 4.01 (d, 0.16H),5.12 (d, 0.16H), 5.22 (d, 0.84H), 6.07 (d, 0.16H), 6.13 (d, 0.84H), 6.46-6.56 (m, 1H), 6.58-6.68 (m, 2H), 6.967.05 (m, 3H), 7.20-7.37 (m, 3H), 7.49 (d, 0.3H), 7.57 (d, 1.7H). 19 2,4-Дифтор[(имидазол-2-ил)сульфанил]метил-3-метокси[(хинолин-5-ил)амино]-(трифторметил)бензолэтанол 200 мг (0.47 ммоль) [2,4-дифтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-2-хинолин 5-амина (пример 9) растворяли в 2.0 мл DMF. Прибавляли 307 мг (0.94 ммоль) карбоната цезия, а затем 189 мг (1.89 ммоль) 2-меркаптоимидазола. Смесь энергично перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь распределяли между этилацетатом и водой. Органический слой промывали водой и рассолом и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 10-50%) дает 132 мг желаемого соединения в виде одного отдельного диастереомера. 1 Н-ЯМР (CDCl3) =2.71 (s, 3 Н), 3.24 (d, 1H), 3.43 (d, 1H), 4.00 (s, 3 Н), 5.30 (d, 1H), 5.95 (d, 1H), 6.32(0.06 ммоль) 2,4-дифтор[(имидазол-2-ил)сульфанил]метил-3-метокси[(2 метилхинолин-5-ил)амино](трифторметил)бензолэтанола растворяли в 6 мл этилацетата, после чего прибавляли 1.5 мл насыщенного водного гидрокарбоната натрия, а затем 32 мг (0.14 ммоль) мхлорнадбензойной кислоты. Двухфазную смесь интенсивно перемешивали 1 ч при комнатной температуре. Реакцию разбавляли водой, слои разделяли и органический слой промывали водой и рассолом. После упаривания остаток очищали при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат/гексан/метанол 4:4:1), получив 3 мг желаемого сульфона в виде аморфного порошка. 1 Н-ЯМР (CD3OD) =2.67 (s, 3 Н), 3.93 (d, 1H), 3.93 (s, 3 Н), 5.50 (s, 1H), 6.30 (d, 1H), 6.93 (dd, 1H),7.28 (s, 1H), 7.38 (t, 1H), 7.42 (d, 1H), 7.52 (dd, 1H), 7.88 (d, 1H), 7.94 (s, 1H), 8.65 (d, 1H). 2,4-Дифтор[(1,2,4-триазол-3-ил)сульфанил]метил-3-метоксихинолин-5-ил)амино)-(трифторметил)бензолэтанол 200 мг (0.47 ммоль) [2,4-дифтор-3-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина (пример 9) растворяли в 2.0 мл DMF. Прибавляли 307 мг (0.94 ммоль) карбоната цезия,а затем 190 мг (1.89 ммоль) 3-меркапто-1,2,4-триазола. Смесь энергично перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь распределяли между этилацетатом и водой. Органический слой промывали водой и рассолом и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 10-50%) дает 66 мг желаемого соединения в виде одного отдельного диастереомера. 1 Н-ЯМР (DMSO d6) =2.57 (s, 3 Н), 3.35 (d, 1H), 3.67 (d, 1H), 3.81 (s, 3 Н), 5.31 (d, 1H), 6.29 (d, 1H),6.33 (d, 1H), 7.06 (dd, 1H), 7.14 (d, 1H), 7.35 (d, 1H), 7.36 (t, 1H), 8.38 (s, 1H), 8.45 (d, 1H). Пример 29. 2,4-Дифтор-3-метокси[(1,2,4-триазол-3-ил)сульфанил]метилил[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанол 50 мг (0.09 ммоль) 2,4-дифтор[(1,2,4-триазол-3-ил)сульфанил]метил-3-метокси[(2 метилхинолин-5-ил)амино](трифторметил)бензолэтанола растворяли в 10 мл этилацетата, после чего прибавляли 2.5 мл насыщенного водного гидрокарбоната натрия, а затем 53 мг (0.24 ммоль) мхлорнадбензойной кислоты. Двухфазную смесь интенсивно перемешивали 1 ч при комнатной температуре. Реакцию разбавляли водой, слои разделяли и органический слой промывали водой и рассолом. После упаривания остаток очищали при помощи препаративной тонкослойной хроматографии на силикагеле (метанол в дихлорметане 10% ) и получали 6 мг желаемого сульфона в виде аморфного порошка. 1 Н-ЯМР (CD3OD) =2.66 (s, 3 Н), 3.86 (d, 1H), 3.92 (s, 3 Н), 3.95 (d, 1H), 5.51 (s, 1 Н), 6.36 (d, 1H), 6.92(2-Метоксифенил)[2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин К 1.74 г (11 ммоль) 5-амино-2-метилхинолина и 1.33 мл (11 ммоль) 2-метоксибензальдегида в 33 мл толуола прибавляли 50 мкл уксусной кислоты и 2 г молекулярных сит. Смесь нагревали в течение 2 ч при кипении и после охлаждения фильтровали через цеолиты. Растворитель упаривали и остаток дважды азеотропно упаривали с небольшими порциями толуола. Получали 3.6 г [1-(2-метоксифенил)метилиден](2-метилхинолин-5-ил)амина в виде желтого масла. 2.25 мл (26 ммоль) 1,1,1-трифторэпоксипропана в 38 мл THF и 11 мл гексана охлаждали до -100 С и прибавляли 15 мл 1,6 М раствора н-бутиллития в гексане в течение 1 ч, в то время как температура не превышала -95 С. Через 10 мин после полного прибавления прибавляли 3.6 г (11 ммоль) сырого [1-(2-метоксифенил)метилиден]-(2-метилхинолин-5-ил)амина в 49 мл THF в течение 1 ч, в то время как температура не превышала -95 С. Через 1 ч при -100 С прибав- 23015258 ляли 12 мл диэтилового эфира и реакционную смесь нагревали до -10 С в течение 1 ч. Реакцию останавливали прибавлением насыщенного раствора хлорида аммония. Слои разделяли и водный слой дважды экстрагировали диэтиловым эфиром, объединенные органические фазы промывали рассолом, сушили над сульфатом натрия и затем упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 0-30%) дает 4.27 г (2-метоксифенил)[2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в виде смеси диастереомеров. Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.38 (m, 1H), 2.74 (s, 3H), 3.09 (d, 1 Н), 3.95 (s, 3H), 5.15 (d, 1H), 5.74 (d, 1H), 6.31(2.68 ммоль) 2-меркаптоимидазола. Смесь энергично перемешивали при комнатной температуре в течение 1.5 ч. Реакционную смесь распределяли между этилацетатом и водой. Органический слой промывали водой и рассолом и упаривали. Флэш-хроматография на силикагеле (ацетон в гексане 0-65%) дает 286 мг желаемого соединения в виде смеси диастереомеров, которая может быть разделена при помощи тонкослойной хроматографии на силикагеле (этилацетат). Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.56 (s, 3 Н), 3.22 (s, 2H), 3.89 (s, 3 Н), 5.40 (d, 1H), 6.21 (d, 1H), 6.37 (d, 1H), 6.83-[(Имидазол-2-ил)сульфанил]метил-3-гидрокси[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанол Аналогично примеру 10 266 мг (0.54 ммоль) -[(имидазол-2-ил)сульфанил]метил-3-метокси-[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанола в 22 мл дихлорметана обрабатывали 4.3 мл 1 М раствора трибромида бора в дихлорметане при -30 С. Обычная обработка через 21 ч при комнатной температуре и хроматография на силикагеле (этилацетат 100%) дает 78 мг и 16 мг двух диастереомеров. Диастереомер 1. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.35 (s, 2H), 5.44 (s, 1 Н), 6.41 (d, 1H), 6.72 (t, 1H), 6.79 (d, 1H) 6.93 3-Метокси[(2-метилхинолин-5-ил)амино)[(1,2,4-триазол-3-ил)сульфанил]метил-(трифторметил)бензолэтанол Аналогично примеру 30 257 мг (0.66 ммоль) [2-метоксифенил][2-(трифторметил)оксиранил]- 24015258 метил-2-метилхинолин-5-амина взаимодействует с 3-меркапто-1,2,4-триазолом в присутствии 431 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч и хроматография на силикагеле (ацетон в гексане 0-75%) дает 293 мг желаемого соединения в виде смеси двух диастереомеров. Основной диастереомер может быть очищен при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат). 1 Н-ЯМР (DMSO d6) =2.56 (s, 3 Н), 3.22 (d, 1H), 3.49 (d, 1H), 3.86 (s, 3 Н), 5.48 (d, 1H), 6.30 (d, 1H),6.33 (d, 1H), 6.84 (t, 1H), 7.00 (d, 1H), 7.07 (d, 1H), 7.21-7.35 (m, 4H), 7.56 (d, 1H), 8.46 (d, 1H). Пример 33. 3-Гидрокси[(2-метилхинолин-5-ил)амино][(1,2,4-триазол-3-ил)сульфанил]метил-(трифторметил)бензолэтанол Аналогично примеру 10 271 мг (0.55 ммоль) 3-метокси[(хинолин-5-ил)амино][(1,2,4-триазол 3-ил)сульфанил]метил(трифторметил)бензолэтанола в 22 мл дихлорметана обрабатывали 4.4 мл 1 М раствора трибромида бора в дихлорметане при -30 С. Обычная обработка через 22 ч при комнатной температуре и хроматография на силикагеле (метанол в дихлорметане 10%) дает 14 мг основного диастереомера. 1 Н-ЯМР (CD3OD) =2.70 (s, 3 Н), 3.57 (d, 1H), 3.66 (d, 1H), 5.53 (s, 1H), 6.49 (d, 1H), 6.78 (t, 1H), 6.85 3-Метокси[(1-метилимидазол-2-ил)сульфанил]метил[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанол Аналогично примеру 30 264 мг (0.68 ммоль) [2-метоксифенил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 310 мг (2.7 ммоль) 2-меркапто-1 метилиндазола в присутствии 443 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч и хроматография на силикагеле (ацетон в гексане 0-65%) дает 294 мг желаемого соединения в виде смеси двух диастереомеров, которая может быть очищена при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат). Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.73 (s, 3 Н), 3.18 (d, 1H), 3.33 (d, 1 Н), 3.48 (s, 3 Н), 3.99 (s, 3 Н), 5.45 (d, 1 Н), 6.23 3-Гидрокси[(имидазол-2-ил)сульфанил]метил[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанол Аналогично примеру 10 271 мг (0.55 ммоль) 3-метокси[(хинолин-5-ил)амино][(1 метилиндазол-2-ил)сульфанил]метил(трифторметил)бензолэтанола в 22 мл дихлорметана обрабатывали 4.4 мл 1 М раствора трибромида бора в дихлорметане при -30 С. Обычная обработка через 5 ч при комнатной температуре дает количественно желаемое соединение в виде смеси двух диастереомеров,которая может быть разделена при помощи препаративной тонкослойной хроматографии на силикагеле[1,3-Бензодиоксо-4-ил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен из 1.08 г (6.8 ммоль) 5-амино-2 метилхинолина и 1.02 г (6.8 ммоль) 4-формил-1,3-бензодиоксола в толуоле. 1.9 г [(1,3-бензодиоксол-4 ил)метилен]-2-метилхинолин-5-амина в THF прибавляли к 1.14 мл (13.2 ммоль) литированного 1,1,1 трифторэпоксипропана при -100 С аналогично примеру 9. Обычная обработка и хроматографическая очистка на силикагеле (ацетон в гексане 10-50%) дают 2.32 г [1,3-бензодиоксол-4-ил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в виде смеси двух диастереомеров. Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.73 (s, 3 Н), 2.79 (m, 1H), 3.17 (d, 1 Н), 5.09 (d, 1 Н), 5.44 (d, 1H), 5.97 (s, 1H), 6.03(s, 1H), 6.61 (d, 1H), 6.78 (m, 2H), 7.04 (d, 1H), 7.24 (d, 1H), 7.40 (t, 1H), 7.47 (d, 1H), 8.05 (d, 1H). Аналогично примеру 30 203 мг (0.50 ммоль) [1,3-бензодиоксол-4-ил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин взаимодействует с 202 мг (2.0 ммоль) 2-меркаптоиндазола в присутствии 329 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч и хроматография на силикагеле (ацетон в гексане 0-50%) дает 294 мг желаемого соединения в виде смеси двух диастереомеров. Основной диастереомер может быть очищен при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат). 1 Н-ЯМР (CDCl3) =2.74 (s, 3 Н), 3.43 (s, 2H), 5.16 (d, 1H), 5.89 (s, 1H), 5.98 (s, 1H), 5.99 (d, 1H), 6.42[2,4-дифтор-3-метоксифенил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 211 мг (1.9 ммоль) 2 меркаптопиримидина в присутствии 307 мг карбоната цезия в DMF. Обычная обработка через 4 ч и хроматография на силикагеле (ацетон в гексане 0-50%) дает 179 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.69 (d, 1H), 3.80 (d, 1H), 3.86 (s, 3 Н), 5.41 (s, 1H), 6.40 (d, 1H), 6.88 2,4-Дифтор[(пиримидин-2-ил)сульфанил]метил-3-гидрокси(2-метилхинолин-5-ил)амино-(трифторметил)бензолэтанол Аналогично примеру 10 59 мг 2,4-дифтор[(пиримидин-2-ил)сульфанил]метил-3-метокси[(2 метилхинолин-5-ил)амино](трифторметил)бензолэтанола в 5 мл дихлорметана обрабатывали 4.4 мл 1 М раствора трибромида бора в дихлорметане при -30 С. Обычная обработка через 22 ч при комнатной температуре и хроматография на силикагеле (ацетон в гексане 10-50%) дает 44 мг желаемого продукта. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.69 (d, 1H), 3.78 (d, 1 Н), 5.38 (s, 1H), 6.41 (d, 1H), 6.80 (dd, 1H),7.06 (t, 1H), 7.10 (dd, 1H), 7.21 (d, 1H), 7.35 (d,1H), 7.37 (t, 1H), 8.39 (d, 1H), 7.41 (d, 2H). Пример 39.[1,3-бензодиоксол-4-ил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 234 мг (2.1 ммоль) 2 меркапто-1-метилиндазол в присутствии 334 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч дает 230 мг сырого желаемого соединения в виде смеси двух диастереомеров. Основной диастереомер может быть очищен при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат). 1 Н-ЯМР (CDCl3) =2.74 (s, 3 Н), 3.42 (s, 2H), 3.54 (s, 3 Н), 5.13 (d, 1H), 5.92 (s, 1H), 6.00 (s, 1H), 6.01[2,4-дифтор-3-метоксифенил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 215 мг (1.9 ммоль) 2 меркапто-1-метилиндазола в присутствии 307 мг карбоната цезия в DMF. Обычная обработка через 4 ч и хроматография на силикагеле (ацетон в гексане 0-50%) дает 132 мг желаемого соединения в виде отдельного диастереомера. 1 Н-ЯМР (CD3OD) =2.65 (s, 3 Н), 3.38 (d, 1H), 3.50 (d, 1H), 3.57 (s, 1H), 3.92 (s, 3H), 5.34 (s, 1H), 6.38 2,4-Дифтор-3-гидрокси[(1-метилимидазол-2-ил)сульфанил]метил-3-[(2-метилхинолин-5-ил)амино]-(трифторметил)бензолэтанол Аналогично примеру 10 39 мг 2,4-дифтор[(1-метилимидазол-2-ил)сульфанил]метил-3 метокси[(2-метилхинолин-5-ил)амино](трифторметил)бензолэтанола в 3.5 мл дихлорметана обрабатывали 0.7 мл 1 М раствора трибромида бора в дихлорметане при -10 С. Обычная обработка через 22 ч при комнатной температуре и препаративная тонкослойная хроматография на силикагеле (ацетон в гексане 50%) дает 4 мг желаемого продукта. 1 Н-ЯМР (CD3OD) =2.66 (s, 3 Н), 3.35 (d, 1H), 3.45 (d, 1H), 3.58 (s, 1H), 5.30 (s, 1H), 6.38 (d, 1H), 6.80[1,3-бензодиоксол-4-ил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 210 мг (2.1 ммоль) 3 меркапто-1,2,4-триазола в присутствии 338 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч дает 250 мг сырого желаемого соединения в виде смеси двух диастереомеров. Основной диастереомер может быть очищен при помощи препаративной тонкослойной хроматографии на силикагеле (этилацетат). 1 Н-ЯМР (DMSO d6) =2.57 (s, 3 Н), 3.35 (d, 1H), 3.69 (d, 1H), 5.16 (d, 1H), 5.78 (s, 1H), 6.06 (s, 1H),- 28015258 6.24 (d, 1H), 6.40 (d, 1H), 6.72 (t, 1H), 6.77 (d, 1H), 7.10 (d, 1H), 7.12 (d, 1H), 7.34 (t, 1H), 7.35 (d, 1H), 8.39[Бензо-2,3-дигидрофуран-7-ил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амин Аналогично примеру 9 соответствующий имин получен из 1.05 г (6.6 ммоль) 5-амино-2 метилхинолина и 0.98 г (6.6 ммоль) 7-формилбензо-2,3-дигидрофурана в толуоле. 1.85 г (6.4 ммоль)(13.2 ммоль) литированного 1,1,1-трифторэпоксипропана при -100 С аналогично примеру 9. Обычная обработка и хроматографическая очистка на силикагеле (ацетон в гексане 10-50%) дают 2.37 г [бензо 2,3-дигидрофуран-7-ил][2-(трифторметил)оксиранил]метил-2-метилхинолин-5-амина в виде смеси двух диастереомеров. Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.70 (m, 1H), 2.72 (s, 3H), 3.12 (d, 1 Н), 3.24 (m, 2H), 4.63 (ddd, 1H), 4.69 (ddd, 1H),5.21 (d, 1H), 5.50 (d, 1H), 6.48 (m, 1H), 6.76 (t, 1H), 7.00 (d, 1 Н), 7.14 (d, 1H), 7.26 (d, 1H), 7.41 (m, 2H), 8.18[1,3-бензо-2,3-дигидро-7-ил][2(трифторметил)оксиранил]метил-2-метилхинолин-5-амина взаимодействует с 232 мг (2.0 ммоль) 2 меркапто-1-метилиндазола в присутствии 332 мг карбоната цезия в DMF. Обычная обработка через 1.5 ч дает 220 мг сырого желаемого соединения в виде смеси двух диастереомеров. Диастереомеры могут быть разделены при помощи тонкослойной хроматографии на силикагеле (этилацетат). Диастереомер 1. 1 Н-ЯМР (CDCl3) =2.73 (s, 3 Н), 3.23 (t, 2H), 3.51 (s, 3 Н), 4.60 (ddd, 1H), 4.68 (ddd, 1H), 5.18 (d, 1H),6.17 (d, 1H), 6.37 (d, 1H), 6.76 (t, 1 Н), 6.82 (s, 1H), 6.93 (s, 1H), 7.09 (d, 1H), 7.24 (d, 1H), 7.30 (d, 1H), 7.36-[(2-Метилхинолин-5-ил)амино]фенил(трифторметил)бензолэтанол 484 мг (2 ммоль) диэтил(фенилоксометил)фосфоната и 2,2,2-трифторацетофенона перемешивали в 3 мл DMF вместе с 14 мг (0.22 ммоль) цианида калия в течение 3 ч (Demir et al. J. Org. Chem. 2005, 70,10584-87). Непосредственная хроматографическая очистка на силикагеле (этилацетат в гексане 33%) дает 580 мг (1-бензоил-2,2,2-трифтор-1-фенилэтил)диэтиловый эфир фосфорной кислоты. 250 мг (0.6 ммоль) эфира фосфорной кислоты перемешивали 18 ч в 10 мл диэтиламина и 1 мл воды. Упаривание и флэшхроматография на силикагеле (этилацетат в гексане 33%) дают 80 мг 3,3,3-трифтор-2-гидрокси-1,2 дифенилпропан-1-она. 80 мг (0.29 ммоль) 3,3,3-трифтор-2-гидрокси-1,2-дифенилпропан-1-она, 0.2 мл
МПК / Метки
МПК: C07D 405/12, C07C 215/16, C07D 215/38, C07C 217/78, A61K 31/136, C07D 401/12, C07D 405/14
Метки: способ, противовоспалительных, качестве, применение, получения, средств, бензиламины
Код ссылки
<a href="https://eas.patents.su/30-15258-benzilaminy-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-protivovospalitelnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Бензиламины, способ их получения и их применение в качестве противовоспалительных средств</a>
Предыдущий патент: Аминопроизводные андростанов и андростенов как лекарственные средства против сердечно-сосудистых нарушений
Следующий патент: Оптическое сигнальное устройство
Случайный патент: Прессованная жевательная резинка