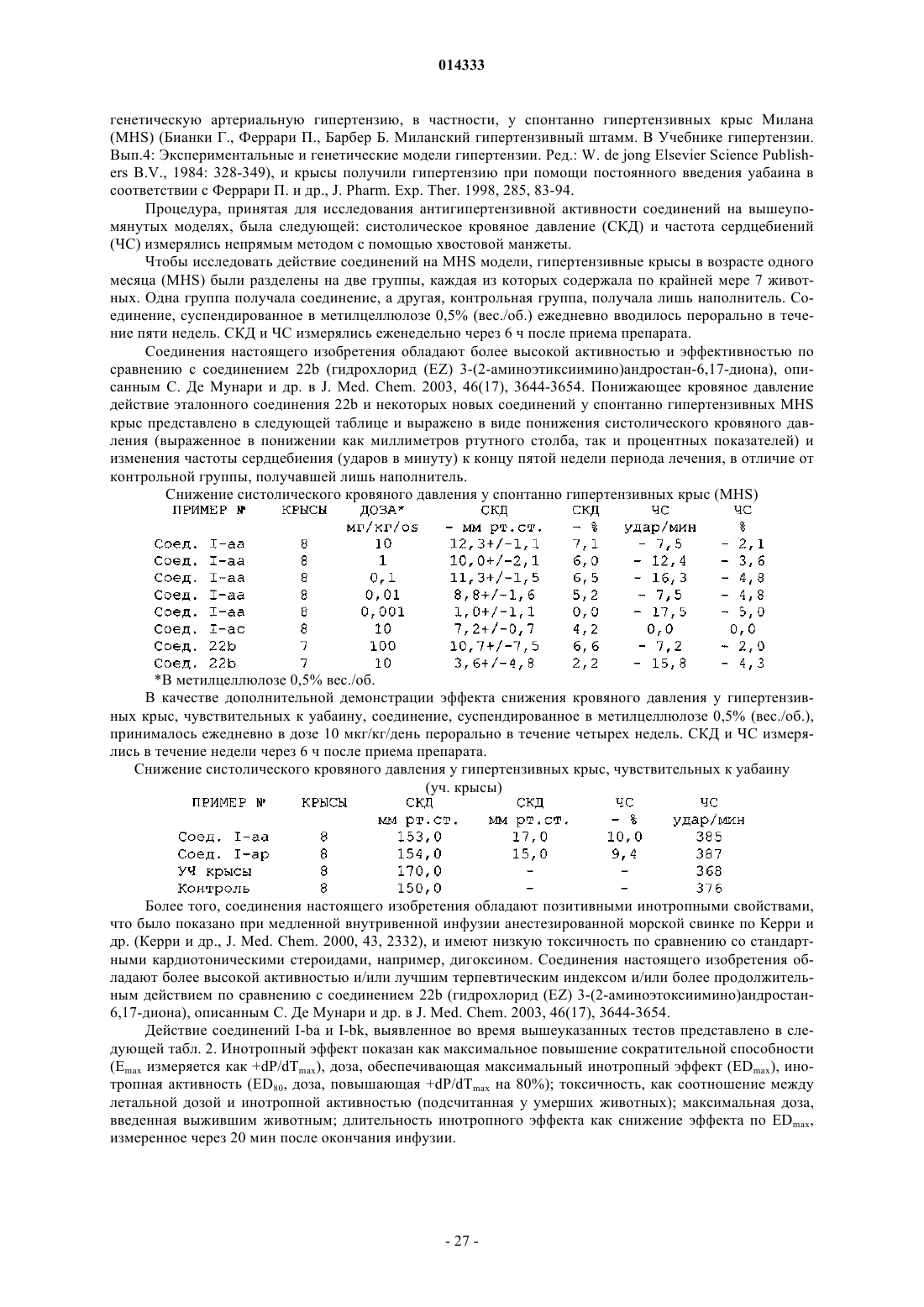
Аминопроизводные в-гомоандростанов и в-гетероандростанов
Номер патента: 14333
Опубликовано: 29.10.2010
Авторы: Черри Альберто, Джакалоне Джузеппе, Феррари Патриция, Ферранди Мара, Дзаппавинья Мария Пия, Бьянки Джузеппе, Карцана Джулио, Моро Барбара, Банфи Леонардо, Торри Мако
Формула / Реферат
1. Соединение общей формулы (I)
где А является двухвалентной группой, выбранной из
![]() ,
,
где символы ![]() означают a или b одинарные связи, связывающие группу А с андростановым скелетом в положении 5 или 8;
означают a или b одинарные связи, связывающие группу А с андростановым скелетом в положении 5 или 8;
В является кислородом или NR4;
R3 является Н или C1-C6-алкильной группой;
X является кислородом, серой или NOR5;
R4 является Н, C1-С6-алкильной группой или формилом или,
когда А является ![]() или
или ![]() , R4также является формилом;
, R4также является формилом;
R5 является Н или C1-С6-алкильной группой;
R1 является Н, C1-С6-алкильной группой или C2-С6-ацильной группой,
где связь ![]() в положении 17 андростанового скелета является одинарной связью; или
в положении 17 андростанового скелета является одинарной связью; или
R1 не присутствует, когда связь ![]() в положении 17 является двойной связью;
в положении 17 является двойной связью;
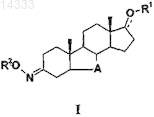
R2 представляет собой DNR6R7или группу
в которой группы D или Z связаны с атомом кислорода;
D является прямым или разветвленным С2-С6-алкиленом или С3-С6-циклоалкиленом, необязательно содержащим фенильное кольцо;
R и R7, которые одинаковы или различны, являются Н, C1-С6-алкилом, фенил-С1-С4-алкилом;
или один из R6 и R7представляет собой С(=NR9)NHR10, а другой Н; или
R6 и R7, которые одинаковы или различны, являются Н, C1-С6-алкилом, фенил-C1-С4-алкилом;
или один из R6 и R7представляет собой С(=NR9)NHR10, a другой Н; или
R6 и R7, взятые вместе с атомом азота, с которым они соединены, формируют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6-членное кольцо, необязательно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот;
R6 и R7 необязательно замещены одной или несколькими гидрокси-, метокси-, этоксигруппами;
R8 является Н, прямым или разветвленным C1-С6-алкилом, необязательно замещенным одной или более гидрокси, метокси, этокси или C(=NR9)NHR10;
R9 и R10, которые одинаковы или различны, являются Н, линейной или разветвленной C1-С6-алкильной группой; или
R9 и R10, взятые вместе с атомом азота и гуанидиновым атомом углерода, формируют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 5- или 6-членное кольцо, необязательно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот;
Z является прямым или разветвленным С1-С4-алкиленом или одинарной связью;
Y является СН2, кислородом, серой или NR11;
R11 является Н или C1-С6-алкильной группой;
n означает 0, или 1, или 2, или 3;
m означает 0, или 1, или 2, или 3;
символ ![]() в положении 17 независимо является одинарной или двойной связью, и, если это одинарная экзоциклическая связь в положении 17, то это a или b одинарная связь.
в положении 17 независимо является одинарной или двойной связью, и, если это одинарная экзоциклическая связь в положении 17, то это a или b одинарная связь.
2. Соединение по п.1, где А выбрано из ![]()
![]() и
и ![]() .
.
3. Соединение по п.1 или 2, где R6 и R7, которые являются одинаковыми или различными, выбраны из Н и C1-С6-алкила.
4. Соединение по любому из предыдущих пунктов, которое выбрано из группы, состоящей из
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7а-гомоандростан-7,17-диона;
фумарата (E,Z) 3-(3-N-метиламинопропоксиимино)-6-аза-7а-гомоандростан-7,17-диона;
фумарата (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7а-гомо-7-тиоксоандростан-17-она;
дигидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7а-гомоандростан-17-она;
дигидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7а-гомоандростан-17-она;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-6-формил-7а-гомоандростан-17-она;
гидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-6-формил-7а-гомоандростан-17-она;
гидрохлорида 3- (Е,Z)-(2-аминоэтоксиимино)-6-аза-7а-гомо-7-(Z)-гидроксииминоандростан-17-она;
гидрохлорида 3-(Е,Z)-(3-N-метиламинопропоксиимино)-6-аза-7а-гомо-7-(Z)-гидроксииминоандростан-17-она;
гидрохлорида 3-(Е,Z)-[3-(R)-пирролидинил]оксиимино-6-аза-7а-гомо-7-(Z)-гидроксииминоандростан-17-она;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7а-гомо-7-(Z)-метоксииминоандростан-17-она;
гидрохлорида 3-(Е,Z)-[3-(R)-пирролидинил]оксиимино-6-аза-7а-гомо-7-(Z)-метоксииминоандростан-17-она;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7а-аза-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-(3-N-метиламинопропоксиимино)-7а-аза-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7а-аза-7а-гомоандростан-7,17-диона;
дифумарата (E,Z) 3-(2-аминоэтоксиимино)-7а-аза-7а-гомоандростан-17-она;
дифумарата (E,Z) 3-(3-N-метиламинопропоксиимино)-7а-аза-7а-гомоандростан-17-она;
дифумарата (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7а-аза-7а-гомоандростан-17-она;
гидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7а-аза-7а-формил-7а-гомоандростан-17-она;
фумарата (E,Z) 3-(2-аминоэтоксиимино)-6-окса-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7-окса-7а-гомоандростан-6,17-диона;
гидрохлорида (Е,Z)-3-(3-N-метиламинопропоксиимино)-7-окса-7а-гомоандростан-6,17-диона;
гидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7-окса-7а-гомоандростан-6,17-диона;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7а-окса-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-(3-N-метиламинопропоксиимино)-7а-окса-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7а-окса-7а-гомоандростан-7,17-диона;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-окса-5b-андростан-7,17-диона;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-В-гомоандростан-17-она;
гидрохлорида (Е,Z)-3-[3-(R)-пирролидинил]оксиимино-В-гомоандростан-17-она;
фумарата (Е,Z)-3-(3-N-метиламинопропоксиимино)-6-окса-7а-гомоандростан-7,17-диона;
фумарата (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-окса-7а-гомоандростан-7,17-диона;
гидрохлорида (Е,Z)-3-(2-аминоэтоксиимино)-6-окса-7а-гомоандростан-17-она;
гидрохлорида (Е,Z)-3-(2-аминоэтоксиимино)-7а-окса-7а-гомоандростан-17-она;
гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-азаандростан-7,17-диона;
фумарата (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-азаандростан-7,17-диона;
фумарата (Е) 3-(2-аминоэтоксиимино)-6-аза-7а-гомоандростан-7,17-диона и
фумарата (Z) 3-(2-аминоэтоксиимино)-6-аза-7а-гомоандростан-7,17-диона.
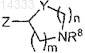
5. Способ получения соединения по любому из пп.1-4, включающий взаимодействие соединения общей формулы (II)
где символы A, R1 и ![]() имеют значения, определенные в п.1,
имеют значения, определенные в п.1,
с соединением общей формулы (III)
![]()
где R2имеет значение, определенное в п.1, причем взаимодействие проводят в полярном растворителе при температуре от 0°С до температуры кипения с обратным холодильником.
6. Применение соединения по любому из пп.1-4 для получения лекарственного средства.
7. Применение по п.6, где лекарственное средство применяется для лечения сердечно-сосудистого заболевания.
8. Применение по п.7, где сердечно-сосудистым заболеванием является сердечная недостаточность и/или гипертензия.
9. Применение по п.6 для получения лекарственного средства для лечения заболевания, вызванного гипертензивными эффектами эндогенного уабаина.
10. Применение по п.9, где заболевание, вызванное гипертензивными эффектами эндогенного уабаина, включает развитие почечной недостаточности при аутосомно-доминантном поликистозе почек (АДПК), преэкламптическую гипертензию, протеинурию и развитие почечной недостаточности у пациентов с аддуциновыми полиморфизмами.
11. Применение соединения по любому из пп.1-4 в качестве гипертензивного агента.
12. Фармацевтическая композиция, включающая одно или несколько соединений по п.1 или 4 в комбинации с наполнителями и/или фармакологически приемлемыми разбавителями.
13. Способ получения фармацевтической композиции по п.12, включающий смешивание одного или нескольких соединений по любому из пп.1-4 с подходящими наполнителями, стабилизаторами и/или фармацевтически приемлемыми разбавителями.
14. Способ лечения млекопитающего, страдающего от сердечно-сосудистого заболевания, включающий введение терапевтически эффективного количества одного или нескольких соединений по любому из пп.1-4.
15. Способ лечения млекопитающего, страдающего от заболевания, вызванного гипертензивными эффектами эндогенного уабаина, включающий введение терапевтически эффективного количества одного или нескольких соединений по любому из пп.1-4.
Текст
Предложены новые аминоалкоксииминопроизводные в положении 3 замещенных Вгомоандростанов и В-гетероандростанов, способы их приготовления и фармацевтические композиции, содержащие их, для лечения сердечно-сосудистых нарушений, таких как сердечная недостаточность и гипертензия. Описаны определенные соединения, имеющие общую формулу (1) где радикалы имеют значения, подробно описанные в описании изобретения.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. (IT) 014333 Область техники, к которой относится изобретение Настоящее изобретение относится к новым аминоалкоксииминопроизводным в положении 3 замещенных В-гомоандростанов и В-гетероандростанов, способам их приготовления и к содержащим их фармацевтическим композициям для лечения сердечно-сосудистых расстройств, таких как сердечная недостаточность и гипертензия. Предпосылки изобретения До сих пор сердечно-сосудистые заболевания являются главной причиной заболеваемости и смертности в странах Запада; среди них гипертензия и сердечная недостаточность - два наиболее часто встречающихся заболевания. Гипертензия является одним из наиболее значительных сердечно-сосудистых факторов риска, и более трети населения старше 60 лет страдают от данного заболевания. Острая сердечная недостаточность поражает 1-2% населения, а также 10% наиболее пожилых людей; ожидается увеличение данного показателя (Шарп Н., и др., The Lancet, 1998, 352, (доп.1), 3-17). Кроме того, гипертензия может быть одной из наиболее значимых причин сердечной недостаточности у пожилых людей(Eur. Heart J., 2001, 22, 1527-1560). Хотя существуют эффективные лекарственные средства для лечения как гипертензии, так и сердечно-сосудистой недостаточности, проводятся дополнительные исследования, чтобы создать более эффективные и безопасные соединения. Несколько лекарственных средств применяются в комбинации для лечения сердечной недостаточности, и среди позитивных инотропных препаратов дигоксин является наиболее часто назначаемым дигиталисным сердечным гликозидом, который может улучшить деятельность миокарда. Очень хорошо известным недостатком дигиталисных лекарственных средств является их аритмогенный побочный эффект. Свидетельством дигиталисной токсичности является повышенная в два-три раза концентрация сыворотки по сравнению с терапевтической дозой, в виде нарушения проводимости и сердечных аритмий, которые являются признаками дигиталисной токсичности (Хоффман Б.Ф., Биггер Дж.Т. Дигиталис и близкие по свойствам сердечные гликозиды. В работе Фармакологические основы терапии, 8-й выпуск; Гудман Гилман, А.; Ниес, А. С; Ралл, Т.В.; Тейлор, П., ред.; Pergamon Press, Нью-Йорк, 1990, с. 814-839). Способность натуральных дигиталисных препаратов увеличивать силу миокардиального сокращения строго связана с их карденолидной структурой, включающей 17-лактон на 14-гидрокси-5,14 андростановом скелете. В области 5,14-андростановых производных известно, что некоторые группы соединений обладают положительными инотропными свойствами.GB 1175219 и US 3580905 раскрыли названия 3-(аминоалкоксикарбонилалкилен)стероидных производных, обладающих свойствами, аналогичными дигиталису с "соотношением между дозой, вызывающей токсичные симптомы (начало сердечной аритмии) и эффективной дозой, сравнимой с соотношением, измеренным для стандартных сердечных гликозидов". Кроме отсутствия явных преимуществ по сравнению с дигиталисными гликозидами, соединения с максимальным соотношением обеспечивают наименьшее повышение сократительной способности. Производные 6-гидрокси и 6-оксоандростана раскрыты в ЕР 0825197 В 1 как лиганды и ингибиторыNa+, K+-АТФазы, и позитивные инотропные препараты, обладающие более низкой токсичностью по сравнению с дигоксином, как было оценено на основе острой токсичности у мышей. Аналогичные соединения также описаны С. Де Мунари и др., в J. Med. Chem. 2003, 46(17), 3644-3654. Доказательства того, что высокие уровни эндогенного уабаина (ЭУ), близкородственного изомеру уабаина, вовлечены в механизм гипертензии, сердечной гипертрофии и недостаточности у человека стимулировали фармакологические исследования по разработке новых антигипертензивных веществ, действующих как блокаторы уабаина. Патогенетические механизмы, благодаря увеличенным уровням ЭУ,действуют на сердечно-сосудистую систему и влекут за собой модуляцию Na-K-АТФазы, ключевых энзимов, ответственных за почечную канальцевую реабсорбцию натрия и активизацию путей трансдукции,вовлеченных в транскрипцию гена, связанного с ростом. При помощи изучения генетических и экспериментальных моделей гипертензии на крысах и сравнения их с человеческими было продемонстрировано,что повышенные уровни циркулирующего ЭУ и генетический полиморфизм аддуцина, белка цитоскелета, связаны с гипертензией и высокой почечной активностью Na-K насоса. Уабаин сам по себе вызывает гипертензию и активирует почечный Na-K насос, если постоянно вводится крысам в малых дозах (OS). В культивируемых почечных клетках, выращенных в течение нескольких дней с наномолярными концентрациями уабаина или трансфицированными с генетическим вариантом гипертензивного аддуцина, результаты Na-K насоса улучшаются. Более того, ЭУ и полиморфизм аддуцина влияют на сердечные осложнения, связанные с гипертензией, посредством активизации путей трансдукции. В результате, препарат, способный взаимодействовать с клеточными и молекулярными сдвигами, поддержанными ЭУ или мутировавшим аддуцином, могут представлять собой приемлемое лечение для пациентов, у которых эти механизмы работают (Ферранди М. и др., Curr. Pharm. Des. 2005; 11 (25) : 3301-5). Как описано выше, наиболее важным качеством позитивных инотропных препаратов является способность различать повышение силы миокардиального сокращения и начало сердечных аритмий. Существует постоянная необходимость в создании доступных лекарственных средств, имеющих-1 014333 более высокий терапевтический индекс и/или более продолжительное действие, оба они являются важными факторами для адаптационной способности пациентов. Предпочтительно, чтобы такие лекарства были пригодны для орального применения. Различные стероиды с увеличенным В-кольцом и/или с одним атомом углерода, замещенным гетероатомом, как отмечалось, обладают различным фармакологическим действием в дополнение к некоторому воздействию на Na+, К+-АТФазу или как диуретики. 3-гидрокси- и 3-кетопроизводные В-гомоандростана описаны в JP 45023140 как анаболические и антиандрогенные стероиды, а также в US 3059019 и X. Дж. Рингольдом в J. Am. Chem. Soc., 1960, 82,961-963, как анаболические и антигонадотропные соединения. Натуральные или синтетические брассинолиды(2,3-дигидрокси-6-кето-7-окса-7 агомопроизводные), как отмечалось, являются регуляторами роста растений (CS 274530) и некоторые из них являются ингибиторами или стимуляторами Na+, K+-АТФазы (Л. Старка и др., Sbornik Lekarski, 1997,98, 21-25). 6-азаэстраны заявлены в US 3328408 как диуретические и гипогликемические вещества и следовательно полезны при лечении ишемической болезни сердца. Соединения, подобные стероидным структурам с атомом кислорода в В-кольце, описаны Р. К. Разданом и др. в J. Med. Chem., 1976, 19, 719-721, как неактивные или почти неактивные элементы у гипертензивных крыс, даже несмотря на то, что их дозировка была достаточно высокой (10 мг/кг). Описание изобретения Было обнаружено, что 3-аминоалкоксииминопроизводные замещенных В-гомоандростанов и Вгетероандростанов отвечают требованиям по созданию лекарственных средств с более высоким терапевтическим индексом и/или более длительным периодом действия. Соединения, представленные в настоящем изобретении, имеют следующую общую формулу (I): где символы обозначаютилипростые связи, связывающие группу А с андростановым скелетом в положении 5 или 8; В является кислородом или NR4;R1 является Н, C1-С 6 алкильной группой или C2-С 6 ацильной группой, если связь в положении 17 андростанового скелета является простой связью; илиD является линейным или разветвленным C2-С 6 алкиленом или С 3-С 6 циклоалкиленом, необязательно содержащим фенильное кольцо;R6 и R7, взятые вместе с атомом азота, с которым они соединены, образуют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6-членное кольцо, дополнительно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот; R6 и R7 необязательно замещены одной или более гидрокси-, метокси-, этоксигруппами;R8 является Н, прямым или разветвленным C1-С 6 алкилом, необязательно замещенным одной илиR9 и R10, одинаковые или различные, означают Н, линейную или разветвленную C1-С 6 алкильную группу; илиR9 и R10, взятые вместе с атомами азота и гуанидиновым атомом углерода, образуют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 5- или 6-членное кольцо, необязательно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот;Z является линейным или разветвленным С 1-С 4 алкиленом или простой связью;m означает 0 или 1, или 2, или 3; символ в положении 17 является, независимо, простой или двойной связью, и если в положении 17 присутствует простая экзоциклическая связь, то она являетсяилипростой связью. Там где соединения формулы (I) могут проявлять таутомерию, предполагается, что формула охватывает все таутомеры; изобретение в своем объеме содержит все возможные стереоизомеры, Z- и Еизомеры, оптические изомеры (R и S) и их смеси, метаболиты и метаболические предшественники соединения формулы (I). Также в объем изобретения включены фармацевтически приемлемые соли. Фармацевтически приемлемыми солями являются соли, сохраняющие биологическую активность основания и полученные из таких известных фармацевтически приемлемых кислот, как, например, соляная, бромисто-водородная,серная, фосфорная, азотная, фумаровая, янтарная, щавелевая, яблочная, виннокаменная, малеиновая, лимонная, метансульфоновая или бензойная кислота и другие, широко используемые в данной области.C1-С 6 алкильная группа может быть прямой или разветвленной или циклической группой, например,метил, этил, н-пропил, изопропил; н-бутил, трет-бутил, циклопентил или циклогексил. С 2-С 6 алкиленовая группа может быть прямой или разветвленной, например, этилен, триметилен,пропилен, тетраметилен, метилпропилен, диметилэтилен. С 3-С 6 циклоалкиленовая группа может быть циклопропиленом, циклобутиленом, циклопентиленом,циклогексиленом. С 2-С 6 ацильная группа может быть с прямыми, разветвленными или циклическими цепями и предпочтительно является ацетилом, пропионилом, бутирилом, пивалоилом, циклопентанкарбонилом. Предпочтительно А выбран среди Предпочтительно R6 и R7, одинаковые или различные, выбраны из Н и C1-С 6 алкила. В контексте настоящего изобретения метаболит или метаболический предшественник означают активный метаболит или метаболический предшественник, а именно соединение формулы (I), которое трансформировано при помощи метаболической реакции, но по существу поддерживает или усиливает фармакологическое действие. Примером метаболитов или метаболических предшественников являются гидроксилированные,карбоксилированные, сульфонированные, гликозилированные, гликуронированные, метилированные или деметилированные окисленные или восстановленные производные соединений формулы (I). Некоторые соединения формулы (I) также могут быть пролекарствами активных форм. Предпочтительными примерами конкретных соединений (I) настоящего изобретения являются гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; фумарат (E,Z) 3-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; фумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-тиоксоандростан-17-она; дигидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-17-она; дигидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-6-формил-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино)-6-аза-6-формил-7 а-гомоандростан-17-она; гидрохлорид 3-(Е,Z)-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17-она; гидрохлорид 3-(Е,Z)-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17 она; гидрохлорид 3-(E,Z)-[3-(R)-пирролидинил]оксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17 она; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-метоксииминоандростан-17-она; гидрохлорид 3-(Е,Z)-[3-(R)-пирролидинил]оксиимино)-6-аза-7 а-гомо-7-(Z)-метоксииминоандростан-17 она; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-аза-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-7,17-диона;-3 014333 дифумарат (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-17-она; дифумарат (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-аза-7 а-гомоандростан-17-она; дифумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-17-она ; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-формил-7 а-гомоандростан-17-она; фумарат (E,Z) 3-(2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-7, 17-диона; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорид (Е,Z)-3-(3-N-метиламинопропоксиимино)-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3- (2-аминоэтоксиимино)-6-окса-5-андростан-7,17-диона; гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-азаандростан-7,17-диона; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-В-гомоандростан-17-она; гидрохлорид (Е,Z)-3-[3-(R)-пирролидинил]оксиимино-В-гомоандростан-17-она; гидрохлорид (Е,Z)-3-[3-(R)-пирролидинил]оксиимино-В-гомоандростан-17-она; фумарат (Е, Z)-3- (3-N-метиламинопропоксиимино)-6-окса-7 а-гомоандростан-7,17-диона; фумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-окса-7 а-гомоандростан-7,17-диона; гидрохлорид (Е,Z)-3-(2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-17-она; гидрохлорид (Е,Z)-3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-17-она; гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-азаандростан-7,17-диона; фумарат (E,Z) 3-[3-(R)-лирролидинил]оксиимино-6-азаандростан-7,17-диона и соответствующие чистые Е- и Z-изомеры EZ-смесей, представленных выше, и S-диастереоизомеры R-диастереоизомеров,описанных выше, а также RS-смеси. В частности, были приготовлены следующие чистые Е- и Z-изомеры: фумарат (Е) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; фумарат (Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; гидрохлорид (Z) 3-(2-аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-диона и гидрохлорид (Е) 3-(2-аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-диона. Соединения формулы (I) могут быть приготовлены из легкодоступных исходных материалов при использовании следующих общих методов и процедур. Несмотря на описание типичных или предпочтительных условий эксперимента (т.е. температуры реакций, время, моли реагентов, растворителей и т.д.),могут быть использованы и другие условия эксперимента, если не заявлено иное. Оптимальные условия реакции могут изменяться в зависимости от использованных реагентов или растворителей, но такие условия могут быть определены квалифицированным техническим персоналом при помощи обычных процедур оптимизации. Более того, изобретение предусматривает процесс приготовления соединений общей формулы (I),начиная с компонентов общей формулы (II) где символы A, R1 и ми общей формулы (III) имеют значения, определенные выше при помощи реакции с соединения где R2 имеет значение, определенное выше в форме свободного основания или соли, такой как, например, дигидрохлорид, в неполярном растворителе, таком как диоксан, тетрагидрофуран, 1,2 диметоксиэтан, метанол, этанол, N,N-диметилформамид, пиридин, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Реакция может проводиться в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как соляная кислота, бромистоводородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, гидрофосфат динатрия или дикалия, дигидрофосфат натрия или калия. Соединения общей формулы (I), где символы A, R1 и имеют значения, определенные выше, и R2 6 7 является DNR R или группой где R7 или R8 являются С (=NR9) NHR10, где R9 и R10 имеют значения, указанные выше, могут быть получены из соответствующих соединений общей формулы (I), где R6 и R8 являются водородом, при помощи реакции с соединениями общей формулы (IV) где R9 и R10 имеют значения, описанные выше, и Т является уходящей группой, такой как, например, метилтио или 1-пиразолил. Реакция может проводиться в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, N, N-диметилформамид, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, необязательно в присутствии основания, такого как гидроксид натрия или калия, триэтиламин, диэтилизопропиламин. Соединения общей формулы (II), как описано выше, могут быть приготовлены из известных соединений, обладающих надлежащей функциональностью в различных позициях, из коммерчески доступных соединений, таких как, например, 3,17-дигидроксиандрост-5-ен-7-он и 3-гидроандрост-5-ен-7, 17 дион, или из соединений, уже описанных в литературе, таких как, например, 3, 3:17, 17 бис(этилендиокси)андростан-6-он, 6-гидроксиандростан-3,17-дион (оба описаны в С. Де Мунари и др.,J. Med. Chem. 2003, 46(17), 3644), или 3,3:17,17-бис(этилендиокси)андрост-5-ен-7-он (описанный ПуйКай Ли и Р.В. Брюггемайером, J. Med. Chem. 1990, 33, 101-105), следуя общим процедурам, перечисленным ниже. Список упомянутых соединений является образцом, не ограничивающим объем изобретения,описанных методов приготовления соединений (II). Соединения общей формулы (II), где А является или иX является кислородом, могут быть получены из соответствующих соединений, где А является, преобразованным в соответствующий цианидрин с последующим восстановлением в аминоспирт и окончательной диазотизацией последнего. Цианогидрин можно получить в результате реакции цианида натрия или калия в присутствии кислоты, такой как серная или уксусная кислота, в растворителе, таком как этанол, диоксан, диметилсульфоксид (DMSO), вода или какая-либо из их смесей, при температуре в диапазоне от 0 С до комнатной температуры, или при помощи обработки кетона другим цианогидрином, таким как ацетонцианогидрин,в присутствии основания, такого как гидроксид натрия или калия, в растворителе, таком как этанол, диоксан, диметилсульфоксид, вода или какая-либо из их смесей, или в самом цианогидрине в виде растворителя, при температуре в диапазоне от 0 С до комнатной температуры. Цианогидрин можно также получить при обработке цианотриметилсиланом в присутствии кислоты Льюиса или основания с последующим гидролизом силилового эфира. Восстановление цианогидрина до соответствующего аминоспирта может быть проведено при каталитической гидрогенизации, с газообразным водородом или в условиях переноса водорода, в присутствии металлических катализаторов, таких как Pd/C, PtO2, Pt, Pt/C или никелевый катализатор Ренея. Аммония формиат, натрий гипофосфит или циклогексадиен могут быть использованы как реагенты переноса водорода. Реакция может быть проведена в растворителях, таких как, например, этанол, метанол,этилацетат, диоксан, тетрагидрофуран, уксусная кислота, N,N-диметилформамид, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, при давлении в диапазоне от атмосферного давления до 10 атм. Восстановление цианогидрина может быть также проведено с восстановителем, таким как алюмогидрид лития в инертном растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Реакция диазотизации аминоспирта в искомые соединения общей формулы (II), где А является или и X является кислородом, может быть проведена с нитритом натрия или калия в присутствии кислоты, такой как серная, соляная или уксусная кислота, в растворителях, таких как этанол, диоксан, диметилсульфоксид, вода или какая-либо из их смесей при температуре в диапазоне от 0 С до комнатной температуры. или Соединения общей формулы (II), где заместитель А является и X является кислородом, также могут быть получены из соединений, где А является при обработке диазометаном или триметилсилилдиазометаном в присутствии кислоты Льюиса, такой как BF3 Et2O, в растворителе, таком как диэтиловый эфир, тетрагидрофуран или дихлорметан при температуре в диапазоне от -7 0 С до температуры кипения с обратным холодильником. или Соединения общей формулы (II), где А является и X является серой, могут быть получены из соединений, где А является или, а X является кислородом, реакцией с реагентом Лавессона или P2S5, в растворителе, таком как толуол или ацетонитрил при температуре в диапазоне от 0 С до температуры кипения с-5 014333 обратным холодильником. или Соединения общей формулы (II), где заместитель А является и X является NOR5, могут быть получены при помощи обработки соединений обили с соединениями общей формущей формулы (II), где А является лы H2NOR5, где R5, как описано выше, представлен в форме свободного основания или соли, такой как,например, гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, N,N-диметилформамид, пиридин, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Реакция может проводиться в присутствии основания,такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как соляная кислота, бромистоводородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, гидрофосфат динатрия или дикалия, дигидрофосфат натрия или калия. Соединения общей формулы (II), где заместитель А является, могут быть получены из соединений, где А является илиRw является Н, С 6 Н 5, тозилом, при обработке основанием, таким как гидроксид натрия или калия, этоксид натрия или калия в растворителе, таком как этанол, бутанол, пентанол, 1,2-этандиол или Na в спирте,трет-бутоксид калия в диметилсульфоксиде при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Аналогичная реакция может быть проведена с восстановителями, такими как алюмогидрид лития в тетрагидрофуране, цианоборгидрид натрия в метаноле или этаноле, необязательно в присутствии кислоты Льюиса, такими как хлорид цинка или боргидрид натрия в метаноле или этаноле при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения, где А является илиRw является Н, С 6 Н 5, тозил может быть получен при помощи реакции с соединениями общей формулы(II), где А является или с соединениями общей формулы H2NNRW как растворитель или в растворителе, таком как этанол, диоксан, диметилсульфоксид, вода или какая-либо из их смесей, при температуре от 0 С до температуры кипения с обратным холодильником., могут быть полуСоединения общей формулы (II), где заместитель А является или при чены из соединений, где А является помощи каталитической гидрогенизации, например, с никелем Ренея, в растворителе, таком как этанол,вода или диоксан или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным или,холодильником. Соединения, где А является могут быть получены при помощи реакции с соединениями общей формулы (II), где А является или с и кислотой Льюиса, такими как BF3Et2O, в растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы(II),где заместители А являются и R3 является водородом, могут быть получены благодаря реакции с соединениями общей формулы (II), где А является или,при помощи восстановления с гидридами металла, например, боргидридом натрия или алюмогидридом лития в совместимом растворителе, таком как метанол, этанол, вода, для образования реагента и диэтилового эфира или тетрагидрофурана для последнего, с натрием в спирте, таком как этанол или пропанол,или каталитической гидрогенизацией, такой как Pd/C, PtO2, Pt, Pt/C или никель Ренея, в растворителе,таком как, например, этанол, метанол, этилацетат, диоксан, тетрагидрофуран, уксусная кислота, N, Nдиметилформамид, вода или их смеси. Все перечисленные реакции могут быть проведены при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, под давлением в диапазоне от атмосферного давления до 10 атм. Соединения общей формулы(II),где заместители А являются и R3 является C1-С 6 алкильной группой, могут быть получены из соединений общей формулы (II), где А является и R3 является водородом, с соединениями общей формулы R3-LG, где LG является уходящей группой,например, такой как хлоро, бромо, йодо, мезилокси, пара-толуолсульфонилокси, трифторметансульфонилокси. Реакция может быть проведена в растворителе, таком как диэтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, толуол или их смеси при температуре от 0 С до температуры кипения с обратным холодильником, необязательно в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия,и необязательно, соли, такой как, например, йодид натрия или калия. Реакция может быть также проведена в смеси органического растворителя, такого как, например, дихлорметан, хлорбензол, толуол, гексан и вода, в присутствии гидроксида натрия или калия и четвертичной аммониевой соли, такой как, на-6 014333 пример, хлорид или бромид или йодид или гидросульфат тетрабутиламмония при температуре в диапазоне от 0 С до температуры смешивания. Соединения общей формулы (II), где заместитель А является или, а В и X являются кислородом, могут быть получены при обработке соответствующих производных пероксидами, такими как перекись водорода, или пероксикислотами, такими как мета-хлорпербензойная кислота, пероксотрифторуксусная кислота или пероксоуксусная кислота. Реакция может быть проведена в растворителе, таком как, например, дихлорметан, хлороформ,толуол или их смеси при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, необязательно в присутствии буфера, такого как гидрофосфат динатрия. Соединения общей формулы (II), где заменитель А является, а В и X являются кислородом, также могут быть получены при помощи обработки производных 5-кето-6-кислота-В-секоандростан с боргидридом натрия с последующей кислотной обработкой. Производные 5-кето-6-кислота-В-секоандростана могут быть получены при обработке производных 5-андростена озоном или перманганатом калия или перйодатом натрия. или Соединения общей формулы (II), где заместитель А является 4 4, В является NR , где R является водородом и X является кислородом, могут быть получены при помощи обработки производных 6- или 7-гидроксииминоандростана, например, SOCl2, 2,4,6 трихлор-1,3,5-триазином, тозилхлоридом, Р 2 О 5, POCl3, H2SO4 в растворителе, таком как толуол, дихлорметан, пиридин, в зависимости от природы реагента, или реагент может быть использован как растворитель при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, необязательно с последующей обработкой основанием, таким как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, триэтиламин, пиридин, в растворителе, таком как метанол,этанол или вода или смесь вышеуказанных растворителей, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы (II), где заместитель А является или, В является NR4, где R4 является C1-С 6 алкильной группой, а X является кислородом,могут быть получены при помощи обработки соответствующих соединений общей формулы (II), где заили, В является NR4, где R4 является водородом,меститель А является а X является кислородом, с соединениями общей формулы R4-LG, где LG является уходящей группой,такой как, например, хлоро, бромо, йодо, мезилокси, пара-толуолсульфонилокси, трифторметансульфонилокси. Реакция может проводиться в растворителях, таких как дизтиловый эфир, диоксан, тетрагидрофуран, 1,2-диметоксиэтан, N,N-диметилформамид, диметилсульфоксид, толуол или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, необязательно в присутствии основания, такого как, например, гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, гидрид натрия или калия, метоксид натрия или калия, трет-бутоксид натрия или калия, и, необязательно, соли, такой как, например, йодид натрия или калия. Реакция может быть также проведена в смеси органических растворителей, таких как, например, дихлорметан, хлорбензол,толуол, гексан и вода, в присутствии гидроксида натрия или калия и соли четвертичного аммония, такой как, например, хлорид или бромид или йодид или гидросульфат тетрабутиламмония, при температуре смеси в диапазоне от 0 С до температуры кипения с обратным холодильником. или,аВ Соединения общей формулы (II), где заместитель А является является кислородом, могут быть получены из соединений общей формулы (II), где заместитель А является или, а В и X являются кислородом, при помощи восстановления со смешанными гидридами, такими как, например, боргидрид натрия или алюмогидрид лития в присутствии кислоты Льюиса, такой как BF3Et2O, в растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан, или каталитической гидрогенизации Pd/C в спирте, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы (II), где заместитель А является или,а В является О, могут быть получены из соединений общей формулы (II), где заместитель А является, а В и X являются кислородом, при помощи восстановления со смешанными гидридами, чтобы образовать соответствующий диол, который может быть преобразован в искомые эфиры при помощи обработки хлоридом тозила или хлоридом тионила в присутствии основания, такого как пиридин, триэтиламин, 4-диметиламинопиридин, в растворителе, таком как диэтиловый эфир, толуол, дихлорметан, пиридин, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. или, в котором В Соединения общей формулы (II), где А является является NR4 и R4 является водородом или C1-С 6 алкильной группой, могут быть получены из соединений общей формулы (II), где А является или, где В является NR4, X яв 4 ляется кислородом и R является водородом или C1-С 6 алкильной группой, при помощи восстановления со смешанными гидридами, такими как, например, алюмогидрид лития, в растворителе, таком как диэти-7 014333 ловый эфир, тетрагидрофуран, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. или, а В явСоединения общей формулы (II), где А является ляется кислородом или NR4, R4 является водородом или C1-С 6 алкильной группой, и X является NOR5,могут быть получены из соединений общей формулы (II), где А является или, где В является кислородом или NR4, R4 является водородом или С 1-С 6 алкильной группой, а X является серой, полученной при помощи реакции с H2NOR5, где R5, как описано выше, представлен в форме свободного основания или соли, такой как, например, гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, N,N-диметилформамид, пиридин, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Реакция может проводиться в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты, такой как соляная кислота, бромистоводородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, гидрофосфат динатрия или дикалия, дигидрофосфат натрия или калия. Соединения общей формулы (II), где А является, а В и X являются кислородом,могут быть получены из соответствующих соединений, где А является, при помощи реакции с KMnO4 или NaIO4 в трет-бутаноле, необязательно в присутствии воды или оснований, таких как карбонат натрия или гидрокарбонат, ацетат натрия или фосфат натрия, или с RuCl3 или RuO2 и NaIO4 или NaBrO3 в растворителе, таком как этилацетат, карбонтетрахлорид, ацетонитрил и вода или смесь вышеперечисленных растворителей, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, и восстановление промежуточной кетокислоты со слабым восстановлением гидридов, например боргидрида натрия с последующим замыканием кольца промежуточного соединения,необязательно с каталитическим количеством кислот, таких как соляная кислота, уксусная кислота или пара-толуолсульфокислота. Соединения общей формулы (II), где А является, а В является NR4, R4 является водородом или С 1-С 6 алкильной группой, и X является кислородом, могут быть получены из соединений общей формулы (II), где А является, при помощи реакции с KMnO4 или NaIO4, в третбутаноле, необязательно в присутствии воды и оснований, таких как карбонат натрия или гидрокарбонат,ацетат натрия или фосфат натрия, или с RuCl3 или RuO2 и NaIO4 или NaBrO3 в растворителе, таком как этилацетат, карбонтетрахлорид, ацетонитрил и вода или смесь вышеуказанных растворителей, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником, с последующей реакцией с аммиаком, аммониевой солью, такой как ацетат или формиат аммония, или амин из общей формулы H2NR4 для получения карбиноламида. Дегидратация последнего с дегидратирующими агентами,такими как тионилхлорид, оксихлорид фосфора, пара-толуолсульфокислота, и каталитическая гидрогенизация энамида создает соединения общей формулы (II), где А является и В являетсяNR4, R4 является водородом или C1-С 6 алкильной группой, и X является кислородом., а В является кислородом или NR4,Соединения общей формулы (II), где А является 4R является водородом или C1-С 6 алкильной группой, а X является NOR5, могут быть получены из соеди, где В является кислородом или NR4, R4 являнений общей формулы (II), где А является ется водородом или C1-C6 алкильной группой, а X является серой, при помощи реакции с H2NOR5, где R5 представлен, как описано выше, в форме свободного основания или соли, такой как, например, гидрохлорид, в растворителе, таком как диоксан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, N,Nдиметилформамид, пиридин, вода или их смеси, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Реакция может проводиться в присутствии основания, такого как гидроксид натрия или калия, карбонат натрия или калия, гидрокарбонат натрия или калия, или кислоты,такой как соляная кислота, бромисто-водородная кислота, уксусная кислота, или соли, такой как ацетат натрия или калия, фосфат натрия или калия, гидрофосфат динатрия или дикалия, дигидрофосфат натрия или калия.,аВ могут быть получены из соединений общей формулы (II), где заменитель А является и X являются кислородом, в результате восстановления со смешанными гидридами, такими как, например, боргидрид натрия или алюмогидрид лития в присутствии кислоты Льюиса, такой как BF3Et2O, в растворителе, таком как диэтиловый эфир, тетрагидрофуран или диоксан, или каталитической гидрогенизации над Pd/C в спирте, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником., а В является О, могут Соединения общей формулы (II), где заместитель А является,аВ также быть получены из соединений общей формулы (II), где заменитель А является и X являются кислородом, в результате восстановления со смешанными гидридами, чтобы образовать соответствующий диол, который может быть преобразован в искомые эфиры при помощи обработки хлоридом тозила или хлоридом тионила в присутствии основания, такого как пиридин, тризтиламин, 4-8 014333 диметиламинопиридин, в растворителе, таком как диэтиловый эфир, толуол, дихлорметан, пиридин, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы (II), где А является, а В является NR4, где R4 является водородом или C1-С 6 алкильной группой, могут быть получены из соединений общей формулы (II), где А является, где В является NR4, где R4 является водородом или C1-С 6 алкильной группой, аX является кислородом, при помощи восстановления со смешанными гидридами, такими как, например,алюмогидрид лития, в растворителе, таком как диэтиловый эфир, тетрагидрофуран диоксан, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы (II), где А является или 4 4, В является кислородом или NR , где R является водородом или C1-С 6 алкильной группой, а X является серой, могут быть получены из соответствующих соединений общей формулы (II), где А является или, где В является кислородом или NR4, где R4 является водородом или C1-С 6 алкильной группой, а X является О, в результате реакции с реагентом Лавессона или P2S5, в растворителе, таком как толуол или ацетонитрил, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником. Соединения общей формулы (II), где А является или,а В является NR4, где R4 является формилом, могут быть получены формилированием соединений общей формулы (II), где А является или, а В является NR4, где R4 является водородом, муравьиной кислотой в уксусном ангидриде или муравьиной кислотой в присутствии конденсирующего агента, такого как N,N'-карбонилдиимидазол, необязательно в присутствии основания, такого как триэтиламин, диэтилизопропиламин, 4-диметиламинопиридин, пиридин, в растворителе, таком как дихлорметан, хлороформ, ацетон, тетрагидрофуран, диоксан, N,N'-диметилформамид. Во всех вышепричисленных преобразованиях любая интерферирующая реактивная группа может быть защищена, а затем с нее может быть снята защита в соответствии с общепринятыми процедурами,описанными в органической химии (см., например: Т.В. Грин и П.Г.М. Вутс Защитные группы в органическом синтезе, J. WileySons, Inc., 3rd Ed., 1999) и хорошо известными специалистам в данной области. Все указанные преобразования являются лишь примерами общепринятых процедур, описанных в органической химии (см. например: Дж. Марч, Передовая органическая химия, J. WileySons, Inc., 4thEd., 1992) и хорошо известных специалистам в данной области. Соединения общей формулы (III) и (IV) имеются в продаже или могут быть приготовлены из соединений, имеющихся в продаже, при помощи стандартных процедур. Способ лечения млекопитающих, страдающих от сердечнососудистых нарушений, включающий использование терапевтически эффективного количества соединений формулы (I), как описано выше,представляет один из аспектов настоящего изобретения. Термин "терапевтически эффективное количество", использованный здесь, указывает на количество терапевтического вещества, необходимого для того, чтобы вылечить или облегчить целевое заболевание или состояние, или чтобы продемонстрировать очевидный терапевтический эффект. Для любого соединения терапевтически эффективная доза может быть определена изначально в клеточной культуре образцов или на животных моделях, обычно мышах, крысах, морских свинках, кроликах, собаках или свиньях. Животная модель может быть также использована для определения надлежащего диапазона концентраций и способов применения. Затем такая информация может быть использована для определения приемлемых доз и способов применения для человека. Точная эффективная доза для человека будет зависеть от степени тяжести болезненного состояния,общего состояния здоровья пациента, возраста, веса и пола пациента, диеты, времени и частоты приема,комбинации(й) лекарственного средства, чувствительности реакции и переносимости/восприимчивости к лечению. Это количество может быть определено путем общепринятого экспериментирования и на основании заключения практикующего врача. Как правило, эффективная доза будет в пределах от 0,01 до 100 мг/кг, желательно от 0,05 до 50 мг/кг. Соединения могут вводится пациенту индивидуально или в комбинации с другими веществами, лекарственными препаратами или гормонами. Лекарственное средство может также содержать фармацевтически приемлемый носитель для введения терапевтического вещества. Такими носителями являются антитела и полипептиды, гены и другие терапевтические вещества, такие как липосомы, при гарантии, что сам носитель не стимулирует производство антител, вредных для пациента, получающего соединение, и могут быть применены без чрезмерной токсичности. Подходящие носители могут быть большими, медленно метаболизированными макромолекулами,такими как протеины, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислоты и инертные вирусные частицы. Всестороннее рассмотрение фармацевтически приемлемых носителей представлено в Remington'sPharmaceutical Sciences (Mack Pub. Co., N. J.1991). Фармацевтически приемлемые носители в терапевтических соединениях могут дополнительно содержать жидкости, такие как вода, соляной раствор, глицерин и этанол. Дополнительно, вспомогательные вещества, такие как увлажнители или эмульгаторы, рН буферные вещества и подобные могут присутствовать в таких соединениях. Такие носители дают возможность создать формулу фармацевтических соединений для их изготовления в виде таблеток, пилюль, драже, жидкостей, гелей, сиропов, суспензий,взвесей и т.п. для приема пациентом внутрь. В составе фармацевтического препарата соединения настоящего изобретения могут назначаться субъекту напрямую. Субъектами, подлежащими лечению, могут быть животные; в частности, человек. Лекарственное средство данного изобретения можно вводить разными способами, включая, но не ограничиваясь, следующие: орально, внутривенно, внутримышечно, внутриартеариально, интрамедуллярно, интратекально, интравентрикулярно, трансдермально или чрескожно, подкожно, интраперитонеально, интраназально, энтерально, местно, сублингвально, интравагинально, ректально или локально на пораженные ткани после хирургической операции. Лечение можно назначать в виде разовой или многократной дозы. Дополнительной целью настоящего изобретения является использование вышеуказанных соединений общей формулы (I) для приготовления лекарственного средства, полезного для лечения сердечнососудистых заболеваний, таких как сердечная недостаточность и гипертензия. Благодаря тому, что соединения настоящего изобретения продемонстрировали способность противодействовать молекулярным эффектам, вызванным концентрациями наномолярного уабаина на NaKATPase, они будут эффективны при лечении заболеваний, вызванных гипертензивными эффектами эндогенного уабаина. В соответствии с предпочтительным воплощением изобретения заболевания, вызванные гипертензивными эффектами эндогенного уабаина, включают прогрессирование заболевания в почечную недостаточность при аутосомно-доминантном поликистозе почек (АДПК), прогрессирование заболевания с развитием преэкламптической гипертензии, протеинурии и почечной недостаточности у пациентов с аддуциновыми полиморфизмами. При аутосомно-доминантном поликистозе почек (АДПК) формирование и увеличение кисты происходят благодаря росту клеток и трансэпителиальной секреции жидкостей, вызывающих прогрессивное ухудшение почечной функции и почечную недостаточность. 1 из 1000 пациентов подвержены АДПК,который является первой генетической причиной почечной недостаточности. Почечная Na-KATPase является важной для транспортирования ионов и жидкостей в АДПК-клетки и их смещение от заданного положения и изменение функции представлены в описании данной патологии (Вилсон П.Д. и др. Am. J.Pathol. 2000; 156: 253-268). Ингибитор Na-KATPase - уабаин замедляет выделение жидкости в АДПКкистах (Грэнтхам Дж.Дж. и др. I Clin. Invest. 1995; 95: 195-202) в микромолярных концентрациях, в противоположность наномолярным концентрациям, которые подобны концентрациям циркулирующего эндогенного уабаина, уабаин стимулирует пролиферацию АДПК-клеток, но не влияет на обычный рост клеток почки человека (Нгуен А.Н. и др. 2007; 18: 46-57). Было продемонстрировано, что уабаин стимулирует АДПК-пролиферацию путем связывания Na-KATPase с высоким сродством и запуская активизацию MEK-ERK пути (Нгуен А.Н. и др. 2007; 18:46-57). Преэклампсия является потенциально разрушительным гипертензиальным нарушением во время беременности, эффективное лечение которого отсутствует до сих пор. Повышенные циркуляционные уровни карденолидов и буфодиенолидов отмечены у преэкламптических пациентов и у крыс в модели заболевания (Лопатин Д.А. и др. J. Hypertens. 1999; 17: 1179-1187; Грейвс С.В, и др. Am. J. Hypertens. 1995; 8:5-11; Адейр С.Д. и др. Am. J. Nephrol. 1996; 16: 529-531). Имеющиеся данные приводят к мысли,что при преэклампсии повышенные концентрации плазмы в ингибиторах Na-KATPase приводят к сосудистому спазму и злокачественной артериальной гипертензии (By Х.В. и др. Am. J. Nephrol. 2005; 25: 520-528). В последнее время было доказано, что дигоксин-специфический Fab (Дигибинд) снижает кровяное давление и повышает натрийурез у преэкламптических пациентов (Пуллен М.А. и др. JPET 2004; 310: 319-325). Вызванная гломерулосклерозом протеинурия имеет место благодаря ухудшению структуры, состоящей из щелевых пор, образованной при помощи отростков подоцитов в клубочках. В частности, щелевая диафграмма протеинов, таких как нефрин, ZO1, подоцин, синаптоподин и другие, дополнительно к их структурным функциям участвует в общих сигнальных путях, регулируемых Fyn-тирозином киназы из семейства Src (Бензинг Т. J. Am. Soc. Nephrol. 2004; 15: 1382-1391). В последнее время ключевая роль в структуре щелевой поры приписывается бета-аддуцину, белку цитоскелета под контролем Fyn (ГотохX. BBRC 2006; 346:600-605; Шима Т. и др. JBC 2001; 276: 42233-42240). Было обнаружено, что полиморфизмы аддуцина, соединенные с АПФ полиморфизмами, связаны со сниженной почечной функцией у европейцев и китайцев (Ванг Й.Дж. и др. J. Mol. Med. 2004; 82: 715-722; Ванг Й. Дж. и др. Am. J. Kidney Dis. 2001; 38: 1158-1168). Ростафуроксин и аналоги, как эндогенные антагонисты уабаина, описываются как вещества, способные противодействовать молекулярному эффекту полиморфизма аддуцина на сигнализирующую киназу тирозина (Ферранди М. и др. JBC, 2004; 279: 3330 6-14; Феррари и др. Am. J.Physiol. Regul. 2006; 290: R529-535; Феррари П. и др. Med. Hypothes. 2007; 68:1307-1314). Дополнительной целью настоящего изобретения являются лекарственные препараты, содержащие одно или более соединений формулы (I), описанных ранее, в комбинации со вспомогательными веществами и/или фармакологически приемлемыми разбавителями. Рассматриваемые соединения могут вместе с соединениями формулы (I) содержать общеизвестные действующие вещества. Дополнительным примером осуществления изобретения является процесс приготовления фармацевтических композиций при помощи смешивания одного или более соединений формулы (I) с подходящими вспомогательными веществами, стабилизаторами и/или фармакологически приемлемыми разбавителями. Изобретение будет проиллюстрировано более подробно при помощи не ограничивающих объем притязаний примеров. Примеры Следующие примеры описывают синтез некоторых соединений формулы (I), тогда как приготовления описывают синтез пригодных промежуточных соединений. Пример 1. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (I-аа) В перемешиваемый раствор 6-аза-7 а-гомоандростан-3,7,17-триона (11-а, пригот. 1, 1,028 г) в тетрагидрофуране (58 мл) быстро по каплям был добавлен раствор дигидрохлорида 2-аминоэтоксиамина(0,482 г) и Na2HPO412 Н 2 О (2,32 г) в Н 2 О (14 мл). Через 4 ч был добавлен NaCl (0,5 г) и смесь перемешивали в течение 10 мин. Фазы были отделены и водная фаза была экстрагирована с тетрагидрофураном/tBuOH 1/1 (3), а затем с tBuOH (3). Объединенные органические экстракты были высушены надNa2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с EtOAc в течение 4 ч и осадок был отфильтрован с получением указанного в заголовке соединения I-аа в виде белого твердого вещества (1,247 г, 93%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,97 (bb, 3 Н), 7,26 (д, 0,5 Н), 7,22 (д, 0,5 Н), 4,09 (м,2 Н), 3,52 (м, 1 Н), 3,15 (м, 0,5 Н), 3,02 (м, 2 Н), 2,93 (м, 0,5 Н), 2,45-1,00 (м, 18 Н), 0,84 (с, 3 Н), 0,79 (с, 3 Н). Пример 2. Фумарат (E,Z) 3-(2-N-метиламиноэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (I-ab) Приготавливается в объеме 51% выхода, как описано в примере 1, начиная с 6-аза-7 агомоандростан-3,7,17-триона (II-а, пригот. 1, 70 мг) и дигидрохлорида 2-N-метиламинэтоксиамина (III-а,пригот. 15, 36 мг). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления смеси EtOAc/Et2O в пропорции 1/1 осадок был отфильтрован с получением указанного в заголовке соединения I-аb в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,00 (bb, 3 Н), 7,25 (д, 0,5 Н), 7,22 (д, 0,5 Н), 6,40 (с, 2 Н),4,09 (м, 2 Н), 3,49 (м, 1 Н), 3,11 (м, 0,5 Н), 3,01 (м, 2 Н), 2,91 (м, 0,5 Н), 2,47 (с, 3 Н), 2,30-1,00 (м, 18 Н), 0,83(III-b, пригот. 16, 213 мг). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26%NH4OH 85/15/1,5). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления смеси EtOAc/Et2O в пропорции 1/1 осадок был отфильтрован с получением указанного в заголовке соединения I-ас. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,00 (bb, 3 Н), 7,21 (д, 0,5 Н), 7,19 (д, 0,5 Н), 6,42 (с, 2 Н),3,97 (м, 2 Н), 3,50 (м, 1 Н), 3,10-2,80 (м, 3 Н), 2,47 (с, 3 Н), 2,30-1,00 (м, 20 Н), 0,83 (с, 3 Н), 0,79 (с, 3 Н). Пример 4. Фумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7 а-гомоандростан-7,17-диона (Iad) Приготавливается в объеме 88% выхода, как описано в примере 1, начиная с 6-аза-7 агомоандростан-3,7,17-триона (II-а, пригот. 1, 334 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина(III-с, пригот. 17, 171 мг). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CHCl3/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления смеси EtOAc/Et2O в пропорции 1/1 осадок был отфильтрован с получением указанного в заголовке соединения I-ad. 1- 11014333 были выделены и водная фаза была экстрагирована с THF (3). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ае в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,85 (bb, 3 Н), 4,10 (м, 2 Н), 4,03 (м, 1 Н), 3,06 (м, 3 Н),2,80 (м, 1,5 Н), 2,77 (м, 1,5 Н), 2,80-1,09 (м, 18 Н), 0,82 (с, 1,5 Н), 0,79 (с, 1,5 Н), 0,78 (с, 1,5 Н), 0,74 (с, 1,5 Н) Пример 6. Фумарат (Е) 3-(2-аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-диона (I-af) К смешанному раствору 3-(Е)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6 метил-7 а-гомоандростан-7,17-диона (11-с, пригот. 3, 200 мг) в сухом THF (0,96 мл) был добавлен 1 М фторид тетрабутиламмония в THF (0,390 мл). После смешивания при комнатной температуре в течение 2 ч раствор был сконцентрирован до малого объема и очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН и они выпарены досуха. Неочищенный продукт измельчен с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-af в виде белого твердого вещества (112 мг, 88%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,00 (м, 4 Н), 6,40 (с, 2 Н), 4,06 (м, 2 Н), 4,01 (м, 1 Н),2,97 (м, 3 Н), 2,77 (с, 3 Н), 2,80-1,09 (м, 18 Н), 0,78 (с, 3 Н), 0, 73 (с, 3 Н). Пример 7. Гидрохлорид (Z) 3-(2-аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-диона (Iag) Приготавливается в объеме 94% выхода, как описано в примере 1, начиная с 3-(Z)-[2-(9 Н-флуорен 9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-дион (II-d, пригот. 3, 160 мг) и 1 М фторида тетрабутиламмония в THF (0,314 мл). Неочищенный продукт был измельчен с Et2O и осадок отфильтрован, растворен в воде и лиофилизирован с получением указанного в заголовке соединения I-ag. 1(III-b, Пригот. 16, 40 мг). Фазы были выделены и и водная фаза была экстрагирована с THF (3). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт был измельчен с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ah в виде белого твердого вещества 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,50 (bb, 2H), 4,10-3,95 (м, 3 Н), 2,94 (bb, 2 Н), 2,80 (м,3 Н), 2,76-2,61 (м, 2 Н), 2,56 (с, 3 Н), 2,46-1,80 (м, 8 Н), 1,78-1,10 (м, 11 Н), 0,83 (с, 1,5 Н), 0,79 (с, 1,5 Н), 0,78(III-с, пригот. 17, 42 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт был растворен в воде и лиофилизирован с получением указанного в заголовке соединения I-ai в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,42 (bb, 2 Н), 4,77 (м, 1 Н), 4,12 (м, 0,5 Н), 4,04 (м,0,5 Н), 3,30-3,06 (м, 4,5 Н), 2,98 (м, 0,5 Н), 2,80 (с, 1,5 Н), 2,77 (с, 1,5 Н), 2,82-1,10 (м, 20 Н), 0,83 (с, 1,5 Н),0,79 (с, 1,5 Н), 0,78 (с, 1,5 Н), 0,73 (с, 1,5 Н) Пример 10. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-тиоксоандростан-17-она (Iaj) Приготавливается в объеме 76% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7 тиоксоандростан-3,17-диона (II-е, пригот. 4, 75 мг) и дигидрохлорида 2-аминоэтоксиамина (33 мг). Фазы были отделены и водная фаза была экстрагирована с THF (3). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт был перетерт сEt2O и осадок отфильтрован с получением указанного в заголовке соединения I-aj в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,76 (д, 0,5 Н), 9,72 (д, 0,5 Н), 7,91 (bb, 3 Н), 4,09 (м,2 Н), 3,85 (м, 1 Н), 3,23 (м, 0,5 Н), 3,04 (м, 2 Н), 2,93 (м, 0,5 Н), 2,85-1,04 (м, 18 Н), 0,85 (с, 3 Н), 0,80 (с, 3 Н). Пример 11. Дигидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-17-она (I-ak) В перемешиваемый раствор 6-аза-7 а-гомоандростан-3,17-диона (II-f, пригот. 5, 75 мг) в диоксане (1 мл) был быстро добавлен по каплям раствор дигидрохлорида 2-аминоэтоксиамина (33 мг) в воде (1 мл).- 12014333 Через 3 ч смесь была лиофилизирована и осадок растерт с Et2O в течение 5 ч, а осадок был отфильтрован. Неочищенный продукт был растворен в воде и лиофилизирован с получением указанного в заголовке соединения I-ak в виде белого твердого вещества (89 мг, 83%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :9,87 (bb, 0,5H), 9,54 (bb, 0,5H), 8,40 (bb, 1H), 8,15 (bb,1,5 Н), 8,06 (bb, 1,5 Н), 4,13 (м, 2 Н), 3,56 (м, 0,5 Н), 3,30-2,94 (м, 5 Н), 2,85 (м, 0,5 Н), 2,73-1,03 (м, 18 Н), 1,10(с, 1,5 Н), 1,08 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 12. Дифумарат (E,Z) 3-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомоандростан-17-она (Ial) Приготавливается в объеме 70% выхода, как описано в примере 1, начиная с 6-аза-7 агомоандростан-3,17-диона (II-f, пригот. 5, 7 4 мг) и дигидрохлорида 3-N-метиламинопропоксиамина (IIIb, пригот. 16, 39 мг). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O в пропорции 1/1 осадок был отфильтрован с получением указанного в заголовке соединения I-al в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,00 (bb, 6 Н), 6,46 (с, 4 Н), 3,96 (м, 2 Н), 3,20-2,70 (м,бН), 2,50 (с, 3 Н), 2,50-0,82 (м, 20 Н), 0,94 (с, 3 Н), 0,78 (с, 3 Н). Пример 13. Дигидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино)-6-аза-7 а-гомоандростан-17 она (I-am) Приготавливается в объеме 90% выхода, как описано в примере 1, начиная с 6-аза-7 агомоандростан-3,7,17-триона (II-f, пригот. 5, 76 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина(I-an) Приготавливается в объеме 90% выхода, как описано в примере 1, начиная с 6-аза-6-формил-7 агомоандростан-3,17-диона (II-g, пригот. 6, 80 мг) и дигидрохлорида 2-аминоэтоксиамина (38 мг). Неочищенный продукт был растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-аn в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,40-7,40 (м, 4 Н), 4,09 (м, 2 Н), 3,95-0,72 (м, 24 Н), 0,93(E,Z) 3-(3-N-метиламинопропоксиимино)-6-аза-6-формил-7 агомоандростан-17-она (I-ао) Приготавливается в объеме 50% выхода, как описано в примере 1, начиная с 6-аза-6-формил-7 агомоандростан-3,17-диона (II-g, пригот. 6, 80 мг) и дигидрохлорида 3-N-метиламинопропоксиамина (IIIb, пригот. 16, 42 мг). Неочищенный продукт был растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ао в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,37 (с, 0,5 Н), 8,34 (bb, 2 Н), 8,32 (с, 0,5 Н), 3,99 (т, 2 Н),3,80 (м, 1 Н), 3,55 (м, 1 Н), 3,05-2,82 (м, 4 Н), 2,72 (т, 1 Н), 2,52 (с, 3 Н), 2,46-0,98 (м, 19 Н), 0,92 (с, 1,5 Н), 0,87(E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-6-формил-7 агомоандростан-17-она (I-ар) Приготавливается в объеме 78% выхода, как описано в примере 1, начиная с 6-аза-6-формил-7 агомоандростан-3,17-диона (II-g, пригот. 6, 100 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (IIIс, Пригот. 17, 53 мг). Неочищенный продукт был растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ар в виде белого твердого вещества. 1(с, 1,5 Н), 0,87 (с, 1,5 Н), 0,75 (с, 3 Н). Пример 17. Гидрохлорид 3-(Е,Z)-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17-она (I-aq) Приготавливается в объеме 40% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7-(Z)гидроксииминоандростан-3,17-диона (II-h, пригот. 7, 100 мг) и дигидрохлорида 2-аминоэтоксиамина (44 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-aq в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,11 (bb, 1H), 7,97 (bb, 3 Н), 5,45 (bb, 1 Н), 4,09 (м, 2 Н),3,43 (м, 1 Н), 3,24 (м, 0,5 Н), 3,04 (м, 2 Н), 2,94 (м, 0,5 Н), 2,52-0,94 (м, 18 Н), 0,83 (с, 1,5 Н), 0,82 (с, 1,5 Н),0,78 (с, 3 Н). Пример 18. Гидрохлорид 3-(Е,Z)-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомо-7-(Z)гидроксииминоандростан-17-она (I-ar) Приготавливается в объеме 60% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7-(Z)гидроксииминоандростан-3,17-диона (II-h, пригот. 7, 148 мг) и дигидрохлорида 3-N- 13014333 метиламинопропоксиамина (III-b, пригот. 16, 79 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ar в виде сухого белого остатка. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,90 (bb, 1H), 8,66 (bb, 2H), 5,22 (bb, 1H), 3,98 (м, 2 Н),3,40 (м, 1 Н), 3,10 (м, 0,5 Н), 2,91 (м, 2 Н), 2,85 (м, 0,5 Н), 2,52 (с, 3 Н), 2,47-0,94 (м, 18 Н), 0,82 (с, 1,5 Н), 0,81(с, 1,5 Н), 0,78 (с, 3 Н). Пример 19. Гидрохлорид 3-(Е,Z)-[3-(R)-пирролидинил]оксиимино)-6-аза-7 а-гомо-7-(Z)гидроксииминоандростан-17-она (I-as) Приготавливается в объеме 60% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7-(Z)гидроксииминоандростан-3,17-диона (II-h, пригот. 7, 179 мг) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-c, пригот. 17, 94 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-as в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,27 (bb, 2 Н), 8,93 (bb, 1H), 5,26 (bb, 1H), 4,76 (bb, 1H),3,43 (m, 1H), 3,06-3,30 (м, 4,5 Н), 2,87 (м, 0,5H), 2,45 (M, 0,5H), 2,39 (м, 1 Н), 2,26 (м, 0,5 Н), 1,90-2,17 (м,8,5H), 1,82-0,93 (м, 10 Н), 0,83 (с, 1,5 Н), 0,82 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 20. Гидрохлорид(E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-метоксииминоандростан-17-она (I-at) Приготавливается в объеме 60% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7-(Z)метоксииминоандростан-3,17-диона (II-i, пригот. 8, 65 мг) и дигидрохлорида 2-аминоэтоксиамина (28 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-at в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,87 (bb, 3 Н), 5,31 (bb, 0,5H), 5,28 (bb, 0,5 Н), 4,08 (м,2 Н), 3,57 (с, 3 Н), 3,21 (м, 0,5 Н), 3,02 (м, 2 Н), 2,92 (м, 0,5 Н), 2,50-0,75 (м, 18 Н), 0,82 (с, 1,5 Н), 0,81 (с,1,5 Н), 0,78 (с, 3 Н). Пример 21. Гидрохлорид 3-(Е,Z)-[3-(R)-пирролидинил]оксиимино-6-аза-7 а-гомо-7-(Z)метоксииминоандростан-17-она (I-au) Приготавливается в объеме 70% выхода, как описано в примере 1, начиная с 6-аза-7 а-гомо-7-(Z)метоксииминоандростан-3,17-диона (II-i, пригот. 8, 61 мг) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-c, пригот. 17, 31 мг). Неочищенный продукт растерт с Et2O и осадок был отфильтрован с получением указанного в заголовке соединения I-au в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,72 (bb, 2 Н), 5,31 (bb, 1 Н), 4,75 (м, 1 Н), 3,58 (с, 3 Н),3,50-0,90 (м, 26 Н), 0,82 (с, 1,5 Н), 0,81 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 22. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-7,17-диона (I-av) Приготавливается в объеме 65% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,7,17-триона (II-j, пригот. 9, 96 мг) и дигидрохлорида 2-аминоэтоксиамина (47 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-av в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,97 (bb, 3 Н), 6,99 (bb, 1 Н), 4,08 (м, 2 Н), 3,58 (м, 1 Н),3,10-1,75 (м, 3 Н), 2,50-1,00 (м, 18 Н), 1,05 (с, 1,5 Н), 1,04 (с, 1, 5 Н), 0, 78 (с, 3 Н). Пример 23. Гидрохлорид (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-аза-7 а-гомоандростан-7,17 диона (I-aw) Приготавливается в объеме 70% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,7,17-триона (II-j, пригот. 9, 58 мг) и дигидрохлорида 3-N-метиламинопропоксиамина(III-b, пригот. 16, 32 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-aw в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,50 (bb, 2 Н), 6,98 (bb, 1 Н), 3,97 (м, 2 Н), 3,59 (м, 1 Н),2,88 (м, 3 Н), 2,52 (с, 1,5 Н), 2,51 (с, 1,5 Н), 2,50-0,95 (м, 20 Н), 1,05 (с, 1,5 Н), 1,04 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 24. Гидрохлорид (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-7,17 диона (I-ax) Приготавливается в объеме 75% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,7, 17-триона (II-j, пригот. 9, 95 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина(III-с, пригот. 17, 32 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-ax в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,04 (bb, 2 Н), 6,99 (bb, 1H), 4,74 (bb, 1H), 3,58 (bb, 1H),3,07-3,28 (м, 3 Н), 2,88 (м, 2 Н), 2,46-1,31 (м, 18 Н), 1,09 (м, 2 Н), 1,05 (с, 1,5 Н), 1,04 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 25. Дифумарат (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-17-она (I-ay) Приготавливается в объеме 71% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,17-диона (II-k, пригот. 10, 44 мг) и дигидрохлорида 2-аминоэтоксиамина (21 мг). Через 1,5 ч смесь была лиофилизирована и осадок очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 90/10/1). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением соединения I-ay в виде белого твердого вещества.(I-az) Приготавливается в объеме 60% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,17-диона (II-k, пригот. 10, 63 мг) и дигидрохлорида 3-N-метиламинопропоксиамина (IIIb, пригот. 16, 37 мг). Через 1,5 ч смесь была лиофилизирована и осадок был очищен при помощи флэшхроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 85/15/1,5). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением указанного в заголовке соединения I-az в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,49 (bb, 1H), 8,39 (bb, 2H), 6,61 (с, 4 Н), 3,96 (т, 2 Н),3,47 (bb, 1H), 3,11 (bb, 2H), 2,92 (bb, 2H), 2,89 (bb, 1H), 2,55 (с, 3 Н), 2,34 (bb, 1H), 2,23-1,30 (м, 18 Н), 0,96(с, 1,5 Н), 0,95 (с, 1,5 Н), 0,81 (с, 3 Н). Пример 27. Дифумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-17-она (I-ba) Приготавливается в объеме 82% выхода, как описано в примере 1, начиная с 7 а-аза-7 агомоандростан-3,17-диона (II-k, Пригот. 10, 93 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (IIIс, Пригот. 17, 53 мг). Через 2 ч смесь была лиофилизирована и осадок был очищен при помощи флэшхроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 83/17/1,7). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением указанного в заголовке соединения I-ba в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):6,45 (с, 4 Н), 4,72 (bb, 1H), 3,25 (м, 3 Н), 3,11 (м, 1 Н),2,87 (м, 3 Н), 2,44 (м, 1 Н), 2,30-0,99 (м, 20 Н), 0,94 (с, 3 Н), 0,79 (с, 3 Н). Пример 28. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-формил-7 а-гомоандростан-17-она(I-bb) Приготавливается в объеме 75% выхода, как описано в примере 1, начиная с 7 а-аза-7 а-формил-7 агомоандростан-3,17-диона (II-1, пригот. 11, 50 мг) и дигидрохлорида 2-аминоэтоксиамина (23 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bb в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,12 (с, 1 Н), 7,86 (bb, 3 Н), 4,11 (т, 1 Н), 4,06 (т, 2 Н),3,46 (bb, 1H), 3,18 (т, 1 Н), 3,03 (м, 0,5 Н), 3,02 (т, 2 Н), 2,91 (м, 0,5 Н), 2,35 (м, 1 Н), 2,72-1,12 (м, 17 Н), 0,90(с, 3 Н), 0,78 (с, 3 Н). Пример 29. Гидрохлорид (E,Z) 3-(3-М-метиламинопропоксиимино)-7 а-аза-7 а-формил-7 агомоандростан-17-она (I-bc) Приготавливается в объеме 63% выхода, как описано в примере 1, начиная с 7 а-аза-7 а-формил-7 агомоандростан-3,17-диона (II-1, пригот. 11, 66 мг) и дигидрохлорида 3-N-метиламинопропоксиамина (IIIb, пригот. 16, 35 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bc в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,54 (bb, 2 Н), 8,12 (с, 1 Н), 4,11 (т, 1 Н), 3,95 (т, 2 Н),3,46 (м, 1 Н), 3,17 (т, 1 Н), 2,95 (bb, 0,5 Н), 2,88 (т, 2 Н), 2,81 (bb, 0,5 Н), 2,51 (с, 3 Н), 2,35 (м, 1 Н), 2,20-1,05(E,Z) 3-[3-(R)-пирролидинил]оксиимино-7 а-аза-7 а-формил-7 агомоандростан-17-она (I-bd) Приготавливается в объеме 65% выхода, как описано в примере 1, начиная с 7 а-аза-7 а-формил-7 агомоандростан-3,17-диона (II-1, пригот. 11, 64 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина (IIIс, пригот. 17, 34 мг). Неочищенный продукт растерт Et2O и осадок отфильтрован с получением I-bd в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :8,96 (bb, 2 Н), 8,12 (с, 1 Н), 4,73 (м, 1 Н), 4,11 (м, 1 Н),3,50-3,05 (м, 6 Н), 2,97 (м, 0,5 Н), 2,83 (м, 0,5 Н), 2,40-1,05 (м, 20 Н), 0,89 (с, 3 Н), 0,78 (с, 3 Н). Пример 31. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7-окса-7 а-гомоандростан-6,17-диона (I-be) Приготавливается в объеме 66% выхода, как описано в примере 1, начиная с 7-окса-7 агомоандростан-3,6,17-триона (II-т, пригот. 12, 88 мг) и дигидрохлорида 2-аминоэтоксиамина (41 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-be в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,78 (bb, 3 Н), 4,29 (т, 1 Н), 4,13-3,69 (м, 3 Н), 3,28-3,18(III-b, пригот. 16, 72 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bf- 15014333 в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,53 (bb, 3 Н), 4,32 (м, 1 Н), 4,09-3,94 (м, 3 Н), 3,29-3,19(III-с, пригот. 17, 4 8 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bg в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,20 (bb, 1H), 9,12 (bb, 1H) 4,76 (bb, 1H), 4,43-4,21 (м,1 Н), 4,13-3,97 (м, 1 Н), 3,28 (м, 4 Н), 3,20 (bb, 0,5H) 2,69-2,23 (м, 3 Н), 2,20-1,08 (м, 16 Н), 0,87 (с, 3 Н), 0,81(с, 3 Н). Пример 34. Фумарат (E,Z) 3-(2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-7,17-диона (I-bh) Приготавливается в объеме 56% выхода, как описано в примере 1, начиная с 6-окса-7 агомоандростан-3,7,17-триона (II-n, пригот. 12, 60 мг) и дигидрохлорида 2-аминоэтоксиамина (28 мг). Через 20 ч неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26%NH4OH 90/7/0,7). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением указанного в заголовке соединения I-bh в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):6,42 (с, 2 Н), 4,59 (м, 1 Н), 4,06 (т, 2 Н), 3,39 (м, 0,5 Н),2,98 (т, 2 Н), 2,92 (bb, 0,5H), 2,41 (м, 2 Н), 2,31 (bb, 1H), 2,22-1,03 (м, 15 Н), 0,93 (с, 1,5 Н) 0,91 (с, 1,5 Н), 0,80(с, 3 Н). Пример 35. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-7,17-диона (I-bi) Приготавливается в объеме 58% выхода, как описано в примере 1, начиная с 7 а-окса-7 агомоандростан-3,7,17-триона (II-o, пригот. 13, 8 0 мг) и дигидрохлорида 2-аминоэтоксиамина (37 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bi в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,66 (bb, 3H), 4,72 (т, 1 Н), 4,06 (т, 2 Н), 3,14 (м, 1 Н),3,02 (м, 2 Н), 2,99 (м, 0,5 Н), 2,42 (м, 0,5 Н), 2,30-1,12 (м, 17 Н), 1,06 (с, 1,5 Н) 1,05 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 36. Гидрохлорид (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-окса-7 а-гомоандростан-7,17 диона (I-bj) Приготавливается в объеме 71% выхода, как описано в примере 1, начиная с 7 а-окса-7 агомоандростан-3,7, 17-триона (II-o, пригот. 13, 75 мг) и дигидрохлорида 3-N-метиламинопропоксиамина(III-b, пригот. 16, 41 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bj в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,70 (м, 1 Н), 3,97 (т, 2 Н), 3,13 (м, 1 Н), 2,98-2,84 (м,3 Н), 2,54 (с, 3 Н), 2,44 (м, 1 Н), 2,28-1,09 (м, 18 Н), 1,06 (с, 1,5 Н) 1,05 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 37. Гидрохлорид (E,Z) 3-[3-(R)пирролидинил]оксиимино-7 а-окса-7 а-гомоандростан-7,17 диона (I-bk) Приготавливается в объеме 69% выхода, как описано в примере 1, начиная с 7-окса-7 агомоандростан-3,7,17-триона (II-о, пригот. 13, 95 мг) и дигидрохлорида 3-(R)-пирролидинилоксиамина(III-с, пригот. 17, 58 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bk в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,89 (bb, 2 Н), 4,71 (м, 2 Н), 3,41-3,05 (м, 5 Н), 2,93 (м,1 Н), 2,43 (м, 1 Н), 2,30-1,09 (м, 18 Н), 1,06 (с, 1,5 Н), 1,05 (с, 1,5 Н), 0,78 (с, 3 Н). Пример 38. Гидрохлорид (E,Z) 3- (2-аминоэтоксиимино)-6-окса-5(3-андростан-7, 17-диона (I-bl) Приготавливается в объеме 30% выхода, как описано в примере 1, начиная с 6-окса-5-андростан 3,7, 17-триона (II-р, пригот. 14, 3 60 мг) и дигидрохлорида 2-аминоэтоксиамина (176 мг). Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением I-bl в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,88 (bb, 3H), 4,41 (bb, 1H), 4,11 (м, 2 Н), 3,16 (м, 0,5 Н),3,05 (м, 2 Н), 2,76 (м, 1 Н), 2,70 (м, 0,5 Н), 2,61-1,93 (м, 5 Н), 1,74-1,08 (м, 10 Н), 1,02 (с, 3 Н), 0, 82 (с, 3 Н). Пример 39. Фумарат (Е) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (I-bm) Смесь 3(Е)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17 диона (II-q, пригот. 18, 720 мг) и 1 М фторида тетрабутиламмония в THF (1,49 мл) перемешивали при комнатной температуре в течение 2 ч. Раствор был сконцентрирован до малого объема и очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 86/14/1,4). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН и выпарено досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-bm в виде белого твердого вещества (340 мг, 57%). 1 Н-ЯМР (300 МГц, D2O, м.д. из TMS):7,37 (bb, 1 Н), 6,66 (с, 2 Н), 4,25 (м, 2 Н), 3,76 (м, 1 Н), 3,30 (м,- 16014333 2 Н), 3,01 (м, 1 Н), 2,69-1,10 (м, 18 Н), 0,97 (с, 3 Н), 0,92 (с, 3 Н). Пример 40. Фумарат (Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (I-bn) Смесь 3(Z)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17 диона (II-r, пригот. 18, 688 мг) и 1 М фторида тетрабутиламмония в THF (1,5 мл) перемешивали при комнатной температуре в течение 2 ч. Раствор был сконцентрирован до малого объема и очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 86/14/1,4). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН и выпарено досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединенияI-bn в виде белого твердого вещества (320 мг, 56%). 1 Н-ЯМР (300 МГц, D2O, м.д. из TMS):7,38 (bb, 1 Н), 6,56 (с, 2 Н), 4,26 (м, 2 Н), 3,75 (м, 1 Н), 3,32 (м,3 Н), 2,66-1,16 (м, 18 Н), 0,97 (с, 3 Н), 0,92 (с, 3 Н). Пример 41. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-В-гомоандростан-17-она (I-bo) Приготавливается, как описано в примере 1, начиная с В-гомоандростан-3, 17-диона (50 мг, X. Дж. Рингольд, J. Am. Chem. Soc. 1960, 961) и дигидрохлорида 3-(2-аминоэтоксиамина (25 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-bo в виде белого твердого вещества (57 мг, 87%). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,40 (с, 2 Н), 4,06 (м, 2 Н), 3,04 (м, 2 Н), 2,88 (м, 0,5 Н),2,81 (м, 0,5 Н), 2,44-0,80 (м, 23 Н), 0,90 (с, 3 Н), 0,77 (с, 3 Н). Пример 42. Гидрохлорид (Е,Z)-3-[3-(R)-пирролидинил]оксиимино-В-гомоандростан-17-она (I-bp) Приготавливается в соответствии с описаниями, представленными в примере 1, начиная с Вгомоандростан-3,17-диона (50 мг, X. Дж. Рингольд, J. Am. Chem. Soc. I960, 961) и дигидрохлорида 3-(R)пирролидинилоксиамина (III-с, пригот. 17, 58 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-bp в виде белого твердого вещества (96 мг, 69%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,02 (bb, 2H), 4,71 (м, 12 Н), 3,40-3,05 (м, 4 Н), 2,81 (м,0,5 Н), 2,75 (м, 0,5 Н), 2,45-0,82 (м, 25), 0,91 (с, 3 Н), 0,78 (с, 3 Н). Пример 43. Фумарат (Е,Z)-3-(3-N-метиламинопропоксиимино)-6-окса-7 а-гомоандростан-7,17 диона(I-bq) Приготавливается в объеме 49% выхода, как описано в примере 1, начиная с 6-окса-7 агомоандростан-3,7,17-триона (II-n, пригот. 12, 210 мг) и дигидрохлорида 3-N-метиламинопропоксиамина(III-b, 117 мг). Через 20 ч неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением указанного в заголовке соединения I-bq в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):6,42 (с, 2 Н), 4,58 (м, 1 Н), 3,98 (м, 2 Н), 3,23 (м, 0,5 Н),2,89-1,0 (м, 22, 5 Н), 2,47 (с, 3 Н), 0,92 (с, 1,5 Н), 0,91 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 44. Фумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-окса-7 а-гомоандростан-7,17-диона(III-с, 117 мг). Через 2 ч неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/MeOH/26% NH4OH 90/10/0,1). К концентрированным фракциям было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления Et2O осадок был отфильтрован с получением указанного в заголовке соединения I-br в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :6,44 (с, 2 Н), 4,74 (м, 1 Н), 4,62 (дд, 0,5 Н), 4,54 (дд,0,5 Н), 3,40-1,00 (м, 25 Н), 0,92 (с, 1,5 Н) 0,91 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 45. Гидрохлорид (Е,Z)-3- (2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-17-она (I-bs) Приготавливается, как описано в примере 1, начиная с 6-окса-7 а-гомоандростан-3,17-диона (II-s,пригот. 19, 35 мг) и дигидрохлорида 3-(2-аминоэтоксиамина (17 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с EtOAc и осадок отфильтрован с получением указанного в заголовке соединения I-bs в виде белого твердого вещества (43 мг, 94%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,87 (bb, 3 Н), 4,08 (м, 2 Н), 3,78-3,40 (м, 3 Н), 3,18 (м,0,5 Н), 3,04 (м, 2 Н), 2,94 (дд, 0,5 Н), 2,50-1,75 (м, 18 Н), 0,90 (с, 1,5 Н), 0,90 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 46. Гидрохлорид (Е,Z)-3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-17-она (I-bt) Приготавливается, как описано в примере 1, начиная с 7 а-окса-7 а-гомоандростан-3,17-диона (II-t,пригот. 20, 85 мг) и дигидрохлорида 3-(2-аминоэтоксиамина (41 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-bt в виде белого твер- 17014333 дого вещества (80 мг, 72%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,83 (bb, 3 Н), 4,07 (м, 2 Н), 3,65-3,35 (м, 3 Н), 3,02 (м,2 Н), 2,46-1,01 (м, 18 Н), 0,95 (с, 1,5 Н), 0,94 (с, 1,5 Н), 0,79 (с, 3 Н). Пример 47. Гидрохлорид (E,Z) 3-(2-аминоэтоксиимино)-6-азаандростан-7,17-диона (I-bu) Приготавливается в соответствии с описанием, представленным в примере 1, начиная с 6 азаандростан-3,7,17-триона (II-u, пригот. 21, 147 мг) и дигидрохлорида 3-(2-аминоэтоксиамина (72 мг). Объединенные органические экстракты были высушены над Na2SO4, отфильтрованы и выпарены досуха. Неочищенный продукт растерт с Et2O и осадок отфильтрован с получением указанного в заголовке соединения I-bu в виде белого твердого вещества (141 мг, 73%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,88 (bb, 3 Н), 7,46 (с, 0,5 Н), 7,37 (с, 0,5 Н), 4,09 (м, 3 Н),3,17 (м, 0,5 Н), 3,04 (м, 3,5 Н), 2,40-1,00 (м, 16 Н), 0, 90 (с, 3 Н), 0, 82 (с, 3 Н). Пример 48. Фумарат (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-азаандростан-7,17-диона (I-bv) Приготавливается в объеме 58% выхода, как описано в примере 1, начиная с 6-азаандростан-3,7,17 триона (II-u, пригот. 21, 55 мг) и дигидрохлорида 3(R)-пирролидинилоксиамина (III-с, 32 мг). Через 2 ч 2 М NaOH было добавлено и водная фаза была извлечена при помощи CH2Cl2 (3). Объединенные органические экстракты были промыты соляным раствором, высушены через Na2SO4 и выпарены досуха. Осадок был растворен в МеОН и было добавлено стехиометрическое количество фумаровой кислоты в МеОН. После добавления EtOAc осадок был отфильтрован с получением указанного в заголовке соединения I-bv в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,46 (с, 0,5 Н), 7,33 (с, 0,5 Н), 6,42 (с, 2 Н), 4,72 (м, 1 Н),3,30-2,95 (м, 6 Н), 2,40-1,00 (м, 18 Н), 0,89 (с, 3 Н), 0,81 (с, 3 Н). Приготовление 1. 6-аза-7 а-гомоандростан-3,7,17-трион (II-а) К перемешиваемому раствору 3,3:17,17-бис(этилендиокси)андростан-6-она (4,5 г) в THF (92 мл) был быстро добавлен по каплям раствор гидрохлорида гидроксиламина (2,4 г), Na2HPO412 Н 2 О (12,33 г) в Н 2 О (44,5 мл). Через 24 ч смесь была экстрагирована при помощи EtOAc (3). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4, отфильтрованы и выпарены досуха с получением 3,3:17,17-бис(этилендиокси)-6(Е)-гидроксииминоандростана (4,65 г, 100%). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):10,37 (с, 1 Н), 3,92-3,67 (м, 8 Н), 3,15 (bb, 1 Н), 2,16 (м,1 Н), 1,95-1,07 (м, 17 Н), 0,94 (с, 1 Н), 0,74 (с, 3 Н), 0,64 (с, 3 Н). К перемешиваемому раствору 3,3:17,17-бис(этилендиокси)-6(Е)-гидроксииминоандростана (7,2 г) в пиридине (115 мл) был добавлен хлорид тозила (10,15 г) при 0 С. Через 24 ч пребывания при комнатной температуре раствор был нагрет до 40 С в течение 48 ч. После охлаждения при комнатной температуре была добавлена вода (5,5 мл). Через 48 ч раствор был погашен 5% водным раствором NaHCO3 до рН 8. Раствор был выпарен, была добавлена вода (180 мл) и водная фаза была извлечена при помощи CH2Cl2(380 мл). Объединенные органические экстракты были промыты соляным раствором, высушены надNa2SO4 и выпарены досуха. Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,гексан/Et2O 90/10) с получением 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомоандростан-7-она (6,56 г, 91%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,03 (bb, 1H), 3,93-3,69 (м, 8 Н), 3,47-3,37 (м, 1 Н), 2,32(м, 1 Н), 1,98-1,10 (м, 17 Н), 0,76 (с, 3 Н), 0,72 (с, 3 Н). Раствор 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомоандростан-7-он (2,42 г) и pTSAH2O (5,67 г) в ацетоне (190 мл) и воде (19 мл) перемешивался при температуре кипения с обратным холодильником в течение 2 ч. Раствор был нейтрализован добавлением 5% водного NaHCO3 и ацетон был выпарен. Водная фаза была извлечена при помощи CH2Cl2 (350 мл). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха. Осадок растерт со смесьюEtOAc/Et2O 40/60 и осадок отфильтрован с получением указанного в заголовке соединения II-а в виде белого твердого вещества (1,50 г, 95%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,23 (bb, 1 Н), 3,86-3,73 (м, 1 Н), 2,64-1,04 (м, 19 Н), 0,92(с, 3 Н), 0,80 (с, 3 Н). Приготовление 2. 6-аза-6-метил-7 а-гомоандростан-3,7,17-трион (II-b) К перемешиваемому раствору 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомоандростан-7-она (пригот. 1, 1,00 г) в THF под N2 (40 мл) был добавлен NaH (60% дисперсия в минеральном масле, 490 мг). Через 1 ч был добавлен Mel (1,064 мл). После перемешивания при комнатной температуре в течение 1,5 ч смесь была погашена добавлением Н 2 О (30 мл) и водная фаза была извлечена при помощи EtOAc (3). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха с получением 3,3:17,17-бис(этилендиокси)-6-аза-6-метил-7 а-гомоандростан-7-она (1,00 г,97%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):3,95-3,70 (м, 9 Н), 2,76 (с, 3 Н), 2,50 (м, 1 Н), 2,14-2,00(м, 2 Н), 1,94-1,08 (м, 15 Н), 1,04-0,92 (м, 1 Н), 0,79 (с, 3 Н), 0,75 (с, 3 Н). 6-аза-6-метил-7 а-гомоандростан-3,7,17-трион (II-b) был приготовлен в объеме 85% выхода из 3,3:17,17-бис(этилендиокси)-6-аза-6-метил-7 а-гомоандростан-7-она при помощи процедуры, описанной выше для приготовления 6-аза-7 а-гомоандростан-3,7, 17-триона (пригот. 1). Объединенные органические- 18014333 экстракты были промыты Н 2 О, высушены над Na2SO4 и выпарены досуха с получением соединения II-b. 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,32 (м, 1 Н), 3,04-2,93 (м, 1 Н), 2,76 (м, 1 Н), 2,73 (с,3 Н), 2,46-1,05 (м, 17 Н), 0,83 (с, 3 Н), 0,79 (с, 3 Н). Приготовление 3. 3(Е)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17 дион (II-с) и 3(Z)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17 дион (II-d) К перемешиваемому раствору гидрохлорида (E,Z) 3-(2 аминоэтоксиимино)-6-аза-6-метил-7 агомоандростан-7,17-диона (I-ae) (430 мг, соотношение 35/65) и Et3N (301 мкл) под N2 в CH2Cl2 (35 мл) при 0 С был добавлен 9-флуоренилметоксикарбонилхлорид (301 мг). После перемешивания в течение ночи при комнатной температуре была добавлена вода и смесь была экстрагирована при помощи CH2Cl2. Органическая фаза была промыта 5% раствором NaHCO3 и высушена над Na2SO4 и выпарена досуха. Осадок был очищен при помощи флэш-хроматографии (SiO2; н-гексан/EtOAc 70/30) с получением 3(Е)[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 а-гомоандростан-7,17-диона (11 с, 205 мг, 33%) и 3(Z)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 агомоандростан-7,17-диона (II-d, 168 мг, 27%).(2 мл) был добавлен реагент Лавессона (40 мг) и размешан при комнатной температуре в течение 3 ч. Был добавлен SiO2, и смесь была выпарена досуха. Осадок был очищен при помощи флэшхроматографии (гексан/ацетон 65/35) до указанного в заголовке соединения II-e (48 мг, 88%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,72 (bb, 1H), 4,13 (м, 1 Н), 2,91-2,70 (м, 3 Н), 2,46-2,30THF под N2 (35 мл) был добавлен LiAlH4 (0,607 мг) порциями в течение более чем 5 мин при комнатной температуре и смесь перемешивали при температуре кипения с обратным холодильником в течение 1 ч. Суспензия была охлаждена при помощи ледяной бани и затем погашена осторожным добавлением Н 2 О(0,6 мл) и 4N NaOH (0,6 мл). Смесь была профильтрована через слой целита и фильтровальная лепешка промыта THF (310 мл). Фильтрат был промыт соляным раствором, высушен над Na2SO4, выпарен досуха и осадок очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 92/8/0,8) с получением 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомоандростана (880 мг, 77%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):3,87-3,07 (м, 8 Н), 2,84 (м, 1 Н), 2,64-2,51 (м, 2 Н), 1,910,99 (м, 19 Н), 0,76 (с, 3 Н), 0,75 (с, 3 Н), 0,67 (м, 1 Н). 6-аза-7 а-гомоандростан-3,17-дион был приготовлен в объеме 95% выхода из 3,3:17,17 бис(этилендиокси)-6-аза-7 а-гомоандростана при помощи описанной выше процедуры приготовления 6 аза-7 а-гомоандростан-3,7,17-триона (пригот. 1). Объединенные органические экстракты были промыты H2O, высушены над Na2SO4 и выпарены досуха с получением указанного в заголовке соединения II-f. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):2,94-2,76 (м, 2 Н), 2,63 (м, 1 Н), 2,46-2,21 (м, 3 Н), 2,141,89 (м, 5 Н), 1,82-1,02 (м, 11 Н), 0,97 (с, 3 Н), 0,84 (м, 1 Н), 0,79 (с, 3 Н). Приготовление 6. 6-аза-6-формил-7 а-гомоандростан-3,17-дион (II-g) 1 М раствора муравьиной кислоты в CHCl3 (3,9 мл) был добавлен по каплям в раствор DCC (403 мг) в CHCl3 при 0 С. Смесь перемешивалась в течение дополнительных 5 мин и затем добавлена в охлажденный льдом раствор 6-аза-7 а-гомоандростан-3,17-диона (II-f, пригот. 5, 300 мг) в пиридине (2,9 мл). Смесь перемешивалась на ледяной бане в течение 1 ч. Испарение растворителя вслед за добавлениемEtOAc образовало осадок, который был удален при помощи фильтрации и промыт EtOAc. Объединенные органические экстракты были выпарены досуха и осадок был очищен при помощи флэш-хроматографии(SiO2, гексан/ацетон 1/1) до указанного в заголовке соединения II-g (250 мг, 76%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,29 (с, 1 Н), 3,81-3,72 (м, 2 Н), 3,29 (м, 1 Н), 2,93 (м,1 Н), 2,47-0,97 (м, 18 Н), 0,97 (с,3 Н), 0,76 (с, 3 Н). Приготовление 7. 6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-3,17-дион (II-h) 3,3-(17,17-бис (этилендиокси)-6-аза-7 а-гомо-7-тиоксоандростан был приготовлен в объеме 62% выхода из 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомоандростана (пригот. 5, 5 67 мг) в соответствии с опи- 19014333 санной выше процедурой приготовления 6-аза-7 а-гомо-7-тиоксоандростан-3,17-диона (пригот. 4). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/EtOAc 40/60). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,55 (bb, 1 Н), 3,92-3,65 (м, 9 Н), 2,80-2,58 (м, 2 Н), 1,990,98 (м, 17 Н), 0,77 (с, 3 Н), 0,73 (с, 3 Н). К перемешиваемому раствору 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомо-7-тиоксоандростана (600 мг) в пиридине (30 мл) был добавлен гидрохлорид гидроксиамина (789 мг). Через 48 ч пребывания при 60 С раствор был охлажден и погашен 5% водным раствором NaHCO3 до рН 8. После выпаривания раствора была добавлена вода (180 мл) и водная фаза была извлечена при помощи CH2Cl2 (380 мл). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха. Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2,CH2Cl2/изопропил алкол/МеОН 94/3/3) с получением 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомо-7-(Z)гидроксииминоандростана (510 мг, 85%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,70 (с, 1 Н), 4,90 (bb, 1 Н), 3,94-3,68 (м, 8 Н), 2,12-1,07(м, 19 Н), 0,86 (bb, 1H), 0,75 (с, 3 Н), 0,70 (с, 3 Н). 6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-3,17-дион был приготовлен в объеме 95% выхода из 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомо-7-(2)-гидроксииминоандростана (461 мг) в соответствии с описанной выше процедурой приготовления 6-аза-7 а-гомоандростан-3,7,17-триона (пригот. 1). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/iPrOH 95/5) с получением указанного в заголовке соединения II-h (369 мг). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :8,83 (с, 1 Н), 5,14 (bb, 1 Н), 3,67 (м, 1 Н), 2,70 (м, 1 Н),2,48-1,90 (м, 9 Н), 1,81-1,02 (м, 9 Н), 0,91 (с, 3 Н), 0,73 (с, 3 Н). Приготовление 8. 6-аза-7 а-гомо-7-(Z)-метоксиаминоандростан-3,17-дион (II-i) К перемешиваемому раствору 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомо-7-тиоксоандростана (Пригот. 6) (240 мг) в пиридине (6,5 мл) был добавлен гидрохлорид метоксиамина (380 мг). Через 48 ч пребывания при 60 С в герметичной емкости раствор был охлажден и погашен 5% водным раствором NaHCO3 до рН 8. После выпаривания раствора была добавлена вода (180 мл) и водная фаза извлечена при помощиCH2Cl2 (380 мл). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха. Неочищенный продукт был очищен при помощи флэш-хроматографии(м, 19 Н), 0,94-0,80 (м, 1 Н), 0,75 (с, 3 Н), 0,70 (с, 3 Н). 6-аза-7 а-гомо-7-(Z)-метоксииминоандростан-3,17-дион был приготовлен в объеме 95% выхода из 3,3:17,17-бис(этилендиокси)-6-аза-7 а-гомо-7-(Z)-метоксииминоандростана (210 мг) в соответствии с описанной выше процедурой приготовления 6-аза-7 а-гомоандростан-3,7,17-триона (пригот. 1). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/EtOAc 5/95) с получением указанного в заголовке соединения II-i (176 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):5,32 (bb, 1H), 3,69 (м, 1 Н), 3,57 (с, 3 Н), 2,73 (м, 1 Н),2,47-1,90 (м, 8 Н), 1,81-0,99 (м, 10 Н), 0,90 (с, 3 Н), 0,79 (с, 3 Н). Приготовление 9. 7 а-аза-7 а-гомоандростан 3,7,17-трион (II-j) Смесь 3,3:17,17-бис(этилендиокси)андрост-5-ен-7-она (5,99 г) и 10% Pd/C (0,599 г) в диоксане (186 мл) размешивались под Н 2 при атмосферном давлении в течение 7 ч. Смесь была профильтрована через целит и фильтрат был выпарен досуха. Неочищенный продукт был очищен при помощи флэшхроматографии (SiO2, гексан/EtOAc 75/25). Продукт растерт с гексаном/Et2O 1/1 и осадок отфильтрован с получением 3,3:17,17-бис(этилендиокси)андростан-7-она (4,06 г, 67%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):3,94-3,74 (м, 8 Н), 2,47 (м, 1 Н), 2,40 (м, 1 Н), 2,20 (м,1 Н), 1,94-1,02 (м, 17 Н), 1,13 (с, 3 Н), 0, 82 (с, 3 Н). 3,3:17,17-бис(этилендиокси)-7(Е)-гидроксииминоандростан был приготовлен в количественном объеме выхода из 3,3:17,17-бис (этилендиокси) андростан-7-она (2,20 г) в соответствии с описанной выше процедурой приготовления 3,3:17,17-бис(этилендиокси)-6(Е)-гидроксииминоандростана (пригот. 1). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):10,17 (с, 1 Н), 3,88-3,71 (м, 8 Н), 2,89 (bb, 1 Н), 2,23-2,05(м, 2 Н), 1,89-0,97 (м, 16 Н), 0,90 (с, 3 Н), 0,80 (м, 1 Н), 0,77 (с, 3 Н). 7(Е)-гидроксииминоандростан-3, 17-дион был приготовлен в объеме 59% выхода из 3,3:17,17 бис(этилендиокси)-7(Е)-гидроксииминоандростана (1,1 г) при помощи описанной выше процедуры приготовления 6-аза-7 а-гомоандростан-3,7,17-триона (пригот. 1). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/ацетон/гексан 20/20/60) с получением 7(Е)гидроксииминоандростан-3,17-диона (508 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):10,37 (с, 1 Н), 3,00 (bb, 1H), 2,57-2,30 (м, 5 Н), 2,15-1,88(м, 4 Н), 1,74-0,89 (м, 10 Н), 1,13 (с, 3 Н), 0, 82 (с, 3 Н). 7 а-аза-7 а-гомоандростан-3,7,17-трион был приготовлен в объеме 79% выхода из 7(Е)гидроксииминоандростан-3,17-диона (4 90 мг) при помощи описанной выше процедуры приготовления(м, 2 Н), 2,27-1,30 (м, 14 Н), 1,15 (с, 3 Н), 1,11 (м, 2 Н), 0,79 (с, 3 Н). Приготовление 10. 7 а-аза-7 а-гомоандростан-3,17-дион (II-k) 3,3:17,17-бис (этилендиокси)-7 а-аза-7 а-гомоандростан-7-он был приготовлен в объеме 91% выхода из 3,3:17,17-бис (этилендиокси)-7 (Е)-гидроксииминоандростана (пригот. 9, 640 мг) в соответствии с описанной выше процедурой приготовления 3,3:17,17-бис (этилендиокси)-6-аза-7 а-гомоандростана (пригот. 1). Неочищенный продукт растерт с гексаном/Et2O 9/1 с получением 3,3:17,17-бис(этилендиокси)-7 ааза-7 а-гомоандростан-7-она (583 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):6,74 (bb, 1 Н), 3,88-3,71 (м, 8 Н), 3,30 (м, 1 Н), 2,75-2,65(м, 1 Н), 1,99-1,10 (м, 17 Н), 0,96 (м, 1 Н), 0,92 (с, 3 Н), 0,75 (с, 3 Н). 3,3:17,17-бис(этилендиокси)-7 а-аза-7 а-гомоандростан был приготовлен в объеме 44% выхода из 3,3:17,17-бис(этилендиокси)-7 а-аза-7 а-гомоандростан-7-она (296 мг) в соответствии с описанной выше процедурой приготовления 3,3:17,17-бис (этилендиокси)-6-аза-7 а-гомоандростана (пригот. 5). Неочищенный продукт был очищен при помощи флэш-хроматографии с получением 3,3:17,17 бис(этилендиокси)-7 а-аза-7 а-гомоандростана (125 мг). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):3,90-3,60 (м, 8 Н), 2,74-2,57 (м, 2 Н), 2,25 (м, 1 Н), 1,931,08 (м, 19 Н), 0,85 (м, 1 Н), 0,80 (с, 3 Н), 0,75 (с, 3 Н). 7 а-аза-7 а-гомоандростан-3,17-дион был приготовлен в количестве 42% выхода из 3,3:17,17 бис(этилендиокси)-7 а-аза-7 а-гомоандростана (395 мг) при помощи описанной выше процедуры приготовления 6-аза-7 а-гомоандростан-3,17-диона (пригот. 5). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH/26% NH4OH 93/7/0,7) с получением указанного в заголовке соединения II-k (128 мг). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):2,80-2,60 (м, 2 Н), 2,45-2,24 (м, 3 Н), 2,15-1,16 (м, 16 Н),1,15-0,93 (м, 2 Н), 1,05 (с, 3 Н), 0,79 (с, 3 Н). Приготовление 11. 7 а-аза-7 а-формил-7 а-гомоандростан-3,17-дион (II-1) 7 а-аза-7 а-формил-7 а-гомоандростан-3,17-дион был приготовлен в количественном объеме выхода из 7 а-аза-7 а-гомоандростан-3,17-диона (II-k, пригот. 10, 55 мг) в соответствии с описанной выше процедурой приготовления 6-аза-6-формил-7 а-гомоандростан-3,17-диона (пригот. 6). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон 60/40) с получением указанного в заголовке соединения II-1 (60 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):8,13 (с, 1 Н), 4,15 (м, 1 Н), 3,52-3,39 (м, 1 Н), 3,18 (м,1 Н), 2,47-1,08 (м, 19 Н), 0,91 (с, 3 Н), 0,89 (с, 3 Н). Приготовление 12. 7-окса-7 а-гомоандростан-3,6,17-трион (II-m) и 6-окса-7 а-гомоандростан-3,7,17 трион (II-n) К перемешиваемому раствору 6-гидроксиандростан-3,17-диона (4,90 г) в пиридине (10 мл) при 0 С были добавлены DMAP (94 мг) и Ас 2 О (4,55 мл). После перемешивания в течение ночи раствор был выпарен. Осадок был обработан водой и экстрагирован при помощи EtOAc (2). Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4, отфильтрованы и выпарены досуха с получением 6-ацетоксиандростан-3,17-диона (5,57 г, 100%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,66 (м, 1 Н), 2,47-2,33 (м, 2 Н), 2,30-2,01 (м, 4 Н), 2,00(с, 3 Н), 1,98-1,08 (м, 12 Н), 1,05 (с, 3 Н), 1,00 (м, 1 Н), 0,84 (м, 1 Н), 0, 80 (с, 3 Н). К перемешиваемому раствору 6-ацетоксиандростан-3,17-диона (5,57 г) в МеОН (188 мл) при 0 С под N2 порциями добавляли NaBH4 (615 мг) в течение 15 мин. После перемешивания в течение 1,5 ч при комнатной температуре смесь была погашена осторожным добавлением Н 2 О (200 мл). МеОН был выпарен и концентрированный раствор был экстрагирован при помощи EtOAc. Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха. Смесь была очищена при помощи флэш-хроматографии (SiO2, циклогексан/Et2O/ацетон 60/20/20) с получением 6 ацетоксиандростан-3,17-диола и 6-ацетоксиандростан-3,17-диола (90/10 смесь, 5,30 г, 95%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :4,55 (м, 1 Н), 4,49 (bb, 1 Н), 4,43 (bb, 1 Н), 3,41 (м, 1 Н),3,28 (м, 1 Н), 1,97 (с, 3 Н), 1,88-0,82 (м, 19 Н), 0,79 (с, 3 Н), 0,64 (м, 1 Н), 0,61 (с, 3 Н). К перемешиваемому раствору 6-ацетоксиандростан-3,17-диола и 6-ацетоксиандростан-3,17-диола (90/10 смесь, 5,30 г) в DMF (120 мл) при 0 С были добавлены имидазол (4,53 г) и третбутилдиметилхлорсилан (5,02 г). После перемешивания в течение ночи при комнатной температуре смесь была погашена добавлением Н 2 О (150 мл). DMF был выпарен и концентрированный раствор был экстрагирован при помощи Et2O. Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха. Смесь была очищена при помощи флэшхроматографии (SiO2, циклогексан/Et2O 95/5) с получением 3,17-ди(диметил-трет-бутилсилилокси)6-ацетоксиандростана и 3,17-ди(диметил-трет-бутилсилилокси)-6-ацетоксиандростана (90/10 смесь,7,58 г, 87%).(с, 3 Н), 1,93-0,88 (м, 20 Н), 0,85 (м, 20 Н), 0,68 (с, 3 Н), 0,68 (м, 1 Н), 0,03-0,00 (м, 12 Н). К размешиваемому раствору 3,17-ди (диметил-трет-бутилсилилокси)-6-ацетоксиандростана и 3,17-ди (диметил-трет-бутилсилилокси)-6-ацетоксиандростана (смесь 90/10, 7,58 г) в МеОН/диоксане 1/4 (100 мл) был добавлен K2CO3 (896 мг). После перемешивания при температуре 40 С в течение 72 ч смесь была погашена добавлением H2O. Органические растворители были выпарены и концентрированный раствор был экстрагирован при помощи EtOAc. Объединенные органические экстракты были промыты соляным раствором, высушены над Na2SO4 и выпарены досуха с получением 3,17-ди(4,07 г), ТРАР (0,412 г) и 4 А молекулярные сита (3,50 г). Смесь размешивали в течение 2 ч, а затем был добавлен SiO2. Смесь была очищена при помощи флэш-хроматографии (SiO2, H-гексан/Et2O 50/50) с получением 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она и 3,17-ди(диметил-третбутилсилилокси)андростан-6-она (смесь 90/10, 6,30 г, 100%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):3,68 (м, 1 Н), 3,67-3,57 (м, 1 Н), 2,38-2,30 (м, 1 Н), 2,202,12 (м, 1 Н), 1,99-1,05 (м, 18 Н), 0,90 (с, 9 Н), 0,88 (с, 9 Н), 0,75 (с, 3 Н), 0,74 (с, 3 Н), 0,07-0,03 (с, 12 Н). К размешиваемому раствору 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она и 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она (смесь 90/10, 660 мг) в CH2Cl2 (10 мл) при 0 С порциями добавлялась 3-хлорпербензойная кислота (70%, 1,20 г) в течение 15 мин. После перемешивания в течение 72 ч при комнатной температуре смесь была погашена осторожным добавлением водного раствора 5% K2CO3 (200 мл). Органический слой был промыт раствором Na2SO3, соляным раствором, высушен над Na2SO4 и выпарен досуха. Смесь была очищена при помощи флэш-хроматографии (SiO2, циклогексан/EtOAc 13/1) с получением 3,17-ди(диметил-трет-бутилсилилокси)-7-окса-7 а-гомоандростан-6-она и 3,17-ди (диметил-трет-бутилсилилокси)-7-окса-7 а-гомоандростан-6-она (смесь 90/10, 101 мг, 14%). 1 Н-ЯМР (300 МГц, ацетон-d6, м.д. из TMS):4,21-4,09 (м, 1 Н), 3,93 (м, 1 Н), 3,69-3,57 (м, 1 Н), 3,64THF (15 мл) был добавлен 1 М раствор TBAF в THF (7,40 мл). Через 48 ч смесь была погашена 5% водным раствором Na2HPO4 и экстрагирована CH2Cl2. Объединенные органические экстракты были промыты H2O, высушены над Na2SO4 и выпарены досуха. Осадок был очищен при помощи флэшхроматографии (SiO2, CH2Cl2/ацетон 80/20) с получением 3,17-дигидрокси-7-окса-7 а-гомоандростан-6 она и 3, 17-дигидрокси-7-окса-7 а-гомоандростан-6-она (смесь 90/10, 390 мг, 98%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,56 (bb, 1H), 4,52 (bb, 1 Н), 4,14 (м, 1 Н), 3,83 (bb, 1 Н),3,46-3,36 (м, 1 Н), 3,31 (м, 1 Н), 3,03 (м, 1 Н), 1,93-0,87 (м, 17 Н), 0,74 (с, 3 Н), 0,63 (с, 3 Н). 7-окса-7 а-гомоандростан-3,6,17-трион был приготовлен в объеме 84% выхода из 3,17 дигидрокси-7-окса-7 а-гомоандростан-6-она и 3,17-дигидрокси-7-окса-7 а-гомоандростан-6-она (смесь 90/10, 3 90 мг) при помощи описанной выше процедуры приготовления 3,17-ди (диметил-третбутилсилилокси)андростан-6-она и 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она (смесь 90/10, пригот. 12). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон 80/20) с получением 7-окса-7 а-гомоандростан-3,6,17-триона (II-m, 330 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,31 (bb, 1H), 4,05 (bb, 1 Н), 3,60 (м, 1 Н), 2,84 (bb, 1H),2,47-1,10 (м, 16 Н), 0, 94 (с, 3 Н), 0,82 (с, 3 Н). 3,17-дигидрокси-6-окса-7 а-гомоандростан-7-он и 3,17-дигидрокси-6-окса-7 а-гомоандростан-7 он (смесь 90/10) были приготовлены в объеме 96% выхода из 3,17-ди (диметил-трет-бутилсилилокси)6-окса-7 а-гомоандростан-7-она и 3,17-ди(диметил-трет-бутилсилилокси)-6-окса-7 а-гомоандростан-7 она (смесь 90/10, 1,32 г) в соответствии с описанной выше процедурой приготовления 3,17 дигидрокси-7-окса-7 а-гомоандростан-6-она и 3,17-дигидрокси-7-окса-7 а-гомоандростан-6-она (смесь- 22014333 90/10, пригот. 12). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон 60/40) с получением 3,17-дигидрокси-6-окса-7 а-гомоандростан-7-она и 3,17-дигидрокси 6-окса-7 а-гомоандростан-7-она (смесь 90/10, 740 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,72 (bb, 1H), 4,51 (bb, 1H), 4,43 (м, 1 Н), 3,46-3,36 (м,1 Н), 3,32 (м, 1 Н), 2,16 (м, 1 Н), 2,13 (м, 1 Н), 1,96-0,81 (м, 17 Н), 0,76 (с, 3 Н), 0,62 (с, 3 Н). 6-окса-7 а-гомоандростан-3,7,17-трион был приготовлен в объеме 70% выхода из 3,17 дигидрокси-6-окса-7 а-гомоандростан-7-она и 3,17-дигидрокси-6-окса-7 а-гомоандростан-7-она (смесь 90/10, 620 мг) при помощи описанной выше процедуры приготовления 3,17-ди(диметил-третбутилсилилокси)андростан-6-она и 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она (смесь 90/10, пригот. 12). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон/CH2Cl2 50/25/25) с получением указанного в заголовке соединения II-n (440 мг). 1 Н-ЯМР (300 МГц, ацетон-d6, м.д. из TMS):4,81 (м, 1 Н), 2,87-2,67 (м, 2 Н), 2,57-2,40 (м, 4 Н), 2,332,22 (м, 1 Н), 2,17-1,21 (м, 12 Н), 01,15 (с, 3 Н), 0,92 (с, 3 Н). Приготовление 13. 7 а-окса-7 а-гомоандростан-3,7,17-трион (II-o) 3,17-дигидроксиандростан-7-он был приготовлен в объеме 96% выхода из 3,17 дигидроксиандрост-5-ен-7-она (700 мг) при помощи описанной выше процедуры приготовления 3,3:17,17-бис(зтилендиокси)андростан-7-она (пригот. 9). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон/CH2Cl2 10/10/10) с получением 3,17 дигидроксиандростан-7-она (670 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,53 (bb, 1H), 4,44 (bb, 1H), 3,47-3,27 (м, 2H), 2,45-2,31(м, 2 Н), 2,05-1,91 (м, 1 Н), 1,89-0,78 (м, 17 Н), 0, 99 (с, 3 Н), 0,59 (с, 3 Н). 3,17-дигидрокси-7 а-окса-7 а-гомоандростан-7-он был приготовлен в объеме 86% выхода из 3,17-дигидроксиандростан-7-она (730 мг) при помощи описанной выше процедуры приготовления 3,и 3,17-ди(диметил-трет 17-ди(диметил-трет-бутилсилилокси)-7-окса-7 а-гомоандростан-6-она бутилсилилокси)-7-окса-7 а-гомоандростан-6-она (смесь 90/10, пригот. 12). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон/CH2Cl2 40/30/30) с получением 3,17 дигидрокси-7 а-окса-7 а-гомоандростан-7-она (660 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,55 (bb, 2H), 4,40 (bb, 1H), 3,54-3,43 (м, 1 Н), 3,32 (м,1 Н), 2,99 (м, 1 Н), 1,93-0,94 (м, 18 Н), 0,91 (с, 3 Н), 0,61 (с, 3 Н). 7 а-окса-7 а-гомоандростан-3,7,17-трион был приготовлен в объеме 81% выхода из 3,17 дигидрокси-7 а-окса-7 а-гомоандростан-7-она (300 мг) при помощи описанной выше процедуры приготовления 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она и 3,17-ди(диметил-третбутилсилилокси)андростан-6-она (смесь 90/10, пригот. 12). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, гексан/ацетон/CH2Cl2 50/25/25) с получением указанного в заголовке соединения 11-о (240 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,73 (м, 1 Н), 3,16 (м, 1 Н), 2,47-2,27 (м, 3 Н), 2,13 (м,1 Н), 2,08-1,33 (м, 13 Н), 1,22 (м, 1 Н), 1,16 (с, 3 Н), 0, 80 (с, 3 Н). Приготовление 14. 6-окса-5-андростан-3,7,17-трион (II-p) К перемешиваемому раствору 3(3-гидроксиандрост-5-ен-7,17-диона в t-BuOH (385 мл) и 0,25 М водному раствору K2CO3 (97,5 мл) при энергичном перемешивании при 60 С были добавлены 0,37 М водного раствора NaIO4 (63,4 мл) и 0,05 М водного раствора KMnO4 (7,3 мл). Через 15 мин был добавлен водный раствор 0,05 М KMnO4 (5 мл), а затем водный раствор 0,37 М NaIO4 (253,6 мл) добавляли по каплям в течение 0,5 ч. Через 5 мин был добавлен 0,05 М водный раствор KMnO4 (3 мл). Через 1,5 ч при 60 С суспензия была охлаждена на бане со льдом и затем погашена при помощи осторожного добавления 10% водного раствора NaHSO3. К концентрированному водному раствору был добавлен NaCl (100 г) и затем экстрагирован при помощи CH2Cl2. Объединенные органические экстракты были промыты Н 2 О,высушены над Na2SO4 и выпарены досуха с получением 3-гидрокси-5,17-диоксо-5,7-секо-Внорандрост-7-оиковой кислоты (4,16 г, 78% ). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :12,17 (bb, 1H), 4,65 (bb, 1H), 4,17 (bb, 1 Н), 3,05 (bb,1H), 2,44-2,13 (м, 3 Н), 2,13-1,18 (м, 10 Н), 0,90 (с, 3 Н), 0,76 (с, 3 Н). К размешиваемому раствору 3-гидрокси-5,17-диоксо-5,7-секо-В-норандрост-7-оиковой кислоты(200 мг) в толуоле (2,9 мл) и МеОН (4 мл) по каплям добавляли 2 М раствора (триметилсилил)диазометана в гексанах (0,412 мл) при 0 С. Через 2 ч был добавлен SiO2 и смесь была очищена при помощи флэш-хроматографии (SiO2, CH2Cl2/MeOH 90/10) с получением метил 3-гидрокси-5,17-диоксо 5,7-секо-В-норандрост-7-оата (180 мг, 88%). 1H-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS) :4,66 (bb, 1H), 4,19 (bb, 1 Н), 3,43 (с, 3 Н), 2,98 (м, 1 Н),2,43-2,24 (м, 3 Н), 2,11-1,95 (м, 2 Н), 1,91-1,19 (м, 11 Н), 0,87 (с, 3 Н), 0,77 (с, 3 Н). К размешиваемому раствору метил 3-гидрокси-5,17-диоксо-5,7-секо-В-норандрост-7-оата (900 мг) в THF (9 мл) при 0 С под N2 добавляли NaBH4 (306 мг) порциями в течение 15 мин. После перемешивания в течение 1,5 ч при комнатной температуре смесь была погашена при помощи осторожного добавле- 23014333 ния 1N HCl до кислой рН и экстрагирована с CH2Cl2/tBuOH 9/1. Объединенные органические экстракты были высушены над Na2SO4 и выпарены досуха с получением 3,17-дигидрокси-6-окса-5-андростан-7 она (800 г, 94%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,61 (bb, 1H), 4,49 (bb, 1H), 4,24 (bb, 1H), 3,57 (bb, 1H),3,45 (м, 1 Н), 2,42 (м, 1 Н), 2,08-1,11 (м, 14 Н), 1,04 (м, 1 Н), 0,97-0,85 (м, 1 Н), 0,93 (с, 3 Н), 0,64 (с, 3 Н). К перемешиваемому раствору NaBrO3 (664 мг) в Н 2 О (9 мл) были добавлены дигидрат RuO2 (24 мг) и EtOAc (18 мл). Через 10 мин был добавлен 3,17-дигидрокси-6-окса-5-андростан-7-он (450 мг). После перемешивания в течение 15 мин при комнатной температуре смесь была погашена осторожным добавлением изо-PrOH и экстрагирована при помощи EtOAc. Объединенные органические экстракты были высушены над Na2SO4 и выпарены досуха. Неочищенный продукт растерт с гексаном/Et2O 1/1 и осадок отфильтрован с получением указанного в заголовке соединения II-р (360 мг, 80%). 1H-ЯМР (300 МГц, ацетон-d6, м.д. из TMS):4,61 (bb, 1 Н), 2,98-2,87 (м, 1 Н), 2,83-2,73 (м, 2 Н), 2,642,18 (м, 5 Н), 1,94-1,46 (м, 8 Н), 1,32-1,18 (м, 1 Н), 1,25 (с, 3 Н), 0,92 (с, 3 Н). Приготовление 15. Дигидрохлорид 3-N-метиламиноэтоксиамина (III-a) К суспензии гидроксида калия (19,7 г) в DMSO (200 мл) при энергичном размешивании был добавлен бензофеноноксим (20,2 г). Раствор гидрохлорида N-метил-2-хлорэтиламина (5,2 г) в DMSO (40 мл) был добавлен по каплям. Через 2,5 ч пребывания при комнатной температуре продукты реакции были вылиты в лед/воду (400 мл), окислены с 37% HCl до рН 2,5 и промыты Et2O. Водный слой был обработан порошкообразным KOH до рН 10 и экстрагирован трижды при помощи Et2O; объединенные органические слои были промыты водой, соляным раствором, высушены над Na2SO4, и растворитель был выпарен досуха. Очищением при помощи флэш-хроматографии (SiO2, CHCl3:МеОН:АсОН от 9:1:0,1 до 7:3:0,3) образован бензофенон О-(2-N-метиламиноэтил) оксим (4,65 г, 62%) в виде вязкого масла. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,51-7,25 (10 Н, м), 4,13 (2 Н, т), 2,72 (2 Н, т), 2,26 (3 Н,с), 1, 60 (1 Н, bb). Бензофенон О-(2-N-метиламиноэтил)оксим (4,65 г) был суспендирован в 6N HCl (24 мл) и смесь кипятили с обратным холодильником в течение 2 ч. Продукты реакции были охлаждены и экстрагированы при помощи Et2O. Водный слой был выпарен досуха с получением указанного в заголовке соединения III-a. (1,78 г, 80%) в виде гигроскопического белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):10,5 (5 Н, bb), 4,26 (2 Н, т), 3,22 (2 Н, т), 2,55 (3 Н, с). Приготовление 16. Дигидрохлорид 3-N-метиламинопропоксиамина (III-b) Бензофенон О-(3-N-метиламинопропил)оксим был приготовлен в объеме 62% выхода из бензофеноноксима и гидрохлорида N-метил-3-хлорпропиламина в соответствии с описанной выше процедурой приготовления бензофенон О-(2-N-метиламиноэтил)оксима (пригот. 53). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):9,20 (2 Н, bb), 7,37 (10 Н, м), 4,14 (2 Н, т), 2,70 (2 Н, т),2,36 (3 Н, с), 1,87 (2 Н, м), 1,83 (3 Н, с). Указанное в заголовке соединение III-b было приготовлено в объеме 80% выхода из бензофенона О-(3-N-метиламинопропил)оксима при помощи описанной выше процедуры приготовления дигидрохлорида 2-N-метиламиноэтоксиамина (III-а, пригот. 53). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):11,08 (3 Н, bb), 9,10 (2 Н, bb), 4,10 (2 Н, т), 2,91 (2 Н, м),2,50 (3 Н, с), 1,96 (2 Н, м). К раствору гидрохлорида (S)-3-гидроксипирролидина (15,0 г) и триэтиламина (37,3 мл) в МеОН(150 мл) при 0 С был добавлен ди-трет-бутилдикарбонат (29,2 г). После перемешивания при комнатной температуре в течение 3 ч растворитель был выпарен. Осадок был разбавлен CH2Cl2, промыт водой и органическая фаза была выпарена досуха до образования N-трет-бутоксикарбонил-(S)-пирролидинола(21,4 г, 95% выход), который был использован без очищения на следующем этапе. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,87 (1 Н, д), 4,19 (1 Н, м), 3,30-3,00 (4 Н, м), 1,90-1,60(150 мл) при 0 С был добавлен ди-трет-бутилдикарбонат (29,2 г). После перемешивания при комнатной температуре в течение 3 ч растворитель был выпарен. Осадок был разбавлен CH2Cl2, промыт водой и органическая фаза была выпарена досуха до N-трет-бутоксикарбонил-(S)-пирролидинола (21,4 г, 95% выход), который был использован без очищения на следующем этапе. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):4,87 (1 Н, д), 4,19 (1 Н, м), 3,30-3,00 (4 Н, м), 1,90-1, 60(150 мл) при 0 С был добавлен метансульфонилхлорид (4,34 мл). После перемешивания при комнатной температуре в течение 3 ч реакционная смесь была налита в лед/воду и экстрагирована при помощиCH2Cl2. Органическая фаза была промыта 5% водным раствором NaHCO3, водой, соляным раствором,высушена и выпарена досуха, чтобы образовать масло, которое затвердело после пребывания в течение ночи в холодильнике. Твердая фаза растерта с Et2O с получением N-трет-бутоксикарбонил-(S)-3- 24014333 пирролидинилметансульфоната (13,0 г, 92%) в виде светло-желтого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):5,23 (1 Н, м), 3,60-3,10 (4 Н, м), 3,23 (3 Н, с), 2,11 (2 Н,м), 1,39 (9 Н, с). К суспензии из порошкового KOH (4,86 г) в DMSO (250 мл) при энергичном перемешивании был добавлен бензофеноноксим (7,86 г). После перемешивания при комнатной температуре в течение 30 мин раствор N-трет-бутоксикарбонил-(S)-3-пирролидинилметансульфоната (10 г) был добавлен в DMSO (70 мл). Через 18 ч при комнатной температуре продукты реакции вылили в талую воду (900 мл) и экстрагировали Et2O. Объединенные органические слои были промыты водой, соляным раствором, высушены и растворитель выпарен. Бензофенон O-[(R)-3-пирролидинил]оксим был получен (13,0 г, 96%) в виде белого твердого вещества и использован без очищения на следующем этапе. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,50-7,20 (10 Н, м), 4,84 (1 Н, м), 3,50-3,00 (4 Н, м), 2,01(2 Н, м), 1,38 (9 Н, с). Бензофенон О-[(R)-3-пирролидинил]оксим (13,0 г) был суспендирован в 6N HCl (250 мл) и смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения продукты реакции были экстрагированы при помощи Et2O. Водный слой был выпарен досуха с получением неочищенного продукта сухого твердого вещества коричневого цвета, которое было обработано 0,34 г активированного угля в чистом EtOH (255 мл) при температуре кипения с обратным холодильником в течение 2 ч. Твердое вещество, полученное после выпаривания, было кристаллизовано 96% EtOH (40 мл) с получением указанного в заголовке соединения III-c (2,98 г, 72%) в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):11,22 (3 Н, bb), 9,74 (1 Н, д), 9,54 (1 Н, bb), 4,98 (1 Н, м),3,60-3,00 (4 Н, м), 2,40-2,00 (2 Н, м). Приготовление 18. 3(Е)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-7 агомоандростан-7,17-дион (II-q) и 3(Z)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-7 агомоандростан-7,17-дион (II-r) Смесь титульных соединений была приготовлена из гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6 аза-7 а-гомоандростан-7,17-диона (I-аа, пример 1, 1,2 4 г) в соответствии с описанной выше процедурой приготовления 3(Е)-[2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6-метил-7 агомоандростан-7,17-диона (II-c) и 3 (Z)- [2-(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-6 метил-7 а-гомоандростан-7,17-диона (II-d, пригот. 3). Неочищенный продукт был очищен при помощи флэш-хроматографии (SiO2, циклогексан/iPrOH/CH2Cl2 50/5/45) с получением 3(Z)-[2-(9H-флуорен-9 илметилкарбонил)аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (II-r, 820 мг, 46%) и 3(Е)-[2(9 Н-флуорен-9-илметилкарбонил)аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона (II-q, 830 мг,47%).(bb, 1 Н), 7,31 (м, 2 Н), 7,17 (bb, 1H), 4,25 (м, 3 Н), 3,93 (т, 2 Н), 3,39 (м, 1 Н), 3,21 (м, 3 Н), 2,85 (м, 1 Н), 2,500,80 (м, 18 Н), 0,79 (с, 3 Н), 0,75 (с, 3 Н). Приготовление 19. 6-окса-7 а-гомоандростан-3,17-дион (II-s) К перемешиваемой суспензии LiAlH4 (165 мг) в THF под N2 при 0 С (14 мл) по каплям был добавлен раствор 3,17-ди(диметил-трет-бутилсилилокси)-6-окса-7 а-гомоандростан-7-она (пригот. 12, 240 мг) и BF3Et2O (1,96 мл) в THF (14 мл) и через 45 мин смесь кипятили с обратным холодильником в течение 1 ч. Суспензия была охлаждена на бане со льдом, а затем погашена осторожным добавлением раствора THF/H2O 1/1 и затем 2N HCl. Смесь была экстрагирована Et2O (3) и затем CH2Cl2. Объединенные органические экстракты были промыты 5% водным раствором NaHCO3, высушены над Na2SO4, отфильтрованы и выпарены досуха. Осадок был очищен при помощи флэш-хроматографии (SiO2, циклогексан/CH2Cl2/ацетон/гексан 1/1/1) с получением 6-окса-7 а-гомоандростан-3,17-диола (50 мг, 25%). 1(м, 19 Н), 0,76 (с, 3 Н), 0,62 (с, 3 Н). 6-окса-7 а-гомоандростан-3,17-дион был приготовлен из 6-окса-7 а-гомоандростан-3,17-диола в соответствии с описанной выше процедурой приготовления 3, 17-ди (диметил-третбутилсилилокси)андростан-6-она и 3,17-ди (диметил-трет-бутилсилилокси)андростан-6-она (пригот. 12). Смесь размешивалась в течение 2 ч, а затем был добавлен SiO2. Смесь была очищена флэшхроматографией (SiO2, циклогексан/ацетон 85/15) с получением 6-окса-7 а-гомоандростан-3,17-диона(с, 3 Н). Приготовление 20. 7 а-окса-7 а-гомоандростан-3,17-дион (II-t) 7 а-окса-7 а-гомоандростан-3,17-диол был приготовлен из 7 а-окса-7 а-гомоандростан-3,7,17-триона(пригот. 13) при помощи описанной выше процедуры приготовления 6-окса-7 а-гомоандростан-3,17- 25014333 диола (пригот. 19). Смесь размешивалась в течение 2 ч, а затем был добавлен SiO2. Смесь была очищена при помощи флэш-хроматографии (SiO2, циклогексан/ацетон/CH2Cl2 1/1/1), чтобы образовать 7 а-окса-7 агомоандростан-3,17-диол (65%). 1 Н-ЯМР (300 МГц (ДМСО-d6, м.д. из TMS:4,45 (д, 1 Н), 4,41 (д, 1 Н), 3,57-3,01 (м, 5 Н), 1,90-0,75(м, 19 Н), 0,79 (с, 3 Н), 0,60 (с, 3 Н). 7 а-окса-7 а-гомоандростан-3,17-дион был приготовлен из 7 а-окса-7 а-гомоандростан-3,17-диола в соответствии с описанной выше процедурой приготовления 6-окса-7 а-гомоандростан-3,17-диона (пригот. 19). Смесь размешивалась в течение 2 ч, а затем был добавлен SiQ2. Смесь была очищена при помощи флэш-хроматографии (SiO2, циклогексан/ацетон/CH2Cl2 70/15/15) с получением указанного в заголовке соединения II-t (85%). 1 Н-ЯМР (300 МГц, ацетон-d6, м.д. из TMS):3,75-3,50 (м, 3 Н), 2,15-1,15 (м, 19 Н), 1,18 (с, 3 Н), 0,87(с, 3 Н). Приготовление 21. 6-азаандростан-3,7,17-трион (II-u) 3(3-гидрокси-6-азаандростан-7,17-дион был приготовлен из 3-(трет-бутилдиметилсилилокси)-6 азаандростан-7,17-диона (гетероциклы, 38 (1994) 5, 1053-1060) в соответствии с описанной выше процедурой приготовления 3,17-дигидрокси-7-окса-7 а-гомоандростан-6-она и 3,17-дигидрокси-7-окса-7 агомоандростан-6-она (пригот. 12). Смесь размешивалась в течение 2 ч, а затем был добавлен SiO2. Смесь была очищена при помощи флэш-хроматографии (SiO2, EtOAc/EtOH/CH2Cl2 50/10/40) с получением 3 гидрокси-6-азаандростан-7,17-диона (83%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,25 (с, 1 Н), 446 (д, 1 Н), 3,39 (м, 1 Н), 2,91 (дд, 1 Н),2,40-0,90 (м, 17 Н), 0,80 (с, 3 Н), 0,78 (с, 3 Н). 6-Азаандростан-3,7,17-трион был приготовлен из 3(3-гидрокси-6-азаандростан-7,17-диона в соответствии с описанной выше процедурой приготовления 3,17-ди(диметил-третбутилсилилокси)андростан-6-она и 3,17-ди(диметил-трет-бутилсилилокси)андростан-6-она (пригот. 12). Смесь размешивалась в течение 35 мин, затем был добавлен SiO2 и смесь была выпарена досуха. Смесь была очищена при помощи флэш-хроматографии (SiO2, ацетон/толуол 1/1) с получением 6 азаандростан-3,7,17-триона (75%). 1 Н-ЯМР (300 МГц, ДМСО-d6, м.д. из TMS):7,34 (с, 1 Н), 3,31 (дд, 1 Н), 2,57-1,07 (м, 17 Н), 0,99 (с,3 Н), 0,83 (с, 3 Н). Биологические исследования и результаты Соединения настоящего изобретения сходны и подавляют энзиматическую активность Na+, K+АТФазы. Чтобы протестировать подавление активности, Na+, K+-АТФаза была очищена по Йоргенсену(Йоргенсен П., ВВА, 1974, 356, 36) и Эрдману (Эрдман Э. и др., Arzneim. Forsh., 1984, 34, 1314) и подавление было измерено в % гидролиза 32 Р-АТФ в присутствии и в отсутствие исследуемых соединений(Молл Ф. и др., Biochem. Pharmacol., 1984, 33, 47; см. табл. 1). В качестве эталонного соединения было использовано соединение 22b (гидрохлорид (EZ) 3-(2-аминоэтоксиимино)андростан-6,17-диона), уже описанный С. Де Мунари и др. в J. Med. Chem. 2003, 46(17), 3644-3654. Таблица 1 Способность этих соединений снижать кровяное давление была исследована у животных, имеющих- 26014333 генетическую артериальную гипертензию, в частности, у спонтанно гипертензивных крыс Милана(MHS) (Бианки Г., Феррари П., Барбер Б. Миланский гипертензивный штамм. В Учебнике гипертензии. Вып.4: Экспериментальные и генетические модели гипертензии. Ред.: W. de jong Elsevier Science Publishers B.V., 1984: 328-349), и крысы получили гипертензию при помощи постоянного введения уабаина в соответствии с Феррари П. и др., J. Pharm. Exp. Ther. 1998, 285, 83-94. Процедура, принятая для исследования антигипертензивной активности соединений на вышеупомянутых моделях, была следующей: систолическое кровяное давление (СКД) и частота сердцебиений(ЧС) измерялись непрямым методом с помощью хвостовой манжеты. Чтобы исследовать действие соединений на MHS модели, гипертензивные крысы в возрасте одного месяца (MHS) были разделены на две группы, каждая из которых содержала по крайней мере 7 животных. Одна группа получала соединение, а другая, контрольная группа, получала лишь наполнитель. Соединение, суспендированное в метилцеллюлозе 0,5% (вес./об.) ежедневно вводилось перорально в течение пяти недель. СКД и ЧС измерялись еженедельно через 6 ч после приема препарата. Соединения настоящего изобретения обладают более высокой активностью и эффективностью по сравнению с соединением 22b (гидрохлорид (EZ) 3-(2-аминоэтиксиимино)андростан-6,17-диона), описанным С. Де Мунари и др. в J. Med. Chem. 2003, 46(17), 3644-3654. Понижающее кровяное давление действие эталонного соединения 22b и некоторых новых соединений у спонтанно гипертензивных MHS крыс представлено в следующей таблице и выражено в виде понижения систолического кровяного давления (выраженное в понижении как миллиметров ртутного столба, так и процентных показателей) и изменения частоты сердцебиения (ударов в минуту) к концу пятой недели периода лечения, в отличие от контрольной группы, получавшей лишь наполнитель. Снижение систолического кровяного давления у спонтанно гипертензивных крыс (MHS) В метилцеллюлозе 0,5% вес./об. В качестве дополнительной демонстрации эффекта снижения кровяного давления у гипертензивных крыс, чувствительных к уабаину, соединение, суспендированное в метилцеллюлозе 0,5% (вес./об.),принималось ежедневно в дозе 10 мкг/кг/день перорально в течение четырех недель. СКД и ЧС измерялись в течение недели через 6 ч после приема препарата. Снижение систолического кровяного давления у гипертензивных крыс, чувствительных к уабаину Более того, соединения настоящего изобретения обладают позитивными инотропными свойствами,что было показано при медленной внутривенной инфузии анестезированной морской свинке по Керри и др. (Керри и др., J. Med. Chem. 2000, 43, 2332), и имеют низкую токсичность по сравнению со стандартными кардиотоническими стероидами, например, дигоксином. Соединения настоящего изобретения обладают более высокой активностью и/или лучшим терпевтическим индексом и/или более продолжительным действием по сравнению с соединением 22b (гидрохлорид (EZ) 3-(2-аминоэтоксиимино)андростан 6,17-диона), описанным С. Де Мунари и др. в J. Med. Chem. 2003, 46(17), 3644-3654. Действие соединений I-ba и I-bk, выявленное во время вышеуказанных тестов представлено в следующей табл. 2. Инотропный эффект показан как максимальное повышение сократительной способности(Emax измeряется как +dP/dTmax), доза, обеспечивающая максимальный инотропный эффект (EDmax), инотропная активность (ED80, доза, повышающая +dP/dTmax на 80%); токсичность, как соотношение между летальной дозой и инотропной активностью (подсчитанная у умерших животных); максимальная доза,введенная выжившим животным; длительность инотропного эффекта как снижение эффекта по EDmax,измеренное через 20 мин после окончания инфузии. Как показано в табл. 2, соединения I-ba и I-bk проявляют позитивные инотропные действия с более безопасными соотношениями, чем у дигитоксина и соединения 22b. В действительности соотношение летальная доза/ED80 невозможно установить, так как ни одно животное не умерло. Более того, I-ba и I-bk имеют пролонгированное действие, что выражается устойчивостью инотропного эффекта после окончания инфузии. Более высокие дозы I-ba и I-bk не исследовались, так как вызванное ими максимальное увеличение сократительной способности было выше аналогичных показателей дигоксина и соединения 22b. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I),где символы означаютилиодинарные связи, связывающие группу А с андростановым скелетом в положении 5 или 8; В является кислородом или NR4;R1 является Н, C1-С 6-алкильной группой или C2-С 6-ацильной группой,где связь в положении 17 андростанового скелета является одинарной связью; илиD является прямым или разветвленным С 2-С 6-алкиленом или С 3-С 6-циклоалкиленом, необязательно содержащим фенильное кольцо;R6 и R7, которые одинаковы или различны, являются Н, C1-С 6-алкилом, фенил-С 1-С 4-алкилом; или один из R6 и R7 представляет собой С(=NR9)NHR10, а другой Н; илиR6 и R7, которые одинаковы или различны, являются Н, C1-С 6-алкилом, фенил-C1-С 4-алкилом; или один из R6 и R7 представляет собой С(=NR9)NHR10, a другой Н; илиR6 и R7, взятые вместе с атомом азота, с которым они соединены, формируют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 4-, 5- или 6-членное кольцо, необязательно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот;R6 и R7 необязательно замещены одной или несколькими гидрокси-, метокси-, этоксигруппами;R8 является Н, прямым или разветвленным C1-С 6-алкилом, необязательно замещенным одной или более гидрокси, метокси, этокси или C(=NR9)NHR10;R9 и R10, которые одинаковы или различны, являются Н, линейной или разветвленной C1-С 6 алкильной группой; илиR9 и R10, взятые вместе с атомом азота и гуанидиновым атомом углерода, формируют незамещенное или замещенное, насыщенное или ненасыщенное моногетероциклическое 5- или 6-членное кольцо, необязательно содержащее другой гетероатом, выбранный из группы, содержащей кислород, серу или азот;Z является прямым или разветвленным С 1-С 4-алкиленом или одинарной связью;m означает 0, или 1, или 2, или 3; символ в положении 17 независимо является одинарной или двойной связью, и, если это одинарная экзоциклическая связь в положении 17, то этоилиодинарная связь. 2. Соединение по п.1, где А выбрано из и. 3. Соединение по п.1 или 2, где R6 и R7, которые являются одинаковыми или различными, выбраны из Н и C1-С 6-алкила. 4. Соединение по любому из предыдущих пунктов, которое выбрано из группы, состоящей из гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; фумарата (E,Z) 3-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомоандростан-7,17-диона; фумарата (E,Z) 3-[3-(R)-пирролидинил]оксиимино-6-аза-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-тиоксоандростан-17-она; дигидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-17-она; дигидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-6-аза-7 а-гомоандростан-17-она; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-6-формил-7 а-гомоандростан-17-она; гидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-6-аза-6-формил-7 а-гомоандростан-17-она; гидрохлорида 3-(Е,Z)-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17-она; гидрохлорида 3-(Е,Z)-(3-N-метиламинопропоксиимино)-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17-она; гидрохлорида 3-(Е,Z)-[3-(R)пирролидинил]оксиимино-6-аза-7 а-гомо-7-(Z)-гидроксииминоандростан-17-она; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомо-7-(Z)-метоксииминоандростан-17-она; гидрохлорида 3-(Е,Z)-[3-(R)пирролидинил]оксиимино-6-аза-7 а-гомо-7-(Z)-метоксииминоандростан 17-она; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-аза-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-7,17-диона; дифумарата (E,Z) 3-(2-аминоэтоксиимино)-7 а-аза-7 а-гомоандростан-17-она; дифумарата (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-аза-7 а-гомоандростан-17-она; дифумарата (E,Z) 3-[3-(R)пирролидинил]оксиимино-7 а-аза-7 а-гомоандростан-17-она; гидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-7 а-аза-7 а-формил-7 а-гомоандростан-17-она; фумарата (E,Z) 3-(2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорида (Е,Z)-3-(3-N-метиламинопропоксиимино)-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-7-окса-7 а-гомоандростан-6,17-диона; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-(3-N-метиламинопропоксиимино)-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-[3-(R)пирролидинил]оксиимино-7 а-окса-7 а-гомоандростан-7,17-диона; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-окса-5-андростан-7,17-диона; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-В-гомоандростан-17-она; гидрохлорида (Е,Z)-3-[3-(R)пирролидинил]оксиимино-В-гомоандростан-17-она; фумарата (Е,Z)-3-(3-N-метиламинопропоксиимино)-6-окса-7 а-гомоандростан-7,17-диона; фумарата (E,Z) 3-[3-(R)пирролидинил]оксиимино-6-окса-7 а-гомоандростан-7,17-диона; гидрохлорида (Е,Z)-3-(2-аминоэтоксиимино)-6-окса-7 а-гомоандростан-17-она; гидрохлорида (Е,Z)-3-(2-аминоэтоксиимино)-7 а-окса-7 а-гомоандростан-17-она; гидрохлорида (E,Z) 3-(2-аминоэтоксиимино)-6-азаандростан-7,17-диона; фумарата (E,Z) 3-[3-(R)пирролидинил]оксиимино-6-азаандростан-7,17-диона; фумарата (Е) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона и фумарата (Z) 3-(2-аминоэтоксиимино)-6-аза-7 а-гомоандростан-7,17-диона. 5. Способ получения соединения по любому из пп.1-4, включающий взаимодействие соединения общей формулы (II)
МПК / Метки
МПК: A61P 9/06, A61K 31/58, A61K 31/566, C07J 63/00, A61P 9/04, C07J 3/00, A61K 31/565
Метки: в-гетероандростанов, в-гомоандростанов, аминопроизводные
Код ссылки
<a href="https://eas.patents.su/30-14333-aminoproizvodnye-v-gomoandrostanov-i-v-geteroandrostanov.html" rel="bookmark" title="База патентов Евразийского Союза">Аминопроизводные в-гомоандростанов и в-гетероандростанов</a>
Предыдущий патент: Селекция клеток-хозяев, экспрессирующих белок на высоких уровнях
Следующий патент: Устройство для аутентификации изделия
Случайный патент: Водопотребляющий бытовой прибор с насосом