Поперечно связанные соединения циклических аминов и средства для борьбы с вредителями
Номер патента: 14057
Опубликовано: 30.08.2010
Авторы: Хамамото Исами, Такахаси Джун, Яно Макио, Ханаи Даисуке, Кавагути Масахиро, Иваса Такао
Формула / Реферат
1. Соединение циклического амина, представленное формулой (1)
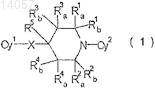
или его соль, или его N-оксид,
где Су1 представляет незамещенное или замещенное ароматическое кольцо, выбранное из группы, состоящей из фенила пиридила и пиридазинила;
X представляет кислород или аминогруппу, которая может иметь заместитель, выбранный из группы, состоящей из (C1-C6)алкила и ацетила;
R1aи R2a или R3a и R4aозначают -CH2-Y-CH2,
где Y представляет собой связь, CH2, S, SO, SO2, О или NR,
где R представляет собой Н, Me или МеСОО;
R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b, и R5, которые не означают -CH2-Y-CH2, каждый, представляют собой водород;
Су2 представляет незамещенное или замещенное ароматическое кольцо, выбранное из группы, состоящей из фенила, пиридинила, пиразинила, пиридазинила, пиримидинила, пиразолила, 1,3,4-тиадизолила и тиазолила и
где Су1 и Су2могут иметь 1-2 заместителя, выбранных из группы, состоящей из галогена, (С1-С3)галоалкила, (С1-С4)алкила, (С1-C3)галоалкокси, (С1-С4)алкокси, (С3-C6)циклоалкил-(С1-C3)алкокси, нитро, циано, (С1-С4)алкоксикарбонила, (С1-C3)алкокси-(С1-С3)алкила, (С2-С4)алкенилокси, (С1-С3)алкинилокси, (С1-C3)алкокси-(С1-С3)алкокси-(С1-C3)алкила,
группы, представленной формулой (а)
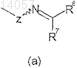
где Z представляет собой кислород; и каждый R6 и R7независимо представляют собой (С1-C3)алкил или (С1-C3)алкокси,
группы, представленной формулой (с)
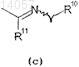
где Y представляет собой кислород;
R10 представляет собой (С1-C3)алкил и
R11 представляет собой водород,
оксазолила, который может иметь заместитель, выбранный из (С1-C3)алкила, (C3-C6)циклоалкил-(С1-C3)алкоксикарбонила, (C3-C6)циклоалкоксикарбонила, (C1-C3)галоалкоксикарбонила, (С2-С4)алкенилоксикарбонила, (С1-C3)алкокси(С1-C3)алкоксикарбонила, (С1-C3)алкилтиокарбонила, гидроксил(C1-C6)алкила, тетрагидрофуранилоксикарбонила и цианилированного (С1-C3)алкоксикарбонила,
при условии, что Су2является незамещенным или замещенным гетероароматическим кольцом, если R1a и R2a имеют значение -CH2-Y-CH2и Су1 является незамещенным или замещенным фенилом, и
Су2 имеет по меньшей мере одну цианогруппу в качестве заместителя, если Су1 является незамещенным или замещенным фенилом и Су2 является пиридин-2-илом.
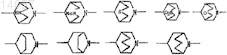
2. Соединение циклического амина, его соль или его N-оксид по п.1, где кольцо пиперидина с мостиковой связью, образованной R1a и R2a или R3a и R4a, выбрано из группы, состоящей из следующих формул:
3. Соединение циклического амина, представленное формулой (2)
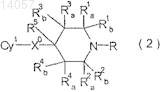
или его соль, или его N-оксид,
где Су1 представляет незамещенное или замещенное ароматическое кольцо, выбранное из группы, состоящей из фенила, пиридила и пиридазанила,
где Су1 может иметь 1-2 заместителя, выбранных из группы, состоящей из галогена, (С1-C3)галоалкила, (С1-С4)алкила, (С1-C3)галоалкокси, (С1-С4)алкокси, (C3-C6)циклоалкил-(С1-C3)алкокси, нитро, циано, (С1-C3)алкоксикарбонила, (С1-C3)алкокси-(С1-C3)алкила, (С2-С4)алкенилокси, (С1-C3)алкинилокси, (С1-C3)алкокси-(С1-C3)алкокси-(С1-C3)алкила,
группы, представленной формулой (а)
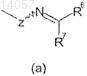
где Z представляет собой кислород; и каждый R6 и R7независимо представляют собой (С1-C3)алкил или (С1-C3)алкокси;
Х0 представляет кислород;
R3a и R4a означают -CH2-Y-CH2,
где Y представляет собой связь, СН2, S, SO, SO2, O или NR,
где R представляет собой Н, Me или МеСОО;
R1a, R1b, R2a, R2b, R3b, R4b и R5, каждый, представляют водород; и
R представляет водород, алкоксикарбонил, алкилкарбонил или 1-алкоксиалкил.
4. Соединение циклического амина, его соль или его N-оксид по п.3, где насыщенное кольцо пиперидина с мостиковой связью, образованной R3a и R4a, выбрано из группы, состоящей из следующих формул:
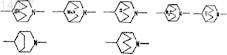
5. Средство для борьбы с вредителями, содержащее в качестве активного ингредиента по меньшей мере одно из соединений циклических аминов, представленных формулой (3)
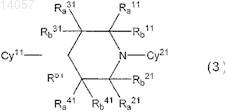
их соль или их N-оксид,
где Су11 представляет незамещенное или замещенное ароматическое кольцо, выбранное из группы, состоящей из фенила, пиридинила и пиридазинила;
X11 представляет кислород или аминогруппу, которая может иметь заместитель, выбранный из группы, состоящей из (C1-C6)алкила и ацетила;
R11a и R21a, или R31a и R41a R1aи R2a или R3a и R4aозначают -CH2-Y-CH2
где Y представляет собой связь, СН2, S, SO, SO2, O или NR,
где R представляет собой Н, Me или МеСОО;
R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b и R5, которые не означают -CH2-Y-CH2, каждый, представляют собой водород;
Су21 представляет незамещенное или замещенное ароматическое кольцо, выбранное из группы, состоящей из фенила, пиридинила, пиразинила, пиридазинила, пиримидинила, пиразолила, 1,3,4-тиадизолила и тиазолила и
где Су11 и Су21могут иметь 1-2 заместителя, выбранных из группы, состоящей из галогена, (С1-C3)галоалкила, (С1-С4)алкила, (С1-C3)галоалкокси, (С1-С4)алкокси, (C3-C6)циклоалкил-(С1-C3)алкокси, нитро, циано, (С1-С4)алкоксикарбонила, (С1-C3)алкокси-(С1-C3)алкила, (С2-С4)алкенилокси, (С1-C3)алкинилокси, (С1-C3)алкокси-(С1-C3)алкокси-(С1-C3)алкила,
группы, представленной формулой (а)
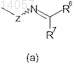
где Z представляет собой кислород; и каждый R6 и R7независимо представляют собой (С1-C3)алкил или (С1-C3)алкокси,
группы, представленной формулой (с)
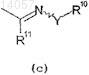
где Y представляет собой кислород;
R10 представляет собой (С1-C3)алкил и
R11 представляет собой водород, оксазолила, который может иметь заместитель, выбранный из (С1-C3)алкила, (C3-C6)циклоалкил-(С1-C3)алкоксикарбонила, (C3-C6)циклоалкоксикарбонила, (C1-C3)галоалкоксикарбонила, (С2-С4)алкенилоксикарбонила, (С1-C3)алкокси-(С1-C3)алкоксикарбонила, (С1-C3)алкилтиокарбонила, гидроксил(C1-C6)алкила, тетрагидрофуранилоксикарбонила и цианилированного (С1-C3)алкоксикарбонила, при условии, что Су21является незамещенным или замещенным гетероароматическим кольцом, если R11a и R21a означают -CH2-Y-CH2и Су11 является незамещенным или замещенным фенилом, и
Су21 имеет по меньшей мере одну цианогруппу в качестве заместителя, если Су11 является незамещенным или замещенным фенилом и Су21 является пиридин-2-илом.
6. Средство для борьбы с вредителями по п.5, где вредитель является насекомым или клещом.
Текст
ПОПЕРЕЧНО СВЯЗАННЫЕ СОЕДИНЕНИЯ ЦИКЛИЧЕСКИХ АМИНОВ И СРЕДСТВА ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ или их соли, или их N-оксиды, где Су 1 представляет незамещенное или замещенное ароматическое кольцо; X представляет кислород, серу, незамещенный или замещенный азот, сульфинил или сульфонил; R1a и R2a, R1a и R4a, R2a и R3a или R3a и R4a вместе образуют насыщенные кольца;R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b, и R5, которые не образуют насыщенные кольца, каждый является независимо водородом, гидроксилом, галогеном, незамещенной или замещенной амино, нитро или органической группой; Су представляет незамещенное или замещенное ароматическое кольцо при условии, что Су является незамещенным или замещенным гетероароматическим кольцом,если R1a и R2a вместе образуют насыщенное кольцо и Су 1 является незамещенным или замещенным фенилом и Су 2 является замещенным пиридин-2-илом, имеющим одну или более цианогруппу в качестве заместителя, если Су 1 является незамещенным или замещенным фенилом, а Су 2 является пиридин-2-илом. 014057 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям циклических аминов и средствам для борьбы с вредителями, которые содержат данные или подобные им циклические соединения амина в качестве активных ингредиентов. Уровень техники Несмотря на то, что традиционно известно большое количество соединений, обладающих инсектицидной/акарицидной активностью, существуют проблемы, как например недостаточная их эффективность, ограничение их использования вследствие проблем с устойчивостью к препарату, явления фитотоксичности или загрязнения растительных организмов, или сильная токсичность по отношению к млекопитающим, рыбам или подобное. В качестве соединений с каркасом, аналогичным таковому в соединениях настоящего изобретения,известны соединения, представленные ниже формулой: В формуле X представляет -О-, -N(R3)-, -S- или подобное, a R1 представляет замещенную насыщенную гетероциклическую группу или подобное. Соединение, представленное ниже формулой, известно в качестве типичного представителя таких соединений (ссылка на патентный документ 1) В формуле X представляет -СН- или подобное; Z представляет связь или подобное; R3 представляет необязательно замещенный арил или необязательно замещенный гетероарил; a R7 и R8 вместе представляют -(CH2)s- или подобное. Однако, если R7 и R8 вместе представляют -(CH2)s, только соединения, в которых R3 является замещенным фенилом аналогично соединению, представленному формулой ниже,конкретно представлены в качестве примеров (ссылка на патентный документ 2). Кроме того, соединения, известные из патентных документов 1 и 2, существуют для медицинских целей, и их применение в средствах для борьбы с вредителями не описано. [Патентный документ 1] WO 02/100833 [Патентный документ 2] WO 05/1457815 Цели изобретения Целью настоящего изобретения является создание средств для борьбы с вредителями, которые могут удобно синтезироваться в промышленных масштабах, которые обладают превосходной биоактивностью и которые не создают проблем в отношении безопасности. Сущность изобретения В результате интенсивных исследований с целью решения вышеупомянутых проблем авторы настоящего изобретения обнаружили, что новые соединения циклических аминов с определенной структурой обладают превосходной инсектицидной/акарицидной активностью для осуществления настоящего изобретения. Другими словами, настоящее изобретение, во-первых, относится к соединениям циклических аминов, представленным формулой (1), их солям или их N-оксидам. В формуле Су 1 представляет незамещенное или замещенное ароматическое кольцо. X представляет кислород, серу, незамещенный или замещенный азот, сульфинил или сульфонил. R1a и R2a, R1a и R4a, R2a иR3a, или R3a и R4a вместе образуют насыщенные кольца. R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b, и R5, которые не образуют вышеупомянутые насыщенные кольца, каждый независимо представляет водород, гидроксил, галоген, незамещенную или замещенную амино, нитро или органическую группу. Су 2 представляет-1 014057 незамещенное или замещенное ароматическое кольцо при условии, что Су 2 является незамещенным или замещенным гетероароматическим кольцом, если R1a и R2a вместе образуют ненасыщенное кольцо, а Су 1 является незамещенным или замещенным фенилом; и Су 2 является замещенным пиридин-2-илом,имеющим одну или более цианогруппу в качестве заместителя, если Су 1 является незамещенным или замещенным фенилом, а Су 2 является пиридин-2-илом. Во-вторых, настоящее изобретение относится также к соединениям циклического амина, представленным формулой (2), их солям или их N-оксидам. В формуле Су 1 представляет незамещенное или замещенное ароматическое кольцо. X представляет кислород, серу, сульфинил или сульфонил. R3a и R4a вместе образуют насыщенное кольцо. R1a, R1b, R2a,R2b, R3b, R4b, И R5 каждый независимо представляет водород, гидроксил, галоген, незамещенную или замещенную амино, нитро или органическую группу. R представляет водород, алкоксикарбонил, алкилкарбонил или 1-алкоксиалкил. В-третьих, настоящее изобретение относится также к средствам для борьбы с вредителями, которые содержат в качестве активных ингредиентов по меньшей мере одно соединение циклического амина,представленное формулой (3), его соли или его N-оксиды. В формуле Су 11 представляет незамещенное или замещенное ароматическое кольцо. X представляет кислород, серу, незамещенный или замещенный азот, сульфинил или сульфонил. R11a и R21a, R11a, и R41a,R21a и R31a или R31a и R41a вместе образуют насыщенные кольца. R11a, R11b, R21a, R21b, R31a, R31b, R41a, R41b иR51, которые не образуют вышеупомянутых насыщенных колец, каждый независимо представляет водород, гидроксил, галоген, незамещенную или замещенную амино, нитро или органическую группу. Су 21 представляет незамещенное или замещенное ароматическое кольцо. Преимущества изобретения Согласно настоящему изобретению можно создать соединения циклических аминов с новой структурой, их соли, их N-оксиды или их интермедиаты во время производства, и особенно средства для борьбы с вредителями с инсектицидной/акарицидной активностью, в том числе по отношению к насекомым и клещам, наносящим вред урожаю, посредством чего может обеспечиваться высокая безопасность. Предпочтительные варианты воплощения изобретения Настоящее изобретение будет описано подробно ниже. 1) Соединения циклических аминов, представленные формулами (1) и (2), их соли или их Nоксиды. В соединениях циклического амина, представленных формулой (1), Су 1 представляет незамещенное или замещенное ароматическое кольцо. Конкретные примеры ароматических колец включают ароматические углеводороды, такие как фенил, нафтален-1-ил, нафтален-2-ил; и гетероароматические кольца, такие как фуран-2-ил, фуран-3-ил,тиофен-2-ил, тиофен-3-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2 ил, тиазол-4-ил, тиазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, изотиазол-3-ил, изотиазол 4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, имидазол-5-ил, пиразол-3-ил, пиразол-4-ил, пиразол-5-ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиодиазол-2-ил, 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил, 1,2,4 триазол-5-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиридазин-3-ил, пиридазин-4-ил, 6 пиразин-2 ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, 1,3,5-триазин-2-ил и 1,2,4-триазин-3-ил; при этом фенил является предпочтительным. Конкретные примеры заместителей в ароматических кольцах включают гидроксил; тиол; галоген,такой как фтор, хлор, бром и йод; циано; нитро; формил; незамещенный или замещенный амино, такой как амино, метиламино, бензиламино, анилино, диметиламино, диэтиламино и фенилэтиламино; алкил(предпочтительно C1-6 алкил), такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил и н-гексил; алкенил, такой как винил, аллил и 2-метоксивинил; алкинил, такой как этинил, 1-пропинил, 2-фенилэтинил и пропаргил: алкокси (предпочтительно C1-6 алкокси) такой как метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, втор-бутокси, изобутокси и трет-бутокси; алкенилокси, такой как винилокси и аллилокси; алкинилокси, такой как этинилокси и пропаргилокси; ари-2 014057 локси, такой как фенокси и бензилокси; гетероарилокси, такой как 2-пиридилокси; галоалкил (предпочтительно C1-6 галоалкил), такой как хлорметил, фторметил, бромметил, дихлорметил, дифторметил, дибромметил, трихлорметил, трифторметил, бромдифторметил, 1,1,1-трифторэтил, 1-хлорэтил, 2-хлорэтил,1-бромэтил и пентафторэтил; галоалкокси (предпочтительно C1-6 галоалкокси), такой как фторметокси,хлорметокси, бромметокси, дифторметокси, дихлорметокси, дибромметокси, трифторметокси, трихлорметокси, трибромметокси, 1,1,1-трифторэтокси, пентафторэтокси и гептафтор-н-пропокси; алкилтиокарбонил (предпочтительно C1-6 алкилтиокарбонил), такой как метилтиокарбонил, этилтиокарбонил, нпропилтиокарбонил, изопропилтиокарбонил, н-бутилтиокарбонил, изобутилтиокарбонил, втор-бутилтиокарбонил, и трет-бутилтиокарбонил; алкилсульфониламино (предпочтительно C1-6 алкилсульфониламино), такой как метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино, н-бутилсульфониламино и трет-бутилсульфониламино; арилсульфониламино (предпочтительно C6-12 арилсульфониламино), такой как фенилсульфониламино; гетероарилсульфониламино (предпочтительно С 3-12 гетероарилсульфониламино), такой как пиперазинилсульфониламино; алкилкарбониламино (предпочтительно C1-6 алкилкарбониламино), такой как метилкарбониламино, этилкарбониламино, н-пропилкарбониламино и изопропилкарбониламино; алкоксикарбониламино (предпочтительно C1-6 алкоксикарбониламино), такой как метоксикарбониламино, этоксикарбониламино, н-пропоксикарбониламино и изопропоксикарбониламино; галоалкилсульфониламино (предпочтительно C1-6 галоалкилсульфониламино), такой как фторметилсульфониламино, хлорметилсульфониламино, бромметилсульфониламино, дифторметилсульфониламино, дихлорметилсульфониламино, 1,1-дифторэтилсульфониламино, трифторметилсульфониламино, 1,1,1-трифторэтилсульфониламино и пентафторэтилсульфониламино; бис(алкилсульфонил) амино (предпочтительно бис(C1-6 алкилсульфонил)амино), такой как бис(метилсульфонил) амино, бис(этилсульфонил)амино, (этилсульфонил) (метилсульфонил) амино,бис(н-пропилсульфонил)амино, бис(изопропилсульфонил)амино, бис(н-бутилсульфонил)амино и бис(трет-бутилсульфонил)амино; бис(галоалкилсульфонил)амино (предпочтительно бис(C1-6 галоалкилсульфонил)амино), такой как бис(фторметилсульфонил)амино, бис(хлорметилсульфонил)амино,бис(бромметилсульфонил)амино, бис (дифторметилсульфонил)амино, бис(дихлорметилсульфонил)амино, бис(1,1-дифторэтилсульфонил)амино, бис(трифторметилсульфонил)амино, бис(1,1,1-трифторэтилсульфонил)амино и бис(пентафторэтилсульфонил)амино; незамещенный или замещенный гидразино,такой как гидразино, N'-фенилгидразино, N'-метоксикарбонилгидразино, N'-ацетилгидразино, и N'метилгидразино; алкоксикарбонил (предпочтительно C1-6 алкоксикарбонил), такой как метоксикарбонил,этоксикарбонил, н-пропоксикарбонил, изо пропоксикарбонил, н-бутоксикарбонил, и третбутоксикарбонил; арил (предпочтительно C6-12 арил), такой как фенил, 1-нафтил и 2-нафтил; аралкил(предпочтительно С 7-20 аралкил), такой как бензил и фенэтил; ненасыщенный 5-членный гетероцикл, такой как фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил, имидазол-5-ил,пиразол-3-ил, пиразол-4-ил, пиразол-5-ил, 1,3,4-охадиазол-2-ил, 1,3,4-тиадиазол-2-ил, 1,2,3-триазол-4-ил,1,2,4-триазол-3-ил и 1,2,4-триазол-5-ил; ненасыщенный 5-членный гетероциклический алкил, такой как 5-фенил-5-трифторметил-изоксазолин-3-ил,2-фурфурилметил,3-тиенилметил и 1-метил-3 пиразолометил; ненасыщенный 6-членный гетероцикл, такой как пиридин-2-ил, пиридин-3-ил, пиридин 4-ил, пиридазин-3-ил, пиридазин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5 ил, 1,3,5-триазин-2-ил и 1,2,4-триазин-3-ил; ненасыщенный 6-членный гетероциклический алкил, такой как 2-пиридилметил, 3-пиридилметил, б-хлор-3-пиридилметил и 2-пиримидилметил; насыщенная гетероциклическая группа, такая как тетрагидрофуран-2-ил, тетрагидропиран-4-ил, пиперидин-3-ил, пирролидин-2-ил, морфолино, пиперидино и N-метилпиперазинил; насыщенный гетероциклический алкил,такой как 2-тетрагидрофуранилметил, 3-пиперазилметил, N-метил-3-пирролидилметил и морфолинометил; N-незамещенный или N-замещенный иминоалкил, такой как N-диметиламиноиминометил, 1-Nфенилиминоэтил, N-гидроксииминометил и N-метоксииминометил; N-незамещенный или Nгидразинокарбонил, такой как N'-метилгидразинокарбонил, N'-фенилгидразинокарбонил и гидразинокарбонил; N-незамещенный или N-замещенный аминокарбонил, такой как аминокарбонил, диметиламинокарбонил и N-фенил-N-метиламинокарбонил; алкилтио, такой как метилтио, этилтио и трет-бутилтио; алкенил, такой как винилтио и аллилтио; алкинилтио, такой как этинилтио и пропаргилтио; арилтио, такой как фенилтио, 4-хлорфенилтио и; гетероарилтио, такой как 2-пиперидилтио и 3-пиридазилтио; аралкилтио, такой как бензилтио и фенэтилтио; алкилсульфонил, такой как метилсульфонил, этилсульфонил и трет-бутилсульфонил; алкенилсульфонил, такой как аллилсульфонил; алкинилсульфонил, такой как пропаргилсульфонил; арилсульфонил, такой как фенилсульфонил; гетероарилсульфонил, такой как 2 пиридилсульфонил и 3-пиридилсульфонил; аралкилсульфонил, такой как бензилсульфонил и фенэтилсульфонил; группы, представленные ниже формулами от (а) до (с); В формулах (а), (b), и (с) R6 и R7 каждый независимо представляет водород, незамещенный или замещенный углеводород, незамещенную или замещенную гетероциклическую группу, незамещенную или замещенную амино, гидрокарбонокси или гидрокарбонтио; R8 и R11 каждый независимо представляет водород, незамещенный или замещенный углеводород, незамещенную или замещенную гетероциклическую группу, или незамещенный или замещенный амино; R9 представляет водород или незамещенный или замещенный углеводород; R10 представляет водород, незамещенный или замещенный углеводород или незамещенную или замещенную гетероциклическую группу; Y и Z каждый независимо представляет кислород или незамещенный или замещенный азот; R6 и R7, R8 и R9, и R10 и R11 могут быть связаны с образованием колец и в этом случае обе две группы в паре представляют функциональные группы, которые могут объединяться с образованием кольца. Конкретные примеры углеводородов, обычно присутствующих в от R6 до R11, включают алкил, такой как метил, этил, изопропил, н-пропил, н-гексил и н-октил; алкенил, такой как винил, аллил, 1-пропенил и 2-фенилеэтенил; алкинил, такой как этинил и пропаргил; и ароматический углеводород, такой как фенил, 1-нафтил и 9-антрацен. Конкретные примеры гетероциклических групп., обычно присутствующих в R6, R7, R8, R10 и R11, включают ненасыщенный 5-членный гетероцикл, такой как фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изоксазол-3-ил, изоксазол 4-ил, изоксазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, имидазол-2-ил, имидазол-4-ил,имидазол-5-ил, пиразол-3-ил, пиразол-4-ил, пиразол-5-ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил,1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил и 1,2,4-триазол-5-ил; ненасыщенный 5-членный гетероциклический алкил, такой как 5-фенил-5-трифторметил-изоксазолин-3-ил, 2-фурфурилметил, 3-тиенилметил и 1 метил-3-пиразолометил; ненасыщенный 6-членный гетероцикл, такой как пиридин-2-ил, пиридин-3-ил,пиридил-4-ил, пиридазин-3-ил, пиридазин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, 1,3,5-триазин-2-ил и 1,2,4-триазин-3-ил; ненасыщенный 6-членный гетероциклический алкил, такой как 2-пиридилметил, 3-пиридилметил, 6-хлор-3-пиридилметил и 2-пиримидилметил; и насыщенный гетероцикл, такой как тетрагидрофуран-2-ил, тетрагидропиран-4-ил, пиперидин-3-ил, пирролидин-2-ил, морфолино, пиперидино и N-метилпиперазинил; насыщенную гетероциклическую алкильную группу, такую как 2-тетрагидрофуранилметил, 3-пиперазилметил, N-метил-3-пирролидилметил и морфолинометил. Конкретные примеры гидрокарбонокси и гидрокарбонтио, обычно присутствующих в R6 иR7, включают метокси, этокси, изопропокси, фенокси, бензилокси, метилтио, этилтио, фенилтио и бензилтио. Конкретные примеры заместителей в функциональных группах, присутствующих в R6 до R11,включают такие же, как перечисленные в качестве конкретных примеров заместителей для Су 1. Y и Z каждый независимо представляет кислород или незамещенный или замещенный азот, и конкретные примеры заместителя на азоте включают такие же, как перечисленные в качестве конкретных примеров заместителей для Су 1. Конкретные примеры группы, представленной формулами от (а) до (с), включают группу, представленную ниже формулой. С 1-6 галоалкил является особенно предпочтительным. При связывании двух или более упомянутых выше заместителей при замене одного заместителя на другой, полученный заместитель может использоваться аналогичным образом в качестве нового заместителя. В формуле (1) X представляет кислород; серу; незамещенный или замещенный азот; сульфинил; или сульфонил, или кислород являются предпочтительными. Следует отметить, что если азот является незамещенным, с азотом связан водород. Если X является замещенным азотом, конкретные примеры заместителей на азоте включают примеры, подобные конкретным примерам заместителей для Су 1. Кроме того, в формуле (1) R1a и R2a, R1a И R4a, R2a и R3a или R3a и R4a вместе образуют насыщенные кольца, и предпочтительно, что R1a и R2a или R3a и R4a объединены с образованием кольца, при этом число атомов в участке поперечных связей кольца пиперидина, которое образует насыщенное кольцо, составляет предпочтительно 2 или 3. Кроме того, элементы, которые составляют участок поперечных связей пиперидина насыщенного-4 014057 кольца, специально не ограничены при условии, что они находятся в химически приемлемых пределах, и их конкретные примеры включают углерод, кислород, серу, азот или кремний, при этом насыщенные кольца могут быть составлены путем комбинирования 2 или более данных элементов в химически приемлемых пределах. Кроме того, у каждого атома могут быть водород или заместители в химически приемлемых пределах, и R1a и R2a, R1a и R4a, R2a и R3a, или R3a и R4a могут быть связаны с кислородом, серой или азотом через двойную связь в химически приемлемых пределах с образовыванием карбонила, тиокарбонила, имино или подобного.R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b и R5, которые не образуют вышеупомянутые насыщенные кольца вместе, каждый независимо, представляют водород, галоген, незамещенную или замещенную амино,нитро, гидроксильную или органическую группу. Органическая группа в общем случае представляет функциональные группы, которые содержат углерод, и конкретные ее примеры включают циано; формил; алкил; алкоксикарбонил; алкокси; галоалкил; галоалкокси; алкилтиокарбонил; алкилсульфониламино; галоалкилсульфониламино; бис(алкилсульфонил)амино; бис(галоалкилсульфонил)амино; и арил; или подобное. В качестве органических групп предпочтительны алкил; алкоксикарбонил; и алкокси; при этом C1-6 алкил; алкоксикарбонил C1-6; и C1-6 алкокси более предпочтительны. Их конкретные примеры включают такие же, как указанные в качестве конкретных примеров заместителей для Су 1. Конкретные примеры кольца пиперидина, которое образовано в формуле (1), включают структуры,представленные показанными ниже формулами. Хотя конкретные примеры ароматического ядра Су 2 включают те, которые аналогичны конкретным примерам Су 1, пиридазил является предпочтительным, а пиридазин-3-ил является более предпочтительным при условии, что Rla и R2a вместе образуют насыщенное кольцо, а Су 2 является незамещенным или замещенным гетероароматическим кольцом, если Су 1 является незамещенным или замещенным фенилом. Кроме того, Су 2 является замещенным пиридин-2-илом, имеющим одну или более цианогруппу в качестве заместителя, если Су 1 является незамещенным или замещенным фенилом, а Су 2 является замещенным пиридин-2-илом. Су 2 не содержит в себе незамещенный пиридин-2-ил, если Су 1 является незамещенным или замещенным фенилом. Замещений пиридин-2-ил, имеющий одну или более цианогруппу в качестве заместителя, означает, что замещенный пиридин-2-ил имеет только цианогруппу в качестве заместителя или цианогруппу и другой заместитель в качестве заместителей. В случае, если R1a и R2a или R3a и R4a соединения (1) настоящего изобретения объединены с образованием насыщенного кольца, существует несколько пар изомеров. Данные изомеры все включены в настоящее изобретение. Следует отметить, что то же самое относится также к случаю, если R1a и R4a илиR2a и R3a объединены с образованием насыщенного кольца. Кроме того, то же самое относится к соединениям (2) настоящего изобретения, которые будут описаны позже. Следующие соединения могут быть представлены в качестве примеров N-оксидов соединений,представленных формулой (1); т. е. соединений, представленных формулой (1), где азот, обозначенныйX, или азот в частях циклического амина тропанового кольца, изотропанового кольца или подобного,является окисленным. Кроме того, примеры солей соединений, представленных формулой (1), включают соли неорганических кислот, такие как гидрохлоридные соли, нитратные соли, сульфатные соли и фосфатные соли; и соли органических кислот, такие; как ацетатные соли, лактатные соли, пропионатные соли и бензоатные соли. Х 0 в формуле (2) соответствует X в формуле (1), за исключением того, что Х 0 не содержит азот и R1a 5 до R в формуле (2) являются такими же, как R1a до R5 в формуле (1), за исключением того, что толькоR3a и R4a вместе образуют насыщенное кольцо.R представляет водород; алкоксикарбонил, такой как 1-хлорэтоксикарбонил, метоксиметоксикарбонил, 1-этоксиэтоксикарбонил, 1,1,1-трихлорэтоксикарбонил и другие, подобные таким примерам характерных примеров заместителей Су 1, как алкоксикарбонил (предпочтительно C1-6 алкоксикарбонил); алкилкарбонил (предпочтительно C1-6 алкилкарбонил), такой как метилкарбонил, этилкарбонил, нпропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил и третбутилкарбонил; или 1-алкоксиалкил (предпочтительно 1-C1-6 алкоксиалкил), такой как метоксиметил,этоксиметил и 1-этоксиэтил. 2) Способ получения.(1) Если X представляет собой кислород или, необязательно, окисленную серу. Соединение (1) может быть получено, наример, путем получения соединения, представленного формулой (5), путем отщепления защитной группы, такой как метил и бензил в соединении, представленном формулой (4) (в дальнейшем называемом соединение (4, как показано ниже, и сочетания соединения (5) с соединением,представленным формулой (6), обычным способом.(В формуле Су 1, Су 2, X, R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b и R5 являются такими же, как указано выше. X' представляет уходящую группу, такую как галоген, a R' представляет защитную группу). Соединение (4), которое является интермедиатом во время производства, может быть получено в общих условиях реакции, как описано далее в настоящей заявке.X и X2, каждый независимо, представляет гидроксил или меркапто, а X3 представляет уходящую группу,такую как галоген). Кроме того, соединение (1) может быть также получено общим способом, показанным ниже в настоящем документе. 1(В формуле Су 1, Су 2, X, R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b и R5 являются такими же, как указано выше. X4 представляет уходящую группу, такую как галоген, а X5 представляет гидроксил или меркапто). Соединение (11), которое будет исходным материалом, может быть также получено общим способом, показанным ниже в уравнении реакции (IV).(2) Если X является необязательно замещенным азотом. Соединения, представленные формулой (17), могут быть получены путем реакции соединений,представленных формулой (15), с соединениями, представленными формулой (16), общим способом, как показано ниже в уравнении реакции (V). 6(В формуле Су 1, Су 2, R1a, R1b, R2a, R2b, R3a, R3b, R4a и R4b являются такими же, как указано выше. R" представляет заместитель на азоте, такой как водород, трифторацетил или трифторметилсульфонил). Соединение (17), которое является соединением настоящего изобретения, может быть получено также сочетанием соединения (15) и соединения, представленного формулой (18), общим способом, как показано ниже в уравнении реакции (VI).(В формуле Су 1, Су 2, R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b, R5 и R" являются такими же, как указано выше. X7 представляет уходящую группу, такую как галоген и сульфонилокси). Соединение (17), которое является соединением настоящего изобретения, может быть получено также сочетанием соединения (19) и соединения, представленного формулой (20), общим способом, как показано ниже в уравнении реакции (VII).(В формуле Су 1, Су 2, X7, R1a, R1b, R2a, R2b, R3a, R3b, R4a, R4b, R5 и R" являются такими же, как указано выше). 3) Агенты для борьбы с вредителями, представленные формулой (3). Агенты для борьбы с вредителями настоящего изобретения отличаются наличием в качестве активного ингредиента соединений формулы (3), их солей или их N-оксидов. Настоящее изобретение относится к средствам для борьбы с вредителями, которые содержат в качестве активных ингредиентов соединения, представленные формулой (3), их соли или их N-оксиды. В формуле (3) Су 11, Су 21, X11 и от R11a до R51 являются такими же, как соответствующие Су 1, Су 2, X и от R1a до R5 в формуле (1), соответственно, за исключением отсутствия ограничений относительно Су 11 и Су 21. Поскольку соединения настоящего изобретения (соединения, представленные формулой (1), их соли или их N-оксиды) обладают инсектицидной активностью против взрослых насекомых и куколок, ларвицидной или овицидной активностью, они могут использоваться для борьбы с насекомыми, наносящими вред урожаю, клещами, санитарными насекомыми, насекомыми-вредителями хранящегося зерна,вредителями одежды, домашними вредителями или подобными. Конкретные организмы, являющиеся объектами контроля, включают следующие. Предпочтительно, вредители, принадлежащие отряду Lepidoptera, такие как Spodoptera litura, Mamestra brassicae, Agrotis ipsilon, зеленые гусеницы, Autographa nigrisigna, Plutella xylostella, AdoxophyesTetranychus urticae, Tetranychus cinnabarinus, Tetranychus kanzawai, Panonychus citri, Panonychus ulmi, Aculops pelekassi, Aculus schlechtendali, Polyphagotarsonemus latus, род Brevipalpus, род Eotetranichus,Rhizoglyphus robini, Tyrophagus putrescentiae, Dermatophagoides farinae, Boophilus microplus и Haemaphysalis longicornis; и паразитарные нематоды растений, такие как Meloidogyne incognita, вид Pratylenchus, Heterodera glycines, Aphelenchoides besseyi и Bursaphelenchus xylophilus. Вредители, к которым предпочтительно относится настоящее изобретение, являются вредителями,принадлежащими отряду Lepidoptera, вредителями, принадлежащими отряду Hemiptera, Acarina, вредителями, принадлежащими отряду Thysanoptera и вредителями, принадлежащими отряду Coleoptera, и особенно предпочтительно Acarina. Кроме того, желательны препараты, которые также эффективны для вредителей или Acarnia, принадлежащих к резистентной линии, потому что в последние годы устойчивость к фосфорорганическим пестицидам, карбаматным пестицидам или акарицидам, разработанным для многих вредителей, таких как Plutella xylostella, Delphacidae, Deltocephalidae и Aphididae, создала проблемы вследствие недостаточного эффекта данных препаратов. Соединения настоящего изобретения являются препаратами, оказывающими превосходное инсектицидное и акарицидное действие не только на вредителей из чувствительных линий, но также и на вредителей линий, устойчивых к фосфорорганическим пестицидам, карбаматным пестицидам и пиретроидным пестицидам, и на Acarnia линии, устойчивой к акарицидам. Соединения настоящего изобретения являются также препаратами, наносящими меньший гербицидный ущерб, обладают более низкой токсичностью для рыб и теплокровных животных и более высокой безопасностью. Соединения настоящего изобретения могут также использоваться как средства, предохраняющие от биологического обрастания для предотвращения присоединения водных организмов к объектам, находящимся в контакте с водой, таким как днище судна (или же обшивка) и рыболовные сети. Некоторые из соединений настоящего изобретения проявляют бактерицидную активность, гербицидную активность или активность в регулирировании роста растений. Кроме того, некоторые интермедиаты соединений настоящего изобретения, которые представлены формулой (1) или (3), проявляют инсектицидную/акарицидную активность. Средства для борьбы с вредителями настоящего изобретения имеют в составе в качестве активных ингредиентов соединения настоящего изобретения, которые представлены формулой (1) или (3), и данные средства могут использоваться или индивидуально, или путем смешивания двух или более из них. Соединения настоящего изобретения могут использоваться так, как они есть, без добавления каких-либо других компонентов. Однако при практическом использовании они обычно дополнительно перемешиваются с сухим веществом, жидкостью или газообразными носителями, или ими пропитываются субстраты, таких как пористые керамические пластины и нетканые ткани, и при добавлении поверхностноактивных веществ и/или других активирующих добавок, если необходимо, используются в виде рецептур в форме, которую могут принимать обычные агрохимикаты, то есть смачиваемого порошка, гранул,опудривающего порошка, эмульсии, водорастворимого порошка, суспендирующего средства, гранулированного смачиваемого порошка, текучего вещества, аэрозоля, средства, испаряющегося при нагревании, фумиганта, ядовитой приманки, микрокапсул или подобного. Если требуется твердая рецептура, в качестве добавок и носителей используются смачиваемые порошки, такие как соевая мука и пшеничная мука; тонкий минеральный порошок, такой как доломитовая земля, апатит, гипс, тальк, бентонит, пирофиллит и глина; и органические и неорганические соединения,такие как бензоат натрия, мочевина и сульфат натрия. Если требуется жидкая форма рецептуры, в качестве растворителей используются нефтяные дистилляты, такие как керосин, ксилол и ароматический растворитель, и циклогексан, циклогексанон, диметилформамид, диметилсульфоксид, спирт, ацетон,метилизобутилкетон, минеральное масло, растительное масло, вода или подобные. В качестве газообразных носителей, используемых в газе-вытеснителе, могут использоваться бутан (газ), сжиженный нефтяной газ (LPG), диметиловый эфир и газ диоксида углерода. В качестве субстрата для ядовитой приманки могут использоваться компоненты приманки, такие как зерновая мука, растительное масло, сахар и кристаллическая целлюлоза; антиоксиданты, такие как дибутилгидрокситолуол и нордигидрогваяретовая кислота; консерванты, такие как дегидрацетовая кислота; средства для предотвращения случайного глотания детьми или домашними животными, такие как порошок стручкового перца; и ароматы, привлекающие вредных насекомых, такие как ароматы сыра и луковые ароматы. Дополнительно, для достижения гомогенных и стабильных форм данных рецептур в случае необходимости возможно также добавить поверхностно-активные вещества. Хотя поверхностно-активные вещества специально не ограничиваются, их примеры включают, например, неионогенные поверхностно-активные вещества, такие как алкиловый простой эфир, если добавляется полиоксиэтилен, сложный эфир высшей жирной кислоты, если добавляется полиоксиэтилен, сорбитановый сложный эфир высшей жирной кислоты, если добавляется полиоксиэтилен, и тристирил фениловый эфир, если добавляется полиоксиэтилен; соль сульфатного сложного эфира алкилфенилового эфира, если добавляется полиокси-9 014057 этилен, алкил нафталин сульфонатная соль, поликарбоксилатная соль, сульфонатная соль лигнина, конденсат формальдегида с алкилнафталин сульфонатом и сополимер изобутилена и малеинового ангидрида. В случае, если соединения настоящего изобретения используются как средства для борьбы с вредителями в сельском хозяйстве, количество активного ингредиента в рецептуре составляет от 0,01 до 90 мас.%, и особенно предпочтительно от 0,05 до 85 мас.%, и смачиваемый порошок, эмульсия, суспендирующие средства, средства для улучшения сыпучести, водорастворимый порошок, гранулированный смачиваемый порошок, которые разбавляются водой до предварительно определенных концентраций, и опудривающий порошок и гранулы могут наноситься на растения или почву как они есть. Кроме того, если соединения настоящего изобретения используются в качестве средств для борьбы с вредителями в целях карантина, эмульсии, смачиваемый порошок, средства для улучшения сыпучести и т.п. применяются путем разбавления водным и масляным раствором до предварительно заданных концентраций, а аэрозоль, ядовитая приманка, противоклещевое покрытие и т.п. могут применяться как они есть. В случае, если соединения настоящего изобретения используются как средства для борьбы с вредителями при борьбе с экзопаразитами домашнего скота, такого как крупный рогатый скот и свиньи, или домашних животных, таких как собаки и кошки, рецептуры с использованием соединений настоящего изобретения используются в известных способах в области ветеринарии. В качестве таких способов, их примеры включают способ для введения в формах, таких как таблетки, капсулы, иммерсионная жидкость, кормовая смесь, свеча и инъекция (внутримышечная, подкожная, внутривенная, интраперитонеальная или подобное), если требуется системный контроль и способ для введения распылением, выливанием или разбрызгиванием масляных или водных жидких рецептур, или способ заключения в среду изделий, которые являются рецептурами смолы, формированными в ошейник, ушные бирки или подобное,если требуется несистемный контроль. В данном случае обычно может использоваться пропорция, где на 1 кг животного-хозяина применяется от 0,01 до 1000 мг соединений настоящего изобретения. Следует отметить, что хотя соединения настоящего изобретения, само собой разумеется, достаточно эффективны, даже если используются индивидуально, они могут также использоваться путем смешивания или путем объединения с одним или более других средств для борьбы с вредителями, антимикробными препаратами, инсектицидами/акарицидами, гербицидами, регуляторами роста ратсений, синергистами, удобрениями, кондиционерами почвы, кормами для животных и тому подобное. Типичные представители активных ингредиентов гермицидов, акарицидов, регуляторов роста растений или им подобных, которые могут использоваться при смешивании или при объединении с соединением настоящего изобретения, представлены ниже. Гермициды: каптан, фольпет, тиурам, зирам, зинеб, манеб, манкозеб, пропинеб, поликарбамат, хлорталонил,квинтозен, каптафол, ипродион, процимедон, фтороимид, мепронил, флутоланил, пенцикурон, оксикарбоксин, фозетил-алюминий, пропамокарб, триадимефон, триадименол, пропиконазол, диклобутразол,битертанол, гексаконазол, миклобутанил, флузилазол, этаконазол, фтортримазол, флутриафен, пенконазол, диниконазол, ципроконазол, фенаримол, трифлумизол, прохлораз, имазалил, пифуразоат, тридеморф, фенпропиморф, трифорин, бутиобат, пирифенокс, аниразин, полиоксины, металаксил, оксадиксил,фуралаксил, изопротиолан, пробеназол, пирролнитрин, бластицидин S, касугамицин, валидамицин, дигидрострептомицин сульфат, беномил, карбендазим, тиофанатметил, гимексазол, основной хлорид меди,основной сульфат меди, фентинацетат, трифенилтин гидроксид, диэтофенкарб, хинометионат, бинапакрил, лецитин, натрия карбонат, дитианон, динокап, фенаминосульф, дикломезин, гуазатин, додин, IBP,эдифенфос, мепанипирим, фермзон, трихламид, метасульфокарб, флуазинам, этохинолак, диметоморф,пироквилон, теклофталам, фталид, оксид феназина, тиабендазол, трициклазол, винклозолин, цимоксанил,циклобутанил, гуазатин, промокарб хлоргидрат, оксолиновая кислота, цифлуфенамид, иминоктадин, крезоксим-метил, триазин, фенгексамид, циазофамид, ципродинил, протиоконазол, фенбуконазол, трифлоксистробин, азоксистробин, гексаконазол, имибенконазол, тебуконазол, дифеноконазол и карпропамид; Инсектициды/акарициды: фосфорорганические и карбаматные пестициды: фентион, фенитротион, диазинон, хлорпирифос, ESP, вамидотион, пентоат, диметоат, формотион,малатион, трихлорфон, тиометон, фосмет, дихлорвос, ацефат, ЕРВР, метил паратион, оксидеметон метил, этион, салитион, цианофос, изоксатион, пиридафентион, фосалон, метидатион, сульпрофос, хлорфенвинфос, тетрахлорвинфос, диметилвинфос, пропафос, изофенфос, этилтиометон, профенфос, пираклофос, монокротофос, азинфос-метил, альдикарб, метомил, тиодикарб, карбофуран, карбосульфан, бенфуракарб, фуратиокарб, пропоксур, ВРМС, МТМС, MIPC, карбарил, пиримикарб, этиофенкарб, феноксикарб, картап, тиоциклам, бенсультап и тому подобное; пиретроидные пестициды: перметрин, циперметрин, дельтаметрин, фенвалерат, фенпропатрин, пиретрин, аллетрин, тетраметрин, резметрин, диметрин, пропатрин, фенотрин, протрин, флувалинат, цифлутрин, цигалотрин, флуцитринат, этофенпрокс, циклопротрин, тралометрин, силафлуофен и акринатрин;- 10014057 бензоилмочевина и другие пестициды: дифлубензурон, хлорфлуазурон, гексафлумурон, трифлумурон, флувеноксурон, флуциклоксурон,бупрофезин, пирипроксифен, метопрен, бензоэпин, диафентиурон, имидаклоприд, фипронил, сульфат никотина, ротенон, метацетальдегид, ацетамиприд, chlorfenapyr, нитенпирам, тиаклоприд, клотианидин,тиаметоксам, динотефуран, индоксакарб, пиметрозин, спиносад, имамектин, пиридалил, тебуфенозид,chromafenozide, метоксифенозид, толфенпирад, машинное масло, микробные пестициды, такие как ВТ и энтомопатогенные вирусы; нематициды: фенамифос, фостиазат, кадусафос и тому подобное; акарициды: хлорбензилат, фенизобромолат, дикофол, амитраз, BPPS, бензомат, гекситиазокс, фенбутатин оксид, полинактин, хинометионат, CPCBS, тетрадифон, авермектин, милбемектин, клофентезин, цигексатин, пиридабен, фенпироксимат, тебуфенпирад, пиримидифен, фенотиокарб, диенохлор, флуакрипирим,ацехиноцил, бифеназат, этоксазол, спиродиклофен, феназахин и тому подобное; регуляторы роста растений: гиббериллины (например, гиббериллин A3, гиббериллин А 4 илигиббериллин А 7), IAA, NAA. Далее настоящее изобретение будет описано с дополнительными подробностями с использованием примеров. Однако настоящее изобретение ни в каком аспекте не ограничивается приведенными ниже примерами. Получение. Пример 1. 23,3 г 2,2,2-трихлорэтил хлорформиатного сложного эфира добавили при комнатной температуре к 150 мл суспензии в бензоле, содержащей 14,1 г тропина и 1,4 г карбоната калия, и однородную смесь кипятили в течение 3,5 ч. После охлаждения до комнатной температуры реакционную смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и высушили безводным сульфатом магния. После упаривания растворителей при пониженном давлении получили 30,1 г маслянистого карбамата (А), и данный карбамат использовали непосредственно в следующей реакции. Затем 65 г цинковой пыли добавили к 250 мл ацетатного раствора данного карбамата (А). После перемешивания в течение 5 мин смесь нагревали при 80 С в течение 1 ч. После охлаждения до комнатной температуры смесь подвергали фильтрованию через целит. Концентрированием фильтрата под вакуумом получили 15,5 г неочищенного продукта соединения (В). 150 мл суспензии в ацетонитриле, содержащей 5,64 г неочищенного продукта соединения (В), полученного как указано выше, 41,5 г карбоната калия и 8,2 г 2-хлор-5-трифторметилпиридина кипятили с обратным холодильником в течение 3,5 ч. После охлаждения до комнатной температуры реакционную смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и высушили безводным сульфатом магния. После упаривания растворителей при пониженном давлении получили 3,5 г соединения (С) в виде кристаллов. 32 мг 60% гидрида натрия при охлаждении льдом добавили к 3 мл раствора в диметилформамиде(DMF), содержащего 0,21 г соединения (С), и однородную смесь перемешивали в течение 40 мин. Затем к данной смеси добавили 0,17 г 2-хлор-5-трифторметилпиридина и полученную смесь нагрели до 100 С и перемешивали при нагревании в течение ночи. После охлаждения до комнатной температуры реакционную смесь вылили в ледяную воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией (элюирующий раствор: смесь растворителей н-гексана и этилацетата) для получения 0,06 г конечного вещества. Температура плавления: 104-105 С. 0,44 г 60% гидрида натрия добавили к 15 мл раствора DMF, содержащего 1,8 г 4-фтор-3-гидроксибензотрифторида и после перемешивания однородной смеси в течение 20 мин к ней добавили 3 мл раствора DMF, содержащего 1,7 г 1-иодопропана, и затем полученный раствор перемешивали в течение 4 ч при комнатной температуре. 1,4 г тропина и 0,43 г 60% гидрида натрия добавили к полученной смеси при комнатной температуре и полученный раствор нагрели до 100 С и перемешивали при нагревании в течение ночи. После охлаждения до комнатной температуры реакционную смесь вылили в ледяную воду и экстрагировали этилацетатом. После промывания водой и высушивания безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией для получения 1,1 г маслянистого соединения (D). 4 мл раствора в метиленхлориде, содержащего 0,83 г 1-хлорэтил хлорформиатного сложного эфира,добавили при комнатной температуре к 6 мл раствора в метиленхлориде, содержащего 1,0 г соединения(D), и однородную смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь разбавили метиленхлоридом, промыли насыщенным водным раствором гидрокарбоната натрия, а затем раствором хлорида натрия, и сушили безводным сульфатом магния. Неочищенный карбонат (Е) получали при упаривании растворителей при пониженном давлении и использовали непосредственно в следующей реакции. К соединению (Е) добавили 6 мл метанола и смесь кипятили с обратным холодильником в течение 2,5 ч. Полученную смесь концентрировали под вакуумом для получения неочищенного соединения (F). Неочищенное соединение (F) обрабатывали щелочью для получения свободного амина, и данный амин использовали непосредственно в следующей реакции. 0,4 г трет-бутоксинатрия, 13,7 мг Pd2(dba)3 и 17,7 мг из 2-(дициклогексилфосфино)-2'-(N,N-диметиламино)бифенила добавили к 11 мл раствора толуола, содержащего 1 г свободной формы соединения(F), полученной как описано выше, и 0,73 г 4-бром-2-фторбензотрифторида, и однородную смесь кипятили с обратным холодильником в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией (элюирующий раствор: смесь растворителей н-гексана и этилацетата) для получения 0,54 г конечного соединения. Вязкое масло. 1- 12014057 Общеее количество 5,8 г 60% гидрида натрия добавили несколькими порциями к 240 мл раствораDMF, содержащего 17,6 г тропина и 21,6 г 2-хлор-5-трифторметилпиридина при 80 С, и однородную смесь перемешивали в течение 2 часов при такой же температуре. После охлаждения до комнатной температуры реакционную смесь вылили в ледяную воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Остаток очищали колоночной хроматографией (NH-гель; использовали DM-1020; элюирующий раствор: смесь растворителей гексана и этилацетата) для получения 25 г соединения (G). 26 г 2,2,2-трихлорэтил хлорформиатного сложного эфира добавили к 150 мл суспензии в бензоле,содержащей 25 г соединения (G) и 1,33 г карбоната калия, при комнатной температуре и смесь кипятили с обратным холодильником в течение 1 ч при нагревании. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и высушили безводным сульфатом магния. Твердый карбонат получили упариванием растворителей при пониженном давлении, и данный карбонат использовали непосредственно в следующей реакции. 42 г цинковой пыли добавили к 300 мл ацетатного раствора, содержащего полученный выше карбонат, и однородную смесь перемешивали в течение 1 ч при нагревании при 100 С. После охлаждения до комнатной температуры смесь фильтровали через целит и после добавления хлорформа и воды к полученному фильтрату отделяли органический слой. Водный слой делали слабо щелочным, экстрагировали хлороформом и смешивали с отделенным органическим слоем. Смесь промывали водой, сушили безводным сульфатом магния, а затем из нее упаривали растворители при пониженном давлении для получения 14,4 г неочищенного соединения (Н). 30 мл суспензии в ацетонитриле, содержащей 2 г соединения (Н), 3,04 г карбоната калия и 1,41 г 2 фтор-5-трифторметилбензальдегида, кипятили с обратным холодильником В течение 3,5 ч. После охлаждения до комнатной температуры реакционную смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и сушили безводным сульфатом магния. Упариванием растворителей при пониженном давлении и очисткой остатка колоночной хроматографией на силикагеле (элюирующий раствор: смесь растворителей н-гексана и этилацетата) было получено 2,77 г конечного соединения. Температура плавления: 122-123 С. 1 0,56 г 60% гидрида натрия добавили к 20 мл раствора DMF, содержащего 1,0 г тропина. 1,76 г 4 фтор-3-изопропоксикарбонилбензотрифторида добавили по капле к данной смеси. После перемешивания в течение ночи при комнатной температуре смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и полученный фильтрат упаривали при пониженном давлении для получения 1,15 г неочищенного соединения (I). Неочищенное соединение (I) использовали непосредственно в следующей реакции. Обратите внимание, что 4-фтор-3-изопропоксикарбонилбензотрифторид получали путем этерификации изопропилом коммерчески доступного 2-фтор-5-трифторметилбензоата. 0,05 г карбоната калия и 0,52 г сложного эфира 1-хлорэтил хлорформиата добавили к 20 мл раствора бензола, содержащего 1,23 г неочищенного соединения (I), и смесь кипятили с обратным холодильником в течение 5 часов при нагревании. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и высушили безводным сульфатом магния. Концентрат, полученный упариванием растворителей при пониженном давлении, растворили в 20 мл метанола и однородный раствор перемешивали в течение ночи при ком- 13014057 натной температуре. После упаривания растворителей при пониженном давлении получили 1,0 г неочищенного соединения (J), и данное соединение использовали непосредственно в следующей реакции. Стадия 2. Получение 3-[2-изопропоксикарбонил-4-(трифторметил)фенокси]-8-[6-цианопиридазин 3-ил]-8-азабицикло [3.2.1]октана. 30 мл суспензии ацетонитрила, содержащей 1,0 г неочищенного соединения (J), 1,16 г карбоната калия и 0,39 г 3-хлор-6-цианопиридазина, кипятили с обратным холодильником в течение 3 ч при нагревании, после охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и высушили безводным сульфатом магния. Концентрат, полученный при упаривании растворителей при пониженном давлении, очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 0,18 г кристаллов. Затем эти кристаллы промывали диэтиловым эфиром для получения 0,04 г конечного соединения. Температура плавления: 219-221 С. 1 0,12 г 60% гидрида натрия добавили при охлаждении льдом к 4 мл раствора DMF, содержащего 0,50 г 4-фтор-3-гидроксибензотрифторида. После перемешивания смеси при комнатной температуре в течение 30 мин к ней добавили 0,51 г 1-йодопропана. Смесь нагрели до 90 С, и смесь перемешивали в течение 30 мин. 4 мл раствора DMF, содержащего 0,41 г соединения (K) и 0,09 г 60% гидрида натрия,добавили к смеси при комнатной температуре и после перемешивания в течение 15 мин полученную смесь нагрели до 100 С и перемешивали в течение 2 ч. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) с образованием 0,75 г соединения (L) в виде маслянистого вещества. 1 0,13 г 10% палладия на угле добавили к 20 мл раствора этилового спирта, содержащего 0,66 г соединения (L). Суспензию перемешивали в течение ночи при комнатной температуре в атмосфере водорода (1,01105 Па). Реакционный раствор фильтровали через целит, и полученный фильтрат упарили при пониженном давлении с образованием 0,55 г неочищенного соединения (М). 3-бром-6-(трифторметил)пиридин получали из коммерчески доступного 3-амино-6-(трифторметил) пиридина обычной реакцией Зандмайера. 0,16 г 3-бром-6-(трифторметил) пиридин, 0,1 г трет-бутокси натрия, 6,47 мг Pd2(dba)3 и 8,34 мг 2- 14014057(дициклогексилфосфино)-2'-(N,N-диметиламино)бифенила добавили к 2 мл раствора толуола, содержащего 0,23 г неочищенного соединения (М), и смесь кипятили с обратным холодильником при нагревании в течение ночи в атмосфере азота. После охлаждения реакционную смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 0,1 г конечного соединения. Температура плавления: 79-80 С. 1 2,6 г 10% палладия на угле добавили к 100 мл раствора этилового спирта, содержащего 4,32 г соединения (K). Суспензию нагрели до 50 С и перемешивали в течение 2 ч в атмосфере водорода, а затем перемешивали в течение ночи при комнатной температуре. Реакционный раствор фильтровали через целит, и полученный фильтрат упаривали при пониженном давлении для получения 2,5 г неочищенного соединения (N). 2-бром-5-(трифторметил)тиадиазол получали из коммерчески доступного 2-амино-5-(трифторметил)тиадиазола обычной реакцией Зандмайера. 0,37 г 2-бром-5-(трифторметил)-1,3,4-тиадиазола, 0,65 г карбоната калия и 10 мг тетра-н-бутиламмонийбромида добавили к 6 мл раствора ацетонитрила, содержащего 0,2 г неочищенного соединения(N), и смесь кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 0,25 г конечного соединения. Стадия 2. Получение 8-[2-гидрокси-4-(трифторметил)фенокси]-3-(5-трифторметил-1,3,4-тиадиазол-2-ил)-3-азабицикло[3.2.1]октана (Q). 1,6 г 60% гидрида натрия добавили к 60 мл раствора DMF, содержащего 6,0 г 4-фтор-3 гидроксибензотрифторида при охлаждении льдом. После перемешивания смеси в течение 30 мин при комнатной температуре 3,2 г хлорметилового эфира добавили по капле при охлаждении льдом. После достижения комнатной температуры полученную смесь перемешивали в течение 30 мин, вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 6,88 г соединения (О). 0,34 г соединения (N) добавили к 6 мл раствора DMF, содержащего 0,36 г соединения (О). Смесь нагрели до 80 С и добавили к ней 0,07 г 60% гидрида натрия, и полученную смесь продолжали нагревать до 80 С в течение 2 ч. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 0,28 г соединенияH-ЯМР (CDCl3,м.д.): 1,68-1,71 (м, 2 Н), 2,10-2,13 (м, 2 Н), 2,62 (ш.с,2 Н), 3,45 (д 2 Н), 3,52 (с, 3H),3,84 (д, 2 Н), 4,63 (с, 1H), 5,20 (с, 2 Н), 7,01 (д, 1H), 7,25 (д, 1H), 7,37 (с, 1H). 4 мл 10% соляной кислоты добавили при комнатной температуре к 4 мл раствора тетрагидрофурана(ТГФ), содержащего 0,28 г соединения (Р). Смесь кипятили с обратным холодильником в течение 1 ч а затем вылили в воду и экстрагировали этилацетатом. Органический слой промыли насыщенным водным раствором гидрокарбоната натрия, а затем раствором хлорида натрия и сушили безводным сульфатом магния. 0,25 г конечного соединения (Q) получали путем испарения растворителей при пониженном давлении. 1 0,07 г соединения (R) синтезировали способом, описанным в опубликованной японской патентной заявке 2001-81071, с использованием 0,25 г соединения (Q). 0,5 мл ацетона и 1 каплю концентрированной соляной кислоты добавили к 1 мл раствора этанола,содержащего 0,07 г соединения (R), и однородную смесь перемешивали в течение 80 мин при комнатной температуре. Реакционную смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводньм сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле (элюент: смесь растворителей н-гексана и этилацетата) для получения 0,05 г конечного соединения. Температура плавления: 113115 С. 1 5 мл суспензии ацетонитрила, содержащей 0,15 г 3-азабицикло[3.2.1]окта-8-ола, 0,65 г карбоната калия и 0,33 г 2-хлор-5-цианопиридина кипятили с обратным холодильником при нагревании в течение ночи. После охлаждения до комнатной температуры смесь вылили в воду и экстрагировали этилацетатом. Органический слой промывали раствором хлорида натрия и сушили безводным сульфатом магния. 0,16 г неочищенного соединения (S) получали путем испарения растворителей при пониженном давлении, и данное соединение использовали непосредственно в следующей стадии. Стадия 2. Получение 8-[2-метоксиметоксильный-4-(трифторметил)фенокси]-3-(5-цианопиридин-2 ил)-3-азабицикло[3.2.1]октана (Т). 0,14 г 60% гидрида натрия добавили к 10 мл раствора DMF, содержащего 0,58 г 4-фтор-3-гидроксибензотрифторид, при охлаждении льдом. После перемешивания смеси в течение 30 мин при комнатной температуре к ней по каплям добавили 0,28 г хлорметилового эфира при охлаждении льдом. После завершения добавления реакционный раствор нагрели до комнатной температуры и перемешивали в течение 30 мин, а затем дополнительно нагревали до 80 С и перемешивали в течение 30 мин. 0,49 г соединения (S) и 0,13 г 60% гидрида натрия добавили к реакционной смеси при 80 С и полученную смесь перемешивали в течение 30 мин, а затем нагревали до 80 С и дополнительно перемешивали в течение 2 ч.- 16014057 Реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле 10 мл 10% соляной кислоты добавили при комнатной температуре к 10 мл раствора ТГФ, содержащего 0,82 г соединения (Т). Смесь кипятили с обратным холодильником при нагревании в течение 30 минут, вылили в воду и экстрагировали этилацетатом. Органический слой промыли раствором хлорида натрия и сушили безводным сульфатом магния. 0,74 г конечного соединения (U) получали путем упаривания растворителей при пониженном давлении. 1H-ЯМР (CDCl3,м.д.): 1,62-1,75 (м, 2 Н), 1,91-1,98 (м, 2 Н), 2,65 (ш.с, 2 Н), 3,17 (д, 2 Н), 4,26 (д, 2 Н),4,66 (с, 1H), 5,63 (с, 1H), 6,60 (д, 1H), 6,98 (д, 1H), 7,13 (д, 1H), 7,16 (с, 1 Н), 7,63 (д, 1H), 8,42 (с, 1H). Данное соединение использовалось непосредственно в следующей стадии без очистки. Стадия 4. Получение 8-[2-изопропилиденаминоокси-4-(трифторметил)фенокси]-3-(5-цианопиридин-2-ил)-3-азабицикло[3.2.1]октана (W). 0,76 г соединения (V) синтезировали по способу, описанному в опубликованной японской патентной заявке 2001-81071, с использованием 0,74 г соединения (U). 1H-ЯМР (CDCl3,м.д.): 1,55-1,68 (м, 2 Н), 1,99-2,04 (м, 2 Н), 2,59 (ш.с, 2 Н), 3,13 (д, 2 Н), 4,22 (д, 2 Н),4,60 (с, 1H), 6,00 (ш.с, 2 Н), 6,59 (д, 1H), 6,98 (д, 1H), 7,20 (д, 1 Н), 7,60 (д, 2 Н), 8,01 (с, 1H), 8,41(с, 1H). 3 мл ацетона и 1 каплю концентрированной соляной кислоты добавили к 3 мл раствора этанола, содержащего 0,76 г соединения (V), и однородную смесь перемешивали в течение 1 ч при комнатной температуре. Смесь вылили в воду и экстрагировали этилацетатом. После промывания водой и сушки безводным сульфатом магния органический слой фильтровали и затем концентрировали под вакуумом. Концентрат очищали колоночной хроматографией на силикагеле(элюент: смесь растворителей н-гексана и этилацетата) для получения 0,45 г конечного соединения (W). Структура была подтверждена ЯМР. Температура плавления: 120-122 С. 1,2 г уксусной кислоты, 80 мл метанола и 5,33 г 90% формалина добавили к 2,2 г бензиламина в указанном порядке. Затем по каплям, при постепенном нагревании смеси от 20 до 45 С, к ней добавили 2,0 г соединения (X) и полученную смесь кипятили с обратным холодильником в течение 5,5 ч и перемешивали в течение ночи при комнатной температуре. Растворители упарили под пониженным давлением из реакционной смеси и к полученному остатку добавили 100 мл воды и 2 мл концентрированной соляной кислоты и промыли диэтиловым эфиром. Путем добавления гидроксида натрия доводили рН водного слоя до 7 или более и экстрагировали хлороформом. После сушки органического слоя безводным сульфатом магния растворители упарили при пониженном давлении, а остаток очищали колоночной хроматографией на силикагеле (хлороформ:метанол= 10:1 (об./об. для получения 4,09 г соединения (Y). Выход 88,5%. Затем 1,86 г боргидрида натрия при 0 С добавили: к 30 мл раствора 2-пропанола, содержащего 2,24 г соединения (Y), после чего к нему добавили 15 мл воды и полученную смесь нагревали при комнатной температуре и перемешивали в течение одного дня. После охлаждения реакционной смеси до 0 С к ней добавили 75 мл 10%-ной соляной кислоты, а затем к ней добавили при такой же температуре 45 мл 10% гидроксида натрия. Полученную смесь экстрагировали хлороформом и органический слой сушили безводным сульфатом магния. Растворители упаривали при пониженном давлении для получения 1,56 г соединения (Z) в виде вязкого масла. Выход 83,8%. Стадия 2. Получение соединения (АА). 0,40 г 60% гидрида натрия добавили к 20 мл раствора DMF, содержащего 1,56 г соединения (Z), полученного в стадии 1, и полученную смесь перемешивали в течение 15 мин при комнатной температуре. К смеси добавили 2,35 г 4-фтор-3-(циклопропилметокси)трифторметилбензола, и полученную в результате смесь перемешивали в течение 3 ч при 100 С. После охлаждения реакционной смеси до комнатной температуры к ней прилили воду и экстрагировали этилацетатом. После промывания насыщенным раствором хлорида натрия и сушки безводным сульфатом магния органический слой фильтровали и концентрировали под вакуумом для получения неочищенного соединения (АА). Полученное неочищенное соединение (АА) очищали колоночной хроматографией на силикагеле(элюент: н-гексан:этилацетат = 2:3 (об./об. для получения 0,98 г соединения (АА-цис) в виде вязкого масла (выход 32,7 %), и 0,76 г соединения (АА-транс) как цистамин (выход 25,4 %), соответственно. Данные ЯМР для АА-цис: 1H-ЯМР (CDCl3,м.д.): 0,34-0,44 (м, 2 Н), 0,60-0,67 (м, 2 Н), 1,26-1,31 (м, 2 Н), 1,94 (ш.с, 2 Н), 2,49 (д,2 Н), 3,17 (д, 2 Н), 3,57 (с, 2 Н), 3,79 (д, 2 Н), 3,88 (д, 2 Н), 4,27 (д, 2 Н), 4,43 (т, 1H), 6,94 (д, 1 Н), 7,10 (с, 1 Н),7,17 (д, 1H), 7,20-7,40 (м, 5 Н). Данные ЯМР для АА-транс: 1 0,20 г 10% Pd/C добавили к 20 мл раствора этанола, содержащего 0,98 г соединения (АА-цис), полученного в стадии 2, и однородную смесь перемешивали в течение 6,5 ч при 60 С в атмосфере водорода(при атмосферном давлении). Реакционную смесь фильтровали, а фильтрат упаривали при пониженном давлении для получения 0,75 г дебензилированного продукта (АВ) в виде маслянистого вещества. Выход 95,9%. 1(ш.с, 1H), 3,04 (д, 2 Н), 3,38 (д, 2 Н), 3,85-3,91 (м, 4 Н), 4,35 (д, 2 Н), 4,59 (т, 1H), 6,95 (д, 1H), 7,10 (с, 1H),7,12 (д, 1H). 0,19 г 3-хлор-6-(трифторметил)пиридазина и 0,15 г 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) добавили к 3 мл раствора N-метилпирролидона, содержащего полученное соединение (АВ), и полученную в результате смесь перемешивали в течение 3 ч при от 120 до 130 С. После охлаждения реакционной смеси до комнатной температуры к ней прилили воду и экстрагировали этилацетатом. После промывания насыщенным раствором хлорида натрия и сушки безводным сульфатом магния органический слой фильтровали и концентрировали под вакуумом. Полученный остаток очищали колоночной хроматогра- 18014057 фией на силикагеле (элюент: н-гексан:этилацетат =1:1 (об./об. для получения 0,24 г конечного соединения (АС). Выход 57 %, температура плавления от 93 до 95 С. Примеры соединений настоящего изобретения, полученных по способу в соответствии с вышеупомянутыми примерами, показаны ниже в таблице, включая соединения, полученные в вышеупомянутых примерах. Следует отметить, что ниже в таблице R1 и R2 обозначают заместители, содержащие заместители, связанные двумя или более заместителями для упрощения таблицы. Кроме того, обозначение"вязк." показывает, что соединение является вязким маслом, а обозначение "аморфн." показывает, что соединение является аморфным. Кроме того, nD21,8-1,5008 означает, что показатель преломления при 21,8 С равен 1,5008 (то же самое относится также к другим). Кроме того, обозначение cPr означает циклопропил, обозначение сНех означает циклогексил (то же самое также относится к другим), обозначение Ас означает ацетил, обозначение nPr означает нормальный пропил, обозначение iPr означает изопропил, обозначение nBu означает нормальный бутил, обозначение iBu означает изобутил, и обозначение tBu означает третичный бутил, и обозначение TMS означает триметилсилил, и обозначение ТГФ означает тетрагидрофуранил. Таблица 1 Обратите внимание, что R1b, R2b, R3a, R3b, R4a, R4b и R5 представляют атом водорода, соответственно, если не указано иначе. Обратите внимание, что R1b, R2b, R3a, R3b, R4a, R4b и R5 представляют атом водорода, соответственно, если не указано иначе. Обратите внимание, что R1b, R2b, R3a, R3b, R4a, R4b и R5 представляют атом водорода, соответственно, если не указано иначе.
МПК / Метки
МПК: A01N 43/78, A01N 43/42, C07D 471/04, C07D 451/14, A01P 7/02, A01N 43/58, A01N 43/90, A01N 43/824, C07D 491/08, A01N 43/56, A01P 7/04
Метки: соединения, поперечно, аминов, связанные, циклических, средства, борьбы, вредителями
Код ссылки
<a href="https://eas.patents.su/30-14057-poperechno-svyazannye-soedineniya-ciklicheskih-aminov-i-sredstva-dlya-borby-s-vreditelyami.html" rel="bookmark" title="База патентов Евразийского Союза">Поперечно связанные соединения циклических аминов и средства для борьбы с вредителями</a>
Предыдущий патент: Сшиваемая полимерная композиция, сшитая полимерная композиция, способ получения композиции, изделие, содержащее композицию (варианты), способ получения изделия
Следующий патент: Способ производства органических карбонатов
Случайный патент: Способ обработки подземных скважин с использованием изменяемых добавок












