Слитые полипептиды, содержащие glp-1 (глюкагон-подобный пептид-1), с повышенной устойчивостью к пептидазам
Формула / Реферат
1. Слитый пептид, содержащий в качестве компонента (I) N-концевую последовательность
(i) GLP-1(7-37) SEQ ID NO:1 или функциональную последовательность, обладающую функциональной активностью GLP-1, как инкретинового гормона, а именно его антиапопатическим действием или его нейротрофическими свойствами, и имеющую последовательность, по меньшей мере на 80% идентичную GLP-1(7-37),
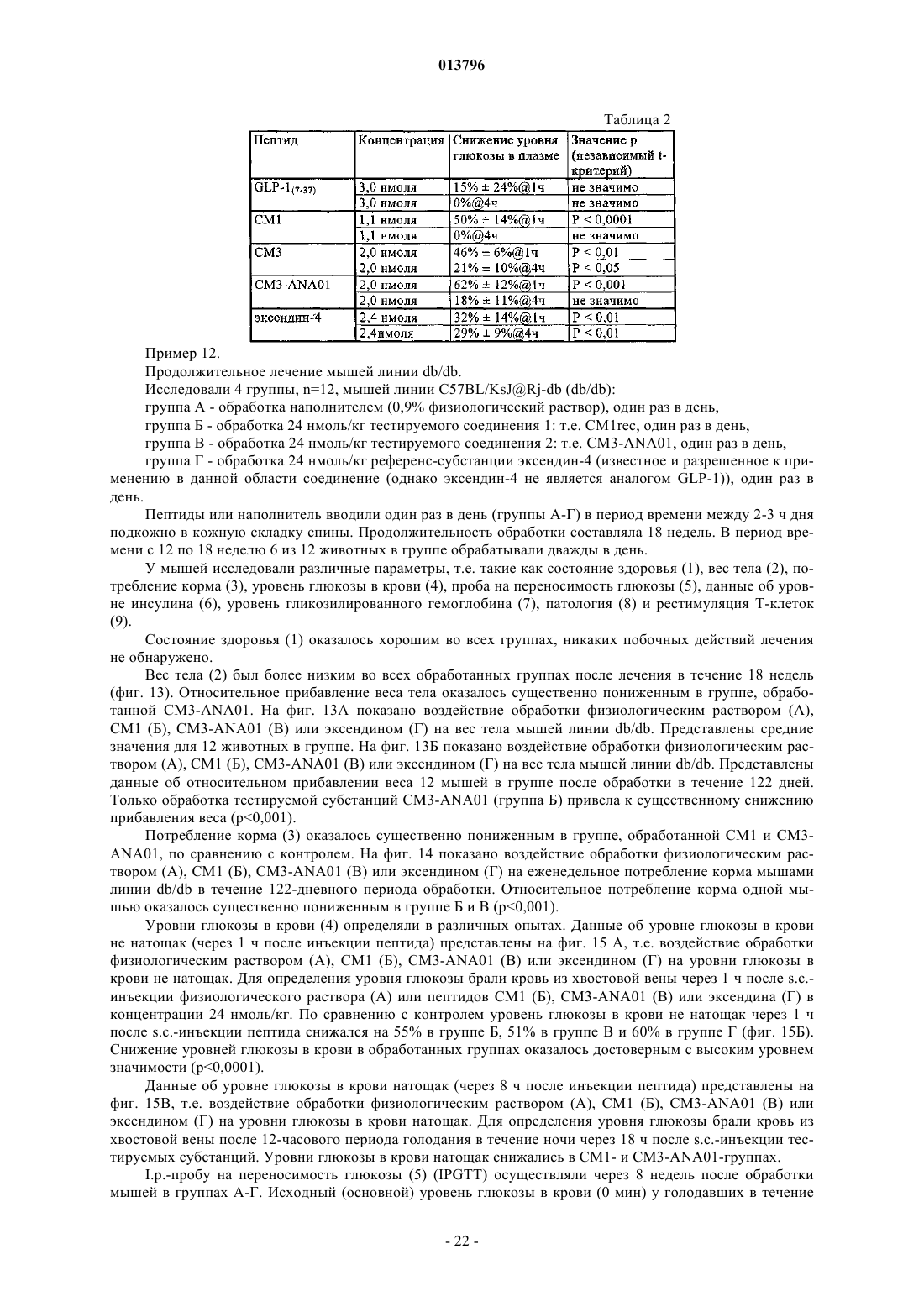
(ii) модифицированный пептид GLP-1, включающий аминокислотную последовательность формулы II
![]()
где Хаа7 обозначает L-гистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, 3-гидроксигистидин, гомогистидин, N-ацетилгистидин, а-фторметилгистидин, а-метилгистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин;
Хаа8 обозначает Ala, Gly, Val, Leu, Ile, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту, где Gly является наиболее предпочтительным;
Хаа16 обозначает Val или Leu;
Xaa18 обозначает Ser, Lys или Arg;
Xaa19 обозначает Tyr или Gln;
Хаа20 обозначает Leu или Met;
Хаа22 обозначает Gly, Glu или Aib;
Xaa23 обозначает Gln, Glu, Lys или Arg;
Хаа25 обозначает Ala или Val;
Хаа26 обозначает Lys, Glu или Arg;
Xaa27 обозначает Glu или Leu;
Хаа30 обозначает Ala, Glu или Arg;
Хаа33 обозначает Val или Lys;
Xaa34 обозначает Lys, Glu, Asn или Arg;
Xaa35 обозначает Gly или Aib;
Хаа36 обозначает Arg, Gly, или Lys, или амид, или отсутствует;
Хаа37 обозначает Gly, Ala, Glu, Pro, Lys, амид или отсутствует,
и в качестве компонента (II) С-концевую пептидную последовательность, состоящую по меньшей мере из 9 аминокислот и содержащую последовательность согласно SEQ ID NO:22 (RRDFPEEVAI) или последовательность, имеющую по меньшей мере 80% идентичность SEQ ID NO:22, и удостаивающую слитый пептид лучшей устойчивостью к инактивации с помощью DPP-IV, причем N-терминальная последовательность слитого пептида является компонентом (I) как таковым или сигнальной пептидной последовательностью, слитой с помощью последовательности, которая расщепляется протеазой, с N-терминальной последовательностью компонента (I), или сигнальным пептидом, слитым без помощи расщепляемой протеазой последовательности между ними с N-терминальным компонентом (I), или лидерной последовательностью, слитой с помощью последовательности, которая расщепляется протеазой с N-терминальным компонентом (I) и является гетерологичной по отношению к препроглюкагону.
2. Слитый пептид по п.1, где компонент (I) является модифицированным GLP-1, включающим аминокислотную последовательность формулы III
![]()
где Хаа7 обозначает L-гистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, 3-гидроксигистидин, гомогистидин, N-ацетилгистидин, а-фторметилгистидин, а-метилгистидин, 3-пиридилаланин, 2-пиридилаланил или 4-пиридилаланин;
Хаа8 обозначает Ala, Gly, Val, Leu, Ile, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту;
Хаа18 обозначает Ser, Lys или Arg;
Хаа22 обозначает Gly, Glu или Aib;
Хаа23 обозначает Gln, Glu, Lys или Arg;
Хаа26 обозначает Lys, Glu или Arg;
Хаа30 обозначает Ala, Glu или Arg;
Хаа34 обозначает Lys, Glu или Arg;
Xaa35 обозначает Gly или Aib;
Хаа36 обозначает Arg или Lys, амид или отсутствует;
Хаа37 обозначает Gly, Ala, Glu или Lys, амид или отсутствует.
3. Слитый пептид по п.1, где компонент (I) является GLP-1(7-35) или GLP-1(7-36).
4. Слитый пептид по любому из пп.1-3, в котором компонент (II) представляет собой пептидную последовательность, которая содержит последовательность, выбранную из SEQ ID NO:23 (RRDFPEEVAIVEEL) или SEQ ID NO:24 (RRDFPEEVAIAEEL), или последовательность, идентичную по меньшей мере на 80% последовательности, представленной SEQ ID NO:23 или 24.
5. Слитый пептид по одному из предыдущих пп.1-4, в котором компонент (II) представляет собой пептидную последовательность, которая содержит последовательность, выбранную из SEQ ID NO:2 (RRDFPEEVAIVEELG) или SEQ ID NO:3 (RRDFPEEVAIAEELG), или последовательность, идентичную по меньшей мере на 80% любой последовательности, представленной в SEQ ID NO:2 или 3.
6. Слитый пептид по одному из предыдущих пп.1-5, в котором компонент (I) и компонент (II) связаны непосредственно или связаны через линкерную последовательность.
7. Слитый пептид по п.6, в котором последовательность состоит из 1-10 аминокислот.
8. Слитый пептид по одному из пп.1-7, где слитый пептид содержит последовательность, выбранную из SEQ ID NO:8
![]()
или SEQ ID NO:12
![]()
или последовательность, идентичную по меньшей мере на 80% последовательностям, представленным в SEQ ID NO: 8 или 12.
9. Слитый пептид по одному из предыдущих пп.1-8, где слитый пептид содержит дополнительный компонент (III), связанный с С-концом компонента (II) и/или с N-концом компонента (I).
10. Слитый пептид по п.9, в котором компонент (III) содержит по меньшей мере четыре аминокислотных остатка, предпочтительно по меньшей мере 10 аминокислотных остатков или включает по меньшей мере 20 аминокислотных остатков.
11. Слитый пептид по п.9 или 10, в котором компонент (III) содержит по меньшей мере 4, предпочтительно по меньшей мере 10, более предпочтительно по меньшей мере 20 дополнительных аминокислотных остатков в N-концевой последовательности GLP-2, такой как проглюкагон или GLP-1(7-37).
12. Слитый пептид по одному из пп.9-11, в котором компонент (III) содержит последовательность, представленную в SEQ ID NO:4 или 5, или последовательность, идентичную по меньшей мере на 80% последовательности, представленной в SEQ ID NO:4 или 5.
13. Слитый пептид по одному из пп.9-12, где слитый пептид содержит пептидную последовательность, выбранную из группы, которая включает SEQ ID NO:6, 7, 10 и 11, или последовательность, гомологичную по меньшей мере на 80% последовательности, представленной в SEQ ID NO:6, 7, 10 или 11.
14. Слитый пептид по одному из предыдущих пп.1-13, в котором по меньшей мере одну из аминокислот дериватизируют путем ковалентной модификации боковой цепи встречающейся в естественных условиях аминокислоты, путем модификации пептидного каркаса, путем модификации NH2- или карбоксильных концевых групп.
15. Слитый пептид по одному из предыдущих пп.1-14, где слитый пептид содержит белок-носитель, прежде всего трансферрин или альбумин, в качестве компонента (IV).
16. Слитый пептид по п.14, в котором по меньшей мере одну из аминокислот дериватизуют с помощью липидной или углеводной группы.
17. Слитый пептид по п.14 или 16, в котором N-концевой остаток His GLP-1 (GLP-1(7)) химически модифицируют на его NH2-конце и/или гистидильной боковой цепи, прежде всего с помощью гидрофобного остатка.
18. Способ получения слитого пептида по одному из предыдущих пп.1-17 с помощью твердофазного пептидного синтеза.
19. Слитый пептид по любому из пп.1-17 в качестве лекарственного средства для применения при терапии человека или животных.
20. Нуклеиновая кислота, кодирующая слитый пептид по одному из предыдущих пп.1-13 или 15.
21. Вектор, содержащий нуклеиновую кислоту по п.20.
22. Клетка-хозяин, содержащая экзогенно интродуцированную ДНК по п.20, в частности вектор по п.21, которая обладает способностью экспрессировать слитый пептид, где клетка-хозяин не является человеческой эмбриональной или зародышевой клеткой.
23. Способ получения слитого пептида по одному из предыдущих пп.1-13 или 15, в котором микроорганизм, трансформированный путем включения нуклеиновой кислоты, кодирующей слитый пептид, ферментируют и выделяют белок.
24. Способ получения белка по п.23, заключающийся в том, что клетки животного выращивают в условиях, при которых белок экспортируется из клеток.
25. Применение слитого пептида по одному из предыдущих пп.1-17, нуклеиновой кислоты по п.20, вектора по п.21 или клетки-хозяина по п.22 для приготовления лекарственного средства, предназначенного для лечения сахарного диабета типа I или II, устойчивости к инсулину, нарушений веса и связанных с ними заболеваний или состояний.
26. Применение слитого пептида по одному из предыдущих пп.1-17, нуклеиновой кислоты по п.20, вектора по п.21 или клетки-хозяина по п.22 для приготовления лекарственного средства, предназначенного для лечения нейродегенеративных нарушений и связанных с ними заболеваний или состояний.
27. Применение слитого пептида по одному из предыдущих пп.1-17, нуклеиновой кислоты по п.20, вектора по п.21 или клетки-хозяина по п.22 для приготовления лекарственного средства, предназначенного для лечения нарушений и заболеваний или состояний, ассоциированных с апоптозом.
Текст
013796 Настоящее изобретение относится к новым слитым пептидам, содержащим GLP-1 с удлиненными С-концами, которые обладают устойчивостью к инактивации эндопептидазой IV, могут экспрессироваться с высоким уровнем в трансформированных клетках животных и которые можно применять, например, для лечения диабета типа II. Ген глюкагона хорошо изучен (см., например, White J.W. и др., Nucleic Acid Res. 14(12), 1986, c. 4719-4730). Молекула препроглюкагона в виде высокомолекулярной молекулы-предшественника синтезируется в панкреатических альфа-клетках и в L-клетках тощей кишки и ободочной кишки. Препроглюкагон представляет собой состоящий из 180 аминокислот прогормон, и его последовательность содержит помимо глюкагона две последовательности родственной структуры: глюкагон-подобный пептид-1 (GLP1) и глюкагон-подобный пептид-2 (GLP-2). В молекуле препроглюкагона между GLP-1 и GLP-2 находится состоящая из 17 аминокислот пептидная последовательность (или точнее состоящая из 15 аминокислот последовательность плюс С-концевой расщепляемый RR-сайт), интронный пептид 2 (IP2). Последовательность IP2 (локализованная между GLP-1 и -2 в молекуле-предшественнике), как правило, расщепляется протеолитически после аминокислоты (ак) 37 GLP-1. Таким образом, молекула препроглюкагона в зависимости от клетки и ее окружения расщепляется на различные пептиды, включая GLP-1(1-37), состоящий из 37 аминокислот пептид в непроцессированной форме. Как правило, его процессинг происходит в поджелудочной железе и в кишечнике. Последовательность GLP-1(1-37) может подвергаться дополнительному протеолитическому расщеплению с образованием активной процессированной формыGLP-1(7-37) образуется представляющий интерес фрагмент, который состоит из аминокислотных остатков от (и включительно) остатка в положении 7 до (и включительно) остатка в положении 37, начиная сN-конца родительского пептида GLP-1. Аминокислотная последовательность амида GLP-1(7-36) и GLP1(7-37) имеет формулу I (SEQ ID NO:43) которая соответствует амиду GLP-1(7-36), когда X обозначает NH2, и GLP-1(7-37), когда X обозначаетGLP-1 представляет собой гормон желудочно-кишечного тракта и наиболее эффективный эндогенный инсулинотропный агент, активность которого включает стимуляцию аденилатциклазной и протеинкиназной активности в бета-клетках. Физиологически в сочетании с желудочным ингибирующим полипептидом из верхнего отдела кишечника он функционирует в качестве эндокринного гормона, который снижает уровень глюкозы в крови. Таким образом, GLP-1, секреция которого происходит в ответ на прием пищи, обладает несколькими видами воздействия на желудок, печень, поджелудочную железу и головной мозг, которые совместно обеспечивают регулирование содержания сахара к крови. Поэтому амид глюкагон-подобного пептида GLP-1(7-36) и его неамидированный аналог GLP-1(7-37) представляют значительный интерес благодаря их высокой эффективности в отношении метаболизма углеводов и возможности их применения для лечения диабета, включая диабет типа II. Диабет типа II характеризуется устойчивостью к инсулину, поскольку клетки не реагируют соответствующим образом на присутствие инсулина. Это является более сложной проблемой, чем диабет типа I. Диабет типа II может оставаться незамеченным у пациента в течение многих лет до его диагностирования, поскольку симптомы, как правило, являются менее выраженными (отсутствие кетоацидоза) и могут быть спорадическими. Однако последствием незамеченного диабета типа II могут быть серьезные осложнения, включая почечную недостаточность и ишемическую болезнь сердца. Это повышает заболеваемость и смертность. Амид GLP-1(7-36) или GLP-1(7-37) обладает непродолжительным временем жизни в сыворотке. Пептид расщепляет дипептидилпептидазой IV (DPP-IV) между остатками 8 и 9. Расщепленный пептид является неактивным. Таким образом, GLP-1 при его экзогенном введении является очень короткоживущим и имеет ограниченное терапевтическое применение. Предпринимались многочисленные попытки синтеза более стабильных (в отношении воздействияDPP-IV) аналогов встречающегося в естественных условиях GLP-1 (GLP-1(7-37. В частности остаток в положении 8, который in vivo представляет собой Ala, заменяли на другой остаток, например Gly, Ser или Thr (Burcelin R. и др., Metabolism 48, 1999, c. 252-258). Было проведено обширное исследованиеGly8- или G8-аналога как в виде синтезированной молекулы, так и в виде молекулы, полученной в клеточных линиях, которые создавали с помощью генной инженерии с целью секреции мутантного полипептида (Burcelin R. и др., Annals of the New York Academy of Sciences 875, 1999, c. 277-285). Для повышения стабильности in vivo без снижения его биологической активности в GLP-1(7-37) интродуцировали различные другие модификации. Однако все эти подходы не привели к получению каких-либо важных для терапевтического применения результатов из-за серьезных проблем. В WO/9953064 на имя Thoren В. описана стратегия создания мультимерной экспрессионной кассеты GLP-1, которую можно встраивать в различные типы клеток, представляющие собой доступные научной общественности иммортализованные линии клеток и культуры, обладающих способностью к делению первичных клеток. Их примерами являются чувствительные к EGF нейросферы, чувствительные кbFGF стволовые клетки-предшественники нейронов из ЦНС млекопитающих, хотя в приведенных в ка-1 013796 честве вариантов осуществления примерах использовали клетки почки детеныша хомяка (ВНК). Установлено, что имплантированные трансфектированные клетки можно применять для успешного лечения больных диабетом мышей, благодаря осуществлению контроля уровня глюкозы его удавалось приводить практически в полное соответствие с уровнем глюкозы в организме контрольных не больных диабетом животных. Однако этот метод не удовлетворяет требованиям общепринятого лечения пациентов, страдающих диабетов. Другой подход к экзогенной стабилизации уровня глюкозы основан на применении нового класса лекарственных средств, известного как эндокринные миметики, возможность применения которых для лечения диабета типа II исследуется в настоящее время. Эксенатид (Byetta) представляет собой синтетическую версию встречающегося в естественных условиях соединения, обнаруженного в слюне ящерицы Gila monster. В клинических опытах установлено, что эндокринный миметик (эксенатид) снижает уровень сахара в крови и улучшает функцию бета-клеток на уровне маркеров. Однако эксенатид оказывает лишь ограниченные воздействия на человеческий эндокринный гормон глюкагон-подобный пептид 1 (GLP-1). В целом, в настоящее время отсутствует доступная эффективная терапия диабета типа II, позволяющая снижать уровень глюкозы в крови аналогично GLP-1, другими словами, терапия, которая обладает полным спектром благоприятных действий, характерных для GLP-1, например его способностью при физиологических концентрация значительно снижать скорость проникновения питательных веществ в кровоток путем снижения скорости опорожнения желудка у страдающих ожирением пациентов или его инсулинстимулирующей активностью. Таким образом, объектом настоящего изобретения является создание пептидных молекул на основе GLP-1, которые обладают биологической активностью и устойчивостью к протеолитическому расщеплению. В настоящем изобретении предложен слитый пептид, который содержит в качестве компонента (I)N-концевую последовательность GLP-1(7-35, 7-36 или 7-37) и в качестве компонента (II) С-концевую пептидную последовательность, состоящую по меньшей мере из 9 аминокислот, или ее функциональный фрагмент, вариант или производное. В основу настоящего изобретения положен тот факт, что созданный пептид, предлагаемый в изобретении, защищен от протеолитического расщепления in vivo, прежде всего протеолитической эндопептидазой IV. Предлагаемый в изобретении пептид, который содержит по меньшей мере два компонента (I) и (II), обладает биологической активностью, характерной для GLP-1, и одновременно придает стабильность GLP-1, который представляет собой компонент (I), в результате С-концевого удлинения. Понятие предлагаемый в изобретении пептид в контексте настоящего описания относится к слитому пептиду, как он определен в контексте настоящего описания, его варианту, аналогу, фрагменту или производному, включая комбинации, например, дериватизированного фрагмента, аналога или варианта слитого пептида. Понятие пептид GLP-1 в контексте настоящего описания означает GLP-1(7-35, -36 или -37), при этом подразумевается, что модифицированный пептид GLP-1 означает любой аналогGLP-1, производное GLP-1, вариант GLP-1 или фрагмент GLP-1, включая дериватизированный фрагмент, аналог или вариант GLP-1(7-35, -36 или -37), который может присутствовать в любом из компонентов (I) и (III) предлагаемого в изобретении пептида. Понятие пептид GLP-2 в контексте настоящего описания означает GLP-2(1-33, -34 или -35), при этом подразумевается, что модифицированный пептидGLP-2 означает любой аналог, фрагмент или вариант GLP-2, включая дериватизированный фрагмент,аналог или вариант GLP-2(1-33, -34 или -35). Варианты, аналоги, фрагменты и производные рассматриваются как модификации немодифицированной последовательности, например, GLP-1(7-35, - 36 или -37) или GLP-2(1-33, -34 или -35). В контексте настоящего изобретения подразумевается, что любой вариант,аналог, фрагмент или производное должно обладать функциональной активностью, например обладать таким же или подобным биологическим действием, что и немодифицированный пептид GLP-1. Предпочтительно предлагаемый в изобретении пептид представляет собой слитый пептид или его вариант, аналог, фрагмент или производное, в котором компонент (I) содержит последовательность, гомологичную по меньшей мере на 80%, более предпочтительно по меньшей мере на 85% и еще более предпочтительно по меньшей мере на 90% последовательности, представленной в SEQ ID NO:1. SEQ IDNO:1 представляет собой нативную аминокислотную последовательность GLP-1(7-37) (состоящую из 31 аминокислоты), которая является высококонсервативной у млекопитающих. Второй компонент (компонент (II слитого пептида, предлагаемого в изобретении (или в более общем смысле любого предлагаемого в изобретении пептида, включая аналоги, фрагменты, варианты или производные слитых пептидов), как правило, содержит последовательность, состоящую по меньшей мере из 9 аминокислот, которые могут иметь структуры типа -изгиба (складки) или не иметь такую структуру. -складчатая структура представляет собой, как правило, элемент вторичной структуры белков или пептидов. Она, как правило, образуется четырьмя аминокислотами, которые изменяют на противоположное направление каркасной цепи пептида или белка. Аминокислотная последовательность компонента (II) содержит по меньшей мере 9 аминокислот и предпочтительно содержит по меньшей мере один остаток пролина или аланина в последовательности. Остатки пролина являются обычными аминокисло-2 013796 тами в -складке, формирующей тетрамерную аминокислотную последовательность. Остаток пролина обычно и чаще всего локализован в положении 2 или 3, предпочтительно 2, тетрамерной последовательности -складки, которая входит в состав компонента (II) слитого пептида. В состав предлагаемого в изобретении слияния может, как правило, входить компонент (II), последовательность которого состоит из 9-30, предпочтительно 9-20 и наиболее предпочтительно 9-15 аминокислот. Другими словами, более короткие последовательности компонента (II) могут быть предпочтительными из-за из повышенной способности связываться с GLP-рецептором по сравнению с более длинными последовательностями. Последовательность компонента (II), хотя это не является необходимым условием, предпочтительно может быть нейтральной или иметь отрицательный заряд при pH 7. Слитый пептид, предлагаемый в изобретении, является предпочтительным, если его компонент (II) содержит последовательность-мотив, выбранную из группы, включающей VAIA, IAEE, PEEV, AEEV,EELG, AAAA, AAVA, AALG, DFPE, AADX, AXDX и XADX, где X обозначает любую аминокислоту(встречающуюся в естественных условиях или модифицированную не встречающуюся в естественных условиях аминокислоту). Эти тетрамерные мотивы могут быть локализованы в любом месте в последовательности компонента (II). В наиболее предпочтительном варианте осуществления изобретения компонент (II) в предлагаемом в изобретении слитом пептиде представляет собой пептидную последовательность, связанную с С-концом компонента (I) через ее N-концевую последовательность-мотив, выбранную из группы, включающей АА, ХА, АХ, RR, RX и XR, где X обозначает любую аминокислоту(встречающуюся в естественных условиях или модифицированную не встречающуюся в естественных условиях аминокислоту). Предпочтительный мотив компонента (II) предлагаемого в изобретении слитого пептида содержит последовательность-мотив, представленную в SEQ ID NO:25 (DFPEEVA), или содержит последовательность, которая гомологична по меньшей мере на 80% последовательности мотива DFPEEVA, которая соответствует частичной последовательности человеческого или мышиного IP-2. Особенно предпочтительным является слитый пептид, в котором компонент (II) представляет собой пептидную последовательность, которая содержит последовательность, представленную в SEQ ID NO:22(RRDFPEEVAI) или SEQ ID NO:26 (AADFPEEVAI) (все пептидные последовательности представлены в однобуквенном коде), или последовательность, гомологичную по меньшей мере на 80% последовательности, представленной в SEQ ID NO:22 или SEQ ID NO:26. SEQ ID NO:22 представляет собой частичную последовательность полноразмерной последовательности (человеческого или мышиного) IP-2 (интронный пептид 2), которая содержит N-концевые 10 аминокислот состоящей из 15 аминокислот полноразмерной последовательности IP-2. SEQ ID NO:26 является производной SEQ ID NO:22, которая получена заменой N-концевых (RR) остатков на (АА). IP-2 является предпочтительным примером содержащей складку пептидной последовательности. Таким образом, другими еще более предпочтительными последовательностями являются последовательности, в которых компонент (II) длиннее частичных аминокислотных последовательностей IP-2, например, содержит N-концевую состоящую из 14 аминокислот последовательность, которая встречается в человеческой (SEQ ID NO:23 (RRDFPEEVAIVEEL или мышиной копии (SEQ ID NO:24 (RRDFPEEVAIAEEL, или последовательность, гомологичную по меньшей мере на 80% последовательности, представленной в SEQ ID NO: 23 или 24. Наиболее предпочтительными в качестве элементов, входящих в компонент (II) слитого пептида, являются полноразмерные последовательности IP-2, которые содержат все 15 аминокислот встречающейся в естественных условиях последовательности IP-2 (SEQ ID NO:2 (RRDFPEEVAIVEELG), человеческая, или SEQ ID NO:3(RRDFPEEVAIAEELG), мышиная), или последовательность, гомологичную по меньшей мере на 80% последовательности, представленной в SEQ ID NO:2 или 3. Под объем настоящего изобретения подпадают также все изоформы IP2 млекопитающих (встречающиеся в естественных условиях в организме млекопитающих варианты IP2). Все последовательности, упомянутые в этом параграфе, могут нести также N-концевой мотив (АА), (АХ) или (ХА) вместо встречающихся в естественных условиях (RR),например SEQ ID NO:27 (AADFPEEVAIVEEL), SEQ ID NO:28 (AADFPEEVAIAEEL), SEQ ID NO:29(AADFPEEVAIVEELG) и SEQ ID NO:30 (AADFPEEVAIAEELG). Можно получать белки, содержащие более одной копии последовательности, включенной в компонент (II), например 2, 3 или даже большее количество копий IP2 или фрагмента, варианта или аналога или производного IP2. Таким образом, предлагаемый в изобретении пептид предпочтительно содержит последовательность, представленную в SEQ ID NO:8 (HAEGTFTSDVSSYLEGQAAKEFIAWLVKGRGRRDFPEEVAIAEELG), т.е. GLP-1(7-37), связанный без какой-либо линкерной последовательности через его С-конец с мышиным IP2, или последовательность, представленную в SEQ ID NO:12 (HAEGTFTSDVSSYLEGQAAKEFIAWLVKGRGRRDFPEEVAIVEELG), т.е. GLP-1(7-37), связанный без какой-либо линкерной последовательности через его С-конец с человеческим IP2. Кроме того, другими предпочтительными предлагаемыми в изобретении вариантами предлагаемых в изобретении пептидов, которые имеют последовательности, представленные в SEQ ID NO:8 и SEQ ID NO:12, являются SEQ ID NO:31 связанный без какой-либо линкерной последовательности через его С-конец с конкретными аналогами или вариантами последовательности IP2. Варианты, аналоги или фрагменты, которые имеют последовательность, гомологичную по меньшей мере на 80% SEQ ID NO:8 и 12, или их производные также подпадают под объем изобретения и являются предпочтительными. Не вдаваясь в какую-либо теорию, при создании настоящего изобретения сделано предположение,что нестабильность GLP-1(7-35, -36 или -37), при введении любому пациенту, который нуждается в этом,является следствием незащищенной 3-мерной структуры. Протеазы могут расщеплять пептид GLP-1(735, -36 или -37) и быстро устранять его физиологическую активность in vivo. Путем связывания пептидной последовательности с С-концом GLP-1(7-35, -36 или -37) его структура приобретает стабильность в отношении ферментативного расщепления. Приобретенную стабильность, вероятно, можно повышать,если дополнительная С-концевая пептидная последовательность (входящая в компонент (II) слитого пептида, предлагаемого в изобретении) приобретает складчатость в результате присутствия -складчатого структурного элемента, образованного из ее первичной структуры и придающего жесткость компоненту(II). Однако -складчатая структура в компоненте (II) предлагаемого в изобретении пептида, вероятно, не является необходимым условием стабилизации последовательности GLP-1 компонента (I) в отношении ферментативного расщепления. Предлагаемый в изобретении пептид, благодаря его С-концевому пептидному удлинению, например, содержащему элемент -складчатой структуры, как установлено, обладает повышенной устойчивостью к инактивации DPP-IV. С-концевой пептид либо не отщепляется от последовательности GLP-1(7-35, -36 или -37) перед воздействием на его рецептор на клетках-мишенях,либо он может ферментативно отщепляться с образованием GLP-1(7-35, -36 или -37) in vivo. Вне зависимости от точной формы связи предлагаемого в изобретении пептида в сайте GLP-1-рецептора, пептид,предлагаемый в изобретении, осуществляет свою функцию в качестве активного инсулинотропного соединения. Пептидные последовательности, которые можно рассматривать в качестве пригодных для включения в компонент (II), из-за их первичной структуры, образующей элемент -складчатой структуры, можно легко идентифицировать с помощью соответствующих, например, спектроскопических методов, например циркулярного дихроизма, или других методов, известных специалисту в данной области. Компонент (II) и компонент (I) можно связывать непосредственно или связывать через линкерную последовательность. Предпочтительно оба компонента непосредственно связывают друг с другом. В случае их связывания через линкер (или спейсер), линкер предпочтительно представляет собой пептидный линкер или органический линкер. Пептидный линкер, как правило, состоит из от 1 до 10 аминокислот, предпочтительно от 1 до 5, еще более предпочтительно от 1 до 3 аминокислот, в некоторых случаях линкерная последовательность может быть длиннее и содержать от 11 до 50 аминокислот. Пептидный линкер может состоять из различных аминокислотных последовательностей. Предпочтительно пептидный линкер должен интродуцировать определенную структурную гибкость между компонентами, подлежащими связыванию. Для достижения структурной гибкости применяют, например, пептидный линкер, который содержит различные количества остатков глицина или пролина, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40% и еще более предпочтительно по меньшей мере 60% остатков пролина и глицина в линкерной последовательности. Вне зависимости от конкретной-4 013796 последовательности пептидный линкер предпочтительно должен быть иммунологически неактивным. В предпочтительном варианте осуществления настоящего изобретения предлагаемый в изобретении пептид, т.е. слитый пептид или его аналоги, фрагмент, варианты или производные, содержит третий компонент (компонент (III, который или связан с С-концом компонента (II) и/или с N-концом компонента (I). Предпочтительно компонент (III) локализован на С-конце компонента (II). Вне зависимости от того, связан ли компонент (III) с N-концом компонента (I) (с помощью его С-конца), или с С-концом компонента (II) (с помощью его N-конца), сочетание может быть непосредственным или косвенным через линкерную последовательность. К линкерной последовательности применимо все описанное выше для линкера, соединяющего компонент (I) и компонент (II). Как правило, компонент (III) содержит по меньшей мере 4 аминокислотных остатка, предпочтительно по меньшей мере 10 дополнительных аминокислотных остатков, более предпочтительно по меньшей мере 20 или по меньшей мере 30 остатков. С точки зрения функции компонент (III) применяют для дополнительного повышения стабильности предлагаемого в изобретении пептида. Считается, что компонент (III) не должен влиять на биологическую функцию предлагаемого в изобретении пептида, которая примерно сопоставима с биологической активностью GLP-1(7-37). Предпочтительно компонент (III) предлагаемого в изобретении пептида содержит по меньшей мере 4, предпочтительно по меньшей мере 10, более предпочтительно по меньшей мере 20 дополнительных аминокислотных остатков N-концевой последовательности изоформы GLP-2 из организма любого вида млекопитающих (другой встречающийся в естественных условиях вариант GLP-2 млекопитающих), например мышиной или человеческой изоформ, последовательности которых представлены в SEQ ID NO:4 и 5. GLP-2 присутствует в проглюкагоне и также принимает участие в метаболизме углеводов. Также как и биологически активная последовательность, входящая в состав компонента (I) (пептид GLP-1), компонент (III) может также содержать аналоги, варианты или производные встречающихся в естественных условиях форм GLP-2. В альтернативном варианте компонент (III) может содержать также по меньшей мере 4, предпочтительно по меньшей мере 10, более предпочтительно по меньшей мере 20 дополнительных аминокислотных остатков N-концевой последовательности GLP-1(7-37), в том числе соответственно все изоформы, характерные для млекопитающих, или, как указано в настоящем описании, все их функциональные варианты, аналоги или производные. Другими словами, компонент (III) может содержать любую форму пептида GLP-1 или модифицированного пептида GLP-1, которая представлена в настоящем описании в качестве приемлемой для компонента (I) предлагаемого в изобретении пептида. В другом альтернативном варианте компонент (III) может содержать также химерные формы GLP-1(7-37) иGLP-2. Химерные формы можно получать путем сочетания GLP-1(7-37) и GLP-2 (или фрагментов, аналогов, вариантов или производных их обоих) друг с другом и путем последующей интродукции указанной химерной формы в качестве компонента (III) в предлагаемый в изобретении пептид. Предпочтительно химерная форма состоит из части последовательности GLP-1(7-37) и части последовательности GLP2, связанных вместе. Например, химерная форма может включать от 5 до 30 N-концевых аминокислотGLP-1 и от 5 до 30 С-концевых аминокислот GLP-2 или наоборот, например, аминокислоты от 7 или 8 до 22, 23, 24, 25, 26, 27 или 28 GLP-1(7-37) и аминокислотную последовательность от положения 15, 16, 17,18, 19, 20, 21, 22, 23 или 24 до, например, С-конца GLP-2. Если модификации встречающихся в естественных условиях форм GLP-2 или GLP-1(7-37) соответственно применяют в качестве компонента (III), то компонент (III) предпочтительно содержит последовательность, представленную в SEQ ID NO:4 или 5, или в SEQ ID NO:1 соответственно, или последовательность, которая по меньшей мере на 80% гомологичная последовательности, представленной в SEQID NO:4 или 5 либо в SEQ ID NO:1. Согласно настоящему изобретению производные этих предпочтительных последовательностей, например, полученные с помощью модификаций боковой цепи или модификаций пептидного каркаса и т.д. (обозначенные в контексте настоящего описания понятием производные), также можно применять в качестве компонента (III). Согласно другому варианту осуществления изобретения компонент (III) может содержать несколько описанных выше последовательностей. Например, компонент (III) может содержать по меньшей мере 2, предпочтительно 2, 3 или 4 копии GLP-1(7-37) и/или GLP-2 или по меньшей мере 2 копии последовательностей, которые по меньшей мере на 80% гомологичны последовательности, представленной в SEQID NO:1, 4 или 5. Кроме того, компонент (III) может содержать более одной копии описанной выше химерной версии GLP-1(7-37) или GLP-2, например, формирующие в конечной счете комбинацию химерной(ых) версии(ий) в сочетании с GLP-1(7-37) и/или GLP-2, или ее модификации, имеющей по меньшей мере 80%-ную гомологию последовательности. Под объем настоящего изобретения подпадает также применение двух или большего количества, предпочтительно двух компонентов (III), которые могут,например, быть (1) связаны своим N-концом с С-концом компонента (II) и (2) связаны своим С-концом сN-концом компонента (I) через линкер или непосредственно. Если применяют два компонента (III), то они могут быть одинаковыми или различными. Таким образом, наиболее предпочтительными являются предлагаемые в изобретении слитые пептиды, которые содержат три компонента (I), (II) и (III). Четыре конкретных варианта, содержащих все эти компоненты, выбирают из группы, включающей: SEQ ID NO:6 (N-GLP-1(7-37)-IP2(мышиный)-RR-5 013796GLP-1(7-37)-С, обозначенный также в контексте настоящего описания как мышиный СМ 1), SEQ ID NO: 7 (N-GLP-1(7-37)-IP2(мышиный)-RR-GLP2-C, обозначенный также в контексте настоящего описания как мышиный СМ 2), SEQ ID NO:10 (N-GLP-1(7-37)-IP2(человеческий)-RR-GLP-1(7-37)-C, обозначенный также в контексте настоящего описания как человеческий СМ 1) и SEQ ID NO:11 (N-GLP-1(7-37)IP2(человеческий)-RR-GLP-2-C, обозначенный также в контексте настоящего описания как человеческий СМ 2) или последовательность, которая по меньшей мере на 80% гомологична последовательности, представленной в SEQ ID NO:6, 7, 10 или 11, или ее производное. Все последовательности 6, 7, 10 и 11 содержат RR-линкер (два остатка аргинина) на С-конце IP2 (компонент (II, который в альтернативном варианте может отсутствовать. Компонент (I) в каждом из указанных вариантов, представленных в SEQID NO:6, 7, 10 или 11, обозначает GLP-1(7-37), а компонент (III) (в каждом из указанных вариантов связанный с С-концом компонента (II представляет собой либо GLP-1(7-37), либо GLP-2. Предлагаемые в изобретении пептиды могут находиться в различных модифицированных формах. Эти модифицированные формы более подробно описаны ниже. Понятие соли в контексте настоящего описания относится как к солям карбоксильных групп, так и к кислотно-аддитивным солям аминогрупп описанных выше слитых пептидов или их аналогов, фрагментов, производных или вариантов. Соли карбоксильной группы можно получать с помощью методов,хорошо известных в данной области, и они представляют собой неорганические соли, например соли натрия, кальция, аммония, железа или цинка и т.п., и соли с органическими основаниями, образованные,например, с аминами, такими как этаноламин, аргинин или лизин, пиперидин, прокаин и т.п. Кислотноаддитивные соли представляют собой, например, соли с минеральными кислотами, такими, например,как соляная кислота или серная кислота, и соли с органическими кислотами, такими, например, как уксусная кислота или щавелевая кислота. Естественно, любые указанные соли должны сохранять соответствующую биологическую активность предлагаемых в изобретении пептидов, т.е. способность снижать скорость проникновения питательных веществ в кровоток. Как будет описано ниже, пептиды в форме солей могут входить в состав фармацевтической композиции. Понятие фрагмент слитого пептида, предлагаемого в настоящем изобретении, относится к любой субпопуляции молекул, т.е. укороченному пептиду, который сохраняет требуемую биологическую активность. Фрагменты легко можно получать путем удаления аминокислот из любого конца молекулы и осуществляя оценку образовавшейся молекулы в отношении ее свойств в качестве агента внутренней секреции. Протеазы, обладающие способностью удалять одномоментно одну аминокислоту или с Nконца и/или с С-конца полипептида, известны в данной области и поэтому определение фрагментов, которые сохраняют требуемую биологическую активность, включает лишь осуществление общепринятых экспериментов. И, наконец, фрагменты можно получать в результате делеций аминокислот на концах пептида и/или аминокислот, локализованных внутри пептидной последовательности. Кроме того, предлагаемый в изобретении пептид, обладающий активностью в отношении диабета типа II, который представляет собой сам слитый пептид, его аналог или вариант, соль, функциональное производное и/или фрагмент, может содержать также дополнительные аминокислотные остатки, фланкирующие предлагаемый в изобретении пептид. В случае, когда образовавшаяся молекула сохраняет устойчивость к действию протеаз или стабильность и способность проявлять активность в качестве агента внутренней секреции, то с помощью общепринятых экспериментов можно определять оказывают ли фланкирующие остатки какое-либо действие на основные или новые характеристики корового пептида,например, в результате их воздействия на панкреатические клетки. Понятие состоит практически из касательно конкретной последовательности означает, что в ней могут присутствовать дополнительные фланкирующие остатки, которые не оказывают влияния на основные и новые характеристики конкретного предлагаемого в изобретении пептида. Это понятие не включает замены, делеции или добавления в конкретной последовательности. Понятие вариант в контексте настоящего изобретения относится к молекуле, которая практически аналогична либо полному предлагаемому в изобретении пептиду, как он определен выше, либо его фрагменту. Варианты пептидов можно получать путем прямого химического синтеза варианта пептида с использованием методов, хорошо известных в данной области. Естественно, указанный вариант предлагаемого в изобретении пептида должен обладать аналогичной противодиабетической, например, инсулинстимулирующей активностью, что и соответствующий встречающийся в естественных условиях пептид GLP-1. В другом случае варианты аминокислотной последовательности пептидов, как они определены выше, можно получать путем мутаций в ДНК, которые кодируют синтезированные производные. Такие варианты представляют собой, например, варианты, полученные в результате делеций или инсерций или замен остатков в аминокислотной последовательности. Для получения конечной конструкции можно также использовать комбинацию делеций, инсерций и замен при условии, что конечная конструкция обладает требуемой активностью. Очевидно, что мутации, которые можно создавать в ДНК, кодирующей вариант пептида, не должны изменять рамку считывания и предпочтительно не должны создавать комплементарные области, которые могут приводить к образованию вторичной структуры мРНК. Понятие аналог указанных выше пептидов согласно настоящему изобретению относится к не-6 013796 встречающейся в естественных условиях молекуле, которая практически аналогична либо полной молекуле, либо ее активному фрагменту. Такой аналог должен обладать такой же активностью, что и соответствующий встречающийся в естественных условиях пептид GLP-1. Типы замен, которые можно осуществлять в предлагаемом в изобретении пептиде, согласно настоящему изобретению могут быть основаны на анализе частоты встречаемости аминокислотных замен в гомологичном белке/пептиде различных видов. На основе такого анализа можно определять консервативные замены, как изменения в пределах одной из следующих пяти групп:I) небольшие алифатические неполярные или имеющие небольшую полярность остатки: Ala, Ser,Thr, Pro, Gly;II) полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln;III) полярные положительно заряженные остатки: His, Arg, Lys;IV) крупные алифатические неполярные остатки: Met, Leu, Ile, Val, Cys;V) крупные ароматические остатки: Phe, Try, Trp. В пределах вышеуказанных групп высококонсервативными считаются следующие замены:Asp/Glu; His/Arg/Lys; Phe/Tyr/Trp; Met/Leu/Ile/Val. К полуконсервативным заменам относятся замены между двумя указанными выше группами (I)-(IV), которые ограничены надгруппой (А), содержащей указанные выше группы (I), (II) и (III), или надгруппой (Б), содержащей указанные выше группы (IV) и(V). Замены не ограничены генетически кодируемыми или даже встречающимися в естественных условиях аминокислотами. В целом, аналоги или варианты предлагаемого в изобретении пептида могут содержать также аминокислотные замены, которые осуществляют, например, для улучшения стабильности (замена гидрофобных аминокислот на гидрофильные аминокислоты). В одном из вариантов осуществления изобретения варианты/аналоги пептида GLP-1, предлагаемого в изобретении (входящие в компонент (I) и/или(III) предлагаемого в изобретении пептида) (модифицированного) пептида GLP-1 отличаются наличием одной или нескольких замен в положениях 7, 8, 11, 12, 16, 22, 23, 24, 25, 27, 30, 33, 34, 35, 36 или 37 пептида GLP-1. Например, следующее обозначение [Arg34-GLP-1(7-37)] относится к аналогу GLP-1, в котором встречающийся в естественных условиях лизин в положении 34 заменен на аргинин. В частности, компонент (I) и/или (III) предлагаемого в изобретении пептида может содержать варианты и аналоги GLP-1(7-35, -36 или -37), включая, например, В другом варианте осуществления изобретения предлагаемый в изобретении пептид содержит в качестве компонента (I) или (III) модифицированный пептид GLP-1, который содержит аминокислотную последовательность следующей формулы II (SEQ ID NO:44): где Хаа 7 обозначает L-гистидин, D-гистидин, дезаминогистидин, 2-аминогистидин, 3-гидроксигистидин,гомогистидин, N-ацетилгистидин, а-фторметилгистидин, а-метилгистидин, 3-пиридилаланин, 2 пиридилаланин или 4-пиридилаланин; Хаа 8 обозначает Ala, Gly, Val, Leu, Ile, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1 аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту, где Gly является наиболее предпочтительным значением; Хаа 16 обозначает Val или Leu;Xaa35 обозначает Gly или Aib; Хаа 36 обозначает Arg, Gly или Lys или амид или отсутствует; Хаа 37 обозначает Gly, Ala, Glu, Pro, Lys, амид или отсутствует. В другом варианте осуществления изобретения компонент (I) и/или (III) предлагаемого в изобретении пептида содержит модифицированный пептид GLP-1, который содержит аминокислотную последовательность следующей формулы III (SEQ ID NO:45):Xaa35 обозначает Gly или Aib; Хаа 36 обозначает Arg или Lys, амид или отсутствует; Хаа 37 обозначает Gly, Ala, Glu или Lys, амид или отсутствует. В наиболее предпочтительном варианте осуществления изобретения компонент (I) и/или (III) предлагаемого в изобретении пептида содержит (модифицированный) пептид GLP-1, который выбирают изGLP-1(7-35), GLP-1(7-36), GLP-1(7-36)-амида, GLP-1(7-37) или его варианта, аналога или производного. Предпочтительными являются также предлагаемые в изобретении пептиды, содержащие в их компонентах (I) и/или (III) модифицированный пептид GLP-1, который несет остаток Aib в положении 8 или аминокислотный остаток в положении 7 пептида GLP-1, который выбирают из группы, включающей Dгистидин, дезаминогистидин, 2-аминогистидин, гидроксигистидин, гомогистидин, N-ацетилгистидин, афторметилгистидин, а-метилгистидин, 3-пиридилаланин, 2-пиридилаланил или 4-пиридилаланин. Примерами методов получения аминокислотных замен в белках, которые можно использовать для создания аналогов, предлагаемых для применения согласно настоящему изобретению, являются любые стадии методов, представленных в U.S. RE 33653; 4959314; 4588585 и 4737462, на имя Mark и др.; 5116943 на имя Koths и др.; 4965195 на имя Namen и др.; и 5017691 на имя Lee и др., и метод получения замещенных лизином белков, описанный в US 4904584 (Shaw и др.). Предпочтительно вариант или аналог, как они определены выше, которые входят в состав компонента (I), (II) и/или (III), должны иметь коровую последовательность, такую же как нативная последовательность, например GLP-1(7-37) или GLP-2, или ее биологически активный фрагмент или любую изоформу IP2, аминокислотная последовательность которой по меньшей мере на 70% идентична нативной аминокислотной последовательности и сохраняет присущую ей биологическую активность. Более предпочтительно такая последовательность по меньшей мере на 80% идентична, по меньшей мере на 90% идентична или наиболее предпочтительно по меньшей мере на 95% идентична нативной последовательности. Если говорят, что последовательность конкретного пептида характеризуется конкретным процентом идентичности относительно полипептиду определенной длины, с которым проводят сравнение, то процент идентичности оценивают относительно пептида, с которым проводят сравнение. Так,пептид, идентичный на 50% полипептиду, с которым проводят сравнение, который состоит из 100 аминокислот, представляет собой состоящий из 50 аминокислот полипептид, который полностью идентичен состоящей из 50 аминокислот области полипептида, с которым проводят сравнение. Он может представлять собой также состоящий из 100 аминокислот полипептид, который на 50% идентичен полипептиду, с которым проводят сравнение, по всей его длине. Естественно, другие полипептиды должны удовлетворять таким же критериям. Понятие идентичность последовательности в контексте настоящего описания означает, что последовательности сравнивают следующим образом. Осуществляют сравнительный анализ первичной структуры последовательностей с помощью версии 9 группы компьютерной генетики(Genetic Computing Group's) программы GAP (глобальная программа сравнительного анализа первичной структуры), используя по умолчания матрицу (BLOSUM62) (значения от -4 до +11), принимая штраф за-8 013796 открытие бреши -12 (за первый нуль в бреши) и штраф за удлинение бреши -4 (за каждый последующий нуль в бреши). После сравнительного анализа первичной структуры рассчитывают процент идентичности, выражая количество совпадений в виде процента от количества аминокислот в заявляемой последовательности. Под объем настоящего изобретения подпадают также производные слитого пептида или его аналога, фрагмента или варианта. Считается, что понятие производное предлагаемого в изобретении пептида относится только к таким модифицированным пептидам, предлагаемым в изобретении, в которых отсутствует замена одной аминокислоты на другую среди двадцати встречающихся в естественных условиях аминокислот. Таким образом, генетически кодируемые аминокислоты можно модифицировать путем взаимодействия с органическим дериватизирующим агентом, который обладает способностью к взаимодействию с выбранными боковыми цепями амино- и карбоксигрупп концевых остатков (предпочтительно путем ковалентной модификации) или путем интродукции не встречающихся в естественных условиях аминокислот (полученных путем химического синтеза, т.е. D-изомеров аминокислот, кодируемых генетическим кодом, Aib (а-аминоизомасляная кислота), Abu (а-аминомасляная кислота), Tie (третбут), n-аинаин, 3-аминометилбензойная кислота, антраниловая кислота), или встречающихся в естественных условиях аминокислот, которые не кодируются генетическим кодом, например гидроксипролин,-карбоксиглутамат, орнитин, фосфосерин, D-аланин и D-глутамин, или путем модификации каркаса пептида путем альтернативного устройства пептидного каркаса. Описанные выше предпочтительные модификации аминокислот предлагаемого в изобретении пептида (в том числе, как указано выше, вариантов, аналогов или фрагментов слитого пептида) могут затрагивать любой сайт (любую аминокислоту) предлагаемого в изобретении пептида, например, расположенный в компоненте (I), (II) и/или (III). Цистеинильные остатки, если присутствуют в любой форме предлагаемого в изобретении пептида,например, в аналоге предлагаемого в изобретении пептида, как правило, вступают во взаимодействие с альфа-галоацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с образованием карбоксиметильных или карбоксиамидометильных производных. Цистеинильные остатки дериватизируют также путем взаимодействия с бромтрифторацетоном, альфа-бром-бета-(5 имидазолил)пропионовой кислотой,хлорацетилфосфатом,N-алкилмалеимидами,3-нитро-2 пиридилдисульфидом, метил-2-пиридилдисульфидом, n-хлорбензоатом ртути, 2-хлор-4-нитрофенолом ртути или хлор-7-нитробензо-2-окса-1,3-диазолом. Гистидильные остатки предлагаемого в изобретении пептида можно дериватизировать путем взаимодействия с диэтилпрокарбонатом при pH 5,5-7,0, поскольку этот агент относительно специфичен в отношении гистидильной боковой цепи. Можно применять также парабромфенацилбромид; реакцию предпочтительно осуществляют в 0,1 М какодилате натрия при pH 6,0. В частности, N-концевой остаток гистидина (His7)GLP-1(7-37), который входит в компонент (I) и/или (III) предлагаемого в изобретении пептида, является очень важным для инсулинотропной активности пептидов GLP-1, как установленоSuzuki с соавторами (Diabetes Res.; Clinical Practice 5 (приложение 1), 1988, с. 30). Таким образом, предлагаемый в изобретении пептид можно модифицировать на His7 GLP-1, который является частью его компонента (I) и/или (III), с помощью алкильных или ацильных (С 1-С 6)групп или путем замены His функционально эквивалентными кольцевыми C5-С 6-структурами. Предпочтительной модификацией является интродукция гидрофобного фрагмента на аминоконец His7 или в его гистидильную боковую цепь. Лизинильные и аминоконцевые остатки предлагаемого в изобретении пептида можно, например,подвергать взаимодействию с янтарным или другими ангидридами карбоновых кислот. Дериватизация с помощью этих агентов оказывает такое действие, как реверсия заряда лизинильных остатков. С помощью модификации ацилом (C12-C18) эпсилон-аминогруппы остатка(ов) лизина в предлагаемом в изобретении пептиде его время полужизни в кровотоке увеличивается. Аргинильные остатки можно, например,модифицировать путем взаимодействия с одним или несколькими общепринятыми реагентами, в том числе фенилглиоксалом; и нингидрином. Для дериватизации аргининовых остатков требуется осуществление реакции в щелочных условиях из-за высокого значения pKa гуанидиновой функциональной группы. Кроме того, эти реагенты можно подвергать взаимодействию с группами лизина, а также эпсилонаминогруппы аргинина. Сама по себе специфическая модификация тирозильных остатков хорошо изучена. Для получения О-ацетилтирозильных видов и е-нитропроизводных предпочтительно можно применять Nацетилимидазол и тетранитрометан соответственно. Карбоксильные боковые группы (аспартил или глутамил) можно избирательно модифицировать путем взаимодействия с карбодиимидами (R'N-C-N-R'), такими как 1-циклогексил-3-[2-морфолинил-(4 этил)]карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, аспартильный и глутамильный остатки можно превращать в аспарагинильный и глутаминильный остатки путем взаимодействия с ионами аммония. Глутаминильный и аспарагинильный остатки можно деамидировать с образованием соответствующих глутамильных и аспартильных остатков. В альтернативном варианте эти остатки можно деамидировать в слабо кислых условиях. Любая форма этих остатков подпадает под объем настоящего изобрете-9 013796 ния. У деамидированных предлагаемых в изобретении пептидов можно изменять чувствительность к протеолитическому расщеплению протеазами или пептидазами, исходя из предположения, что деамидирование может иметь важное физиологическое значение при непосредственном протеолитическом расщеплении предлагаемого в изобретении пептида. Следует отметить, что полученные в результате биосинтеза предлагаемые в изобретении пептиды могут расщепляться при определенных условиях хранения, что приводит к деамидированию в одном из нескольких положений в предлагаемом в изобретении пептиде. Остаток метионина в предлагаемых в изобретении пептидах может обладать чувствительностью к окислению, прежде всего до образования сульфоксида. В качестве других указанных выше производных можно использовать и дезамидированные предлагаемые в изобретении пептиды и/или сульфоксиды предлагаемых в изобретении пептидов, которые обладают полной биологической активностью. Другими приемлемыми реагентами для дериватизации содержащих альфа-аминокислоты остатков являются сложные имидоэфиры, такие как метилпиколинимидат; пиридоксалфосфата; пиридоксал; хлорборогидрид; тринитробензолсульфоновая кислота; О-метилизомочевина; 2,4-пентиндион; и катализируемая трансаминазой реакция с глиоксилатом. Концевые аминокислотные остатки предлагаемого в изобретении пептида с карбокси-(С-конец) и амино-(N-конец) группами (а также карбокси- или амидные группы боковых цепей аминокислот, см. выше) могут присутствовать в защищенной форме (например С-конец защищен амидной группой) с помощью амино- или карбоксильных защитных групп и/или в незащищенной форме. Кроме того, можно применять кислотно-аддитивные соли предлагаемого в изобретении пептида. Обычными кислотноаддитивными солями являются соли галогенводородных кислот, т.е. HBr, HI или более предпочтительноHCl. ПЭГилирование карбоксильных групп концевых или боковых цепей или эпсилон-аминогруппы лизина в предлагаемом в изобретении пептиде придает устойчивость к окислению и также подпадает под объем настоящего изобретения. Другие модификации, приводящие к получению производных предлагаемых в изобретении пептидов, затрагивают углеводы и/или липиды, которые могут быть ковалентно сшиты с предлагаемым в изобретении пептидом. Предпочтительно сшивать липиды и/или углеводы с серином, треонином, аспарагином, глутамином или тирозином или глутаматом или аспартатом через их реактивные фрагменты боковой цепи. В альтернативном варианте углеводы и/или липиды можно связывать также с концевыми фрагментами предлагаемого в изобретении пептида. Кроме того, предлагаемый в изобретении пептид можно сшивать с отличным по функциональной активности пептидным или белковым фрагментом, который может также повышать стабильность предлагаемого в изобретении пептида и/или может служить для улучшения транспортных свойств предлагаемого в изобретении пептида в общей воде организма,прежде всего в крови. Приемлемые пептиды или белки можно выбирать, например, из альбумина, трансферрина и т.д., которые непосредственно сшивают (в качестве компонента IV) с предлагаемым в изобретении пептидом или сшивают через пептидную или органическую линкерную последовательность. Предпочтительно эти пептиды или белки связывают с одним из концов предлагаемого в изобретении пептида. Для решения проблемы, связанной с расщеплением предлагаемого в изобретении пептида, следующим вариантом осуществления настоящего изобретения является ретроинвертированный изомер предлагаемого в изобретении пептида, состоящий из D-аминокислот, или по меньшей мере частично состоящий из D-аминокислот. Понятие ретро-инвертированный изомер относится к изомеру линейного пептида, в котором направление последовательности является обратным, и хиральность каждого аминокислотного остатка является инвертированной (см., например, Jameson и др., Nature, 368, 1994, c. 744-746; Brady и др., Nature, 368, 1994, c. 692-693). Касательно родительского пептида ретроинвертированной пептид собирают, используя обратный порядок аминокислот, как правило, защищенных с помощью F-moc производных аминокислот. Как правило, неочищенные пептиды можно очищать с помощью ЖХВР с обращенной фазой. Другие модификации, которые можно интродуцировать в предлагаемые в изобретении пептиды,представляют собой модификации пептидного каркаса. Предпочтительно модифицированные предлагаемые в изобретении пептиды представляют собой каркасные миметики. Их каркас отличается от встречающегося в естественных условиях каркаса, в то время как структуры боковых цепей идентичны структурам предлагаемых в изобретении пептидов, их фрагментов, вариантов, производных или аналогов. В целом, каркасные миметики несут модификацию одной или нескольких групп каркасной цепи-CS-, -СН 2-, -SOn-, -Р=О(ОН)- или -В(ОН)- вместо -СО-. Пептидный миметик предлагаемого в изобретении пептида может представлять собой комбинацию каждой из указанных модификаций. В частности,можно объединять модификации каждой из групп I, II и III. В пептидном миметике можно модифицировать каждую группу каркасной цепи или в альтернативном варианте только некоторое количество групп цепи можно заменять на не встречающуюся в естественных условиях группу. Предпочтительно все группы каркасной цепи предлагаемого в изобретении пептида, такие как -NH-, -CHR- или СО, заменяют- 10013796 на другую не встречающуюся в естественных условиях группу. В случае, когда амидную связь(-NH-CO-) каркаса предлагаемого в изобретении пептида заменяют (во всей молекуле или по меньшей мере в одном положении), предпочтительные для замены группы представляют собой биостерические,например, ретроинвертированные амидные связи (-CO-NH-), гидроксилэтилен (-СН(ОН)-СН 2-), алкен(СН 2=СН-), карба (СН 2-СН 2-) и/или -Р=О(ОН)-СН 2-. В альтернативном варианте удлинение цепи каркаса путем встраивания можно осуществлять в каркасном миметике предлагаемого в изобретении пептида,например, с помощью групп, фланкирующих С-альфа атом. На любой стороне С-альфа атома можно встраивать, например, -О-, -S-, -СН-, -NH-. Особенно предпочтительной является олигокарбаматная структура пептидного каркаса предлагаемых в изобретении пептидов. Амидную связь заменяют на карбаматную группу. Мономерные Nзащищенные аминоалкилкарбонаты можно получать на основе соответствующих аминокислот или аминоспиртов. Их превращают в активные сложные эфиры, например, сложный n-нитрофениловый эфир, с помощью F-moc-группы или фоточувствительной нитроатрилоксикарбонильной группы путем твердофазного синтеза. Предлагаемые в изобретении пептиды защищают от протеолитического расщепления согласно указанному выше методу. Прежде всего их защищают от действия дипептидиламинопептидазы-4 (DPP-IV). Понятие защищенный от действия DPP-IV в контексте настоящего описания относится к пептиду по п.1 формулы изобретения. Предлагаемые в изобретении пептиды, а также их производные, аналоги,фрагменты и варианты, несущие GLP-1(7-35, -36 или -37) в качестве части компонента (I) и/или (III) предлагаемого в изобретении пептида, обладают устойчивостью к присутствующей в плазме пептидазе(DPP-IV). Устойчивость пептида к расщеплению дипептидиламинопептидазой IV определяют, например, с помощью изложенного далее анализа расщепления. Аликвоты пептидов инкубируют при 37 С с аликвотой очищенной дипептидиламинопептидазы IV в течение 4-22 ч в соответствующем буфере при pH 7-8 (буфер не содержит альбумин). Ферментативные реакции прекращают, добавляя трифторуксусную кислоту, и продукты расщепления пептида отделяют и оценивают с помощью ЖХВР или ЖХ-МС-анализа. Один из методов осуществления анализа заключается в осуществлении следующей процедуры: смеси наносят на колонку Zorbax300SB-C18 (диаметр пор 30 нм, частицы размером 5 мкм) 1502,1 мм, и элюируют при скорости потока 0,5 мл/мин линейным градиентом ацетонитрила в 0,1% трифторуксусной кислоте (градиент от 0 до 100% ацетонитрила в течение 30 мин). Пептиды и их продукты расщепления можно оценивать по их абсорбции при 214 нм (пептидные связи) или 280 нм (ароматические аминокислоты), и определять количественно путем интеграции площадей их пиков. Схему расщепления можно определять с помощью ЖХ-МС, при использовании которых можно определять МС-спектры отдельного пика. Процентное соотношение интактного/расщепленного соединения в данный момент времени используют для оценки стабильности пептидов в отношении расщепления DPP-IV. Предлагаемый в изобретении пептид рассматривается как стабилизированный (обладающий повышенной стабильностью) в отношении расщепления DPP-IV, когда его стабильность в 10 раз выше, чем уGLP-1(7-37), при выражении в процентах интактного соединения в данный момент времени. Таким образом, стабилизированный в отношении расщепления DPP-IV предлагаемый в изобретении пептид предпочтительно по меньшей мере в 10, более предпочтительно по меньшей мере в 20 раз более стабилен,чем GLP-1(7-37) сам по себе. Стабильность можно оценивать с помощью любого метода, известного специалисту в данной области, например, добавляя DPP-IV в раствор подлежащего оценке пептида, и определяя расщепление пептида, например, во времени, например, спектроскопическим методом, анализом методом Вестерн-блоттинга, путем скрининга с использованием антител и т.д. Параллельно предлагаемый в изобретении пептид оценивают в качестве соединения, которое обладает действием GLP-1(737), например, оценивая связывание с его нативным рецептором (GLP-1-рецептор). Предпочтительно предлагаемый в изобретении пептид обладает аффинностью к связыванию с GLP-1-рецептором, составляющему по меньшей мере 10%, предпочтительно по меньшей мере 50% от аффинности связывания встречающегося в естественных условиях пептида GLP-1. Аффинность связывания можно определять с помощью любого пригодного метода, например, с помощью резонанса поверхностного плазмона и т.д. Кроме того, предпочтительно, если предлагаемый в изобретении пептид вызывает формирование внутриклеточного цАМФ путем связывания с внеклеточным рецептором, который передает сигнал в клетку. Пептиды, предлагаемые в изобретении, можно получать синтетически с помощью методов твердофазного пептидного синтеза, аналогично тому, как получают амид GLP-1(7-36) и GLP-1(7-37) в данной области, и можно очищать после этого в лабораторных условиях, например, с использованием одной стадии очистки на ЖХВР-колонке с обращенной фазой или с помощью приемлемых хроматографических методов. Однако предпочтительно создают клетки, либо микробные клетки, либо клетки животных, для производства предлагаемого в изобретении пептида. Предлагаемый в изобретении пептид можно выделять из клеток, в которых он экспрессируется, например, с помощью общепринятых методов разделения. Так,клетки можно выращивать в соответствующих условиях, например, с использованием подложки и пита- 11013796 тельных веществ, in vitro, и секретируемый белок, т.е. предлагаемый в изобретении пептид, выделять из внеклеточной среды. Созданные таким образом в клетках последовательности предпочтительно включают лидерные последовательности и последовательности сигнальных пептидов, которые обеспечивают определенную направленность секреции предлагаемого в изобретении пептида. Клетки предпочтительно экспрессируют протеазу, которая обладает способностью расщеплять лидерные и сигнальные последовательности, либо эндогенные, либо сконструированные генные последовательности. В альтернативном варианте сконструированные генные последовательности, кодирующие предлагаемый в изобретении пептид, не содержат указанные лидерные последовательности и последовательности сигнальных пептидов, в результате экспрессируемый внутри клетки предлагаемый в изобретении пептид не может секретироваться и его выделяют из клеток с помощью процессов, включающих лизис клеток. При использовании таких методов кодирующие последовательности могут включать способствующие очистке метки,позволяющие эффективно экстрагировать пептидный продукт из среды, эти метки можно отщеплять для высвобождения выделенного предлагаемого в изобретении пептида. Изобретение относится также к нуклеиновой кислоте, которая кодирует предлагаемый в изобретении пептид, представляющий собой слитый пептид или его фрагмент, аналог или вариант. Под объем настоящего изобретения подпадает любая нуклеиновая кислота, кодирующая предлагаемые в изобретении пептиды. В результате вырожденности генетического кода предлагаемый в изобретении пептид могут кодировать несколько нуклеотидных последовательностей. Подпадающая под объем настоящего изобретения молекула нуклеиновой кислоты может содержать нуклеиновую кислоту, кодирующую предлагаемый в изобретении пептид, и, кроме того, дополнительные (функционально активные) нуклеотидные последовательности. В предпочтительном варианте осуществления настоящего изобретения указанная молекула нуклеиновой кислоты может кодировать (а) полную аминокислотную последовательность GLP-1 (GLP-1(1-37 или функционально активную последовательность GLP-1(7-35, -36 или -37),(б) отщепляемую любой протеазой последовательность на N-конце последовательности GLP-1, кодирующей последовательность, которая указана в (а), расположенную против хода транскрипции относительно последовательности, указанной в (б), которая может кодировать лидерную последовательность. В другом предпочтительном варианте осуществления изобретения расположенная против хода транскрипции относительно нуклеотидной последовательности, кодирующей последовательность, которая указана в (б), в молекуле нуклеиновой кислоты может дополнительно присутствовать (в) последовательность,которая кодирует сигнальный пептид. В альтернативном варианте предлагаемая в изобретении молекула нуклеиновой кислоты может иметь последовательность (в), слитую против хода транскрипции с последовательностью, указанной в (а), без какой-либо находящейся между ними последовательности, кодирующей лидерную последовательность (б). Предпочтительно лидерная последовательность и последовательность сигнального пептида являются гетерологичными относительно препроглюкагона. Изобретение относится также к вектору, содержащему предлагаемую в изобретении нуклеиновую кислоту (молекулу) и другие функционально активные компоненты для экспрессии предлагаемой в изобретении нуклеиновой кислоты (молекулы). Как правило, предлагаемую в изобретении нуклеиновую кислоту (молекулы) можно сливать с промоторной последовательностью и, наконец, объединять с другими регуляторными последовательностями, например с энхансерной последовательностью. Для репликации плазмида может содержать сайт инициации репликации. Для селекции клеток, трансфектированных предлагаемым в изобретении вектором, вектор можно снабжать одним или несколькими генами,обеспечивающими устойчивость к антибиотику(ам) (например, канамицину, ампициллину). Вектор может представлять собой плазмиду, которая содержит промотор бактериального происхождения и гены,обусловливающие устойчивость к антибиотикам, и исходный промотор и гены, обусловливающие устойчивость к антибиотикам, для репликации и экспрессии в клетках млекопитающих. Изобретение относится также к клетке-хозяину, содержащей экзогенно интродуцированную ДНК, предлагаемую в изобретении, которая обладает способностью к трансляции указанного белка-предшественника. Клетка-хозяин может представлять собой либо прокариотическую клетку-хозяина, либо эукариотическую клеткухозяина, например клетку млекопитающего. Следующим объектом изобретения является способ лечения животного, предпочтительно человека,заключающийся в том, что вводят предлагаемый в изобретении пептид, который содержит компоненты(I) и (II) и необязательно компонент (III). Изобретение относится также к соответствующему применению указанных предлагаемых в изобретении пептидов для получения продукта, предназначенного для лечения или предупреждения заболевания или состояния, ассоциированного с метаболизмом глюкозы. Примерами связанных с глюкозой нарушений являются (но, не ограничиваясь ими): сахарный диабет типа I или типа II (ИНСД, инсулин-независимый (сахарный) диабет) или устойчивость к инсулину, нарушения или заболевания, связанные с весом тела, или связанные с ним состояния, где нарушения веса тела или связанные с ним состояния включают ожирение, состояния, связанные с избыточным весом,нарушение регуляции насыщения, пониженные уровни инсулина в плазме, повышенные уровни глюкозы в крови или пониженную массу панкреатических бета-клеток. Предложено предпочтительно применять предлагаемые в изобретении пептиды для приготовления лекарственного средства, предназначенного для лечения диабета типа II (ИНСД). Следовательно, настоящее изобретение относится к применению- 12013796 предлагаемого в изобретении пептида, например, для снижения веса индивидуума, для снижения порога насыщения индивидуума, для послеобеденного повышения уровней инсулина в плазме у индивидуума,для снижения уровня глюкозы в крови натощак у индивидуума, для повышения массы панкреатических бета-клеток у индивидуума или для лечения диабета типа I или II у пациента. Кроме того, с помощью предлагаемых в изобретении пептидов, т.е. слитых пептидов или их аналогов, фрагментов, вариантов или производных, можно лечить пациентов с другими заболеваниями или нарушениями. Предлагаемые в изобретении пептиды можно применять для приготовления лекарственного средства, предназначенного для лечения нейродегенеративных нарушений и заболеваний или связанных с ними состояний и для лечения нарушений и заболеваний, ассоциированных с апоптозом. Применение предлагаемого в изобретении пептида для лечения указанных нарушений обусловлено следующими причинами: рецепторы GLP-1, которые связаны с путем вторичного мессенджера циклического АМФ, экспрессируются в головном мозге грызунов и людей. Хемоархитектура распределения рецепторов в головном мозге коррелирует не только с имеющей решающее значение ролью GLP-1 в регуляции потребления пищи и ответом на вызывающий отвращение (к пище) стресс. Установлено также, что связьGLP-1 со своим рецептором GLP-1 приводит к проявлению нейротропной активности и служит защитой от индуцируемого глутаматом апоптоза и окислительного повреждения культивируемых нейронов. Кроме того, установлено, что GLP-1 модифицирует процессинг предшественника амилоидного -белка в культурах клеток и в зависимости от дозы снижает уровни амилодного -пептида в головном мозге invivo. Так, GLP-1 известен также в качестве регулятора центральной нервной системы. Предлагаемые в изобретении пептиды, имитирующие биологическую активность физиологически активного GLP-1, обладают терапевтической ценностью для лечения, например, болезни Альцгеймера (АБ) и других нейродегенеративных состояний, связанных с центральной и периферической нервной системой (например,амиотрофический боковой склероз (ALS), болезнь Александера, синдром Альперса (прогрессирующая полидистрофия мозга), атаксия-телеангиэктазия, болезнь Канавана, синдром Кокейна, болезнь Крейтцфельдта-Якоба, рассеянный склероз, болезнь Сандхоффа, болезнь Пика, атаксия спинного мозга, болезнь Шильдера и болезнь Паркинсона). Кроме того, установлено, что физиологически активный GLP-1 обладает антиапоптозным действием в отношении различных клеток, например, ценным действием GLP-1 является возможность его применения для сохранения массы и функции свежевыделенных человеческих островковых или других типов клеток. В результате биологически активный предлагаемый в изобретении пептид можно применять для лечения нарушений, обусловленных апоптозом клеток или тканей. Предлагаемый в изобретении пептид можно применять для приготовления композиции, которую вводят экзогенно и которая содержит выделенный предлагаемый в изобретении пептид. Полученную композицию можно применять также для лечения вышеуказанных нарушений. Указанные выше нарушения можно лечить также с помощью предлагаемых в изобретении клеток-хозяев, нуклеиновых кислот(молекул) или векторов или более предпочтительно предлагаемые в изобретении клетки-хозяева, нуклеиновые кислоты (молекулы) или векторы можно применять для приготовления лекарственного средства, предназначенного для лечения указанных нарушений. Приготовление форм, которые содержат в качестве действующего вещества последовательности предлагаемого в изобретении пептида, как правило, хорошо известно в данной области, например, описано в US 4608251; 4601903; 4599231; 4599230; 4596792 и 4578770, которые все включены в настоящее описание в качестве ссылки. Как правило, такие формы приготавливают в виде предназначенных для инъекции или жидких растворов, или суспензий, которые предпочтительно содержат воду (водная форма) или могут быть эмульгированы. Понятие водная форма означает форму, содержащую по меньшей мере 50 мас.% воды. Аналогично этому понятие водный раствор означает раствор, содержащий по меньшей мере 50 мас.% воды, а понятие водная суспензия означает суспензию, содержащую по меньшей мере 50 мас.% воды. Для внутривенной, кожной или подкожной инъекции или инъекции в область поражения действующее вещество должно находиться в форме приемлемого для парентерального введения водного раствора, который не содержит пирогенов и имеет приемлемое значение pH, изотоничность и стабильность. Жидкие фармацевтические композиции, как правило, включают жидкий наполнитель, такой как вода. Предпочтительно жидкий наполнитель может представлять собой физиологический соляной раствор,декстрозный, этанольный или другой раствор сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль или их комбинации. Дополнительными примерами являются другие изотоничные наполнители, такие как раствор Рингера для инъекций или лактированный раствор Рингера(Рингер-лактат) для инъекций. Если изобретение относится к фармацевтическому препарату, который содержит водный раствор соединения, предлагаемого в настоящем изобретении, и буфер, то указанное соединение присутствует в концентрации от 0,1 мг/мл или выше, и значение pH указанного препарата составляет от примерно 2,0 до примерно 10,0, предпочтительно от примерно 7,0 до примерно 8,5. Предпочтительно значение pH препарата находится в диапазоне по меньшей мере 1 единицы pH от изоэлектрической точки соединения,- 13013796 предлагаемого в настоящем изобретении, еще более предпочтительно значение pH препарата находится в диапазоне по меньшей мере 2 единицы pH от изоэлектрической точки соединения, предлагаемого в настоящем изобретении. Можно приготавливать также твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией. Фармацевтический препарат может представлять собой высушенную вымораживанием форму, в которую лечащий врач или пациент добавляет растворители и/или разбавители перед применением. Другими словами приготовленный препарат не требуется немедленно вводить индивидууму. Как правило, после приготовления ее упаковывают для хранения в замороженном состоянии или в виде высушенной формы для последующего восстановления с получением жидкой формы или другой формы, пригодной для введения индивидууму. В другом варианте осуществления изобретения фармацевтический препарат представляет собой высушенный препарат (например, сушкой вымораживанием или распылительной сушкой), готовый к применению без какого-либо предварительного растворения. Под высушенной формой понимают высушенную фармацевтическую композицию или препарат, который сушат либо сушкой вымораживаниемMumenthaler и др., Pharm. Res. 11, 1994, c. 12-20) или воздушной сушкой (Carpenter и Crowe, Cryobiology 25, 1988, c. 459-470; и Roser, Biopharm. 4, 1991, c. 47-53). Образование агрегатов полипептида в процессе хранения жидкой фармацевтической композиции оказывает отрицательной воздействие на биологическую активность полипептида, приводящее к потере терапевтической эффективности фармацевтической композиции. Кроме того, образование агрегатов может приводить к другим проблемам, таким как блокада трубок, мембран или насосов, когда содержащую полипептид фармацевтическую композицию вводят с помощью системы для инфузии. В содержащем пептид фармацевтическом препарате, предлагаемом в настоящем изобретении, могут присутствовать другие ингредиенты. Такие дополнительные ингредиенты могут представлять собой смачивающие вещества, эмульгаторы, антиоксиданты, наполнители, pH-забуферивающие агенты (например, фосфатный или цитратный, или малеатный буферы), консерванты, поверхностно-активные вещества, стабилизаторы, модификаторы тоничности, хелатирующие агенты, ионы металлов, жирные носители, белки (например, человеческий сывороточный альбумин, желатин или белки) и/или цвиттерион(например, аминокислота, такая как бетаин, таурин, аргинин, глицин, лизин и гистидин). Стабилизаторы, которые можно применять в предлагаемых в изобретении препаративных формах,предпочтительно следует выбирать из группы, включающей высокомолекулярные полимеры или низкомолекулярные соединения. В другом варианте осуществления изобретения стабилизатор выбирают из группы, включающей полиэтиленгликоль (например, ПЭГ 3350), поливиниловый спирт (ПВС), поливинилпирролидон, карбоксигидроксицеллюлозу или ее производные (например, НРС (гидроксипропилцеллюлоза), HPC-SL, HPC-L и НРМС (гидроксипропилметилцеллюлоза, циклодестрины, серосодержащие субстанции, такие как монотиоглицерин, тиогликолевая кислота и 2-метилтиоэтанол, и различные соли(например, хлорид натрия). Композиции, содержащие каждый из указанных стабилизаторов индивидуально, представляют собой альтернативный вариант осуществления изобретения. Фармацевтические композиции могут также содержать дополнительные стабилизирующие агенты, которые еще более повышают стабильность терапевтически активного полипептида. Представляющими наибольший интерес в контексте настоящего изобретения стабилизаторами являются (но, не ограничиваясь ими) метионин и ЭДТК, защищающая полипептид от метионинового окисления, и неионогенное поверхностно-активное вещество, которое защищает полипептид от агрегации, ассоциированной с замораживанием-оттаиванием или механическим сдвигом. Поверхностно-активные вещества, которые можно применять в предлагаемых в изобретении препаративных формах, предпочтительно можно выбирать из группы, включающей детергент, этоксилированное касторовое масло, полигликолизированные глицериды, ацетилированные моноглицериды, эфиры жирных кислот и сорбитана, блок-полимеры полиоксипропилена-полиоксиэтилена (например, полоксамеры, такие как Pluronie F68, полоксамер 188 и 407, Тритон Х-100), эфиры жирных кислот и полиоксиэтиленсорбината, звездообразный ПЭО (полиэтиленоксид), производные полиоксиэтилена и полиэтилена, такие как алкилированные и алкоксилированные производные (Твины, например, Твин-20, Твин-40,Твин-80, и Brij-35), полиоксиэтиленгидроксистеарат, моноглицериды или их этоксилированные производные, диглицериды или их полиоксиэтиленовые производные, спирты, глицерин, лецитины и фосфолипиды (например, фосфатидилсерин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозит,дифосфатидилглицерин и сфингомиелин), производные фосфолипидов (например, дипальмитоилфосфатидная кислота) и лизофосфолипидов (например, пальмитоиллизофосфатидил-L-серин и сложные 1 ацил-sn-глицеро-3-фосфатные эфиры этаноламина, холина, серина или треонина) и алкильные, алкоксильные (сложные алкиловые эфиры), алококси- (простые алкиловые эфиры) производные лизофосфатидила и фосфатидилхолинов, например лауроиловые и миристоиловые производные лизофосфатидилхолина, дипальмитоилфосфатидилхолина, и модификаторы полярной головной группы, представляющие- 14013796 собой холины, этаноламины, фосфатидную кислоту, серины, треонины, глицерин, инозит, и положительно заряженные DODAC, DOTMA, DCP, BISHOP, лизофосфатидилсерин и лизофосфатидилтреонин,и глицерофосфолипиды (например, цефалины), глицерогликолипиды (например, галактопиранозид),сфингогликолипиды (например, церамиды, ганглиозиды), додецилфосфохолин, лизолецитин куриного яйца, производные фузидоновой кислоты (например, тауро-дигидрофузидат натрия и т.д.), жирные кислоты с длинной цепью и соли С 6-С 12 кислот (например, олеиновой кислоты и каприловой кислоты),ацилкарнитины и их производные, N'X-ацилированные производные лизина, аргинина или гистидина,или производные с ацилированной боковой цепью лизина или аргинина, N-ацилированные производные дипептидов, содержащие любую комбинацию лизина, аргинина и нейтральных или кислотных аминокислот, N-ацилированное производное трипептида, содержащее любую комбинацию нейтральных аминокислот и двух заряженных аминокислот, DSS (докусат натрия, регистрационный номер CAS [577-117], докусат кальция, регистрационный номер CAS [128-49-4], докусат калия, регистрационный номерCAS [7491-09-0]), ДСН (додецилсульфат натрия или лаурилсульфат натрия), каприлат натрия, холевую кислоту или ее производные, желчные кислоты и их соли и конъюгаты с глицином или таурином, урсодезоксихолевую кислоту, холат натрия, дезоксихолат натрия, таурохолат натрия, гликохолат натрия, Nгексадецил-N,N-диметил-3-аммонио-1-пропансульфонат, анионогенные (алкиларилсульфонаты) одновалентные поверхностно-активные вещества, цвиттерионные поверхностно-активные вещества (например,N-алкил-N,N-диметиламмонио-1-пропансульфонаты, 3-холамидо-1-пропилдиметиламмонио-1-пропансульфонат), катионогенные поверхностно-активные вещества (четвертичные аммониевые основания)(например, цетилтриметиламмонийбромид, цетилпиридинийхлорид), неионогенные поверхностноактивные вещества (например, додецил-D-глюкопиранозид), полоксамины (например, тетроники(Tetronic's, которые представляют собой тетрафункциональные блок-сополимеры, полученные в результате последовательного добавления пропиленоксида и этиленоксида к этилендиамину, или поверхностно-активное вещество можно выбирать из группы, включающей имидазолиновые производные или их смеси. Композиции, содержащие каждое из указанных конкретных поверхностно-активных веществ индивидуально, представляют собой альтернативный вариант осуществления изобретения. Применение поверхностно-активного вещества в фармацевтических композициях хорошо известно специалистам в данной области. Для удобства в качестве ссылки представлен справочник Remington: The Science andPractice of Pharmacy, 19-e изд., 1995. Фарацевтически приемлемые консерванты предпочтительно можно выбирать из группы, включающей фенол, o-крезол, m-крезол, n-крезол, метил-n-гидроксибензоат, пропил-n-гидроксибензоат, 2 феноксиэтанол, бутил-n-гидроксибензоат, 2-фенилэтанол, бензиловый спирт, этанол, хлорбутанол и тиомеросал, бронопол, бензойную кислоту, имидмочевину, хлоргекседин, дигидроацетат натрия, хлоркрезол, этил-n-гидроксибензоат, бензетонийхлорид, хлорфенесин (3-n-хлорфеноксипропан-1,2-диол) или их смеси. Придающие изотоничность агенты предпочтительно можно выбирать из группы, включающей соль(например, хлорид натрия), сахар или сахарный спирт, аминокислоту (например, L-глицин, L-гистидин,аргинин, лизин, изолейцин, аспарагиновая кислота, триптофан, треонин), альдит (например, глицерин,1,2-пропандиол (пропиленгликоль), 1,3-пропандиол, 1,3-бутандиол), полиэтиленгликоль (например, ПЭГ 400) или их смеси. Можно применять любой сахар, такой как моно-, ди- или полисахариды, или водорастворимые глюканы, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, оксиэтилированный крахмал и Na-карбоксиметилцеллюлозу. В одном из вариантов осуществления изобретения добавка в виде сахара представляет собой сахарозу. Понятие сахарный спирт относится к С 4 С 8 углеводороду, содержащему по меньшей мере одну -ОН- группу, и включает, например, маннит, сорбит, инозит, галацитит, дульцит, ксилит и арабит. В одном из вариантов осуществления изобретения добавка в виде сахарного спирта представляет собой маннит. Указанные выше сахара или сахарные спирты можно применять индивидуально или в сочетании. Не существует точного предела применяемого количества, если сахар или сахарный спирт растворим в жидком препарате и не оказывает отрицательного действия на стабилизирующую активность, которую достигают с помощью способов, предлагаемых в изобретении. Хелатирующие агенты предпочтительно можно выбирать из солей этилендиаминтетрауксусной кислоты (ЭДТК), лимонной кислоты и аспарагиновой кислоты и их смесей. Буферы предпочтительно выбирают из группы, включающей ацетат натрия, карбонат натрия, цитрат, глицилглицин, гистидин, глицин, лизин, аргинин, первичный кислый фосфат натрия, динатрийфосфат, фосфат натрия и трис(гидроксиметил)аминометан, гепес (Hepes), бицин, трицин, яблочную кислоту,сукцинат, малеиновую кислоту, фумаровую кислоту, винную кислоту, аспарагиновую кислоту или их смеси. Композиции, содержащие каждый из указанных конкретных буферов индивидуально, представляют собой альтернативный вариант осуществления изобретения. Применение вышеуказанных добавок в фармацевтических композициях, содержащих предлагаемый в изобретении терапевтический пептид, хорошо известно специалисту в данной области, прежде всего касательно диапазона их концентраций. Для удобства в качестве ссылки представлен справочникRemington: The Science and Practice of Pharmacy, 19-oe изд., 1995. Препаративные формы, содержащие предлагаемый в изобретении пептид, можно вводить парентерально путем инъекции, например, подкожно, внутрикожно или внутримышечно. Композицию, предназначенную для парентерального введения предлагаемого в изобретении пептида, можно, например, приготавливать с помощью метода, описанного в WO 03/002136. Дополнительные препаративные формы, пригодные для других путей введения, представляют собой суппозитории и в некоторых случаях формы для орального, трансбуккального, подъязычного, внутрибрюшинного, внутривагинального, анального и внутричерепного введения. Для суппозиториев традиционные связующие вещества и носители могут представлять собой, например, полиалкиленгликоли или триглицериды; такие суппозитории можно приготавливать из смесей, содержащих действующее вещество в концентрации от 0,5 до 10%, предпочтительно 12%. В препаративные формы для орального введения входят такие, например, общепринятые эксципиенты, как имеющие чистоту, пригодную для фармацевтического применения, маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и т.п. Эти композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, препаративных форм с пролонгированным высвобождением или порошков и содержат 10-95% действующего вещества, предпочтительно 25-70%. Как отмечалось выше, для контроля продолжительности действия можно применять дополнительные фармацевтические методики. Для создания препаратов с контролируемым высвобождением можно применять полимеры, предназначенные для образования комплекса или абсорбции пептида, предлагаемого в настоящем изобретении. Для осуществления контролируемого введения действующего вещества(пептида) можно выбирать соответствующие макромолекулы (например, сложные полиэфиры, полиминокислоты, поливинилпирролидон, сополимеры этилена и винилацетата, метилцеллюлозу, карбоксиметилцеллюлозу и сульфат протамина), применять соответствующую концентрацию макромолекул и методы включения. Такие сведения указаны в Remington's Pharmaceutical Sciences (см. выше). Другой возможный метод регулирования продолжительности действия с помощью препаратов с контролируемым высвобождением заключается в том, что включают пептид, предлагаемый в настоящем изобретении, в частицы полимерного материала, такого как сложные полиэфиры, полиаминокислоты, гидрогели, поли(молочная кислота) или сополимеры этилена и винилацетата. Предлагаемые в изобретении пептиды могут иметь нейтральную форму или форму соли. Пептид,предлагаемый в настоящем изобретении, может быть в достаточной степени кислым или в достаточной степени щелочным для взаимодействия с любым(ой) из многочисленных органических или неорганических оснований и органических и неорганических кислот с образованием (аддитивной) соли, например,образованной со свободными аминогруппами пептида. Обычно применяемые для образования кислотноаддитивных солей кислоты представляют собой неорганические кислоты, такие как соляная кислота,бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и т.п., и органические кислоты, такие как винная кислота, асп-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, миндальная кислота, n-бромфенилсульфоновая кислота, угольная кислота,янтарная кислота, лимонная кислота, бензойная кислота. Примерами таких солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат,формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат,гидроксибензоат, метоксибензоат, фталат, сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат,фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат. Соли, образованные со свободными карбоксильными группами, можно получать также из неорганических оснований, таких, например, как гидроксиды натрия, калия, аммония, кальция или железа(3), и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п. Кислотно-аддитивные соли, соли карбоксилатов, сложных (низш.)алкиловых эфиров и амидов предлагаемых в изобретении пептидов можно приготавливать согласно методам, описанным вWO 91/11457 (1991); ЕР 0733644 (1996) и US 5512549 (1996). Препараты, содержащие предлагаемые в изобретении пептидные последовательности, вводят путем, который соответствует дозе препарата, и в таком количестве, которое является терапевтически эффективным. Подлежащее введению количество зависит от индивидуума, подлежащего лечению, включая, например, серьезность заболевания пациента. Приемлемые диапазоны доз составляют, например,порядка нескольких сотен микрограммов действующего вещества на терапевтическую дозу, предпочтительно от примерно 0,1 до 2000 мкг (даже рассматривается применение больших количеств, составляющих 1-10 мг), например, от примерно 0,5 до 1000 мкг, предпочтительно от 1 до 500 мкг и особенно предпочтительно от примерно 10 до 100 мкг. Препараты, содержащие предлагаемые в изобретении пептиды плюс, например, дополнительные эксципиенты, например глицин и маннит, или другие добавки, могут поступать в продажу в лиофилизированной форме в пузырьках. При этом прилагается входящий в комплект пузырек с разбавителем, что позволяет пациенту восстанавливать продукт с получением требуемой концентрации перед введением- 16013796 дозы. Предлагаемые в изобретении препараты могут также поступать в продажу в виде других хорошо известных приспособлений, таких как предварительно заполненные шприцы и т.д. Ниже изобретение проиллюстрировано с помощью примеров. Примеры Пример 1. Создание генетических конструкций. Кодирующую последовательность кДНК GLP-1(7-37) получали путем синтеза, включая в последовательность сайты HincII и EcoRI, как показано на фиг. 1 а. Отдельно синтезировали кДНК, проиллюстрированную на фиг. 1 б, включая в кодирующие последовательности GLP-1(7-37) IP2 и сайты рестрикции, распознаваемые SfoI, EcoRI и XbaI, как проиллюстрировано на фиг. 1 б. Для обеспечения пути секреции GLP-1 использовали гетерологичную сигнальную последовательность стромелизина 3 (регистрационный номер NM005940). Для этой цели кДНК, кодирующую сигнальную и лидерную последовательность стромелизина, амплифицировали с использованием ПЦР с обратной транскриптазой с человеческой РНК и применяли в сочетании с конструкцией, представленной на фиг. 1 а или фиг. 1 б, для создания конструкции, представленной на фиг. 1 в и фиг. 1 г соответственно.HincII/EcoRI-фрагмент конструкции, представленной на фиг. 1 а, клонировали в сайте SfoI последовательности, представленной на фиг. 1 г, с получением конструкции, представленной на фиг. 1 д. Аналогично этому EcoRI-фрагмент конструкции, представленной на фиг. 1 г, клонировали в сайте EcoRI эукариотической экспрессионной плазмиды, получая конструкцию, представленную на фиг. 1 е. Для создания конструкции, представленной на фиг. 1 ж, HincII/XbaI-фрагмент конструкции, представленной на фиг. 1 б,повторно клонировали в сайте SfoI/XbaI конструкции, представленной на фиг. 1 г. На фиг. 1 з представлена синтезированная последовательность с оптимизированным кодоном, которая кодирует лидерную и сигнальную последовательности стромелизина, со встроенной укороченной эндогенной интронной последовательностью, слитой с последовательностями, которые кодируют человеческий GLP-1(7-37), IP2 иNO:16, а в SEQ ID NO:15 показана также последовательность транслированного пептида. Синтезировали также последовательности, представленные на фиг. 1 и и фиг. 1 к. Их затем применяли для создания конструкции, представленной на фиг. 1 л, путем клонирования NaeI/BssHII-фрагмента конструкции, представленной на фиг. 1 к, в линеаризованной с помощью NaeI/BssHII последовательности, представленной на фиг. 1 з. Последовательность ДНК конструкции, представленной на фиг. 1 л, показана в SEQ ID NO:14, а в SEQ ID NO:13 показана также последовательность транслированного пептида. Конструкцию, представленную на фиг. 1 м, получали путем расщепления с помощью BssHII и повторного встраивания путем лигирования последовательности, представленной на фиг. 1 з. Последовательность ДНК конструкции, представленной на фиг. 1 м, показана в SEQ ID NO:18, а в SEQ ID NO:17 показана также последовательность транслированного пептида. Конструкцию, представленную на фиг. 1 н, получали путем клонирования AfeI/BssHII-фрагмента последовательности, представленной на фиг. 1 и, в линеаризованной с помощью AfeI/BssHII последовательности, представленной на фиг. 1 з. Последовательность ДНК конструкции, представленной на фиг. 1 н, показана в SEQ ID NO:20, а в SEQ ID NO:19 показана также последовательность транслированного пептида. Описанные выше конструкции специалист в данной области может получать с помощью общепринятых методов. Пример 2. Трансфекция, клональная селекция и экспрессия GLP-1 в клетках млекопитающих. Источник клеток: HEK293 (линия клеток почки человеческого эмбриона,АСС 305, DSMZ коллекция клеточных культур, Германия), AtT20 (линия клеток мышиного рака гипофиза LAF1, 87021902, Европейская коллекция клеточных культур, Великобритания), клетки линии hTERT-MSC,полученные от проф. Kassem, Университетский госпиталь Оденсе (University Hospital of Odense), Дания. Для трансфекции 106 клеток использовали 0,5-2 мкг плазмидной ДНК с различными конструкциямиGLP-1. Конструкции создавали с помощью пути, описанного в примере 1. HEK293-клетки трансфектировали стандартным методом совместного осаждения фосфатом кальция, который описан в Current Protocols in Molecular Biology (Ausubel и др., 1994ff, Harvard Medical School, т.2., часть 9.1). AtT20-клетки трансфектировали с использованием технологии FuGene (фирма Roche) согласно методу, описанному вhTERT-MSC-клеток осуществляли с помощью технологии Nucleofector (фирма Amaxa), представляющей собой метод, не связанный с применением вирусов, который основан на сочетании электрических параметров и специфических для типа клеток растворов. С помощью устройства типа Nucleofector (программа С 17) и Nucleofector-раствора VPE-1001 достигали эффективности трансфекции 60%. Через 48 ч после трансфекции осуществляли отбор клеточных клонов со стабильной интегрированной в хромосому ДНК, добавляя в культуральную среду агент для селекции бластицидин (2 мкг/мл). Через 12-15 дней стабильно трансфектированные клеточные клоны можно было выделять и размножать для изучения их характеристик. Кратковременную экспрессию различных конструкций GLP-1 оценивали в клетках линии hTERT- 17013796MSC и HEK293. В то время как только незначительный уровень активного GLP-1 был обнаружен в мономерных конструкциях GLP-1103 и 317 (которые несли только одну копию GLP-1(7-37, выраженное увеличение уровня экспрессии обнаружено в димерной конструкции GLP-1217 (которая содержала GLP-1(7-37) в качестве компонента (I) и в качестве компонента (III как в hTERT-MSC-, так и вHEK293-клетках. Полученные результаты обобщены на фиг. 2. Удлинение конструкции GLP-1159(содержащей четыре копии IP2 в качестве компонента (II не приводило к дополнительному заметному повышению (данные не показаны). После трансфекции клеток линии hTERT-MSC различными конструкциями отбирали клоны, которые стабильно экспрессировали GLP-1. Уровни экспрессии представлены в табл. I. Таблица I Пример 3. Анализ методом Вестерн-блоттинга пептидов GLP-1, секретируемых из клеток млекопитающих. Супернатанты клеточных культур секретирующих GLP-1 клеток разделяли с помощью электрофореза на ПААГ с использованием 10-20%-градиента ДСН (120 В, 90 мин) и переносили на мембрану из ПВДФ (поливинилендифторид) (мембрана Immobilon-P, 0,45 мкм, Millipore IPVH 00010) путем полусухого блоттинга (2,0 мА/см 2, 60 мин). После фиксации метанолом и блокирования (3% мас./об. БСА,0,1 об.% Твин-20 в TBS) осуществляли иммуноблоттинг мембраны с использованием 1 мкг/мл антитела к GLP-1 (HYB 147-12, фирма Antibodyshop) при 4 С в течение ночи (о/n). После отмывки и инкубации с использованием 0,02 мкг/мл идентифицирующего антитела (антитело к мышиному IgG, конъюгированное с HRP (переоксидаза из хрена), фирма Perkin Elmer, PC 2855-1197) при комнатной температуре (КТ) в течение 4 ч, использовали хемилюминесцентное обнаружение для локализации белка. Данные анализа методом Вестерн-блоттинга представлены на фиг. 3 (1: 100 нг синтетического GLP1(7-37), растворенного в супернатанте подвергнутых мнимой трансфекции клеток линии hTERT-MSC, 2: супернатант клеток линии hTERT-MSC (клон 79 ТМ 217/13), секретирующих димерный GLP-1 из конструкции 217, 3: супернатант клеток линии AtT20 (клон 81-А-217/3), секретирующих димерный GLP-1 из конструкции 217; М: предварительно окрашенный белковый маркер [кДа]). Полученные результаты свидетельствуют о том, что предлагаемые в изобретении пептиды, которые содержат GLP-1(7-37) и С-концевой дополнительный фрагмент (2 и 3 на фиг. 3) секретируются из трансфектированных линий клеток и их можно выявлять с помощью антитела к GLP-1, которое связывается с расположенными внутри молекулы эпитопами GLP-1(7-37). Пример 4. Стабильность in vitro в плазме пептидов GLP-1, секретируемых из человеческих клеток. Клетки линии HEK293 и hTERT-MSC подвергали кратковременной трансфекции конструкциями,кодирующими гетерологичную сигнальную последовательность стромелизина, которую функционально связывали с вариантами GLP-1, кодирующими следующие пептиды: Супернатанты клеточных культур, содержащие пептиды GLP-1, секретируемые из клеток, или синтетический GLP-1(7-37) (фирма Bachem), инкубировали с человеческой обогащенной лимфоцитами плазмой, обладающей дипептидилпептидной активностью, при 37 С и 5% СО 2 в течение 3 или 4 ч. Синтетический GLP-1(7-37) в супернатанте подвергнутых мнимой трансфекции клеток использовали в качестве позитивного контроля DPP-IV-активности, которая, как установлено, ингибировалась добавлением ингибитора DPP-1V inhibitor ( DPP4, фирма Biotrend). Содержание активного GLP оценивали с помощью ELISA для GLP-1 (активного) ( EGLP-35K, фирма Biotrend), используя антитело, которое связывается с N-концевым эпитопом GLP-1(7-37), идентифицирующим расщепленный DPP-IV неактивный пептид GLP-1(9-37). Полученные результаты представлены на фиг. 4 (HEK293-клетки) и 5 (hTERT-MSC-клетки). Обе линии клеток HEK293 и hTERT-MSC представляли собой эффективных хозяев для генных конструкций. Нумерация вариантов 1-3 при изложении результатов, полученных для трасфектированных клеток, такая же, как и в примере 3 (1: 100 нг синтетического GLP-1(7-37), растворенного в супернатанте подвергнутых мнимой трансфекции клеток линии hTERT-MSC, 2: супернатант клеток линии hTERT-MSC (клон 79 ТМ 217/13), секретирующих димерный GLP-1 из конструкции 217, 3: супернатант клеток линииAtT20 (клон 81-А-217/3), секретирующих димерный GLP-1 из конструкции 217). В то время как кон- 18013796 струкция 1, которая продуцировала GLP-1 дикого типа, инактивировалась DPP-IV аналогично синтетическому GLP-1, предлагаемые в изобретении удлиненные на С-конце формы GLP-1 (2 и 3 на фиг. 4, 3 на фиг. 5) оказались более устойчивыми к расщеплению и сохраняли по меньшей мере 40% активности. Удлиненные на С-конце пептиды GLP-1 обладали в значительной степени повышенной стабильностью в человеческой плазме in vitro. Пептид GLP-1 с димерной последовательностью (3) оказался практически полностью стабильным в присутствии DPP-IV, не подвергаясь расщеплению in vitro. Пример 5. Анализ пептидов GLP-1 методом Вестерн блоттинга. Различные пептиды GLP-1 получали с помощью твердофазного синтеза (syn) или методом рекомбинации в E.coli (rec). Пептиды GLP-1 (31 нг SEQ ID NO:1 и 10 нг каждой из SEQ ID NO:6, SEQ ID NO:7,SEQ ID NO:8) разделяли с помощью электрофореза на ПААГ с использованием 10-20%-градиента ДСН(120 В, 90 мин) и переносили на мембрану из ПВДФ (мембрана Immobilon-P, 0,45 мкм, Millipore IPVH 00010) путем полусухого блоттинга (2,0 мА/см 2, 60 мин). После фиксации метанолом и блокирования(3% мас./об. БСА, 0,1 об.% Твин-20 в TBS) осуществляли иммуноблоттинг мембраны с использованием 1 мкг/мл антитела к GLP-1 (HYB 147-12, фирма Antibodyshop) при 4 С в течение ночи (о/п). После отмывки и инкубации с использованием 0,02 мкг/мл идентифицирующего антитела (антитело к мышиномуIgG, конъюгированное с HRP, фирма Perkin Elmer, PC 2855-1197) при КТ в течение 4 ч, использовали хемилюминесцентное обнаружение для локализации белка. На фиг. 6 показаны результаты, полученные методом Вестерн-блоттинга, для указанных пептидов. Использовали следующие обозначения: SEQ ID Пример 6. Стабильность in vitro в человеческой плазме пептидов GLP-1CM. Синтетические пептиды GLP-1 (SEQ ID NO:1syn, SEQ ID NO:6syn, SEQ ID NO:7rec, SEQ ID NO:8syn) инкубировали в концентрации 20 нг/мл с человеческой плазмой при 37 С и 5% СО 2 в течение 3 ч. Дипептидилпептидазную активность плазмы ингибировали с помощью ингибитора DPP-IV ( DPP4, фирма Biotrend). Содержание активного GLP оценивали с помощью ELISA для GLP-1 (активного) ( EGLP35K, фирма Biotrend). В отличие от нативного GLP-1(7-37) (SEQ ID NO:1) предлагаемые в изобретении удлиненные на Сконце пептиды GLP-1, последовательность которых представлена в SEQ ID NO:6, SEQ ID NO:7 и SEQ IDNO:8, обладали в значительной степени повышенной стабильностью в человеческой плазме in vitro(фиг. 7). В качестве контроля (справа) представлены результаты, полученные в экспериментах с добавлением DPP-IV. В этих контрольных экспериментах активность GLP-1 полностью сохранялась. Пример 7. Биологические исследования in vitro. Производство циклического АМФ. Клетки линии RIN-5F (опухолевые крысиные островковые клетки; ЕСАСС No. 95090402) выращивали в 24-луночных планшетах в течение 4 дней до достижения 70% конфлюэнтности. Клетки промывали дважды средой DMEM (Е 15-009, фирма РАА) перед добавлением 0,5 мл среды DMEM (E15-009,фирма РАА), дополненной 1% HSA (человеческий сывороточный альбумин (фирма Aventis, 0,2 мМIBMX (858455, фирма Sigma) и тестируемых пептидов. После инкубации в течение 20 мин при 25 С клетки дважды промывали охлажденным на льду ЗФР. Клеточный цАМФ экстрагировали, добавляя 0,1 н.HCl, содержащую 0,5% Тритон Х-100. Циклический АМФ оценивали количественно с помощью набора для иммуноферментного анализа (ИФА) цАМФ (низкое значение pH) (каталожный номер DE0355, фирма RD). Для стимуляции использовали 310-8 М SEQ ID NO:1, SEQ ID NO:6syn, SEQ ID NO:6rec, SEQ IDNO:7rec, SEQ ID NO:8syn. Полученные результаты представлены на фиг. 8. 100% производство цАМФ соответствует основному уровню производства в отсутствии GLP-1. GLP-1 связывается со сшитыми с белком G рецепторами и стимулирует производство цАМФ. Все изученные молекулы повышали производство клеточного цАМФ. Пример 8. Биологический анализ in vivo. Страдающих диабетом типа II 11-недельных мышей (C57BL/Ks-Leprdb/db, фирма Harlan) обрабатывали 5 мкг пептида путем подкожной инъекции дважды в день в 9 ч утра и 5 ч вечера (n=5 особей на группу). Оценивали уровень глюкозы в крови до (день 0) и после обработки пептидами GLPCM (день 2, 4,7, 10) в 10 утра после голодания в течение ночи. Данные представлены относительно уровней глюкозы в крови, которые были определены в день 0.SEQ ID NO:7 (синтетическая или рекомбинантная обладали антигипергликемическим действием. Самые хорошие результаты получали при использовании рекомбинантной последовательности SEQ IDNO:6 (СМ 1) и синтетической последовательности SEQ ID NO:8 (СМ 3). На фиг. 9 (у-ось) показано относительное воздействие обработки. Уровень глюкозы в крови в день 0 принимали за 1. У необработанных животных обнаружено постоянное увеличение уровня глюкозы в крови с течением времени, а у животных, обработанных предлагаемыми в изобретении пептидами, в целом (grosso modo) выявлено постоянное снижение уровней глюкозы в крови с течением времени. Пример 9. Оценка стабильности в плазме in vitro пептидов GLP1 (метод изучения кинетики). Инкубировали с 10% человеческой плазмы в буфере для инкубации (50 мМ триэтаноламин-HCl(pH 7,8), 0,2% HSA) аликвоты по 1 мкМ следующих пептидов: СМ 3, замещенные аланином аналоги СМ 3(СМ 3-ANA01, CM3-ANA02, CM3-ANA03, CM3-ANA04), укороченные на С-конце аналоги СМ 3 (СМ 3ANA06, CM3-ANA07) или удлиненные на С-конце аналоги СМ 3 (CM3-ANA09), при 37 С и 5% СО 2 в течение 0, 3, 6 и 9 ч. Дипептидилпептидазную активность ингибировали, добавляя ингибитор DPPIV( DPP, фирма Biotrend) и уровень активного GLP-1 определяли с помощью ELISA для GLP-1 (активного) ( EGLP-35K, фирма Linco). Результаты получали в трех повторностях по меньшей мере в двух независимых экспериментах. Предлагаемые в изобретении пептиды, включающие по меньшей мере девять аминокислот, добавленных к С-концу GLP-1, представляют собой СМ 3 (мышиный, GLP-1(7-37)-IP2) и их производные с модифицированными последовательностями, входящими в компонент (II) (IP2), т.е. СМ 3-ANA01, CM3ANA01, CM3-ANA02, CM3-ANA03, CM3-ANA04, CM3-ANA05, СМ 3-ANA07, CM3-ANA07. ПептидыGLP-1 и CM3-ANA06 использовали в качестве контрольных или референс-субстанций. На фиг. 10 представлены данные об уровне активности GLP-1 в виде % от уровня, полученного в момент начала эксперимента (0 ч) (0 ч=100%). Ясно видно, что GLP-1 обладал очень низкой стабильностью в плазме, через 9 ч после обработки в плазме сохранялось только 9% активности. Для CM3-ANA01 обнаружена наиболее высокая стабильность, при этом 84% продукта сохранялось через 9 ч. Активность предлагаемых в изобретении пептидов сохранялась на уровне по меньшей мере 30% через 9 ч, в то время как для пептидов с более короткими удлинениями этот показатель не достигался. Исходя из данных о кинетике изучаемой субстанции, можно определять время, необходимое для расщепления до 80% активного GLP-1 относительно значения, полученного в 0 ч (DT80: время расщепления 80%). Перечень последовательностей, перечисленных в порядке увеличения значений DT80 Предлагаемые в изобретении субстанции обладают существенно более продолжительной стабильностью in vitro в плазме по сравнению с референс-субстанциями. Не вдаваясь в какую-либо теорию,можно предположить, что удлинение С-конца GLP-1 вносит стерические помехи, препятствующие проникновению активного сайта DPP-IV в указанные аналоги, что и позволяет им избегать расщепления, в то время как у более коротких референс-субстанций не обнаружено это защитное действие, обусловливающее стабильность GLP-1. Эта гипотеза подтверждается постоянно возрастающей стабильностью по мере увеличения длины С-концевых удлинений пептидов CM3-ANA06 (36 ак), СМ 3-ANA07 (40 ак) и СМ 3 (46 ак). Однако это явление зависит не только от количества аминокислот, что показано при заменах на аланин в IP2-области СМ 3. Пептид CM3-ANA03, имеющий такое же количество аминокислот, что и СМ 3, обладал существенно более низкой стабильностью, чем СМ 3. С другой стороны, СМ 3-ANA01,который также состоит из 46 аминокислот, обладал более высокой стабильностью в плазме, чем СМ 3. Эти данные могут свидетельствовать о том, что помимо количества аминокислот, на стабильность могут влиять стерические эффекты. Наиболее предпочтительными являются пептиды, которые несут удлинение, содержащее IP2, на С-конце GLP-1 или удлинение, обладающее определенной степенью гомологи сIP2, что может являться результатом специфической конформации, препятствующей проникновению вN-концевую область активного сайта DPP-IV. Пример 10. Исследование in vivo - иммуногенность. Для решения вопроса о наличии потенциальной иммуногенности изученной субстанции СМ 1 осуществляли опыты на мышах на фирме Parabioscience (Гронинген, Германия). Исследование осуществляли на мышах линии BALB/c, которым вводили 5 повторных инъекций (70 мкг пептида/дозу, i.v.) в течение 22 дней (n=5). Установлено, что CM1syn не обладал токсичностью и индуцировал лишь минимальный Т-клеточный гуморальный иммунный ответ и титр антител, что показано на приведенном ниже чертеже. Нельзя исключать иммунологическое действие побочных продуктов (чистота пептида составляла лишь 95%). На фиг. 11 представлены результаты исследований по оценке потенциальных иммуногенных эффектов пептида CM1syn. На левой стороне (фиг. 11 А) показаны результаты оценки Т-клеточного вторичного иммунного ответа. Эксплантировали селезенку обработанных и контрольных мышей, выделяли Т-клетки и стимулировали возрастающими количествами антигена. Оценивали пролиферативный вторичный иммунный ответ. На правой стороне (фиг. 11 Б) представлены результаты определения титра антигенспецифического антитела подтипа IgG в иммунной сыворотке животных. Пример 11. Оценка зависимости эффективности от дозы на больных диабетом мышах. После голодания в течение 2 ч болеющих диабетом мышей линии C57BL/KsJRj-db (db/db) обрабатывали GLP-1, CM1, СМ 3, СМ 3-ANA01 и эксендином-4 в пяти различных концентрациях. Шестую группу обрабатывали только физиологическим раствором. Обрабатывали по 7 животных на группу. Уровень глюкозы в крови определяли после взятия крови из хвостовой вены непосредственно до инъекции, через 1 и 4 ч после инъекции. Результаты в виде кривых зависимости ответа от дозы представлены на фиг. 12 (фиг. 12 А (GLP-1),фиг. 12 Б (СМ 1), фиг. 12 В (СМ 3) и фиг. 12 Г (СМ 3-ANA01. Для каждой изучаемой субстанции строили график, характеризующий изменение в процентах уровня глюкозы в крови относительно исходного значения при использовании различных концентраций. Определяли значение ED50 для различных изученных субстанций из кривых зависимости ответа от дозы, при этом оценивали значения через 1 ч в виде снижения уровня глюкозы в процентах по сравнению с исходным уровнем. Для определения значенияED50 для GLP-1, СМ 3-ANA01, СМ 3rec и эксендина 4 применяли модель Моргана-Меркера-Флодина (Morgan-Mercer-Flodin) (MMF), для СМ 1 применяли модель Ричардса (Richards). Обе модели представляют собой модели на основе аппроксимации сигмовидной зависимостью, которые можно применять для оценки зависимости ответа от дозы. Для каждого пептида определяли значения ED50 для уровня глюкозы в плазме (однократная s.с.-доза в мкг/мышь), исходя из процента снижения уровня глюкозы в крови. Эти данные обобщены в табл. 1. Таблица 1 Исходя из значений ED50, можно считать, что аналоги GLP-1 CM1, СМ 3 и СМ 3-ANA01 обладают более чем в 20 раз более высокой биологической активностью in vivo, что наиболее вероятно является результатом повышенной стабильности в плазме. Все изученные пептиды приводили к значительному снижению уровней глюкозы в крови у больных гипергликемией мышей линии db/db, по меньшей мере, в наиболее высоких концентрациях. Данные о снижении уровней глюкозы в плазме после однократной s.с.-инъекции 1,1-3,0 нмоль пептида (относительно контроля) обобщены в табл. 2. В табл. 2 представлены данные о понижающем уровень глюкозы действии тестируемых субстанций (относительно контроля). Данные о снижении уровня глюкозы в плазме и соответствующих уровнях значимости представлены для периода времени, составляющего 1 ч(1 ч) и 4 ч (4 ч) после инъекции пептида. Обнаружены различия в длительной эффективности пептидов. Только эксендин-4 и СМ 3 обладали способностью значительно снижать уровни глюкозы в крови через 4 ч. Пример 12. Продолжительное лечение мышей линии db/db. Исследовали 4 группы, n=12, мышей линии C57BL/KsJRj-db (db/db): группа А - обработка наполнителем (0,9% физиологический раствор), один раз в день,группа Б - обработка 24 нмоль/кг тестируемого соединения 1: т.е. CM1rec, один раз в день,группа В - обработка 24 нмоль/кг тестируемого соединения 2: т.е. СМ 3-ANA01, один раз в день,группа Г - обработка 24 нмоль/кг референс-субстанции эксендин-4 (известное и разрешенное к применению в данной области соединение (однако эксендин-4 не является аналогом GLP-1, один раз в день. Пептиды или наполнитель вводили один раз в день (группы А-Г) в период времени между 2-3 ч дня подкожно в кожную складку спины. Продолжительность обработки составляла 18 недель. В период времени с 12 по 18 неделю 6 из 12 животных в группе обрабатывали дважды в день. У мышей исследовали различные параметры, т.е. такие как состояние здоровья (1), вес тела (2), потребление корма (3), уровень глюкозы в крови (4), проба на переносимость глюкозы (5), данные об уровне инсулина (6), уровень гликозилированного гемоглобина (7), патология (8) и рестимуляция Т-клеток(9). Состояние здоровья (1) оказалось хорошим во всех группах, никаких побочных действий лечения не обнаружено. Вес тела (2) был более низким во всех обработанных группах после лечения в течение 18 недель(фиг. 13). Относительное прибавление веса тела оказалось существенно пониженным в группе, обработанной CM3-ANA01. На фиг. 13 А показано воздействие обработки физиологическим раствором (А),СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г) на вес тела мышей линии db/db. Представлены средние значения для 12 животных в группе. На фиг. 13 Б показано воздействие обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г) на вес тела мышей линии db/db. Представлены данные об относительном прибавлении веса 12 мышей в группе после обработки в течение 122 дней. Только обработка тестируемой субстанций CM3-ANA01 (группа Б) привела к существенному снижению прибавления веса (р 0,001). Потребление корма (3) оказалось существенно пониженным в группе, обработанной СМ 1 и CM3ANA01, по сравнению с контролем. На фиг. 14 показано воздействие обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г) на еженедельное потребление корма мышами линии db/db в течение 122-дневного периода обработки. Относительное потребление корма одной мышью оказалось существенно пониженным в группе Б и В (р 0,001). Уровни глюкозы в крови (4) определяли в различных опытах. Данные об уровне глюкозы в крови не натощак (через 1 ч после инъекции пептида) представлены на фиг. 15 А, т.е. воздействие обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г) на уровни глюкозы в крови не натощак. Для определения уровня глюкозы брали кровь из хвостовой вены через 1 ч после s.c.инъекции физиологического раствора (А) или пептидов СМ 1 (Б), CM3-ANA01 (В) или эксендина (Г) в концентрации 24 нмоль/кг. По сравнению с контролем уровень глюкозы в крови не натощак через 1 ч после s.с.-инъекции пептида снижался на 55% в группе Б, 51% в группе В и 60% в группе Г (фиг. 15 Б). Снижение уровней глюкозы в крови в обработанных группах оказалось достоверным с высоким уровнем значимости (р 0,0001). Данные об уровне глюкозы в крови натощак (через 8 ч после инъекции пептида) представлены на фиг. 15 В, т.е. воздействие обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г) на уровни глюкозы в крови натощак. Для определения уровня глюкозы брали кровь из хвостовой вены после 12-часового периода голодания в течение ночи через 18 ч после s.c.-инъекции тестируемых субстанций. Уровни глюкозы в крови натощак снижались в СМ 1- и CM3-ANA01-группах.I.p.-пробу на переносимость глюкозы (5) (IPGTT) осуществляли через 8 недель после обработки мышей в группах А-Г. Исходный (основной) уровень глюкозы в крови (0 мин) у голодавших в течение- 22013796 12 ч животных определяли путем взятия крови из хвостовой вены после s.c.-инъекции тестируемой субстанции и i.р.-инъекции 20%-ного раствора глюкозы (1 г глюкозы на кг). Уровень глюкозы в крови определяли также через 15, 30, 45, 60, 90 и 120 мин после инъекции глюкозы. Во всех обработанных группах обнаружена существенная нормализации переносимости глюкозы (фиг. 16 А). На фиг. 16 А представлены данные об абсолютных уровнях глюкозы в крови во время проведения i.p.-пробы на переносимость глюкозы (IPGTT) через 8 недель после обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01(В) или эксендином (Г) (средние значения для каждой группы (n=12. Другое представление данных, приведенных на фиг. 16 А, касающихся пробы на переносимость глюкозы, дано на фиг. 16 Б. На фиг. 16 Б представлены относительные уровни глюкозы в крови при осуществлении i.p.-пробы на толерантность к глюкозе (IPGTT) через 8 недель после обработки физиологическим раствором (А), СМ 1 (Б), CM3-ANA01 (В) или эксендином (Г), стандартизованные относительно исходного уровня глюкозы в крови (100%). Уровни инсулина (6) определяли у мышей после их 12-часового периода голодания в течение ночи. После обработки в течение 18 недель в организме всех мышей в опытных группах продуцировалось существенно больше инсулина, чем в необработанной контрольной группе. На фиг. 17 представлены данные об уровнях инсулина в сыворотке мышей после 18-недельной обработки 0,9%-ным физиологическим раствором (группа А), пептидом СМ 1 (группа Б), пептидом CM3-ANA01 (группа В) или эксендином-4 (группа Г). Непосредственно после взятия образов крови их обрабатывали смесью протеазных ингибиторов для того, чтобы избежать расщепления инсулина. Анализировали уровень инсулина в сыворотке с помощью набора Insulin Mouse Ultrasensitive ELISA (каталожный номер EIA-3440, фирма DRG). Достоверность различий определяли с помощью t-критерия Стьюднта. Гликозилированный гемоглобин (7) образуется в результате избытка в плазме глюкозы, связывающейся с гемоглобином в эритроцитах (RBC). Поскольку продолжительность жизни RBC составляет 120 дней, оценка гликозилированного гемоглобина является показателем долговременного контроля глюкозы и рассматривается как более надежный показатель, чем уровень глюкозы в крови. Получали образцы цельной крови из заглазничного синуса и анализировали с помощью набора Enzymatic HbA1c Test Kit( DZ121 А, фирма Diazyme) для определения уровней гликозилированного гемоглобина. Рассматривая в качестве параметра уровень гликозилированного гемоглобина, обнаружено существенное снижение его повышения во всех обработанных группах. На фиг. 18 А показано относительное повышение уровня гликозилированного гемоглобина (GHb) в образцах цельной крови через 6, 12 и 18 недель после обработки физиологическим раствором (А), СМ 1(Б), СМ 3-ANA01 (В) или эксендином (Г). На фиг. 18 Б показано относительное повышение уровня гликозилированного гемоглобина (GHb) в образцах цельной крови через 18 недель после обработки физиологическим раствором (А), СМ 1 (Б), СМ 3-ANA01 (В) или эксендином (Г). Результаты представлены в виде среднего значений для всех животной в каждой группе (n=12). Повышение уровня гликозилированного гемоглобина во всех обработанных группах оказалось существенно ниже, чем в контроле. Оценивали патологию (8) мышей. По данным аутопсии не обнаружено различий в органах в группах обработанных и необработанных животных (группа А) за исключением объема поджелудочных желез. Определяли массу поджелудочных желез и установлено ее существенное увеличение во всех обработанных группах. На фиг. 19 представлены данные о массе поджелудочных желез в день умерщвления животных после 18-недельной обработки 0,9%-ным физиологическим раствором (группа А, n=11), пептидом СМ 1 (группа Б, n=12), пептидом CM3-ANA01 (группа В, n=12) или эксендином-4 (группа Г, n=12). Для оценки потенциальных иммунологических действий тестируемых субстанций оценивали типIV иммуногенности (9) с помощью вторичной стимуляции Т-клеток. Для этой цели вырезали селезенку у 8 животных в каждой группе, выделяли Т-клетки и повторно стимулировали различными концентрациями соответствующей тестируемой субстанции. По сравнению с необработанными контрольными животными не обнаружено существенного повышения пролиферации повторно стимулированных пептидом Тклеток. На фиг. 20 показаны полученные in vitro данные о вторичном иммунном ответе клеток селезенки на обработку различными концентрациями тестируемых субстанций СМ 1 (фиг. 20 А) и CM3-ANA01(фиг. 20 Б) и референс-субстанции эксендина-4 (фиг. 20 В). С помощью нерадиоактивного метода анализа клеточной пролиферации (Cell Proliferation ELISA, BrdU (5-бромдезоксиуридин), хемилюминесцентный анализ) оценивали in vitro вторичный иммунный ответ клеток селезенки мышей из групп А-Г на обработку 3-кратными разбавлениями тестируемых субстанций СМ 1 и CM3-ANA01 и референс-субстанции эксендина-4, начиная с концентрации 50 мкг/мл, в трех повторностях для каждой мыши. Индекс стимуляции (SI) рассчитывали как отношение уровня ответа в присутствии соответствующего пептида к уровню ответа в отсутствии пептидов. Представлены средние значениясреднеквадратические отклонения,полученные для соответствующей обработанной группы и контрольной группы (группа А: n=3, группа Б:n=6, группа В: n=7, группа Г: n=6). При расчете средних значений анализировали только мышей, у которых величина SI превышала более чем в 6,5 величину, полученную в позитивных контрольных культурах, обработанных 5 мкг/мл Con А (конканавалин А). Продолжительное исследование с использованием больных диабетом мышей дополнительно подтвердило эффективность предлагаемых в изобретении удлиненных на С-конце пептидов. При оценке- 23013796 всех изученных параметров (вес тела, потребление корма, уровень глюкозы в крови, уровень гликозилированного гемоглобина, переносимость глюкозы, секреция инсулина, масса поджелудочных желез) для удлиненных на С-конце пептидов выявлено заметное терапевтического действие. С учетом гомологии удлиненных на С-конце CellMed-пептидов с эндогенной последовательностью, установлено, что указанные предлагаемые в изобретении пептиды обладают преимуществом с позиций иммуногенности по сравнению с имеющим происхождения из организмов, не относящихся к млекопитающим, эксендином-4. Данные, полученные в опыте по оценке иммуногенности на мышах, подтверждают отсутствие клинически значимой иммуногенности пептида СМ 1. Перечень последовательностей(i) GLP-1(7-37) SEQ ID NO:1 или функциональную последовательность, обладающую функциональной активностью GLP-1, как инкретинового гормона, а именно его антиапопатическим действием или его нейротрофическими свойствами, и имеющую последовательность, по меньшей мере на 80% идентичную GLP-1(7-37),(ii) модифицированный пептид GLP-1, включающий аминокислотную последовательность формулы IIXaa35 обозначает Gly или Aib; Хаа 36 обозначает Arg, Gly, или Lys, или амид или отсутствует; Хаа 37 обозначает Gly, Ala, Glu, Pro, Lys, амид или отсутствует,и в качестве компонента (II) С-концевую пептидную последовательность, состоящую по меньшей мере из 9 аминокислот и содержащую последовательность согласно SEQ ID NO:22 (RRDFPEEVAI) или последовательность, имеющую по меньшей мере 80% идентичность SEQ ID NO:22, и удостаивающую слитый пептид лучшей устойчивостью к инактивации с помощью DPP-IV, причем N-терминальная последовательность слитого пептида является компонентом (I) как таковым или сигнальной пептидной последовательностью, слитой с помощью последовательности, которая расщепляется протеазой, с Nтерминальной последовательностью компонента (I), или сигнальным пептидом, слитым без помощи расщепляемой протеазой последовательности между ними с N-терминальным компонентом (I), или лидерной последовательностью, слитой с помощью последовательности, которая расщепляется протеазой сN-терминальным компонентом (I) и является гетерологичной по отношению к препроглюкагону. 2. Слитый пептид по п.1, где компонент (I) является модифицированным GLP-1, включающим аминокислотную последовательность формулы IIIXaa35 обозначает Gly или Aib; Хаа 36 обозначает Arg или Lys, амид или отсутствует; Хаа 37 обозначает Gly, Ala, Glu или Lys, амид или отсутствует. 3. Слитый пептид по п.1, где компонент (I) является GLP-1(7-35) или GLP-1(7-36). 4. Слитый пептид по любому из пп.1-3, в котором компонент (II) представляет собой пептидную последовательность, которая содержит последовательность, выбранную из SEQ ID NO:23(RRDFPEEVAIVEEL) или SEQ ID NO:24 (RRDFPEEVAIAEEL), или последовательность, идентичную по меньшей мере на 80% последовательности, представленной SEQ ID NO:23 или 24. 5. Слитый пептид по одному из предыдущих пп.1-4, в котором компонент (II) представляет собой пептидную последовательность, которая содержит последовательность, выбранную из SEQ ID NO:2(RRDFPEEVAIVEELG) или SEQ ID NO:3 (RRDFPEEVAIAEELG), или последовательность, идентичную по меньшей мере на 80% любой последовательности, представленной в SEQ ID NO:2 или 3. 6. Слитый пептид по одному из предыдущих пп.1-5, в котором компонент (I) и компонент (II) связаны непосредственно или связаны через линкерную последовательность. 7. Слитый пептид по п.6, в котором последовательность состоит из 1-10 аминокислот.
МПК / Метки
МПК: C07K 19/00, C07K 14/605
Метки: слитые, glp-1, содержащие, устойчивостью, пептид-1, пептидазам, повышенной, полипептиды, глюкагон-подобный
Код ссылки
<a href="https://eas.patents.su/30-13796-slitye-polipeptidy-soderzhashhie-glp-1-glyukagon-podobnyjj-peptid-1-s-povyshennojj-ustojjchivostyu-k-peptidazam.html" rel="bookmark" title="База патентов Евразийского Союза">Слитые полипептиды, содержащие glp-1 (глюкагон-подобный пептид-1), с повышенной устойчивостью к пептидазам</a>
Предыдущий патент: Производные индола и их применение
Следующий патент: Способ получения амидов и сложных эфиров пиридинкарбоновой кислоты
Случайный патент: Способ получения найлона-6