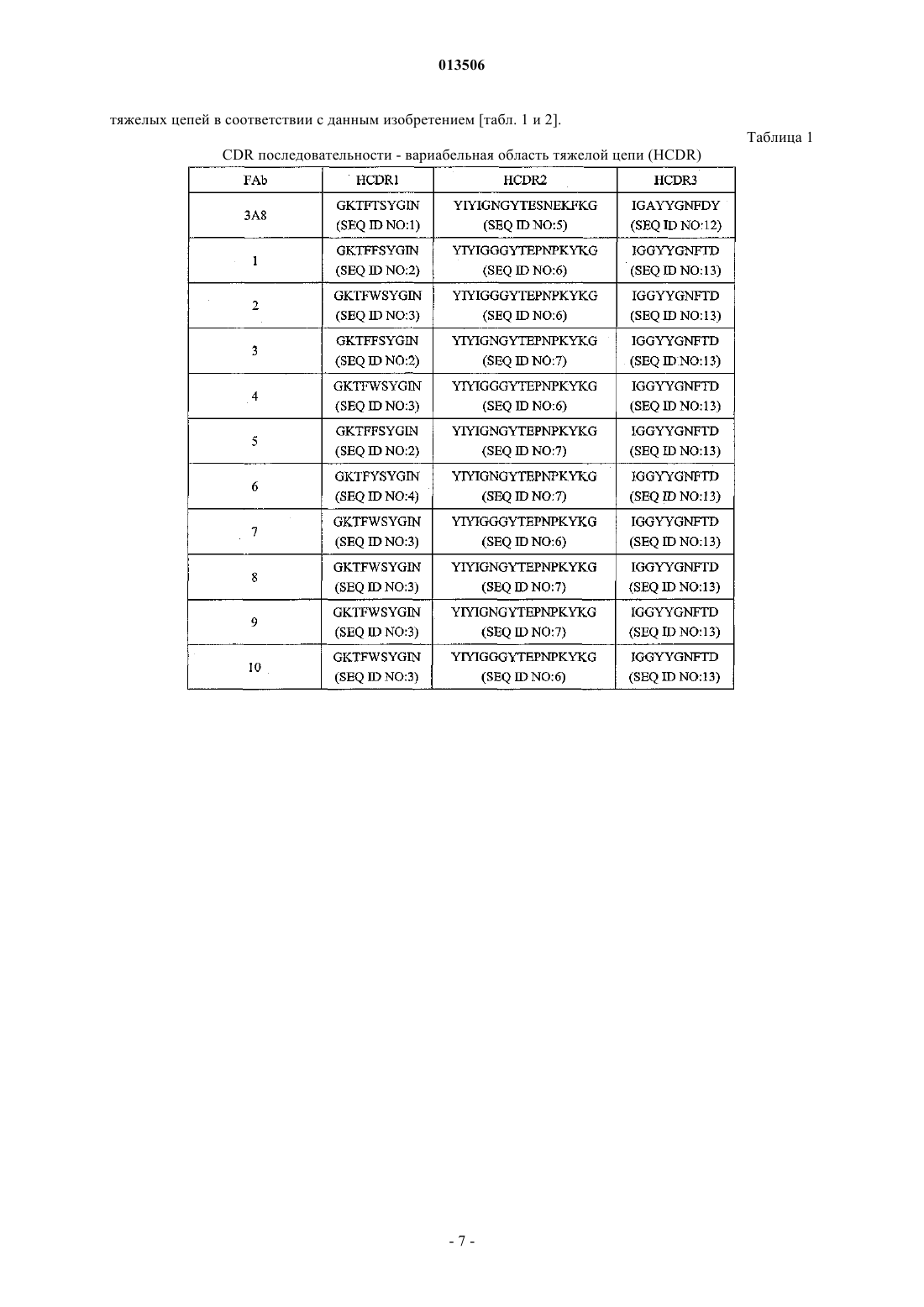
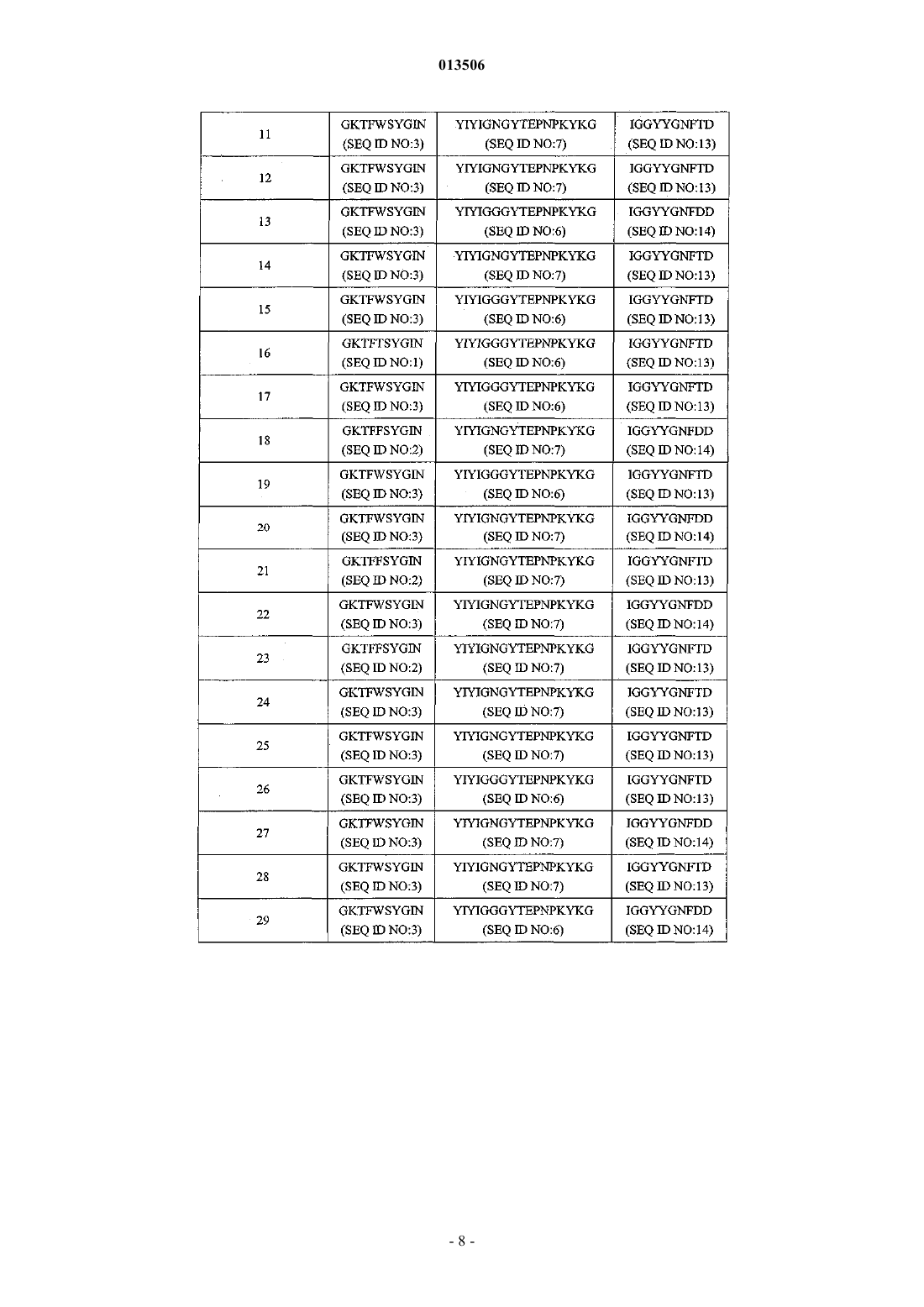
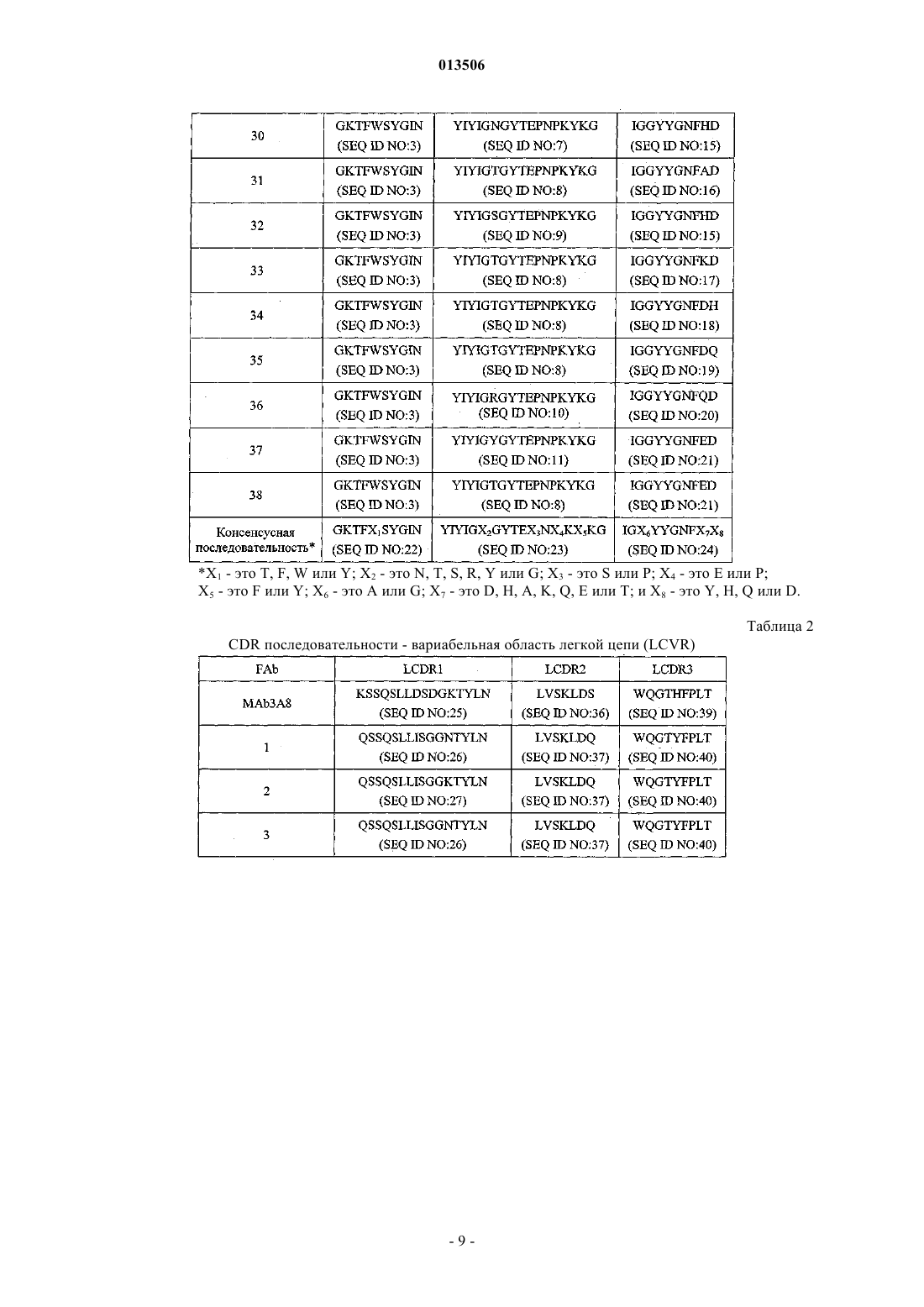
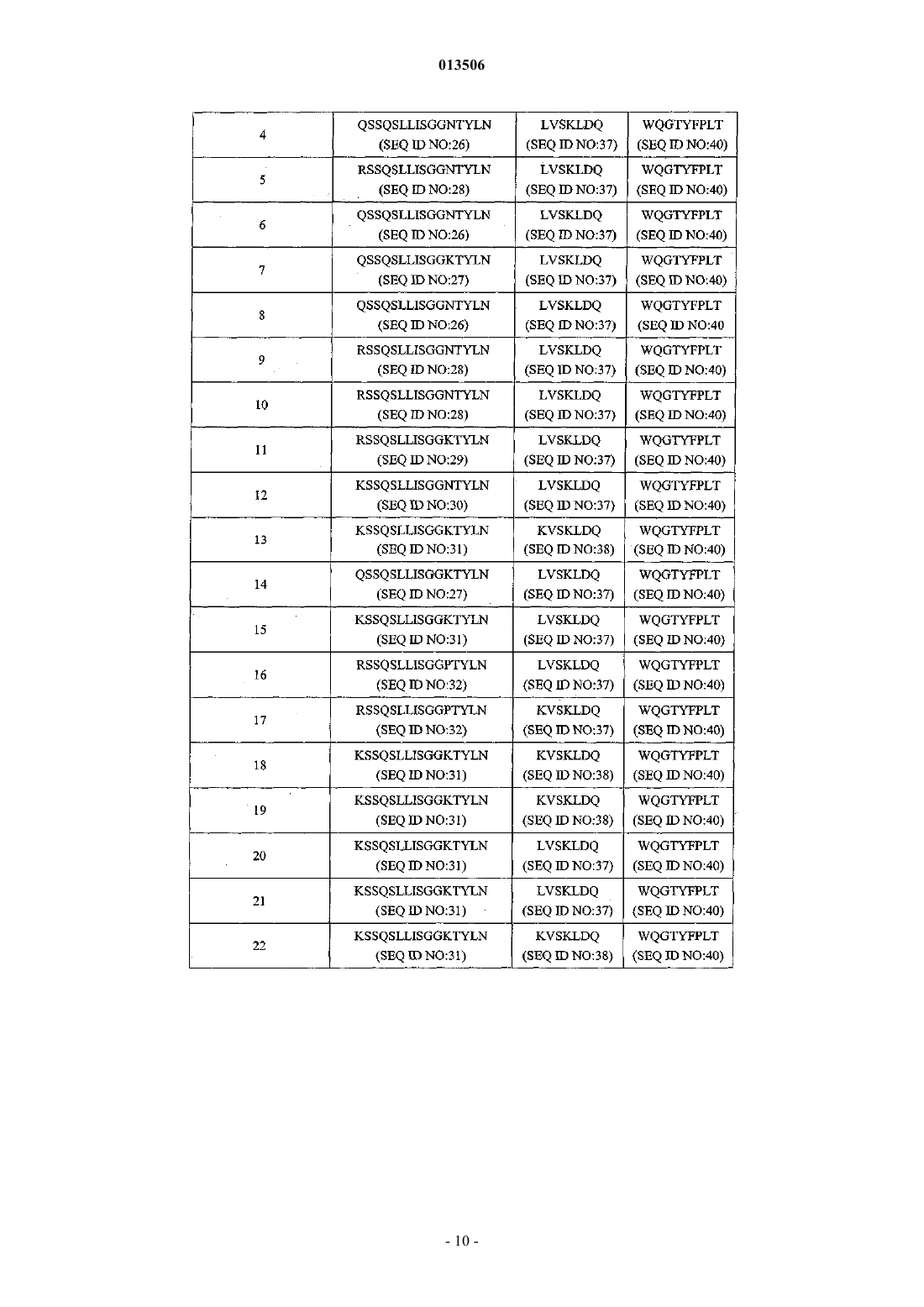
Антитело к il-23 и его применение
Номер патента: 13506
Опубликовано: 30.06.2010
Авторы: Брайт Стюарт Уиллис, Бидлер Кэтрин Бротигэм, Дикинсон Крейг Дуэйн, Маркис Дэвид Мэттью, Вассеро Ален Филипп, Кикли Кристин Кей
Формула / Реферат
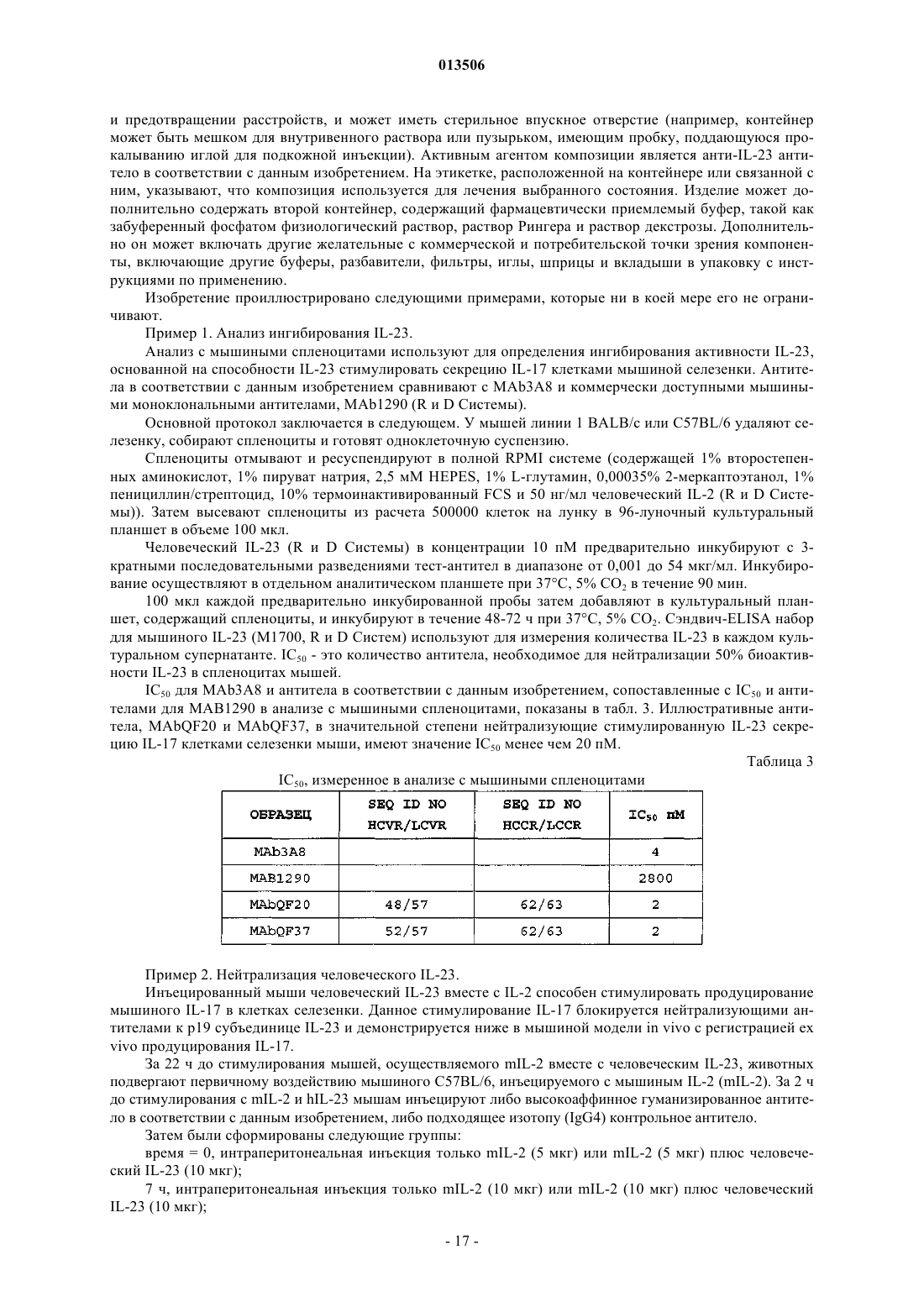
1. Антитело или его антигенсвязывающая часть, которые специфически связываются с р19 субъединицей IL-23 между аминокислотными остатками 129-159 аминокислотной последовательности SEQ ID NO:60, нейтрализуют активность IL-23, имеют KD, составляющую от приблизительно 45 до приблизительно 160 пМ, и имеют IC50, составляющий от приблизительно 1 до приблизительно 20 пМ.
2. Антитело или его антигенсвязывающая часть по п.1, которые являются гуманизированным антителом.
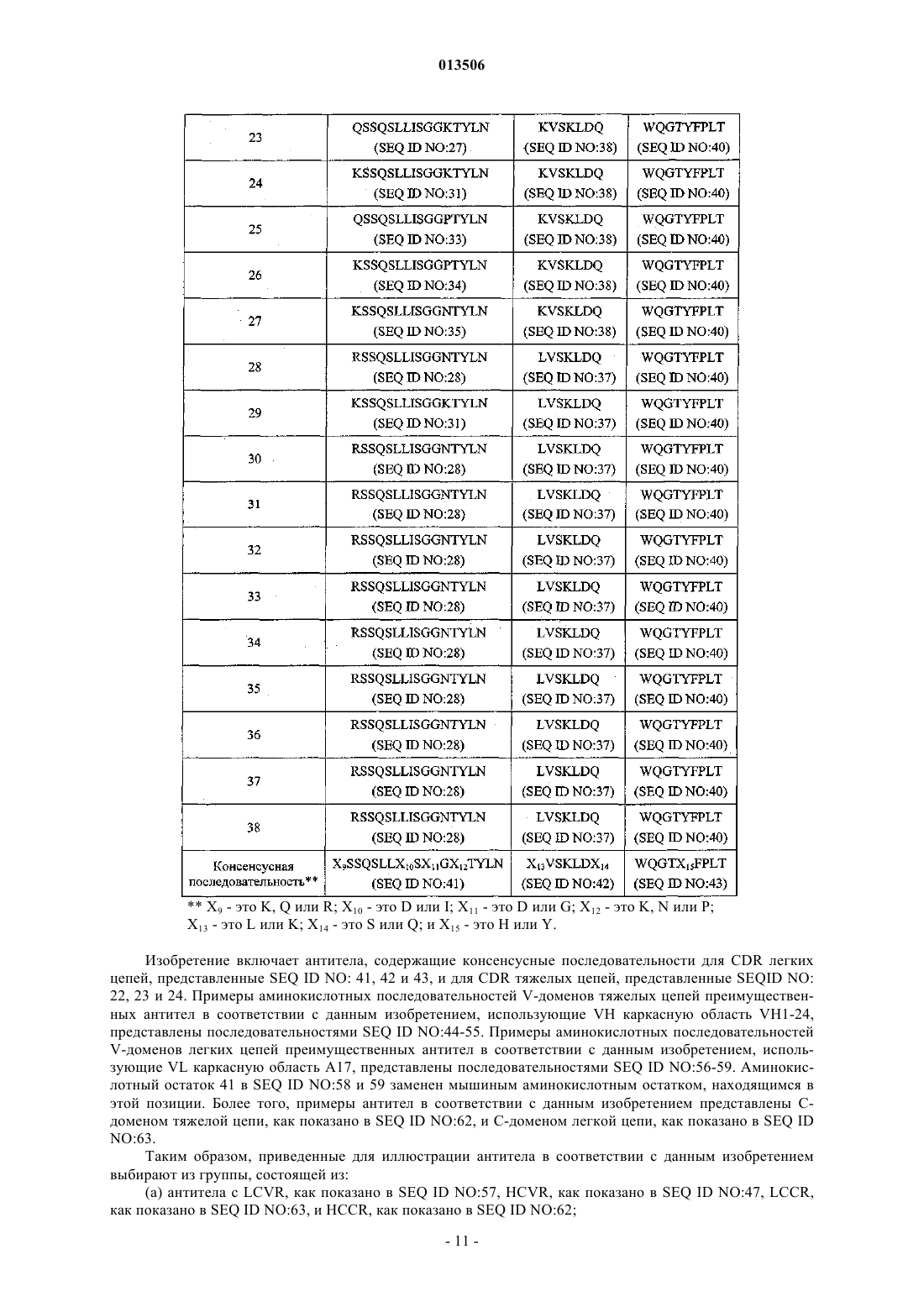
3. Антитело или его антигенсвязывающая часть по любому из пп.1-2, содержащие вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:44-55, и вариабельную область легкой цепи, выбранную из группы, состоящей из SEQ ID NO:56-59.
4. Антитело или его антигенсвязывающая часть по любому из пп.1-3, где тяжелая цепь антитела имеет константную область, выбранную из группы, состоящей из константных областей тяжелых цепей человеческих IgG1, IgG2, IgG3и IgG4.
5. Антитело или его антигенсвязывающая часть по п.3, содержащие вариабельную область тяжелой цепи SEQ ID NO:52 и вариабельную область легкой цепи SEQ ID NO:57.
6. Антитело по п.5, где тяжелая цепь антитела имеет константную область SEQ ID NO:62 и легкая цепь антитела имеет константную область SEQ ID NO:63.
7. Фармацевтическая композиция, содержащая:
(a) антитело или его антигенсвязывающую часть по любому из пп.1-6 и
(b) приемлемый фармацевтический носитель.
8. Способ лечения рецидивирующе-ремитирующего рассеянного склероза у больного, нуждающегося в таком лечении, включающий введение указанному больному эффективного количества антитела или его антигенсвязывающей части по любому из пп.1-6.
9. Применение антитела или его антигенсвязывающей части по любому из пп.1-6 для изготовления медикамента для лечения больного с рецидивирующе-ремитирующим рассеянным склерозом.
Текст
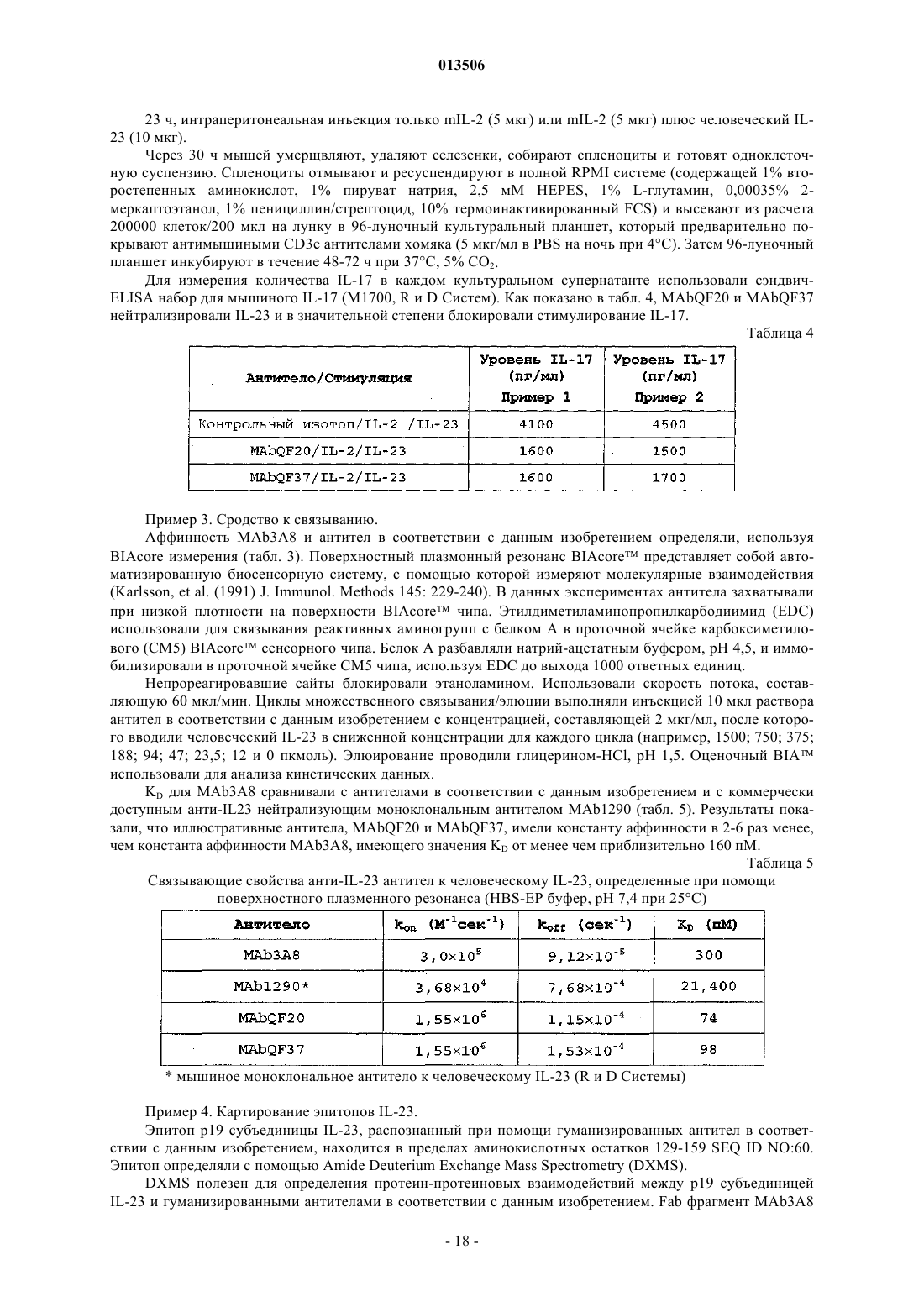
013506 Область техники, к которой относится изобретение Данное изобретение относится к области медицины, в частности к моноклональным антителам к интерлейкину 23 (IL-23). Более конкретно изобретение относится к нейтрализующим анти-IL-23 моноклональным антителам для лечения аутоиммунных заболеваний. Предпосылки создания изобретения Считается, что цитокин IL-23 является важным для активации ряда воспалительных клеток, что является необходимым для индуцирования хронического воспаления. IL-23 имеет отдельную, но комплиментарную функцию в отношении IL-12, гетеродимерному цитокину массой 70 кДа, состоящему из ковалентно связанных субъединиц р 40 и р 35. IL-23 состоит из той же субъединицы р 40, что и IL-12, но ковалентно спаренной с р 19 субъединицей (Langrish et al., Immunological Reviews 202:96-105, 2004). Дополнительно IL-23 задействован во вторичном иммунном ответе Т-клеток на патоген путем стимулирования секреции прововоспалительного цитокина IL-17 из активированных Т-клеток. Имеется все больше свидетельств того, что высокие уровни IL-17 ассоциированы с аутоиммунными, воспалительными заболеваниями, включая ревматоидный артрит, псориаз и рассеянный склероз (Aggarwal et al., J. Biol.Chem 278(3):1910-1914, 2003). Следовательно, нейтрализующее антитело к IL-23 будет ингибировать секрецию и прововоспалительные эффекты IL-17 и, в конечном счете, влияние IL-17 на воспалительные заболевания. Несмотря на то, что об антителах к человеческому IL-23 сообщалось ранее, высокая аффинность нейтрализующих антител к человеческому IL-23, распознающих специфический эпитоп на р 19 субъединице, не была раскрыта. Вне сомнения, имеется потребность в модифицированных применительно к заболеванию терапиях для лечения аутоиммунной болезни. Соответственно, имеется потребность в высокоаффином нейтрализующем антителе, которое специфически связывает р 19 субъединицу IL-23 и, таким образом, блокирует прововоспалительную активность IL-17, которое можно использовать в качестве терапевтического агента. Высокоафинное антитело,которое специфически связывает р 19 субъединицу IL-23, также желательно, так как может позволить вводить антитело больному подкожно, а не внутривенно. Также имеется потребность в антителе, которое специфически связывает р 19 субъединицу IL-23 с низким значением IC50 в анализе ингибирования IL-23, для того, чтобы создать терапевтическое анти-IL23 антитело с минимальной эффективной терапевтической дозой. Данное изобретение удовлетворяет эти потребности и обеспечивает связанные с ними преимущества, тем самым обеспечивая успешное лечение аутоиммунного заболевания. Краткое описание сущности изобретения Воплощением в соответствии с данным изобретением является антитело или его антигенсвязывающая часть, которые специфически связываются с р 19 субъединицей IL-23 между аминокислотными остатками 129-159 аминокислотной последовательности, показанной в SEQ ID NO:60, нейтрализуют активность IL23, имеют KD менее чем приблизительно 160 пМ и имеют IC50 менее чем приблизительно 20 пМ. Еще одним воплощением в соответствии с данным изобретением является антитело или его антигенсвязывающая часть, содержащие вариабельную область (V-домен) тяжелой цепи, как показано в SEQID NO:52, V-домен легкой цепи, как показано в SEQ ID NO:57, константную область (С-домен) тяжелой цепи, как показано в SEQ ID NO:62, и С-домен легкой цепи, как показано в SEQ ID NO:63. Другое воплощение в соответствии с данным изобретением касается антитела или его антигенсвязывающей части, которые специфически связываются с р 19 субъединицей IL-23, включающих V-домен тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO:44-55, и V-домен легкой цепи, содержащий аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO:56-59. Еще одним воплощением в соответствии с данным изобретением является антитело или его антигенсвязывающая часть, которые специфически связываются с р 19 субъединицей IL-23, включающие Vдомен легкой цепи, содержащий аминокислотную последовательность, как показано в SEQ ID NO:57, иV-домен тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:48, 49 или 52. В другом воплощении, V-домен легкой цепи (LCVR) анти-IL-23 моноклонального антитела в соответствии с изобретением содержит 1, 2 или 3 пептида, выбранных из группы, состоящей из пептидов с последовательностью, показанной в (a) SEQ ID NO:26-35; (b) SEQ ID NO:37-38 и (с) SEQ ID NO:40 (то есть один пептид из (а), один пептид из (b) и один пептид из (с) для антитела, содержащего 3 указанных пептида), при LCDR1, LCDR2 и LCDR3 соответственно. В еще одном воплощении изобретения V-домен тяжелой цепи (HCVR) анти-IL-23 моноклонального антитела в соответствии с изобретением содержит 1, 2 или 3 пептида, выбранных из группы, состоящей из пептидов с последовательностью, показанной в (а) SEQ ID NO:1-4; (b) SEQ ID NO:5-11 и (с) SEQ IDNO:13-21 (то есть один пептид из (а), один пептид из (b) и один пептид из (с) для антитела, содержащего 3 указанных пептида), при HCDR1, HCDR2 и HCDR3 соответственно. Данное изобретение дополнительно обеспечивает анти-IL-23 моноклональное антитело, содержащее шесть пептидов, выбранных из группы, состоящей из пептидов с последовательностью, как показано(f) SEQ ID NO:13-21 (то есть один пептид из каждого из (a-f, при LCDR1, LCDR2, LCDR3, HCDR1,HCDR2 и HCDR3 соответственно. Данное изобретение дополнительно обеспечивает анти-IL-23 моноклональное антитело, содержащее шесть пептидов с последовательностью, показанной в SEQ ID NO:41, 42, 43, при LCDR1, LCDR2 иLCDR3 соответственно, и SEQ ID NO:22, 23 и 24 при HCDR1, HCDR2 и HCDR3 соответственно. Другое воплощение изобретения обеспечивает гуманизированные анти-IL-23 моноклональные антитела и их антигенсвязывающие части, которые связывают специфический эпитол, содержащий аминокислотные остатки 129-159 р 19 субъединицы IL-23; (129-159 остатки последовательности SEQ IDNO:60), и противодействуют или нейтрализируют по крайней мере in vitro или in vivo, биологическую активность, связанную с IL-23 или с его частью. В другом воплощении антитела в соответствии с изобретением имеют IC50 менее чем или равные приблизительно 100, 75, 50, 25, 20, 15, 13, 10, 8, 5, 2 или 1 пМ в in vitro анализе с мышиными спленоцитами, как описано в примере 1. Преимущественно антитела в соответствии с изобретением имеют IC50 менее чем или равные приблизительно 20 пМ. В еще одном воплощении антитела в соответствии с изобретением характеризируются сильным сродством к (KD) p19 субъединицы человеческого IL-23, то есть менее чем приблизительно 160, 100, 75,50 или 25 пМ. Преимущественно антитела в соответствии с изобретением имеют KD менее чем приблизительно 100 пМ. Кроме того, антитела в соответствии с изобретением дополнительно характеризируются koff от р 19 субъединицы человеческого IL-23 меньшей чем 410-4 с-1. Другое воплощение в соответствии с данным изобретением включает изолированное антитело любого из упомянутых выше осуществлений, где антитело представляет собой полноразмерное антитело, в значительной степени интактное антитело, химерное антитело, Fab фрагмент, F(ab')2 фрагмент или одноцепочный Fv фрагмент. Преимущественно изолированное антитело или его антигенсвязывающая часть,согласно любому из упомянутых выше воплощений, является гуманизированным антителом. Изобретение включает изолированные нуклеиновые кислоты, содержащие полинуклеотиды, кодирующие антитела, описанные и заявленные в данной заявке. Изобретение также охватывает клеткихозяева, трансфицированные векторами, содержащими эти полинуклеотиды, которые экспрессируют антитела, описанные и заявленные в данной заявке. Изобретение охватывает способ лечения аутоиммунной болезни, который включает введение субъекту эффективного количества антитела, описанного и заявленного в данной заявке. Преимущественно аутоиммунным заболеванием, подлежащим лечению, является рассеянный склероз. Наконец, изобретение охватывает применение антитела для получения лекарственного средства или для лечения аутоиммунного заболевания у субъекта, нуждающегося в этом. Подробное описание изобретения Данное изобретение обеспечивает аминокислотные последовательности изолированных человеческих антител или их антигенсвязывающих частей, которые специфически связывают р 19 субъединицуIL-23, и являются полезными для лечения аутоиммунного заболевания. Для более легкого понимания настоящего изобретения определенные термины будут сначала определены. р 19 субъединица человеческого IL-23 представляет собой состоящий из 189 аминокислот полипептид, содержащий лидерную последовательность в 21 аминокислоту [SEQ ID NO:60]. Термин "антитело", который в данной заявке предназначен для обозначения молекул иммуноглобулина, состоящих из четырех полипептидных цепей: две тяжелые цепи (Н) и две легкие цепи (L), соединенные между собой дисульфидными связями. Каждая тяжелая цепь состоит из V-домена тяжелой цепи(сокращенного в данной заявке как HCVR или VH) и С-домена тяжелой цепи (сокращенного в данной заявке как HCCR или СН). С-Домен тяжелой цепи состоит из трех доменов: CH1, CH2 и СН 3. Каждая легкая цепь состоит из V-домена легкой цепи (сокращенного в данной заявке как LCVR и VL) и Сдомена легкой цепи (сокращенного в данной заявке как LCCR). С-Домен легкой цепи состоит из одного домена CL.HCVR и LCVR домены могут быть дополнительно подразделены на гипервариабельные домены,названные участками, определяющими комплементарность (CDR), чередующиеся с более консервативными участками, названными каркасными областями (FR). Каждый HCVR и LCVR состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2,CDR2, FR3, CDR3, FR4. В данной заявке 3 CDR тяжелой цепи названы HCDR1, HCDR2 и HCDR3, и 3CDR легкой цепи названы LCDR1, LCDR2 и LCDR3. CDR содержат большинство остатков, которые осуществляют специфическое взаимодействие с антигеном. Нумерация и положение CDR аминокислотных остатков в HCVR и LCVR доменах соответствует широко известной номенклатуре Кэбота. Легкие цепи классифицируют как каппа и лямбда. Тяжелые цепи классифицируют как гамма, мю,альфа, дельта или эпсилон, а изотопы антител определены как IgG (подклассы IgG1, IgG2, IgG3 и IgG4),IgM, IgA, IgD и IgE соответственно. В пределах легких и тяжелых цепей, вариабельные и константные области соединяют при помощи J-области - приблизительно 12 или больше аминокислот, с тяжелой це-2 013506 пью, также включающей D-область - приблизительно 3 или больше аминокислот. Термин "антигенсвязывающий участок" антитела, как его в данной заявке используют, относится к одному или более фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (то есть с р 19 субъединицей IL-23). Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами целого антитела. Примеры связывающих фрагментов, охваченных термином "антигенсвязывающая часть" антитела, включают (i) Fab фрагмент, моновалентный фрагмент,состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2 фрагмент, бивалентный фрагмент, содержащий дваFab фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd фрагмент, состоящий из VH и СН 1 доменов; (iv) Fv фрагмент, состоящий из VL и VH доменов одноплечевого антитела, (v)dAb фрагмент, состоящий из VH домена; и (vi) изолированный гипервариабельный участок (CDR). Кроме того, хотя два домена Fv фрагмента (VL и VH) кодируются отдельными генами, они могут быть соединены при помощи рекомбинантных методов синтетическими линкерами, которые предоставляют им возможность находиться в виде единой белковой цепи, в которой VL и VH области спариваются, чтобы образовать моновалентные молекулы (известные как одноцепочечный Fv (scFv. Такие одноцепочечные антитела также будут охвачены термином "антигенсвязывающая часть" антитела. Другие формы одноцепочечных антител, такие как димеры, также включены в этот термин. Димеры - это бивалентные, биспецифические антитела, у которых VH и VL домены экспрессированы на одиночной полипептидной цепи,но с использованием линкера, который слишком короткий, чтобы позволить спаривание между двумя доменами на той же цепи, что, таким образом, принуждает домены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта.CDR-участки антигенсвязывающего участка антител в соответствии с изобретением имеют полностью или большей частью мышиное происхождение, по желанию, с измененными определенными аминокислотными остатками, например замещенными другим аминокислотным остатком (см. табл. 1 и 2),чтобы оптимизировать конкретные свойства антитела, то есть KD, koff, IC50. В других воплощениях изобретения антигенсвязывающий участок IL-23 антитела может быть получен из других нечеловеческих видов, включая кролика, крысу или хомяка, но не ограничиваясь ими. Как вариант антигенсвязывающий участок может быть получен из человеческой последовательности. Термин "моноклональное антитело", как его в данной заявке используют, не ограничен антителами,полученными в гибридомных технологиях. "Моноклональное тело" относится к антителу, которое получено из единой копии или клона, включая, например, эукариотный, прокариотный или фаговый клон, но не к способу, с помощью которого он был получен. "Моноклональное антитело" может быть интактным антителом (содержащим полную или полноразмерную Fc область), в значительной степени интактным антителом или частью или фрагментом антитела, содержащим антигенсвязывающий участок, напримерFab фрагментом, Fab' фрагментом или F(ab')2 фрагментом мышиного антитела или химерного, гуманизированного или человеческого антитела. Термин "гуманизированное антитело" обозначает антитело, которое частично или полностью составлено из аминокислотных последовательностей, полученных из человеческих антител гаметического типа или реарранжированной последовательности, и сделанных путем изменения последовательности антитела, имеющего нечеловеческие (преимущественно мышиное моноклональное антитело) гипервариабельные участки (CDR). Каркасные области гипервариабельного участка в значительной степени замещены соответствующими человеческими каркасными областями (или существенная, или значительная их часть, то есть, как минимум, 90, 92, 94, 95, 96, 97, 98 или 99%, следуя номенклатуре Кэбота) и кодируются нуклеиновой информационной последовательностью, которая встречается в человеческой гаметической иммуноглобулиновой области или в их рекомбинантной, или мышиной формах, вне зависимости от того, продуцируются указанные тела в человеческой клетке или нет.CDR участки гуманизированного антитела могут быть изменены или оптимизированы от CDR родительского нечеловеческого антитела, из которого они происходят, для того, чтобы получить желаемые свойства, например специфичность, аффинность и/или предпочтительное связывание. Измененные или оптимизированные CDR могут иметь аминокислотные замещения, добавки и/или делеции по сравнению с родительскими CDR, преимущественно приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в целом в пределах шести CDR доменов. Например, положения аминокислот CDR, которые находятся в SEQ ID NO:44-59 это положения, которые были изменены в CDR, как показано для Mab3 А 8. С другой стороны, мышиное антитело Mab3 А 8 может быть родительским антителом для сравнения CDR антитела в соответствии с изобретением. Как обсуждается в данной заявке, антитело в контексте гуманизированного антитела не ограничено полноразмерным антителом и может включать фрагменты и одноцепочные формы. Под термином "рекомбинантное человеческое антитело", как его используют в данной заявке, имеются в виду все человеческие антитела, которые получены, экспрессированы, созданы или изолированы с помощью рекомбинантных средств, например, такие как антитела, экспрессированные с применением экспрессирующего вектора, трансфицированного в клетку-хозяин; антитела, изолированные из рекомбинантной, комбинаторной библиотеки человеческих антител; антитела, изолированные из животного (например, мыши), которое является трансгенным для генов иммуноглобулина человека, или антитела, приготовленные, экспрессированные, созданные или изолированные с помощью любых других средств, ко-3 013506 торые включают сплайсинг последовательностей гена иммуноглобулина человека в другие ДНК последовательности. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области, полученные из последовательностей человеческого иммуноглобулина гаметического типа. Кроме того, в определенных воплощениях изобретения такие рекомбинантные антитела человека подвергаются мутагенезу in vitro, и поэтому аминокислотные последовательности VH и VL областей рекомбинантных антител являются последовательностями, которые, несмотря на то, что получены и происходят из гаметических VH и VL последовательностей человека, не могут естественным путем возникать в пределах гаметического набора антитела человека in vivo. Под термином "изолированное антитело", как его используют в данной заявке, имеется в виду антитело, которое в значительной степени свободно от других антител, имеющих другие антигенные свойства (например, изолированное антитело, которое специфически связывает р 19 субъединицу человеческогоIL-23, в значительной степени свободно от антител, которые специфически связывают другие антигены). Изолированное антитело, которое специфически связывает р 19 субъединицу человеческого IL-23, может,кроме того, иметь перекрестную реактивность к другим антигенам, таким как IL-23 молекулы из других видов. Более того, изолированное антитело может быть в значительной степени свободным от других клеточных материалов и/или химических продуктов. Под термином "нейтрализующее антитело", как его в данной заявке используют, имеется в виду антитело, чье связывание с р 19 субъединицей человеческого IL-23 приводит к ингибированию биологической активности человеческого IL-23. Как выяснилось, измерения одного или более индикаторов биологической активности человеческого IL-23 с использованием либо биоанализа с мышиными спленоцитами [пример 1], либо анализ подавления активности человеческого IL-23 [пример 2], позволяет оценить это ингибирование биологической активности человеческого IL-23."Вариантные" антитела относятся в данной заявке к молекуле, которая отличается по аминокислотной последовательности от аминокислотной последовательности "родительского" антитела благодаря добавлению, делеции и/или замещению одного или более аминокислотных остатков последовательности родительского антитела. В преимущественном воплощении изобретения вариант антитела содержит по крайней мере одно аминокислотное добавление, делецию и/или замещение в CDR областях родительского антитела (например, от одного до приблизительно десяти и преимущественно 2, 3, 4, 5, 6, 7 или 8). Что касается идентичности и гомологичности последовательности вариантного антитела, то она определена в данной заявке как процент аминокислотных остатков в последовательности вариантного антитела, идентичный остаткам родительского антитела после выравнивания последовательностей и введения разрывов, при необходимости, для достижения максимальной процентной идентичности последовательности. Вариантное антитело сохраняет способность связывать антиген или преимущественно эпитоп, с которым связывается родительское антитело, и преимущественно имеет по крайней мере одно свойство или биологическую активность, которые превосходят такие же свойства или биологическую активность родительского антитела. Например, вариантное антитело преимущественно имеет более сильную способность к связыванию, более низкую скорость диссоциации, более низкое IC50 или повышенную способность к ингибированию биоактивности антигена, чем у родительского антитела. Вариантное антитело, представляющее в данной заявке особый интерес, является таким антителом, которое демонстрирует по крайней мере приблизительно 2-кратное, преимущественно по крайней мере приблизительно 5-кратное, 10 кратное или 20-кратное повышение свойства или биоактивности по сравнению с родительским антителом."Родительское" антитело означает в данной заявке антитело, которое содержит аминокислотную последовательность, используемую для получения вариантного антитела. Родительское антитело может иметь каркасную последовательность мышиного происхождения, но преимущественно каркасная последовательность имеет полностью или большей частью человеческое происхождение. Родительское антитело может быть мышиным, химерным, гуманизированным или человеческим антителом. Антитела, которые "специфически связывают", связывают р 19 субъединицу IL-23 человека, но не связывают р 40 субъединицу человеческого IL-23. Антитело, которое специфически связывает IL-23 человека, может демонстрировать некоторую перекрестную реактивность с IL-23 из других видов. Термин "эпитоп" относится к части молекулы, способной быть распознанной и связанной антителом в одной или более антигенсвязывающих областях антитела. Эпитопы часто состоят из химически активной поверхностной группы молекул, таких как аминокислоты или боковые цепи сахаров, и имеют специфические особенности трехмерной структуры, а также специфические зарядовые особенности. Под"ингибирующим эпитопом" и/или "нейтрализующим эпитопом" имеется в виду эпитоп, который в случае специфического связывания интактной молекулы с эпитопом с помощью антитела приводит к потере или снижению биологической активности молекулы in vivo или in vitro, или в организме, содержащем молекулу. Используемый в данной заявке термин "антигенный эпитоп" определен как часть полипептида, к которой антитело может специфически присоединиться, что определяется любым хорошо известным из уровня техники методом, например традиционным иммуноанализом. "Нелинейный эпитоп" или"конформационный эпитоп" содержит независимые полипептиды (или аминокислоты) в пределах антигенного белка, с которым связывается специфичное к эпитопу антитело.-4 013506 Под термином "kon", как его в данной заявке используют, имеется в виду константа скорости реакции, или константа скорости специфической реакции для прямой реакции, или реакции комплексообразования, измеренная в единицах М-1 с-1. Под термином "koff", как его в данной заявке используют, имеется в виду константа скорости реакции распада или константа скорости специфической реакции для диссоциации антитела из комплекса антитело/антиген, измеренная в единицах с-1. Под термином "KD", как его в данной заявке используют, имеется в виду константа диссоциации специфического взаимодействия антитело-антиген. Ее рассчитывают по формулеkoff/kon = KD Антитела в соответствии с данным изобретением являются высокоаффинными антителами, главным образом демонстрирующими низкие значения koff. Для целей данного описания термин "высокая аффинность" относится к аффинности или к KD, имеющей значение от 1,610-10 М до приблизительно 4,510-11 M. Термин "потенциал" - это мера биологической активности, которую обозначают как IC50, или эффективная концентрация антитела, необходимая для нейтрализации 50% биоактивности IL-23 в мышиных спленоцитах в биоанализе, описанном в примере 1. Используемый в данной заявке термин "молекула нуклеиновой кислоты" обозначает как молекулы ДНК, так и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но преимущественно является двухцепочечной ДНК. Используемый в данной заявке термин "изолированная молекула нуклеиновой кислоты" относится к нуклеиновым кислотам, кодирующим антитела или части антител (например, VH, VL, CDR3), которые связывают IL-23 человека, и обозначает молекулу нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или его часть, свободны от других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связывают антигены, отличные от человеческого IL-23, которую другие последовательности могут естественно фланкировать в геномной ДНК человека. Так, например, изолированная нуклеиновая кислота в соответствии с изобретением, кодирующаяVH область антитела к человеческому IL-23, не содержит никакие другие последовательности, кодирующие другие VH области, которые связывают отличные от человеческого IL-23 антигены. Используемый в данной заявке термин "вектор" относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, к которой она была присоединена. Одним типом вектора является "плазмида", которая относится к кольцевой двухцепочечной петле ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другой тип вектора - это вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин"), как его в данной заявке используют, относится к клетке, в которую был введен рекомбинантный экспрессирующий вектор. Моноклональное антитело 3 А 8 является мышиным моноклональным антителом (MAb3 А 8), которое специфически связывается с эпитопом на р 19 субъединице IL-23 человека. MAb3 А 8 было гуманизировано и оптимизировано, что привело к высокой аффиности антител с сильной IL-23 нейтрализующей активностью и высокой специфичностью к р 19 субъединице IL-23, но не к р 40 субъединице. Преимущественные антитела или их антигенсвязывающие части в соответствии с изобретением демонстрируют высокую аффинность (низкие значения KD) к такому же эпитопу, как MAb3 А 8, и имеют сродство к связыванию выше, чем наблюдается для MAb3 А 8. Связывающие свойства, которые определяют антитела в соответствии с данным изобретением, свойственны исключительно вариабельным областям антитела, в особенности CDR областям антитела. Первоначальным толчком к гуманизации антител из других видов является возможность снижения иммунного ответа, вызванного антителом, в случае его введения больному человеку в качестве лекарственного средства. Более человеческие последовательности, которые используют в гуманизированном антителе, снижают риск иммуногенности. Кроме того, введенные гуманизированные антитела, как правило, имеют более продолжительное время полужизни в кровотоке, чем введенные нечеловеческие антитела. К тому же, если желательной является эффекторная функция, потому что эффекторный участок является человеческим, то он может лучше взаимодействовать с другими частями иммунной системы человека. Изменения могут быть получены в последовательностях, описанных в данной заявке как предпочтительные области тяжелых и легких цепей без существенного влияния на биологические свойства антитела. Это особенно верно для С-доменов и для части V-доменов антитела, которые не влияют на способность CDR связывать IL-23. Кроме того, в данном изобретении могут быть использованы обсуждаемые в данной заявке Vдомены каркасной области антитела человека или их варианты. Более того, независимо от выбора каркасной области, если целью является снижение риска иммуногенности, то количество изменений относительно выбранной человеческой каркасной области будет минимальным. Гуманизированное антитело в соответствии с изобретением может содержать или может быть получено из гаметической каркасной области легкой цепи человека. В определенных воплощениях изобре-5 013506 тения гаметическую последовательность легкой цепи выбирают из VK последовательностей человека,включающих А 1, А 10, А 11, А 14, А 17, А 18, А 19, А 2, А 20, А 23, А 26, А 27, A3, A30, А 5, А 7, В 2, В 3, L1,L10, L11, L12, L14 , L15, L16, L18, L19, L2, L20, L22, L23, L24, L25, L4/l8a, L5, L6, L8, L9, O1, O11, O12,O14, O18, O2, O4 и O8, но не ограничиваясь ими. В некоторых воплощениях, эту гаметическую каркасную область легкой цепи человека выбирают из V1-11, V1-13, V1-16, V1-17, Vl-18, Vl-19, Vl-2, Vl-20, Vl22, Vl-3, Vl-4, Vl-5, Vl-7, V1-9, V2-1, V2-11, V2-13, V2-14, V2-15, V2-17, V2-19, V2-6, V2-7, V2-8, V3-2,V3-3, V3-4, V4-1, V4-2, V4-3, V4-4, V4-6, V5-1, V5-2, V5-4 и V5-6. В других осуществлениях гуманизированное антитело в соответствии с изобретением может содержать гаметическую каркасную область тяжелой цепи человека или может быть получено из нее. В конкретных воплощениях изобретения эту гаметическую каркасную область тяжелой цепи выбирают изVH1-18, VH1-2, VH1-24, VH1-3, VH1-45, VH1-46, VH1-58, VH1-69, VH1-8, VH2-26, VH2-5, VH2-70,VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-35, VH3-38, VH3-43,VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-7, VH3-72, VH3-73, VH3-74, VH3-9, VH4-28, VH4-31,VH4-34, VH4-39, VH4-4, VH4-59, VH4-61, VH5-51, VH6-1 и VH7-81. В конкретных воплощениях изобретения V-домен легкой цепи и/или V-домен тяжелой цепи содержит каркасную область или по крайней мере часть каркасной области (например, содержащую 2 или 3 субобласти, такие как FR2 и FR3). В определенных воплощениях, по крайней мере, FRL1, FRL2, FRL3 или FRL4 являются полностью человеческими. В других воплощениях, по крайней мере, FRH1, FRH2,FRH3 или FRH4 являются полностью человеческими. В некоторых воплощениях, по крайней мере,FRL1, FRL2, FRL3 или FRL4 являются гаметической последовательностью (например, человеческой гаметической) или содержат человеческие консенсусные последовательности для конкретной каркасной области. В других примерах, по крайней мере, FRH1, FRH2, FRH3 или FRH4 являются гаметической последовательностью (например, человеческой гаметической) или содержат человеческие консенсусные последовательности для конкретной каркасной области. В предпочтительных воплощениях все каркасные области являются человеческими каркасными областями. Предпочтительные аминокислотные последовательности С-домена человеческой тяжелой цепи гуманизированных антител в соответствии с данным изобретением включают константную область IgG1[SEQ ID NO:61] или константную область IgG4 [SEQ ID NO:62]. Предпочтительной аминокислотной последовательностью С-домена человеческой легкой цепи гуманизированных антител в соответствии с данным изобретением является С-домен каппа-цепи [SEQ ID NO:63]. Дополнительно предпочтительной каркасной областью V-домена человеческой тяжелой цепи является VH1-24 [SEQ ID NO:64], предпочтительной каркасной областью V-домена человеческой легкой цепи является А 17 [SEQ ID NO:65]. SEQ ID NO:64 и 65 представляют собой гаметические человеческие последовательности с нативными CDR. CDR из MAb3 А 8 добавляют наряду с лучшими по совместимости человеческими J-областями для образования завершенных V-доменов. Считается, что дополнительные С-домены человеческих тяжелых или легких цепей и каркасные последовательности V-доменов,помимо описанных выше, рассматриваются в данном изобретении и известны из уровня техники. Данное изобретение охватывает антитела или их антигенсвязывающие части, которые связывают специфический эпитоп на р 19 субъединице IL-23 и нейтрализуют активность IL-23. Так, описанные в данной заявке CDR и V-домены легких и тяжелых цепей используют в производстве полноразмерных антител так же, как и функциональные фрагменты и аналоги, которые сохраняют сродство к связыванию белка, используя специфические CDRs к р 19 субъединице IL-23. Сродство к связыванию MAb3 А 8 определяют, используя поверхностный плазмонный резонанс(BIAcore). В этих экспериментах антитело захватывают при низкой плотности либо белком А, либо анти-Fc антителом на BIAcore чипе, и лиганд протекает мимо. Измеряют наращивание массы на поверхности чипа. Этот аналитический метод позволяет определять в реальном времени как скорость ассоциации, так и скорость диссоциации для получения сродства (KD) к связыванию. MAb3 А 8 имеет KD, составляющее приблизительно 300 пМ (пикомолей). Гуманизированные антитела в соответствии с данным изобретением имеют KD, составляющее от приблизительно 45 до приблизительно 160 пМ; от приблизительно 45 до приблизительно 150 пМ; от приблизительно 45 до приблизительно 100 пМ; от приблизительно 50 до приблизительно 95 пМ; от приблизительно 60 до приблизительно 85 пМ; или от приблизительно 70 до приблизительно 80 пМ. Преимущественно гуманизированные антитела в соответствии с данным изобретением имеют KD, составляющее менее чем приблизительно 100 пМ. Антитела или их антигенсвязывающие части в соответствии с данным изобретением нейтрализуют биологическую активность IL-23. Используют два вида анализа для проверки способности MAb3 А 8 и преимущественных антител в соответствии с данным изобретением к нейтрализации IL-23 активности[примеры 1 и 2]. Данное изобретение также направлено на рекомбинантную ДНК, кодирующую антитела, которые при экспрессировании специфически связываются с р 19 субъединицей IL-23 человека. Преимущественно ДНК кодирует антитела, которые, когда экспрессируются, содержат одну или больше CDR легких иCDR последовательности - вариабельная область тяжелой цепи (HCDR)CDR последовательности - вариабельная область легкой цепи (LCVR) Х 9 - это K, Q или R; Х 10 - это D или I; Х 11 - это D или G; Х 12 - это K, N или Р; Х 13 - это L или K; X14 - это S или Q; и Х 15 - это Н или Y. Изобретение включает антитела, содержащие консенсусные последовательности для CDR легких цепей, представленные SEQ ID NO: 41, 42 и 43, и для CDR тяжелых цепей, представленные SEQID NO: 22, 23 и 24. Примеры аминокислотных последовательностей V-доменов тяжелых цепей преимущественных антител в соответствии с данным изобретением, использующие VH каркасную область VH1-24,представлены последовательностями SEQ ID NO:44-55. Примеры аминокислотных последовательностейV-доменов легких цепей преимущественных антител в соответствии с данным изобретением, использующие VL каркасную область А 17, представлены последовательностями SEQ ID NO:56-59. Аминокислотный остаток 41 в SEQ ID NO:58 и 59 заменен мышиным аминокислотным остатком, находящимся в этой позиции. Более того, примеры антител в соответствии с данным изобретением представлены Сдоменом тяжелой цепи, как показано в SEQ ID NO:62, и С-доменом легкой цепи, как показано в SEQ IDNO:63. Таким образом, приведенные для иллюстрации антитела в соответствии с данным изобретением выбирают из группы, состоящей из:(g) антитела с LCVR, как показано в SEQ ID NO:57, и HCVR, как показано в SEQ ID N0:55, LCCR,как показано в SEQ ID NO:63, и HCCR, как показано в SEQ ID NO:62. Нейтрализующие антитела в соответствии с данным изобретением получают путем генерирования соответствующих геномных последовательностей антитела, то есть аминокислотных последовательностей, полученных с помощью арранжирования соответствующих неклеотидных последовательностей и экспрессирования их в подходящей клеточной линии. Желаемые нуклеотидные последовательности могут быть получены с использованием мутагенеза, основанного на кодоне. Такие процедуры позволяют получать любые и все встречающиеся аминокислотные остатки в любых желаемых положениях кодона в пределах олигонуклеотида. Они могут включать целиком случайные замещения любой из 20 аминокислот в желаемом положении. С другой стороны, этот процесс может быть осуществлен таким образом,чтобы получить конкретную аминокислоту в желательном месте в пределах аминокислотной цепи, такой как новые CDR последовательности в соответствии с изобретением. В целом, может быть легко получена соответствующая нуклеотидная последовательность для экспрессирования любой желаемой аминокислотной последовательности и, используя такие процедуры, могут быть репродуцированы новые CDR последовательности в соответствии с данным изобретением. Это дает возможность синтезировать полипептиды,такие как антитела, с любыми желаемыми аминокислотными последовательностями. Например, сейчас можно определить аминокислотную последовательность любого желаемого домена предпочтительного антитела и, по желанию, получить гомологические цепи с одной или более аминокислотами, замещенными другими желаемыми аминокислотами, для того, чтобы получить ряд замещенных аналогов. При применении этих методов необходимо принимать во внимание то, что, вследствие выраженности генетического кода, такие способы, как случайный олигонуклеотидный синтез и частичный дегенеративный олигонуклеотидный синтез, будут инкорпорировать повторы для кодонов, задающих определенную аминокислоту в определенном положении, хотя такие способы могут быть использованы для того, чтобы обеспечить основной набор всех возможных аминокислотных последовательностей и сортировать их по оптимальным функциям как в качестве антител, так и для других целей. В качестве альтернативы, такие последовательности антител могут быть синтезированы химически или получены другими способами, хорошо известными специалистам в данной области. В соответствии с раскрытым в данной заявке изобретением, усовершенствованные высокоактивные антитела могут быть генерированы путем комбинирования в единой полипептидной структуре одной или больше раскрытых в данной заявке CDR последовательностей, предназначенных для того, чтобы независимо привести к увеличению эффективности или биологической активности. Аминокислотные изменения приводят к снижению koff для указанного антитела, преимущественно с увеличением аффинности антитела. Более высокая активность может быть достигнута с низким значением koff, даже если аффинность сохраняется такой же или является несколько сниженной. Такое антитело лучше всего получать путем синтеза требуемых полипептидных цепей при помощи синтеза в соответствующим образом рекомбинированных клетках, имеющих инкорпорированные в них подходящие нуклеотидные кодирующие последовательности для требуемых полипептидных цепей, содержащих измененные CDR сегменты. В качестве неограничивающего примера могут быть использованы такие новые CDR последовательности, а получившиеся антитела отобраны по эффективности или биологической активности с использованием либо биоанализа со спленоцитами, либо описанного в данной заявке протокола нейтрализации активности IL-23 человека, где антитело демонстрирует высокую аффинность к конкретной антигенной структуре, такой как р 19 субъединица IL-23 человека. С другой стороны, ценным должно быть то, что не все места в пределах последовательностей различных доменов антитела могут быть равными в том, что замещения в любом виде в конкретном месте могут быть полезными или вредными. К тому же, в плане сродства, замещения определенных видов аминокислот в определенных местах могут также быть преимуществом или недостатком. Например, нет необходимости пробовать все возможные гидрофобные аминокислоты в заданном положении. Возможно, что будет подходить любая гидрофобная аминокислота. С другой стороны, кислая или основная аминокислота в заданном месте может обеспечивать большие колебания в измеряемой аффинности. Как уже описано, KD измеряют как отношение kon и koff констант kon и koff, например kon 3,1l07 (М-1 с-1) иkoff 0,910-4 (с-1) при сочетании дают KD, составляющее 2,910-12 М. Таким образом, аффинность может- 12013506 быть улучшена путем повышения kon или снижения koff. Соответственно, увеличение koff антитела в соответствии с данным изобретением, вероятно, приведет к более эффективному терапевтическому агенту. В соответствии с вышеизложенным, антитела в соответствии с данным изобретением представляют собой высокоаффинные моноклональные антитела. Дополнительно, такие антитела являются моноклональными только в том смысле, что они могут быть получены из клона клеток одного типа. К тому же,это не ограничивает их конкретным происхождением. Такие антитела могут быть легко получены в клетках, которые, как правило, не продуцируют антитела, такие как СНО, NSO или COS клетки. Ко всему прочему, такие антитела могут быть получены в клетках других типов, особенно в клетках млекопитающих и даже бактериальных и растительных клетках, изменяя с помощью генной инженерии такие клетки так, чтобы они экспрессировали и компановали полипептидные легкие и тяжелые цепи, формирующие антитело. Дополнительно, такие цепи могут быть химически синтезированы, но они рассматриваются как "моноклональные" антитела в том смысле, в котором используется этот термин, поскольку они будут специфичными для заданной антигенной детерминанты. Таким образом, используемый в данной заявке термин "моноклональное антитело" больше предназначен для обозначения специфичности и чистоты молекул антитела, а не способа, с использованием которого получены указанные антитела. Таким же образом термин "эффективность", как его в данной заявке используют, предназначен для описания зависимости производимого антителом эффекта, при его использовании в терапевтических целях, от концентрации такого антитела. Так, эффективность означает биологическую активность относительно заданного антигена. В качестве неограничивающего примера, эффективность, или биологическую активность, или биологический эффект измеряют для анти-IL-23 антитела либо в биоанализе со спленоцитами, либо в описанном в данной заявке протоколе нейтрализации IL-23 человека. Относительная эффективность антител, полученных методами в соответствии с данным изобретением, обозначенная как IC50, будет обычно находиться в диапазоне от приблизительно 1 до приблизительно 100 пМ; от приблизительно 1 до приблизительно 50 пМ; от приблизительно 1 до приблизительно 25 пМ. Преимущественно IC50 будет составлять приблизительно 25, 20, 15, 13, 10, 8, 5, 2 или 1 пМ. Лучше всего антитела в соответствии с данным изобретением имеют IC50 приблизительно 20 пМ. Наоборот, аффинность антитела к антигену - это просто математическое отношение kon к koff. К тому же, KD антител, полученных методами в соответствии с данным изобретением, будет обычно находиться в диапазоне от приблизительно 210-10 до приблизительно 2510-12 М, преимущественно будет составлять приблизительно 160, 100, 75, 50 или 25 пМ. Лучше всего антитела в соответствии с изобретением имеют KD, составляющее менее чем приблизительно 100 пМ. В другом воплощении антитела или их антигенсвязывающие части в соответствии с данным изобретением будут, как правило, содержать константную и вариабельную области млекопитающих, преимущественно человеческие. Указанная вариабельная область содержит каркасные области тяжелой и легкой цепи и CDR тяжелой и легкой цепи, где каркасные области тяжелой и легкой цепи имеют последовательностные характеристики антитела млекопитающего, преимущественно человека, и где CDR тяжелой и легкой цепи являются такими же, как и соответствующие области антител других видов, отличных от человека, преимущественно мыши. В еще другом воплощении в соответствии с данным изобретением эффективность повышают, используя Fab фрагмент нейтрализующего антитела к человеческому IL-23, имеющий KD, составляющее менее чем, приблизительно 160 пМ, и путем снижения koff до значения, меньшего чем приблизительно 110-3 с-1, преимущественно менее чем приблизительно 510-4 с-1, лучше всего менее чем приблизительно 110-4 с-1. Аминокислоты, присутствующие в CDR таких Fab фрагментов, показаны в табл. 1 и 2. В отдельных воплощениях данное изобретение относится к изолированным антителам, имеющимKD менее чем приблизительно 160 пМ, где koff составляет менее чем приблизительно 110-3 с-1, преимущественно менее чем приблизительно 510-4 с-1, и лучше всего менее чем приблизительно 110-4 с-1(включая все их комбинации). Так, преимущественные антитела в соответствии с данным изобретением связывают р 19 субъединицу зрелого человеческого IL-23 с KD, составляющим приблизительно 160 пМ или менее, имеют коэффициент кинетики koff, составляющий 110-3 с-1 или менее, и нейтрализуют активность человеческого IL-23. В соответствии с данным изобретением, ДНК, кодирующая антитела, обычно будет включать контролирующую экспрессию полинуклеотидную последовательность, функционально связанную с последовательностями, кодирующими антитело и включающими естественносвязанные или гетерологические промоторные области. Преимущественно, контролирующие экспрессию последовательности являются эукариотическими промоторными системами в векторах, способных к трансформированию или трансфектированию эукариотических клеток-хозяев, но также могут использовать и контролирующие последовательности для прокариотических хозяев. Как только вектор будет инкорпорирован в подходящую линию клеток-хозяев, клетку-хозяин размножают в условиях, подходящих для экспрессирования нуклеотидных последовательностей, и, если желательно, для сбора и очистки легких цепей, тяжелых цепей,димеров легких/тяжелых цепей или интактных антител, связывающих фрагментов или других иммуноглобулиновых форм.- 13013506 Нуклеотидные последовательности в соответствии с данным изобретением, способные, в конечном счете, экспрессировать желательные антитела, могут быть сформированы из множества различных полинуклеотидов (геномных или кДНК, РНК, синтетических олигонуклеотидов и т.п.) и компонентов (например, V, J, D и С доменов), используя любую из множества хорошо известных методик. Соединение подходящих геномных и синтетических последовательностей является общим методом получения, но и кДНК последовательности также могут быть использованы. ДНК последовательности человеческого С-домена могут быть изолированы из целого ряда человеческих клеток при помощи хорошо известных процедур, но преимущественно из иммортализованных Вклеток. Подходящие источники клеток для полинуклеотидных последовательностей и клетки-хозяева для экспрессии и секреции иммуноглобулина могут быть получены из целого ряда хорошо известных из уровня техники источников. Как описано в данной заявке, в дополнение к антителам, особенно описанным в данной заявке, могут быть легко спланированы и получены другие "в значительной степени гомологичные" модифицированные антитела, используя разнообразные методы рекомбинантных ДНК, хорошо известные специалистам в данной области. Например, каркасные области могут быть изменены от нативных последовательностей на уровне первоначальной структуры с помощью нескольких аминокислотных замещений, терминальных и промежуточных добавок и делеций и подобными методами. Более того, ряд различных человеческих каркасных областей может быть использован отдельно или в комбинации в качестве основы для гуманизированных иммуноглобулинов в соответствии с данным изобретением. В основном, модификации генов могут быть легко осуществлены с помощью ряда хорошо известных технологий, таких как сайт-специфический мутагенез. С другой стороны, могут быть получены полипептидные фрагменты, содержащие только часть первоначальной структуры антитела, эти фрагменты обладают одной или несколькими активностями иммуноглобулина (например, фиксацией комплемента). Эти полипептидные фрагменты могут быть получены путем протеолитического расщепления интактных антител с помощью методов, хорошо известных из уровня техники, или вставкой терминирующих кодонов при помощи сайт-специфического мутагенеза в желаемые места на векторах, в такие как после CH1 для продуцирования Fab фрагментов или после области "талии" для продуцирования F(ab')2 фрагментов. Одноцепочечные антитела могут быть получены путем соединения VL и VH с ДНК-линкером. Как заявлялось ранее, нуклеотиды экспрессируются в хозяевах после того, как последовательности будут функционально связаны (например, помещены для того, чтобы гарантировать функционирование) с последовательностью, контролирующей экспрессирование. Эти экспрессирующие векторы обычно реплицируются в организмах-хозяевах либо как эписомы, либо как интегральная часть хромосомальной ДНК хозяина. В большинстве случаев, экспрессирующие векторы будут содержать селекционные маркеры, например тетрациклин, неомицин и дигидрофолатредуктазу, что позволит обнаружить те трансформированные клетки, которые содержат желаемые ДНК последовательности. Е. coli является прокариотическим хозяином, полезным, в частности, для клонирования полинуклеотидов в соответствии с данным изобретением. Другие пригодные для использования микробиологические хозяева включают бациллы, такие как Bacillus subtilus, и другие энтеробактерии, такие как Salmonella, Serratia, и ряд видов Pseudomonas. В этих прокариотических хозяевах можно также получить экспрессирующий вектор, который обычно содержит контролирующие экспрессию последовательности,совместимые с клеткой-хозяином (например, репликатор). Кроме того, может присутствовать любой из целого ряда хорошо известных промоторов, таких как промоторная система лактозы, промоторная система триптофана (trp), промоторная система бета-лактамазы или промоторная система из фага лямбда. Промоторы обычно контролируют экспрессию, если надо, то необязательно с последовательностьюоператором, и имеют последовательности с рибосомосвязывающим центром и подобное для инициирования и завершения транскрипции и трансляции. Кроме бактерий, для экспрессии также могут быть использованы другие микроорганизмы, такие как, например, дрожжи. Pichia pastoris является преимущественным хозяином с пригодными векторами,имеющими контролирующие экспрессию последовательности, такие как промоторы, включая 3 фосфоглицераткиназу или другие гликолитические ферменты, и сайт индикации репликации, терминирующие последовательности и другие подобные. Культура клеток ткани млекопитающего также может быть использована для экспрессии и продуцирования полипептидов в соответствии с данным изобретением. Эукариотические клетки являются особенно предпочтительными, поскольку целый ряд пригодных линий клеток-хозяев, способных секретировать интактные иммуноглобулины, были разработаны в уровне техники, и включают клеточные линии СНО, различные клеточные линии COS, клетки HeLa, миеломные клеточные линии, трансформированные В-клетки, клеточные линии эмбриональной почки человека или гибридомы. Предпочтительными клеточными линиями являются СНО и миеломные клеточные линии, такие как SP2/0 и NS0. Экспрессирующие векторы для этих клеток могут включать контролирующие экспрессию последовательности, такие как сайт инициации репликации, промотор, энхансер, и необходимые перерабатывающие информацию сайты, такие как рибосомосвязывающие центры, РНК сплайсинговые сайты, сайты- 14013506 полиаденилирования и транскрипционные терминаторные последовательности. Предпочтительными контролирующими экспрессию последовательностями являются промоторы, полученные из генов иммуноглобулина, SV40, аденовируса, вируса папилломы крупного рогатого скота, цитомегаловирусов и подобных. Предпочтительные сайты полиаденилирования включают последовательности, полученные из SV40 и гормона роста крупного рогатого скота. Векторы, содержащие представляющие интерес полинуклеотидные последовательности (например,последовательности, кодирующие легкую и тяжелую цепи, и контролирующие экспрессию последовательности), могут быть перенесены в клетку-хозяин с помощью хорошо известных методов, которые меняются в зависимости от вида клетки-хозяина. Например, кальций-хлоридная трансфекция является общеиспользуемой для прокариотических клеток, в то время как обработка фосфатом кальция и электропорация могут быть использованы для других клеточных хозяев. После экспрессирования антитела могут быть очищены в соответствии со стандартными процедурами, включающими осаждение сульфатом аммония, ионообменную, аффинную (например, белок А),обращенно-фазовую, гидрофобную колоночную хроматографию, гель электрофорез и подобные. Предпочтительными для использования являются по сути чистые иммуноглобулины, имеющие чистоту, составляющую по крайней мере приблизительно от 90 до 95% и от 98 до 99% или еще предпочтительнее более чистые. Очищенные частично или до желаемой гомогенности полипептиды могут затем использоваться с терапевтической или профилактической целью, как указано в данной заявке. Антитела в соответствии с данным изобретением применяют с терапевтической, профилактической,диагностической или исследовательской целью, как описано в данной заявке. Антитело в соответствии с данным изобретением может быть использовано для диагностирования нарушений или болезней, связанных с экспрессией IL-23. Подобным образом антитело в соответствии с данным изобретением может быть использовано в анализе для мониторинга уровней IL-23 у субъекта, тестируемого по поводу IL-23 связанного состояния. Применения с исследовательской целью включают методы, в которых используют антитела в соответствии с данным изобретением и метки для обнаружения IL-23 в образце, например в жидкости человеческого организма, или в клетке, или в экстракте ткани. Антитела в соответствии с данным изобретением могут быть использованы с модификацией или без нее и представляют собой антитела, меченные путем ковалентного или нековалентного присоединения детектируемой частицы. Детектируемая частица может быть любой частицей, способной производить либо непосредственно, либо косвенно, обнаруживаемый сигнал. Множество традиционных протоколов для измерения IL-23, включая, например, ELISA, RIA иFACS, известны из уровня техники и обеспечивают основу для диагностирования измененных или анормальных уровней экспрессии IL-23. Нормальные или стандартные значения экспрессии определяют с использованием любого известного из уровня техники метода, например объединением образца, содержащего полипептид IL-23, , например, с антителами в условиях, пригодных для образования комплекса антиген/антитело. Антитело непосредственно или косвенно метят обнаруживаемым веществом для облегчения обнаружения связанного или несвязанного антитела. Пригодные обнаруживаемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Для удобства антитело согласно с данным изобретением может быть обеспечено в наборе, в виде упакованных реактивов в заданных количествах с инструкциями для выполнения диагностического анализа. В случае меченного ферментом антитела набор будет включать субстраты и кофакторы, необходимые ферменту (например, субстрат-предшественник, который обеспечивает обнаруживаемые хромофоры или флуорофоры). Кроме того, могут быть включены другие вспомогательные вещества, как, например, стабилизаторы, буфера (например, блокирующий буфер или лизисный буфер) и тому подобное. Относительные количества различных реактивов могут широко изменяться для обеспечения концентраций в растворе реактивов, которые в значительной степени оптимизируют чувствительность анализа. В частности, реактивы могут обеспечиваться в виде сухого порошка, обычно лиофилизированного, включающего наполнители, которые при растворении будут обеспечивать раствор реактивов, имеющий подходящую концентрацию. Данное изобретение также относится к методам лечения человека, испытывающего опосредованноеIL-23 воспалительное нарушение, которые включают введение эффективной дозы антитела, специфичного к р 19 субъединице человеческого IL-23, пациенту, нуждающемуся в таком лечении. Антитела в соответствии с данным изобретением связывают и нейтрализуют IL-23. Различные опосредованные IL-23 расстройства включают рассеянный склероз, ревматоидный артрит (RA), реакцию "трансплантант против хозяина", псориаз, болезнь Крона, другие воспалительные заболевания кишечника и опухоли. Преимущественно IL-23 антитела, охваченные данным изобретением, используют для лечения рецидивирующе-ремитизирующего рассеянного склероза, самой распространенной формы рассеянного склероза. Антитела или их антигенсвязывающие части в соответствии с данным изобретением могут быть в форме композиции, содержащей антитело в соответствии с данным изобретением, суспендированное в фармакологически приемлемом растворителе или наполнителе. Такие фармацевтические композиции- 15013506 могут быть введены любым способом, известным из уровня техники, пригодным для намеченного использования - лечения аутоиммунного заболевания, преимущественно рассеянного склероза. Предпочтительным путем введения является парентеральный, определенный в данной заявке как относящийся к способу введения, который включает внутривенные, внутримышечные, внутрибрюшинные, надчревные,подкожные и внутрисуставные инъекции и инфузии. Более предпочтительным путем введения является подкожный, осуществляемый раз в неделю. Вводимая доза будет зависеть от возраста, состояния здоровья и массы реципиента, вида сопутствующего лечения, если оно имеет место, частоты лечения и природы желаемого эффекта. Композиции, в рамках данного изобретения, включают все композиции, где антитела или антигенсвязывающие части присутствуют в количестве, которое является эффективным для достижения желаемого медицинского эффекта при лечении рассеянного склероза. В то время как индивидуальные потребности могут изменяться от одного больного к другому, определение оптимальных диапазонов эффективных количеств всех компонентов находится в пределах возможностей врача-клинициста, обладающего обычными познаниями в данной области техники. Фармацевтические композиции для введения разрабатываются с учетом пригодности для выбранного метода введения и, в случае необходимости, используют фармацевтически приемлемые наполнители, такие как буфера, поверхностно-активные агенты, консерванты, солюбилизирующие агенты, изотонические агенты, стабилизирующие агенты, носители и тому подобное. Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton PA, последнее издание, включенные в данную заявку как ссылка,обеспечивают перечень методов приготовления лекарственных средств в том виде, в каком они известны профессионалам. Концентрация IL-23 антитела в лекарственных средствах может составлять по крайней мере от приблизительно,0,1 вплоть до 15 или 20 мас.% и будет выбрана, прежде всего, исходя из объемов жидкости, вязкости, стабильности и так далее, в соответствии с конкретно выбранным методом введения. Преимущественные концентрации IL-23 антитела, в общем, будут находиться в диапазоне от 1 до приблизительно 100 мг/мл. Предпочтительно от 10 до приблизительно 50 мг/мл. Лекарственное средство может включать буфер. Преимущественно буфер представляет собой цитратный или фосфатный буфер или их комбинацию. В основном, рН составляет от приблизительно 5 до приблизительно 7,5. рН лекарственного средства подбирают таким образом, чтобы сбалансировать стабильность антитела (химическую или физическую) и для удобства больного при его введении. Лекарственное средство также может включать соль,такую как NaCl. Дополнительно лекарственное средство может включать детергент для предотвращения агрегации и для поддержания стабильности. Лекарственное средство стерилизуют фильтрацией после его получения или обеспечивают его микробиологическую приемлемость иным способом. Консервант, такой как мета-крезол, или фенол, или их смесь, может быть добавлен для предотвращения микробного роста и загрязнения. Типичная композиция для внутривенной инфузии могла бы иметь объем, составляющий вплоть до 250 мл жидкости, такой как стерильный раствор Рингера, с концентрацией антитела, составляющей 1-100 мг/мл. Терапевтические агенты в соответствии с данным изобретением могут быть заморожены или лиофилизированы для хранения или перерастворены в пригодном стерильном носителе перед использованием. Лиофилизация и перерастворение могут приводить к разной степени потерям активности антитела (например, с традиционными иммуноглобулинами, IgM антитела в большей степени теряют активность, чем IgG антитела). Дозировки могут быть скорректированы для компенсации потери активности. Хотя вышеизложенные методы кажутся наиболее пригодными и более всего подходят для введения белков, таких как гуманизированные антитела, но и другие способы введения, такие как трансдермальное введение или пероральное введение, также могут быть применены, а соответствующие лекарственные средства могут быть разработаны путем подходящей адаптации. Дополнительно желательным может быть применение лекарственных средств с контролированным высвобождением, с использованием биодеградирующих пленок или матриц, или осмотических мини-насосов, или систем доставки на основе декстрановых шариков, альгината или коллагена. Таким образом, лекарственные средства для введения антител в соответствии с данным изобретением имеются в наличии и могут быть выбраны из целого ряда вариантов. Типичные уровни дозирования могут быть оптимизированы с использованием стандартных клинических методов и будут зависеть от способа введения и состояния больного. В общем, дозы будут находиться в диапазоне от 10 мкг/кг/месяц до 10 мг/кг/месяц. В другом аспекте предполагается использование антител и их антигенсвязывающих частей в соответствии с изобретением в качестве медикамента для лечения аутоиммунного заболевания. В еще одном аспекте обеспечивается промышленное изделие, полезное для лечения или предотвращения описанных выше расстройств или состояний. Изделие содержит контейнер и маркировку. Пригодные контейнеры включают, например, флаконы, пузырьки, шприцы и пробирки. Контейнеры могут быть сделаны из разнообразных материалов, как, например, стекло или пластмасса. Контейнер содержит композицию антитела в соответствии с данным изобретением, которая эффективна при лечении- 16013506 и предотвращении расстройств, и может иметь стерильное впускное отверстие (например, контейнер может быть мешком для внутривенного раствора или пузырьком, имеющим пробку, поддающуюся прокалыванию иглой для подкожной инъекции). Активным агентом композиции является анти-IL-23 антитело в соответствии с данным изобретением. На этикетке, расположенной на контейнере или связанной с ним, указывают, что композиция используется для лечения выбранного состояния. Изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Дополнительно он может включать другие желательные с коммерческой и потребительской точки зрения компоненты, включающие другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению. Изобретение проиллюстрировано следующими примерами, которые ни в коей мере его не ограничивают. Пример 1. Анализ ингибирования IL-23. Анализ с мышиными спленоцитами используют для определения ингибирования активности IL-23,основанной на способности IL-23 стимулировать секрецию IL-17 клетками мышиной селезенки. Антитела в соответствии с данным изобретением сравнивают с MAb3 А 8 и коммерчески доступными мышиными моноклональными антителами, MAb1290 (R и D Системы). Основной протокол заключается в следующем. У мышей линии 1 BALB/c или C57BL/6 удаляют селезенку, собирают спленоциты и готовят одноклеточную суспензию. Спленоциты отмывают и ресуспендируют в полной RPMI системе (содержащей 1% второстепенных аминокислот, 1% пируват натрия, 2,5 мМ HEPES, 1% L-глутамин, 0,00035% 2-меркаптоэтанол, 1% пенициллин/стрептоцид, 10% термоинактивированный FCS и 50 нг/мл человеческий IL-2 (R и D Системы. Затем высевают спленоциты из расчета 500000 клеток на лунку в 96-луночный культуральный планшет в объеме 100 мкл. Человеческий IL-23 (R и D Системы) в концентрации 10 пМ предварительно инкубируют с 3 кратными последовательными разведениями тест-антител в диапазоне от 0,001 до 54 мкг/мл. Инкубирование осуществляют в отдельном аналитическом планшете при 37 С, 5% СО 2 в течение 90 мин. 100 мкл каждой предварительно инкубированной пробы затем добавляют в культуральный планшет, содержащий спленоциты, и инкубируют в течение 48-72 ч при 37 С, 5% СО 2. Сэндвич-ELISA набор для мышиного IL-23 (M1700, R и D Систем) используют для измерения количества IL-23 в каждом культуральном супернатанте. IC50 - это количество антитела, необходимое для нейтрализации 50% биоактивности IL-23 в спленоцитах мышей.IC50 для MAb3 А 8 и антитела в соответствии с данным изобретением, сопоставленные с IC50 и антителами для МАВ 1290 в анализе с мышиными спленоцитами, показаны в табл. 3. Иллюстративные антитела, MAbQF20 и MAbQF37, в значительной степени нейтрализующие стимулированную IL-23 секрецию IL-17 клетками селезенки мыши, имеют значение IC50 менее чем 20 пМ. Таблица 3 Пример 2. Нейтрализация человеческого IL-23. Инъецированный мыши человеческий IL-23 вместе с IL-2 способен стимулировать продуцирование мышиного IL-17 в клетках селезенки. Данное стимулирование IL-17 блокируется нейтрализующими антителами к р 19 субъединице IL-23 и демонстрируется ниже в мышиной модели in vivo с регистрацией ехvivo продуцирования IL-17. За 22 ч до стимулирования мышей, осуществляемого mIL-2 вместе с человеческим IL-23, животных подвергают первичному воздействию мышиного C57BL/6, инъецируемого с мышиным IL-2 (mIL-2). За 2 ч до стимулирования с mIL-2 и hIL-23 мышам инъецируют либо высокоаффинное гуманизированное антитело в соответствии с данным изобретением, либо подходящее изотопу (IgG4) контрольное антитело. Затем были сформированы следующие группы: время = 0, интраперитонеальная инъекция только mIL-2 (5 мкг) или mIL-2 (5 мкг) плюс человеческий IL-23 (10 мкг); 7 ч, интраперитонеальная инъекция только mIL-2 (10 мкг) или mIL-2 (10 мкг) плюс человеческий- 17013506 23 ч, интраперитонеальная инъекция только mIL-2 (5 мкг) или mIL-2 (5 мкг) плюс человеческий IL23 (10 мкг). Через 30 ч мышей умерщвляют, удаляют селезенки, собирают спленоциты и готовят одноклеточную суспензию. Спленоциты отмывают и ресуспендируют в полной RPMI системе (содержащей 1% второстепенных аминокислот, 1% пируват натрия, 2,5 мМ HEPES, 1% L-глутамин, 0,00035% 2 меркаптоэтанол, 1% пенициллин/стрептоцид, 10% термоинактивированный FCS) и высевают из расчета 200000 клеток/200 мкл на лунку в 96-луночный культуральный планшет, который предварительно покрывают антимышиными CD3e антителами хомяка (5 мкг/мл в PBS на ночь при 4 С). Затем 96-луночный планшет инкубируют в течение 48-72 ч при 37 С, 5% СО 2. Для измерения количества IL-17 в каждом культуральном супернатанте использовали сэндвичELISA набор для мышиного IL-17 (М 1700, R и D Систем). Как показано в табл. 4, MAbQF20 и MAbQF37 нейтрализировали IL-23 и в значительной степени блокировали стимулирование IL-17. Таблица 4BIAcore измерения (табл. 3). Поверхностный плазмонный резонанс BIAcore представляет собой автоматизированную биосенсорную систему, с помощью которой измеряют молекулярные взаимодействия(Karlsson, et al. (1991) J. Immunol. Methods 145: 229-240). В данных экспериментах антитела захватывали при низкой плотности на поверхности BIAcore чипа. Этилдиметиламинопропилкарбодиимид (EDC) использовали для связывания реактивных аминогрупп с белком А в проточной ячейке карбоксиметилового (СМ 5) BIAcore сенсорного чипа. Белок А разбавляли натрий-ацетатным буфером, рН 4,5, и иммобилизировали в проточной ячейке CM5 чипа, используя EDC до выхода 1000 ответных единиц. Непрореагировавшие сайты блокировали этаноламином. Использовали скорость потока, составляющую 60 мкл/мин. Циклы множественного связывания/элюции выполняли инъекцией 10 мкл раствора антител в соответствии с данным изобретением с концентрацией, составляющей 2 мкг/мл, после которого вводили человеческий IL-23 в сниженной концентрации для каждого цикла (например, 1500; 750; 375; 188; 94; 47; 23,5; 12 и 0 пкмоль). Элюирование проводили глицерином-HCl, рН 1,5. Оценочный BIA использовали для анализа кинетических данных.KD для MAb3 А 8 сравнивали с антителами в соответствии с данным изобретением и с коммерчески доступным анти-IL23 нейтрализующим моноклональным антителом MAb1290 (табл. 5). Результаты показали, что иллюстративные антитела, MAbQF20 и MAbQF37, имели константу аффинности в 2-6 раз менее,чем константа аффинности MAb3 А 8, имеющего значения KD от менее чем приблизительно 160 пМ. Таблица 5 Связывающие свойства анти-IL-23 антител к человеческому IL-23, определенные при помощи поверхностного плазменного резонанса (HBS-EP буфер, рН 7,4 при 25 С) мышиное моноклональное антитело к человеческому IL-23 (R и D Системы) Пример 4. Картирование эпитопов IL-23. Эпитоп р 19 субъединицы IL-23, распознанный при помощи гуманизированных антител в соответствии с данным изобретением, находится в пределах аминокислотных остатков 129-159 SEQ ID NO:60. Эпитоп определяли с помощью Amide Deuterium Exchange Mass Spectrometry (DXMS).DXMS полезен для определения протеин-протеиновых взаимодействий между р 19 субъединицей- 18013506 использовали как модель связывающего фрагмента. Отдельные эпитопы идентифицировали с помощью данной процедуры и включили в дополнение к остаткам 129-159 SEQ ID NO:60, остаткам 129-152; 151159 и 134-152, со всеми позициями остатков, исходя из SEQ ID NO:60. Стандартный конкурентный анализ ELISA использовали для определения наличия связывания гуманизированными антителами в соответствии с изобретением тех же эпитопов, которые связывалMAb3 А 8. Гуманизированные антитела-кандидаты анализировали с биотинилированным MAb3 А 8 в зависимом от концентрации способе. Концентрация-зависимое испытание показало, что конкурентные антитела в соответствии с данным изобретением связывают те же вышеуказанные эпитопы на зрелом IL-23. Таким образом, гуманизированные антитела в соответствии с данным изобретением связывают выше идентифицированные эпитопы р 19 субъединицы IL-23 и нейтрализуют активность IL-23 и, в связи с этим, полезны в лечении воспалительных заболеваний, связанных с экспрессией IL-23, таких как аутоиммунное заболевание, преимущественно рассеянный склероз. Пример 5. ЕАЕ (экспериментальный аутоиммунный энцефаломиелит) модель для рассеянного склероза. ЕАЕ представляет собой опосредованный CD4+ Т-клетками миелосклероз центральной нервной системы (ЦНС), который служит моделью для рассеянного склероза у человека (PC). Развитие патологических процессов ЕАЕ включает антиген-специфическую активацию Т-клеток, инфильтрацию Т-клеток и макрофагов в ЦНС и последующую дифференциацию Th1. IL-23 стимулирует секрецию IL-17 из Тклеток и IL-17 способствует развитию рассеянного склероза (PC). Повышенные уровни IL-23 были идентифицированы в сыворотке больных с PC и микрочип-анализ PC повреждений у больных людей продемонстрировал повышение уровня IL-17 (Lock, et al. Nat. Med. 8:500-508, 2002). В крови и в цереброспинальной жидкости больных рассеянным склерозом в значительной степени увеличено количество IL-17 мРНК-экспрессирующих мононуклеарных клеток (МНК) и было обнаружено повышенное количествоIL-17 мРНК-экспрессирующих МНК крови во время клинического обострения PC в сравнении с его ремиссией (Matusevicius, et al. Multiple Sclerosis, 5:1-1-104, 1999). Описанный в данной заявке пример демонстрирует действие анти-IL-23 антитела в модели рецидивирующе-ремитирующего ЕАЕ, где антитело к мышиному IL-23 ингибирует секрецию IL-17 из Т-клеток и поэтому снижает шкалу ЕАЕ в активной модели ЕАЕ. Для индуцирования болезни 8-9-недельным мышам линии SJL/J в две точки на боку в день 0 подкожно инъецировали 100 мкл полного адъюванта Фрейнда (CFA), содержащего 50 мкг пиридоксальфосфата 139-151 и 200 мкг Mycobacterium tuberculosisH37 RA. В первый день ремиссии (23-26 день) мышей случайным образом поделили на группы: (i) группа, обработанная носителем (забуференный фосфатом физиологический раствор (PBS, (ii) группа, обработанная контрольным антителом - изотоп IgG1, 10 мг/кг, и (iii) группа, обработанная мышиным моноклональным антителом IgG1 к мышиному IL-23, 10 мг/кг. Начиная с первого дня ремиссии, и затем еженедельно в течение 6 недель мышам интраперитонеально инъецировали по 0,2 мл вышеуказанных агентов. Начиная с 7 дня и по 60 день, мышей оценивали по уровням паралича. Мышей умерщвляли через неделю после последней обработки. Клинические признаки болезни развивались, начиная с приблизительно 12 дня по 15 день, с пиком болезни, находящимся в пределах с приблизительно 17 по 22 день. Отдельные животные субъективно оценивались, как минимум, 2 оценщиками согласно клинической тяжести ЦНС заболевания, независимо и не беря во внимание идентичные до степени смешения группы. Оценка 0 - это норма; оценка 0,5 - дистальная хромота или спастический хвост; оценка 1,5 - безвольный хвост и слабость задних конечностей; оценка 2,0 - односторонний частичный паралич задних конечностей; оценка 2,5 - двусторонний частичный паралич задних конечностей; оценка 3,0 - полный двусторонний паралич задних конечностей; оценка 3,5 - полный паралич задних конечностей и односторонний частичный паралич передних конечностей; оценка 4,0 - полный паралич передних и задних конечностей,оценка 5,0 - умирающее животное или смерть. Группа, обработанная IL-23 антителом, имела в значительной степени более низкие оценки в сравнении с группой, обработанной контрольным изотопом. В каждой обрабатываемой группе у мышей удаляли селезенки и готовили индивидуальные одноклеточные суспензии спленоцитов. Спленоциты культивировали в течение 2 дней в присутствии пиридоксальфосфата (пептида, используемого для индуцирования появления симптомов ЕАЕ, поэтому, таким образом, повторно стимулируя популяцию иммунокомпетентных клеток в ex-vivo установке). Через два дня культуральные супернатанты оценивали по концентрации 22 цитокинов/хемокинов (используя набор стандартов от Linco, Inc.). Культуральные супернатанты из группы, обработанной контрольным изотопом MAb, имели концентрацию IL-17, составляющую приблизительно 450 пг/мл, в то время как культуральные супернатанты из группы, обработанной анти-IL-23 MAb, имели концентрацию IL-17, составляющую приблизительно 175 пг/мл. Таким образом, в группе, обработанной анти-IL-23 MAb, наблюдается значительное снижение (р 0,002) концентрации мыщиного IL-17.
МПК / Метки
МПК: A61K 39/395, C07K 16/24, A61P 25/00
Метки: применение, il-23, антитело
Код ссылки
<a href="https://eas.patents.su/30-13506-antitelo-k-il-23-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антитело к il-23 и его применение</a>
Предыдущий патент: Способ снижения уровней акриламида в пищевых продуктах и используемая для этого композиция ферментов
Следующий патент: Фунгицидные смеси
Случайный патент: Фунгицидная композиция