Вакцина
Формула / Реферат
1. Применение белка L1 вируса папилломы человека (HPV) или его иммуногенного фрагмента из первого HPV-типа в изготовлении лекарственного средства для усиления иммунного ответа, ранее вызванного белком L1 вируса папилломы человека или его иммуногенным фрагментом из другого HPV-типа.
2. Применение по п.1, где второй тип является филогенетически родственным первому типу.
3. Применение по п.1 или 2 белка L1 HPV 31 или HPV 52 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент.
4. Применение по п.3 белка HPV 31 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент.
5. Применение по п.3 белка HPV 52 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент.
6. Применение по п.1 или 2 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 31 или HPV 52, содержащую белок L1 или его фрагмент.
7. Применение по п.6 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 31, содержащую белок L1 или его фрагмент.
8. Применение по п.6 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 52, содержащую белок L1 или его фрагмент.
9. Применение по п.1 или 2 белка L1 HPV 45 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 18, содержащую белок L1 или его фрагмент.
10. Применение по п.1 или 2 белка L1 HPV 18 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 45, содержащую белок L1 или его фрагмент.
11. Схема вакцинации для защиты от HPV-инфекции и/или заболевания, включающая доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент, по меньшей мере, из HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент по меньшей мере из одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал.
12. Способ предупреждения HPV-инфекции и/или заболевания, включающий доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент по меньшей мере из HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент по меньшей мере из одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал времени.
13. Способ или схема по п.11 или 12, где первая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 16, HPV 18 и, возможно, HPV 33.
14. Способ или схема по п.13, где первая вакцина дополнительно содержит белок L1 или его иммуногенный фрагмент из HPV 58.
15. Способ или схема по любому из пп.11-13, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31, и/или HPV 45, и/или HPV 52.
16. Способ или схема по п.15, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31 и HPV 45.
17. Способ или схема по п.16, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31, HPV 45 и HPV 52.
18. Способ или схема по любому из пп.11-17, где первая и вторая вакцины не имеют идентичных белков L1 или общих белковых фрагментов.
19. Способ или схема по любому из пп.11-18, где компонент HPV 16 или HPV 18 в первой вакцине защищает от HPV-инфекции и/или заболевания, вызванных по меньшей мере одним HPV-типом во второй вакцине.
20. Вакцинная композиция, содержащая комбинацию белка L1 HPV 31 или его иммуногенного фрагмента и белка L1 HPV 45 или его иммуногенного фрагмента, причем вакцина не содержит белок L1 HPV 16 или HPV 18 или его иммуногенные фрагменты.
21. Вакцинная композиция по п.20, включающая белок L1 HPV 52 или его иммуногенный фрагмент.
22. Набор, содержащий первую HPV-вакцину, содержащую белок L1 или его иммуногенный фрагмент, по меньшей мере, из HPV 16 и HPV 18, и вторую HPV-вакцину, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент по меньшей мере из одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал.
23. Набор по п.22, где первый вакцинный компонент содержит белки L1 HPV 16 и HPV 18 или их иммуногенные фрагменты, и второй вакцинный компонент содержит белки HPV 31 и HPV 45 или их иммуногенные фрагменты.
24. Применение, способ, схема, вакцина или набор по любому из пп.1-23, где белок L1 HPV находится в форме вирусоподобной частицы.
25. Применение, способ, схема, вакцина или набор по любому из пп.1-24, где первая или вторая вакцина либо обе вакцины содержат адъювант.
26. Применение, способ, схема, вакцина или набор по п.25, где адъювант содержит 3D-МФЛ.
27. Применение, способ, схема, вакцина или набор по п.25, где адъювант содержит соль алюминия.
28. Применение, способ, схема, вакцина или набор по п.26 или 27, где адъювант содержит соль алюминия и 3D-МФЛ.
29. Применение, способ, схема, вакцина или набор по п.26, где адъювант содержит адъювант на основе эмульсии масло-в-воде и 3D-МФЛ.
30. Применение, способ, схема, вакцина или набор по п.29, где эмульсия масло-в-воде содержит метаболизируемое масло, стерин и эмульгатор.
Текст
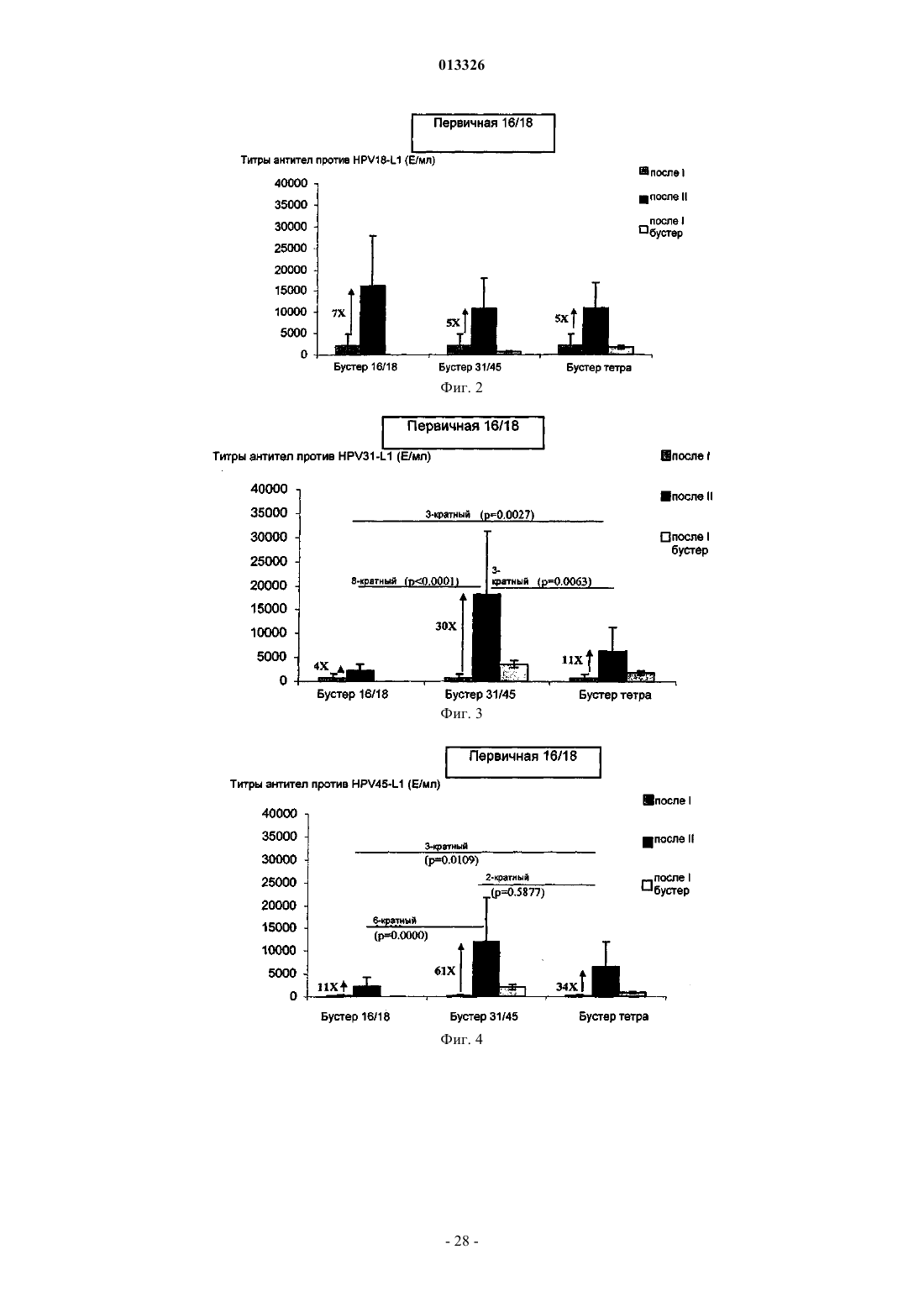
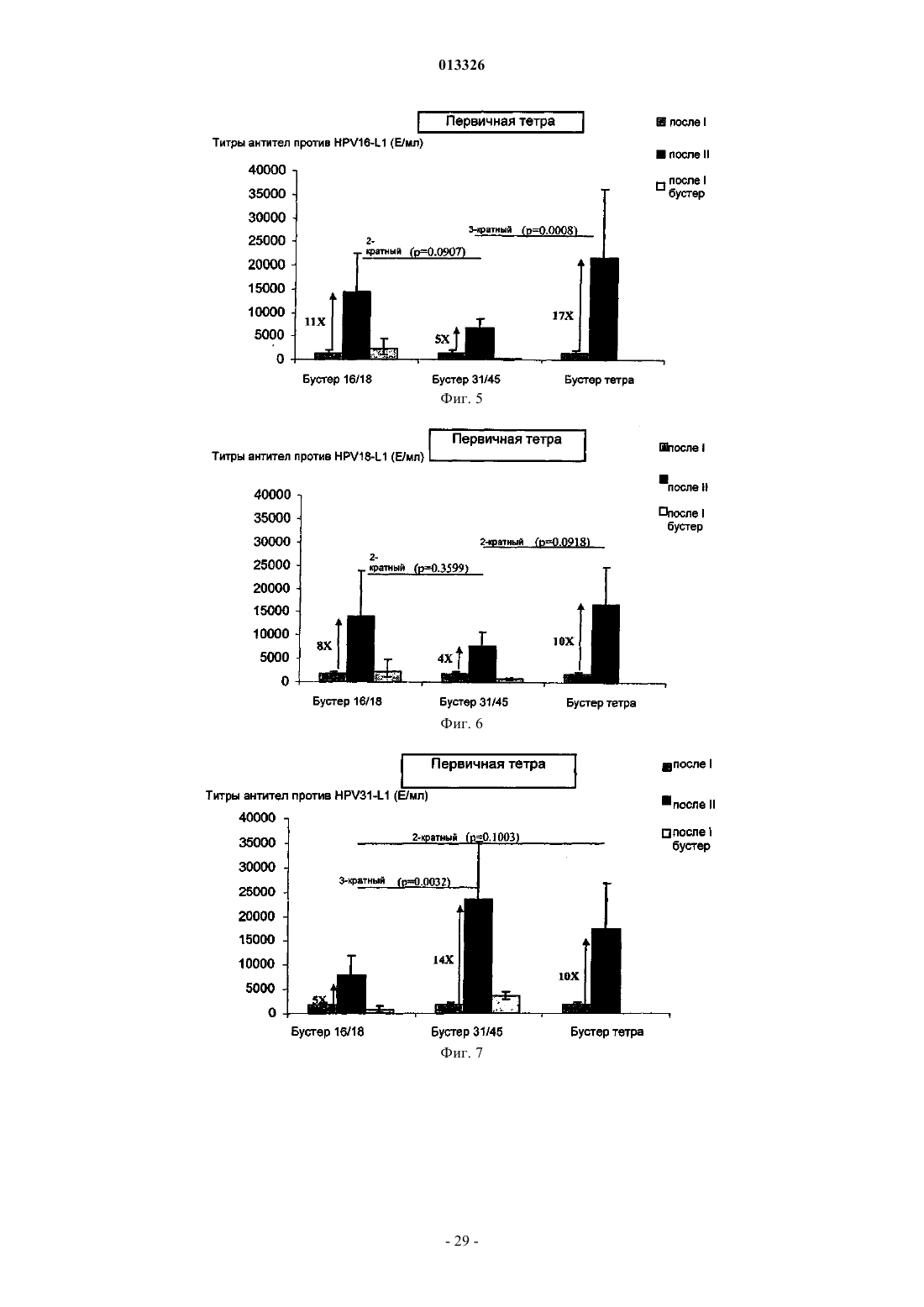
013326 Настоящее изобретение относится к вакцинам против вируса папилломы человека (HPV). Предшествующий уровень техники Вирусы папилломы представляют собой небольшие ДНК-содержащие опухолевые вирусы, которые являются высоко видоспецифичными. К настоящему времени описано свыше 100 индивидуальных генотипов вируса папилломы человека (HPV). HPV как правило специфичны в отношении кожи (напримерHPV-1 и -2) или поверхностей слизистых оболочек (например HPV-6 и -11) и обычно вызывают доброкачественные опухоли (бородавки), которые сохраняются в течение нескольких месяцев или лет. Такие доброкачественные опухоли могут беспокоить индивидов, но не представляют угрозу для жизни, за редким исключением. Некоторые HPV также ассоциированы с раком и известны как онкогенные HPV-типы. Самая сильная положительная взаимосвязь между HPV и раком у человека представляет собой взаимосвязь, существующую между HPV-16 и HPV-18 и раком шейки матки. Рак шейки матки представляет собой наиболее распространенную злокачественную опухоль в развивающихся странах, причем ежегодно в мире возникает 500000 новых случаев. Другие HPV-типы, которые могут вызвать рак, представляют собой типы 31, 33, 35, 39, 45, 51, 52,56, 58, 59, 66 и 68. Типы 16 и 18 представляют собой типы, которые имеют наибольшую взаимосвязь с раком шейки матки. Типы 31 и 45 представляют собой типы, которые имеют наибольшую взаимосвязь с риском возникновения рака (Munoz N., Bosch F.X., de Sanjose S. et al. International Agency for Research onCancer Multicenter Cervical Cancer Study Group. N Engl J Med 2003; 348: 518-27.) Предположили, что вирусоподобные частицы (VLP) HPV, представляют собой потенциальные вакцины для лечения HPV. Исследования на животных показали, что VLP не обеспечивают перекрестный иммунитет против инфекции, вызванной другими типами HPVсм., например, Suzich, J. A., et al., ProcNatl Acad Sci, 92: 11553-11557, 1995, и Breitburd, Seminars in Cancer Biology, vol. 9, 1999, pp 431-445. В WO 2004/056389 раскрыто, что вакцина на основе VLP HPV 16, 18 может обеспечить перекрестный иммунитет против инфекции, вызванной HPV-типами, отличными от 16 и 18. Статистически значимый иммунитет обнаружен против некоторых групп HPV-типов. Все еще сохраняется потребность в вакцине, которая защищает от множества HPV-типов. Краткое изложение сущности изобретения Настоящее изобретение относится к схеме вакцинации для защиты от HPV-инфекции и/или заболевания, включающей доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из по меньшей мере HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компонентыL1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности и доставку осуществляют с подходящим интервалом по времени. Настоящее изобретение дополнительно относится к схеме вакцинации для защиты от HPVинфекции или заболевания, включающей доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV 16 и HPV 18, и через подходящий интервал второйHPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPVтипа. Изобретение также относится к способу предупреждения HPV-инфекции и/или заболевания, включающему доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 иHPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставку осуществляют через подходящий интервал времени. Изобретение также относится к способу предупреждения HPV-инфекции и/или заболевания, включающему доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из по меньшей мере HPV 16 и HPV 18, и через подходящий интервал второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPV-типа. Изобретение также относится к вакцинным композициям по изобретению как таковым. Изобретение также относится к наборам, содержащим первую и вторую вакцинные композиции по изобретению. В одном из аспектов изобретение относится к применению белка L1 HPV или его иммуногенного фрагмента из первого HPV-типа в изготовлении лекарственного средства для усиления иммунного ответа, вызванного белком L1 HPV или его иммуногенным фрагментом из второго HPV-типа, отличного от первого. В одном из аспектов белок L1 или его фрагмент из второго HPV-типа находится в форме вирусоподобной частицы и используется для усиления ответа, вызванного белком L1 или его фрагментом из первого HPV-типа, также находящимся в форме вирусоподобной частицы. Изобретение также относится к применению L1 HPV, предпочтительно в форме VLP, из штаммовHPV, которые не представляют собой HPV 16, для усиления ответа против HPV 16.-1 013326 Изобретение также относится к применению L1, предпочтительно в форме VLP, из штаммов HPV,которые не представляют собой HPV 18, для усиления ответа против HPV 18. В одном из аспектов штаммы для усиления иммунного ответа представляют собой штаммы, для которых наблюдается некоторый уровень перекрестного иммунитета в примере 1, такие как HPV 31,HPV45 и HPV 52. Графические материалы Фиг. 1 и 5 иллюстрируют антитела, генерированные против HPV 16 с использованием различных схем первичной и бустер-иммунизации; фиг. 2 и 6 - антитела, генерированные против HPV 18 с использованием различных схем первичной и бустер-иммунизации; фиг. 3 и 7 - антитела, генерированные против HPV 31 с использованием различных схем первичной и бустер-иммунизации; фиг. 4 и 8 - антитела, генерированные против HPV 45 с использованием различных схем первичной и бустер-иммунизации; фиг. 9 - сводную информацию об ответах в виде антител на фиг. 1-8; фиг. 10 и 14 - % HPV 16 L1 специфических Т-клеток в популяции CD4+ с использованием различных схем первичной и бустер-иммунизации; фиг. 11 и 15 - % HPV 18 L1 специфических Т-клеток в популяции CD4+ с использованием различных схем первичной и бустер-иммунизации; фиг. 12 и 16 - % HPV 31 L1 специфических Т-клеток в популяции CD4+ с использованием различных схем первичной и бустер-иммунизации; фиг. 13 и 17 - % HPV 45 L1 специфических Т-клеток в популяции CD4+ с использованием различных схем первичной и бустер-иммунизации; фиг. 18 иллюстрирует сводные данные по клеточно-опосредованному иммунитету (CMI) на фиг. 10-13. Подробное описание изобретения Общая информация о существовании перекрестного иммунитета, обеспечиваемого HPV 16 и HPV 18 против эпизодической и хронической инфекции, оцениваемого в отношении некоторых групп HPVтипов, раскрыта в WO2004/056389. Авторы изобретения неожиданно обнаружили, что перекрестный иммунитет против некоторых (отличных от HPV 16, HPV 18) HPV-типов (оцениваемый по эффективности вакцины на основе HPV 16 иHPV 18 против этих типов) выше, чем против некоторых других (отличных от HPV 16, HPV 18) HPVтипов. Перекрестный иммунитет можно рассматривать как иммунитет, обеспечиваемый вакциной, содержащей один HPV-тип, против инфекции (эпизодической или хронической) и/или заболевания, вызванных другим HPV-типом. Перекрестный иммунитет можно оценить с учетом эффективности вакцины(Э.В.), где Э.В. представляет собой % улучшения защиты против инфекции или заболевания с помощью вакцины по сравнению с группой плацебо для данного типа. Инфекция может быть эпизодической или хронической. Заболевание может представлять собой аномальную цитологию, атипичные плоские клетки невыясненной этиологии (ASCUS), CIN1, CIN2,CIN3 или рак шейки матки, связанный с HPV-инфекцией. Инфекцию можно оценить, например, путем полимеразной цепной реакции (ПЦР). Заболевание можно оценить путем гистологического исследования или анализа биомаркеров, таких как р 16. Считают, что имеется некоторый уровень перекрестного иммунитета, когда перекрестный иммунитет является статистически более значимым по сравнению с тем, который обеспечивает плацебо. Подходящий уровень перекрестного иммунитета составляет более 0% и до 20%, до 40%, до 60%, до 70%, до 80% или более 80%, измеренный по эффективности HPV-вакцины против инфекции или заболевания,вызванного HPV-типом, не присутствующим в вакцине, по сравнению с плацебо. Такое обнаружение имеет потенциальное значение для разработки вакцины и разработки схем вакцинации. Например, типы, для которых обнаружен перекрестный иммунитет, могут быть использованы друг для друга в качестве первичной или бустер-иммунизации через подходящий интервал, а также для обеспечения гомологичной защиты и могут дать возможность для снижения количества вакцинаций для любого данного HPV-типа. Настоящее изобретение относится к схеме вакцинации для защиты от HPV-инфекции или заболевания, включающей доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из по меньшей мере HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компонентыL1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности и доставки осуществляют через подходящий интервал. Подходящий интервал может составлять 7 суток, 2 недели, 4 недели, 6 недель, 8 недель, 3 месяца, 4,месяца, 5 месяцев, 6 месяцев, 1 год. Схемы вакцинации могут составлять, например, 0, 1 месяц, или 0, 2 месяца или 0, 4 месяца или 0, 6 месяцев. Как правило, подходящий интервал представляет собой такой-2 013326 интервал, в течение которого может наблюдаться бустер-эффект вакцины, которую доставляют второй,например по измерению титров антител или клеточно-опосредованного иммунитета. Как правило, подходящий интервал представляет собой такой интервал, в течение которого первичный иммунный ответ вызывают путем доставки вакцины, что измеряют, например, по титрам антител в сыворотке крови, перед доставкой второй вакцины. В одном из аспектов подходящий интервал равен интервалу, следующему непосредственно за пиком первичного ответа, типично ответа в виде антител. В одном из аспектов этот интервал составляет от 2-26 недель после первичной вакцинации, подходящим образом 2-22 недели,2-18 недель, 2-14 недель, 2-12 недель, 2-10 недель, 2-8 недель, 2-6 недель, и в одном из аспектов 1 месяц после первичной вакцинации. Онкогенные HPV-типы включают HPV31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68. Подходящим образом, перекрестный иммунитет наблюдают между по меньшей мере одним компонентом первой вакцины и одним компонентом второй вакцины. Сама по себе первая вакцина подходящим образом содержит белок L1 или его иммуногенный фрагмент из HPV 16 и HPV 18, а вторая вакцина подходящим образом содержит белок L1 или его иммуногенный фрагмент из HPV 31, или HPV 45, илиHPV 52. В одном из аспектов первая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 16 и HPV 18. В дополнительном аспекте первая вакцина содержит белок L1 или его иммуногенный фрагмент из дополнительных HPV-типов, таких как один или более чем один из HPV-типов 31, 33, 35, 39, 45,51, 52, 56, 58, 59, 66, 68. В одном из аспектов HPV-тип представляет собой HPV 33. В еще одном аспекте вторая вакцина исключает присутствие по меньшей мере антигенов HPV 16 и 18 в первой вакцине и содержит белок L1 или его иммуногенный фрагмент HPV-типа, для которого показано, что он обладает перекрестно-защитным взаимодействием с HPV 16 и/или HPV 18, подходящим образом HPV 31 и/или 45 и/или 52. Вторая вакцина может включать дополнительные типы, такие как один или более чем один из HPV 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. В одном из аспектов вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31 и/или HPV 45. В еще одном аспекте вторая вакцина включает белок L1 или его иммуногенный фрагмент из типа 52. В еще одном аспекте вторая вакцина включает белок L1 или его иммуногенный фрагмент из типа 58. Таким образом, изобретение относится к вакцинной композиции, содержащей белок L1 или его иммуногенный фрагмент из HPV 31, но не содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV16 и HPV18. Изобретение также относится к вакцинной композиции, содержащей белок L1 или его иммуногенный фрагмент из HPV 45, но не содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV 16 и HPV 18. Изобретение также относится к вакцинной композиции, содержащей белок L1 или его иммуногенный фрагмент из HPV 52, но не содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV 16 и HPV 18. В еще одном аспекте вторая вакцина не включает все L1 HPV, содержащие антигены первой вакцины. Подходящим образом, первая и вторая вакцины не содержат идентичные белки L1 или идентичные фрагменты полноразмерного белка. Для того чтобы избежать неопределенности, могут существовать области в белках L1 или фрагментах L1, используемых в первой и второй вакцине, которые подобны или идентичны. Тем не менее, применение идентичных антигенов, где антиген представляет собой полноразмерный L1 или его фрагмент, в первой и второй вакцине в этом аспекте не является предпочтительным. В одном из аспектов первая и вторая вакцины не содержат белок L1 HPV или его иммуногенный фрагмент из того же типа HPV. В одном из аспектов компоненты первой вакцины содержит виды HPV, которые филогенетически не родственны, такие как HPV 16 и HPV 18. В одном из аспектов компоненты второй вакцины содержат виды HPV, которые филогенетически не родственны, такие как HPV 31 и HPV45. Филогенетически неродственные типы находятся в группах различных видов, как оценено deVilliers et al. Virology. 2004 Jun 20; 324(l): 17-27. Подходящим образом, компоненты HPV 16 и/или HPV 18 в первом вакцинном компоненте защищают от HPV-инфекции и/или заболевания, вызванных по меньшей мере одним HPV-типом во второй вакцине. Подходящим образом первая и вторая вакцины по изобретению содержат L1 VLP HPV следующих Подходящим образом, вакцина, доставляемая второй, усиливает иммунный ответ против по меньшей мере одного компонента в вакцине, доставляемой первой. Усиление подходящим образом может быть измерено, например, по титрам антител с использованием способов, стандартных в данной области техники, таких как твердофазный иммуноферментный анализ (ИФА). В одном из аспектов белок L1 HPV или его иммуногенный фрагмент использован для усиления уровня перекрестно реактивных антител, ранее вызванных другим HPV-типом. В одном из аспектов изобретение относится к применению белка L1 или его иммуногенного фрагмента из одного HPV-типа для усиления иммунного ответа против второго HPV-типа, отличного от первого. В одном из аспектов изобретение относится к применению белка L1 или его иммуногенного фрагмента одного HPV-типа для усиления иммунного против гомологичного HPV-типа. В одном из аспектов изобретение относится к применению белка L1 или его иммуногенного фрагмента из одного HPV-типа для усиления иммунного ответа против второго HPV-типа, отличного от первого, где второй тип филогенетически родственен первому типу. Филогенетическое родство между HPVтипами хорошо известно в данной области техники (смотри, например de Villers et al. Virology. 2004 Jun 20; 324(l): 17-27). В этой публикации можно обнаружить, что папилломавирусы находятся в различных видах, которые являются филогенетически родственными. Например, в виде 16 обнаружены типы 16, 31,33. В виде 7 обнаружены типы 18 и 45. В еще одном аспекте изобретение относится к применению белка L1 HPV 31 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16 (генерированного вакциной HPV 16), содержащую белок L1 или его фрагмент. В еще одном аспекте изобретение относится к применению белка L1 HPV 52 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент. В еще одном аспекте изобретение относится к применению белка L1 HPV 45 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 18, содержащую белок L1 или его фрагмент. В еще одном аспекте изобретение относится к применению белка L1 HPV 18 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 45, содержащую белок L1 или его фрагмент. В еще одном аспекте изобретение относится к применению белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 31, содержащую белок L1 или его фрагмент. В еще одном аспекте изобретение относится к применению белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 52, содержащую белок L1 или его фрагмент. В одном из аспектов настоящее изобретение относится к схеме вакцинации для защиты от HPVинфекции или заболевания, включающей доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент из, по меньшей мере, HPV 16 и HPV 18, и через подходящий интервал второйHPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPVтипа. В этом аспекте изобретения компоненты определенных выше первой и второй вакцин могут быть доставлены в обратной последовательности. В качестве примера первый HPV, который доставляют, может содержать антигены HPV 31 и HPV 45, тогда как вторая вакцина, которую доставляют, содержит антигены HPV 16 и HPV 18. Вакцины по изобретению дополнительно могут включать, с ограничениями по изобретению, антигены из других HPV-типов, таких как другие антигенные онкогенные типы (например HPV 31, 33, 35, 39,45, 51, 52, 56, 58, 59, 66, 68), кожные типы (например типы 5, 8) и типы остроконечных кондилом (6, 11). Подходящим образом, каждая вакцина способна защищать против хронической инфекции HPVтипами, присутствующими в вакцине. Подходящим образом, каждая вакцина способна обеспечивать защиту против эпизодической инфекции HPV-типами, присутствующими в вакцине. Эпизодическая и хроническая инфекция шейки матки определены в примере 1. Подходящим образом, каждая вакцина способна защищать против цитологических аномалий, связанных с HPV-инфекцией (например ASCUS, CIN 1, CIN2, CIN3, рак шейки матки), соответственно вызванной типами, не присутствующими в вакцине, такими как HPV 31, 45 или 52.-4 013326 Белок L1 или белковые фрагменты дополнительных HPV-типов могут быть включены в вакцину по изобретению, такие как кожные типы (в частности HPV 5 и 8) и типы, ассоциированные с остроконечными кондиломами, такие как HPV 6 и 11. Типы 6 и 11 здесь не рассматривают как онкогенные типы. В одном из аспектов вакцина может содержать компоненты белка L1 HPV, предпочтительно в виде вирусоподобных частиц, в различных количествах. В одном из аспектов VLP HPV 16 и HPV 18 могут быть предложены в более высокой дозе по сравнению с другими онкогенными типами, такими как HPV 33 или 58. В одном из аспектов предложены VLP только HPV 16 и HPV 18 L1 в количестве 20 мкг на дозу для применения у людей. Другие VLP HPV могут быть использованы в меньшей дозе, такой как 15 или 10 мкг на дозу для применения у людей. В одном из аспектов изобретения вакцина может содержать ранний антиген HPV, например антиген, выбранный из перечня, состоящего из Е 1, Е 2, Е 3, Е 4, Е 5, Е 6, Е 7 или Е 8 HPV. В альтернативном аспекте вакцина может быть лишена раннего антигена HPV, например антигена, выбранного из перечня,состоящего из Е 1, Е 2, Е 3, Е 4, Е 5, Е 6, Е 7 или Е 8 HPV. В одном из аспектов вакцинный компонент по изобретению является трехвалентным (содержит L1HPV или его фрагмент из 3 различных онкогенных HPV-типов). В еще одном аспекте вакцина является тетравалентной. В еще одном аспекте вакцина является пентавалентной. В еще одном аспекте вакцина является гексавалентной. В еще одном аспекте вакцина является гептавалентной. В еще одном аспекте вакцина является октавалентной. Здесь также рассмотрены более высокие валентности. В дополнительных аспектах вакцина, по меньшей мере, является тетравалентной, или по меньшей мере, пентавалентной, или, по меньшей мере, гексавалентной, или по меньшей мере гептавалентной или по меньшей мере октавалентной в отношении онкогенных HPV-типов. В еще одном аспекте комбинированные вакцины по изобретению содержат белок L1 или его иммуногенные фрагменты из 4, 5, 6, 7, 8, 9 или 10 различныхHPV-типов. Предпочтительно комбинация компонентов HPV в вакцине не влияет значительно на иммуногенность любого из компонентов HPV. В частности, предпочтительно, чтобы отсутствовала биологически релевантная интерференция между антигенами HPV в комбинации по изобретению, так что комбинированная вакцина по изобретению способна обеспечивать эффективный иммунитет против инфекции, вызванной каждым генотипом HPV, представленным в вакцине. Подходящим образом, иммунный ответ против данного HPV-типа в комбинации составляет по меньшей мере 50% от иммунного ответа того же самого HPV-типа при индивидуальном измерении, предпочтительно 100% или, по существу, 100%. В отношении ответов на HPV 16 и HPV 18 комбинированная вакцина по изобретению предпочтительно стимулирует иммунный ответ, который составляет по меньшей мере 50% от обеспечиваемого комбинированной HPV 16/HPV 18 вакциной. Подходящим образом, иммунный ответ, генерируемый вакциной по изобретению, находится на уровне, при котором все еще обнаруживается защитный эффект каждогоHPV-типа. Иммунный ответ может быть измерен подходящим образом, например путем ответа в виде антител, в доклинических исследованиях или экспериментах на людях. Измерение ответов в виде антител хорошо известно в данной области техники и раскрыто (например) в WO 03/077942. Когда вакцина или композиция по изобретению содержит иммуногенный фрагмент L1, то подходящие иммуногенные фрагменты L1 HPV включают мутанты L1 по усечениям, делециям, заменам или вставкам. Такие иммуногенные фрагменты подходящим образом способны увеличивать иммунный ответ(при необходимости с адъювантом), причем указанный иммунный ответ способен распознавать белокL1, такой как вирусоподобную частицу, из HPV-типа, от которого белок L1 происходит. В одном из аспектов подходящий иммуногенный фрагмент HPV 16 способен обеспечивать перекрестный иммунитет против по меньшей мере одного из HPV 31 и HPV 52 и, в одном из аспектов изобретения, способен обеспечивать перекрестный иммунитет против обоих. В еще одном аспекте подходящий иммуногенный фрагмент HPV 18 обеспечивать перекрестный иммунитет против HPV 45. Перекрестный иммунитет, обеспечиваемый иммуногенными фрагментами HPV 16 и/или HPV 18,может быть оценен в исследованиях на людях, например как изложено в примере 1. Аналогично, различные вакцины по настоящему изобретению могут быть тестированы с использованием стандартных способов, например как в примере 1, или в стандартных доклинических моделях,для подтверждения того, что вакцина является иммуногенной. Подходящие иммуногенные фрагменты L1 включают усеченные белки L1. В одном из аспектов усечением удаляют сигнал ядерной локализации. В еще одном аспекте усечение представляет собой усечение С-конца. В еще одном аспекте усечением С-конца удаляют менее чем 50 аминокислот, подходящим образом предпочтительно менее чем 40 аминокислот. Когда L1 получен из HPV 16, то в еще одном аспекте усечением С-конца удаляют 34 аминокислоты из L1 HPV 16. Когда L1 получен из HPV 18, то в еще одном аспекте усечением С-конца удаляют 35 аминокислот из L1 HPV 18. В одном из аспектов последовательность HPV 16 представляет собой следующую последовательность (SEQ ID NO:1): В еще одном аспекте изобретение относится к вирусоподобным частицам, состоящим только из L1HPV 16, имеющим представленную выше аминокислотную последовательность, и к композициям, содержащим такие VLP. Последовательность HPV 16 также может представлять собой последовательность, раскрытую вWO 9405792 или US 6649167, например усеченную подходящим образом. Подходящие усечения представляют собой усечения в положении, эквивалентном изображенному выше, как оценивают путем сравнения последовательностей. В одном из аспектов последовательность HPV 18 представляет собой следующую последовательность (SEQ ID NO: 2): В еще одном аспекте изобретение относится к вирусоподобным частицам, состоящим только из L1HPV 18, имеющим представленную выше аминокислотную последовательность, и к композициям, содержащим такие VLP. Альтернативная последовательность HPV 18, раскрытая в WO 9629413, может быть усечена подходящим образом. Подходящие усечения осуществлены в положении, эквивалентном изображенному выше, как оценивают путем сравнения последовательностей. Другие последовательности HPV 16 и HPV 18 хорошо известны в данной области техники и могут быть подходящими для применения по настоящему изобретению. Когда белок L1 получен из другого HPV-типа, то могут быть использованы С-концевые усечения,соответствующие полученным для HPV 16 и HPV 18, основываясь на сопоставлении последовательности ДНК или белка. Также могут быть получены подходящие усечения HPV 31, HPV 45, HPV 52, HPV 58, HPV 33 в одном из аспектов путем удаления С-концевых фрагментов белка L1, эквивалентных описанным выше, как оценивают путем совмещения последовательностей. Нуклеотидная последовательность усеченного L1 из серотипа 31 (SEQ ID NO:5) В еще одном аспекте изобретение относится к вирусоподобным частицам, состоящим только из L1HPV 31, имеющим аминокислотную последовательность, кодируемую представленной выше последовательностью, и к композициям, содержащим такие VLP. Нуклеотидная последовательность усеченного L1 из серотипа 45 (SEQ ID NO:6) В еще одном аспекте изобретение относится к вирусоподобным частицам, состоящим только из L1HPV 45, имеющим аминокислотную последовательность, кодируемую представленной выше последовательностью, и к композициям, содержащим такие VLP. Белок L1 или его фрагмент по изобретению могут находиться в форме слитого белка, такого как слияние белка L1 с L2 или ранним белком. Белок L1 HPV подходящим образом находится в форме капсомера или вирусоподобной частицы(VLP). В одном из аспектов в настоящем изобретении могут быть использованы VLP HPV. VLP HPV и способы получения VLP хорошо известны в данной области техники. Как правило, VLP конструируют из структурных белков L1 и возможно L2 вируса, см., например, WO 9420137, US 5985610, WO 9611272,US 6599508B1, US 6361778B1, ЕР 595935. Любая подходящая VLP HPV может быть использована в настоящем изобретении, которая обеспечивает перекрестный иммунитет, например L1 или L1 + L2 VLP. Подходящим образом, VLP представляет собой только L1 VLP. Образование VLP может быть оценено стандартными способами, такими как, например, электронная микроскопия и динамическое лазерное светорассеяние.VLP может включать полноразмерный белок L1. В одном из аспектов белок L1, использованный с образованием VLP, представляет собой усеченный белок L1, как описано выше.VLP могут быть получены в любом подходящем клеточном субстрате, таком как клетки дрожжейVLP подходящим образом получают с использованием способов разборки и обратной сборки, которые могут привести к получению более стабильных и/или гомогенных VLP вируса папилломы. Например, в McCarthy et al, 1998 "Quantitative Disassembly and Reassembly of Human Papillomavirus Type 11 Virus like Particles in Vitro", J. Virology 72(1):33-41 описана разборка и обратная сборка рекомбинантных L1VLP HPV 11, очищенных из клеток насекомых, с получением гомогенного препарата VLP. В WO9913056 и US6245568 также описаны способы разборки/обратной сборки для получения VLP HPV. В одном из аспектов VLP HPV по изобретению получают в соответствии с описанным в WO 9913056 или US 6245568.L1 HPV по изобретению можно объединять с адъювантом или иммуностимулятором, таким как детоксифицированный липид А из любого источника и нетоксичные производные липида А, сапонины и другие реагенты, способные стимулировать ответ ТН 1-типа, но не ограниченным ими. Давно известно, что энтеробактериальный липополисахарид (ЛПС) представляет собой сильный стимулятор иммунной системы, хотя его применение в адъювантах ограничено его токсическими действиями. Нетоксичное производное ЛПС, представляющее собой монофосфориллипид А (МФЛ), получаемое путем удаления коровой углеводной группы и фосфата из глюкозамина с редуцирующим концом,описано Ribi et al (1986, Immunology и Immunopharmacology of bacterial endotoxins, Plenum Publ. Corp.,NY, p 407-419) и имеет следующую структуру: Еще один детоксифицированный вариант МФЛ является результатом удаления ацильной цепи из положения 3 дисахаридной цепи и назван 3-O-деацилированным монофосфориллипидом A (3D-МФЛ). Он может быть очищен и получен способами, раскрытыми в GB 2122204 В, в котором также раскрыт препарат дифосфориллипида А и его 3-О-деацилированных вариантов. Подходящая форма 3D-МФЛ находится в форме эмульсии, имеющей небольшой размер частиц, составляющий в диаметре менее 0,2 мкм, и способ ее изготовления раскрыт в WO 94/21292. Водные препараты, включающие монофосфориллипид А и поверхностно-активное вещество, описаны в WO 9843670A2. Адъюванты на основе бактериального липополисахарида, которые включают в состав композиций по настоящему изобретению, могут быть очищены и получены из бактериальных источников или, альтернативно, они могут быть синтетическими. Например, очищенный монофосфориллипид А описан Ribiet al. 1986 (выше), и 3-О-деацилированный монофосфорил или дифосфориллипид А, полученный из Salmonella sp., описан в GB 2220211 и US 4912094. Описаны другие очищенные и синтетические липополисахариды (Hilgers et al., 1986, Int. Arch. Allergy. Immunol, 79(4):392-6; Hilgers et al., 1987, Immunology,60(l):141-6; и ЕР 0549074 B1). В одном из аспектов адъювант на основе бактериального липополисахарида представляет собой 3D-МФЛ. Соответственно, производные ЛПС, которые могут быть использованы в настоящем изобретении,представляют собой такие иммуностимуляторы, которые по структуре подобны структуре ЛПС или МФЛ, или 3D-МФЛ. В еще одном аспекте настоящего изобретения производные ЛПС могут представлять собой ацилированный моносахарид, представляющий собой субфрагмент вышеописанной структуры МФЛ. Сапонины упомянуты в Lacaille-Dubois, M. and Wagner H. (1996. A review of the biological and pharmacological activities of saponins. Phytomedicine vol. 2 pp 363-386). Сапонины представляют собой стероидные или тритерпеновые гликозиды, широко распространенные в царствах растений и морских животных. Сапонины примечательны тем, что образуют коллоидные растворы в воде, которые пенятся при-8 013326 встряхивании, и что осаждают холестерин. Когда сапонины находятся около клеточных мембран, они образуют порообразные структуры в мембране, что приводит к разрыву мембраны. Гемолиз эритроцитов представляет собой пример этого явления, которое представляет собой свойство некоторых, а не всех сапонинов. Сапонины известны в качестве адъювантов в вакцинах для системного введения. Адъювантная и гемолитическая активность индивидуальных сапонинов широко исследованы в данной области техники(Lacaille-Dubois and Wagner, выше). Например, Quil А (полученный из коры североамериканского дереваQuillaja Saponaria Molina) и его фракции описаны в US 5057540 и "Saponins as vaccine adjuvants", Kensil,С. R., Crit Rev Ther Drug Carrier Syst, 1996, 12 (1-2): 1-55; и ЕР 0362279 B1. Структуры частиц, названных иммуностимулирующими комплексами (ИСК), включающих фракции Quil A, являются гемолитическими и используются в изготовлении вакцин (Morein, В., ЕР 0109942 В 1; WO 96/11711; WO 96/33739). Гемолитические сапонины QS21 и QS17 (Фракции Quil А, очищенные с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ, описаны в качестве сильных системных адъювантов, и способ их получения раскрыт в патенте США 5057540 и ЕР 0362279 В 1. Другие сапонины, которые используют в исследованиях системной вакцинации, включают сапонины, полученные из других видов растений,таких как Gypsophila и Saponaria (Bomford et al., Vaccine, 10(9):572-577, 1992). Усиленная система включает комбинацию нетоксичного производного липида А и сапонинового производного, в частности комбинацию QS21 и 3D-МФЛ, раскрытую в WO 94/00153, или менее реактивную композицию, в которой QS21 гасят холестерином, как раскрыто в WO 96/33739. В WO 95/17210 описан особенно сильный адъювантный препарат, содержащий QS21 и 3D-МФЛ в эмульсии масло-в-воде, и применение этого адъюванта образует один из аспектов данного изобретения. Соответственно, в одном из воплощений настоящего изобретения предложена вакцина с детоксифицированным липидом А или нетоксичным производным липида А в качестве адъюванта, более предпочтительно с монофосфориллипидом А или его производным в качестве адъюванта. В одном из аспектов вакцина дополнительно включает сапонин, например QS21. В одном из аспектов препарат включает эмульсию масло-в-воде. В настоящем изобретении также предложен способ изготовления вакцинного препарата, включающий смешивание L1 пептида по настоящему изобретению с фармацевтически приемлемым эксципиентом, таким как 3D-МФЛ. Дополнительные компоненты, которые могут быть включены в вакцинный препарат по изобретению, включают неионные детергенты, такие как октоксинолы и полиоксиэтиленовые эфиры, как здесь описано, в частности трет-октилфеноксиполиэтоксиэтанол (Triton X-100) и моноолеат полиоксиэтиленсорбита (Tween 80); и соли желчных кислот или производные холиновой кислоты, как здесь описано, в частности дезоксихолат натрия или тауродезоксихолат. Таким образом, в одном из аспектов изобретения препарат содержит 3D-МФЛ, Triton X-100, Tween 80 и дезоксихолат натрия, которые можно объединять с антигенным препаратом L2 с получением подходящей вакцины. В одном из воплощений настоящего изобретения вакцина включает везикулярный адъювантный препарат, содержащий холестерин, сапонин и производное ЛПС. В этой связи адъювантный препарат подходящим образом содержит моноламеллярную везикулу, включающую холестерин, имеющую липидный бислой, подходящим образом содержащий диолеоилфосфатидилхолин, где сапонин и производное ЛПС ассоциированы с липидным бислоем или внедрены в него. В одном из аспектов эти адъювантные препараты содержат QS21 в качестве сапонина и 3D-МФЛ в качестве производного ЛПС, где отношение QS21:холестерин составляет от 1:1 до 1:100 мас./мас., и в одном из аспектов отношение 1:5 мас./мас. Такие адъювантные препараты описаны в ЕР 0822831 В, который включен в данное описание ссылкой. Подходящим образом вакцины по изобретению применяют в комбинации с алюминием, и подходящим образом они адсорбированы или частично адсорбированы на алюминиевых адъювантах. Подходящим образом, адъювант представляет собой соль алюминия, которая может находиться в комбинации с 3D-МФЛ, такой как фосфат алюминия и 3D-МФЛ. Также подходит гидроксид алюминия, возможно в комбинации с 3D-МФЛ. В еще одном аспекте настоящего изобретения вакцина содержит комбинацию VLP HPV с солью алюминия или солью алюминия + 3D-МФЛ. Гидроксид алюминия подходит в качестве соли алюминия. Вакцина также может содержать алюминий или алюминиевое соединение в качестве стабилизатора. В еще одном аспекте адъювант может представлять собой комбинацию адъюванта на основе эмульсии масло-в-воде и 3D-МФЛ. В одном из аспектов эмульсия масло-в-воде содержит метаболизируемое масло, стерин и эмульгатор. Вакцины по изобретению могут быть доставлены при помощи любого из множества путей, таких как пероральная доставка (например см. WO 9961052 А 2), местный, подкожный путь, введение в слизистые оболочки (как правило, внутривагинально), внутривенный, внутримышечный, интраназальный,подъязычный, внутрикожный путь и при помощи суппозитория. Возможно, вакцина также может быть приготовлена или введена вместе с другими антигенами HPV или антигенами, отличными от HPV. Подходящим образом, эти антигены, отличные от HPV, могут обеспечивать иммунитет против других заболеваний, таких как заболевания, передающиеся половым путем,-9 013326 таких как вирус простого герпеса, вирус Эпштейна-Барр (EBV), хламидии и вирус иммунодефицита человека (HIV). Авторы изобретения предпочитают, чтобы вакцина включала gD или его усеченный вариант на основе вируса простого герпеса (HSV). Таким образом, вакцина обеспечивает иммунитет противHPV и HSV. Доза компонентов вакцины варьирует в зависимости от состояния, пола, возраста и массы индивида, пути введения и HPV вакцины. Количество также может варьировать в зависимости от количества типов VLP. Подходящим образом, доставляют количество вакцины, подходящее для того, чтобы вызвать иммунологически защитный ответ. Подходящим образом, каждая доза вакцины включает 1-100 мкг каждой VLP, в одном из аспектов 5-80 мкг, в еще одном аспекте 5-30 мкг каждой VLP, в еще одном аспекте 5-20 мкг каждой VLP, в еще одном аспекте 5, 6, 10, 15 или 20 мкг. Для всех вакцин по изобретению в одном из аспектов вакцину используют для вакцинации девушек-подростков в возрасте 10-15 лет, таких как 10-13 лет. Тем не менее, также могут быть вакцинированы более старшие девушки в возрасте больше 15 лет и взрослые женщины. Вакцина также может быть введена женщине в случае аномального мазка по Папаниколау или после хирургического вмешательства по удалению повреждения, вызванного HPV, или тем, кто являются серонегативными и ДНКнегативными в отношении онкогенных HPV-типов. Вакцина по изобретению может быть использована для мужчин. В одном из аспектов вакцину вводят в 2 дозы, например в соответствии со схемой, соответственно,0, 1 месяц или 0, 6 месяцев. Подходящим образом, схема вакцинации включает бустер-инъекцию через 510 лет, например 10 лет. В одном из аспектов изобретение относится к трехдозовой вакцине, в которой(например) доставляют первую вакцину и вторую вакцину, причем первая и вторая вакцина отличаются,с последующим введением третьей вакцины, содержащей один или более чем один или все элементыHPV первой или второй вакцин. В одном из аспектов первая и вторая вакцины полностью отличаются в отношении компонентов L1 HPV. Например, первая вакцина может содержать или состоять из белка L1 HPV 16 и HPV 18. Вторая вакцина может состоять из белка L1 HPV 31 и HPV 45. Третья вакцина может содержать белок L1 из всех 4 HPV-типов: HPV 16, 18, 31 и 45. В одном из аспектов изобретение относится к трехдозовой вакцине, в которой (например) доставляют первую HPV-вакцину и вторую HPV-вакцину, причем первая и вторая вакцина отличаются, с последующим введением третьей вакцины, где третья вакцина не содержит ни одного из компонентов L1HPV первой или второй вакцин. В одном из аспектов вакцина представляет собой жидкий вакцинный препарат, хотя вакцина может быть лиофилизирована и разведена перед введением. Сущность всех источников информации в настоящей заявке, включая заявки на патенты и выданные патенты, включены в данное описание ссылкой. Вакцины по изобретению содержат некоторые компоненты HPV, как изложено выше. В еще одном аспекте изобретения вакцина состоит по существу или состоит из указанных компонентов. Используемый в настоящем изобретении термин "вакцина" относится к композиции, содержащей иммуногенный компонент, способный вызывать иммунный ответ у индивида, такого как человек, возможно подходящим образом изготовленная или с адъювантом. Вакцина подходящим образом вызывает защитный иммунный ответ против эпизодической инфекции или хронической инфекции, или цитологической аномалии, такой как ASCUS, CIN1, CIN2, CIN3 или рак шейки матки, вызванной одним или более чем одним HPV-типом. Настоящее изобретение далее описано следующими примерами, которые служат для иллюстрации изобретения. Пример 1. Точные подробности проводимого эксперимента приведены в Harper et al., the Lancet. 2004 Nov 13; 364 (9447): 1757-65, включенной в данное описание ссылкой. В общих словах, здоровых женщин в возрасте от 15 до 25 лет, иммунизировали смесью L1 VLPHPV 16 и HPV 18. При регистрации женщины были: 1) серонегативными в отношении HPV-16 и HPV18; 2) негативными в отношении инфекции шейки матки HPV высокого риска (обнаруживаемой путем ПЦР HPV); 3) в течение жизни имели 6 или меньшее количество сексуальных партнеров и 4) имели нормальные мазки по Папаниколау. Смесь содержала на дозу 0,5 мл 20 мкг L1 VLP HPV-16, 20 мкг L1 VLP HPV-18 и в качестве адъюванта 500 мкг гидроксида алюминия и 50 мкг 3D-МФЛ. Группе плацебо инъецировали 500 мкг одного лишь гидроксида алюминия. Оценивали эффективность вакцины (ЭВ) против некоторых онкогенных HPV-типов, где ЭВ представляет собой % улучшения защиты от инфекции при помощи вакцины по сравнению с группой плацебо. Перекрестный иммунитет оценивали по обнаружению наличия нуклеиновой кислоты, специфичной в отношении различных онкогенных типов в вакцинах и контрольной группе. Обнаружение осуществляли с использованием способов, описанных в WO 03014402, и ссылок в ней, в частности путем неспеци- 10013326 фической амплификации ДНК HPV и последующего обнаружения типов ДНК с использованием системыLiPA в соответствии с описанным в WO 99/14377 и в Kleter et al., [Journal of Clinical Microbiology (1999),37 (8): 2508-2517], полное содержание которых включено в данное описание ссылкой. Тем не менее, для обнаружения ДНК HPV в образце может быть использован любой подходящий способ, такой как типоспецифичная ПЦР, с использованием праймеров, специфичных в отношении каждого интересующего типа HPV. Подходящие праймеры известны специалисту в данной области техники или могут быть легко сконструированы, принимая во внимание, что последовательности онкогенныхHPV-типов известны. Подробно раздел со способами из статьи Lancet для полноты воспроизведен ниже. Первичная задача этого исследования заключалась в том, чтобы оценить эффективность вакцины в предупреждении инфекции HPV-16, HPV-18 или обоих (HPV-16/18) у участников за период 6-18 месяцев, которые, как было исходно показано при помощи твердофазного иммуноферментного анализа(ELISA), являются серонегативными в отношении HPV-16/18, и в соответствии с ПЦР негативными в отношении ДНК HPV-16/18. Вторичные задачи включали: оценку эффективности вакцины в предупреждении хронической инфекции HPV-16/18, и оценку эффективности вакцины в предупреждении цитологически подтвержденных плоскоклеточных интраэпителиальных поражений низкой степени (LSIL),плоскоклеточных интраэпителиальных поражений высокой степени (HSIL) и гистологически подтвержденного LSIL (CIN 1), HSIL (CIN 2 или 3) плоскоклеточного рака, или аденокарциномы, ассоциированной с инфекцией HPV-16/18 в течение периода 6-18 месяцев и 6-27 месяцев. Предупреждение цитологии атипичных плоских клеток невыясненной этиологии (ASCUS), ассоциированной с инфекцией HPV16/18, представляло собой вторичный анализ к итоговым анализам. Кроме того, авторы провели пробный анализ гистопатологических конечных результатов CIN 1 и 2,ассоциированных с ДНК HPV-16/18, обнаруживаемой при помощи ПЦР в пораженной ткани. Другие задачи включали оценку иммуногенности, безопасности и иммунности вакцины. Исследователи в Северной Америке (Канада и США) и Бразилии приглашали женщин для этого исследования эффективности при помощи рекламы или на основе предыдущего участия в перекрестном эпидемиологическом исследовании HPV, которое проводили с июля по декабрь 2000 г. Для каждой из 32 исследуемых областей получено разрешение в узаконенной комиссии относительно протокола, форм согласия и дополнений. Женщины дали отдельные письменные согласия на участие в исследовании и кольпоскопию. Для женщин, не достигших 18 лет, обязательным было согласие родителей и самого участника. Проведены две фазы исследования: исходная фаза для вакцинации и наблюдения, завершившаяся на 18-й месяц; и слепая длительная фаза наблюдения, завершившаяся на 27-й месяц. Женщины, подходящие для исходной фазы (месяцы 0-18), включали здоровых женщин в возрасте 15-25 лет, которые имели ранее не более шести сексуальных партнеров, не имели аномальных мазков по Папаниколау или аблативного или хирургического лечения шейки матки и не лечились от наружных кондилом; и которые были цитологически негативными, серонегативными в отношении антител к HPV16 и HPV-18 в соответствии с ELISA и HPV-ДНК-негативными в соответствии с ПЦР для 14 HPV-типов высокого риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, и 68) не более чем за 90 дней до начала исследования. Женщины, завершившие исходную фазу самого раннего исследования, и не перенесшие аблативного или хирургического лечения шейки матки, или удаления матки после регистрации, были допущены к участию в расширенной фазе исследования (месяцы 18-27). Процедуры Каждая доза бивалентной вакцины на основе вирусоподобных частиц HPV-16/18 (GlaxoSmithKlineBiologicals, Rixensart, Belgium) содержала 20 мкг HPV-16 L1 вирусоподобных частиц и 20 мкг HPV-18 L1 вирусоподобных частиц. Каждый тип вирусоподобных частиц получали на клеточном субстрате Spodoptera frugiperda Sf-9 и Trichoplusia ni Hi-5 с адъювантом AS04, содержащим 500 мкг гидроксида алюминия и 50 мкг 3-деацилированного монофосфориллипида А (МФЛ, Corixa, Montana, USA), содержащегося в однодозовом флаконе. Плацебо содержала 500 мкг гидроксида алюминия на дозу и по внешнему виду была идентична вакцине HPV-16/18. Каждый участник исследования получал дозу вакцины или плацебо 0-5 мл на нулевой месяц, в 1-й и 6-й месяц. Специалисты, обеспечивающие медицинское обслуживание, получали образцы из шейки матки при помощи цервикальной кисточки и шпателя (промытого в PreservCyt, Cytyc Corporation, Boxborough, MA,USA) на цитологию и тестирование ДНК HPV при отборе и на 6-й, 12-й, и 18-й месяцы. На нулевой и 6-й месяцы и затем каждые 3 месяца женщины сами получали цервико-вагинальные образцы при помощи двух последовательных тампонов на стержне (помещаемых в PreservCyt) для тестирования ДНК HPV.preferences. Am J Obstet Gynecol 186 (2002), pp. 365-373]. Центральная лаборатория (Quest Diagnostics,Teterboro, NJ, USA) сообщала о цитологических результатах (ThinPrep, Cytyc Corporation), используя систему классификации 1991 Bethesda.- 11013326 В руководствах по протоколу рекомендовалась кольпоскопия после двух результатов ASCUS, или одного результата атипичных гландулоцитов невыясненной этиологии, LSIL или HSIL, плоскоклеточного рака, аденокарциномы in situ или аденокарциномы. В этих руководствах также рекомендовали биопсию при каждом подозрении на поражение. Центральная гистологическая лаборатория ставила исходный диагноз на основе фиксированных в формалине образцов ткани для клинической оценки. Группа из трех патологов ставила последующий согласованный диагноз в отношении поражений, ассоциированных с HPV-16 и HPV-18, при помощи системы CIN. Этот согласованный диагноз также включал обзор срезов, полученных на момент микропрепарирования для обнаружения путем ПЦР патологической ДНК HPV. ДНК HPV, выделенную из цитологического образца (MagNaPure Total Nucleic Acid system, RocheDiagnostics, Almere, Netherlands) и из образца цервикальной биопсии (экстракция протеиназой К), амплифицировали из аликвоты очищенной тотальной ДНК при помощи SPF 10 праймеров широкого спектра, амплифицирующих область гена L1 в 65 п.о. [В. Kleter, L.J. van Doom, J. ter Schegget et al., Novelby general SPF(10) PCR and HPV genotyping. J Pathol 194 (2001), pp. 51-58]. Продукты амплификации обнаруживали при помощи ДНК-ферментного иммуноанализа. Анализ при помощи линейных зондовline probe assay for detection and identification of anogenital human papillomavirus. J Clin Microbiol 37 (1999),pp. 2508-2517]. Любую частицу, положительную в соответствии с ДНК-ферментным иммуноанализом,тестировали при помощи ПЦР, типоспецифичной в отношении HPV-16 и HPV-18. Праймеры для ПЦР,типоспецифичной в отношении HPV-16, амплифицировали сегмент гена Е 6/Е 7 длиной 92 п.о., праймеры для ПЦР, типоспецифичной в отношении HPV-18, амплифицировали сегмент гена L1 длиной 126 п.о.Microbiol 34 (1996), pp. 745-747]. Авторы определяли эпизодическую инфекцию шейки матки с HPV-16/18 по меньшей мере по одному положительному результату ПЦР для HPV-16 или HPV-18 в течение исследования, и хроническую инфекцию HPV-16/18 по меньшей мере по двум положительным результатам анализов HPV-ДНК ПЦР для того же самого вирусного генотипа, с периодом времени между тестами по меньшей мере 6 месяцев.adolescent girls: risk factors and differences, by phylogenetic type. J Infect Dis 190 (2004), pp. 37-45]. Результаты HPV-ДНК теста скрыты от исследователей в процессе исследования, и цитологические и гистологические диагнозы раскрывали только для задач клинического лечения. Анализы включали результаты ДНК HPV-16/18 для образцов из шейки матки и комбинированных образцов из шейки матки и полученных самостоятельно цервиковагинальных образцов. Авторы отбирали сыворотку крови у участников исследования на 0, 1, 6, 7, 12, и 18 месяцы для оценки иммуногенности. Серологическое тестирование антител к вирусоподобным частицам HPV-16 иHPV-18 осуществляли путем ELISA. Рекомбинантные вирусоподобные частицы HPV-16 или HPV-18 использовали в качестве антигенов вирусной оболочки для обнаружения антител (смотри webappendixhttp://imaqe.thelancet.com/extras/04art10103webappendix.pdf). Серопозитивную реакцию определяли как титр, превышающий или равный отсекающему титру для анализа, установленному на уровне 8 единицELISA/мл для HPV-16 и 7 единиц ELISA/мл для HPV-18. Типичные природные титры определяли путем использования образцов крови, полученных у женщин в предшествующем эпидемиологическом исследовании, которые, как было обнаружено, в соответствии с ELISA являются серопозитивными в отношении HPV-16 или HPV-18. Женщины регистрировали симптомы, которые испытывали в течение первых 7 суток после вакцинации, в ежедневных картах по трехуровневой шкале интенсивности симптомов. Дополнительно, путем интервью они сообщали персоналу, проводящему исследования, все негативные явления в течение первых 30 суток после вакцинации. В течение исследования собирали информацию о серьезных негативных явлениях и беременности. Статистические способы Исходя из 6% кумулятивного коэффициента заболеваемости для инфекций типов HPV-16 и HPV-18 в течение 12 месяцев, авторы оценили, что 500 женщин на исследуемую группу обеспечивали 80%-ную- 12013326 возможность оценить нижний предел 95%-ного доверительного интервала (ДИ) эффективности вакцины выше нуля. Авторы предположили 80%-ный уровень удержания в течение 18 месяцев. Предварительные анализы эффективности, безопасности и иммуногенности осуществляли исключительно для задач планирования будущих исследований; Способ O'Brien and Fleming использовали для приведения значения для конечного анализа после проведения предварительных анализов (в общем =0,05; двухстадийный тест). [PC O'Brien and TR. Fleming, A multiple testing procedure for clinical trials. Biometrics 35 (1979), pp. 549-556]. Стратифицированную блок-рандомизацию в соответствии с принятыми алгоритмами централизовали при помощи системы рандомизации в Интернете. Стратификацию осуществляли в соответствии с возрастом (15-17, 18-21 и 22-25 лет) и регионом (Северная Америка и Бразилия). Каждой дозе вакцины присваивали случайно выбранный номер, основываясь на специфической информации об участнике,введенной в компьютерную систему рандомизации персоналом, проводящим исследования. Распределение обработки остается скрытым от исследователей и женщин, участвующих в длительном исследовании. Группы "всех включенных пациентов" (intention-to-treat, ITT) и "в соответствии с протоколом" (according-to-protocol, ATP) представлены на схеме, в которой причины исключения из анализов перечислены в порядке ранжирования; женщин, удовлетворяющих более чем одному исключающему критерию,только подсчитывали в соответствии с самым высоким ранжирующим критерием. Авторы ссылаются на множества участников, входящих в группы всех включенных пациентов и в соответствии с протоколом,как на группы, хотя информация, используемая для ограничения включения субъекта в группу "в соответствии с протоколом" известна только после выполнения. Авторы провели анализы эффективности как для группы всех включенных пациентов, так и для группы в соответствии с протоколом. Расчет эффективности вакцины в 18-месячном анализе в соответствии с протоколом основан на доле участников с инфекцией HPV-16/18 в вакцинированной группе по сравнению с плацебо. Эффективность вакцины определяли как 1 минус отношение между этими двумя долями; 95% ДИ измерял точность оценки эффективности, р-значения рассчитывали при помощи двустороннего точного критерия Фишера. Соответствующие уровни выражали как количества случаев с исходами, разделенные на количества участников в группе риска. В соответствии с протоколом 18 месячная группа включала зарегистрированных женщин, которые приняли три дозы в соответствии со схемой приема вакцины и следовали протоколу, описанному на схеме. Расчет эффективности вакцины в 27-месячных анализах в группах всех включенных пациентов и в соответствии с протоколом основан на Сох пропорциональной модели рисков с использованием проявления по времени случаев инфекции HPV-16/18 в вакцинированных группах по сравнению с плацебо. Это позволяло контролировать накапливающиеся данные для индивида по времени в каждой группе. Эффективность вакцины рассчитывали с использованием 1 минус относительный риск и р-значения рассчитывали с использованием логарифмического рангового критерия. Соответствующие значения выражали в виде количества случаев, разделенного на общее время для индивида. Все зарегистрированные женщины, которые получали по меньшей мере одну дозу вакцины или плацебо, были негативными в отношении HPV-ДНК с высоким риском в 0 месяц, и имели какие-либо данные, доступные для измерения исхода, включали в группу "всех включенных пациентов". 27-месячная группа "в соответствии с протоколом" включала результаты исходов из 18-месячной группы "в соответствии с протоколом" и результаты, полученные в течение длительной фазы (от 18 до 27 месяцев). Расчет р-значений для анализа безопасности осуществляли с использованием сравнений в соответствии с точным критерием Фишера. Группа для анализа безопасности включала всех зарегистрированных женщин, которые получали по меньшей мере одну дозу вакцины или плацебо и удовлетворяли установленным минимальным требованиям протокола (см. протокол ниже). Иммуногенность оценивали в подмножестве группы оценки безопасности в соответствии с протоколом, которая включала женщин с серологическими результатами на 0, 7 и 18 месяцы, получивших все три дозы исследуемой вакцины или плацебо в соответствии со схемой, удовлетворяющих схеме отбора образцов крови, и не становились позитивными в отношении HPV-16/18-ДНК в течение исследования. Уровни серопозитивной реакции в вакцинированной группе и группе плацебо сравнивали с использованием точного критерия Фишера (р 0,001 считалась значимой). Геометрические средние титров сравнивали с использованием теста ANOVA и Крускала-Валлиса. Блок-рандомизацию и статистические анализы проводили с использованием SAS версия 8.2 (SASInstitute, Cary, North Carolina). Исходный анализ и результаты Результаты исходных анализов по перекрестному иммунитету представлены в заявке на патент WO 2004/056389, которая включена в данное описание ссылкой. Исходный анализ осуществляли в группе "ITT" (intention-to-treat, представляющей всех индивидов,получающих по меньшей мере одну дозу вакцины). Эти данные представлены в табл. А. Результаты, представленные в табл. Б и В, относятся к группе "АТР" (according-to-protocol, в соответствии с протоколом) для пациентов, удовлетворяющих всем критериям исследования. Таблица Б представляет собой медианный анализ с данными, полученными на всех пациентах в момент времени, в который по меньшей мере 50% группы составляли 18 месяцев после первой вакцинации. В табл. В приведены окончательные результаты, все данные получены на субъектах через 18 месяцев после первой- 14013326 вакцинации (месяц 0). В группе АТР все пациенты получали 3 дозы вакцины через 0, 1 и 6 месяцев и были серонегативными через 6 месяцев. Как продемонстрировано данными, представленными в табл. А, иммунизация смесью VLP HPV 16 и HPV 18 обеспечивала выраженный перекрестный иммунитет против других HPV-типов. В этот момент времени размеры образцов слишком малы для того, чтобы обеспечить точный статистический анализ,тем не менее данные демонстрируют положительную тенденцию и свидетельствуют о том, что иммунизация VLP HPV 16 и HPV 18 является эффективной против инфекции, вызванной другими HPV-типами. Это было подтверждено по мере осуществления исследования. В табл. Б продемонстрировано, что HPV 16 и HPV 18 обеспечивают статистически значимый перекрестный иммунитет против группы онкогенных типов высокого риска 31, 33, 35, 39, 45, 51, 52, 56, 58,59, 66 и 68. В табл. В продемонстрировано, что за исключением типов, родственных HPV-18 (которые демонстрируют очень сильную тенденцию), имеется оцененный статистически значимый перекрестный иммунитет против групп: HPV 31, 35, 58; HPV 31, 33, 35, 52, 58; и 12 типов высокого риска (отличных от HPV16/18). Осуществили дополнительный анализ на специфический перекрестный иммунитет против специфических типов. Эффективность вакцины оценивали против инфекций и заболеваний, связанных с 12 онкогенными типами высокого риска 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68, HPV-16 филогенетическиродственными типами (группы 31, 35 и 58; 31, 33, 35, 52 и 58) и HPV-18 филогенетически родственные типы (45 и 59). Анализ осуществляли в группе "АТР" (в соответствии с протоколом) на пациентах, удовлетворяющих всем критериям исследования. В группе АТР все пациенты получали 3 дозы вакцины в 0, 1 и 6 месяцы и были серонегативными на 6 месяц. Результаты В соответствии с продемонстрированными данными, представленными в табл. 1, иммунизация смесью VLP HPV 16 и HPV 18 обеспечивала статистически значимый перекрестный иммунитет против эпизодической инфекции типами HPV 31, 52 и 45 по сравнению с контролем. Статистически значимый перекрестный иммунитет против эпизодической инфекции также наблюдали против группы всех типов, родственных HPV 16 (HPV-31, 33, 35, 52 и 58) и группы всех типов высокого риска, за исключением 16 и 18 (HPV31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68). Статистически значимый перекрестный иммунитет против хронической инфекции также наблюдали против типов 31 и 52, и также наблюдали против группы всех типов, родственных HPV 16 (см. табл. 2). Статистически значимый перекрестный иммунитет также наблюдали против цитологических аномалий, ассоциированных с HPV 52, и также наблюдали против цитологических аномалий, ассоциированных с группой всех типов, родственных HPV 16 (HPV-31, 33, 35, 52 и 58), и группой всех типов высокого риска, за исключением 16 и 18 (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68). Таблица А Образцы отбирали на 9, 12, 15 и 18 месяцы у пациентов и тестировали в отношении HPV-инфекции,вызванной указанными выше типами. Таблица Б. Эффективность вакцины после трех доз в предупреждении эпизодических гетерологи- 15013326 ческих инфекций. Эффективность вакцины против инфекции, вызванной типами, филогенетически родственнымиHPV-16 и/или HPV-18 и всеми типами высокого риска, за исключением HPV-16 и HPV-18 - группа АТР Образцы отбирали на 18 месяц у пациентов и тестировали в отношении HPV-инфекции, вызванной указанными выше типами. Таблица 1. Эффективность против эпизодических инфекций, вызванных типами, родственными 16/18 Образцы из шейки матки: группа АТР- 17013326 Таблица 2. Эффективность против хронических инфекций, вызванных типами, родственными 16/18 Все образцы: группа АТР Таблица Е. Эффективность против цитологических аномалий, ассоциированных с типами, родственными 16/18 группа АТР В табл. 1, 2 и 3,N = количество субъектов в конкретной группе ПД = пораженная доля = n (количество субъектов с эпизодической HPV-инфекцией, хронической% эффективности вакцины составляет 1-(А/В)100, приведенный к относительному размеру вакцинированной группы и группы плацебо,где А =% женщин в вакцинированной группе с эпизодической инфекцией, хронической инфекцией или цитологическими аномалиями в зависимости от таблицы; В = % женщин в группе плацебо с эпизодической инфекцией, хронической инфекцией или цитологическими аномалиями в зависимости от таблицы. Пример 2. Использовали 10 групп мышей С 57 В 1/6, содержащих по 24 мыши на группу.- 18013326 Мышей вакцинировали в соответствии с приведенной ниже информацией по схеме в 2 дозы на сутки 0 и сутки 28, используя внутримышечное введение (1 группа мышей получала первичную иммунизацию и бустер-иммунизацию NaCl, не представлена ниже). Вакцинацию осуществляли, используя различные комбинации вирусоподобных частиц HPV. Использовали 4 различные VLP: VLP только HPV 16 L1, VLP только HPV 18 L1, VLP только HPV 31 L1 иVLP получали и очищали, по существу, как описано в WO 2003077942A2, включенным здесь путем ссылки. Более подробно, VLP HPV 16 очищали с использованием последовательных стадий: анионообменной хроматографии (диметиламиноэтил - DMAE), анионообменной хроматографии (триметиламиноэтил - ТМАЕ),гидроксиапатитной хроматографии, фильтрации и еще одной анионообменной стадии, с использованием стадии с диэтиламиноэтилом (DEAE) с последующей окончательной фильтрацией. VLP HPV 31 получали с использованием той же самой последовательности стадий.VLP HPV 18 получали с использованием последовательных стадий: анионообменной хроматографии (диметиламиноэтил - DMAE), анионообменной хроматографии (триметиламиноэтил - ТМАЕ), гидроксиапатитной хроматографии, фильтрации и октилсефарозной колонки (хроматография на основе гидрофобных взаимодействий) с последующей окончательной фильтрацией. VLP HPV 45 получали с использованием той же самой последовательности стадий. Следующие последовательности L1 использовали для получения VLP для этого эксперимента: Нуклеотидная последовательность усеченного L1 серотипа 16 (SEQ ID NO:3) Нуклеотидная последовательность усеченного L1 серотипа 18 (SEQ ID NO:4)- 19013326 Нуклеотидная последовательность усеченного L1 серотипа 31 (SEQ ID NO:5) Нуклеотидная последовательность усеченного L1 серотипа 45 (SEO ID NO:6) Каждый антиген использовали в дозе 2 мкг. VLP HPV 16, 18 и 45 абсорбировали. Используемый адъювант обозначили как AS04D, в количестве 1/10 от дозы для человека, составляющей 5 мкг 3D-МФЛ и 50 мкг гидроксида алюминия в общем для каждой вакцины. Вирусоподобные частицы HPV объединяли с гидроксидом алюминия и 3D-МФЛ, как раскрыто вWO 00/23105. Например, в тетравалентной вакцине 16, 18, 31, 45 по 2 мкг каждой VLP HPV 16 адсорбировали на 5 мкг гидроксида алюминия. То же самое осуществляли для HPV 18 и HPV 45. Для VLP HPV 31 2 мкгVLP адсорбировали на 2,5 мкг гидроксида алюминия. Отдельно 5 мкг 3D-МФЛ адсорбировали на 17,5 мкг гидроксида алюминия. 3D-МФЛ и VLP затем смешивали и добавляли дополнительное количество гидроксида алюминия с получением 50 мкг на дозу вакцины. Считывания Титры антител определяли с использованием классических способов твердофазного иммуноферментного анализа (ИФА), хорошо известных в данной области техники, на 14 сутки после исходной вакцинации и второй вакцинации (соответственно после I и после II). Внутриклеточное окрашивание (ICS, Roederer et al. 2004 Clin. Immunol. 110:199) осуществляли через 14 суток после II для получения CMI ответов. Результаты приведены на фиг. 1-18 ниже. На этих фигурах данные после I и после II представляют собой измерения после дозы вакцины I и II, соответственно. Столбик, обозначенный как "после I бустер" относится к группе, которой сначала давали NaCl с последующей дозой бивалентной или тетравалентной вакцины на 28-е сутки. Фиг. 1-9 иллюстрируют ответы в виде антител, полученные при различных схемах вакцинации. Фиг. 10-18 иллюстрируют CMI ответы, полученные при различных схемах вакцинации. Заключения 1 - Гетерологичный бустер, состоящий из HPV 31 и 45 L1 VLP, эффективен в усилении гомологичных HPV 16 и 18 L1 VLP ответов, вызванных примированием HPV 16 и 18 L1 VLP. 2 - Гетерологичный бустер, состоящий из HPV 31 и 45 L1 VLP, эффективен в усилении гетерологичных HPV 31 и 45 L1 VLP ответов, вызванных примированием HPV 16 и 18 L1 VLP. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение белка L1 вируса папилломы человека (HPV) или его иммуногенного фрагмента из первого HPV-типа в изготовлении лекарственного средства для усиления иммунного ответа, ранее вызванного белком L1 вируса папилломы человека или его иммуногенным фрагментом из другого HPVтипа. 2. Применение по п.1, где второй тип является филогенетически родственным первому типу. 3. Применение по п.1 или 2 белка L1 HPV 31 или HPV 52 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент. 4. Применение по п.3 белка HPV 31 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент. 5. Применение по п.3 белка HPV 52 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 16, содержащую белок L1 или его фрагмент. 6. Применение по п.1 или 2 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 31 или HPV 52, содержащую белок L1 или его фрагмент. 7. Применение по п.6 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 31, содержащую белок L1 или его фрагмент. 8. Применение по п.6 белка L1 HPV 16 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 52, содержащую белок L1 или его фрагмент. 9. Применение по п.1 или 2 белка L1 HPV 45 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 18, содержащую белок L1 или его фрагмент. 10. Применение по п.1 или 2 белка L1 HPV 18 или его иммуногенного фрагмента в изготовлении лекарственного средства для усиления иммунного ответа на вакцину HPV 45, содержащую белок L1 или его фрагмент. 11. Схема вакцинации для защиты от HPV-инфекции и/или заболевания, включающая доставку первой HPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент, по меньшей мере, из HPV 16 и HPV 18, и второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент по меньшей мере из одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал. 12. Способ предупреждения HPV-инфекции и/или заболевания, включающий доставку первойHPV-вакцины, содержащей белок L1 или его иммуногенный фрагмент, по меньшей мере, из HPV 16 иHPV 18, и второй HPV-вакцины, которая не содержит компоненты L1 HPV 16 и HPV 18 первой вакцины- 26013326 и которая содержит белок L1 или его иммуногенный фрагмент из по меньшей мере одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал времени. 13. Способ или схема по п.11 или 12, где первая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 16, HPV 18 и, возможно, HPV 33. 14. Способ или схема по п.13, где первая вакцина дополнительно содержит белок L1 или его иммуногенный фрагмент из HPV 58. 15. Способ или схема по любому из пп.11-13, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31, и/или HPV 45, и/или HPV 52. 16. Способ или схема по п.15, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31 и HPV 45. 17. Способ или схема по п.16, где вторая вакцина содержит белок L1 или его иммуногенный фрагмент из HPV 31, HPV 45 и HPV 52. 18. Способ или схема по любому из пп.11-17, где первая и вторая вакцины не имеют идентичных белков L1 или общих белковых фрагментов. 19. Способ или схема по любому из пп.11-18, где компонент HPV 16 или HPV 18 в первой вакцине защищает от HPV-инфекции и/или заболевания, вызванных по меньшей мере одним HPV-типом во второй вакцине. 20. Вакцинная композиция, содержащая комбинацию белка L1 HPV 31 или его иммуногенного фрагмента и белка L1 HPV 45 или его иммуногенного фрагмента, причем вакцина не содержит белок L1HPV 16 или HPV 18 или его иммуногенные фрагменты. 21. Вакцинная композиция по п.20, включающая белок L1 HPV 52 или его иммуногенный фрагмент. 22. Набор, содержащий первую HPV-вакцину, содержащую белок L1 или его иммуногенный фрагмент, по меньшей мере, из HPV 16 и HPV 18, и вторую HPV-вакцину, которая не содержит компонентыL1 HPV 16 и HPV 18 первой вакцины и которая содержит белок L1 или его иммуногенный фрагмент по меньшей мере из одного другого онкогенного HPV-типа, где первая и вторая вакцины могут быть доставлены в любой последовательности, и доставки осуществляют через подходящий интервал. 23. Набор по п.22, где первый вакцинный компонент содержит белки L1 HPV 16 и HPV 18 или их иммуногенные фрагменты, и второй вакцинный компонент содержит белки HPV 31 и HPV 45 или их иммуногенные фрагменты. 24. Применение, способ, схема, вакцина или набор по любому из пп.1-23, где белок L1 HPV находится в форме вирусоподобной частицы. 25. Применение, способ, схема, вакцина или набор по любому из пп.1-24, где первая или вторая вакцина либо обе вакцины содержат адъювант. 26. Применение, способ, схема, вакцина или набор по п.25, где адъювант содержит 3D-МФЛ. 27. Применение, способ, схема, вакцина или набор по п.25, где адъювант содержит соль алюминия. 28. Применение, способ, схема, вакцина или набор по п.26 или 27, где адъювант содержит соль алюминия и 3D-МФЛ. 29. Применение, способ, схема, вакцина или набор по п.26, где адъювант содержит адъювант на основе эмульсии масло-в-воде и 3D-МФЛ. 30. Применение, способ, схема, вакцина или набор по п.29, где эмульсия масло-в-воде содержит метаболизируемое масло, стерин и эмульгатор.
МПК / Метки
МПК: A61K 39/12
Метки: вакцина
Код ссылки
<a href="https://eas.patents.su/30-13326-vakcina.html" rel="bookmark" title="База патентов Евразийского Союза">Вакцина</a>
Предыдущий патент: Вакцина
Следующий патент: Способ приготовления очищенных конъюгатов лекарственных средств
Случайный патент: Устройство для перемещения инвалидного кресла по ступеням лестничного марша