Иммуноконъюгаты против интегрина, способы и варианты применения
Номер патента: 13323
Опубликовано: 30.04.2010
Авторы: Эмфлетт Годфри, Лутц Роберт Дж., Чэнь Цимин, Стивз Рита М., Трикха Мохит
Формула / Реферат
1. Конъюгат лекарственного средства с антителом, представленный формулой
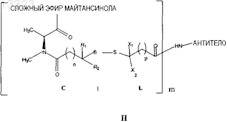
где антитело представляет собой антитело, специфичное в отношении человеческой альфа-V-субъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу;
майтансиноид этерифицирован в С-3;
R1 и R2представляют собой Me;
X1 и X2независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов, разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов, фенильную, замещенную фенильную или гетероциклическую арильную группу или гетероциклоалкильную группу;
n представляет собой 2;
р представляет собой 1-5;
m представляет собой 1-10.
2. Конъюгат антитела с лекарственным средством по п.1, в котором антитело конкурирует за связывание человеческого альфа-V-интегрина с моноклональным антителом CNTO 95 или его фрагментом.
3. Конъюгат антитела по п.1, в котором молекула антитела представляет собой моноклональное антитело CNTO 95 или рекомбинантное антитело, имеющее по меньшей мере одну из определяющих комплементарность областей (CDR) CNTO 95, показанных в SEQ ID NO: 1-6, или, как показано, консервативные замены по меньшей мере одной CDR.
4. Конъюгат антитела по п.2, в котором моноклональное антитело конкурирует с MAb CNTO 95 за связывание с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3.
5. Конъюгат антитела по п.1, в котором молекула антитела специфична в отношении эпитопа в аминокислотной последовательности SEQ ID NO: 9.
6. Конъюгат антитела с лекарственным средством по п.1, в котором антитело является человеческим, гуманизированным или химерным антителом.
7. Способ продуцирования конъюгата по п.1, включающий в себя стадии (а) введения одной или нескольких свободных или защищенных тиольных групп в молекулу антитела, специфичную в отношении интегринов с человеческой субъединицей альфа-V; (b) взаимодействия молекулы антитела стадии (а) с соединением, которое токсично в отношении клеток при IС50, составляющем 10-9 М или менее, причем указанное соединение имеет одну или несколько дисульфидных или тиольных групп; и (с) получения указанного конъюгата.
8. Способ по п.7, в котором токсичное соединение представляет собой майтансиноид.
9. Способ по п.7 или 8, в котором для введения свободных или защищенных тиольных групп в молекулу антитела применяют N-гидроксисукцинимидовый сложный эфир (2-пиридил)-3-дитиопропановой кислоты (SPDP), N-гидроксисукцинимидовый сложный эфир (2-пиридил)-4-дитиопентановой кислоты (SPP) или N-гидроксисукцинимидовый сложный эфир (2-пиридил)-4-дитиобутановой кислоты.
10. Применение конъюгата по любому из пп.1-6 для получения фармацевтической композиции для лечения злокачественной опухоли.
11. Способ лечения злокачественной опухоли у нуждающегося в этом пациента, включающий в себя введение пациенту терапевтически эффективного количества конъюгата по любому из пп.1-6, в котором злокачественная опухоль представляет собой аденокарциному молочной железы, аденокарциному легких, аденокарциному поджелудочной железы, аденокарциному толстого кишечника, почечно-клеточную аденокарциному или аденокарциному желудка.
12. Способ лечения злокачественной опухоли по п.11, в котором злокачественная опухоль представляет собой плоскоклеточную карциному головы и шеи, плоскоклеточную карциному пищевода, плоскоклеточную карциному легких, плоскоклеточную карциному кожи или плоскоклеточную карциному шейки матки.
13. Применение конъюгата по любому из пп.1-6 для лечения или предотвращения метастатического распространения злокачественной опухоли, включающее в себя введение пациенту терапевтически эффективного количества конъюгата по любому из пп.1-6.
14. Способ ингибирования роста злокачественных клеток у нуждающегося в этом млекопитающего, включающий в себя введение млекопитающему конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ингибирования роста указанных злокачественных клеток у указанного млекопитающего.
15. Способ по п.14, согласно которому конъюгат антитела вводят внутривенно.
16. Способ по п.15, согласно которому конъюгат антитела вводят в количестве от 0,05 до 12,0 мг/кг массы тела.
17. Способ по п.14, согласно которому млекопитающее представляет собой пациента-человека.
18. Способ ингибирования ангиогенеза у нуждающегося в этом млекопитающего, включающий в себя введение млекопитающему с зависимым от ангиогенеза заболеванием конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ингибирования указанного ангиогенеза, где зависимое от ангиогенеза заболевание представляет собой заболевание, выбранное из группы, состоящей из метастазирования злокачественной опухоли, ангиомы, ангиофибромы, диабетической ретинопатии, ретинопатии недоношенных, неоваскулярной глаукомы, болезни роговицы, индуцированной ангиогенезом, инволюции желтого пятна, дегенерации желтого пятна, птеригия, дегенерации сетчатки, ретроленальных фиброплазий, гранулярного конъюнктивита, псориаза, телеангиоэктазии, пиогенной гранулемы, себорейного дерматита, акне и артрита.
19. Способ ослабления воспалительного заболевания у нуждающегося в этом млекопитающего, включающий в себя введение нуждающемуся в этом млекопитающему конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ослабления одного или нескольких симптомов указанного воспалительного заболевания, выбранного из группы, состоящей из ревматоидного артрита, дегенерации желтого пятна, псориаза, диабетической ретинопатии.
20. Способ по п.18, согласно которому указанным моноклональным антителом лечат ангиогенное заболевание кожи, выбранное из группы, состоящей из псориаза, венозных язв, акне, розовых угрей, бородавок, экземы, гемангиом и лимфангиогенеза.
21. Способ по п.18, согласно которому указанным моноклональным антителом лечат нарушение, связанное с неоваскуляризацией роговицы или сетчатки.
22. Способ по любому из пп.11, 12, 14-21, согласно которому антитело вводят в сочетании со вторым терапевтическим или профилактическим средством или способом.
23. Конъюгат лекарственного средства с антителом, представленный формулой
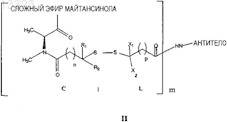
где антитело представляет собой антитело, специфичное в отношении человеческой альфа-V-субъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу;
майтансиноид этерифицирован в С-3;
R1 представляет собой Н;
R2 представляет собой Me;
X1 и X2независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов, разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов, фенильную, замещенную фенильную или гетероциклическую арильную группу или гетероциклоалкильную группу;
n представляет собой 2;
р представляет собой 1-5;
m представляет собой 1-10.
24. Фармацевтическая композиция, включающая в себя конъюгат по п.1 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
25. Фармацевтическая композиция, включающая в себя конъюгат по п.23 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
26. Набор, включающий в себя композицию конъюгата по п.1 и контейнер и дополнительно включающий вкладку в упаковку или этикетку, указывающую на то, что композиция может использоваться для лечения заболевания, характеризующегося клетками, экспрессирующими субъединицу альфа-V-интегрина.
27. Набор, включающий в себя композицию конъюгата по п.23 и контейнер и дополнительно включающий вкладку в упаковку или этикетку, указывающую на то, что композиция может использоваться для лечения заболевания, характеризующегося клетками, экспрессирующими субъединицу альфа-V-интегрина.
28. Набор по п.26, в котором во вкладке в упаковку указано, что композиция может использоваться для лечения злокачественной опухоли.
29. Набор по п.27, в котором во вкладке в упаковку указано, что композиция может использоваться для лечения злокачественной опухоли.
30. Конъюгат лекарственного средства с антителом, включающий в себя антитело, которое связывается с альфа-V-субъединицей гетеродимерного человеческого интегринового рецептора, конъюгированного с цитотоксичным средством с IC50, составляющей 10-9 М или менее, где конъюгат антитела и лекарственного средства оказывает цитотоксическое или цитостатическое действие на линию клеток злокачественной опухоли, экспрессирующих альфа-V-интегрин, представленный формулой
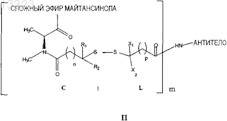
где антитело представляет собой антитело, специфичное в отношении человеческой альфа-V-субъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу;
майтансиноид этерифицирован в С-3;
R1, R2, X1 и X2независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов, разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов, фенильную, замещенную фенильную или гетероциклическую арильную группу или гетероциклоалкильную группу;
n представляет собой 1-5;
р представляет собой 1-5;
m представляет собой 1-10; и
когда n равно 1, 2 или 3, то R1 и R2 не являются одновременно Н.
31. Конъюгат антитела по п.30, в котором n=2, R1 и R2оба представляют собой метил и р=2.
32. Конъюгат антитела, представленный формулой
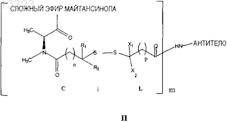
где антитело представляет собой антитело, специфичное в отношении человеческой альфа-V-субъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу;
майтансиноид этерифицирован в С-3;
R1 и R2представляют собой Н;
р равен 2;
X1 представляет собой Me;
X2 представляет собой Н;
n равно 2;
m имеет значение 1-10.
33. Конъюгат антитела по п.30, в котором n=2, R1 и R2оба представляют собой метил, р=2 и оба X1и Х2 представляют собой Н.
34. Фармацевтическая композиция, включающая в себя конъюгат по любому из пп.30-33 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
35. Набор, включающий в себя композицию конъюгата по любому из пп.30-33 и контейнер и дополнительно включающий вкладку в упаковку или этикетку, указывающую на то, что композиция может использоваться для лечения заболевания, характеризующегося клетками, экспрессирующими субъединицу альфа-V-интегрина.
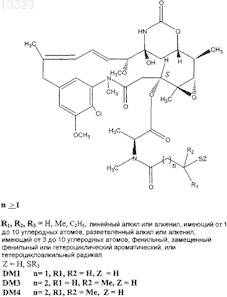
Текст
013323 Область техники, к которой относится изобретение Настоящее изобретение относится к конъюгатам опухолеспецифических антител с цитотоксическими соединениями. Предпочтительные конъюгаты содержат соединения майтансиноидов, связанные с антителом против интегрина дисульфидной связью. Предшествующий уровень техники Делались многочисленные попытки усилить эффективность антинеопластических лекарственных средств путем конъюгации таких средств с моноклональными антителами (Mab) против ассоциированных с опухолями антигенов для увеличения концентрации лекарственного средства за счет направленной доставки в опухоль. Потенциал антител в отношении действенного разрушения опухолевых клеток, напротив, ограничен антителами, направленными на блокирование пролиферативных стимулов, таких как факторы роста EGF и Her-2, за счет блокирования связывания лиганда с данными рецепторами или блокирования передачи сигнала данных рецепторов (ErbB1 и ErbB2) или теми антителами, которые имеют эффекторные функции (ADCC или CDC). Поэтому ведут поиск продукта, сочетающего специфичностьMab с потенциалом, к разрушению клеток в виде метаболического яда. Примерами последнего являются конъюгированное с доксорубицином антитело Mab BR96 (Braslawsky, et al. Cancer Immunol Immunother 33:367-374, 1991) и экзотоксин Pseudomonas, слитый с антителами или фрагментами против факторов роста (Kreitment et al., Internat. J. Immunopharm. 14 (3):465-472, 1992). Данные попытки столкнулись с непредвиденными ограничениями, например с необходимостью относительно высокой внутриклеточной концентрации токсина по сравнению с числом внешних участков связывания на клетке. Если число ассоциированных с опухолью антигенов на поверхности клетки оценивают как 105 молекул/клетку, цитотоксические средства, которые могут эффективно использоваться в таких конъюгатах, должны иметь значение IC50 в отношении опухолевых клеток-мишеней, составляющее 10-10-10-11 (Chari, R.V.J. Adv. Drug Delivery Rev. 1998, 31, 89-104). Во-вторых, лекарственное средство должно высвобождаться после связывания с мишенью и проникать в клетку, или вся конструкция должна транспортироваться в клетку, и токсин должен там отщепляться или активироваться иначе. Некоторые из данных недостатков могут быть в большей или меньшей степени разрешены применением сильно действующих лекарственных средств, конъюгированных с интернализирующим антителом и применением химической связи, которая усиливает лабильность во внутриклеточных условиях. ВChari et al. (Cancer Res. 52:127-131, 1992; Liu et al., Proc. Natl. Acad. Sci USA 93:8618-8623, 1996; патент США 5208020) разработаны конъюгаты антител, в которых антитело связано с майтансиноидом дисульфидной связью. Майтансиноиды представляют собой противогрибковые и противоопухолевые средства растительного происхождения. Выделение трех петлевых макролидов из этаноловых экстрактов Maytenus ovatus иMaytenus buchananii впервые описано S.М. Kupchan et al. и является субъектом патента США 3896111 вместе с демонстрацией их противолейкозных эффектов на экспериментальных мышах в интервале доз мкг/кг. Однако майтансиноиды имеют неприемлемую токсичность, вызывая центральную и периферическую невропатии и побочные эффекты, в частности тошноту, рвоту, диарею, усиление тестов функции печени и реже слабость и летаргию. Поэтому исследования были некоторое время сфокусированы на поиске правильной группы-мишени с подходящим химическим методом для получения конъюгата майтансиноида-антитела с приемлемым периодом полураспада. В отличие от высокой цитотоксичности свободного майтансиноида конъюгат с антителом имеет токсичность, на несколько порядков более низкую в отношении антиген-отрицательных клеток по сравнению с антиген-положительными клетками. Связь дисульфидным мостиком имеет преимущество легкого отщепления данных связей в клетках-мишенях внутриклеточным глутатионом, с высвобождением высокотоксичного свободного лекарства. Данный подход применяли к антителам против ассоциированных с опухолями антигенов, например, при использовании конъюгатов C242-DM1 (Liu et al., Proc. Natl.Acad. Sci USA 93:8618-8623, 1996) и HuN901-DM1 (Chari et al., 2000). Однако применение данных конъюгатов ограничено вследствие ограниченной экспрессии соответствующих антигенов-мишеней. Поэтому все еще остается необходимость улучшить данный подход использованием антител, направленных на экспрессируемые в большом количестве опухолеассоциированные антигены и, необязательно, на антигены, экспрессируемые в большом количестве во время пролиферативной и метастазирующей стадии злокачественной опухоли, что обеспечивает естественное концентрирование токсина в наиболее вирулентных клетках. Моноклональные антитела против интегринов. Значимые доказательства показывают, что прогрессирующий рост опухолей зависит от ангиогенеза, образования новых кровеносных сосудов, предоставляющих опухолям питательные вещества и кислород, отводящих отходы и действующих как проводники метастазов опухолевых клеток в отдаленные участки (Gastl et al., Oncol. 54: 177-184). Последние исследования далее определили роль интегринов в процессе ангиогенеза. Во время ангиогенеза некоторое количество интегринов, которые экспрессированы на поверхности активированных эндотелиальных клеток, регулируют критические адгезивные взаимодействия с различными белками ЕСМ, регулируя различные биологические события, например миграцию клеток, их пролиферацию и дифференцировку. Более конкретно, близкородственные, но различные-1 013323 интегрины V3 и V5, как было показано, опосредуют независимые пути процесса ангиогенеза. Антитело, полученное против V3, блокировало индуцированный основным фактором роста фибробластов(bFGF) ангиогенез, в то время как антитело, специфичное в отношении V5, ингибировало ангиогенез,индуцированный фактором роста эндотелия сосудов (VEGF) (Eliceiri, et al., J. Clin. Invest. 103: 1227-1230(1999); Friedlander et al., Science 270: 1500-1502 (1995. Поэтому интегрины, и особенно интегрины, содержащие альфа-V-субъединицу, являются предполагаемыми терапевтическими мишенями для заболеваний, в развитии которых участвует ангиогенез, например заболеваний глаз и неоплазий, перестройки тканей, такой как повторный стеноз, и пролиферации некоторых типов клеток, в частности эпителиальных и плоскоклеточных карцином. Лекарственные конъюгаты антител. Описаны конъюгаты связывающих клетки агентов с высокоцитотоксичным майтансином (патент США 5208020 и 5416064; R.V.J. Chan et al., 1992 Cancer Res. 52:127-131). Некоторые реагенты или реактанты, такие как сложные эфиры N-гидроксисукцинимидила (NHS), для взаимодействия с аминогруппами белка были разработаны для применения в образовании конъюгатов белок-лекарство. Реагенты данного типа, в общем, описаны Carlsson et al. (Biochem J. 173: 723, 1978) и в патенте США 4149003. Реагенты с нитропиридильным линкером для конъюгации майтансина с Mab и другими белками описаны в WO 2004/016801. В указанных выше процессах связывающие клетки агенты модифицируют бифункциональным агентом, таким как N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP), для введения активного дисульфидного радикала. Взаимодействие с содержащим тиол цитотоксическим лекарственным средством представляет конъюгат, в котором связывающее клетку средство, такое как моноклональное антитело, и лекарство связывают дисульфидными связями. Обнаружено, что положение гидроксила С-3 может модифицироваться без потери активности, фактически, некоторые эфиры, как было обнаружено, имели повышенную цитотоксичную активность (См. Cassady, et al. Chem. Pharm. Bull. 52(1): 1-26, 2004 для обзора). В патентах США 5208020 и 5416064 конкретно описано применение активированного эфира майтансола и N-метил-N-(3-метилдитиопропаноил)-L-аланина. Майтансоидный радикал, участвующий в данном взаимодействии, который высвобождается при восстановительном расщеплении дисульфидной связи, обозначен DM1 [N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)майтансин, рег.CAS 139504-50-0]. Таким образом, все конъюгаты, полученные с использованием метилдитиолированной формы DM1, сохраняют незамещенный углерод метилена, прилегающего к дисульфидной связи на относящейся к лекарству стороне конъюгата (фиг. 1). Для усиления стабильности данной дисульфидной связи in vivo важно предоставить стерически напряженные дисульфидные связи, как это отмечалось ранее (Thorpe, et al. Cancer Research 47:5924-31,1987). Данная цель может достигаться путем применения перекрестных линкеров, которые несут один или два метильных заместителя на атоме углерода, прилегающем к дисульфидной связи, или применения активированных лекарств, несущих по меньшей мере один заместитель на альфа-углеродном атоме, прилегающем к сульфгидрильному или дисульфидному заместителю. Хотя проблемы направленной доставки в настоящее время четко раскрыты, поиск подходящей комбинации специфичности и сродства антитела, химии конъюгации и токсина является непредсказуемым. Целью настоящего изобретения является предоставление новых конъюгатов антитела и майтансина, где антитело направлено на антигены клеточной поверхности, число которых достаточно для доставки токсичной дозы майтансиноида, причем данные конъюгаты имеют подходящую химическую и биологическую стабильность для представления терапевтически эффективной скорости высвобождения при введении субъекту. Сущность изобретения Целью настоящего изобретения является представление новых конъюгатов антитела и майтансина,где антитело направлено на антигены клеточной поверхности, число которых достаточно для доставки токсичной дозы майтансиноида, и где известно, что антитело интернализуется клеткой после связывания с антигеном-мишенью. В конкретном варианте осуществления конъюгаты включают в себя дисульфидную связь, которую конструируют посредством замещения прилегающих углеродов метилена с обеспечением терапевтически эффективной скорости высвобождения при введении субъекту. В конкретном варианте осуществления изобретение относится к конъюгату антитело-лекарство, включающему в себя антитело, которое связывается с альфа-V-субъединицей человеческого интегрина, конъюгированное с цитотоксическим агентом с IC50, составляющим 10-9 М или менее, где конъюгат антитело-лекарство оказывает цитотоксическое или цитостатическое действие на клеточную линию злокачественной опухоли,экспрессирующую альфа-V-интегрин. В данном варианте осуществления антитела согласно изобретению специфичны, по меньшей мере, в отношении одной альфа-V-субъединицы гетеродимерного интегринового рецептора, такого как гетеродимерный белок-интегрин альфа-V-бета-1, альфа-V-бета-3, альфа-Vбета-5, альфа-V-бета-6 или альфа-V-бета-8 либо его фрагмент. Предпочтительные конъюгаты содержат майтансиноидные соединения, связанные с антителом дисульфидной связью, и антитело способно связывать витронектин и фибиноген.-2 013323 В одном из аспектов конъюгаты антитела согласно изобретению представлены формулой где А представляет собой антитело, специфичное в отношении человеческой интегриновой субъединицы альфа-V; где указанное антитело способно интернализоваться клеткой, экспрессирующей указанную субъединицу альфа-V; С представляет собой цитотоксин с IC50, составляющей 10-9 М или менее;L представляет собой связывающую группу, которая связывает антитело и цитотоксин и далее включает в себя связь, расщепляемую компонентами внутриклеточной среды;m представляет среднее число молекул цитотоксина, связанных с антителом, и представляет собой целое число в интервале 1-10, конкретнее в интервале 3-4. Цитотоксин может быть выбран из группы, состоящей из майтансиноидов, калихеамицинов, эпотилонов, дискодермолида, элеутробинов, доластатинов, криптофицинов, камптотецинов, ризоксина (рег.CAS 90996546), или производных таксана и других таких соединений, которые проявляют 50% максимального ингибирования (IC50 или GI50) в отношении роста опухолевых клеток 10-9 М или менее. В аспекте первого объекта изобретения конъюгат антитела против альфа-V-интегрина и майтансиноида включает в себя любой белок или пептид, содержащий молекулу, которая включает в себя антитело, конкурирующее за связывание с альфа-V-субъединицей гетеродимерного человеческого интегринового рецептора с моноклональным антителом CNTO 95. В одном из вариантов осуществления антитело включает в себя по меньшей мере часть определяющей комплементарность области (CDR) тяжелой или легкой цепи или их связывающую лиганд область, происходящую из антитела, обозначенного CNTO 95,в комбинации с вариабельной областью тяжелой цепи или легкой цепи, константной областью тяжелой цепи или легкой цепи, каркасной областью или любой его частью, которая может быть встроенной в антитело с CDR. Описанное здесь антитело CNTO 95 представляет собой человеческое антитело против альфа-V, происходящее от иммунизации трансгенной мыши, содержащей гены для экспрессии человеческих иммуноглобулинов. Таким образом, в одном из вариантов осуществления изобретение относится к антителам, содержащим по меньшей мере одну область CDR или вариабельную область, происходящую из антитела CNTO 95. В предпочтительном варианте осуществления антитело представляет собой CNTO 95. В другом аспекте изобретения конъюгат антитело-майтансиноид включает в себя сложный эфир майтансинола, который высвобождается после расщепления связи, соединяющей цитотоксин С с линкеромL, компонентами внутриклеточной среды. В одном из вариантов осуществления майтансиноид этерифицируется в С-3, С-14, С-15 или С-20 ацилированной аминокислотой, в которой ацильная группа несет защищенную сульфгидрильную группу, где атом углерода ацильной группы, прилегающей к защищенной сульфгидрильной группе, имеет один или два заместителя, причем указанные заместители представляют собой CH3, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, имеющий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический, гетероциклоалкильный радикал или Н; и где ацильная группа имеет длину линейной цепи по меньшей мере в два углеродных атома между карбонильной функциональностью и атомом серы. В предпочтительном варианте осуществления майтансиноид представляет собой сложный эфир 3-майтансинола, а ацилированная аминокислотная группа несет 0, 1 или 2 метильные группы на углеродном атоме, прилегающем к защищенному сульфгидрилу. В предпочтительном варианте осуществления этерифицированный майтансинол выбран изN2'-дезацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтансина (DM4). Вторым объектом изобретения является представление соединений-конъюгатов антитела против интегрина и майтансиноида, которые могут использоваться для лечения пролиферативных заболеваний человека, вызванных аномальной пролиферацией и характеризующихся неовасуляризацией. В особенно предпочтительном варианте осуществления соединения согласно изобретению применяют в способе лечения злокачественной опухоли, включая злокачественные опухоли молочной железы, толстого кишечника, прямой кишки, легких, предстательной железы, почки, печени, поджелудочной железы, пищевода,желудка, эндометрия, яичников, шейки матки или кости. Соединения согласно изобретению могут использоваться отдельно или в комбинации с другими средствами в профилактике или лечении первичных злокачественных опухолей или в профилактике или лечении метастазирующих заболеваний. В другом способе второй объект изобретения относится к комбинированному применению соединений-конъюгатов антитела против интегрина и майтансиноида со средствами химиотерапии при лечении злокачественной опухоли. Предпочтительные конъюгаты содержат соединения майтансиноиды, связанные с антителом дисульфидной связью, и предпочтительные средства для химиотерапии представляют собой доксорубицин, таксан, камптотецин, подофиллотоксин, аналог нуклеозида или аналог пиримидина. В третьем объекте изобретения конъюгат антитела и майтансиноида получают способом, в котором антитело взаимодействует с биспецифическим химическим линкерным реагентом, таким как Nсукцинимидил-(2-пиридилтио)алканоат, и впоследствии взаимодействует с предактивированным май-3 013323 тансиноидом, где обмен дисульфидами приводит к образованию стерически напряженной дисульфидной связи между антителом и майтансиноидом. В другом аспекте изобретения конъюгат антитела и майтансиноида получают с использованием сложного эфира майтансинола, в котором ацильная группа несет защищенную сульфгидрильную группу. В одном из вариантов осуществления майтансиноид этерифицируется в С-3, С-14, С-15 или С-20 ацилированной аминокислотой, в которой ацильная группа несет защищенную сульфгидрильную группу, в которой атом углерода ацильной группы, прилегающий к защищенной сульфгидрильной группе, имеет один или два заместителя, причем указанные заместители выбраны из СН 3, С 2 Н 5, линейного алкила или алкенила, имеющего от 1 до 10 атомов углерода, разветвленного или циклического алкила или алкенила, атомов углерода, разветвленного или циклического алкила или алкенила, имеющего от 3 до 10 атомов углерода, фенила, замещенного фенила, гетероциклического арильного радикала, гетероциклоалкильного радикала или Н; и где ацильная группа имеет длину линейной цепи, равную по меньшей мере двум атомам углерода между карбонильной функциональностью и атомом серы. В предпочтительном варианте осуществления майтансиноид представляет собой сложный эфир 3-майтансинола, а ацилированная аминокислотная группа несет 0, 1 или 2 метильные группы на углеродном атоме, прилегающем к защищенному сульфгидрилу. В предпочтительном варианте осуществления этерифицированный майтансинол выбран изN2'-дезацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтансина (DM4). Еще в одном аспекте изобретения конъюгат антитела против альфа-V-интегрина и майтансиноида получают, по существу, в одну стадию взаимодействия майтансиноида, несущего реакционноспособный сложный эфир, с антителом против интегрина, до этого не активированным химически. Реакционноспособный сложный эфир майтансиноида может представлять собой сложный эфир N-сукцинимидила, Nсульфосукцинимидила, N-фталимидила, N-сульфофталимидила, 2-нитрофенила, 4-нитрофенила, 2,4 динитрофенила, 3-сульфонил-4-нитрофенила или 3-карбокси-4-нитрофенила. Краткое описание чертежей На фиг. 1 показана химическая структура тиолированных амидов майтансина с предпочтительными видами молекул; отмечены DM1, DM3 и DM4. На фиг. 2 показаны химические структуры предпочтительных бифункциональных линкерных реагентов согласно изобретению и их химические акронимы. Фиг. 3 представляет собой схематичное изображение способа синтеза для получения конъюгатов антитело-майтансиноид согласно изобретению. Фиг. 4 представляет собой график, на котором показано изменение объема опухоли человеческой меланомы с течением времени в голых мышах и эффект введения CNTO 95. Мышей инокулировали подкожно клетками A375.S2 (3106) и дозирование CNTO 95 или контроля начинали через 3 суток. Мышей обрабатывали CNTO 95 или носителем три раза в неделю в дозе 10 мг/кг внутрибрюшинно. Каждая точка данных представляет собой средний объем опухоли от 10 несущих опухоль животных(ст.ош.среднего). CNTO 95, введенное три раза в неделю, значимо ингибировало рост опухолей по сравнению с обработанными контролем животными, на 26 сутки (Р=0,0005). Фиг. 5 представляет собой график, на котором показано изменение объема опухоли человеческой меланомы с течением времени в голых крысах и эффекта введения CNTO 95. Крыс инокулировали подкожно клетками A375.S2 (3106) и лечение CNTO 95 или контролем начинали через трое суток. Крыс обрабатывали CNTO 95 или носителем три раза в неделю в дозе 10 мг/кг внутривенно. Каждая точка данных представляет собой средний объем опухоли от 9 несущих опухоль животных (ст.ош.среднего). Фиг. 6 представляет собой график, на котором показан рост клеток человеческой меланомыA375.S2 с течением времени в голых мышах. Объемы опухоли выражены в виде среднего значения ст.ош.среднего (n=9 или 10). Стрелки указывают на внутривенные инъекции лекарственного средства. Звездочка указывает на то, что одно из неотвечающих животных умерщвляли, когда объем ее опухоли превысил 1500 мм 3. Фиг. 7 представляет собой график, на котором показан рост клеток человеческой меланомыA375.S2 с течением времени в голых крысах. На 14 сутки, когда средний объем опухоли достигал 250 мм 3, животных случайным образом группировали и вводили первую дозу. Всех животных умерщвляли на 35 сутки. Объем опухоли выражали в виде среднего значения ст.ош.среднего (n=9 или 10). Стрелки указывают на сутки внутривенных инъекций лекарственного средства. Фиг. 8 представляет собой график, на котором показано изменение общей массы тела с течением времени в несущих опухоль мышах, инъецированных на 7 сутки после имплантации опухоли, и опять каждые 7 суток 5 3, 6 или 10 мг/кг CNTO 364; на 7 и 14 сутки 25 мг/кг CNTO364 или F105-DM1 и на 7,14 и 35 сутки 15 мг/кг CNTO364. Фиг. 9 представляет собой график, на котором показано изменение объема опухоли с течением времени у тех же животных, которые описаны на фиг. 8. Фиг. 10 представляет собой график, на котором показаны объемы индивидуальных опухолей для-4 013323 всех животных в группах, описанных на фиг. 8. Фиг. 11 представляет собой график средней массы тела ст.ош.среднего (n=6) от времени для голых крыс, которые имели подкожную опухоль в результате введения клеток А 549 человеческой карциномы легких и которых лечили CNTO 364 в дозе 15 мг/кг или контролем. Стрелки указывают на время внутривенных инъекций лекарственного средства. Фиг. 12 представляет собой график, на котором показан рост опухолей человеческих карцином легких А 549 у самок бестимусных мышей. Лечение CNTO 364 (15 мг/кг) снижало развитые опухоли, полученной в результате введения клеток А 549 человеческой карциномы легких у самок бестимусных мышей. Фиг. 13 представляет собой график рассеяния, на котором показаны отдельные массы опухолей в момент окончания исследования роста опухолей человеческих карцином легких А 549 у самок бестимусных крыс, которых лечили 15 мг/кг CNTO364 или контрольными веществами. Горизонтальные линии указывают на медиану каждой группы исследования. Фиг. 14 А и В представляют собой графики, на которых показано изменение среднего объема опухоли с течением времени у крыс, которые имели опухоли, вызванные НТ 29 толстого кишечника человека и которых лечили CNTO 364 (CNTO 95-SPP-DM1), CNTO 365 (CNTO 95-SSHPB-DM4) и CNTO 366(CNTO 95-SSNPP-DM4). А. Контроль PBS и не относящееся к делу антитело F1 05, конъюгированное с тиолированными майтансинами с использованием того же способа и реагентов и инъецированное на 7 и 21 сутки в дозе 10 мг/кг. В. Контроль PBS и описанные конъюгированные антитела, инъецированные в дозе 20 мг/кг на 7 и 21 сутки, кроме группы CNTO365, которая получала одну инъекцию на 7 сутки. Фиг. 15 А и В представляют собой графики, на которых показано среднее изменение массы тела у крыс, несущих опухоли НТ 29, как показано на фиг. 14. Подробное описание изобретения 1. Определения. Для более легкого понимания настоящего изобретения некоторые термины вначале определены. Дополнительные определения приведены по ходу подробного описания. Термины альфа-V-интегрин,интегрин с субъединицей альфа-V и интегрин, содержащий субъединицу альфа-V, используются здесь взаимозаменяемо и означают трансмембранные гликопротеиновые субъединицы альфа-V функционального интегринового гетеродимера и включают в себя все варианты, изоформы и гомологи видов альфа-V. В соответствии с этим, антитела согласно изобретению могут в некоторых случаях перекрестно взаимодействовать с альфа-V из видов, отличных от человека, и с другими белками, которые структурно родственны человеческому альфа-V (например, человеческие гомологи альфа-V). В других случаях антитела могут быть полностью специфичны в отношении человеческого альфа-V и не проявляют видовой или иной перекрестной реактивности. Используемый здесь термин антитело включает в себя целые антитела и любой антигенсвязывающий фрагмент его одной цепи. Таким образом, антитело включает в себя любой белок или пептид,содержащий молекулу, которая включает в себя по меньшей мере часть иммуноглобулиновой молекулы,например, в качестве неограничивающих примеров по меньшей мере одну определяющую комплементарность область (CDR) или тяжелую, или легкую цепь, или связывающую лиганд часть, вариабельную область тяжелой или легкой цепи, константную область легкой или тяжелой цепи, каркасную область(FR), или любую часть антитела, или по меньшей мере одну часть связывающего белка, которая может быть встроена в антитело по настоящему изобретению. Антитело может быть мышиным, человеческим,гуманизированным или химерным. Антигенсвязывающий фрагмент или его часть включает в себя одноцепочечные антитела и их фрагменты. Функциональные фрагменты включают в себя антигенсвязывающие фрагменты, которые связываются с альфа-V-субъединицей млекопитающих. Примеры связывающих фрагментов, входящих в термин антигенсвязывающая часть антитела, включают в себя (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН; (ii) F(ab')2-фрагмент, бивалентный фрагмент, включающий в себя два Fab-фрагмента, связанных дисульфидным мостиком в области шарнира; (iii) Fd-фрагмент,состоящий из доменов VH и СН; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb, в котором домены VH и VL экспрессированы на одной полипептидной цепи, но с использованием линкера, слишком короткого для обеспечения образования пары двух доменов на одной цепи, принуждающего таким образом домены образовывать пары с комплементарными доменами другой цепи с созданием двух антигенсвязывающих участков; и (vi) выделенную определяющую комплементарность область (CDR). Более того, хотя два домена Fv-фрагмента VL и VH кодируются отдельными генами, они могут объединяться с использованием рекомбинантных способов, синтетическим линкером, который дает им возможность существовать в виде одного белка, в котором области VL и VH образуют моновалентные молекулы (известные как одноцепочечные Fv (scFv. Такие одноцепочные антитела, так же как подразумевается, входят в термин антигенсвязывающая часть антитела. Данные фрагменты антитела получают с использованием обычных способов, известных специалистам в данной области, и-5 013323 фрагменты подвергают скринингу на предмет применения тем же образом, как интактные антитела. Такие фрагменты могут продуцироваться ферментативным расщеплением, синтетическими или рекомбинатными способами, известными в данной области и/или описанными здесь. Термин эпитоп означает белковую детерминанту, способную к специфичному связыванию антитела. Эпитопы обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые группы сахаров и обычно имеют специфичные трехмерные характеристики,а также специфичные характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первым, но не с последним, теряется в присутствии денатурирующих растворителей. Термин нативный конформационный эпитоп или нативный белковый эпитоп используются здесь взаимозаменяемо и включают в себя белковые эпитопы, образующиеся в результате конформационного фолдинга интегриновой молекулы, которые возникают, когда аминокислоты из различных частей линейной последовательности интегриновой молекулы собираются вместе очень близко в 3-мерном пространстве. Такие конформационные эпитопы распределяются на внеклеточной стороне плазматической мембраны. Используемый здесь термин человеческое антитело, как подразумевается,включает в себя антитела, имеющие вариабельные и константные области, происходящие из иммуноглобулиновых последовательностей человеческой зародышевой линии или близко соответствующие таким последовательностям. Человеческое антитело согласно изобретению может включать в себя аминокислотные последовательности, не кодируемые иммуноглобулиновыми последовательностями человеческой зародышевой линии (например, содержат мутации, введенные путем случайного или сайтспецифического мутагенеза in vitro, или соматические мутации in vivo). Таким образом, используемый здесь термин человеческое антитело относится к антителу, в котором, по существу, каждая часть белка(например, CDR, каркас, домены CL, СН (например, CH1, CH2, CH3), шарнир, (VL, VH, по существу,сходна с антителом человеческой зародышевой линии. Человеческие антитела классифицированы на группы на основе сходства их аминокислотной последовательности, см., например,http://people.cryst.bbk.ac.uk/ubcg07s/. Таким образом, с использованием поиска сходства последовательности антитело со сходной линейной последовательностью может быть выбрано в качестве образца для создания гуманизированных антител. Гуманизация (также называемая переформирование или пересадка CDR) в настоящее время является хорошо отработанным способом снижения иммуногенности моноклональных антител (mAb) из ксеногенных источников (обычно грызунов) и для улучшения эффекторных функций (ADCC, активация комплемента, связывание CIq). Сконструированное mAb получают с использованием способов молекулярной биологии, однако простая пересадка CDR определяющих комплементарность областей (CDR) грызунов в каркасные области человека часто приводит к потере сродства связывания и/или специфичности исходных mAb. Для гуманизации антитела конструирование гуманизированного антитела включает в себя вариации, такие как замена консервативных аминокислот в остатках CDR, и обратная замена остатков из mAb грызунов в человеческих каркасных областях (обратные мутации). Положения для замены могут быть выявлены или идентифицированы путем сравнения последовательностей для структурного анализа или путем анализа моделей гомологии 3D-структуры вариабельных областей. В процессе созревания сродства в недавнее время использовали фаговые библиотеки для варьирования аминокислот в выбранных положениях. Сходным образом, многие подходы применяли для выбора наиболее подходящих каркасных областей, в которые нужно пересаживать CDR грызунов. Поскольку число данных известных параметров структур антител возрастает, улучшается продуманность и изощренность данных способов. Может использоваться консенсус последовательностей зародышевой линии из одного антитела и фрагментов каркасных последовательностей в каждой вариабельной области легкой или тяжелой цепи из различных человеческих mAb. Другим подходом к гуманизации является модификация только поверхностных остатков последовательности грызунов наиболее обычными остатками, находящимися в человеческих mAb, и это называется перестройка последовательности или облицовка. Описаны известные последовательности человеческих Ig, напримерKabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983),причем каждый приведенный источник полностью включен сюда в качестве ссылки. Химерные антитела представляют собой те антитела, которые сохраняют отдельные домены,обычно вариабельный домен, от одного вида и остальное от другого вида, например химеры мышь-6 013323 человек. Используемые здесь термины моноклональное антитело или композиция моноклонального антитела относятся к препарату молекул антител одной молекулярной композиции. В одном из вариантов осуществления человеческие моноклональные антитела получают посредством гибридомы, которая включает в себя В-клетку, полученную из трансгенного животного, не являющегося человеком, например трансгенной мыши, имеющей геном, содержащий человеческий трансген тяжелой цепи и трансген легкой цепи, слитую с иммортализованной клетки. Однако в общем кодирующие антитело последовательности клонируют и встраивают в клетку хозяина или продуцирующую клеточную линию. Используемый здесь термин рекомбинантная клетка хозяина (или просто клетка хозяина), как подразумевается, относится к клетке, в которую введен рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины, как подразумевается, относятся не только к конкретной рассматриваемой клетке, но и к потомству такой клетки. Поскольку некоторые модификации могут произойти в последующих поколениях вследствие мутации или воздействий внешней среды, такое потомство фактически может быть не идентично родительской клетке, но, тем не менее, включается в объем используемого здесь термина клетка хозяина. Рекомбинантные клетки хозяина включают, например, линии СНО или происходящую от мышиной миеломы SP/О клеточную линию. Используемый здесь термин рекомбинантное человеческое антитело включает все человеческие или гуманизированные антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, например (а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам человеческого иммуноглобулина, или из происходящей из данного животного гибридомы, (b) антитела, выделенные из клетки хозяина, трансформированной для экспрессии данного антитела, например из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные другими средствами, которые включают в себя встраивание последовательностей человеческих иммуноглобулиновых генов в другие последовательности ДНК. Используемый здесь термин выделенное антитело, как подразумевается, относится к антителу,которое, по существу, свободно от других антител, имеющих другие антигенные специфичности (например, выделенное антитело, которое специфично связывается с альфа-V, по существу, свободно от антител, которое специфично связывается с антигенами, отличными от альфа-V). Выделенное антитело, специфично связывающееся с эпитопом, изоформой или вариантом человеческого альфа-V, может, однако,иметь перекрестную реактивность в отношении других родственных антигенов, например из других видов (например, гомологи вводов альфа-V). Более того, выделенное антитело может быть, по существу,свободным от других клеточных материалов и/или химических веществ. Используемый здесь термин специфичное связывание относится к антителу, связывающемуся с предварительно определяемым антигеном. Обычно антитело связывается с константой диссоциации (KD), составляющей 10-7 М или менее,и связывается с предварительно определенным антигеном с KD, которая по меньшей мере в два раза ниже, чем его KD, для связывания неспецифичного антигена (например, БСА, казеин), отличного от предварительно определенного антигена или близкородственного антигена. Используемый здесь изотип относится к классу антитела (например, IgM или IgG1), который кодируется генами константной области тяжелой цепи. Сокращения.Ab - антитела, поликлональные или моноклональные,aV - интегриновая субъединица альфа-V,b3 - интегриновая субъединица бета-3,bFGF - основной фактор роста фибробластов,HUVEC - эндотелиальные клетки пупочной вены человека,IFN - интерферон,Ig - иммуноглобулин,IgG - иммуноглобулин G,Mab - моноклональное антитело,NPB - N-сукцинимидил-5-нитро-(2-пиридилдитио)бутират,SMCC - сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат,SMNP - N-сукцинимидил-4-метил-4-(5-нитро-2-пиридилдитио)пентанат,SMPT - 4- сукцинимидилоксикарбонил-(2-пиридилдитио)толуол,SPDB - N-сукцинимидил-4-(2-пиридилдитио)бутират,SPDP - N-сукцинимидил-4-(2-пиридилдитио)пропионат,SPP - N-сукцинимидил-4-(2-пиридилтио)пентанат,SP - N-сукцинимидил-4-(2-пиридил),SS - сульфосукцинимидил,SSNPP - сульфосукцинимидил-N-сукцинимидил-4-(5-нитро-2-пиридилдитио)пентанат,VEGF - фактор роста эндотелия сосудов.-7 013323 2. Композиции. А. Конъюгаты антител согласно изобретению. Конъюгаты антител согласно изобретению представлены формулой где А представляет собой антитело, специфичное в отношении человеческой субъединицы альфа-Vинтегрина, в которой указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу; С представляет собой цитотоксин с IC50, равной 10-9 М или менее;L представляет собой линкерную группу, которая связывает антитело и цитотоксин и далее включает в себя связь, расщепляемую компонентами внутриклеточной среды;m представляет собой среднее число цитотоксиновых молекул, связанных с антителом, и является целым числом в интервале 1-5, предпочтительно 3-4. Цитотоксин может быть выбран из группы, состоящей из майтансиноидов, калихеамицинов, эпотилонов, дискодермолида, элеутробинов, доластатинов, криптофицинов, камптотецинов, ризоксина (рег.CAS 90996546) или производных таксана и других таких соединений, которые проявляют 50% максимального ингибирования (IC50 или GI50) в отношении роста опухолевых клеток 10-9 М или менее. Линкеры, содержащие расщепляемые внутри клеток связи, включают в себя кислотно-лабильные связи, такие как связи цис-аконитила, сложные эфиры, чувствительные к кислоте гидразоновые связи,деградируемые в лизосомах пептидные линкеры, расщепляемые гидролазами линкеры, специфичные в плане расщепления протеазой или пептидазой линкеры, и дисульфидные (сульфгидрильные) линкеры(см. Dyba, M., et al. 2004, Curr. Pharm. Design. 10:2311-2334 для обзора). Поскольку линкер может быстро или селективно расщепляться во внутриклеточных условиях по сравнению с условиями, преобладающими, например, в циркуляторном русле, он обеспечивает дальнейшую специфичность и безопасность в плане общей фармакодинамики конъюгата. Дисульфидные связи особенно предпочтительны по причине благоприятного восстановительного потенциала в клеточных компартментах, а также по причине индуцируемой активации ферментов восстановления (Saito, G. et al. Adv. Drug. Delivery Rev. 2003 55:199-215). В одном из вариантов осуществления связь находится между атомом серы, присутствующем в молекуле антитела, например в боковой цепи остатка цистеина, и другим атомом серы, присутствующей в токсичном соединении. В другом варианте осуществления связывающий радикал состоит из одного или нескольких атомов или химических групп. Другое основное соображение при химическом связывании биологической молекулы, такой как рекомбинантный белок, с химическим соединением заключается в том, что дериватизационная химия может и в большинстве случаев будет давать новую молекулярную сущность, которая поэтому может иметь неизвестные биологические свойства. Так, следует понимать, что продукты физиологического расщепления должны конструироваться так, что они дадут производные с предназначенной биологической активностью. Майтансиноиды согласно изобретению, включая DM1, DM3, DM4 и другие, как показано и описано на фиг. 1, сохраняют биологическую активность. Конъюгаты антитела против альфа-V-интегрина и майтансиноида согласно изобретению получают путем химического связывания антитела против альфа-V с молекулой майтансиноида, без значимого снижения биологической активности антитела, и с предоставлением майтансиноида, который при высвобождении в физиологических условиях сохраняет свой цитотоксический потенциал. Примеры подходящих майтансиноидов представляют собой сложные эфиры майтансинола и аналоги майтансинола, включая в качестве неограничивающих примеров те, которые имеют модифицированное ароматическое кольцо, и те, которые имеют модификации в положениях С-19, С-20, или С-14, или С-15, или С-4,5-дезокси. Предпочтительными являются сложные эфиры майтансинола С-3. Особенно предпочтительными майтансиноидами являются производные N-метилаланиновых сложных эфиров майтансинола (N2"дезацетилмайтансин). Особенно предпочтительные конъюгаты включают в себя дисульфидную связь,которая при расщеплении путем восстановления высвобождает соответствующий майтансиноид, несущий свободный тиол. Содержащие тиол майтансиноиды предпочтительного типа показаны на фиг. 1N2'-дезацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтансин (DM4). Конъюгаты молекул антитела согласно изобретению и токсического соединения могут быть образованы с использованием любых способов, известных в настоящее время или разработанных ранее. Например, цитотоксическое соединение может быть модифицировано с получением свободной аминогруппы и затем присоединено к молекуле антитела кислотолабильным линкером или фотолабильным линкером. Токсическое соединение может конденсироваться с пептидом и впоследствии связываться с молекулой антитела для продукции лабильного в плане воздействия пептидаз линкера. Токсическое соединение может обрабатываться для получения первичной гидроксильной группы,которая может сукцинилироваться и связываться с молекулой антитела для продукции конъюгата, который может расщепляться внутриклеточными эстеразами, с высвобождением свободного лекарственного средства.-8 013323 Для создания дисульфидной связи между антителом А и цитотоксином С предпочтительно токсическое соединение обрабатывают с созданием свободной или защищенной тиольной группы, и затем одно или несколько содержащих дисульфид или тиол токсических соединений ковалентно связывают с молекулой антитела дисульфидной(ыми) связью(ями). Дисульфидная связь должна образовываться непосредственно со свободным тиолом антитела, но может образовываться дериватизацией любой реакционноспособной группы в антителе для введения участка дисульфидного обмена, например, связыванием бифункционального линкера со свободными аминогруппами антитела. Например, молекулы антитела могут модифицироваться реагентами перекрестного связывания, такими как N-сукцинимидил-3-(2 пиридилдитио)пропионат(SDPB),N-сукцинимидил-4-(2-пиридилдитио)пентанат (SPP), N-сукцинимидил-5-(2-пиридилдитио)пентанат, 2-иминотиолан (IT) или ацетилянтарный ангидрид, известными способами. Таким образом, конъюгаты антитела против альфа-V-интегрина с цитотоксином согласно изобретению представлены формулой II, в которой майтансинол этерифицируют в положении С-3, и антитело представляет собой антитело против интегриновой субъединицы альфа-V; R1, R2, X1 и Х 2 независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов,разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов, фенильную, замещенную фенильную, или гетероциклическую арильную группу, или гетероциклоалкильную группу; n представляет собой 1-5; р представляет собой 1-5; m представляет собой 1-10. В предпочтительном варианте линкерный радикал представляет собой 4-тиопентанат, происходящий из SPP, или 4-тиопентанат. Молекула антитела, содержащая свободные или защищенные тиольные группы, происходящие таким образом, затем взаимодействует с содержащим дисульфид или тиол токсическими соединениями для продукции конъюгатов. Конъюгаты могут быть очищены путем ВЭЖХ или гель-фильтрацией. В. Антитела против альфа-V согласно изобретению. В дополнение к связыванию альфа-V человеческие антитела или антигенсвязывающие фрагменты или их части, описанные выше, могут быть выбраны на основании сохранения других функциональных свойств антител согласно изобретению, например: 1) связывание живых клеток, экспрессирующих человеческую альфа-V; 2) предотвращение связывания живых клеток с матриксными белками; 3) связывание с человеческим альфа-V с KD 10-8 М или менее (например, 10-9 М или 10-10 М или менее); 4) проявление независимого от кальция связывания с альфа-V; 5) связывание с уникальным эпитопом на альфа-V или отношение к уникальной группе комплементарности антител, связывающихся с альфа-V; 6) ингибирование ангиогенеза in vitro или in vivo или 7) снижение опухолевой массы или предотвращение роста опухоли in vivo. Еще в одном аспекте изобретения структурные свойства человеческих антител против альфа-V согласно изобретению CNTO 95 используют для создания структурно родственных человеческих антител против альфа-V, которые сохраняют по меньшей мере одно функциональное свойство антител, которые сохраняют по меньшей мере одно функциональное свойство антител согласно изобретению, такое как связывание с альфа-V. Более конкретно, одна или несколько областей CDR CNTO 95 могут комбинироваться рекомбинантно с известными областями каркаса человека и CDR для создания дополнительных,сконструированных рекомбинантно человеческих антител против альфа-V согласно изобретению. В предпочтительном варианте осуществления антитело для применения в конъюгатах антител против альфа-V, описанных здесь, представляет собой человеческое антитело против альфа-V, происходящее от иммунизации трансгенной мыши, содержащей гены для экспрессии человеческих иммуноглобулинов. Получение антитела описано подробно в публикации РСТWO 02/12501 и в публикации заявки на выдачу патента США 2003/040044, причем оба данных источника включены сюда в качестве ссыл-9 013323 ки. Антитело включает в себя любой белок или пептид, содержащий молекулу, которая включает в себя по меньшей мере часть определяющей комплементарность области (CDR) тяжелой или легкой цепи, или ее лиганд-связывающую часть, происходящую из антитела, обозначенного CNTO 95 (см. публикацию РСТ WO 02/12501 и публикацию заявки на выдачу патента США 2003/040044), в комбинации с вариабельной областью тяжелой цепи или легкой цепи, константной областью тяжелой или легкой цепи, каркасной областью, или любой частью указанного антитела, которая может встраиваться в антитело. Предпочтительно CDR1, 2 и/или 3 описанных выше сконструированных антител включают в себя точную(ые) аминокислотную(ые) последовательность(и), соответствующую(ие) полностью человеческому Mab, обозначенному CNTO 95, Gen0101, CNTO 95, С 371 А, полученные путем иммунизации трансгенной мыши, как описано здесь. Однако обычный специалист в данной области поймет, что может быть возможным некоторое отклонение от точной последовательности CDR CNTO 95, при сохранении,тем не менее, способности антитела эффективно связывать альфа-V (например, консервативные замены). В конкретном варианте осуществления антитело или антигенсвязывающий фрагмент могут иметь антигенсвязывающую область, которая включает в себя по меньшей мере часть по меньшей мере одной CDR тяжелой цепи (т.е. CDR1, CDR2 и/или CDR3), имеющей аминокислотную последовательность соответствующих CDR1, 2 и/или 3 (например, SEQ ID NO: 1, 2 и/или 3). В другом, особенно предпочтительном варианте осуществления антитело или антигенсвязывающая часть или вариант может иметь антигенсвязывающую область, которая включает в себя по меньшей мере часть по меньшей мере одной CDR легкой цепи (т.е. CDR1, CDR2 и/или CDR3), имеющей аминокислотную последовательность соответствующихCDR1, 2 и/или 3 (например, SEQ ID NO: 4, 5 и/или 6) легкой цепи CNTO 95. В предпочтительном варианте осуществления три CDR тяжелой цепи и три CDR легкой цепи антитела или антигенсвязывающего фрагмента имеют аминокислотную последовательность соответствующего CDR mAb CNTO 95. В соответствии с этим в другом варианте осуществления сконструированное антитело может быть составлено из одного или нескольких CDR, которые, например, на 90, 95, 98 или 99,5% идентичны в отношении одного или нескольких CDR CNTO 95. Антитела против альфа-V-субъединицы по настоящему изобретению могут включать в себя в качестве неограничивающих примеров по меньшей мере одну часть, последовательность или комбинацию, выбранную из 5 до всех из следующих друг за другом аминокислот по меньшей мере одной из SEQ ID NO: 1-6. Антитело против альфа-V-субъединицы по настоящему изобретению может далее включать в себя полипептид по меньшей мере из одной из 70-100% следующих друг за другом аминокислот по меньшей мере одной из SEQ ID NO: 7, 8. Например, аминокислотная последовательность вариабельной области легкой цепи может сравниваться с последовательностью SEQ ID NO: 8,или аминокислотная последовательность тяжелой цепи CDR3 может сравниваться с SEQ ID NO: 7. Как описано и заявлено здесь, последовательности, приведенные в SEQ ID NO: 1-8, включают в себя консервативные модификации последовательности, т.е. модификации аминокислотной последовательности, которые значимо не влияют или не изменяют характеристик антитела, кодируемого нуклеотидной последовательностью или содержащего аминокислотную последовательность. Такие консервативные модификации последовательности включают в себя аминокислотные замены, добавления и делеции. Модификации могут вводиться в SEQ ID NO: 1-8 или в кодирующие их нуклеиновые кислоты стандартными способами, известными в данной области, такими как сайт-специфический мутагенез или опосредованный ПЦР мутагенез. Консервативные аминокислотные замены включают те, в которых аминокислотный остаток замещен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Данные семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), с кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин,пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин,изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предсказанный несущественный аминокислотный остаток в антителе против человеческого альфа-V предпочтительно заменяют другим аминокислотным остатком из того же семейства боковых цепей. По меньшей мере одно антитело согласно изобретению связывается по меньшей мере с одним конкретным эпитопом, специфичным в отношении по меньшей мере одного белка альфа-V-субъединицы,его субъединицы, фрагмента, части или любой комбинации. По меньшей мере один эпитоп может включать в себя по меньшей мере одну связывающую антитело область, которая включает в себя по меньшей мере одну часть указанного белка, причем данный эпитоп предпочтительно составлен по меньшей мере одной внеклеточной, растворимой, гидрофильной, внешней или цитоплазматической частью указанного белка. По меньшей мере один определенный эпитоп может включать в себя любую комбинацию по меньшей мере одной аминокислотной последовательности по меньшей мере из 1-3 аминокислот до целой определенной части следующих друг за другом аминокислот SEQ ID NO: 9. Как констатировалось ранее, изобретение также относится к антителам, антигенсвязывающим фрагментам, иммуноглобулиновым цепям и CDR, включающим в себя аминокислоты в последовательности,- 10013323 которая по существу соответствует описанной здесь аминокислотной последовательности. Предпочтительно, такие антитела или антигенсвязывающие фрагменты и антитела, включающие в себя такие цепи или CDR, могут связываться с человеческой альфа-V-субъединицей с высоким сродством (например, KD меньше или равна примерно 10-9 М). Аминокислотные последовательности, которые являются, по существу, идентичными описанным здесь последовательностям, включают в себя последовательности, включающие в себя консервативные аминокислотные замены, а также делеции и/или вставки аминокислот.Аминокислоты в антителе против альфа-V-субъединицы по настоящему изобретению, которые существенны для функционирования, могут идентифицироваться способами, известными в данной области, такими как сайт-специфический мутагенез или мутагенез аланинового сканирования (например,Ausubel, supra, Chapters 8, 15; Cunningham and Wells, Science 244:1081-1085 (1989. Последняя процедура вводит единичные аланиновые мутации в каждый остаток молекулы. Полученные в результате мутантные молекулы затем тестируют на биологическую активность, например, в качестве неограничивающего примера по меньшей мере на одну активность по нейтрализации альфа-V-субъединицы. Участки, критичные для связывания антитела, также могут идентифицироваться путем структурного анализа, такого как кристаллизация, ядерный магнитный резонанс и фотоаффинное мечение (Smith, et al., J. Mol. Biol. 224:899-904 (1992) и de Vos, et al., Science 255:306-312 (1992. 3. Способы получения конъюгатов. Исходное соединение майтансинол, используемый при продукции соединений DM1, DM3 и DM4, и родственные активированные майтансиноида (фиг. 1) согласно изобретению могут быть получены из природного С-3 сложного эфира майтансина, выделенного из природных источников (Kupchan et al., J.Amer. Chem. Soc. 97, 5294 (1975 путем восстановительного расщепления. Реагент гидрид литиятриметоксиалюминия в тетрагидрофуране при -40 С особенно подходит для данной стадии. Другие природные сложные эфиры майтансиноидов могут также быть предпочтительно получены путем культивирования микроорганизма, который принадлежит к роду Nocardia (патент США 4151042) или Actinosynnema spp., которые сконструированы для продукции майтансинола, майтанацина или С-3 сложных эфиров майтансинола, таких как пропионат майтансинола, в культуральном бульоне, и экстракции соединений из культурального бульона для дальнейшей очистки. Имеется много связывающих групп, известных в данной области, для получения конъюгатов антитела и майтансиноида, включая, например,дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидные линкеры, лабильные при воздействии пептидаз или сложные эфиры, которые могут быть кислотолабильными или расщепляемыми эстеразой. Как описано в патенте США 5208020, этерификация майтансинола или аналога карбоновыми кислотами, содержащими метилдитиогруппу или другую защищенную тиогруппу, включая, например, Nметил-N-[3-(метилдитио)-1-оксопропил]-L-аланин, приводит к продукции соответствующих, содержащих дисульфид майтансиноидов. В случае, когда получаются два диастереоизомерных продукта, содержащих D- и L-ацильные боковые цепи, диастереоизомерные сложные эфиры майтансиноидов легко разделяются способами, известными в данной области, и содержание менее желательного продукта Dаланилового аналога-изомера снижают для получения майтансинола по WO 03096782. Восстановительное расщепление дисульфидной группы дитиотреитом дает соответствующий, содержащий тиол майтансиноид, который легко связывается через дисульфидные или тиоэфирные связи со связывающими клетки агентами. Тиол-майтансиноиды могут быть очищены путем ВЭЖХ с использованием колонки С 18 в обращенно-фазовом режиме с элюцией градиентом вода-ацетонитрил. Бифункциональные реагенты для связывания. Известно, что при получении конъюгатов двух веществ, из которых по меньшей мере одно включает в себя белок или полипептид, применяют бифункциональные агенты для ковалентного присоединения конъюгата, причем аминогруппы в конъюгированных молекулах обычно используются для реакции конъюгации. Бифункциональные средства для присоединения включают в себя N-сукцинимидил-3-(2 пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров, такие как диметиладипимидатHCl, активные сложные эфиры, такие как дисукцинимидилсуберат, альдегиды, такие как глутаральдегид, бисазидосоединения, такие как бис(п-аксидобензоил)гександиамин, производные бис-диазония, такие как бис-(п-диазонийбензоил)этилендиамин, диизоцианаты, такие как толуол-2,6-диизоцианат, и активные бис-соединения фтора, такие как 1,5-дифтор-2,4-динитробензол. SPDP находится среди наиболее часто применяемых реагентов для данной цели, и было доказано, что могут использоваться многие другие кислоты, включающие в себя радикалы N-сукцинимидил-(2-пиридилтио)-, N-сукцинимидил-(5-нитро-2 пиридилтио)- или N-сукцинимидил-(4-пиридилдитио)-короткоцепочечный алкан. На фиг. 2 показаны структуры обычно используемых бифункциональных линкеров и их акронимов. Конъюгация активированного антитела с тиолированным майтансиноидом. Получение конъюгатов CNTO 95-майтансиноид проводили, следуя способу, описанному ранее(Chari et al., Cancer Res. 52: 127-131, 1992, и патент США 5208020), и как показано на фиг. 3. В данной процедуре антитело модифицировали бифункциональным линкером в отношении линкера к антителу в интервале от 5 до 10 к 1 для введения дитиопиридильных групп на боковые группы аминокислот антите- 11013323 ла. Активированное антитело отделяют от остатков линкера хроматографией путем гель-фильтрации наG25. Отношение линкер-антитело после очистки составляет менее 5-10:1 и обычно находится в интервале от 3:1 до 5:1, и его измеряют поглощением при 252 и 280 нм. Активированный тиол-майтансиноид добавляют в молярном избытке по отношению к измеренному линкеру. После конъюгации смесь опять очищают хроматографией путем гель-фильтрации на G25 с получением объединенного продукта. В качестве альтернативы конъюгат антитела против интегрина и майтансиноида получают, по существу, в одну стадию взаимодействия майтансиноида, несущего реакционноспособный сложный эфир с антителом против интегрина, ранее не активированным химически. Реакционноспособный сложный эфир майтансиноида может быть сложным эфиром N-сукцинимидила, N-сульфосукцинимидила, Nфталимидила, N-сульфофталимидила, 2-нитрофенила, 4-нитрофенила, 2,4-динитрофенила, 3-сульфонил 4-нитрофенила или 3-карбокси-4-нитрофенила. Способ описан в публикации WO 2002098883, содержание которой включено сюда в качестве ссылки. 4. Способы применения конъюгатов согласно изобретению. Антитела согласно изобретению могут вводиться нуждающемуся в этом субъекту для предотвращения, лечения, управления или ослабления злокачественной опухоли или одного или нескольких ее симптомов. Антитела согласно изобретению могут также вводиться в комбинации с одной или несколькими другими способами лечения, предпочтительно способами лечения, которые могут использоваться для предотвращения, управления или лечения злокачественной опухоли (включая в качестве неограничивающих примеров профилактические или терапевтические средства, перечисленные здесь ниже), нуждающемуся в этом субъекту для предотвращения, лечения, управления или ослабления злокачественной опухоли или одного или нескольких ее симптомов. В конкретном варианте осуществления изобретение относится к способу предотвращения, лечения, управления или ослабления злокачественной опухоли или одного или нескольких ее симптомов, причем указанный способ включает в себя нуждающемуся в этом субъекту дозы профилактически или терапевтически эффективного количества препарата, содержащего конъюгаты против альфа-V-антитела согласно изобретению. В другом варианте осуществления изобретение относится к способу предотвращения, лечения или ослабления злокачественной опухоли или одного, или нескольких ее симптомов, причем указанный способ включает в себя введение нуждающемуся в этом субъекту дозы профилактически или терапевтически эффективного количества конъюгатов антитела против альфа-V согласно изобретению в сочетании с профилактически или терапевтически эффективным одним или несколькими способами лечения (например, хирургическое, радиационное лечение, или введение терапевтических средств, отличных от конъюгатов против альфа-V-антитела). Конъюгаты антитела согласно изобретению могут использоваться в качестве первой, второй, третьей или четвертой очереди лечения злокачественной опухоли. Изобретение относится к способам лечения или ослабления у субъекта одного или нескольких симптомов злокачественной опухоли. Далее изобретение относится к способам предотвращения рецидива злокачественной опухоли у пациентов, которых лечили и которые не имели активности заболевания, после введения конъюгата антитела против альфа-V согласно изобретению. Злокачественные опухоли, которые можно лечить способами согласно изобретению, включают в себя в качестве неограничивающих примеров неоплазии, опухоли, метастазы или любое заболевание или нарушение, характеризующееся неконтролируемым ростом клеток. Злокачественная опухоль может представлять собой первичную или метастазирующую злокачественную опухоль. Злокачественные клетки могут экспрессировать интегрины с альфа-V-субъединицей или могут не экспрессировать данные белки. В предпочтительном варианте осуществления злокачественная опухоль, которую контролируют,лечат или ослабляют ее воздействие согласно способам согласно изобретению, представляет собой злокачественную опухоль, экспрессирующую альфа-V-субъединицу интегрина, и она метастазирует в другой участок или орган в организме пациента или имеет потенциал для метастазирования. Конкретные примеры злокачественных опухолей, которые можно лечить способами согласно изобретению, включают в себя в качестве неограничивающих примеров злокачественные опухоли головы, шеи, рта, горла,пищевода, грудной клетки, кости, легких, толстого кишечника, прямой кишки, желудка, предстательной железы, молочной железы, яичников, почки, печени, поджелудочной железы и головного мозга. Дополнительные злокачественные опухоли включают в себя в качестве неограничивающих примеров следующее: лейкозы, неограничивающими примерами которых являются острый лейкоз, острый лимфоцитарный лейкоз, острые миелоцитарные лейкозы, такие как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный лейкоз, эритролейкоз и миелодиспластический синдром, хронические лейкозы,неограничивающими примерами которых являются хронический миелоцитарный (гранулоцитарный) лейкоз, хронический лимфоцитарный лейкоз, волосато-клеточный лейкоз; истинная полицитемия; лимфомы, неограничивающими примерами которых являются болезнь Ходжкина, неходжкинская лимфома; миеломы, такие как множественная миелома, несекреторная миелома, остеосклеротическая миелома,лейкоз плазматических клеток, солитарная плазмацитома и экстрамедуллярная плазмацитома; макроглобулинемия Вальденстрема; злокачественную опухоль костей и саркомы соединительной ткани, такие как саркома кости, миеломная болезнь кости, остеосаркома, хондросаркома, саркома Юинга, болезнь костей Педжета, злокачественная гигантоклеточная опухоль, фибросаркома кости, хордома, периостеальная- 12013323 саркома, мягкоклеточные саркомы, ангиосаркома (гемангиосаркома), фибросаркома, саркома Капоши,леймиосаркома, липосаркома, лимфангиосаркома, неврилеммома, рабдомиосаркома, синовиальная саркома; опухоли головного мозга, неограничивающими примерами которых являются глиома, астроцитома, неглиальная опухоль, акустическая невринома, краниофарингиома, медуллобластома, менингиома,пинеоцитома, пинеобластома, первичная опухоль головного мозга; рак молочной железы, включающий в себя аденокарциному и интрадуктальную карциному, и папиллярный рак молочной железы; рак надпочечников, включающий в себя феохромоцитому и адренокортикальную карциному; рак щитовидной железы; рак поджелудочной железы; злокачественные опухоли гипофиза; злокачественные опухоли глаза,неограничивающими примерами которых являются окулярная меланома, хороидная меланома, меланома цилиарного тела и ретинобластома; вагинальные злокачественные опухоли; рак вульвы; злокачественные опухоли шейки матки; злокачественные опухоли матки, неограничивающими примерами которых являются карцинома, эндометрия и саркома матки; злокачественные опухоли яичника; злокачественные опухоли пищевода и другие злокачественные опухоли головы и шеи, неограничивающими примерами которых являются плоскоклеточный рак, аденокарцинома, мукоэпидермоидная карцинома, аденоплоскоклеточная карцинома, саркома, меланома, плазмацитома, бородавчатая карцинома и зерноклеточная (мелкоклеточная) карцинома; злокачественные опухоли желудка; злокачественные опухоли толстого кишечника; злокачественные опухоли прямой кишки; злокачественные опухоли печени, такие как гепатоцеллюлярная карцинома и гепатобластома, злокачественные опухоли желчного пузыря; холангиокарциномы; злокачественные опухоли легких, такие как немелкоклеточный рак легких, плоскоклеточная карцинома(эпидермоидная карцинома), аденокарцинома, крупноклеточная карцинома и мелкоклеточный рак легких; злокачественные опухоли яичек, хориокарцинома (опухоль желточного мешка), злокачественные опухоли предстательной железы; злокачественной опухоли ротовой полости, не ограниченные плоскоклеточной карциномой; базальные злокачественные опухоли; злокачественные опухоли слюнной железы; почечно-клеточный рак и другие злокачественные опухоли почки; и злокачественные опухоли мочевого пузыря, не ограниченные переходно-клеточной карциномой (для обзора по таким заболеваниям см.Lippincott Company; 6th Edition, 2001). Способами и композициями согласно изобретению также можно лечить предзлокачественные состояния. Такие злокачественные опухоли могут включать в себя в качестве неограничивающих примеров фолликулярные лимфомы, карциномы с мутациями р 53, гормонозависимые опухоли молочной железы, предстательной железы и яичника, и предраковые повреждения, такие как семейный аденоматозный полипоз и миелодиспластические синдромы. В предпочтительном варианте осуществления злокачественная опухоль, которую предотвращают,контролируют, лечат или ослабляют ее воздействие способом согласно изобретению, выбрана из рака предстательной железы, рака молочной железы, злокачественной опухоли кости, меланомы, рака легких и рака яичника. В другом варианте осуществления злокачественная опухоль, которую предотвращают,контролируют, лечат или ослабляют ее воздействие способом согласно изобретению, выбрана из метастазирующих опухолей, включающих в себя в качестве неограничивающих примеров опухоли, которые имеют или не имеют метастазов в кости (неограничивающие примеры представляют собой злокачественные опухоли предстательной железы, молочной железы и легких, которые метастазируют или имеют потенциал для метастазирования в кость), опухоли, которые метастазируют или могут метастазировать в легкие, опухоли, которые метастазируют или могут метастазировать в головной мозг, и опухоли, которые метастазируют или могут метастазировать в другие органы или ткани субъекта. Способы лечения злокачественных опухолей. Любое средство или вид лечения (например, виды химиотерапии, радиационной терапии, гормональной терапии и/или биологической терапии, или иммунотерапии), которые известны, применялись или в настоящее время применяются для профилактики, лечения, управления или ослабления воздействия злокачественной опухоли, или одного, или нескольких ее симптомов, могут использоваться в комбинации с конъюгатом с антителом против альфа-V согласно изобретению в соответствии с описанным здесь изобретением. Терапевтические или профилактические средства включают в себя в качестве неограничивающих примеров пептиды, полипептиды, белки, белки слияния, молекулы нуклеиновой кислоты,малые молекулы, средства-миметики, синтетические лекарственные средства, неорганические молекулы и органические молекулы. Неограничивающие примеры классов таких средств (т.е. противораковых средств) цитотоксины, ингибиторы ангиогенеза и средства, используемые для предоставления облегчения боли или для отмены повреждающих эффектов одного или нескольких терапевтических средств (например, применение бифосфоната для снижения гиперкальцемических эффектов глюкокортикоидов). Биологические иммуномодулирующие средства включают в себя антитела против Т-клеточного рецептора, такие как антитела против CD3 (например, Nuvion (Protein Design Labs), OKT3 (JohnsonJohnson), или антитела против CD20 Rituxan (IDEC, антитела против CD52 (например, CAMPATH 1H(Ilex, антитела против CD11a (например, Xanelim (Genentech; антитела и антагонисты против цитокина или против рецептора цитокина, такие как антитела против рецептора IL-2 (Zenapax (Protein DesignLabs, антитела против рецептора IL-6 (например, MRA (Chugai и антитела против IL-12 (CNTO 1275(Centocor, антитела против TNF-альфа (Remicade (Centocor или антагонист рецептора TNF (Enbrel(Immunex, антитела против IL-6 (BE8 (Diaclone) и CNTO328 (Centocor,и антитела, которые иммуноспецифично связываются с опухолеассоциированными антигенами (например, трастузимаб (Genentech). Ингибиторы ангиогенеза (т.е. антиангиогенные агенты) включают в качестве неограничиващих примеров ангиостатин (фрагмент плазминогена); антиангиогенный антитромбина III; ангиозим. Бифосфонаты включают в себя в качестве неограничивающих примеров алендронат; клодронат; этидронат; ибадронат; памидронат; ризедронат; тилудронат и золедронат. Неограничивающие конкретные примеры противораковых средств; которые могут быть использованы в соответствии со способами согласно изобретению; включают в себя 5-фторурацил; ацивицин; альдеслейкин; альтретамин; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназу; азацитидин; ацетепу; азотомицин; батимистат; бикалутамид; блеомицина сульфат; бреквинар натрия; бропиримин; бусульфан; карбоплатин; кармустин; гидрохлорид карубицина; карцелезин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанина мезилат; диазихон; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эзорубицина гидрохлорид; эстрамустин; экстрамустина натрия фосфат; этанидазол; этопозид; этопозида фосфат; фазарабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; флуроцитабин; фосквидон; фостриецин натрия; гемцитабин; гемцитабина гидрохлорид; гидроксимочевину; идарубицина гидрохлорид; ифосфамид; ильмофосин; интерлейки II (включая рекомбинантный интерлейкин II; или rIL2); интерферон альфа-2 а; интерферон альфа-2b; интерферона альфа-m; интерферон альфа-n3; интерферон бета-Ia; интерферон гамма-Ib; ипроплатин; иринотекана гидрохлорид; ланреотида ацетат; летрозол; лейпролида ацетат; лиарозола гидрохлорид; лометрексол натрия; ломустин; лозоксантрона гидрохлорид; мазопрокол; мехлорэтамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредэпу; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловую кислоту; нокодазол; ормаплатин; паклитаксел; пегаспаргазу; порфромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; роглетимид; сафингола гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенер; тализомицин; тегафур; телоксантрона гидрохлорид; темопорфин; тенипосид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепу; тиазофурин; тирапазамин; топотекан; триметрексат; триметрексата глюкуронат; трипторелин; урацил-мустард; уредепу; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндезин; виндезина сульфат; винепиридина сульфат; винглицината сульфат; винлейрозина сульфат; винорельбина тартрат; винросидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин; зорубицина гидрохлорид. Изобретение также относится к введению антитела согласно изобретению в комбинации с радиационной терапией, включающей в себя применение рентгеновских лучей, гамма-лучей и других источников радиации для разрушения раковых клеток. В предпочтительных вариантах осуществления радиационное лечение осуществляют путем облучения внешним пучком или телетерапии, в которой радиация направляется из удаленного источника. В других предпочтительных вариантах осуществления радиационное лечение осуществляют путем внутренней терапии или брахитерапии, в которой радиоактивный источник помещают внутри организма вблизи злокачественных клеток или опухолевой массы. В конкретных вариантах осуществления пациентам с раком молочной железы вводят профилактически или терапевтически эффективное количество конъюгата против антитела против альфа-V согласно изобретению в комбинации с введением профилактически или терапевтически эффективного количества одного или нескольких средств, которые могут использоваться для лечения рака молочной железы,включая в качестве неограничивающих примеров доксорубицин, эпирубицин, комбинацию доксорубицина и циклофосфамида (АС), комбинацию циклофосфамида, доксорубицина и 5-фторурацила (САР),комбинацию циклофосфамида, эпирубицина и 5-фторурацила (CEF), или другие средства, например,герцептин, тамоксифен, паклитаксел или таксотер. В конкретных вариантах осуществления пациентам с раком предстательной железы вводят профилактически или терапевтически эффективное количество конъюгата против антитела против альфа-V согласно изобретению в комбинации с введением профилактически или терапевтически эффективного количества одного или нескольких средств, которые могут использоваться для лечения рака предстательной железы, включая в качестве неограничивающих примеров радиационную терапию внешним пучком; интерстициальную имплантацию радиоизотопов, т.е. рения, палладия или иридия; лейпролид или другие антагонисты LHRH, нестероидные антиандрогены (флутамид, нилутамид, бикалутамид), стероидные антиандрогены (ципротерона ацетат), комбинацию лейпролида и флутамида, экстрогены, такие как DES, этинилэкстрадиол; преднизон в низкой дозе, или другие режимы химиотерапии, о которых сообщали, что они приводили к субъективному улучшению симптомов и снижению уровня PSA. В конкретных вариантах осуществления пациентам с раком яичника вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с введением профилактически или терапевтически эффективного количества одного или- 14013323 нескольких средств, которые могут использоваться для лечения рака яичника, включая в качестве неограничивающих примеров: внутрибрюшинную радиационную терапию, такую как терапию 32 Р; общую абдоминальную или тазовую радиационную терапию, цисплатин, комбинацию паклитаксела (таксол) или доцетаксела (таксотер) и цисплатина или карбоплатина, комбинацию циклофосфамида и цисплатина,комбинацию циклофосфамида и карбоплатина, комбинацию 5-FU и лейковорина, этопозид, липосомальный доксорубицин, гемцитабин, ифосфамид, гексаметилмеламин (НММ) или топотекан. В конкретных вариантах осуществления пациентам с метастазами опухоли в кости вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с введением профилактически или терапевтически эффективного количества одного или нескольких средств, которые могут использоваться для лечения метастазов опухоли в кости,включая в качестве неограничивающих примеров: средства или виды лечения, применяемые при лечении основной злокачественной опухоли, такие как ингибиторы гормонов для рака предстательной железы или молочной железы, метастазирующего в кости, радиотерапию или химиотерапию с проникающими в кости радиоизотопами металлов (стронций-89 и самарий-153) и бифосфонатами (например, палмидронат или алендронат). Виды лечения злокачественной опухоли и их дозировки, пути введения и рекомендованные способы применения известны в данной области и описаны в такой литературе, как Physician'sDesk Reference (57th ed., 2003), доступной в настоящее время через Интернет путем подписки на PDR(R)Electronic Library, Thomson Micromedex, Greenwood Village, Colorado (Edition 2004). Лечение воспалительных нарушений. Конъюгаты антитела против альфа-V согласно изобретению могут вводиться нуждающемуся в этом субъекту для предотвращения лечения или ослабления воспалительного нарушения, или одного, или нескольких его симптомов. Антитела согласно изобретению могут также вводиться в комбинации с одним или несколькими другими видами лечения, предпочтительно с теми, которые могут использоваться для предотвращения, управления, лечения или ослабления воспалительного нарушения (включая в качестве неограничивающих примеров профилактические или терапевтические средства, перечисленные здесь и ниже), нуждающемуся в этом субъекту для предотвращения, управления, лечения или ослабления воспалительного нарушения или одного, или нескольких его симптомов. Воспалительные нарушения, которые можно лечить способами согласно изобретению, включают в себя в качестве неограничивающих примеров астму, энцефалит, воспалительное заболевание кишечника,хроническую обструктивную болезнь легких (ХОБЛ), аллергические нарушения, септический шок, легочный фиброз, недифференцированную спондилоартропатию, недифференцированную артропатию,артрит, остеоартрит, спондилоартропатии (например, псориатический артрит, анкилозирующий спондилит, синдром Рейтера (реактивный артрит), воспалительный остеолиз, болезнь Вильсона и хроническое воспаление вследствие вирусных и бактериальных инфекций. Кроме того, аутоиммунные нарушения ассоциированы с воспалительной патологией. Виды противовоспалительного лечения. Настоящее изобретение относится к способам профилактики, управления, лечения или ослабления воспалительного заболевания или одного, или нескольких его симптомов, причем указанные, способы включают в себя введение нуждающемуся в этом субъекту конъюгата антитела против альфа-V согласно изобретению и одной или нескольких способов лечения (например, профилактических или терапевтических средств, отличных от антител или фрагментов антител, которые иммуноспецифично связываются с интегринами альфа-V. Любое средство или вид лечения, которые известны, применялись или в настоящее время применяются для профилактики, лечения, управления или ослабления воспалительного нарушения или одного или нескольких его симптомов, могут использоваться в комбинации с конъюгатом антитела против альфа-V согласно изобретению в соответствии с описанным здесь изобретением. Неограничивающие примеры таких средств включают в себя иммуномодулирующие средства, антиангиогенные средства, противовоспалительные средства и антагонисты TNF-альфа. Конкретные примеры иммуномодулирующих средств, которые могут быть введены в комбинации с конъюгатом антитела против альфа-V согласно изобретению субъекту с воспалительным нарушением,включают в себя метотрексат, лефлуномид, циклофосфамид, цитоксан, нуран, циклоспорин А, миноциклин, азатиоприн, антибиотики (например, FK506 (такролимус, метилпреднизолон (MP), кортикостероиды, стероиды, микофенолат мофетил, рапамицин (сиролимус), лефлунамид, антитела против Т-клеточного рецептора (например, Orthoclone OKT3 (JohnsonJohnson), Nuvion (Protein Design Labs),или антитела против CD20 (Rituxan (IDEC, антитела против CD52 (например, САМРАТН 1 Н (Ilex,антитела против рецептора IL-2 (например, Zenapax (Protein Design Labs, антитела против IL6 (CNTO 328, Centocor) или антитела против рецептора IL-6 (MRA, Chugai) и антитела против IL-12 (CNTO1275,Centocor), антитела против IFN, антитела против TNF, антитела против IL-1, антагонисты IL-1 альфа/бета. Примеры антагонистов TNF-альфа, которые могут вводиться в комбинации с конъюгатами против антитела альфа-V согласно изобретению субъекту с воспалительным нарушением, включают в себя белки, полипептиды, пептиды, белки слияния, антитела (и их антигенсвязывающие фрагменты), такие как антитела, которые иммуноспецифически связываются с TNF-альфа, молекулы нуклеиновой кислоты (на- 15013323 пример, антисмысловые молекулы или тройные спирали), органические молекулы, неорганические молекулы и малые молекулы, которые блокируют, снижают, ингибируют или нейтрализуют функцию, активность и/или экспрессию TNF-альфа. Примеры антагонистов TNF-альфа включают в себя инфликсимаб (REMICADE; Centocor), D2E7 (HUMARA; Abbott Laboratories/Knoll Pharmaceuticals Co., Mt. Olive,N.J.), CDP571, который так же известен, как HUMICADE и CDP-870 (оба - от Celltech/Pharmacia, Slough,Великобритания), TNF-R1 (Amgen), этанерцепт (ENBREL; Immunex), и ингибиторы других представителей надсемейства рецепторов TNFR. Другие антагонисты TNF, относящиеся к изобретению, включают в себя в качестве неограничивающих примеров IL-10, которые, как известно, блокируют продукцию TNFальфа, и средства против р 38 MAPK. Неограничивающие примеры противовоспалительных средств, которые могут вводиться в комбинации с конъюгатом антитела против альфа-V согласно изобретению субъекту с воспалительным нарушением, включают в себя нестероидные противовоспалительные лекарственные средства (NSAID), стероидные противовоспалительные средства, бета-агонисты, антихолинергические средства и метилксантины. Неограничивающие примеры NSAID включают в себя аспирин, ибупрофен, целекоксиб (CELEBREX), диклофенак (VOLTAREN), этодолак (IODINE), фенопрофен (NALFON), индометацин(ACTRON) и набуметон (RELAFEN). Такие NSAID функционируют путем ингибирования фермента циклоксигеназы (например, СОХ-1 и/или СОХ-2). Неограничивающие примеры стероидных противовоспалительных средств включают в себя глюкокортикоиды, дексаметазон (DECADRON), кортизон, гидрокортизон, преднизон (DELTASONE), преднизолон и триамцинолон. В конкретных вариантах осуществления пациентам с остеоартритом вводят в профилактически или терапевтически эффективном количестве конъюгат антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для предотвращения, лечения, управления или ослабления остеоартрита, включая в качестве неограничивающих примеров: анальгетики, такие как ацетаминофен, фенацетин; и трамадол, NSAID, такие как аспирин, дифлунизал, диклофенак, этодолак, фенаматы, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, метилсалицилат, небуметон, напроксин, оксапразин, фенилбутазон, пироксикам, сулиндак и толметин; специфичные в отношении циклооксигеназы (Сох)-2 ингибиторы (CSI), такие как целекоксиб и рофекоксиб; внутри-околосуставную препаратов-депо, например, глюкокортикоидов или биофармацевтических средств, и внутрисуставную инъекцию гиалуроновой кислоты. Конъюгаты антитела против альфа-V согласно изобретению могут также использоваться в комбинации с другими нефармакологическими мерами при предотвращении, лечении, управлении и ослаблении остеоартрита, включая в качестве неограничивающих примеров промывание остеоартритного сустава, снижение загрузки сустава; применение тепла или холода на пораженный сустав; мазь капсаицина; упражнения и другие виды физического лечения, и хирургическая замена сустава. В конкретных вариантах осуществления пациентам с ревматоидным артритом вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для предотвращения, лечения, управления или ослабления ревматоидного артрита, включая в качестве неограничивающих примеров: NSAID, анальгетики и CSI, которые обсуждались, для остеоартрита. Кроме того, другие виды лечения могут использоваться одновременно, перед или после введения антитела против альфа-V согласно изобретению, например, ежемесячные введения глюкокортикоидов в высокой дозе или внутрисуставное введение глюкокортикоидов; модулирующие заболевание противоревматические лекарственные средства (DMARD), включая метотрексат, соединения золота (например, ауранофин), Dпеницилламин, антималярийные препараты (например, хлорохин) и сульфалазин; нейтрализующие TNFальфа средства, такие как этанецепт и инфликсимаб; иммуносупрессорные и цитотоксические средства,неограничивающими примерами которых являются азатиоприн, лефлуномид, циклоспорин и циклофосфамид; и хирургические вмешательства, такие как артропластика, полное удаление сустава, реконструктивная хирургия руки, открытая или атрокопическая синовиоэктомия и ранняя теносиновиоэктомия кисти; внешние вмешательства, такие как различные биопротезы и вспомогательные устройства, и другие физические виды лечения; и диетические добавки, такие как повышенный прием омега-3-жирных кислот(таких как эйкозапентановая кислота). В конкретных вариантах осуществления пациентам с хронической обструктивной болезнью легких(ХОБЛ) вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для предотвращения, лечения, управления или ослабления ХОБЛ, включая в качестве неограничивающих примеров: бронходилататоры, включающие в себя в качестве неограничивающих примеров бета-адренергические агонисты короткого и длительного действия, такие как альбутерол,пирбутерол, тербуталин и метапротеренол, пероральный альбутерол с замедленным высвобождением и ингалируемый сальметерол; антихолинергические препараты, такие как ипратропиум-бромид и теофиллин и его производные; глюкокортикоиды; кислород; пересадку легких; хирургическую операцию по- 16013323 снижению объема легких; эндотрахеальную интубацию, поддержку вентиляции; ежегодное вакцинирование от гриппа и пневмококка; физические упражнения; и отмену курения. В конкретных вариантах осуществления пациентам с фиброзом легких вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для предотвращения, лечения, управления или ослабления фиброза легких, включая в качестве неограничивающих примеров: кислород; кортикостероиды; цитотоксические лекарственные средства (циклофосфамид или азатиоприн); бронходилататоры, такие как бета-адренергические агонисты короткого и длительного типа действия, антихолинэргетики и теофиллин и его производные); и антигистаминные препараты (дифенгидрамин и доксиламин). В конкретных вариантах осуществления пациентам с астмой вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для лечения астмы, включая в качестве неограничивающих примеров: катехоламины, например, норадреналин, изопротеренол и изоэтарин; резорцинолы, например, метапротеренол, тербуталин и фенотерол; и салигенины, например,сальбутамол; метилксантины, включая теофиллин и его различные соли; антихолинергетики, включая атропина сульфат, акопина метилнитрат и ипратропиум-бромид; глюкокортикоиды; стабилизирующие тучные средства кромолин натрия и недокромил натрия; модуляторы лейкотриена зилейтон, зафирлукаст и монтелукаст; иммуносупрессорные средства, включая метотрексат; и ацетилцистеин. В конкретных вариантах осуществления пациентам с аллергией вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в комбинации с другими средствами или видами лечения, которые могут использоваться для лечения аллергии, включая в качестве неограничивающих примеров: кромолин; антигистамины; средствасимпатомиметики (альфа-адренергические и бета-адренергические лекарственные средства); теофиллин и его производные; глюкокортикоиды; и средства лечения, десенситизирующие иммунную систему инъекциями аллергена. Лечение аутоиммунного нарушения. Конъюгат антитела против альфа-V согласно изобретению может вводиться нуждающемуся в этом субъекту для предотвращения, управления, лечения или ослабления аутоиммунного нарушения или его одного, или нескольких симптомов. Конъюгат антитела против альфа-V согласно изобретению также может вводиться в комбинации с одним или несколькими другими видами лечения, предпочтительно,видами лечения, которые могут использоваться для профилактики, управления или лечения аутоиммунного нарушения (включая в качестве неограничивающих примеров терапевтические средства, перечисленные здесь ниже), нуждающемуся в этом субъекту для профилактики, управления, лечения или ослабления аутоиммунного нарушения или одного, или нескольких его симптомов. В конкретном варианте осуществления изобретение относится к способу профилактики, управления, лечения или ослабления аутоиммунного заболевания или одного, или нескольких его симптомов, причем указанный способ включает в себя введение нуждающемуся в этом субъекту дозы профилактически или терапевтически эффективного количества жидкого препарата согласно изобретению. В другом варианте осуществления изобретение относится к способу предотвращения, управления,лечения или ослабления аутоиммунного нарушения или одного, или нескольких его симптомов, причем указанный способ относится к введению нуждающемуся в этом субъекту дозы профилактически или терапевтически эффективного количества жидкого препарата согласно изобретению и дозы профилактически или терапевтически эффективного количества одного или нескольких видов лечения (например,профилактических или терапевтических средств), отличных от антител или фрагментов антител, которые иммуноспецифично связываются с альфа-V-интегринами. Изобретение относится к способам управления, лечения или ослабления аутоиммунного нарушения или одного, или нескольких его симптомов у субъекта, рефрактерного к обычным видам лечения такого аутоиммунного заболевания, причем указанные способы включают в себя введение указанному субъекту дозы профилактически или терапевтически эффективного количества антител согласно изобретению. Изобретение также относится к способам управления, лечения или ослабления аутоиммунного нарушения или одного, или нескольких его симптомов у субъекта, устойчивого к существующим видам лечения такого аутоиммунного заболевания одним средством, причем указанные способы включают в себя введение указанному субъекту дозы профилактически или терапевтически эффективного количества конъюгата антитела против альфа-V согласно изобретению и дозы профилактически или терапевтически эффективного количества одного или нескольких видов лечения (например, профилактических или терапевтических средств), отличных от антител или фрагментов антитела, которые иммуноспецифически связываются с альфа-V-интегрином. Изобретение также относится к способам управления, лечения или ослабления аутоиммунного нарушения или одного, или нескольких его симптомов путем введения конъюгата антитела против альфа-V согласно изобретению в комбинации с любым другим лечением пациентам, у которых подтверждена рефрактерность к другим видам лечения, но их при этом не лечат ими. Изобретение также относится к- 17013323 альтернативным способам управления или лечения аутоиммунного нарушения, в которых другой вид лечения, как доказано или может быть доказано, является слишком токсичным, т.е. приводит к неприемлемым или непереносимым побочным эффектам для подвергающегося лечению субъекта. В частности, изобретение относится к альтернативным способам управления или лечения аутоиммунного нарушения, в которых пациент устойчив к другим видам лечения. Далее изобретение относится к способам предотвращения аутоиммунного нарушения у пациентов, которых лечили введением конъюгата антитела против альфа-V и которые не имели при этом активности данного заболевания. При аутоиммунных нарушениях иммунная система переключает иммунный ответ при том, что нет чужеродных соединений, с которыми надо бороться, и обычно защищающая иммунная система вызывает повреждение своих собственных тканей, по ошибке атакуя их. Имеется много различных аутоиммунных заболеваний, которые повреждают организм различными путями. Например, головной мозг повреждается у субъектов рассеянным склерозом, кишечник у субъектов повреждается болезнью Крона, а синовий,кость и хрящ различных суставов у субъектов повреждается ревматоидным артритом. Аутоиммунные заболевания прогрессируют, может произойти разрушение одного или нескольких типов тканей организма, ненормальный рост органа, который может сопровождаться неоваскуляризацией указанного органа или ткани, или изменение функции органа. Аутоиммунное нарушение может затрагивать только один орган или тип ткани, или поражает множественные органы и ткани. Органы и ткани, обычно подверженные аутоиммунным нарушениям, включают в себя красные кровяные клетки, кровеносные сосуды, соединительные ткани, эндокринные железы (например, щитовидную или поджелудочную железу),мышцы, суставы и кожу. Примеры аутоиммунных нарушений, которые можно лечить способами согласно изобретению, включают в себя в качестве неограничивающих примеров очаговую алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, аутоиммунные заболевания надпочечников, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунный оофорит и орхит, аутоиммунную тромбоцитопению, болезнь Бехчета, буллезный пемфигоид,кардиомиопатию, синдром мальадсорбции - дерматит, синдром хронической усталости и иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полинейропатию, гранулематозный аллергический ангиит, рубцовый пемфигоид, синдром CREST, болезнь холодового агглютинина,болезнь Крона, дискоидную волчанку, врожденную смешанную криоглобулинемию, фибромиалгиюфибромиозит, гломерулонефрит, болезнь Грейвса, миелополирадикулоневрит, тироидит Хасимото,идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру (ITP), невропатиюIgA, ювенильный артрит, плоский лишай, волчаночный эритрематоз, болезнь Меньера, смешанную болезнь соединительной ткани, рассеянный склероз, сахарный диабет I типа или иммунологически опосредованный сахарный диабет, миастению гравис, обыкновенную пузырчатку, пернициозную анемию, узелковый полиартериит, полихондрит, полигландулярный синдром, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматоидный артрит, саркоидоз, склеродермию,синдром Шегрена-Ларсена, синдром мышечной скованности, системную красную волчанку, артериит Такаясу, височный артериит/гигантоклеточный артериит, язвенный колит, увеит, васкулиты, такие как дерматит-герпесовидный васкулит, витилиго и гранулематоз Вегенера. Виды лечения аутоиммунных заболеваний и их дозировки, пути введения и рекомендации по применению известны в данной области и описаны в такой литературе, как Physician's Desk Reference (56thed., 2002 and 57th ed., 2003). Настоящее изобретение относится к способам предотвращения, управления, лечения или ослабления либо только аутоиммунного нарушения как такового, либо нескольких его симптомов, причем указанные способы включают в себя введение нуждающемуся в этом пациенту конъюгата антитела против альфа-V согласно изобретению и одного или нескольких видов лечения (например, профилактических или терапевтических средств), отличных от антител и фрагментов антител, которые иммуноспецифически связываются с альфа-V-интегринами. Любое средство или вид лечения, который, как известно, может использоваться или использовался для предотвращения, управления, лечения или ослабления аутоиммунного нарушения либо как такового, либо нескольких его симптомов, может использоваться в комбинации с описанным здесь конъюгатом антитела против альфа-V согласно изобретению. Неограничивающие примеры таких средств включают в себя иммуномодулирующие средства, противовоспалительные средства и антагонисты TNF-альфа. Конкретные примеры иммуномодулирующих средств, противовоспалительных средств и антагонистов TNF-альфа, которые могут использоваться в сочетании с конъюгатом антитела против альфа-V согласно изобретению для профилактики, управления, лечения или ослабления аутоиммунного нарушения, описаны здесь выше. В конкретных вариантах осуществления пациентам с рассеянным склерозом (PC) вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в сочетании с другими средствами или видами терапии, которые могут использоваться при предотвращении, лечении, управлении и ослабленииPC, включая в качестве неограничивающих примеров IFN-бета-1b (Betaseron) и IFN-альфа-2 а (Avonex); глатирамер-ацетат (Copaxone); митоксантрон; метотрексат; циклофосфамид; внутривенный иммуноглобулин; глюкокортикоиды; метилпреднизолон; 2-хлордезоксиаденозин (кладрибин); баклофен (перораль- 18013323 но или интратекально через стационарный катетер); циклоэнзаприна гидрохлорид; клоназепам; клонидина гидрохлорид; карбамазепин; габапентин; амитриптилин; примидон; ондансетрон; изониазид; оксибутинин; толтеродин; пропантелин; бетанекол; теразолина гидрохлорид; силденафила цитрат; амантадин; пемолин; витамины в высоких дозах; оротат кальция; ганцикловир; антибиотик; и замену плазмы. В конкретных вариантах осуществления пациентам с псориазом вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в сочетании с другими средствами или видами терапии, которые могут использоваться при предотвращении, лечении,управлении и ослаблении псориаза, включая местные, содержащие стероиды препараты; тар (Estar,Psorigel, крем Fototar); аналоги витамина D для местного введения, такие как мазь кальпотриена; ультрафиолетовое облучение с псораленом или без него; метотрексат; циклоспорин; сульфасалазин; и синтетические ретиноиды. В конкретных вариантах осуществления пациентам с болезнью Крона вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в сочетании с другими средствами или видами терапии, которые могут использоваться при предотвращении, лечении, управлении и ослаблении болезни Крона, включая в качестве неограничивающих примеров средства против диареи (лоперамид, дифеноксилат с атопином, холестирамин или колестипол); спазмолитики (пропантелин, дицикломин или гиосциамин); средства на основе 5-аминосалициловой кислоты (сульфалазин, мезаламин (Asacol) и его форма с замедленным высвобождением (Pentasa); кортикостероиды; иммуномодуляторные лекарственные средства, которые могут использоваться в ревматических заболеваниях - азатиоприн, меркаптопурин, циклоспорин и метотрексат; антибиотики; ингибиторыTNF, включая энтерасепт и инфликсимаб; иммуносупрессорные средства, включая такролимус, микофенолат мофетил и талидомид; нутриционные виды лечения; энтеральные виды лечения с элементными диетами (например, прием Vivonex в течение 4 недель); и общее парентеральное питание. В конкретных вариантах осуществления пациентам с системной красной волчанкой вводят профилактически или терапевтически эффективное количество конъюгата антитела против альфа-V согласно изобретению в сочетании с другими средствами или видами терапии, которые могут использоваться при предотвращении, лечении, управлении и ослаблении системной красной волчанки, включая в качестве неограничивающих примеров: противомалярийные средства (включая в качестве неограничивающих примеров гидроксихлорохин); глюкокортикоиды (например, может использоваться внутривенная импульсная терапия с низкой дозировкой или высокой дозировкой); иммуносупрессорные и иммуномодулирующие средства, включая циклофосфамид, хлорамбуцил и азатиоприн, метотрексат и микофенолат мофетил; андрогенные стероиды (включая в качестве неограничивающих примеров даназол); и антикоагулянты (включая в качестве неограничивающих примеров варфарин). Незлокачественные или связанные с иммунитетом пролиферативные заболевания. Конъюгаты согласно изобретению также могут использоваться для лечения незлокачественных пролиферативных заболеваний и особенно тех, в которых используется ангиогенез. Ангиогенез известен как фактор, играющий роль в некоторых патологических состояниях, включая в дополнение к тому, что он обеспечивает способность опухолей расти и метастазировать, в нарушениях глаза, включая ретинопатии, и в нарушениях кожи, включая псориаз и саркому Капоши. Репрезентативные примеры таких не относящихся к опухолям зависимых от ангиогенеза заболеваний включают в себя неоваскуляризацию роговицы, гипертрофические шрамы и келоиды, пролиферативную диабетическую ретинопатию, ревматоидный артрит, артериовенозные мальформации (обсуждаемые выше), атеросклеротические бляшки и ишемическую болезнь сердца, замедленное заживление ран, гемофильные суставы, несрастание переломов, синдром Рандю-Ослера-Вебера, псориаз, обыкновенную пузырчатку, синдром Бехчета, острый респираторный дистресс-синдром (ARDS), пиогенную гранулому, склеродермию, трахому, меноррагию (обсуждалось выше) и адгезию сосудов. 5. Фармацевтические композиции. Изобретение относится к стабильным препаратам конъюгатов антител против альфа-V и майтансиноидов, которые предпочтительно представляют собой водный фосфатно-солевой буферный или смешанный раствор, а также консервированные растворы и препараты, содержащие консервант, а также консервированные препараты многократного применения, подходящие для фармацевтического или ветеринарного применения, включающие в себя по меньшей мере один конъюгат антитела против альфа-V и майтансиноида в фармацевтически приемлемом препарате. Предпочтительные консерванты включают в себя те консерванты, которые выбраны из группы, состоящей из фенола, м-крезола, п-крезола, о-крезола,хлоркрезола, бензилового спирта, алкилпарабена (метил, этил, пропил, бутил и т.п.), бензалкония хлорида, бензетония хлорида, дегидроацетата натрия и тимерозала или их смесей. По меньшей мере один конъюгат антитела против альфа-V и майтансиноида в описанных здесь стабильных или консервированных препаратах или растворах может вводиться пациенту в соответствии с настоящим изобретением различными способами доставки, включающими в себя п./к. или в./м. инъекцию; чрескожный путь, легочный путь, введение через слизистые оболочки, имплантацию, осмотический насос, картридж, микронасос или другие средства, понятные и хорошо известные специалисту в данной области.- 19013323 6. Фармацевтические препараты. В предпочтительном способе введения CNTO 95-майтансиноида лекарственное вещество вводится внутривенно по предварительно установленному катетеру, укомплектованному сумкой для инфузий.CNTO 95-мертансин поставляется в 20 мл одноразовых сосудах от ImmunoGen, Inc. (Cambridge, Массачусетс). Каждый сосуд содержит белок в концентрации от 0,05 примерно до 2,0 мг/мл в буферном растворе (pH 6,50,5), состоящем из одноосновного фосфата калия (0,57 мг/мл), одноосновного фосфатамоногидрата натрия (0,20 мг/мл), двухосновного фосфата натрия (0,555 мг/мл) и хлорида натрия(8,16 мг/мл) в очищенной воде USP. Лекарственный продукт предварительно фильтруют дважды после вливания дозируемого объема в сумку для инфузий пропусканием его через связывающий небольшие количества белка фильтр 5- и выводят пациентам через встроенный 0,22 мкм фильтр в течение 8 ч. После инфузии линию внутривенного введения следует ополоснуть жидкостью для обеспечения доставки полной дозы лекарственного средства. Основанные на предшествующем опыте введения внутривенным методом конъюгатов Mabмайтансиноида людям дозы в интервале от 22 до 295 мг/м 2 можно вводить каждые три недели (J. Clin.Oncol. 21:211-222, 2003). 7. Готовые изделия. Изобретение относится к готовому изделию, содержащему материалы, которые могут использоваться для лечения нарушений, описанных выше, включающему в себя конъюгат антител против альфаV и майтансиноида, контейнер и этикетку или вкладку в упаковку на контейнере, или в сочетании с ним. Готовое изделие предпочтительно содержит по меньшей мере один сосуд, включающий в себя раствор по меньшей мере одного конъюгата антитела против альфа-V и майтансиноида с предписанными буферами и/или консервантами, необязательно в водном разбавителе, где указанный упаковочный материал содержит этикетку, которая указывает на то, что такой раствор может храниться в течение некоторого периода времени. Изобретение может относиться к готовому изделию, включающему в себя упаковочный материал, первый сосуд, содержащий лиофилизованный по меньшей мере один конъюгат антитела против альфа-V и майтансиноида, и второй сосуд, содержащий водный растворитель с предписанным буфером или консервантом, где указанный упаковочный материал содержит этикетку, в которой имеется инструкция для практикующего специалиста или пациента, как восстанавливать по меньшей мере один конъюгат антитела против альфа-V и майтансиноида в водном разбавителе, с получением раствора. Подходящие контейнеры включают в себя, например, бутылки, сосуды, шприцы и т.д. Контейнеры могут быть образованы из различных материалов, таких как стекло или пластик. Контейнер может иметь стерильный порт для доступа (например, контейнер может представлять собой сумку для внутривенного раствора или сосуд, имеющий пробку, которую можно проткнуть иглой для подкожной инъекции). По меньшей мере одно средство в композиции представляет собой конъюгат антитела против альфа-V и майтансиноида. Этикетка или вкладка в упаковку показывает, что композиция применяется для лечения выбранного состояния, такого как злокачественная опухоль. Вкладка в упаковку может показывать, что антитело или композиция применяется для лечения злокачественной опухоли, которая не отвечает или слабо отвечает на стандартное лечение, как показано здесь для конкретных заболеваний и диагнозов. В других вариантах осуществления вкладка в упаковку может указывать на то, что конъюгат антитела и майтансиноида или его композиция может использоваться для лечения метастазирующего рака, рака предстательной железы, рака молочной железы или колоректального рака. Хотя изобретение описано в общих терминах, варианты осуществления изобретения будут далее описаны в следующих примерах. Пример 1. Получение и описание моноклонального антитела CNTO 95. Получение антитела CNTO 95 к альфа-V-интегрину подробно описано в публикации РСТWO 02/12501 и в публикации США 2003/040044, которые включены здесь в качестве ссылки. В частности, человеческое моноклональное антитело CNTO 95 получали путем иммунизации(CBA/JC57/BL6/J, GenPharm International) F2 гибридных мышей V3 интегрином, выделенным из плаценты человека. Антитело состоит из вариабельной человеческой области и константной области IgG1 каппа. Способ получения желаемых характеристик CNTO 95 был описан ранее в WO0212501 и Trikha etal. 2004, Int. J. Cancer 110 (3): 326-335. Использовали трансгенных мышей (GenPharm International), экспрессирующих человеческие иммуноглобулины, но не мышиные IgM или Ig1. Эти мыши содержали человеческие трансгенные последовательности, определяющие слияние V(D)J сегментов, переключение классов тяжелых цепей и соматические мутации для образования спектра иммуноглобулинов с человеческими последовательностями(Taylor et al., International Immunology 6:579-591 (1993. Трансген легкой цепи происходит частично из клона дрожжевой искусственной хромосомы, включающей в себя примерно половину зародышевой линии человеческой VK области. Дополнительно к нескольким VH генам, трансген тяжелой цепи (НС) кодирует как человеческую , так и человеческую 1 (Lonberg et al., Nature 368:856-859 (1994, и/или 3 константную область. Мышей, происходящих из линии с генотипом НС 012, использовали в процессах иммунизации и слияния для создания анти-альфа-V моноклонального антитела, применяемого для полу- 20013323 чения конъюгата согласно изобретению. Человеческую плаценту (измельченную с помощью гомогенизатора) или клетки человеческой меланомы М 21, экспрессирующие V3 интегрин, подвергали экстракции с использованием OTG (октилтиогликозид, Pierce) в солевом буфере, как описано ранее (WO 0212501). Эти препараты эмульгировали в равном объеме полного адъюванта Фрейнда и использовали для иммунизации хирургически кастрированных самцов мыши в возрасте от 15 до 17 недель (GenPharm, Foster City, CA) в дни 0 и 14, а также эмульгировали в неполном адъюванте Фрейнда и проводили иммунизацию в дни 28, 48 и 56. Через трое суток выделяли мышиные спленоциты, которые демонстрировали титр 1:1280 против V3, с использованием твердофазного формата ИФА. Слияние проводили при соотношении 1:1 клеток миеломы мыши(SP2/0) к жизнеспособным клеткам селезенки. Супернатанты гибридомы изучали с помощью микропланшетного ИФА или твердофазного ИФА, отбирали линии, продуцирующие антитела, и проверяли их на наличие желаемых характеристик. Анализ ELISA подтвердил, что антитела, выделенные из двух гибридом, С 371 А (также называемойMab CNTO 95) и С 372 А, связывают V3 концентрационно-зависимым образом. Пятидесятипроцентного связывания достигали при 0,07 и 0,7 мкг/мл для С 372 А и CNTO 95 соответственно. В этом же исследовании анти-альфа-II-бета 3 антитело, с 7 Е 3 IgG, показало пятидесятипроцентное максимальное связывание при 0,07 мкг/мл. Чтобы подтвердить уникальную специфичность конкурентного связывания (или комплементации)CNTO 95, были проведены анализы с использованием следующих мышиных антител: m7E3 IgG, антиальфа-V-бета-3 (клон LM609, Chemicon), анти-альфа-V-бета-5 (клон P1F6, Gibco), анти-бета-3 (Chemicon,AMAC) или анти-альфа-V (клон VNR139, Gibco). Результаты этих анализов показали, что CNTO 95 связывает эпитоп, с которым другие изученные антитела не взаимодействуют. Степени сродства связывания с очищенными интегринами сравнивали со связыванием с рецепторами, экспрессируемыми различными клеточными линиями, с использованием 125-I CNTO 95. КлеткиA375S2 и М 21 экспрессируют как V3, так и V5, клетки НТ-29 экспрессируют V5. Для сравнения использовали другие моноклональные антитела, способные связывать интегрины. Величину Kd вычисляли по кривой насыщения связывания, в каждом случае используя множественные повторения различных серий антител. На плашках, покрытых V3, значение KD CNTO 95 было 2,11,3310-10 М; а значение KD абциксимаба было 2,51, 4610-10 М. Значение KD CNTO 95 на V5 было 2,51,0410-11 M. Абциксимаб не показал связывания и зависимости от дозировки на плашках, покрытых V5. Как показано на фиг. 4, введение CNTO 95 подавляет рост опухоли человеческой меланомы у голых мышей. На 26 день CNTO 95 подавляет опухолевый рост примерно на 80% по сравнению с опухолями у контрольных мышей. В этой модели CNTO 95 не взаимодействовало с ангиогенными сосудами хозяина,так как не связывало мышиные интегрины, что позволяет предположить, что блокирование человеческих интегринов, экспрессируемых опухолью, самостоятельно может подавлять опухолевый рост у мышей,независимо от антиангиогенных эффектов. Для исследований на крысах были закуплены у Harlan самки голых крыс в возрасте 6-7 недель. Двадцати крысам подкожно вводили клетки A375.S2 (3106) в боковую область (день 1). На день 4 крыс случайным образом разделяли на 2 группы. Одной группе вводили внутривенно CNTO 95 (10 мг/кг в PBS),тогда как другой группе вводили изотипически сходный контрольный IgG (10 мг/кг). Затем указанные дозы продолжали вводить еженедельно до дня 46 (всего 6 доз). Опухоли измеряли штангенциркулем дважды в неделю и объемы опухолей вычисляли по формуле (длинаширину 2)/2. Вес тела также определяли еженедельно. У крыс CNTO 95 способен блокировать как крысиные ангиогенные интегрины, так и человеческие интегрины, экспрессируемые клетками опухоли. Лечение в течение недели голых крыс,имеющих опухоль, с помощью CNTO 95 в дозе 10 мг/кг уменьшало рост опухоли, в сравнении с крысами, которым вводили контрольные моноклональные антитела изотипически сходного человеческого IgG(фиг. 5). На 46 сутки лечение CNTO 95 привело к значительному уменьшению конечного размера опухоли по сравнению с контрольными голыми крысами (р=0,0007). В целом, CNTO 95 является полностью человеческим моноклональным антителом, которое связывает членов семейства альфа-V-интегринов с уникальной специфичностью, авидностью и активностью, как продемонстрировано множеством функциональных анализов, показывающих, что оно нейтрализует биологические эффекты интегриновых рецепторов альфа-V-бета-3 и альфа-V-бета-5 in vitro и in vivo. CNTO 95 подавляет адгезию, миграцию, пролиферацию и инвазию как опухолевых, так и эндотелиальных клеток in vitro и демонстрирует, что связывание и блокирование множественных альфа-V-интегриновых рецепторов более эффективно, чем блокирование только одного интегрина. Кроме того, CNTO 95 подавляет ангиогенез и рост опухоли in vivo. Рост опухолей человеческой меланомы был значительно уменьшен при блокировании интегринов опухолевых клеток в мышиной модели или путем сочетанного блокирования интегринов опухолевых клеток и ангиогенных интегринов хозяина в крысиной модели, показывая потенциальную важность использования множественных клеточных мишеней для повышения противоопухолевой эффективности. Результаты моделей in vitro models демонстрируют, что CNTO 95 имеет потенциальные антиангиогенные способности, подавляя адгезию, пролиферацию, миграцию и капиллярное проникновение эндо- 21013323 телиальных клеток. Кроме того, CNTO 95 блокирует ангиогенез, стимулированный как bFGF, так и М 21 клетками меланомы в крысиной модели Matrigel, и bFGF клетками в модели ангиогенеза у приматов.CNTO 95 показало нулевые антиангиогенные эффекты как в модели грызунов, так и в новой модели нечеловекоподобных приматов (узконосые обезьяны). В дополнение к блокированию интегринов на ангиогенном эндотелии, способность подавлять интегриновую функцию на самих опухолевых клетках уменьшает рост опухолей. Многие альфа-Vинтегрины предположительно играют критическую роль в биологии опухолевых клеток. В модели 5 мышиных ксенотрансплантатов, где отсутствует перекрестное реагирование CNTO 95 с интегринами хозяина, лечение CNTO 95 значительно подавляло рост v3/5-позитивных опухолей меланомы. Одним из наиболее важных свойств CNTO 95 является его полностью человеческая природа. В связи с этим, маловероятно, что CNTO 95 может вызвать иммунные ответы у пациентов. Более того, так какCNTO 95 способно связываться не только с альфа-V-бета-3 и альфа-V-бета-5, но также с другими альфаV-интегринами, такими как альфа-V-бета-6 и альфа-V-бета-1, оно, вероятно, способно подавлять различные проявления, опосредованные интегринами. Пример 2. Получение конъюгатов CNTO 95-майтансин. Антительные конъюгаты тиолированных майтансинов получали для дальнейшего биологического тестирования, начиная с использования бифункциональных линкеров, как описано. Антитела CNTO 95 для конъюгации поставляла фирма Centocor. CNTO 95 были поставлены в общем количестве примерно 20 мг/мл (260 мг). Антитело диализировали в буфере А (50 мМ KPi, 50 мМNaCl, 2 мМ EDTA pH 6,5), затем переносили в 8 мг/мл в 95% буфер А, 5% ЕТОН. Антитело модифицировали с помощью 6,5-кратного молярного избытка SPP для побуждения линкера к конъюгации с лекарственным средством, с образованием CNTO 95-SS-Py, где S-Py является 2-меркаптопиридином. Остаточный SPP удаляли с помощью G25 гель-фильтрационной хроматографии. Соотношение линкера к антителу определили как 4,7. Конъюгат Ab-SS-Py модифицировали с помощью 1,7-кратного молярного избытка DM1 (MW=737,5 г/М) к линкеру, используя концентрацию антитела 3,2/мл в 97% буфере А, 3% диметилацетамида. После конъюгации конъюгат повторно хроматографировали на G25 с использованием PBS, pH 6,5 в качестве буфера. Полученный в результате конъюгат содержал 3,2 М DM1 на 1 МCNTO-95: [Ab]=2,59 мг/мл, [DM1]=38,3 мкг/мл. Расчеты были основаны на определении поглощения фильтрованного материала при 252 и 280 нм с использованием коэффициентов экстинкции: Ab=224,000 М-1 см-1 при 280 нм, DM1=5700 М-1 см-1 при 280 нм, Ab=82,880 М-1 см-1 при 252 нм и DM1=26,790 М-1 см-1 при 252 нм. Продукт анализировали с помощью SDS-PAGE в невосстанавливающих условиях, SEC HPLC, и путем определения сродства связывания с альфа-V-бета-3 и альфа-V-бета-5 белком с помощью ELISA. С помощью PAGE молекулярную массу продукта определяли в пределах примерно 160 кД, также визуализировали продукт с несколько меньшей молекулярной массой. При использовании анализа SEC HPLC,фракция конъюгата, элюирующая мономер (18,8'), составила 96%, и примерно 4% элюированного конъюгата представляли собой вещества с более высокой молекулярной массой (16,2'). Сродство связывания вычисляли путем построения графика абсорбции-концентрации при заданной Kd=3,0 е-11 М для CNTO 95 и Kd=3,5 е-11 М для конъюгата на альфа-V-бета-5. Для обоих веществ была задана Kd, равная приблизительно 3,0 е-9 на альфа-V-бета-5. Другие группы CNTO 95-SPP-DM1 и CNTO 95, конъюгированных с DM4, и посторонних антител,которые метят нечеловеческий антиген, F105, и конъюгируют сходным образом, получали аналогичным способом с использованием бифункциональных линкеров, как показано на фиг. 2 и 3. Характеристики этих способов получения приведены ниже. Получение CNTO 95-SPP-DM1 (CNTO 364). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM1 с помощью SPP линкера следующим образом: 270,6 мг CNTO 95 конъюгировали с 3,7 мг DM1, полученные в результате 98 мл конъюгата хранили при 2-8 С в 2,74 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM1, равную 37,6 мкг/мл. Таким образом, соотношениеCNTO 95). С помощью HPLC в составе препарата определяли 96,3% мономера и 0,59% свободного лекарственного средства. Получение CNTO 95-SPP-DM1 (CNTO 364). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM1 с помощью SPP линкера следующим образом: 104 мг CNTO 95 конъюгировали с 1,82 мг DM1, полученные в результате 26 мл конъюгата хранили при 2-8 С в 3,65 мг/мл конъюгированного антитела CNTO 95-SPP-DM1 в PBS при pH 6,5. Путем поглощения определяли концентрацию DM1,равную 70,07 мкг/мл. Таким образом, препарат содержал соотношение 3,80 моль DM1 на моль CNTO 95(1 мкг DM1 эквивалентен 57,2 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 93,4% мономера и 1,61% свободного лекарственного средства. Получение CNTO 95-SPP-DM1 (CNTO 364). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM1 с помощью SPP линкера следующим образом: 228 мг CNTO 95 конъюгировали с 4,13 мг DM1, полученные в результате 102 мл конъюгата хранили при 2-8 С в 2,24 мг/мл конъюгированного антитела CNTO 95-SPP-DM1 в PBS при pH 6,5. Путем поглощения определяли концентрацию DM1,- 22013323 равную 40,53 мкг/мл. Таким образом, препарат содержал соотношение 3,93 моль DM1 на моль CNTO 95(1 мкг DM1 эквивалентен 55,3 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 94,7% мономера и 1,00% свободного лекарственного средства. Получение CNTO 95-SSNPB-DM4 (CNTO 365). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM4 с помощью SSNPB линкера следующим образом: 121 мг CNTO 95 конъюгировали с 2,18 мг DM4, полученные в результате 34 мл конъюгата хранили при 2-8 С в 3,25 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 64,11 мкг/мл. Таким образом,соотношение DM4 на моль антитела составляло 3,57 (1 мкг DM4 эквивалентен 55,6 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 95,4% мономера и 3,23% свободного лекарственного средства. Получение CNTO 95-SSNPP-DM4 (CNTO 366). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM4 с помощью SSNPP линкера следующим образом: 101 мг CNTO 95 конъюгировали с 1,45 мг DM4, полученные в результате 30 мл конъюгата хранили при 2-8 С в 3,07 мг/мл антитела вPBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 48,39 мкг/мл. Таким образом, препарат содержал соотношение 2,95 моль DM4 на моль CNTO 95 (1 мкг DM4 эквивалентен 69,5 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 85,9% мономера и 1,18% свободного лекарственного средства. Получение CNTO 95-SPDB-DM4 (CNTO 365). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM4 с помощью SPDB линкера следующим образом: 228,5 мг CNTO 95 конъюгировали с 4,37 мг DM4, полученные в результате 104,5 мл конъюгата хранили при 2-8 С в 2,19 мг/мл конъюгированного антитела CNTO 95-SPDB-DM4 в PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 41,84 мкг/мл. Таким образом, препарат содержал соотношение 3,92 моль DM4 на моль CNTO 95 (1 мкг DM4 эквивалентен 52,3 мкг конъюгированного антитела CNTO 95). С помощьюHPLC в составе препарата определяли 93,6% мономера и 0,55% свободного лекарственного средства. Получение CNTO 95-SPDB-DM4 (CNTO 365). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM4 с помощью SPDB линкера следующим образом: 309 мг CNTO 95 конъюгировали с 5,4 мг DM4, полученные в результате 130,7 мл конъюгата хранили при 2-8 С в 2,36 мг/мл конъюгированного антитела CNTO 95-SPDB-DM4 в PBS при pH 6,5. Путем поглощения определяли концентрациюDM4, равную 41,2 мкг/мл. Таким образом, препарат содержал соотношение 3,57 моль DM4 на мольCNTO 95 (1 мкг DM4 эквивалентен 57,5 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 93,8% мономера и 0,40% свободного лекарственного средства. Получение CNTO 95-SPP-DM1 (CNTO 364). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM1 с помощью SPP линкера следующим образом: 270,6 мг CNTO 95 конъюгировали с 3,7 мг DM1, полученный в результате конъюгат хранили при 2-8 С в 2,74 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM1, равную 37,6 мкг/мл. Таким образом, препарат содержал соотношение 2,98 моль DM1 на моль CNTO 95 (1 мкг DM1 эквивалентен 68,9 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 96,3% мономера и 0,59% свободного лекарственного средства. Получение CNTO 95-SPP-DM1 (CNTO 364). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM1 с помощью SPP линкера следующим образом: 245 мг F105 конъюгировали с 4,28 мг DM1, полученные в результате 91,5 мл конъюгата хранили при 2-8 С в 2,68 мг/мл конъюгированного антитела F105-SPP-DM1 в PBS при pH 6,5. Путем поглощения определяли концентрацию DM1,равную 46,76 мкг/мл. Таким образом, препарат содержал соотношение 3,79 моль DM1 на моль F105(1 мкг DM1 эквивалентен 57,3 мкг конъюгированного антитела F105). С помощью HPLC в составе препарата определяли 90,3% мономера и 2,44% свободного лекарственного средства. Получение CNTO 95-SPP-DM4 (CNTO 366). Моноклональное антитело CNTO 95 конъюгировали с майтансиноидом DM4 с помощью SPP линкера следующим образом: 76,7 мг CNTO 95 конъюгировали с 1,10 мг DM4, полученные в результате 35 мл конъюгата хранили при 2-8 С в 2,19 мг/мл конъюгированного антитела CNTO 95-SPP-DM4 в PBS при pH 6,5. Путем поглощения определяли концентрацию DM4,равную 31,5 мкг/мл. Таким образом, препарат содержал соотношение 2,96 моль DM4 на моль CNTO 95(1 мкг DM4 эквивалентен 69,4 мкг конъюгированного антитела CNTO 95). С помощью HPLC в составе препарата определяли 97,3% мономера и 1,14% свободного лекарственного средства. Получение F105-SSNPB-DM4. Моноклональное антитело F105 конъюгировали с майтансиноидомDM4 с помощью SSNPB линкера следующим образом: 106 мг F105 конъюгировали с 1,84 DM4, полученные в результате 25 мл конъюгата хранили при 2-8 С в 3,85 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 73,45 мкг/мл. Таким образом, соотношение DM4 на моль антитела составляло 3,57 (1 мкг DM4 эквивалентен 57,5 мкг конъюгированного антитела F105). С помощьюHPLC в составе препарата определяли 85,1% мономера и 1,92% свободного лекарственного средства. Получение F105-SSNPB-DM4. Моноклональное антитело F105 конъюгировали с майтансиноидомDM4 с помощью SSNPB линкера следующим образом: 106 мг F105 конъюгировали с 1,84 мг DM4, полученные в результате 30 мл конъюгата хранили при 2-8 С в 3,46 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 57,93 мкг/мл. Таким образом, соотношение DM4 на моль анти- 23013323 тела составляло 3,32 (1 мкг DM4 эквивалентен 65,4 мкг конъюгированного антитела F105). С помощьюHPLC в составе препарата определяли 88,8% мономера и 1,85% свободного лекарственного средства. Получение F105-SSNPP-DM4. Моноклональное антитело F105 конъюгировали с майтансиноидомDM4 с помощью SSNPP линкера следующим образом: 105 мг F105 конъюгировали с 1,76 мг DM4, полученные в результате 28 мл конъюгата хранили при 2-8 С в 3,41 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 62,87 мкг/мл. Таким образом, препарат содержал соотношение 3,45 моль DM4 на моль F105 (1 мкг DM4 эквивалентен 59,4 мкг конъюгированного антитела F105). С помощью HPLC в составе препарата определяли 85,9 % мономера и 3,75% свободного лекарственного средства. Получение F105-SPDB-DM4. Моноклональное антитело F105 конъюгировали с майтансиноидомDM4 с помощью SPDP линкера следующим образом: 230,5 мг F105 конъюгировали с 4,12 мг DM4, полученные в результате 104,5 мл конъюгата хранили при 2-8 С в 2,21 мг/мл PBS при pH 6,5. Путем поглощения определяли концентрацию DM4, равную 39,41 мкг/мл. Таким образом, препарат содержал соотношение 3,66 моль DM4 на моль F105 (1 мкг DM4 эквивалентен 56,0 мкг конъюгированного антителаF105). С помощью HPLC в составе препарата определяли 89,2% мономера и 0,65% свободного лекарственного средства. В целом, следующие вещества были синтезированы для дальнейших анализов (табл. 1). Таблица 1(CNTO 95-SPP-DM4), ImmunoGen лот 2020-48, 31,5 мг/мл DM4, 2,19 мг/мл конъюгированного антитела, уровень эндотоксинов 0,1 EU/мг. Клетки: клетки человеческой карциномы толстого кишечника НТ 29 и клетки человеческой карциномы легкого А 549 получали от АТСС и культивировали в альфаМЕМ с добавлением 10% фетальной бычьей сыворотки (FBS). Клетки человеческой карциномы яичника А 2780 получали от National CancerInstitute. Клетки А 2780 культивировали в среде RPMI 1640, содержащей 10% FBS. Клетки собирали,промывали, суспендировали в свободной от сыворотки DMEM и последовательно инкубировали в течение 60 мин на льду с сериями разведений CNTO 95, CNTO 364, CNTO 365, CNTO 366 и FITC-мечеными анти-человеческими антителами (10 мг/мл). Отсутствие первичных антител или замена первичных антител антителами подходящего изотипа служили отрицательным контролем. Клетки немедленно анализировали с помощью проточного цитометра FACS Scan II (Becton Dickinson, Mountain View, CA). Данные анализировали с помощью программного пакета GraphPad Prism software с использованием нелинейной регрессии для определения концентрации 50% максимального связывания (табл. 2). В большинстве случаев константа эффективного связывания изменялась менее чем 2-кратно. Таблица 2CNTO 366 (CNTO 95-SPP-DM4), ImmunoGen лот 2020-48, 31,5 мкг/мл DM4, 2,19 мг/мл конъюгированного антитела, уровень эндотоксинов 0,1 EU/мг. Клетки НТ 29 человеческой карциномы толстого кишечника и клетки А 549 человеческой карциномы легкого (АТСС) культивировали в альфаМЕМ с добавлением 10% FBS при 37 С в присутствии 5%CO2. Клетки высаживали в белые 96-луночные плашки для культуры ткани (5000 клеток/лунка) в культуральную среду и инкубировали в течение 16 ч. Серии разведений иммуноконъюгатов добавляли в каждую соответствующую лунку (0-20 мкг/мл). Плашки с культурой ткани инкубировали при 37 С в течение 96 ч. Анализ ATPLIte проводили в соответствии с инструкцией производителя. Данные анализировали с помощью программного пакета GraphPad Prism software с использованием нелинейной регрессии (табл. 3) для определения концентрации для половины максимального количества клеток, определявшегося по светимости. Таблица 3 Пример 5. Лечение с помощью CNTO 95-DM1 крыс с опухолями, происходящими от человеческой меланомы. Исследовали эффективность CNTO 364, в сравнении с CNTO 95, против клеток развернутой п/к меланомы человека A375.S2. CNTO 95-DM1 был изготовлен ImmunoGen Inc., лот 1716-74 В, концентрация маточного раствора: 2,59 мг/мл. 5 мг/кг CNTO 95-DM1 эквивалентны 74 мкг/кг DM1. CNTO 95 получали от Centocor, лот 5380-027, концентрация маточного раствора=20 мг/мл. Человеческий IgGDM1: человеческий IgG ChromPure получали от Jackson ImmunoResearch Laboratories. Человеческий IgGDM1 был изготовлен ImmunoGen, лот 1762-50, концентрация маточного раствора 2,8 мг/мл. 5 мг/кг этого конъюгата эквивалентны 76 мкг/кг DM1. Майтансин: ImmunoGen, лот 1710-121, концентрация- 25013323 маточного раствора=16,38 мкг/мл в PBS, pH 6,5. Маточный раствор майтансина разводили PBS до 15 и 7,5 мкг/мл. PBS: ImmunoGen, pH 6,5. Клетки A375.S2 меланомы человека закупали у АТСС, транспортировали и хранили в виде замороженных аликвот в Centocor Cell Biology Services. Девятинедельным бестимусным голым крысам подкожно вводили клетки A375.S2 меланомы человека. На 14 день, когда средний объем опухоли достигал 250-300 мм 3, животных разделяли на группы по 9/10 и начинали лечение. CNTO 95-DM1 и подходящие контрольные соединения вводили внутривенно(три инъекции через день в первую неделю, одна инъекция в неделю следующие две недели в дни 11, 14,16, 21 и 28). Отмечали размеры опухоли и вес тела. На фиг. 6 отображены во времени изменения объемов опухоли человеческой меланомы у голых мышей. Объемы опухоли приведены как среднее значение станд. откл. (n=9 или 10). Стрелками показано внутривенное введение лекарственного средства. Звездочка показывает, что одно животное, не отвечавшее на лечение, было усыплено, когда объем опухоли у него превысил 1500 мм 3. Всех животных усыпили на 35 день. Объемы опухоли приведены как среднее значение станд. откл. (n=9 или 10). Стрелками показано внутривенное введение лекарственного средства. CNTO 95-DM1 в дозе 5 мг/кг прекращал рост опухоли и уменьшал средний объем опухоли, тогда какCNTO 95 в дозе 10 мг/кг не вызывал эффекта в этом эксперименте. Во втором эксперименте на крысах средний объем опухоли достигал 250 мм 3 на 14 день. Животных разделили на группы и первое внутривенное введение лекарственного средства провели на 14 день. Последующие инъекции проводили на 16 и 18 день той же недели, а затем один раз в неделю на 23 и 31 день. Всех животных усыпили на 35 день. CNTO 95-DM1 в дозе 5 мг/кг вызывал полную регрессию ксенотрансплантата человеческой меланомы A375.S2 у самок бестимусных крыс (фиг. 7). Контрольные соединения, включающие в себя PBS, свободный CNTO 95, неспецифичный конъюгат антитело-DM1, свободный майтансин и свободный CNTO 95 плюс свободный майтансин, не показали каких-либо значительных эффектов. Пример 6. Лечение с помощью CNTO 95-DM1 крыс с опухолями, происходящими от человеческой карциномы толстого кишечника. Исследовали эффективность CNTO 364, в сравнении с CNTO 95, против развернутой п/к НТ 29 карциномы толстого кишечника человека.CNTO 364, ImmunoGen лот 1806-50, концентрация белка 2,53 мг/мл, концентрация DM1 41,8 мг/мл, отношение DM1 к CNTO 95 3,6 моль DM1 на моль CNTO 95. PBS или антитело F105-DM1 использовали в качестве контроля F105-DM1; ImmunoGen лот 1806-44, концентрация белка 2,2 мг/мл,концентрация DM1 38,3 мг/мл, отношение DM1 к F105 3,8 моль DM1 на моль F105. Все реагенты проверяли на наличие эндотоксинов, значения LAL были ниже 1,0 EU/мг. Клеточная линия карциномы толстого кишечника человека НТ 29, экспрессирующая интегрины aVb3, aVb5 и aVb6, была получена из банка клеток Centocor. В этой клеточной линии определили отсутствие микоплазм и бактериальных агентов. Клетки культивировали в аМЕМ с добавлением 10% FBS, 1% пирувата и 1% MEM заменимой аминокислоты, в присутствии 5% CO2, при 37 С. В этой работе использовали семьдесят самок бестимусных крыс от Harlan Laboratories (Indianapolis,IN). Крысам подкожно вводили 5106 НТ 29 клеток (0,2 мл, 25106 клеток/мл) в заднюю боковую область(со стороны спины, примерно 0,5 дюйма ниже последнего ребра и 0,5 дюйма от позвоночника). Всех крыс наблюдали ежедневно (в рабочие дни) на предмет появления пальпируемой опухоли. Животных стратифицировали по индивидуальному объему опухоли в семь групп, каждая группа включала в себя 9 животных (табл. 4). Начальный объем опухоли для всех групп составлял в среднем 250-260 мм 3. Таблица 4 В день разделения на группы (день 0) животных взвешивали и вводили им внутривенно контрольное антитело F105-DM1 в дозе 25 мг/кг или CNTO 364 в дозах 3, 6, 10, 15 или 25 мг/кг. Все тестируемые и контрольные вещества вводили в объеме 1 мл/100 г веса тела. CNTO 364 в группах, получавших дозу 3,6 и 10 мг/кг, вводили внутривенно по схеме q7d5. CNTO 364 в группе, получавшей дозу 15 мг/кг, вводили на 7, 14 и 35 дни. CNTO 364 в группе, получавшей дозу 25 мг/кг, и F105-DM1 в группе, получавшей дозу 25 мг/кг, вводили на 7 и 14 дни. Две последние группы были усыплены вследствие значительной потери веса (более 10% на день 0) в соответствии с требованиями правил IACUC (фиг. 8). Величины объемов опухолей измеряли дважды в неделю. Опухоли измеряли штангенциркулем в двух направлениях (длина и ширина) в миллиметрах (мм). Объем опухоли (мм 3) вычисляли с использованием формулы V=(длинаширинатолщина)/2. Статистическую обработку проводили с помощью программного пакета GraphPad Prism software с использованием непарного t-теста.CNTO 364 ингибировало рост прижившихся опухолей толстого кишечника доза-зависимым обра- 26013323 зом (фиг. 9). CNTO 364 в дозе 10 мг/кг по схеме дозирования q7d5 вызывало полную регрессию опухоли в трех случаях и частичную регрессию в двух случаях из 9 животных (фиг. 10). Лечение с использованием CNTO 364 в дозе 15 мг/кг на 7, 14 и 35 дни вызывало полную регрессию опухоли в четырех случаях и частичную регрессию в четырех случаях у 9 животных с опухолью. Контрольная группа, получавшаяPBS, была усыплена на 35 день после имплантации опухолевых клеток (средний объем опухоли превышал 5000 мм 3). В это время различие в объемах опухолей между группами, которым вводили CNTO 364 в дозе 10 мг/кг и 15 мг/кг, по сравнению с контрольной группой, которой вводили PBS, вычисленное с использованием двойного непарного t-теста, имело значение Р 0,0001. Две подряд инъекции как CNTO 364 в дозе 25 мг/кг, так и F105-DM1 в дозе 25 мг/кг, были токсичны и вызывали неприемлемое снижение веса тела (фиг. 8). Однако единичная инъекция CNTO 364 в дозе 25 мг/кг вызывала полную регрессию развернутой опухоли человеческой карциномы толстого кишечника НТ 29 со средним значением объема опухоли более 4000 мм 3 (данные не приводятся). Пример 7. Лечение с помощью CNTO 95-DM1 крыс с опухолями, происходящими от человеческой карциномы легкого. Это исследование проводили для оценки эффективности in vivo конъюгата CNTO 95-DM1 у самок бестимусных крыс с человеческой карциномой легкого А 549. CNTO 95 получали от Centocor (Malvern,PA), а конъюгирование DM1 проводили в ImmunoGen (Cambridge, MA). CNTO 364 являлся (CNTO 95SPP-DM1) и соответствовал описанному в примере 1. Клеточную линию человеческой карциномы легкого А 549 (АТСС) культивировали в альфаМЕМ,содержащей 10% FBS, а клетки для подкожной имплантации бестимусным крысам получали в свободной от сыворотки альфаМЕМ. В заднюю боковую область (со стороны спины, примерно 0,5 дюйма ниже последнего ребра и 0,5 дюйма от позвоночника) тела самок бестимусных крыс (возраст 6 недель, получены от Harlan Laboratory, Indianapolis, IN) подкожно имплантировали 5106 клеток (0,2 мл, 25106 клеток/мл). Когда средний объем опухоли достиг 250 мм 3, животных стратифицировали на группы, в зависимости от дозировки, со сходным средним объемом опухоли (табл. 5) и вводили дозы внутривенно на 17 и 29 дни после инъекции опухолевых клеток. Таблица 5 Величины объемов опухолей измеряли дважды в неделю. Опухоли измеряли электронным штангенциркулем Vernier в двух направлениях (длина и ширина) в миллиметрах (мм). Объем опухоли (мм 3) вычисляли с использованием формулы V=(длинаширинатолщина)/2. Объемы опухолей представлены как среднее значениестанд.откл. (n=6). Результаты отображены графически в зависимости от времени,фиг. 12, стрелками показано время внутривенного введения лекарственного средства. При использовании веса тела как индикатора переносимости (фиг. 11) видно, что схема дозирования CNTO 364, примененная в этом исследовании, хорошо переносилась животными, вызывая временную потерю лишь 3% веса тела по сравнению с начальным весом тела после первой инъекции. Применяли односторонний дисперсионный анализ (ANOVA) с тестом Бонферрони с использованием программного пакета GraphPad Prism 4 software (GraphPad Software, Inc., San Diego, CA) при 95% доверительном интервале. Ссылка на фиг. 12: группа 1, PBS; группа 2, F105-DM1 в дозе 15 мг/кг; группа 3,CNTO 364 в дозе 15 мг/кг; группа 4, CNTO 95 в дозе 15 мг/кг; группа 5, CNTO 95 в дозе 15 мг/кг плюс майтансин в дозе 260 мг/кг; группа 6, майтансин в дозе 260 мг/кг. Значение Р определяли с помощью одностороннего дисперсионного анализа (ANOVA) с тестом Бонферрони для множественных сравнений. Р 0,05, CNTO 364 против F105-DM1, CNTO 95 плюс майтансин или только майтансин; Р 0,01,CNTO 364 против CNTO 95; Р 0,001, CNTO 364 против PBS. Конъюгирование DM1 с CNTO 95 с образованием большой молекулы должно изменить фармакокинетические свойства DM1 в виде продления времени полужизни DM1 in vivo. Для исключения этой возможности иммуноконъюгат неспецифичного антитела F105 с DM1 включили в это исследование для определения, была ли активность конъюгата CNTO 95-DM1 зависящей от CNTO 95. Так как CNTO 95 является антиангиогенным и антиопухолевым соединением, a DM1 является цитотоксичным агентом,возможно, что антиопухолевая активность была связана с простым сложением эффектов свободногоCNTO 95 и свободного DM1. В связи с этим группы, получавшие свободный CNTO 95, свободный CNTO 95 плюс свободный майтансин и свободный майтансин, были включены в исследование. Как показано на фиг. 13, CNTO 364 в дозе 15 мг/кг, применявшийся по схеме ql2d2, уничтожал шесть из шести ксенотрансплантатов опухоли легкого А 549. Наблюдалась одна полная регрессия опухоли в группе F105- 27013323DM1 и две в группе CNTO 95 плюс майтансин. Эти результаты демонстрируют превосходство иммуноконъюгата CNTO 95-DM1, CNTO 364, в регрессии опухоли легкого А 549. Животные, получавшие лечение CNTO364 в этом режиме дозирования, показали временную токсичность для кожи и снижение веса тела без явных признаков тяжелых токсических эффектов. Пример 8. Сравнение структур конъюгатов на моделях карциномы толстого кишечника человека. Для проверки переносимости и свойств различных соединений, используемых при получении иммуноконъюгатов CNTO 95, была выбрана модель развернутой опухоли, полученная путем подкожной имплантации клеток, происходящих из человеческой опухоли толстого кишечника НТ 29, крысам с иммунной недостаточностью. CNTO 95-SPP-DM1 (CNTO 364), CNTO 95-SSNPB-DM4 (CNTO 365), CNTO 95-SSNPP-DM4 (CNTO 366) и эквивалентные им моноклональные антитела F 105 получали от ImmunoGen (Cambridge, MA). Сто самых бестимусных крыс (в возрасте 4-6 недель) получали от Harlan Laboratories. Человеческие НТ 29 (АТСС) культивировали в альфаМЕМ с добавлением 10% FBS при 37 С в присутствии 5% CO2. Клетки для инокуляции получали в концентрации двадцать пять миллионов клеток на мл свободной от сыворотки альфаМЕМ. Самок бестимусных крыс инокулировали путем подкожного введения 5106 клеток НТ 29 (0,2 мл, 25106 клеток/мл) в заднюю боковую область (со стороны спины,примерно 0,5 дюйма ниже последнего ребра и 0,5 дюйма от позвоночника). Всех крыс наблюдали дважды в неделю на предмет появления пальпируемой опухоли. Животных стратифицировали на 13 групп, 6 животных в группе, на основе среднего значения объема опухоли для каждой группы приблизительно 250 мм 3. В день разделения на группы (день 7) каждой группе вводили первую дозу, как показано в табл. 6. Дозы иммуноконъюгатов вычисляли на основе содержания DM1 или DM4 в каждом конъюгате.L и Н представляют 175 и 350 мкг/кг DM1 или DM4, соответственно. Все тестируемые вещества вводили в объеме 1 мл/100 г веса тела. Кроме группы 11, которой вводили только одну дозу на 7 день, всем другим группам вводили дозы на 7 и 21 дни. Изменения в объемах опухолей использовали в качестве индикатора эффективности (фиг. 14 А и В), а изменения в весе тела (фиг. 15 А и В) использовали для изучения переносимости. Все измерения представлены как среднее значение в группе станд.откл. Таблица 6 Животные, которым вводили CNTO 365 и F105-SSNPB-DM4 в дозе 350 мкг/кг DM4, теряли более чем 10% от исходного веса тела после введения первой дозы, как показано на фиг. 14 В. В связи с этим в этих двух группах введение лекарственного средства не продолжали после одной инъекции. Потеря 10% веса тела была преходящей, и животные восстанавливали вес в течение 10 дней после прекращения лечения. Остальным группам вводили дозы как на 7, так и на 21 день, при этом не наблюдали значительного снижения веса тела, за исключением группы, которой вводили высокие дозы CNTO 364, в которой животные теряли более 10% веса тела. Значительное снижение веса тела не наблюдали в других экспериментах с использованием CNTO 364 в этом режиме дозирования. Как показано на фиг. 14 В, единичная инъекция CNTO 365 в высокой дозе вызывала полную регрессию имевшейся подкожной человеческой карциномы толстого кишечника НТ 29 у 4 из 6 животных. CNTO 364 в высокой дозе (350 мкг/кг DM1) иCNTO 365 в низкой дозе (175 мкг/кг DM4) также вызывали регрессию имевшейся опухоли толстого кишечника (2 из 6 животных в каждой группе, соответственно) или значительно подавляли рост опухоли толстого кишечника НТ 29. Однако низкая доза CNTO 364 (175 мкг/кг DM1) и CNTO 366 в обеих дозах не оказывали какого-либо значительного эффекта на размер опухоли. Эти результаты позволяют предположить, что CNTO 365 более активен и эффективен, чем CNTO 364 и CNTO 366, при введении внутривенно по схеме q14d2 в этой модели ксенотрансплантированной опухоли. Должно быть очевидным, что практическое осуществление согласно изобретению не ограничивается тем, которое было частично представлено в приведенном выше описании и примерах. Множество модификаций и вариантов по настоящему изобретению возможно в свете указанных выше способов и, в связи с этим, входят в состав прилагаемой формулы изобретения.- 28013323 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат лекарственного средства с антителом, представленный формулой где антитело представляет собой антитело, специфичное в отношении человеческой альфа-Vсубъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу; майтансиноид этерифицирован в С-3;X1 и X2 независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов, разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов,фенильную, замещенную фенильную или гетероциклическую арильную группу или гетероциклоалкильную группу;m представляет собой 1-10. 2. Конъюгат антитела с лекарственным средством по п.1, в котором антитело конкурирует за связывание человеческого альфа-V-интегрина с моноклональным антителом CNTO 95 или его фрагментом. 3. Конъюгат антитела по п.1, в котором молекула антитела представляет собой моноклональное антитело CNTO 95 или рекомбинантное антитело, имеющее по меньшей мере одну из определяющих комплементарность областей (CDR) CNTO 95, показанных в SEQ ID NO: 1-6, или, как показано, консервативные замены по меньшей мере одной CDR. 4. Конъюгат антитела по п.2, в котором моноклональное антитело конкурирует с MAb CNTO 95 за связывание с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3. 5. Конъюгат антитела по п.1, в котором молекула антитела специфична в отношении эпитопа в аминокислотной последовательности SEQ ID NO: 9. 6. Конъюгат антитела с лекарственным средством по п.1, в котором антитело является человеческим, гуманизированным или химерным антителом. 7. Способ продуцирования конъюгата по п.1, включающий в себя стадии (а) введения одной или нескольких свободных или защищенных тиольных групп в молекулу антитела, специфичную в отношении интегринов с человеческой субъединицей альфа-V; (b) взаимодействия молекулы антитела стадии (а) с соединением, которое токсично в отношении клеток при ЕС 50, составляющем 10-9 М или менее, причем указанное соединение имеет одну или несколько дисульфидных или тиольных групп; и (с) получения указанного конъюгата. 8. Способ по п.7, в котором токсичное соединение представляет собой майтансиноид. 9. Способ по п.7 или 8, в котором для введения свободных или защищенных тиольных групп в молекулу антитела применяют N-гидроксисукцинимидовый сложный эфир (2-пиридил)-3-дитиопропановой кислоты (SPDP), N-гидроксисукцинимидовый сложный эфир (2-пиридил)-4-дитиопентановой кислоты(SPP) или N-гидроксисукцинимидовый сложный эфир (2-пиридил)-4-дитиобутановой кислоты. 10. Применение конъюгата по любому из пп.1-6 для получения фармацевтической композиции для лечения злокачественной опухоли. 11. Способ лечения злокачественной опухоли у нуждающегося в этом пациента, включающий в себя введение пациенту терапевтически эффективного количества конъюгата по любому из пп.1-6, в котором злокачественная опухоль представляет собой аденокарциному молочной железы, аденокарциному легких, аденокарциному поджелудочной железы, аденокарциному толстого кишечника, почечноклеточную аденокарциному или аденокарциному желудка. 12. Способ лечения злокачественной опухоли по п.11, в котором злокачественная опухоль представляет собой плоскоклеточную карциному головы и шеи, плоскоклеточную карциному пищевода,плоскоклеточную карциному легких, плоскоклеточную карциному кожи или плоскоклеточную карциному шейки матки. 13. Применение конъюгата по любому из пп.1-6 для лечения или предотвращения метастатического распространения злокачественной опухоли, включающее в себя введение пациенту терапевтически эф- 29013323 фективного количества конъюгата по любому из пп.1-6. 14. Способ ингибирования роста злокачественных клеток у нуждающегося в этом млекопитающего,включающий в себя введение млекопитающему конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ингибирования роста указанных злокачественных клеток у указанного млекопитающего. 15. Способ по п.14, согласно которому конъюгат антитела вводят внутривенно. 16. Способ по п.15, согласно которому конъюгат антитела вводят в количестве от 0,05 до 12,0 мг/кг массы тела. 17. Способ по п.14, согласно которому млекопитающее представляет собой пациента-человека. 18. Способ ингибирования ангиогенеза у нуждающегося в этом млекопитающего, включающий в себя введение млекопитающему с зависимым от ангиогенеза заболеванием конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ингибирования указанного ангиогенеза, где зависимое от ангиогенеза заболевание представляет собой заболевание, выбранное из группы, состоящей из метастазирования злокачественной опухоли, ангиомы, ангиофибромы,диабетической ретинопатии, ретинопатии недоношенных, неоваскулярной глаукомы, болезни роговицы,индуцированной ангиогенезом, инволюции желтого пятна, дегенерации желтого пятна, птеригия, дегенерации сетчатки, ретроленальных фиброплазий, гранулярного конъюнктивита, псориаза, телеангиоэктазии, пиогенной гранулемы, себорейного дерматита, акне и артрита. 19. Способ ослабления воспалительного заболевания у нуждающегося в этом млекопитающего,включающий в себя введение нуждающемуся в этом млекопитающему конъюгата моноклонального антитела по любому из пп.1-6, который предотвращает связывание CNTO 95 с живыми клетками, экспрессирующими человеческий интегрин альфа-V-бета-3, в количестве, эффективном для ослабления одного или нескольких симптомов указанного воспалительного заболевания, выбранного из группы, состоящей из ревматоидного артрита, дегенерации желтого пятна, псориаза, диабетической ретинопатии. 20. Способ по п.18, согласно которому указанным моноклональным антителом лечат ангиогенное заболевание кожи, выбранное из группы, состоящей из псориаза, венозных язв, акне, розовых угрей, бородавок, экземы, гемангиом и лимфангиогенеза. 21. Способ по п.18, согласно которому указанным моноклональным антителом лечат нарушение,связанное с неоваскуляризацией роговицы или сетчатки. 22. Способ по любому из пп.11, 12, 14-21, согласно которому антитело вводят в сочетании со вторым терапевтическим или профилактическим средством или способом. 23. Конъюгат лекарственного средства с антителом, представленный формулой где антитело представляет собой антитело, специфичное в отношении человеческой альфа-Vсубъединицы интегрина, причем указанное антитело способно интернализоваться клеткой, экспрессирующей указанную альфа-V-субъединицу; майтансиноид этерифицирован в С-3;X1 и X2 независимо представляют собой Н, Me, C2H5, линейный алкил или алкенил, имеющий от 1 до 10 углеродных атомов, разветвленный алкил или алкенил, имеющий от 3 до 10 углеродных атомов,фенильную, замещенную фенильную или гетероциклическую арильную группу или гетероциклоалкильную группу;m представляет собой 1-10. 24. Фармацевтическая композиция, включающая в себя конъюгат по п.1 и фармацевтически приемлемый носитель, разбавитель или наполнитель. 25. Фармацевтическая композиция, включающая в себя конъюгат по п.23 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
МПК / Метки
МПК: C07K 16/28, A61K 39/44
Метки: способы, применения, иммуноконъюгаты, варианты, против, интегрина
Код ссылки
<a href="https://eas.patents.su/30-13323-immunokonyugaty-protiv-integrina-sposoby-i-varianty-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуноконъюгаты против интегрина, способы и варианты применения</a>
Предыдущий патент: Ориентированные стружечные плиты и способ их получения
Следующий патент: Фармацевтические композиции бендамустина, предназначенные для лиофилизации
Случайный патент: Устройство рулонного прессования (варианты)