Замещённые индолы, содержащие их композиции, способ получения и применение
Номер патента: 12613
Опубликовано: 30.10.2009
Авторы: Филош-Ромм Брюно, Вивьяни Фабрис, Бак Эрик, Суай Катрин, Ронан Батист, Алле Франк, Леталлек Жан-Филипп, Табар Мишель
Формула / Реферат
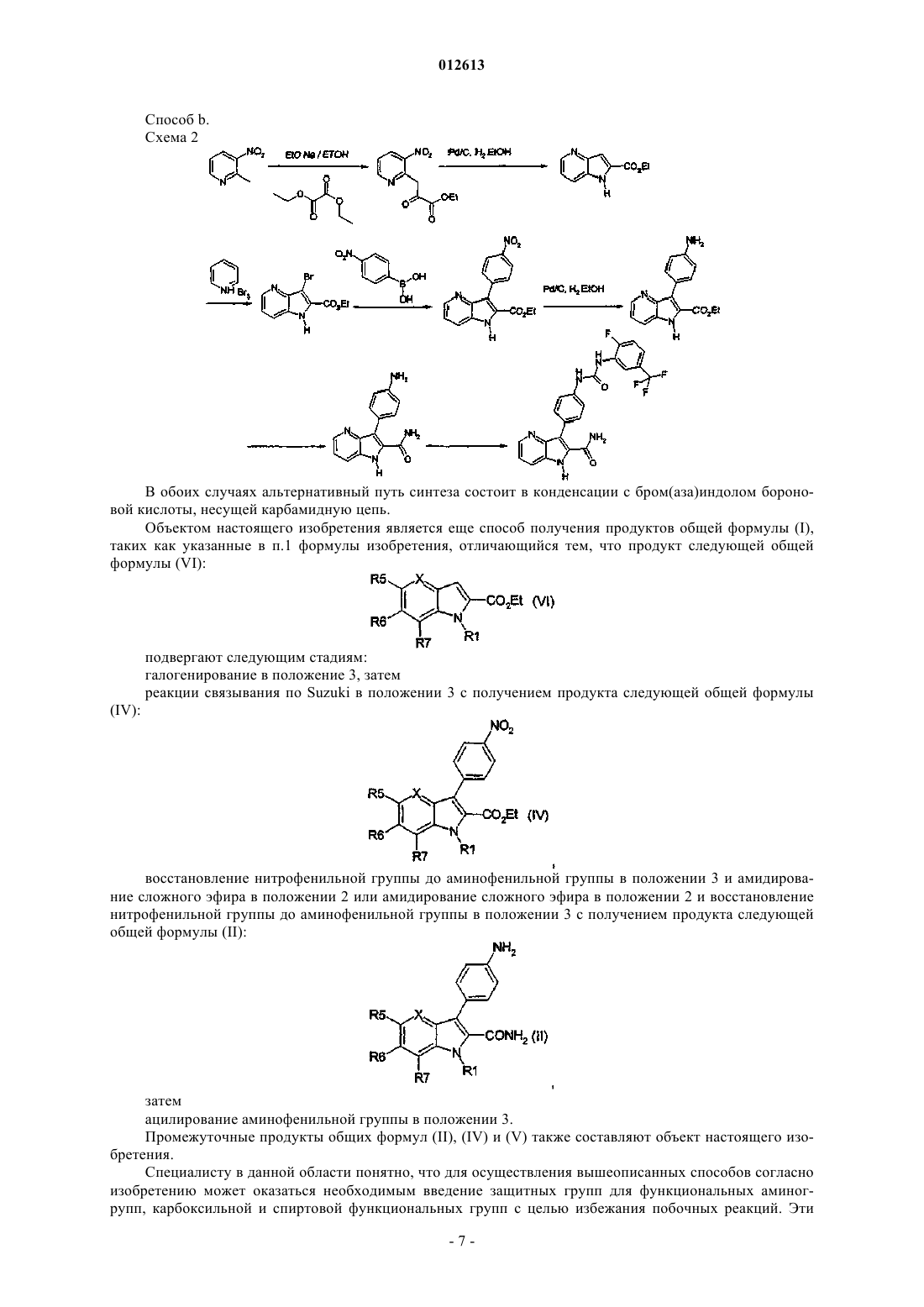
1. Продукт, отвечающий следующей формуле (I)
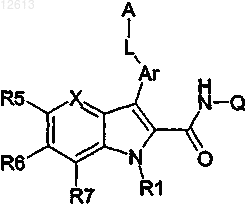
где
a) Ar обозначает фенил;
b) А обозначает фенил, пиразол или изоксазол, в случае необходимости замещенный;
c) R1 означает Н;
d) X означает N или N-оксид или СН;
e) L обозначает NH-CO-NH или NH-SO2;
f) R5, R6, R7 и R12, каждый независимо, выбирают из группы, состоящей из Н, NO2, O(R2), N(R2)(R3), NHC(О)R2N(R3)(R4); где каждый R2, R3, R4 независимо выбирают из группы, состоящей из Н, (C1-C4)алкила, в случае необходимости замещенного галогеном, ОН или (С3-С5)гетероциклоалкила;
g) Q обозначает Н.
2. Продукт по п.1, отличающийся тем, что a) R1 означает Н.
3. Продукт по любому из пп.1 или 2, отличающийся тем, что R5, R6, R7 и R8, каждый независимо, выбирают из группы, состоящей из Н, NH(CH2)2OH, O(CH2)2OCH3, NHCOCH2N(СН3)2, O(CH2)2NH(CH2)2OCH3, O(CH2)2NH(CH2)2OH, пиридин-3-илкарбониламиногруппы, 2-(N,N-диэтиламино)этоксигруппы, 3-(N,N-диэтиламино)пропоксигруппы, 2-(пирролидин-1-ил)этоксигруппы, 3-(пирролидин-1-ил)пропоксигруппы, 2-(пиперидин-1-ил)этоксигруппы, 3-(пиперидин-1-ил)пропоксигруппы, 2-(4-метилпиперазин-1-ил)этоксигруппы, 3-(4-метилпиперазин-1-ил)пропоксигруппы, 2-(морфолин-4-ил)этоксигруппы, 3-(морфолин-4-ил)пропоксигруппы.
4. Продукт по любому из пп.1-3, отличающийся тем, что R5 и R7 независимо выбирают из Н и F.
5. Продукт по любому из пп.1-4, отличающийся тем, что R6 означает Н.
6. Продукт по п.1, отличающийся тем, что А замещен первым заместителем, выбираемым из группы, состоящей из (C1-C4)алкила, галоген(C1-C4)алкила, С6арила, О-(C1-C4)алкила, O-(С3-С6)циклоалкила, О-С6арила, О-(С3-С5)гетероарила, S-(C1-C4)алкила, S-(С3-С6)циклоалкила, S-С6арила, S-(С3-С5)гетероарила, причем каждый возможно замещен заместителем, выбираемым из (C1-C3)алкила, галогена, О-(C1-C3)алкила.
7. Продукт по п.6, отличающийся тем, что А замещен вторым заместителем, выбираемым из группы, состоящей из F, Cl, Br, I, ОН, CON(R8)(R9), N(R8)CO(R9), (C1-C3)алкил-ОН, (C1-C3)алкил-N(R8)(R9), (С1-С3)алкил-(R10), N(R8)(R9), O-(C1-C4)алкил-N(R8)(R9); где R8 и R9 независимо выбирают из Н, (C1-C3)алкила, (C1-С3)алкил-ОН, (C1-C3)алкил-NH2, (C1-C3)алкил-СООМ, (С1-С3)алкил-SO3M; причем, когда R8 и R9 одновременно отличаются от Н, они могут быть связаны с образованием цикла, включающего 0-3 гетероатома, выбираемых из О, N и S; где М означает Н или катион щелочного металла, выбираемого из Li, Na и K; и где R10 означает Н или возможно замещенный неароматический гетероцикл, включающий 2-7 атомов углерода и 1-3 гетероатома, выбираемых из N, О и S.
8. Продукт по любому из пп.6 или 7, отличающийся тем, что А означает фенил, пиразолил или изоксазолил, замещенный галогеном, в частности F, (C1-C4)алкилом, галоген-(C1-C3)алкилом, в частности CF3, О-(C1-C4)алкилом, О-циклоалкилом, S-(С1-С4)алкилом, S-циклоалкилом, галоген-О-(C1-C4)алкилом и галоген-S-(C1-C4)алкилом.
9. Продукт по любому из пп.1-8, отличающийся тем, что А означает фенил, замещенный 0, 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из галогена, алкила, галогеналкила, О-алкила, О-циклоалкила, S-алкила, S-циклоалкила, причем каждый возможно замещен заместителем, выбираемым из (C1-C3)алкила, галогена, О-(C1-C3)алкила.
10. Продукт по п.1, отличающийся тем, что его выбирают из
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пирроло-[3,2-b]пиридин-2-карбоксамида;
3-[4-(3-фенилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-[4-(3-м-толилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-[4-(3-трифторметилфенилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-[4-(3,5-диметилфенилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-[4-(2-фторфенилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1-метил-1Н-индол-2-карбоксамида;
3-{4-[3-(2-хлор-4-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(5-трет-бутилизоксазол-3-ил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-трифторметоксифенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-метокси-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-[4-(2-фтор-5-трифторметилбензолсульфониламино)фенил]-1Н-индол-2-карбоксамида;
3-[4-(2,3-дихлорбензолсульфониламино)фенил]-1Н-индол-2-карбоксамида;
3-{4-[3-(5-трет-бутил-2-п-2-толил-2Н-пиразол-3-ил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-метилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(5-диметиламино-2-фторфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-диметиламинофенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-пирролидин-1-илметил-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-метоксиметил-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-4-окси-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-метокси-5-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-6-(2-метоксиэтокси)-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-6-(2-пирролидин-1-илэтокси)-1Н-индол-2-карбоксамида;
3-{6-[3-(2-фтор-5-трифторметилфенил)уреидо]пиридин-3-ил}-6-метокси-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-6-метокси-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-6-гидрокси-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-6-(2-гидроксиэтокси)-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-7-нитро-1Н-индол-2-карбоксамида;
7-амино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-7-(2-гидроксиэтиламино)-1Н-индол-2-карбоксамида;
7-(2-диметиламиноацетиламино)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{6-[3-(2-метокси-5-трифторметилфенил)уреидо]пиридин-3-ил}-1Н-индол-2-карбоксамида;
3-{6-[3-(2-фтор-5-трифторметилфенил)уреидо]пиридин-3-ил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-трет-бутилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-трифторметилсульфанилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-дифторметоксифенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-фтор-4-метилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-хлорфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-диметиламинофенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-[4-(3-п-толилуреидо)фенил]-1Н-индол-2-карбоксамида;
3-{4-[3-(4-фторфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-хлор-4-фторфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-[4-(3-тиофен-2-илуреидо)фенил]-1Н-индол-2-карбоксамида;
3-{4-[3-(2-дифторметоксифенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-метоксифенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-метоксифенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-бромфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-фторфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-хлорфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(3-этилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-изопропилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(5-метил-2-трифторметилфуран-3-ил)уреидо]фенил}-1Н-индол-2-карбоксамида;
5-фтор-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
6-фтор-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)метилкарбониламино]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]-3-фторфенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]-3-метилфенил}-1Н-индол-2-карбоксамида;
4-метокси-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
5-метокси-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
5-нитро-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
5-трифторметокси-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(2-морфолин-1-илэтокси)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(2-пирролидин-1-илэтокси)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(3-пиридин-3-илкарбониламино)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(3-метоксиэтиламино)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-гидрокси-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-метокси-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
6-(морфолин-1-илэтокси)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фтор-4-гидрокси-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-хлор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(2-морфолин-1-илэтокси)-3-{4-[3-(4-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
7-(2-морфолин-1-илэтокси)-3-{4-[3-(4-метил-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-(пирролидин-1-илметокси)-3-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(4-(4-метилпиперазин-1-илметил)-3-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамида;
3-{4-[3-(2-фторфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-метоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-[4-(3-о-толилуреидо)фенил]-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3-фторфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3-метоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-[4-(3-м-толилуреидо)фенил]-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-фторфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-метоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-[4-(3-п-толилуреидо)фенил]-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-хлор-3-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-хлор-5-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-фтор-3-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-фтор-3-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-метил-3-трифторметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-трифторметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(4-дифторметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3,4-диметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3,4-диметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3,5-диметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2,5-диметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2-метокси-5-метилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(2,5-диметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3-хлор-4-дифторметоксифенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида;
3-{4-[3-(3,5-диметилфенил)уреидо]фенил}-1Н-пирроло[3,2-b]пиридин-2-карбоксамида.
11. Продукт по п.1, отличающийся тем, что он представляет собой 3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-индол-2-карбоксамид.
12. Способ получения продуктов общей формулы (I), таких как указанные в п.1, отличающийся тем, что продукт следующей общей формулы (VI)
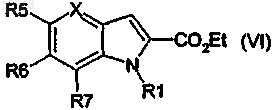
подвергают следующим стадиям:
галогенирование в положение 3, затем
реакция связывания по Suzuki в положении 3 с получением продукта следующей общей формулы (IV):
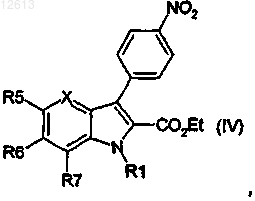
восстановление нитрофенильной группы до аминофенильной группы в положении 3 и амидирование сложного эфира в положении 2 или амидирование сложного эфира в положении 2 и восстановление нитрофенильной группы до аминофенильной группы в положении 3, с получением продукта следующей общей формулы (II):
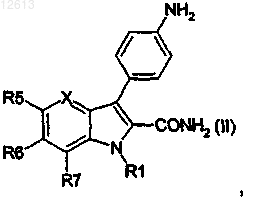
затем ацилирование аминофенильной группы в положении 3.
13. Лекарственное средство, отличающееся тем, что оно включает продукт формулы (I) по любому из пп.1-11, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат, или сольват продукта формулы (I).
14. Фармацевтическая композиция, содержащая продукт по любому из пп.1-11 в комбинации с фармацевтически приемлемым эксципиентом.
15. Применение продукта по любому из пп.1-11 в качестве ингибитора реакции, катализируемой киназой.
16. Применение по п.15 продукта по любому из пп.1-11, отличающееся тем, что киназу выбирают из KDR, Tie2, Auroral, Aurora2, FAK, PDGFR, FLT1, FGFR, VEGF-R1 и VEGF-R3.
17. Применение по п.16 продукта по любому из пп.1-11, отличающееся тем, что киназу выбирают из KDR и Tie2.
18. Применение по п.16 продукта по любому из пп.1-11 в качестве ингибитора нескольких реакций, катализируемых киназами, выбираемыми среди KDR, Tie2, Auroral, Aurora2, FAK, PDGFR, FLT1, FGFR, VEGF-R1 и VEGF-R3.
19. Применение по п.18 продукта по любому из пп.1-11, отличающееся тем, что киназами являются KDR и Tie2 или KDR, Tie2 и FAK.
20. Применение продукта по любому из пп.1-11 для получения лекарственного средства, пригодного для лечения патологического состояния.
21. Применение по п.20, отличающееся тем, что патологическим состоянием является рак.
22. Применение по п.20, отличающееся тем, что патологическим состоянием является заболевание, связанное с дерегуляцией ангиогенеза, такое как псориаз, хроническое воспаление, связанная с возрастом макулярная дегенерация, ревматоидный артрит, диабетическая ретинопатия, саркома Капоши, инфантильная гемангиома.
23. Продукты общих формул (VI), (IV) и (II) такие, как указанные в п.12, со значениями R1, R5, R6, R7 и X, указанными в п.1, в качестве промежуточных продуктов.
Текст
012613 Настоящее изобретение относится, в особенности, к новым химическим соединениям, в частности к новым замещенным индолам, содержащим их композициям и их применению в качестве лекарственных средств. Более конкретно, изобретение относится к новым индолам и специфическим 4-азаиндолам, обладающим противораковой активностью за счет модуляции активности некоторых киназ. На сегодняшний день большинство коммерчески доступных соединений, используемых в химиотерапии, вызывает значительные проблемы в отношении побочных эффектов и толерантности у пациентов. Эти эффекты могут быть ограничены, если используемые лекарственные средства селективно воздействуют на раковые клетки, за исключением здоровых клеток. Одно из решений для ограничения нежелательных воздействий химиотерапии, следовательно, может состоять в использовании лекарственных средств, воздействующих на метаболические пути или конститутивные элементы этих путей, в большинстве своем экспрессирующихся в раковых клетках и не экспрессирующихся или мало экспрессирующихся в здоровых клетках. Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование гидроксильных групп специфических остатков белков, таких как тирозиновые, сериновые или треониновые остатки. Такие фосфорилирования могут в высокой степени модифицировать функцию белков; таким образом, протеинкиназы играют важную роль в регуляции большого разнообразия клеточных процессов, включая, в частности, метаболизм, клеточную пролиферацию, клеточную дифференцировку,клеточную миграцию или сохранение клетки. Среди различных клеточных функций, в которых принимает участие активность протеинкиназы, некоторые представляют собой аттрактивные мишени для лечения раковых заболеваний, а также других заболеваний. Таким образом, одним из объектов настоящего изобретения является получение композиций, обладающих противораковой активностью за счет воздействия, в частности, на некоторые киназы. Из киназ, в отношении которых стремятся достичь модуляции активности, предпочтительны KDR и Tie2. Продукты, составляющие объект настоящего изобретения, отвечают следующей формуле (I)a) A и Ar независимо выбирают из группы, состоящей из арила, гетероарила, замещенного арила,замещенного герероарила;b) R1 означает Н или возможно замещенный алкил;e) R5, R6, R7 и R12, каждый независимо, выбирают из группы, состоящей из Н, галогена, CF3, NO2,R2, CN, O(R2), OC(O)(R2), OC(O)N(R2)(R3), OS(O2)(R2), N(R2)(R3), N=C(R2)(R3), N(R2)C(O)(R3),N(R2)C(O)O(R3), N(R4 )С(O)N(R2)(R3), N(R2)C(O)R3N(R4)2, NHC(O)R2N(R3)(R4), N(R4)С(S)N(R2)(R3),N(R2)C(S)R3N(R4)2, NHC(S)R2N(R3)(R4), N(R2)S(O2)(R3), OS(O2)(R3), C(O)(R2), C(O)O(R2),С(O)N(R2)(R3), С(=N(R3(R2), C(=N(OR3(R2), S(R2), S(O)(R2), S(O2)(R2), S(O2)O(R2), S(O2)N(R2)(R3); где R2, R3, R4, каждый независимо, выбирают из группы, состоящей из Н, алкила, алкилена, алкинила,арила, алкиларила, гетероарила, алкилгетероарила, циклоалкила, алкилциклоалкила, гетероциклила, алкилгетероциклила, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклила; и где, когда R2 и R3 одновременно находятся в одном из R5, R6, R7 и R12, они могут быть связаны друг с другом с образованием цикла, включающего 0-3 гетероатома, выбираемых среди атомов О, N и S;f) Q выбирают из Н, СН 3 и циклопропила. Предпочтительные продукты формулы (I) отвечают следующему определению:(O2)N(R2)(R3); где R2, R3, R4, каждый имеют вышеуказанные значения;f) Q имеет вышеуказанное значение. Более предпочтительные продукты формулы (I) отвечают следующему определению:a) A и Ar независимо выбирают из группы, состоящей из арила, гетероарила, замещенного арила,замещенного гетероарила;c) X означает СН или N;e) R5, R6, R7 и R12, каждый, независимо выбирают из группы, состоящей из Н, галогена, CF3, NO2,R2, CN, O(R2), OC(O)(R2), OC(O)N(R2)(R3), OS(O2)(R2), N(R2)(R3), N=C(R2)(R3), N(R2)C(O)(R3),N(R2)C (O)O(R3), N(R4)С(O)N(R2)(R3), N(R4)C(S)N(R2)(R3), N(R2 ) S (O2)(R3), OS(O2)(R3), C(O)(R2),C(O)O(R2), C(O)N(R2)(R3), С(=N(R3(R2), С(=N(OR3(R2), S(R2), S(O)(R2), S(O2)(R2), S(O2)O(R2),S(O2)N(R2)(R3); где каждый R2, R3, R4 независимо выбирают из группы, состоящей из Н, алкила, алкилена, алкинила, арила, алкиларила, гетероарила, алкилгетероарила, циклоалкила, алкилциклоалкила, гетероциклила, алкилгетероциклила, замещенного алкила, замещенного алкилена, замещенного алкинила,замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклила; и где, когда R2 и R3 одновременно находятся в одном из R5, R6, R7 и R12, они могут быть связаны друг с другом с образованием цикла, который может, в случае необходимости, содержать один или несколько гетероатомов, выбираемых среди атомов О, N и S;f) Q означает Н. Продукты согласно изобретению содержат заместитель Q, который представляет собой предпочтительно Н. В продуктах формулы (I) группа Ar-L-A преимущественно означает в которой каждый X1, Х 2, Х 3 и Х 4 независимо выбирают из N и C-R11, где R11 выбирают из группы,состоящей из Н, галогена, NO2, R2, CN, O(R2), OC(O)(R2), ОС(О)N(R2)(R3), OS(O2)(R2), N(R2)(R3),N=C(R2)(R3),N(R2)С(O)(R3),N(R2)С(O)O(R3),N(R4)C(O)N(R2)(R3),N(R4)С(S)N(R2)(R3),N(R2)S(O2)(R3), C(O)(R2), C(O)O(R2), C(O)N(R2)(R3), С(=N(R3(R2), C(=N(OR3(R2), S(R2), S(O)(R2),S(O2)(R2), S(O2)O(R2), S (O2)N(R2)(R3). Предпочтительные заместители R11 выбирают из группы, состоящей из Н, F, Cl, метила, NH2, OCF3R5 и R7 преимущественно выбирают из Н и F.R6 предпочтительно означает Н. Предпочтительные заместители L-A выбирают среди NH-CO-NH-А, NH-SO2-A и NH-CO-CH2-A. Особенно эффективную комбинацию получают, когда L-A означает NHCONH-A.-2 012613 Продукты согласно изобретению предпочтительно содержат заместитель А, который выбирают из группы, состоящей из фенила, пиридила, пиримидила, пиридазинила, пиразинила, тиенила, фурила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, пиразолила, имидазолила, индолила, индазолила, бензимидазолила, бензоксазолила и бензотиазолила, причем А возможно замещен. Более предпочтительно А выбирают среди фенила, пиразолила и изоксазолила, причем А возможно замещен. Заместитель А в высшей степени преимущественно замещен первым заместителем, выбираемым из группы, состоящей изалкила, галогеналкила, алкилена, алкинила, арила, O-алкила, O-циклоалкила, Oарила, О-гетероарила, S-алкила, S-циклоалкила, S-арила, S-гетероарила, причем каждый возможно замещен заместителем, выбираемым среди (C1-C3)-алкила, галогена, О-(C1-С 3)-алкила. Заместитель А предпочтительно замещен вторым заместителем, выбираемым из группы, состоящей из F, Cl, Br, I, ОН,SO3M, COOM, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3)-алкил-ОН, (C1-C3)-алкил-N(R8)(R9), (C1C3)-алкил-(R10), (С 1-С 3)-алкил-СООН, N(R8)(R9), O-(С 2-С 4)-алкил-NR8R9; где R8 и R9 независимо выбирают среди Н, (C1-C3)-алкила, (C1-C3)-алкил-ОН, (C1-C3)-алкил-NH2, (C1-C3)-алкил-СООМ, (C1-C3)алкил-SO3M; причем, когда R8 и R9 одновременно отличаются от Н, они могут быть связаны с образованием цикла, который содержит 0-3 гетероатома, выбираемых среди N, S и О; где М означает Н или катион щелочного металла, выбираемого среди Li, Na и K; и где R10 означает Н или возможно замещенный неароматический гетероцикл, включающий 2-7 атомов углерода и 1-3 гетероатома, выбираемых среди N,О и S. Особенно предпочтительные заместители А выбирают среди фенила, пиразолила и изоксазолила; причем вышеуказанные заместители А предпочтительно замещены галогеном (в особенности, F), (С 1 С 4)-алкилом, галоген-(C1-C3)-алкилом (в особенности, CF3), О-(С 1-С 4)-алкилом, О-циклоалкилом, S-(C1C4)-алкилом, S-циклоалкилом, галоген-О-(С 1-С 4)-алкилом и галоген-S-(С 1-С 4)-алкилом. Предпочтительным заместителем А является фенил, замещенный с помощью 0, 1, 2, 3, 4 или 5 заместителей, выбираемых из группы, состоящей изалкила, галогеналкила, алкилена, алкинила, арила, Оалкила, О-циклоалкила, О-арила, О-гетероарила, S-алкила, S-циклоалкила, S-арила, S-гетероарила, причем каждый возможно замещен заместителем, выбираемым среди (С 1-С 3)-алкила, галогена, О-(C1-C3)алкила и F, Cl, Br, I, ОН, SO3M, COOM, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3)-алкил-ОН, (С 1-С 3)алкил-N(R8)(R9), (C1-C3)-алкил-(R10), (C1-C3)-алкил-СООН, N(R8)(R9), О-(C2-C4)-алкил-N(R8)(R9); гдеR8 и R9 независимо выбирают среди Н, (C1-C3)-алкила, (C1-C3)-алкил-ОН, (C1-C3)-алкил-NH2, (С 1-С 3)алкил-СООМ, (C1-С 3)-алкил-SO3M; где, когда R8 и R9 одновременно отличаются от Н, они могут быть связаны с образованием цикла, включающего 0-3 гетероатома, выбираемых среди О, N и S; где М означает означает Н или катион щелочного металла, выбираемого среди Li, Na и K; и где R10 означает Н или возможно замещенный неароматический гетероцикл, включающий 2-7 атомов углерода и 1-3 гетероатома, выбираемых среди N, О и S. Продукты примеров 1-104 преимущественно составляют объект настоящего изобретения. Продукт согласно изобретению может находиться: 1) в нехиральной форме, или 2) в рацемической форме, или 3) в обогащенной одним стереоизомером форме, или 4) в обогащенной одним энантиомером форме,и может быть, в случае необходимости, превращен в соль. Продукт согласно изобретению может быть использован для получения лекарственного средства,пригодного для лечения патологического состояния, в особенности рака, или связанного с дерегуляцией ангиогенеза заболевания, такого как псориаз, хроническое воспаление, связанная с возрастом макулярная дегенерация, ревматоидный артрит, диабетическая ретинопатия, саркома Капоши, инфантильная гемангиома. Настоящее изобретение относится также к терапевтическим композициям, включающим продукт согласно изобретению в комбинации с фармацевтически приемлемым эксципиентом согласно выбранному способу введения. Фармацевтическая композиция может находиться в твердой форме, жидкой форме или в форме липосом. Из твердых композиций можно назвать порошки, желатиновые капсулы, таблетки. В число пероральных форм также можно включать твердые формы, защищенные по отношению к кислой среде желудка. Используемые для твердых форм носители представляют собой, в частности, минеральные носители, такие как фосфаты, карбонаты, или органические носители, такие как лактоза, целлюлозы, крахмал или полимеры. Жидкие формы образованы растворами, суспензиями или дисперсиями. В качестве диспергирующего носителя они содержат либо воду, либо органический растворитель (этанол, NMP или другие), либо смеси поверхностно-активных веществ и растворителей или комплексообразователей и растворителей. Жидкие формы предпочтительно являются инъецируемыми, и вследствие этого готовая лекарственная форма является приемлемой для такого использования. Приемлемые пути введения путем инъекции включают внутривенный, интраперитонеальный, внутримышечный и подкожный пути введения, причем обычно предпочтительным является внутривенный-3 012613 путь введения. Вводимая доза соединений согласно изобретению подбирается практикующим врачом в зависимости от пути введения пациенту и состояния этого последнего. Соединения согласно настоящему изобретению могут быть введены индивидуально или в смеси с другими противораковыми средствами. Из возможных комбинаций можно назвать: алкилирующие агенты и, в частности, циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломид, прокарбазин и гексаметилмеламин; производные платины, такие как, в частности, цисплатин, карбоплатин или оксалиплатин; антибиотики, такие как, в частности, блеомицин, митомицин, дактиномицин; антимикроканальциевые агенты, такие как, в частности, винбластин, винкристин, виндезин, винорелбин, таксоиды (паклитаксел и доцетаксел); антрациклины, такие как, в частности, доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лозоксантрон; ингибиторы топоизомераз I и II групп, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс; фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин; аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, 6-тиогуанин; аналоги аденозина, такие как пентостатин, цитарабин или флударабинфосфат; метотрексат и фолиновая кислота; различные ферменты и соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиноевая кислота, сурамин, дексразоксан, амифостин, герцептин, а также эстрогенные гормоны, андрогенные гормоны; антиваскулярные агенты, такие как производные комбретастатина или колхицина и их пролекарственные формы. С соединениями согласно настоящему изобретению также можно сочетать лучевую терапию. Эти терапии могут быть проведены одновременно, раздельно, последовательно. Терапия адаптируется практикующим врачом в зависимости от заболевания, которое нужно лечить. Продукты согласно изобретению пригодны в качестве ингибиторов некоторых киназ. KDR, Tie2,Aurora1, Aurora2, FAK, PDGFR, FLT1, FGFR и VEGF-R3 представляют собой киназы, в отношении которых продукты согласно изобретению являются особенно пригодными в качестве ингибиторов. Из этих киназ предпочтительны KDR и Tie2. Из продуктов согласно изобретению продукты общей формулы (I),в которой X означает атом азота, являются предпочтительными в качестве ингибиторов KDR, Tie2 иFAK. Причины, по которым выбраны эти последние киназы, приводятся ниже.KDR (Kinase insert Domain Receptor), также называемый VEGF-R2 (Vascular Endothelial Growth Factor Receptor 2) экспрессируется главным образом в эндотелиальных клетках. Этот рецептор фиксирует фактор ангиогенного роста VEGF и служит, таким образом, медиатором трансдукционного сигнала за счет активации его внутриклеточного киназного домена. Прямое ингибирование киназной активностиVEGF-R2 позволяет уменьшать феномен ангиогенеза в присутствии экзогенного VEGF (Vascular Endothelial Growth Factor: фактор васкулярного эндотелиального роста) (Strawn и др., Cancer Research., 56,3540-3545 (1996. Этот процесс наглядно объяснен, в частности, с помощью мутантов VEGF-R2 (Millauer и др., Cancer Research., 56, 1615-1620 (1996. Рецептор VEGF-R2, по-видимому, не выполняет никакой другой функции у взрослого, чем таковая, связанная с ангиогенной активностью VEGF. Следовательно, селективный ингибитор киназной активности VEGF должен проявлять токсичность только в незначительной степени. Кроме этой центральной роли в динамическом ангиогенном процессе, недавно полученные результаты наводят на мысль, что экспрессия VEGF способствует сохранению опухолевых клеток после химиотерапии и лучевой терапии, что подчеркивает потенциальный синергизм ингибиторов KDR с другими агентами (Lee и др., Cancer Research., 60, 5565-5570 (2000.Tie2 (ТЕК) является членом семейства рецепторов тирозинкиназы, экспрессирующимся главным образом в эндотелиальных клетках. Tie2 является первым рецептором с активностью тирозинкиназы,который известен одновременно как агонист (ангиопоэтин 1 или Ang1), который стимулирует автофосфорилирование рецептора и клеточную сигнализацию [S. Davis и др., Cell, 87, 1161-1169 (1996)], и антагонист (ангиопоэтин 2 или Ang2) [P.С. Maisonpierre и др., Science, 277, 55-60 (1997)]. Ангиопоэтин 1 может давать синергический эффект с VEGF на последних стадиях неоангиогенеза [Т. Asahara, Circ. Res.,233-240 (1998)]. Эксперименты по нокаутированию и трансгенные манипуляции в отношении экспрессии Tie2 или Ang1 приводят к животным, которые обладают дефицитами васкуляризации [D.J. Dumont и др., Genes Dev., 8, 1897-1909 (1994); и С. Suri, Cell, 81, 1171-1180 (1996)]. Связывание Ang1 с его рецептором приводит к автофосфорилированию киназного домена Tie2, который является существенным для-4 012613 неоваскуляризации, а также для рекрутмента и взаимодействия сосудов с перицитами и гладкомышечными клетками; эти явления способствуют созреванию и стабильности вновь образующихся сосудов(1997), и Lin P., PNAS, 95, 8829-8834 (1998), показано ингибирование опухолевого роста и опухолевой васкуляризации, а также уменьшение метастаз легкого во время аденовирусных инфекций или инфекций внеклеточного домена Tie2 (Теk) на моделях ксенотрансплантатов опухоли молочной железы и меланомы. Ингибиторы Tie2 могут быть использованы в случае состояний, где неоваскуляризация протекает несоответствующим образом (то есть, в случае диабетической ретинопатии, хронического воспаления,псориаза, саркомы Капоши, хронической неоваскуляризации вследствие макулярной дегенерации, ревматоидного артрита, инфантильной гемангиомы и раковых заболеваний).FAK (Focal Adhesion Kinase) представляет собой цитоплазматическую тирозинкиназу, играющую важную роль в трансдукции сигнала, транслируемого интегринами, семейства гетеродимерных рецепторов клеточной адгезии. FAK и интегрины солокализованы в перимембранных структурах, называемых адгезивными бляшками. В случае многочисленных типов клеток показано, что активация FAK, а также ее фосфорилирование по тирозиновым остаткам и, в особенности, ее автофосфорилирование по тирозину 397 зависят от связывания интегринов с их внеклеточными лигандами и, следовательно, индуцируются во время клеточной адгезии [L. Kornberg и др., J. Biol. Chem., 267(33), 23439-442 (1992)]. Автофосфорилирование по тирозину 397 FAK выполняет сайт связывания другой тирозинкиназы, Src, через ее доменSrc тогда может фосфорилировать FAK по тирозину 925, рекрутируя таким образом адаптивный белокGrb2 и индуцируя в некоторых клетках активацию пути белка ras и МАР-киназы, участвующих в контролировании клеточной пролиферации [Schlaepfer и др., Nature, 372, 786-791 (1994); Schlaepfer и др.,Prog. Biophy. Mol. Biol., 71, 435-478 (1999); Schlaepfer и Hunter, J. Biol. Chem., 272, 13189-13195 (1997)]. Активация FAK также может индуцировать сигнальный путь jun NH2-концевой киназы (JNK) и приводить к прогрессированию клеток к фазе G1 клеточного цикла [Oktay и др., J. Cell. Biol., 145, 1461-1469(1999)]. Фосфатидилинозит-3-ОН-киназа (PI3-киназа) также связывается с FAK по тирозину 397, и это взаимодействие может быть необходимым для активации Р 13-киназы [Chen и Guan, Proc. Nat. Acad. Sci.USA, 91, 10148-10152 (1994); Ling и др., J. Cell. Biochem., 73, 533-544 (1999)]. Комплекс FAK/Src фосфорилирует различные субстраты, как паксиллин и p130CAS в фибробластах [Vuori и др., Mol. Cell. Biol.,16, 2606-2613 (1996)]. Результаты многочисленных исследований подтверждают гипотезу, что ингибиторы FAK могут быть пригодны при лечении рака. Исследования наводят на мысль, что FAK может играть важную роль в пролиферации и/или сохранении клеток in vitro. Например, в случае клеток СНО, некоторыми авторами показано, что суперэкспрессия p125FAK приводит к ускорению транзиции от G1 к S, что наводит на мысль о том, что p125FAK благоприятствует клеточной пролиферации [J.-H. Zhao и др., J. Cell. Biol., 143,1997-2008 (1998)]. Другими авторами показано, что опухолевые клетки, обработанные антисмысловыми олигонуклеотидами FAK, утрачивают свою адгезию и подвергаются апоптозу [Xu и др., Cell Growth Differ., 4, 413-418 (1996)]. Также показано, что FAK промотирует миграцию клеток in vitro. Так, дефицитные для экспрессии FAK фибробласты (нокаутированная по FAK мышь) обладают округлой морфологией, дефицитами клеточной миграции в ответ на хемотаксические сигналы и эти дефициты ликвидируются повторной экспрессией FAK [D.J. Sieg и др., J. Cell Science, 112, 2677-2691 (1999)]. Суперэкспрессиия С-терминального домена FAK (FRNK) блокирует растягивание адгезивных клеток и уменьшает клеточную миграцию in vitro [A. Richardson и J.T. Parsons, Nature, 380, 538-540 (1996)]. Суперэкспрессиия FAK в клетках СНО, COS и в клетках человеческой астроцитомы благоприятствует миграции клеток. Вовлечение FAK в промотирование пролиферации и миграции клеток в случае многочисленных типов клеток in vitro наводит на мысль о потенциальной роли FAK в неопластических процессах. Недавно проведенное исследование действительно показало увеличение пролиферации опухолевых клеток in vivo после индукции экспрессии FAK в клетках человеческой астроцитомы [L.A. Cary и др., J. Cell Sci., 109,1787-1794 (1996); D. Wang и др., J. Cell Sci., 113, 4221-4230 (2000)]. Кроме того, иммуногистохимические исследования человеческих биопсий показали, что FAK суперэкспрессируется в злокачественных опухолях простаты, молочной железы, щитовидной железы, ободочной кишки, меланомы, головного мозга и легких, причем уровень экспрессии FAK прямо коррелирует с опухолями, обладающими наиболее агрессивным фенотипом [Т.М. Weiner и др., Lancet, 342 (8878), 1024-1025 (1993); Owens и др., CancerResearch, 55, 2752-2755 (1995); K. Maung и др., Oncogene, 18, 6824-6828 (1999); D. Wang и др., J. Cell Sci.,113, 4221-4230 (2000)]. Определения Термин галоген относится к элементу, выбираемому среди F, Cl, Br и I. Термин алкил относится к насыщенному, линейному или разветвленному, углеводородному заместителю с 1-12 атомами углерода. Примерами алкильного заместителя являются заместители метил,этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил,-5 012613 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 1-этилбутил, 2-этилбутил, 3, 3-диметилбутил, гептил, 1-этилпентил, октил, нонил, децил, ундецил и додецил. Термин алкилен относится к линейному или разветвленному углеводородному заместителю с одной или несколькими ненасыщенными связями и с 2-12 атомами углерода. Примерами алкиленовых заместителей являются заместители этиленил, 1-метилэтиленил, проп-1-енил, проп-2-енил, Z-1-метилпроп 1-енил, Е-1-метилпроп-1-енил, Z-1,2-диметилпроп-1-енил, Е-1,2-диметилпроп-1-енил, бут-1,3-диенил, 1 метилиденилпроп-2-енил,Z-2-метилбут-1,3-диенил,Е-2-метилбут-1,3-диенил,2-метил-1 метилиденилпроп-2-енил, ундец-1-енил и ундец-10-енил. Термин алкинил относится к линейному или разветвленному углеводородному заместителю по меньшей мере с двумя ненасыщенными связями, которые несет пара вицинальных атомов углерода, и с 2-12 атомами углерода. Примерами алкинильного заместителя являются заместители этинил, проп-1 инил, проп-2-инил и бут-1-инил. Термин арил относится к моно- или полициклическому ароматическому заместителю с 6-14 атомами углерода. Примерами арильного заместителя являются заместители фенил, нафт-1-ил, нафт-2-ил,антрацен-9-ил, 1,2,3,4-тетрагидронафт-5-ил и 1,2,3,4-тетрагидронафт-6-ил. Термин гетероарил относится к моно- или полициклическому гетероароматическому заместителю с 1-13 атомами углерода и 1-4 гетероатомами. Примерами гетероарильного заместителя являются заместители пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, фурил, тиенил, имидазолил, оксазолил, тиазолил,изоксазолил, изотиазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидил,пиразинил, 1,3,5-триазинил, индолил, бензо[b]фурил, бензо[b]тиенил, индазолил, бензимидазолил, азаиндолил, хинолеил, изохинолеил, карбазолил и акридил. Термин гетероатом в рамках изобретения относится по меньшей мере к двухвалентному атому,отличающемуся от атома углерода. Примерами гетероатома являются N, О, S и Se. Термин циклоалкил относится к насыщенному или частично ненасыщенному циклическому углеводородному заместителю с 3-12 атомами углерода. Примерами циклоалкильного заместителя являются заместители циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, бицикло[2,2,1]гептил, циклооктил, бицикло[2,2,2]октил, адамантил и пергидронафтил. Термин гетероциклил относится к насыщенному или частично ненасыщенному циклическому углеводородному заместителю с 1-13 атомами углерода и 1-4 гетероатомами. Предпочтительно, насыщенный или частично ненасыщенный циклический углеводородный заместитель является моноциклическим и включает 4 или 5 атомов углерода и 1-3 гетероатома. Термин замещенный относится к заместителю, отличающемуся от Н, как, например, галоген, алкил, арил, гетероарил, циклоалкил, гетероциклил, алкилен, алкинил, ОН, О-алкил, О-алкилен, О-арил, Огетероарил, NH2, NH-алкил, NH-арил, NH-гетероарил, SH, S-алкил, S-арил, S(O2)H, S(O2)-алкил, S(O2)арил, SO3H, SO3-алкил, SO3-арил, СНО, С(О)-алкил, С(О)-арил, С(О)ОН, С(О)О-алкил, С(О)О-арил,ОС(О)-алкил, ОСО(О)-арил, C(O)NH2, С(О)NH-алкил, С(О)NH-арил, NHCHO, NHC(О)-алкил, NHC(O)арил, NH-циклоалкил, NH-гетероциклил. Продукты согласно изобретению могут быть получены обычными способами органической химии. Нижеприведенные схемы 1 и 2 служат примером двух способов, используемых для получения соединений нижеследующих примеров. На этом основании они не представляют собой ограничения объема охраны изобретения в том, что касается способа получения заявляемых соединений. Способ а. Схема 1 В обоих случаях альтернативный путь синтеза состоит в конденсации с бром(аза)индолом бороновой кислоты, несущей карбамидную цепь. Объектом настоящего изобретения является еще способ получения продуктов общей формулы (I),таких как указанные в п.1 формулы изобретения, отличающийся тем, что продукт следующей общей формулы (VI): подвергают следующим стадиям: галогенирование в положение 3, затем реакции связывания по Suzuki в положении 3 с получением продукта следующей общей формулы восстановление нитрофенильной группы до аминофенильной группы в положении 3 и амидирование сложного эфира в положении 2 или амидирование сложного эфира в положении 2 и восстановление нитрофенильной группы до аминофенильной группы в положении 3 с получением продукта следующей общей формулы (II): затем ацилирование аминофенильной группы в положении 3. Промежуточные продукты общих формул (II), (IV) и (V) также составляют объект настоящего изобретения. Специалисту в данной области понятно, что для осуществления вышеописанных способов согласно изобретению может оказаться необходимым введение защитных групп для функциональных аминогрупп, карбоксильной и спиртовой функциональных групп с целью избежания побочных реакций. Эти-7 012613 группы представаляют собой такие, которые могут быть удалены, не затрагивая остальной части молекулы. В качестве примеров защитных групп для функциональной аминогруппы можно назвать третбутилкарбамат, который может быть регенерирован с помощью йодтриметилсилана; ацетил, который может быть регенерирован в кислой среде (например, соляная кислота). В качестве защитных групп для карбоксильной функциональной группы можно назвать сложные эфиры (например, сложный метоксиметиловый эфир, сложный бензиловый эфир). В качестве защитных групп для спиртовой функциональной группы можно назвать сложные эфиры (например, сложный бензоиловый эфир), которые могут быть регенерированы в кислой среде или путем каталитического гидрирования. Другие используемые защитные группы описаны T.W. GREENE и др. в руководстве Protective Groups in Organic Synthesis, третье издание, 1999, Wiley-Interscience. Соединения формулы (I) выделяют и они могут быть очищены обычными известными методами,например путем кристаллизации, хроматографии или экстракции. Энантиомеры, диастереоизомеры соединений формулы (I) также составляют часть изобретения. Соединения формулы (I), включающие основной остаток, в случае необходимости, могут быть превращены в аддитивные соли неорганической или органической кислоты путем воздействия такой кислоты в растворителе, например органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Соединения формулы (I), включающие кислотный остаток, в случае необходимости, могут быть превращены в соли металлов или в аддитивные соли азотсодержащих оснований согласно само по себе известным способам. Эти соли могут быть получены путем воздействия металлсодержащего основания(как, например, щелочной или щелочно-земельный металл), аммиака, амина или соли амина на соединение формулы (I) в растворителе. Образовавшуюся соль выделяют обычными способами. Эти соли также составляют часть настоящего изобретения. Когда продукт согласно настоящему изобретению имеет по меньшей мере одну свободную основную функциональную группу, могут быть получены фармацевтически приемлемые соли путем реакции между вышеуказанным продуктом и неорганической или органической кислотой. Фармацевтически приемлемые соли включают хлориды, нитраты, сульфаты, гидросульфаты, пиросульфаты, бисульфаты,сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты,ацетаты, пропионаты, акрилаты, 4-гидроксибутираты, каприлаты, капроаты, деканоаты, оксалаты, малонаты, сукцинаты, глутараты, адипаты, пимелаты, малеаты, фумараты, цитраты, тартраты, лактаты, фенилацетаты, манделаты, себацинаты, субераты, бензоаты, фталаты, метансульфонаты, пропансульфонаты, ксилолсульфонаты, салицилаты, циннаматы, глутаматы, аспартаты, глюкуронаты, галактуронаты. Когда продукт согласно настоящему изобретению имеет по меньшей мере одну свободную кислотную функциональную группу, могут быть получены фармацевтически приемлемые соли путем реакции между вышеуказанным продуктом и неорганическим или органическим основанием. Фармацевтически приемлемые основания включают гидроксиды катионов щелочных или щелочно-земельных металлов,таких как Li, Na, K, Mg, Ca; основные аминосоединения, такие как аммиак, аргинин, гистидин, пиперидин, морфолин, пиперазин, триэтиламин. Изобретение также описывается нижеследующими примерами, приводимыми в качестве пояснения изобретения. Анализы путем LC/MS (жидкостная хроматография/масс-спектрометрия) осуществляли на прибореMicromass, модель LCT, который связан с устройством HP 1100. Относительное содержание продуктов определяли с помощью диодного детектора HP G1315A в диапазоне длин волн 200-600 нм и детектора по светорассеянию Sedex 65. Регистрацию масс-спектров (Mass spectra) осуществляли в диапазоне 180-800. Данные анализировали, используя программное обеспечение Micromass MassLynx. Разделение осуществляли на колонке Hypersil BDS C18, 3 мкм (504,6 мм), элюируя линейным градиентом 5-90% ацетонитрила, содержащего 0,05% (об./об.) трифторуксусной кислоты (ТФУК), в воде,содержащей 0,05% (об./об.) ТФУК, в течение 3,5 мин с расходом 1 мл/мин. Общее время анализа, включая период повторного уравновешивания колонки, составляет 7 мин. Масс-спектры получали при использовании ионизации электронным распылением (ES+) на прибореPlatform II (Micromass). Описаны обнаруженные ионы. Температуры плавления измеряли в капилляре на приборе Mettler FP62, в диапазоне от 30 до 300 С,при подъеме на 2 С в минуту. Времена удерживания в случае продуктов примеров 72-74 определяли при использовании колонок типа XBRIDGE C18, 350 мм, частицы размером 2,5 мкм. Продукты элюировали линейным градиентом 5-95% ацетонитрила в воде, содержащей 0,1% муравьиной кислоты, в течение 7 мин с расходом 1,1 мл/мин. Времена удерживания продуктов примеров 77-102 определяли при использовании колонок типаWaters Xterra C18, 350 мм, частицы размером 3,5 мкм. Продукты элюировали линейным градиентом 590% ацетонитрила в воде, содержащей 0,5% ТФУК, в течение 7 мин с расходом 600 мкл/мин.-8 012613 Очистка путем LC/MS Продукты могут быть очищены путем LC/MS, используя систему Waters FractionLynx, состоящую из градиентного насоса Waters, модель 600, регенерационного насоса Waters, модель 515, насоса для разбавления Waters Reagent Manager, автоинжектора Waters, модель 2700, двух вентилей Rheodyne, модельLabPro, диодного детектора Waters, модель 996, масс-спектрометра Waters, модель ZMD, и сборника фракций Gilson, модель 204. Система контролировалась программным обеспечением WatersFractionLynx. Разделение осуществляли альтернативно при использовании двух колонок Waters Symmetry (C18, 5 мкм, 19 50 мм, регистрационный номер по каталогу 186000210), причем одна колонка находится в процессе выполнения регенерации с помощью смеси вода/ацетонитрил в соотношении 95:5(об./об.), содержащей 0,07% (об./об.) трифторуксусной кислоты, в то время как другая колонка находится в процессе выполнения разделения. Элюирование колонок осуществляли, используя линейный градиент 5-95% ацетонитрила, содержащего 0,07% (об./об.) трифторуксусной кислоты, в воде, содержащей 0,07%(об./об.) трифторуксусной кислоты, с расходом 10 мл/мин. На выходе из разделительной колонки одну тысячную часть элюента отделяли с помощью LC Packing Accurate, разбавляли метиловым спиртом с расходом 0,5 мл/мин и направляли к детекторам из расчета 75% к диодному детектору, а остальные 25% к масс-спектрометру. Остальную часть элюента (999/1000) направляли к сборнику фракций, куда поток выводили, пока массу ожидаемого продукта не детектировали с помощью программного обеспеченияFractionLynx. Молекулярные формулы ожидаемых продуктов получали при использовании программного обеспечения FractionLynx, согласно которому сбор продукта начинается тогда, когда сигнал детектируемой массы соответствует иону [М+Н]+ и/или [M+Na]+. В некоторых случаях, в зависимости от результатов аналитического метода LC/MS, когда был определен интенсивный ион, соответствующий[М+2 Н], также, при использовании программного обеспечения FractionLynx, определяли значение, соответствующее половине рассчитанной молекулярной массы (MW/2). В этих условиях, сбор также начинали, когда были определены сигнал массы иона [М+2 Н] и/или сигнал массы иона [M+Na+H]. Продукты собирали в тарированные стеклянные пробирки. После сбора растворители выпаривали в центрифужном выпарном аппарате Savant AES 2000 или Genevac HT8 и массы продуктов определяли путем взвешивания пробирок после выпаривания растворителей. Пример 1. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид Способ а. Этил-3-бром-1 Н-индол-2-карбоксилат. К раствору 37,8 г этилиндол-2-карбоксилата в 900 мл пиридина медленно добавляют при температуре 0 С и в атмосфере аргона 67 г пиридинийтрибромида в 300 мл пиридина. Раствор затем нагревают при температуре 50 С в течение 30 мин, затем выливают в 4 л смеси воды со льдом. Образовавшееся твердое вещество отфильтровывают, промывают водой и отжимают. После высушивания в вакууме получают 48,4 г этил-3-бром-1 Н-индол-2-карбоксилата, характеристики которого являются следующими. Масс-спектр (ES+): m/z=269 [MH]+ Температура плавления=148-150 С (по Кофлеру) Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 1,38 (т, J=7,0 Гц, 3 Н), 4,38 (кв., J=7,0 Гц, 2 Н), 7,20 (т уш., J=8,0 Гц, 1 Н), 7,37 (т уш., J=8,0 Гц, 1 Н), 7,50 (д уш., J=8,0 Гц, 1 Н), 7,54 (д уш., J=8,0 Гц, 1 Н), 12,2 (м уш., 1 Н). ИК-спектр (KBr): 3454; 3319; 3297; 1701; 1681; 1517; 1331; 1240 и 644 см-1. Этил-3-(4-нитрофенил)-1 Н-индол-2-карбоксилат. К раствору 5 г этил-3-бром-1 Н-индол-2-карбоксилата и 7,8 г 4-нитрофенилбороновой кислоты в 110 мл этанола и 110 мл толуола последовательно добавляют в атмосфере аргона и при перемешивании 46 мл 1 М раствора карбоната натрия, 2,23 г хлорида лития, затем 1,1 г тетракис(трифенилфосфин)палладия. Раствор кипятят с обратным холодильником в течение 2 ч 30 мин, затем концентрируют при пониженном давлении. Осадок отфильтровывают, затем перекристаллизуют из этанола, получая 5,1 г этил-3-(4-нитрофенил)-1 Н-индол-2-карбоксилата, характеристики которого являются следующими. Масс-спектр (ES+): m/z=311 [MH]+ Температура плавления=218-220 С (по Кофлеру)-9 012613 Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 1,21 (т, J=7,0 Гц, 3 Н), 4,26 (кв., J=7,0 Гц, 2 Н), 7,14 (т уш., J=8,0 Гц, 1 Н), 7,37 (т уш., J=8,0 Гц, 1 Н), и 7,50 и 7,60 (м, 2 Н), 7,81 (д уш., J=8,5 Гц, 2 Н), 8,30 (д уш.,J=8,5 Гц, 2 Н), 12,2 (м уш., 1 Н). ИК-спектр (KBr): 3405; 1717; 1510; 1343; 1239; 859 и 757 см-1. 3-(4-Нитрофенил)-1 Н-индол-2-карбоксамид. К раствору 3,3 г этил-3-(4-нитрофенил)-1 Н-индол-карбоксилата в 50 мл 7 н раствора аммиака в метаноле добавляют раствор 0,5 г хлорида аммония в 30 мл концентрированного раствора гидроксида аммония. Раствор затем нагревают в запаянной трубке при температуре 125 С в течение 15 ч. После охлаждения образовавшееся твердое вещество отфильтровывают, промывают водой, затем отжимают. После высушивания в вакууме получают 1,5 г 3-(4-нитрофенил)-1 Н-индол-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=282 [MH]+ Температура плавления=258-260 С (по Кофлеру) Элементный анализ, %: С 63,74; Н 3,76; N 14,90 (теоретически рассчитано, %: С 64,06; Н 3,94; N 14,94). Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 7,13 (т уш., J=8,0 Гц, 1 Н), от 7,22 до 7,65 (м очень уш., частично скрытый, 2 Н), 7,30 (т уш., J=8,0 Гц, 1 Н), 7,51 (д уш., J=8,0 Гц, 1 Н), 7,59 (д уш., J=8,0 Гц,1 Н), 7,79 (д уш., J=8,5 Гц, 2 Н), 8,31 (д уш., J=8,5 м, 2 Н), от 11,4 до 11,8 (м очень уш., 1 Н). 3-(4-Аминофенил)-1 Н-индол-2-карбоксамид. К суспензии 1,3 г 3-(4-нитрофенил)-1 Н-индол-2-карбоксамида в 50 мл 5 н соляной кислоты добавляют 2,7 г олова. Смесь перемешивают при комнатной температуре в течение 5 ч, затем нейтрализуют с помощью 5 н раствора гидроксида натрия. Водную фазу экстрагируют три раза по 50 мл этилацетата и органическую фазу сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. После очистки флэш-хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (20:80 по объемам), получают 0,15 г 3-(4-аминофенил)-1 Н-индол-2-карбоксамида,характеристики которого являются следующими. Масс-спектр (ES+): m/z=252 [МН]+ Температура плавления=180-182 С (по Кофлеру) Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 5,24 (с уш., 2 Н), 6,12 (м уш., 1 Н), 6,70 (д уш., J=8,5 Гц, 2 Н), 7,01 (т уш., J=8,0 Гц, 1 Н), 7,13 (д уш., J=8,5 Гц, 2 Н), 7,20 (т уш., J=8,0 Гц, 1 Н), 7,33 (д уш., J=8,0 Гц, 1 Н), 7,43 (д уш., J=8,0 Гц, 1 Н), и 7,30 и 7,45 (м уш. частично скрытый, 1 Н), 11,45 (м уш., 1 Н). ИК-спектр (KBr): 3452; 3370; 1648; 1582; 1545; 1345 и 747 см-1. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид. К раствору 0,11 г 3-(4-аминофенил)-1 Н-индол-2-карбоксамида в 18 мл тетрагидрофурана по каплям добавляют при температуре 10 С 0,089 мл 2-фтор-5-трифторметилфенилизоцианата в виде раствора в 2 мл тетрагидрофурана. После перемешивания в течение 1 ч при температуре 20 С добавляют 5 мл метанола и 2 мл триэтиламина и перемешивание продолжают в течение 1 ч. Реакционную среду затем концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (35:65 по объемам), получая 0,13 г 3-4-[3-(2 фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=457 [MH]+ Температура плавления=240-242 С (по Кофлеру) Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,48 (м уш., 1 Н), 7,06 (т уш., J=8,0 Гц, 1 Н), 7,23 (т уш., J=8,0 Гц, 1 Н), от 7,36 до 7,57 (м, 7 Н), 7,60 (д уш., J=8, 5 Гц, 2 Н), 8,65 (дд, J=2,5 и 7,5 Гц, 1 Н), 8,97 (м уш., 1 Н), 9,32 (м уш., 1 Н), 11,6 (м уш., 1 Н). ИК-спектр (KBr): 3463; 3338; 1651; 1590; 1543; 1443; 1340; 1119; 1070 и 745 см-1. Пример 2. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2-b]пиридин-2-карбоксамид- 10012613 К раствору этилата натрия, полученного путем добавления 4 г натрия к 400 мл этанола, добавляют при перемешивании и в атмосфере аргона 121,7 г этилоксалата, затем 15,8 г 2-метил-3-нитропиридина в виде раствора в 100 мл этанола. Реакционную смесь перемешивают в течение 15 ч и образовавшееся твердое вещество отфильтровывают, промывают последовательно с помощью 100 мл этанола и 100 мл диизопропилового эфира, после чего отсасывают. Твердое вещество обрабатывают с помощью 300 мл этанола и подкисляют 5 н раствором соляной кислоты. Полученное твердое вещество отфильтровывают,промывают с помощью 50 мл 5 н раствора соляной кислоты, затем с помощью 100 мл этанола и отсасывают. После высушивания в вакууме получают 18,7 г этил-3-(3-нитропиридин-2-ил)-2-оксопропионата,характеристики которого являются следующими. Масс-спектр (ES+): m/z=239 [MH]+ Температура плавления=38 С (по Кофлеру) Спектр 1H-ЯМР (400 МГц, ДМСО-d6,в м.д.): 1,30 (т, J=7,0 Гц, 3 Н), 4,29 (кв., J=7,0 Гц, 2 Н), 7,12 (с,1 Н), 7,57 (дд, J=5,5 и 8,5 Гц, 1 Н), 8,66 (д уш., J=8,5 Гц, 1 Н), 8,85 (д уш., J=5,5 Гц, 1 Н), 14,9 (м уш., 1 Н). ИК-спектр (KBr): 1722; 1644; 1560; 1532; 1346; 1231; 1141; 1024 и 777 см-1. Этил-1 Н-пирроло[3,2-b]пиридин-2-карбоксилат. 18,4 г Этил-3-(3-нитропиридин-2-ил)-2-оксопропионата и 5,5 г 10%-ного палладия-на-угле добавляют к 500 мл этанола и реакционную смесь гидрируют при давлении 2 бар в течение 3 ч при температуре 20 С. Реакционную смесь затем фильтруют через тонкий слой силикагеля и фильтрат концентрируют при пониженном давлении, получая 14,1 г этил-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата, характеристики которого являются следующими. Масс-спектр (ES+): m/z=191 [MH]+ Температура плавления=176-178 С (по Кофлеру) Спектр 1H-ЯМР (400 МГц, ДМСО-d6,в м.д.): 1,36 (т, J=7,0 Гц, 3 Н), 4,37 (кв., J=7,0 Гц, 2 Н), 7,20 (с уш., 1 Н), 7,27 (дд, J=4,5 и 8,5 Гц, 1 Н), 7,84 (д уш., J=8,5 Гц, 1 Н), 8,45 (дд, J=1,5 и 4,5 Гц, 1 Н), 12,15 (м уш.,1 Н). Этил-3-бром-1 Н-пирроло[3,2-b]пиридин-2-карбоксилат. К раствору 0,5 г этил-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата в 12 мл пиридина при температуре 0 С и в атмосфере аргона медленно добавляют 0,9 г пиридинийтрибромида в 5 мл пиридина. Раствор затем нагревают при температуре 50 С в течение 15 мин, после чего выливают в 100 мл смеси воды со льдом. Образовавшееся твердое вещество отфильтровывают, промывают водой и отсасывают. После высушивания в вакууме получают 0,56 г этил-3-бром-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата, характеристики которого являются следующими. Масс-спектр (ES+): m/z=270 [MH]+ Температура плавления=180 С (по Кофлеру) ИК-спектр (KBr): 2983; 2841; 2681; 1711; 1513; 1374; 1346; 1261; 1209; 1012; 767 и 651 см-1. Этил-(4-нитрофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксилат. К раствору 2 г этил-3-бром-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата и 1,5 г 4-нитрофенилбороновой кислоты в 50 мл диоксана добавляют 3 г карбоната калия и 0,8 г тетракис(трифенилфосфин)палладия. Смесь кипятят с обратным холодильником в течение 20 ч, затем фильтруют. Фильтрат концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (50:50 по объемам), с получением 0,52 г этил-(4-нитрофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата, характеристики которого являются следующими. Масс-спектр (ES+): m/z=312 [MH]+ Температура плавления=234-236 С (по Кофлеру) Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 1,25 (т, J=7, 0 Гц, 3 Н), 4,32 (кв., J=7,0 Гц, 2 Н), 7,38(дд, J=4,5 и 8,5 Гц, 1 Н), 7,94 (дд, J=1,5 и 8,5 Гц, 1 Н), 7,99 (д уш., J=9,0 Гц, 2 Н), 8,30 (д уш., J=9,0 Гц, 2 Н),8,52 (дд, J=1,5 и 4,5 Гц, 1 Н), 12,4 (с уш., 1 Н). ИК-спектр (KBr): 3371; 1724; 1598; 1508; 1345; 1252; 1158; 857 и 771 см-1. 3-(4-Нитрофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамид. Раствор 0,4 г этил-(4-нитрофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксилата в 10 мл 7 н раствора аммиака в метаноле нагревают при температуре 100 С в течение 16 ч в закрытом резервуаре. Растворитель затем выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя этилацетатом, с получением 0,16 г 3-(4-нитрофенил)-1 Н-пирроло[3,2b]пиридин-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES +): m/z=283 [MH]+ Температура плавления=260 С (по Кофлеру) Спектр 1 Н-ЯМР (400 МГц, ДМСО-d6,в м.д.): 7,33 (дд уш., J=4,5 и 8,5 Гц, 1 Н), 7,82 (м уш., 2 Н),7,91 (д уш., J=8,5 Гц, 1 Н), 8,16 (д уш., J=8,5 Гц, 2 Н), 8,33 (д уш., J=8,5 Гц, 2 Н), 8,52 (д уш., J=4,5 Гц, 1 Н),12,25 (м уш., 1 Н). 3-(4-Аминофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамид.- 11012613 К раствору 0,15 г 3-(4-нитрофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида в 10 мл метанола добавляют 0,113 г Pd/C (10%-ный). После перемешивания в течение 3,5 ч при температуре 22 С и при давлении 2 бар водорода реакционную среду фильтруют через силикагель, затем концентрируют при пониженном давлении, получая 0,1 г 3-(4-аминофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=253 [MH]+ Температура плавления=236-238 С (по Кофлеру) Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 5,20 (с уш., 2 Н), 6,46 (м уш., 1 Н), 6,68 (д уш., J=8,5 Гц, 2 Н), 7,20 (дд, J=4,5 и 8,5 Гц, 1 Н), 7,28 (д уш., J=8,5 Гц, 2 Н), 7,62 (м уш., 1 Н), 7,78 (д уш., J=8,5 Гц,1 Н), 8,35 (д уш., J=4,5 Гц, 1 Н), 11,65 (м уш., 1 Н). 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2-b]пиридин-2-карбоксамид. К раствору 80 мг 3-(4-аминофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида в 18 мл тетрагидрофурана добавляют 73 мг 2-фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 1 ч смесь концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (20:80 по объемам), с получением 110 мг 34-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=458 [MH]+ Температура плавления=206-208 С (по Кофлеру) Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,91 (м уш., 1 Н), 7,24 (дд, J=4,5 и 8,5 Гц, 1 Н), 7,39 (м уш., 1 Н), 7,51 (м частично скрытый, 1 Н), 7,56 (д уш., J=8,5 Гц, 2 Н), 7,64 (д уш., J=8,5 Гц, 2 Н), от 7,60 до 7,71 (м уш. частично скрытый, 1 Н), 7,82 (дд, J=1,5 и 8,5 Гц, 1 Н), 8,40 (дд, J=1,5 и 4,5 Гц, 1 Н), 8,65 (дд уш.,J=2,5 и 7,5 Гц, 1 Н), 8,96 (м уш., 1 Н), 9,31 (с уш., 1 Н), от 11,7 до 11,9 (м очень уш., 1 Н). ИК-спектр (KBr): 3456; 3382; 1717; 1659; 1600; 1543; 1442; 1340; 1312; 1193; 1167; 1118; 1069 и 774 см-1. Пример 3. 3-[4-(3-Фенилуреидо)фенил]-1 Н-индол-2-карбоксамид 3-[4-(3-Фенилуреидо)фенил]-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из фенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=371 [MH]+ Температура плавления=232-234 С Спектр 1 Н-ЯМР (400 МГц, ДМСО-d6,в м.д.): 6,43 (м уш., 1 Н), 6,98 (т уш., J=8,0 Гц, 1 Н), 7,05 (т уш., J=8,0 Гц, 1 Н), 7,23 (т уш., J=8,0 Гц, 1 Н), 7,29 (т уш., J=8,0 Гц, 2 Н), от 7,39 до 7,52 (м, 7 Н), 7,59 (д уш.,J=8,5 Гц, 2 Н), 8,72 (с уш., 1 Н), 8,80 (с уш., 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3460; 3384; 3325; 1654; 1596; 1540; 1499; 1312; 1231 и 747 см-1. Пример 4. 3-[4-(3-м-Толилуреидо)фенил]-1 Н-индол-2-карбоксамид 3-[4-(3-м-Толилуреидо)фенил]-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 3-метилфенилизоцианата. Его характеристики являются следующими Масс-спектр (ES+): m/z=385 [MH]+ Температура плавления=140-142 С Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 2,30 (с, 3 Н), 6,42 (м уш., 1 Н), 6,80 (д уш., J=8, 0 Гц,1 Н), 7,05 (т уш., J=8,0 Гц, 1 Н), от 7,13 до 7,30 (м, 3 Н), 7,32 (с уш., 1 Н), от 7,38 до 7,53 (м, 5 Н),7,59 (д уш.,J=8,5 Гц, 2 Н), 8,69 (с уш., 1 Н), 8,83 (с уш., 1 Н), 11,6 (с уш., 1 Н). 3-[4-(3-Трифторметилфенилуреидо)фенил]-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 3-трифторметилфенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=439 [MH]+ Температура плавления=156-158 С Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,45 (м уш., 1 Н), 7,05 (т уш., J=7,5 Гц, 1 Н), 7,23 (т уш., J=7, 5 Гц, 1 Н), 7,32 (д уш., J=8,5 Гц, 1 Н), 7,43 (д уш., J=8,5 Гц, 2 Н), от 7,38 до 7,64 (м, 5 Н), 7,61 (д уш., J=8,5 Гц, 2 Н), 8,04 (с уш., 1 Н), 8,97 (с уш., 1 Н), 9,15 (с уш., 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3462; 3378; 1654; 1590; 1542; 1448; 1337; 1312; 1230; 1125; 1070; 746 и 698 см-1. Пример 6. 3-[4-(3,5-Диметилфенилуреидо)фенил]-1 Н-индол-2-карбоксамид 3-[4-(3,5-Диметилфенилуреидо)фенил]-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 3,5-диметилфенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=399 [MH]+ Температура плавления=168-170 С Спектр 1H-ЯМР (400 МГц, ДМСО-d6,в м.д.): 2,24 (с, 6 Н), 6,43 (м уш., 1 Н), 6,62 (с уш., 1 Н), 7,05 (т уш., J=8,0 Гц, 1 Н), 7,10 (с уш., 2 Н), 7,23 (т уш., J=8,0 Гц, 1 Н), от 7,39 до 7,53 (м, 5 Н), 7,58 (д уш., J=8,5 Гц,2 Н), 8,60 (с уш., 1 Н), 8,82 (с уш., 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3459; 3375; 1654; 1586; 1541; 1310; 1215; 851 и 745 см-1. Пример 7. 3-[4-(2-Фторфенилуреидо)фенил]-1 Н-индол-2-карбоксамид 3-[4-(2-Фторфенилуреидо)фенил]-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 2-фторфенилизоцианата. Его характеристики являются следующими Масс-спектр (ES+): m/z=389 [MH]+ Температура плавления=146-148 С Спектр 1 Н-ЯМР (400 МГц, ДМСО-d6,в м.д.): 6,46 (м уш., 1 Н), от 6,98 до 7,08 (м, 2 Н), 7,15 (т уш.,J=8,0 Гц, 1 Н), от 7,20 до 7,28 (м, 2 Н), 7,43 (д уш., J=8,5 Гц, 2 Н), от 7,40 до 7,52 (м скрытый, 1 Н), 7,46 (д уш., J=8,0 Гц, 1 Н), 7,49 (м уш., 1 Н), 7,59 (д уш., J=8,5 Гц, 2 Н), 8,18 (т уш., J=8,0 Гц, 1 Н), 8,64 (с уш., 1 Н),9,24 (с уш., 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3457; 3374; 1651; 1596; 1540; 1455; 1313 и 747 см-1. Пример 8. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1-метил-1 Н-индол-2-карбоксамид 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1-метил-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 3-(4-нитрофенил)-1 Н-индол-2-карбоксамида (пример 1). 1-Метил-3-(4-нитрофенил)-1 Н-индол-2-карбоксамид. К раствору 0,3 г 3-(4-нитрофенил)-1 Н-индол-2-карбоксамида в 8 мл безводного диметилформамида в атмосфере аргона добавляют 0,047 г гидрида натрия, затем 73 мкл йодметана. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и добавляют 45 мл воды. После высушивания в вакууме получают 0,22 г 1-метил-3-(4-нитрофенил)-1 Н-индол-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=389 [MH+] Температура плавления: 146-148 С 1-Метил-3-(4-аминофенил)-1 Н-индол-2-карбоксамид. 0,2 г 1-метил-3-(4-нитрофенил)-1 Н-индол-2-карбоксамида и 0,14 г 10%-ного палладия-на-угле добавляют к 8 мл метанола и реакционную смесь гидрируют при давлении 5 бар в течение 4 ч 30 мин при температуре 20 С. Реакционную смесь затем фильтруют через тонкий слой силикагеля и фильтрат концентрируют при пониженном давлении с получением 0,91 г 1-метил-3-(4-аминофенил)-1 Н-индол-2 карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z= [MH+] Температура плавления: 96-98 С Спектр 1 Н-ЯМР (400 МГц, ДМСО-d6,в м.д.): 3,82 (с, 3 Н), 5,11 (с уш., 2 Н), 6,65 (д уш., J=8,0 Гц,2 Н), 7,08 (т уш., J=8,0 Гц, 1 Н), 7,15 (д уш., J=8,0 Гц, 2 Н), 7,21 (м уш., 1 Н), 7,25 (т уш., J=8,0 Гц, 1 Н), 7,50(д уш., J=8,0 Гц, 1 Н), 7,53 (д уш., J=8,0 Гц, 1 Н), 7,61 (м уш., 1 Н). 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1-метил-1 Н-индол-2-карбоксамид. К раствору 0,086 г 1-метил-3-(4-аминофенил)-1 Н-индол-2-карбоксамида в 18 мл тетрагидрофурана добавляют 0,075 г 2-фтор-5-трифторметилфенилизоцианата и перемешивание продолжают в течение 1 ч. Добавляют 5 мл метанола, реакционную смесь затем концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (20:80 по объемам), с получением 90 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 метил-1 Н-индол-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=471 [MH+] Температура плавления: 260 С Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 3,83 (с, 3 Н), 7,13 (т уш., J=8,0 Гц, 1 Н), 7,29 (т уш.,J=8,0 Гц, 1 Н), 7,39 (м, 1 Н), 7,45 (д уш., J=8,5 Гц, 2 Н), от 7,49 до 7,58 (м, 5 Н), 7,62 (д уш., J=8,0 Гц, 1 Н),7,71 (м уш., 1 Н), 8,65 (дд, J=2,5 и 7,5 Гц, 1 Н), 8,95 (м уш., 1 Н), 9,28 (м уш., 1 Н). ИК-спектр (KBr): 3477; 3351; 3308; 3281; 3181; 1712; 1650; 1600; 1537; 1442; 1310; 1116; 821 и 743 см-1. Пример 9. 3-4-[3-(3-Хлор-4-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид 3-4-[3-(3-Хлор-4-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 3-хлор-4-трифторметилфенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=473 [MH+] Температура плавления: 168-170 С Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,49 (м уш., 1 Н), 7,05 (т уш., J=8,0 Гц, 1 Н), 7,23 (т уш., J=8,0 Гц, 1 Н), от 7,40 до 7,54 (м, 6 Н), 7,60 (д уш., J=8,5 Гц, 2 Н), 7,75 (д, J=9,0 Гц, 1 Н), 7,95 (д, J=1,5 3-4-[3-(5-трет-Бутилизоксазол-3-ил)уреидо]фенил-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 5-трет-бутилизоксазол-3-изоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=418 [MH+] Температура плавления: 176-178 С Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 1,31 (с, 9 Н), 6,47 (м уш., 1 Н), 6,52 (с, 1 Н), 7,05 (т уш., J=8,0 Гц, 1 Н), 7,23 (т уш., J=8,0 Гц, 1 Н), от 7,39 до 7,52 (м, 5 Н), 7,58 (д уш., J=8,5 Гц, 2 Н), 8,94 (с уш.,1 Н), 9,52 (с уш. 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3461; 3275; 2968; 1695; 1653; 1607; 1539; 1280 и 745 см-1. Пример 11. 3-4-[3-(4-Трифторметоксифенил)уреидо]фенил-1 Н-индол-2-карбоксамид 3-4-[3-(4-Трифторметоксифенил)уреидо]фенил-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 4-трифторметоксифенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=455 [MH+] Температура плавления: 162-164 С Элементный анализ, %: С 60,92; Н 3,66; N 11,85 (теоретически рассчитано, %: С 60,79; Н 3,77; N 12,33). Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,44 (м уш., 1 Н); 7,05 (т уш., J=8,0 Гц, 1 Н); 7,23 (т уш., J=8,0 Гц, 1 Н); 7,30 (д уш., J=8,5 Гц, 2 Н); от 7,38 до 7,52 (м, 5 Н); 7,58 (м, 4 Н); 8,86 (с уш., 1 Н); 8,94 (с уш., 1 Н); 11,6 (с уш., 1 Н). Пример 12. 3-4-[3-(2-Метокси-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид 3-4-[3-(2-Метокси-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид получают согласно вышеописанному способу а, исходя из 2-метокси-5-триформетилфенилизоцианата. Его характеристики являются следующими. Масс-спектр (ES+): m/z=469[MH+] Температура плавления: 178-180 С Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 3,99 (с, 3 Н), 6,46 (м уш., 1 Н), 7,05 (т уш., J=8,0 Гц,1 Н), от 7,19 до 7,27 (м, 2 Н), 7,33 (дд, J=2,0 и 8,5 Гц, 1 Н), от 7,40 до 7,54 (м, 5 Н), 7,60 (д уш., J=8,5 Гц, 2 Н),8,56 (с уш., 1 Н), 8,59 (д, J=2,0 Гц, 1 Н), 9,55 (с уш., 1 Н), 11,6 (м уш., 1 Н). ИК-спектр (KBr): 3463; 3342; 1655; 1593; 1540; 1447; 1269; 1134 и 746 см-1. К раствору 100 мг 3-(4-аминофенил)-1 Н-индол-2-карбоксамида (пример 1) в 12 мл пиридина при температуре 0 С добавляют по каплям 162 мг 2-фтор-5-трифторметилфенилсульфонилхлорида в 6 мл пиридина. Смесь перемешивают при комнатной температуре в течение 6 ч, затем выливают в 50 мл смеси вода/лед, выпавший осадок отфильтровывают. После очистки флэш-хроматографией на колонке с диоксидом кремния, элюируя смесью циклогексана и этилацетата (20:80 по объемам), получают 50 мг 3[4-(2-фтор-5-трифторметилбензолсульфониламино)фенил]-1 Н-индол-2-карбоксамида,характеристики которого являются следующими. Масс-спектр (ES+): m/z=478 [MH+] Температура плавления: 176-178 С Элементный анализ, %: С 55,11; Н 3,47; N 8,34 (теоретически рассчитано, %: С 55,35; Н 3,17; N 8,80). Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,50 (м уш., 1 Н), 7,02 (т уш., J=8,0 Гц, 1 Н), от 7,18 до 7,25 (м, 3 Н), 7,31 (д уш., J=8,0 Гц, 1 Н), от 7,35 до 7,50 (м, 4 Н), 7,72 (т уш., J=8,0 Гц, 1 Н), от 8,07 до 8,18 3-[4-(2,3-Дихлорбензолсульфониламино)фенил]-1 Н-индол-2-карбоксамид получают по методике примера 13, исходя из 3,4-дихлорфенилсульфонилхлорида. Его характеристики являются следующими. Масс-спектр (ES+): m/z=460 [MH+] Температура плавления: 260 С Спектр 1H-ЯМР (300 МГц, ДМСО-d6,в м.д.): 6,54 (м уш., 1 Н), 7,02 (т уш., J=8,0 Гц, 1 Н), от 7,17 до 7,25 (м, 3 Н), от 7,31 до 7,50 (м, 5 Н), 7,58 (т, J=8,0 Гц, 1 Н), 7,95 (дд, J=2,5 и 8,0 Гц, 1 Н), 8,10 (дд, J=2,5 и 8,0 Гц, 1 Н), 10,9 (м уш., 1 Н), 11,6 (с уш., 1 Н). ИК-спектр (KBr): 3476; 3422; 3389; 3358; 1670; 1651; 1583; 1540; 1404; 1343; 1166; 935; 748 и 596 см-1. Пример 15. 3-4-[3-(5-трет-Бутил-2-п-толил-2 Н-пиразол-3-ил)уреидо]фенил-1 Н-индол-2-карбоксамид К раствору 100 мг 3-(4-аминофенил)-1 Н-индол-2-карбоксамида (пример 1) в 18 мл тетрагидрофурана добавляют при температуре 0 С, 43 мг трифосгена, затем 110 мкл триэтиламина. Смесь перемешивают в течение 1 ч при комнатной температуре, затем добавляют 110 мг 5-трет-бутил-2-п-толил-2 Н- 16012613 пиразол-3-иламина. Смесь перемешивают в течение 1 ч, концентрируют при пониженном давлении и остаток порошкуют при использовании 2 мл этилацетата с получением твердого вещества белого цвета. После отфильтровывания и высушивания получают 150 мг 3-4-[3-(5-трет-бутил-2-п-толил-2 Н-пиразол 3-ил)уреидо]фенил-1 Н-индол-2-карбоксамида, характеристики которого являются следующими. Масс-спектр (ES+): m/z=507 [MH+] Температура плавления: 260 С Спектр 1 Н-ЯМР (300 МГц, ДМСО-d6,в м.д.): 1,29 (с, 9 Н), 2,39 (с, 3 Н), 6,38 (с, 1 Н), 6,41 (м уш.,1 Н), 7,05 (т уш., J=7,5 Гц, 1 Н), 7,22 (т уш., J=7,5 Гц, 1 Н), 7,35 (д уш., J=8,5 Гц, 2 Н), от 7,37 до 7,48 (м, 7 Н),7,54 (д уш., J=8,5 Гц, 2 Н), 8,37 (с уш., 1 Н), 9,13 (с уш., 1 Н), 11,65 (с уш., 1 Н). ИК-спектр (KBr): 3457; 3374; 1651; 1596; 1540; 1455; 1313; 1246; 1181; 854 и 747 см-1. Пример 16. 3-4-[3-(2-Фтор-5-метилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид К 0,2 г (0,796 ммоль) 3-(4-аминофенил)-1 Н-индол-2-карбоксамида в виде раствора в 10 см 3 тетрагидрофурана, при температуре около 20 С и в атмосфере аргона, добавляют 0,115 см 3 (0,876 ммоль) 2 фтор-5-метилфенилизоцианата. После перемешивания в течение 18 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 400 мг остатка, который очищают флэш-хроматографией [элюент: этилацетат/циклогексан (7:3 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 250 мг остатка желтого цвета, который перемешивают в 10 см 3 дихлорметана, затем отфильтровывают и высушивают при пониженном давлении (2,7 кПа), получая 180 мг 3-4-[3-(2-фтор-5-метилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида в виде твердого вещества бежевого цвета, плавящегося при температуре 220 С. Спектр 1H-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 2,28 (с, 3 Н),6,46 (с уш., 1 Н), 6,81 (м, 1 Н), 7,06 (т уш., J=8 Гц 1 Н), 7,11 (т уш., J=10 Гц, 1 Н), 7,23 (т уш., J=8 Гц, 1 Н), от 7,36 до 7,53 (м, 5 Н), 7,59 (д, J=9 Гц,2 Н), 8,02 (д уш., J=8 Гц, 1 Н), 8,55 (с уш., 1 Н), 9,21 (с, 1 Н), 11,61 (с, 1 Н). Масс-спектр (ES+): m/z=403(+)=(М+Н)(+) Масс-спектр (ES-): m/z=401(-)=(М-Н)(-) Пример 17. 3-4-[3-(5-Диметиламино-2-фторфенил)уреидо]фенил-1 Н-индол-2-карбоксамид К 0,2 г (0,796 ммоль) 3-(4-аминофенил)-1 Н-индол-2-карбоксамида, при температуре около 20 С и в атмосфере аргона, добавляют 18 см 3 (2,52 ммоль) 0,14 н раствора 5-диметиламино-2 фторфенилизоцианата в тетрагидрофуране, затем 0,1 см 3 (0,796 ммоль) триэтиламина. После перемешивания в течение 18 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа) с получением 0,7 г масла каштанового цвета, которое очищают флэшхроматографией [элюент: этилацетат/циклогексан (7:3 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 220 мг остатка желтого цвета,который перемешивают в 10 см 3 диэтилового эфира, затем отфильтровывают и высушивают при пониженном давлении (2,7 кПа) с получением 200 мг 3-4-[3-(5-диметиламино-2-фторфенил)уреидо]фенил 1 Н-индол-2-карбоксамида в виде твердого вещества бежевого цвета, плавящегося при температуре 180220 С. Спектр 1H-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 2,86 (с, 6 Н), 6,32 (дт, J=3 и 9 Гц, 1 Н), 6,43 (с очень- 17012613 уш., 1 Н), от 7,00 до 7,08 (м, 2 Н), 7,23 (т, J=7 Гц, 1 Н), от 7,38 до 7,54 (м, 5 Н), 7,59 (д, J=9 Гц, 2 Н), 7,68 (дд,J=3 и 7 Гц, 1 Н), 8,45 (с уш., 1 Н), 9, 19 (с, 1 Н), 11,6 (с, 1 Н). Масс-спектр (ES+): m/z=432(+)=(М+Н)(+) 0,14 н Раствор 5-диметиламино-2-фторфенилизоцианата в тетрагидрофуране получают следующим образом. К 2,82 г (9,5 ммоль) трифосгена в виде раствора в 150 см 3 дихлорметана при температуре около 5 С и в атмосфере аргона добавляют 1,09 г (7,1 ммоль) 4-фтор-N1,N1-диметилбензол-1,3-диамина, затем 4,6 см 3 пиридина. После перемешивания в течение 18 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который порошкуют при использовании 40 см 3 тетрагидрофурана. После отфильтровывания получают приблизительно 0,14 н раствор 5-диметиламино-2-фторфенилизоцианата в тетрагидрофуране, который прямо вводят на следующую стадию. 4-Фтор-N1,N1-диметилбензол-1,3-диамин может быть получен следующим образом. К суспензии 0,6 г (5,63 ммоль) 10%-ного палладия-на-угле в 100 см 3 метанола, при температуре около 20 С, добавляют 3,23 г (17,54 ммоль) (4-фтор-3-нитрофенил)диметиламина. После гидрирования в течение 30 мин в автоклаве при давлении водорода 5 бар и при температуре около 25 С реакционную смесь отфильтровывают, катализатор промывают 3 раза по 10 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) с получением 2,7 г 4-фтор-Nl,Nl-диметилбензол-1,3 диамина в виде масла каштанового цвета. Масс-спектр (ионизация электронным ударом, EI):(4-Фтор-3-нитрофенил)диметиламин может быть получен следующим образом. К 5 г (32 ммоль) 4-фтор-3-нитроанилина в виде раствора в 50 см 3 диметилформамида, при температуре около 20 С и в атмосфере аргона, добавляют 13,27 г (96 ммоль) карбоната калия, затем при температуре около 5 С добавляют 4,6 см 3 (73,6 ммоль) йодметана. После перемешивания в течение 63 ч при температуре около 20 С реакционную смесь выливают в 100 см 3 воды, затем экстрагируют 3 раза по 100 см 3 дихлорметана. Органические фазы объединяют, промывают 3 раза по 100 см 3 воды, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 5,5 г остатка, который очищают флэш-хроматографией [элюент: этилацетат/циклогексан(2:8 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 2,78 г (4-фтор-3-нитрофенил)диметиламина в виде твердого вещества оранжевокрасного цвета. Масс-спектр (ES+): m/z=185(+)=(М+Н)(+). Пример 18. 3-4-[3-(3-Диметиламинофенил)уреидо]фенил-1 Н-индол-2-карбоксамид К 0,1 г (0,4 ммоль) 3-(4-аминофенил)-1 Н-индол-2-карбоксамида при температуре около 20 С и в атмосфере аргона добавляют 8,5 см 3 (0,8 ммоль) 0,14 н раствора 3-диметиламинофенилизоцианата в тетрагидрофуране, затем 0,055 см 3 (0,4 ммоль) триэтиламина. После перемешивания в течение 18 ч при температуре около 20 С добавляют 0,1 см 3 воды, затем реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,7 г остатка, который очищают флэш-хроматографией [элюент: дихлорметан/метанол (95:5 по объемам)]. После концентрирования при пониженном давлении фракций,содержащих ожидаемый продукт, получают 81 мг 3-4-[3-(3-диметиламинофенил)уреидо]фенил-1 Ниндол-2-карбоксамида в виде твердого вещества белого цвета, плавящегося при температуре в интервале от 160 до 220 С. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 2,89 (с, 6 Н), 6,38 (д, J=9 Гц, 1 Н), 6,42 (с уш., 1 Н),6,74 (д, J=9 Гц, 1 Н), 6,94 (с уш., 1 Н), от 7,00 до 7,12 (м, 2 Н), 7,23 (т, J=7 Гц, 1 Н), 7,40 (д, J=8 Гц, 2 Н), 7,43(д частично скрытый, J=8 Гц, 1 Н), 7,46 (д, J=8 Гц, 1 Н), 7,49 (с уш., 1 Н), 7,58 (д, J=8 Гц, 2 Н), 8,56 (с, 1 Н),8,72 (с, 1 Н), 11,60 (с, 1 Н). Масс-спектр (ES+): m/z=414(+)=(М+Н)(+). 0,14 н Раствор 3-диметиламинофенилизоцианата в тетрагидрофуране получают следующим обра- 18012613 зом. К 2,82 г (9,5 ммоль) трифосгена в виде раствора в 150 см 3 дихлорметана при температуре около 5 С и в атмосфере аргона добавляют 1,46 г (7 ммоль) N1,N1-диметилбензол-1,3-диаминдигидрохлорида, затем 9,9 см 3 (71,64 ммоль) триэтиламина. После перемешивания в течение 20 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток,который порошкуют при использовании 50 см 3 тетрагидрофурана. После отфильтровывания, получают приблизительно 0,14 н раствор 3-диметиламинофенилизоцианата в тетрагидрофуране, который прямо вводят на следующую стадию. Пример 19. 3-4-[3-(2-Пирролидин-1-илметил-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2 карбоксамид К 0,05 г (0,2 ммоль) 4-(4-аминофенил)-1 Н-пиррол-3-карбоксамида в виде раствора в 10 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона, 19,7 мг (0,066 ммоль) трифосгена, затем 0,056 см 3 (0,4 ммоль) триэтиламина. После перемешивания в течение 1 ч при температуре около 20 С, добавляют 48,61 мг (0,2 ммоль) 2-пирролидин-1-илметил-5-трифторметилфениламина в виде раствора в 2 см 3 тетрагидрофурана. После перемешивания в течение 3 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,15 г остатка,который очищают флэш-хроматографией [элюент:дихлорметан/метанол (95:5 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 45 мг 34-[3-(2-пирролидин-1-илметил-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида в виде твердого вещества бежевого цвета, плавящегося при температуре в интервале от 190 до 250 С. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 1,74 (м, 4 Н), 2,50 (м частично скрытый, 4 Н), 3,73(с, 2 Н), 6,52 (с уш., 1 Н),7,05 (т, J=7 Гц, 1 Н), 7,23 (т, J=7 Гц, 1 Н), 7,31 (д, J=8 Гц, 1 Н), от 7,40 до 7,52 (м,6 Н), 7,63 (д, J=8 Гц, 2 Н), 8,37 (с, 1 Н), 9,63 (с, 1 Н), 9,86 (с, 1 Н), 11,68 (с уш., 1 Н). Масс-спектр (ES+): m/z=521(+)=(М+Н)(+). 2-Пирролидин-1-илметил-5-трифторметилфениламин может быть получен следующим образом. К суспензии 0,05 г (0,47 ммоль) 10%-ного палладия-на-угле в 25 см 3 метанола при температуре около 25 С добавляют 0,44 г (1,604 ммоль) 1-(2-нитро-4-трифторметилбензил)пирролидина. После гидрирования в течение 3 ч в автоклаве при давлении водорода 5 бар и при температуре около 25 С реакционную смесь отфильтровывают, катализатор промывают 3 раза по 5 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,4 г 2-пирролидин-1 илметил-5-трифторметилфениламина в виде масла оранжевого цвета. Масс-спектр (ES+): m/z=245(+)=(М+Н)(+). 1-(2-Нитро-4-трифторметилбензил)пирролидин может быть получен следующим образом. К 0,5 г (2,087 ммоль) 1-хлорметил-2-нитро-4-трифторметилбензола в виде раствора в 20 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона добавляют 0,35 см 3 (4,174 ммоль) пирролидина. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь разбавляют с помощью 250 см 3 дихлорметана, промывают 3 раза по 200 см 3 воды, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 458 мг 1-(2-нитро-4-трифторметилбензил)пирролидина в виде масла. Масс-спектр (E1): m/z=274(+)=(М)(+); 257(+)=(М-ОН)(+); 226(+)=(M-H2NO2)(+); 70(+)=(C4H8N)(+). Пример 20. 3-4-[3-(2-Метоксиметил-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2 карбоксамид К 134 мг (0,536 ммоль) 4-(4-аминофенил)-1H-пиррол-3-карбоксамида в виде раствора в 20 см 3 тетрагидрофурана при температуре около 20 С и в атмосфере аргона добавляют 52,5 мг (0,177 ммоль) трифосгена, затем 0,15 см 3 (1,072 ммоль) триэтиламина. После перемешивания в течение 1 ч при температуре около 20 С добавляют 110 мг (0,536 ммоль) 2-метоксиметил-5-трифторметилфениламина в виде раствора в 2 см 3 тетрагидрофурана. После перемешивания в течение 3 ч при температуре около 20 С добавляют 1 см 3 воды, затем реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа),получая 0,4 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент:этилацетат/циклогексан (7:3 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 20 мг 3-4-[3-(2-метоксиметил-5 трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида в виде твердого вещества бежевого цвета,плавящегося при температуре в интервале от 170 до 220 С. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 3,38 (с частично скрытый, 3 Н), 4,58 (с, 2 Н), 6,46(с уш., 1 Н), 7,05 (т, J=7 Гц, 1 Н), 7,23 (т, J=7 Гц, 1 Н), от 7,32 до 7,51 (м, 6 Н), 7,56 (д, J=7 Гц, 1 Н), 7,64 (д,J=9 Гц, 2 Н), 8,32 (с уш., 1 Н), 8,77 (с очень уш., 1 Н), 9,96 (с очень уш., 1 Н), 11,63 (с очень уш., 1 Н). Масс-спектр (ES+): m/z=482(+)=(М+Н)(+). 2-Метоксиметил-5-трифторметилфениламин может быть получен следующим образом. К суспензии 0,02 г (0,188 ммоль) 10%-ного палладия-на-угле в 20 см 3 метанола при температуре около 25 С добавляют 0,15 г (0,638 ммоль) 1-метоксиметил-2-нитро-4-трифторметилбензола. После гидрирования в течение 3 ч в автоклаве при давлении водорода 1 бар и при температуре около 25 С реакционную смесь отфильтровывают, катализатор промывают 3 раза по 5 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,12 г 2-метоксиметил-5 трифторметилфениламина в виде масла желтого цвета. Масс-спектр (ES+) : m/z=206(+)=(М+Н)(+); 174(+)=(М-СН 3 О)(+). 1-Метоксиметил-2-нитро-4-трифторметилбензол может быть получен следующим образом. К 0,222 г (1 ммоль) (2-нитро-4-трифторметилфенил)метанола в виде раствора в 10 см 3 дихлорметана при температуре около 20 С и в атмосфере аргона добавляют 0,65 см 3 (10 ммоль) йодметана, затем 1,163 г (5 ммоль) оксида серебра и 0,07 см 3 воды. После перемешивания в течение 18 ч при температуре около 20 С в отсутствие света реакционную смесь фильтруют через Celite. Celite промывают с помощью 10 см 3 дихлорметана. Фильтрат затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток растворяют в 10 см 3 дихлорметана, добавляют при температуре около 20 С и в атмосфере аргона 0,65 см 3 (10 ммоль) йодметана, затем 1,163 г (5 ммоль) оксида серебра и 0,07 см 3 воды. После перемешивания в течение 60 ч при температуре около 20 С в отсутствие света реакционную смесь фильтруют через Celite . Celite промывают с помощью 10 см 3 дихлорметана. Фильтрат затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток очищают флэш-хроматографией [элюент: дихлорметан]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 157 мг 1-метоксиметил-2-нитро-4-трифторметилбензола в виде масла. Спектр 1H-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 3,40 (с, 3 Н), 4,83 (с, 2 Н), 7,96 (д, J=8 Гц, 1 Н), 8,16(2-Нитро-4-трифторметилфенил)метанол может быть получен следующим образом. К 0,5 г (1,9 ммоль) 2-нитро-4-трифторметилбензилацетата в виде раствора в 50 см 3 метанола добавляют при температуре около 20 С 1,9 см 3 (1,9 ммоль) 1 М водного раствора гидроксида натрия. После перемешивания в течение 2 ч при температуре около 20 С добавляют 20 см 3 водного насыщенного раствора фосфата натрия, затем экстрагируют 3 раза по 50 см 3 дихлорметана. Органические фазы объединяют, промывают с помощью 50 см 3 водного насыщенного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа),получая 0,424 г (2-нитро-4-трифторметилфенил)метанола в виде масла. Масс-спектр (ES-): m/z=220(-)=(М-Н)(-). 2-Нитро-4-трифторметилбензилацетат может быть получен следующим образом. К 20 г (244 ммоль) ацетата натрия в виде раствора в 100 см 3 уксусной кислоты добавляют при тем- 20012613 пературе около 20 С и в атмосфере аргона 2 г (8,348 ммоль) 1-хлорметил-2-нитро-4-трифторметилбензола. После перемешивания в течение 60 ч при температуре около 100 С реакционную смесь разбавляют с помощью 200 см 3 воды, затем экстрагируют 2 раза по 300 см 3 дихлорметана. Органические фазы объединяют, промывают с помощью 100 см 3 воды, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,15 г 2-нитро-4 трифторметилбензилацетата в виде масла оранжевого цвета. Масс-спектр (химическая ионизация, CI): К 0,1 г (0,218 ммоль) 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2b]пиридин-2-карбоксамида в виде раствора в 4 см 3 хлороформа добавляют при температуре около 0 С и в атмосфере аргона 109,5 мг (0,444 ммоль) 3-хлорпероксибензойной кислоты в виде раствора в 6 см 3 дихлорметана. После перемешивания в течение 1 ч при температуре около 0 С, затем в течение 24 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа),получая 87 мг остатка, который очищают флэш-хроматографией [элюент:дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования при пониженном давлении фракций,содержащих ожидаемый продукт, получают 65 мг твердого вещества желтого цвета, которое порошкуют при использовании 4 см 3 циклогексана. После отфильтровывания и высушивания при пониженном давлении (2,7 кПа) при температуре около 30 С получают 57 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-4-окси-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида в виде твердого вещества белого цвета, плавящегося при температуре около 283 С. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 6,12 (с уш., 1 Н), 7,17 (дд, J=9 и 6 Гц, 1 Н), от 7,35 до 7,55 (м, 3 Н), 7,37 (д, J=9 Гц, 1 Н), 7,43 (д, J=9 Гц, 1 Н), 7,49 (д, J=9 Гц, 2 Н), 7,69 (с уш., 1 Н), 7,96 (д, J=6 Гц, 1 Н), 8,64 (д уш., J=6 Гц, 1 Н), 9,03 (с, 1 Н), 9,38 (с, 1 Н),12,37 (с уш., 1 Н). Масс-спектр (ES+): m/z=474(+)=(М+Н)(+). Пример 22. 3-4-[3-(2-Метокси-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2-b]пиридин 2-карбоксамид К 0,2 г (0,7 93 ммоль) 3-(4-аминофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида в виде раствора в 18 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 82,4 мг (0,278 ммоль) трифосгена, затем 0,223 см 3 триэтиламина. После перемешивания в течение 1 ч при температуре около 20 С, добавляют 182 мг (0,952 ммоль) 2-метокси-5-трифторметилфениламина в виде раствора в 17 см 3 тетрагидрофурана. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который очищают флэш-хроматографией [элюент:дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 109 мг 34-[3-(2-метокси-5-трифторметилфенил)уреидо]фенил-1 Н-пирроло[3,2-b]пиридин-2-карбоксамида в виде твердого вещества желтого цвета, плавящегося при температуре около 194 С. Спектр 1H-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 3,99 (с, 3 Н), 6,97 (с уш., 1 Н), от 7,18 до 7,27 (м,- 21012613 2 Н), 7,33 (дд, J=9 и 1 Гц, 1 Н), 7,56 (д, J=9 Гц, 2 Н), 7,63 (д, J=9 Гц, 2 Н), 7,66 (с очень уш., 1 Н), 7,81 (дд, J=8 и 1,5 Гц, 1 Н), 8,40 (дд, J=4,5 и 1,5 Гц, 1 Н), 8,58 (м, 2 Н), 9,56 (с, 1 Н), 11,88 (с очень уш., 1 Н). Масс-спектр (ES+): m/z=470(+)=(М+Н)(+). 3-(4-Аминофенил)-1 Н-пирроло[3,2-b]пиридин-2-карбоксамид получают как описывается в примере 2. Пример 23. 3-4-[3-(2-Фтор-5-триформетилфенил)уреидо]фенил-6-(2-метоксиэтокси)-1 Н-индол-2 карбоксамид К раствору 79 мг (0,24 ммоль)3-(4-аминофенил)-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксамида в 6 мл тетрагидрофурана добавляют в атмосфере аргона и при комнатной температуре 40 мкл (0,28 ммоль) 2-фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 22 ч при комнатной температуре и в атмосфере аргона реакционную смесь концентрируют досуха при пониженном давлении. Полученный продукт обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (96:4 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 78 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-6-(2-метоксиэтокси)-1H-индол-2-карбоксамида в виде твердого вещества белого цвета. Спектр 1H-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 3,32 (с, частично скрытый, 3 Н), 3,69 (м, 2 Н), 4,09(м, 2 Н), 6,31 (м уш., 1 Н), 6,72 (дд, J=2,5 и 9,0 Гц, 1 Н), 6,91 (д, J=9,0 Гц, 1 Н), 7,28 (д, J=9,0 Гц, 1 Н), от 7,32 до 7,45 (м уш., 1 Н), 7,39 (м, 1 Н), 7,42 (д уш., J=8,5 Гц, 2 Н), 7,51 (дд, J=9,0 и 11 Гц, 1 Н), 7,59 (д уш., J=8,5 Гц, 2 Н), 8,64 (дд, J=2,0 и 7,5 Гц, 1 Н), 8,98 (с уш., 1 Н), 9,34 (с уш., 1 Н), 11,4 (с, 1 Н). Масс-спектр (ES): m/z=531 (MH+); m/z=514 (MH+-NH3) пик молекулярного иона. 3-(4-Аминофенил)-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксамид может быть получен следующим образом. 8 мл 7 н раствора аммиака в метаноле и 4 мл 28%-ного раствора аммиака в воде добавляют к 80 мг(0,24 ммоль) метил-3-(4-аминофенил)-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилата и реакционную среду нагревают при температуре 100 С в течение 16 ч в герметически закрытой стеклянной пробирке. Затем добавляют 2 мл 28%-ного раствора аммиака в воде и реакционную смесь нагревают при температуре 100 С в течение 24 ч. Реакционную среду выпаривают досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (98:2, затем 95:5 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 40 мг 3-(4-аминофенил)-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Масс-спектр (EI): m/z=325 (M+) пик молекулярного иона; m/z=308 (M-NH3)+; m/z=249 (m/z=308C3H7O)+; m/z=221 (m/z=249-CO)+; m/z=59 (C3H7O+). Метил-3-(4-аминофенил)-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. 0,321 мл (2,29 ммоль) триэтиламина при комнатной температуре добавляют к 396 мг (2,29 ммоль) гидрохлорида (4-аминофенил)бороновой кислоты в смеси метанола и толуола (30 мл/25 мл). Смесь перемешивают при комнатной температуре в течение 15 мин, затем при комнатной температуре добавляют 300 мг (0,91 ммоль) метил-3-бром-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилата, после чего добавляют раствор 242 мг (2,28 ммоль) карбоната натрия в 5 мл воды. Добавляют при комнатной температуре и в атмосфере аргона 108 мг (2,55 ммоль) хлорида лития, затем 74 мг (0,06 ммоль) тетракис(трифенилфосфин)-палладия. Реакционную смесь кипятят с обратным холодильником в течение 4 ч 30 мин в атмосфере аргона и выдерживают при комнатной температуре в течение 16 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают этилацета- 22012613 том, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэшхроматографией [элюент: дихлорметан/метанол (99:1 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 219 мг метил-3-(4-аминофенил)6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилата в виде твердого вещества бледно-желтого цвета. Масс-спектр (EI): m/z=340 (M+-) пик молекулярного иона; m/z=308 (M-CH3OH)+; m/z=281 (MC2H3O2)+; m/z=221 (m/z=281-C3H8O)+; m/z=59 (C3H7O+). Метил-3-бром-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. Раствор 104 мг (0,42 ммоль) метил-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилата в 3 мл диметилформамида охлаждают до температуры -40 С на бане со смесью ацетона и твердого диоксида углерода,затем при температуре -40 С добавляют раствор 74 мг (0,41 ммоль) N-бромсукцинимида в 1 мл диметилформамида. Раствор перемешивают при температуре в интервале от -45 до -30 С в течение 30 мин,после чего при температуре -40 С добавляют раствор 30 мг (0,17 ммоль)N-бромсукцинимида в 1 мл диметилформамида. Раствор перемешивают при температуре в интервале от -45 до -30 С в течение 1 ч. Раствор разбавляют этилацетатом, температуру повышают до комнатной, затем органическую фазу промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: этилацетат/циклогексан (1:2 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 92 мг метил-3-бром-6-(2-метоксиэтокси)-1 Н-индол-2 карбоксилата в виде твердого вещества белого цвета. Масс-спектр (EI): m/z=327 (M+-); m/z=269 (М-С 2 Н 2 О 2)+; m/z=237 (m/z=269-CH3OH)+; m/z=59(С 3 Н 7 О+); m/z=45 (C2H5O+) пик молекулярного иона. Метил-6-(2-метоксиэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. 4,915 мл (52,30 ммоль) 2-бромэтилметилового эфира добавляют при комнатной температуре к суспензии 2 г (10,46 ммоль) метил-6-гидрокси-1 Н-индол-2-карбоксилата, 8,68 г (52,30 ммоль) йодида калия и 7,23 г (52,30 ммоль) карбоната калия в 150 мл ацетона. Реакционную среду кипятят с обратным холодильником в течение 22 ч. Реакционную смесь возвращают к комнатной температуре, затем добавляют этилацетат. Органическую фазу промывают водой, затем сушат над безводным сульфатом магния,фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают флэшхроматографией [элюент: ацетон/циклогексан (1:6 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 630 мг метил-6-(2-метоксиэтокси)1 Н-индол-2-карбоксилата в виде твердого вещества желтого цвета. Масс-спектр (EI): m/z=249 (M+) пик молекулярного иона; m/z=191 (M-C2H2O2)+; m/z=159 (m/z=191CH3OH)+. Метил-6-гидрокси-1 Н-индол-2-карбоксилат может быть получен следующим образом. 0,144 мл (2,70 ммоль) концентрированной серной кислоты добавляют при комнатной температуре к раствору 5,98 г (33,75 ммоль) 6-гидрокси-1 Н-индол-2-карбоновой кислоты в 350 мл метанола. Смесь кипятят с обратным холодильником в течение 9 дней, затем реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают водой, подщелачивают до рН=9 с помощью 38%-ного раствора гидроксида калия, затем продукт 6 раз экстрагируют этилацетатом. Органические фазы объединяют, затем сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении, получая 5,81 г метил-6-гидрокси-1 Н-индол-2-карбоксилата в виде твердого вещества каштанового цвета. Масс-спектр (EI): m/z=191 (M+) пик молекулярного иона; m/z=159 (M-CH3OH)+; m/z=131 (m/z=159+CO) . 6-Гидрокси-1 Н-индол-2-карбоновая кислота может быть получена следующим образом. 146 мл (146 ммоль) 1 М раствора трибромида бора в дихлорметане медленно добавляют при температуре 0 С к раствору 10 г (48,73 ммоль) метил-6-метокси-2-индолкарбоксилата в 500 мл дихлорметана. Реакционную среду перемешивают при температуре 0 С в течение 1 ч и при комнатной температуре в течение 2 ч. Реакционную среду охлаждают до температуры 0 С и при температуре 0 С медленно добавляют 100 мл (100 ммоль) 1 М раствора трибромида бора в дихлорметане. Реакционную смесь перемешивают при температуре 0 С в течение 1 ч и при комнатной температуре в течение 16 ч. Затем реакционную среду охлаждают до температуры около 0 С и при перемешивании медленно добавляют 1 н раствор соляной кислоты (247 мл). Полученную смесь фильтруют через фильтр из пористого стекла. Органическую фазу (дихлорметан) отделяют от фильтрата, затем водную фазу подкисляют с помощью 5 н соляной кислоты и экстрагируют этилацетатом. Органическую фазу (этилацетат) сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении, получая 6,39 г 6 гидрокси-1 Н-индол-2-карбоновой кислоты в виде твердого вещества каштанового цвета. Масс-спектр (ES): m/z=176 (M-H)- пик молекулярного иона. Пример 24. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-(2-пирролидин-1-илэтокси)- 23012613 1 Н-индол-2-карбоксамид К раствору 45 мг (0,12 ммоль) 3-(4-аминофенил)-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2 карбоксамида в 6 мл тетрагидрофурана добавляют в атмосфере аргона и при комнатной температуре 17 мкл (0,12 ммоль) 2-фтор-5-трифторметилфенил-изоцианата. После перемешивания в течение 22 ч при комнатной температуре и в атмосфере аргона реакционную смесь обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент:дихлорметан/метанол (70:30 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 32 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Спектр 1 Н-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 1,69 (м, 4 Н), 2,54 (м, 4 Н), 2,81 (т, J=6,0 Гц, 2 Н),4,08 (т, J=6, 0 Гц, 2 Н), 6,30 (м уш., 1 Н), 6,72 (дд, J=2,5 и 9,0 Гц, 1 Н), 6,91 (д, J=2,5 Гц, 1 Н), 7,27 (д, J=9,0 Гц, 1 Н), от 7,32 до 7,48 (м уш., 1 Н), 7,39 (м, 1H), 7,42 (д уш., J=8,5 Гц, 2 Н), 7,51 (дд, J=9,0 и 11,0 Гц, 1 Н),7,60 (д уш., J=8,5 Гц, 2 Н), 8,65 (дд, J=2,5 и 7,5 Гц, 1 Н), 8,99 (д, J=2,5 Гц, 1 Н), 9,36 (с, 1 Н), 11,4 (с, 1 Н). Масс-спектр (ES): m/z=570 (MH+) пик молекулярного иона. 3-(4-Аминофенил)-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксамид может быть получен следующим образом. 8 мл 7 н раствора аммиака в метаноле и 4 мл 28%-ного раствора аммиака в воде добавляют к 133 мг(0,35 ммоль) метил-3-(4-аминофенил)-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилата и реакционную среду нагревают при температуре 100 С в течение 16 ч в герметически закрытой стеклянной пробирке. Затем добавляют 2 мл 28%-ного раствора аммиака в воде и реакционную смесь нагревают при температуре 100 С в течение 24 ч. Реакционную среду выпаривают досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: этилацетат/метанол (70:30 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 25 мг 3-(4-аминофенил)-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксамида в виде твердого вещества бледно-желтого цвета. Масс-спектр (EI): m/z=365 (MH+) пик молекулярного иона. Метил-3-(4-аминофенил)-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. 0,22 3 мл (1,59 ммоль) триэтиламина добавляют при комнатной температуре к 275 мг (1,59 ммоль) гидрохлорида (4-аминофенил)бороновой кислоты в смеси метанола и толуола (30 мл/25 мл). Смесь перемешивают при комнатной температуре в течение 15 мин, затем при комнатной температуре добавляют 222 мг (0,60 ммоль) метил-3-бром-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилата, после чего добавляют раствор 168 мг (1,58 ммоль) карбоната натрия в 5 мл воды. Добавляют при комнатной температуре и в атмосфере аргона 75 мг (1,77 ммоль) хлорида лития, затем 51 мг (0,04 ммоль) тетракис(трифенилфосфин)палладия. Реакционную смесь кипятят с обратным холодильником в течение 5 ч в атмосфере аргона и выдерживают при комнатной температуре в течение 16 ч. Реакционную смесь концентрируют досуха при пониженном давлении. Полученный остаток обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией[элюент: дихлорметан/метанол (98:2 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 252 мг метил-3-(4-аминофенил)-6-(2-пирролидин- 24012613 1-илэтокси)-1 Н-индол-2-карбоксилата в виде твердого вещества оранжевого цвета. Масс-спектр (EI): m/z=379 (М+-); m/z=84 (C5H10N+) пик молекулярного иона. Метил-3-бром-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. Раствор 495 мг (1,72 ммоль) метил-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилата в 11 мл диметилформамида охлаждают до температуры -40 С на бане со смесью ацетона и твердого диоксида углерода, затем при температуре -40 С по каплям добавляют раствор 306 мг (1,72 ммоль)Nбромсукцинимида в 6 мл диметилформамида. Раствор перемешивают при температуре -40 С и медленно доводят до комнатной температуры в течение 5 ч. Полученный остаток обрабатывают этилацетатом, затем промывают водой, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (90:10 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 263 мг метил-3-бром-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2 карбоксилата в виде твердого вещества серого цвета. Масс-спектр (ES): m/z=367 (MH+) пик молекулярного иона. Метил-6-(2-пирролидин-1-илэтокси)-1 Н-индол-2-карбоксилат может быть получен следующим образом. В токе аргона и при комнатной температуре, 2,20 г (8,37 ммоль) трифенилфосфина добавляют к раствору 800 мг (4,18 ммоль) метил-6-гидрокси-1 Н-индол-2-карбоксилата в 60 мл тетрагидрофурана. Затем при комнатной температуре к реакционной среде добавляют 0,979 мл (8,37 ммоль) 1-(2 гидроксиэтил)-пирролидина. Реакционную смесь затем охлаждают до температуры около 5 С на бане со смесью воды и льда и к реакционной среде по каплям добавляют раствор 1,46 г (8,37 ммоль) диэтилазодикарбоксилата в 5 мл тетрагидрофурана, причем во время добавления поддерживают температуру в интервале от 5 до 10 С. После этого реакционную смесь перемешивают при температуре 5 С в течение 15 мин, затем при комнатной температуре в течение 40 ч. К реакционной среде добавляют этилацетат. Органическую фазу промывают водой, затем сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией[элюент: дихлорметан/метанол (90:10 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 880 мг метил-6-(2-пирролидин-1-илэтокси)-1 Ниндол-2-карбоксилата в виде твердого вещества каштанового цвета. Масс-спектр (EI): m/z=288 (M+-); m/z=84 (C5H10N+) пик молекулярного иона. Метил-6-гидрокси-1 Н-индол-2-карбоксилат получают как описывается в примере 23. Пример 25. 3-6-[3-(2-Фтор-5-трифторметилфенил)уреидо]пиридин-3-ил-6-метокси-1 Н-индол-2 карбоксамид Суспензию 100 мг (0,37 ммоль) 3-бром-6-метокси-1 Н-индол-2-карбоксамида и 43 мг (0,04 ммоль) тетракис(трифенилфосфин)палладия-(0) в 5 мл диоксана перемешивают при комнатной температуре в течение 10 мин. Затем при комнатной температуре добавляют 190 мг (0,45 ммоль) 1-(2-фтор-5 трифторметилфенил)-3-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пиридин-2-ил]мочевины, а также 6 мл диоксана, затем раствор 86 мг (1,48 ммоль) фторида калия в 1 мл воды. Смесь кипятят с обратным холодильником в течение 16 ч 45 мин. Реакционную среду выпаривают досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент:дихлорметан/метанол (99:1,затем 98:2, затем 97:3, затем 94:4, по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 60 мг 3-6-[3-(2-фтор-5-трифторметилфенил)уреидо]пиридин-3-ил-6-метокси-1 Н-индол-2-карбоксамида в виде твердого вещества желтого цвета. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 3,81 (с, 3 Н), 6,75 (дд, J=2,0 и 8,5 Гц, 1 Н), 6,93 (д,J=2,0 Гц, 1 Н), 7,00 (м уш., 1 Н), 7,35 (д, J=8,5 Гц, 1 Н), от 7,39 до 7,59 (м, 4 Н), 7,89 (дд, J=2,0 и 8,5 Гц, 1 Н),8,35 (д, J=2,0 Гц, 1 Н), 8,70 (д уш., J=7,5 Гц, 1 Н), 10,05 (с уш., 1 Н), 11,3 (м очень уш., 1 Н), 11,5 (с уш., 1 Н). Масс-спектр (ES): m/z=488 (МН+) пик молекулярного иона.- 25012613 3-Бром-6-метокси-1 Н-индол-2-карбоксамид может быть получен следующим образом. Раствор 540 мг (2,84 ммоль) 6-метокси-1 Н-индол-2-карбоксамида в 8 мл пиридина охлаждают до температуры 0 С и к нему по каплям добавляют раствор 908 мг (2,84 ммоль) пиридинийтрибромида в 6 мл пиридина. Реакционную среду перемешивают при температуре 0 С в течение 30 мин и при комнатной температуре в течение 19 ч. В реакционную среду добавляют 20 мл смеси воды со льдом. Реакционную среду затем перемешивают при комнатной температуре в течение 1 ч, после чего фильтруют через фильтр из пористого стекла, получая 538 мг 3-бром-6-метокси-1 Н-индол-2-карбоксамида в виде твердого вещества белого цвета. Масс-спектр (ES): m/z=269 (MH+) пик молекулярного иона. 6-Метокси-1 Н-индол-2-карбоксамид может быть получен следующим образом. Суспензию 4 г (19,49 ммоль) метил-6-метокси-2-индолкарбоксилата в 60 мл 28%-ного водного раствора аммиака нагревают при температуре 50 С в течение 14 ч в автоклаве. После фильтрации смеси через фильтр из пористого стекла, полученное твердое вещество белого цвета промывают водой и высушивают, затем добавляют к горячей смеси этилацетата и циклогексана (100 мл/10 мл). Среду охлаждают на бане со смесью воды и льда и фильтруют через фильтр из пористого стекта, получая 1,05 г 6-метокси 1 Н-индол-2-карбоксамида в виде твердого вещества белого цвета. Масс-спектр (EI): m/z=190 (M+) пик молекулярного иона; m/z=173 (M-NH3)+; m/z=145 (M-CH3NO)+. 1-(2-Фтор-5-трифторметилфенил)-3-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пиридин-2 ил]мочевина может быть получена следующим образом. Суспензию 505 мг (1,80 ммоль) трициклогексилфосфина и 276 мг (0,48 ммоль) бис(дибензилиденацетон)палладия в 20 мл диоксана перемешивают при комнатной температуре и в атмосфере аргона в течение 10 мин. В реакционную среду добавляют 4,54 г (12,01 ммоль) 1-(5-бромпиридин-2-ил)-3(2-фтор-5-трифторметилфенил)мочевины, затем 80 мл диоксана, 4,12 г (16,20 ммоль) бис(пинаколят)диборана и 1,77 г (18,04 ммоль) ацетата калия. Реакционную смесь кипятят с обратным холодильником в атмосфере аргона в течение 16 ч, затем при комнатной температуре добавляют 300 мл воды. Смесь перемешивают при комнатной температуре в течение 10 мин, после чего фильтруют через фильтр из пористого стекла и полученное твердое вещество промывают небольшим количеством воды. Полученное твердое вещество обрабатывают с помощью 350 мл кипящего этилацетата и после фильтрации в горячем состоянии фильтрат выпаривают досуха при пониженном давлении. Получают 3,05 г 1-(2 фтор-5-трифторметилфенил)-3-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пиридин-2-ил]мочевины в виде твердого вещества бледно-желтого цвета. Масс-спектр (ES): m/z=426 (MH+) пик молекулярного иона. 1-(5-бромпиридин-2-ил)-3-(2-фтор-5-трифторметилфенил)мочевина может быть получена следующим образом. 3,27 мл (23,44 ммоль) триэтиламина добавляют при температуре 0 С, к раствору 4,06 г (23,47 ммоль) 2-амино-5-бромпиридина в 200 мл безводного тетрагидрофурана. Затем при температуре 0 С по каплям добавляют 3,39 мл (23,44 ммоль) 2-фтор-5-трифторметилфенилизоцианата. Реакционную среду перемешивают при комнатной температуре в течение 64 ч. К реакционной среде добавляют 400 мл этилацетата. Органическую фазу затем промывают водой, потом водным насыщенным раствором хлорида натрия, затем, наконец, фильтруют через фильтр из пористого стекла. Получают 4,55 г 1-(5 бромпиридин-2-ил)-3-(2-фтор-5-фторметилфенил)мочевины в виде твердого вещества белого цвета. Масс-спектр (EI): m/z=377 (М+); m/z=179 (C7H5NF4+); m/z=172 (C5H5N2Br+) пик молекулярного иона. Пример 26. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-метокси-1 Н-индол-2-карбоксамид Суспензию 2,54 г (9,44 ммоль) 3-бром-6-метокси-1 Н-индол-2-карбоксамида и 1,0 9 г (0,94 ммоль) тетракис-(трифенилфосфин)палладия-(0) в 125 мл диоксана перемешивают при комнатной температуре в течение 10 мин. Затем при комнатной температуре добавляют 4,81 г (11,33 ммоль) 1-(2-фтор-5 трифторметилфенил)-3-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пиридин-2-ил]мочевины, а так- 26012613 же 150 мл диоксана, затем раствор 2,19 г (37,77 ммоль) фторида калия в 25 мл воды. Смесь кипятят с обратным холодильником в течение 18 ч. Реакционную среду выпаривают досуха при пониженном давлении. Полученный остаток обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (98:2 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт,получают 1,73 г 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-6-метокси-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Спектр 1H-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 3,78 (с, 3 Н), 6,30 (м уш., 1 Н), 6,71 (дд, J=2,5 и 9,0 Гц, 1 Н), 6,91 (д, J=2,5 Гц, 1 Н), 7,28 (д, J=9,0 Гц, 1 Н), от 7,32 до 7,45 (м уш., 1 Н), 7,39 (м, 1 Н), 7,42 (д уш.,J=8,5 Гц, 2 Н), 7,51 (дд, J=9,0 и 11,0 Гц, 1 Н), 7,60 (д уш., J=8,5 Гц, 2 Н), 8,64 (дд, J=2,0 и 7,5 Гц, 1 Н), 8,99 (с уш., 1 Н), 9,37 (с уш., 1 Н), 11,4 (с уш., 1 Н). Масс-спектр (ES): m/z=487 (MH+); m/z=470 (MH+-NH3) пик молекулярного иона. 1-(2-Фтор-5-трифторметилфенил)-3-[5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пиридин-2 ил]мочевина может быть получена согласно методике, описанной в заявке на патент США 2005043347 А 1. 3-Бром-6-метокси-1 Н-индол-2-карбоксамид может быть получен как описывается в примере 25. Пример 27. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-гидрокси-1 Н-индол-2-карбоксамид Суспензию 1,11 г (2,28 ммоль) 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-6-метокси 1 Н-индол-2-карбоксамида в 100 мл дихлорметана охлаждают до температуры -5 С на бане со смесью ацетона и твердого диоксида углерода, затем при температуре -5 С по каплям добавляют 12,34 мл (12,34 ммоль) 1 М раствора трибромида бора в дихлорметане. Реакционную смесь перемешивают при температуре около 0 С в течение 2 ч, затем при комнатной температуре в течение 26 ч. Реакционную смесь затем охлаждают до температуры около 0 С на бане со смесью воды и льда и добавляют по каплям 30 мл 1 н соляной кислоты, затем 50 мл дихлорметана и 30 мл воды. Смесь перемешивают при температуре около 0 С в течение 15 мин, затем при комнатной температуре в течение 30 мин. Реакционную среду после этого отфильтровывают через фильтр из пористого стекла, получая твердое вещество каштанового цвета. Его очищают флэш-хроматографией [элюент: дихлорметан/метанол (95:5 по объему)]. После концентрирования при пониженном давлении фракций, содержащих ожидаемый продукт, получают 840 мг 3-4-[3(2-фтор-5-трифторметилфенил)уреидо]фенил-6-гидрокси-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Спектр 1 Н-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 6,21 (м уш., 1 Н), 6,58 (дд, J=2,0 и 8,5 Гц, 1 Н), 6,80(д, J=2,0 Гц, 1 Н), 7,18 (д, J=8,5 Гц, 1 Н), 7,30 (м уш., 1 Н), 7,40 (м, 3 Н), 7,51 (дд, J=9,0 и 11,0 Гц, 1 Н), 7,58 (д уш., J=8,5 Гц, 2 Н), 8,65 (дд, J=2,0 и 7,5 Гц, 1 Н), 8,92 (д, J=3,0 Гц, 1 Н), 9,23 (с, 1 Н), 9,29 (с, 1 Н), 11,2 (с,1 Н). Масс-спектр (ES): m/z=471 (M-H)- пик молекулярного иона. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-метокси-1 Н-индол-2-карбоксамид может быть получен как описывается в примере 26. Пример 28. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-(2-гидроксиэтокси)-1 Н-индол 2-карбоксамид 1,23 г (8,90 ммоль) карбоната калия добавляют при комнатной температуре к раствору 280 мг (0,59 ммоль) 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-6-гидрокси-1 Н-индол-2-карбоксамида в 10 мл диметилформамида. Затем при комнатной температуре добавляют 0,69 мл (8,89 ммоль) йодэтанола. Реакционную среду нагревают при температуре 110 С в течение 2 ч 30 мин. Среду обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают препаративной LC/MS. После выпаривания досуха растворителя при пониженном давлении, полученный остаток порошкуют при использовании этилацетата и диизопропилового эфира и после фильтрации получают 48 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-6-(2-гидроксиэтокси)-1 Н-индол-2 карбоксамида в виде твердого вещества серого цвета. Спектр 1H-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 3,75 (кв, J=5,5 Гц, 2 Н), 4,00 (т, J=5,5 Гц, 2 Н), 4,86(д уш., J=8,5 Гц, 2 Н), 8,65 (дд, J=2,5 и 7,5 Гц, 1 Н), 8,97 (с уш., 1 Н), 9,33 (с уш., 1 Н), 11,4 (с, 1 Н). Масс-спектр (ES): m/z=517 (MH+) пик молекулярного иона; m/z=500 (MH+-NH3). 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-6-гидрокси-1 Н-индол-2-карбоксамид может быть получен как описывается в примере 27. Пример 29. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-7-нитро-1 Н-индол-2-карбоксамид Суспензию 2,70 г (9,5 ммоль) 3-бром-7-нитро-1 Н-индол-2-карбоксамида и 1,10 г (0,95 ммоль) тетракис-(трифенилфосфин)палладия-(0) в 135 мл диоксана перемешивают при комнатной температуре в течение 10 мин. Затем при комнатной температуре добавляют 4,84 г (11,41 ммоль) 1-(2-фтор-5 трифторметилфенил)-3-[4-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенил]мочевины, а также 165 мл диоксана, затем раствор 2,215 г (38,13 ммоль) фторида калия в 27 мл воды. Смесь кипятят с обратным холодильником в течение 18 ч. Затем при температуре около 50 С к реакционной среде добавляют шпатель сажи, после чего реакционную среду перемешивают при температуре 50 С в течение 10 мин. Реакционную среду фильтруют через целит, затем промывают этилацетатом. Фильтрат выпаривают досуха при пониженном давлении. Полученный остаток обрабатывают этилацетатом, промывают водой, затем органическую фазу сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (99:1, затем 98:2, по объему)]. После концентрирования при пониженном давлении фракций,- 28012613 содержащих ожидаемый продукт, получают 3,44 г 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-7-нитро-1 Н-индол-2-карбоксамида в виде твердого вещества желтого цвета. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO-d6,в м.д.): 7,33 (т, J=7,5 Гц, 1 Н), 7,40 (м, 1 Н), 7,45 (д уш.,J=8,5 Гц, 2 Н), 7,51 (дд, J=9,0 и 11,0 Гц, 1 Н), 7,59 (д уш., J=8,5 Гц, 2 Н), 7,69 (м уш., 2 Н), 7,96 (д, J=7,5 Гц,1 Н), 8,27 (д, J=7,5 Гц, 1 Н), 8,65 (дд, J=2,5 и 7,5 Гц, 1 Н), 8,95 (д уш., J=2,5 Гц, 1 Н), 9,32 (с, 1 Н), 11,55 (с,1 Н). Масс-спектр (ES): m/z=500 (M-H)- пик молекулярного иона. 3-Бром-7-нитро-1 Н-индол-2-карбоксамид может быть получен следующим образом. Суспензию 2,57 г (12,53 ммоль) 7-нитро-1 Н-индол-2-карбоксамида в 35 мл пиридина охлаждают до температуры 0 С на бане со смесью воды и льда. Затем при температуре 0 С по каплям добавляют раствор 4,01 г (12,53 ммоль) пиридинийтрибромида в 20 мл пиридина, после чего реакционную смесь перемешивают при температуре 0 С в течение 30 мин и при комнатной температуре в течение 16 ч. Затем в реакционную среду добавляют 70 мл смеси воды со льдом. После этого реакционную среду перемешивают при комнатной температуре в течение 15 мин, потом отфильтровывают через фильтр из пористого стекла, получая 2,81 г 3-бром-7-нитро-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Масс-спектр (EI): m/z=283 (M+) пик молекулярного иона; m/z=266 (M-NH3)+; m/z=220 (m/z=266+NO2) ; m/z=141 (m/z=220-Br)+. 7-Нитро-1 Н-индол-2-карбоксамид может быть получен следующим образом. Суспензию 133 мг (0,57 ммоль) этил-7-нитроиндол-2-карбоксилата в 3,84 мл 28%-ного водного раствора аммиака нагревают при температуре 50 С в закупоренной стеклянной пробирке в течение 18 ч. Реакционную среду отфильтровывают через фильтр из пористого стекла. Полученное твердое вещество желтого цвета промывают водой и циклогексаном, затем высушивают в вакууме. Получают 70 мг 7 нитро-1 Н-индол-2-карбоксамида в виде твердого вещества желтого цвета. Масс-спектр (ES): m/z=206 (MH+) пик молекулярного иона. Пример 30. 7-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид 3,28 г палладия-на-угле добавляют к суспензии 3,42 г (6,82 ммоль) 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-7-нитро-1 Н-индол-2-карбоксамида в 480 мл метанола. Реакционную смесь гидрируют при температуре 30 С в течение 2 ч при давлении 3 бар в автоклаве, затем фильтруют через целит. Фильтрат выпаривают досуха при пониженном давлении. Полученный остаток порошкуют при использовании этилацетата и небольшого количества дихлорметана, после чего отфильтровывают. Получают 1,30 г 7-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида в виде твердого вещества серого цвета. Спектр 1H-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 5,40 (с уш., 2 Н), 6,17 (м уш., 1 Н), 6,41 (д, J=7,5 Гц,1 Н), 6,62 (д, J=7,5 Гц, 1 Н), 6,78 (т, J=7,5 Гц, 1 Н), 7,39 (м, 1 Н), 7,41 (д уш., J=8,5 Гц, 2 Н), 7,47 (м уш., 1 Н),7,51 (дд, J=9, 0 и 11,0 Гц, 1 Н), 7,61 (д уш., J=8,5 Гц, 2 Н), 8,65 (дд, J=2,0 и 7,5 Гц, 1 Н), 8,99 (м уш., 1 Н),9,33 (м уш., 1 Н), 11,25 (с уш., 1 Н). Масс-спектр (ES): m/z=472 (MH+) пик молекулярного иона; m/z=455 (MH+-NH3). 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-7-нитро-1 Н-индол-2-карбоксамид может быть получен как описывается в примере 29. Пример 31. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-7-(2-гидроксиэтиламино)-1 Ниндол-2-карбоксамид Суспензию 160 мг (0,34 ммоль) 7-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Ниндол-2-карбоксамида и 20 мг (0,34 ммоль) 2-гидроксиацетальдегида в 16 мл метанола и 19,43 мкл (0,34 ммоль) уксусной кислоты нагревают при температуре 50 С в течение 3 ч, затем при комнатной температуре добавляют 64 мг (1,02 ммоль) цианоборгидрида натрия и реакционную смесь перемешивают при этой температуре в течение 16 ч. Реакционную смесь выпаривают досуха при пониженном давлении. Полученный остаток обрабатывают этилацетатом и водой, после чего подщелачивают до рН=10 с помощью 30%-ного раствора гидроксида натрия. Органическую фазу отделяют, сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией [элюент: дихлорметан/метанол (94:6 по объему)]. Полученное неочищенное твердое вещество порошкуют при использовании этилацетата и небольшого количества диэтилового эфира и после отфильтровывания получают 14 мг 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-7-(2-гидроксиэтиламино)-1 Н-индол-2-карбоксамида в виде твердого вещества каштанового цвета. Спектр 1 Н-ЯМР (400 МГц, (CD3)2SO-d6,в м.д.): 3,25 (м частично скрытый, 2 Н), 3,67 (кв, J=6,0 Гц,2 Н), 4,72 (т, J=6,0 Гц, 1 Н), 5,95 (т, J=6,0 Гц, 1 Н), 6,17 (м уш., 1 Н), 6,32 (д, J=7,5 Гц, 1 Н), 6,64 (д, J=7,5 Гц,1 Н), 6,86 (т, J=7,5 Гц, 1 Н), от 7,35 до 7,48 (м, 4 Н), 7,51 (м, 1 Н), 7,60 (д уш., J=8,5 Гц, 2 Н), 8,65 (д уш.,J=7,5 Гц, 1 Н), 8,97 (с уш., 1 Н), 9,33(8, 1 Н), 11,4 (с, 1 Н). Масс-спектр (ES): m/z=516 (MH+) пик молекулярного иона; m/z=499 (MH+-NH3). 7-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид может быть получен как описывается в примере 30. Пример 32. 7-(2-Диметиламиноацетиламино)-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамид 14,78 мкл (0,11 ммоль) триэтиламина добавляют при комнатной температуре к суспензии 50 мг(0,11 ммоль) 7-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-индол-2-карбоксамида,11 мг (0,11 ммоль) N,N-диметилглицина, 20 мг (0,10 ммоль) 1-(3-диметиламинопропил)-3 этилкарбодиимид-гидрохлорида и 16 мг (0,10 ммоль) 1-гидроксибензотриазол-гидрата в 6 мл дихлорметана. Затем для солюбилизации смеси добавляют 2 мл диметилформамида. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную среду разбавляют путем добавления дихлорметана, после чего промывают последовательно с помощью водного насыщенного раствора гид- 30
МПК / Метки
МПК: C07D 413/12, A61K 31/407, A61K 31/404, C07D 209/12, C07D 209/14
Метки: содержащие, получения, композиции, замещённые, способ, индолы, применение
Код ссылки
<a href="https://eas.patents.su/30-12613-zameshhyonnye-indoly-soderzhashhie-ih-kompozicii-sposob-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые индолы, содержащие их композиции, способ получения и применение</a>
Предыдущий патент: Способ борьбы с грибковыми заболеваниями бобовых культур
Следующий патент: Способ получения бутадиена из н-бутана
Случайный патент: Устройство для получения энергии