Замещённые пирролы и имидазолы, содержащие их композиции, способ получения и применение
Номер патента: 12267
Опубликовано: 28.08.2009
Авторы: Ронан Батист, Бак Эрик, Алле Франк, Вивьяни Фабрис, Табар Мишель, Эль Амад Юссеф, Суай Катрин
Формула / Реферат
1. Соединение, отвечающее следующей формуле (I):
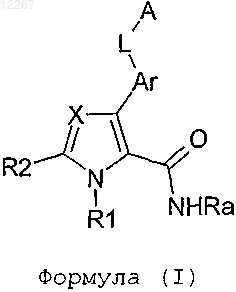
в которой:
1) А обозначает фенил, необязательно замещенный одним или несколькими одинаковыми или разными заместителями, независимо выбранными из группы, включающей F, Cl, CH3, OCH3, OCF3;
2) Ar обозначает фенил;
3) L обозначает NH-CO-NH;
4) Ra обозначает Н;
5) R1 обозначает Н;
6) X выбирают из CR3 и N;
7) R2 выбирают из Н и галогена,
8) R3 выбирают из группы, состоящей из Н, галогена, NH2, NH-COO-tBu, -NH-CO-NH-2-F-5-CF3Ph, Me2CH2CONH-, PhCONH-, PyCONH-, -COOEt, -COOH, 2,4-диMePhCH2NHCO-, -CONH2, 4-Ме-пиперазин-1-ил-CO-, пирролидин-1-ил, Me2N(CH2)2OCO-, Cl.
2. Соединение по п.1, отличающееся тем, что R2 означает атом водорода.
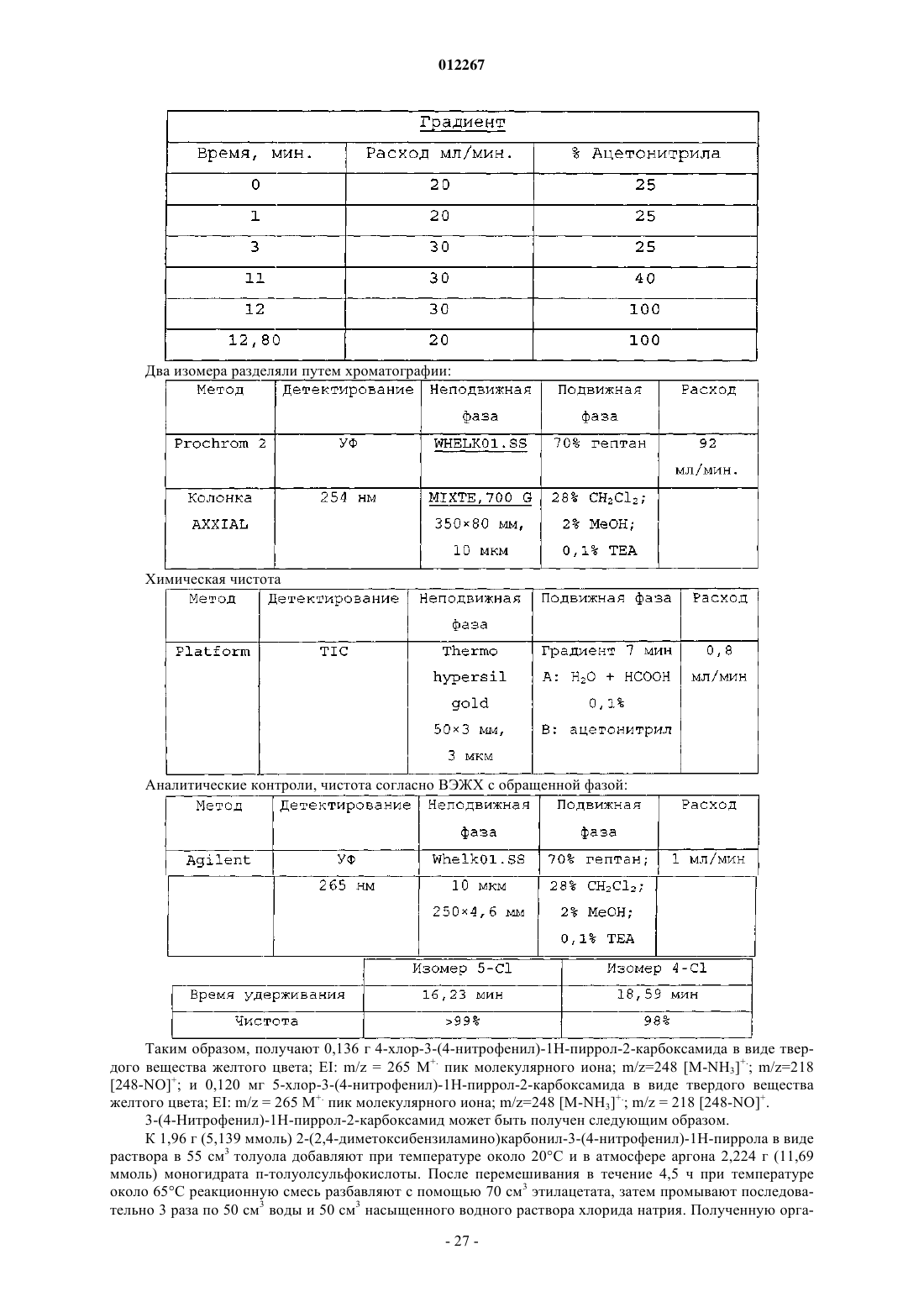
3. Соединение по любому из пп.1-2, отличающееся тем, что X означает CR3.
4. Соединение по любому из пп.1-3, отличающееся тем, что по меньшей мере один из R2 или R3 означает галоген.
5. Соединение по п.1, отличающееся тем, что его выбирают среди
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-трет-бутоксикарбониламино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-амино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамидгидрохлорида;
4-[3-(2-фтор-5-трифторметилфенил)уреидо]-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-ацетиламино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-(2-диметиламиноацетиламино)-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-бензоиламино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
4-никотиноиламино-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
этил-5-карбамоил-4-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-фторфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-метоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-[4-(3-о-толилуреидо)фенил]-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3-фторфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3-метоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-[4-(3-м-толилуреидо)фенил]-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-фторфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-метоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-[4-(3-п-толилуреидо)фенил]-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-хлор-3-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-хлор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-фтор-3-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-фтор-3-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-метил-3-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-трифторметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(4-дифторметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
зтил-5-карбамоил-4-{4-[3-(3,4-диметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3,4-диметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
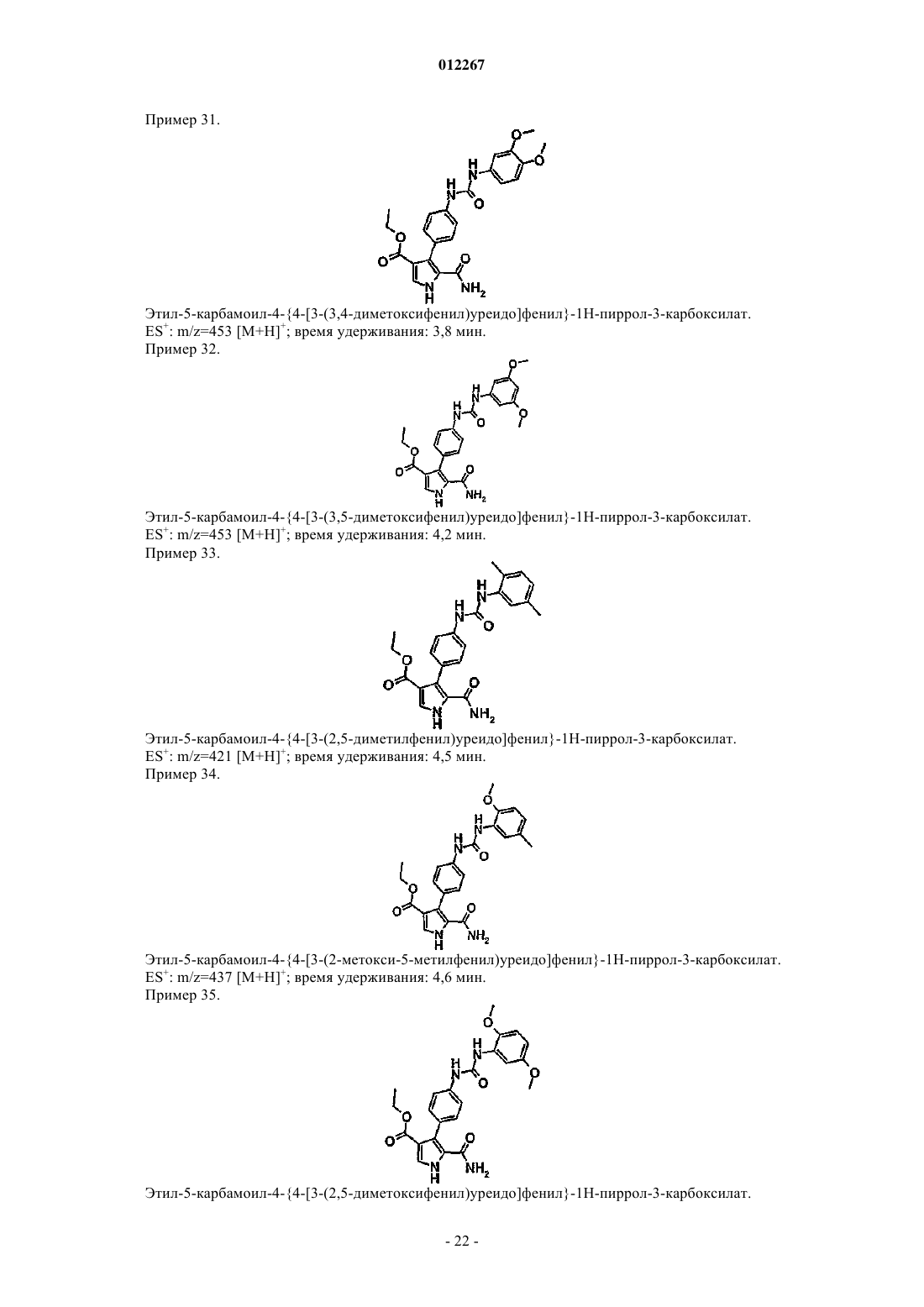
этил-5-карбамоил-4-{4 -[3-(3,5-диметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2,5-диметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2-метокси-5-метилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(2,5-диметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3-хлор-4-дифторметоксифенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
этил-5-карбамоил-4-{4-[3-(3,5-диметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
5-карбамоил-4-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоновой кислоты;
4-(2,4-диметоксибензиламино)карбонил-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2,4-дикарбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-4-(4-метилпиперазин-1-карбонил)-1Н-пиррол-2-карбоксамида;
3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-4-(пирролидин-1-карбонил)-1Н-пиррол-2-карбоксамида;
2-диметиламиноэтил-5-карбамоил-4-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-3-карбоксилата;
4-хлор-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
5-хлор-3-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-1Н-пиррол-2-карбоксамида;
5-{4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил}-3H-имидазол-4-карбоксамида.
6. Фармацевтическая композиция, включающая соединение по любому из пп.1-5 в комбинации с фармацевтически приемлемым эксципиентом, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат или сольват соединения формулы (I).
7. Применение продукта по любому из пп.1-5 для получения лекарственного средства, пригодного для лечения рака.
Текст
012267 Настоящее изобретение относится, в особенности, к новым химическим соединениям, в частности,к новым замещенным пирролам и имидазолам, содержащим их композициям и их применению в качестве лекарственных средств. Более конкретно, изобретение относится к новым специфическим пирролам и имидазолам, обладающим противораковой активностью за счет модуляции активности белков, в частности киназ. На сегодняшний день большинство коммерчески доступных соединений, используемых в химиотерапии, вызывает значительные проблемы в отношении побочных эффектов и толерантности у пациентов. Эти эффекты могут быть ограничены в соответствии с тем, что используемые лекарственные средства селективно воздействуют на раковые клетки, за исключением здоровых клеток. Одно из решений для ограничения нежелательных воздействий химиотерапии, следовательно, может состоять в использовании лекарственных средств, воздействующих на метаболические пути или конститутивные элементы этих путей, в большинстве своем экспрессирующиеся в раковых клетках и которые не экспрессируются или мало экспрессируются в здоровых клетках. Протеинкиназы представляют собой семейство ферментов, которые катализируют фосфорилирование гидроксильных групп специфических остатков белков, таких как тирозиновые, сериновые или треониновые остатки. Такие фосфорилирования могут в высокой степени модифицировать функцию белков; таким образом, протеинкиназы играют важную роль в регуляции большого разнообразия клеточных процессов, включая, в частности, метаболизм, клеточную пролиферацию, клеточную дифференцировку,клеточную миграцию или сохранение клетки. Среди различных клеточных функций, в которых принимает участие активность протеинкиназы, некоторые процессы представляют собой аттрактивные мишени для лечения раковых заболеваний, а также других заболеваний. Таким образом, одним из объектов настоящего изобретения является получение композиций, обладающих противораковой активностью за счет воздействия, в частности, на киназы. Из киназ, в отношении которых стремятся достичь модуляции активности, предпочтительны FAK, KDR и Tie2. Эти продукты отвечают следующей формуле (I): в которой: 1) А и Ar независимо выбирают из группы, состоящей из арила, гетероарила, гетероциклила, замещенного арила, замещенного гетероарила, замещенного гетероциклила, циклоалкила, замещенного циклоалкила; 2) L выбирают из группы, состоящей из NH, CO-NH, NH-CO, NH-SO2, SO2NH, NH-CH2, CH2-NH,CH2-CO-NH, NH-CO-CH2, NH-CH2-CO, CO-CH2-NH, NH-CO-NH, NH-CS-NH, NH-CO-O, O-CO-NH, CH2NH-CO-NH, NH-CO-NH-CH2, NH-CO-CH2-CO-NH; 3) Ra выбирают из группы, состоящей из Н, алкила и циклоалкила; 4) R1 выбирают из группы, состоящей из Н, R, COR, SO2R, где R выбирают из группы, состоящей из Н, OR"4, NR"5R"6, (C1-C6)-алкила, циклоалкила, гетероциклила, замещенного гетероциклила, арила,замещенного арила, гетероарила, замещенного гетероарила, где R"4 выбирают среди Н, фенила, алкила,и где R"5 и R"6 независимо выбирают из группы, состоящей из Н, R, OR"4, (C1-C6)-алкила, циклоалкила,гетероциклила, замещенного гетероциклила, арила, замещенного арила, гетероарила, замещенного гетероарила, или R"5 и R"6 связаны между собой с образованием насыщенного 5-8-членного цикла, включающего от 0 до 3 гетероатомов, выбираемых среди О, S и N; 5) X выбирают среди CR3 и N; 6) R2 и R3 независимо выбирают из группы, состоящей из Н, галогена, R'2, CN, O(R'2), OC(O)(R'2),ОС(О)N(R'2)(R'3), OS(O2)(R'2), N(R'2)(R'3), N=C(R'2)(R'3), N(R'2)С(O)(R'3), N(R'2)C(O)O(R'3),N(R'4)C(O)N(R'2)(R'3), N(R'4)С(S)N(R'2)(R'3), N(R'2)S(O2) (R'3), C(O)(R'2), C(O)O(R'2), С(O)N(R'2)(R'3),C(=N(R'3(R'2), C(=N(OR'3(R'2), S(R'2), S(O)(R'2), S(O2)(R'2), S(O2)O(R'2), S(O2)N(R'2) (R'3); где каждый R'2, R'3, R'4 независимо выбирают из группы, состоящей из Н, алкила, алкилена, алкинила, арила,гетероарила, циклоалкила, гетероциклила, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила, замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклила; и где, когда R'2 и R'3, каждый, отличаются от Н и одновременно встречаются в R2 или R3,они могут быть связаны между собой с образованием цикла, включающего от 0 до 3 гетероатомов, выбираемых среди атомов О, S и N. В продуктах формулы (I) группа Ar-L-A преимущественно означает где каждый X1, Х 2, Х 3 и Х 4 независимо выбирают из N и C-R'5, где R'5 имеет такое же значение, как R2. Предпочтительны заместители R'5, выбираемые из группы, состоящей из Н, F, Cl, метила, NH2,OMe, OCF3 CONH2.R2 предпочтительно означает Н. Предпочтительными согласно изобретению продуктами являются такие, в которых X означает CR3. По меньшей мере один из R2 или R3 означает галоген.R3 также предпочтительно выбирают из группы, состоящей из Н, галогена, NH2, N(R'2)С(О)(R'3),N(R'2)С(О)О(R'3), N(R'4)C(O)N(R'2)(R'3), C(O)O(R'2), С(О)N(R'2)(R'3), где каждый R'2, R'3 независимо выбирают из группы, состоящей из Н, алкила, алкилена, алкинила, арила, гетероарила, циклоалкила, гетероциклила, замещенного алкила, замещенного алкилена, замещенного алкинила, замещенного арила,замещенного гетероарила, замещенного циклоалкила, замещенного гетероциклила, где, когда R'2 и R'3,каждый, отличаются от Н и одновременно встречаются в R2 или R3, они могут быть связаны между собой с образованием цикла, включающего от 0 до 3 гетероатомов, выбираемых среди О, S и N.R3 более предпочтительно выбирают из группы, состоящей из Н, галогена, NH2, NH-COO-алкила,-NH-CO-NH-арила, где арил незамещен или замещен одним или несколькими атомами галогена или галогенированными алкильными группами, -NH-CO-алкильными группами, группами -NH-СО-алкилN(алкил)(алкил'), группами -СООН, -COO-алкильными группами, группами -COO-алкилN(алкил)(алкил'), -CO-NH-алкиларильными группами, где арил незамещен или замещен одной или несколькими алкоксильными группами, группами -CONH2, -СО-гетероциклильными группами, где гетероциклил незамещен или замещен одной или несколькими алкильными группами.R1 предпочтительно означает Н. Ra предпочтительно означает Н. Предпочтительные заместители L-A преимущественно выбирают среди NH-CO-NH-A и NH-SO2-A. Особенно эффективную комбинацию L-A получают, когда L-A означает NHCONH-A. Продукты согласно изобретению предпочтительно имеют заместитель А, который выбирают из группы, состоящей из возможно замещенного фенила, пиридила, пиримидила, тиенила, фурила, пирролила, оксазолила, тиазолила, изоксазолила, изотиазолила, пиразолила, имидазолила, индолила, индазолила, бензимидазолила, бензоксазолила и бензотиазолила. Более предпочтительно А выбирают среди возможно замещенного фенила, пиразолила и изоксазолила. Заместитель А в высшей степени преимущественно замещен первым заместителем, выбираемым из группы, состоящей из алкила, замещенного алкила, алкилена, алкинила, арила, гетероарила, О-алкила,замещенного О-алкила, О-арила, О-гетероарила, S-алкила, замещенного S-алкила, S-арила, Sгетероарила, причем каждый возможно замещен заместителем, выбираемым среди (C1-C3)-алкила, галогена, О-(C1-C3)-алкила. Заместитель А предпочтительно замещен вторым заместителем, выбираемым из группы, состоящей из F, Cl, Br, I, ОН, SH, SO3M, СООМ, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3) алкил-ОН, (C1-С 3)алкил-N(R8)(R9), (C1-С 3)-алкил-(R10), (C1-С 3)-алкил-СООН, N(R8)(R9); где R8 и R9 независимо выбирают среди Н, (C1-С 3)-алкила, галогенированного (C1-С 3)-алкила, (C1-C3)-алкил-ОН, (C1-С 3)-алкил-NH2, (C1C3)-алкил-СООМ, (C1-C3)-алкил-SO3M; где, когда R8 и R9 одновременно отличаются от Н, они могут быть связаны с образованием 5-7-членного цикла, возможно содержащего от 1 до 3 гетероатомов; где М означает Н или катион щелочного металла, выбираемого среди Li, Na и K; и где R10 означает Н или возможно замещенный неароматический гетероцикл, включающий от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбираемых среди N, О и S. Особенно предпочтительные заместители А выбирают среди фенила, пиразолила и изоксазолила; причем вышеуказанные заместители А могут быть замещены галогеном, (C1-С 4)-алкилом, галогенирозанным (C1-C3)-алкилом, О-(C1-С 4)-алкилом, S-(C1-С 4)-алкилом, галогенированным О-(C1-С 4)-алкилом, Sциклоалкилом, галоген-О-(C1-С 4)-алкилом и галогенированным S-(C1-С 4)-алкилом. Когда А является дизамещенным, два заместителя А могут образовывать 5-7-членный цикл, возможно включающий от 1 до 3 гетероатомов. Другие предпочтительные заместители А замещены одним или несколькими, одинаковыми или разными, заместителями, независимо выбираемыми из группы, состоящей из F, Cl, Br, I, ОН, SH, SO3M,СООМ, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3)-алкил-ОН, (C1-C3)-алкил-N(R8)(R9), (C1-C3)алкил-(R10), (C1-C3)-алкил-СООН, N(R8)(R9), (C1-C6)-алкила, (С 2-С 6)-алкилена, (С 2-Сб)-алкинила, арила,гетероарила, О-(C1-С 6)-алкила, О-арила, О-гетероарила, S-(C1-С 6)-алкила, S-арила, S-гетероарила, причем каждый возможно замещен одним или несколькими заместителями, выбираемыми среди (C1-C3)-алкила,галогена, О-(C1-C3)-алкила; где R8 и R9 независимо выбирают среди Н, (C1-C3)-алкила, (C1-C3)-алкилОН, (C1-C3)-алкил-NH2, (C1-C3)-алкил-СООМ, (C1-C3)-алкил-SO3M; где, когда R8 и R9 одновременно отличаются от Н, они могут быть связаны с образованием 5-7-членного цикла, включающего от 0 до 3 ге-2 012267 тероатомов, выбираемых среди О, N и S; где М означает Н или катион щелочного металла, выбираемого среди Li, Na и K; и где R10 означает Н или возможно замещенный неароматический гетероцикл, включающий от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбираемых среди N, О и S. Предпочтительные согласно изобретению продукты выбирают среди 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида; 4-трет-бутоксикарбониламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамида; 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорида; 4-[3-(2-фтор-5-трифторметилфенил)уреидо]-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил 1 Н-пиррол-2-карбоксамида; 4-ацетиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида; 4-(2-диметиламиноацетиламино)-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 2-карбоксамида; 4-бензоиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-2-карбоксамида; 4-никотиноиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-2-карбоксамида; этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-фторфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-метоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-[4-(3-о-толилуреидо)фенил]-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3-фторфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3-метоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-[4-(3-м-толилуреидо)фенил]-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-фторфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-метоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-[4-(3-п-толилуреидо)фенил]-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-хлор-3-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-хлор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-фтор-3-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-фтор-3-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-метил-3-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-трифторметоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(4-дифторметоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3- (3, 4-диметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3,4-диметоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3,5-диметоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2,5-диметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2-метокси-5-метилфенил)уреидо]-фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(2,5-диметоксифенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3-хлор-4-дифторметоксифенил)уреидо]-фенил-1 Н-пиррол-3-карбоксилата; этил-5-карбамоил-4-4-[3-(3,5-диметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата; 5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоновой кислоты; 4-(2,4-диметоксибензиламино)карбонил-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-2-карбоксамида; 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2,4-дикарбоксамида; 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-4-(4-метилпиперазин-1-карбонил)-1 Нпиррол-2-карбоксамида;-3 012267 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-4-(пирролидин-1-карбонил)-1 Н-пиррол-2 карбоксамида; 2-диметиламиноэтил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-3-карбоксилата; 4-хлор-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида; 5-хлор-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида; 5-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-3H-имидазол-4-карбоксамида. Продукт согласно изобретению может находиться: 1) в нехиральной форме, или 2) в рацемической форме, или 3) в обогащенной одним стереоизомером форме, или 4) в обогащенной одним энантиомером форме,и может быть, в случае необходимости, превращен в соль. Продукт согласно изобретению может быть использован для получения лекарственного средства,пригодного для лечения патологического состояния, в особенности рака. Настоящее изобретение относится также к терапевтическим композициям, включающим продукт согласно изобретению в комбинации с фармацевтически приемлемым эксципиентом согласно выбранному способу введения. Фармацевтическая композиция может находиться в твердой форме, жидкой форме или в форме липосом. Из твердых композиций можно назвать порошки, желатиновые капсулы, таблетки. В число пероральных форм также можно включать твердые формы, защищенные по отношению к кислой среде желудка. Используемые для твердых форм носители представляют собой, в частности, минеральные носители, такие как фосфаты, карбонаты, или органические носители, такие как лактоза, целлюлозы, крахмал или полимеры. Жидкие формы образованы растворами, суспензиями или дисперсиями. В качестве диспергирующего носителя они содержат либо воду, либо органический растворитель (этанол, NMP или другие), либо смеси поверхностно-активных веществ и растворителей или комплексообразователей и растворителей. Жидкие формы предпочтительно являются инъецируемыми, и вследствие этого готовая лекарственная форма является приемлемой для такого использования. Приемлемые пути введения путем инъекции включают внутривенный, интраперитонеальный, внутримышечный и подкожный пути введения, причем обычно предпочтительным является внутривенный путь введения. Вводимая доза соединений согласно изобретению подбирается практикующим врачом в зависимости от пути введения пациенту и состояния этого последнего. Соединения согласно настоящему изобретению могут быть введены индивидуально или в смеси с другими противораковыми средствами. Из возможных сочетаний можно назвать алкилирующие агенты и, в частности, циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломид, прокарбазин и гексаметилмеламин; производные платины, такие как, в частности, цисплатин, карбоплатин или оксалиплатин; антибиотики, такие как, в частности, блеомицин, митомицин, дактиномицин; антимикроканальциевые агенты, такие как, в частности, винбластин, винкристин, виндезин, винорелбин, таксоиды (паклитаксел и доцетаксел); антрациклины, такие как, в частности, доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лозоксантрон; ингибиторы топоизомераз I и II групп, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс; фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин; аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, 6-тиогуанин; аналоги аденозина, такие как пентостатин, цитарабин или флударабин-фосфат; метотрексат и фолиновая кислота; различные ферменты и соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиноевая кислота, сурамин, дексразоксан, амифостин, герцептин, а также эстрогенные гормоны, андрогенные гормоны; антиваскулярные агенты, такие как производные комбретастатина, например СА 4 Р, халконы или колхицин, например ZD6126, и их пролекарственные формы. С соединениями согласно настоящему изобретению также можно сочетать лучевую терапию. Эти терапии могут быть проведены одновременно, раздельно, последовательно. Терапия адаптируется практикующим врачом в зависимости от заболевания, которое нужно лечить. Продукты согласно изобретению пригодны в качестве ингибиторов реакции, катализируемой киназой. FAK, KDR и Tie2 представляют собой киназы, в отношении которых продукты согласно изобретению являются особенно пригодными в качестве ингибиторов.-4 012267 Доводы, по которым выбраны эти киназы, приводятся ниже.FAK представляет собой цитоплазматическую тирозинкиназу, играющую важную роль в трансдукции сигнала, транслируемого интегринами, семейства гетеродимерных рецепторов клеточной адгезии.FAK и интегрины солокализованы в перимембранных структурах, называемых адгезивными бляшками. В случае многочисленных типов клеток показано, что активация FAK, a также ее фосфорилирование по тирозиновым остаткам и, в особенности, ее автофосфорилирование по тирозину 397 зависят от связывания интегринов с их внеклеточными лигандами и, следовательно, индуцируются во время клеточной адгезии [L. Kornberg и др., J. Biol. Chem., 267(33), 23439-442 (1992)]. Автофосфорилирование по тирозину 397 FAK выполняет сайт связывания другой тирозинкиназы, Src, через ее домен SH2 [Schaller и др., Mol.Cell. Biol., 14, 1680-1688 (1994); Xing и др., Mol. Cell. Biol., 5, 413-421 (1994)]. Src тогда может фосфорилировать FAK по тирозину 925, рекрутируя, таким образом, адаптивный белок Grb2 и индуцируя в некоторых клетках активацию пути ras и МАР-киназы, участвующей в контролировании клеточной пролиферации [Schlaepfer и др., Nature, 372, 786-791 (1994); Schlaepfer и др., Prog. Biophy. Mol. Biol., 71, 435-478(1999); Schlaepfer и Hunter, J. Biol. Chem., 272, 13189-13195 (1997)]. Активация FAK также может индуцировать сигнальный путь jun NH2-концевой киназы (JNK) и приводить к прогрессированию клеток к фазе G1 клеточного цикла [Oktay и др., J. Cell. Biol., 145, 1461-1469 (1999)]. Фосфатидилинозит-3-ОНкиназа (PI3-киназа) также связывается с FAK по тирозину 397 и это взаимодействие может быть необходимым для активации PI3-киназы [Chen и Guan, Proc. Nat. Acad. Sci. USA, 91, 10148-10152 (1994); Ling и др., J. Cell.Biochem., 73, 533-544 (1999)]. Комплекс FAK/Src фосфорилирует различные субстраты, как паксиллин и p130CAS в фибробластах [Vuori и др., Mol. Cell. Biol., 16, 2606-2613 (1996)]. Результаты многочисленных исследований подтверждают гипотезу, что ингибиторы FAK могут быть пригодны при лечении рака. Исследования наводят на мысль, что FAK может играть важную роль в пролиферации и/или сохранении клеток in vitro. Например, в случае клеток СНО, некоторыми авторами показано, что сверхпродуцирование p125FAK приводит к ускорению транзиции от G1 к S, что наводит на мысль о том, что p125FAK способствует клеточной пролиферации J.-H. Zhao и др., J. Cell. Biol., 143,1997-2008 (1998)]. Другими авторами показано, что опухолевые клетки, обработанные антисмысловыми олигонуклеотидами FAK, утрачивают свою адгезию и подвергаются апоптозу [Xu и др., Cell Growth Differ., 4, 413-418 (1996)]. Также показано, что FAK промотирует миграцию клеток in vitro. Так, дефицитные в отношении экспрессии FAK фибробласты (нокаутированная по FAK мышь) обладают округлой морфологией, дефицитами клеточной миграции в ответ на хемотаксические сигналы, и эти дефициты ликвидируются повторной экспрессией FAK [D.J. Sieg и др., J. Cell Science, 112, 2677-2691 (1999)]. Сверхпродуцирование С-терминального домена FAK (FRNK) блокирует растягивание адгезивных клеток и уменьшает клеточную миграцию in vitro [A. Richardson и J.T. Parsons, Nature, 380, 538-540 (1996)]. Сверхпродуцирование FAK в клетках СНО, COS и в клетках человеческой астроцитомы благоприятствует миграции клеток. Вовлечение FAK в промотирование пролиферации и миграции клеток в случае многочисленных типов клеток in vitro наводит на мысль о потенциальной роли FAK в неопластических процессах. Недавно проведенное исследование действительно показало увеличение пролиферации опухолевых клеток in vivo после индукции экспрессии FAK в клетках человеческой астроцитомы [L.A. Cary и др., J. Cell Sci., 109, 1787-1794 (1996); D. Wang и др., J. Cell Sci., 113, 4221-4230 (2000)]. Кроме того, иммуногистохимические исследования человеческих биопсий показали, что FAK сверхпродуцируется в злокачественных опухолях простаты, молочной железы, щитовидной железы, ободочной кишки, меланомы, головного мозга и легких, причем уровень экспрессии FAK прямо коррелирует с опухолями, обладающими наиболее агрессивным фенотипом [Т.М. Weiner и др., Lancet, 342 (8878), 1024-1025 (1993);KDR (рецептор с встроенным киназным доменом), также называемый VEGF-R2 (рецептор-2 фактора васкулярного эндотелиального роста), экспрессируется главным образом в эндотелиальных клетках. Этот рецептор фиксируется на факторе ангиогенного роста VEGF и служит, таким образом, медиатором трансдукционного сигнала за счет активации его внутриклеточного киназного домена. Прямое ингибирование киназной активности VEGF-R2 позволяет уменьшать феномен ангиогенеза в присутствии экзогенного VEGF (Vascular Endothelial Growth Factor: фактор васкулярного эндотелиального роста) (Strawn и др., Cancer Research., 56, 3540-3545 (1996. Этот процесс наглядно объяснен, в частности, с помощью мутантов VEGF-R2 (Millauer и др., Cancer Research., 56, 1615-1620 (1996. Рецептор VEGF-R2, повидимому, не выполняет никакой другой функции у взрослого, чем таковая, связанная с ангиогенной активностью VEGF. Следовательно, селективный ингибитор киназной активности VEGF должен проявлять токсичность только в незначительной степени. Кроме этой центральной роли в динамическом ангиогенном процессе, недавно полученные результаты наводят на мысль, что экспрессия VEGF способствует сохранению опухолевых клеток после химиотерапии и лучевой терапии, что подчеркивает потенциальный синергизм ингибиторов KDR с другими агентами (Lee и др., Cancer Research., 60, 5565-5570 (2000.Tie2 (TEK) является членом семейства рецепторов тирозинкиназы, характерным в случае эндотелиальных клеток. Tie2 является первым рецептором с тирозинкиназной активностью, который известен одновременно как агонист (ангиопоэтин 1 или Ang1), который стимулирует автофосфорилирование рецептора и клеточную сигнализацию [S. Davis и др., Cell, 87, 1161-1169 (1996)], и антагонист (ангиопоэтин 2 или Ang2) [P.С. Maisonpierre и др., Science, 277, 55-60 (1997)]. Ангиопоэтин 1 может давать синергический эффект с VEGF на последних стадиях неоангиогенеза [Т. Asahara, Circ. Res., 233-240 (1998)]. Эксперименты по нокаутированию и трансгенные манипуляции в отношении экспрессии Tie2 илиAng1 приводят к животным, которые обладают дефицитами васкуляризации [D.J. Dumont и др., GenesDev., 8, 1897-1909 (1994); и С. Suri, Cell, 87, 1171-1180 (1996)]. Связывание Ang1 с его рецептором приводит к автофосфорилированию киназного домена Tie2, который является существенным для неоваскуляризации, а также для рекрутмента и взаимодействия сосудов с перицитами и гладкомышечными клетками; эти явления способствуют созреванию и стабильности вновь образующихся сосудов [Р.С. Maisonpierre и др., Science, 277, 55-60 (1997)]. Авторами Lin и др., J. Clin. Invest., 100 (8), 2072-2078 (1997), и LinP., PNAS, 95, 8829-8834 (1998), показано ингибирование опухолевого роста и опухолевой васкуляризации, а также уменьшение метастаз легкого во время аденовирусных инфекций или встраиваний внеклеточного домена Tie2 (Tek) в случае моделей ксенотрансплантатов опухоли молочной железы и меланомы. Ингибиторы Tie2 могут быть использованы в случае состояний, где неоваскуляризация протекает несоответствующим образом (то есть в случае диабетической ретинопатии, хронического воспаления,псориаза, саркомы Капоши, хронической неоваскуляризации вследствие макулярной дегенерации, ревматоидного артрита, инфантильной гемангиомы и раковых заболеваний). Определения. Термин галоген относится к элементу, выбираемому среди F, Cl, Br и I. Термин алкил относится к насыщенному, линейному или разветвленному углеводородному заместителю с 1-12 атомами углерода. Примерами алкильного заместителя являются метил, этил, пропил,1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2 метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил,гексил, 1-метилпентил, 2-метилпентил, 1-этилбутил, 2-этилбутил, 3,3-диметилбутил, гептил, 1 этилпентил, октил, нонил, децил, ундецил и додецил. Термин алкилен относится к линейному или разветвленному углеводородному заместителю с одной или несколькими ненасыщенными связями и с 2-12 атомами углерода. Примерами алкиленового заместителя являются этиленил, 1-метилэтиленил, проп-1-енил, проп-2-енил, Z-1-метилпроп-1-енил, Е-1 метилпроп-1-енил,Z-1,2-диметилпроп-1-енил,Е-1,2-диметилпроп-1-енил,бут-1,3-диенил,1 метилиденилпроп-2-енил, Z-2-метилбут-1,3-диенил, Е-2-метилбут-1,3-диенил, 2-метил-1-метилиденилпроп-2-енил, ундец-1-енил и ундец-10-енил. Термин алкинил относится к линейному или разветвленному углеводородному заместителю по меньшей мере с двумя ненасыщенными связями, которые несет пара вицинальных атомов углерода, и с 2-12 атомами углерода. Примерами алкинильного заместителя являются этинил, проп-1-инил, проп-2 инил и бут-1-инил. Термин арил относится к моно- или полициклическому ароматическому заместителю с 6-14 атомами углерода. Примерами арильного заместителя являются фенил, нафт-1-ил, нафт-2-ил, антрацен-9-ил,1,2,3,4-тетрагидронафт-5-ил и 1,2,3,4-тетрагидронафт-6-ил. Термин гетероарил относится к моно- или полициклическому гетероароматическому заместителю с 1-13 атомами углерода и 1-4 гетероатомами. Примерами гетероарильного заместителя являются пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, фурил, тиенил, имидазолил, оксазолил, тиазолил, изоксазолил,изотиазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидил, пиразинил,1,3,5-триазинил, индолил, бензо[b]фурил, бензо[b]тиенил, индазолил, бензимидазолил, азаиндолил, хинолеил, изохинолеил, карбазолил и акридил. Термин гетероатом, как используемый в данном контексте, относится по меньшей мере к двухвалентному атому, отличающемуся от атома углерода. Примерами гетероатома являются N, О, S и Se. Термин циклоалкил относится к насыщенному или частично ненасыщенному циклическому углеводородному заместителю с 3-12 атомами углерода. Примерами циклоалкильного заместителя являются циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, бицикло[2,2,1]гептил, циклооктил, бицикло[2,2,2]октил, адамантил и пергидронафтил. Термин гетероциклил относится к насыщенному или частично ненасыщенному циклическому углеводородному заместителю с 1-13 атомами углерода и 1-4 гетероатомами. Предпочтительно насыщенный или частично ненасыщенный циклический углеводородный заместитель является моноциклическим и включает 4 или 5 атомов углерода и 1-3 гетероатома. Термин замещенный относится к одному или нескольким заместителям, отличающимся от Н,как, например, галоген; алкил; галогенированный алкил; арил; арил, замещенный одной или несколькими алкоксильными группами; гетероарил; циклоалкил; гетероциклил; алкилен; алкинил; ОН; О-алкил; О-6 012267 алкилен; О-арил; O-гетероарил; NH2; NH-алкил; NH-арил; NH-гетероарил; N-алкил-алкил'; SH; S-алкил;S-арил; S(O2)H; S(O2)-алкил; S(O2)-арил; SO3H; SO3-алкил; SO3-арил; СНО; С(О)-алкил; С(O)-арил; С(О)ОН; С(О)О-алкил; С(О)О-арил; ОС(О)-алкил; ОСО(O)-арил; C(O)NH2; С(O)NH-алкил; C(O)NHарил; NHCHO; NHC(O)-алкил; NHC(O)-арил; NH-циклоалкил; NH-гетероциклил. Объектом настоящего изобретения также является способ получения продуктов формулы (I). Продукты согласно изобретению могут быть получены обычными способами органической химии. Нижеприведенная схема 1 служит примером способа, используемого для получения соединения примера 1, относящегося к замещенным пирролам. На этом основании она не представляет собой ограничения объема охраны изобретения в том, что касается способов получения заявленных соединений. Схема 1 Нижеприводимые схемы служат примерами способов, используемых для получения соединений примеров, касающихся замещенных имидазолов. На этом основании они не представляют собой ограничения объема охраны изобретения в том, что касается способов получения заявленных соединений. Специалисту в данной области понятно, что для осуществления вышеописанных способов согласно изобретению может оказаться необходимым введение защитных групп для функциональной аминогруппы, карбоксильной и спиртовой функциональных групп с целью избежания побочных реакций. Эти группы представляют собой такие, которые можно удалить, не затрагивая остальной части молекулы. В качестве примеров защитных групп для функциональной аминогруппы можно назвать третбутилкарбамат, который может быть регенерирован с помощью трифторуксусной кислоты или иодтриметилсилана; ацетил, который может быть регенерирован в кислой среде (например, соляная кислота). В качестве защитных групп для карбоксильной функциональной группы можно назвать сложные эфиры(например, сложный метоксиметиловый эфир, сложный бензиловый эфир). В качестве защитных групп для спиртовой функциональной группы можно назвать сложные эфиры (например, сложный бензоиловый эфир), которые могут быть регенерированы в кислой среде или путем каталитического гидрирования. Другие используемые защитные группы описаны T.W. GREENE и др. в руководстве ProtectiveGroups in Organic Synthesis, третье издание, 1999, Wiley-Interscience. Соединения формулы (I) выделяют, и они могут быть очищены обычными известными методами,например путем кристаллизации, хроматографии или экстракции. Энантиомеры, диастереоизомеры соединений формулы (I) также составляют часть изобретения. Соединения формулы (I), включающие основной остаток, в случае необходимости, могут быть превращены в аддитивные соли неорганической или органической кислоты путем воздействия такой кислоты в растворителе, например, органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Соединения формулы (I), включающие кислотный остаток, в случае необходимости, могут быть-9 012267 превращены в соли металлов или в аддитивные соли азотсодержащих оснований согласно само по себе известным способам. Эти соли могут быть получены путем воздействия металлсодержащего основания(как, например, щелочной или щелочно-земельный металл), аммиака, амина или соли амина на соединение формулы (I) в растворителе. Образовавшуюся соль выделяют обычными способами. Эти соли также составляют часть настоящего изобретения. Когда продукт согласно настоящему изобретению имеет по меньшей мере одну свободную основную функциональную группу, могут быть получены фармацевтически приемлемые соли путем реакции между вышеуказанным продуктом и неорганической или органической кислотой. Фармацевтически приемлемые соли включают хлориды, нитраты, сульфаты, гидросульфаты, пиросульфаты, бисульфаты,сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты,ацетаты, пропионаты, акрилаты, 4-гидроксибутираты, каприлаты, капроаты, деканоаты, оксалаты, малонаты, сукцинаты, глутараты, адипаты, пимелаты, малеаты, фумараты, цитраты, тартраты, лактаты, фенилацетаты, манделаты, себацинаты, субераты, бензоаты, фталаты, метансульфонаты, птолуолсульфонат, пропансульфонаты, ксилолсульфонаты, салицилаты, циннаматы, глутаматы, аспартаты, глюкуронаты, галактуронаты. Когда продукт согласно настоящему изобретению имеет по меньшей мере одну свободную основную функциональную группу, могут быть получены фармацевтически приемлемые соли путем реакции между вышеуказанным продуктом и неорганическим или органическим основанием. Фармацевтически приемлемые основания включают гидроксиды катионов щелочных или щелочно-земельных металлов,таких как Li, Na, K, Mg, Ca; основные аминосоединения, такие как аммиак, аргинин, гистидин, пиперидин, морфолин, пиперазин, триэтиламин. Изобретение также описывается нижеследующими примерами, приводимыми для пояснения изобретения. Анализы путем LC/MS (жидкостная хроматография/масс-спектрометрия) осуществляли на прибореMicromass, модель LCT, который связан с устройством HP 1100. Относительное содержание продуктов определяли с помощью диодного детектора HP G1315A в диапазоне длин волн 200-600 нм и детектора по светорассеянию Sedex 65. Регистрацию масс-спектров (Mass spectra) осуществляли в диапазоне 180-800. Данные анализировали, используя программное обеспечение Micromass MassLynx. Разделение осуществляли на колонке Hypersil BDS C18, 3 мкм (504,6 мм), элюируя линейным градиентом 5-90% ацетонитрила, содержащего 0,05% (об./об.) трифторуксусной кислоты (ТФУК), в воде, содержащей 0,05%(об./об.) ТФУК, в течение 3,5 мин с расходом 1 мл/мин. Общее время анализа, включая период повторного уравновешивания колонки, составляет 7 мин. Масс-спектры получали при использовании ионизации электронным распылением (ES+) на прибореPlatform II (Micromass). Описаны обнаруженные основные ионы. Температуры плавления измеряли в капилляре на приборе Mettler FP62, в диапазоне от 30 до 300 С,при подъеме температуры на 2 С в мин. Очистка путем LC/MS. Продукты могут быть очищены путем LC/MS, используя систему Waters FractionLynx, состоящую из градиентного насоса Waters, модель 600, регенерационного насоса Waters, модель 515, насоса для разбавления Waters Reagent Manager, автоинжектора Waters, модель 2700, двух вентилей Rheodyne, модельLabPro, диодного детектора Waters, модель 996, масс-спектрометра Waters, модель ZMD, и сборника фракций Gilson, модель 204. Система контролировалась с помощью программного обеспечения WatersFractionLynx. Разделение осуществляли альтернативно при использовании двух колонок Waters Symmetry (C18, 5 мкм, 1950 мм, регистрационный номер по каталогу 186000210), причем одна колонка находится в процессе выполнения регенерации с помощью смеси вода/ацетонитрил в соотношении 95:5(об./об.), содержащей 0,07% (об./об.) трифторуксусной кислоты, в то время как другая колонка находится в процессе выполнения разделения. Элюирование колонок осуществляли, используя линейный градиент 5-95% ацетонитрила, содержащего 0,07% (об./об.) трифторуксусной кислоты, в воде, содержащей 0,07%(об./об.) трифторуксусной кислоты, с расходом 10 мл/мин. На выходе из разделительной колонки, одну тысячную часть эфлюента отделяли с помощью LC Packing Accurate, разбавляли метиловым спиртом с расходом 0,5 мл/мин. и направляли к детекторам, из расчета 75% к диодному детектору, а остальные 25% к масс-спектрометру. Остальную часть эфлюента (999/1000) направляли к сборнику фракций, куда поток выводили, пока масса ожидаемого продукта не была определена с помощью программного обеспеченияFractionLynx. Молекулярные формулы ожидаемых продуктов получали при использовании программного обеспечения FractionLynx, согласно которому сбор продукта начинается тогда, когда сигнал детектируемой массы соответствует иону [М+Н]+ и/или [M+Na]+. В некоторых случаях, в зависимости от результатов аналитического метода LC/MS, когда был определен интенсивный ион, соответствующий[М+2 Н], также при использовании программного обеспечения FractionLynx определяли значение, соответствующее половине рассчитанной молекулярной массы (MW/2). В этих условиях сбор также начинали тогда, когда были определены сигнал массы иона [М+2 Н] и/или сигнал массы иона [M+Na+H]. Продукты собирали в тарированные стеклянные пробирки. После сбора растворители выпаривали в цен- 10012267 трифужном выпарном аппарате Savant AES 2000 или Genevac HT8 и массы продуктов определяли путем взвешивания пробирок после выпаривания растворителей. Анализ при использовании EI-CI: прямое введение (DCI = помещение образца на филамент). Масс-спектрометр Finnigan SSQ7000; область массы m/z=29-900; энергия электронов 70 эВ; температура источника 70 С; реактивный газ CI аммиак; EI = ионизация путем электронного удара; CI = химическая ионизация. Анализ при использовании ионизации электроным распылением: (ионизация электронным распылением с образованием положительных ионов: ES+; ионизация электронным распылением с образованием отрицательных ионов: EI-). Сочетание LC-MS-DAD-ELSD:MS: Waters-Micromass ZQ; LC: Agilent HP 1100; колонка Xbridge Waters C18; 350 мм, 2,5 мкм; элюент: градиент вода (с 0,1% муравьиной кислоты) + ацетонитрил; УФ: =254 нм. Спектр 1 Н-ЯМР при 400 МГц регистрировали на спектрометре BRUKER AVANCE DRX-400 с химическими сдвигами ( в м.д.) при использовании в качестве стандарта диметилсульфоксида-d6 (ДМСОd6) с =2,50 м.д. при температуре 303 K. Пример 1. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамид. К 0,490 г (2,435 ммоль) 3-(4-аминофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 35 см 3 тетрагидрофурана при температуре около 20 С и в атмосфере аргона добавляют 0,704 см 3 2-фтор-5 трифторметилфенилизоцианата и 0,678 см 3 триэтиламина. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа),получая остаток, который обрабатывают с помощью 40 см 3 этилацетата. Органическую фазу промывают 3 раза по 20 см 3 воды и 30 см 3 водного насыщенного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,1 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5, затем 1:1:0, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,3 г 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 2-карбоксамида в виде твердого вещества желтого цвета, плавящегося при температуре 236 С. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 6,15 (т, J=2,5 Гц: 1 Н); 6,89 (т, J=2,5 Гц: 1 Н); 6,10-7,30 (очень уш.мт: 2 Н); 7,34-7,42 (мт: 3H); 7,44-7,54 (мт: 3H); 8,63 (дд, J=8,5 и 2,5 Гц: 1 Н); 8,90 (уш.д, J=3 Гц: 1 Н); 9,21 (уш.с: 1 Н); 11,4 (уш.с: 1 Н). 3-(4-Аминофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. Суспензию 0,3 г (1,387 ммоль) метил-3-(4-аминофенил)-1 Н-пиррол-2-карбоксилата в 50 см 3 22%ного водного раствора гидроксида аммония нагревают в автоклаве при температуре около 50 С при давлении 12 бар в течение 20 ч. После прекращения нагревания, затем возврата к комнатной температуре и атмосферному давлению реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,31 г твердого вещества оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонтрил (96:2:2, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,085 г 3-(4-аминофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета; молекулярная масса = 201; IE: m/z = 201 M+-; m/z = 184 [M-NH3]+.; m/z = 155 [MH2CONH2]+. Метил-3-(4-аминофенил)-1 Н-пиррол-2-карбоксилат может быть получен следующим образом. К суспензии 0,1 г (0,942 ммоль) 10%-ного палладия-на-угле в 35 см 3 метанола добавляют при температуре около 20 С 1 г (4,061 ммоль) метил-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксилата. После гидрирования в течение 20 ч в автоклаве при давлении 3 бар водорода и при температуре около 35 С реакционную смесь отфильтровывают, катализатор промывают 2 раза по 5 см 3 метанола, затем фильтрат кон- 11012267 центрируют досуха при пониженном давлении (2,7 кПа), получая 0,67 г метил-3-(4-аминофенил)-1 Нпиррол-2-карбоксилата в виде твердого вещества оранжевого цвета; молекулярная масса = 216; IE:m/z=216 M+.; m/z=184 [M-СН 3 ОН]+.; m/z=155 [M-H2COOCH3]+. Метил-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксилат может быть получен следующим образом. К суспензии 1,62 г (40,63 ммоль) гидрида натрия в виде 60%-ной дисперсии в минеральном масле, в 100 см 3 тетрагидрофурана в течение 25 мин при температуре около 20 С и в атмосфере аргона по каплям добавляют смесь 5,87 г (19,35 ммоль) 1-[(Е)-2-(4-метилфенил)сульфонилвинил]-4-нитробензола и 3,7 см 3(38,7 ммоль) метилизоцианацетата в виде раствора в 150 см 3 тетрагидрофурана. После перемешивания в течение 5 ч при температуре около 20 С реакционную смесь обрабатывают смесью из 100 см 3 воды и 200 см 3 этилацетата. Органическую фазу промывают 2 раза по 100 см 3 воды и 150 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 5,3 г масла коричневого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан]. После концентрирования фракций при пониженном давлении получают 2,12 г метил-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксилата в виде твердого вещества желтого цвета; молекулярная масса = 246; IE: m/z = 246 M+.; m/z = 214 [M-CH3OH]+. 1-[(Е)-2-(4-Метилфенил)сульфонилвинил]-4-нитробензол может быть получен следующим образом. К 15 г (85,47 ммоль) метил-п-толилсульфона в виде раствора в 450 см 3 тетрагидрофурана добавляют при температуре около 0 С и в атмосфере аргона 117,5 см 3 (188 ммоль) 1,06 М раствора н-бутиллития в гексане. После перемешивания в течение 30 мин при температуре около 0 С добавляют в атмосфере аргона 13 см 3 (85,47 ммоль) диэтилхлорфосфата в виде раствора в 70 см 3 тетрагидрофурана. После перемешивания в течение 30 мин при температуре около 0 С реакционную смесь охлаждают до температуры около -78 С, затем добавляют в атмосфере аргона 13,05 г (85,47 ммоль) 4-нитробензальдегида в виде раствора в 130 см 3 тетрагидрофурана. После перемешивания в течение 1 ч при температуре около -78 С температуру реакционной смеси оставляют повышаться до температуры около 20 С, добавляют 100 см 3 воды и концентрируют при пониженном давлении (2,7 кПа), получая твердое вещество бежевого цвета. Это твердое вещество перемешивают в 250 см 3 воды в течение 20 мин, отфильтровывают, промывают 3 раза по 40 см 3 воды, высушивают в сушильном шкафу при пониженном давлении (2,7 кПа) при температуре 35 С в течение 5 ч, получая 25,43 г 1-[(Е)-2-(4-метилфенил)сульфонилвинил]-4-нитробензола в виде твердого вещства бежевого цвета, плавящегося при температуре 176 С; молекулярная масса = 303; IE: 4-трет-Бутилоксикарбониламино-3-(4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 2-карбоксамид. К 0,096 г (0,303 ммоль) 4-трет-бутилоксикарбониламино-3-(4-аминофенил)-1 Н-пиррол-2 карбоксамида в виде раствора в 11 см 3 тетрагидрофурана добавляют при температуре около 25 С и в атмосфере аргона 0,044 см 3 2-фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 1 ч при температуре около 20 С реакционную смесь разбавляют с помощью 40 см 3 этилацетата, затем промывают 3 раза по 15 см 3 воды и 15 см 3 водного насыщенного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,181 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,15 г 4-трет-бутилоксикарбониламино-3-4-[3-(2-фтор-5 трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета. 1 Н-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 1,35 (уш.с, 9 Н); 5,70 (уш.м, 1 Н); 6,88 (уш.с, 1 Н); 7,05 (уш.м,1 Н); 7,26 (д, J=8,5 Гц, 2 Н); 7,39 (м, 1 Н); 7,49 (м частично скрытый, 1 Н); 7,49 (д, J=8,5 Гц, 2 Н); 7,70 (уш.с,1 Н); 8,62 (дд, J=2,5 и 7,5 Гц, 1 Н); 9,03 (уш.с, 1 Н); 9,36 (с, 1 Н); 11,3 (уш.с, 1 Н); ES+: m/z = 522: [М+Н]+; ES-:m/z = 520: [M-H]-. 4-трет-Бутилоксикарбониламино-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. К суспензии 0,024 г (0,222 моль) 10%-ного палладия-на угле в 63 см 3 метанола добавляют при температуре около 20 С 0,331 г (0,956 ммоль) 4-трет-бутилоксикарбониламино-3-(4-нитрофенил)-1 Нпиррол-2-карбоксамида. После гидрирования в течение 5 ч в автоклаве при давлении 4 бар водорода и- 12012267 при температуре около 40 С, реакционную смесь отфильтровывают. Катализатор промывают 2 раза по 15 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,3 г 4-трет-бутилоксикарбониламино-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества белого цвета, плавящегося при температуре около 142 С; EI: m/z=316 M+.; m/z = 260 [М-трет-Bu]+.;m/z = 243 [М-О-трет-Bu]+; m/z = 199 [243-CONH2]+; m/z=57 [трет-Bu] пик молекулярного иона. 4-трет-Бутилоксикарбониламино-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. К 0,45 г (1,635 ммоль) 5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоновой кислоты в виде суспензии в 15 см 3 ацетонитрила добавляют при температуре около 5 С и в атмосфере аргона 0,214 см 3 триэтиламина, затем 0,370 см 3 дифеноксифосфорил-азида. Реакционную среду выдерживают в течение 30 мин вплоть до установления температуры около 20 С, после чего нагревают в течение 2,5 ч при температуре около 60 С. Реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая масло коричневого цвета, которое обрабатывают с помощью 25 см 3 трет-бутанола. После перемешивания в течение 2 ч при температуре около 60 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,56 г твердого вещества цвета охры, которое очищают флэшхроматографией [элюент: дихлорметан/метанол/ацетонитрил (96:2:2, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,331 г 4-трет-бутилоксикарбониламино-3-(4 нитрофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): EI: m/z = 346 M+.; m/z=290 [М-трет-Bu]+.; m/z = 273 [М-Отрет-Bu]+; m/z = 229 [273-CONH2]+; m/z=57 [трет-Bu]+ пик молекулярного иона. 5-Карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоновая кислота может быть получена следующим образом. Раствор 2,8 г (9,232 ммоль) этил-5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилата в 33,6 см 3 (0,614 моль) концентрированной серной кислоты нагревают при температуре около 80 С в течение 2 ч. Реакционную смесь медленно и при перемешивании выливают в 350 см 3 смеси воды со льдом. После перемешивания в течение 30 мин реакционную смесь фильтруют через фильтр из плавленого стекла 3. Твердое вещество промывают 4 раза по 100 см 3 холодной воды, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 45 С в течение 24 ч, получая 2,25 г 5-карбамоил-4-(4 нитрофенил)-1 Н-пиррол-3-карбоновой кислоты в виде твердого вещества бежевого цвета; ES+: m/z = 276[M+H]+; ES-: m/z = 274 [М-Н]-. Этил-5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилат может быть получен следующим образом. К 18 г (69,16 ммоль) этил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилата в виде суспензии в 300 см 3 дихлорметана добавляют при температуре около -24 С и в атмосфере аргона 8,1 см 3 (91,29 ммоль) хлорсульфонилизоцианата в виде раствора в 100 см 3 дихлорметана. После перемешивания в течение 30 мин при температуре около -24 С реакционную смесь выдерживают в течение 2 ч вплоть до установления температуры около 20 С. После инициирования кристаллизации с помощью стеклянной палочки, реакционную смесь перемешивают при температуре около 20 С в течение 30 мин. Реакционную смесь затем охлаждают до температуры около 5 С, после чего фильтруют через фильтр из плавленого стекла 3. Твердое вещество промывают 3 раза по 40 см 3 дихлорметана, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 40 С в течение 3 часов. Твердое вещество после этого суспендируют в 500 см 3 воды; полученную смесь затем нагревают при температуре около 40 С в течение 3 ч, после чего охлаждают до температуры около 5 С в течение 1 ч перед фильтрацией через фильтр из плавленого стекла 3. Твердое вещество промывают последовательно 2 раза по 50 см 3 воды и 2 раза по 30 см 3 петролейного эфира, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 40 С в течение 16 ч, получая 15,4 г этил-5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилата в виде твердого вещества бежевого цвета; EI: m/z = 303 M+.; m/z = 274 [M-CH2CH3]+; m/z = 258 [MОСН 2 СН 3]+.; m/z = 241 [258-ОН]+ пик молекулярного иона. Этил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилат может быть получен следующим образом. К суспензии 0,512 г (12,8 ммоль) гидрида лития, в виде 60%-ной дисперсии в минеральном масле, в 20 см 3 диэтилового эфира по каплям добавляют при температуре около 20 С и в атмосфере аргона смесь 2,212 г (10 ммоль) этил-4-нитроциннамата и 1,991 г (10,2 ммоль) тозилметилизоцианата в виде раствора в смеси из 18 см 3 диметилсульфоксида и 36 см 3 диэтилового эфира. После перемешивания в течение 1 ч при температуре кипения с обратным холодильником реакционную смесь обрабатывают смесью из 70 см 3 воды, 20 см 3 водного насыщенного раствора хлорида натрия и 100 см 3 этилацетата. Водную фазу экстрагируют с помощью 50 см 3 диэтилового эфира и 2 раза по 75 см 3 дихлорметана. Все органические фазы объединяют, сушат над безводным сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая масло черного цвета, которое обрабатывают смесью из 75 см 3 воды и 50 см 3 этилацетата. Водную фазу экстрагируют 2 раза по 50 см этилацетата. Все органические фазы объединяют, сушат над безводным сульфатом натрия, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,82 г твердого вещества черного цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат (3:2 по объемам)]. После концентрирования- 13012267 фракций при пониженном давлении получают 1,48 г твердого вещества оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан]. После концентрирования фракций при пониженном давлении получают 0,78 г этил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилата в виде твердого вещества желтого цвета; IE: m/z=260 (M+.) пик молекулярного иона; m/z = 215 (M-C2H5O+) ; m/z = 169 (215-NO2). Пример 3. 4-Амино-3-(4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид. К 0,15 г (0,288 ммоль) 4-трет-бутилоксикарбониламино-3-4-[3-(2-фтор-5-трифторметилфенил) уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде суспензии в 1 см 3 диоксана добавляют при температуре около 20 С 0,72 см 3 4 н. раствора хлороводорода в диоксане. После перемешивания в течение 5 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа),получая остаток, который очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил(градиент от 90:5:5 до 80:10:10, по объемам)]. После концентрирования фракций при пониженном давлении получают 85 мг твердого вещества желтого цвета, которое затем перемешивают в 4 см 3 пентана в течение 16 ч. После отфильтровывания через фильтр из плавленого стекла 3, твердое вещество промывают 2 раза по 1 см 3 пентана, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 40 С в течение 4 ч, получая 47 мг 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил 1 Н-пиррол-2-карбоксамидгидрохлорида в виде твердого вещества желтого цвета, плавящегося при температуре около 174 С. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 5,30-8,00 (м очень уш., 2 Н); 6,34 (д, J=2,5 Гц, 1 Н); 7,27 (д,J=8,5 Гц, 2 Н); 7,39 (м, 1 Н); 7,50 (м частично скрытый, 1 Н); 7,53 (д, J=8,5 Гц, 2 Н); 8,63 (уш.д, J=7,0 Гц,1 Н); 8,96 (уш.с, 1 Н); 9,29 (с, 1 Н); 10,7 (уш.с, 1 Н); ES+: m/z = 422: [М+Н]+; ES-: m/z = 420: [M-H]-. 4-трет-Бутилоксикарбониламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 2-карбоксамид может быть получен как описывается в примере 2. Пример 4. 4-[3-(2-Фтор-5-трифторметилфенил)уреидо]-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил 1 Н-пиррол-2-карбоксамид. К 0,107 г (0,254 ммоль) 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 2-карбоксамидгидрохлорида в виде раствора в 10 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,037 см 3 2-фтор-5-трифторметилфенилизоцианата и 0,035 см 3 триэтиламина. После перемешивания в течение 1 ч при температуре около 20 С реакционную смесь разбавляют с помощью 10 см 3 этилацетата, затем промывают последовательно 2 раза по 15 см 3 воды и 15 см 3 водного насыщенного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,27 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат (7:3 по объемам), затем дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,079 г 4-[3-(2-фтор-5-трифторметилфенил)уреидо]-3-4-[3-(2-фтор-5 трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества белого цвета,плавящегося при температуре в интервале от 186 до 190 С.(уш.с, 1 Н); 9,45 (уш.с, 1 Н); 11,3 (уш.с, 1 Н); ES+: m/z = 627 [M+H]+. 4-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид может быть получен как описывается в примере 3. Пример 5. 4-Ацетиламино-3-(4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамид. К 0,15 г (0,328 ммоль) 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамидгидро-хлорида в виде раствора в 4,5 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,023 см 3 ацетилхлорида, 0,091 см 3 триэтиламина и 8 мг 4 диметиламинопиридина. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь разбавляют с помощью 15 см 3 дихлорметана, затем промывают 2 раза по 10 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество, которое перекристаллизуют при нагревании из 5 см 3 дихлорметана. Перекристаллизованное твердое вещество отфильтровывают при использовании фильтра из плавленого стекла 3, промывают 2 раза по 3 см 3 дихлорметана, после чего высушивают при пониженном давлении (2,7 кПа) при температуре около 40 С в течение 5 ч, получая 0,084 г 4-ацетиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества белого цвета, плавящегося при температуре 228,5 С; ES+: m/z = 464(дд, J=2,5 и 7,5 Гц, 1 Н); 8,70 (с, 1 Н); 9,02 (уш.с, 1 Н); 9,36 (уш.с, 1 Н); 11,3 (уш.с, 1 Н). 4-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид может быть получен как описывается в примере 3. Пример 6. 4-(2-Диметиламиноацетиламино)-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-2-карбоксамид. К 0,15 г (0,328 ммоль) 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамидгидро-хлорида в виде раствора в 4,5 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,052 см 3 диметиламиноацетилхлоридгидрохлорида, 0,091 см 3 триэтиламина и 8 мг 4-диметиламинопиридина. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь разбавляют с помощью 15 см 3 дихлорметана, затем промывают 2 раза по 10 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 148 мг твердого вещества бежевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил(82:9:9 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,107 г 4(2-диметиламиноацетиламино)-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамида в виде твердого вещества желтого цвета, плавящегося при температуре 178 С; ES+:- 15012267 7,25-7,31 (м, 3H); 7,39 (м, 1 Н); 7,50 (м, 1 Н); 7,58 (д, J=8,5 Гц, 2 Н); 8,61 (м, 1 Н); 8,68 (с, 1 Н); 9,11 (уш.с,1 Н); 9,49 (уш.с, 1 Н); 11,35 (уш.с, 1 Н). 4-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид может быть получен как описывается в примере 3. Пример 7. 4-Бензоиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-2-карбоксамид. К 0,15 г (0,328 ммоль) 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамидгидрохлорида в виде раствора в 4,5 см 3 тетрагидрофурана добавляют, при температуре около 20 С и в атмосфере аргона, 0,038 см 3 бензоилхлорида и 0,091 см 3 триэтиламина. После перемешивания в течение 4 ч при температуре около 20 С реакционную смесь разбавляют с помощью 15 см 3 дихлорметана, затем промывают 2 раза по 10 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество, которое перекристаллизуют при нагревании из 5 см 3 метанола. Перекристаллизованное твердое вещество отфильтровывают при использовании фильтра из плавленого стекла 3, промывают 2 раза по 2 см 3 метанола, после чего высушивают при пониженном давлении (2,7 кПа) при температуре около 35 С в течение 5 ч, получая 0,075 г 4-бензоиламино-3-4-[3-(2-фтор-5 трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества белого цвета,плавящегося при температуре 239,7 С; ES+: m/z = 526 [M+H]+. 4-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид может быть получен как описывается в примере 3. Пример 8. 4-Никотиноиламино-3-(4-[3-(2-фтор-5-трифторметилфенил)-уреидо]фенил-1 Н-пиррол-2-карбоксамид. К 0,15 г (0,328 ммоль) 4-амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамидгидрохлорида в виде раствора в 4,5 см 3 тетрагидрофурана добавляют, при температуре около 20 С и в атмосфере аргона, 0,058 см 3 никотиноилхлоридгидрохлорида, 0,091 см 3 триэтиламина и 8 мг 4-диметиламинопиридина. После перемешивания в течение 16 ч при температуре кипения с обратным холодильником реакционную смесь разбавляют с помощью 15 см 3 дихлорметана, затем промывают 2 раза по 10 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния,отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 148 мг твердого вещества бежевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (82:9:9, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,01 г 4-никотиноиламино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-2-карбоксамида в виде твердого вещества желтого цвета. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 5,85 (уш.м, 1 Н) ; 7,12 (д, J=3,0 Гц, 1 Н); 7,33 (д, J=8,5 Гц,2 Н); 7,38 (м, 1 Н); 7,45-7,53 (м, 4 Н); 8,10 (м, 1 Н); 8,61 (м, 1 Н); 8,68 (дд, J=1,5 и 5,0 Гц, 1 Н); 8,92 (д, J=2,0 Гц, 1 Н); 8,93 (м, 1 Н); 9,25 (с, 1 Н); 9,52 (с, 1 Н); 11,5 (уш.с, 1 Н); ES+: m/z = 527: [M+H]+. 4-Амино-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамидгидрохлорид может быть получен как описывается в примере 3. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)-уреидо]фенил-1 Н-пиррол-3-карбоксилат. К 0,23 г (0,842 ммоль) этил-5-карбамоил-4-(4-аминофенил)-1 Н-пиррол-3-карбоксилата в виде раствора в 30 см 3 тетрагидрофурана добавляют, при температуре около 20 С и в атмосфере аргона, 0,122 см 3(0,842 ммоль) 2-фтор-5-трифторметилфенил-изоцианата. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь разбавляют с помощью 40 см 3 этилацетата, затем промывают последовательно 2 раза по 30 см 3 воды и 30 см 3 насыщенного водного раствора хлорида натрия, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении(2,7 кПа), получая 0,431 г твердого вещества желтого цвета, которое очищают флэш-хроматографией[элюент: дихлорметан/метанол/ацетонитрил (94:3:3, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,345 г твердого вещества желтого цвета, которое затем перемешивают в 5 см 3 дихлорметана в течение 1 ч. После отфильтровывания через фильтр из плавленого стекла 3,твердое вещество промывают 2 раза по 3 см 3 дихлорметана, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 30 С в течение 4 ч, получая 0,333 г этил-5-карбамоил-4-4-[3-(2 фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета, плавящегося при температуре 179 С. 1ES+: m/z = 479 [M+H]+; ES-: m/z=477 [M-H]-. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)-уреидо]фенил-1 Н-пиррол-3-карбоксилат может быть получен следующим образом. К суспензии 0,204 г (1,912 ммоль) 10%-ного палладия-на-угле в 140 см 3 метанола добавляют при температуре около 20 С 2,5 г (8,243 ммоль) этил-5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3 карбоксилата. После гидрирования в течение 4 ч в автоклаве при давлении водорода 4 бар и температуре около 35 С реакционную смесь отфильтровывают; катализатор затем промывают 2 раза по 20 см 3 метанола, после чего фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток,который вводят во второй раз в реакцию гидрирования при тех же условиях, что и вышеуказанные. Таким образом, после обработки, подобной таковой, описанной выше, получают 1,93 г этил-5-карбамоил-4(4-аминофенил)-1 Н-пиррол-3-карбоксилата в виде твердого вещества желтого цвета; EI: m/z=273 M+. пик молекулярного иона; m/z = 256 [M-NH3]+.; m/z = 228 [M-CONH3]+. Этил-5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоксилат может быть получен как описывается в примере 2. Продукты примеров 10-37 могут быть получены по аналогии с продуктом примера 9, исходя из этил-5-карбамоил-4-(4-аминофенил)-1 Н-пиррол-3-карбоксилата и соответствующего арил-изоцианата;LCMS были осуществлены на спектрометре LCT фирмы Micromass при использовании колонки Highpurity C18, 504,6 мм, частицы размером 5 мкм, фирмы Thermo; градиент, доходящий до 90% ацетонитрила за 5 мин (начальные условия: 95% воды с 0,5% ТФУК - 5% ацетонитрила). Пример 10. 5-Карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоновая кислота. К 0,14 г (0,497 ммоль) гидрохлорида 5-карбамоил-4-(4-аминофенил)-1 Н-пиррол-3-карбоновой кислоты в виде раствора в 18 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,072 см 3 (0,497 ммоль) 2-фтор-5-трифторметилфенилизоцианата и 0,07 см 3 (0,497 ммоль) триэтиламина. После перемешивания в течение 5 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который очищают флэшхроматографией [элюент: дихлорметан/метанол/ацетонитрил (градиент от 90:5:5 до 80:10:10, по объемам)]. После концентрирования фракций при пониженном давлении получают твердое вещество, которое затем перемешивают в 5 см 3 пентана в течение 3 ч. После отфильтровывания через фильтр из плавленого стекла 3 твердое вещество промывают 2 раза по 1 см 3 пентана, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 30 С в течение 15 ч, получая 0,105 г 5-карбамоил-44-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоновой кислоты в виде твердого вещества желтого цвета, плавящегося при температуре 194 С. 1[M+H]+; ES-: m/z = 449 [M-H]-. Гидрохлорид 5-карбамоил-4-(4-аминофенил)-1 Н-пиррол-3-карбоновой кислоты может быть получен следующим образом. К суспензии 0,135 г (0,126 ммоль) 10%-ного палладия-на-угле в 20 см 3 метанола добавляют при температуре около 20 С 0,15 г (0,545 ммоль) 5-карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоновой кислоты. После гидрирования в течение 3 ч в автоклаве при давлении 3 бар водорода и при температуре- 23012267 около 30 С, реакционную смесь обрабатывают с помощью 5 см 3 4 н. раствора хлороводорода в диоксане,затем фильтруют. Катализатор промывают 2 раза по 2 см 3 4 н. раствора хлороводорода в диоксане, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,141 г гидрохлорида 5 карбамоил-4-(4-аминофенил)-1 Н-пиррол-3-карбоновой кислоты в виде твердого вещества желтого цвета;ES+: m/z = 246 [M+H]+. 5-Карбамоил-4-(4-нитрофенил)-1 Н-пиррол-3-карбоновая кислота может быть получена как описывается в примере 2. Пример 39. 4-(2,4-Диметоксибензиламино)карбонил-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-2-карбоксамид. К 0,321 см 3 (2,09 ммоль) 2,4-диметоксибензиламина в виде раствора в 10 см 3 толуола добавляют при температуре около 20 С и в атмосфере аргона 1,36 см 3 (2,717 ммоль) 2 М раствора триметилалюминия в толуоле, затем 0,5 г (1,045 ммоль) этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата. После перемешивания в течение 16 ч при температуре около 60 С реакционную смесь разбавляют с помощью 50 см 3 этилацетата, затем промывают последовательно 2 раза по 30 см 3 насыщенного водного раствора хлорида аммония и 2 раза по 25 см 3 воды. Полученную органическую фазу сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,52 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,170 г 4-(2,4 диметоксибензиламино)карбонил-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2 карбоксамида в виде твердого вещества желтого цвета, плавящегося при температуре выше 260 С. 1 Н-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 3,68 (с, 3H); 3,70 (с, 3H); 4,12 (д, J=6,0 Гц, 2 Н); 5,34 (уш.м,1 Н); 6,40 (дд, J=2,5 и 8,5 Гц, 1 Н); 6,46 (д, J=2,5 Гц, 1 Н); 6,86 (д, J=8,5 Гц, 1 Н); 6,99 (т, J=6,0 Гц, 1 Н); 7,17m/z=600 [M+H]+. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)-уреидо]фенил-1 Н-пиррол-3 карбоксилат может быть получен как описывается в примере 9. Пример 40. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2,4-дикарбоксамид. К 0,15 г (0,25 ммоль) 4-(2,4-диметоксибензиламино)карбонил-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]-фенил-1 Н-пиррол-2-карбоксамида в виде раствора в 3 см 3 толуола добавляют при температуре около 20 С и в атмосфере аргона 0,108 г моногидрата п-толуолсульфокислоты. После перемешивания в течение 48 ч при температуре около 65 С реакционную смесь разбавляют с помощью 0,25 см 3 метанола, затем рН доводят до значения 12-13 путем добавления 1 н. водного раствора гидроксида натрия. Реакционную среду экстрагируют 3 раза по 15 см 3 этилацетата. Органическую фазу промывают последовательно с помощью 20 см 3 воды и 20 см 3 насыщенного водного раствора хлорида натрия, затем сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,175 г твердого вещества желтого цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,047 г 3-4-[3-(2-фтор-5-трифторметилфенил) уреидо]фенил-1 Н-пиррол-2,4-дикарбоксамида в виде твердого вещества белого цвета, плавящегося при температуре 196 С. 1 Н-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 5,32 (уш.м, 1 Н); 6,41-6,77 (уш.м, 2 Н); 7,15 (уш.м, 1 Н); 7,24(дд, J=2,0 и 7,5 Гц, 1 Н); 9,11 (уш.с, 1 Н); 9,46 (уш.с, 1 Н); 11,85 (уш.с, 1 Н); ES+: m/z=450 [М+Н]+. 4-(2,4-Диметоксибензиламино)карбонил-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-2-карбоксамид может быть получен как описывается в примере 39. Пример 41. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-4-(4-метилпиперазин-1-карбонил)-1 Нпиррол-2-карбоксамид. Следуют методике, аналогичной таковой, описанной в примере 39, но исходя из Nметилпиперазина и этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол 3-карбоксилата. После подобной обработки получают 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-4-(4-метилпиперазин-1-карбонил)-1 Н-пиррол-2-карбоксамид; ES+: m/z=533 [M+H]+. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилат может быть получен как описывается в примере 9. Пример 42. 3-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-4-(пирролидин-1-карбонил)-1 Н-пиррол-2 карбоксамид. Следуют методике, аналогичной таковой, описанной в примере 39, но исходя из пирролидина и этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилата. После подобной обработки получают 3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-4(пирролидин-1-карбонил)-1 Н-пиррол-2-карбоксамид; ES+: m/z = 504 [M+H]+. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилат может быть получен как описывается в примере 9. Пример 43. 2-Диметиламиноэтил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-3-карбоксилат. К 0,12 г (0,266 ммоль) этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Нпиррол-3-карбоксилата в виде раствора в 4 см 3 диметилформамида добавляют при температуре около 20 С и в атмосфере аргона 0,06 см 3 2-диметиламиноэтанола, 0,085 см 3 триэтиламина, 112 мг 1-(3 диметиламинопропил)-3-этилкарбодиимидгидрохлорида и 80 мг 1-гидроксибензотриазолгидрата. После перемешивания в течение 3 ч при температуре около 70 С реакционную смесь выливают в 40 см 3 дистиллированной воды, затем перемешивают в течение 1 ч при температуре около 20 С. Реакционную смесь фильтруют через фильтр из плавленого стекла 3, твердое вещество промывают 2 раза по 5 см 3 воды, затем высушивают на воздухе, получая 0,065 г твердого вещества белого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/28%-ный водный раствор гидроксида аммония(12:2,25:0,38 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,04 г 2-диметиламиноэтил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3 карбоксилата в виде твердого вещества белого цвета; ES+: m/z = 522 [M+H]+; время удерживания: 6,61 мин. Этил-5-карбамоил-4-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-3-карбоксилат- 25012267 может быть получен как описывается в примере 9. Пример 44. 4-Хлор-3-(4-[3-(2-фтор-5-трифторметилфенил)уреидофенил-1 Н-пиррол-2-карбоксамид. К 0,03 г (0,127 ммоль) 4-хлор-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 2,7 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,019 см 3 (0,134 ммоль) 2-фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перекристаллизуют из 4 см 3 ацетонитрила. После отфильтровывания через фильтр из плавленого стекла 3 твердое вещество промывают с помощью 2 см 3 ацетонитрила, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 45 С в течение 2 ч, получая 0,037 г 4-хлор-34-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества белого цвета. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 5,83 (уш.м, 1 Н); 7,08 (с, 1 Н); 7,18 (уш.м, 1 Н); 7,28 (д, J=8,5 Гц, 2 Н); 7,38 (м, 1 Н); 7,50 (м частично скрытый, 1 Н); 7,55 (д, J=8,5 Гц, 2 Н); 8,62 (дд, J=2,0 и 7,5 Гц, 1 Н); 9,04 (уш.с, 1 Н); 9,39 (уш.с, 1 Н); 11,8 (уш.с, 1 Н); ES+: m/z=441 [M+H]+; ES-: m/z = 439 [M-H]-. 4-Хлор-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. К 0,136 г (0,512 ммоль) 4-хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 2,8 см 3 уксусной кислоты добавляют при температуре около 20 С и в атмосфере аргона 134 мг (2,048 ммоль) цинковой пыли. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь разбавляют с помощью 20 см 3 этилацетата и 15 см 3 воды, затем рН доводят до значения 8-9 путем добавления 1 н водного раствора гидроксида натрия. Водную фазу экстрагируют 2 раза по 15 см 3 этилацетата. Объединенные органические фазы сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,145 г твердого вещества оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,03 г 4-хлор-3-(4 аминофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества бежевого цвета; EI: m/z = 235 M+.;m/z = 218 [М-NH2]+.; m/z = 155 [M-Cl-CONH3]+; m/z = 44 [CONH2]+ пик молекулярного иона. 4-Хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамид и 5-хлор-3-(4-нитрофенил)-1 Н-пиррол-2 карбоксамид могут быть получены следующим образом. К 0,495 г (2,141 ммоль) 3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 13,7 см 3 ацетонитрила добавляют при температуре около 20 С и в атмосфере аргона 286 мг (1,868 ммоль) порошкообразного N-хлорсукцинимида. После перемешивания в течение 16 ч при температуре около 65 С реакционную смесь разбавляют с помощью 40 см 3 этилацетата, затем промывают последовательно 3 раза по 20 см 3 воды и 20 см 3 насыщенного водного раствора хлорида натрия. Полученную органическую фазу затем сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,45 г твердого вещества красного цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол/ацетонитрил (98:1:1, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,3 г смеси 4-хлор-3-(4-нитрофенил)-1 Н-пиррол-2 карбоксамида и 5-хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в пропорциях, соответствующих 55:45, в виде твердого вещества оранжевого цвета, которое очищают с помощью препаративной LC-MSВЭЖХ. Два изомера разделяли путем хроматографии: Аналитические контроли, чистота согласно ВЭЖХ с обращенной фазой: Таким образом, получают 0,136 г 4-хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета; EI: m/z = 265 M+. пик молекулярного иона; m/z=248 [M-NH3]+.; m/z=218[248-NO]+; и 0,120 мг 5-хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета; EI: m/z = 265 M+. пик молекулярного иона; m/z=248 [M-NH3]+.; m/z = 218 [248-NO]+. 3-(4-Нитрофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. К 1,96 г (5,139 ммоль) 2-(2,4-диметоксибензиламино)карбонил-3-(4-нитрофенил)-1 Н-пиррола в виде раствора в 55 см 3 толуола добавляют при температуре около 20 С и в атмосфере аргона 2,224 г (11,69 ммоль) моногидрата п-толуолсульфокислоты. После перемешивания в течение 4,5 ч при температуре около 65 С реакционную смесь разбавляют с помощью 70 см 3 этилацетата, затем промывают последовательно 3 раза по 50 см 3 воды и 50 см 3 насыщенного водного раствора хлорида натрия. Полученную орга- 27012267 ническую фазу сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество желтого цвета, которое затем перемешивают в 15 см 3 ацетонитрила в течение 16 ч. После отфильтровывания через фильтр из плавленого стекла 3,твердое вещество промывают 2 раза по 4 см 3 холодного ацетонитрила, после чего высушивают при пониженном давлении (2,7 кПа) при температуре около 35 С в течение 5 ч, получая 0,5 г 3-(4-нитрофенил)1 Н-пиррол-2-карбоксамида в виде твердого вещества цвета охры; EI: m/z = 231 М+. пик молекулярного иона; m/z=214 [M-NH3]+.; m/z = 184 [M-HNO2]+. 2-(2,4-Диметоксибензиламино)карбонил-3-(4-нитрофенил)-1 Н-пиррол может быть получен следующим образом. К 2,435 см 3 (15,84 ммоль) 2,4-диметоксибензиламина в виде раствора в 65 см 3 толуола добавляют,при температуре около 20 С и в атмосфере аргона, 10,3 см 3 (20,59 ммоль) 2 М раствора триэтилалюминия в толуоле, затем 1,95 г (7,92 ммоль) метил-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксилата. После перемешивания в течение 1 ч при температуре около 20 С, затем в течение 16 ч при температуре около 60 С реакционную смесь разбавляют с помощью 170 см 3 этилацетата. Полученный раствор промывают последовательно 3 раза по 70 см 3 насыщенного водного раствора хлорида аммония и 2 раза по 50 см 3 воды, затем сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество желтого цвета, которое затем перемешивают в 20 см 3 ацетонитрила при температуре около 20 С в течение 30 мин. После отфильтровывания через фильтр из плавленого стекла 3 твердое вещество промывают с помощью 10 см 3 холодного ацетонитрила, после чего высушивают при пониженном давлении (2,7 кПа) при температуре около 35 С в течение 3 ч, получая 1,96 г 2-(2,4-димтоксибензиламино)карбонил-3-(4-нитрофенил)-1 Н-пиррола в виде твердого вещества желтого цвета; ES+: m/z = 382. [М+Н]+; ES-: 3 80 [М-Н]-. Метил-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксилат может быть получен, как описывается в примере 1. Пример 45. 5-Хлор-3-4-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамид. К 0,055 г (0,233 ммоль) 5-хлор-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 5 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,035 см 3 (0,245 ммоль) 2-фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перекристаллизуют из 4 см 3 ацетонитрила. После отфильтровывания через фильтр из плавленого стекла 3 твердое вещество промывают с помощью 2 см 3 ацетонитрила, затем высушивают при пониженном давлении (2,7 кПа) при температуре около 35 С в течение 4 ч, получая 0,076 г 5-хлор-34-[3-(2-фтор-5-трифторметилфенил)уреидо]фенил-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета. 1H-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 6,16 (с, 1 Н); 6,45 (уш.м, 1 Н); 7,12 (уш.м, 1 Н); 7,38 (м частично скрытый, 1 Н); 7,40 (д, J=9,0 Гц, 2 Н); 7,45 (д, J=9,0 Гц, 2 Н); 7,49 (дд, J=9,0 и 11,0 Гц, 1 Н); 8,63 (дд,J=2,0 и 7,5 Гц, 1 Н); 8,90 (д, J=2,5 Гц, 1 Н); 9,22 (с, 1 Н); 12,1 (уш.м, 1 Н); ES+: m/z = 291 [M+Na]+. 5-Хлор-3-(4-аминофенил)-1 Н-пиррол-2-карбоксамид может быть получен следующим образом. К 0,12 г (0,452 ммоль) 5-хлор-3-(4-нитрофенил)-1 Н-пиррол-2-карбоксамида в виде раствора в 2,36 см 3 уксусной кислоты добавляют при температуре около 20 С и в атмосфере аргона 118 мг (1,806 ммоль) цинковой пыли. После перемешивания в течение 2 ч при температуре около 20 С реакционную смесь разбавляют с помощью 30 см 3 этилацетата и 15 см 3 воды, затем рН доводят до значения 8-9 путем добавления 1 н. водного раствора гидроксида натрия. Водную фазу экстрагируют 2 раза по 20 см 3 этилацетата. Органические фазы объединяют, сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,103 г твердого вещества оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90:5:5 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,055 г 5-хлор-3-(4 аминофенил)-1 Н-пиррол-2-карбоксамида в виде твердого вещества желтого цвета; EI: m/z = 235 M+.; m/z 5-4-[3-(2-Фтор-5-трифторметилфенил)уреидо]фенил-3H-имидазол-4-карбоксамид. К 0,055 г (0,272 ммоль) 5-(4-аминофенил)-3H-имидазол-4-карбоксамида в виде раствора в 4 см 3 тетрагидрофурана добавляют при температуре около 20 С и в атмосфере аргона 0,040 см 3 (0,272 ммоль) 2 фтор-5-трифторметилфенилизоцианата. После перемешивания в течение 16 ч при температуре около 20 С реакционную смесь отфильтровывают через фильтр из плавленого стекла 3. Полученное твердое вещество промывают последовательно 3 раза по 2 см 3 тетрагидрофурана и 3 раза по 2 см 3 пентана, затем высушивают при пониженном давлении (2,7 кПа), получая 0,058 г 5-4-[3-(2-фтор-5 трифторметилфенил)уреидо]фенил-3H-имидазол-4-карбоксамида в виде твердого вещества бежевого цвета, плавящегося при температуре 325 С. 1 Н-ЯМР (400 МГц, ДМСО-d6)(в м.д.): 6,98 (уш.м, 1 Н); 7,30 (уш.м, 1 Н); 7,40 (м, 1 Н); 7,49 (м частично скрытый, 1 Н); 7,51 (д, J=8,5 Гц, 2 Н); 7,71 (с, 1 Н); 7,82 (д, J=8,5 Гц, 2 Н); 8,62 (дд, J=2,0 и 7,5 Гц,1 Н); 9,00 (уш.с, 1 Н); 9,37 (уш.с, 1 Н); 12,65 (уш.м, 1 Н); EI: m/z=407 M+.; m/z = 205 [C8H3NOF4]+. пик молекулярного иона; m/z = 179 [C7H5NF4]+ 5-(4-Аминофенил)-3H-имидазол-4-карбоксамид может быть получен следующим образом. К суспензии 0,009 г (0,081 ммоль) 10%-ного палладия-на-угле в 20 см 3 метанола добавляют при температуре около 20 С, 0,04 г (0,172 ммоль) 5-(4-нитрофенил)-3H-имидазол-4-карбоксамида. После гидрирования в течение 3 ч в автоклаве при давлении водорода 3 бар при температуре около 25 С реакционную смесь отфильтровывают. Катализатор промывают 2 раза по 2 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,034 г 5-(4-аминофенил)-3Hимидазол-4-карбоксамида в виде твердого вещества каштанового цвета. EI: m/z = 202 M+.; CI: m/z = 203[M+H]+; ES+: m/z = 203 [M+H]+; ES-: m/z = 201 [M-H]-. 5-(4-Нитрофенил)-3H-имидазол-4-карбоксамид может быть получен следующим образом. Раствор 0,05 г (0,192 ммоль) этил-5-(4-нитрофенил)-3H-имидазол-4-карбоксилата в 4 см 3 7 н. раствора аммиака в метаноле и 8 см 3 28%-ного водного раствора гидроксида аммония нагревают в автоклаве при температуре около 80 С при давлении 12 бар в течение 20 ч. После прекращения нагревания, затем возврата к комнатной температуре и атмосферному давлению, реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,068 г твердого вещества, которое очищают флэшхроматографией [элюент: этилацетат/метанол (95:5, по объемам)]. После концентрирования фракций при пониженном давлении получают 0,012 г 5-(4-нитрофенил)-3H-имидазол-4-карбоксамида в виде твердого вещества белого цвета; EI: m/z = 232 M+.: m/z = 231 [M-H]- пик молекулярного иона; CI: m/z=233 [M+H]+;m/z=250 [M+NH4]+ пик молекулярного иона. Этил-5-(4-нитрофенил)-3H-имидазол-4-карбоксилат может быть получен следующим образом. К 4,572 г (59,32 ммоль) ацетата аммония в виде раствора в 60 см 3 уксусной кислоты добавляют при температуре около 20 С и в атмосфере аргона 1,493 г (5,93 ммоль) этил-3-(4-нитрофенил)-2,3 диоксопропионата и 32,06 г (356 ммоль) формальдегида. После перемешивания в течение 4 ч при температуре около 65 С реакционную смесь отфильтровывают через фильтр из плавленого стекла 3. Полученное твердое вещество промывают с помощью 50 см 3 метанола, затем фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают с помощью 30 см 3 дихлорметана. Полученный раствор промывают последовательно с помощью 30 см 3 насыщенного водного раствора карбоната натрия, 30 см 3 воды и 30 см 3 насыщенного водного раствора хлорида натрия, затем сушат над безводным сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество желтого цвета, которое очищают флэш-хроматографией[элюент: этилацетат/циклогексан (4:1 по объемам)]. После концентрирования фракций при пониженном давлении получают 0,197 г этил-5-(4-нитрофенил)-3H-имидазол-4-карбоксамида в виде твердого вещества желтого цвета; EI: m/z = 261 M+. пик молекулярного иона; m/z=215 [M-HOEt]+. Этил-3-(4-нитрофенил)-2,3-диоксопропионат может быть получен как описывается в литературе авторами Dayer Francis; Huu Le Dao; Gold Hellmut; Rod6-Gowal Heike; Dahn Hans; Helvetica Chimica Acta,57(7), 2201-2209 (1974). Определение активности соединений - эксперментальные протоколы. 1. FAK. Ингибирующее действие соединений в отношении FAK устанавливали путем определения ингибирования автофосфорилирования фермента, используя тест разрешенной во времени флуоресценции(HTRF). Полную кДНК человеческой FAK, N-конец которой маркирован по гистидину, клонировали в вектор экспрессии бакуловируса pFastBac HTc. Белок экспрессировали и очищали до гомогенности примерно 70%. Киназную активность определяли путем инкубирования фермента (6,6 мкг/мл) с различными концентрациями тестируемого соединения в буфере 50 мМ Гепес, рН=7,2, 10 мМ MgCl2, 100 мкМ Na3VO4,15 мкМ АТФ, в течение 1 ч при температуре 37 С. Ферментативную реакцию прекращали путем добавления буфера Гепес, рН 7,0, содержащего 0,4 мМ KF, 133 мМ этилендиаминтетрауксусной кислоты(ЭДТУ), 0,1% бычьего сывороточного альбумина и маркировку осуществляли в течение 1-2 ч при комнатной температуре путем добавления в этот буфер антитела к гистидину, маркированного с помощьюXL665, и моноклонального фосфоспецифического к тирозину антитела, конъюгированного с криптатом европия (Еи-К). Характеристики двух флуорофоров приводятся G. Mathis и др. в Anticancer Research, 17,3011-3014 (1997). Перенос энергии от возбужденного криптата европия на XL665-акцептор, пропорционален степени автофосфорилирования FAK. Сигнал специфической стабильной длительности XL-665 измеряли в счетчике бляшек Packard Discovery. Все тесты осуществляли в двух повторениях и рассчитывали среднее из двух тестов. Ингибирование активности автофосфорилирования FAK с помощью соединений согласно изобретению выражали в процентах ингибирования по отношению к контролю, активность которого определяли в отсутствие тестируемого соединения. Для расчета процента ингибирования рассматривали соотношение [сигнал при 665 нм/сигнал при 620 нм]. 2. KDR. Ингибирующее действие соединений определяли в тесте фосфорилирования субстрата с помощью фермента KDR in vitro методом сцинтилляции (96-луночный планшет, NEN). Цитоплазматический домен человеческого фермента KDR клонировали в виде гибрида GST в вектор экспрессии бакуловируса pFastBac. Белок экспрессировали в клетках SF21 и очищали до гомогенности примерно 60%. Киназную активность KDR определяли в буфере 20 мМ MOPS, 10 мМ MgCl2, 10 мМ MnCl2, 1 мМ дитиотреитола, 2,5 мМ EGTA, 10 мМ b-глицерофосфата, рН=7,2, в присутствии 10 мМ MgCl2, 100 мкМNa3VO4, 1 мМ NaF. 10 мкл соединения добавляли к 70 мкл киназного буфера, содержащего 100 нг фермента KDR, при температуре 4 С. Реакцию инициировали путем добавления 20 мкл раствора, содержащего 2 мкг субстрата (фрагмент SH2-SH3 PLC, экспрессированного в виде гибридного белка GST), 2 мкКи 33 Р[АТФ] и 2 мкМ нерадиоактивного АТФ. После инкубации в течение 1 часа при температуре 37 С, реакцию прекращали путем добавления 1 объема (100 мкл) 200 мМ ЭДТУ. Буфер для инкубации удаляли и лунки промывали три раза с помощью 300 мкл забуференного фосфатом физиологического раствора (PBS). Радиоактивность измеряли в каждой лунке, используя счетчик радиоактивности TopCount NXT (Packard). Фон определяли путем измерения радиоактивности в четырех разных лунках, содержащих только радиоактивный АТФ и субстрат. Контроль полной активности оценивали в четырех разных лунках, содержащих все реагенты (33 Р[АТФ], KDR и субстрат PLC), но в отсутствие соединения. Ингибирование активности KDR с помощью соединения согласно настоящему изобретению выражали в процентах ингибирования по отношению к контрольной активности, определяемой в отсутствие соединения. Соединение SU5 614 (Calbiochem) (1 мкМ) включали в каждый планшет в качестве контроля ингибирования. 3. Tie2. Кодирующую последовательность человеческого Tie2, соответствующую аминокислотам внутриклеточного домена 776-1124, получали путем полимеразной цепной реакции (PCR), используя кДНК,выделенную из человеческой плаценты, в качестве модели. Эту последовательность встраивали в вектор экспрессии бакуловируса pFastBacGT в виде гибридного белка GST. Ингибирующее действие молекул определяли в тесте фосфорилирования PLC с помощью Tie2 в присутствии GST-Tie2, очищенного до гомогенности примерно 80%. Субстрат состоял из фрагментовSH2-SH3 PLC, зкспрессированного в виде гибридного белка GST. Киназную активность Tie2 определяли в буфере 20 мМ MOPS, рН=7,2, содержащем 10 мМ MgCl2,10 мМ MnCl2, 1 мМ дитиотреитола, 10 мМ глицерофосфата. В 96-луночный планшет FlashPlate, выдерживаемый на льду, вносили реакционную смесь, состоящую из 70 мкл киназного буфера, содержащего 100 нг фермента GST-Tie2, на лунку. Затем добавляли 10 мкл тестируемой молекулы, разведенной в ДМСО до концентрации максимально 10%. Для данной концентрации каждое измерение осуществляли в четырех повторениях. Реакцию инициировали путем добавления 20 мкл раствора, содержащего 2 мкгGST-PLC, 2 мкМ нерадиоактивного АТФ и 1 мкКи 33 Р[АТФ]. После инкубации в течение 1 ч при температуре 37 С реакцию прекращали путем добавления 1 объема (100 мкл) 200 мМ ЭДТУ. После удаления буфера для инкубации лунки промывали три раза с помощью 300 мкл PBS. Радиоактивность определяли при использовании счетчика MicroBeta 1450, Wallac.
МПК / Метки
МПК: C07D 233/90, C07D 207/34, A61K 31/40, A61K 31/4164, A61K 35/00
Метки: способ, композиции, получения, содержащие, имидазолы, пирролы, применение, замещённые
Код ссылки
<a href="https://eas.patents.su/30-12267-zameshhyonnye-pirroly-i-imidazoly-soderzhashhie-ih-kompozicii-sposob-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые пирролы и имидазолы, содержащие их композиции, способ получения и применение</a>
Предыдущий патент: Сульфониламиноциклические соединения и их применение
Следующий патент: Способ газификации угля в псевдоожиженном слое и устройство для его осуществления
Случайный патент: Способ прогнозирования землетрясений