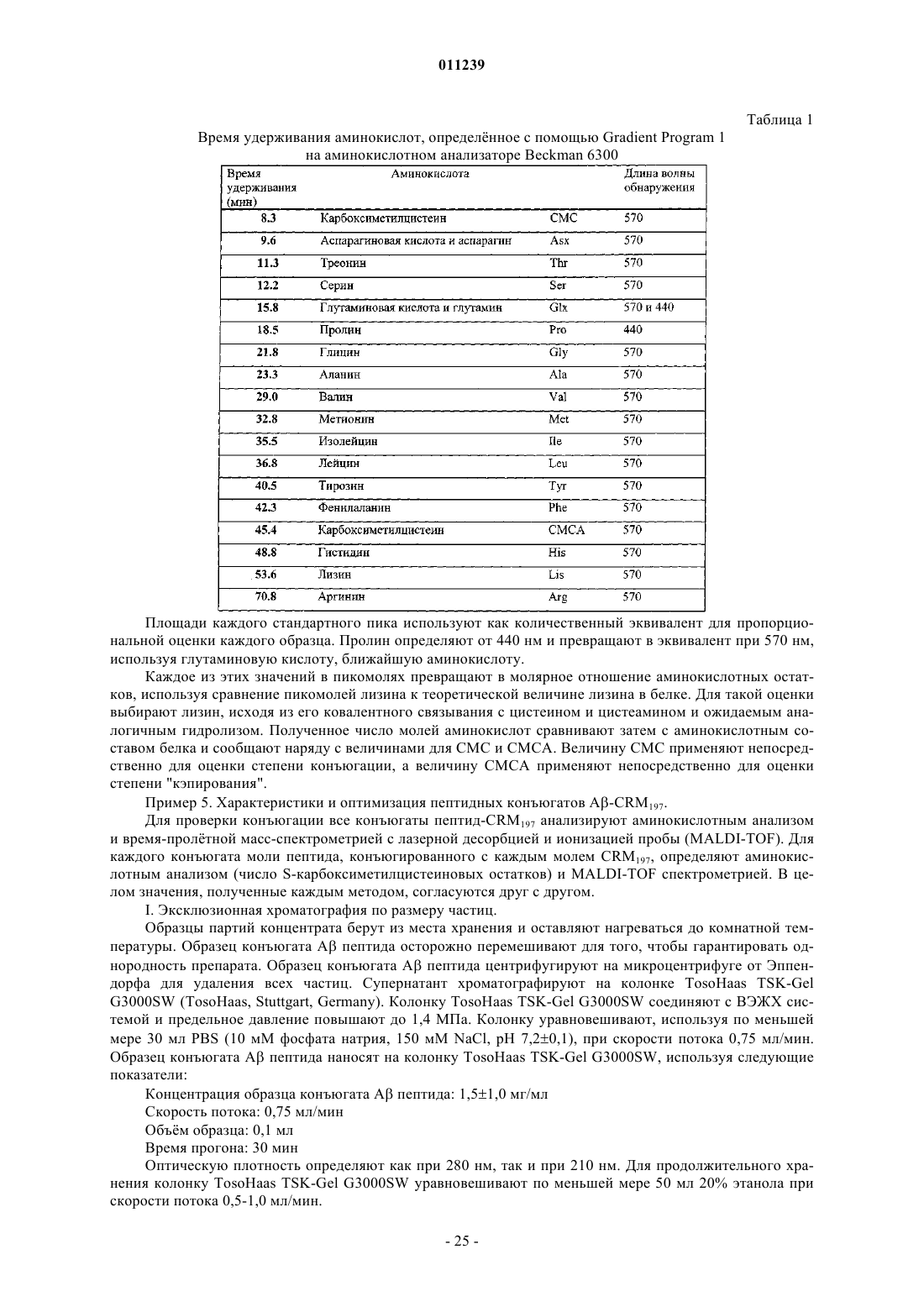
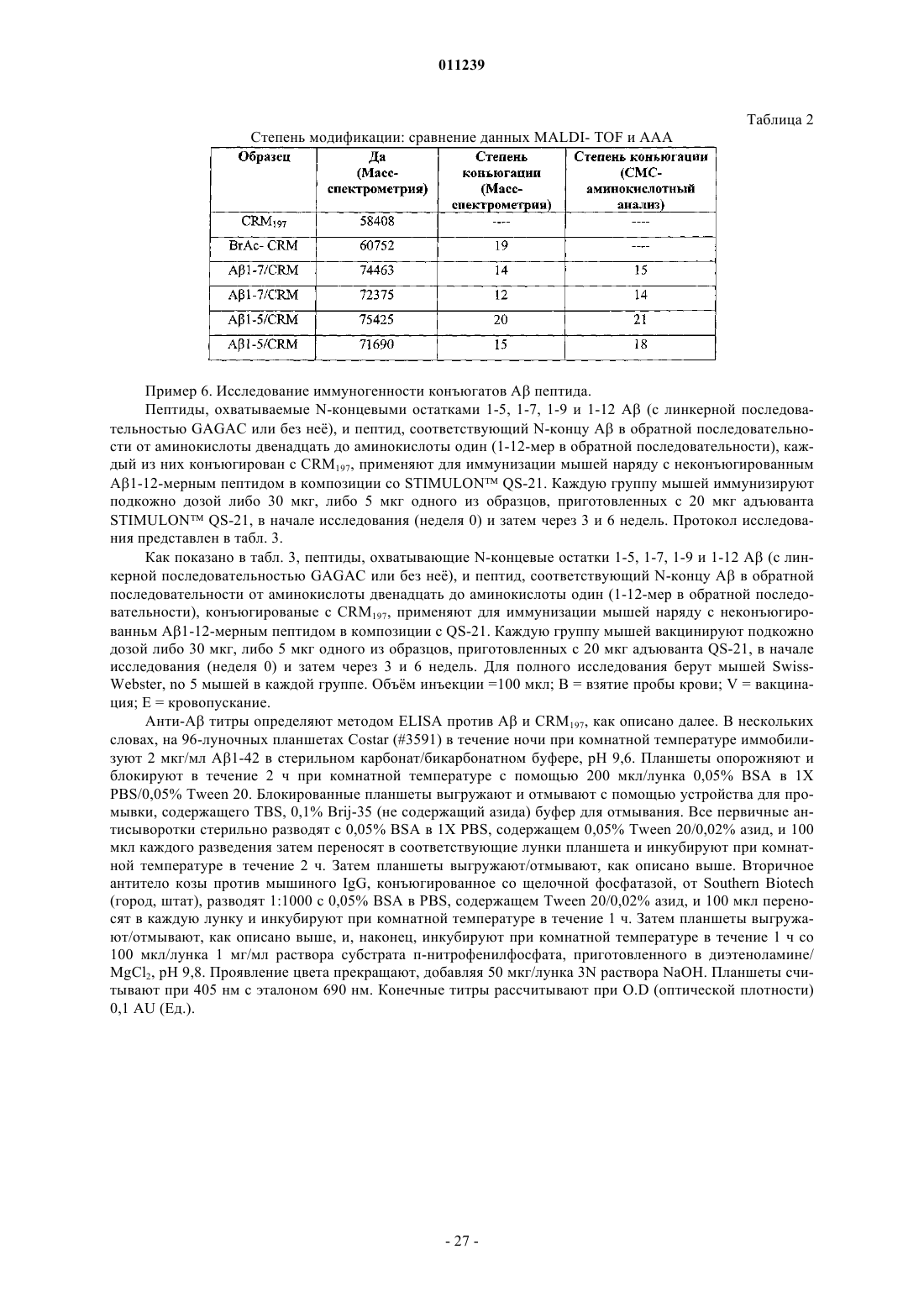
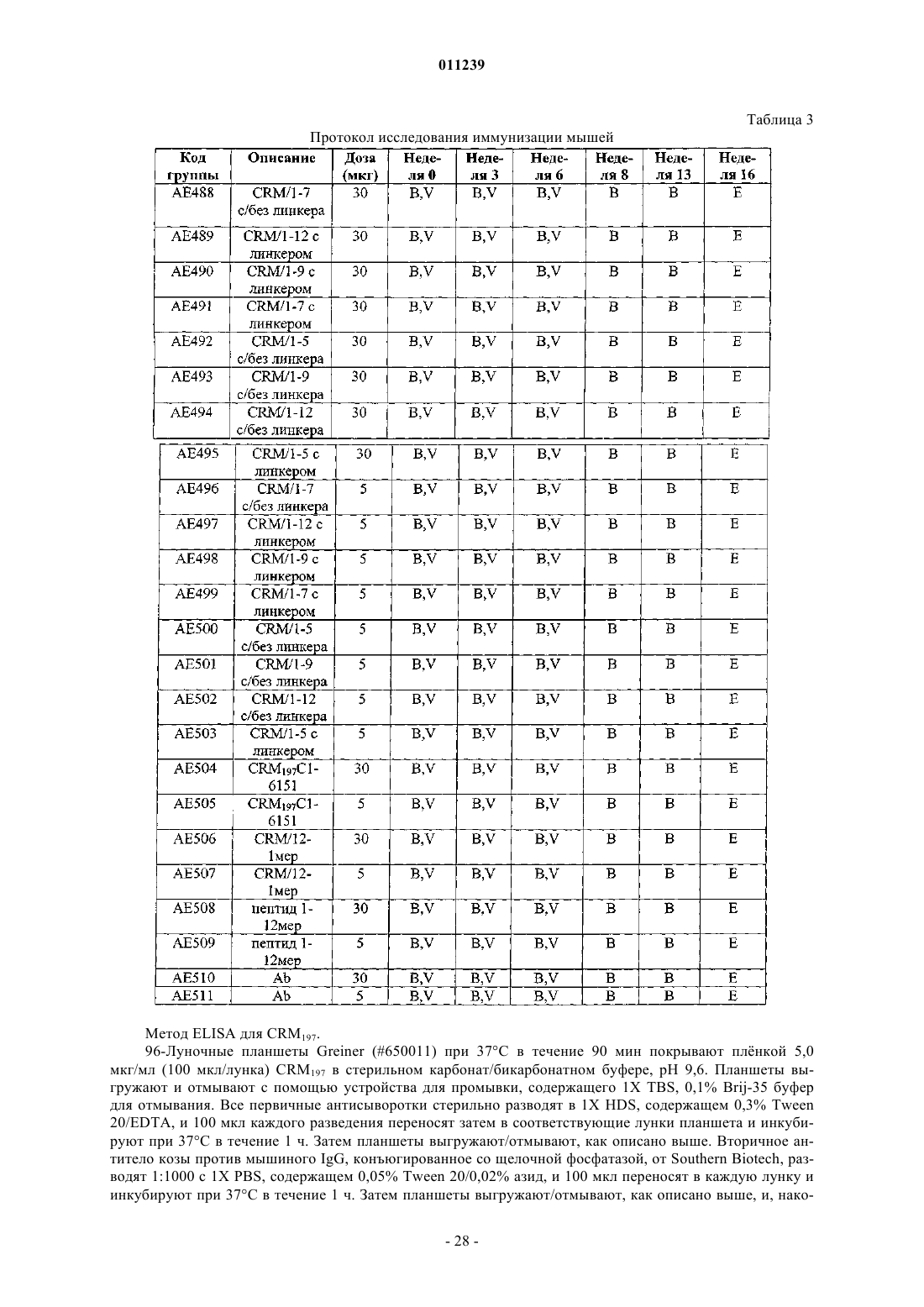
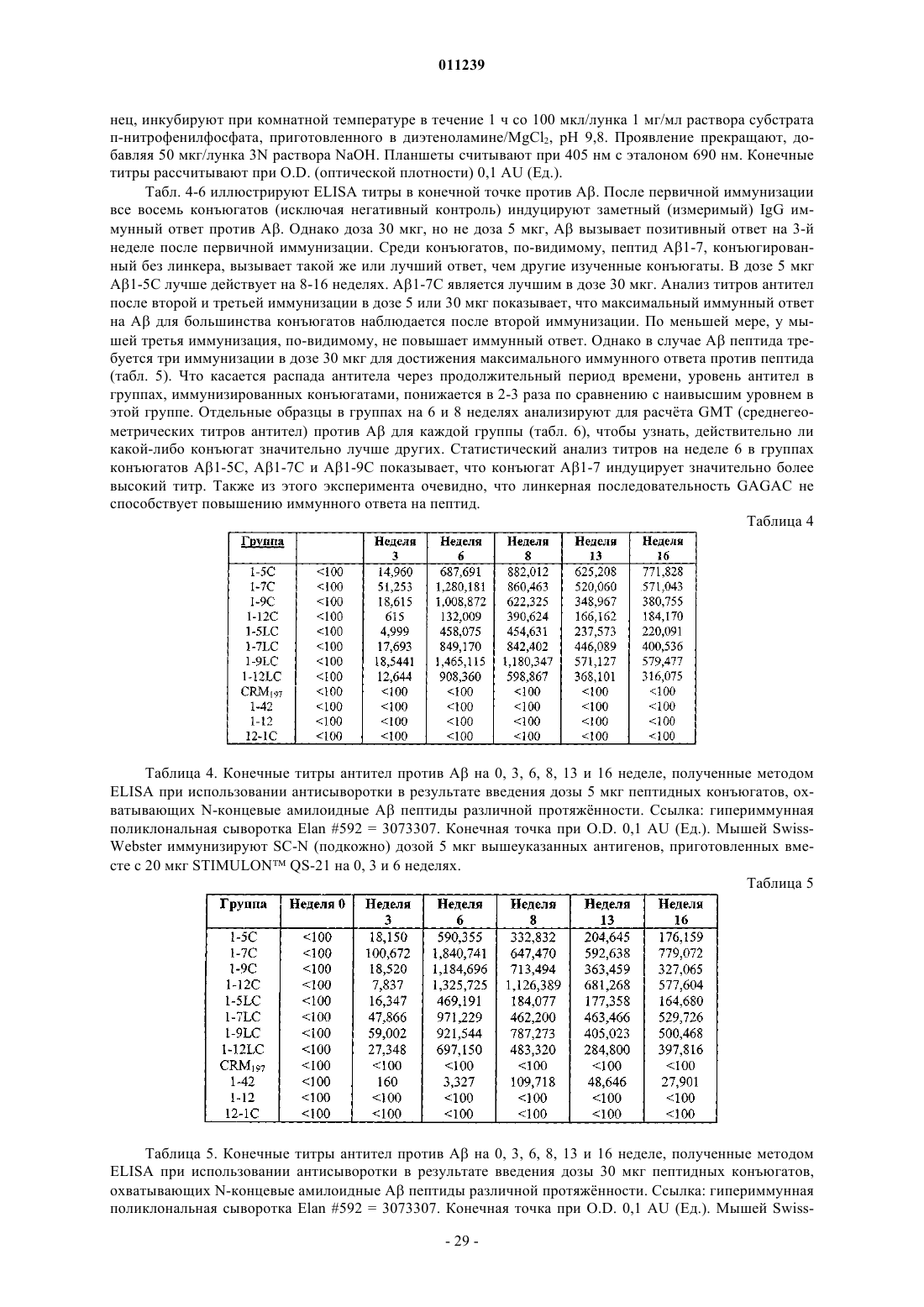
Конъюгаты aβ иммуногенных пептидных носителей и способы их получения
Формула / Реферат
1. Способ получения иммуногенного конъюгата, включающий стадии:
(а) введение реакционноспособной группы в аминокислотный остаток пептидного иммуногена, причём пептидный иммуноген представляет собой Ab пептид, или его фрагмент, или аналог;
(б) дериватизацию одной или более функциональных групп белка-носителя с целью получения активированной функциональной группы на белке-носителе;
(в) реакцию пептидного иммуногена стадии (а) с белком-носителем стадии (б) в условиях образования конъюгата, причём реакционноспособная группа пептидного иммуногена ковалентной связью связывается с активированной функциональной группой на белке-носителе; и
(г) последующую реакцию конъюгата стадии (в) с кэпирующим агентом для инактивации любой оставшейся активированной функциональной группы на белке-носителе для получения иммуногенного конъюгата.
2. Способ по п.1, отличающийся тем, что белок-носитель выбирают из группы, состоящей из человеческого сывороточного альбумина, гемоцианина лимфы улитки (KLH), молекул иммуноглобулина, тироглобулина, овальбумина, гемагглютинина вируса гриппа, полипептида PADRE, малярийного циркумспорозоитного (CS) белка, поверхностного антигена гепатита В (HBSAg 19-28), белка теплового шока (HSP) 65, Mycobacterium tuberculosis, холерогена, мутантов холерогена с пониженной токсичностью, дифтерийного токсина, белка CRM197, перекрёстно-реактивного с дифтерийным токсином, рекомбинантной стрептококковой С5а пептидазы, Streptococcus pyogenes ORF 1224, Streptococcus pyogenes ORF 1664, Streptococcus pyogenes ORF2452, пневмолизина Streptococcus pneumoniae, мутантов пневмолизина с пониженной токсичностью, Chlamydia pneumoniae ORF T367, Chlamydia pneumoniae ORF T858, столбнячного токсина, ВИЧ gp120 T1, микробных поверхностных компонентов, распознающих адгезивные молекулы матрикса (MSCRAMMS), факторов роста, гормонов, цитокинов и хемокинов.
3. Способ по п.2, отличающийся тем, что белок-носитель представляет собой CRM197.
4. Способ по п.1, отличающийся тем, что пептидный иммуноген представляет собой фрагмент Ab.
5. Способ по п.4, отличающийся тем, что фрагмент Ab выбирают из группы, состоящей из Ab 1-3, 1-4, 1-5, 1-6, 1-7, 1-9, 1-10,1-11, 1-12, 1-16, 1-28, 3-6, 3-7, 13-28, 15-24, 16-22, 16-23, 17-23, 17-24, 18-24, 18-25, 17-28, 25-35, 33-42, 35-40 и 35-42.
6. Способ по п.1, отличающийся тем, что функциональную группу белка-носителя дериватизируют с помощью сшивающего реагента.
7. Способ по п.6, отличающийся тем, что функциональную группу дериватизируют с помощью галогенацетильного агента.
8. Способ по п.1, отличающийся тем, что кэпирующий реагент, который используют для инактивации какой-либо активированной функциональной группы на белке-носителе, выбирают из группы реагентов, состоящей из цистеамина, N-ацетилцистеамина, этаноламина, гидроксида натрия, карбоната натрия, бикарбоната аммония и аммиака.
9. Иммуногенный конъюгат, содержащий пептидный иммуноген, связанный ковалентной связью с белком-носителем, отличающийся тем, что белок-носитель имеет формулу
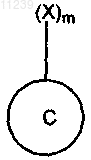
где С обозначает белок-носитель, а X обозначает дериватизируемую функциональную группу аминокислотного остатка на белке-носителе, и где m обозначает целое число больше 0, но меньше или равное 85, и где иммуногенный конъюгат имеет формулу
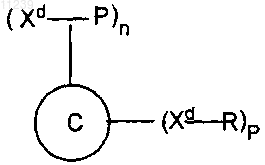
где С обозначает белок-носитель, a Xd обозначает дериватизируемую функциональную группу аминокислотного остатка белка-носителя, и где Р обозначает пептидный иммуноген, содержащий Ab пептид, или фрагменты Ab, или его аналоги, связанный ковалентной связью с помощью реакционноспособной группы аминокислотного остатка пептидного иммуногена с дериватизированной функциональной группой аминокислотного остатка белка-носителя, R обозначает кэпирующую молекулу, связанную ковалентной связью с дериватизированной функциональной группой аминокислотного остатка белка-носителя, тем самым предохраняется функциональность белка-носителя таким образом, что сохраняется его способность вызывать заданные иммунные ответы на пептидный иммуноген, содержащий Ab пептид, или фрагменты Ab, или его аналоги, чего в отсутствие носителя не происходило бы, n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85.
10. Иммуногенный конъюгат по п.9, отличающийся тем, что белок-носитель выбирают из группы, состоящей из человеческого сывороточного альбумина, гемоцианина лимфы улитки (KLH), молекул иммуноглобулина, тироглобулина, овальбумина, гемагглютинина вируса гриппа, полипептида PADRE, малярийного циркумспорозоитного (CS) белка, поверхностного антигена гепатита В (HBSAg 19-28), белка теплового шока (HSP) 65, Mycobacterium tuberculosis, холерогена, мутантов холерогена с пониженной токсичностью, дифтерийного токсина, белка CRM197 перекрёстно-реактивного с дифтерийным токсином, рекомбинантной стрептококковой С5а пептидазы, Streptococcus pyogenes ORF 1224, Streptococcus pyogenes ORF 1664, Streptococcus pyogenes ORF 2452, пневмолизина Streptococcus pneumoniae, мутантов пневмолизина с пониженной токсичностью, Chlamydia pneumoniae ORF T367, Chlamydia pneumoniae ORF T858, столбнячного токсина, ВИЧ gp120 T1, микробных поверхностных компонентов, распознающих адгезивные молекулы матрикса (MSCRAMMS), факторов роста, гормонов, цитокинов и хемокинов.
11. Иммуногенный конъюгат по п.10, отличающийся тем, что белок-носитель представляет собой CRM197.
12. Иммуногенный конъюгат по п.9, отличающийся тем, что пептидный иммуноген представляет собой фрагмент Ab.
13. Иммуногенный конъюгат по п.12, отличающийся тем, что этот фрагмент Ab выбирают из группы, состоящей из Ab 1-3, 1-4, 1-5, 1-6, 1-7, 1-9, 1-10, 1-11, 1-12, 1-16, 1-28, 3-6, 3-7, 13-28, 15-24, 16-22, 16-23, 17-23, 17-24, 18-24, 18-25, 17-28, 25-35, 33-42, 35-40 и 35-42.
14. Иммуногенный конъюгат, полученный способом по п.1 и имеющий формулу
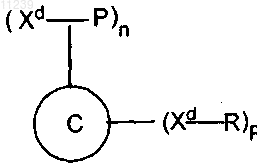
где С обозначает белок-носитель, а Xd обозначает дериватизированную функциональную группу аминокислотного остатка белка-носителя и где Р обозначает пептидный иммуноген, содержащий Ab пептид, или фрагменты Ab, или его аналоги, связанный ковалентной связью с помощью реакционноспособной группы аминокислотного остатка пептидного иммуногена с дериватизированной функциональной группой аминокислотного остатка белка-носителя, R обозначает кэпирующую молекулу, связанную ковалентной связью с дериватизированной функциональной группой аминокислотного остатка белка-носителя, что предохраняет функциональность носителя таким образом, что сохраняется его способность вызывать заданный иммунный ответ на пептидный иммуноген, чего в другом случае, без носителя, не происходило бы, n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85.
15. Иммуногенный конъюгат по п.14, отличающийся тем, что белок-носитель выбирают из группы, состоящей из человеческого сывороточного альбумина, гемоцианина лимфы улитки (KLH), молекул иммуноглобулина, тироглобулина, овальбумина, гемагглютинина вируса гриппа, полипептида PADRE, малярийного циркумспорозоитного (CS) белка, поверхностного антигена гепатита В (HBSAg 19-28), белка теплового шока (HSP) 65, Mycobacterium tuberculosis, холерогена, мутантов холерогена с пониженной токсичностью, дифтерийного токсина, белка CRM197, перекрёстно-реактивного с дифтерийным токсином, рекомбинантной стрептококковой С5а пептидазы, Streptococcus pyogenes ORF 1224, Streptococcus pyogenes ORF 1664, Streptococcus pyogenes ORF 2452, пневмолизина Streptococcus pneumoniae, мутантов пневмолизина с пониженной токсичностью, Chlamydia pneumoniae ORF T367, Chlamydia pneumoniae ORF T858, столбнячного токсина, ВИЧ gp120 T1, микробных поверхностных компонентов, распознающих адгезивные молекулы матрикса (MSCRAMMS), факторов роста, гормонов, цитокинов и хемокинов.
16. Иммуногенный конъюгат по п.15, отличающийся тем, что белок-носитель представляет собой CRM197.
17. Иммуногенный конъюгат по п.14, отличающийся тем, что пептидный иммуноген представляет собой фрагмент Аb.
18. Иммуногенный конъюгат по п.17, отличающийся тем, что этот фрагмент Ab выбирают из группы, состоящей из Ab 1-3, 1-4, 1-5, 1-6, 1-7, 1-9, 1-10, 1-11, 1-12, 1-16, 1-28, 3-6, 3-7, 13-28, 15-24, 16-22, 16-23, 17-23, 17-24, 18-24, 18-25, 17-28, 25-35, 33-42, 35-40 и 35-42.
19. Иммуногенная композиция, содержащая иммуногенный конъюгат пептидного иммуногена с белком-носителем, полученный способом по п.1, вместе с одним или более фармацевтически приемлемым эксципиентом, разбавителем и/или адъювантом.
20. Иммуногенная композиция по п.19, отличающаяся тем, что белок-носитель выбирают из группы, состоящей из человеческого сывороточного альбумина, гемоцианина лимфы улитки (KLH), молекул иммуноглобулина, тироглобулина, овальбумина, гемагглютинина вируса гриппа, полипептида PADRE, малярийного циркумспорозоитного (CS) белка, поверхностного антигена гепатита В (HBSAg 19-28), белка теплового шока (HSP) 65, Mycobacterium tuberculosis, холерогена, мутантов холерогена с пониженной токсичностью, дифтерийного токсина, белка CRM197, перекрёстно-реактивного с дифтерийным токсином, рекомбинантной стрептококковой С5а пептидазы, Streptococcus pyogenes ORF 1224, Streptococcus pyogenes ORF 1664, Streptococcus pyogenes ORF 2452, пневмолизина Streptococcus pneumoniae, мутантов пневмолизина с пониженной токсичностью, Chlamydia pneumoniae ORF T367, Chlamydia pneumoniae ORF T858, столбнячного токсина, ВИЧ gp120 T1, микробных поверхностных компонентов, распознающих адгезивные молекулы матрикса (MSCRAMMS), факторов роста, гормонов, цитокинов и хемокинов.
21. Иммуногенная композиция по п.20, отличающаяся тем, что белок-носитель представляет собой CRM197.
22. Иммуногенная композиция по п.19, отличающаяся тем, что пептидный иммуноген представляет собой фрагмент Ab.
23. Иммуногенная композиция по п.22, отличающаяся тем, что этот фрагмент Ab выбирают из группы, состоящей из Аb 1-3, 1-4, 1-5, 1-6, 1-7, 1-9, 1-10, 1-11, 1-12, 1-16, 1-28, 3-6, 3-7, 13-28, 15-24, 16-22, 16-23, 17-23, 17-24, 18-24, 18-25, 17-28, 25-35, 33-42, 35-40 и 35-42.
24. Иммуногенная композиция по п.19, отличающаяся тем, что один или более адъювантов выбирают из группы, состоящей из GM-CSF, 529SE, IL-12, фосфата алюминия, гидроксида алюминия, Mycobacterium tuberculosis, Bordetella pertussis, бактериальных липополисахаридов, аминоалкил глюкозаминфосфатов, MPLФ (3-O-деацилированного монофосфориллипида А), полипептида, Quil А, СтимулонаФ QS-21, коклюшного токсина (РТ) и Е. coli термолабильного токсина (LT), IL-1b, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, интерферона a, интерферона b, интерферона g, G-CSF, TNF-a и TNF-b.
25. Способ по п.1, отличающийся тем, что стадия введения реакционноспособной группы в пептидный иммуноген представляет собой добавление аминокислотного остатка, содержащего реакционноспособную группу.
26. Способ по п.25, отличающийся тем, что аминокислотный остаток представляет собой остаток цистеина, в котором реакционноспособной группой является -SH, или аминокислотный остаток представляет собой остаток аргинина, в котором реакционноспособной группой является гуанидильная группа, или аминокислотный остаток представляет собой остаток глутамата или аспартата, в котором реакционноспособной группой является -СООН, или аминокислотный остаток представляет собой остаток лизина, а реакционноспособной группой является -NH2.
27. Способ по п.25, отличающийся тем, что реакционноспособная группа, введённая в пептидный иммуноген, представляет собой -SH цистеинового остатка, а остаток цистеина вводят в Ab пептидный иммуноген с помощью добавления в процессе пептидного синтеза.
28. Способ по п.27, отличающийся тем, что остаток цистеина локализован на карбоксиконце Ab пептидного иммуногена.
29. Способ по п.1, отличающийся тем, что стадия введения реакционноспособной группы в пептидный иммуноген представляет собой образование тиольной группы в боковой цепи аминокислотного остатка, чувствительного к такой модификации, с помощью тиолирующего реагента.
30. Способ по п.29, отличающийся тем, что тиолирующий реагент представляет собой тиолактон N- ацетилгомоцистеина.
31. Способ по п.25 или 29, отличающийся тем, что аминокислотный остаток локализован на аминоконце Ab пептидного иммуногена или на карбоксиконце Ab пептидного иммуногена.
32. Способ по п.1, отличающийся тем, что белок-носитель дополнительно содержит один или более полипептидных линкеров, связанных ковалентной связью с белком-носителем, и тем, что одна или более функциональных групп является заместителем одного или более полипептидных линкеров.
33. Иммуногенный конъюгат по п.9 или 14, отличающийся тем, что реакционноспособная группа аминокислотного остатка пептидного иммуногена содержит свободную сульфгидрильную группу.
34. Иммуногенный конъюгат по п.33, отличающийся тем, что свободная сульфгидрильная группа представляет собой боковую цепь цистеинового остатка или тиолированную боковую цепь лизинового остатка.
35. Иммуногенный конъюгат по п.9 или 14, отличающийся тем, что реакционноспособная группа аминокислотного остатка пептидного иммуногена представляет собой гуанидильную группу, карбоксильную группу или e-аминогруппу.
36. Иммуногенный конъюгат по п.13 или 18, отличающийся тем, что реакционноспособная группа аминокислотного остатка представляет собой свободную сульфгидрильную группу цистеинового остатка.
37. Иммуногенный конъюгат по п.36, отличающийся тем, что цистеиновый остаток локализован на карбоксиконце пептидного иммуногена.
38. Иммуногенный конъюгат по п.9 или 14, отличающийся тем, что белок-носитель дополнительно содержит пептидный линкер, связанный ковалентной связью с белком-носителем, и тем, что функциональная группа является заместителем пептидного линкера.
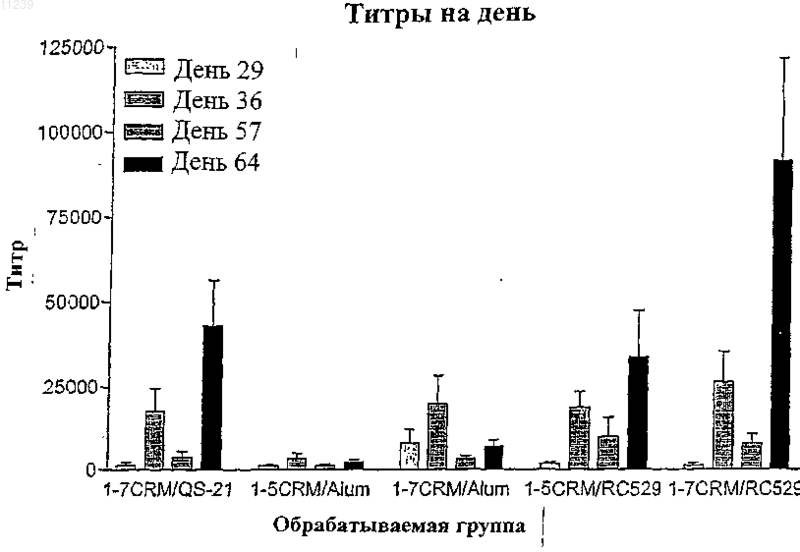
Текст
011239 Предпосылки создания изобретения Сущностью приобретнного иммунитета является способность организма реагировать на присутствие чужеродных веществ и продуцировать компоненты (антитела и клетки), способные специфически взаимодействовать с ними и защищать хозяина от их инвазии. "Антиген" или "иммуноген "представляет собой вещество, способное вызывать этот тип иммунного ответа, а также способное взаимодействовать с сенсибилизированными клетками и антителами, которые вырабатываются против них. Антигены или иммуногены обычно представляют собой макромолекулы, которые содержат определнные антигенные сайты или "эпитопы", узнаваемые различными компонентами иммунной системы и взаимодействующие с ними. Они могут существовать в виде отдельных молекул, представляющих собой синтетические органические вещества, белки, липопротеины, гликопротеины, РНК, ДНК или полисахариды, или они могут представлять собой часть клеточных структур (бактерии или грибки) или вирусы (Harlow and Lane 1988a, b, с; Male et al., 1987). Малые молекулы, такие как короткие пептиды, несмотря на то, что обычно способны реагировать с продуктами иммунного ответа, часто не могут вызвать ответ на себя самих. Эти пептидные иммуногены или "гаптены", как их также называют, на самом деле являются неполными антигенами и, хотя не способны сами по себе вызвать иммуногенность или продуцирование антител, их можно сделать иммуногенными, связывая их с подходящим носителем. Носителями обычно являются более высокомолекулярные белковые антигены, способные вызывать иммунологический ответ при введении in vivo. При иммунном ответе антитела продуцируются и секретируются В-лимфоцитами вместе с Тхелперными (TH) клетками. В большинстве систем гаптен-носитель В-клетки продуцируют антитела,специфические как к гаптену, так и к носителю. В этих случаях Т-лимфоциты имеют домены специфического связывания на носителе, но не распознают один гаптен. Проявляя своего рода синергизм, В- и Тклетки кооперируются, индуцируя гаптен-специфический антительный ответ. Если после того, как возникает такой иммунный ответ, хозяина заражают только гаптеном, обычно он отвечает, продуцируя гаптен-специфические антитела при использовании клеток памяти, образовавшихся после начальной иммунизации. Синтетические гаптены, имитирующие некоторые важные эпитопные структуры на макромолекулах с более высокой молекулярной массой, часто конъюгируются с носителями, обеспечивая иммунный ответ на более высокомолекулярную "родительскую" молекулу. Например, короткие пептидные сегменты можно синтезировать из известных последовательностей белка и связать с носителем, чтобы индуцировать иммуногенность к нативному белку. Этот тип синтетического подхода к получению иммуногена стал основой многих современных исследований по созданию вакцин. Однако во многих случаях создание только лишь В-клеточного ответа с применением синтетических конъюгатов пептид-носитель, как бы ни был хорош их дизайн, не всегда является гарантией абсолютного защитного иммунитета к интактному антигену. Иммунного ответа, выработанного коротким пептидным эпитопом из вирусной частицы большего размера или бактериальной клетки, может быть достаточно только для того, чтобы формировать память на В-клеточном уровне. В этих случаях общепринято в настоящее время, что ответ цитотоксических Т-клеток является более важным показателем защитного иммунитета. Создание пептидных иммуногенов с подходящими эпитопными сайтами связывания для узнавания как В-клеток, так и Тклеток является одним из наиболее перспективных областей современной иммунологии. Десятилетиями успешно применялся способ повышения иммуногенности малых или слабо иммуногенных молекул конъюгацией этих молекул с большими молекулами "носителей" (см., например, Gobelet al. (1939) J. Exp. Med. 69: 53). Например, описаны многие иммуногенные композиции, в которые очищенные капсулированные полимеры конъюгируют с белками носителей, образуя более эффективные композиции с использованием этого "эффекта носителя". (Schneerson et al. (1984) Infect. Immun. 45: 582591). Также было показано, что конъюгация позволяет преодолеть (обойти) слабый антительный ответ,обычно наблюдаемый у детей, иммунизированных свободным полисахаридом (Anderson et al. (1985) J.Pediatr. 107: 346; Insel et al. (1986) J. Exp. Med. 158:294). Конъюгаты гаптен-носитель успешно получали, используя различные сшивающие/связывающие реагенты, такие как гомобифункциональные, гетеробифункциональные или сшивающие линкеры нулевой длины. В настоящее время имеются многие такие методы связывания сахаридов, белков и пептидов в пептидные носители. В большинстве таких методов создают аминную, амидную, уретановую, изотиомочевинную или дисульфидную связи или в некоторых случаях тиоэфирную. Недостатком применения связывающих агентов, которые вводят реактивные сайты (реакционные центры) в боковые цепи реактивных аминокислотных молекул в молекулах носителя и/или гаптена, является то, что реактивные сайты, если они не нейтрализованы, свободны для реакции с нежелательной молекулой либо in vitro (тем самым вредно влияя на стабильность конъюгата(ов, либо in vivo (тем самым вызывая повышенный риск побочных явлений у людей или животных, иммунизированных этими препаратами). Такие избыточные реактивные сайты могут реагировать или их можно "кэпировать" так, чтобы инактивировать эти сайты, используя различные известные химические реакции, но, с другой стороны, эти реакции могут быть деструктивными для функциональности конъюгатов. Но могут возникнуть особые сложности, когда пытаются создать конъюгат введением реактивных сайтов в молекулу носителя, так как более значи-1 011239 тельный размер и более сложная структура (по сравнению с гаптеном) могут сделать конъюгат более восприимчивым к разрушительному действию химической реакции. В действительности, неизвестны примеры способов получения конъюгата, когда активируют носитель, затем его конъюгируют с гаптеном и, наконец, "кэпируют" остальные реактивные сайты, при этом сохраняя способность полученного конъюгата функционировать как иммуногенная композиция, имеющая заданные свойства "эффекта носителя". Краткое описание изобретения Настоящее изобретение относится к способам получения иммуногенного конъюгата пептидного иммуногена, содержащего A пептид, или фрагмент A, или его аналоги, с белковым/полипептидным носителем, причм A пептид, или фрагменты A, или их аналоги конъюгируют с носителем по дериватизированным функциональным группам аминокислотных остатков носителей, таких как остатки лизина, а любые неконъюгированные дериватизированные функциональные группы аминокислотных остатков инактивируют кэпированием, блокируя их реакции с другими молекулами, включая белки/полипептиды, тем самым защищая функциональность носителя, так что он сохраняет способность вызывать заданный иммунный ответ против пептидного иммуногена, что в отсутствие носителя было бы невозможно. Кроме того, данное изобретение также относится к конъюгатам, полученным вышеописанными методами, и к иммуногенным композициям, содержащим такие конъюгаты. В одном варианте настоящее изобретение относится к первому способу конъюгации пептидного иммуногена, содержащего A пептид, или фрагмент A пептида, или его аналог, реакцией реакционноспособной (реактивной) группы аминокислотного остатка пептидного иммуногена с белковым/полипептидным носителем, имеющим одну или более функциональных групп, причм данный способ включает стадии: (а) ация одной или более функциональных групп белкового/полипептидного носителя с образованием дериватизированной молекулы с реактивными (реакционноспособными) сайтами;(б) реакция дериватизированного белкового/полипептидного носителя со стадии (а) с реакционноспособной (реактивной) группой аминокислотного остатка пептидного иммуногена в таких условиях реакции, при которых пептидный иммуноген конъюгируется с дериватизированным белковым/полипептидным носителем за счт функциональных групп; и (в) дальнейшая реакция конъюгата с"кэпирующим" реагентом для инактивации свободных реакционноспособных (реактивных) функциональных групп на активированном белковом/полипептидном носителе, тем самым защищается функциональность носителя, так что сохраняется его способность выявлять заданный иммунный ответ против пептидного иммуногена, чего в отсутствие носителя не могло бы быть. В одном варианте изобретения белковый/полипептидный носитель выбирают из группы, состоящей из человеческого сывороточного альбумина, гемоцианина лимфы улитки, молекул иммуноглобулина,тиреоглобулина, овальбумина, гемагглютинина вируса гриппа, PAN-DR связывающего пептида (PADRE полипептида), circumsporozite (CS, окружающего поры) белка возбудителя малярии, поверхностного антигена гепатита В (HBsAg19-28), белка теплового шока (HSP) 65, бациллы Кальметта- Герена (BCG), холерогена (холерного токсина), мутантов холерогена с пониженной токсичностью, дифтерийного токсина,белка CRM197, перекрстно-реактивного с дифтерийньм токсином, рекомбинантной Streptococcal C5a пептидазы, Streptococcus piogenes ORF1224, Streptococcus piogenes ORF1664, Streptococcus piogenesORF2452, пневмолизина Streptococcus pneumoniae, мутантов пневмолизина с пониженной токсичностью,Clamydia pneumoniae ORF T367, Clamydia pneumoniae ORF T858, столбнячного токсина, ВИЧ gp120 T1,компонентов, узнающих адгезивные матричные молекулы поверхности микробных клеток(MSCRAMMS), фактора/гормона роста, цитокинов и хемокинов. В другом варианте изобретения белковый/полипептидный носитель содержит Т-клеточный эпитоп. Ещ в одном варианте изобретения белковый/полипептидный носитель является бактериальным токсоидом, таким как столбнячный токсоид, холерный токсин или мутант холерного токсина, описанные выше. В предпочтительном варианте изобретения белковый/полипептидный носитель представляет собой CRM197. Ещ в одном варианте изобретения белковый/полипептидный носитель представляет собой гемагглютинин вируса гриппа, полипептид PADRE, CS белок возбудителя малярии, поверхностного антигена гепатита В (HBsAg19-28), белка теплового шока 65 (HSP 65) или полипептида из Mycobacterium tuberculosis (BCG). В предпочтительном варианте изобретения белковый/полипептидный носитель выбирают из рекомбинантной Streptococcal C5a пептидазы, Streptococcus piogenes ORF1224, Streptococcus piogenesT858. В одном варианте изобретения белковый/полипептидный носитель представляет собой фактор или гормон роста, который стимулирует или повышает иммунный ответ и выбирается из группы, состоящей из IL-1, IL-2, -интерферона, IL-10, GM-GSF, MIP-1, MIP-1 и RANTES. В одном аспекте изобретение включает пептидный иммуноген, содержащий A пептид, или фраг-2 011239 мент A, или его аналог, выявляющий (вызывающий) иммунный ответ против некоторых эпитопов в A. Иммуногенные пептиды по изобретению включают иммуногенные гетерологичные пептиды. В некоторых иммуногенных пептидах A фрагмент связан с носителем с образованием иммуногенного гетерологичного пептида, а затем этот гетерологичный пептид связывается с носителем с применением способа по настоящему изобретению с образованием конъюгата. В другом аспекте настоящего изобретения пептидный иммуноген является полипептидом, содержащим N-концевой сегмент по меньшей мере из 1-5 остатков A, причм первый остаток является Nконцевым остатком полипептида, в котором полипептид не содержит С-концевого сегмента A. Ещ в одном аспекте изобретения пептидный иммуноген представляет собой полипептид, содержащий Nконцевой сегмент A, причм этот сегмент начинается с остатка 1-3 A и заканчивается остатками 7-11A. В некоторых аспектах изобретения пептидный иммуноген представляет собой агент, который индуцирует иммуногенный ответ против N-концевого сегмента A, причм сегмент начинается с остатка 1-3A и кончается остатками 7-11 A, не индуцируя иммунного ответа против эпитопа в остатках 12-43A43. В другом аспекте настоящего изобретения пептидный иммуноген представляет собой гетерологичный полипептид, содержащий сегмент A, связанный с гетерологичной аминокислотной последовательностью, которая индуцирует Т-хелперный ответ против гетерологичной аминокислотной последовательности и, тем самым, В-клеточный ответ против N-концевого сегмента. В некоторых пептидных иммуногенах N-концевой сегмент A связан на С-конце с гетерологичным полипептидом. В некоторых пептидных иммуногенах N-концевой сегмент A связан на N-конце с гетерологичным полипептидом. В некоторых пептидных иммуногенах N-концевой сегмент A связан на Nконце и С-конце с первым и вторым гетерологичными полипептидами. В некоторых пептидных иммуногенах N-концевой сегмент A связан на N-конце с гетерологичным полипептидом и на С-конце по меньшей мере с одной добавочной копией N-концевого сегмента. В некоторых пептидных иммуногенах полипептид содержит, от N-конца до С-конца, N-концевой сегмент A, множество добавочных копий Nконцевого сегмента и гетерологичный аминокислотный фрагмент. В некоторых из вышеописанных пептидных иммуногенах полипептид дополнительно содержит по меньшей мере одну добавочную копию N-концевого сегмента. В некоторых из вышеописанных пептидных иммуногенах фрагмент не содержит по меньшей мере 5 С-концевых аминокислот в A43. В некоторых аспектах вышеописанных пептидных иммуногенах фрагмент содержит до 10 непрерывных аминокислот из A. В другом аспекте изобретение включает пептидный иммуноген, содержащий A пептид, или фрагменты A, или их аналоги, вызывающие иммунный ответ против некоторых эпитопов в A, возможно, в конфигурации, называемой конфигурацией множественных антигенных пептидов (МАП, MAP). В некоторых из вышеприведнных аспектах изобретения пептидный иммуноген образован из Nконцевой половины A. В некоторых аспектах изобретения пептидный иммуноген представляет собойA фрагмент, выбранный из группы, состоящей из A1-3, 1-4, 1-5, 1-6, 1-7, 1-10, 1-11, 1-12, 1-16, 3-6 и 37. В некоторых из вышеприведнных аспектов изобретения пептидный иммуноген образован из внутренней области A. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A13-28, 15-24, 17-28 и 25-35. В некоторых из вышеприведнных аспектов изобретения пептидный иммуноген образован из С-конца A. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A33-42, 35-40 и 35-42. В некоторых аспектах изобретения пептидный иммуноген представляет собойA фрагмент, выбранный из группы, состоящей из A1-3, 1-4, 1-5, 1-6, 1-7, 1-10, 1-11, 1-12, 1-16, 1-28, 36, 3-7, 13-28, 15-24, 17-28, 25-35, 33-42, 35-40 и 35-42. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A1-5, A1-7, A1-9 иA1-12. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A1-5-L, A1-7-L, A1-9-L и A1-12-L, где L обозначает линкер. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A1-5-L-C, A1-7-L-C, A1-9-L-C и A1-12-L-C, где С обозначает цистеиновый аминокислотный остаток. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A16-22, A16-23, A17-23, A17-24, A18-24 и A18-25. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A16-22-С, A16-23-С, A17-23-С, A17-24-С, A18-24-С и A18-25-С, где С обозначает цистеиновый аминокислотный остаток. В других аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из С-A16-22, С-A16-23, A17-23, СA17-24, С-A18-24 и С-A18-25-С, где С обозначает цистеиновый аминокислотный остаток. В некоторых из вышеописанных пептидных иммуногенов гетерологичные полипептиды выбирают из группы, состоящей из пептидов, имеющих Т-клеточный эпитоп, В-клеточный эпитоп и их комбина-3 011239 цию. В одном варианте изобретения функциональная группа одной или более аминокислотных молекул белкового/полипептидного носителя или возможно присоединнного полипептидного линкера дериватизирована с применением сшивающего реагента. В другом варианте изобретения дериватизирующий реагент представляет собой сшивающий реагент нулевой длины. В другом варианте изобретения дериватизирующий реагент представляет собой гомобифункциональный сшивающий реагент. Ещ в одном варианте изобретения дериватизирующий реагент представляет собой гетеробифункциональный сшивающий реагент. В предпочтительном варианте изобретения гетеробифункциональный реагент представляет собой реагент, который реагирует с первичной или функциональной -аминогруппой одной или более аминокислотных молекул белкового/полипептидного носителя и боковой тиольной группой одной или более аминокислотных молекул пептидного иммуногена. В одном варианте изобретения гетеробифункциональный реагент представляет собой N-сукцинимидилбромацетат. В другом варианте изобретения первичная функциональная -аминогруппа представляет собой аминогруппу лизина. Ещ в одном варианте изобретения дериватизация функциональной первичной аминогруппы и -аминогруппы лизина белкового/полипептидного носителя с помощью Nсукцинимидилбромацетата приводит к бромацетилированию первичной аминогруппы и -аминогруппы лизина белкового/полипептидного носителя. В более предпочтительном варианте изобретения боковая тиольная группа представляет собой тиольную группу цистеинового остатка пептидного иммуногена,который может быть локализован на карбокси-конце пептидного иммуногена или внутри пептидного иммуногена. В другом варианте изобретения боковую тиольную группу вводят (образуют) по реакции тиолирования с помощью таких реагентов как N-ацетилгомоцистеинтиолактон, реагент Траута (2-иминотиолан),SATA (N-сукцинимидил-S-ацетилтиоацетат), SMPT (4-сукцинимидилоксикарбонилметил-2-пиридилтиотолуол), Sulfo LC SPDP (сульфосукцинимидил пиридилдитиопропионамидогексаноат), SPDP (сукцинимидилпиридилдитиопропионат). В предпочтительном варианте изобретения "кэпирующий" реагент, который используют для инактивации свободных реакционных функциональных групп на активированном белковом/полипептидном носителе, выбирают из группы реагентов, состоящей из цистеамина, Nацетилцистеамина и этаноламина. В особенно предпочтительном варианте изобретения "кэпирующий" реагент, который используют для инактивации свободных реакционных функциональных групп на активированном белковом/полипептидном носителе, выбирают из группы реагентов, состоящих из гидроксида натрия, карбоната натрия, бикарбоната аммония и аммиака. В одном варианте изобретения реакционная (реактивная) группа аминокислотного остатка пептидного иммуногена представляет собой свободную сульфгидрильную группу. В другом варианте изобретения одна или более функциональных групп расположены на линкере,который, необязательно (возможно), связан с белковым/полипептидным носителем. В предпочтительном варианте изобретения линкер представляет собой пептидный линкер. В более предпочтительном варианте изобретения пептидный линкер представляет собой полилизин. В другом варианте изобретение относится ко второму способу конъюгации пептидного иммуногена, содержащего A пептид, или фрагменты A, или аналоги A, или их аналоги с белковым/полипептидным носителем, имеющим структуру где С обозначает белковый/полипептидный носитель, а X обозначает дериватизируемую функциональную группу аминокислотного остатка на белковом/полипептидном носителе или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, и где m обозначает целое число больше 0, но меньше или равное 85, причм этот способ содержит стадии:(а) дериватизации одной или более функциональных групп белкового/полипептидного носителя или необязательно связанной с белковьм полипептидным носителем молекулы линкера с образованием дериватизированной молекулы с реактивными сайтами; (б) реакции дериватизированного белкового/полипептидного носителя со стадии (а) с реактивной (реакционной) группой аминокислотного остатка пептидного иммуногена с образованием ковалентно связанного конъюгата: пептидный иммуногенбелковый/полипептидный носитель; и (в) последующей реакции указанного конъюгата с "кэпирующим" реагентом для инактивации свободных реакционных функциональных групп на активированном белковом/полипептидном носителе, в результате чего "кэпированные" группы не могут реагировать с другими молекулами, включая белки/полипептиды, тем самым защищается функциональность носителя, то есть он сохраняет способность выявлять заданный иммунный ответ против пептидного иммуногена, что в-4 011239 отсутствие носителя было бы невозможно, таким образом образуется конъюгат "кэпированный" пептидный иммуноген-белковый/полипептидный носитель, имеющий формулу где С обозначает белковый/полипептидный носитель, a Xd обозначает дериватизируемую функциональную группу аминокислотного остатка белкового/полипептидного носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем,Р обозначает пептидный иммуноген, ковалентно связанный с дериватизированной функциональной группой аминокислотного остатка белкового носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, R обозначает "кэпирующую" молекулу, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового/полипептидного носителя или, возможно, аминокислотного остатка пептидного линкера, связанного с белковым/полипептидным носителем, n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85. Полные варианты первого способа по изобретению, приведнные выше, также применимы для конъюгатов, полученных вышеописанным вторым способом. В одном варианте данное изобретение относится к конъюгатам пептидного иммуногена, содержащего A-пептид, или фрагменты A, или их аналоги, с белковым/полипептидным носителем, где белковый/полипептидный носитель имеет формулу где С обозначает белковый/полипептидный носитель, а X обозначает дериватизируемую функциональную группу аминокислотного остатка на белковом/полипептидном носителе или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, и где m обозначает целое число больше 0, но меньше или равное 85, конъюгат "кэпированный" пептидный иммуноген-белковый/полипептидный носитель имеет формулу где С обозначает белковый/полипептидный носитель, а X обозначает дериватизируемую функциональную группу аминокислотного остатка белкового/полипептидного носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем,Р обозначает молекулу пептидного иммуногена, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, R обозначает "кэпирующую" молекулу, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового/полипептидного носителя или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, тем самым защищается функциональность носителя, так что он сохраняет способность выявлять заданный иммунный ответ против пептидного иммуногена, иначе, без носителя, это было бы невозможно; n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85. Полные варианты первого и второго способов по изобретению, подробно описанные ранее, также применимы к вышеописанным конъюгатам. В другом варианте изобретение относится к конъюгатам пептидного иммуногена, содержащего A пептид, или фрагменты A, или их аналоги, с белковым/полипептидным носителем, полученным по второму способу по изобретению и имеющим формулу где С обозначает белковый/полипептидный носитель, a Xd обозначает дериватизируемую функциональ-5 011239 ную группу аминокислотного остатка белкового/полипептидного носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем,Р обозначает молекулу пептидного иммуногена, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, R обозначает "кэпирующую" молекулу, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового/полипептидного носителя или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, тем самым защищается функциональность носителя, так что он сохраняет способность выявлять заданный иммунный ответ против пептидного иммуногена, иначе, без носителя, это было бы невозможно; n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85. Полные варианты второго способа изобретения, подробно описанные ранее, также применимы к конъюгатам, полученным вторым, вышеописанным, способом. В другом варианте изобретение относится к иммуногенным композициям, содержащим конъюгат пептидного иммуногена с белковым/полипептидным носителем, полученный вторым способом по изобретению, вместе с одним или более фармацевтически приемлемых эксципиентов, разбавителей и адъювантов. Полные варианты второго способа изобретения, подробно описанные ранее, и полученные таким образом коньюгаты также применимы к вышеописанным иммуногенным композициям, содержащим эти конъюгаты. В другом варианте изобретение относится к способу индуцирования иммунного ответа у млекопитающего, который заключается во введении субъекту эффективного количества иммуногенной композиции по настоящему изобретению. Подробно описанные (полные) варианты изобретения, применимые к иммуногенной композиции,содержащей конъюгаты по настоящему изобретению, также применимы к варианту изобретения, относящемуся к способу применения иммуногенных композиций. Краткое описание чертежей Фиг. 1 - на схеме показан химический процесс, применяемый для конъюгации фрагментов A пептида с белковым/полипептидным носителем CRM197 с образованием конъюгата A/CRM197; фиг. 2 - на схеме показан процесс кислотного гидролиза, применяемый для количественного определения S-карбоксиметилцистеина и S-карбоксиметилцистеамина для оценки степени конъюгации конъюгатов пептидный иммуноген-белок/полипептид, таких как конъюгат A/CRM197; фиг. 3 - изображена зависимость реакции конъюгации A пептид/CRM от рН; фиг. 4 - изображена зависимость конъюгации A пептид/CRM от соотношения пептид:CRM; фиг. 5 - верификация процесса "кэпирования" при конъюгации A-7/CRM. Значение рН реакционной смеси в ходе реакции 9.15. Время реакции с пептидом составляет 16 ч, "кэпирование" с помощью Nацетилцистеина длится 8 ч; фиг. 6 - конъюгация и "кэпирование" с различными пептидами: отношения CRM:пептид. рН реакционной смеси во время реакции 9.0. Время реакции с пептидом составляет 16 ч, "кэпирование" с помощью N-ацетилцистеина длится 8 ч; фиг. 7 - титры сыворотки приматов на 36 день после иммунизации приматов конъюгатами A пептида с различными адъювантами; фиг. 8 - титры сыворотки приматов на 64 день после иммунизации приматов конъюгатами A пептида с различными адъювантами; фиг. 9 - титры сыворотки приматов по дням и по группам обработки. Приматов иммунизируют с помощью конъюгатов A1-7 или A1-5 CRM197 с квасцами или RC529 в качестве адъювантов и титры антител против A определяют на день 29, 36, 57 и 64; фиг. 10 - пептид-белковые конъюгаты характеризуют с помощью SDS- PAGE вестерн-блоттинга с применением готового геля с трис-трицином. Дорожки (полоски): маркер (дорожка 1); L-28375 24/01 Подробное описание изобретения Настоящее изобретение относится к способам получения конъюгатов пептидный иммуногенноситель, в которых непрореагировавшие активные функциональные группы на носителе, образующиеся при активации, инактивируют, используя "кэпирующие" реагенты, такие как N-ацетилцистеамин, для того, чтобы предотвратить их последующие реакции. Настоящее изобретение относится также к конъюгатам "кэпированный" носитель-пептидный иммуноген, полученным этими способами, и к иммуногенным композициям, содержащим указанные конъюгаты. Способ повышения иммуногенности малых или слабо иммуногенных молекул, таких как сахариды,с использованием конъюгации успешно применялся десятилетиями (см., например, Goebel et al. (1939) J.Exp. Med. 69: 53), и описаны многие иммуногенные композиции, в которых очищенные капсулированные полимеры конъюгированы с белками-носителями с целью получения более эффективных иммуногенных композиций, используя этот "эффект носителя". Например, Schneerson et al. (J. Exp. Med. 152: 361-376, 1980) описывают конъюгаты Haemophilis influenzae b полисахарида с белком, которые "наделяют" иммунитетом к инвазивным заболеваниям, вызванным микроорганизмами. Показано, что конъюгатыPRP (полирибозилрибитолфосфат, капсулированный полимер Н. influenzae b) являются более эффективными, чем иммуногенные композиции на основе одного полисахарида (Chu et al. (1983) Infect. Immun. 40: 245; Schneerson et al. (1984) Infect. Immun. 45: 582-591). Также было показано, что конъюгация позволяет преодолеть (обойти) слабый антительный ответ, обычно наблюдаемый у детей, иммунизированных свободным полисахаридом (Anderson et al. (1985) J. Pediatr. 107: 346; Insel et al. (1986) J. Exp. Med. 158: 294). Другим преимуществом применения в качестве белкового носителя бактериального токсина или токсоида, против которого обычная иммунизация людей (например, столбнячного или дифтерийного) является стандартной практикой, заключается в том, что заданный иммунитет к токсину или токсоиду индуцируется наряду с иммунитетом против патогенов, ассоциированных с капсулированным полимером. Конъюгаты антигенная детерминанта/гаптен-носитель также использовались для получения высокоспецифических моноклональных антител, которые могут узнавать дискретные химические эпитопы на связанном гаптене. Полученные моноклональные антитела часто используют для изучения эпитопной структуры и взаимодействий между нативными белками. Во многих случаях антигенные детерминанты,используемые для получения этих моноклональных антител, являются малыми пептидными сегментами,представляющими ключевые антигенные сайты на поверхности белков большего размера. Критериями для хороших носителей, используемых при получении конъюгата антигенная детерминанта/гаптенноситель, являются потенциал для иммуногенности, наличие функциональных групп, подходящих для конъюгации с антигенной детерминантой/гаптеном, достаточная растворимость даже после дериватизации и отсутствие токсичности in vivo. Этим критериям отвечают конъюгаты, полученные способами по данному изобретению. Конъюгаты могут представлять собой любые стабильные конъюгаты пептидный иммуноген-носитель, полученный способом конъюгации по настоящему описанию. Конъюгаты получают, используя способ по настоящему изобретению, в котором белковый/полипептидный носитель, имеющий следующую структуру: где С обозначает белковый/полипептидный носитель, а Xd обозначает дериватизируемую функциональную группу аминокислотного остатка на белковом/полипептидном носителе или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, и где m обозначает целое число больше 0, но меньше или равное 85, ковалентно связан с пептидным иммуногеном и где конъюгат пептидный иммуноген-белковый/полипептидный носитель представлен следующей формулой: где С обозначает белковый/полипептидный носитель, а X обозначает дериватизируемую функциональную группу аминокислотного остатка белкового/полипептидного носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидньгм носителем,Р обозначает пептидный иммуноген, ковалентно связанный с дериватизированной функциональной группой аминокислотного остатка белкового носителя или, необязательно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, R обозначает "кэпирующую" молекулу, ковалентно связанную с дериватизированной функциональной группой аминокислотного остатка белкового/полипептидного носителя или, возможно, аминокислотного остатка пептидного линкера, ковалентно связанного с белковым/полипептидным носителем, тем самым защищается функциональность носителя, так что он сохраняет способность выявлять заданный иммунный ответ против пептидного иммуногена, иначе, без носителя, это было бы невозможно; n обозначает целое число больше 0, но меньше или равное 85, и р обозначает целое число больше 0, но меньше 85. Выбор носителей. Некоторые пептидные иммуногены содержат подходящий эпитоп для индуцирования иммунного ответа, но слишком малый для того, чтобы быть иммуногенным. В таком случае пептидные иммуногены связывают с подходящим носителем, что способствует выявлению иммунного ответа. В вышеприведнном схематическом изображении конъюгата пептидный иммуноген-носитель, получаемого способом по настоящему изобретению, С обозначает белковый/полипептидный носитель, с которым пептидные иммуногены конъюгируются непосредственно, за счт дериватизированных функциональных групп аминокислотных остатков на самих носителях, либо опосредованно, за счт дериватизированных функциональных групп на пептидных линкерах, ковалентно связанных с носителями. Подходящие белковые/полипептидные носители включают, но без ограничения, альбумин (включая человеческий сывороточный альбумин), гемоцианин лимфы улитки, молекулы иммуноглобулинов, тиреоглобулин, овальбумин, MSCRAMMS, столбнячный токсоид (анатоксин), или токсоид других патогенных бактерий с пониженной токсичностью, включая мутанты, такой как дифтерийный, Е. coli, холерный или Н. pylori, или ослабленное производное токсина. Одним из таких носителей является белок CRM197 (SEQ ID NO: 40),перекрстно-реактивный с дифтерийным токсином. Другие носители включают Т-клеточные эпитопы, которые связываются с множественными МНС аллелями, например по меньшей степени с 75% всех человеческих МНС аллелей. Такие носители в уровне техники иногда называют "универсальные Т-клеточные эпитопы". Типичные носители с универсальными Т-клеточными эпитопами включают Другие носители для стимулирования или повышения иммунного ответа, с которыми может конъюгироваться пептидный иммуноген или гаптен, включают цитокины, такие как IL-1, IL-1 ипептиды,IL-2, INF, IL-10, GM-CSF, и хемокины, такие как MIP l ии RANTES. Иммуногенные пептиды могут также быть связаны с белковыми/пептидными носителями, которые повышают транспорт через ткани,как описано в O'Mahony, международные заявки WO 97/17163 и WO 97/17614, которые вводятся в данное описание в качестве ссылки во всей полноте для любых целей. Другие носители включают Streptococcal C5a пептидазу, Streptococcus piogenes ORF1224, 1664 и 2452, Clamydia pneumoniae ORF T367 и Т 858, пневмолизин Streptococcus pneumoniae, мутанты пневмолизина с пониженной токсичностью, факторы и гормоны роста. В одном предпочтительном варианте настоящего изобретения белок-носитель представляет собойCRM197, нетоксический мутант дифтерийного токсина с одной аминокислотной заменой в первичной последовательности. Глицин в аминокислотном положении 52 молекулы заменяется на глутаминовую кислоту в результате единичной замены нуклеотидного кодона. Вследствие этой замены белок не содержит ADP-рибозилтрансферазной активности и становится нетоксическим. Его молекулярная масса составляет 58408 Да. CRM197 получают в больших количествах при использовании рекомбинантной экспрессии в соответствии с патентом США 5614382, который вводится в данное описание в качестве ссылки. Конъюгация сахаридов, а также пептидов с CRM197 осуществляется путм связывания за счт аминогрупп лизиновых остатков. На примере некоторых промышленных продуктов чтко установлено,что CRM197 является прекрасным и безопасным носителем для В-клеточных эпитопов. Иммуногенные пептиды. Применяемый в данном описании термин "пептидный иммуноген" или "гаптен" представляет собой любой белок или образованные из него субъединичную структуру/фрагмент/аналог, которые при введении млекопитающему могут выявлять иммунный ответ, способствовать иммунному ответу или индуцироваться, вызывая иммунный ответ. В частности, термин применяется для обозначения полипептидной антигенной детерминанты из любого источника (бактерий, вируса или эукариот), которая может связываться с носителем способом по данному описанию. Такие полипептидный иммуноген/антигенные детерминанты могут происходить из вирусных, бактериальных клеток и клеток млекопитающих. Пептидные иммуногены можно конъюгировать с носителем для применения в качестве иммунотерапевтических средств для предупреждения, лечения или уменьшения интенсивности различных заболеваний человека. Такие пептидные иммуногены включают пептидные иммуногены, образованные из A пептида из 39-43 аминокислот, предпочтительно из 42 аминокислот, который является основным компонентом бляшек, характерных для болезни Альцгеймера (AD) (см. патент США 4666829; GlennerWong(1984) Biochem. Biophys. Res. Commun. 120: 1131; Hardy (1984) TINS 20: 1131; Hardy (197(9)7 TINS 20: 154), которые образуются из амилоидных пептидов амилина, полипептидного материала, продуцируемого островковыми клетками поджелудочной железы, непосредственно связанными с диабетом типа II,пептидов, образованных из генных продуктов липопротеинов низкой плотности, связанных с атероскле- 11011239 розом, и антигенных пептидов из воспалительных цитокинов и факторов роста, таких как интерлейкин 6(IL-6), фактор некроза опухолей(TNF) и GDF-8. Такие эукариотические пептидные иммуногены могут включать либо Т-клеточный (CTL, ЦТЛ), либо В-клеточный эпитоп, также известный как амилоидный белок или А 4 пептид.A, также известный как -амилоидный белок или А 4 пептид (см. патент США 4666829; GlennerWong, Biochem. Biophys. Res. Commun. 120: 1131 (1984, представляет собой пептид из 39-43 аминокислот, который является основным компонентом бляшек, характерных для болезни Альцгеймера. A образуется при процессировании белка большего размера APP под действием двух ферментов, называемыхисекретазами (см. Hardy TINS 20: 154 (1997. Известные мутации в APP, ассоциированном с болезнью Альцгеймера, происходят близ (проксимально) к сайту расщепленияилисекретазами или внутри A. Например, положение 717 находится проксимально к сайту расщепления APP -секретазой при его процессировании в A, а положения 670/671 находятся проксимально к сайту расщепления -секретазой. Полагают, что мутации вызывают AD путм взаимодействия в реакциях расщепления, в результате которых образуется A, так что повышается количество 42/43 аминокислотной формы образующегося A.A обладает необычным свойством, он может фиксировать и активировать как классические, так и альтернативные каскады комплемента. В частности, он связывается с Clq и, в конечном счте, с C3bi. Эта ассоциация способствует связыванию с макрофагами, приводя к активации В клеток, кроме того, C3bi далее разрушается, а затем связывается с CR2 на В клетках в зависимости от Т клеток, приводя к 10000 кратному увеличению активации этих клеток. Этот механизм заставляет A вырабатывать иммунный ответ в избытке этого или других антигенов. А имеет несколько природных форм. Человеческие формы A обозначаются A39, А 40, А 41,А 42 и A43. Последовательности этих пептидов и их связь с белком-предшественником APP иллюстрируется на фиг. 1 в Hardy et al., TINS 20: 155-158 (1997). Например, A42 имеет последовательностьA41, A40 и A39 отличаются от A42 тем, что в них отсутствуют Ala, Ala-Ile и Ala-Ile-Val, соответственно, на С-конце. A43 отличается от A42 присутствием треонинового остатка на С-конце. Пептидные иммуногены, которые представляют собой фрагменты A, эффективны по сравнению с интактной молекулой для применения в способах по настоящему изобретению по нескольким причинам. Во-первых, так как только определнные эпитопы внутри A индуцируют иммуногенный ответ, полезный для лечения болезни Альцгеймера, доза фрагмента, содержащего такие эпитопы, дат более высокую молярную концентрацию полезных иммуногенных эпитопов, чем равная по массе доза интактногоA. Во-вторых, некоторые пептидные иммуногены A вызывают иммуногенный ответ против амилоидных отложений, не вызывая заметного иммуногенного ответа против белка APP, из которого образованA. В третьих, пептидные иммуногены A проще получать, чем интактный A из-за их более короткой длины. В четвртых, пептидные иммуногены A не агрегируются таким же образом, что и интактныйA, это упрощает получение конъюгатов с носителями. Некоторые пептидные иммуногены A имеют последовательность по меньшей мере из 2, 3, 5, 6, 10 или 20 непрерывных аминокислот природного пептида. Некоторые пептидные иммуногены содержат не более 10, 9, 8, 7, 5 или 3 непрерывных остатков A. В предпочтительном варианте изобретения пептидные иммуногены N-концевой половины A используют для приготовления конъюгатов. Предпочтительные пептидные иммуногены включают A1-5, 1-6, 1-7, 1-10, 1-11, 3-7, 1-3 и 1-4. Обозначение A1-5, например, указывает на N-концевой фрагмент, включающий 1-5 аминокислотные остатки A. Особенно предпочтительны фрагменты A, начиная с N-конца и кончая остатком, входящим в остатки 7-11 A. В некоторых способах фрагмент представляет собой N-концевой фрагмент, иной, нежели A1-10. Другие предпочтительные фрагменты включают A13-28, 15-24, 1-28, 25-35, 35-40, 35-42 и другие внутренние фрагменты и фрагменты на С-конце. Некоторые A-пептиды по изобретению являются иммуногенными пептидами, которые при введении их пациенту - человеку или животному - генерируют антитела, специфически связывающиеся с одним или более эпитопов между остатками 16 и 25 A. Предпочтительные фрагменты включают A16-22,16-23, 17-23, 17-24, 18-24 и 18-25. Антитела, специфически связывающиеся с эпитопами между остатками 16 и 25, специфически связываются с растворимым A, не связываясь с бляшками A. Эти типы антитела могут специфически связываться с растворимым A в кровотоке пациента или животной модели,не связываясь специфически с бляшками из A отложений в мозге пациента или модели. Специфическое связывание антител с растворимым A ингибирует включение A в бляшки, тем самым ингибируя прогрессирование бляшек у пациента или ингибируя дальнейшее увеличение размера или частоты встречае- 12011239 мости бляшек, если такие бляшки уже появились до начала лечения (до введения препарата). Предпочтительно во вводимом фрагменте A отсутствует эпитоп, который вызывает Т-клеточный ответ на фрагмент. Обычно Т-клеточные эпитопы по размеру протяжннее, чем 10 непрерывных аминокислот. Поэтому размер предпочтительных фрагментов A составляет 5-10, или более предпочтительно 7-10 непрерывных аминокислот, или наиболее предпочтительно 7 непрерывных аминокислот; т.е. достаточная протяжнность, чтобы вызвать антительный ответ, не вызывая Т-клеточный ответ. Отсутствие Тклеточных эпитопов является предпочтительным, так как эти эпитопы не нужны для иммуногенной активности фрагментов и могут вызвать нежелательный воспалительный ответ в субпопуляции пациентов(Anderson et al. (2002) J. Immunol. 168, 3697-3701; Senior (2002) Lancet Neurol. 1, 3). Фрагмент A15-25 и его субфрагменты из 7-8 непрерывных аминокислот являются предпочтительными, так как эти пептиды постоянно генерируют (вырабатывают) высокий иммуногенный ответ на A пептид. Эти фрагменты включают A16-22, A16-23, A16-24, A17-23, A17-24, A18-24 и A18-25. Особенно предпочтительные субфрагменты A15-25 имеют протяжнность 7 непрерывных аминокислот. Обозначение A15-21, например, показывает, что фрагмент включает остатки 15-21 A и не содержит других остатков A и предпочтительно содержит 7-10 непрерывных аминокислот. Эти фрагменты могут вырабатывать антительный ответ, который включает антитела, специфические к концу. Пептидные иммуногены A требуют скрининга на активность клиринга или предупреждения амилоидных отложений (см. международную заявку WO 00/72880). Введение N-концевых фрагментов A индуцирует продуцирование антител, которые узнают A отложения in vivo и in vitro. В некоторых способах применяются фрагменты, в которых отсутствует по меньшей мере один, а иногда по меньшей мере 5 или 10 С-концевых аминокислот, имеющихся в природных формах A. Например, фрагмент, в котором отсутствуют 5 С-концевых аминокислот A, включает первые N-концевые 38 аминокислот A. Если не указано иначе, ссылка на A включает природные человеческие аминокислотные последовательности, указанные выше, а также аналоги, включая аллели, виды и осуществляемые варианты. Аналоги обычно отличаются от природных пептидов в одном, двух или нескольких положениях, часто за счт консервативных замен. Обычно аналоги имеют последовательности, на 80 или 90% идентичные последовательностям природных пептидов. Некоторые аналоги также включают неприродные аминокислоты или модификации N- или С-концевых аминокислот в одном, двух или нескольких положениях. Например, остаток природной аспарагиновой кислоты в положении 1 и/или 7 A может быть замещн изоаспарагиновой кислотой. Примерами неприродных аминокислот являются D, , -дизамещнные аминокислоты, Nалкиламинокислоты, молочная кислота, 4-гидроксипролин, -карбоксиглутамат, -N,N,N-триметиллизин,-N-ацетиллизин,O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин,5 гидроксилизин, -N-метиларгинин, -аланин, орнитин, норлейцин, норвалин, гидроксипролин, тироксин, -аминомасляная кислота, гомосерин, цитруллин и изоаспарагиновая кислота. Иммуногенные пептиды также включают аналоги A и их фрагменты. Некоторые терапевтические агенты по изобретению представляют собой полностью-D пептиды, например полностью-D A, полностью-D A фрагмент, или аналоги полностью-D A или полностью-D A фрагмента. Можно проводить скрининг фрагментов и аналогов на профилактическую или терапевтическую эффективность в отношении трансгенных животных моделей по сравнению с непролеченными или "пролеченными" плацебо-контрольными животными,как описано в международной заявке WO 00/72880. Пептидные иммуногены охватывают также более длинные полипептиды, которые включают, например, иммуногенный участок A пептида вместе с другими аминокислотами. Например, предпочтительные иммуногенные пептиды включают составные (химерные, гибридные) белки, содержащие сегмент A, связанный с гетерологичной аминокислотной последовательностью, которая индуцирует Тхелперный ответ против гетерологичной аминокислотной последовательности и, тем самым, Вклеточный ответ против сегмента A. Такие полипептиды можно подвергать скринингу на профилактическую или терапевтическую эффективность в отношении трансгенных животных моделей по сравнению с непролеченными или "пролеченными" плацебо-контрольными животными, как описано в международной заявке WO 00/72880. А пептид, аналог, иммуногенный фрагмент или другой полипептид можно вводить в дезагрегированной или агрегированной форме. Дезагрегированный A или его фрагменты означают мономерные пептидные единицы. Дезагрегированный A или его фрагменты обычно являются растворимыми и способны к самоагрегации с образованием растворимых олигомеров, протофибрилл и ADDL. ОлигомерыA и их фрагменты обычно являются растворимыми и существуют преимущественно в виде -спиралей или случайных спиралей. Агрегированный A или его фрагменты означают олигомеры A или их фрагменты, которые ассоциированы в нерастворимые ансамбли в виде -складок. Агрегированный A или его фрагменты также означают фибриллярные полимеры. Фибриллы обычно являются нерастворимыми. Некоторые антитела связывают либо растворимый A или его фрагменты, либо агрегированный A или- 13011239 его фрагменты. Некоторые антитела связывают как растворимый A или его фрагменты, так и агрегированный A или его фрагменты. Иммуногенные пептиды также включают мультимеры мономерных иммуногенных пептидов. Иммуногенные пептиды, отличные от A пептидов, должны индуцировать иммуногенный ответ против одного или более перечисленных выше предпочтительных фрагментов A (например, A1-3, 1-7, 1-10 и 37). Иммуногенные пептиды по настоящему изобретению связываются с носителем по способу по настоящему изобретению с образованием конъюгата. Иммуногенный пептид может связываться на свом аминоконце, карбоксильном конце или по обоим концам с носителем с образованием конъюгата. Необязательно, в конъюгате могут присутствовать множественные повторы иммуногенного пептида.N-концевой фрагмент A может связываться на свом С-конце с пептидом-носителем с образованием конъюгата. В таких конъюгатах N-концевой остаток A является N-концевым остатком конъюгата. Соответственно, такие конъюгаты эффективно индуцируют антитела, связывающиеся с эпитопом, которому требуется свободный N-концевой остаток A. Некоторые иммуногенные пептиды по изобретению содержат множество повторов N-концевого сегмента A, связанного на С-конце с одной или более копий пептида-носителя с образованием конъюгата. N-концевой фрагмент A, включнный в такие конъюгаты,иногда начинается A1-3 и заканчивается А 7-11. A1-7, 1-3, 1-4, 1-5 и 3-7 являются предпочтительными N-концевыми фрагментами A. Некоторые конъюгаты содержат отличающиеся N-концевые A в тандеме (связанные последовательно). Например, конъюгат может содержать A1-7 с последующимA1-3, связанный с носителем. В некоторых конъюгатах N-концевой сегмент A связан на свом N-конце с носителем-пептидом. Можно использовать такое же множество N-концевых сегментов A, как и в случае С-концевого связывания. Некоторые конъюгаты содержат пептидный носитель, связанный с N-концом N-концевого сегмента A, который, в свою очередь, связан с одним или более дополнительных N-концевых сегментовA в тандем (связанные последовательно). Предпочтительно такие иммуногенные A фрагменты, будучи связаны с подходящим носителем, индуцируют иммуногенный ответ, который специфически направлен на определнный A фрагмент, не будучи направлен на другие фрагменты A. Иммуногенные пептиды по изобретению включают иммуногенные гетерологичные пептиды. В некоторых иммуногенных пептидах A фрагмент связан с носителем с образованием иммуногенного гетерологичного пептида. Этот гетерологичный пептид связывается с носителем с применением способа по данному изобретению с образованию конъюгата. Некоторые из таких иммуногенных гетерологичных пептидов содержат фрагменты A, связанные с эпитопами столбнячного токсоида, такими как описанные в патенте США 5196512, европейских патентах ЕР 378881 и ЕР 427347. Необязательно, иммуногенный пептид может быть связан с одной или множеством копий носителя, например, как по N-, так и по С-концу носителя, с образованием иммуногенного гетерологичного пептида. Другие такие иммуногенные гетерологичные пептиды содержат фрагменты A, связанные с носителями-пептидами, описанными в патенте США 5736142. Например, иммуногенный гетерологичный пептид может содержать A1-7,связанный с последующим A1-3, связанный с последующим носителем. Примеры таких иммуногенных гетерологичных пептидов включают Некоторые иммуногенные гетерологичные пептиды содержат мультимер иммуногенных пептидов,представленных формулой 2x, в которой x обозначает целое число от 1 до 5. Предпочтительно х обозначает два, так что мультимер содержит четыре иммуногенных пептида, связанных в предпочтительной конфигурации, называемой MAP4 (см. патент США 5229490). Такие иммуногенные пептиды затем связаны с носителем способом по настоящему изобретению с образованием конъюгата. Конфигурация MAP4 показана ниже, где разветвлнные структуры получают, инициируя пептидный синтез как по N-концевой аминогруппе, так и по аминогруппе боковой цепи лизина. В зависимости от того, сколько раз лизиновые остатки включаются в последовательность и имеют возможность раз- 15011239 ветвляться, в конечной структуре присутствуют множественные N-концы. В данном примере четыре идентичных N-конца дают разветвлнное лизинсодержащее ядро. Такая мультиплетность значительно повышает отвечаемость родственных В-клетокA пептид, аналог, активный фрагмент или другой полипептид можно вводить в ассоциированной форме, или в форме мультимера, или в диссоциированной форме. Терапевтические агенты также включают мультимеры или мономерные иммуногенные агенты. Агенты, отличные от A пептидов, должны индуцировать иммуногенный ответ против одного или более перечисленных выше предпочтительных фрагментов A (например, 1-10, 1-7, 1-3 и 3-7) и могут также конъюгироваться с носителем способом по настоящему изобретению. Предпочтительно такие агенты, конъюгированные с подходящим носителем,индуцируют иммуногенный ответ, который специфически направлен на один из этих фрагментов, не будучи направлен на другие фрагменты A. Для того чтобы облегчить конъюгацию пептидного иммуногена с носителем, к концам антигенных детерминант могут быть добавлены дополнительные аминокислоты. Дополнительные остатки можно также использовать для модификации физических или химических свойств пептидного иммуногена. Аминокислоты, такие как тирозин, цистеин, лизин, глутаминовая или аспарагиновая кислота и т.п., можно ввести на С- или N-конце пептидного иммуногена. Кроме того,можно также ввести пептидные линкеры, содержащие аминокислоты, такие как глицин и аланин. Помимо этого, антигенные детерминанты могут отличаться от природной последовательности, будучи модифицированы ацилированием концевой NH2-группы, например алканоил- или тиогликолилацилированием (ацилирование алкановыми (С 1-С 20) кислотами или тиогликолевой кислотой), амидированием по карбоксиконцу, например, аммиаком, метиламином и т.д. В некоторых примерах эти модификации могут создать сайты связывания с подложкой или другой молекулой. Пептидные иммуногены, используемые для получения конъюгатов по настоящему изобретению способом по данному описанию, можно объединять связыванием с образованием полимеров (мультимеров), или из них можно готовить композиции без связывания, в виде смеси. Если пептид связан с идентичным пептидом, тем самым образуя гомополимер, то присутствует множество повторяющихся эпитопных единиц. Например, метод множественных антигенных пептидов (МАП, MAP) применяют для конструирования полимеров, содержащих как CTL эпитоп, так и/или пептиды антител и пептиды. "CTL" эпитоп представляет собой эпитоп, образованный из выбранных эпитопных областей потенциальных целевых антигенов. Когда пептиды различаются, например, смесь, представляющая различные вирусные субтипы, различные эпитопы внутри субтипа, различные специфичности рестрикции ГКГ (HLA) или пептиды, которые содержат Т-хелперные эпитопы, получают гетерополимеры с повторяющимися единицами. Помимо ковалентного связывания, также рассматривается нековалентное связывание, при котором могут образоваться межмолекулярные и внутриструктурные связи. Такие пептидные иммуногены и их аналоги синтезируют твердофазным пептидным синтезом или рекомбинантной экспрессией или получают из природных источников. Автоматические пептидные синтезаторы можно получить от многих поставщиков, таких как Applied Biosystems, Foster City, California. Рекомбинантная экспрессия может осуществляться в бактериальных клетках (таких как Е. coli),клетках дрожжей, насекомых или млекопитающих. Методики рекомбинантной экспрессии описаны вSambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press, NY, 2nd ed., 1989). Некоторые иммуногенные пептиды также выпускаются промышленно (например, American Peptide Company, Inc., Sunnyvale, CA, и California Peptide Research, Inc., Napa, CA).- 16011239 Можно также провести скрининг библиотек случайных пептидов или других соединений на пригодность их в качестве пептидных иммуногенов. Комбинаторные библиотеки можно получать для многих типов соединений, которые можно синтезировать постадийно. Такие соединения включают полипептиды, миметики бета-поворотов, гормоны, олигомерные N-замещнные глицины и олигокарбаматы и т.п. Большие комбинаторные библиотеки соединений можно создавать методом кодированных синтетических библиотек (ESL), описанным в международных заявках WO 95/12608, WO 93/06121, WO 94/08051,WO 95/35503 и WO 95/30642. Пептидные библиотеки можно также получать методами фагового дисплея(см., например, Devlin, WO 91/18980). Дериватизация и конъюгация иммуногенного пептида с белком-носителем. Сайт соединения пептидного иммуногена с белковым/полипептидным носителем и природа сшивающего агента, который используется для связывания пептидного иммуногена с носителем - оба фактора являются важными для специфичности полученного в результате антитела против него. Для корректного узнавания пептидный иммуноген должен быть связан с носителем в соответствующей ориентации. Для того чтобы антитело узнало затем свободные пептидные иммуногены без носителя, конъюгат пептидный иммуноген-белковый/полипептидный носитель должен презентировать пептидные иммуногены в экспонированной и доступной форме. Оптимальная ориентация часто достигается при направлении реакции сшивания на специфические сайты на пептидных иммуногенах. Один способ для пептидного иммуногена достигнуть этого заключается в связывании конечного цистеинового остатка в процессе пептидного синтеза. Это создат на одном конце пептида сульфгидрильную группу для конъюгации с носителем. Сшивание (перекрстное связывание) с использованием этой группы обеспечивает присоединение пептидного иммуногена только на одном конце, тем самым гарантируя постоянную ориентацию. При конъюгации пептидный иммуноген-носитель целью является не сохранение исходного (нативного) состояния устойчивости носителя, но презентация гаптена наилучшим образом, возможным для иммунной системы. При достижении этой цели выбор химического метода конъюгации может регулировать полученный титр и специфичность антител, полученных против гаптена. В некоторых случаях может быть важно выбрать сшивающий агент, содержащий спейсерную "ножку", достаточно длинную для презентации антигена в нерестриктированной форме. Также может быть важно контролировать плотность пептидного иммуногена на поверхности носителя. Слишком маленькая замена в пептидном иммуногене может привести к малому ответу или к отсутствию ответа. Слишком высокая плотность пептидного иммуногена в действительности может вызвать иммунологическую супрессию и снижение ответа. Это необходимо принимать во внимание при выборе не только подходящих сшивающих реагентов, но также соответствующих соотношений белкового/полипептидного носителя и пептидного иммуногена. Возможны различные способы связывания беловых/пептидных носителей с пептидными иммуногенами. Ионные взаимодействия возможны по концевым группам или по -аминогруппе лизина. Также возможно образование водородной связи между боковыми группами остатков и пептидным иммуногеном. Наконец, конформационные взаимодействия между белковыми/пептидными носителями и иммуногенным пептидом могут привести к стабильному связыванию. Конъюгаты пептидные иммуногены-носитель успешно получают, используя различные сшивающие агенты, такие как нулевой длины, гомобифункциональные или гетеробифункциональные кросс-линкеры. Наименьшие доступные реагирующие системы для биоконъюгации представляют собой так называемые кросс-линкеры нулевой длины. Эти соединения опосредуют конъюгацию двух молекул, образующих связь, не содержащую дополнительных атомов. Таким образом, один атом молекулы является спейсером. Во многих схемах конъюгации конечный комплекс связывается вместе с помощью химических компонентов, которые при сшивании вносят чужеродные структуры в вещества. В некоторых применениях присутствие этих промежуточных линкеров может быть вредным для предполагаемого применения. Например, при приготовлении конъюгатов пептидный иммуноген-носитель получают комплекс с намерением генерировать иммунный ответ на присоединнный гаптен. Иногда (случайно) участок антител,продуцированных этим ответом, может иметь специфичность к сшивающему агенту (кросс-линкеру),применяемому при конъюгации. Сшивающие агенты (кросс-линкеры) нулевой длины исключают возможность такого типа кросс-реактивности, опосредуя непосредственное связывание двух веществ. Гомобифункциональные реагенты, которые были первыми сшивающими (перекрстносвязывающими) реагентами, применяемыми для модификации и конъюгации макромолекул, состояли из биреактивных соединений, содержащих по обоим концам одну и ту же функциональную группу (Hartman and Wold, 1966). Эти реагенты могут связывать один белок с другим, связываясь ковалентной связью с одинаковыми общими группами в обеих молекулах. Так, -аминогруппы лизина или N-концевые аминогруппы одного белка могут сшиваться (перекрстно связываться) с теми же самыми функциональными группами на втором белке просто при их смешении в присутствии гомобифункционального реагента. Гетеробифункциональные реагенты для конъюгации содержат две различных реакционноспособных (реактивных) группы, которые могут связываться с двумя различными функциональными "мишенями" на белках и других макромолекулах. Например, один участок кросс-линкера может содержать аминореактивную группу, тогда как другой участок может состоять из сульфгидрилреактивной группы. Ре- 17011239 зультатом является способность направлять реакцию сшивания на выбранные участки целевых молекул,тем самым лучше осуществляется контроль над процессом конъюгации. Гетеробифункциональные реагенты используют для сшивания (перекрстного связывания) белков и других молекул в двух- или трхстадийном процессе, который ограничивает степень полимеризации,часто достигаемой при использовании гомобифункциональных кросс-линкеров. В настоящее время имеется множество методов связывания пептидных иммуногенов с белковыми/полипептидными носителями с помощью кросс-линкеров нулевой длины, гомобифункциональных или гетеробифункциональных кросс-линкеров. С помощью большинства методов создают аминные,амидные, уретановые, тиоизомочевино или дисульфидные связи или, в некоторых случаях, тиоэфирные связи. В более общем методе связывания белков используются бифункциональные сшивающие реагенты. Они представляют собой малые спейсерные молекулы, содержащие на конце активные группы. Спейсерные молекулы могут иметь идентичные или различные активные группы на каждом конце. Наиболее обычные активные функциональности, связывающие группы и образующиеся связи представлены ниже: 1. Альдегид - аминовторичный амин 2. Малеимидо - сульфгидрил (тиоэфир 3. Сукцинимидо - амино (амин 4. Имидат (иминоэфир) - амино (-амид 5. Фенилазиды - амино (фениламин 6. Ацилгалогенид - сульфгидрил (тиоэфир 7. Пиридилсульфиды - сульфгидрил (дисульфид 8. Изотиоцианат - амино (изотиомочевина Реактивность данного белка-носителя, с точки зрения его способности модифицироваться сшивающим агентом таким образом, чтобы конъюгироваться с пептидным иммуногеном, определяется аминокислотным составом и последовательной локализацией отдельных аминокислот в трхмерной структуре молекулы, а также составом аминокислотным составом пептидного иммуногена. Для линкеров (L) между белковыми/пептидными носителями и другими пептидами (например, между белковыми/пептидными носителями и пептидным иммуногеном) спейсеры обычно выбирают изAla, Gly или других нейтральных спейсеров из неполярных аминокислот или нейтральных полярных аминокислот. В некоторых вариантах изобретения нейтральный спейсер представляет собой Ala. Следует понимать, что возможно присутствующий спейсер не обязательно состоит из одинаковых остатков и,следовательно, может быть гетеро- или гомоолигомером. Типичные спейсеры включают гомоолигомерыAla. В случае присутствия спейсера он обычно состоит по меньшей мере из двух остатков, более обычно из трх-шести остатков. В других вариантах изобретения белковый/полипептидный носитель конъюгируется с пептидным иммуногеном, предпочтительно с белковым/пептидным носителем, позиционированным на аминоконце. Пептид может соединяться нейтральным линкером, таким как Ala-Ala-Ala или подобным ему, и предпочтительно содержать липидный остаток, такой как остаток пальмитиновой кислоты или т.п., который связан с - или -аминогруппами Lys остатка PAM)2Lys), связанного с аминоконцом пептидного конъюгата, как правило, Ser-Ser связью или т.п. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A1-5-L, A1-7-L, A1-9-L и A1-12-L. В некоторых аспектах изобретения линкер представляет собой GAGA (SEQ ID NO: 10). Для того чтобы упростить конъюгацию пептидного иммуногена с носителем, можно по концам антигенных детерминант добавить дополнительные аминокислоты. Дополнительные остатки можно также использовать для модификации физических или химических свойств пептидного иммуногена. Аминокислоты, такие как тирозин, цистеин, лизин, глутаминовая или аспарагиновая кислота и т.п., можно ввести на С- или N-конце пептидного иммуногена. Кроме того, можно также вводить пептидные линкеры,содержащие аминокислоты, такие как глицин и аланин. Помимо этого, антигенные детерминанты могут отличаться от природной последовательности модификацией концевой NH2-группы ацилированием, например ацилированием с помощью (С 1-С 20)алкановой или тиогликолевой кислот, амидированием по карбоксиконцу, например, аммиаком, метиламином и т.д. В некоторых примерах эти модификации могут создать сайты связывания с подложкой или другой молекулой. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A1-5-C, A1-7-C, A1-9-C и A1-12-C. В некоторых аспектах изобретения пептидный иммуноген представляет собой A фрагмент, выбранный из группы, состоящей из A15-L-C, A1-7-L-C, A1-9-L-C и A1-12-L-C. Пептидный иммуноген связан с белковым/пептидным носителем либо непосредственно, либо через линкер, либо по амино- или по карбоксиконцу пептидного иммуногена. Аминоконец либо пептидного иммуногена, либо белкового/пептидного носителя может быть ацилированным. Кроме того, конъюгат пептидный иммуноген-белковый/пептидный носитель может быть связан с алканоил (C1-C20) липидами через один или более связывающих остатков, таких как Gly, Gly-Gly, Ser, Ser-Ser, как описано ниже.- 18011239 Другие применяемые липиды включают холестерин, жирные кислоты и т.п. Пептидные иммуногены могут связываться с носителем химическим сшиванием. Методы связывания иммуногена с носителем включают образование дисульфидных связей с помощью N-сукцинимидил 3-(2-пиридилтио)пропионата (SPDP) (Carlsson, J. et al. (1978) Biochem J, 173: 723) и сукцинимидил 4-(Nмалеинимидометил)циклогексан-1-карбоксилата (SMCC) (если пептид не содержит сульфгидрильную группу, е можно создать добавлением цистеинового остатка к гаптену). Эти реагенты образуют дисульфидную связь между ними и пептидным цистеином, расположенным на одном белке, и амидную связь за счт -аминогруппы лизина или другой свободной аминогруппы в других аминокислотах. Различные такие дисульфид/амид-образующие агенты описаны в Immuno. Rev. 62: 85 (1982). Другие бифункциональные связывающие агенты образуют скорее тиоэфирную, нежели дисульфидную связь. Агенты, образующие тиоэфир, включают реакционноспособный эфир 6-малеинимидкапроновой кислоты, 2 бромуксусной кислоты и 2-йодуксусной кислоты, 4-(N-малеинимидометил)циклогексан-l-карбоновой кислоты. Карбоксильные группы можно активировать, объединяя их с сукцинимидом или натриевой солью 1-гидрокси-2-нитро-4-сульфоновой кислоты. Лизиновые остатки являются наиболее распространнными аминокислотными остатками, и чаще всего эти остатки модифицируют с помощью сшивающих реагентов для получения нуклеофильных сайтов, которые затем связывают с гаптеном. Это соединение проводят за счт любой химически активной гидрофильной боковой цепи на молекулах гаптена. Такие химические активные боковые группы включают гуанидильную группу аргинина, карбоксильные группы глутамата и аспарагиновой кислоты,сульфгидрильную группу цистеина и -аминогруппу лизина, ещ некоторые. Модификацию белка таким образом, чтобы они в конечном счте могли связываться с другими частицами, проводят, сшивая реагенты, которые реагируют с любой из боковых цепей молекул белка-носителя или гаптена. В одном аспекте настоящего изобретения белок-носитель с молекулой линкера или без не функционализируют (или дериватизируют) реагентом, который вводит реактивные сайты в молекулу белканосителя, способные к дальнейшей модификации с введением нуклеофильных групп. В одном варианте изобретения носитель реагирует с галогенацетилирующим реагентом, который предпочтительно реагирует с рядом функциональных групп на аминокислотных остатках белков, такими как сульфгидрильная группа цистеина, первичная -аминогруппа лизинового остатка,конец -аминов, тиоэфир метионина и оба азота имидазолильной боковой цепи гистидина (Gurd, 1967). В предпочтительном варианте изобретения первичные -аминогруппы лизиновых остатков белка-носителя дериватизируют с помощью Nгидроксисукцинимидилбромацетата с целью получения бромацетилированного носителя. Конъюгирование пептидного иммуногена и активированного белка-носителя проводят, медленно добавляя активированный носитель к раствору, содержащему пептидный иммуноген. Применяя способ по данному изобретению можно конъюгировать пептидные иммуногены, обсуждавшиеся выше, в разделе В, с любыми носителями, обсуждавшимися выше, в разделе А. Конъюгаты,получающиеся по способу по данному изобретению, используются в качестве иммуногенов для получения антител против A с целью применения их в пассивной/активной иммунотерапии. Кроме того, A или A фрагмент, связанный с носителем, можно вводить лабораторным животным при получении моноклональных антител к A. В одном аспекте изобретения конъюгат представляет собой конъюгат, выбранный из группы, состоящей из A1-7-CRM197, (A1-73)-CRM197 и (A1-75)-CRM197. В одном аспекте изобретения конъюгат представляет собой конъюгат, выбранный из группы, состоящей из CRM197-A1-5, CRM197-A1-7,CRM197-A1-9 и CRM197-A1-12. В одном аспекте изобретения конъюгат представляет собой конъюгат,выбранный из группы, состоящей из A1-5-C-CRM197, A1-7-C-CRM197, A1-9-C-CRM197 и A1-12-CCRM197, A16-23-C-CRM197, A17-24-C-CRM197, A18-25-C-CRM197, CRM197-C-A16-23, CRM197-CA17-24, CRM197-C-A18-25, A16-22-C-CRM197, A17-23-C-CRM197, A18-24-C-CRM197, CRM197-CA16-22, CRM197-C-A17-23 и CRM197-C-A18-24, A1-9-C-CRM197 и A1-12-C-CRM197. Ещ в одном аспекте изобретения конъюгат представляет собой конъюгат, выбранный из группы, состоящей из A15-L-C-CRM197, A1-7-L-C-CRM197, A1-9-L-C-CRM197 и A1-12-L-C-CRM197."Кэпирование". Недостатком применения связывающих агентов, которые вводят реактивные сайты в боковые цепи реактивных молекул аминокислот на молекулах носителя и/или молекулах гаптенов, является то, что реактивные сайты, если они не нейтрализованы, могут реагировать с любой нежелательной молекулой либо in vitro, либо in vivo. В способе по настоящему изобретению "кэпирование" непрореагировавших функциональных групп осуществляют реакцией конъюгатов с боковыми реактивными группами с реагентами, которые инактивируют/"кэпируют" реактивные группы. Типичные инактивирующие/"кэпирующие" реагенты для применения со способом конъюгации по настоящему изобретению включают цистеамин, N-ацетилцистеамин и этаноламин. Или же "кэпирование" осуществляют реакцией с аммиаком или бикарбонатом аммония, каждый из которых переводит галогенацетильные группы в аминоацетильные группы. "Кэпирование" также выполняют в щелочной среде (рН 9,0-9,8) с применением гидроксида натрия или карбоната натрия, в результате чего галогенацетильные группы гидролизуют- 19011239 ся до гидроксиацетильных групп. Одним потенциальным преимуществом превращения галогенацетильных групп в аминоацетильные или гидроксиацетильные группы, в отличие от реакции с производными цистеамина, этаноламина и т.д., является введение по реакции с аммиаком или гидроксидом/карбонатом химических функциональностей (функциональных групп) сравнительно меньшего размера. Полученные в результате "кэпированные" функциональные группы, например аминоацетильная или гидроксиацетильная, вызывают значительно меньшие нарушения на участке белка-носителя конъюгата. "Кэпированный" конъюгат пептидный иммуноген-белок-носитель при необходимости очищают известными методами, такими как хроматография (гель-фильтрация, ионообменная, гидрофобное взаимодействие или аффинная), диализ, ультрафильтрация-диафильтрация, селективная преципитация с применением сульфата аммония или спирта и т.п. Иммуногенные конъюгаты и композиции."Кэпированные" конъюгаты пептидный иммуноген-белок-носитель вводят в виде иммуногенных композиций млекопитающим, в частности людям, в профилактических и/или терапевтических целях. Конъюгаты по настоящему изобретению применяются для выявления и/или повышения иммунного ответа против иммуногенов. Например, конъюгаты CTL-носитель применяют для лечения и/или предупреждения вирусной инфекции, амилоидогенных заболеваний, рака и т.д. Или используют также конъюгаты полипептидный иммуноген-носитель, которые индуцируют антительный ответ. При терапевтическом применении конъюгат по настоящему изобретению вводят индивидууму, уже страдающему амилоидогенным заболеванием, таким как болезнь Альцгеймера. Больным в инкубационном периоде или в острой фазе заболевания можно вводить конъюгат по настоящему изобретению отдельно или в сочетании с другими лекарственными средствами, в зависимости от ситуации. При терапевтическом применении иммуногенную композицию по настоящему изобретению вводят пациенту в количестве, достаточном для выявления (выработки) эффективного CTL (Т-клеточного) ответа или гуморального ответа на амилоидную бляшку, и для лечения или, по меньшей мере, частичного прекращения прогрессирования заболевания, симптомов и/или осложнений. Количество, достаточное для достижения такого результата, определяется как "терапевтически эффективная доза". Эффективное для этого количество частично зависит от пептидной композиции, способа введения, стадии и тяжести подвергаемого лечению заболевания, веса и общего состояния здоровья пациента, суждения лечащего врача. Терапевтически эффективные количества иммуногенных композиций по настоящему изобретению для начальной иммунизации с целью терапии или профилактики обычно находятся в пределах примерно от 1 до 10000 мкг пептида для пациента весом 70 кг, обычно около 0,1-8000 мкг, предпочтительно около 0,1-5000 мкг и наиболее предпочтительно около 0,1-1000 мкг. После этих доз следуют бустерные дозы около 0,1-1000 мкг пептида по схеме повторной иммунизации в течение от недель до месяцев в зависимости от реакции пациента и состояния, определяемых специфическим иммунным ответом. Помимо этого, настоящее изобретение применяется в целях профилактики для предупреждения и/или уменьшения интенсивности амилоидогенного заболевания. Эффективные количества описаны выше. Кроме того, специалист в данной области техники также знает, как корректировать или модифицировать профилактическое лечение в зависимости от ситуации, например повторной иммунизацией и корректируя дозы и схемы лечения. Терапевтическое лечение можно начинать при первых признаках заболевания. После этого следуют бустерные дозы до прекращения прогрессирования или до реверсирования заболевания, или до заметного ослабления симптомов и в последующий период. Иммуногенные композиции по настоящему изобретению для терапевтического или профилактического лечения можно вводить парентеральным, топическим, внутривенным, оральным, подкожным,внутриартериальным, интракраниальным, интраперитонеальным, интраназальным или внутримышечным способом для профилактического и/или терапевтического лечения. Типичным способом введения иммуногенного агента является подкожный, хотя другие способы одинаково эффективны. Другим обычным способом является внутримышечная инъекция. Этот вид инъекции обычно осуществляют в мышцы руки или ноги. В некоторых способах агенты инъецируют непосредственно в конкретную ткань, в которой аккумулированы отложения, например интракраниальная (внутричерепная) инъекция. Внутримышечная инъекция предпочтительна для введения антитела. В некоторых способах конкретные терапевтические антитела инъецируют непосредственно в череп. Из-за простоты введения иммуногенные композиции по изобретению особенно пригодны для орального применения. Кроме того, изобретение включает иммуногенные композиции для парентерального применения, которые содержат раствор пептидов или конъюгатов, растворенных или суспендированных в приемлемом носителе, предпочтительно в водном носителе. Можно применять различные разбавители, эксципиенты и буферы, например воду, забуференную воду, фосфатный буфер, 0,3% глицин, гиалуроновую кислоту и т.п. Эти композиции можно стерилизовать обычными общеизвестными методами стерилизации или можно стерильно фильтровать. Полученные водные растворы можно упаковывать для применения как есть или лиофилизировать, при этом лиофилизированный препарат объединяют со стерильным раствором перед введением. Композиции могут- 20011239 содержать фармацевтически приемлемые вспомогательные вещества, требующиеся для приближения к физиологическим условиям, такие как буферизующие агенты, агенты, корректирующие тонус, увлажнители и т.п., например ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитан монолаурат, триэтаноламина олеат и т.д. Для тврдых композиций можно использовать обычные нетоксические тврдые носители. Эти носители могут включать, например, манит, лактозу, крахмал, стеарат магния, сахарин натрий, тальк, целлюлозу, глюкозу, сахарозу, карбонат магния и т.д. - все фармацевтической степени чистоты. Для орального применения фармацевтически приемлемую нетоксическую композицию готовят, включая любые обычные эксципиенты, такие как вышеперечисленные носители, и обычно 10-95% активного ингредиента, то есть одного или более конъюгатов по изобретению, и более предпочтительно в концентрации 2575%. Концентрация иммуногенных композиций по настоящему изобретению в фармацевтических препаратах может варьироваться в широких пределах, т.е. обычно от менее чем 0,1 вес.% или по меньшей мере от около 2 до 20-50 вес.%, и выбирается прежде всего по объму, вязкости жидкостей и т.д. в соответствии с конкретным выбранным способом введения. Конъюгаты по настоящему изобретению можно также вводить в липосомах, которые служат для нацеливания конъюгатов на конкретную ткань, такую как лимфоидная ткань, или нацелены селективно на инфицированные клетки, а также служат для повышения периода полужизни пептидной композиции. Липосомы включают эмульсии, пены, мицеллы, нерастворимые монослои, жидкие кристаллы, дисперсии фосфолипидов, ламеллярные слои и т.п. В этих препаратах доставляемую композицию включают как часть липосомы, индивидуально или в сочетании с молекулой, которая связывается, например, с рецептором, преобладающим среди лимфоидных клеток. Эти молекулы включают моноклональные антитела,которые связываются с CD45 антигеном или с другими терапевтическими или иммуногенными композициями. Так, липосомы, заполненные заданной композицией по настоящему изобретению, можно направить на сайт лимфоидных клеток, куда липосомы затем доставляют выбранные терапевтические/иммуногенные пептидные композиции. Липосомы для применения по изобретению готовят из липидов, образующих стандартные везикулы, эти липиды обычно включают нейтральные или отрицательно заряженные фосфолипиды и стерин(ол), такой как холестерин. При отборе липидов обычно руководствуются соображениями о размере частиц, лабильности или устойчивости липосом к кислоте в кровотоке. Известны различные способы получения липосом, описанные, например, в Szoka, et al., Ann. Rev.Biophys. Bioeng. 9:467 (1980), патентах США 4235871, 4501728, 4837028 и 5019369. Для введения в виде аэрозолей композиции по настоящему изобретению применяют, предпочтительно, в тонкоизмельчнном виде вместе с поверхностно-активным веществом и газом-вытеснителем. Обычно процентное содержание композиции составляет 0,01-20 вес.%, предпочтительно 1-10%. Естественно, поверхностно-активное вещество должно быть нетоксическим и предпочтительно растворимым в газе-вытеснителе. Типичными такими агентами являются эфиры или частичные эфиры жирных кислот,содержащих 6-22 углеродных атома, таких как капроновая, октановая, лауриновая, пальмитиновая, стеариновая, линолевая, линоленовая и олеиновая кислоты, и алифатического многоатомного спирта, или их циклического дегидратированного производного. Можно применять смешанные сложные эфиры, такие как смешанные или природные глицериды. Поверхностно-активное вещество может составлять 0,1-20 вес.% от веса композиции, предпочтительно 0,25-5%. Остальное содержимое композиции обычно составляет газ-вытеснитель. При необходимости можно также включать носитель, такой как лецитин для интраназальной доставки. Конъюгаты по настоящему изобретению можно, необязательно, применять в комбинации с другими агентами, которые, по меньшей мере, частично эффективны для лечения и/или облегчения амилоидного заболевания и/или его симптомов. В случае болезни Альцгеймера и синдрома Дауна, при которых амилоидные отложения наблюдаются в мозге, конъюгаты по изобретению можно применять в сочетании с другими агентами, которые повышают прохождение агентов по изобретению через гематоэнцефалический барьер. Иммуногенная композиция обычно содержит адъювант. Адъювант представляет собой вещество,которое повышает иммунный ответ при введении вместе с иммуногеном или антигеном. Показано, что ряд цитокинов или лимфокинов обладают иммуномодулирующей активностью и, следовательно, могут использоваться в качестве адъювантов, включая, но без ограничения, интерлейкины 1-, 1-, 2, 4, 5, 6, 7,8, 10, 12 (см., например, патент США 5723127), 13, 14, 15, 16, 17 и 18 (и мутантные формы), интерфероны-,и , гранулоцитарно-макрофагальный колониестимулирующий фактор (см., например, патент США 5078996), макрофагальный колониестимулирующий фактор, гранулоцитарный колониестимулирующий фактор, GSF и фактор некроза опухолейи . Другие адъюванты, применимые по данному изобретению, включают хемокин, в том числе без ограничения МСР-1, MIP-, MIP- и RANTES. Адгезивные молекулы, такие как селектин, например, L-селектин, Р-селектин и Е-селектин, также могут применяться в качестве адъювантов. Другие применяемые адъюванты включают, без ограничения, муциноподобную молекулу, например, CD34, GlyCAM-1 и MadCAM-1, представитель семейства интегринов,- 21011239 такой как LFA-1, VLA-1, Mac-1 и р 150.95, член суперсемейства иммуноглобулинов, такой как РЕСАМ,ICAM, например ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3, молекулы костимуляторов, такие как CD40 иCD40L, факторы роста, включая фактор роста сосудов, фактор роста нервной ткани, фактор роста фибробластов, эпидермальный фактор роста, В 7.2, PDGF, BL-1 и эндотелиальный фактор роста сосудов, рецепторные молекулы, включая Fas, TNF рецептор, Flt, Аро-1, р 55, WSL-1, TRAMP, Аро-3, AIR, LARD,NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2 и DR6. Другая молекула адъюванта включает каспазу(ICE). См. также международные заявки WO 98/17799 и WO 99/43839. Подходящие адъюванты, применяемые для повышения иммунного ответа, включают, без ограничения, MPL (3-О-деацилированный монофосфорил-липид А (Corixa, Hamilton, MT), который описан в патенте США 49120914. Также пригодны для применения в качестве адъювантов аналоги синтетического липида А или аминоалкил глюкозамин фосфаты (AGP) или их производные или аналоги, поставляемые Corixa (Hamilton, MT) и описанные в патенте США 6113918. Один такой AGP представляет собой 2[(R)-3-тетрадеканоилокситетрадеканоиламино]этил 2-дезокси-4-О-фосфоно-3-O-[(S)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоиламино]-b-D-глюкопиранозид,который известен как 529 (также известный как RC529; Corixa). Этот адъювант 529 готовят в виде водного раствора (529 AF) или в виде стабильной эмульсии. Другие адъюванты включают эмульсии в минеральном масле и в воде, соли кальция, такие как фосфат кальция, соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия и т.д., амфиген, авридин, L121/сквален, D-лактид-полилактид/гликозид, поверхностно-активные кислоты, полиолы, мурамил-дипептид, убитая бацилла Bordetella, сапонины, такие как стимулон (Stimulon QS-21, Antigenics, Framingham, MA), описанный в патенте США 5057540, и полученные из него частицы, такие какCpG (патент США 6207646), коклюшный токсин (РТ) или Е. coli термолабильный токсин (LT), в частности, LT-K63, LT-R72, РТ-K9/G129; см., например, международные заявки WO 93/13302 и WO 92/19265. Также применимы в качестве адъювантов токсины холеры и их мутанты, включая описанные в международной заявке WO 00/18434 (в которых глутаминовая кислота в аминокислотном положении 29 заменена другой аминокислотой (отличной от аспарагиновой кислоты предпочтительно гистидином). Аналогичные СТ токсины или мутанты описаны в международной заявке WO 02/098368 (в них изолейцин в аминокислотном положении 16 заменн на другую аминокислоту, либо индивидуально, либо в сочетании с заменой серина в аминокислотном положении 68 на другую аминокислоту; и/или в них валин в аминокислотном положении 72 заменн на другую аминокислоту). Другие СТ токсины описаны в международной заявке WO 02/098369 (в них аргинин в аминокислотном положении 25 заменн другой аминокислотой; и/или аминокислота встроена (инсерция) в аминокислотное положение 49; и/или вводятся(инсерция) две аминокислоты в аминокислотные положения 35 и 36). Следует понимать, что ссылка в данном описании на любую теорию для объяснения описанных результатов не ограничивает объм изобретения. Независимо от способа по изобретению результатов и преимуществ по данному описанию можно достичь со ссылкой на нижеприведнные примеры изобретения. Для рядового специалиста в данной области техники очевидно, что можно сделать многие модификации, не отходя от сущности или объма прилагаемой формулы изобретения. Все публикации и патентные заявки, упоминаемые в данном описании, вводятся ссылкой во всей полноте для любых целей в той степени, как если бы в отношении каждой отдельной публикации, каждого отдельного патента или каждой отдельной патентной заявки конкретно и отдельно указано, что она(он) вводится ссылкой. Пример 1. Конъюгация CRM197 с А пептидом. Конъюгацию гаптенов/антигенных пептидов проводят реакцией активированного носителя CRM197,содержащего тридцать девять остатков лизина, с гаптен/антигенньгм пептидом, содержащим тиольную группу в боковой цепи, описанными ниже методами (фиг. 1). Все A пептиды содержат цистеиновый остаток на карбокси-конце для того, чтобы упростить конъюгацию этих пептидов за счт сульфгидрильной группы цистеина с белком-носителем. Эти пептиды получают твердофазным синтезом.I. Активация. Свободные аминогруппы CRM197 бромацетилируют избытком эфира N-гидроксисукцинимида и бромуксусной кислоты (Sigma Chemical Co., St. Louis, MO) (Bernatowicz and Matsueda, 1986). К охлаждаемому льдом раствору CRM197 (15 мг) прибавляют 10% (об./об.) 1,0 М NaHCO3 (pH 8,4). Эфир Nгидроксисукцинимида и бромуксусной кислоты в количестве, равном по весу количеству CRM197, растворяют в 200 мл диметилформамида (ДМФА), медленно прибавляют к CRM197 и осторожно перемешивают при комнатной температуре в темноте в течение 1 ч. Полученный бромацетилированный (активированный) белок очищают, пропуская через обессоливающую колонку (P6-DG), используя в качестве элюента PBS/1 мМ EDTA (рН 7,0). После очистки фракции, соответствующие активированномуCRM197, собирают и концентрацию белка определяют ВСА анализом. Аминогруппы белка, как до, так и после обработки эфиром N-гидроксисукцинимида и бромуксусной кислоты, реагируют с 2,4,6- 22011239 тринитробензолсульфоновой кислотой (TNBSA), которая служит индикатором бромацетилированияII. Конъюгация. Перед конъюгацией пептиды реагируют с 5,5'-дитиобис(2-нитробензойной кислотой) [реагент Эльмана] для проверки содержания свободных -SH-групп (около 62-88% восстановленных). Для первых четырх A пептидов (аминокислоты 1-7 без линкера, аминокислоты 1-12 с GAGA (SEQ ID: 10) линкером,аминокислоты 1-9 с GAGA (SEQ ID: 10) линкером и аминокислоты 1-7 с GAGA (SEQ ID: 10) линкером) около 8,0-10,0 мг пептида растворяют в стерильной дистиллированной воде до примерной концентрации 20 мг/мл. Пептид медленно добавляют к холодному активированному CRM197 в отношении 1:1 (вес/вес) и рН доводят примерно до 7,0-7,2, добавляя 20-36 мкл 1N NaOH. Полученный материал осторожно перемешивают в течение ночи при 4 С в темноте с последующим диализом в темноте против двух 1 л сменPBS, рН 7,2. Для следующих четырх A пептидов (аминокислоты 1-5 без линкера, аминокислоты 1-9 без линкера, аминокислоты 1-12 без линкера и аминокислоты 1-5 без линкера) используют регент Эльмана для проверки свободных -SH-групп. CRM197 бромацетилируют, очищают и проводят реакцию сTNBSA, как описано ранее. рН каждого пептида доводят до 7,0, добавляя 0,1 М NaHPO4 (рН 8,5) в 2,2 объме растворнного пептида. Пептид медленно добавляют к холодному активированному CRM197 в отношении 1:1 и реакцию оставляют на ночь при 4 С в темноте. Полученный материал подвергают диализу. Конечный контрольный пептид (1-12-мер в обратной ориентации) конъюгируют с CRM197, как описано выше, с последующей модификацией. Предпочтительнее довести рН активированного CRM197 примерно до 7,5, добавляя 20% (об./об.) 0,5 М NaHPO4 (рН 8,0), чем корректировать рН пептида до 7,0. Каждый конъюгат после диализа переносят в стерильную пробирку на 15 мл из полипропилена, закрывают алюминиевой фольгой и хранят при 4 С. Затем методом масс-спектрометрии последовательно проверяют активацию реактивных аминокислотных остатков на носителе.CRM197 (100 мг) в 0,01 М натрий-фосфатном буфере, 0,9% NaCl, рН 7,0, в атмосфере аргона реагирует с эфиром N-гидроксисукцинимида и бромуксусной кислоты (растворнным в ДМСО с концентрацией 20 мг/мл) в весовом отношении 1:1. Реакционную смесь титруют, так как необходимо поддерживать рН 7,0. Смесь перемешивают в темноте в течение 1,5 ч при комнатной температуре. Реакционную смесь фильтруют через фильтр 1,2 мкм в сосуд для концентрации системы UF/DF (Millipore LabscaleTFF, Billerica, MA). Очистку проводят на мембране 10K или 30K диафильтрацией (30-кратной) против 0,01 М натрий-фосфатного буфера/0,9% NaCl, рН 7,0. Бромацетилированный CRM197 фильтруют через фильтр 0,2 мкм. Степень бромацетилирования определяют реакцией активированного CRM197 с цистеином с последующим аминокислотным анализом и количественным определением полученного карбоксиметилцистеина (CMC). Конъюгация A пептида и бромацетилированного CRM197 и "кэпирование" N-ацетилцистеамином. Бромацетилированный CRM197 (50 мг) переносят в реакционную колбу. К раствору при перемешивании при температуре 2-8 С прибавляют 1 М раствор карбоната/бикарбоната натрия. Титруют в атмосфере аргона до достижения рН 9,0. Отдельно взвешивают 50 мг пептида A и растворяют в воде для инъекций (WFI, ВДИ) с концентрацией 20 мг/мл. К этому раствору прибавляют 1 М раствор карбоната/бикарбоната натрия до рН 9,0. Раствор пептида прибавляют к раствору бромацетилированного CRM197 и смесь перемешивают при 2-8 С в течение 14-18 ч. Оставшиеся бромацетильные группы "кэпируют" 20 кратным молярным избытком N-ацетилцистеамина в течение 3-6 ч при 2-8 С. Реакционную смесь фильтруют через фильтр 1,2 мкм в сосуд для концентрации системы UF/DF(Millipore XL) и конъюгат очищают при комнатной температуре 30-кратной диафильтрацией на мембране 10K или 30K MWCO (Millipore) против 0,01 М натрий- фосфатного буфера/0,9% NaCl, рН 7,0. Ретентат собирают, фильтруют и анализируют через фильтр 0,2 мкм и анализируют на содержание белка (колориметрический анализ Lowry или Micro-BCA) методом SDS-PAGE, аминокислотным анализом и на иммуногенность на мышах. Пример 3. Превращение непрореагировавших бромацетильных групп в аминоацетильные группы с помощью "кэпирования". Бромацетилированный CRM197 (50 мг), полученный, как описано выше в примере 2, переносят в реакционную колбу. К раствору при перемешивании при температуре 2-8 С прибавляют 1 М раствор карбоната/бикарбоната натрия. Титруют в атмосфере аргона до достижения рН 9,0. Отдельно взвешивают 50 мг пептида A и растворяют в WFI (ВДИ) с концентрацией 20 мг/мл. К этому раствору прибавляют 1 М раствор карбоната/бикарбоната натрия до рН 9,0. Раствор пептида прибавляют к раствору бромацетилированного CRM197 и смесь перемешивают при 2-8 С в течение 14-18 ч. Оставшиеся бромацетильные группы "кэпируют" 20-кратным молярным 8% раствором бикарбоната аммония в течение 4 ч при 2-8 С. Реакционную смесь фильтруют через фильтр 1,2 мкм в сосуд для концентрации системы UF/DF(Millipore XL) и конъюгат очищают при комнатной температуре 30-кратной диафильтрацией на мембране 10K или 30K MWCO против 0,01 М натрий-фосфатного буфера/0,9% NaCl, pH 7,0. Ретентат собирают,фильтруют и анализируют через фильтр 0,2 мкм и анализируют на содержание белка (колориметрический анализ Lowry или Micro-BCA) методом SDS-PAGE, аминокислотным анализом и на иммуногенность на мышах. Пример 4. Количественное определение S-карбоксиметилцистеина и S-карбоксиметилцистеамина как оценка степени конъюгации и "кэпирования" конъюгатов пептидный иммуноген-белок/полипептид. Кислотный гидролиз пептид-пептидных конъюгатов, полученных с помощью бромацетильной активации, приводит к образованию устойчивого к кислоте S-карбоксиметилцистеина (CMC) из цистеинов в конъюгированных сайтах и образованию устойчивого к кислоте S-карбоксиметилцистеамина (СМСА) из цистеинов в "кэпированных" сайтах (фиг. 2). Все конъюгированные и "кэпированные" лизины превращают обратно в лизин и детектируют в виде лизина. Все другие аминокислоты гидролизуют до свободных аминокислот, за исключением триптофана и цистеина, которые в условиях гидролиза разрушаются. Аспарагин и глутамин превращают в аспарагиновую кислоту и глутаминовую кислоту соответственно. Образцы конъюгатов разводят деионизированной водой до общей концентрации белка менее 1 мг/мл. Аликвоты 10 мкг каждого конъюгата сушат и ресуспендируют в 100 мкл 6N HCl [Pierce], 5 мкл расплавленного фенола [Sigma-Aldrich] и 1 мкл 2-меркаптоэтанола [Sigma-Aldrich]. Затем образцы инкубируют в вакууме (100 мл) при 110 С в течение 22 ч. Полученные гидролизаты сушат, ресуспендируют в 250 мкл буфера цитрата натрия для разведения образцов Beckman Na-S (pH 2,2) [Beckman Instruments,Inc., Fullerton, CA] и фильтруют, используя 0,2 мкм нейлоновые мундштучные фильтры Whatman и шприцы на 1 мл. Каждый образец затем вносят в петлю для жидких образцов аминокислотного анализатора Beckman 6300 и помещают в анализатор. Аминокислоты из каждого гидролизованного образца и контрольного образца разделяют ионообменной хроматографией с последующей реакцией с раствором нингидринаBeckman Ninhydrin NinRX при 135 С. Дериватизированные аминокислоты затем дериватизируют в частотном интервале видимого излучения при 570 и 440 нм (см. табл. 1). В каждой серии анализов наряду с образцами и контрольными образцами используют стандартный набор аминокислот [Pierce Amino Acid- 24011239 Таблица 1 Время удерживания аминокислот, определнное с помощью Gradient Program 1 на аминокислотном анализаторе Beckman 6300 Площади каждого стандартного пика используют как количественный эквивалент для пропорциональной оценки каждого образца. Пролин определяют от 440 нм и превращают в эквивалент при 570 нм,используя глутаминовую кислоту, ближайшую аминокислоту. Каждое из этих значений в пикомолях превращают в молярное отношение аминокислотных остатков, используя сравнение пикомолей лизина к теоретической величине лизина в белке. Для такой оценки выбирают лизин, исходя из его ковалентного связывания с цистеином и цистеамином и ожидаемым аналогичным гидролизом. Полученное число молей аминокислот сравнивают затем с аминокислотным составом белка и сообщают наряду с величинами для CMC и СМСА. Величину CMC применяют непосредственно для оценки степени конъюгации, а величину СМСА применяют непосредственно для оценки степени "кэпирования". Пример 5. Характеристики и оптимизация пептидных конъюгатов A-CRM197. Для проверки конъюгации все конъюгаты пептид-CRM197 анализируют аминокислотным анализом и время-пролтной масс-спектрометрией с лазерной десорбцией и ионизацией пробы (MALDI-TOF). Для каждого конъюгата моли пептида, конъюгированного с каждым молем CRM197, определяют аминокислотным анализом (число S-карбоксиметилцистеиновых остатков) и MALDI-TOF спектрометрией. В целом значения, полученные каждым методом, согласуются друг с другом.I. Эксклюзионная хроматография по размеру частиц. Образцы партий концентрата берут из места хранения и оставляют нагреваться до комнатной температуры. Образец конъюгата A пептида осторожно перемешивают для того, чтобы гарантировать однородность препарата. Образец конъюгата A пептида центрифугируют на микроцентрифуге от Эппендорфа для удаления всех частиц. Супернатант хроматографируют на колонке TosoHaas TSK-GelG3000SW (TosoHaas, Stuttgart, Germany). Колонку TosoHaas TSK-Gel G3000SW соединяют с ВЭЖХ системой и предельное давление повышают до 1,4 МПа. Колонку уравновешивают, используя по меньшей мере 30 мл PBS (10 мМ фосфата натрия, 150 мМ NaCl, pH 7,20,1), при скорости потока 0,75 мл/мин. Образец конъюгата A пептида наносят на колонку TosoHaas TSK-Gel G3000SW, используя следующие показатели: Концентрация образца конъюгата A пептида: 1,51,0 мг/мл Скорость потока: 0,75 мл/мин Объм образца: 0,1 мл Время прогона: 30 мин Оптическую плотность определяют как при 280 нм, так и при 210 нм. Для продолжительного хранения колонку TosoHaas TSK-Gel G3000SW уравновешивают по меньшей мере 50 мл 20% этанола при скорости потока 0,5-1,0 мл/мин.(заводской) полиакриламидной мини-гель системой и рабочим буфером NuPAGE MES SDS. Аликвоту 8 мкг каждого активированного CRM или конъюгата смешивают с буфером для восстановления образца и нагревают при 100 С в течение 5 мин. Конъюгаты и стандарты молекулярных масс (MB) (Invitrogen,Carlsbad, CA) наносят на 10% (вес/об., акриламид) гель NuPage (Novex) на основе Bis-Tris-HCl забуференной системы и проводят электрофорез в рабочем буфере MES SDS-PAGE (Laemmli). После SDSPAGE гель окрашивают с помощью Pierce Gel Code Blue (Pierce, Rockford, IL). Конъюгат A пептидCRM197 представлен основной полосой около 66 кДа, выше полосы нативного CRM и полосы димера около 120 кДа, наряду с полосами минорных мультимеров (данные не показаны).III. Масс-спектрометрический анализ MALDI-TOF конъюгатов пептид-CRM197. Масс-спектрометрические измерения проводят для непосредственного определения примерной степени конъюгации. Соответствующие аликвоты активированного CRM197 и образцов конъюгатов анализируют с помощью MALDI-TOF масс-спектромстрии с 3,5-диметокси-4-гидроксикоричной кислотой(синапиновой кислоты) в качестве матрицы. Молекулярная масса активированного CRM197, определнная методом MALDI-TOF масс-спектрометрии (масс-спектрометр Finnigan MAT Lasermat 2000, Ringoes,NY), составляет около 60,5 кДа, а для конъюгатов варьируется от 65 до 74 кДа в зависимости от степени конъюгации (данные не показаны). Найдено, что до 22 лизиновых остатков (50%) в CRM197 модифицировано в отношении 1:1.IV. Эксперименты по оптимизации. Степень активации и степень конъюгации являются функцией отношения реагент:белок, температуры реакции и рН реакционного буфера. Ниже даны некоторые примеры для иллюстрации оптимальных условий конъюгации, проведнные с целью определения оптимальной величины рН для получения воспроизводимых контрольных показателей процесса в реакциях конъюгации. Результаты (фиг. 3) показывают, что реакция конъюгации в A 5-мер (DAEFRC) (SEQ ID NO:1), так же как в A 7-мер(DAEFRHDC) (SEQ ID NO:2) зависит от рН, и более высокую степень модификации/конъюгации получают при повышенном значении рН. При использовании ТФК (TFA) соли 5-мерного и 7-мерного пептидов, меняя пептидную нагрузку, оценивают степень конъюгации при рН 9,0 (фиг. 4). Из этих результатов видно, что пептидные конъюгаты с определнным числом пептидных копий на молекулу CRM можно получать, меняя в процессе конъюгации отношение пептид/активированный CRM. Аналогичные эксперименты проводят с ацетатом (уксусно-кислой солью) A 7-мерного пептида. При конъюгации A1-7/CRM процесс "кэпирования" оценивают, сравнивая число молей СМСА наCRM с числом молей CMC на CRM. Когда сумма CMC и СМСА для каждого тестированного соотношения пептид:CRM остатся постоянной, предполагают, что процесс "кэпирования" закончен (фиг. 5). Общая (тотальная) модификация в конъюгате остатся между 19 и 21, что сравнимо с числом бромацетилированных лизиновых остатков (фиг. 5). Эти эксперименты проводят с ТФК (TFA) в качестве противоиона для пептида. Конъюгацию A1-7/CRM повторяют, предпочтительно используя не ТФК соль, а ацетат,и эти данные показаны на фиг. 5 и 6. Процесс "кэпирования", очевидно, закончен, при этом общее числоCMC и СМСА для каждой точки остатся между значениями 20 и 22. Условия реакции конъюгации ACRM оптимизируют при рН 9,0, причм степень в ходе реакции конъюгации регулируется отношением пептида к CRM. Варьируя отношения от 0,1 до 1,5, можно менять степень конъюгации (фиг. 6). Степень активации и степень конъюгации являются функцией отношения реагент:белок, температуры реакции и рН реакционного буфера. Степень модификации (конъюгации) для каждого конъюгата рассчитывают, вычитая величину массы активированного CRM197 из величины массы каждого конъюгата, а затем делят на массу пептида, использованного для получения конъюгата. Степень модификации(конъюгации) для всех конъюгатов дана в табл. 2. Степень конъюгации также сравнивают со значениями, полученными при определении числа образовавшихся S-карбоксиметилцистеиновых остатков на моль CRM197 (также показано в табл. 2). Пример 6. Исследование иммуногенности конъюгатов A пептида. Пептиды, охватываемые N-концевыми остатками 1-5, 1-7, 1-9 и 1-12 A (с линкерной последовательностью GAGAC или без не), и пептид, соответствующий N-концу A в обратной последовательности от аминокислоты двенадцать до аминокислоты один (1-12-мер в обратной последовательности), каждый из них конъюгирован с CRM197, применяют для иммунизации мышей наряду с неконъюгированнымA1-12-мерным пептидом в композиции со STIMULON QS-21. Каждую группу мышей иммунизируют подкожно дозой либо 30 мкг, либо 5 мкг одного из образцов, приготовленных с 20 мкг адъювантаSTIMULON QS-21, в начале исследования (неделя 0) и затем через 3 и 6 недель. Протокол исследования представлен в табл. 3. Как показано в табл. 3, пептиды, охватывающие N-концевые остатки 1-5, 1-7, 1-9 и 1-12 A (с линкерной последовательностью GAGAC или без не), и пептид, соответствующий N-концу A в обратной последовательности от аминокислоты двенадцать до аминокислоты один (1-12-мер в обратной последовательности), конъюгированые с CRM197, применяют для иммунизации мышей наряду с неконъюгированньм A1-12-мерным пептидом в композиции с QS-21. Каждую группу мышей вакцинируют подкожно дозой либо 30 мкг, либо 5 мкг одного из образцов, приготовленных с 20 мкг адъюванта QS-21, в начале исследования (неделя 0) и затем через 3 и 6 недель. Для полного исследования берут мышей SwissWebster, no 5 мышей в каждой группе. Объм инъекции =100 мкл; В = взятие пробы крови; V = вакцинация; Е = кровопускание. Анти-A титры определяют методом ELISA против A и CRM197, как описано далее. В нескольких словах, на 96-луночных планшетах Costar (3591) в течение ночи при комнатной температуре иммобилизуют 2 мкг/мл A1-42 в стерильном карбонат/бикарбонатном буфере, рН 9,6. Планшеты опорожняют и блокируют в течение 2 ч при комнатной температуре с помощью 200 мкл/лунка 0,05% BSA в 1XPBS/0,05% Tween 20. Блокированные планшеты выгружают и отмывают с помощью устройства для промывки, содержащего TBS, 0,1% Brij-35 (не содержащий азида) буфер для отмывания. Все первичные антисыворотки стерильно разводят с 0,05% BSA в 1X PBS, содержащем 0,05% Tween 20/0,02% азид, и 100 мкл каждого разведения затем переносят в соответствующие лунки планшета и инкубируют при комнатной температуре в течение 2 ч. Затем планшеты выгружают/отмывают, как описано выше. Вторичное антитело козы против мышиного IgG, конъюгированное со щелочной фосфатазой, от Southern Biotech(город, штат), разводят 1:1000 с 0,05% BSA в PBS, содержащем Tween 20/0,02% азид, и 100 мкл переносят в каждую лунку и инкубируют при комнатной температуре в течение 1 ч. Затем планшеты выгружают/отмывают, как описано выше, и, наконец, инкубируют при комнатной температуре в течение 1 ч со 100 мкл/лунка 1 мг/мл раствора субстрата п-нитрофенилфосфата, приготовленного в диэтеноламине/MgCl2, рН 9,8. Проявление цвета прекращают, добавляя 50 мкг/лунка 3N раствора NaOH. Планшеты считывают при 405 нм с эталоном 690 нм. Конечные титры рассчитывают при O.D (оптической плотности) 0,1 AU (Ед.).- 27011239 Таблица 3 Протокол исследования иммунизации мышей Метод ELISA для CRM197. 96-Луночные планшеты Greiner (650011) при 37 С в течение 90 мин покрывают плнкой 5,0 мкг/мл (100 мкл/лунка) CRM197 в стерильном карбонат/бикарбонатном буфере, рН 9,6. Планшеты выгружают и отмывают с помощью устройства для промывки, содержащего 1X TBS, 0,1% Brij-35 буфер для отмывания. Все первичные антисыворотки стерильно разводят в 1X HDS, содержащем 0,3% Tween 20/EDTA, и 100 мкл каждого разведения переносят затем в соответствующие лунки планшета и инкубируют при 37 С в течение 1 ч. Затем планшеты выгружают/отмывают, как описано выше. Вторичное антитело козы против мышиного IgG, конъюгированное со щелочной фосфатазой, от Southern Biotech, разводят 1:1000 с 1X PBS, содержащем 0,05% Tween 20/0,02% азид, и 100 мкл переносят в каждую лунку и инкубируют при 37 С в течение 1 ч. Затем планшеты выгружают/отмывают, как описано выше, и, нако- 28011239 нец, инкубируют при комнатной температуре в течение 1 ч со 100 мкл/лунка 1 мг/мл раствора субстрата п-нитрофенилфосфата, приготовленного в диэтеноламине/MgCl2, рН 9,8. Проявление прекращают, добавляя 50 мкг/лунка 3N раствора NaOH. Планшеты считывают при 405 нм с эталоном 690 нм. Конечные титры рассчитывают при O.D. (оптической плотности) 0,1 AU (Ед.). Табл. 4-6 иллюстрируют ELISA титры в конечной точке против A. После первичной иммунизации все восемь конъюгатов (исключая негативный контроль) индуцируют заметный (измеримый) IgG иммунный ответ против A. Однако доза 30 мкг, но не доза 5 мкг, A вызывает позитивный ответ на 3-й неделе после первичной иммунизации. Среди конъюгатов, по-видимому, пептид A1-7, конъюгированный без линкера, вызывает такой же или лучший ответ, чем другие изученные конъюгаты. В дозе 5 мкгA1-5 С лучше действует на 8-16 неделях. A1-7 С является лучшим в дозе 30 мкг. Анализ титров антител после второй и третьей иммунизации в дозе 5 или 30 мкг показывает, что максимальный иммунный ответ на A для большинства конъюгатов наблюдается после второй иммунизации. По меньшей мере, у мышей третья иммунизация, по-видимому, не повышает иммунный ответ. Однако в случае A пептида требуется три иммунизации в дозе 30 мкг для достижения максимального иммунного ответа против пептида(табл. 5). Что касается распада антитела через продолжительный период времени, уровень антител в группах, иммунизированных конъюгатами, понижается в 2-3 раза по сравнению с наивысшим уровнем в этой группе. Отдельные образцы в группах на 6 и 8 неделях анализируют для расчта GMT (среднегеометрических титров антител) против A для каждой группы (табл. 6), чтобы узнать, действительно ли какой-либо конъюгат значительно лучше других. Статистический анализ титров на неделе 6 в группах конъюгатов A1-5 С, A1-7 С и A1-9 С показывает, что конъюгат A1-7 индуцирует значительно более высокий титр. Также из этого эксперимента очевидно, что линкерная последовательность GAGAC не способствует повышению иммунного ответа на пептид. Таблица 4 Таблица 4. Конечные титры антител против A на 0, 3, 6, 8, 13 и 16 неделе, полученные методомELISA при использовании антисыворотки в результате введения дозы 5 мкг пептидных конъюгатов, охватывающих N-концевые амилоидные A пептиды различной протяжнности. Ссылка: гипериммунная поликлональная сыворотка Elan 592 = 3073307. Конечная точка при O.D. 0,1 AU (Ед.). Мышей SwissWebster иммунизируют SC-N (подкожно) дозой 5 мкг вышеуказанных антигенов, приготовленных вместе с 20 мкг STIMULON QS-21 на 0, 3 и 6 неделях. Таблица 5 Таблица 5. Конечные титры антител против A на 0, 3, 6, 8, 13 и 16 неделе, полученные методомELISA при использовании антисыворотки в результате введения дозы 30 мкг пептидных конъюгатов,охватывающих N-концевые амилоидные A пептиды различной протяжнности. Ссылка: гипериммунная поликлональная сыворотка Elan 592 = 3073307. Конечная точка при O.D. 0,1 AU (Ед.). Мышей Swiss- 29011239 Таблица 6. Конечные GMT антител против A через 6 и 8 недель, полученные методом ELISA при использовании антисыворотки в результате введения дозы 30 мкг пептидных конъюгатов, охватывающих N-концевые пептиды амилоида-A различной протяжнности. Ссылка: гипериммунная поликлональная сыворотка Elan 592 = 3073307. Конечная точка при O.D. 0,1 AU (Ед.). Мышей Swiss-Webster иммунизируют SC-N (подкожно) дозой 30 мкг вышеуказанных антигенов, приготовленных вместе с 20 мкг STIMULON QS-21 на 0, 3 и 6 неделях.a. Статистический анализ титров антител на 6 неделе после введения 1-5 С, 1-7 С и 1-9 С с применением критерия Тьюки-Крамера показывает статистическую разницу только между 1-5 С по сравнению с 1-7 С, тогда как анализ с применением Т-теста Стьюдента показывает статистическую разницу между 15 С по сравнению с 1-7 С и между 1-5 С по сравнению с 1-9 С.b. Статистический анализ титров антител на 8 неделе после введения 1-5 С, 1-7 С и 1-9 С не показывает статистической разницы между этими тремя группами. Однако, очевидно, имеется тенденция, которая может указывать на разницу между 1-5 С по сравнению с 1-7 С. Окрашивание тканей мозга мышей линии PDAPP. Анализ окрашивания тканей мозга мышей линии PDAPP указывает на функциональность конъюгатов A пептида и/или A1-42 антисыворотки. Образцы сыворотки отдельных групп мышей анализируют отдельно на их способность узнавать бляшки, содержащие амилоидный пептид, в тканях мозга мышейPDAPP. Результаты показаны в табл. 7 А и 7 В. За исключением антисывороток конъюгата A 5-мера,наблюдается зависящий от дозы (доза-эффект) ответ узнавания бляшек. Вне зависимости от линкера антисыворотки, полученные в результате введения 30 мкг конъюгата, имеют лучший паттерн реактивности по сравнению с антисыворотками, полученными в результате введения 5 мкг конъюгата. Однако в случае антисывороток, полученных в результате введения конъюгата A5-мера, наблюдается, по-видимому,сходная или лучшая реактивность в группе, получавшей дозу 5 мкг. Сравнение всех этих результатов приводит к выводу, что конъюгаты, полученные из A1-5-мера по A1-9-мер, достаточны для выявления распознающего бляшки иммунного ответа у мышей и присутствие линкера не является существенным. Из данного исследования можно сделать следующие заключения: (а) все пептидные конъюгаты индуцируют высокие титры антител против белка-носителя CRM197 с равными или более высокими уровнями по сравнению с контрольным неконъюгированным CRM197 (не показано), (б) конъюгаты с линкеромGAGAC не повышают иммуногенность или функциональность по сравнению с конъюгатами без линкера, (в) данные по иммуногенности и окрашиванию тканей мозга мышей PDAPP (первичный показатель функционального антитела) показывают, что конъюгаты A1-5-мера и A1-7-мера, очевидно, являются предпочтительными иммуногенами для дальнейшей разработки.
МПК / Метки
МПК: C07K 1/00
Метки: пептидных, получения, конъюгаты, носителей, способы, а&beta, иммуногенных
Код ссылки
<a href="https://eas.patents.su/30-11239-konyugaty-abeta-immunogennyh-peptidnyh-nositelejj-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты aβ иммуногенных пептидных носителей и способы их получения</a>